Содержание
Статья по химии на тему: Кислоты читать
Главная>Статьи по химии
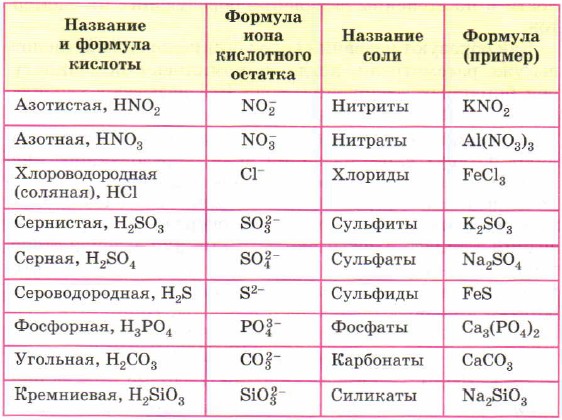
Кислоты
Кислоты представляют собой химически сложные вещества, молекулы которых состоят из кислотного остатка и атомов Н водорода (одного или нескольких). Недаром слова «кислый» и «кислота» — однокоренные: по своим вкусовым качествам все кислоты имеют кислый привкус, что совсем не означает, что кислотные составы можно пробовать. Среди них, большая половина — едкие, а остальные даже токсичные. Есть, конечно, и исключения – уксусная, лимонная, яблочная, аскорбиновая и щавелевая, которые знакомы каждому с детства, и их успешно используют в пищевой промышленности.
Какого бы происхождения ни была кислота (природного или синтетического), она всегда в своей структуре будет иметь определенное количество атомов водорода, которые могут вступать в реакционные соединения. В ходе химической реакции каждая молекула кислоты будет отдавать атомы водорода, а взамен будет принимать атомы различных металлов. Так происходит замещение.
Так происходит замещение.
Кислоты принято классифицировать по двум признакам:
1. или есть атомы кислорода в молекуле,
2. по количеству водородных атомов, которые способны замещаться на атомы металлов.
Первая группа, в свою очередь, имеет две подгруппы:
- бескислородные кислоты (фтороводородная кислота HF, соляная HCl, бромоводородная HBr, иодоводородная HI, сероводородная H2S).
- кислородосодержащие кислоты (серная H2SO4, сернистая H2SO3, фосфорная H3PO4, угольная H2CO3, азотная HNO3, кремниевая H2SiO3).
Вторая группа тоже имеет несколько подгрупп:
- одноосновные кислоты (имеют 1 атом водорода),
- двухосновные кислоты (имеют 2 атома водорода),
- трехосновные кислоты (имеют 3 атома водорода).
Химические свойства кислот описываются следующими правилами:
1. Кислоты взаимодействуют с основаниями, образуя соль, которая всегда будет содержать неизменный кислотный остаток. Эта реакция получила название нейтрализации. Второй продукт, образующийся в ходе протекания реакции нейтрализации, это – вода.
Эта реакция получила название нейтрализации. Второй продукт, образующийся в ходе протекания реакции нейтрализации, это – вода.
Чтобы нейтрализация состоялась, требуется выполнить следующее условие: хотя бы один из компонентов должен хорошо растворяться в воде. А так как кислоты отлично соответствуют этому параметру, они могут взаимодействовать как с нерастворимыми, так и с растворимыми основаниями. Исключение – кремниевая кислота, которая практически не растворяется в воде, поэтому может вступать в реакцию только с растворимыми основаниями (KOH, NaOH).
2. Растворы кислот действуют на индикаторы (специальные вещества), изменяя их окраску в воде. Кислоты изменяют цветовую окраску индикатора в один определенный цвет, поэтому всегда можно точно определить, что в составе вещества присутствует кислота. Так, лакмус и оранжевый метиловый станут красными.
Индикаторы – вещества довольно сложного строения. В основаниях и нейтральных растворах они будут совсем другого цвета, чем в кислотной среде.
3. Кислоты реагируют с металлами при выполнении такого условия:
- металл по шкале активности должен быть максимально реакционноспособным. Так серебро, золото и медь с кислотой реагировать не будут, а цинк, кальций и натрий, наоборот, будут взаимодействовать очень активно. Причем будет выделяться много газов водорода и большое количество тепла.
Некоторые металлы будут вступать в реакцию только с разбавленными кислотами. Если же кислоты концентрированные (безводные), то никакого замещения не произойдет.
см. также:
Все статьи по химии
Допустима ли для словаря свободная маркировка. (0 = недопустима, 1 = допустима)
Сепарацию некоторых специальных продуктов невозможно эффективно осуществлять с использованием традиционных технологий. Для таких заводов и объектов KBR поставляет высокотехнологичные решения для достижения плановых производственных показателей.
Каким бы сложным ни было производство, мы предлагаем новейшие, соответствующие последнему слову техники процессы и технологические решения для кристаллизации, выпаривание и концентрации и очистки сильных неорганических кислот. Используя наши известные бренды KBR Ecoplanning Oy™ и PLINKE GmbH, мы предлагаем опыт и знания в области неорганической химии, накопленные в течение 65 лет, чтобы помогать нашим заказчикам индивидуальными решениями для их предприятий.
Используя наши известные бренды KBR Ecoplanning Oy™ и PLINKE GmbH, мы предлагаем опыт и знания в области неорганической химии, накопленные в течение 65 лет, чтобы помогать нашим заказчикам индивидуальными решениями для их предприятий.
«Мы предлагаем новейшие, соответствующие последнему слову техники процессы и технологические решения для кристаллизации, выпаривание и концентрации и очистки сильных неорганических кислот».
Наши решения позволят вашему заводу соответствовать плановым производственным показателям и спецификациям качества безопасно, надежно и эффективно на протяжении долгих лет работы. Воспользуйтесь нашими технологическим возможностями.
Концентрация азотной кислоты
Для концентрации, очистки и восстановления азотной кислоты могут использоваться технологии производства азотной кислоты от PLINKE. Технологии PLINKE могут использоваться в различных сферах применения:
- концентрация разбавленной кислоты в процессах, где необходима высококонцентрированная азотная кислота;
- восстановление истощенной азотной кислоты для повторного применения в процессе или для перепродажи;
- извлечение азотной кислоты из сточных вод для ее дальнейшего использования и (или) по экологическим причинам.

Процесс обработки серной кислоты
Технологии обработки PLINKE для очистки и концентрации серной кислоты, получаемой из ряда источников истощенной кислоты, включая производственный процесс нитрования, химические процессы, такие как производство метилэтилкетона и сульфирование, производство некоторых красителей и пигментов, сушка хлора, очистка газа и синтез органических соединений.
Процессы обработки смеси кислот
Процессы сепарации, очистки и концентрации от PLINKE для смесей серной и азотной кислоты, содержащих органические и летучие загрязняющие примеси, и специализированное оборудование, такое как установки предварительной обработки для стабилизации и разложения, диазотирующие сепараторные установки DEN®, установки предварительной концентрации NAPC®, технология высокой концентрации NACSAC® и установки концентрации SAC®.
Процесс обработки соляной кислоты
Разнообразные процессы PLINKE для обработки кислот и загрязненного воздуха, разработанные под различные требования, такие как предварительная концентрация до 24 % HCI, средняя концентрация до 35 %, высокая концентрация до 100 % HCI, очистка и восстановление паров соляной кислоты.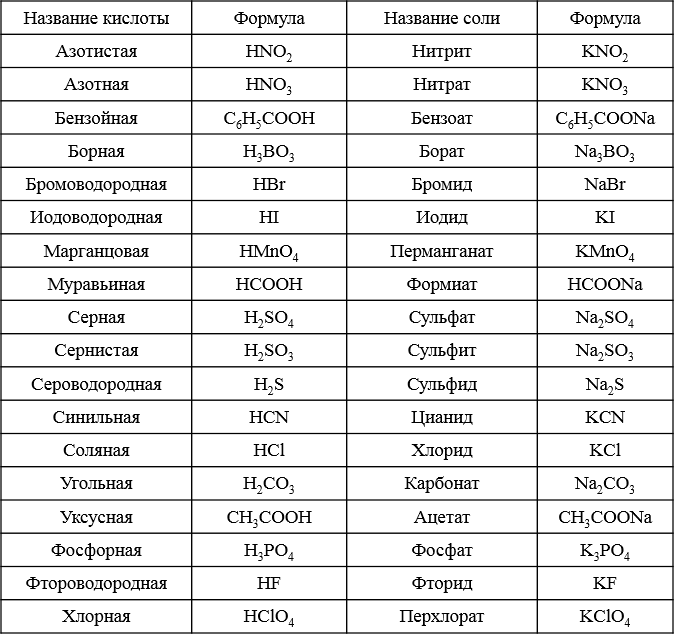
Технология поглощения NOx
РПатентованная технология поглощения NOx от PLINKE для отходящих газов, обеспечивающая максимальный выход и самые низкие выбросы в окружающую среду за счет высокоэффективной абсорбционной колонны с охлаждаемым поддоном, в которой, как правило, используется только вода и атмосферный воздух.
Процесс адиабатической нитрации
Фирменный процесс PLINKE для адиабатической нитрации бензола с целью получения нитробензола с использованием интегрированной установки для нитрации и обработки истощенной кислоты, который позволяет получить нитробензол отличного качества и обеспечивает высокую энергоэффективность. Для установки не требуется много места и значительных инвестиций.
Технологии испарения
Ряд испарительных процессов и оборудования от Ecoplanning Oy™, индивидуально проектируемых для разбавления отработанных кислот, включая испарители с падающей пленкой, принудительной циркуляцией и восходящей пленкой, а также рекомпрессию пара, для уменьшения объема экологически вредных стоков,Нашим основным решением является рафинирование и концентрация фосфорной кислоты для пищевой промышленности и производства удобрений.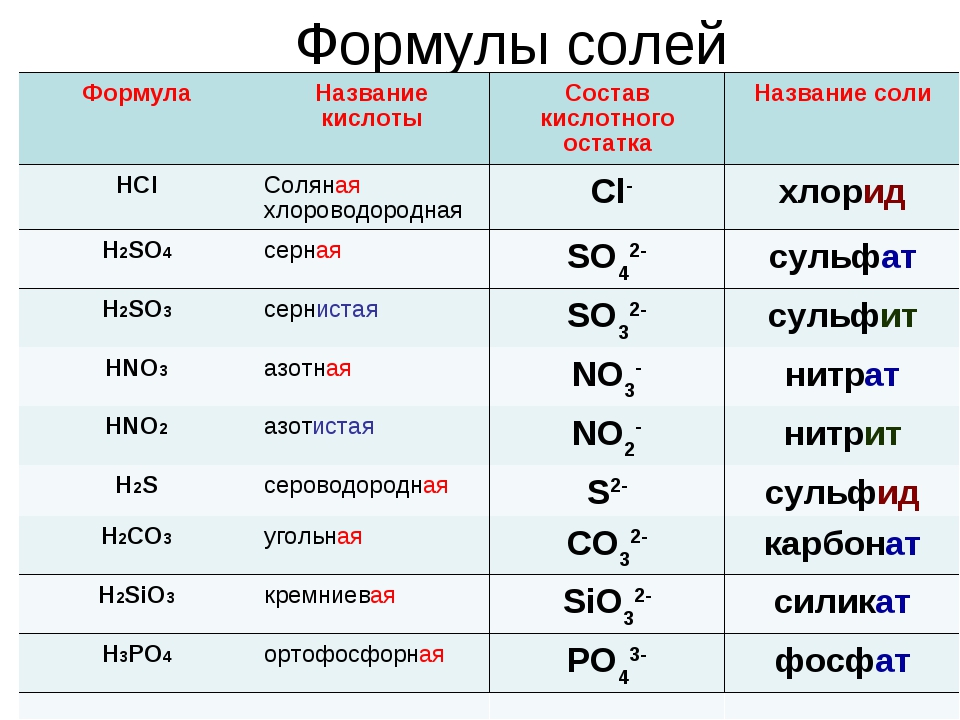
Технологии кристаллизации
Надежные и простые в использовании процессы от Ecoplanning Oy™ спроектированы для обеспечения соответствия широкому диапазону требований к продукту (таких как размер кристалла или чистота), включая кристаллизаторы с принудительной циркуляцией, кристаллизаторы с циркуляционной трубой, кристаллизаторы с циркуляционной трубой и перегородкой, Наши основные решения включают кристаллизацию зольной пыли для целлюлозных комбинатов и кристаллизацию сульфатов металлов в отходах производства металлургических и горно-обогатительных предприятий.
Карпухина Е.В Урок химии «Кислоты» — Мои статьи — Каталог статей
Цель урока: Сформировать представления учащихся о кислотах как классе неорганических соединений.
Задачи урока:
Образовательные.
- Познакомить учащихся с составом, названиями и классификацией кислот.
- Обратить внимание на обнаружение кислот с помощью индикаторов.

- Познакомить учащихся с важнейшими кислотами.
- Научиться составлять формулы оксидов соответствующих кислотам.
Развивающие.
- Развивать умения анализировать, сравнивать, обобщать, выделять существенные признаки и свойства объектов, классифицировать факты, делать выводы.
- Развивать логико-смысловое мышление учащихся, память, химический язык.
Воспитательные.
- Совершенствовать коммуникативные умения в ходе выполнения опытов с соблюдением правил техники безопасности.
- Развивать умения формулировать и аргументировать собственное мнение, самостоятельность.
- Прививать культуру умственного труда.
- Развивать коммуникабельность, умение работать в группах, парах.
Тип урока: урок усвоения новых знаний.
Межпредметные связи: биология, география, литература, история.
Пояснительная записка.
- Необходимость использования компьютерной презентации на данном уроке продиктована следующими причинами:
- Возможность показа дополнительного иллюстративного материала.

- Средство для обеспечения наглядности и уплотнения материала.
- Организация самопроверки без затрат времени урока.
- Более эффективная работа учащихся на уроке, что способствует формированию более прочных знаний по теме и предмету.
- Организация разных видов деятельности учащихся.
- Позволяет экономично расходовать время урока.
План урока.
- Организационный момент — 1 мин.
- Актуализация знаний — мотивационный этап — 3 мин.
- Объяснение нового материала — операционный этап — 15 мин.
- Закрепление нового материала — 15 мин.
- Аналитический этап — 5 мин.
- Задание на дом — 1 мин.
Автор учебника: И.Г. Остроумов Химия 8 класс
Оборудование: штатив для пробирок, пробирки, стеклянная палочка.
Реактивы: растворы органических и неорганических кислот: H2SO4;вода; КОН; индикаторы.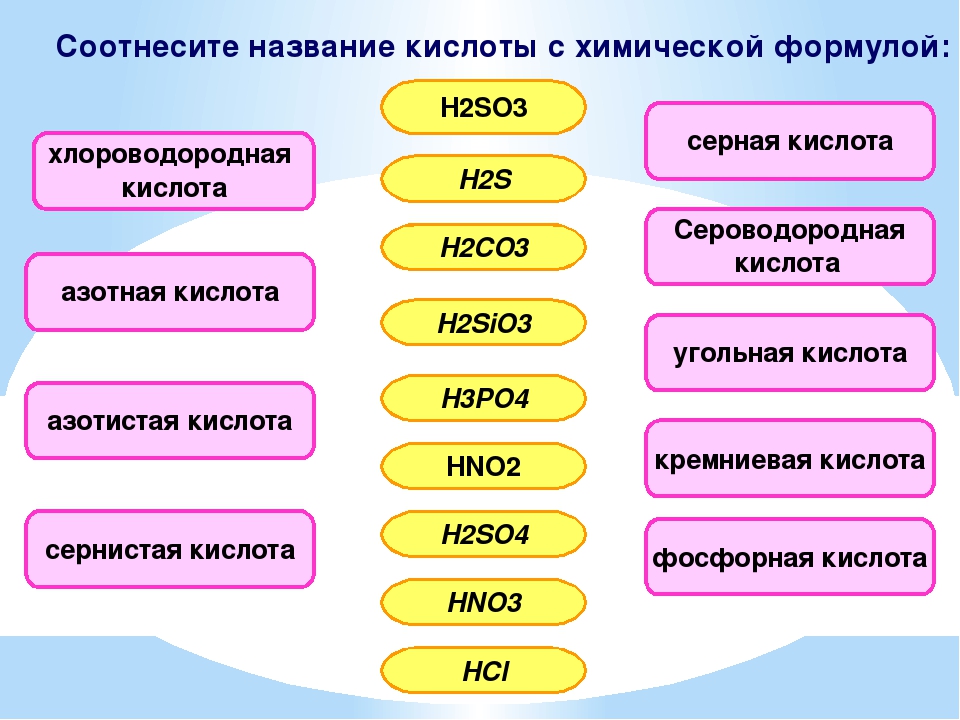
Методы: беседа, самостоятельная работа, эксперимент.
Скачать
§ 1. СЕРНАЯ КИСЛОТА. Токсикологическая химия. В.Ф. Крамаренко
Для доказательства присутствия минеральных кислот в диализатах определяют кислотность этих жидкостей и наличие в них анионов соответствующих кислот.
Определение кислотности диализатов проводится с помощью кислотно-основных индикаторов, которые изменяют свою окраску в кислой среде (метиловый фиолетовый, метиловый оранжевый, конго красный и др.).
К небольшому объему диализата прибавляют несколько капель раствора индикатора, изменение окраски которого указывает на наличие кислот в исследуемых жидкостях. От прибавления раствора метилового фиолетового (интервал рН перехода окраски 0,1—1,5 и 1,5—3,2) к исследуемой жидкости с рН= 1,5…3,2 зеленая окраска индикатора переходит в фиолетовую. Красная окраска метилового оранжевого при рН = 3,0. ..4,4 переходит в желтую. Сине-фиолетовая окраска конго красного при рН = 3,0…5,2 переходит в красную. Для проверки кислотности вытяжек (диализатов) и для ориентировочного определения рН среды может быть использована бумага, пропитанная универсальным индикатором.
..4,4 переходит в желтую. Сине-фиолетовая окраска конго красного при рН = 3,0…5,2 переходит в красную. Для проверки кислотности вытяжек (диализатов) и для ориентировочного определения рН среды может быть использована бумага, пропитанная универсальным индикатором.
После того как установлена ярко выраженная кислая реакция вытяжек из биологического материала или диализатов, проводят исследование этих жидкостей на наличие анионов серной, азотной, соляной и других кислот.
Обнаружение сульфат-ионов, хлорид-ионов и ионов других кислот в вытяжках (диализатах) еще не является доказательством отравлений серной, соляной или другой кислотой. Это объясняется тем, что анионы указанных кислот могут быть в организме как составная часть органов и тканей.
Для доказательства отравлений минеральными кислотами необходимо отогнать их из диализатов. При этом отгоняются только свободные кислоты. Соли этих кислот, поступившие в вытяжки из исследуемых объектов, не перегоняются. Учитывая то, что серная и азотная кислоты перегоняются при относительно высокой температуре, вначале эти кислоты переводят в более летучие соединения, которые в процессе перегонки легко переходят в дистилляты.
Учитывая то, что серная и азотная кислоты перегоняются при относительно высокой температуре, вначале эти кислоты переводят в более летучие соединения, которые в процессе перегонки легко переходят в дистилляты.
§ 1. СЕРНАЯ КИСЛОТА
На отравление серной кислотой может указывать внешний вид объектов исследования. Так, например, у лиц, принявших концентрированную серную кислоту, могут быть повреждения тканей губ, языка, пищевода, желудка и т. д. Одежда, на которую попала серная кислота, может быть повреждена. Однако доказательством отравления серной кислотой является обнаружение ее в дистиллятах, полученных после перегонки этой кислоты из диализатов.
Выделение серной кислоты из биологического материала.
Подлежащие исследованию органы трупов измельчают, заливают водой до получения кашицеобразной массы, которую оставляют на 1—2 ч. Полученную вытяжку отфильтровывают, подвергают диализу, а затем из диализата отгоняют серную кислоту.
При химико-токсикологическом исследовании серной кислоты на одежде или на других объектах эту кислоту можно извлечь этиловым спиртом, в котором растворяется эта кислота и не растворяются ее соли. С этой целью исследуемый материал измельчают и прибавляют к нему этиловый спирт. Через некоторое время жидкость отфильтровывают от твердых частиц исследуемого материала. Фильтрат на водяной бане выпаривают досуха. К сухому остатку прибавляют 10 мл воды, кипятят несколько минут, а затем охлаждают жидкость до комнатной температуры. Из полученной жидкости отгоняют серную кислоту и исследуют ее в дистилляте.
Отгонка серной кислоты.
К диализатам прибавляют медные опилки и нагревают. При этом образуется ангидрид сернистой кислоты SO
2, который отгоняют и собирают в приемник, содержащий раствор иода. При взаимодействии ангидрида сернистой кислоты с водой и иодом образуется серная кислота:
Способ отгонки серной кислоты состоит в следующем: в колбу аппарата для отгонки жидкостей, состоящего из колбы, холодильника с форштосом и приемника, вносят диализат и медные опилки.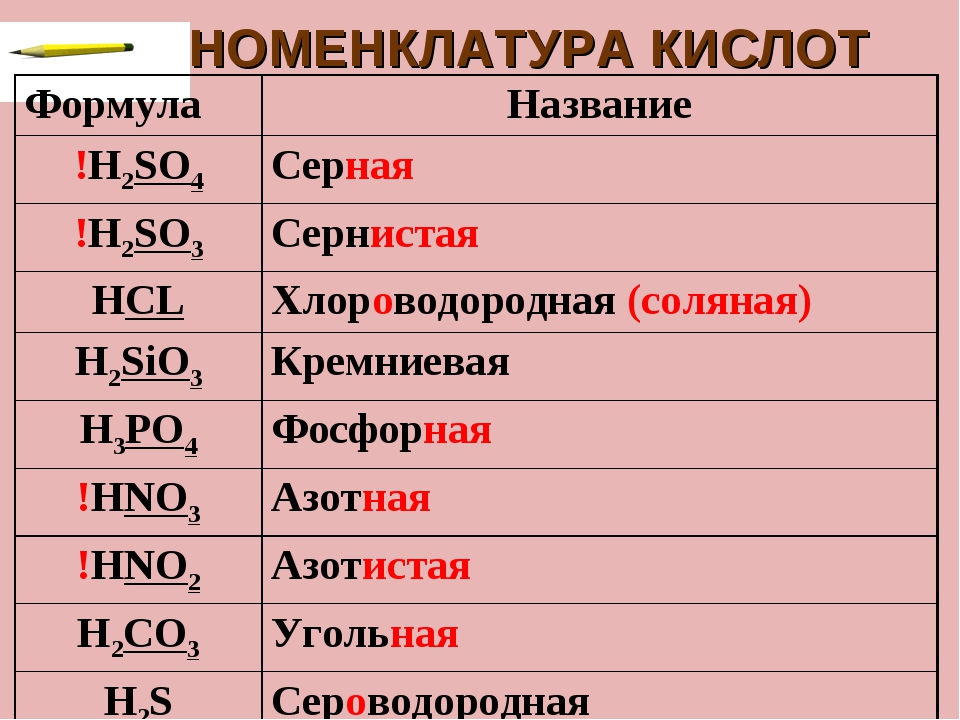 Конец форштоса опускают в приемник, содержащий раствор иода. Колбу устанавливают на масляную или песочную баню и нагревают. Если во время перегонки происходит быстрое обесцвечивание иода, то его раствор небольшими порциями дополнительно вносят в приемник. После окончания отгонки серной кислоты в приемник прибавляют 2—3 мл разбавленной соляной кислоты и нагревают жидкость до полного исчезновения иода, не вступившего в реакцию с ангидридом сернистой кислоты. Освобожденный от иода дистиллят используют для обнаружения в нем серной кислоты.
Конец форштоса опускают в приемник, содержащий раствор иода. Колбу устанавливают на масляную или песочную баню и нагревают. Если во время перегонки происходит быстрое обесцвечивание иода, то его раствор небольшими порциями дополнительно вносят в приемник. После окончания отгонки серной кислоты в приемник прибавляют 2—3 мл разбавленной соляной кислоты и нагревают жидкость до полного исчезновения иода, не вступившего в реакцию с ангидридом сернистой кислоты. Освобожденный от иода дистиллят используют для обнаружения в нем серной кислоты.
Для обнаружения серной кислоты в дистилляте применяют реакции с хлоридом бария, ацетатом свинца и родизонатом натрия.
Реакция с хлоридом бария.
К 3—5 каплям дистиллята прибавляют 1—2 капли 5 %-го раствора хлорида бария. Появление белого осадка сульфата бария указывает на наличие серной кис-
лоты в дистилляте. Образовавшийся осадок не растворяется в азотной и соляной кислотах, а также в щелочах.
Реакция с ацетатом свинца.
К нескольким каплям дистиллята прибавляют 2—3 капли 3 %-го раствора ацетата свинца. При наличии серной кислоты выпадает белый осадок сульфата свинца, который не растворяется в азотной кислоте, но растворяется в едких щелочах и в растворе ацетата аммония при нагревании:
Реакция с родизонатом натрия
основана на том, что родизо-нат натрия с солями бария образует родизонат бария, имеющий красную окраску. От прибавления серной кислоты или сульфатов к родизонату бария он разлагается. При этом образуется осадок сульфата бария и исчезает красная окраска родизоната:
Выполнение реакции.
На фильтровальную бумагу наносят каплю 1 %-го раствора хлорида бария и каплю свежеприготовленного 0,2 %-го раствора родизоната натрия. При этом на бумаге пятно приобретает красную окраску. На это пятно наносят 1—2 капли дистиллята. В присутствии серной кислоты окраска пятна исчезает. Эта реакция является специфичной на сульфаты и серную кислоту.
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
Еще по теме:
История — Химии
Кафедра химии была организована в 1954 году и называлась кафедрой общей и неорганической химии. Основателем и первым заведующим кафедрой являлся доцент Малиновский В.С. В этой должности он проработал с 1.09.1954 по 22.07.1964 года. С 1964 года обязанности заведующего кафедрой исполняла старший преподаватель Рюхина Т.П.; с 1968 по 1972 год — профессор Морозов А.А.; с 1972 по 1980 год — доцент Шелкановцева Н.А. В этот период студентам первого курса читались лекции по общей химии и химии элементов и проводились практические занятия по общей и аналитической химии. Студенты второго курса изучали физическую и коллоидную химии. Преподавание этих дисциплин осуществляли ассистенты кафедры: Драницина В.Б., Шутова Т.Н., к.х.н. Гумиюк В.Н., к.х.н. Колосова И.И., Пинт Л.В., Семенилкин Б.И., Крутько Т.П., Кравченко Г.Ф., Морозова Г.А.
С 1972 по 1993 год в институте существовало подготовительное отделение, где химию все эти годы преподавала Крутько Т. П.
П.
Основной тематикой научной работы кафедры в период с 1955 по 1980 год являлось определение содержания микроэлементов в почве, культурных и диких растениях; изучение биологической роли микроэлементов и их влияния на эндемические заболевания в Калининской области. По этой тематике Рюхиной Т.П. была защищена диссертация на соискание ученой степени кандидата биологических наук.
С 1980 года и по 2007 год кафедрой руководил доктор биологических наук, профессор Каргаполов А.В. В 1967 году окончил с отличием Калининский государственный медицинский институт. С 1967 года по 1968 год работал в должности врача — стоматолога в г. Белый Калининской области. С 1971 на научно-педагогической работе. В 1972 году утвержден ВАК в ученой степени кандидата медицинских наук, в 1984 году – в звании доктора биологических наук, в 1985 году – в ученом звании профессора.
Александр Васильевич – основатель всесоюзной школы липидологии, автор оригинальной конструкции для проведения тонкослойной хроматографии.
В начале 90 – х. годов под его руководством разработан универсальный аппаратно-программный комплекс (АПК), который позволяет на основе данных инфракрасной спектроскопии крови проводить прогнозирование и диагностику различных заболеваний. АПК нашел применение в биохимии, в фармации, биотехнологии, экологических и геофизических исследованиях.
Всего опубликовано свыше 300 работ, получено 30 патентов, защищено 35 кандидатских и докторских диссертаций. А.В. Каргаполов являлся действительным членом Академии медико-технических наук и член-корреспондентом Российской экологической академии, лауреатом премии имени А. Чижевского. В 2005 году присвоено почетное звание «Заслуженный работник высшей школы Российской Федерации».
С 2007 года и по настоящее время кафедрой заведует доктор биологических наук, профессор Зубарева Г.М. и руководит лабораторией молекулярной спектроскопии.
Зубарева Г.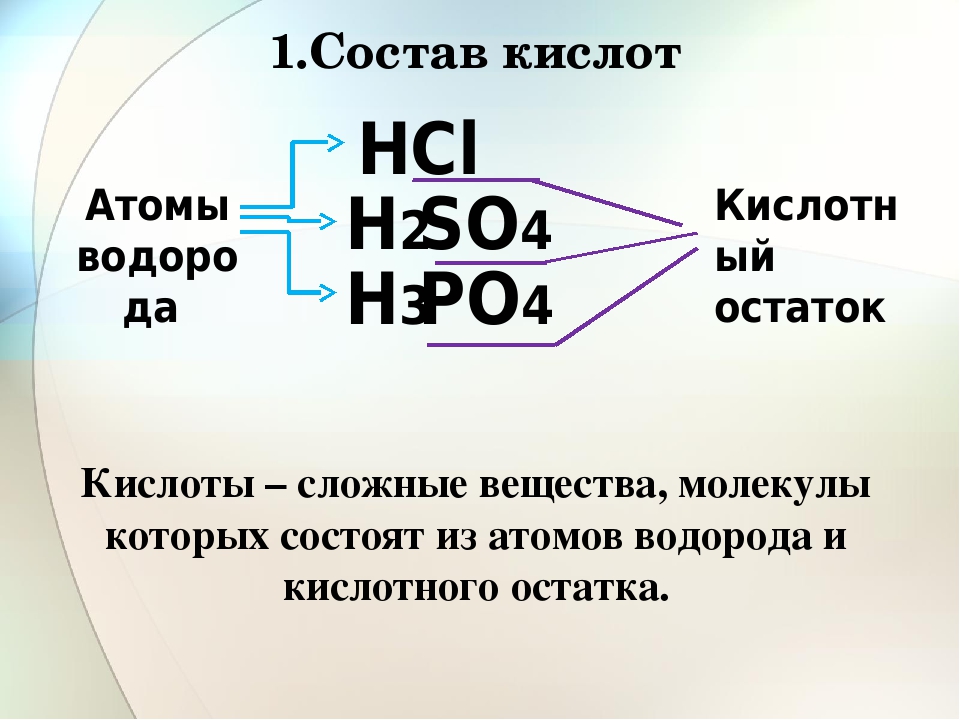 М. в 1979 году окончила с отличием биолого-химический факультет Бурятского государственного педагогического института им. Доржи Базарова. По окончании института работала учителем химии и биологии в школах Калужской и Калининской области. С 1989 года Зубарева Г.М. работает на кафедре общей и биоорганической химии Калининского института. В 1997 году утвержден ВАК в ученой степени кандидата биологических наук, в 2005 году – в звании доктора биологических наук, в 2010 году – в ученом звании профессора. С 2012 — член-корреспондент Российской академии естествознания.
М. в 1979 году окончила с отличием биолого-химический факультет Бурятского государственного педагогического института им. Доржи Базарова. По окончании института работала учителем химии и биологии в школах Калужской и Калининской области. С 1989 года Зубарева Г.М. работает на кафедре общей и биоорганической химии Калининского института. В 1997 году утвержден ВАК в ученой степени кандидата биологических наук, в 2005 году – в звании доктора биологических наук, в 2010 году – в ученом звании профессора. С 2012 — член-корреспондент Российской академии естествознания.
Зубарева Г.М. является лауреатом премии Чижевского. На IV Международном Салоне промышленной собственности «Архимед» представленные патенты Зубаревой Г.М. с соавторами «Способ исследования крови» и «Способ исследования чистоты воды» отмечены золотой и серебряной медалями. С 2003года является действительным членом Американской ассоциации развития науки.
Учебная работа кафедры
На кафедре проходят обучение студенты 1 курса лечебного, педиатрического, стоматологического факультетов, а с 2001 года — студенты фармацевтического факультета. На кафедре осуществляется преподавание общей, неорганической, органической, физической, коллоидной и аналитической химии. Студентам читаются лекции, с ними проводятся лабораторно-практические занятия. При кафедре работает кружок СНО. Студенты ежегодно докладывают результаты своих экспериментальных работ на студенческой научной конференции.
На кафедре осуществляется преподавание общей, неорганической, органической, физической, коллоидной и аналитической химии. Студентам читаются лекции, с ними проводятся лабораторно-практические занятия. При кафедре работает кружок СНО. Студенты ежегодно докладывают результаты своих экспериментальных работ на студенческой научной конференции.
Для проведения лекций и практических занятий были составлены рабочие программы по всем курсам, методические пособия для практических занятий, тестовый контроль, а также ситуационные задания.
Для студентов фармацевтического факультета проводятся занятия по общей, органической, физколлоидной и аналитической химии. Читаются лекции профессором, доктором биологических наук Г.М. Зубаревой, к.б.н. Г.Е. Бординой, к.х.н. Н.П. Лопиной. Практические занятия проводят данные преподаватели, а также старшие преподаватели Крутько Т.П., Халяпина Я.М. ассистенты: Алексеев А.В., Волкова Л.Р., Кудрявых Н.М., Ромась П.В.
Для углубления знаний по неорганической химии проводится элективный курс «Химия элементов и их соединений», для студентов II курса фармацевтического факультета элективный курс по органической и аналитической химии «Применение ИК-спектроскопии для исследования лекарственных препаратов». Данные курсы проводят профессор д.б.н. Г.М. Зубарева, к.б.н. Г.Е. Бордина, к.х.н. Н.П. Лопина.
Данные курсы проводят профессор д.б.н. Г.М. Зубарева, к.б.н. Г.Е. Бордина, к.х.н. Н.П. Лопина.
Приемная комиссия БГМУ
Программа вступительных испытаний по химии
Общие указания
На экзамене по химии поступающий в ВУЗ должен:
- показать знание основных теоретических положений химии как одной из важнейших естественных наук, лежащих в основе научного понимания природы;
- уметь применять теоретические положения химии при рассмотрении классов неорганических и органических веществ и их соединений;
- уметь раскрывать зависимость свойств веществ от их состава и строения;
- знать свойства важнейших веществ, применяемых в народном хозяйстве и в быту;
- понимать научные принципы важнейших химических производств (не углубляясь в детали устройства различной аппаратуры)
- решать типовые и комбинированные задачи по основным разделам химии.

На экзамене можно пользоваться следующими таблицами:
- «Периодическая система химических элементов Д.И.Менделеева»,
- «Растворимость оснований, кислот и солей в воде»,
- «Электрохимический ряд стандартных электродных потенциалов».
При решении задач разрешается пользоваться калькулятором.
Теоретические основы химии.
Предмет и задачи химии. Место химии среди естественных наук.
1. Основные понятия химии.
Основы атомно-молекулярного учения. Понятие атома, элемента, вещества. Простое вещество, сложное вещество. Понятие об аллотропных модификациях. Относительная атомная и относительная молекулярная масса. Стехиометрия: закон сохранения массы вещества, постоянство состава. Моль. Молярная масса. Закон Авогадро и его следствие. Уравнение Менделеева-Клапейрона. Явления физические и химические. Валентность и степень окисления.
2. Периодический закон и периодическая система элементов Д.И. Менделеева. Строение атома. Химическая связь. Строение вещества.
Периодический закон и периодическая система элементов Д.И. Менделеева. Строение атома. Химическая связь. Строение вещества.
Строение ядер и электронных оболочек атомов химических элементов (s-, p-, d-элементов). Периодический закон химических элементов Д.И. Менделеева и строение периодической системы. Изотопы. Характеристика отдельных химических элементов главных подгрупп на основании положения в периодической системе и строения атома. Значение периодического закона для понимания научной картины мира, развития науки и техники.
Виды химической связи: Ковалентная (полярная и неполярная), ионная, металлическая, водородная. Механизм образования и примеры соединений. Модель гибридизации орбиталей. Агрегатные состояния веществ, вещества аморфные и кристаллические. Типы кристаллических решеток.
3. Основные закономерности протекания химических реакций.
Классификация химических реакций: реакции соединения, разложения, замещения, ионного обмена. Окислительно–восстановительные реакции, важнейшие окислители и восстановители. Электролиз. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Скорость химических реакций. Зависимости скорости от природы реагирующих веществ, концентрации, температуры. Катализ. Обратимость химических реакций. Химическое равновесие и условия его смещения.
Окислительно–восстановительные реакции, важнейшие окислители и восстановители. Электролиз. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Скорость химических реакций. Зависимости скорости от природы реагирующих веществ, концентрации, температуры. Катализ. Обратимость химических реакций. Химическое равновесие и условия его смещения.
4. Растворы. Электролитическая диссоциация.
Растворы. Растворимость веществ. Зависимость растворимости веществ от их природы, температуры, давления. Типы растворов. Выражение состава раствора (массовая доля, объемная доля, молярная концентрация). Значение растворов в промышленности, медицине, быту. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Ионные уравнения реакций.
Неорганическая химия.
1. Основные классы неорганических соединений.
Оксиды, кислоты, гидроксиды, соли: классификация, номенклатура, способы получения и свойства.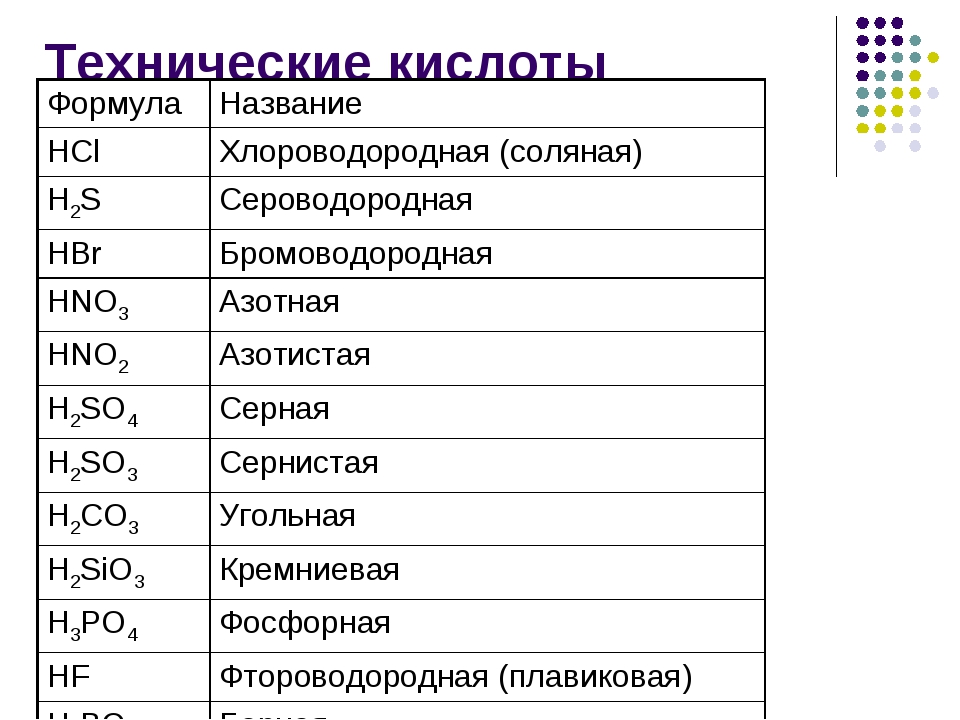 Амфотерность. Гидролиз солей.
Амфотерность. Гидролиз солей.
2. Неметаллы.
Водород, его химические и физические свойства.
Вода. Физические, химические свойства. Кристаллогидраты. Значение воды в промышленности, сельском хозяйстве, быту, природе. Охрана водоемов от загрязнения.
Общая характеристика элементов YII группы главной подгруппы. Хлор. Физические, химические свойства. Свойства и способы получения галогеноводородов, галогенидов, кислородсодержащих соединений хлора.
Общая характеристика элементов главной подгруппы YI группы. Кислород, его получение, сравнение физических и химических свойств кислорода и озона. Окислительно–восстановительные реакции с участием пероксида водорода. Сера, ее физические и химические свойства. Соединения серы: сероводород, оксиды серы (IY, YI). Серная и сернистая кислоты, их свойства, соли серной и сернистой кислот. Производство серной кислоты.
Общая характеристика элементов Y группы главной подгруппы. Азот. Физические и химические свойства. Свойства аммиака и солей аммония, оксидов азота (I, II, IY), азотистой кислоты и нитритов, азотной кислоты и нитратов. Производство аммиака и азотной кислоты. Фосфор, его физические и химические свойства. Свойства соединений фосфора: фосфороводорода, фосфидов, оксида фосфора (Y), фосфорной кислоты и фосфатов.
Общая характеристика элементов IY группы главной подгруппы. Углерод, его аллотропные модификации, физические и химические свойства.. Свойства соединений углерода: оксидов (II, IY), угольной кислоты и ее солей. Свойства кремния, оксида кремния, кремниевой кислоты и силикатов.
3. Металлы.
Положение в периодической системе. Особенности строения атомов металлов. Металлическая связь. Характерные физические и химические свойства. Электрохимический ряд напряжений металлов. Коррозия металлов.
Общая характеристика IА- и IIА- групп периодической системы. Свойства натрия, калия, кальция и магния и их соединений. Жесткость воды и способы ее устранения. Свойства алюминия и его соединений. Свойства железа, оксидов, гидроксидов и солей железа (II и III). Природные соединения железа. Свойства перманганата калия: восстановление перманганат иона в кислой, нейтральной и щелочной средах.
Медико-биологическое значение соединений указанных металлов.
Органическая химия.
1. Теоретические положения органической химии.
Основные положения теории химического строения А.М. Бутлерова. Зависимость свойств веществ от химического строения. Виды изомерии. Электронная природа химических связей в молекулах органических соединений, способы разрыва связей, понятие о свободных радикалах.
2. Основные классы органических соединений.
Углеводороды.
Гомологический ряд предельных углеводородов, их электронное и пространственное строение (sp3-гибридизация). Номенклатура, физические и химические свойства, способы получения предельных углеводородов. Циклоалканы.
Гомологический ряд этиленовых углеводородов. Двойная связь: σ– и p – связи, sp2–гибридизация. Изомерия углеродного скелета и положение двойной связи. Номенклатура этиленовых углеводородов. Физические и химические свойства, способы получения. Природный каучук, его строение и свойства.
Гомологический ряд ацетиленовых углеводородов. Тройная связь, sp–гибридизация. Номенклатура, физические и химические свойства, способы получения. Получение ацетилена карбидным способом и из метана.
Ароматические углеводороды (арены). Бензол, электронное и пространственное строение, химические свойства. Гомологи бензола. Понятие о взаимном влиянии атомов на примере толуола.
Природные источники углеводородов: нефть, природный газ и попутные нефтяные газы, уголь. Фракционная перегонка нефти. Крекинг. Ароматизация нефтепродуктов. Охрана окружающей среды при нефтепереработке.
Кислородсодержащие соединения.
Спирты, их строение. Номенклатура, химические свойства, способы получения спиртов. Многоатомные спирты, номенклатура, особые свойства (этиленгликоль, глицерин). Ядовитость спиртов, их губительное действие на организм человека. Фенол, его строение, физические и химические свойства фенола.
Альдегиды, их строение. Номенклатура, физические и химические свойства. Получение и применение муравьиного и уксусного альдегидов. Понятие о кетонах.
Карбоновые кислоты, их строение. Карбоксильная группа, взаимное влияние карбоксильной группы и углеводного радикала. Физические и химические свойства карбоновых кислот. Муравьиная, уксусная, стеариновая, олеиновая, бензойная кислоты. Получение и применение карбоновых кислот. Сложные эфиры. Строение, химические свойства. Реакция этерификации.
Азотсодержащие соединения.
Амины алифатические и ароматические, их строение. Номенклатура, химические свойства, способы получения аминов.
Аминокислоты. Строение, химические свойства, изомерия.
Понятие об азотсодержащих гетероциклических соединениях на примере пиридина и пиррола.
3. Важнейшие природные соединения.
Жиры, строение, химические свойства, их роль в природе.
Углеводы: строение и свойства глюкозы, рибозы, дезоксирибозы, сахарозы, крахмала и целлюлозы. Применение целлюлозы и её производных. Понятие об искусственных волокнах.
Синтез пептидов, их строение. Строение, структура и свойства белков. Успехи в изучении и синтезе белков. Значение микробиологической промышленности. Строение нуклеотидов и полинуклеотидов. Различие в строении РНК и ДНК. Биологическая роль указанных классов соединений.
Типовые расчетные задачи
1. Вычисление массовой или объемной доли компонента.
2. Вычисление молярной концентрации.
3. Вычисление относительных плотностей веществ в газообразном состоянии.
4. Вычисление объема газообразного вещества известной массы или известного количества при нормальных условиях.
5. Установление молекулярной формулы вещества по массовой доле элементов или по массам продуктов сгорания.
6. Вычисление массы (объема, количества вещества) одного из участников реакции по известной массе (объему, количеству вещества) другoгo участника реакции.
7. То же, с предварительным нахождением, какое из веществ вступает в реакцию полностью.
8. То же, с учетом выхода продукции реакции в процентах от теоретически возможного.
9. То же, с учетом массовой доли примесей в реагенте.
10. Определение состава соли (кислая или средняя) по массам веществ, вступающих в реакцию.
11. Определение состава двухкомпонентной смеси по массам веществ, образующихся в ходе одной или нескольких реакций.
Все расчетные задачи могут быть как в прямом, так и в обратном вариантах (например, расчет массовой доли вещества по его массе и известной массе раствора или же расчет массы вещества по известной массовой доле и массе раствора). Сложные задачи включают в себя две или больше перечисленных типовых задач.
Рекомендуемая литература
:
- Рудзитис Г.Е., Фельдман Ф.Г. Химия для 8–11 классов. М.: «Просвещение», 2011.
- Гузей Л.С. и др. Химия для 8-11 классов. М., «Дрофа», 2004.
- В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин. Химия для 8-11 классов. М.: Дрофа, 2008
- Габриелян О.С. Химия для 8-11 классов. М., «Дрофа», 2005.
- Гольдфарб Я.Л., Ходаков Ю.Б., Додонов Ю.Б. Сборник задач и упражнений по химии. — М.: «Дрофа», 2005.
- Е.А. Еремина, О.Н. Рыжова Справочник школьника по химии. Еремина М.: Издательство «Экзамен», 2006.
Дополнительная литература:
- Хомченко Г.П. Химия для поступающих в ВУЗы. М.: «Высшая школа», 2003.
- Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в ВУЗы. М., «Высшая школа», 2005.
- Кузьменко Н.Е., Магдесиева Н.Н., Еремин В.В. Задачи по химии для абитуриентов. Курс повышенной сложности. – М: «Высшая школа», 2004.
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия для школьников старших классов и поступающих в ВУЗы. М., «Дрофа», 2008.
- Егоров А.С., Дионисьев В.Д., Ермакова В.К. и др. Химия. Пособие – репетитор. Ростов-на-Дону, «Феникс», 2006.
ICSC 0486 — ПИВАЛИНОВАЯ КИСЛОТА
ICSC 0486 — ПИВАЛИНОВАЯ КИСЛОТА
| ПИВАЛИНОВАЯ КИСЛОТА | ICSC: 0486 |
| 2,2-ДИМЕТИЛПРОПАНОВАЯ КИСЛОТА | Май 2018 |
| CAS #: 75-98-9 | |
| UN #: 3261 | |
| EINECS #: 200-922-5 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. При температуре превышающей 64°C могут образовываться взрывоопасные смеси паров с воздухом. | НЕ использовать открытый огонь. При температуре свыше 64°C применять замкнутую систему и вентиляцию. | Использовать распыленную воду, порошок, спиртоустойчивую пену, двуокись углерода. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Кашель. Боли в горле. | Применять местную вытяжку. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. | Защитные перчатки. | Промыть кожу большим количеством воды или принять душ. обратиться за медицинской помощью в случае раздражения кожи.. |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: респиратор с фильтром для органических газов и твердых частиц, подходящий для концентрации вещества в воздухе. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Удалить жидкость при помощи песка или инертного абсорбента. Если вещество твердое: смести просыпанное вещество в контейнеров. При необходимости, сначала намочить, чтобы избежать появления пыли. Смыть остаток большим количеством воды. Хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН
ОСТОРОЖНО
Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных окислителей, оснований и пищевых продуктов и кормов. Хранить сухим. Хорошо закрывать. Вентиляция вдоль пола. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ПИВАЛИНОВАЯ КИСЛОТА | ICSC: 0486 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C5H10O2 / (CH3)3CCOOH |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Определение и примеры в химии
Кислота — это химическое соединение, которое отдает протоны или ионы водорода и / или принимает электроны. Большинство кислот содержат связанный атом водорода, который может высвобождаться (диссоциировать) с образованием катиона и аниона в воде. Чем выше концентрация ионов водорода, производимых кислотой, тем выше ее кислотность и ниже pH раствора.
Слово acidus происходит от латинских слов acidus или acere , которые означают «кислый», поскольку одна из характеристик кислот в воде — кислый вкус (напр.г., уксус или лимонный сок).
В этой таблице представлен обзор основных свойств кислот по сравнению с основаниями.
| Обзор кислотных и основных свойств | ||
|---|---|---|
| Имущество | Кислота | База |
| pH | менее 7 | больше 7 |
| лакмусовая бумага | от синего к красному | не меняет лакмусовую бумажку, но может вернуть кислотную (красную) бумагу обратно в синюю |
| вкус | кислый (e.г., уксус) | горькое или мыльное (например, пищевая сода) |
| запах | ощущение жжения | часто без запаха (исключение — аммиак) |
| текстура | липкий | скользкая |
| реактивность | реагирует с металлами с образованием газообразного водорода | реагирует с несколькими жирами и маслами |
Кислоты Аррениуса, Бренстеда-Лоури и Льюиса
Есть разные способы определения кислот.Под «кислотой» обычно подразумевается кислота Аррениуса или Бренстеда-Лоури. Кислоту Льюиса обычно называют «кислотой Льюиса». Причина различий в определениях заключается в том, что эти разные кислоты не включают один и тот же набор молекул:
- Кислота Аррениуса : Согласно этому определению кислота — это вещество, которое увеличивает концентрацию ионов гидроксония (H 3 O + ) при добавлении в воду. Вы также можете рассмотреть возможность увеличения концентрации иона водорода (H + ) в качестве альтернативы.
- Кислота Бренстеда-Лоури : Согласно этому определению кислота — это материал, способный действовать как донор протонов. Это менее ограничительное определение, потому что растворители, кроме воды, не исключаются. По существу, любое соединение, которое может быть депротонировано, представляет собой кислоту Бренстеда-Лоури, включая обычные кислоты, а также амины и спирт. Это наиболее широко используемое определение кислоты.
- Кислота Льюиса : Кислота Льюиса — это соединение, которое может принимать электронную пару с образованием ковалентной связи.Согласно этому определению, некоторые соединения, не содержащие водорода, квалифицируются как кислоты, включая трихлорид алюминия и трифторид бора.
Примеры кислот
Это примеры типов кислот и конкретных кислот:
- Аррениусовая кислота
- Кислота монопротоновая
- Кислота Льюиса
- Кислота соляная
- Серная кислота
- Плавиковая кислота
- Уксусная кислота
- Желудочная кислота (содержащая соляную кислоту)
- Уксус (содержащий уксусную кислоту)
- Лимонная кислота (содержится в цитрусовых)
Сильные и слабые кислоты
Кислоты можно определить как сильные или слабые в зависимости от того, насколько полно они диссоциируют на ионы в воде.Сильная кислота, такая как соляная кислота, полностью диссоциирует на ионы в воде. Слабая кислота только частично диссоциирует на ионы, поэтому раствор содержит воду, ионы и кислоту (например, уксусную кислоту).
Узнать больше
Смотри:
В чем разница между кислотами и основаниями?
| |
Определения кислот и оснований
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
то
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Кислоты и основания — Викиверситет
В химии соединение может быть кислотой или основанием. Кислоты и основания очень важны в химии. Они описывают большой класс веществ.Понимание их свойств позволяет нам рационализировать закономерности, встречающиеся в химии.
Контрастные свойства кислот и щелочей [править | править источник]
Вот список, который противопоставляет их свойства:
- Кислоты окрашивают синюю лакмусовую бумажку в красный цвет. Основания окрашиваются в красный цвет лакмусовой бумаги в синий цвет.
- Кислоты выделяют ионы H + (водорода) в воде; основания выделяют ионы OH- (гидроксид) в воде.
- Кислоты обычно имеют кислый привкус из-за кислых ионов H +; основы горькие на вкус из-за иона ОН-; но у них могут быть другие вкусы в зависимости от другой части молекулы.
- Основания обычно мыльные.
- Кислоты разъедают активные металлы; Основы денатурируют белок.
- Кислоты имеют pH менее 7; Основания имеют pH больше 7
Подобные свойства кислот и щелочей [править | править источник]
Вот список свойств, общих для кислот и оснований.
- Когда вы растворяете кислоту или основание в воде, они образуют ионы. Благодаря этому вода лучше проводит электричество.
- Чем сильнее кислота (или основание), тем больше образуется ионов, поэтому проводимость раствора увеличивается.
- Оба они могут проводить электричество.
- Когда кислота реагирует с основанием, образуется соль
- Они оба могут переносить и делить ионы
Кислоты реагируют с металлами 1 и 2 групп с образованием газообразного водорода.
Кислоты с pH менее 3 взорвутся при взаимодействии с раствором Дойера.
Примеры обычных кислых веществ [править | править источник]
- Цитрусовые (апельсины, лимоны, лаймы)
- Яблоки
- Ананасы
- Манго
- Вода и безалкогольные напитки (углекислый газ реагирует в воде с образованием углекислоты)
- Желудочная кислота
- Уксус
- Жидкие очистители для слива, содержащие серную кислоту (Rooto)
Вещи, уникальные для щелочей (оснований) [править | править источник]
Основания кажутся скользкими и мыльными, потому что они гидролизуют эфир жирных кислот кожи (реакция омыления).
Примеры обычных вещей, которыми являются щелочи [править | править источник]
- Мыло для рук
- Щелок
- Сода пищевая
- Отбеливатель
- Шпинат
- Очиститель окон
- Укус осы
- Очиститель для дренажа (Drano, Red Devil)
- Зубная паста
14.3 Относительная сила кислот и оснований — Химия 2e
Задачи обучения
К концу этого раздела вы сможете:
- Оценивать относительную силу кислот и оснований в соответствии с их константами ионизации
- Обосновать тенденции кислотно-щелочной силы в зависимости от молекулярной структуры
- Выполнение расчетов равновесия для слабых кислотно-основных систем
Константы ионизации кислоты и основания
Относительная сила кислоты или основания — это степень, до которой они ионизируются при растворении в воде.Если реакция ионизации практически завершена, кислоту или основание называют сильным ; если происходит относительно небольшая ионизация, кислота или основание слабые. Как будет видно из оставшейся части этой главы, слабых кислот и оснований намного больше, чем сильных. Наиболее распространенные сильные кислоты и основания перечислены на рис. 14.6.
Рис. 14.6 Здесь перечислены некоторые из наиболее распространенных сильных кислот и оснований.
Относительная сила кислот может быть определена количественно путем измерения их констант равновесия в водных растворах.В растворах с той же концентрацией более сильные кислоты ионизируются в большей степени и, следовательно, дают более высокие концентрации ионов гидроксония, чем более слабые кислоты. Константа равновесия кислоты называется константой ионизации кислоты, K a . Для реакции кислоты HA:
HA (aq) + h3O (l) ⇌h4O + (aq) + A− (aq), HA (aq) + h3O (l) ⇌h4O + (aq) + A− (aq) ,
записана константа кислотной ионизации
Ka = [h4O +] [A -] [HA] Ka = [h4O +] [A -] [HA]
, где концентрации являются равновесными.Хотя вода является реагентом в реакции, она также является растворителем, поэтому мы не включаем [H 2 O] в уравнение. Чем больше K a кислоты, тем больше концентрация h4O + h4O + и A — по сравнению с концентрацией неионизированной кислоты HA в равновесной смеси и тем сильнее кислота. Кислота классифицируется как «сильная», когда она подвергается полной ионизации, и в этом случае концентрация ГК равна нулю, а константа кислотной ионизации неизмеримо велика ( K a ≈ ∞).Частично ионизированные кислоты называются «слабыми», и их константы кислотной ионизации могут быть измерены экспериментально. Таблица констант ионизации для слабых кислот представлена в Приложении H.
Чтобы проиллюстрировать эту идею, ниже показаны три уравнения кислотной ионизации и значения K a . Константы ионизации увеличиваются от первого к последнему из перечисленных уравнений, показывая, что относительная сила кислоты увеличивается в порядке CH 3 CO 2 H Ch4CO2H (водн.) + H3O (l) ⇌h4O + (водн.) + Ch4CO2- (водн.) Ka = 1.8 × 10−5Ch4CO2H (вод.) + H3O (l) ⇌h4O + (вод.) + Ch4CO2− (вод.) Ka = 1,8 × 10−5 Еще одним показателем силы кислоты является процент ионизации. Процент ионизации слабой кислоты определяется в терминах состава равновесной смеси: % ионизации = [h4O +] экв [HA] 0 × 100% ионизация = [h4O +] экв [HA] 0 × 100 , где числитель эквивалентен концентрации сопряженного основания кислоты (по стехиометрии [A — ] = [H 3 O + ]).В отличие от значения K a , процент ионизации слабой кислоты изменяется с начальной концентрацией кислоты, обычно уменьшаясь с увеличением концентрации. Расчеты равновесия, описанные ниже в этой главе, могут быть использованы для подтверждения этого поведения. Рассчитайте процент ионизации раствора азотистой кислоты (слабая кислота) 0,125- M с pH 2,09. Процент ионизации кислоты составляет: Преобразование предоставленного pH в молярность иона гидроксония дает [h4O +] = 10−2.09 = 0,0081M [h4O +] = 10-2,09 = 0,0081M Подставляя это значение и полученную начальную концентрацию кислоты в уравнение процентной ионизации, получаем 8,1 × 10–30,125 × 100 = 6,5% 8,1 × 10–30,125 × 100 = 6,5% (Напомним, что предоставленное значение pH 2,09 является логарифмическим, поэтому оно содержит только две значащие цифры, что ограничивает достоверность вычисленного процента ионизации.) Рассчитайте процент ионизации раствора уксусной кислоты 0,10- M с pH 2.89. Просмотр моделирования сильных и слабых кислот и оснований на молекулярном уровне. Как и в случае кислот, относительная сила основания отражается в величине его константы ионизации основания ( K b ) в водных растворах. В растворах с той же концентрацией более сильные основания ионизируются в большей степени и поэтому дают более высокие концентрации гидроксид-иона, чем более слабые основания. Более сильное основание имеет большую константу ионизации, чем более слабое основание.Для реакции основания, B: B (водн.) + H3O (l) ⇌HB + (aq) + OH− (aq), B (aq) + h3O (l) ⇌HB + (aq) + OH− (aq), константа ионизации записывается как Kb = [HB +] [OH -] [B] Kb = [HB +] [OH -] [B] Анализ данных для трех слабых оснований, представленных ниже, показывает, что прочность основания увеличивается в порядке NO2- NO2− (вод. 5.6 × 10−10Nh4 (aq) + h3O (l) ⇌Nh5 + (aq) + OH− (aq) Kb = 1.8 × 10−5NO2− (aq) + h3O (l) ⇌HNO2 (aq) + OH− (aq ) Kb = 2.17 × 10−11Ch4CO2− (aq) + h3O (l) ⇌Ch4CO2H (aq) + OH− (aq) Kb = 5.6 × 10−10Nh4 (aq) + h3O (l) ⇌Nh5 + (aq) + OH− (aq ) Кб = 1,8 × 10−5 Таблица констант ионизации для слабых оснований приведена в Приложении I. Что касается кислот, относительная сила основания также отражается в его процентной ионизации, вычисляемой как . , но будет варьироваться в зависимости от константы базовой ионизации и начальной концентрации раствора. Кислотно-основная химия Бренстеда-Лоури — это перенос протонов; таким образом, логика предполагает связь между относительной силой конъюгированных кислотно-основных пар.Сила кислоты или основания количественно выражается в ее константе ионизации, K a или K b , которая представляет собой степень реакции ионизации кислотой или основанием. Для сопряженной пары кислота-основание HA / A — уравнения ионизационного равновесия и выражения для константы ионизации равны . Сложение этих двух химических уравнений дает уравнение для автоионизации воды: HA (aq) + h3O (l) + A− (aq) + h3O (l) ⇌h4O + (aq) + A− (aq) + OH− (aq) + HA (aq) HA (aq) + h3O (l ) + A− (aq) + h3O (l) ⇌h4O + (aq) + A− (aq) + OH− (aq) + HA (aq). Как обсуждалось в другой главе о равновесии, константа равновесия для суммированной реакции равна математическому произведению констант равновесия для добавленных реакций, поэтому Ka × Kb = [h4O +] [A -] [HA] × [ HA] [OH -] [A -] = [h4O +] [OH -] = KwKa × Kb = [h4O +] [A -] [HA] × [HA] [OH -] [A -] = [h4O +] [ OH -] = кВт Это уравнение устанавливает соотношение между константами ионизации для любой сопряженной пары кислота-основание, а именно, их математическое произведение равно ионному произведению воды, K w .При изменении этого уравнения становится очевидной обратная связь между силами пары сопряженная кислота-основание: Ka = кВт / KborKb = кВт / KaKa = кВт / KborKb = кВт / Ka Обратная пропорциональная зависимость между K a и K b означает, что чем сильнее кислота или основание, тем слабее ее сопряженный партнер . Рисунок 14.7 иллюстрирует это соотношение для нескольких пар конъюгированных кислот и оснований. Рис. 14.7 Показаны относительные силы нескольких пар конъюгированных кислот и оснований. Рис. 14.8 На этом рисунке показаны силы сопряженных кислотно-основных пар относительно силы воды в качестве эталонного вещества. Перечень пар сопряженных кислот и оснований, показанный на рисунке 14.8, составлен таким образом, чтобы показать относительную силу каждого вида по сравнению с водой, значения которой выделены в каждом столбце таблицы. В столбце с кислотами те виды, которые указаны под водой, являются более слабыми кислотами, чем вода. Эти виды не подвергаются кислотной ионизации в воде; они не являются кислотами Бренстеда-Лоури.Все перечисленные выше виды воды являются более сильными кислотами, которые в некоторой степени переносят протоны в воду при растворении в водном растворе с образованием ионов гидроксония. Виды над водой, но ниже иона гидроксония представляют собой слабых кислот , подвергающихся частичной кислотной ионизации, тогда как те, что выше иона гидроксония, представляют собой сильных кислот , которые полностью ионизируются в водном растворе. Если все эти сильные кислоты полностью ионизированы в воде, почему в столбце указано, что они различаются по силе, причем азотная кислота является самой слабой, а хлорная кислота — самой сильной? Обратите внимание, что единственная разновидность кислоты, присутствующая в водном растворе любой сильной кислоты, — это H 3 O + ( водн. ), что означает, что ион гидроксония является самой сильной кислотой, которая может существовать в воде; любая более сильная кислота будет полностью реагировать с водой с образованием ионов гидроксония.Этот предел кислотной силы растворенных веществ в растворе называется эффектом выравнивания . Чтобы измерить разницу в силе кислот для «сильных» кислот, кислоты должны быть растворены в растворителе, который на меньше основного , чем вода. В таких растворителях кислоты будут «слабыми», поэтому можно определить любые различия в степени их ионизации. Например, бинарные галогениды водорода HCl, HBr и HI являются сильными кислотами в воде, но слабыми кислотами в этаноле (HCl В правом столбце рисунка 14.8 перечислены вещества в порядке увеличения прочности основания сверху вниз. Следуя той же логике, что и в левом столбце, перечисленные выше вещества являются более слабыми основаниями, поэтому они не подвергаются ионизации основанием при растворении в воде. Виды, перечисленные между водой и сопряженным с ней основанием, гидроксид-ионом, являются слабыми основаниями, которые частично ионизируются. Перечисленные ниже гидроксид-ионы представляют собой сильные основания, которые полностью ионизируются в воде с образованием гидроксид-ионов (т.е.е., они сравнялись с до гидроксида). Сравнение столбцов «кислота» и «основание» в этой таблице подтверждает обратное соотношение между силами конъюгированных кислотно-основных пар. Например, все сопряженные основания сильных кислот (вверху таблицы) имеют незначительную силу. Сильная кислота показывает неизмеримо большие K a , и поэтому ее сопряженное основание будет иметь K b , которое по существу равно нулю: сильная кислота: Ka≈∞конъюгированная основа: Kb = Kw / Ka = Kw / ∞≈0 сильная кислота: Ka≈∞конъюгированная основа: Kb = Kw / Ka = Kw / ∞≈0 Аналогичный подход может быть использован для подтверждения наблюдения, что конъюгированные кислоты сильных оснований ( K b ≈ ∞) имеют незначительную силу ( K a ≈ 0). Используйте K b для нитрит-иона NO2-, NO2-, чтобы вычислить K a для его сопряженной кислоты. K b для NO2 − NO2− в этом разделе указано как 2,17 × × 10 −11 . Кислота, сопряженная с NO2-NO2-, представляет собой HNO 2 ; K a для HNO 2 можно рассчитать, используя соотношение: Ka × Kb = 1.0 × 10−14 = KwKa × Kb = 1.0 × 10−14 = Kw Решение относительно K a дает Ka = KwKb = 1,0 × 10−142,17 × 10−11 = 4,6 × 10−4Ka = KwKb = 1,0 × 10−142,17 × 10−11 = 4,6 × 10−4 Этот ответ можно проверить, найдя K a для HNO 2 в Приложении H. Определите относительную концентрацию кислот Nh5 + Nh5 + и HCN, сравнив их константы ионизации. Константа ионизации HCN приведена в Приложении H как 4,9 × × 10 −10 .Константа ионизации Nh5 + Nh5 + не указана, но константа ионизации его сопряженного основания, NH 3 , указана как 1,8 × × 10 −5 . Nh5 + Nh5 + — немного более сильная кислота ( K a для Nh5 + Nh5 + = 5.6 × × 10 −10 ). В главе о химическом равновесии были представлены несколько типов расчетов равновесия и различные математические стратегии, которые помогают их выполнять.Эти стратегии обычно полезны для равновесных систем независимо от класса химической реакции, и поэтому они могут быть эффективно применены к задачам кислотно-основного равновесия. В этом разделе представлены несколько примеров упражнений, включающих расчет равновесия для кислотно-основных систем. K a из равновесных концентраций Уксусная кислота — основной ингредиент уксуса (рис. 14.9), который придает ему кислый вкус.В состоянии равновесия раствор содержит [CH 3 CO 2 H] = 0,0787 M и [h4O +] = [Ch4CO2 -] = 0,00118M. [H4O +] = [Ch4CO2 -] = 0,00118M. Каково значение K a для уксусной кислоты? Рис. 14.9 Уксус содержит уксусную кислоту, слабую кислоту. (кредит: модификация работы «HomeSpot HQ» / Flickr) Соответствующее уравнение равновесия и выражение его константы равновесия показаны ниже. Замена предоставленных равновесных концентраций позволяет напрямую вычислить K на для уксусной кислоты.Ch4CO2H (водн.) + H3O (l) ⇌h4O + (водн.) + Ch4CO2− (водн.) Ch4CO2H (водн.) + H3O (l) ⇌h4O + (водн.) + Ch4CO2− (водн.) Ион HSO4-HSO4-, слабая кислота, используемая в некоторых бытовых чистящих средствах: Какова константа кислотной ионизации этой слабой кислоты, если равновесная смесь имеет следующий состав: [h4O +] [h4O +] = 0.027 М ; [HSO4 -] = 0,29 М; [HSO4 -] = 0,29 М; и [SO42 -] = 0,13M? [SO42 -] = 0,13M? K a для HSO4 − HSO4− = 1,2 × × 10 −2 K b из равновесных концентраций Кофеин, C 8 H 10 N 4 O 2 — слабое основание. Каково значение K b для кофеина, если раствор в состоянии равновесия имеет [C 8 H 10 N 4 O 2 ] = 0.050 M , [C8h20N4O2H +] [C8h20N4O2H +] = 5,0 × × 10 −3 M и [OH — ] = 2,5 × × 10 −3 M ? Соответствующее уравнение равновесия и выражение его константы равновесия показаны ниже. Замена предоставленных равновесных концентраций позволяет напрямую вычислить K b для кофеина. Какова константа равновесия ионизации иона HPO42-HPO42-, слабого основания? , если состав равновесной смеси следующий: [OH — ] = 1,3 × × 10 −6 M ; [h3PO4 -] = 0,042 М; [h3PO4 -] = 0,042 М; и [HPO42 -] = 0,341M? [HPO42 -] = 0,341M? K b для HPO42− = 1.6 × 10−7HPO42− = 1,6 × 10−7 K a или K b от pH PH раствора азотистой кислоты HNO 2 0,0516- M составляет 2,34. Какой у него K a ? Предусмотренная концентрация азотистой кислоты составляет формальных концентраций, которые не учитывают какое-либо химическое равновесие, которое может быть установлено в растворе.Такие концентрации рассматриваются как «начальные» значения для расчетов равновесия с использованием табличного подхода ICE. Обратите внимание, что начальное значение иона гидроксония указано как , приблизительно ноль, потому что присутствует небольшая концентрация H 3 O + (1 × 10 −7 M ) из-за автопротолиза воды. Во многих случаях, таких как все, представленные в этой главе, эта концентрация намного меньше, чем концентрация, создаваемая ионизацией рассматриваемой кислоты (или основания), и ею можно пренебречь. Приведенный pH является логарифмической мерой концентрации иона гидроксония, возникающей в результате кислотной ионизации азотистой кислоты, и, таким образом, представляет собой «равновесное» значение для таблицы ICE: [h4O +] = 10-2,34 = 0,0046M [h4O +] = 10-2,34 = 0,0046M Таблица ICE для этой системы тогда Наконец, рассчитайте значение константы равновесия, используя данные в таблице: Ka = [h4O +] [NO2 -] [HNO2] = (0,0046) (0,0046) (0,0470) = 4,6 × 10−4Ka = [h4O +] [NO2 -] [HNO2] = (0,0046) (0,0046) (0.0470) = 4,6 × 10−4 PH раствора бытового аммиака 0,950- M , раствора NH 3, составляет 11,612. Что такое K b для NH 3 . Муравьиная кислота, HCO 2 H, является одним из раздражителей, вызывающих реакцию организма на укусы и укусы некоторых муравьев (рис. 14.10). Рис. 14.10 Боль при укусе и укусе некоторых муравьев вызывается муравьиной кислотой.(кредит: Джон Танн) Каковы концентрация иона гидроксония и pH 0,534- M раствора муравьиной кислоты ? HCO2H (водн.) + H3O (л) ⇌h4O + (водн.) + HCO2− (водн.) Ka = 1,8 × 10−4HCO2H (водн.) + H3O (l) ⇌h4O + (водн.) + HCO2− (вод.) Ka = 1,8 × 10−4 Таблица ICE для этой системы — Подстановка членов равновесной концентрации в K выражение дает Ka = 1,8 × 10–4 = [h4O +] [HCO2 -] [HCO2H] Ka = 1,8 × 10–4 = [h4O +] [HCO2 -] [HCO2H] = (x) (x) 0.534 − x = 1,8 × 10−4 = (x) (x) 0,534 − x = 1,8 × 10−4 Относительно большая начальная концентрация и малая константа равновесия позволяет сделать упрощающее предположение, что x будет намного меньше 0,534, и поэтому уравнение принимает вид Ka = 1,8 × 10−4 = x20,534Ka = 1,8 × 10−4 = x20,534 Решение уравнения для x дает x2 = 0,534 × (1,8 × 10–4) = 9,6 × 10–5×2 = 0,534 × (1,8 × 10–4) = 9,6 × 10–5x = 9,6 × 10–5x = 9,6 × 10–5 = 9,8 × 10 −3M = 9,8 × 10−3M Чтобы проверить предположение, что x мало по сравнению с 0.534, его относительная величина может быть оценена: x0,534 = 9,8 · 10−30,534 = 1,8 · 10−2 (1,8% от 0,534) x0,534 = 9,8 · 10−30,534 = 1,8 · 10−2 (1,8% от 0,534) Поскольку x составляет менее 5% от начальной концентрации, предположение верно. Как определено в таблице ICE, x равно равновесной концентрации иона гидроксония: x = [h4O +] = 0,0098Mx = [h4O +] = 0,0098M Наконец, рассчитанный pH составляет . В водном растворе ионизируется лишь небольшая часть слабой кислоты. Каков процент ионизации раствора уксусной кислоты 0,100- M , CH 3 CO 2 H? процент ионизации = 1,3% Найдите концентрацию гидроксид-иона, pOH и pH 0.25- M раствор триметиламина, слабое основание: Таблица ICE для этой системы — Подстановка членов равновесной концентрации в выражение K b дает Кбайт = [(Ch4) 3NH +] [OH -] [(Ch4) 3N] = (x) (x) 0,25 − x = 6,3 × 10−5 Кбайт = [(Ch4) 3NH +] [OH -] [(Ch4) 3N] = (x) (x) 0,25 − x = 6,3 × 10-5 Предполагая, что x << 0.25 и решение для x дает x = 4,0 × 10−3Mx = 4,0 × 10−3M Это значение меньше 5% от начальной концентрации (0,25), поэтому предположение оправдано. [OH -] = ~ 0 + x = x = 4,0 · 10−3M [OH -] = ~ 0 + x = x = 4,0 · 10−3M = 4,0 · 10−3M = 4,0 · 10−3M По расчетам pOH составляет pOH = −log (4,0 × 10−3) = 2,40 pOH = −log (4,0 × 10−3) = 2,40 Используя отношение, представленное в предыдущем разделе этой главы: pH + pOH = pKw = 14.00pH + pOH = pKw = 14,00 позволяет вычислить pH: pH = 14,00 − pOH = 14,00−2,40 = 11,60 pH = 14,00 − pOH = 14,00−2,40 = 11,60 Рассчитайте концентрацию гидроксид-иона и процент ионизации 0,0325- M раствора аммиака , слабого основания с K b 1,76 × × 10 −5 . В некоторых случаях сила слабой кислоты или основания и его формальная (начальная) концентрация приводят к значительной ионизации.Хотя стратегия ICE остается эффективной для этих систем, алгебра немного сложнее, потому что упрощающее предположение о том, что x незначительно, не может быть сделано. Расчеты такого рода показаны в примере 14.14 ниже. Бисульфат натрия, NaHSO 4 , используется в некоторых бытовых чистящих средствах в качестве источника иона HSO4-HSO4-, слабой кислоты. Какой pH у 0.50- M раствор HSO4−? HSO4−? Таблица ICE для этой системы — Подставляя члены равновесной концентрации в K , выражение дает Ka = 1,2 × 10−2 = [h4O +] [SO42 -] [HSO4 -] = (x) (x) 0,50 − xKa = 1,2 × 10−2 = [h4O +] [SO42 -] [HSO4 -] = ( х) (х) 0,50 − х Если предположить, что x << 0,5, упрощение и решение приведенного выше уравнения дает Это значение x явно ненамного меньше 0.50 М ; скорее, это примерно 15% от начальной концентрации: x0,50 = 7,7 × 10−20,50 = 0,15 (15%) x0,50 = 7,7 × 10−20,50 = 0,15 (15%) Поскольку упрощающее предположение для этой системы неприменимо, выражение константы равновесия решается следующим образом: Ka = 1,2 × 10−2 = (x) (x) 0,50 − xKa = 1,2 × 10−2 = (x) (x) 0,50 − x Преобразуя это уравнение, получаем 6,0 × 10−3−1,2 × 10−2x = x26,0 × 10−3−1,2 × 10−2x = x2 Запись уравнения в квадратичной форме дает х2 + 1.2 × 10−2x − 6,0 × 10−3 = 0x2 + 1,2 × 10−2x − 6,0 × 10−3 = 0 Решение для двух корней этого квадратного уравнения приводит к отрицательному значению, которое может быть отброшено как физически нерелевантное, и положительному значению, равному x . Как определено в таблице ICE, x равно концентрации гидроксония. x = [h4O +] = 0,072MpH = −log [h4O +] = — log (0,072) = 1,14x = [h4O +] = 0,072MpH = −log [h4O +] = — log (0,072) = 1,14 Рассчитайте pH 0,010- M раствора кофеина , слабого основания: В отсутствие какого-либо выравнивающего эффекта кислотная сила бинарных соединений водорода с неметаллами (A) увеличивается по мере того, как прочность связи H-A уменьшается по группе в периодической таблице. Для группы 17 порядок увеличения кислотности HF По всей строке периодической таблицы, кислотная сила бинарных водородных соединений увеличивается с увеличением электроотрицательности атома неметалла, потому что полярность связи H-A увеличивается. Таким образом, порядок увеличения кислотности (для удаления одного протона) во втором ряду: CH 4 Рисунок 14.11 На рисунке показаны тенденции силы бинарных кислот и оснований. Тройные соединения, состоящие из водорода, кислорода и некоторого третьего элемента («E»), могут иметь структуру, как показано на изображении ниже. В этих соединениях центральный атом E связан с одним или несколькими атомами O, и по крайней мере один из атомов O также связан с атомом H, что соответствует общей молекулярной формуле O m E (OH) n . Эти соединения могут быть кислотными, основными или амфотерными в зависимости от свойств центрального атома E.Примеры таких соединений включают серную кислоту, O 2 S (OH) 2 , серную кислоту, OS (OH) 2 , азотную кислоту, O 2 NOH, хлорную кислоту, O 3 ClOH, алюминий. гидроксид, Al (OH) 3 , гидроксид кальция, Ca (OH) 2 , и гидроксид калия, KOH: Если центральный атом E имеет низкую электроотрицательность, его притяжение для электронов низкое. У центрального атома существует небольшая тенденция к образованию прочной ковалентной связи с атомом кислорода, и связь a между элементом и кислородом легче разрывается, чем связь b между кислородом и водородом.Следовательно, связь a является ионной, гидроксид-ионы выделяются в раствор, и материал ведет себя как основание — как в случае с Ca (OH) 2 и KOH. Более низкая электроотрицательность характерна для более металлических элементов; следовательно, металлические элементы образуют ионные гидроксиды, которые по определению являются основными соединениями. Если, с другой стороны, атом E имеет относительно высокую электроотрицательность, он сильно притягивает электроны, которые он разделяет с атомом кислорода, делая связь относительно сильно ковалентной.Связь кислород-водород, связь b , тем самым ослабляется, потому что электроны смещаются в сторону E. Связь b является полярной и легко выделяет ионы водорода в раствор, поэтому материал ведет себя как кислота. Высокие электроотрицательности характерны для более неметаллических элементов. Таким образом, неметаллические элементы образуют ковалентные соединения, содержащие кислотные группы -OH, которые называются оксикислотами. Увеличение степени окисления центрального атома E также увеличивает кислотность оксикислоты, потому что это увеличивает притяжение E для электронов, которые он разделяет с кислородом, и тем самым ослабляет связь O-H.Серная кислота, H 2 SO 4 , или O 2 S (OH) 2 (со степенью окисления серы +6), более кислая, чем сернистая кислота, H 2 SO 3 , или OS (OH) 2 (со степенью окисления серы +4). Аналогично, азотная кислота, HNO 3 или O 2 NOH (степень окисления N = +5), более кислая, чем азотистая кислота, HNO 2 или ONOH (степень окисления N = +3). В каждой из этих пар степень окисления центрального атома больше для более сильной кислоты (Рисунок 14.12). Рис. 14.12 По мере увеличения степени окисления центрального атома E кислотность также увеличивается. Гидроксисоединения элементов со средней электроотрицательностью и относительно высокой степенью окисления (например, элементы, расположенные рядом с диагональной линией, отделяющей металлы от неметаллов в периодической таблице), обычно являются амфотерными. Это означает, что гидроксисоединения действуют как кислоты, когда они реагируют с сильными основаниями, и как основания, когда они реагируют с сильными кислотами.Амфотеризм гидроксида алюминия, который обычно существует в виде гидрата Al (H 2 O) 3 (OH) 3 , отражается в его растворимости как в сильных кислотах, так и в сильных основаниях. В сильных основаниях относительно нерастворимый гидратированный гидроксид алюминия, Al (H 2 O) 3 (OH) 3 , превращается в растворимый ион [Al (h3O) 2 (OH) 4] -, [ Al (h3O) 2 (OH) 4] -, реакцией с гидроксид-ионом: Al (h3O) 3 (OH) 3 (водн.) + OH− (водн.) ⇌h3O (l) + [Al (h3O) 2 (OH) 4] — (водн.) Al (h3O) 3 (OH) 3 (водн. ) + OH− (водн.) ⇌h3O (l) + [Al (h3O) 2 (OH) 4] — (водн.) В этой реакции протон передается от одной из связанных с алюминием молекул H 2 O к гидроксид-иону в растворе.Таким образом, соединение Al (H 2 O) 3 (OH) 3 действует как кислота в этих условиях. С другой стороны, при растворении в сильных кислотах он превращается в растворимый ион [Al (h3O) 6] 3+ [Al (h3O) 6] 3+ путем реакции с ионом гидроксония: 3h4O + (водн.) + Al (h3O) 3 (OH) 3 (водн.) ⇌Al (h3O) 63+ (водн.) + 3h3O (l) 3h4O + (водн.) + Al (h3O) 3 (OH) 3 (водн.) ⇌ Al (h3O) 63+ (водн.) + 3h3O (л) В этом случае протоны переносятся от ионов гидроксония в растворе на Al (H 2 O) 3 (OH) 3 , и соединение действует как основание. Кислоты и основания имеют решающее значение, когда дело доходит до органической химии. Не те сумасшедшие ледовые карты и расчеты pKa. На уровне органической химии вас попросят дифференцировать и ранжировать кислоты и основания, глядя на их молекулярную структуру и сравнивая их реакции. Это проявляется в начале Orgo 1, когда вы изучаете материал, затем снова при ранжировании реакционной способности оснований в реакциях элиминирования и снова в Orgo 2 при изучении стабильности сложных молекул. Как репетитор по орго, я часто расстраиваюсь из-за того, как преподается этот материал. Мои ученики приходят ко мне, сбитые с толку данными, которые они запомнили, но не понимают. И поэтому я создал то, что, как я надеюсь, является полным ресурсом, который поможет вам ПОЛУЧИТЬ кислоты и основания. Обязательно посмотрите каждое видео, чтобы узнать информацию о концепции / тенденциях. Если вы хотите, чтобы этот предмет уделял больше внимания математике, см. Мою серию уроков по MCAT Acid / Base. Тогда скачайте мою БЕСПЛАТНУЮ шпаргалку по кислотной базе , чтобы заниматься на ходу.А когда почувствуете себя готовым, посмотрите, как вы справляетесь, в моем тесте на кислотную основу . Не забудьте взять с собой мини-шпаргалку по сильным кислотам / основам. Первый шаг к ранжированию кислот и оснований для ПОНИМАНИЯ кислот и оснований. Это видео знакомит вас с определениями Аррениуса, Бронстеда-Лоури и Льюиса с точки зрения логики, а не запоминания. В этом видео также показано, как распознать кислоту / основание в реакционной паре конъюгата. Вот небольшая статья, дополняющая вводное видео: Это видео вполне может быть недостающим звеном между вашим учебником и логикой кислотно-щелочного ранжирования. Начните с изучения взаимосвязи ka / pKa / силы кислоты, а затем узнайте, что вам ДЕЙСТВИТЕЛЬНО нужно понять для сильных и слабых кислот. Видео 3 CARIO C = Заряд Видео 4 CARIO A = Atom
HNO2 (водный раствор) + h3O (l) ⇌h4O + (водный раствор) + NO2− (водный раствор) Ka = 4,6 × 10−4HNO2 (водный раствор) + h3O (l) ⇌h4O + (водный раствор) + NO2− (водный раствор) Ka = 4,6 × 10−4
HSO4− (водный раствор) + h3O (водный раствор) ⇌h4O + (водный раствор) + SO42− (водный раствор) Ka = 1,2 × 10−2 HSO4− (водный раствор) + h3O (водный раствор) ah4O + (водный раствор) + SO42− (водный раствор) Ka = 1,2 × 10−2 Пример 14,7
Расчет процентной ионизации от pH
Решение
[h4O +] экв [HNO2] 0 × 100 [h4O +] экв [HNO2] 0 × 100 Проверьте свои знания
Ссылка на обучение
% ионизации = [OH-] экв / [B] 0 × 100 %% ионизация = [OH-] экв / [B] 0 × 100% Относительные силы конъюгированных кислотно-основных пар
HA (aq) + h3O (l) ⇌h4O + (aq) + A− (aq) Ka = [h4O +] [A -] [HA] HA (aq) + h3O (l) ⇌h4O + (aq) + A− ( aq) Ka = [h4O +] [A -] [HA]
A− (aq) + h3O (l) ⇌OH− (aq) + HA (aq) Kb = [HA] [OH -] [A−] A− (aq) + h3O (l) ⇌OH− (aq) + HA (водн.) Kb = [HA] [OH -] [A−]
2h3O (l) ⇌h4O + (водный) + OH− (водный) 2h3O (l) ⇌h4O + (водный) + OH− (водный) Пример 14,8
Расчет констант ионизации для сопряженных кислотно-основных пар
Раствор
Проверьте свои знания
Ответ:
Расчет кислотно-основного равновесия
Пример 14.9
Определение
Решение
Ka = [h4O +] [Ch4CO2 -] [Ch4CO2H] = (0,00118) (0,00118) 0,0787 = 1,77 × 10−5Ka = [h4O +] [Ch4CO2 -] [Ch4CO2H] = (0,00118) (0,00118) 0,0787 = 1,77 × 10− 5 Проверьте свои знания
HSO4− (водный) + h3O (l) ⇌h4O + (водный) + SO42− (водный) HSO4− (водный) + h3O (l) ⇌h4O + (водный) + SO42− (водный) Ответ:
Пример 14.10
Определение
Решение
C8h20N4O2 (водн.) + H3O (l) ⇌C8h20N4O2H + (водн.) + OH- (водн.) C8h20N4O2 (водн.) + H3O (l) ⇌C8h20N4O2H + (водн.) + OH- (водн.)
Kb = [C8h20N4O2H +] [OH -] [C8h20N4O2] = (5.0 × 10–3) (2,5 × 10–3) 0,050 = 2,5 × 10–4Kb = [C8h20N4O2H +] [OH -] [C8h20N4O2] = (5,0 × 10–3) (2,5 × 10–3) 0,050 = 2,5 × 10−4 Проверьте свои знания
HPO42− (водн.) + H3O (l) ⇌h3PO4− (водн.) + OH− (водн.) HPO42− (aq) + h3O (l) ⇌h3PO4− (водн.) + OH− (водн.) Ответ:
Пример 14.11
Определение
HNO2 (водный) + h3O (l) ⇌h4O + (водный) + NO2- (водный) HNO2 (водный) + h3O (l) ⇌h4O + (водный) + NO2− (водный) Решение
Проверьте свои знания.
Пример 14.12
Расчет равновесных концентраций в слабокислом растворе
Решение
pH = −log [h4O +] = — log (0,0098) = 2,01 pH = −log [h4O +] = — log (0.0098) = 2,01 Проверьте свои знания
Ch4CO2H (водн.) + H3O (л) ⇌h4O + (водн.) + Ch4CO2− (водн.) Ka = 1,8 × 10−5Ch4CO2H (водн.) + H3O (л) h4O + (водн.) + Ch4CO2− (водн.) Ka = 1,8 × 10−5 Ответ:
Пример 14.13
Расчет равновесных концентраций в слабом основном растворе
(Ch4) 3N (aq) + h3O (l) ⇌ (Ch4) 3NH + (aq) + OH− (aq) Kb = 6.3 × 10−5 (Ch4) 3N (aq) + h3O (l) ⇌ (Ch4) 3NH + (водный) + OH− (водный) Kb = 6.3 × 10−5 Решение
Как определено в таблице ICE, x равно равновесной концентрации гидроксид-иона: Проверьте свои знания
Пример 14.14
Расчет равновесных концентраций без упрощающих предположений
HSO4− (aq) + h3O (l) ⇌h4O + (aq) + SO42− (aq) Ka = 1,2 × 10−2HSO4− (aq) + h3O (l) ⇌h4O + (aq) + SO42− (aq) Ka = 1,2 × 10−2 Решение
Когда мы проверяем предположение, мы вычисляем: Проверьте свои знания
C8h20N4O2 (водн.) + H3O (l) ⇌C8h20N4O2H + (водн.) + OH− (водн.) Kb = 2.5 × 10−4C8h20N4O2 (водн.) + H3O (l) ⇌C8h20N4O2H + (водн.) + OH− (водн.) Kb = 2,5 × 10−4 Влияние молекулярной структуры на кислотно-щелочную прочность
Бинарные кислоты и основания
Тройные кислоты и основания
Кислоты и основания в органической химии
Входит в серию:
Видео 1 — Введение в кислоты и основания в органической химии
Письменное руководство: сравнение кислот Аррениуса, Бренстеда-Лоури и Льюиса
Видео 2- Кислотно-щелочная прочность с использованием Ka / pKa / + pure Logic
5 факторов, которые помогут вам ранжировать кислоты и основания = CARIO
Видео 5 CARIO R = Резонанс
Видео 6 I = Индукция
Видео 7: O = Орбитальный
Видео 8: Кислотность ароматических соединений
Видео 9: Практические вопросы по кислотно-щелочной органической химии
<- Вернуться к Companion программы по органической химии
, чтобы узнать, что изучать дальше!
Кислоты и щелочи — Кислоты, основания и соли — (CCEA) — Редакция GCSE Chemistry (Single Science) — CCEA
Кислота — это вещество, которое при растворении производит ионов водорода, H + (водный) в воде.
Чем выше концентрация ионов водорода в растворе, тем ниже pH. (Высший уровень)
Щелочь — это вещество, которое при растворении в воде производит гидроксид-иона, OH — (водн.) .
(Высший уровень) Сильные кислоты полностью ионизируются в воде . Они полностью распадаются, образуя в растворе высокую концентрацию ионов водорода.
Например, соляная кислота полностью ионизируется на ионы водорода и хлорида:
HCl (водный) → H + (водный) + Cl — (водный)
Сильные кислоты включают:
- соляную кислоту
- серная кислота
- азотная кислота
(высший уровень) Сильные щелочи полностью ионизируются в воде .Они полностью распадаются с образованием в растворе высокой концентрации гидроксид-ионов.
Например, гидроксид натрия полностью ионизируется на ионы натрия и гидроксида:
NaOH (водный) → Na + (водный) + OH — (водный)
Сильные щелочи включают:
- гидроксид натрия
- гидроксид калия
(Высший уровень) Слабые кислоты только частично ионизируются в воде . Лишь небольшая часть их молекул при добавлении в воду распадается на ионы водорода.
Например, этановая кислота — слабая кислота.
CH 3 COOH (водн.) ⇌ H + (водн.) + CH 3 COO — (водн.)
«Обратимая стрелка» (⇌) указывает на обратимую реакцию.
(Высший уровень) Слабые щелочи только частично ионизируются в воде . Лишь небольшая часть их молекул при добавлении в воду распадается на ионы гидроксида.
Например, аммиак — слабая щелочь:
NH 3 (водн.) + H Posted in Разное