Содержание
Количество теплоты
Количество теплоты — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Внутренняя энергия тела может изменяться за счет работы внешних сил. Для характеристики изменения внутренней энергии при теплообмене вводится величина, называемая количеством теплоты и обозначаемая Q.
В международной системе единицей количества теплоты, также как работы и энергии, является джоуль: [Q] = [A] = [E] = 1 Дж.
На практике еще иногда применяется внесистемная единица количества теплоты – калория. 1 кал. = 4,2 Дж.
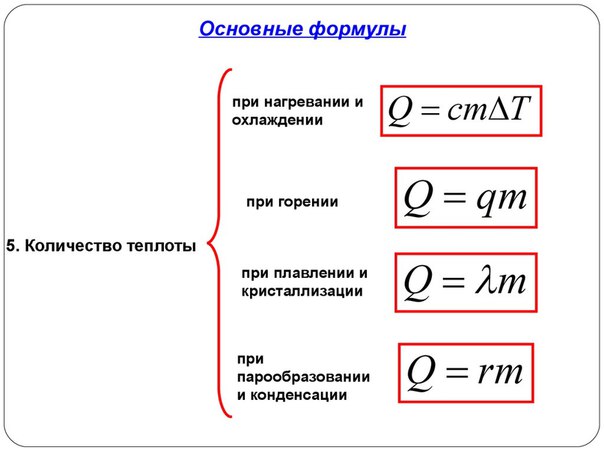
Количество теплоты, передаваемое от одного тела к другому, может идти на нагревание тела, плавление, парообразование, либо выделяться при противоположных процессах – остывании тела, кристаллизации, конденсации. Теплота выделяется при сгорании топлива.
Теплота выделяется при сгорании топлива.
Между массой вещества и количеством теплоты, необходимым для его нагревания, существует прямая пропорциональная зависимость.
- Количество теплоты, необходимое для нагревания тела или выделяющееся при его охлаждении, прямо пропорционально массе тела и изменению его температуры:
Q = cmΔT,
где с — удельная теплоемкость [Дж/кг·К], m — масса тела [кг], ΔT — изменение температуры [К]
- Количество теплоты, необходимое для превращения жидкости в пар или выделяющееся при его конденсации, прямо пропорционально массе жидкости:
Q = Lm,
где L — удельная теплота парообразования [Дж/кг], m — масса тела [кг]
- Количество теплоты, необходимое для плавления тела или выделяющееся при его кристаллизации, прямо пропорционально массе этого тела:
Q = λm,
где λ (лямбда) — удельная теплота плавления [Дж/кг], m — масса тела [кг]
- Количество теплоты, выделяющееся при сгорании топлива, прямо пропорционально его массе:
Q = qm,
где q — удельная теплота сгорания [Дж/кг], m — масса тела [кг]
Удельная теплоемкость вещества показывает, чему равно количество теплоты, необходимое для нагревания или выделяющееся при охлаждении 1 кг вещества на 1 К.
Удельные теплоты парообразования, плавления, сгорания показывают, какое количество теплоты требуется для парообразования, плавления или выделяется при конденсации, кристаллизации, сгорании 1 кг вещества.
Другие заметки по физике
Количество теплоты | Физика
Изменить внутреннюю энергию газа в цилиндре можно не только совершая работу, но и нагревая газ (рис. 43). Если закрепить поршень, то объем газа не будет изменяться, но температура, а следовательно, и внутренняя энергия будут возрастать.
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом или теплопередачей.
Энергию, переданную телу в результате теплообмена, называют количеством теплоты. Количеством теплоты называют также энергию, которую тело отдает в процессе теплообмена.
Молекулярная картина теплообмена. При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул холодного тела с более быстро движущимися молекулами горячего тела. В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются.
В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются.
При теплообмене не происходит превращения энергии из одной формы в другую: часть внутренней энергии горячего тела передается холодному телу.
Количество теплоты и теплоемкость. Из курса физики VII класса известно, что для нагревания тела массой m от температуры t1 до температуры t2 необходимо сообщить ему количество теплоты
Q = cm(t2 – t1) = cmΔt. (4.5)
При остывании тела его извечная температура t2 меньше начальной t1 и количество теплоты, отдаваемое телом, отрицательно.
Коэффициент c в формуле (4.5) называют удельной теплоемкостью. Удельная теплоемкость – это количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К.
Удельную теплоемкость выражают в джоулях, деленных на килограмм, умноженный на кельвин. Различным телам требуется неодинаковое количество энергии для увеличения температуры на 1 К. Так, удельная теплоемкость воды 4190 Дж/(кг · К), а меди 380 Дж/(кг · К).
Различным телам требуется неодинаковое количество энергии для увеличения температуры на 1 К. Так, удельная теплоемкость воды 4190 Дж/(кг · К), а меди 380 Дж/(кг · К).
Удельная теплоемкость зависит не только от свойств вещества, но и от того, при каком процессе осуществляется теплопередача. Если нагревать газ при постоянном давлении, то он будет расширяться и совершать работу. Для нагревания газа на 1°C при постоянном давлении ему нужно будет передать большее количество теплоты, чем для нагревания его при постоянном объеме.
Жидкие и твердые тела расширяются при нагревании незначительно, и их удельные теплоемкости при постоянном объеме и постоянном давлении мало различаются.
Удельная теплота парообразования. Для превращения жидкости в пар необходима передача ей определенного количества теплоты. Температура жидкости при этом превращении не меняется. Превращение жидкости в пар при постоянной температуре не ведет к увеличению кинетической энергии молекул, но сопровождается увеличением их потенциальной энергии. Ведь среднее расстояние между молекулами газа во много раз больше, чем между молекулами жидкости. Кроме того, увеличение объема при переходе вещества из жидкого состояния в газообразное требует совершения работы против сил внешнего давления.
Ведь среднее расстояние между молекулами газа во много раз больше, чем между молекулами жидкости. Кроме того, увеличение объема при переходе вещества из жидкого состояния в газообразное требует совершения работы против сил внешнего давления.
Количество теплоты, необходимое для превращения при настоянной температуре 1 кг жидкости в пар, называют удельной теплотой парообразования. Обозначают эту величину буквой r и выражают в джоулях на килограмм.
Очень велика удельная теплота парообразования воды: 2,256 · 106 Дж/кг при температуре 100°C. У других жидкостей (спирт, эфир, ртуть, керосин и др.) удельная теплота парообразования меньше в 3-10 раз.
Для превращения в пар жидкости массой m требуется количество теплоты, равное:
Qn = rm (4.6)
При конденсации пара происходит выделение такого же количества теплоты
Qk = –rm. (4.7)
Удельная теплота плавления. При плавлении кристаллического тела вся подводимая к нему теплота идет на увеличение потенциальной энергии молекул. Кинетическая энергия молекул не меняется, так как плавление происходит при постоянной температуре.
Кинетическая энергия молекул не меняется, так как плавление происходит при постоянной температуре.
Количество теплоты λ (лямбда), необходимое для превращения 1 кг кристаллического вещества при температуре плавления в жидкость той же температуры, называют удельной теплотой плавления.
При кристаллизации 1 кг вещества выделяется точно такое же количество теплоты. Удельная теплота плавления льда довольно велика: 3,4 · 105 Дж/кг.
Для того чтобы расплавить кристаллическое тело массой m, необходимо количество теплоты, равное:
Qпл = λm. (4.8)
Количество теплоты, выделяемое при кристаллизации тела, равно:
Qкр = – λm. (4.9)
1. Что называют количеством теплоты? 2. От чего зависит удельная теплоемкость веществ? 3. Что называют удельной теплотой парообразования? 4. Что называют удельной теплотой плавления? 5. В каких случаях количество переданной теплоты отрицательно?
Количество теплоты: нагревание, охлаждение, плавление, кристаллизация, парообразование, конденсация, горение.
 Термодинамическая система
Термодинамическая система
Тестирование онлайн
Количество теплоты. Основные понятия
Количество теплоты
Термодинамика
Раздел молекулярной физики, который изучает передачу энергии, закономерности превращения одних видов энергии в другие. В отличие от молекулярно-кинетической теории, в термодинамике не учитывается внутреннее строение веществ и микропараметры.
Термодинамическая система
Это совокупность тел, которые обмениваются энергией (в форме работы или теплоты) друг с другом или с окружающей средой. Например, вода в чайнике остывает, происходит обмен теплотой воды с чайником и чайника с окружающей средой. Цилиндр с газом под поршнем: поршень выполняет работу, в результате чего, газ получает энергию, и изменяются его макропараметры.
Количество теплоты
Это энергия, которую получает или отдает система в процессе теплообмена. Обозначается символом Q, измеряется, как любая энергия, в Джоулях.
В результате различных процессов теплообмена энергия, которая передается, определяется по-своему.
Нагревание и охлаждение
Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле
Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии. Удельная теплоемкость — известная, уже вычисленная для всех веществ величина, значение смотреть в физических таблицах.
Теплоемкость вещества С — это количество теплоты, которое необходимо для нагревания тела без учета его массы на 1К.
Плавление и кристаллизация
Плавление — переход вещества из твердого состояния в жидкое. Обратный переход называется кристаллизацией.
Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле
Удельная теплота плавления известная для каждого вещества величина, значение смотреть в физических таблицах.
Парообразование (испарение или кипение) и конденсация
Парообразование — это переход вещества из жидкого (твердого) состояния в газообразное. Обратный процесс называется конденсацией.
Удельная теплота парообразования известная для каждого вещества величина, значение смотреть в физических таблицах.
Горение
Количество теплоты, которое выделяется при сгорании вещества
Удельная теплота сгорания известная для каждого вещества величина, значение смотреть в физических таблицах.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса. Алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующим в теплообмене, равна нулю:
Q1+Q2+…+Qn=0
Формула количества теплоты в физике
Содержание:
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $\delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$\delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$\delta Q=c m d T=\nu c_{\mu} d T(2)$$
где $c=\frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{\mu}=c \cdot \mu$ — молярная теплоемкость,
$\mu$ – молярная масса вещества,
$\nu=\frac{m}{\mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($\Delta Q$), которое получает тело при увеличении его температуры на величину
$\Delta t = t_2 — t_1$ можно вычислить как:
$$\Delta Q=c m \Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($\Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($\delta Q$) равное:
$$\delta Q=\lambda d m$$
где $\lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$\delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 —
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2— количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
\begin{array}{l}
\mathrm{cmt}=\mathrm{cm}_{1} t_{1}+\mathrm{~cm}_{2} t_{2} \rightarrow \mathrm{mt}=\mathrm{m}_{1} t_{1}+\mathrm{~m}_{2} t_{2} \rightarrow \\
\rightarrow \rho \mathrm{Vt}=\rho V_{1} t_{1}+\rho \mathrm{V}_{2} t_{2} \rightarrow \mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
\end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
\left\{\begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \\
V=V_{1}+V_{2}
\end{array}\right.
$$
Решив ее получим:
$$
\begin{array}{l}
V_{1}=\frac{\left(t_{2}-t\right)}{t_{2}-t_{1}} V \\
V_{2}=\frac{\left(t-t_{1}\right)}{t_{2}-t_{1}} V
\end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
\begin{array}{l}
V_{1}=\frac{(60-40)}{60-10} 200=80 \text { (л) } \\
V_{2}=\frac{(40-10)}{60-10} 200=120 \text { (л) }
\end{array}
$$
Ответ. {*}\right)
{*}\right)
\end{array}
$$
Ответ. $\Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.
Урок 23. внутренняя энергия. работа. количество теплоты — Физика — 10 класс
Работа и теплопередача как способы изменения внутренней энергии
Выражение для внутренней энергии одноатомного идеального или разреженного реального газов имеет следующий вид: $U = \frac{3}{2} \cdot \nu \cdot R \cdot T$.
Для идеального газа из молекул с двумя, тремя или большим числом атомов требуется учёт кинетической энергии вращения молекул (их уже нельзя считать материальными точками), поэтому выражение для их внутренней энергии отличается от $U = \frac{3}{2} \cdot \nu \cdot R \cdot T$, но только числовым коэффициентом.
Для двухатомного газа (например, H2, O2, CO и пр.):
$U = \frac{5}{2} \cdot \nu \cdot R \cdot T$.
Для газа с тремя атомами и более (например, CO2, CH4):
$U = 3 \cdot \nu \cdot R \cdot T$.
Чтобы изменить внутреннюю энергию вещества, нужно передать ему некоторое количество теплоты либо совершить над ним работу.
Существует три вида теплопередачи:
Теплопроводность – это процесс переноса энергии от более нагретых частей тела к менее нагретым, осуществляемый хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Простой пример – нагревание ложки в горячем чае.
Конвекция – вид теплопередачи, при котором внутренняя энергия передаётся струями или потоками жидкости, или газа. Пример: проветривание комнаты.
Излучение – процесс переноса энергии посредством электромагнитного излучения. Простой пример: солнечный свет.
Механическая работа меняет механическую энергию тела. В термодинамике то же самое. К примеру, если газ двигает поршень, расширяясь, то у нас, как и в механике, есть и сила, и перемещение. Разница только в том, что при совершении работы в термодинамике меняется не кинетическая или потенциальная энергия газа как целого тела, а кинетическая энергия его молекул, то есть внутренняя энергия газа.
Если газ расширяется, то работу газа принято считать положительной. Если же сжимается – то отрицательной.
Формула для нахождения работы газа при изобарном процессе примет следующий вид: $A = p \cdot \Delta V$.
Для изотермического процесса формула принимает следующий вид: $A = \nu \cdot R \cdot T \cdot ln \frac{V_2}{V_1}$.
Термодинамика — Физика — Теория, тесты, формулы и задачи
Оглавление:
Основные теоретические сведения
Теплоемкость вещества
К оглавлению…
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. Тогда количество теплоты (энергии) необходимое для изменения температуры некоторого тела массой m можно рассчитать по формуле:
При этом в этой формуле абсолютно не важно в каких единицах подставлена температура, так как нам важно не ее абсолютное значение, а изменение. Единица измерения удельной теплоемкости вещества: Дж/(кг∙К).
Единица измерения удельной теплоемкости вещества: Дж/(кг∙К).
- Если t2 > t1, то Q > 0 – тело нагревается (получает тепло).
- Если t2 < t1, то Q < 0 – тело охлаждается (отдает тепло).
Произведение массы тела на удельную теплоемкость вещества, из которого оно изготовлено называется теплоемкостью тела (т.е. просто теплоемкостью без слова «удельная»):
Если в условии задачи сказано про теплоемкость тела, то количество теплоты, отданное или полученное этим телом, можно рассчитать по формуле:
Итак, запомните:
- Удельная теплоемкость обозначается маленькой буквой с, и является характеристикой вещества.
- (Просто) Теплоемкость обозначается большой буквой С, и является характеристикой данного тела.
Напомним, что количество теплоты Q отданное каким–либо источником (нагревателем) рассчитывается по формуле: Q = Pt, где: P – мощность источника, t – время, в течение которого источник отдавал тепло. При решении задач не путайте время работы источника и температуру.
При решении задач не путайте время работы источника и температуру.
Фазовые превращения
К оглавлению…
Фазой вещества называется однородная система, например, твердое тело, физические свойства которой во всех точках одинаковые. Между различными фазами вещества при обычных условиях существует четко выраженная граница (поверхность) раздела. При изменении внешних условий (температуры, давления, электрических и магнитных полей) вещество может переходить из одной фазы в другую. Такие процессы называются фазовыми превращениями (переходами).
Процесс фазового перехода из жидкого состояния в газообразное (парообразование) или из твердого в жидкое (плавление) может происходить только при сообщении веществу некоторого количества теплоты. Обратные фазовые переходы (конденсация и кристаллизация, или отвердевание) сопровождаются выделением такого же количества теплоты.
Количество теплоты, поступающее в систему или выделяющееся из нее, изменяет ее внутреннюю энергию. Это означает, что внутренняя энергия пара при 100°С больше, чем жидкости при той же температуре. Указанные фазовые переходы идут при постоянных температурах, которые называются соответственно температурой кипения и температурой плавления. Количество теплоты, необходимое для превращения жидкости в пар или выделяемое паром при конденсации, называется теплотой парообразования:
где: r – удельная теплота парообразования. Единица измерения [r] = 1 Дж/кг. Физический смысл удельной теплоты парообразования: она равна количеству теплоты, необходимому для превращения в пар 1 кг жидкости, находящейся при температуре кипения. Превращение жидкости в пар не требует доведение жидкости до кипения. Вода может превратиться в пар и при комнатной температуре. Такой процесс называется испарением.
Количество теплоты, необходимое для плавления тела или выделяемое при кристаллизации (отвердевании), называется теплотой плавления:
где: λ – удельная теплота плавления. Единица измерения [λ] = 1 Дж/кг. Физический смысл удельной теплоты плавления: теплота, необходимая для плавления 1 кг вещества, находящегося при температуре плавления. Удельные теплоты парообразования и плавления называются также скрытыми теплотами, поскольку при фазовых переходах температура системы не меняется, несмотря на то, что теплота к ней подводится.
Единица измерения [λ] = 1 Дж/кг. Физический смысл удельной теплоты плавления: теплота, необходимая для плавления 1 кг вещества, находящегося при температуре плавления. Удельные теплоты парообразования и плавления называются также скрытыми теплотами, поскольку при фазовых переходах температура системы не меняется, несмотря на то, что теплота к ней подводится.
Обратите внимание: что во время фазовых переходов температура системы не изменяется. А также на то, что сами фазовые переходы начинаются только после достижения необходимой температуры.
Наиболее распространенным источником энергии для нужд человека является топливо – вещество, при сгорании которого выделяется некоторое количество теплоты. Количество теплоты, выделяемое при сгорании топлива массой m, называется теплотой сгорания топлива:
где: q – удельная теплота сгорания (теплотворная способность, калорийность) топлива. Единица измерения [q] = 1 Дж/кг. Физический смысл удельной теплоты сгорания топлива: величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива.
Физический смысл удельной теплоты сгорания топлива: величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива.
Уравнение теплового баланса
К оглавлению…
В соответствии с законом сохранения энергии для замкнутой системы тел, в которой не происходит никаких превращений энергии, кроме теплообмена, количество теплоты, отдаваемое более нагретыми телами, равно количеству теплоты, получаемому более холодными. Теплообмен прекращается в состоянии термодинамического равновесия, т.е. когда температура всех тел системы становится одинаковой. Сформулируем уравнение теплового баланса: в замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующими в теплообмене, равна нулю:
При использовании такой формы записи уравнения теплового баланса, чтобы не сделать ошибку, запомните: когда Вы будете считать теплоту при нагревании или охлаждении тела, нужно из большей температуры вычитать меньшую, чтобы теплота всегда была положительной. Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
При использовании такой формы записи, нужно всегда от конечной температуры отнимать начальную. При таком подходе знак их разности сам «покажет» отдаёт тело теплоту или получает.
Запомните, что тело поглощает теплоту если происходит:
- Нагревание,
- Плавление,
- Парообразование.
Тело отдает теплоту если происходит:
- Охлаждение,
- Кристаллизация,
- Конденсация,
- Сгорание топлива.
Именно в этой теме, имеет смысл не решать задачи в общем виде, а сразу подставлять числа.
Взаимные превращения механической и внутренней энергии
При неупругих ударах механическая энергия частично или полностью переходит во внутреннюю энергию тел, то есть тела могут нагреваться и плавится. В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
Работа идеального газа
К оглавлению…
Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно–кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно–кинетические модели для иллюстрации своих выводов.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.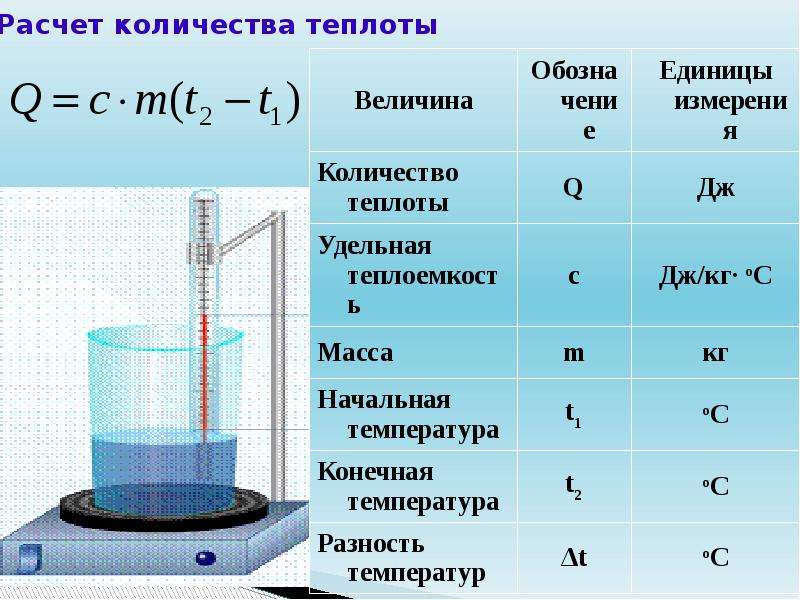
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими (или квазистационарными, еще одно название таких процессов — равновесные).
В изобарном процессе работу идеального газа можно рассчитывать по формулам:
Подчеркнем еще раз: работу газа по расширению можно считать по этим формулам только если давление постоянно. Согласно данной формуле, при расширении газ совершает положительную работу, а при сжатии – отрицательную (т.е. газ сопротивляется сжатию и над ним нужно совершать работу чтобы оно состоялось).
Если давление нельзя считать постоянным, то работу газа находят, как площадь фигуры под графиком в координатах (p, V). Очевидно, что в изохорном процессе работа газа равна нулю.
Ввиду того, что работа газа численно равна площади под графиком, становится понятно, что величина работы зависит от того, какой именно процесс происходил, ведь у каждого процесса свой график, а под ним своя площадь. Таким образом, работа зависит не только и не столько от начального и конечного состояний газа, сколько от процесса, с помощью которого конечное состояние было достигнуто.
Внутренняя энергия
К оглавлению…
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний) и всегда, в любых процессах для одноатомного идеального газа определяется выражением:
Обратите внимание: эта формула верна только для одноатомного газа, зато она применима ко всем процессам (а не только к изобарному, как формула для работы).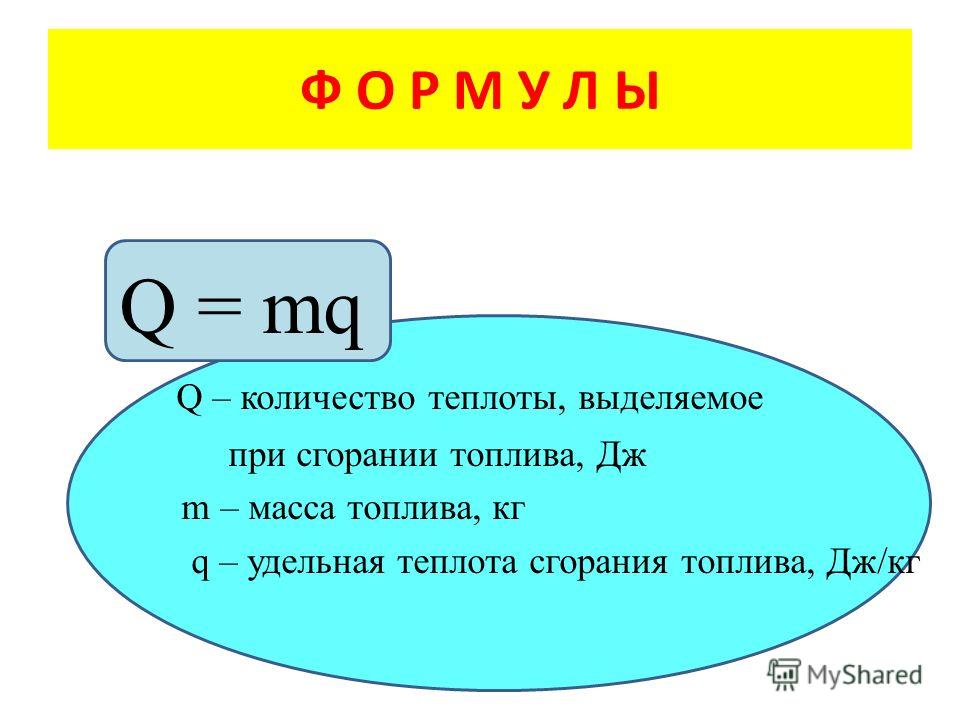 Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Первый закон термодинамики
К оглавлению…
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон (начало) термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами (такая формулировка более удобна и понятна, в таком виде совсем очевидно, что это просто закон сохранения энергии).
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких–либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
Адиабатным (адиабатическим) называют процесс, в ходе которого система не обменивается теплотой с окружающей средой. При адиабатном процессе Q = 0. Поэтому: ΔU + A = 0, то есть: A = – ΔU. Газ совершает работу за счет уменьшения собственной внутренней энергии.
Первое начало термодинамики и изопроцессы
К оглавлению…
Для различных изопроцессов можно выписать формулы по которым могут быть рассчитаны полученная теплота Q, изменение внутренней энергии ΔU и работа газа A. Изохорный процесс (V = const):
Изобарный процесс (p = const):
Изотермический процесс (T = const):
Адиабатный процесс (Q = 0):
Если в задаче явно не сказано, что газ одноатомный (или не назван один из инертных газов, например, гелий), то применять формулы из этого раздела нельзя.
Циклы. Тепловые машины
К оглавлению. ..
..
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т.д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
КПД тепловой машины может быть рассчитан по формуле:
где: Q1 – количество теплоты полученное рабочим телом за один цикл от нагревателя, Q2 – количество теплоты переданное рабочим телом за один цикл холодильнику. Работа совершенная тепловой машиной за один цикл:
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).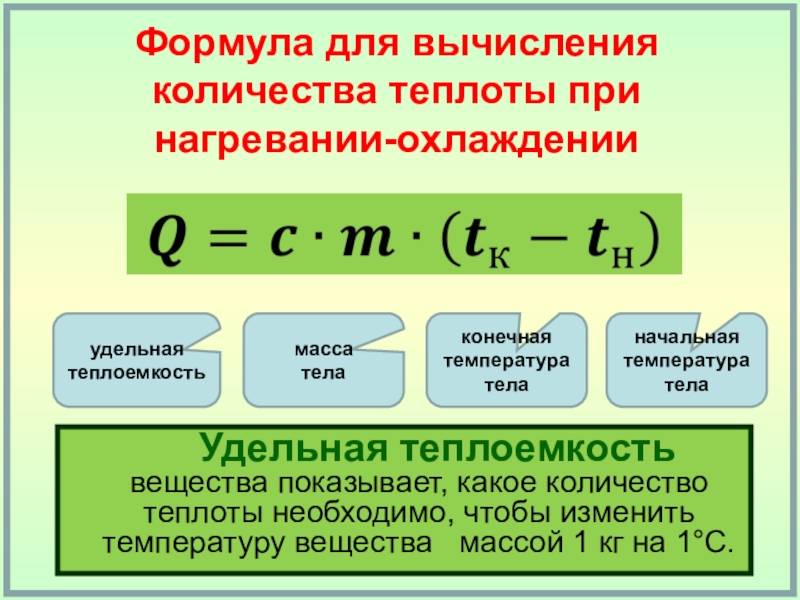
Наибольший КПД при заданных температурах нагревателя T1 и холодильника T2, достигается если тепловая машина работает по циклу Карно. Цикл Карно состоит из двух изотерм и двух адиабат. КПД цикла Карно равен:
Второе начало (второй закон) термодинамики
К оглавлению…
Первый закон термодинамики не устанавливает направление протекания тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
При этом сама система и окружающие тела возвращаются к исходному состоянию.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из–за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т.д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У.Кельвин дал в 1851 году следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют «вечным двигателем второго рода». Как уже должно было стать понятно, второе начало термодинамики запрещает существование такого двигателя.
Немецкий физик Р.Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. Следует отметить, что обе формулировки второго закона термодинамики эквивалентны.
Сложные задачи по термодинамике
К оглавлению…
При решении различных нестандартных задач по термодинамике необходимо учитывать следующие замечания:
- Для нахождения работы идеального газа надо построить график процесса в координатах p(V) и найти площадь фигуры под графиком. Если дан график процесса в координатах p(T) или V(T), то его сначала перестраивают в координаты p(V).
 Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V). - Для нахождения работы смеси газов используют закон Дальтона.
- При объединении теплоизолированных сосудов не должна изменяться внутренняя энергия всей системы, т.е. на сколько джоулей увеличится внутренняя энергия газа в одном сосуде, на столько уменьшится в другом.
- Вообще говоря, давление и температуру газа можно измерять только в состоянии термодинамического равновесия, когда давление и температура во всех точках сосуда одинаковы. Но бывают ситуации, когда давление одинаково во всех точках, а температура нет. Это может быть следствием разной концентрации молекул в разных частях сосуда (проанализируйте формулу: p = nkT).
- Иногда приходится в задачах по термодинамике использовать знания из механики.
Расчет КПД циклов по графику
К оглавлению. ..
..
Задачи данной темы по праву считаются одними из самых сложных задач в термодинамике. Итак, для решения Вам придется, во-первых, перевести график процесса в p(V) – координаты. Во-вторых, надо рассчитать работу газа за цикл. Полезная работа равна площади фигуры внутри графика циклического процесса в координатах p(V). В-третьих, необходимо разобраться, где газ получает, а где отдает теплоту. Для этого вспомните первое начало термодинамики. Внутренняя энергия идеального газа зависит только от его температуры, а работа – от объема. Поэтому, газ получает теплоту, если:
- Увеличиваются и его температура, и объем;
- Увеличивается объем, а температура постоянна;
- Увеличивается температура, а объем постоянен.
Газ отдает теплоту, если:
- Уменьшаются и его температура, и объем;
- Уменьшается объем, а температура постоянна;
- Уменьшается температура, а объем постоянен.

Если один из параметров увеличивается, а другой уменьшается, для того, чтобы понять, отдает газ теплоту или получает ее, необходимо «в лоб» по первому началу термодинамики рассчитать теплоту и посмотреть на ее знак. Положительная теплота – газ ее получает. Отрицательная – отдает.
Первый тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ получает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, полученная газом за один цикл, то есть теплота только в тех процессах, в которых газ получал ее.
Второй тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ отдает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, отданная газом за один цикл, то есть теплота только в тех процессах, в которых газ отдавал ее.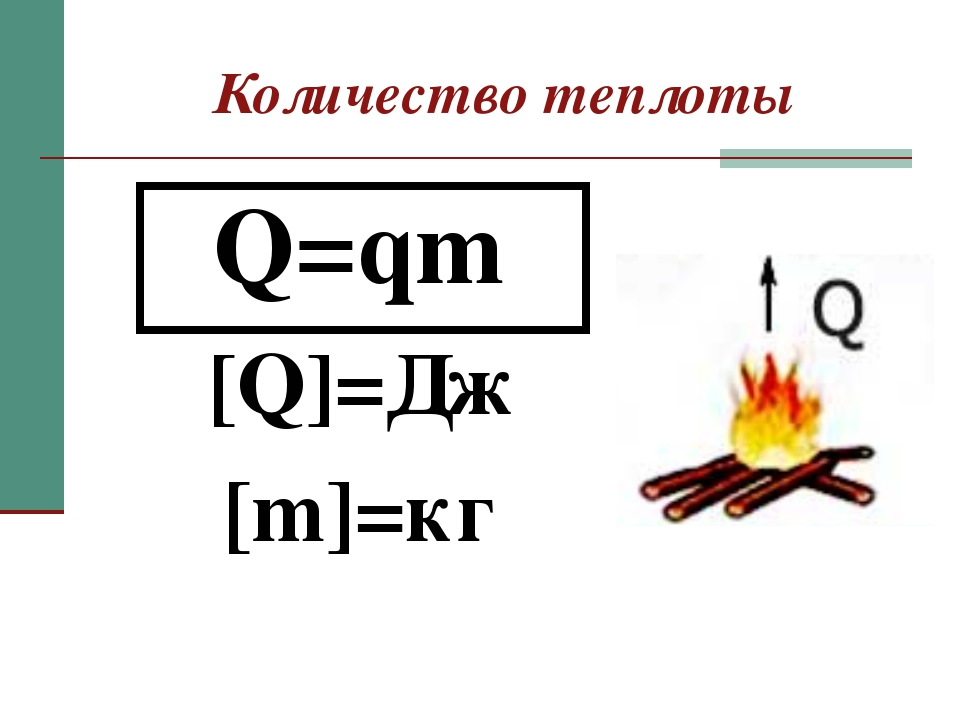
Третий тип задач. Газ получает теплоту не в удобных для расчета изохорных или изобарных процессах, в цикле есть изотермы или адиабаты, или вообще «никакие» процессы. Применяйте формулу:
Свойства паров. Влажность
К оглавлению…
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно–кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, то есть к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, т.е. число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, это значит, что скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Насыщенный пар имеет максимальные: давление, концентрацию, плотность при данной температуре. Они зависят только от температуры насыщенного пара, но не от его объема.
Это означает, что если бы мы сосуд закрыли не крышкой, а поршнем, и после того, как пар стал насыщенным, стали бы его сжимать, то давление, плотность и концентрация пара не изменились бы. Если быть более точным, то давление, плотность и концентрация на небольшое время увеличились бы, и пар стал бы перенасыщенным. Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
- Фраза: «В закрытом сосуде с водой…» – означает, что над водой насыщенный пар.
- Выпадение росы означает, что пар становится насыщенным.
Абсолютной влажностью ρ называют количество водяного пара, содержащегося в 1 м3 воздуха (т.е. просто плотность водяных паров; из уравнения Клапейрона-Менделеева выражается отношение массы к объему и получается следующая формула):
где: р – парциальное давление водяного пара, М – молярная масса, R – универсальная газовая постоянная, Т – абсолютная температура. Единица измерения абсолютной влажности в СИ [ρ] = 1 кг/м3, хотя обычно используют 1 г/м3.
Относительной влажностью φ называется отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м3 воздуха при данной температуре:
Относительную влажность можно также определить как отношение давления водяного пара р к давлению насыщенного пара р0 при данной температуре:
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100°С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. Важно знать, что температура кипения жидкости зависит от давления. В герметически закрытом сосуде жидкость кипеть не может, т.к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром.
Поверхностное натяжение
К оглавлению…
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, также как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может скачком переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Вследствие плотной упаковки молекул сжимаемость жидкостей, то есть изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Ep поверхности жидкости пропорциональна ее площади:
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости на единицу при постоянной температуре.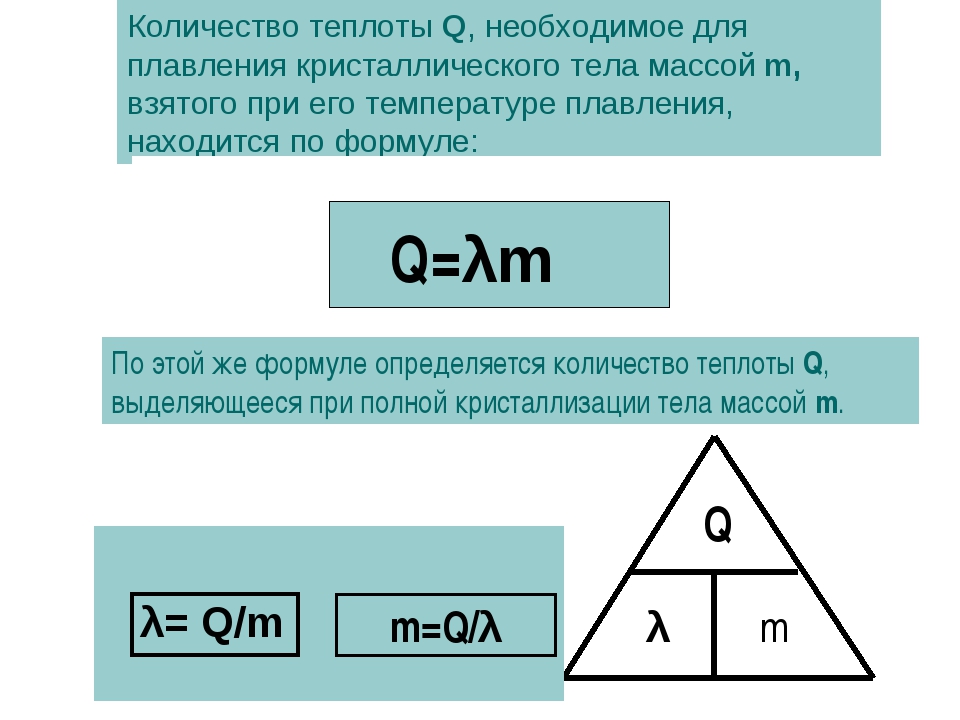 В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии (любое тело всегда стремится скатиться с горы, а не забраться на нее). Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку. Сила поверхностного натяжения, действующая на участок границы жидкости длиной L вычисляется по формуле:
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. При этом высота столба жидкости в капилляре:
где: r – радиус капиляра (т.е. тонкой трубки). При полном смачивании θ = 0°, cos θ = 1. В этом случае высота столба жидкости в капилляре станет равной:
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Количество теплоты. Удельная теплоемкость вещества :: Класс!ная физика
КОЛИЧЕСТВО ТЕПЛОТЫ
При теплопередаче (теплообмене) внутренняя энергия одних тел уменьшается, а других – увеличивается, без изменения механической энергии тел и без совершения работы.
При этом уменьшается внутренняя энергия тела-нагревателя,
а внутренняя энергия нагреваемого тела увеличивается .
Процесс теплопередачи характеризуется количеством теплоты.
Количеством теплоты (Q) называется изменение внутренней энергии тела, происходящее в результате теплопередачи.
Количество теплоты измеряется в системе СИ в джоулях.
[Q] = 1Дж.
Кроме того, для измерения количества теплоты (вне системы СИ) используется единица, называемая калорией (кал).
1 калория равна количеству теплоты, необходимому для нагревания 1 г воды на 1 градус С.
Опытным путем было установлено, что для нагревания 1 г воды на 1 градус требуется
совершить работу в 4,18 Дж, следовательно 1кал = 4,18Дж.
УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ ВЕЩЕСТВА
Удельная теплоемкость вещества показывает, какое количество теплоты необходимо, чтобы изменить температуру единицы массы данного вещества на 1°С.
Единица удельной теплоемкости в системе СИ :
[c] = 1Дж/кг·градусС.
Удельную теплоемкость данного вещества можно приближенно считать постоянной величиной.
У разных веществ удельная теплоемкость имеет разные значения.
Если одинаковым по массе телам из разных веществ передать одно и то же количество теплоты, то они нагреются до разной температуры. Вещество с меньшей теплоемкостью нагреется сильнее,
а вещество с большей теплоемкостью — слабее.
КНИЖНАЯ ПОЛКА
Глобальное потепление. Ведет ли оно к катастрофе?
ИНТЕРЕСНО
…что в пустынях днем очень жарко, а ночью температура падает ниже 0°С. Это происходит потому,
что песок обладает малой удельной теплоемкостью, поэтому быстро нагревается и охлаждается.
Устали? — Отдыхаем!
Тепло — Химия LibreTexts
Тепло — это количество энергии , которое передается от одной системы к ее окружению из-за разницы температур.
История теплопередачи
В 1822 году Жан-Батист Жозеф Фурье основал закон теплопередачи Фурье. Он смог прийти к этому закону с помощью математических выражений и показал, как теплопроводность в телах может быть проанализирована с помощью математических рядов. Закон Фурье о теплопередаче гласит, что скорость передачи тепла через тело пропорциональна отрицательному градиенту температуры в теле.
Он смог прийти к этому закону с помощью математических выражений и показал, как теплопроводность в телах может быть проанализирована с помощью математических рядов. Закон Фурье о теплопередаче гласит, что скорость передачи тепла через тело пропорциональна отрицательному градиенту температуры в теле.
Первый закон термодинамики
Первый закон термодинамики, также известный как закон сохранения Ene rgy , гласит, что полная энергия остается постоянной между взаимодействиями системы и ее окружения. По сути, энергии не может быть создано или уничтожено . Математическая модель этого приведена ниже.
\ [q_ {System} + q_ {Surroundings} = 0 \]
Когда две системы или тела сближаются, тепло как энергия передается от более горячего тела к более холодному телу .В результате молекулы более горячего тела теряют кинетическую энергию более холодного тела. Затем это приводит к потоку тепла между телами, более холодное тело будет иметь повышенную температуру, а более горячее тело понизится.
Факторы, от которых зависит количество тепла, необходимое для изменения температуры вещества:
- Величина изменения температуры
- Количество вещества
- Тип вещества
- Компоненты: тип атомов / молекул
Смена фаз и нагрев
Во-первых, тепло вызывает разницы в температуре , когда тепло течет от одного тела к другому.Теплообмен может также вызвать изменение состояния вещества . Например, нагревание H 2 O (s) (лед) заставит молекулы двигаться с большей скоростью. Увеличение скорости нарушило бы межмолекулярные силы и заставило бы твердое тело превратить фазу в жидкость, где межмолекулярные силы не такие сильные и ограничивающие, как в твердом теле.
Можно также посмотреть на фазовые диаграммы, чтобы увидеть, как тепло и давление влияют на изменение фаз.Фазовая диаграмма — это графическое представление условий температуры и давления, при которых твердые тела, жидкости и газы существуют либо в виде отдельных фаз, либо состояний вещества, либо в виде двух или более фаз, находящихся в равновесии друг с другом. На следующем рисунке показан пример фазовой диаграммы:
На следующем рисунке показан пример фазовой диаграммы:
Можно также посмотреть кривые нагрева, чтобы увидеть изменение температуры по мере добавления тепла. Ниже приведен пример кривой нагрева. Обратите внимание, что при изменении фазы температура не меняется.
Тепл. Ед.
калорий — это количество тепла, необходимое для изменения температуры 1 г воды на 1 градус Цельсия. килокалорий (1 кКал = 1000 кал) — это единица тепла, с которой мы обычно сталкиваемся в повседневной жизни, например, на обратной стороне коробки с хлопьями. Обратите внимание, что калории обозначаются строчной буквой «c», а килокалории обозначаются заглавной буквой «C».
Калория также связана с единицей энергии СИ, джоулей .
1 кал = 4,184 джоулей
Британская тепловая единица (БТЕ) также используется для определения количества тепла, необходимого для подъема одного фунта воды на один градус по Фаренгейту.
1 БТЕ = 252 калории = 1055 джоулей
Тепловая мощность
Теплоемкость — это количество тепла, обычно выражаемое в Джоулях или калориях, необходимое для изменения системы на 1 градус Цельсия. Удельная теплоемкость — это количество тепла, необходимое для подъема 1 грамма вещества на 1 градус Цельсия.
Например, удельная теплоемкость H 2 O (л) составляет 4,18 Дж / г ° C.
- \ (C_p \) обозначает удельную теплоемкость для удельной теплоемкости при постоянном давлении.
- \ (C_v \) обозначает удельную теплоемкость для удельной теплоемкости при постоянном объеме.
Расчет количества тепла
Чтобы рассчитать количество тепла, необходимое для подъема чего-либо при определенном изменении температуры, нам потребуется определенная информация.
- Изменение температуры
- Количество вещества (только для использования с C p или C v )
- Обычно дается в граммах или молях вещества.

- Обычно дается в граммах или молях вещества.
- Удельная теплоемкость или теплоемкость
Теперь мы можем использовать следующую формулу для определения количества необходимого тепла.
\ [q = m \, C_p \, \ Delta {T} \]
или
\ [q = C_p \ Delta {T} \]
Где,
- \ (q \) = Количество тепла
- \ (m \) = Масса вещества
- \ (\ Delta {T} \) = Изменение температуры
- \ (C_p \) = удельная / молярная теплоемкость
- \ (C \) = Теплоемкость (не зависит от массы)
Помните, что вам не всегда нужно использовать удельную или молярную теплоемкость.Для нахождения энергии можно использовать обычную теплоемкость, и в этом случае количество вещества не является необходимой информацией. Это когда вы использовали бы второе уравнение.
Упражнение \ (\ PageIndex {1} \)
Учитывая 500 г H 2 O (л) , сколько тепла требуется для повышения температуры H 2 O (л) с 8 ° C до 88 ° C?
- Ответ
Ответы находятся в разделе прикрепленных файлов.

Список литературы
- Биндель, Т. Х., Фочи, Дж. К. «Управляемое открытие: закон удельной теплоты». J. Chem. Educ. 1997 : 74, 955.
- Кимбро, Дорис Р. «Теплоемкость, температура тела и гипотермия». J. Chem. Educ. 1998 : 75, 48.
- Петруччи и др. Общие принципы химии и современные приложения . 9 изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2007
- Engel, et al. Физическая химия для наук о жизни . Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2008
- Смит, Э. Брайан. Основы химической термодинамики . 5-е изд. Лондон: Imperial College Press, 2004
- Stolen, et al. Химическая термодинамика материалов макроскопические и микроскопические аспекты . Западный Суссекс, Англия: John Wiley & Sons Ltd, 2004
- «тепло». Британская энциклопедия. 2008. Британская энциклопедия онлайн. 31 мая 2008 г.
 ,
, - «удельная теплоемкость.»Encyclopdia Britannica. 2008. Encyclopdia Britannica Online. 31 мая 2008 г.
- «Британская тепловая единица». Британская энциклопедия. 2008. Британская энциклопедия онлайн. 31 мая 2008 г.,
- «Теплопередача», Интернет-энциклопедия Microsoft® Encarta® 2008 uk.encarta.msn.com © 1997-2008
- AP HS Chemistry . Интернет. 11 марта 2010 г. http://aphschem.blogspot.com/2009/10…curve-lab.html Unit Operations in Food Processing — R. L. Earle. NZIFST — Новозеландский институт пищевых наук и технологий .Интернет. 11 марта 2010 г.
Как рассчитать количество выделяемого тепла
Обновлено 12 февраля 2020 г.
Клэр Гиллеспи
Проверено: Lana Bandoim, B.S.
Некоторые химические реакции выделяют энергию за счет тепла. Другими словами, они передают тепло своему окружению. Они известны как экзотермических реакций: «Экзо» относится к внешним или внешним, а «термический» означает тепло.
Некоторые примеры экзотермических реакций включают горение (горение), реакции окисления (ржавление) и реакции нейтрализации между кислотами и щелочами. Многие предметы повседневного обихода, такие как грелки для рук и самонагревающиеся банки для кофе и других горячих напитков, подвергаются экзотермическим реакциям.
TL; DR (слишком долго; не читал)
Для расчета количества тепла, выделяемого в химической реакции, используйте уравнение Q = mc ΔT , где Q — тепловая энергия перенесенная (в джоулях), м — масса нагреваемой жидкости (в килограммах), c — удельная теплоемкость жидкости (джоуль на килограмм градусов Цельсия), а ΔT — изменение температуры жидкости (градусы Цельсия).
Разница между теплом и температурой
Важно помнить, что температура и тепло — это не одно и то же. Температура — это мера того, насколько что-то горячее, измеряется в градусах Цельсия или Фаренгейта, а тепла — это мера тепловой энергии, содержащейся в объекте, измеряется в джоулях.
Температура — это мера того, насколько что-то горячее, измеряется в градусах Цельсия или Фаренгейта, а тепла — это мера тепловой энергии, содержащейся в объекте, измеряется в джоулях.
Когда тепловая энергия передается объекту, его повышение температуры зависит от:
- массы объекта
- вещества, из которого сделан объект
- количества энергии, приложенной к объекту
Чем больше тепловой энергии переносится на объект, тем больше увеличивается его температура.
Удельная теплоемкость
Удельная теплоемкость ( c ) вещества — это количество энергии, необходимое для изменения температуры 1 кг вещества на 1 единицу температуры. Различные вещества имеют разную удельную теплоемкость, например, вода имеет удельную теплоемкость 4 181 джоулей / кг градусов C, кислород имеет удельную теплоемкость 918 джоулей / кг градусов C, а свинец имеет удельную теплоемкость 128 джоулей / кг градусов C.
Калькулятор тепловой энергии
Чтобы рассчитать энергию, необходимую для повышения температуры известной массы вещества, вы используете формулу удельной теплоемкости:
Q — энергия, передаваемая в джоулях, м — масса веществ в кг, c — удельная теплоемкость в Дж / кг градусов C, а ΔT — изменение температуры в градусах C в формуле удельной теплоемкости.
Калькулятор тепловыделения
Представьте, что 100 г кислоты были смешаны со 100 г щелочи, что привело к повышению температуры с 24 до 32 градусов Цельсия.
Уравнение реакции нейтрализации между кислотой и щелочью может быть уменьшено до:
H + + OH — -> h3O
Используемая формула: Q = mc ∆T
Масса = м = 100 г + 100 г / 1000 г на кг = 0,2 г (одна значащая цифра)
Удельная теплоемкость воды = c = 4,186 Дж / кг градусов C
Изменение температуры = ΔT = 24 градуса C — 32 градуса C = -8 градусов C
Q = (0. 2 кг) (4,186 Дж / кг ° C) (-8 ° C)
2 кг) (4,186 Дж / кг ° C) (-8 ° C)
Q = -6,688 Дж, что означает выделение 6688 джоулей тепла.
Какие вещества будут удерживать тепло в течение нескольких часов?
Воздух, которым вы дышите, может удерживать тепло до 14 часов в закрытом помещении. Вы можете подумать, что древесина дольше сохраняет тепло, но вы ошибаетесь, так как древесина сохраняет тепло только до 2 часов 20 минут. Как переменная в термодинамике, тепло представляет собой энергию, которая перемещается или передается от высокотемпературного объекта, такого как дровяная печь, к более холодному, как в воздухе в комнате.Эта передача тепла от одного объекта к другому называется конвекцией. Формула коэффициента теплопередачи помогает определить, какие объекты удерживают тепло в течение нескольких часов.
TL; DR (слишком долго; не читал)
Закон охлаждения Ньютона гласит, что коэффициент теплопередачи материала должен быть как можно ниже. Коэффициент теплопередачи измеряется в специальных единицах ватт на квадратный метр в градусах Цельсия. Эта единица измерения — мера тепловой энергии, которая должна быть передана за одну секунду на один квадратный метр, чтобы изменить материал на 1.8 градусов по Фаренгейту или 1 градус Цельсия.
Эта единица измерения — мера тепловой энергии, которая должна быть передана за одну секунду на один квадратный метр, чтобы изменить материал на 1.8 градусов по Фаренгейту или 1 градус Цельсия.
Древесина, которая горит
Древесина — твердый волокнистый материал, состоящий в основном из целлюлозы и лигнина, который делает ветви деревьев жесткими, поэтому древесина быстро выделяет тепло. У него очень низкий коэффициент теплопередачи — 0,13 Вт на квадратный метр градусов Цельсия. Деревянная плита весом 1 кг остынет от 104 градусов по Фаренгейту (50 градусов по Цельсию) до 68 градусов (20 градусов по Цельсию) за 2 часа 20 минут.
Осадочный песок
Как осадочный материал, состоящий из сложного диоксида кремния, песок встречается на пляжах и в пустынях по всему миру.Песок имеет низкий коэффициент теплопередачи 0,06 Вт на квадратный метр по Цельсию. Это означает, что он может сохранять тепло в течение очень долгого времени, и объясняет, почему песок на пляже в жаркой стране остается теплым через несколько часов после захода солнца. 1-килограммовый контейнер с песком остынет с 104 до 68 градусов по Фаренгейту за 5 часов 30 минут.
1-килограммовый контейнер с песком остынет с 104 до 68 градусов по Фаренгейту за 5 часов 30 минут.
Пенополистирол
Пенополистирол, синтетический пластиковый полимер, используемый в упаковке товаров и как форма изоляции, используемой в строительной отрасли.Он имеет низкий коэффициент теплопередачи 0,03 Вт на квадратный метр градусов Цельсия. Это делает его отличной теплоизоляцией в строительстве. Блок полистирола весом 1 кг охладится с 104 до 68 градусов F за 11 часов 20 минут.
Воздух для дыхания
Состоит из 78 процентов азота, 21 процента кислорода, 0,03 процента углекислого газа и других газовых примесей, воздух, которым вы дышите, может сохранять тепло в течение многих часов после нагрева, и именно этот факт позволяет нашим домам чтобы оставаться в тепле после выключения центрального отопления.Воздух имеет коэффициент теплопередачи 0,024 Вт на квадратный метр градусов Цельсия. 1-килограммовый контейнер с воздухом охладится с 104 градусов по Фаренгейту до 68 градусов по Фаренгейту за 14 часов 15 минут.
Урок физики
На предыдущей странице мы узнали, что тепло делает с объектом, когда оно накапливается или выделяется. Прирост или потеря тепла приводят к изменениям температуры, изменению состояния или выполнения работы. Тепло — это передача энергии. Когда объект приобретается или теряется, внутри этого объекта будут происходить соответствующие изменения энергии.Изменение температуры связано с изменением средней кинетической энергии частиц внутри объекта. Изменение состояния связано с изменением внутренней потенциальной энергии, которой обладает объект. А когда работа сделана, происходит полная передача энергии объекту, над которым она выполняется. В этой части Урока 2 мы исследуем вопрос . Как измерить количество тепла, полученного или выделенного объектом?
Удельная теплоемкость
Предположим, что несколько объектов, состоящих из разных материалов, нагреваются одинаково.Будут ли предметы нагреваться одинаково? Ответ: скорее всего, нет. Разные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость. Удельная теплоемкость относится к количеству тепла, необходимому для изменения температуры единицы массы (скажем, грамма или килограмма) на 1 ° C. В учебниках часто указывается удельная теплоемкость различных материалов. Стандартные метрические единицы — Джоуль / килограмм / Кельвин (Дж / кг / К). Чаще используются единицы измерения — Дж / г / ° C.Используйте виджет ниже, чтобы просмотреть удельную теплоемкость различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. Д.) И нажмите кнопку «Отправить»; результаты будут отображены в отдельном окне.
Разные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость. Удельная теплоемкость относится к количеству тепла, необходимому для изменения температуры единицы массы (скажем, грамма или килограмма) на 1 ° C. В учебниках часто указывается удельная теплоемкость различных материалов. Стандартные метрические единицы — Джоуль / килограмм / Кельвин (Дж / кг / К). Чаще используются единицы измерения — Дж / г / ° C.Используйте виджет ниже, чтобы просмотреть удельную теплоемкость различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. Д.) И нажмите кнопку «Отправить»; результаты будут отображены в отдельном окне.
Удельная теплоемкость твердого алюминия (0,904 Дж / г / ° C) отличается от удельной теплоемкости твердого железа (0,449 Дж / г / ° C). Это означает, что для повышения температуры данной массы алюминия на 1 ° C потребуется больше тепла, чем для повышения температуры той же массы железа на 1 ° C. Фактически, для повышения температуры образца алюминия на заданное количество потребуется примерно вдвое больше тепла по сравнению с тем же изменением температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти вдвое больше, чем у железа.
Фактически, для повышения температуры образца алюминия на заданное количество потребуется примерно вдвое больше тепла по сравнению с тем же изменением температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти вдвое больше, чем у железа.
Теплоемкость указана из расчета на грамм или на килограмм . Иногда значение указывается из расчета на моль, и в этом случае оно называется молярной теплоемкостью. Тот факт, что они перечислены на основе на сумму , указывает на то, что количество тепла, необходимое для повышения температуры вещества, зависит от того, сколько вещества имеется.Эту истину, несомненно, знает всякий, кто варил на плите кастрюлю с водой. Вода закипает при температуре 100 ° C на уровне моря и при слегка пониженной температуре на возвышенностях. Чтобы довести кастрюлю с водой до кипения, ее сначала нужно поднять до 100 ° C. Это изменение температуры достигается за счет поглощения тепла горелкой печи. Быстро замечаешь, что для того, чтобы довести до кипения полную кастрюлю с водой, требуется значительно больше времени, чем для того, чтобы довести до кипения наполовину полную. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы вызвать такое же изменение температуры.Фактически, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в двойной массе воды.
Быстро замечаешь, что для того, чтобы довести до кипения полную кастрюлю с водой, требуется значительно больше времени, чем для того, чтобы довести до кипения наполовину полную. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы вызвать такое же изменение температуры.Фактически, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в двойной массе воды.
Удельная теплоемкость также указана из расчета на K или на ° C. Тот факт, что удельная теплоемкость указана из расчета на градус , указывает на то, что количество тепла, необходимое для повышения данной массы вещества до определенной температуры, зависит от изменения температуры, необходимого для достижения этой конечной температуры.Другими словами, важна не конечная температура, а общее изменение температуры. Для изменения температуры воды с 20 ° C до 100 ° C (изменение на 80 ° C) требуется больше тепла, чем для повышения температуры того же количества воды с 60 ° C до 100 ° C (изменение на 40 ° C). ° С). Фактически, для изменения температуры данной массы воды на 80 ° C требуется вдвое больше тепла по сравнению с изменением на 40 ° C. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды вместо холодной.
° С). Фактически, для изменения температуры данной массы воды на 80 ° C требуется вдвое больше тепла по сравнению с изменением на 40 ° C. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды вместо холодной.
Это обсуждение удельной теплоемкости заслуживает одного заключительного комментария. Термин «удельная теплоемкость» в некоторой степени похож на , неправильное наименование . Этот термин подразумевает, что вещества могут иметь способность содержать вещь , называемую теплотой. Как уже говорилось ранее, тепло — это не то, что содержится в объекте. Тепло — это то, что передается к объекту или от него. Объекты содержат энергию в самых разных формах. Когда эта энергия передается другим объектам с разной температурой, мы называем переданную энергию тепловой или тепловой энергией .Хотя это вряд ли приживется, более подходящим термином будет удельная энергоемкость.
Связь количества тепла с изменением температуры
Удельная теплоемкость позволяет математически связать количество тепловой энергии, полученной (или потерянной) образцом любого вещества, с массой образца и ее результирующим изменением температуры. Связь между этими четырьмя величинами часто выражается следующим уравнением.
Связь между этими четырьмя величинами часто выражается следующим уравнением.
Q = m • C • ΔT
где Q — количество тепла, передаваемого к объекту или от него, m — масса объекта, C — удельная теплоемкость материала, из которого состоит объект, а ΔT — результирующее изменение температуры объекта. Как и во всех других ситуациях в науке, значение дельта (∆) для любой величины рассчитывается путем вычитания начального значения количества из окончательного значения количества. В этом случае ΔT равно T конечный — T начальный .При использовании приведенного выше уравнения значение Q может быть положительным или отрицательным. Как всегда, положительный и отрицательный результат расчета имеет физическое значение. Положительное значение Q указывает на то, что объект получил тепловую энергию от окружающей среды; это соответствовало бы повышению температуры и положительному значению ΔT. Отрицательное значение Q указывает на то, что объект выделяет тепловую энергию в окружающую среду; это соответствовало бы снижению температуры и отрицательному значению ΔT.
Знание любых трех из этих четырех величин позволяет человеку вычислить четвертое количество. Обычная задача на многих уроках физики включает решение проблем, связанных с отношениями между этими четырьмя величинами. В качестве примеров рассмотрим две проблемы ниже. Решение каждой проблемы разработано для вас. Дополнительную практику можно найти в разделе «Проверьте свое понимание» внизу страницы.
Пример задачи 1 |
Как и любая проблема в физике, решение начинается с определения известных величин и соотнесения их с символами, используемыми в соответствующем уравнении. В этой задаче мы знаем следующее:
м = 450 г
С = 4,18 Дж / г / ° C
T начальная = 15 ° C
T окончательная = 85 ° C
Мы хотим определить значение Q — количество тепла. Для этого мы использовали бы уравнение Q = m • C • ΔT. Буквы m и C известны; ΔT можно определить по начальной и конечной температуре.
Для этого мы использовали бы уравнение Q = m • C • ΔT. Буквы m и C известны; ΔT можно определить по начальной и конечной температуре.
T = T окончательный — T начальный = 85 ° C — 15 ° C = 70 ° C
Зная три из четырех величин соответствующего уравнения, мы можем подставить и решить для Q.
Q = m • C • ΔT = (450 г) • (4,18 Дж / г / ° C) • (70 ° C)
Q = 131670 Дж
Q = 1.3×10 5 J = 130 кДж (округлено до двух значащих цифр)
Пример задачи 2 |
По сравнению с предыдущей проблемой это гораздо более сложная проблема. По сути, эта проблема похожа на две проблемы в одной. В основе стратегии решения проблем лежит признание того, что количество тепла, теряемого водой (Q вода ), равно количеству тепла, полученного металлом (Q металл ). Поскольку значения m, C и ΔT воды известны, можно вычислить Q water .Это значение Q воды равно значению металла Q . Как только значение металла Q известно, его можно использовать со значением m и ΔT металла для расчета металла Q . Использование этой стратегии приводит к следующему решению:
Часть 1: Определение потерь тепла водой
Дано:
м = 50,0 г
С = 4,18 Дж / г / ° C
Т начальная = 88,6 ° С
Т финал = 87.1 ° С
ΔT = -1,5 ° C (T конечный — T начальный )
Решить для Q воды :
Q вода = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (-1,5 ° C)
Q вода = -313,5 Дж (без заземления)
(Знак — означает, что вода теряет тепло)
Часть 2: Определите стоимость металла C
Дано:
Q металл = 313.5 Дж (используйте знак +, так как металл нагревается)
m = 12,9 г
T начальная = 26,5 ° C
T окончательная = 87,1 ° C
ΔT = (T конечный — T начальный )
Решить для C металл :
Переставьте Q из металла = m из металла • C из металла • ΔT из металла , чтобы получить C из металла = Q из металла / (м из металла • ΔT из металла )
C металл = Q металл / (м металл • ΔT металл ) = (313.5 Дж) / [(12,9 г) • (60,6 ° C)]
C металл = 0,40103 Дж / г / ° C
C металл = 0,40 Дж / г / ° C (округлено до двух значащих цифр)
Жара и изменения состояния
Приведенное выше обсуждение и соответствующее уравнение (Q = m • C • ∆T) связывает тепло, получаемое или теряемое объектом, с результирующими изменениями температуры этого объекта. Как мы узнали, иногда тепло накапливается или теряется, но температура не меняется.Это тот случай, когда вещество претерпевает изменение состояния. Итак, теперь мы должны исследовать математику, связанную с изменениями состояния и количества тепла.
Чтобы начать обсуждение, давайте рассмотрим различные изменения состояния, которые можно наблюдать для образца вещества. В таблице ниже перечислены несколько изменений состояния и указаны имена, обычно связанные с каждым процессом.
Процесс | Изменение состояния |
Плавка | От твердого до жидкого |
Замораживание | От жидкости к твердому веществу |
Испарение | От жидкости к газу |
Конденсация | Газ — жидкость |
Сублимация | Твердое тело в газ |
Депонирование | Газ в твердое вещество |
В случае плавления, кипения и сублимации к образцу вещества должна быть добавлена энергия, чтобы вызвать изменение состояния.Такие изменения состояния называют эндотермическими. Замораживание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; энергия приобретается льдом, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Есть ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Безусловно, есть.
Количество энергии, необходимое для изменения состояния образца материи, зависит от трех вещей. Это зависит от того, что такое субстанция, от того, сколько субстанции претерпевает изменение состояния, и от того, какое изменение состояния происходит. Например, для плавления льда (твердая вода) требуется другое количество энергии, чем для плавления железа. И для таяния льда (твердая вода) требуется другое количество энергии, чем для испарения того же количества жидкой воды. И, наконец, для плавления 10 требуется другое количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества — это три переменные, которые влияют на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления — это изменение энергии, связанное с изменением состояния твердое-жидкое.)
Значения удельной теплоты плавления и удельной теплоты испарения указаны из расчета на количество .Например, удельная теплота плавления воды составляет 333 Дж / грамм. Чтобы растопить 1,0 грамм льда, требуется 333 Дж энергии. Чтобы растопить 10 граммов льда, требуется в 10 раз больше энергии — 3330 Дж. Такое рассуждение приводит к следующим формулам, связывающим количество тепла с массой вещества и теплотой плавления и испарения.
Для плавления и замораживания: Q = m • ΔH сварка
Для испарения и конденсации: Q = m • ΔH испарение
, где Q представляет количество энергии, полученной или высвобожденной во время процесса, m представляет собой массу образца, ΔH плавления представляет собой удельную теплоту плавления (на грамм) и ΔH испарения представляет собой удельную теплоемкость плавления. испарение (из расчета на грамм).Подобно обсуждению Q = m • C • ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и испарения; это согласуется с тем фактом, что образец вещества должен набирать энергию, чтобы плавиться или испаряться. Значения Q отрицательны для процесса замораживания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или конденсироваться.
В качестве иллюстрации того, как можно использовать эти уравнения, рассмотрим следующие два примера задач.
Пример задачи 3 |
Уравнение, связывающее массу (48,2 грамма), теплоту плавления (333 Дж / г) и количество энергии (Q): Q = m • ΔH fusion .Подстановка известных значений в уравнение приводит к ответу.
Q = м • ΔH сварка = (48,2 г) • (333 Дж / г)
Q = 16050,6 Дж
Q = 1,61 x 10 4 Дж = 16,1 кДж (округлено до трех значащих цифр)
Пример Задачи 3 включает в себя довольно простой расчет типа plug-and-chug. Теперь мы попробуем пример задачи 4, который потребует более глубокого анализа.
Пример задачи 4 |
В этой задаче лед тает, а жидкая вода остывает. Энергия передается от жидкости к твердому телу. Чтобы растопить твердый лед, на каждый грамм льда необходимо передать 333 Дж энергии. Эта передача энергии от жидкой воды ко льду охлаждает жидкость.Но жидкость может охладиться только до 0 ° C — точки замерзания воды. При этой температуре жидкость начнет затвердевать (замерзнуть), а лед полностью не растает.
Мы знаем следующее о льду и жидкой воде:
Информация о льду:
м = 50,0 г
ΔH плавление = 333 Дж / г
Информация о жидкой воде:
С = 4.18 Дж / г / ° C
T начальная = 26,5 ° C
T окончательный = 0,0 ° C
ΔT = -26,5 ° C (T конечный — T начальный )
Энергия, полученная льдом, равна энергии, потерянной из воды.
Q лед = -Q жидкая вода
Знак — указывает, что один объект получает энергию, а другой объект теряет энергию. Мы можем вычислить левую часть приведенного выше уравнения следующим образом:
Q лед = m • ΔH плавление = (50.0 г) • (333 Дж / г)
Q лед = 16650 Дж
Теперь мы можем установить правую часть уравнения равной m • C • ΔT и начать подставлять известные значения C и ΔT, чтобы найти массу жидкой воды. Решение:
16650 Дж = -Q жидкая вода
16650 Дж = -м жидкая вода • C жидкая вода • ΔT жидкая вода
16650 Дж = -м жидкая вода • (4.18 Дж / г / ° C) • (-26,5 ° C)
16650 Дж = -м жидкая вода • (-110,77 Дж / ° C)
м жидкая вода = — (16650 Дж) / (- 110,77 Дж / ° C)
м жидкая вода = 150,311 г
м жидкая вода = 1,50×10 2 г (округлено до трех значащих цифр)
Еще раз о кривых нагрева и охлаждения
На предыдущей странице Урока 2 обсуждалась кривая нагрева воды.Кривая нагрева показывала, как температура воды увеличивалась с течением времени по мере нагрева образца воды в твердом состоянии (т. Е. Льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает преобразование воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает преобразование воды из жидкого состояния в газообразное.Эти изменения состояния произошли без каких-либо изменений температуры. Однако добавление тепла к образцу воды, не имеющей температуры фазового перехода, приведет к изменению температуры.
Теперь мы можем подойти к теме кривых нагрева на более количественной основе. На диаграмме ниже представлена кривая нагрева воды. На нанесенных линиях есть пять помеченных участков.
Три диагональных участка представляют собой изменения температуры пробы воды в твердом состоянии (участок 1), жидком состоянии (участок 3) и газообразном состоянии (участок 5).Две горизонтальные секции представляют изменения в состоянии воды. На участке 2 проба воды тает; твердое вещество превращается в жидкость. В секции 4 образец воды подвергается кипению; жидкость превращается в газ. Количество тепла, передаваемого воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m • C • ΔT. А количество тепла, переданного воде в секциях 2 и 4, связано с массой образца и теплотой плавления и испарения по формулам Q = m • ΔH fusion (раздел 2) и Q = m • ΔH испарение (раздел 4).Итак, теперь мы попытаемся вычислить количество тепла, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0 ° C в газообразное состояние при 120,0 ° C. Для расчета потребуется пять шагов — по одному шагу для каждого раздела приведенного выше графика. Хотя удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости:
Твердая вода: C = 2,00 Дж / г / ° C
Жидкая вода: C = 4,18 Дж / г / ° C
Газообразная вода: C = 2.01 Дж / г / ° C
Наконец, мы будем использовать ранее сообщенные значения ΔH fusion (333 Дж / г) и ΔH испарения (2,23 кДж / г).
Раздел 1 : Изменение температуры твердой воды (льда) с -20,0 ° C до 0,0 ° C.
Используйте Q 1 = m • C • ΔT
, где m = 50,0 г, C = 2,00 Дж / г / ° C, T начальная = -200 ° C и T конечная = 0,0 ° C
Q 1 = m • C • ΔT = (50.0 г) • (2,00 Дж / г / ° C) • (0,0 ° C — -20,0 ° C)
Q 1 = 2,00 x10 3 Дж = 2,00 кДж
Раздел 2 : Таяние льда при 0,0 ° C.
Используйте Q 2 = m • ΔH сварка
, где m = 50,0 г и ΔH плавление = 333 Дж / г
Q 2 = м • ΔH плавление = (50,0 г) • (333 Дж / г)
Q 2 = 1,665 x10 4 Дж = 16.65 кДж
Q 2 = 16,7 кДж (округлено до 3 значащих цифр)
Раздел 3 : Изменение температуры жидкой воды с 0,0 ° C на 100,0 ° C.
Используйте Q 3 = m • C • ΔT
, где m = 50,0 г, C = 4,18 Дж / г / ° C, T начальная = 0,0 ° C и T конечная = 100,0 ° C
Q 3 = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (100,0 ° C — 0,0 ° C)
Q 3 = 2.09 x10 4 Дж = 20,9 кДж
Раздел 4 : Кипячение воды при 100,0 ° C.
Используйте Q 4 = m • ΔH испарение
, где m = 50,0 г и ΔH испарение = 2,23 кДж / г
Q 4 = m • ΔH испарение = (50,0 г) • (2,23 кДж / г)
Q 4 = 111,5 кДж
Q 4 = 112 кДж (округлено до 3 значащих цифр)
Раздел 5 : Изменение температуры жидкой воды со 100.От 0 ° C до 120,0 ° C.
Используйте Q 5 = m • C • ΔT
, где m = 50,0 г, C = 2,01 Дж / г / ° C, T начальная = 100,0 ° C и T конечная = 120,0 ° C
Q 5 = m • C • ΔT = (50,0 г) • (2,01 Дж / г / ° C) • (120,0 ° C — 100,0 ° C)
Q 5 = 2,01 x10 3 J = 2,01 кДж
Общее количество тепла, необходимое для превращения твердой воды (льда) при -20 ° C в газообразную воду при 120 ° C, является суммой значений Q для каждого участка графика.То есть
Q итого = Q 1 + Q 2 + Q 3 + Q 4 + Q 5
Суммирование этих пяти значений Q и округление до нужного количества значащих цифр приводит к значению 154 кДж в качестве ответа на исходный вопрос.
В приведенном выше примере есть несколько особенностей решения, над которыми стоит задуматься:
- Первое: длинная задача была разделена на части, каждая из которых представляет собой одну из пяти частей графика.Поскольку было вычислено пять значений Q, они были помечены как Q 1 , Q 2 и т. Д. Этот уровень организации требуется в многоступенчатой задаче, такой как эта.
- Секунда: внимание было уделено знаку +/- на ΔT. Изменение температуры (или любой величины) всегда рассчитывается как конечное значение величины за вычетом начального значения этой величины.
- Третий: На протяжении всей проблемы внимание уделялось подразделениям.Единицы Q будут либо в Джоулях, либо в килоджоулях, в зависимости от того, какие количества умножаются. Отсутствие внимания к устройствам — частая причина сбоев в подобных проблемах.
- Четвертый: На протяжении всей задачи внимание уделялось значащим цифрам. Хотя это никогда не должно становиться основным акцентом какой-либо проблемы в физике, это, безусловно, деталь, на которую стоит обратить внимание.
Мы узнали здесь, на этой странице, как рассчитать количество тепла, задействованного в любом процессе нагрева / охлаждения и в любом процессе изменения состояния.Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице Урока 2, посвященной калориметрии. Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой.
Проверьте свое понимание
1. Вода имеет необычно высокую удельную теплоемкость. Какое из следующих утверждений логически следует из этого факта?
а.По сравнению с другими веществами горячая вода вызывает сильные ожоги, потому что она хорошо проводит тепло.
б. По сравнению с другими веществами вода при нагревании быстро нагревается до высоких температур.
c. По сравнению с другими веществами, образец воды требует значительного количества тепла, чтобы немного изменить ее температуру.
2. Объясните, почему в больших водоемах, таких как озеро Мичиган, может быть довольно холодно в начале июля, несмотря на то, что температура наружного воздуха около или выше 90 ° F (32 ° C).
3. В таблице ниже описан термический процесс для различных объектов (выделен красным жирным шрифтом). Для каждого описания укажите, набирается или теряется тепло объектом, является ли процесс эндотермическим или экзотермическим, и является ли Q для указанного объекта положительным или отрицательным значением.
| Процесс | Получено или потеряно тепло? | Эндо- или экзотермический? | Q: + или -? | |
а. | Кубик льда помещают в стакан с лимонадом комнатной температуры, чтобы охладить напиток. | |||
г. | Холодный стакан лимонада стоит на столе для пикника под жарким полуденным солнцем и нагревается до 32 ° F. | |||
г. | Конфорки на электроплите выключаются и постепенно остывают до комнатной температуры. | |||
г. | Учитель вынимает из термоса большой кусок сухого льда и опускает его в воду. Сухой лед возгоняется, образуя газообразный диоксид углерода. | |||
e. | Водяной пар в увлажненном воздухе ударяется о окно и превращается в каплю росы (каплю жидкой воды). |
4. Образец металлического цинка массой 11,98 грамма помещают в баню с горячей водой и нагревают до 78,4 ° C. Затем его удаляют и помещают в чашку из пенополистирола, содержащую 50,0 мл воды комнатной температуры (T = 27,0 ° C; плотность = 1,00 г / мл). Вода прогревается до температуры 28.1 ° С. Определите удельную теплоемкость цинка.
5. Джейк достает из туалета банку с газировкой и выливает ее в чашку со льдом. Определите количество тепла, теряемого содой комнатной температуры при плавлении 61,9 г льда (ΔH fusion = 333 Дж / г).
6. Теплота сублимации (ΔH сублимации ) сухого льда (твердый диоксид углерода) составляет 570 Дж / г. Определите количество тепла, необходимое для превращения 5,0-фунтового мешка сухого льда в газообразный диоксид углерода.(Дано: 1,00 кг = 2,20 фунта)
7. Определите количество тепла, необходимое для повышения температуры 3,82-граммового образца твердого пара-дихлорбензола с 24 ° C до жидкого состояния при 75 ° C. Пара-дихлорбензол имеет температуру плавления 54 ° C, теплоту плавления 124 Дж / г и удельную теплоемкость 1,01 Дж / г / ° C (твердое состояние) и 1,19 Дж / г / ° C (жидкое состояние).
Теплоемкость и удельная теплоемкость
- Определите теплоемкость.
- Определите удельную теплоемкость.
- Выполните вычисления с учетом удельной теплоемкости.
Какой бассейн прогреется быстрее?
Если бы плавательный бассейн и болот, наполненные водой с одинаковой температурой, подвергались одинаковому подаче тепловой энергии, то в детском бассейне температура, несомненно, повышалась бы быстрее, чем в плавательном бассейне. Теплоемкость объекта зависит как от его массы, так и от его химического состава. Из-за своей гораздо большей массы плавательный бассейн с водой имеет большую теплоемкость, чем ведро с водой.
Теплоемкость и удельная теплоемкость
Различные вещества по-разному реагируют на тепло. Если металлический стул стоит на ярком солнце в жаркий день, он может стать довольно горячим на ощупь. Вода с одинаковой массой на одном и том же солнце не станет почти такой же горячей. Мы бы сказали, что вода имеет высокую теплоемкость (количество тепла, необходимое для повышения температуры объекта на 1 ° C). Вода очень устойчива к изменениям температуры, в то время как металлы в целом нет.Удельная теплоемкость вещества — это количество энергии, необходимое для повышения температуры 1 грамма вещества на 1 ° C. В таблице ниже приведены значения удельной теплоты некоторых распространенных веществ. Символ удельной теплоемкости: c p , с индексом p, указывающим на то, что удельная теплоемкость измеряется при постоянном давлении. Единицами измерения удельной теплоемкости могут быть джоули на грамм на градус (Дж / г ° C) или калории на грамм на градус (кал / г ° C). В этом тексте для удельной теплоемкости будет использоваться Дж / г ° C.
| Вещество | Удельная теплоемкость (Дж / г ° C) |
| Вода (л) | 4,18 |
| Вода (и) | 2,06 |
| Вода (г) | 1,87 |
| Аммиак (г) | 2,09 |
| Этанол (л) | 2,44 |
| Алюминий (и) | 0.897 |
| Углерод, графит (ы) | 0,709 |
| Медь (и) | 0,385 |
| Золото | 0,129 |
| Утюг (и) | 0,449 |
| Выводы | 0,129 |
| Ртуть (л) | 0,140 |
| Серебро (а) | 0,233 |
Обратите внимание, что вода имеет очень высокую удельную теплоемкость по сравнению с большинством других веществ.Вода обычно используется в качестве охлаждающей жидкости для оборудования, поскольку она способна поглощать большое количество тепла (см. , таблица выше). Прибрежный климат намного более умеренный, чем внутренний климат из-за наличия океана. Вода в озерах или океанах поглощает тепло из воздуха в жаркие дни и отдает его обратно в воздух в прохладные дни.
Рисунок 17.5
Эта электростанция в Западной Вирджинии, как и многие другие, расположена рядом с большим озером, поэтому воду из озера можно использовать в качестве охлаждающей жидкости.Прохладная вода из озера закачивается в растение, а более теплая вода выкачивается из растения и возвращается в озеро.
Резюме
- Определены теплоемкость и удельная теплоемкость.
Практика
Вопросы
Посмотрите видео и ответьте на вопросы ниже
- Что было в первом воздушном шаре?
- Что было в воздушном шаре отправки?
- Почему не лопнул первый воздушный шар?
- Почему лопнул второй воздушный шар?
Обзор
Вопросы
- Что такое тепловая мощность?
- Что такое удельная теплоемкость?
- У вас есть 10-граммовый кусок алюминия и 10-граммовый кусок золота, стоящие на солнце.Какой металл сначала нагреется на десять градусов?
- У вас есть 20-граммовый кусок алюминия и 40-граммовый кусок алюминия, лежащие на солнце. Какая часть первой встанет на десять градусов?
- heat capacity: Количество тепла, необходимое для повышения температуры объекта на 1 ° C.
- удельная теплоемкость: Количество энергии, необходимое для повышения температуры 1 грамма вещества на 1 ° C.
Список литературы
- Бассейн: Пользователь: Mhsb / Wikimedia Commons; Детский бассейн: Пользователь: Aarchiba / Википедия.Бассейн: http://commons.wikimedia.org/wiki/File:Freshwater_swimming_pool.jpg; Детский бассейн: http://commons.wikimedia.org/wiki/File:Wading-pool.jpg.
- Пользователь: Raeky / Wikimedia Commons. http://commons.wikimedia.org/wiki/File:Mount_Storm_Power_Plant,_Areial.jpg.
[/ hidden-answer
]
Удельная теплоемкость и теплоемкость
Цель обучения
- Рассчитать изменение температуры вещества с учетом его теплоемкости и энергии, используемой для его нагрева.
Ключевые моменты
- Теплоемкость — это отношение количества тепловой энергии, переданной объекту, к результирующему увеличению его температуры.
- Молярная теплоемкость — это количество тепла, необходимое для повышения температуры одного моля чистого вещества на один градус К.
- Удельная теплоемкость — это количество тепла, необходимое для повышения температуры одного грамма чистого вещества на один градус К.
Условия
- теплоемкость — способность вещества поглощать тепловую энергию; количество тепла, необходимое для повышения температуры одного моля или грамма вещества на один градус Цельсия без какого-либо изменения фазы.{-1} [/ латекс]). Теплоемкость — это обширное свойство, что означает, что она зависит от размера / массы образца. Например, для образца, содержащего в два раза больше вещества, чем для другого образца, потребуется вдвое больше тепловой энергии (Q) для достижения такого же изменения температуры ([латекс] \ Delta T [/ latex]), которое требуется для изменения температура первого образца.
Молярная и удельная теплоемкость
Есть две производные величины, которые определяют теплоемкость как интенсивное свойство (т.е., независимо от размера образца) вещества. Их:
- молярная теплоемкость, которая представляет собой теплоемкость на моль чистого вещества. Молярная теплоемкость часто обозначается CP для обозначения теплоемкости в условиях постоянного давления, а также CV для обозначения теплоемкости в условиях постоянного объема. Единицами молярной теплоемкости являются [латекс] \ frac {J} {K \ bullet mol} [/ латекс].
- — удельная теплоемкость, часто называемая просто удельной теплоемкостью, которая представляет собой теплоемкость на единицу массы чистого вещества.Он обозначен как c P и c V , и его единицы измерения указаны в [latex] \ frac {J} {g \ bullet K} [/ latex].
Тепло, энтальпия и температура
Зная молярную теплоемкость или удельную теплоемкость чистого вещества, можно рассчитать количество тепла, необходимое для повышения / понижения температуры этого вещества на заданную величину. Применяются следующие две формулы:
[латекс] q = mc_p \ Delta T [/ латекс]
[латекс] q = nC_P \ Delta T [/ латекс]
В этих уравнениях м — это масса вещества в граммах (используется при расчетах с удельной теплоемкостью), а n — это количество молей вещества (используется при расчетах с молярной теплоемкостью).
Пример
Молярная теплоемкость воды CP равна 75,2
[латекс] \ frac {J} {mol \ bullet K} [/ latex] . Сколько тепла нужно, чтобы поднять температуру 36 граммов воды с 300 до 310 К?Нам дана молярная теплоемкость воды, поэтому нам нужно преобразовать данную массу воды в моль:
[латекс] \ text {36 грамм} \ times \ frac {\ text {1 mol} H_2O} {\ text {18 g}} = \ text {2.0 mol} H_2O [/ latex]
Теперь мы можем подставить наши значения в формулу, которая связывает тепло и теплоемкость:
[латекс] q = nC_P \ Delta T [/ латекс]
[латекс] q = (2.0 \; \ text {mol}) \ left (75.2 \; \ frac {J} {mol \ bullet K} \ right) (10 \; K) [/ latex]
[латекс] q = 1504 \; J [/ латекс]
Интерактивный: определение удельной и скрытой теплоты Удельная теплоемкость — это мера тепловой энергии, необходимой для повышения температуры определенного количества вещества на один кельвин. Скрытая теплота плавления описывает количество тепла, необходимое для плавления твердого вещества. Когда твердое тело плавится, температура в основном остается постоянной до тех пор, пока все твердое вещество не расплавится.Вышеупомянутое моделирование демонстрирует удельную теплоемкость и скрытую теплоту.
Учебник по удельной теплоемкости Этот урок связывает тепло с изменением температуры. В нем обсуждается, как количество тепла, необходимое для изменения температуры, зависит от массы и задействованного вещества, и эта взаимосвязь представлена удельной теплоемкостью вещества C.Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
тепла | Определение и факты
Изучите основы теплопередачи и определите разницу между теплом и температурой.
Объяснение теплопередачи.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Тепло , энергия, которая передается от одного тела к другому в результате разницы температур. Если два тела при разных температурах сближаются, энергия передается — т.е.е. тепловые потоки — от более горячего тела к более холодному. Эффект этой передачи энергии обычно, но не всегда, заключается в повышении температуры более холодного тела и понижении температуры более горячего тела. Вещество может поглощать тепло без повышения температуры за счет перехода от одного физического состояния (или фазы) к другому, например, от твердого к жидкому (плавление), от твердого к парообразному (сублимация), от жидкости к пару. (кипение) или из одной твердой формы в другую (обычно это называется кристаллическим переходом).Важное различие между теплом и температурой (тепло является формой энергии, а температура — мерой количества этой энергии, присутствующей в теле) было прояснено в 18-19 веках.
Британская викторина
Викторина «Все о физике»
Кто был первым ученым, проведшим эксперимент по управляемой цепной ядерной реакции? Какая единица измерения для циклов в секунду? Проверьте свою физическую хватку с помощью этой викторины.
Тепло как форма энергии
Поскольку все многочисленные формы энергии, включая тепло, могут быть преобразованы в работу, количество энергии выражается в единицах работы, таких как джоули, фут-фунты, киловатт-часы или калории. Существуют точные отношения между количеством тепла, добавляемого к телу или отводимого от него, и величиной воздействия на состояние тела. Две наиболее часто используемые единицы тепла — это калория и британская тепловая единица (БТЕ).Калория (или грамм-калория) — это количество энергии, необходимое для повышения температуры одного грамма воды с 14,5 до 15,5 ° C; BTU — это количество энергии, необходимое для повышения температуры одного фунта воды с 63 до 64 ° F. Одна БТЕ составляет примерно 252 калории. Оба определения указывают, что изменения температуры должны измеряться при постоянном давлении в одну атмосферу, поскольку количество задействованной энергии частично зависит от давления. Калория, используемая для измерения содержания энергии в продуктах, — это большая калория, или килограмм-калория, равная 1000 грамм-калориям.
В общем, количество энергии, необходимое для подъема единицы массы вещества через заданный температурный интервал, называется теплоемкостью или удельной теплоемкостью этого вещества. Количество энергии, необходимое для повышения температуры тела на один градус, варьируется в зависимости от наложенных ограничений. Если тепло добавляется к газу, находящемуся в постоянном объеме, количество тепла, необходимое для повышения температуры на один градус, меньше, чем если бы тепло добавлялось к тому же газу, свободному для расширения (как в цилиндре, оснащенном подвижным поршнем ) и так работаю.В первом случае вся энергия идет на повышение температуры газа, но во втором случае энергия не только способствует повышению температуры газа, но и обеспечивает энергию, необходимую для работы, совершаемой газом над газом. поршень. Следовательно, теплоемкость вещества зависит от этих условий. Чаще всего определяют удельную теплоемкость при постоянном объеме и удельную теплоемкость при постоянном давлении. Французские ученые Пьер-Луи Дюлон и Алексис-Тереза Пети в 1819 году показали, что теплоемкость многих твердых элементов тесно связана с их атомным весом.Так называемый закон Дюлонга и Пти был полезен при определении атомного веса некоторых металлических элементов, но из него есть много исключений; Позднее было обнаружено, что отклонения можно объяснить на основе квантовой механики.
Неверно говорить о тепле в теле, потому что тепло ограничивается передачей энергии. Энергия, хранящаяся в теле, — это не тепло (и не работа, так как работа — это еще и энергия в пути). Однако принято говорить о явном и скрытом тепле.Скрытая теплота, также называемая теплотой испарения, — это количество энергии, необходимое для превращения жидкости в пар при постоянной температуре и давлении. Энергия, необходимая для плавления твердого тела в жидкость, называется теплотой плавления, а теплота сублимации — это энергия, необходимая для преобразования твердого тела непосредственно в пар, эти изменения также происходят в условиях постоянной температуры и давления.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчасВоздух представляет собой смесь газов и водяного пара, и вода, присутствующая в воздухе, может изменять фазу; я.е., он может стать жидким (дождь) или твердым (снег). Чтобы различать энергию, связанную с фазовым переходом (скрытое тепло), и энергию, необходимую для изменения температуры, было введено понятие явного тепла.

 Удельная теплоемкость воды составляет 4,18 Дж / г / ° C.
Удельная теплоемкость воды составляет 4,18 Дж / г / ° C.