Содержание
Типы кристаллических решеток — HimHelp.ru
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
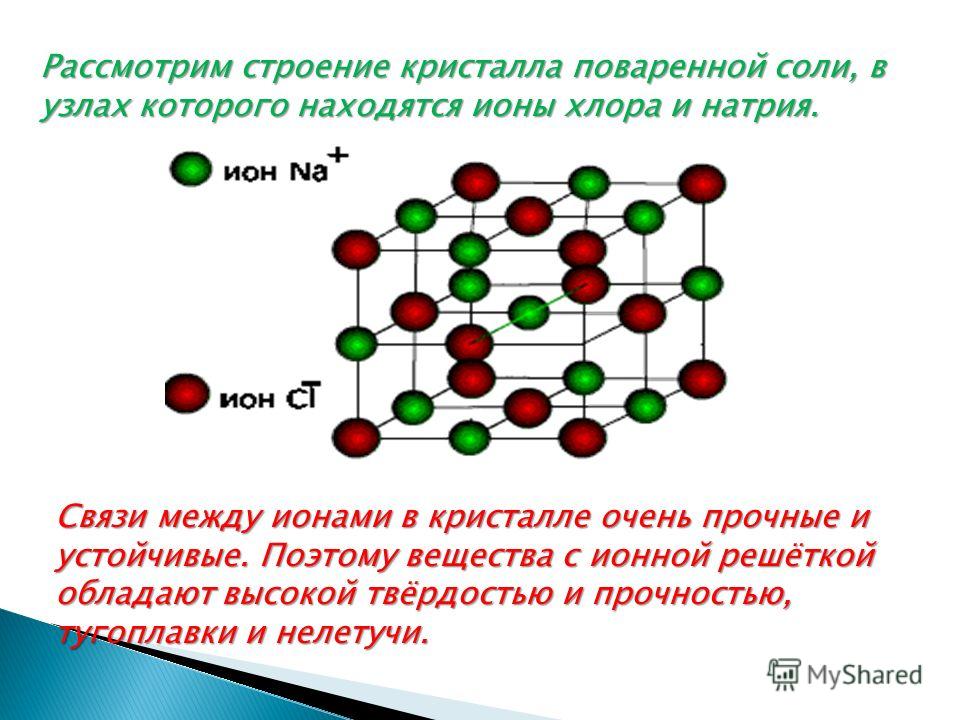
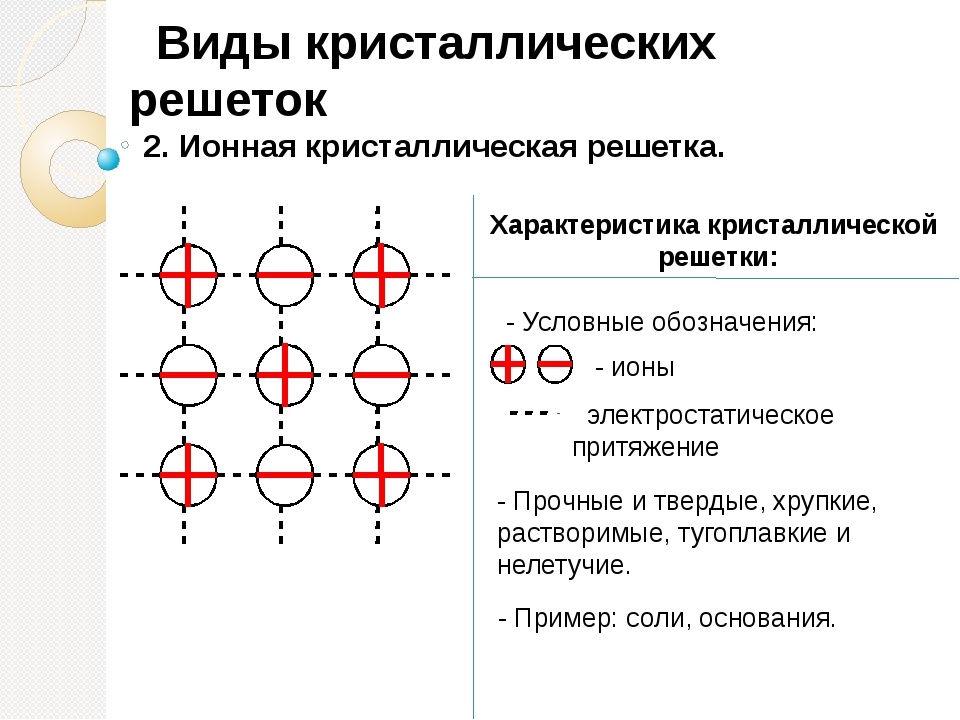
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион – шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl–, NanCln, где n – большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз – одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис . Большинство кристаллических органических соединений имеют молекулярную решетку.
Кристаллические решетки
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном, твердом и жидком. Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.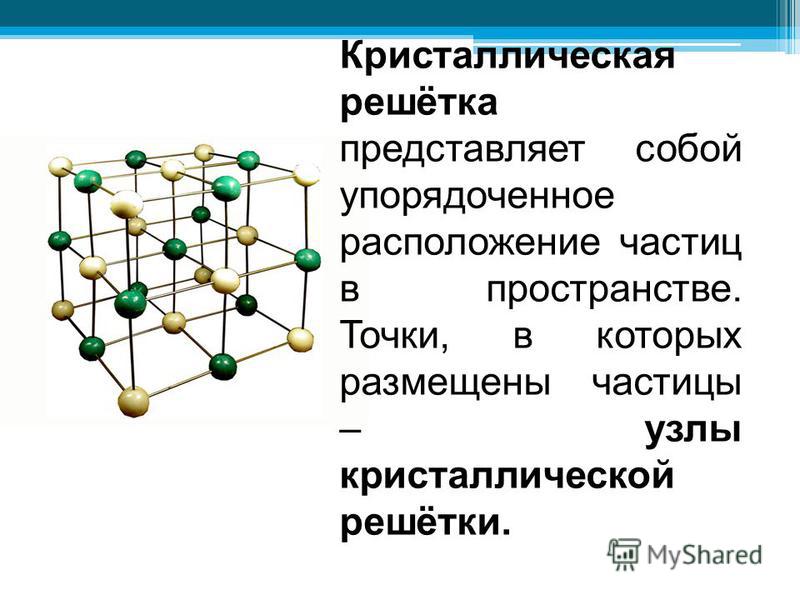
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными.
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы.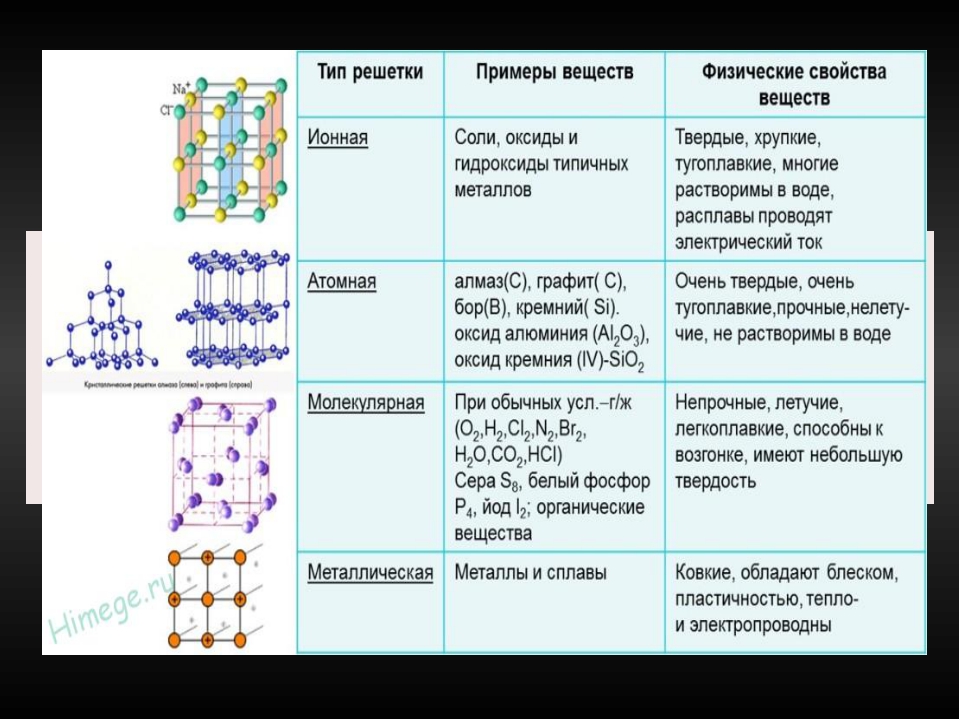 В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H20), так и неполярными (N2, O3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения.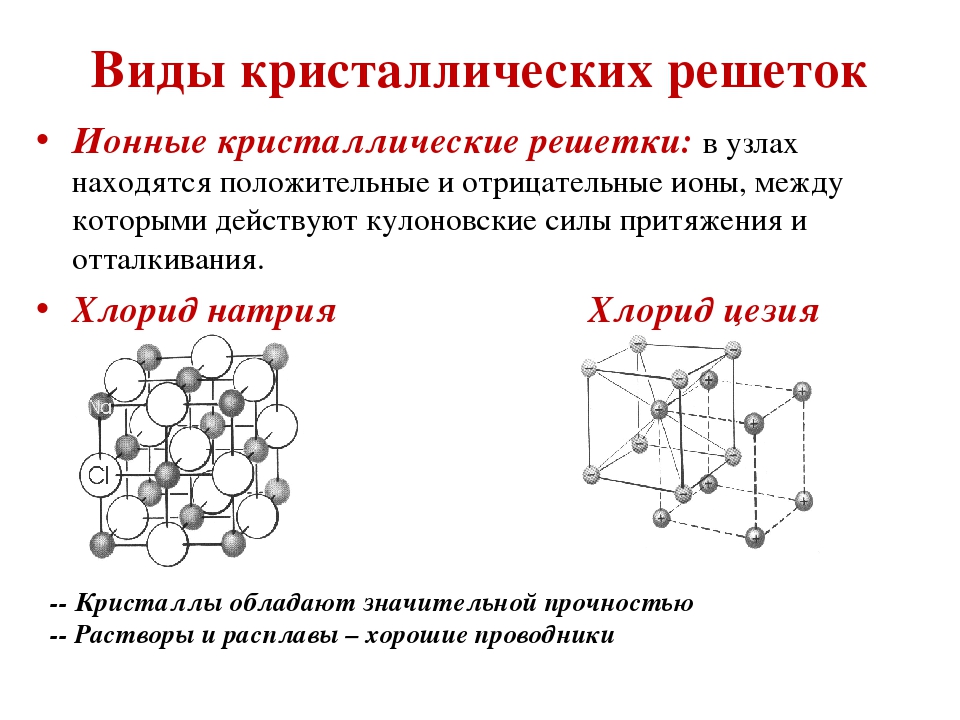 Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H2, O2, CL2, N2, I2), трех – (O3), четырех – (P4), восьмиатомными (S8) молекулами. Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Основные типы химической связи. Химическая связь. Типы химических связей Тест 3 виды химической связи
связи.
веществ.
Ход урока: (Cлайд 3)
- Объяснение темы “Основные типы химической
связи”. - Закрепление (Тест)
- Работа в графическом редакторе “Paint” –
составление графических формул веществ. - Домашнее задание.
Ход урока
I. Химический диктант.
(Cлайд 4)
II. Проверка домашнего задания
(Cлайд 5)
(Устный опрос)
- Что такое электроотрицательность?
- Зависимость электроотрицательности от
расположения элемента в таблице Менделеева? - Как определить принадлежность элемента к
металлам или неметаллам по
электроотрицательности?
III. Объяснение темы “Основные типы химической
связи”.
 (
(
Cлайд 6)
- Связь между элементами с одинаковой или близкой
электроотрицательностью называется
ковалентной. (Cлайд 7) - Связь между металлами называется
металлической. - Связь между элементами со значительно
отличающейся электроотрицательностью
называется ионной. - Связь между электроотрицательными элементами
разных молекул при помощи водорода называется
водородной.
IV. Закрепление (Тест)
(Cлайд 19)
“Закрепление 3” – для тех, кто не совсем уверен
в своих знаниях,
“Закрепление 4” – для тех, кто уверен в своих
знаниях,
“Закрепление 5” – для тех, кто абсолютно уверен
в своих знаниях.
- Отвечаете на вопросы.
- Получаете оценку и ждете пока учитель не
разрешит закрыть программу.
V. Работа в графическом редакторе “Paint” –
составление графических формул веществ.
(Cлайд
9)
1. Открываете программу “Paint”.
Открываете программу “Paint”.
2. При помощи “наборов инструментов”
составляете графические формулы веществ: воды,
фторида натрия, хлороводорода, метана.
H 2 O, NaF, HCl, CH 4 .
Тест «Типы связей и кристаллических решеток»
Вариант №1
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.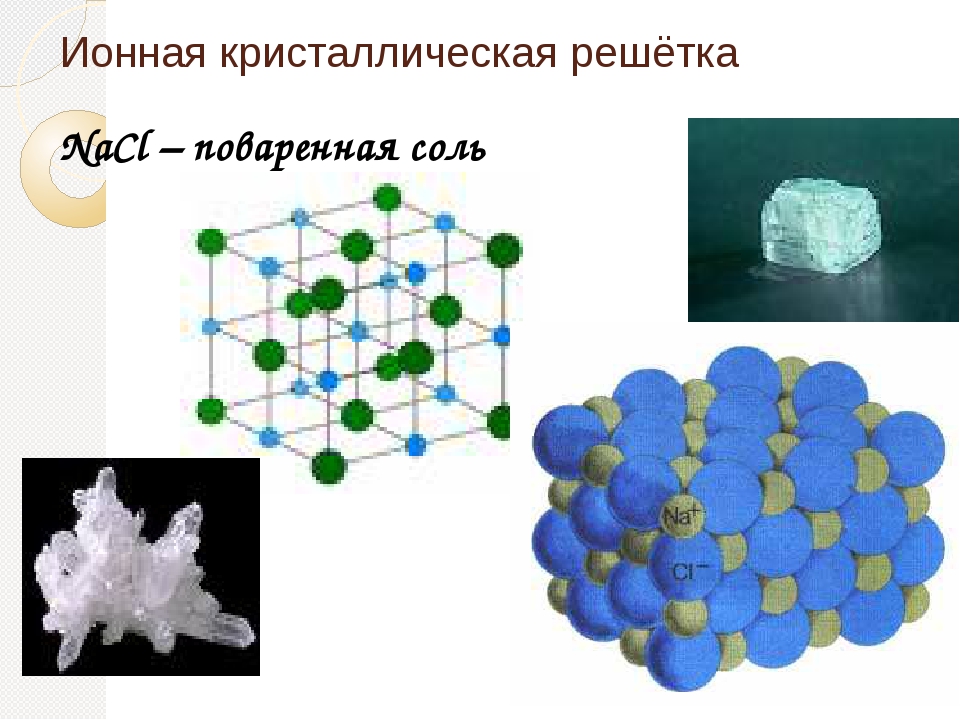
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6.Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
А8. Кристаллическая решетка углекислого газа (CO2)
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
1) лёд 2) графит 3) HF 4) KNO3
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
А1.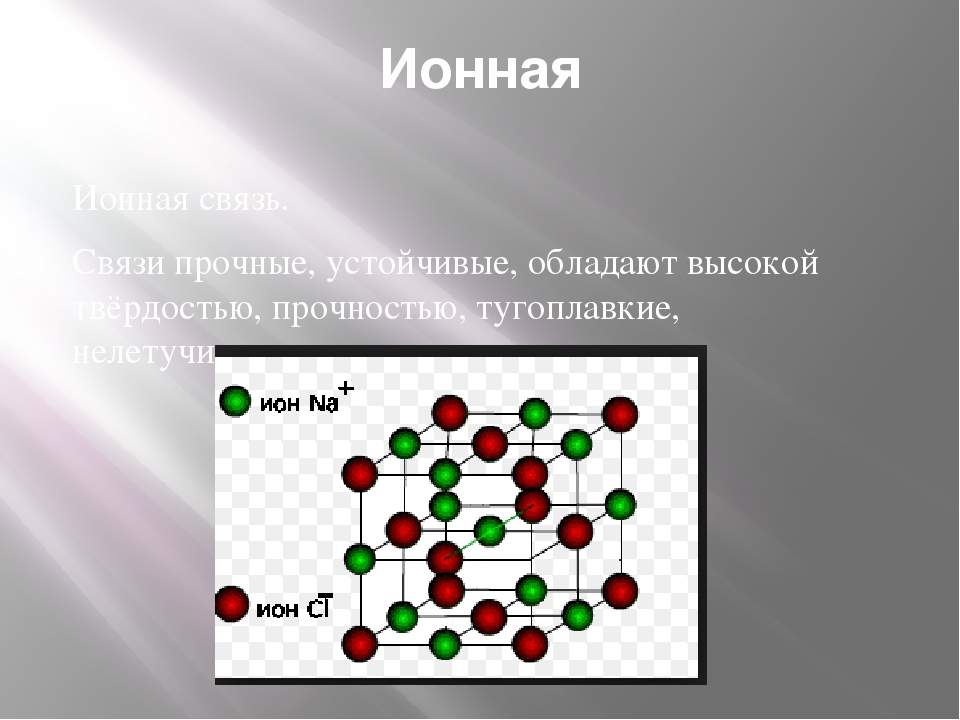 Вещества только с ионной связью приведены в ряду
Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7. При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9.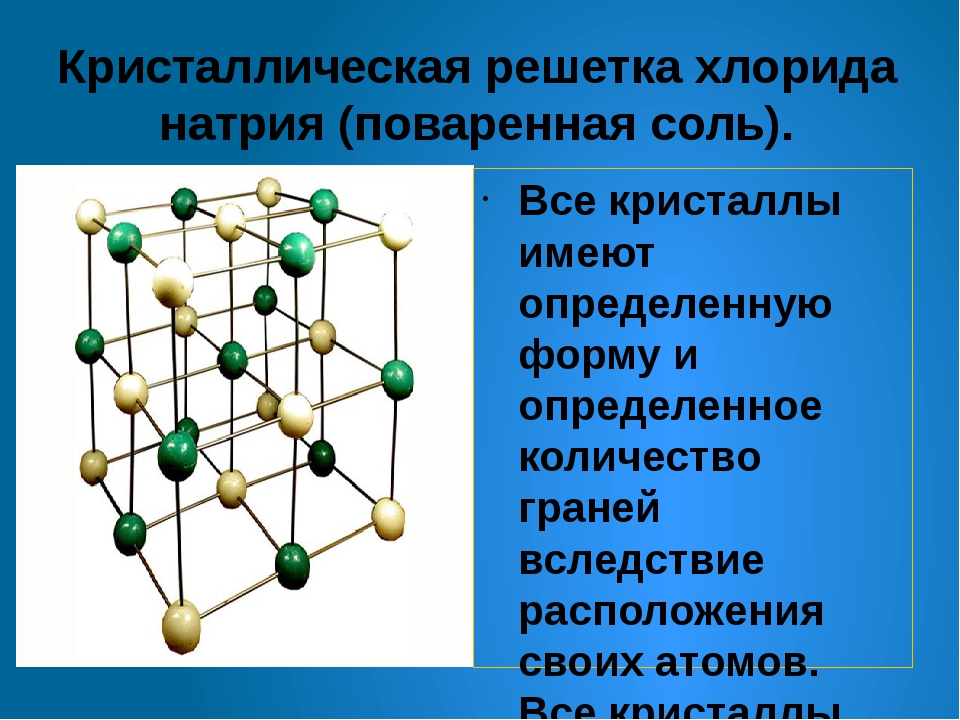 Электронная пара в молекуле HBr
Электронная пара в молекуле HBr
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В1. Установите соответствие между соединением и типом связи в соединении.
В2. Установите соответствие между соединением и типом кристаллической решетки
В3. Установите соответствие между соединением и типом связи в соединении.
Типы химических свиязей.
Часть А
1)
Li
+
и
I
—
2)
Br
—
и
H
+
3)
H
+
и
B
3+
4)
S
2-
и
O
2-
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1)NaCl, KOH 2) HI, H
2
O 3)CO
2
, Br
2
4)CH
4
, F
2
1)1 2)2 3)3 4)4
1)
KCl
2)
CO
3)
H
2
O
4)
HCl
Часть В.
А)железо 1)ионная
Д)азот
Часть С
Типы химических свиязей.
Часть А
1.Химическая связь в молекуле фтороводорода
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
2. ионная связь образуется между атомами
1) натрия и фтора 2)серы и водорода 3) серы и кислорода 4)хлора и водорода
3. Ионная связь образуется между ионами
1)
Li
+
и
I
—
2)
Br
—
и
H
+
3)
H
+
и
B
3+
4)
S
2-
и
O
2-
4. Химическая связь между атомами химических элементов с порядковыми номерами 3 и 35
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
5. Химическая связь между атомами, электроотрицательности которых не отличаются друг от друга, называется
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
6. Химическая связь атома химического элемента, имеющего шесть электронов на внешнем электронном слое с водородом
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
7. Ковалентная полярная связь в каждом из двух веществ:
Ковалентная полярная связь в каждом из двух веществ:
1)NaCl, KOH 2) HI, H
2
O 3)CO
2
, Br
2
4)CH
4
, F
2
8. Две общие электронные пары имеются в молекуле
1)водорода 2)бромоводорода 3)сероводорода 4) аммиака
9. Одну ковалентную связь имеет молекула
1)иодоводорода 2)азота 3)метана 4)кислорода
10. Число общих электронных пар в соединениях состава ЭО
2
1)1 2)2 3)3 4)4
11. Укажите формулу лишнего соединения
1)
KCl
2)
CO
3)
H
2
O
4)
HCl
Часть В.
12. Установите соответствие между названием соединения и типом химической связи в этом соединении.
Название соединения Тип химической связи
А)железо 1)ионная
Б)кислород 2)ковалентная полярная
В)вода 3)ковалентная неполярная
Г)бромид литии 4)металлическая
Д)азот
13. Ковалентная полярная связь имеет место в соединениях:
1)сероводород 2)угарный газ 3)фтор 4)цинк 5)фторид калия 3)фтор
14. Три ковалентные полярные связи имеют молекулы
Три ковалентные полярные связи имеют молекулы
1)азота 2)фосфина 3) углекислого газа 4)аммиака 5)метана
Часть С
15. Приведите примеры четырех соединений калия, имеющих одновременно и ионную и ковалентную связь.
16. Назовите соединение, имеющее одну ковалентную неполярную связь атомов, электроны которых расположены на трех энергетических слоях.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
(HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
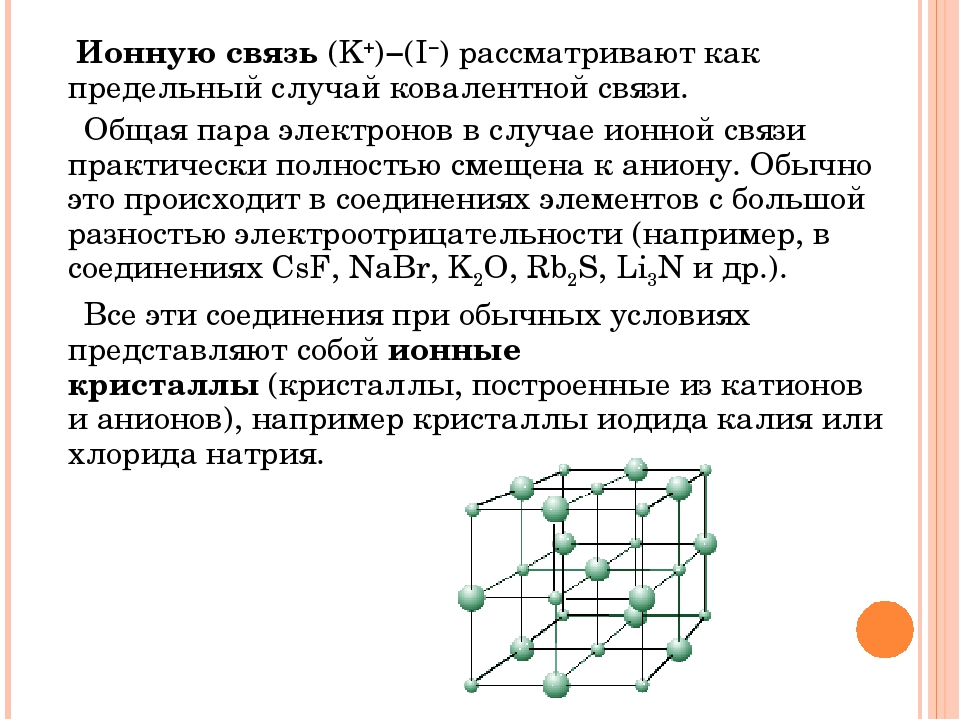
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2O, H 2F 2, NH 3. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов).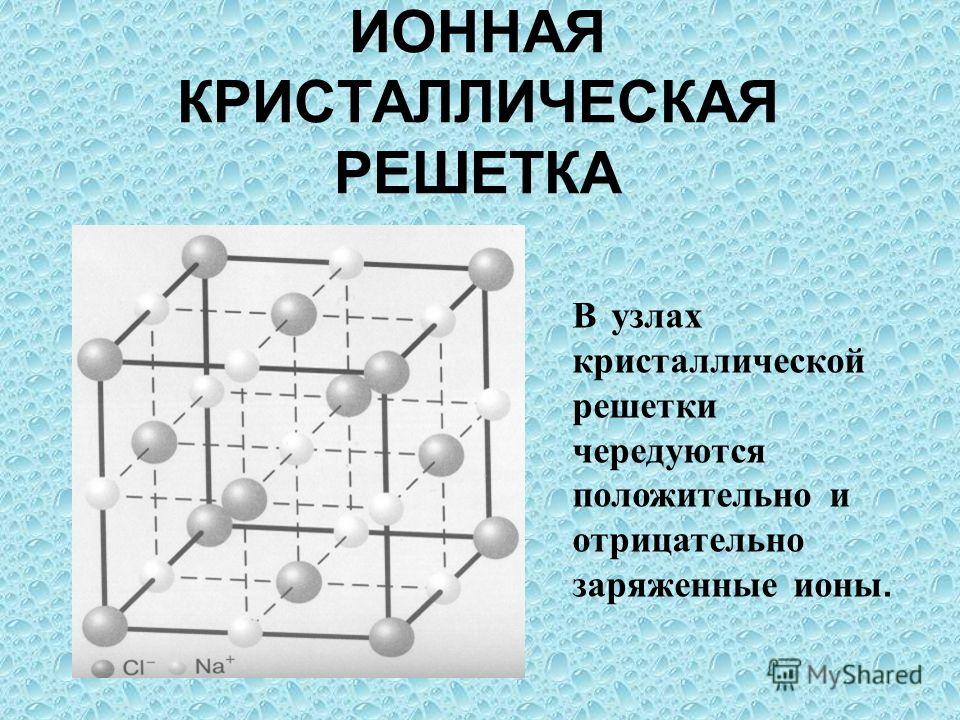 Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
1. Связь между ионами металла и блуждающими электронами называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
2. Химическая связь, возникающая между атомами неметаллов одного вида называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
3. Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
4. Химическая связь, возникающая между атомами типичного металла и типичного неметалла называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
5. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N 2 , NH 3, CO 2, NH 3, H 2, KF H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
6. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью: N 2 , NH 3, CO 2, Na, NH 3, H 2, KF H 2 O, НCl F 2, HF, C Ca. CO 3
7. Выберите группу веществ, в состав которой входят только вещества с металлической связью: Na, CO 2, K, Al, NH 3, Fe H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
8. Выберите группу веществ, в состав которой входят только вещества с ионной связью: Nа, К, Аl, Fe CO 2, Na.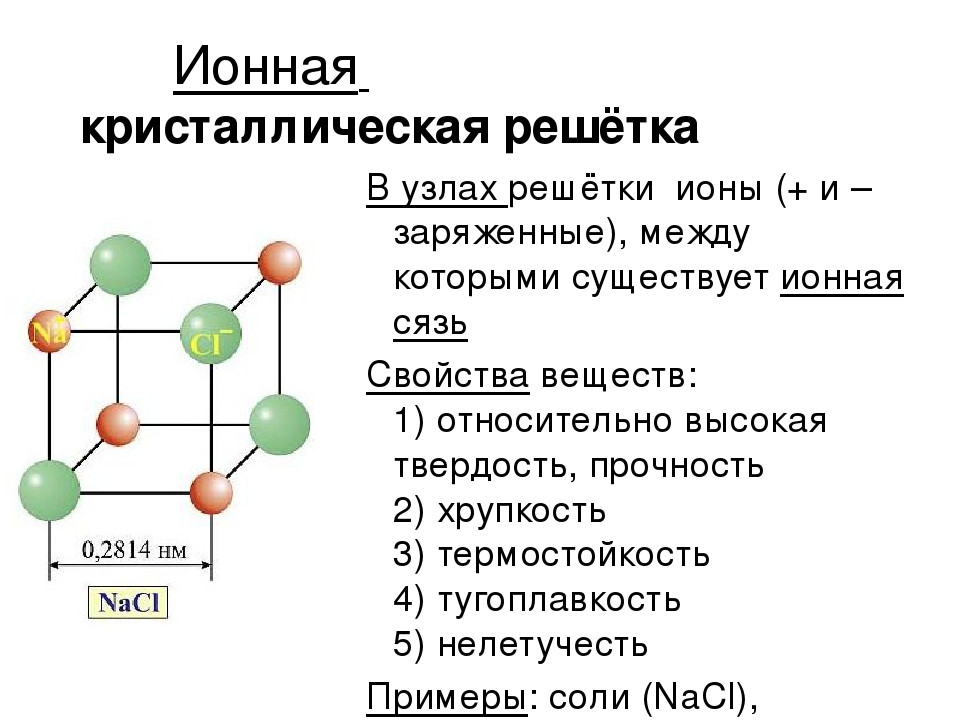 Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
9. Определите вид химической связи и тип кристаллической решетки, если вещество обладает высокой температурой плавления и кипения, твердое, тугоплавкое, хорошо растворимо в воде. Раствор проводит электрический ток. Ковалентная полярная связь и атомная кристаллическая решетка Ионная связь и ионная кристаллическая решетка Ковалентная полярная связь и молекулярная кристаллическая решетка. Металлическая связь и металлическая кристаллическая решетка. Ковалентная неполярная связь и молекулярная кристаллическая решетка
Химические элементы и вещества в свете электронной теории. Кристаллическая структура 9 класс онлайн-подготовка на
Химические связи. Кристаллическая структура
Практически все вещества в природе могут находиться в трех агрегатных состояниях — газообразном, жидком и твердом. При этом вполне обычным представляется их последовательный переход из одного состояния в другое, например, при охлаждении: газ конденсируется в жидкость, а затем кристаллизуется.
Одинаковые молекулы связаны между собой во всем объеме одинаково. Это приводит к образованию периодически повторяющейся в пространстве структуры – кристаллической решетки.
Твердыми кристаллическими именуются те вещества и тела, которые имеют определенный тип пространственной кристаллической решетки, то есть обладают способностью изменяться в определенном направлении, но не во всех (это называется анизотропия).
Изотропия — способность менять физические характеристики по всем направлениям одновременно.
Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует.
Общие свойства:
● Механические — то есть: упругость, твердость, способность к деформации.
● Тепловые — это температуры кипения и плавления, а также коэффициент теплового расширения. Электрические и магнитные — проводимость тепловая и электрическая.
Если описывать строение кристаллических и аморфных тел, то в первую очередь следует указать тип частиц, которые их слагают. В случае кристаллов это могут быть ионы, атомы, атом-ионы (в металлах), молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
1. Ионная кристаллическая решетка. Её имеют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
2. Металлическая кристаллическая решетка обусловлена металлической химической связью. Атомы металлов довольно слабо удерживают валентные электроны.
3. Атомная кристаллическая решетка — атомы веществ соединены между собой прочными ковалентными химическими связями.
4. Молекулярная кристаллическая решетка
В узлах молекулярного типа кристаллической решётки располагаются молекулы. Как правило, легко разрушить.
Ионная решетка — Ионные соединения — AQA — GCSE Combined Science Revision — AQA Trilogy
Ионное соединение — это гигантская структура ионов. Ионы имеют регулярное повторяющееся расположение, называемое ионной решеткой. Решетка образуется из-за того, что ионы притягиваются друг к другу и образуют регулярный узор с противоположно заряженными ионами рядом друг с другом.
Двумерная модель заполнения пространства для ионной решетки в хлориде натрия Трехмерная модель заполнения пространства для ионной решетки в хлориде натрия
Помните, что структура решетки гигантская — например, одна крупинка соли может содержать 1 .2 × 10 18 (1,200,000,000,000,000,000) ионов. Расположение решетки продолжается в трех измерениях. Вот почему твердые ионные соединения образуют кристаллы правильной формы.
Трехмерная модель шарика и ручки для ионной решетки в хлориде натрия
Ионная связь
Ионная решетка удерживается вместе за счет сильных электростатических сил притяжения между противоположно заряженными ионами. Силы действуют в решетке во всех направлениях. Это называется ионной связью.
Представление ионных соединений
Для представления гигантских ионных структур используются различные типы моделей.У каждого есть свои преимущества и недостатки. Например:
- двумерная модель, заполняющая пространство, четко показывает расположение ионов в одном слое, но не показывает, как расположен следующий слой ионов
- трехмерная модель шара и ручки показывает расположение ионов в большей части кристалла, но использование стержней для связей вводит в заблуждение, потому что силы притяжения между ионами фактически действуют во всех направлениях
- трехмерная модель также вводит в заблуждение, потому что она показывает много свободного пространства между ионами, которых нет
Примеры ионной связи | Биологический словарь
Ионные связи — это один из двух основных типов химических связей.Они образуются в результате электростатического притяжения между противоположно заряженными ионами и обычно возникают между металлами и неметаллами. Когда много ионов связываются вместе, они образуют гигантскую регулярную трехмерную структуру, называемую ионной решеткой или кристаллической решеткой.
Ионная связь между противоположно заряженными ионами
Что такое ионная связь?
Ионная связь — это тип химической связи, образованной электростатическим притяжением между двумя противоположно заряженными ионами. Эти ионы создаются путем переноса валентных электронов между двумя атомами, обычно металлическим и неметаллическим.
Как образуются ионы?
Ионы образуются, когда атом теряет или получает электрон. Атом, который получает электрон, становится отрицательно заряженным , и называется анионом . Атом, теряющий электрон, становится положительно заряженным катионом .
Во время ионной связи два атома (обычно металл и неметалл) обмениваются валентными электронами . Один атом действует как донор электронов, а другой — как акцептор электронов.Этот процесс называется переносом электрона и создает два противоположно заряженных иона.
Ион — это атом с чистым зарядом
Как образуются ионные связи?
Противоположно заряженные ионы имеют сильное электростатическое притяжение между собой. Это притяжение представляет собой ионную связь , , и она позволяет положительному и отрицательному иону образовывать стабильное ионное соединение с нейтральным зарядом .
Например, когда атом натрия встречает атом хлора , натрий отдает один валентный электрон хлору. Это создает положительно заряженный ион натрия и отрицательно заряженный ион хлора . Электростатическое притяжение между ними образует ионную связь, в результате чего образуется стабильное ионное соединение, называемое хлорид натрия (также известная как поваренная соль).
Ионная связь в хлориде натрия
Примеры ионных связей
Некоторые примеры ионных связей включают:
- NaCl: хлорид натрия
- NaBr: бромид натрия
- NaF: фторид натрия
- NaI: йодид натрия
- KF: фторид калия
- KCl: хлорид калия
- KI: йодид калия
- KBr: бромид калия
- LiI: иодид лития
- Li2O: оксид лития
- MgO: оксид магния
- MgS: сульфид магния
- MgSe: селенид магния
- CaCl: хлорид кальция
- CaO: оксид кальция
- CaSe: селенид кальция
Что такое ионное соединение?
Ионное соединение обычно состоит из металла и неметалла.Когда много ионов объединяются, они образуют большие структуры, называемые ионными решетками . Ионы в ионной решетке выстраиваются в правильную трехмерную форму с противоположно заряженными ионами рядом друг с другом. Эту структуру также иногда называют кристаллической решеткой .
Структура ионной решетки
Свойства ионных соединений
В ионной решетке сильное электростатическое притяжение между противоположно заряженными ионами действует во всех направлениях, придавая им уникальный набор свойств.
Ионные соединения имеют высокие температуры плавления и кипения
Ионные соединения имеют высокие температуры плавления и кипения. Это связано с тем, что для разрыва ионных связей требуется много энергии из-за сильного электростатического притяжения между противоположно заряженными ионами.
Ионные соединения имеют высокую температуру плавления
Ионные соединения легко разрушаются
Ионные соединения твердые, но хрупкие. Требуется большая сила, чтобы разорвать ионные связи, которые удерживают их вместе, но, если приложить достаточную силу, они легко разрушаются.Это происходит потому, что разрыв ионных связей сближает ионы с одинаковым зарядом. Сильные отталкивающие силы, существующие между ионами с одинаковым зарядом, заставляют их разлетаться, в результате чего ионное соединение разрушается.
Ионные соединения проводят электричество
Вещество может проводить электричество, если оно содержит заряженные частицы, которые могут свободно перемещаться. Все ионные соединения содержат заряженные частицы (ионы), но они не могут проводить электричество в твердой форме, потому что ионы не могут двигаться.Ионное вещество может проводить электричество только в том случае, если оно расплавилось или растворилось в воде, позволяя ионам перемещаться.
В чем разница между ионной связью и ковалентной связью?
Два основных типа химических связей — это ионные связи и ковалентные связи, но между ними есть некоторые ключевые различия.
Ионное и ковалентное связывание
| Ионные связи | Ковалентные связи |
|---|---|
| Связь металлов и неметаллов | Связь между неметаллами |
| Включает полный перенос электронов | Включает разделение электронов |
| Встречается между ионами со значительно различающейся электроотрицательностью | Встречается между атомами с одинаковой электроотрицательностью |
В то время как ионные связи предполагают полный перенос электронов между атомами, ковалентные связи образуются, когда два атома разделяют электроны.Обычно это происходит между атомами одного и того же элемента или между двумя близкими друг к другу элементами в периодической таблице. Ковалентные связи, скорее всего, образуются между двумя атомами с одинаковыми значениями электроотрицательности (то есть теми, которые обладают аналогичной способностью притягивать электроны). Обычно они возникают между двумя неметаллами, хотя их также можно наблюдать между металлами и неметаллами.
Ионные связи обычно прочнее ковалентных из-за электростатического притяжения, которое существует между противоположно заряженными ионами.
Энергия решетки
Энергия решетки
Энергия решетки
Энергия решетки и сила ионного
Облигация
Сила притяжения между противоположно заряженными частицами прямо пропорциональна
к произведению расходов на два объекта ( q 1 и q 2 )
и обратно пропорциональна квадрату расстояния между объектами ( r 2 ).
Сила связи между ионами противоположного заряда в ионном соединении.
следовательно, зависит от зарядов на ионах и расстояния между центрами
ионы, когда они упаковываются, образуя кристалл.
Оценка силы связи в ионном соединении может быть получена с помощью
измерение энергии решетки соединения, которая является энергией, выделяемой при
противоположно заряженные ионы в газовой фазе объединяются в твердое тело.
Пример: энергия решетки NaCl — это энергия, выделяемая при Na + и Cl —.
ионы в газовой фазе объединяются, чтобы сформировать решетку чередующихся Na + и
Cl — ионов в кристалле NaCl, показанном на рисунке ниже.
| Na + ( г ) + Cl — ( г ) NaCl ( с ) | H o = -787.3 кДж / моль |
Энергия решетки ионных соединений относительно велика. Энергия решетки
NaCl, например, составляет 787,3 кДж / моль, что лишь немного меньше выделяемой энергии.
когда горит природный газ.
Связь между ионами противоположного заряда наиболее прочна, когда ионы маленькие.
Таким образом, энергия решетки галогенидов щелочных металлов является наибольшей для LiF и
наименьший для CsI, как показано в таблице ниже.
Энергия решетки галогенидов щелочных металлов (кДж / моль)
| Факс — | Класс — | Br — | Я — | |||||
| Li + | 1036 | 853 | 807 | 757 | ||||
| Na + | 923 | 787 | 747 | 704 | ||||
| К + | 821 | 715 | 682 | 649 | ||||
| руб. + | 785 | 689 | 660 | 630 | ||||
| CS + | 740 | 659 | 631 | 604 |
Ионная связь также должна становиться сильнее по мере увеличения заряда ионов.Данные в таблице ниже показывают, что энергии решетки солей OH —
и ионы O 2- быстро увеличиваются по мере увеличения заряда иона.
Энергия решетки солей OH — и O 2 —
Ионы (кДж / моль)
| ОН — | О 2- | |||
| Na + | 900 | 2481 | ||
| мг 2+ | 3006 | 3791 | ||
| Al 3+ | 5627 | 15 916 |
Энергия решетки и растворимость
Когда соль, такая как NaCl, растворяется в воде, кристаллы исчезают на макроскопическом изображении.
шкала.В атомном масштабе ионы Na + и Cl — в кристалле являются
выпущен в раствор.
| NaCl ( с ) | H 2 O | Na + ( водн. ) + Cl — ( водн. ) |
Таким образом, энергия решетки соли дает приблизительное представление о растворимости
соль в воде, потому что она отражает энергию, необходимую для разделения положительного и
отрицательные ионы в соли.
Соли натрия и калия растворимы в воде, поскольку имеют относительно небольшие
энергии решетки. Соли магния и алюминия часто гораздо менее растворимы, потому что они
требуется больше энергии для разделения положительных и отрицательных ионов в этих солях. NaOH, для
Например, хорошо растворяется в воде (420 г / л), но Mg (OH) 2 растворяется в воде
только до 0,009 г / л, и Al (OH) 3 практически нерастворим в воде.
Ионная связь | Химическая связь
Природа ионной связи (ESABX)
Когда электроны переносятся от одного атома к другому, это называется ионной связью .
Электроотрицательность — это свойство атома, описывающее, насколько сильно он притягивает или удерживает электроны. Ионная связь происходит, когда разница в электроотрицательности между двумя атомами превышает \ (\ text {1,7} \). Обычно это происходит, когда атом металла связывается с атомом неметалла. Когда разница в электроотрицательности велика, один атом будет притягивать общую электронную пару намного сильнее, чем другой, вызывая перенос электронов на атом с более высокой электроотрицательностью.Когда образуются ионные связи, металл отдает один или несколько электронов из-за низкой электроотрицательности с образованием положительного иона или катиона. Атом неметалла имеет высокую электроотрицательность и поэтому легко получает электроны с образованием отрицательного иона или аниона. Затем два иона притягиваются друг к другу электростатическими силами.
- Ионная связь
Ионная связь — это тип химической связи, при которой один или несколько электронов передаются от одного атома к другому.
Пример 1:
В случае \ (\ text {NaCl} \), разница в электроотрицательности между \ (\ text {Na} \) (\ (\ text {0,93} \)) и \ (\ text {Cl} \) (\ (\ text {3,16} \)) равно \ (\ text {2,1} \). У натрия только один валентный электрон, а у хлора их семь. Поскольку электроотрицательность хлора выше, чем электроотрицательность натрия, хлор будет очень сильно притягивать валентный электрон атома натрия. Этот электрон от натрия передается хлору.{-} \) ион.
Хлор — двухатомная молекула, поэтому для участия в ионной связи он должен сначала распасться на два атома хлора. Натрий является частью металлической решетки, и отдельные атомы сначала должны оторваться от решетки.
Таким образом, электрон переходит от натрия к хлору:
Рисунок 6.1: Ионная связь в хлориде натрия
Вычисленное уравнение реакции:
\ [2 \ text {Na} + \ text {Cl} _ {2} \ rightarrow 2 \ text {NaCl} \]
Пример 2:
Другой пример ионной связи имеет место между магнием \ ((\ text {Mg}) \) и кислородом \ ((\ text {O} _ {2}) \) с образованием оксида магния \ ((\ text {MgO} ) \).{2 -} \). Сила притяжения между противоположно заряженными ионами — это то, что удерживает соединение вместе.
Вычисленное уравнение реакции:
\ [2 \ text {Mg} + \ text {O} _ {2} \ rightarrow 2 \ text {MgO} \]
Поскольку кислород представляет собой двухатомную молекулу, два атома магния потребуются для соединения с одной молекулой кислорода (которая имеет два атома кислорода), чтобы произвести две единицы оксида магния \ ((\ text {MgO}) \).
Структура кристаллической решетки ионных соединений (ESABY)
Ионные вещества на самом деле представляют собой комбинацию множества ионов, связанных вместе в гигантскую молекулу.Расположение ионов в регулярной геометрической структуре называется кристаллической решеткой . Так что на самом деле \ (\ text {NaCl} \) не содержит один \ (\ text {Na} \) и один \ (\ text {Cl} \) ион, а скорее много этих двух ионов, расположенных в кристалле. решетка, в которой соотношение ионов \ (\ text {Na} \) к \ (\ text {Cl} \) равно 1: 1. Структура кристаллической решетки показана ниже.
Рис. 6.2: Расположение кристаллической решетки в \ (\ text {NaCl} \)
Рисунок 6.3: Модель заполнения пространства решетки хлорида натрия
Свойства ионных соединений (ЭСАБЗ)
Ионные соединения обладают рядом свойств:
Ионы расположены в решетчатой структуре
Ионные твердые вещества являются кристаллическими при комнатной температуре
Ионная связь представляет собой сильное электростатическое притяжение.Это означает, что ионные соединения часто бывают твердыми и имеют высокие температуры плавления и кипения
Ионные соединения хрупкие, и связи в плоскостях разрываются, когда соединение находится под давлением (напряжением)
Твердые кристаллы не проводят электричество, а ионные растворы —
Практика Сиявулы дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам учиться.Тренируйтесь где угодно, когда угодно и на любом устройстве!
Зарегистрируйтесь сейчас для тренировки
Ионные соединения
Упражнение 6.3
Объясните разницу между ковалентной связью и ионной связью .
Решение еще не доступно.
Магний и хлор реагируют с образованием хлорида магния.
В чем разница в электроотрицательности этих двух элементов?
Укажите химическую формулу:
ион магния
хлорид-ион
ионное соединение, которое образуется во время этой реакции
Напишите сбалансированное химическое уравнение протекающей реакции.
Решение пока недоступно.
Нарисуйте диаграммы Льюиса, представляющие следующие ионные соединения:
натрия йодид \ ((\ text {NaI}) \)
кальция бромид \ ((\ text {CaBr} _ {2}) \)
хлорид калия \ ((\ text {KCl}) \)
Решение пока недоступно.
кристалл | Определение, типы, структура и факты
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако при осмотре определение становится менее однозначным. Например, кубик масла становится твердым после хранения в холодильнике и явно твердый. После того, как этот кубик оставался на кухонном столе в течение дня, он становится довольно мягким, и неясно, следует ли считать масло твердым.Многие кристаллы ведут себя как масло в том смысле, что они твердые при низких температурах, но мягкие при более высоких. Их называют твердыми веществами при всех температурах ниже их точки плавления. Возможное определение твердого тела — это объект, который сохраняет свою форму, если его не трогать. Актуальный вопрос заключается в том, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы твердых тел
Основные единицы твердых тел — это атомы или атомы, которые объединились в молекулы.Электроны атома движутся по орбитам, которые образуют оболочку вокруг ядра. Оболочки заполняются в систематическом порядке, каждая оболочка вмещает только небольшое количество электронов. У разных атомов разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов в атоме определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Например, все заполненные оболочки атома аргона (Ar) заполнены, в результате чего атом имеет сферическую форму. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена только частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо — это магнит. Ковалентная связь между двумя атомами углерода (C) — самая прочная связь в природе. Эта прочная связь делает алмаз самым твердым.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Твердое тело является кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, положение каждого атома известно точно во всем кристалле. В большинстве жидкостей отсутствует дальний порядок, хотя во многих есть ближний порядок. Ближний радиус действия определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях атомы первых соседей расположены в той же структуре, что и в соответствующей твердой фазе.Однако на расстояниях, которые находятся на расстоянии многих атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти особые вещества называются жидкими кристаллами. Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, которые имеют ближний порядок, но не имеют дальнего порядка, называются аморфными. Практически любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние).Это состояние нестабильно, и твердое вещество со временем кристаллизуется. Если временной шкалой кристаллизации являются годы, то аморфное состояние кажется стабильным. Стекла — это пример аморфного твердого тела. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) такой же ближний порядок существует, но направления связей меняются на расстояниях дальше от любого атома. Аморфный кремний — это разновидность стекла. Квазикристаллы — это еще один тип твердых тел, в которых отсутствует дальний порядок.
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла. На самом деле они состоят из миллионов зерен (мелких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует внутри одного зерна, на границе между зернами он меняет направление. Типичный кусок железа или меди (Cu) поликристаллический. Монокристаллы металлов мягкие и податливые, а поликристаллические металлы тверже и прочнее и более полезны в промышленности.Большинство поликристаллических материалов можно превратить в крупные монокристаллы после продолжительной термообработки. Раньше кузнецы нагревали кусок металла, чтобы сделать его пластичным: тепло заставляет несколько зерен увеличиваться в размерах за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время колотили по нему; удары сделают его снова поликристаллическим, увеличивая его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и молекулярные твердые тела.Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если только они не заржавели. Полупроводники иногда блестят, а иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, тогда как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда в сульфид кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, аналогично количеству полупроводников.На самом деле висмут называют полуметаллом. Молекулярные твердые вещества обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество разных кристаллов огромно.
Типы связи в кристаллах
Атомы связываются во время химических реакций, приводя к образованию кристаллов. Кристаллы определяются как твердое состояние вещества, в котором атомы плотно упакованы вместе.Отличительная особенность кристаллов в том, что их твердая форма симметрична со всех сторон. Специфическая геометрическая форма кристаллов называется кристаллической решеткой. Когда электроны атомов соединяются с окружающими атомами, химическая связь завершается, и образуются кристаллы.
Ионные связи
Когда образуются ионные кристаллы, электроны перепрыгивают со своих орбит и связываются с соответствующим поддерживающим атомом. Результирующая комбинация отрицательно или положительно заряженных электростатических сил стабилизирует ионы.Физик Шарль Огюстен де Кулон определил эти электростатические силы, или кулоновские силы, в форме закона. Согласно закону Кулона, силы притяжения, образованные между атомами, стягивают атомы вместе, и это действие отрицательно воспроизводится из-за одинаковых зарядов между одними и теми же ионами. Это приводит к очень прочной связи атомов в кристаллах. Эти очень интенсивные силы придают этим кристаллам высокие температуры плавления и жесткую структуру.
Ковалентные связи
Ковалентная связь, как следует из названия, представляет собой кристаллическую структуру, в которой электроны не покидают свои орбиты.Электроны, напротив, распределяются между двумя атомами. Таким образом, общий электрон связывает каждые два соседних атома. Связанные атомы также разделяют другой электрон от соседних атомов и так далее. Ковалентная связь между атомами вещества приводит к образованию геометрического кристалла.
Связи Ван-дер-Ваальса
Связь Ван-дер-Ваальса — это слабое взаимодействие между атомами вещества, приводящее к кристаллам мягкой консистенции. Внешняя орбита атомов полностью заполнена общими электронами, но их заряд продолжает переноситься.
Водородные связи
Водородная связь образуется, когда атом водорода притягивается к соответствующим электронам соответствующих атомов. Это мешает формированию кристаллов. Атом водорода, будучи связанным с другим атомом, притягивается к отрицательному заряду соседней молекулы. Это ограничивает атом водорода между двумя отрицательными зарядами. Водородные связи обычно встречаются в кристаллах льда, где атомы водорода плотно упакованы между двумя атомами кислорода.
Металлические связи
При формировании металлических кристаллов все электроны с атомных орбит вырываются со своего пути. Они слипаются и образуют облако. Весь этот кластер притягивается положительно заряженными центрами атомов. Это притяжение удерживает атомы вместе. Все металлы образуют кристаллы этого типа. Поскольку электроны могут свободно перемещаться в соединении, образующиеся кристаллы обладают высокой проводимостью.
термодинамика — Как водородные связи разрывают ионные связи кристаллической решетки?
термодинамика — Как водородные связи разрывают ионные связи кристаллической решетки? — Обмен химического стека
Сеть обмена стеков
Сеть Stack Exchange состоит из 177 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange
0
+0
- Авторизоваться
Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов в области химии.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществу
Кто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено
1к раз
$ \ begingroup $
На этот вопрос уже есть ответы :
Закрыт 4 года назад.
В случае растворения хлорида натрия в воде. У меня создалось впечатление, что водородные связи намного слабее, чем ионные связи в хлориде натрия, так как же они преодолевают силу ионной связи? Неужели ионы просто кишат достаточным количеством молекул воды, так что объединенные силы дипольного взаимодействия разрывают ионную связь? Или возможно, что из-за того, что реакция растворения хлорида натрия является эндотермической, водородных связей самих по себе недостаточно для разрыва ионных связей, поэтому для этого реакция должна потреблять энергию из окружающей среды (для этого реакция должна быть энтропийно благоприятной, верно?)?
Создан 05 апр.
$ \ endgroup $
1
$ \ begingroup $
Ваше предположение, что именно водородная связь разрывает ионные связи, неверно.Забудьте о водородных связях. Верно, что они существуют как в чистой воде, так и в растворе хлорида натрия. Молекулы воды окружают ионы Na + и Cl —. Взаимодействие там диполь-ионное. Na-OH 2 и Cl-HOH. Очевидно, что только в одном из них присутствует атом H. (обратите внимание, что «-«, который я использовал, это , а не , предназначенный для обозначения ковалентной или ионной связи, скорее он предназначен для демонстрации электронного взаимодействия между двумя противоположно заряженными частицами (ионы Cl и Na имеют полный целочисленный заряд, атомы H и O имеют только частичный противоположный заряд, в основном индуцированный.На этот вопрос можно ответить, просто помахав рукой о термодинамике: энергия сольватированных ионов Na и Cl меньше энергии этих двух ионов в кристалле. Таким образом, в среднем ионы покидают кристалл и попадают в жидкость (до тех пор, пока их концентрация не станет настолько высокой, что между двумя фазами установится равновесие). Итак, хотя — это верно, что связь HOH … Cl можно назвать водородной связью, но, насколько я могу судить, такой подход не имеет очевидного преимущества. Происходящие диполь-ионные взаимодействия неразборчивы.Каждый ион окружен участками (ориентированных) молекул воды. Чтобы узнать больше, см. Https://en.wikipedia.org/wiki/Solvation_shell и особенно https://en.wikipedia.org/wiki/Solvation
.
Создан 05 апр.
альфонс
85644 серебряных знака44 бронзовых знака
$ \ endgroup $
1
Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Ваша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
