Содержание
Изобретен графеновый фильтр для опреснения морской воды
- Пол Ринкон
- Редактор отдела науки ВВС
Автор фото, Uni Manchester
Підпис до фото,
Мембраны из графена могут творить чудеса
Британские ученые создали первый в мире фильтр для опреснения морской воды, используя специальное «решето» из графена, пропускающее молекулы воды, но задерживающее ионы натрия, хлора и другие компоненты солей.
Это изобретение может помочь миллионам людей по всему миру, испытывающим проблемы с доступом к чистой питьевой воде.
Сейчас новый фильтр проходит испытания — его сравнивают с уже существующими мембранами для опреснения воды.
До последнего времени производить графеновые «сита» на промышленной основе было крайне затруднительно.
Результаты исследования команды ученых Манчестерского университета под руководством доктора Рахула Найра были опубликованы в журнале Nature Nanotechnology: физики заявляют, что им удалось разрешить многие практические проблемы производства при помощи производного вещества, оксида графена.
Графен является двумерной аллотропной модификацией углерода — это слой вещества толщиной в один атом, соединенный посредством σ- и π-связей в гексагональную двумерную кристаллическую решетку.
Графен был открыт группой исследователей из Манчестерского университета; это один из самых легких и жестких материалов с необычными свойствами теплопроводности.
Однако до сих пор возникали трудности с производством однослойного графена — как с технической, так и финансовой точки зрения.
Однако, как говорит доктор Найр, оксид графена можно с легкостью производить при помощи простого процесса окисления в лаборатории, а затем его можно нанести на пористый материал — и использовать полученный результат как фильтр.
Автор фото, EPA
Підпис до фото,
У миллионов людей по всему миру нет регулярного доступа к питьевой воде
Проблема любого фильтра, по его словам, состоит в том, что в нем необходимо «просверливать» крошечные отверстия.
«Но если диаметр отверстия окажется больше одного нанометра, соли морской воды проникнут через него, — поясняет он. — Так что, чтобы сделать мембрану пригодной для опреснения, она должна быть пронизана совершенно одинаковыми отверстиями размером меньше нанометра, а это очень сложная задача».
Мембраны из оксида графена уже были испытаны для фильтрации наночастиц, органических молекул и даже крупных солей. Но до сих пор они были непригодны для очищения воды от обычной соли, так как для этого отверстия в «сите» должны быть еще меньше.
До сих пор проблема состояла в том, что пленки оксида графена немного разбухают при намачивании — и начинают пропускать не только воду, но и ионы магния, натрия и ряда других веществ. Найр и его коллеги решили эту проблему, научившись склеивать одиночные полоски из оксида графена при помощи обычной эпоксидной смолы — таким образом, они почти не разбухают при контакте с водой.
Этот метод заодно позволил ученым «настраивать» свойства мембраны — так, чтобы она пропускала больше или меньше соли.
При растворении обычных солей в воде, вокруг каждой молекулы соли образуется своеобразная оболочка из молекул воды.
Это позволяет капиллярам мембран из оксида графена пропускать вону, отсеивая морскую соль.
«Молекулы воды могут пройти через мембрану по одной, но молекулы хлорида натрия этого сделать не могут — для этого они должны быть окружены водой, а вместе с водяной оболочкой молекула соли оказывается больше, чем диаметр капилляра», — объясняет доктор Найр.
Автор фото, PHOTOSTOCK-ISRAEL/SCIENCE PHOTO LIBRARY
Підпис до фото,
Теперь ученые должны сравнить, насколько хорошо новый фильтр работает по сравнению с материалами, уже существующими на рынке
Кроме того, молекулы воды проникают через мембрану с большой скоростью, что делает это изобретение идеальным для опреснения морской воды.
«Диаметр капилляра достигает около одного нанометра, что почти соответствует размеру молекулы воды, а это, в свою очередь, приводит к цепной реакции: одна молекула тянет за собой другую, и они проходят через мембрану наподобие поезда», — объясняет Рахул Найр.
«За счет этого вода движется быстрее: если увеличить давление с одной стороны, то все молекулы быстро перетекут на другую за счет водородной связи между ними. Но это происходит только в том случае, если диаметр тоннеля очень мал», — добавляет он.
По оценкам ООН, к 2025 году более 14% населения Земли будут испытывать нехватку в питьевой воде. Многие страны уже строят большие установки по опреснению воды.
В настоящий момент подобные установки используют мембраны из полимеров.
«Мы продемонстрировали, что можем контролировать размеры пор мембраны и за счет этого опреснять воду, что еще недавно было невозможным. Теперь мы должны изучить, как наш фильтр работает по сравнению с лучшими материалами, уже существующими на рынке», — продолжает доктор Найр.
Рам Деванатан из Тихоокеанской Северо-Западной национальной лаборатории США, говорит, что необходимо проверить новые фильтры и на предмет срока службы — выдержат ли они длительный контакт с морской водой, — а также выяснить, как они будут реагировать на загрязнения воды биологическими веществами.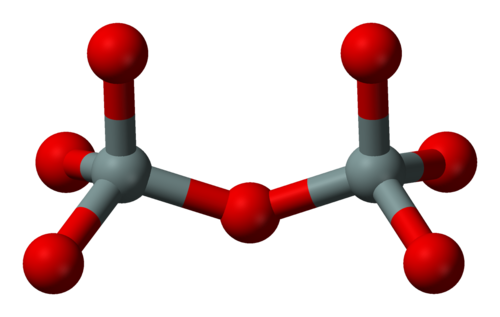
Найден новый способ извлечения соли из морской воды
Ученые из Национальной лаборатории имени Лоуренса в Беркли нашли способ сделать опреснение менее дорогим. Они создали так называемые «термически чувствительные» ионные жидкости для отделения воды от соли. Статья, посвященная разработке, опубликована в журнале Communications Chemistry.
Ионные жидкости представляют собой жидкие соли, которые связываются с водой, что делает их полезными в прямом осмосе для отделения загрязняющих веществ от воды. Но термически чувствительные ионные жидкости представляются самым лучшим вариантом потому, что для своей работы поглощают тепловую энергию, а не электрическую.
«Современное опреснение обратным осмосом работает очень хорошо, но стоимость такого процесса очень велика из-за затрат электроэнергии, — отметил один из соавторов статьи, Роберт Костецки. — Наше исследование показывает, что использование недорогого «бесплатного» тепла, такого как геотермальное, солнечное или генерируемое машинами, в сочетании с термочувствительными ионными жидкостями может компенсировать большую часть затрат, которые входят в современные технологии опреснения обратным осмосом, которые полагаются исключительно на электроэнергию».
Новая работа ставила целью исследовать поведение ионных жидкостей в воде на молекулярном уровне. Используя ядерную магнитно-резонансную спектроскопию и динамическое рассеяние света, а также методы моделирования молекулярной динамики, команда сделала неожиданное открытие.
Долгое время считалось, что эффективное разделение ионной жидкости зависит от общего отношения органических компонентов (частей ионной жидкости, которые не являются ни положительно, ни отрицательно заряженными) к ее положительно заряженным ионам. Но ученые из лаборатории имени Лоуренса выяснили, что количество молекул воды, которое ионная жидкость может отделить от морской, зависит от близости ее органических компонентов к положительно заряженным ионам. Это новое свойство поможет создать лучшие системы опреснения морской воды.
Влиятельный ион | Наука и жизнь
Как один ион влияет на миллион молекул воды.
Что происходит, когда вы бросаете крупинку соли в стакан с водой? Молекулы воды начинают «разбирать» кристаллическую решетку соли, вытаскивая оттуда ионы натрия и хлора. Вокруг каждого иона образуется многослойная «шуба» из молекул воды. На языке химии это называется гидратация, а сама шуба – гидратной оболочкой. Исследователи из Политехнической школы в Лозанне решили выяснить, насколько велик размер этой водяной шубы у ионов, и пришли к удивительным результатам.
Вокруг каждого иона образуется многослойная «шуба» из молекул воды. На языке химии это называется гидратация, а сама шуба – гидратной оболочкой. Исследователи из Политехнической школы в Лозанне решили выяснить, насколько велик размер этой водяной шубы у ионов, и пришли к удивительным результатам.
Считалось, что число молекул воды в гидратной оболочки у различных ионов составляет порядка сотни, что соответствует примерно трём слоям «водяной шубы». Это значит, что попавший в воду ион взаимодействует приблизительно с сотней окружающих его молекул воды, а молекулы, которые находятся за этим радиусом воздействия, никак не «ощущают» на себе присутствие иона. Под словом «ощущают» понимается наблюдаемое изменение какой-нибудь характеристики молекулы. Скажем, молекулы, которые непосредственно взаимодействуют с ионом, чуть-чуть изменяют свои геометрические параметры, например, длину связи между атомом кислорода и водорода.
Но у воды есть ещё одна замечательная особенность – это сильные водородные связи между молекулами. Они намного слабее химической связи между атомами внутри молекулы, но в то же время от межмолекулярного взаимодействия зависят свойства вещества, например, температура кипения или гидравлические свойства жидкости. Когда ион попадает в воду, то он своим присутствие искажает характер взаимодействия окружающих молекул воды друг с другом. Вопрос – сколько молекул «чувствуют» существование ионного соседа. Оказалось, что один ион может влиять приблизительно на миллион окружающих его молекулы воды, хотя, как мы уже говорили, раньше это число ограничивалось сотнями молекул. Это означает, что миллион молекул вокруг одного иона изменяют свой характер взаимодействия со своими соседями, и этот эффект удалось зарегистрировать в эксперименте.
Они намного слабее химической связи между атомами внутри молекулы, но в то же время от межмолекулярного взаимодействия зависят свойства вещества, например, температура кипения или гидравлические свойства жидкости. Когда ион попадает в воду, то он своим присутствие искажает характер взаимодействия окружающих молекул воды друг с другом. Вопрос – сколько молекул «чувствуют» существование ионного соседа. Оказалось, что один ион может влиять приблизительно на миллион окружающих его молекулы воды, хотя, как мы уже говорили, раньше это число ограничивалось сотнями молекул. Это означает, что миллион молекул вокруг одного иона изменяют свой характер взаимодействия со своими соседями, и этот эффект удалось зарегистрировать в эксперименте.
Такое структурирование воды относительно небольшим количеством ионов может лежать в основе другого интересного эффекта – уменьшении поверхностного натяжения воды при растворении в ней неорганических солей. Исследователи предположили, что это может быть связано с тем, что ионы, находящиеся в толще раствора, делают его немного более «жёстким» за счёт искажения структуры водородных связей, в то время как поверхностный слой воды становится более «подвижным».
Всего экспериментаторы проверили воздействие больше двух десятков разных веществ, везде получив схожие результаты. Кроме того, они посмотрели, как меняется эффект, если вместо обычной воды взять тяжёлую воду – в которой атомы водорода заменены на его изотоп дейтерий. По своим химическим свойствам тяжёлая вода практически ничем не отличается от обычной, но, как выяснилось, не в этом эксперименте. Чтобы добиться от тяжёлой воды такого же изменения поверхностного натяжения, потребовались концентрации ионов в 6 раз большие, чем в случае с обычной водой. Авторы исследования отдельно подчеркнули, что результаты их работы полностью воспроизводимы и не имеет ничего общего с такими распространёнными мифами, как «память» воды, и никоим образом не подтверждают эффективность гомеопатии, в которой постулируется сохранение эффекта вещества, разбавленного до концентрации «один атом во Вселенной».
«Вода России» — Химический состав воды
Хими́ческий соста́в воды́ – совокупность
находящихся в воде веществ в различных химических
и физических состояниях.
Общеизвестна химическая формула воды – Н2О.
Однако до конца XVIII в. считалось, что вода является неделимым веществом. В 1781
г. английский ученый Генри Кавендиш доказал, что вода состоит из двух элементов, которые
позже французский учёный Антуан Лавуазье назвал кислородом и водородом. Дальнейшие
исследования показали, что вещество «вода» обладает уникальной структурой и не менее
уникальными свойствами. Во-первых, она состоит из соединения двух газов, причем никакие
другие газы, смешиваясь между собой, не образуют жидкость. Во-вторых, вода имеет максимальную
плотность при 4°С, благодаря чему лёд плавает на её поверхности и предохраняет её от полного
замерзания. В-третьих, вода меняет удельную теплоёмкость в интервале от
В-третьих, вода меняет удельную теплоёмкость в интервале от
точки плавления (0°С) до точки кипения (100°С). Наименьшая удельная теплоёмкость приходится
на интервал в 30–40°С. Последнее обстоятельство во многом определило пути эволюции:
этот интервал – температура тела теплокровных животных.
Большинство
необычных свойств воды определяется строением её молекулы, физической природой составляющих
её атомов и компоновкой самих молекул. Молекула воды напоминает равнобедренный треугольник,
в основании которого расположены ядра атома водорода, а в вершине – ядро атома кислорода.
Поэтому молекула воды характеризуется значительной полярностью: отрицательный и положительный
заряды в ней разнесены. В результате молекулы воды способны ассоциировать, то есть
В результате молекулы воды способны ассоциировать, то есть
образовывать группировки, называемыми кластерами.
Атомы
водорода и кислорода имеют несколько природных изотопов. Например, у водорода их три:
обычный водород (протий), тяжёлый водород (дейтерий) и сверхтяжёлый радиоактивный
водород (тритий).
В природе наиболее распространена
вода, состоящая из обычных изотопов кислорода и водорода (99,73%). Тяжёлая вода (оксид
дейтерия) внешне выглядит, как обычная. Тяжёлая вода используется в ядерных реакторах
для торможения нейтронов. Сверхтяжёлую воду применяют в термоядерных
реакциях.
Из химических свойств
воды следует отметить одно из самых важных – способность растворять твёрдые вещества
и вымывать их, поэтому в водных
объектах, поверхностных и подземных, обнаружены
почти все известные науке химические элементы.
Механизмом растворения многих кристаллических
солей является гидролитическая диссоциация, когда молекула соли распадается на ионы
с положительным и отрицательным зарядом – соответственно на катионы и анионы. Поскольку
вода – диполь, ионы окружают молекулы воды, формируя так называемую гидратную оболочку.
Силы взаимодействия ионов с молекулами воды достаточно велики. Вот почему в состав
многих минералов входит вода.
Процесс, обратный
растворению – осаждение (седиментация), т.е. выпадение веществ из водного раствора.
Благодаря этому процессу образовались месторождения солей хлоридов натрия, калия,
магния и многих других. Возникают трудности в использовании для хозяйственных целей
воды с высоким содержанием растворённых солей. Так, высокое содержание солей магния
и кальция, так называемых солей жёсткости, приводит к образованию накипи, ухудшает
качество питьевой воды и не позволяет использовать такую воду в ряде производств.
В процессе природного круговорота вода, соприкасаясь
со всевозможными веществами, становится раствором различного, зачастую очень сложного
состава. Наименьшая концентрация растворённых веществ (десятки миллиграмм в литре)
отмечается в атмосферных осадках, ледниках
и снежниках,
поскольку при испарении вода теряет бόльшую
часть растворённых в ней веществ. Однако при выпадении в виде дождя
или снега вода поглощает аэрозоли и пыль, которые содержатся в атмосфере. Поэтому
в местах, где сильно загрязнена атмосфера, осадки становятся источниками загрязнения
водных объектов. Количественный показатель
Количественный показатель
содержания растворённых в воде веществ
называется общей минерализацией и выражается величиной мг/л или г/л. Содержание растворённых
веществ в воде морей и океанов выражают также в относительных единицах, как правило,
в промилле (‰), то есть г/кг, и называют солёностью (иногда
– минерализацией). Если в одном литре природной воды содержится до 1 г (1000 мг) растворённых
веществ, её считают пресной, от 1 до 25 г – солоноватой, от 25 до 50 г – солёной (или
морской солёности) и выше 50 г – высокосолёной (или рассолом). Если выделить из океанской
воды все соли, они покрыли бы поверхность земного шара слоем стометровой толщины.
Важнейшее свойство природной воды заключается в том,
что она является «буфером» в отношении кислотности. Свойство буферности кислотности
– это способность воды сохранять более или менее неизменным содержание ионов водорода
(Н+), т.е. сохранять значение рН при попадании в неё определенного количества
кислоты или основания, которые нейтрализуются растворёнными в ней углекислым газом
и гидрокарбонат-ионами. С концентрацией гидрокарбонат-ионов напрямую связана устойчивость
состава природной воды к кислотным дождям.
В водных растворах подавляющее большинство солей существуют в виде ионов.
В природных водах преобладают три аниона (гидрокарбонат HCO3–,
хлорид Cl– и сульфат SO42-) и четыре катиона (кальций
Ca2+, магний Mg2+, натрий Na+ и калий K+)
– их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы,
ионы кальция и магния – горький; гидрокарбонат-ионы безвкусны. Они составляют в пресных
водах свыше 90% всех растворённых веществ. В ряде случаев к главным компонентам можно
отнести также калий, бром, стронций и др.
Под влиянием
климатических и других условий химический состав природных вод изменяется и приобретает
черты, характерные для различных видов природных вод (атмосферные осадки, реки, озёра,
подземные
воды).
Вещества,
содержащиеся в природных и техногенных водах,
можно условно разделить на классы. По составу: органические и
минеральные; по форме нахождения: растворённые и взвешенные; по происхождению: природные
и антропогенные; по действию на живые организмы: токсичные и нетоксичные; по концентрации:
макроэлементы – мезоэлементы – микроэлементы. В воде могут быть растворены газы (кислород,
углекислый газ, азот, сероводород, метан и пр.).
Химический
состав природной воды определяет путь, совершённый водой в процессе своего круговорота
и течения по поверхности Земли. Количество растворённых и взвешенных веществ в воде
Количество растворённых и взвешенных веществ в воде
зависит, во-первых, от состава пород, с которыми она соприкасалась, во-вторых, от
природно-климатических условий бассейна, в третьих, от уровня антропогенной нагрузки
на бассейн водного объекта, в-четвёртых, от населяющих водные объекты живых организмов.
Воды большинства чистых рек принадлежат к гидрокарбонатному
классу, с преобладанием ионов кальция. Реки сульфатного и хлоридного классов сравнительно
малочисленны. Они распространены преимущественно в степной полосе и полупустынях.
Преобладающими катионами природных вод хлоридного класса являются, главным образом,
ионы натрия. Воды хлоридного класса отличаются высокой минерализацией.
Воды хлоридного класса отличаются высокой минерализацией.
В случае, если промышленные и бытовые стоки (очищенные или частично очищенные)
составляют значительную часть стока реки, они заметно влияют на катионно-анионный
состав. Например, вода р. Москвы
от гидрокарбонатно-кальциевого на входе в город
меняет свой состав при выходе из города на воду
с составом катионов: Na→K→Ca→Mg→NH4+ и составом
анионов: HCO→Cl–→SO→NO→PO.
Минерализация и химический состав
воды озёр в отличие от рек меняются в очень широких пределах. Различие в минерализации
Различие в минерализации
отражается и на ионном составе воды озёр. С увеличением минерализации озёрной воды
происходит относительный рост ионов в её составе в такой последовательности: для анионов
HCO→SO→Cl–; для катионов Ca2+→Mg2+→Na+.
Состав морской воды характеризуется большим содержанием
солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций:
HCO3— →SO42-→Cl—
и Ca2+→Mg2+→Na+
или Ca2+→Na+→Mg2+, то для
морских вод, начиная с общей минерализации
1 г/кг, соотношения меняются: Cl–→SO→HCO
и Na+→Mg2+→Ca2+. Концентрации
Концентрации
микроэлементов обычно очень малы,
в сумме они не превышают 0,01% массы всех растворённых солей. Чем более изолировано
море от океана, тем заметнее отличается состав его воды от состава воды в океане.
Первостепенное значение имеют условия водообмена с океаном, соотношение объёма материкового
стока с объёмом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные воды отличаются исключительным разнообразием
химического состава, в том числе и ионного. Ионный состав подземных вод прежде всего
зависит от условий их формирования и залегания.
В
настоящее время состав поверхностных вод в густо населённых районах мира в значительной
мере формируется за счёт различных поверхностных (диффузных) источников загрязнения.
Это сток с сельскохозяйственных и городских территорий, с производственных площадок,
дорог, с осадками, а также при определенных условиях – вторичное загрязнение из донных
отложений. К диффузным источникам добавляются точечные, преимущественно в городах.
Сточные воды, поступающие в черте города, сильно различаются по составу. Для бытовых
стоков основными показателями загрязнения являются биогенные элементы, т. е. вещества,
е. вещества,
способствующие росту микроводорослей, органические вещества, синтетические поверхностно-активные
вещества (СПАВ), бактерии. В последние годы возрастает объём ксенобиотиков в сточных
водах. Это лекарства, средства гигиены, моющие средства. Номенклатура этих «новых»
загрязняющих веществ насчитывает многие тысячи наименований. Влияние на живые организмы
и здоровье людей большинства из них остается неизученным, для таких веществ нормативы
содержания в природной воде заведомо отсутствуют.
Современные
водные объекты по составу содержащихся в них веществ сильно отличаются от их природного
ненарушенного человеком состояния. Это отличие будет нарастать, если не принимать
Это отличие будет нарастать, если не принимать
меры по снижению уровня загрязнений от хозяйственной деятельности.
Н.М. Щеголькова
Ученые выяснили, почему избыток соли опасен для мозга — Российская газета
Богатая солью диета связана с повышенным риском появления цереброваскулярных заболеваний (наиболее опасное из них — инсульт) и слабоумия. А причиной этому является иммунный ответ организма на хлорид натрия, выяснила группа ученых из Корнеллского университета (США), опубликовавшая результаты своей работы в журнале Nature Neuroscience.
— Полученные данные ярко демонстрируют то, какую важную роль кишечник играет в работе мозга. Нам удалось найти очередной пример того, как пища влияет на наше поведение и здоровье, и показать, как неправильные пищевые привычки негативно влияют на микрососуды мозга и способствуют развитию слабоумия, — подчеркнул ведущий автор исследования Джузеппе Фарако.
О вреде чрезмерного потребления соли известно давно. Оно, в частности, является причиной гипертонии и сердечно-сосудистых заболеваний. Сильнее других от этого воздействия страдают сосуды мозга, что связано с дефицитом оксида азота (NO). Однако связь между избытком соли и дефицитом NO до сих пор не была выявлена.
Чтобы разобраться в этом вопросе, ученые поставили эксперимент на мышах, которых посадили на диету, в ходе которой уровень потребления соли у животных был в 8-16 раз выше нормы. После этого с помощью МРТ был исследован кровоток в мозге мышей, который, как выяснилось, снизился как в коре (на 28 процентов), так и в гиппокампе (на четверть).
Затем настала очередь когнитивных тестов. Животных проверяли на то, как они могут распознавать и обследовать объекты, и результаты тоже ухудшились. При этом возвращение к нормальной диете приводило к тому, что мозг животных снова начинал работать как обычно. Примерно такой же эффект наблюдался и в экспериментах на пространственное ориентирование, когда мышам надо было найти выход из лабиринта.
Причину этих побочных эффектов стали искать в кишечнике. Оказалось, что избыток соли приводит к резкому росту так называемых Т-хелперов (Th27) — это T-лимфоциты, главной функцией которых является усиление адаптивного иммунного ответа. Th27 в свою очередь продуцируют интерлейкины, небольшие информационные молекулы, появление которых и приводит к подавлению выработки оксида азота, необходимого сосудам мозга.
Качество воды и неравенство
Март 2020 г.
Автор: Филип Дэвис, профессор, специалист по технологии очистки воды, Инженерный факультет Университета Бирмингема, Соединенное Королевство
В настоящее время около полумиллиарда людей страдают от острой нехватки воды на протяжении всего года, а от 1,8 до 2,9 млрд человек страдают от этой проблемы несколько месяцев в году. К 2025 году половина населения мира будет жить в районах, где ощущается дефицит воды.
К 2025 году половина населения мира будет жить в районах, где ощущается дефицит воды. (Фото: Max2611 / iStock / Getty Images Plus)
(Фото: Max2611 / iStock / Getty Images Plus)
В плане качества воды водные ресурсы распределены в мире не лучшим образом. Основная часть воды (97,5 процента) – это океан, и эта вода слишком соленая, чтобы ее можно было пить. Речная и озерная вода приемлемого качества составляет менее половины процента мировых запасов воды. Между этими двумя крайностями существуют другие источники воды, например, грунтовые воды, которые во многих местах являются слишком солеными и для потребления их необходимо очищать, и промышленные сточные воды, которые могут содержать самые разные естественные и антропогенные загрязняющие вещества.
Наиболее уязвимы от проблемы нехватки воды те районы, где потребности в питьевой воде и воде для орошения превышают объем запасов воды, пополняемых за счет осадков. К таким районам относятся пустынные зоны (расположенные в широтах от 15 до 45 градусов), особенно в Северном полушарии. Страны этих регионов обладают неодинаковыми возможностями для строительства объектов инфраструктуры, таких как плотины, трубопроводы для подачи воды или опреснительные установки.
Поскольку гораздо больше воды требуется для сельскохозяйственной деятельности, чем для прямого потребления, важным фактором являются также экономические возможности для импорта продовольствия. В настоящее время такие страны, как Кувейт и Катар, которые не имеют практически никаких возобновляемых естественных источников пресной воды, решают эту проблему опресняя морскую воду и импортируя продовольственные товары. В то же время, такие страны со слабой экономикой и сложной политической ситуацией, как Сомали и Йемен, страдают от катастрофической нехватки воды. Если говорить о прогнозах, проблемными зонами, где возможно ухудшение ситуации в связи с нехваткой воды, являются Египет, Пакистан, Индия, а также северные и северо-западные регионы Китая.
Опреснение морской воды является перспективным способом увеличить объем водоснабжения значительного процента населения районов, страдающих от нехватки воды. Благодаря инновационным технологиям возможности опреснительных установок существенно расширены, а потребление электроэнергии опреснительными установками сократилось почти наполовину за последние 20 лет, благодаря чему они стали гораздо менее дорогостоящими. (Фото: PhotoStock-Israel / Alamy Stock Photo)
(Фото: PhotoStock-Israel / Alamy Stock Photo)
Прибрежные опреснительные установки
Цивилизация зарождалась и развивалась в прибрежных зонах. Это значит, что опреснение морской воды является перспективным способом увеличить объем водоснабжения значительного процента населения районов, страдающих от нехватки воды. Однако строительство опреснительных сооружений требует значительных затрат, и до недавних пор они потребляли в три раза больше электроэнергии, чем традиционные методы очистки воды. Это значит, что на практике в наибольшем объеме опресненную морскую воду потребляют богатые, располагающие значительными запасами ископаемого топлива страны Персидского залива.
Эти опреснительные установки удаляют соль из морской воды с использованием метода, который называется обратным осмосом, когда вода под давлением прогоняется через полупроницаемую мембрану, которая пропускает молекулы и ионы воды, но задерживает более крупные молекулы соли. Благодаря инновационным технологиям качество таких мембран постоянно повышается, что увеличивает объем очищенной воды на выходе. В результате пропускная способность опреснительных установок увеличилась в разы, и некоторые из них выдают почти 1 миллион кубических метров пресной воды в день.
В результате пропускная способность опреснительных установок увеличилась в разы, и некоторые из них выдают почти 1 миллион кубических метров пресной воды в день.
Благодаря совершенствованию этих и других технологий, используемых для опреснения воды, за последние годы потребление электроэнергии опреснительными установками сократилось почти наполовину за последние 20 лет, благодаря чему они стали гораздо менее дорогостоящими. До некоторых пор эта тенденция будет продолжаться, но есть определенный нижний предел – в лучшем случае энергопотребление можно сократить максимум в два раза по сравнению с тем, что потребляется сейчас.
Что делать населению удаленных от моря районов?
Довольно много людей живут в районах, удаленных от моря, в том числе в Китае, Индии и Соединенных Штатах, и подача опресненной воды на большие расстояния может быть экономически нецелесообразным или слишком дорогостоящим способом водоснабжения этих районов. Жителям многих из этих районов приходится использовать грунтовые воды низкого качества.
Я особенно ясно осознал эту проблему, проводя исследования на северо-западе Индии. По данным Продовольственной и сельскохозяйственной организации ООН, 64 процента сельскохозяйственного производства зависит от грунтовых вод. Согласно результатам гидрогеологических исследований, около половины территории Индии расположена выше водоносных горизонтов, где вода содержит слишком много соли и не соответствует стандартам питьевой воды.
Тем не менее в большинстве мест эта вода является гораздо менее соленой, чем морская, поэтому теоретически для ее опреснения может потребоваться меньше энергии. Это открывает возможности для инновационных решений, которые могут снизить затраты на опреснение и сделать воду более доступной для малоимущих групп населения.
Наша технология
В Университете Бирмингема мы разработали технологию, которая предназначена в основном для очистки грунтовых вод. В процессе обработки грунтовых вод самое трудное – это удаление остаточного рассола. Наша технология «повышенной рекуперации» обеспечивает превращение максимального объема грунтовой воды в пресную воду, и при этом остается минимум остаточного рассола. Это довольно трудно обеспечить, поскольку для увеличения объема очищенной воды требуется больше энергии.
Это довольно трудно обеспечить, поскольку для увеличения объема очищенной воды требуется больше энергии.
Мы начали с того, что взяли за основу объем потребления энергии существующими установками обратного осмоса и спроектировали систему, цель которой – обеспечить экономию электроэнергии. Мы разработали технологию опреснения, которая может работать в автономном режиме, причем энергия вырабатывается из возобновляемых источников.
Энергетический баланс систем обратного осмоса (ОО) определяется законами термодинамики: по мере повышения давления подачи воды уменьшается ее объем (при определенной стандартной температуре). Самая важная часть этого уравнения – это энергия, используемая для поддержания соленой воды под давлением. Эта энергия должна генерироваться насосом высокого давления, который является наиболее энергоемким компонентом опреснительной системы. В нашей системе достаточно использовать давление, которое немного выше того, что определяется законами термодинамики, в то время как в обычных системах давление в несколько раз выше.
В плане качества водные ресурсы распределены в мире не лучшим образом. Основная часть воды (97,5 процента) – это океан, и эта вода слишком соленая, чтобы ее можно было пить. Речная и озерная вода приемлемого качества составляет менее половины процента мировых запасов воды. (Фото: Tom Hanley / Alamy Stock Photo)
С самого начала мы поставили перед собой задачу – разработать такую систему, которую можно было бы построить полностью из уже имеющихся компонентов. Мы решили использовать «герметичный контур», конструкцию, при которой происходит рециркуляция соленого концентрата, обеспечивающая поддержание минимального давления. Очень важно, что в нашей системе клапаны расположены в таком порядке, который не позволяет рециркулируемому концентрату смешиваться с поступающей в контур водой, что снизило бы эффективность и повысило энергопотребление.
Этот новый порядок расположения клапанов также позволил нам вместо двух отдельных операций – промывки резервуара и его наполнения – использовать одну операцию «промывки-наполнения», когда система промывается под сильным напором и осадки смываются с мембраны. Такое объединение двух стадий в одну также сводит к минимуму время простоя и увеличивает пропускную способность системы.
Такое объединение двух стадий в одну также сводит к минимуму время простоя и увеличивает пропускную способность системы.
Мы назвали эту систему «ОО с герметичным контуром», чтобы ее можно было отличить от систем обратного осмоса, которые использовались до сих пор. По сравнению с традиционными системами наш метод способен обеспечить экономию электроэнергии в размере от 33 до 66 процентов при коэффициенте водоотдачи в 80 процентов.
Однако преимущества нашей системы обратного осмоса с герметичным контуром на этом не заканчиваются. Это конструкторское решение открывает возможности для использования низконапорных мембран, способных работать под менее высоким давлением подаваемой воды. Мы рассчитываем на то, что такие мембраны будут служить дольше, что снизит затраты на материально-техническое обслуживание. Функция промывки также означает, что система является самоочищающейся, а это значит, что ее работой можно управлять удаленно и для этого не требуются технические специалисты.
Для чего нужен патент?
Мы изготовили нашу систему из готовых стандартных компонентов. Вместе с тем мы готовы рассматривать любые варианты коммерциализации, в том числе социальное предприятие, и решили запатентовать наше изобретение, чтобы не стеснять себя в выборе. Мы стараемся обеспечить охрану нашей технологии на многих рынках в рамках Договора о патентной кооперации (PCT).
Система прямого осмоса с герметичным контуром, разработанная учеными Бирмингемского университета в Великобритании, может использоваться в автономном режиме, а энергия вырабатывается из возобновляемых источников. Это идеальная система для использования в экономически малообеспеченных районах. (Фото: ABHISHEK KUMAR SAH / iStock /Getty Images Plus)
Мы реализуем один из наших проектов в долине р. Иордан, довольно удачном месте для испытания нашей технологии. Долина р. Иордан – гидрологический тупик, поэтому неудивительно, что там скапливается соль, и бассейн этой реки является довольно проблематичной зоной в плане использования водных ресурсов в сельском хозяйстве.
Истощение запасов грунтовых вод в этих районах является общей проблемой для стран региона. Международные соглашения ограничивают доступ палестинцев, живущих на Западном берегу, к грунтовым водам, а бесхозяйственность привела к чрезмерной откачке воды, в результате чего рекордно высокие показатели минерализации воды заставляют менять систему земледелия. Товарные культуры, не переносящие высокое содержание соли в воде, сменяются финиковыми пальмами сорта «меджул», потребляющими большое количество воды, из-за чего запасы грунтовых вод могут иссякнуть уже в ближайшие пять лет.
Этот проект является продолжением работы, начатой вместо со студентами израильского Института Арава, которые помогли разработать прототип технологии. Сейчас мы возвращаемся в этот регион, чтобы установить и протестировать увеличенный вариант нашей системы. В настоящее время наши партнеры в Рамалла приобретают необходимые комплектующие, и в этом году должно начаться строительство.
Соль притягивает воду: разбираемся с мифами о задержке жидкости в организме — Красота
не бойтесь задержки жидкости — лишняя вода легко выводится из организма
Фото: unsplash.com
«Нет, я не буду есть это на ночь, а то утром встану с опухшим лицом!» — сколько раз вы слышали такие слова от подруг или сами ограничивали себя в количестве съеденного сыра и других соленых продуктов. Чтобы вы перестали нервничать и клеить на лицо патчи, чуть открыв глаза утром, WomanHit.ru объяснил несколько мифов и дал полезные советы по борьбе с отеками:
Много соли есть нельзя
Ни одно медицинское исследование не оспорит тот факт, что натрий притягивает воду — потребление большого количества соли действительно обернется немедленными отеками. Однако здоровый организм спустя время выведет лишнюю воду в результате потребления большего количества жидкости и физической активности. Диетологи советуют потреблять в день не больше 2300 мг соли, тогда как, например, среднестатистический американец потребляет 3400 мг в день. Большинство соли вы потребляете из готовых продуктов — сыры, колбасы, хлеб, смеси специй, соусы, готовые блюда. В натуральных продуктах — орехи, фрукты, овощи и прочее — содержание натрия почти на нуле, а некоторые из них даже снижают уровень соли — бананы, авокадо и зелень. Ешьте их, чтобы ускорить выведение воды из организма после съеденной пачки чипсов вприкуску с сыром.
Снизьте потребление углеводов
Углеводы также заставляют организм запасать дополнительную воду. Когда мы потребляем богатую углеводами пищу, накопленная энергия сохраняется в виде молекул гликогена. Каждый грамм гликогена поставляется с 3 г прикрепленной к ней молекул воды. Сокращение количества углеводов в рационе — быстрый способ израсходовать запасы гликогена, а значит уменьшить объем накопленной жидкости. По данным зарубежного Institute of Medicine’s Food and Nutrition Board, взрослым людям необходимо по меньшей мере 130 г углеводов для ежедневного функционирования, но, в среднем, они потребляют в разы больше. Замена некоторых ежедневных источников углеводов продуктами с высоким содержанием белка, такими как постное мясо, яйца и соевые продукты, поможет «подсушить» тело.
Усиленные тренировки делают вас полнее
Вы наверняка замечали, как после выполнения физических упражнений ваши мышцы наливаются кровью и опухают. Позже они «сдуваются» обратно, а места микроразрывов зарастают белковыми соединениями и формируют новые ткани. Однако у некоторых процесс восстановления между тренировками проходит не так просто: к поврежденным мышцам усиливается приток лимфы, за счет чего увеличиваются объемы вашего тела. Если вы тренировали пресс или ягодицы, такой эффект может вызвать у вас серьезное беспокойство. Однако мы советуем не переживать — делайте растяжку, принимайте теплые ванные и пейте больше воды, тогда отек спадет через 2—3 дня.
Витаминные добавки
Витамин B−6 и оксид магния доказали эффективность в борьбе с отеками. Эти добавки ускоряют работу почек, что способствует быстрому выведению жидкости через мочевую систему. Исследования показывают, что эти две добавки облегчают предменструальные симптомы, включая задержку жидкости в области живота. Они также могут уменьшить вздутие живота, отек в ногах и болезненность молочных желез. Прежде чем начать прием, проконсультируйтесь с доктором и сдайте анализы по его назначению.
соль | Химия, история, возникновение, производство и факты
Соль (NaCl) , хлорид натрия , минеральное вещество, имеющее большое значение для здоровья человека и животных, а также для промышленности. Минеральную форму галита или каменной соли иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
соль
Кристалл соли увеличен.
Геологическая служба США
Узнайте о влиянии соли на здоровье человека
Узнайте о соли, в том числе о ее влиянии на здоровье.
Contunico © ZDF Enterprises GmbH, Майнц Посмотреть все видео к этой статье
Свойства поваренной соли показаны в таблице. Соль необходима для здоровья как людей, так и животных. Поваренная соль, повсеместно используемая в качестве приправы, мелкозернистая и очень чистая. Чтобы гарантировать, что это гигроскопичное (т. Е. Притягивающее воду) вещество останется сыпучим при контакте с атмосферой, добавляются небольшие количества алюмосиликата натрия, трикальцийфосфата или силиката магния.Йодированная соль, то есть соль, в которую были добавлены небольшие количества йодида калия, широко используется в регионах, где йод отсутствует в рационе, и этот дефицит может вызвать отек щитовидной железы, обычно называемый зобом. Животноводству также нужна соль; он часто выпускается в виде сплошных блоков.
В мясоперерабатывающей, колбасной, рыбной и пищевой промышленности соль используется в качестве консерванта или приправы, либо и того, и другого. Он используется для обработки и консервирования шкур, а также в качестве рассола для охлаждения.
В химической промышленности соль требуется при производстве бикарбоната натрия (пищевой соды), гидроксида натрия (каустической соды), соляной кислоты, хлора и многих других химикатов. Соль также используется в производстве мыла, глазури и фарфоровой эмали и входит в металлургические процессы в качестве флюса (вещества, способствующего плавлению металлов).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
При нанесении на снег или лед соль снижает температуру плавления смеси.Таким образом, большие количества используются в северном климате, чтобы помочь очистить проезжие части от скопившегося снега и льда. Соль используется в оборудовании для умягчения воды, которое удаляет из воды соединения кальция и магния.
История использования
В некоторых частях Западного полушария и в Индии использование соли было введено европейцами, но в некоторых частях Центральной Африки она по-прежнему остается роскошью, доступной только богатым. Там, где люди питаются в основном молоком и сырым или жареным мясом (чтобы не терялись его природные соли), добавки хлорида натрия не нужны; кочевники со своими отарами овец или стадами крупного рогатого скота, например, никогда не едят соль с пищей.С другой стороны, люди, которые живут в основном на злаковых, овощных или отварных мясных диетах, нуждаются в добавках соли.
Привычное употребление соли тесно связано с переходом от кочевой жизни к земледелию, этапом цивилизации, оказавшим глубокое влияние на ритуалы и культы почти всех древних народов. Богам поклонялись как дарителям добрых плодов земли, и соль обычно включалась в жертвоприношения, полностью или частично состоящие из зерновых элементов.Такие подношения были распространены среди греков и римлян, а также среди ряда семитских народов.
Заветы обычно заключались во время жертвенной трапезы, в которой соль была обязательным элементом. Консервирующие свойства соли сделали ее особенно подходящим символом прочного компакта, скрепившим ее обязательством верности. Таким образом, слово , соль приобрело коннотации высокого уважения и почета в древних и современных языках. Примеры включают арабское признание: «Между нами соль», еврейское выражение «съесть соль дворца» и современную персидскую фразу namak arām , «неверно соли» (т.е., нелояльные или неблагодарные). В английском языке термин «соль земли» описывает человека, которого очень уважают.
Соль вносит большой вклад в наши знания о древних торговых путях. Одна из старейших дорог Италии — Соляная дорога (Via Salaria), по которой римская соль из Остии доставлялась в другие части Италии. Геродот рассказывает о караванном пути, объединившем соляные оазисы Ливийской пустыни. Древняя торговля между Эгейским и Черноморским побережьями юга России в значительной степени зависела от соляных ванн (прудов для испарения морской воды для получения соли) в устье Днепра и от соленой рыбы, привозимой из этого района.
Соляные лепешки использовались в качестве денег в Эфиопии, других странах Африки и Тибете. В римской армии офицерам и солдатам разрешалось употреблять соль; в имперские времена этот salarium (от которого происходит английское слово salary ) был преобразован в денежное довольствие на соль.
Китай, США, Индия, Германия, Канада и Австралия являются крупнейшими производителями соли в мире в начале 21 века.
Франк Осборн Вуд
Соль аммония — обзор
Определение азота
Соли аммония, нитратные соли, а также неорганический и органический азот можно определить кислотно-основным титрованием.Каждый из них включает преобразование пробы в титруемый аммиак.
Солями аммония легче всего работать. В прямой методике раствор аммониевой соли обрабатывают раствором NaOH, а аммиак перегоняют в раствор стандартной HCl. Типичный дистилляционный аппарат для перегонки и сбора NH 3 показан на рис. 8-9. Оставшуюся кислоту титруют стандартным NaOH (метиловый красный или метиловый оранжевый).
Рис. 8-9.Аппарат для перегонки аммиака.
Nh5 ++ OH− → Nh4 (г) + h3ONh4 (г) + HCl → Nh5Cl
Непрямая процедура требует кипячения соли аммония (кроме карбоната или бикарбоната) со стандартным раствором NaOH. Впоследствии аммиак перестает выделяться, а оставшийся NaOH титруют стандартной HCl (метиловый красный или метиловый оранжевый).
Нитратные соли восстанавливаются до аммиака Al, Zn и сплавом Деварда (50Cu, 45Al, 5Zn) в сильнощелочном растворе.
3NO3− + 8Al + 5OH− + 2h3O → 8AlO2_ + 3Nh3
Аммиак, полученный в реакции, перегоняется в кислоту, как описано ранее.С помощью этой процедуры также можно определить соли нитритов.
Определение азота в неорганических и органических пробах методом Кьельдаля широко применяется в промышленных, клинических и исследовательских лабораториях. Типичный анализ — это азот в крови и других биологических веществах, в зерновых и удобрениях. В этом методе азот в образце превращается в аммиак путем разложения кипящей концентрированной серной кислотой.
Органический N → h3SO4 — катализатор окисленияNh5HSO4
Затем кислоту осторожно нейтрализуют сильным щелочным раствором и аммиак перегоняют, как и раньше.Процесс пищеварения идет очень медленно, и для его ускорения были предложены различные модификации. Часто добавляют сульфат калия, повышающий температуру кипения. Могут использоваться катализаторы, такие как Hg, HgO, CuSO 4 , Se или смеси Se-FeSO 4 . Азот в белках, аминах и амидах обычно не требует специальных катализаторов. Однако нитро-, азо-, гидразо- и цианосоединения обычно требуют модификации методики.
Полезной модификацией процедуры перегонки является перегонка аммиака в почти насыщенный раствор борной кислоты, а не в HCl.
Nh4 + h4BO3 → Nh5 ++ h3BO3−
Образующийся H 2 BO 3 — титруется стандартным HCl обратно до H 3 BO 3 . В стехиометрической точке титрования раствор будет содержать H 3 BO 3 и NH 4 Cl. Поэтому необходим индикатор, меняющий цвет в диапазоне pH 5–6. Бромкрезоловый зеленый или смешанный индикатор бромкрезоловый зеленый – метиловый красный являются удовлетворительными индикаторами. Главное преимущество в том, что требуется только один стандартный раствор (HCl).Точная концентрация раствора борной кислоты не требуется, однако необходимо холостое титрование индикатора.
Соль: близко и личное
Фото: Clipart.com
Назначение
Рассматривать соль под разным увеличением, чтобы учащиеся могли начать понимать, что материалы могут состоять из частей, которые слишком малы, чтобы их можно было увидеть без увеличения.Сделать подробные наблюдения.
Контекст
В этом возрасте у учащихся должно быть много возможностей наблюдать и описывать различные объекты, уделяя особое внимание физическим свойствам объекта, а также тому, из чего он сделан.
Сейчас для учащихся важно продвигать такие исследования дальше, наблюдая за объектами / веществами с увеличением и записывая подробные наблюдения. С помощью луп ученики должны исследовать вещества, состоящие из больших скоплений частиц, чтобы обнаруживать неожиданные детали в меньших масштабах.( Benchmarks for Science Literacy , p. 76.) Это открытие подготавливает их к пониманию того, что вся материя состоит из атомов, крошечных движущихся частей, слишком маленьких, чтобы их можно было увидеть.
На этом уроке студенты будут предсказывать, наблюдать и объяснять детали соли, когда они рассматривают ее под разными увеличениями. Они будут наблюдать соль невооруженным глазом, а затем под ручным объективом, микроскопом и электронным микроскопом (электронное изображение через Интернет). Для завершения этого урока важно, чтобы учащиеся имели предыдущий опыт работы с ручными линзами и микроскопами.
Такое подробное наблюдение дает студентам возможность вести письменные записи своих открытий и анализировать собранные данные. В процессе записи и обсуждения наблюдений учащиеся должны будут делать прогнозы и отмечать различия.
Подробнее
Мотивация
Насыпьте немного соли на ладонь и обойдите комнату, позволяя учащимся увидеть ее, не говоря ни слова. Для этого можно использовать поваренную, морскую или кошерную соль.Однако вы можете использовать морскую соль или кошерную соль, поскольку кристаллы в этой форме немного больше.
После того, как все ученики увидят вещество, задайте следующие вопросы:
- Как вы думаете, что это за вещество в моей руке?
- Эта соль выглядит иначе, чем соль, используемая в вашем доме? Если да, то как?
Объясните студентам, что соль можно обрабатывать естественным путем, например, морскую соль, или ее можно обрабатывать на заводе, куда по разным причинам добавляются химические вещества.Продолжить опрос:
- Где найти соль? Как это используется? (Большинство студентов скажут о еде или приготовлении пищи, но предложат им другое применение, например, на скользких дорогах, в океане / море, при приготовлении мяса.)
- Как бы вы описали соль? (Ответы должны включать форму, цвет, запах и т. Д.)
- Кто из вас когда-либо смотрел на соль через ручную линзу или под микроскопом?
Затем попросите студентов подумать о том, как кристаллы соли могут выглядеть при увеличении.Предложите им подумать о форме и текстуре. Затем объясните студентам, что они будут смотреть на соль под разным увеличением и записывать свои наблюдения.
Разработка
В этом упражнении учащиеся исследуют соль под последовательным увеличением. Студенты будут записывать свои наблюдения в студенческий лист Science NetLinks, Salt: Up Close and Personal.
Есть много способов структурировать это задание в зависимости от потребностей ваших учеников, размера класса и доступного оборудования.Следующая модель предназначена для небольших групп и центров, через которые студенты могут перемещаться. Центры могут быть созданы следующим образом:
- Центр 1: Невооруженный глаз — чайная ложка соли на листе черной плотной бумаги.
- Центр 2: Ручная линза — чайная ложка соли на листе черной плотной бумаги и ручная линза.
- Центр 3: Микроскоп — меньшее количество соли, микроскоп, предметное стекло и покровное стекло.
- Центр 4: Электронный микроскоп — студенты посетят веб-сайт Science Learning Network и увидят изображение кошерной соли.
Информация об электронном микроскопе:
Если вы хотите лучше понять, как работает электронный микроскоп, в Science Learning Network есть раздел, посвященный тому, как работает SEM. Разница между обычным микроскопом (световым) и сканирующим электронным микроскопом заключается в том, что световой микроскоп использует световые волны для увеличения изображения, а электронный микроскоп использует электроны.Электронный микроскоп показывает изображения в черно-белом режиме, но может достигать большего увеличения и показывать больше деталей, чем световой микроскоп.
Задание:
Раздайте и просмотрите лист ученика: «Соль: близко и лично». Скажите студентам, что они будут смотреть на соль с использованием различного оборудования и разного увеличения, а затем запишут свои выводы. Предложите студентам сделать подробные наблюдения, описания и рисунки на этом листе. Например, они должны использовать геометрические формы при проведении и записи наблюдений; я.е., они должны описывать соль в форме ромба, квадрата и т. д., а не просто говорить «это точки».
Сообщите учащимся, что они обсудят свои наблюдения с классом. Также поощряйте их мыслить независимо и не использовать работы других студентов.
Перед тем, как начать упражнение, попросите учащихся сделать предположения о том, как будет выглядеть соль при увеличении, и запишите свои предположения в соответствующей области в листе для учащихся. Опять же, они должны быть как можно более подробными и описательными.Затем попросите учеников высказать свои наблюдения и заполнить ученический лист.
Когда все студенты закончат наблюдения, задайте следующие вопросы:
- Почему для вас было важно сделать прогноз? (Например, чтобы я мог записывать свои мысли и быть более уверенным в том, как они меняются с течением времени.)
- Как ваши прогнозы соотносятся с тем, что вы на самом деле наблюдали в отношении структуры соли? (например, соль действительно выглядела как маленькие квадратики / кристаллы.Соль была скорее прозрачной, чем белой.)
- Как кристаллы соли были одинаковыми под увеличительным стеклом и электронным микроскопом? Чем они отличались? (Ответы студентов должны быть сосредоточены на деталях формы и структуры.)
Оценка
Обсуждение продолжается, но основное внимание уделяется ведению документации. Студенты должны понять, как запись наблюдений упростила сравнение и анализ физических деталей соли.
- Какое самое интересное различие было замечено при каждом увеличении?
- Как технический паспорт помог вам в этой деятельности? (Ответы могут быть разными.)
- Были ли какие-либо другие элементы, которые мы могли бы добавить в таблицу данных, чтобы упростить или сделать запись наблюдений более полной? (Ответы могут быть разными.)
По окончании обсуждения соберите листы для учащихся и оцените их должным образом. Студенты должны описать соль в письменной и рисованной форме, используя как можно больше деталей.Должны быть заметные различия между их описаниями при последовательных увеличениях, а также письменные сравнения для каждого увеличения.
Расширения
Студенты могут исследовать больше изображений из Science Learning Network. Этот веб-сайт позволяет ученикам смотреть на туалетную бумагу, царапать и нюхать бумагу под электронным микроскопом. Предложите учащимся сравнить, как бумага выглядит под увеличительным стеклом или как она выглядит в обычном виде. Студенты могут нарисовать или объяснить разницу между ними.
Студенты могут ознакомиться с книгой Вики Кобб « Грязь и грязь, как вы никогда не видели» . Они могли написать краткое описание того, что нового или удивительного в частицах грязи, сажи и других предметах, состоящих из частей.
Отправьте нам отзыв об этом уроке>
Хлоридная соль Земли — и Марса тоже?
апрель 2004
Пока марсоход НАСА Opportunity исследует Красную планету и передает ценные данные обратно на Землю, ученые сообщают захватывающую новость о том, что Марс когда-то был гораздо более теплой и влажной планетой, чем сегодня.И хотя поиск доказательств существования жизни на Красной планете продолжается, убедительные доказательства присутствия воды и были найдены. На фотографиях с Марса, таких как приведенная ниже, показаны отложения, которые очень похожи на отложения, образовавшиеся на Земле в присутствии воды. И химические исследования выявили соли, содержащие хлор, которые, вероятно, образовались из древней испаряющейся соленой марсианской воды.
Соляные истории
Фотография с Марса: Ученые считают, что это осадочная порода
, образовавшаяся в воде, когда Марс был более влажной планетой.
Соли, образующиеся в результате медленного испарения морской воды в течение длительных периодов времени, обычны на Земле.
Одним из примеров является хлорид натрия — минерал галит, NaCl, также известный как обычная поваренная соль. Еще одна природная соль, содержащаяся в галите, — это хлорид калия — KCl, также известный как минерал сильвит.
Калий-химический символ K?
Вы можете задаться вопросом, почему калий обозначается «K» в сокращенном химическом обозначении.«К» означает калий, слово, производное от «щелочь» или арабского «аль-кали», что означает «пепел солянки». Исторически карбонат калия (K2CO3), называемый поташом, важным удобрением для растений, получали путем перемешивания золы, оставшейся после пожара, в горшке с водой (горшок с водой + зола = поташ), а затем испарением воды.
Неудивительно, что те же химические элементы, что и на Земле, присутствуют и на Марсе, потому что ученые считают, что все планеты Солнечной системы «родились» из одного и того же исходного вещества.Но мы можем задаться вопросом, чем хлоридный минерал, образованный на Марсе, может отличаться от минерала, образовавшегося на Земле. Наука — это нескончаемая охота за ответами на вопросы, которые постоянно возникают по мере сбора новой информации.
Элементы: Земля перерабатывает их
Мы знаем, что калий и хлор — два из многих химических элементов, переносимых с континентов Земли в моря как силы природы.
изнашивать камни.Калий и хлор — два химических элемента, содержащихся в минералах, составляющих горные породы. Природные воды медленно растворяют эти и другие элементы из минералов и переносят их под действием силы тяжести в океаны. Земные процессы можно рассматривать как крупномасштабные природные проекты по переработке отходов: минералы в горных породах континента расщепляются ветром, водой и живыми организмами на более простые компоненты, а затем снова превращаются в новые минералы, такие как те, что обнаруживаются в соляных отложениях.
Соль для жизни
Здесь, на Земле, минерал сильвин — полезный источник калия.Многие живые организмы зависят от калия для своего существования, потому что калий имеет решающее значение для функционирования живых клеток —
микроскопические строительные блоки жизни. Человеческие существа, например, состоят из клеток кожи, мышечных клеток, костных клеток, клеток крови и клеток различных органов. Для правильного функционирования клетки должны принимать и выделять постоянный поток химикатов — например, питательные вещества должны поступать в клетки, а продукты жизнедеятельности должны выделяться.Калий играет важную роль в регулировании этого «химического движения» внутрь и из живых клеток.
KCl — это лекарство, отпускаемое по рецепту, когда он используется для повышения уровня калия в крови у людей с дефицитом этого элемента. Он также может использоваться в качестве заменителя соли хлорида натрия людьми, которым не следует принимать хлорид натрия по медицинским показаниям. Вкус KCl похож на NaCl, но немного горьковатый.(Известно, что геологи отличают сильвит от галита с помощью этого «вкусового теста».) Человеческая кровь и вода океана содержат одинаковые концентрации или уровни солей, поэтому неудивительно, что, когда существует медицинская потребность в калии , эта потребность удовлетворяется натуральным продуктом морей.
KCl: пример ионного связывания
Химическая связь — это процесс, который связывает элементы вместе с образованием соединений.KCl является примером ионной связи.
Ниже представлена простая диаграмма атомов калия и хлора. Показано, что электроны расположены кольцами вокруг центрального ядра. Электроны заполняют эти кольца или оболочки, как их известно, в определенном порядке. Для многих элементов наиболее стабильным является состояние, в котором восемь электронов находятся на внешней электронной оболочке. Обратите внимание, что калий имеет один электрон во внешней оболочке, а хлор — семь. Когда два атома находятся в контакте, калий легко передает свой внешний электрон хлору, который легко принимает его, в результате чего оба атома достигают состояния восьми крайних электронов.При таком переносе электрона образуется ионная связь в KCl.
Атомный номер 19 Атомный номер 17
(19 электронов) (17 электронов)
Фото NASA Opportunity
Последующие мероприятия:
- Чем природные процессы на Марсе, такие как выветривание горных пород, могут отличаться от земных? Какого рода информация необходима для оценки различий? Например, как гравитация на Марсе сравнивается с гравитацией на Земле?
- Нарисуйте точную диаграмму, чтобы показать, как происходит ионная связь в NaCl.Используйте Периодическую таблицу, чтобы получить атомный номер Na и Cl. Атомный номер скажет вам, сколько электронов нужно нарисовать для каждого элемента.
- Почему Марс называют Красной планетой?
Проверить:
Интернет-сайт Mars для детей:
http://marsprogram.jpl.nasa.gov/funzone_flash.html
Все о космическом телескопе Хаббл:
http: // sm3a.gsfc.nasa.gov/classrm.html
Чтобы просмотреть список предыдущих функций «Хлорсодержащее соединение месяца», щелкните
здесь.
под микроскопом: морская соль против поваренной соли | Управление науки и общества
На фотографиях 1 и 2 показана морская соль, а на фотографии 3 — поваренная соль.
Хотя вкус их может отличаться от вкуса взыскательного шеф-повара, и их кристаллы могут выглядеть иначе под микроскопом, поваренная и морская соль по сути являются просто хлоридом натрия.Хотя морская соль действительно содержит некоторые другие минералы, такие как хлорид кальция или сульфат калия, она по-прежнему состоит на 90% или более из хлорида натрия.
Ионы натрия и хлора выполняют важные функции. Натрий регулирует кровяное давление и играет роль в передаче сообщений между нервами и мышцами, в то время как хлорид является компонентом соляной кислоты, необходимой для пищеварения.
Работа по поддержанию нужной концентрации минералов в крови ложится на почки. Если уровень хлорида натрия в крови повышается из-за приема слишком большого количества соли, почки будут выделять меньше воды, чтобы разбавить кровь и поддерживать надлежащую концентрацию соли.Однако это приводит к увеличению объема крови, что может привести к повышению артериального давления и отеку тканей, поскольку вода вытекает из кровотока.
Жажда часто сопровождает прием большого количества соли, потому что вода также будет вытягиваться из клеток, чтобы поддерживать нужную концентрацию соли в кровотоке. Вот почему употребление соленой пищи может привести как к жажде, так и к обезвоживанию! И неважно, поваренная это, морская, йодированная или гималайская соль.
Текущая рекомендация состоит в том, чтобы потребление натрия не превышало 2300 мг в день (это 6000 мг хлорида натрия или примерно одна чайная ложка), хотя есть некоторые разногласия по поводу того, должны ли люди с нормальным кровяным давлением ограничивать потребление соли.Некоторые исследования фактически показали, что люди, потребляющие менее 3000 мг натрия в день, подвергаются большему риску сердечных заболеваний, чем люди, потребляющие 4000-5000 мг натрия. Большая часть соли в рационе поступает из обработанных пищевых продуктов, а не из солонки. Один кусок пиццы может содержать до 1000 мг натрия.
@AdaMcVean
Хотите прокомментировать эту статью? Смотрите здесь, на нашей странице в Facebook!
Химический состав столовой соли
Поваренная соль — одна из самых распространенных бытовых химикатов.Поваренная соль содержит от 97% до 99% хлорида натрия, NaCl. Чистый хлорид натрия представляет собой твердое ионное кристаллическое вещество. Однако в поваренной соли присутствуют и другие соединения, в зависимости от ее источника или добавок, которые могут быть включены перед упаковкой. В чистом виде хлорид натрия имеет белый цвет. Поваренная соль может быть белой или иметь слабый фиолетовый или синий оттенок из-за примесей. Морская соль может быть тускло-коричневой или серой. Неочищенная каменная соль может иметь любой цвет в зависимости от ее химического состава.
Откуда берется соль?
Одним из основных источников поваренной соли является минерал галит или каменная соль.Добывается галит. Минералы в добытой соли придают ей химический состав и аромат, уникальный для ее происхождения. Каменную соль обычно очищают из добытого галита, поскольку галит встречается с другими минералами, в том числе с некоторыми, которые считаются токсичными. Самородная каменная соль — это , продаваемая для употребления в пищу, но химический состав непостоянен, и могут возникнуть риски для здоровья из-за некоторых примесей, которые могут составлять до 15% от массы продукта.
Другой распространенный источник поваренной соли — это испаренная морская вода или морская соль.Морская соль состоит в основном из хлорида натрия с небольшими количествами хлоридов и сульфатов магния и кальция, водорослей, отложений и бактерий. Эти вещества придают морской соли сложный аромат. В зависимости от источника морская соль может содержать загрязняющие вещества, связанные с источником воды. Кроме того, можно смешивать добавки с морской солью, главным образом, чтобы она текла более свободно.
Независимо от того, является ли источником соли галит или море, продукты содержат сопоставимые количества натрия по весу.Другими словами, использование того же количества морской соли, а не галита (или наоборот) не влияет на количество пищевого натрия, которое вы получаете из него.
Добавки к соли
Натуральная соль уже содержит множество химикатов. Когда его перерабатывают в поваренную соль, он также может содержать добавки.
Одной из наиболее распространенных добавок является йод в виде йодида калия, йодида натрия или йодата натрия. Йодированная соль может также содержать декстрозу (сахар) для стабилизации йода.Дефицит йода считается самой большой предотвратимой причиной умственной отсталости, когда-то известной как умственная отсталость. Соль йодирована, чтобы предотвратить кретинизм у детей, а также гипотиреоз и зоб у взрослых. В некоторых странах йод обычно добавляют в соль (йодированную соль), а продукты, не содержащие эту добавку, могут быть помечены как «неойодированная соль». Неодизированная соль не подвергалась удалению химикатов; скорее, это означает, что дополнительный йод не был добавлен.
Еще одна распространенная добавка к поваренной соли — фторид натрия.Фтор добавлен, чтобы предотвратить кариес. Эта добавка чаще встречается в странах, где вода не фторируется.
«Дважды обогащенная» соль содержит соли железа и йодид. Фумарат железа — обычный источник железа, который добавляют для предотвращения железодефицитной анемии.
Другой добавкой может быть фолиевая кислота (витамин B 9 ). Фолиевая кислота или фолицин добавляются для предотвращения дефектов нервной трубки и анемии у развивающихся младенцев. Этот тип соли может использоваться беременными женщинами для предотвращения распространенных врожденных дефектов.Соль, обогащенная фолицином, имеет желтоватый цвет из-за витамина.
В соль могут быть добавлены вещества, предотвращающие слеживание, чтобы зерна не слипались. Распространены любые из следующих химических веществ:
- Алюмосиликат кальция
- Карбонат кальция
- Силикат кальция
- Соли жирных кислот (кислые соли)
- Карбонат магния
- Оксид магния
- Диоксид кремния
- Алюмосиликат натрия
- Ферроцианид натрия или желтый пруссат соды
- Трикальций фосфат
Explainer: что такое рентгеновская кристаллография?
Около 100 лет назад отец и его сын на севере Англии провели эксперимент, который произвел революцию в методах изучения молекул.Усовершенствованная версия их метода до сих пор остается одним из важнейших инструментов для ученых.
Для достижения этой цели Уильям Генри Брэгг и его сын Уильям Лоуренс Брэгг использовали поваренную соль (хлорид натрия). Они приготовили чистый кристалл соли и посветили на него рентгеновскими лучами, которые создали красивый геометрический узор на фотобумаге, помещенной позади него.
Рентгенограмма кристалла фермента.
Джефф Даль
Другие делали подобное и раньше, но Брэгги совершили интуитивный прыжок.Они поняли, что в схеме точек спрятана информация о молекулярной структуре соли. Затем Лоуренс Брэгг придумал формулу, теперь известную как закон Брэгга, которую можно использовать для извлечения этой информации, позволяющей ему выяснить, как атомы натрия и хлора расположены в кристалле соли.
Сегодня мы знаем, что внутри кристаллов есть атомы, расположенные в правильном порядке. Каждый из этих атомов имеет плотное ядро, содержащее нейтроны и протоны, и менее плотные внешние оболочки, содержащие электроны.Рентгеновские лучи, попадающие на эти препятствия, взаимодействуют с другими рентгеновскими лучами, что вызывает явление, называемое дифракцией, которому подвергаются все волны (свет или звук), когда они сталкиваются с препятствиями. Результат этой дифракции — это то, что было запечатлено на фотопластинке командой Брэгга.
Шариковая модель пролина.
Питер Мюррей-Раст
Даже если вы никогда не обращали внимания на уроке химии, вы можете распознать представление химических структур в виде шариков и палочек, где шарики являются атомами и склеивают связи, удерживающие их вместе.Но Брэгги об этом не знали. Их работа не только подтвердила существование атомов, но и показала, как они собираются вместе, чтобы образовать соединения.
С этого момента загадочный способ взаимодействия атомов друг с другом стал доступен ученым. Они могли начать разгадывать структуру молекул. В прошлом веке 27 Нобелевских премий были присуждены за открытия, непосредственно связанные с использованием рентгеновской кристаллографии. Влияние работы семьи, родившейся в Йоркшире, можно оценить не лучше, чем Макс Перуц, обладатель одной из 27 Нобелевских премий:
.
Почему вода закипает при 100ºC, а метан при -161ºC, почему кровь красная, а трава зеленая, почему алмаз твердый, а воск мягкий, почему текут ледники и железо становится твердым, когда вы его ударяете, как сокращаются мышцы, как солнечный свет заставляет растения расти и как живые организмы смогли развиться во все более сложные формы… ответы на все эти проблемы пришли из структурного анализа.
Знаменитая фотография 51.
Раймонд Гослинг / Королевский колледж Лондона
В 1953 году Розалинда Франклин использовала рентгеновскую кристаллографию для получения изображений кристалла ДНК. Одно из этих изображений, названное фотографией 51, в конечном итоге привело Джеймса Уотсона, Фрэнсиса Крика и Мориса Уилкинса к описанию спиральной структуры ДНК, названной самой важной «фотографией» из когда-либо сделанных.
Эти изображения, сделанные кристаллографами, известны как дифракционные картины, и теперь мы можем создавать такие изображения с помощью лазерных указателей.Когда свет от лазера проходит через спиральную пружину, он образует характерную метку «X» на стене позади.
Для большинства и без понимания закона Брэгга трудно совершить прыжок от пятнистого креста к основной структуре невидимых атомов. Но результат поразительно похож на знаменитый образ Франклина. Угол креста и расстояние между точками содержат информацию о толщине проволоки и натяжении пружины, например, сжатие пружины изменяет рисунок рисунка.Точно так же фото 51 содержит все данные, необходимые для разблокировки структуры ДНК.
ДНК
, вероятно, самая известная структура, определенная с помощью рентгеновской кристаллографии, но это лишь одна из тысяч: от поваренной соли до лекарств и от материалов до массивных сложных белков, структура которых определяет наше понимание процесса, делающего жизнь возможной. Воздействие рентгеновской кристаллографии — одна из причин, почему ООН назвала 2014 год Международным годом кристаллографии.
Светлое будущее
Но химики ненавидят рентгеновскую кристаллографию, потому что у нее есть одно серьезное ограничение. Как следует из названия, для этого метода требуются кристаллы, которые должны быть определенного качества и размера. Вырастить хорошие кристаллы соли легко, но создание кристалла сложной молекулы, такого как белок, часто терпит неудачу. Многие ученые построили свою карьеру, просто научившись создавать кристаллы хорошего качества из определенного белка.
Вот почему сегодняшние достижения в области рентгеновской кристаллографии частично обусловлены попытками обойти проблему кристаллов. Один из способов сделать это — использовать более мощные рентгеновские лучи. Подобно тому, как яркий факел более ярок, чем свеча, чем больше энергии в рентгеновском луче, тем меньше кристалл, необходимый для получения хорошей дифракционной картины.
Источник рентгеновского излучения, который использовали Брэгги, представлял собой небольшую стеклянную трубку, напоминающую лампочку. Он производил рентгеновские лучи, достаточно сильные, чтобы выявить структуру простого кристалла соли.Напротив, современные источники света — это огромные ускорители частиц, называемые синхротронами, такие как алмазный источник света. Эти инструменты могут достигать сотен метров в поперечнике и генерировать лучи в десятки тысяч раз мощнее, чем само Солнце. И с помощью этих невероятных лучей ученые могут извлекать структуры из все меньших и меньших кристаллов, пока не станет возможным избавиться от кристаллов.
Другие статьи из этой серии: Малоизвестная наука, которая улучшила все вокруг нас
.
