Содержание
Напишите структурные формулы N2; Nh4; h3O; HCl
ейй помогите пожалуйста я новичок потому в меня нет много балов даю 20 пожалуйста помогите
У реакції вступає по 0,75 моль хлоридної кислоти з такими основами натрій гідроксид,магній гідроксид, алюмінію гідроксид.Складіть рівняння реакцій і о
…
бчисліть кількість речовини кожної основи,необхідної для реакції
ОЧЕНЬ СРОЧНО!!!!У 513 г води розчинили 27г солі. Визначте концентрацію розчину.
СРОЧНО!На пам’ятнику Богдану Хмельницькому в м. Києві можнапомітити зеленкуватий наліт, який утворився в результаті вза-ємодії міді у складі сплаву з
…
речовинами навколишнього сере-довища. Запропонуйте спосіб очищення поверхні пам’ятникавід утвореного нальоту
Які із запропонованих речовин розкладаються при нагріванні:а) цинк гідроксид; б) етанол; в) етан; г) хлоридна кислота; д) кальцій карбонат; е) нітрат
…
на кислота; є) етанова кислота.
відомо що напій кока-кола містить ортофосфатну кислоту як за допомогою певної солі та індикатора можна це визначити поміркуй де можна використати цей
…
напій знаючи його склад
До електролітів середньої сили не відносять:а) нітратну кислоту; б) фторидну кислоту; в) хлоридну кислоту; г) сульфідну кислоту; д) ортофосфатну кис
…
лоту; є) сульфатну кислоту.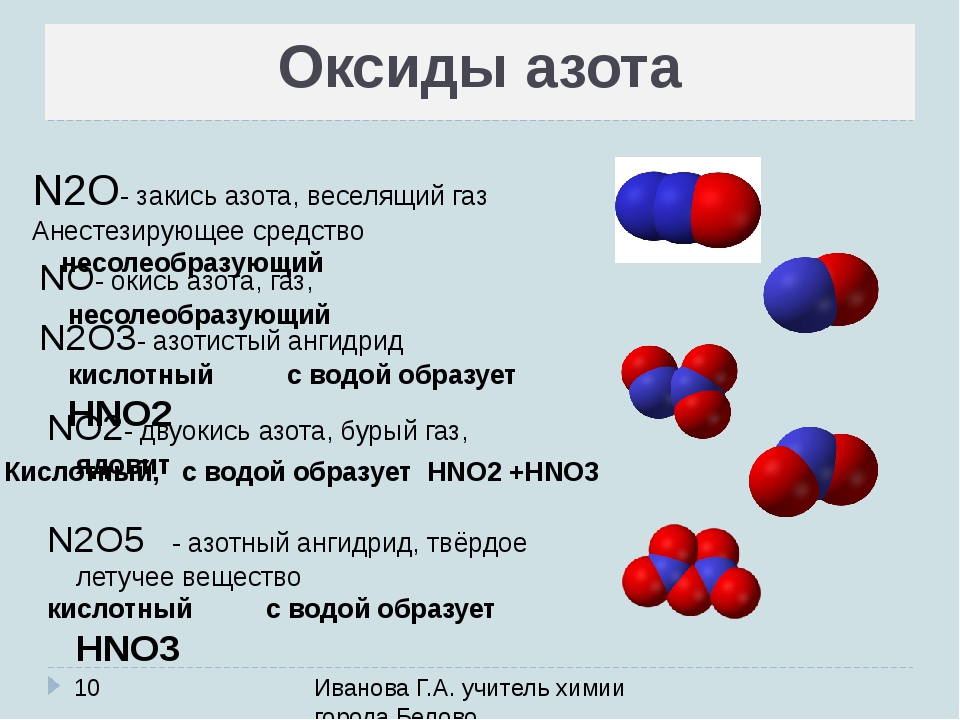
Тест.
Кто является автором следующей теории растворов. При растворении частицы растворенного вещества и растворителя не только распадаются, но и взаи
…
модействуют друг с другом, при этом образуются гидратированные ионы, при этом или выделяется или поглощается тепло.
А) Я.Х Вант Гофф Б) С. Аррениус В) Д.И Менделеев Г) М.В.Ломоносов
2. Из предложенного перечня выберите только те вещества/смеси, которые могут проводить электрический ток, благодаря направленному движению в них разнозаряженных частиц к определенным электродам.
А) Медь Б) Речной песок В) Морская вода Г) Сахарная вода Д)Кристаллическая поваренная соль Е) 20% соляная кислота
3. Из предложенного списка выберите только те вещества, растворимость в воде которых повышается при увеличении температуры
А) Хлорид натрия Б) Золото В) Кислород Г) Подсолнечное масло
4. Оцените правильность утверждения
1) Аквариум нельзя наполнять быстроохлажденной кипяченой водой.
2) Природные карбонаты, залегающие на дне морей и океанов, ежедневно разлагаются с образованием углекислого газа, который, в основном, покидает толщу воды и растворяется в воздухе.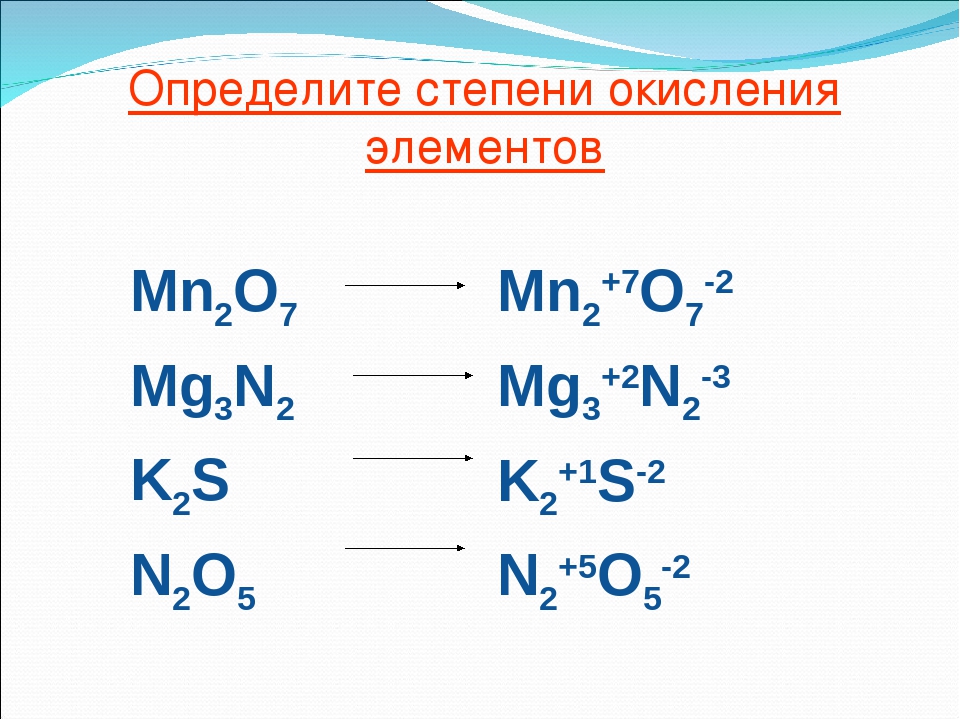
А) Верно только 1 Б) Верно только 2 В) Верны оба утверждения Г) Утверждения не верны.
5. Как называется раствор в котором растворенное вещество при данных условиях достигло максимальной концентрации и больше не растворяется?
А) Неоднородный Б) Пересыщенный В) Ненасыщенный Г) Насыщенный
6. Сколько грамм поваренной соли нужно добавить к дистиллированной воде, чтобы приготовить 200г физраствор ( 0,9% раствор натрия хлорида в воде)?
А) 18г Б) 1,8г В) 180г Г) 0,18г
7. Как называются соединения солей с водой, находящейся в них в их твердом состоянии при тех температурах, когда она обычно жидка.
А) Катоды Б) Сольваты В) Гидраты Г) Кристаллогидраты
8. Как называется класс веществ при электролитической диссоциации которых в качестве анионов образуются гидроксид ионы, а в качестве катионов ионы металлов?
А) Основания Б) Оксиды В) Кислоты Г) Соли
Який об’єм вуглекислого газу утвориться внаслідок згорання 810кг целюлози?
пж химия
1. Встановіть відповідність між реагентами та продуктами хімічних реакцій:
1) NaOH+CO₂ A.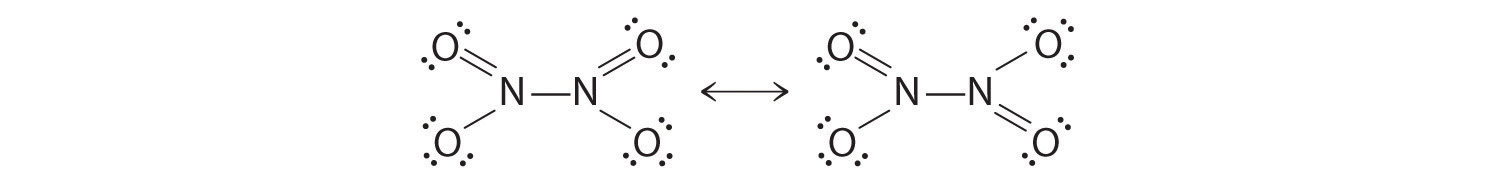 FeO+H₂O
FeO+H₂O
2)NaOH+h3SO₄ Б.Na₂CO₃+H₂O
3)Fe(OH)₂+HCl В.Na
…
₂SO₄+H₂O
4)Fe(OH)₂ Г.FeCl₂+H₂O
2. З якими із перлічених речовин реагуватиме NaOH (необхідне підкресліть)?
H₂SO₄,MgO,SO₃,Cu(NO₃)₂,KCl,H₃PO₄,Zn,CO₂,KOH.
3. Вкажіть ряд, в якому наведено тільки кислотні оксиди:
а)калій оксид,магній оксид,ферум(III) оксид.
б)алюміній оксид,карбон(II) оксид,нітроген(I) оксид.
в)сульфур(IV) оксид,карбон(IV) оксид,сульфур(VI) оксид.
г)нітроген(II) оксид,карбон(II) оксид,барій оксид.
4. Допишіть пропущені формули хімічних сполук. Перетворіть схеми на рівняння реакцій:
а)……………+KOH→Fe(OH)₃+………………
б)HNO₃+KOH→………………..+H₂O
5. Допишіть рівняння реакцій термічного розкладу:
а)Mg(OH)₂→
б)Al(OH)₃→
6. Складіть рівняння хімічних реакцій, що відповідають схемі:
P→P₂O₅→H₃PO₄→Ca₃(PO₄)₂
1)___________________
2)___________________
3)___________________
Алерана стимулятор роста ресниц и бровей двойная формула 6 мл N2 во Фрязино
Форма выпуска
Стимулятор роста ресниц и бровей
Состав
Церамиды, витамин Е, экстракты крапивы, каштана и элеутерококка, таурин, растительные масла миндаля, касторовое, жожоба и репейное, пантенол и гиалуронат натрия.
Упаковка
Пенал 2х6мл.
Фармакологическое действие
Средство разработано с учетом физиологических особенностей роста волос, имеет двойную формулу: День и Ночь.
Формула «День» стимулирует рост ресниц и бровей, обеспечивает их защиту от негативных внешних воздействий, служит идеальной основой под тушь.
Активные компоненты формулы «День»:
Церамиды защищают ресницы от ломкости
Пантенол и гиалуронат натрия оказывают восстанавливающий и увлажняющий эффект.
Экстракты крапивы, каштана и элеутерококка улучшают микроциркулляцию в коже, ускоряют обменные процессы
Таурин способствует формированию и росту здоровых волос
Формула «Ночь» увлажняет, улучшает питание, восстанавливает структуру и природную пигментацию ресниц и бровей, улучшает питание волосяных фолликулов
Активные компоненты формулы «Ночь»:
Растительные масла миндаля, касторовое, жожоба и репейное прекрасно увлажняют, смягчают, восстанавливают текстуру и природную пигментацию ресниц и бровей.
Витамин Е обладает антиоксидантными свойствами и улучшает питание фолликулов.
Стимулятор роста для ресниц и бровей ALERANA не содержит гормонов, продуктов животного происхождения, парабенов и отдушек.
Стимулятор роста подходит для использования при ношении контактных линз.
Показания
Стимуляция роста, укрепление, восстановление структуры и цвета ресниц и бровей, защита ресниц и бровей от внешних воздействий.
Противопоказания
Не рекомендуется при индивидуальной непереносимости компонентов.
Применение при беременности и кормлении грудью
Возможно.
Способ применения и дозы
Способ применения формулы «День»: наносится на ресницы и брови после утреннего умывания. Можно использовать при ношении контактных линз, хорошо подходит в качестве основы под тушь для ресниц.
Способ применения формулы «Ночь»: рекомендуется нанести на чистые ресницы и брови после вечерних гигиенических процедур.
Особые указания
Для достижения стойкого результата рекомендуется проводить курсы продолжительностью 1-3 месяца 2 раза в год.
Лекарственное взаимодействие
Нет данных.
Передозировка
Нет данных.
Условия хранения
Хранить в сухом недоступном для детей месте при температуре от 5 до 25 градусов С.
Срок годности
2 года.
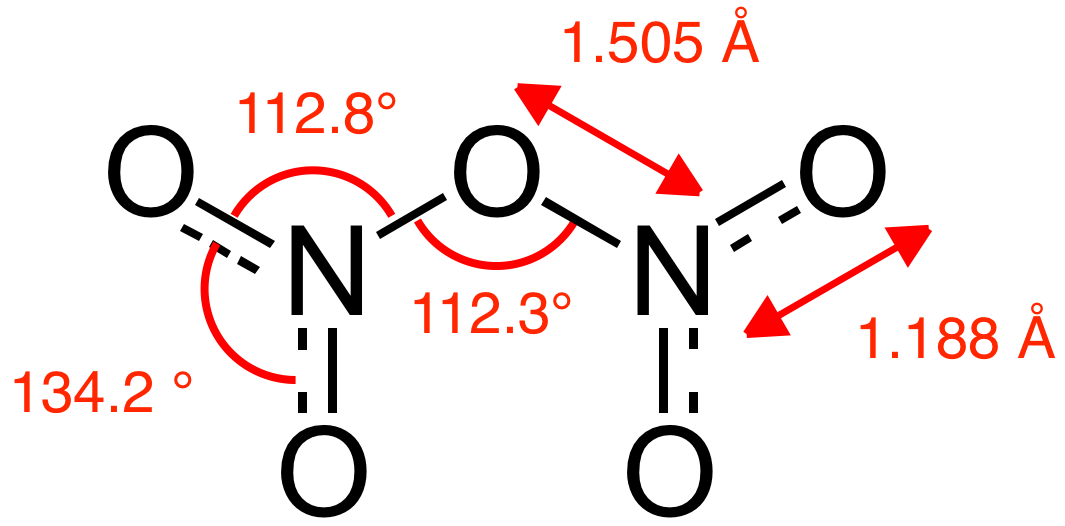
Азот (N2)
|
Приобрести сжиженный Азот можно на головном предприятии по заранее согласованной заявке (КОНТАКТЫ)
Приобрести газообразный Азот можно во всех торговых представительствах (КОНТАКТЫ)
Ознакомится со способами доставки (УСЛУГИ)
|
Азот (N2)– бесцветный инертный газ, не имеющий характерного запаха и вкуса. Он мало растворим в жидкостях и практически не проводит электричество, не горюч. На производство газ поставляют в баллонах черного цвета с желтой надписью
Применение азота
Азот в баллонах широко используется практически в каждой отрасли народного хозяйства:
- В металлургии для создания защитной среды во время отжига черных и цветных сплавов, разливки сталей, криозакалки, криообжига, спекания порошковыми металлами, нанесения защитных покрытий, пайки твердым припоем и т.
 д.
д. - В горнодобывающей отрасли для наполнения взрывоопасных шахт.
- На нефтяных и газовых платформах для создания нужного давления пластов, заполнения резервуаров, замораживания протечек и т. д.
- В сельском хозяйстве для длительного хранения пищевых продуктов, силосов.
- В автомобилестроении для низкотемпературной закалки ответственных частей механизмов.
- В медицине для замораживания биологического материала и в криохирургии.
Свойства азота
|
Параметр
|
Значение
|
|
Формула
|
N2
|
|
Цвет
|
Бесцветный
|
|
Реакционноспособность
|
Не горит
|
|
Растворимость в воде, мл/100 г
|
2,3
|
|
Температура конденсации, ºС
|
-195,80
|
|
Температура кристаллизации, ºС
|
-209,86
|
|
Плотность, кг/м3
|
1,2506
|
Технические характеристики баллонов
|
Параметр
|
Баллон 5 л
|
Баллон 10 л
|
Баллон 20 л
|
Баллон 40 л
|
|
Объем, л
|
5
|
10
|
20
|
40
|
|
Рабочее давление, МПа (кгс/см2)
|
14,7 (150)
| |||
|
Проверочное давление, МПа (кгс/см2)
|
22,5 (225)
| |||
|
Диаметр цилиндра, мм
|
140
|
140
|
219
|
219
|
|
Длина баллона, мм
|
480
|
870
|
770
|
1400
|
|
Масса баллона, кг
|
8,5
|
15
|
39
|
65
|
|
Материал
|
Сталь 30 ХГСА, 45 Д
| |||
Состав технического газа
|
Показатель
|
Норма для марки азота
| |||||
|
Особой чистоты
|
Повышенной чистоты
|
Технический газ
| ||||
|
1 сорт
|
2 сорт
|
1 сорт
|
2 сорт
|
1 сорт
|
2 сорт
| |
|
Содержание азота, % об.
|
99,999
|
99,996
|
99,99
|
99,95
|
99,6
|
99,0
|
|
Содержание кислорода, % об., не более
|
0,0005
|
0,001
|
0,001
|
0,05
|
0,4
|
1,0
|
|
Содержание паров воды, % об., не более
|
0,0007
|
0,0007
|
0,0015
|
0,004
|
0,009
|
Проходит испытание
|
|
Содержание масла
|
Не определяется
|
Выдерживает испытание
| ||||
|
Содержание водорода, % об.
|
0,0002
|
0,001
|
Не нормируется
| |||
|
Содержание углеродных соединений в пересчете на метан, % об., не более
|
0,0003
|
0,001
|
Не нормируется
| |||
Условия хранения
Допускается длительное хранение в сухом, прохладном помещении с низкой пожарной опасностью и хорошей системой вентиляции. Поблизости не должно быть агрессивных сред и легковоспламеняющихся веществ, складируют вдали от источников открытого огня, приборов отопления.
Транспортировка
1) Доставка сжиженного азота специальным транспортом.
2) Доставка в кассетах по 8 баллонов и европаллетах по 12 баллонов
Чтобы сделать заказ или уточнить условия поставки, обращайтесь в торговые представительства вашего региона. (КОНТАКТЫ)
(КОНТАКТЫ)
|
Встречайте новый журнал «Formula Рукоделия»!
Иногда приходит время перемен. Приходит время, когда нужно сняться с места, упаковать чемоданы – и отправиться туда, куда давно мечтали. И, разумеется, взять с собой любимое рукоделие, чтобы скоротать часы в дороге. Ну а мы приготовили для вас немало интересных проектов для летнего отпуска.
ВЫШИВКА
Вас ждет шесть вышивальных проектов, но в их числе – сразу три части многоцветного женского портрета от компании «Эстэ». В этом номере мы также публикуем симпатичный прибрежный пейзаж с рыбацкой деревушкой, стильную подушку с тропическими мотивами, похожую на набивную ткань, и портрет голливудской дивы 50-х годов.
Кроме того, вас ждут новые обзоры вышивальных наборов и швейных аксессуаров.
ШИТЬЕ И ДЕКОР
Вместе со Светланой Мусатовой мы продолжаем годовой проект – квилт-панно, посвященное четырем временам года. Также вас ждет мастер-класс по скрапбукингу – вы оформите не только открытку из бонусной бумаги, но и симпатичную банку-копилку, которая поможет вам сэкономить немного денег для летнего отпуска. А новый творческий конкурс от компании Prym на этот раз посвящен дорожным аксессуарам для рукоделия.
СТАТЬИ И ИНТЕРВЬЮ
Вас ждет большой материал, посвященный джинсовой моде: интервью дизайнеров, советы экспертов, обзоры коллекций, и также анонс фестиваля «Формула DENIMа», который пройдет в рамках осенней выставка «Формула Рукоделия».
А ТАКЖЕ:
Обзор новинок для детского творчества, творческие конкурсы, письма читателей, анонсы самых интересных мероприятий, бесплатная бумага для скрапбукинга, рубрика для садоводов, конкурсы, призы и подарки!
|
Canon PowerShot N2 — PowerShot and IXUS digital compact cameras
Отказ от ответственности
Все данные
основаны
на
стандартных
методах
тестирования,
применяемых
компанией
Canon (в
соответствии
со
стандартами
CIPA), если не
указано
иное.
Может быть
изменено
без
предварительного
уведомления.
Примечания
¹
Обработка
изображения
может
привести к
уменьшению
числа
пикселей.
¹ В
зависимости
от
выбранного
размера
изображения.
¹ Значения
приводятся
по
максимальному
оптическому
фокусному
расстоянию.
Для камер,
фокусное
расстояние
которых
превышает
350 мм
(эквивалент
для 35-мм
пленки),
значение
приводится
по
фокусному
расстоянию
350 мм.
¹ В
условиях,
когда не
срабатывает
вспышка.
² В
зависимости
от
скорости
доступа /
емкости
карты
памяти /
параметров
сжатия.
¹ Для
максимального
времени
записи (HD) 1280 x 720
требуются
карты
памяти
следующего
типа: класс
скорости
передачи
данных 4 или
выше. (Full HD) 1920 x 1080 -
(Full HD) 1920 x 1080 -
класс
скорости
передачи
данных 6 или
выше. (iFrame) 1280 x 720 -
класс
скорости 6
или выше.
² В
зависимости
от
скорости
доступа /
емкости
карты
памяти /
параметров
сжатия.
¹
Использование
Wi-Fi может
быть
ограничено
в ряде
стран и
регионов.
Поддержка
Wi-Fi зависит
от
устройства
и региона.
Более
подробную
информацию
можно
получить
по адресу
www.canon-europe.com/wirelesscompacts
N2 Крем для Контура Глаз
Более тонкая и хрупкая кожа вокруг глаз обладает специфическими свойствами, требующими особого ухода. Практически лишенная гидролипидной пленки, которая защищает кожу и низкая в сальных железах, область вокруг глаз имеет тенденцию к старению быстрее, чем другие области лица. Обогащенный глюкуроновой кислотой, стволовыми клетками солнечного вита и экстрактом альбизии джулибриссина, N2 FDM увлажняет контур глаз, разглаживает и укрепляет кожу вокруг глаз, оказывая омолаживающее действие, которое помогает уменьшить морщины и подтянуть кожу. После регулярного использования кожа выглядит более тонизированной и молодой.
После регулярного использования кожа выглядит более тонизированной и молодой.
Роскошная формула Fattoria di Montemaggio делает N2 FDM Крем для Контура Глаз обязательным средством по уходу за кожей вокруг глаз.
N2 FDM крем для контура глаз – ключевой элемент:
- Увлажняет
- Уменьшает морщины
- Подъемное действие
- Рекомендуется для зрелой кожи
- Убедительный сайт
- Детоксикация кожи
- Увеличьте допуск кожи к ультрафиолетовому излучению
- Борьба с фотостарением
- Для жизненно важной и здоровой кожи
- Анти-старение
- Регенерирующий
- Оживление
Почему Montemaggio: Стволовые Клетки Красного Винограда (Solar Vitis)
Стволовые клетки, извлеченные из красного винограда, присутствующие в дневном, ночном креме, сыворотке для лица и креме для контура глаз, способствуют улучшению периферического кровообращения и оказывают естественное регенерирующее, восстанавливающее и реактивирующее действие на клеточное долголетие.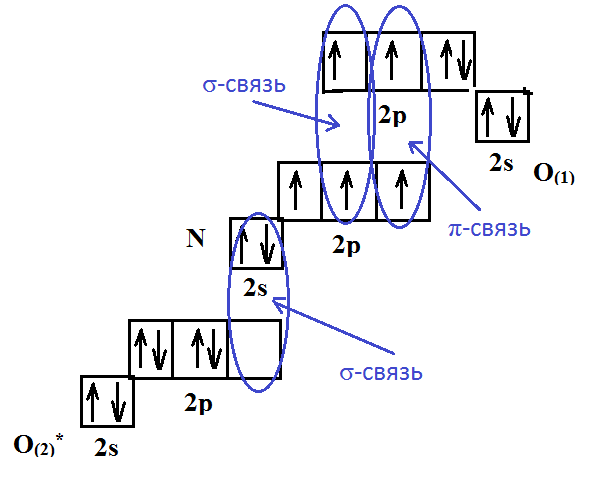
Экстракт витиса виниферы помогает сохранить свойства стволовых клеток кожи, защищая их от ультрафиолетового излучения, которое отвечает за процесс старения кожи. Растительные стволовые клетки, благодаря своему доказанному антиоксидантному и защитному действию, в последние годы становятся все более популярным ингредиентом в косметике. Основным преимуществом, которое они привносят в кожу, является стимул к регенерации и восстановлению. Эта особенность свойственна стволовым клеткам, которые благодаря своей особой конформации могут полностью регенерировать себя: это почти чудодейственная прерогатива, которая, однако, не должна приводить к путанице растительных тканей с человеческими. В растениях, по сути, эти клетки могут позволить регенерацию внутри растения, в то время как при использовании в косметических препаратах, не определяя процессов саморегенерации тканей, они приносят неоспоримую пользу красоте кожи, так как противодействуют старению кожи.
Почему Montemaggio: Альбиция Джулибриссин – Дерево Счастья
Цветы и кора мимозы (Albizia julibrissin) являются одними из самых ценных в китайской ботанике для снятия тревоги, стресса и депрессии. Albizia julibrissin работает, улучшая дыхание, удаляя кожу токсичных гликогенов и увеличивая клеточную энергию, уменьшая образование пигментов Advanced Glycation End-products, которые являются известным источником морщин, тусклости и потери кожи. Альбизия является чрезвычайно мощным антиоксидантом – фактически показала, что она в шесть раз сильнее, чем L-аскорбиновая кислота (витамин С) при удалении свободных радикалов.
Albizia julibrissin работает, улучшая дыхание, удаляя кожу токсичных гликогенов и увеличивая клеточную энергию, уменьшая образование пигментов Advanced Glycation End-products, которые являются известным источником морщин, тусклости и потери кожи. Альбизия является чрезвычайно мощным антиоксидантом – фактически показала, что она в шесть раз сильнее, чем L-аскорбиновая кислота (витамин С) при удалении свободных радикалов.
Почему Монтемаджио: Глюкуроновая Кислота
Глюкуроновая кислота, присутствующая в дневном креме МДФ, сыворотке для лица МДФ, креме для контура глаз, является активным веществом, способным стимулировать синтез гиалуроновой кислоты, эластина и ламинина-5; это позволяет вмешаться в процессы регенерации клеток для содействия расслабленной, эластичной и компактной коже.
Глюкуроновая кислота является производной глюкозы, остатки которой составляют дисахаридные единицы, принадлежащие к наиболее известной гиалуроновой кислоте, фундаментальному компоненту дермы для поддержки и увлажнения тканей, которые наша кожа естественным образом вырабатывает. С течением времени концентрация гиалуроновой кислоты, присутствующей в тканях, имеет тенденцию к снижению, а процессы старения приводят к ее ухудшению с появлением морщин и большей вялостью цвета лица. Гиалуроновая кислота также определяет в соединительной ткани важную степень увлажненности, текучести и пластичности кожной ткани и устроена таким образом, что связывает значительное количество молекул воды.
С течением времени концентрация гиалуроновой кислоты, присутствующей в тканях, имеет тенденцию к снижению, а процессы старения приводят к ее ухудшению с появлением морщин и большей вялостью цвета лица. Гиалуроновая кислота также определяет в соединительной ткани важную степень увлажненности, текучести и пластичности кожной ткани и устроена таким образом, что связывает значительное количество молекул воды.
Как использовать:
Наносите N2 FDM Eye Contour ежедневно, утром и вечером, и легкими круговыми движениями массируйте кожу. Этот крем против морщин, укрепляющий и увлажняющий кожу вокруг глаз, благодаря своим активным ингредиентам, делает кожу выглядящей моложе, поэтому наносите каждый день щедро и дайте крему впитаться перед использованием других средств. Для достижения лучших результатов используйте другие косметические средства Fattoria di Montemaggio.
Нажмите здесь, чтобы посмотреть другие косметические средства:
N1 Скраб Montemaggio с гранулами из фундука, миндаля и
масла абрикоса
Сыворотка для лица N3 с глюкуроновой кислотой и стволовыми клетками из красного винограда
N. 4 Дневной крем с глюкуроновой кислотой и стволовыми клетками из красного винограда!
4 Дневной крем с глюкуроновой кислотой и стволовыми клетками из красного винограда!
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
он же
Закон Снеллиуса, отражение и преломление
Закон Снеллиуса, отражение и преломление
Для того, чтобы пройти по самому быстрому пути через систему, луч меняет направление при переходе от среды с одним показателем преломления к другой среде с другим показателем преломления.
Закон Снеллиуса, который можно сформулировать как
нА Sinθ A = нБ Sinθ B
предсказывает, как луч изменит направление при переходе из одной среды в другую или при отражении от границы раздела двух сред. Углы в этом уравнении относятся к нормали к поверхности, как показано ниже.
Углы в этом уравнении относятся к нормали к поверхности, как показано ниже.
На следующем рисунке луч падает на границу раздела двух разнородных сред. Плоскость, которая включает падающий луч и линию, проведенную перпендикулярно поверхности, называется плоскостью падения. Эта плоскость также содержит отраженных и преломленных лучей. Преломленный луч проходит во вторую среду и движется в другом направлении, чем падающий луч. Углы падающего, отраженного и преломленного лучей относительно нормали к поверхности называются соответственно углами падения qi, отражения qr и преломления qt.Показатель преломления среды 1 равен n1, а среды 2 — n2.
Иллюстрация падающих, отраженных и преломленных лучей.
В случае отраженного луча nA = nB = n2 = n1,
n1 Sinθ i = n1 Sinθ r , что совпадает с Sinθ i = Sinθ r.
Из этого легко увидеть, что угол падения и угол отражения одинаковы!
В случае прошедшего или преломленного луча
n1 Sinθ i = n2 Sinθ t.
Если n1
n1 Sinqθ i = n2 Sin (90 °) = n2.
Из этого,
qc = Sin -1 (n2 / n1).
Эти диаграммы иллюстрируют два разных случая рефракции. Полное внутреннее преломление показано на рисунке справа.
Многие устройства используют полное внутреннее отражение, включая оптические волноводы (например, оптическое волокно). Волновод — это отрезок прозрачного материала, окруженный материалом с более низким показателем преломления.Лучи, которые пересекают границу раздела между материалом волновода и окружающим материалом под углами, равными или превышающими критический угол, захватываются волноводом и проходят по нему без потерь.
Волновод — это отрезок прозрачного материала, окруженный материалом с более низким показателем преломления.Лучи, которые пересекают границу раздела между материалом волновода и окружающим материалом под углами, равными или превышающими критический угол, захватываются волноводом и проходят по нему без потерь.
Лучи могут быть захвачены в волноводе из-за полного внутреннего отражения.
Молекулярная масса N2
Молярная масса of N2 = 28,0134 г / моль
Перевести граммы N2 в моль или моль N2 в граммы
Расчет молекулярной массы:
14.0067 * 2
| Элемент | Обозначение | Атомная масса | Количество атомов | Массовый процент |
| Азот | N | 14. 0067 0067 | 2 | 100,000% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Определение молярной массы начинается с единиц граммов на моль (г / моль).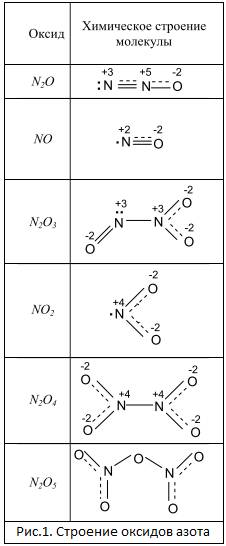 При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Universal Industrial Gases, Inc … Свойства азота N2, использование, применение
Многоотраслевое использование азота:
Инертные свойства азота делают его хорошим
Защитный газ для многих применений. Азот
Покрытие используется для защиты легковоспламеняющихся или взрывоопасных твердых веществ
и жидкости от контакта с воздухом.Некоторые химические вещества, поверхности
твердые вещества и хранящиеся пищевые продукты обладают свойствами, которые необходимо защищать от
разложение под воздействием атмосферного кислорода и влаги. Защита
достигается за счет содержания этих предметов в (под) азотной атмосфере. «Инертинг» или
«набивка» — это другие термины, используемые для описания вытеснения воздуха и
азотная подушка.
«Промывание»
с азотом — это барботирование газообразного азота через жидкость для удаления
нежелательные летучие компоненты, включая летучие органические соединения (ЛОС)
что может быть необходимо для соблюдения правил сокращения загрязнения.
Некоторые вещества трудно измельчить
или измельчить, потому что они жесткие, иначе они были бы испорчены
тепло, выделяемое механическими процессами, такими как шлифование.
Жидкий азот можно использовать для замораживания мягких или вязких веществ перед
их ввод в процесс уменьшения размера. Баллон с холодным испарением азота
использоваться для охлаждения материалов (и в инертной атмосфере) во время измельчения.
Криогенное измельчение используется в различных сферах, в том числе при производстве мелкого помола.
измельченные фармацевтические препараты, пластмассы и пигменты; и для измельчения шин в
заводы по переработке отходов.
Металлы
Производство азота:
Азот используется для обработки расплава при производстве стали и других металлов, а также в качестве защитного газа при термообработке чугуна, стали и других металлов. Он также используется в качестве технологического газа вместе с другими газами для снижения карбонизации и азотирования.
Вспышка или ребра на литом металле
удаляются охлаждением жидким азотом, что делает их хрупкими,
и позволяет
их разрывать механическим воздействием.
Использование в производстве и строительстве:
Термоусадочный фитинг — интересная альтернатива традиционному расширительному фитингу. Вместо того, чтобы нагревать внешнюю металлическую часть, внутренняя часть охлаждается жидким азотом, так что металл сжимается и может быть вставлен. Когда металл возвращается к своей нормальной температуре, он расширяется до исходного размера, обеспечивая очень плотную посадку.
Жидкий азот используется для охлаждения бетона во время его заливки и укладки.
Более медленное отверждение приводит к лучшему отверждению
характеристики.
Когда
строительные работы должны выполняться на мягком, пропитанном водой грунте, например при строительстве туннелей под водотоками, грунт может быть эффективно заморожен жидким азотом. Трубы вбиваются в землю, жидкий азот по трубам прокачивается под землей. Когда азот попадает в почву, он испаряется, отводя тепло от почвы и замораживая ее.
Трубы вбиваются в землю, жидкий азот по трубам прокачивается под землей. Когда азот попадает в почву, он испаряется, отводя тепло от почвы и замораживая ее.
Химическая, фармацевтическая и нефтяная промышленность:
Нефтеперерабатывающие заводы, нефтехимические заводы и морские танкеры используют азот для очистки оборудования, резервуаров и трубопроводов от опасных паров и газов (например, после
завершение операции транспортировки по трубопроводу или завершение производственного цикла)
и для поддержания инертной и защитной атмосферы в резервуарах для хранения легковоспламеняющихся жидкостей.
Холодный газообразный азот используется для охлаждения реакторов, заполненных катализатором, во время технического обслуживания. Время охлаждения можно существенно сократить.
Охлаждение
реакторы (и материалы внутри) работают до низкой температуры, что позволяет лучше контролировать побочные реакции в сложных реакциях
в фармацевтической промышленности. Жидкий азот часто используется для обеспечения
Жидкий азот часто используется для обеспечения
необходимое охлаждение, так как оно может привести к быстрому снижению температуры
и затем может легко поддерживать желаемую температуру холодной реакции.Охлаждение реактора и
в системах контроля температуры обычно используется
циркулирующий низкотемпературный теплоноситель для передачи холода
производится путем испарения жидкого азота в
оболочка
корпус реактора. Жидкий азот испаряется в специально разработанных
теплообменники, передающие охлаждение циркулирующему теплу
переносящая жидкость.
Жидкий азот используется при заканчивании газовой скважины для «гидроразрыва».
природные газоносные горные образования, в частности, плотные газовые образования,
в том числе сланцевый газ и природный газ из угля (метан угольных пластов)
где следует избегать гидроразрыва пласта.Азот также используется для поддержания давления в нефти и природном газе.
добывающие формации. В отличие от углекислого газа, который также используется для
В отличие от углекислого газа, который также используется для
наддув, азот мало
сродство к жидким углеводородам, поэтому оно накапливается и остается
в бензобаке.
Азот используется в качестве инертного газа для проталкивания жидкостей через линии, чтобы очистить линии.
и прогонять «свиней» по трубопроводам, чтобы выметать один материал перед
использование линии для транспортировки другого материала.
Резина и
Использование в пластмассовой промышленности:
Материалы становятся твердыми и хрупкими при охлаждении до очень низких температур. Это свойство позволяет удалять вспышки или плавники при гипсе.
пластмассы и резина. Отливки охлаждаются жидким азотом, а вспышка прерывается механическим воздействием.
Продукты питания
и напитки:
Сильный холод
в
жидкий азот позволяет очень быстро замораживать продукты, в результате
повреждение клеток кристаллами льда и улучшение внешнего вида, вкуса и текстуры. Хорошо спроектированные криогенные туннели и спиральные морозильные камеры эффективно улавливают
Хорошо спроектированные криогенные туннели и спиральные морозильные камеры эффективно улавливают
охлаждение от испарения жидкости и от холодного газообразного азота, когда он течет
через морозильную камеру.
При хранении таких веществ, как растительное масло и вино, инертные свойства азота могут использоваться для
защищать от потери качества из-за окисления, удаляя воздух, захваченный жидкостью (барботирование)
и защита жидкостей в резервуарах для хранения путем заполнения парового пространства (покрытия).
Азот (и азот
смешанный с CO2 и кислородом) используется в транспортных средствах и в упаковке в модифицированной атмосфере (MAP) для
продлить срок хранения упакованных пищевых продуктов, предотвращая окисление, плесень, насекомых
заражение и миграция влаги.
Здоровье
Использование для ухода:
Азот
используется в качестве защитного газа при упаковке некоторых лекарств для предотвращения
разложение путем окисления или адсорбции влаги.
Азот используется для
заморозить кровь, а также вирусы для вакцинации. Он также используется для замораживания семени домашнего скота, которое затем может храниться годами.
Быстрое замораживание в результате сильного холода сводит к минимуму повреждение клеточной стенки.
Жидкий азот также используется в некоторых МРТ (магнитных
Resonance Imaging) для предварительного охлаждения низкотемпературных магнитов перед
к использованию гораздо более дорогого жидкого гелия для окончательного охлаждения.
Жидкий азот используется в криохирургии для разрушения пораженных тканей.
Разное использование азота:
Азот
используется непосредственно в качестве охлаждающей жидкости для тяжелых экологических испытаний многих изделий,
или в качестве источника холода для охлаждения циркулирующего сухого воздуха.
Реферат: Ключевые слова: Загрузить статью: Рекомендуемое цитирование: | |
Что такое формула Ридберга и как она работает?
Формула Ридберга — это математическая формула, используемая для предсказания длины волны света, возникающего в результате движения электрона между энергетическими уровнями атома.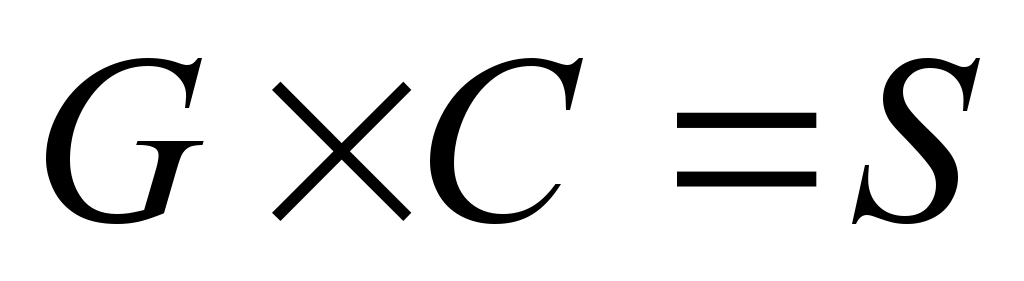
Когда электрон переходит с одной атомной орбитали на другую, энергия электрона изменяется.Когда электрон переходит с орбитали с высокой энергией на состояние с более низкой энергией, создается фотон света. Когда электрон переходит из состояния с низкой энергией в состояние с более высокой энергией, фотон света поглощается атомом.
У каждого элемента есть свой спектральный отпечаток. Когда газообразное состояние элемента нагревается, он излучает свет. Когда этот свет проходит через призму или дифракционную решетку, можно различить яркие линии разных цветов. Каждый элемент немного отличается от других элементов.Это открытие стало началом исследований в области спектроскопии.
Уравнение Ридберга
Йоханнес Ридберг был шведским физиком, который попытался найти математическую связь между одной спектральной линией и следующей из определенных элементов. В конце концов он обнаружил, что между волновыми числами последовательных линий существует целочисленная связь.
Его открытия были объединены с моделью атома Бора, чтобы создать следующую формулу:
1 / λ = RZ
2 (1 / н
1 2 — 1 / н
2 2 )
где
λ — длина волны фотона (волновое число = 1 / длина волны)
R = постоянная Ридберга (1.0973731568539 (55) х 10
7 м
-1 )
Z =
атомный номер атома
п
1 и n
2 целые числа, где n
2 > п
1 .
Позже было обнаружено, что n 2 и n 1 связаны с главным квантовым числом или квантовым числом энергии. Эта формула очень хорошо работает для переходов между энергетическими уровнями атома водорода с одним электроном. Для атомов с множеством электронов эта формула перестает работать и давать неверные результаты.Причина неточности в том, что степень экранирования внутренних электронов или внешних электронных переходов варьируется. Уравнение слишком упрощено, чтобы компенсировать различия.
Уравнение слишком упрощено, чтобы компенсировать различия.
Формула Ридберга может быть применена к водороду для получения его спектральных линий. Установка n 1 на 1 и запуск n 2 от 2 до бесконечности дает ряд Лаймана. Также могут быть определены другие спектральные серии:
| n 1 | n 2 | сходится к | Имя |
| 1 | 2 → ∞ | 91.13 нм (ультрафиолет) | Lyman серии |
| 2 | 3 → ∞ | 364,51 нм (видимый свет) | Balmer серии |
| 3 | 4 → ∞ | 820,14 нм (инфракрасный) | Paschen серии |
| 4 | 5 → ∞ | 1458,03 нм (дальняя инфракрасная область) | Кронштейн серии |
| 5 | 6 → ∞ | 2278,17 нм (дальняя инфракрасная область) | Pfund серии |
| 6 | 7 → ∞ | 3280.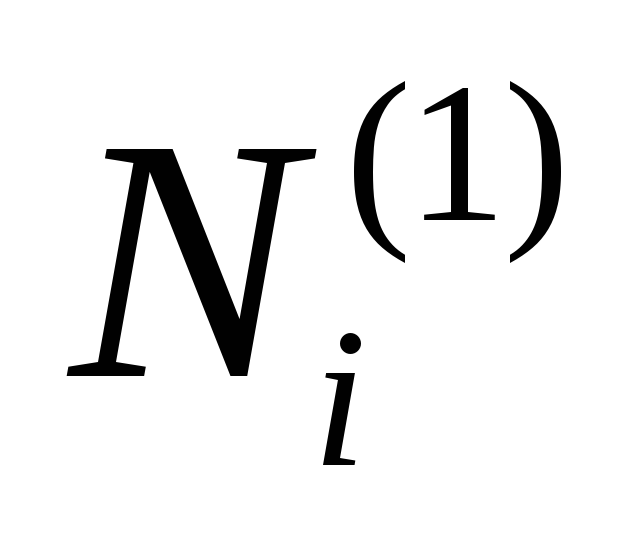 56 нм (дальняя инфракрасная область 56 нм (дальняя инфракрасная область | Хамфрис серии |
Для большинства проблем вы будете иметь дело с водородом, поэтому вы можете использовать формулу:
1 / λ = R
H (1 / п
1 2 — 1 / н
2 2 )
где R H — постоянная Ридберга, поскольку Z водорода равен 1.
Работает формула Ридберга, пример задачи
Найдите длину волны электромагнитного излучения, испускаемого электроном, релаксирующим с n = 3 до n = 1.
Чтобы решить проблему, начните с уравнения Ридберга:
1 / λ = R (1 / n
1 2 — 1 / н
2 2 )
Теперь вставьте значения, где n 1 равно 1, а n 2 равно 3. Используйте 1,9074 x 10 7 m -1 для постоянной Ридберга:
1 / λ = (1,0974 х 10
7 ) (1/1
2 — 1/3
2 )
1 / λ = (1,0974 x 10
7 ) (1 — 1/9)
1 / λ = 9754666.67 кв.м.
-1
1 = (9754666,67 м
-1 ) λ
1 / 9754666,67 м
-1 = λ
λ = 1,025 х 10
-7 кв.м.
Обратите внимание, что формула дает длину волны в метрах, используя это значение для постоянной Ридберга. Вас часто просят дать ответ в нанометрах или ангстремах.
N2 полярный или неполярный?
Вы когда-нибудь проводили эксперимент, в котором вы окунали цветок в холодное вещество и разбивали его о стол, как стекло? Это был жидкий азот.Даже продукты, которые вы едите, которых хватит на долгое время, несомненно, были сохранены с помощью газообразного азота. Однако, когда мы смотрим на химическую структуру N2, у начинающих химиков часто возникает вопрос, является ли N2 полярным или неполярным. Давайте исследуем несколько тем о структуре и реакционной способности N2, чтобы найти ответ!
Итак, N2 полярный или неполярный? N2 — это неполярная молекула из-за своей линейной геометрической структуры, и это двухатомная молекула. В результате оба атома обладают равной электроотрицательностью и имеют равную долю заряда, а общая молекула приводит к общему нулевому дипольному моменту, что делает ее неполярной молекулой.
Азот, или N2, является очень распространенным и необходимым химическим веществом для биологической жизни и промышленных процессов. Азот составляет 78% от объема воздуха, которым мы дышим каждый день, и в сложной форме он содержится во всех живых существах.
Азота также много в промышленной химии, включая удобрения, красители, нейлон и взрывчатые вещества. Чаще всего любые чистящие средства, которые вы использовали с аммиаком, Nh4, были сделаны из молекулярного азота.
Полярность на основе электроотрицательности
Когда атомы образуют связи для создания молекул, мы можем определить уровень полярности молекулы.Ионные связи полностью переносят валентные электроны между атомами, образуя заряд для обоих атомов.
Например, когда натрий (Na) связывается с хлором (Cl), натрий отдает свой один валентный электрон хлору, образуя Na + и Cl-, наиболее стабильную форму этих атомов.
Однако мы обсуждаем ковалентные связи, которые разделяют электроны между атомами. Эти связи возникают между неметаллами, а ковалентные связи могут быть полярными или неполярными.
Когда возникают ковалентные связи, происходит перенос электронной плотности от одного атома к другому.Если электроотрицательности атомов не равны, электроны не будут разделены поровну, образуя частично ионные заряды на каждом атоме.
Прекрасным примером этого является образование соляной кислоты или HCl.
Электроотрицательность обычно предоставляется для используемого вами элемента, поэтому я предоставлю их здесь. Водород (H) имеет электроотрицательность 2,1, а хлор (Cl) имеет электроотрицательность 3,0; чем выше электроотрицательность, тем более отрицательным будет атом, когда он стабилен.
Водород имеет один валентный электрон и ему нужны два для завершения своей валентной оболочки; У хлора семь электронов, и ему нужно восемь, чтобы завершить его валентную оболочку. Таким образом, они разделят свой один электрон, образуя ковалентную связь.
Таким образом, они разделят свой один электрон, образуя ковалентную связь.
Однако хлор будет поглощать большую электронную плотность, поскольку его электроотрицательность выше, чем у водорода.
Это означает, что хлор будет демонстрировать частичный отрицательный заряд из-за повышенной электронной плотности. И наоборот, водород развивает частичный положительный заряд из-за отсутствия электронной плотности.
Это создает дипольный момент, который направляет электронную плотность к более электроотрицательной молекуле.
Следовательно, молекула соляной кислоты будет полярной, потому что существует разница в электроотрицательностях и дипольном моменте молекул.
Вот статья, чтобы проверить полярность HCl.
Почему N2 неполярная молекула?
Давайте применим эту логику к N2. Атомы азота имеют электроотрицательность примерно 3.04. Но в газообразном азоте это гомоядерная молекула, то есть это два одинаковых атома, связанных вместе.
Не было бы разницы в электроотрицательности между двумя атомами азота, а это значит, что у них была бы одинаковая электронная плотность.
Если электронная плотность разделена поровну между двумя атомами, дипольный момент не может образоваться. Таким образом, можно считать, что N2 неполярен.
Структура Льюиса N2
Структура Льюиса — это очень простое представление валентных или крайних электронов в молекуле.Это не объясняет геометрию молекулы, но это шаг вперед в приближении к географии.
Но чтобы выяснить, полярный ли N2 или неполярный, структура Льюиса может выявить лучший электронный состав молекулы.
Азот входит в группу 5A периодической таблицы, что означает, что его внешняя оболочка имеет пять электронов. Структура Льюиса одиночного атома азота представлена ниже.
Азот, как и большинство элементов в периодической таблице, следует правилу октетов, что означает, что ему нужно восемь электронов во внешней оболочке.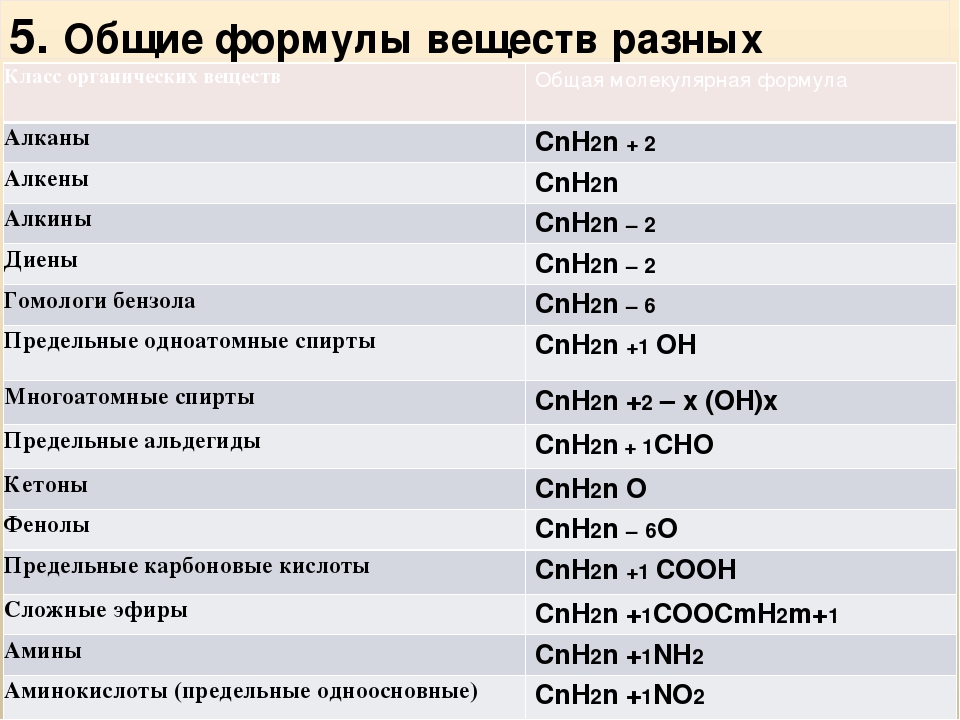
Таким образом, он будет искать другие атомы, которые также хотят выполнить правило октетов, чтобы они могли совместно использовать валентные электроны. Например, аммиак — это соединение, состоящее из одной молекулы азота и трех молекул водорода.
Цель состоит в том, чтобы создать электронные пары: наверху структуры Льюиса для атома азота уже есть пара электронов или неподеленная пара, поэтому они недоступны для связывания.
Остальные три одиночных электрона доступны для образования ковалентных связей или связей, которые разделяют электроны между двумя атомами с другими атомами, которые имеют одиночные электроны.
Водород имеет один электрон, и ему нужны только два электрона, чтобы завершить его внешнюю оболочку; таким образом, в азоте есть место для трех атомов водорода.
Как показано ниже, у азота теперь восемь электронов, окружающих его, в виде одной неподеленной пары и трех одинарных связей.
Теперь правило октетов азота выполнено, и водород имеет два электрона, необходимых для полной валентной оболочки.
Это оставляет нам структуру Льюиса аммиака, которая соответствует его молекулярной формуле Nh4.Ознакомьтесь со статьей, чтобы узнать полярность Nh4.
Теперь возьмем молекулярную формулу азота N2. Азот представляет собой двухатомную молекулу, что означает, что при стандартной температуре и давлении (1 атм при 25 ° C) атомы азота естественным образом связываются с другим атомом азота, чтобы выполнить правило октетов обоих атомов.
Азот существует в этом семействе с другими двухатомными молекулами, такими как кислород, водород и четыре галогена (фтор, хлор, йод и бром). Итак, что такое структура Льюиса N2?
Что ж, помня, что у азота пять валентных электронов, причем два из этих электронов образуют неподеленную пару, им нужно завершить правило октетов, связав свои три других свободных электрона.
Как показано на рисунке выше, один электрон от одной молекулы азота образует одинарную связь с другим электроном от другого азота.
Для того чтобы оба атома азота выполняли правило октетов, все три свободных электрона образуют связи, образуя тройную связь. Таким образом, молекула азота существует в природе с тройной связью, что делает ее низкоэнергетической и стабильной по природе.
Таким образом, молекула азота существует в природе с тройной связью, что делает ее низкоэнергетической и стабильной по природе.
Молекулярная геометрия N2
Теперь, когда мы рассмотрели структуру Льюиса, мы можем исследовать молекулярную геометрию для N2.
Обычно структуру молекулы можно предсказать по структуре Льюиса, но структура Льюиса может направить нас к теории отталкивания электронных пар валентной оболочки или теории VSEPR.
Теория
VSEPR основана на предположении, что геометрия молекулы минимизирует отталкивание электронов в валентной оболочке этого атома.
Помните, что электроны отрицательны, и, как и магниты, они будут отталкивать друг друга, если подойдут слишком близко друг к другу, создавая напряжение в молекуле.Итак, мы хотим минимизировать это напряжение.
Мы знаем, что газообразный азот существует в виде двухатомной молекулы, и структура Льюиса показывает, что только два атома участвуют в ее структуре.
Согласно теории VSEPR, N2 может принимать только линейную структуру или просто прямую линию. Это означает, что два атома разнесены под углом 180 °, как показано ниже.
Это означает, что два атома разнесены под углом 180 °, как показано ниже.
Обычно линейные молекулы неполярны, но это не всегда так (см. Соляная кислота, фтористоводородная кислота, монооксид углерода), поэтому мы не можем предполагать, что N2 неполярен только на этом основании.
Для этого нам придется немного глубже погрузиться в электронную плотность и электроотрицательность, как уже обсуждалось выше.
Для большего понимания вам также следует прочитать статью о структуре Льюиса N2, молекулярной геометрии и гибридизации.
Заключение
Азот в виде соединения чрезвычайно распространен в нашей повседневной жизни. Как двухатомная гомоядерная молекула, мы можем определить ее полярность по ее структуре, геометрии и электронной плотности.
Мы обнаружили, что газообразный азот образует прочную тройную связь, имеет линейную геометрию с углом 180 ° между атомами азота и равномерно распределяет свою электронную плотность между атомами азота.

 , не менее
, не менее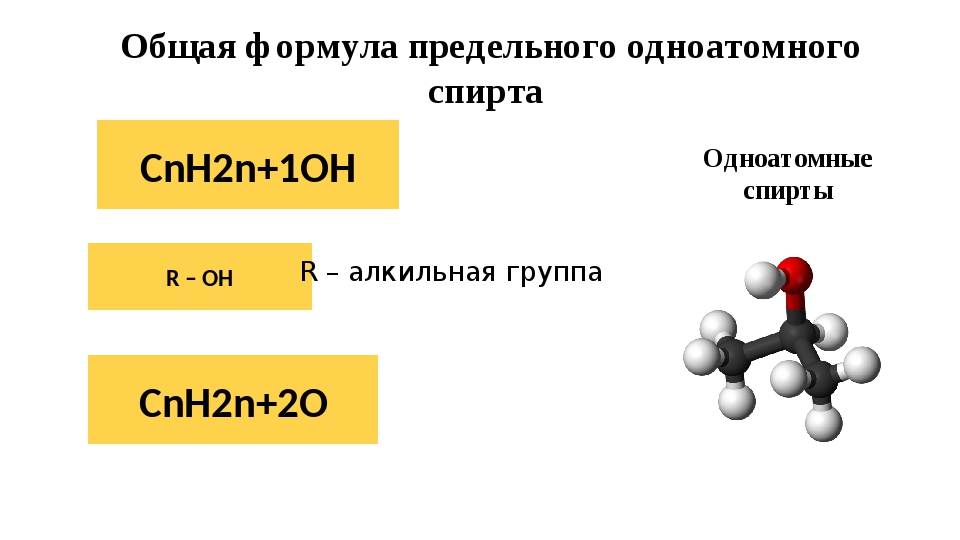 , не более
, не более Любителей примитивов наверняка порадует небольшой сэмплер «Атлантида» от компании «Совиный лес», а те, кто любит юмористические сюжеты, точно оценят серию вышитых открыток с учеными совами.
Любителей примитивов наверняка порадует небольшой сэмплер «Атлантида» от компании «Совиный лес», а те, кто любит юмористические сюжеты, точно оценят серию вышитых открыток с учеными совами. Дизайнер Наталья Орехова расскажет вам о том, как правильно продавать вышивку в Интернете. Также в этом номере вы найдете историю о том, как компания MADEIRA пришла на российский рынок, интервью с мастером Юлией Гориной и художницей Александрой Должницкой. А еще вас ждет рукодельная история о том, как оформить семейное наследие в технике картонаж, и репортаж с рукодельной выставки в Кельне.
Дизайнер Наталья Орехова расскажет вам о том, как правильно продавать вышивку в Интернете. Также в этом номере вы найдете историю о том, как компания MADEIRA пришла на российский рынок, интервью с мастером Юлией Гориной и художницей Александрой Должницкой. А еще вас ждет рукодельная история о том, как оформить семейное наследие в технике картонаж, и репортаж с рукодельной выставки в Кельне. 
 Такая динамика открывает прекрасные возможности для студентов бакалавриата. Хотя большинство студентов не знакомы с F1, они будут иметь базовое представление о гонках в целом. Кроме того, хотя большинство американцев не осознают этого, количество источников данных по F1 имеется в большом количестве во всем мире.Это создает благодатную среду, богатую данными, и дает возможность новичку легко понять окружающую среду.
Такая динамика открывает прекрасные возможности для студентов бакалавриата. Хотя большинство студентов не знакомы с F1, они будут иметь базовое представление о гонках в целом. Кроме того, хотя большинство американцев не осознают этого, количество источников данных по F1 имеется в большом количестве во всем мире.Это создает благодатную среду, богатую данными, и дает возможность новичку легко понять окружающую среду.