Содержание
На какие типы по тепловому эффекты можно разделить химические реакции?
1. Укажите основные оксиды. I.SO2; II. CaO; III. CrO; IV. CRO3; V. Al2O3; VI. FeO а) I, II B) II, III C) II, III, VI D) III, IV, V 2. Какая реакция не
…
йтрализации? A) NaOH + CO2 → NaHCO3 C) 2 KOH + CuSO4 → Cu (OH) 2+ K2SO4 Б) NaOH + HCl → NaCl + h3O D) Na2SO4 + Ba Cl2 → BaSO4 + 2NaCl 3. В каком случае дается только кислая соль? A) Na3PO4, NaHSO3 C) KHCO3, Mg (OH) Cl Б) KnaCO3, KAl (SO4) 2 D) NaHSO4, KHCO3 4.Ca CaO CaCO3 CaCl 2 + Z _CO2 Определите предмет Z. A) O2 B) CO2 C) h3 D) h3 O 5. Какое уравнение представляет собой гомогенная реакция? A) C (б) + O2 (q) → CO2 (q) B) 2 CO (q) + O2 (q) → 2CO2 (q) В) Zn (б) 2HCl (м) → ZnCl (б) + h3 (q) D) 2 NaCl + h3SO4 → NaSO42HCl (q) (б) (м) (б) 6. Между молекулами каких веществ образуются водородные связи? 1.HCL 2.HF 3.CO2 4.h3O 5.h3S 6.CO2 7. Укажите неполярный ковалентно связанный материал. A) h3O B) Nh4 C) HCl D) N2 E) CaO 8. Укажите вещество, образующее кристаллическую решетку ионного типа. A) NaCl B) HCl C) HClO3 D) Ch5 E) h3O 9. Укажите неэлектролит? A) HNO3 B) NaCl C) MgSO4 D) h3SO4 E) C6h3O6 10. Покажите краткую электронную формулу элемента с порядковым номером 16 моль. A) … 2522P4 B) …. 2522P6 C) ….. 3523P2 D) …. 3523P4 E) ….. 3523P2
A) NaCl B) HCl C) HClO3 D) Ch5 E) h3O 9. Укажите неэлектролит? A) HNO3 B) NaCl C) MgSO4 D) h3SO4 E) C6h3O6 10. Покажите краткую электронную формулу элемента с порядковым номером 16 моль. A) … 2522P4 B) …. 2522P6 C) ….. 3523P2 D) …. 3523P4 E) ….. 3523P2
ПОМОГИТЕ С К/Р ПОЖАЛУЙСТА
Допоможіть будь ласка
напишите варианты пжжжжжжж
Укажи относительно чистые источники воды:реки и озераостаточная водаподземные водысточные воды
В 300 грамм воды растворили 30 г соли. Найти массовую долю в растворе.
Найти массовые доли элементов в фосфате лития.
Кто будет списывать с других ис
…
точников, буду подавать жалобу и ваш комментарий заблокируют! Помогите пожалуйста не надо списывать то, что не подходит под вопрос!
Помогите пожалуйста срочно
Обчисліть маси розчинів з масовими частками кислоти 35% та 10%, щоб отримати 400 г розчину з масовою часткою розчиненої речовини 20%.
вкажіть розчинену речовину у розчині цукру
Помогите решить 2 задачи по химии Пж!!
ГДЗ / ответы Химия 8 класc Кузнецова Н.
 Е. §17 Сущность, признаки и условия протекания химических реакций. Тепловой эффект химической реакции » Крутые решение для вас от GDZ.cool
Е. §17 Сущность, признаки и условия протекания химических реакций. Тепловой эффект химической реакции » Крутые решение для вас от GDZ.cool
ГДЗ / ответы Химия 8 класc Кузнецова Н.Е. §17 Сущность, признаки и условия протекания химических реакций. Тепловой эффект химической реакции
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1 Что называется химической реакцией?
Химической реакцией называют превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением и свойствами.
На какие типы (по тепловому эффекту) можно разделить химические реакции?
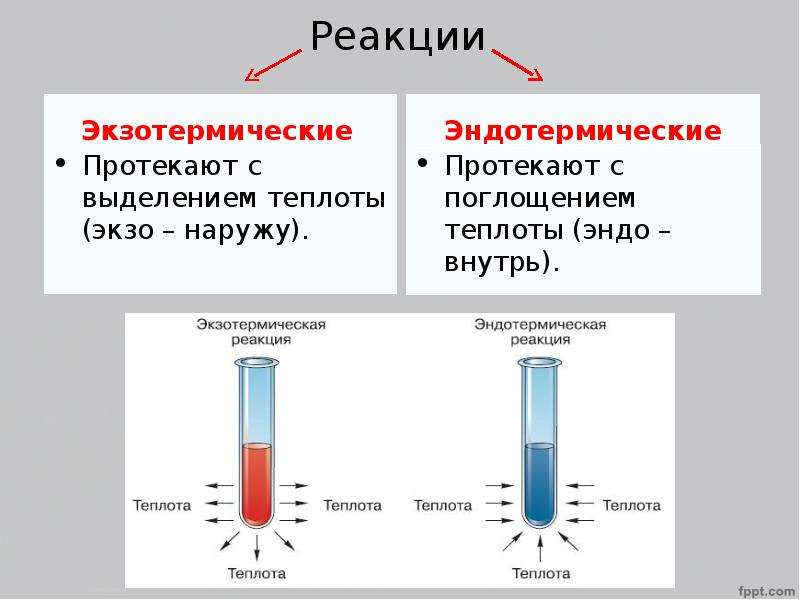
Hа экзотермические реакции (протекающие с выделением теплоты) и эндотермические реакции (протекающие с поглощением теплоты).
Задание 2 Какие признаки говорят о том, что перечисленные ниже процессы являются химическими реакциями:
а) гниение листьев;
Изменение цвета, появление запаха.
б) пригорание пищи;
Изменение цвета, появление запаха.
в) ржавление железа;
Изменение цвета.
г) окисление меди;
Изменение цвета.
д) взаимодействие известковой воды и углекислого газа;
Появление осадка.
е) скисание молока?
Появление запаха и осадка.
Задание 3 Приведите примеры протекания химических реакций, для которых характерны признаки: выделение газа, появление осадка, изменение окраски.
Примеры химических реакций с выделением газа: взаимодействие пищевой соды с уксусной кислотой; взаимодействие лимонной кислоты с накипью; разложение пероксида водорода в присутствии крови, взаимодействие щелочных металлов с водой, горение природного газа.
Примеры химических реакций с появлением осадка: взаимодействие раствора едкого натра с раствором медного купороса, взаимодействие раствора гашеной извести с углекислым газом.
Примеры химических реакций с изменением окраски: ржавление железа, чернение серебра, взаимодействие иода с раствором крахмала.
Задание 4 Изобразите схему реакции образования сероводорода из серы и водорода: H2 + S → H2S. Объясните её с точки зрения атомно-молекулярного учения.
Согласно атомно-молекулярному учению все вещества состоят из атомов, соединённых друг с другом в молекулы или другие частицы. В процессе данной реакции происходит разрушение молекулы водорода H―H, и образуются 2 атома водорода, которые соединяются с атомом серы, в результате образуется молекула сероводорода H―S―H.
Задание 4 К какому типу – экзо- или эндотермическому – относятся следующие реакции: образование воды из водорода и кислорода, самовозгорание и взрыв метана (газ который часто выделяется породой и скапливается в шахтах).
Oтносятся к экзотермическим реакциям, поскольку протекают с выделением теплоты.
|
1. 
|
Экзотермические реакции
|
1 |
|
2. |
Эндотермические реакции
|
1 |
|
3. 
|
Тепловой эффект реакций
|
2 |
|
4. |
Термохимические уравнения экзотермических реакций
|
2 |
|
5. 
|
Термохимические уравнения эндотермических реакций
|
2 |
|
6. |
Запись термохимических уравнений
|
4 |
|
7. 
|
Расчёт количества теплоты по известному тепловому эффекту
|
4 |
|
8. |
Расчёт теплового эффекта реакции по количеству выделившейся теплоты
|
4 |
|
9. 
|
Расчёт объема газа по теплоте, выделившейся в ходе реакции
|
5 |
|
10. |
Расчёт массы вещества по теплоте, выделившейся в ходе реакции
|
5 |
|
1. 
|
Экзотермические реакции |
1 вид — рецептивный |
лёгкое |
1 Б. |
Знать определение экзотермических реакций, понятие о тепловом эффекте реакции. |
|
2. |
Эндотермические реакции |
1 вид — рецептивный |
лёгкое |
1 Б. 
|
Знать определение эндотермических реакций, понятие о тепловом эффекте реакции. |
|
3. |
Тепловой эффект реакций |
2 вид — интерпретация |
среднее |
2 Б. |
Знать определение теплового эффекта реакций, условия, от которых он зависит. |
|
4. 
|
Термохимические уравнения экзотермических реакций |
2 вид — интерпретация |
среднее |
2 Б. |
Знать определение экзотермических реакций, термохимических уравнений реакций, их важнейших отличительных особенностей. |
|
5. |
Термохимические уравнения эндотермических реакций |
2 вид — интерпретация |
среднее |
2 Б. 
|
Знать определение эндотермических реакций, термохимических уравнений реакций, их важнейших отличительных особенностей. |
|
6. |
Запись термохимических уравнений |
3 вид — анализ |
сложное |
4 Б. |
Уметь анализировать запись термохимических уравнений. |
|
7. 
|
Расчёт количества теплоты по известному тепловому эффекту |
3 вид — анализ |
сложное |
4 Б. |
Уметь проводить расчёт количества теплоты по известному тепловому эффекту реакции. |
|
8. |
Расчёт теплового эффекта реакции по количеству выделившейся теплоты |
3 вид — анализ |
сложное |
4 Б. 
|
Уметь проводить расчёт теплового эффекта реакции по количеству выделившейся теплоты. |
|
9. |
Расчёт объема газа по теплоте, выделившейся в ходе реакции |
3 вид — анализ |
сложное |
5 Б. |
Уметь проводить расчёт объёма газа по теплоте, выделившейся в ходе реакции. |
|
10. 
|
Расчёт массы вещества по теплоте, выделившейся в ходе реакции |
3 вид — анализ |
сложное |
5 Б. |
Уметь проводить расчёт объёма газа по теплоте, выделившейся в ходе реакции. |
Охарактеризуйте основные типы химических реакций по их признакам. § 11, вопрос 1. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.
Предлагаю вот так написать, должно быть правильно
Химические реакции можно разделить по следующим признакам:
а) По составу исходных веществ и продуктов реакции.
1) Реакции соединения (из нескольких простых или сложных веществ образуется одно сложное)
2Са + O2 = 2СаО
Cu + Сl2 = CuCl2
2) Реакции разложения (из одного сложного вещества образуется несколько простых или сложных)
2Н2О2 = 2H2O + O2
СаСО3 = СаО + СО2
3) Реакции замещения (из простого и сложного вещества образуется простое и сложное)
Zn + СuSО4 = ZnSО4 + Cu
Mg + 2HCl = MgCl2 + H2
4) Реакции обмена (из двух сложных веществ образуется два сложных)
ВаСl2 + NаSО4 = BaSO4↓ + 2NaCl
Рb(NО3)2 + 2КСl = РbСl2↓ + 2KNO3
НNО3 + КОН = КNО3 + Н2О
б) По изменению степени окисления элементов в ходе реакции.
1) Окислительно-восстановительные реакции.
8НNО3 + 3Cu = 3Сu(NО3)2 + 2NO + 4Н2О
2Аl + 6НСl = 2AlCl3 + 3Н2
2) Реакции, в которых степень окисления не изменяется.
2НСl + Са(ОН)2 = СаСl2 + 2Н2О
Na2CO3 + Ва(ОН)2 = ВаСО3↓ + 2NaOH
в) По обратимости.
1) Обратимые (равновесные) реакции.
2) Необратимые реакции.
4Mg + 5Н2SО4 = 4MgSО4 + H2S + 4Н2О
НNО3 + КОН = КNО3 + Н2О
г) По тепловому эффекту.
1) Экзотермические реакции (протекающие с выделением
тепла)
2Н2 + О2 = 2Н2О + Q
СН4 + 2О2 = СО2 + 2Н2О + Q
2) Эндотермические реакции (протекающие с поглощением
тепла).
Cu(ОH)2 = CuО + Н2О – Q
H2S = H2 + S – Q
Классификация химических реакций
Химические реакции следует отличать от ядерных реакций. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например превращение алюминия в магний:
2713Аl + 11Н = 2412Мg + 42Не
Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Реакции, идущие без изменения состава веществ.
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
С (графит) ↔ С (алмаз)
S (ромбическая) ↔ S (моноклинная)
Р (белый) ↔ Р (красный)
Sn (белое олово) ↔ Sn (серое олово)
3O2 (кислород) ↔ 2O3 (озон)
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, так как углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
CH3— CH2— С= — СН ↔ СН3— С= — С- СН3
этилацетилен диметнлацетилен
4. Изомеризация галогеналканов (А. Е. Фаворский, 1907 г.).
5. Изомеризация цианита аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1828 г. изомеризацией цианата аммония при нагревании.
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения
— это такие реакции, при которых из двух и более веществ образуется одно сложное вещество
В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы:
1. Получение оксида серы (IV):
S + O2 = SO — из двух простых веществ образуется одно сложное.
2. Получение оксида серы (VI):
SO2 + 02 → 2SO3 — из простого и сложного веществ образуется одно сложное.
3. Получение серной кислоты:
SO3 + Н2O = Н2SO4 — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
4NО2 + O2 + 2Н2O = 4НNO3
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1. Реакция гидрирования — присоединения водорода:
CH2=CH2 + Н2 → Н3-СН3
этен → этан
2. Реакция гидратации — присоединения воды.
3. Реакция полимеризации.
2. Реакции разложения
— это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами:
1. Разложение оксида ртути(II) — из одного сложного вещества образуются два простых.
2. Разложение нитрата калия — из одного сложного вещества образуются одно простое и одно сложное.
3. Разложение перманганата калия — из одного сложного вещества образуются два сложных и одно простое, то есть три новых вещества.
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности:
1. Реакция дегидратации (отщепления воды) этанола:
С2H5OH → CH2=CH2 + H2O
2. Реакция дегидрирования (отщепление водорода) этана:
CH3-CH3 → CH2=CH2 + H2
или СН3-СН3 → 2С + ЗН2
3. Реакция крекинга (расщепления) пропана:
CH3-СН2-СН3 → СН2=СН2 + СН4
3. Реакции замещения
Реакции замещения
— это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1. Взаимодействие щелочных или щелочноземельных металлов с водой:
2Na + 2Н2O = 2NаОН + Н2
2. Взаимодействие металлов с кислотами в растворе:
Zn + 2НСl = ZnСl2 + Н2
3. Взаимодействие металлов с солями в растворе:
Fе + СuSO4 = FеSO4 + Сu
4. Металлотермия:
2Аl + Сr2O3 → Аl2O3 + 2Сr
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена. Другой пример — бромирование ароматического соединения (бензола, толуола, анилина).
FеВr3
С6Н6 + Вr2 → С6Н5Вr + НВr
бензол → бромбензол
Обратим внимание на особенность реакции замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещество, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола. Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена
— это такие реакции, при которых два сложных вещества обмениваются своими составными частями
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2O).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1. Реакция нейтрализации, идущая с образованием соли и воды.
2. Реакция между щелочью и солью, идущая с образованием газа.
3. Реакция между щелочью и солью, идущая с образованием осадка:
СuSO4 + 2КОН = Сu(ОН)2 + К2SO4
или в ионном виде:
Сu2+ + 2OН— = Сu(ОН)2
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1. Реакция, идущая с образованием слабого электролита — Н2O:
СН3СООН + NаОН → Nа(СН3СОО) + Н2O
2. Реакция, идущая с образованием газа:
2СН3СООН + СаСO3 → 2СН3СОО + Са2+ + СO2 + Н2O
3. Реакция, идущая с образованием осадка:
2СН3СООН + К2SO3 → 2К(СН3СОО) + Н2SO3
или
2СН3СООН +SiO → 2СН3СОО + Н2SiO3
По этому признаку различают следующие реакции:
1. Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1. Mg0 + H+2SO4 = Mg+2SO4 + H2↑
2. 2Mg0 + O02 = Mg+2O-2
Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса.
2KMn+7O4 + 16HCl— = 2KCl— + 2Mn+2Cl—2 + 5Cl02↑ + 8H2O
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов.
1. Они восстанавливаются в соответствующие спирты:
Альдекиды окисляются в соответствующие кислоты:
2. Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, многие реакции разложения, реакции этерификации:
НСООН + CHgOH = НСООСН3 + H2O
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1. Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота(II) из азота и кислорода и реакция газообразного водорода с твердым иодом.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения. Гидрирование этилена — пример экзотермической реакции. Она идет при комнатной температуре.
2. Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
1. Обжиг известняка
2. Крекинг бутана
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением:
Н2(г) + С12(г) = 2НС1(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) — 90,4 кДж
По агрегатному состоянию реагирующих веществ различают:
1. Гетерогенные реакции
— реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах).
2. Гомогенные реакции
— реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе).
По участию катализатора различают:
1. Некаталитические реакции, идущие без участия катализатора.
2. Каталитические реакции
, идущие с участием катализатора. Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным. Следует отметить, что более 70% химических производств используют катализаторы.
По направлению различают:
1. Необратимые реакции протекают в данных условиях только в одном направлении. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
2. Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия — антонимы процессов:
• гидрирование — дегидрирование,
• гидратация — дегидратация,
• полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма — обмена веществ.
1. Радикальные реакции идут между образующимися в ходе реакции радикалами и молекулами.
Как вы уже знаете, при всех реакциях происходит разрыв старых и образование новых химических связей. Способ разрыва связи в молекулах исходного вещества определяет механизм (путь) реакции. Если вещество образовано за счет ковалентной связи, то могут быть два способа разрыва этой связи: гемолитический и гетеролитический. Например, для молекул Сl2, СН4 и т. д. реализуется гемолитический разрыв связей, он приведет к образованию частиц с неспаренными электронами, то есть свободных радикалов.
Радикалы чаще всего образуются, когда разрываются связи, при которых общие электронные пары распределены между атомами примерно одинаково (неполярная ковалентная связь), однако многие полярные связи также могут разрываться подобным же образом, в частности тогда, когда реакция проходит в газовой фазе и под действием света, как, например, в случае рассмотренных выше процессов — взаимодействия С12 и СН4—. Радикалы очень реакционноспособны, так как стремятся завершить свой электронный слой, забрав электрон у другого атома или молекулы. Например, когда радикал хлора сталкивается с молекулой водорода, то он вызывает разрыв общей электронной пары, связывающей атомы водорода, и образует ковалентную связь с одним из атомов водорода. Второй атом водорода, став радикалом, образует общую электронную пару с неспаренным электроном атома хлора из разрушающейся молекулы Сl2, в результате чего возникает радикал хлора, который атакует новую молекулу водорода и т. д
Реакции, представляющие собой цепь последовательных превращений, называют цепными реакциями.
За разработку теории цепных реакций два выдающихся химика — наш соотечественник Н. Н. Семенов и англичанин С. А. Хиншелвуд были удостоены Нобелевской премии.
Аналогично протекает и реакция замещения между хлором и метаном:
По радикальному механизму протекают большинство реакций горения органических и неорганических веществ, синтез воды, аммиака, полимеризация этилена, винилхлорида и др.
Типичные ионные реакции — это взаимодействие между электролитами в растворе. Ионы образуются не только при диссоциации электролитов в растворах, но и под действием электрических разрядов, нагревания или излучений. γ-Лучи, например, превращают молекулы воды и метана в молекулярные ионы.
По другому ионному механизму происходят реакции присоединения к алкенам галогеноводородов, водорода, галогенов, окисление и дегидратация спиртов, замещение спиртового гидроксила на галоген; реакции, характеризующие свойства альдегидов и кислот. Ионы в этом случае образуются при гетеролитическом разрыве ковалентных полярных связей.
инициирующей реакцию, различают:
1. Фотохимические реакции. Их инициирует световая энергия. Кроме рассмотренных выше фотохимических процессов синтеза НСl или реакции метана с хлором, к ним можно отнести получение озона в тропосфере как вторичного загрязнителя атмосферы. В роли первичного в этом случае выступает оксид азота(IV), который под действием света образует радикалы кислорода. Эти радикалы взаимодействуют с молекулами кислорода, в результате чего получается озон.
Образование озона идет все время, пока достаточно света, так как NO может взаимодействовать с молекулами кислорода с образованием того же NO2. Накопление озона и других вторичных загрязнителей атмосферы может привести к появлению фотохимического смога.
К этому виду реакций принадлежит и важнейший процесс, протекающий в растительных клетках, — фотосинтез, название которого говорит само за себя.
2. Радиационные реакции.
Они инициируются излучениями большой энергии — рентгеновскими лучами, ядерными излучениями (γ-лучами, а-частицами — Не2+ и др.). С помощью радиационных реакций проводят очень быструю радиополимеризацию, радиолиз (радиационное разложение) и т. д.
Например, вместо двухстадийного получения фенола из бензола его можно получать взаимодействием бензола с водой под действием радиационных излучений. При этом из молекул воды образуются радикалы [•OН] и [•H•], с которыми и реагирует бензол с образованием фенола:
С6Н6 + 2[ОН] → С6Н5ОН + Н2O
Вулканизация каучука может быть проведена без серы с использованием радиовулканизации, и полученная резина будет ничуть не хуже традиционной.
3. Электрохимические реакции. Их инициирует электрический ток. Помимо хорошо известных вам реакций электролиза укажем также реакции электросинтеза, например, реакции промышленного получения неорганических окислителей
4. Термохимические реакции. Их инициирует тепловая энергия. К ним относятся все эндотермические реакции и множество экзотермических реакций, для начала которых необходима первоначальная подача теплоты, то есть инициирование процесса.
Рассмотренная выше классификация химических реакций отражена на схеме.
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам. Например, составим характеристику процесса синтеза аммиака.
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гетерогенная (точнее, гетерогенно-каталитическая), протекающая с уменьшением давления в системе. Для успешного управления процессом необходимо учитывать все приведенные сведения. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки.
Классификация неорганических и органических реакций. А19. Классификация химических реакций в неорганической и органической химии. Классификация химических реакций по механизмам
ОПРЕДЕЛЕНИЕ
Химическими реакция
называют превращения веществ, в которых происходит изменение их состава и (или) строения.
Наиболее часто под химическими реакциями
понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы,
число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения,
а формулы продуктов – в правой. Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ
целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается
соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения
из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой
химической реакции будет выглядеть следующим образом:
Например:
СаСО 3 + СО 2 + Н 2 О = Са(НСО 3) 2
SO 3 + H 2 O = H 2 SO 4
2Mg + O 2 = 2MgO.
2FеСl 2 + Сl 2 = 2FеСl 3
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции
чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция
соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения
. В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
Например:
CaCO 3 CaO + CO 2 (1)
2H 2 O =2H 2 + O 2 (2)
CuSO 4 × 5H 2 O = CuSO 4 + 5H 2 O (3)
Cu(OH) 2 = CuO + H 2 O (4)
H 2 SiO 3 = SiO 2 + H 2 O (5)
2SO 3 =2SO 2 + O 2 (6)
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 +4H 2 O (7)
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
С 18 H 38 = С 9 H 18 + С 9 H 20 (8)
C 4 H 10 = C 4 H 6 + 2H 2 (9)
При реакциях замещения
простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение
химической реакции замещения будет выглядеть следующим образом:
Например:
2Аl + Fe 2 O 3 = 2Fе + Аl 2 О 3 (1)
Zn + 2НСl = ZnСl 2 + Н 2 (2)
2КВr + Сl 2 = 2КСl + Вr 2 (3)
2КСlO 3 + l 2 = 2KlO 3 + Сl 2 (4)
СаСО 3 + SiO 2 = СаSiO 3 + СО 2 (5)
Са 3 (РО 4) 2 + ЗSiO 2 = ЗСаSiO 3 + Р 2 О 5 (6)
СН 4 + Сl 2 = СН 3 Сl + НСl (7)
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Реакциями обмена
называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с
участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
АВ + СD = АD + СВ
Например:
CuO + 2HCl = CuCl 2 + H 2 O (1)
NaOH + HCl = NaCl + H 2 O (2)
NаНСО 3 + НСl = NаСl + Н 2 О + СО 2 (3)
AgNО 3 + КВr = АgВr ↓ + КNО 3 (4)
СrСl 3 + ЗNаОН = Сr(ОН) 3 ↓+ ЗNаСl (5)
Реакции обмена не являются окислительно-восстановительными. Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на
окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO 2 = 2MgO + C (1)
Mg 0 – 2e = Mg 2+ (восстановитель)
С 4+ + 4e = C 0 (окислитель)
FeS 2 + 8HNO 3 (конц) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O (2)
Fe 2+ -e = Fe 3+ (восстановитель)
N 5+ +3e = N 2+ (окислитель)
AgNO 3 +HCl = AgCl ↓ + HNO 3 (3)
Ca(OH) 2 + H 2 SO 4 = CaSO 4 ↓ + H 2 O (4)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и
эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
N 2 + 3H 2 = 2NH 3 +46,2 кДж (1)
2Mg + O 2 = 2MgO + 602, 5 кДж (2)
N 2 + O 2 = 2NO – 90,4 кДж (3)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в
которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с
образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
А + В ↔ АВ
Например:
СН 3 СООН + С 2 Н 5 ОН↔ Н 3 СООС 2 Н 5 + Н 2 О
Примерами необратимых реакций может служить следующие реакции:
2КСlО 3 → 2КСl + ЗО 2
С 6 Н 12 О 6 + 6О 2 → 6СО 2 + 6Н 2 О
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего
соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание
некоторых реакций вообще невозможно без присутствия катализатора:
2H 2 O 2 = 2H 2 O + O 2 (катализатор MnO 2)
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF 2 + H 2 O, где Ме – металл.
Примеры решения задач
ПРИМЕР 1
Химические свойства веществ выявляются в разнообразных химических реакциях.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями
. Часто встречается и такое определение: химической реакцией
называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются посредством химических уравнений и схем, содержащих формулы исходных веществ и продуктов реакции. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части — веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т.д.), это указывается соответствующим символом, как правило, над (или «под») знаком равенства.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки.
В качестве классификационных признаков
могут быть выбраны следующие:
1.
Число и состав исходных веществ и продуктов реакции.
2.
Агрегатное состояние реагентов и продуктов реакции.
3.
Число фаз, в которых находятся участники реакции.
4.
Природа переносимых частиц.
5.
Возможность протекания реакции в прямом и обратном направлении.
6.
Знак теплового эффекта разделяет все реакции на: экзотермические
реакции, протекающие с экзо
-эффектом — выделение энергии в форме теплоты (Q>0, ∆H
С +О 2 = СО 2 + Q
и эндотермические
реакции, протекающие с эндо
-эффектом — поглощением энергии в форме теплоты (Q0):
N 2 +О 2 = 2NО — Q.
Такие реакции относят к термохимическим
.
Рассмотрим более подробно каждый из типов реакций.
Классификация по числу и составу реагентов и конечных веществ
1. Реакции соединения
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО 3 + СО 2 + Н 2 О = Са(НСО 3) 2 ,
так и относиться к числу окислительно-восстановительных:
2FеСl 2 + Сl 2 = 2FеСl 3 .
2. Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
| t o | ||
| 4HNO 3 | = | 2H 2 O + 4NO 2 O + O 2 O. |
2AgNO 3 = 2Ag + 2NO 2 + O 2 ,
(NH 4)2Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.
Реакции разложения в органической химии носят название крекинга
:
С 18 H 38 = С 9 H 18 + С 9 H 20 ,
или дегидрирования
C 4 H 10 = C 4 H 6 + 2H 2 .
3. Реакции замещения
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe 2 O 3 = 2Fе + Аl 2 О 3 ,
Zn + 2НСl = ZnСl 2 + Н 2 ,
2КВr + Сl 2 = 2КСl + Вr 2 ,
2КСlO 3 + l 2 = 2KlO 3 + Сl 2 .
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО 3 + SiO 2 = СаSiO 3 + СО 2 ,
Са 3 (РО 4) 2 + ЗSiO 2 = ЗСаSiO 3 + Р 2 О 5 ,
Иногда эти реакции рассматривают как реакции обмена
:
СН 4 + Сl 2 = СН 3 Сl + НСl.
4. Реакции обмена
Реакциями обмена
называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами — оксидами, основаниями, кислотами и солями:
ZnO + Н 2 SО 4 = ZnSО 4 + Н 2 О,
AgNО 3 + КВr = АgВr + КNО 3 ,
СrСl 3 + ЗNаОН = Сr(ОН) 3 + ЗNаСl.
Частный случай этих реакций обмена — реакции нейтрализации
:
НСl + КОН = КСl + Н 2 О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО 3 + НСl = NаСl + Н 2 О + СО 2 ,
Са(НСО 3) 2 + Са(ОН) 2 = 2СаСО 3 ↓ + 2Н 2 О,
СН 3 СООNа + Н 3 РО 4 = СН 3 СООН + NаН 2 РО 4 .
5. Реакции переноса.
При реакциях переноса атом или группа атомов переходит от одной структурной единицы к другой:
АВ + ВС = А + В 2 С,
А 2 В + 2СВ 2 = АСВ 2 +АСВ 3 .
Например:
2AgCl + SnCl 2 = 2Ag + SnCl 4 ,
H 2 O + 2NO 2 = HNO 2 + HNO 3 .
Классификация реакций по фазовым признакам
В зависимости от агрегатного состояния реагирующих веществ различают следующие реакции:
1. Газовые реакции
2. Реакции в растворах
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н 2 О(ж)
3. Реакции между твердыми веществами
| t o | ||
| СаО(тв) +SiO 2 (тв) | = | СаSiO 3 (тв) |
Классификация реакций по числу фаз.
Под фазой
понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Все многообразие реакций с этой точки зрения можно разделить на два класса:
1.Гомогенные (однофазные) реакции.
К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах.
2.Гетерогенные (многофазные) реакции.
К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO 2 (г) + NaOH(p-p) = NaHCO 3 (p-p).
газотвердофазные реакции
СO 2 (г) + СаО(тв) = СаСO 3 (тв).
жидкотвердофазные реакции
Na 2 SO 4 (р-р) + ВаСl 3 (р-р) = ВаSО 4 (тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО 3) 2 (р-р) + Н 2 SО 4 (р-р) = СО 2 (r) +Н 2 О(ж) + СаSО 4 (тв)↓.
Классификация реакций по типу переносимых частиц
1. Протолитические реакции.
К протолитическим реакциям
относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием — вещество, способное присоединять протон, например:
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H + → Zn 2 + + H 2 ,
FeS 2 + 8HNO 3 (конц) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
3. Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO 3) 2 + 4NH 3 = (NO 3) 2 ,
Fe + 5CO = ,
Al(OH) 3 + NaOH = .
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
Обратимые и необратимые химические реакции
Обратимыми
называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом:
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например:
СН 3 СООН + С 2 Н 5 ОН СН 3 СООС 2 Н 5 + Н 2 О.
Необратимыми
называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО 3 → 2КСl + ЗО 2 ,
или окисление глюкозы кислородом воздуха:
С 6 Н 12 О 6 + 6О 2 → 6СО 2 + 6Н 2 О.
Урок 114
Тема учебного занятия
:
Классификация химических реакций в органической и неорганической химии.
Продолжительность:
45 мин
Цель урока:
Повторить и обобщить представление о химической реакции, как о процессе превращения, рассмотреть некоторые из многочисленных классификаций химических реакций по различным признакам.
Задачи урока:
1)
Образовательная
– систематизировать, обобщить и углубить знания учащихся о химических реакциях и их классификации, развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, указывать типы реакций, делать выводы и обобщения.
2)
Развивающая
– развивать речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
3)
Воспитательная
– воспитание самостоятельности, сотрудничества, нравственных качеств – коллективизма, способности к взаимовыручке.
Средства обучения:
Учебник О.С. Габриелян. Химия – 10, 11. М.: Дрофа 2008г.; таблицы растворимости, Периодической системы химических элементов Д.И. Менделеева, компьютер,
Методы:
— Организация УПД:
беседа, объяснение
Контроль:
фронтальный опрос, минисамостоятельные работы на закрепление.
Тип урока:
Повторение, закрепление и систематизация знаний полученных ранее.
Форма урока:
Этапы урока:
1. Организационная часть:
Цель
– подготовить обучащихся к началу работы на уроке.
2. Подготовка к восприятию ранее изученной темы.
Цель
– актуализация ранее полученных знаний через восстановление опорных знаний – целепологание.
3. Повторение и закрепление ранее изученного материала.
Цель
– повторение, закрепление и систематизация знаний ранее полученных.
4. Подведение итогов, оценка деятельности обучащихся, домашнее задание.
Цель
– анализ, самоанализ, применение теоретических знаний обучащихся на практике.
План работы:
Организационный момент……………………………………………………….2 мин
Мотивация…………………………………………………………………………3 мин
Изучение материалов……………………………………………………………30 мин
Закрепление …………………………………………………………………..…..5 мин
Выводы ……………………………………………………………………….……3 мин
Домашнее задание ………………………………………………………….….…2 мин
Ход учебного занятия
Приветствие, учет посещаемости
Организация внимания студентов
Подготовка к уроку
Мотивация
Обучащимся задаются вопросы.
1)Что такое химическая реакция?
(термин «реакция» с латыни означает «противодействие», «отпор», «ответное действие»).
2)Признаки химических реакций?
а) Изменение окраски. б) Появление запаха. в) Образования осадка. г) Выделение газа. д) Выделение или поглощение тепла. е) Выделение света.
3)А каковы же условия возникновения и течения химических реакций?
а) Нагревание. б) Измельчение и перемешивание. в) Растворение. г) Добавление катализатора. д) Давление.
Преподаватель благодарит обучащихся за ответы.
Формирования интереса к материалу занятия студентов
Запись темы урока в тетрадь
Изучение нового материала
Без химических реакций невозможна жизнь. В окружающем нас мире протекает огромное число реакций. Чтобы ориентироваться в огромном царстве химических реакций необходимо знать их типы. В любой науке применяется приём классификаций, позволяющих по общим признакам разделить всё множество объектов на группы. И сегодня на уроке мы поговорим о типах химических реакций и по каким при
знакам их классифицируют. ПРИЛОЖЕНИЕ 1
1 признак химической реакции:
«Число и состав исходных и полученных веществ».
Определить какое вещество пропущено, уровнять химическую реакцию, определить тип химической реакции?
а)
2
КОН +
Н2
SO
4
=
K
2
SO
4 +
2
H
2
O
обмен
б) С2Н2 + Н2О =
СН3СОН
соединение
в)
2
Na
+
2
HCI
=
2
NaCI
+
H
2
замещение
г) СН4 = С +
2 Н2
разложение
2 признак химической реакции:
«Изменение степени окисления».
Уровнять предложенную реакцию с помощью электронного баланса и указать окислитель и восстановитель
. Н2
S
+
8
HNO
3 =
H
2
SO
4 +
8
NO
2 +
4
H
2
O
ОВР
S
– восстановитель;
N
– окислитель. Н2О + СО2 = Н2СО3
не ОВР
3 признак химической реакции:
«Тепловой эффект».
Определить, какая из предложенных реакций является экзотермической?
1) СН4 + 2 О2 = СО2 + 2 Н2О
+
Q
экзотермическая
2) 2
HgO
= 2
Hg
+
O
2
—
Q
эндотермическая
4 признак химической реакции:
«Агрегатное состояние веществ».
Определить тип химической реакции по агрегатному состоянию веществ.
1) 3
C
2
H
2 =
C
6
H
6
гетерогенная
2)
Zn
+
S
=
ZnS
гомогенная
5 признак химической реакции:
«Введение других веществ».
Определить среди предложенных реакций каталитическую?
а)
N
2 + 3
H
2 = 2
NH
3
каталитическая
б) СН4 + 2 О2 = СО2 + 2 Н2О
некаталитическая
6 признак химической реакции:
«Обратимость».
Определить среди предложенных: какая обратимая, т.е. идущая в двух направлениях, а какая необратимая, идущая до конца. а) С2Н2 + Н2 = С2Н4
обратимая
б) 2
Na
+ 2
H
2
O
= 2
NaOH
+
H
2
необратимая
Обучащиеся работают с реакциями по 6 признакам и вносят результаты в таблицу, заранее выданную для каждого
(приложение
2
).
4. Применение химических реакций в строительстве (сообщения обучающихся)
Объяснение преподавателя. Демонстрация слайдов
Прослушивание объяснения преподавателя, просмотр слайдов. Запись в тетрадь определения.
Закрепление
Обучащиеся на чистых листочках выполняют дифференцированное задание
(приложение 3).
Организация работы студентов. Контроль
Выполнение задания в тетради.
Выводы и итоги урока
Обучащимся задаются вопросы:
1
) О каком явлении мы сегодня вели речь? 2) С какими понятиями мы сегодня работали?
3) Какие умения на уроке применяли?
4)Достигли ли мы задач, поставленных в начале урока?
Оценка деятельности студентов на уроке
Самооценка оценки деятельности на уроке
Домашнее задание
У
В. Маяковского
есть такая философская мысль:
Если звёзды зажигаются в небе,
значит, это кому-нибудь нужно.
Если химики изучают классификацию химических реакций, то, следовательно, это кому – то нужно. И здесь у меня возникает желание предложить вам небольшой
реферат
, в котором на примерах нужно показать значение всех типов реакций в реальной жизни, в её богатстве и разнообразии
(творческое домашнее задание).
ПРИЛОЖЕНИЕ 1
Химические реакции, или химические явления, – это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Рассмотрим классификацию химических реакций по различным признакам.
I. По числу и составу реагирующих веществ
Реакции, идущие без изменения состава веществ
В неорганической химии к таким реакциям можно отнести процессы получения одного химического элемента, например:
C (графит)
C (алмаз)
P (белый)
P (красный)
3O2 (кислород)
2O3 (озон)
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
Изомеризация .
Реакция изомеризации алканов имеет большое практическое значение, так как углеводороды изостроения обладают меньшей способностью к детонации.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций:
соединения, разложения, замещения и обмена.
Реакции соединения
– это такие реакции, при которых из двух и более веществ образуется одно сложное вещество. В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы:
Получение оксида серы (IV):
S + O2 = SO2 – из двух простых веществ образуется одно сложное.
Получение оксида серы (VI):
2SO2 + O2
2SO3
– из простого и сложного веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
4NO2 + О2 + 2Н2O = 4HNO3
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
Реакция гидрирования – присоединения водорода:
Реакции разложения
– это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами:
Разложение оксида ртути (II):
2HgO
2Hg + O2
– из одного сложного вещества образуются два простых.
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности:
Реакция дегидратации (отщепления воды) этанола:
Реакция дегидрирования (отщепление водорода) этана:
Реакции замещения
– это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе. B неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
Взаимодействие щелочных или щелочноземельных металлов с водой:
2Na + 2h3O = 2NaOH + h3
Взаимодействие металлов с кислотами в растворе:
Zn + 2HCl = ZnCl2 + h3
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, – способность его атомов водорода замещаться на атомы галогена:
Ch4Cl
HCl
хлорметан
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола:
+ HNO3
C6H5NO2
h3O
бензол
нитробензол
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
Реакции обмена
– это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2О).
B неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
Реакция нейтрализации, идущая с образованием соли и воды:
NaOH + HNO3 = NaNO3 + Н2O
или в ионном виде:
OH– + H+ = h3O
Реакция между щелочью и солью, идущая с образованием газа:
2Nh5Cl + Са(ОН)2 = CaCl2 + 2Nh4 + 2Н2O
B органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты: Реакция, идущая с образованием слабого электролита – h3O:
Na(Ch4COO) + h3O
Реакция, идущая с образованием газа:
2Ch4COOH + CaCO3 → 2Ch4COO– + Ca2+ + CO2 + h3O
Реакция, идущая с образованием осадка:
2Ch4COOH + K2SiO3 → 2K(Ch4COO) + h3SiO3↓
II. По изменению степеней окисления химических элементов, образующих вещества
По этому признаку различают следующие реакции:
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции. К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, например:
Li
2
O
+
Н
2
O = 2LiOH
,
многие реакции разложения:
Fe
2
O
3
+
3H
2
O
реакции этерификации:
HCOOH
+
CH
3
OH
HCOOCH
3
+
H
2
O
III. По тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1.Экзотермические реакции
протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
N
2
+
O
2
= 2
NO
–
Q
Экзотермические реакции, которые протекают с выделением света, относят к
реакциям горения
, например:
4P
+
5O
2
=
2P
2
O
5
+
Q
Гидрирование этилена – пример экзотермической реакции:
CH
3
–CH
3
+
Q
Она идет при комнатной температуре.
2.Эндотермические реакции
протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
Обжиг известняка:
CaO
+
CO
2
–
Q
Количество выделенной или поглощенной в результате реакции
энергии называют
тепловым эффектом реакции
, а уравнение химической реакции с указанием этого эффекта называют
термохимическим уравнением
, например:
H
2
(г)
+
Cl
2
(г) = 2HCl(г)
+
92,3 кДж
N
2
(г)
+
O
2
(г) = 2NO(г)
–
90,4 кДж
IV. По агрегатному состоянию реагирующих веществ (фазовому составу)
По агрегатному состоянию реагирующих веществ различают:
Гетерогенные реакции
– реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
2Al(т)
+
3CuCl
2
(р-p) = 3Cu(т)
+
2AlCl3(р-p)
CaC
2
(т)
+
2H
2
O(ж) = C
2
H
2
+
Ca(OH)
2
(р-p)
Гомогенные реакции
– реакции, в которых реагирующие вещества и
продукты реакции
находятся в одном агрегатном состоянии (в одной фазе):
H
2
(г)
+
F
2
(г)
=
2HF(г)
V. По участию катализатора
По участию катализатора различают:
Некаталитические реакции
, идущие без участия катализатора:
2Hg
+
O
2
2.
Каталитические реакции
, идущие с участием катализатора:
C
2
H
5
OH
CH
2
=CH
2
+
H
2
O
Этанол
этен
Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы –
, все они относятся к каталитическим или, точнее, ферментативным. Следует отметить, что более 70 % химических производств используют катализаторы.
VI. По направлению
По направлению различают:
Необратимые реакции
протекают в данных условиях только в одном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
Обратимые реакции
в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия – антонимы процессов:
гидрирование – дегидрирование,
гидратация – дегидратация,
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит
название
гидролиза
Рисунок 1.
Классификация химических реакций
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам. Например, составим характеристику процесса синтеза аммиака:
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гетерогенная (точнее, гетерогенно-каталитическая), протекающая с уменьшением давления в системе. Для успешного управления процессом необходимо учитывать все приведенные сведения. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки.
Приложение 2
Классификация реакций
Тип реакции
Пример
не сопровождаются изменением состава
Аллотропные модификации
C (графит)
C (алмаз)
с изменением состава веществ
с выделением или поглощением тепла
С изменением степени окисления
По направлению
По изменению фазового состава
По использованию катализатора
Приложение 3
Запишите термохимическое уравнение реакции горения метана, если известно, что при сгорании 5,6 л этого газа (н. у.) выделяется 225 кДж теплоты.
При соединении 18 г алюминия в кислороде выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Классификация
химических реакций
Реферат по
химии ученика 11 класса средней шк.№ 653 Николаева Алексея
В качестве классификационных признаков могут быть
выбраны следующие:
1.
Число и состав исходных веществ и продуктов реакции.
2.
Агрегатное состояние реагентов и продуктов реакции.
3.
Число фаз, в которых находятся участники реакции.
4.
Природа переносимых частиц.
5.
Возможность протекания реакции в прямом и обратном
направлении.
6.
Тепловой эффект.
7. Явление катализа.
Классификация
по числу и составу исходных веществ и продуктов реакции.
Реакции
соединения.
При реакциях соединения из
нескольких реагирующих веществ относительно простого состава получается одно
вещество более сложного состава:
A + B + C = D
Как правило, эти реакции
сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и
менее богатых энергией соединений.
Неорганическая
химия.
Реакции соединения простых
веществ всегда носят окислительно-восстановительный характер. Реакции
соединения, протекающие между сложными веществами, могут происходить как без
изменения валентности:
СаСО 3 + СО 2
+ Н 2 О = Са(НСО 3) 2 ,
так и относиться к числу
окислительно-восстановительных:
2FеСl 2 + Сl 2
= 2FеСl 3 .
Органическая
химия.
В органической химии такие
реакции часто называют реакциями присоединения. В них обычно участвуют
соединения, содержащие двойную или тройную связь. Разновидности реакций
присоединения: гидрирование, гидратация, гидрогалогенирование, полимеризация.
Примеры данных реакций:
T o
Н 2 С = СН 2
+ Н 2 → CН 3 – СН 3
этилен этан
T o
HC=CH + HCl → H 2 C=CHCl
ацетилен хлорвинил
T o
n
СН 2 =СН 2 →
(-СН 2 -СН 2 -)n
Этилен полиэтилен
Реакции
разложения.
Реакции разложения приводят к
образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного
вещества могут быть как простые, так и сложные вещества.
Неорганическая
химия.
Из реакций разложения,
протекающих без изменения валентных состояний, следует отметить разложение
кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
t o | ||
CuSO 4 5H 2 O | CuSO 4 + 5H 2 O |
t o | ||
4HNO 3 | 2H 2 O + 4NO 2 O |
2AgNO 3 = 2Ag + 2NO 2 + O 2 ,
(NH 4)2Cr 2 O 7 = Cr 2 O 3
+ N 2 + 4H 2 O.
Органическая
химия.
В органической химии к реакциям
разложения относятся: дегидратация, дегидрирование» крекинг,
дегидрогалогенирование, а также реакции деполимеризации, когда из полимера
образуется исходный мономер. Соответствующие уравнения реакций:
T o
С 2 Н 5 ОН
→ C 2 H 4 + Н 2 O
T o
С 6 Н 14
→ С 6 Н 6 + 4Н 2
гексан бензол
C 8 H 18
→ C 4 H 10 + C 4 H 8
Октан бутан бутен
C 2 H5Br → C 2 H 4 +
НВг
бромэтан этилен
(-СН 2 – СН = С — СН 2
-)n → n СН 2 = СН – С =
СН 2
\СНз \ СНз
природный каучук 2-метилбутадиен-1,3
Реакции
замещения.
При реакциях замещения обычно
простое вещество взаимодействует со сложным, образуя другое простое вещество и
другое сложное:
А + ВС = АВ + С.
Неорганическая
химия.
Эти реакции в подавляющем
большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe 2 O 3
= 2Fе + Аl 2 О 3
Zn + 2НСl = ZnСl 2 + Н 2
2КВr + Сl 2 = 2КСl +
Вr 2
2
КС
lO 3 + l 2 =
2KlO 3 +
С
l 2 .
Примеры реакций замещения, не
сопровождающихся изменением валентных состояний атомов, крайне немногочисленны.
Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот,
которым отвечают газообразные или летучие ангидриды:
СаСО 3 + SiO 2
= СаSiO 3 + СО 2
Са 3 (РО 4) 2
+ ЗSiO 2 = ЗСаSiO 3 + Р 2 О 5
Органическая
химия.
В органической химии реакции
замещения понимаются шире, то есть замещать может не один атом, а группа атомов
или замещается не атом, а группа атомов. К разновидности реакции замещения
можно отнести нитрование и галогенирование предельных углеводородов, ароматических
соединений и спиртов:
C 6 H 6 + Br 2
→ C 6 H 5 Br + HBr
бензол бромбензол
C 2 H 5 OH +
HCl → C 2 H 5 Cl + H 2 O
Этанол хлорэтан
Реакции
обмена.
Реакциями обмена
называют реакции между двумя соединениями, которые
обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Неорганическая
химия
Если при реакциях замещения
протекают окислительно-восстановительные процессы, то реакции обмена всегда
происходят без изменения валентного состояния атомов. Это наиболее
распространенная группа реакций между сложными веществами — оксидами,
основаниями, кислотами и солями:
ZnO + Н 2 SО 4
= ZnSО 4 + Н 2 О
AgNО 3 + КВr = АgВr +
КNО 3
СrСl 3 + ЗNаОН =
Сr(ОН) 3 + ЗNаСl.
Частный случай этих реакций
обмена — реакции нейтрализации:
НСl + КОН = КСl + Н 2 О.
Обычно эти реакции подчиняются
законам химического равновесия и протекают в том направлении, где хотя бы одно
из веществ удаляется из сферы реакции в виде газообразного, летучего вещества,
осадка или малодиссоциирующего (для растворов) соединения:
NаНСО 3 + НСl = NаСl +
Н 2 О + СО 2
Са(НСО 3) 2
+ Са(ОН) 2 = 2СаСО 3 ↓ + 2Н 2 О
Органическая
химия
НСООН + NaOH → HCOONa + Н 2 O
муравьиная кислота формиат
натрия
реакции гидролиза:
Na 2 CO3 + Н 2 О
NaHCO 3 + NaOH
карбонат натрия гидрокарбонат
натрия
СО 3 + Н 2 О
НСО 3 + ОН
реакции этерификации:
CH 3 COOH + C 2 H 5 OH
CH 3 COOC 2 H 5 +
H 2 O
уксусная этанол этиловый эфир уксусной кислоты
Агрегатное
состояние реагентов и продуктов реакции.
Газовые
реакции
Реакции
в растворах
NaОН(рр) + НСl(p-p) = NaСl(p-p)
+ Н 2 О(ж)
Реакции
между твердыми веществами
t o | ||
СаО | СаSiO 3 (тв) |
Число фаз, в
которых находятся участники реакции.
Под фазой понимают совокупность однородных частей
системы с одинаковыми физическими и химическими свойствами и отделенных друг от
друга поверхностью раздела.
Гомогенные
(однофазные) реакции.
К ним относят реакции,
протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах.
Гетерогенные
(многофазные) реакции.
К ним относят реакции, в которых
реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO 2 (г) + NaOH(p-p) =
NaHCO 3 (p-p).
газотвердофазные реакции
СO 2 (г) + СаО(тв) =
СаСO 3 (тв).
жидкотвердофазные реакции
Na 2 SO 4 (рр)
+ ВаСl 3 (рр) = ВаSО 4 (тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО 3) 2 (рр)
+ Н 2 SО 4 (рр) = СО 2 (r) +Н 2 О(ж)
+ СаSО 4 (тв)↓.
Природа
переносимых частиц.
Протолитические
реакции.
К протолитическим реакциям относят химические
процессы, суть которых заключается в переносе протона от одних реагирующих
веществ к другим.
В основе этой классификации
лежит протолитическая теория кислот и оснований, в соответствии с которой
кислотой считают любое вещество, отдающее протон, а основанием — вещество,
способное присоединять протон, например:
К протолитическим реакциям
относят реакции нейтрализации и гидролиза.
Окислительно-восстановительные
реакции.
Все химические реакции
подразделяются на такие, в которых степени окисления не изменяются (например,
реакция обмена) и на такие, в которых происходит изменение степеней окисления.
Их называют окислительно-восстановительными реакциями. Ими могут быть реакции
разложения, соединения, замещения и другие более сложные реакции. Например:
Zn
+ 2
H
+
→
Zn
2
+
+
H
2
FeS 2 + 8HNO 3 (конц
) = Fe(NO 3) 3
+ 5NO + 2H 2 SO 4 + 2H 2 O
Подавляющее большинство
химических реакций относятся к окислительно-восстановительным, они играют
исключительно важную роль.
Лиганднообменные
реакции.
К таковым относят реакции, в
ходе которых происходит перенос электронной пары с образованием ковалентной
связи по донорноакцепторному механизму. Например
:
Cu(NO 3) 2 + 4NH 3 = (NO 3) 2
Fe + 5CO =
Al(OH) 3 + NaOH =
Характерной особенностью
лиганднообменных реакций является то, что образование новых соединений,
называемых комплексными, происходит без изменения степени окисления.
Возможность
протекания реакции в прямом и обратном направлении.
Необратимые
реакции.
Необратимыми
называют такие химические процессы, продукты которых не
способны реагировать друг с другом с образованием исходных веществ. Примерами
необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО 3 → 2КСl +
ЗО 2 ,
или окисление глюкозы кислородом
воздуха:
С 6 Н 12 О 6
+ 6О 2 → 6СО 2 + 6Н 2 О
Обратимые
реакции.
Обратимыми
называют такие химические процессы, продукты которых
способны реагировать друг с другом в тех же условиях, в которых они получены, с
образованием исходных веществ.
Для обратимых реакций уравнение
принято записывать следующим образом:
А + В
АВ.
Две противоположно направленные
стрелки указывают на то, что при одних и тех же условиях одновременно протекает
как прямая, так и обратная реакция, например:
СН 3 СООН + С 2 Н 5 ОН
СН 3 СООС 2 Н 5
+ Н 2 О.
2SO 2 +O 2
2SO 3 + Q
Следовательно, данные реакции не
идут до конца, потому, что одновременно происходят две реакции — прямая (между
исходными веществами) и обратная (разложение продукта реакции).
Классификация
по тепловому эффекту.
Количество теплоты, которое
выделяется или поглощается в результате реакции, называется тепловым эффектом
данной реакции. По тепловому эффекту реакции делят:
Экзотермические.
Протекают с выделением тепла
СН 4 + 2O 2
→ СО 2 + 2Н 2 O + Q
Н 2 + Cl 2
→ 2HC
l
+ Q
Эндотермические.
Протекают с поглощением тепла
N 2 +
О
2
→ 2NO-Q
2Н 2 O → 2Н 2
+ O 2 — Q
Классификация
с учетом явления катализа.
Каталитические.
К ним относятся все процессы с
участием катализаторов.
Кат
.
2SO 2 + O 2
2SO 3
Некаталитические.
К ним относятся любые мгновенно
протекающие реакции в растворах
BaCl 2 + H 2 SO 4 = 2HCl + BaSO 4 ↓
Список
литературы
Ресурсы Интернет:
http://chem.km.ru
– «Мир Химии»
http
://
chemi
.
org
.
ru
– «Пособие для
абитуриентов. Химия»
http
://
hemi
.
wallst
.
ru
– «Альтернативный учебник по химии для 8-11 классов»
«Руководство по химии. Поступающим в ВУЗы» — Э.Т. Оганесян, М.
1991г.
Большой Энциклопедический
Словарь. Химия» — М. 1998г.
1) Первый признак классификации – по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
FeS 2 + 18HNO 3 = Fe(NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
б) без изменения степени окисления
CaO + 2HCl = CaCl 2 + H 2 O
Окислительно-восстановительными
называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
2) Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
-реакции соединения или присоединения
в органической химии.
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
NH 3 + HCl = NH 4 Cl
CaO + CO 2 = CaCO 3
-реакции разложения.
Реакции разложения можно рассматривать как процессы, обратные соединению.
C 2 H 5 Br = C 2 H 4 + HBr
Hg(NO 3) 2 = Hg + 2NO 2 + O 2
– реакции замещения.
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
Zn + CuSO 4 = Cu + ZnSO 4
Cu + 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
– обмена (в том числе и нейтрализации).
CaO + 2HCl = CaCl 2 + H 2 O
KCl + AgNO 3 = AgCl¯ + KNO 3
3) По возможности протекать в обратном направлении – обратимые и необратимые.
4) По типу разрыва связей – гомолитические (равный разрыв, каждый атом по 1 электрону получает) и гетеролитический (неравный разрыв – одному достается пара электронов)
5) По тепловому эффекту
экзотермические (выделение тепла) и эндотермические (поглощение тепла). Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
6) По фазе
а) Гомогенные (однородные вещества, в одной фазе, например г-г, реакции в растворах)
б) Гетерогенные (г-ж, г-тв, ж-тв, реакции между несмешивающимися жидкостями)
7) По использованию катализатора. Катализатор – вещество ускоряющее химическую реакцию.
а) каталитические (в том числе и ферментативные) – без использование катализатора практически не идут.
б) некаталитические.
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
Необратимыми
называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O 2 = 2CaO
BaBr 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaBr
Обратимыми
называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N 2 +3H 2 ↔2NH 3
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими
называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими
называют реакции, протекающие через образование ионных частиц — катионов и анионов.
Радикальными
(цепными) называют химические реакции с участием радикалов, например:
CH 4 + Cl 2 hv →CH 3 Cl + HCl
Ионными
называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO 3 = KNO 3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C 6 H 6 + Cl 2 FeCl3 → C 6 H 5 Cl + HCl
H 2 C =CH 2 + Br 2 → BrCH 2 –CH 2 Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH 3 Br + NaOH → CH 3 OH + NaBr
CH 3 C(O)H + C 2 H 5 OH → CH 3 CH(OC 2 H 5) 2 + H 2 O
Экзотермическими
называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH
Эндотермическими
называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q 0.
Гомогенными
называют реакции, протекающие в однородной среде.
Гетерогенными
называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Каталитические реакции протекают только в присутствии катализатора. Некаталитические реакции идут в отсутствие катализатора.
Классификация органических реакций приведена в таблице:
Зависимость энергии активации и температуры
Энергия активации
Энергия активации — это энергия, необходимая для возникновения реакции, определяющая ее скорость.
Цели обучения
Обсудить понятие энергии активации
Основные выводы
Ключевые моменты
- Реакции требуют ввода энергии для начала реакции; это называется энергией активации (E A ).
- Энергия активации — это количество энергии, необходимое для достижения переходного состояния.
- Источником энергии активации, необходимой для проталкивания реакции, обычно является тепловая энергия из окружающей среды.
- Для того, чтобы клеточные реакции происходили достаточно быстро в короткие сроки, их энергия активации снижается молекулами, называемыми катализаторами.
- Ферменты — катализаторы.
Ключевые термины
- энергия активации : минимальная энергия, необходимая для возникновения реакции.
- катализ : увеличение скорости химической реакции за счет снижения ее энергии активации.
- переходное состояние : промежуточное состояние во время химической реакции, которое имеет более высокую энергию, чем реагенты или продукты.
Многие химические реакции и почти все биохимические реакции не происходят спонтанно и должны иметь начальный вклад энергии (называемый энергией активации), чтобы начаться. Энергию активации необходимо учитывать при анализе как эндергонических, так и экергонических реакций. Экзергонические реакции имеют чистое высвобождение энергии, но они по-прежнему требуют небольшого количества энергии, прежде чем они смогут продолжить свои этапы высвобождения энергии.Это небольшое количество энергии, необходимое для протекания всех химических реакций, называется энергией активации (или свободной энергией активации) и обозначается аббревиатурой E A .
Энергия активации : энергия активации — это энергия, необходимая для протекания реакции; он ниже, если реакция катализируется. Горизонтальная ось этой диаграммы описывает последовательность событий во времени.
Энергия активации в химических реакциях
Почему для протекания реакции с высвобождением энергии с отрицательной ∆G требуется немного энергии? Причина кроется в этапах химической реакции.В ходе химических реакций определенные химические связи разрываются и образуются новые. Например, когда молекула глюкозы разрушается, связи между атомами углерода молекулы разрываются. Поскольку эти связи накапливают энергию, при разрыве они выделяют энергию. Однако, чтобы привести их в состояние, позволяющее разорвать связи, молекула должна быть несколько искажена. Для достижения этого искаженного состояния требуется небольшой подвод энергии, которое называется переходным состоянием : это высокоэнергетическое, нестабильное состояние.По этой причине молекулы реагентов недолго находятся в переходном состоянии, но очень быстро переходят к следующим этапам химической реакции.
Клетки время от времени связывают экзэргоническую реакцию [латекс] (\ Delta \ text {G} & \ text {lt}; 0) [/ latex] с эндергонической реакцией [латекс] (\ Delta \ text {G} & \ text {gt}; 0) [/ latex], позволяя им продолжить. Этот спонтанный переход от одной реакции к другой называется энергетической связью. Свободная энергия, выделяемая в результате экзергонической реакции, поглощается эндергонической реакцией
.Одним из примеров энергетического взаимодействия с использованием АТФ является трансмембранный ионный насос, который чрезвычайно важен для клеточной функции.
Диаграммы свободной энергии
Диаграммы свободной энергии иллюстрируют энергетические профили данной реакции. Является ли реакция экзэргонической (ΔG <0) или эндергонической (ΔG> 0), определяет, будут ли продукты на диаграмме существовать в более низком или более высоком энергетическом состоянии, чем реагенты. Однако мера энергии активации составляет , не зависящую от от ΔG реакции.Другими словами, при данной температуре энергия активации зависит от природы происходящего химического превращения, но не от относительного энергетического состояния реагентов и продуктов.
Хотя на изображении выше обсуждается концепция энергии активации в контексте экзергонической прямой реакции, те же принципы применимы к обратной реакции, которая должна быть эндергонической. Обратите внимание, что энергия активации обратной реакции больше, чем прямой реакции.
Энергия активации в эндергонической реакции : В этой эндергонической реакции все еще требуется энергия активации для преобразования реагентов A + B в продукт C. Этот рисунок подразумевает, что энергия активации находится в форме тепловой энергии.
Тепловая энергия
Источником энергии активации, необходимой для проталкивания реакции, обычно является тепловая энергия из окружающей среды. Тепловая энергия (общая энергия связи реагентов или продуктов химической реакции) ускоряет движение молекул, увеличивая частоту и силу, с которой они сталкиваются.Он также немного перемещает атомы и связи внутри молекулы, помогая им достичь переходного состояния. По этой причине нагрев системы приведет к более частой реакции химических реагентов в этой системе. Тот же эффект имеет повышение давления в системе. Как только реагенты поглотили достаточно тепловой энергии из своего окружения, чтобы достичь переходного состояния, реакция продолжится.
Энергия активации конкретной реакции определяет скорость, с которой она будет протекать.Чем выше энергия активации, тем медленнее будет протекать химическая реакция. Пример ржавчины железа показывает медленную реакцию. Эта реакция происходит медленно с течением времени из-за его высокого значения E A . Кроме того, горение многих видов топлива, которое является сильно экзергоническим, будет происходить с незначительной скоростью, если их энергия активации не будет преодолена достаточным количеством тепла от искры. Однако, как только они начинают гореть, химические реакции выделяют достаточно тепла для продолжения процесса горения, обеспечивая энергию активации для окружающих молекул топлива.
Подобно этим реакциям вне клеток, энергия активации для большинства клеточных реакций слишком высока для того, чтобы тепловая энергия могла быть преодолена с высокой скоростью. Другими словами, для того, чтобы важные клеточные реакции происходили со значительной скоростью (количество реакций в единицу времени), их энергия активации должна быть снижена; это называется катализом. Для живых клеток это очень хорошо. Важные макромолекулы, такие как белки, ДНК и РНК, накапливают значительную энергию, и их распад является экергоническим.{\ text {E} _ \ text {a} / \ text {RT}} [/ latex]
где
- k — коэффициент или константа скорости реакции
- А — частотный коэффициент реакции. Это определено экспериментально.
- R — универсальная газовая постоянная
- T — температура в Кельвинах
Теория столкновений
Теория столкновений дает качественное объяснение химических реакций и скоростей, с которыми они происходят, апеллируя к принципу, согласно которому для реакции молекулы должны сталкиваться.
Цели обучения
Обсудить роль энергии активации, столкновений и ориентации молекул в теории столкновений
Основные выводы
Ключевые моменты
- Молекулы должны столкнуться, чтобы вступить в реакцию.
- Для того, чтобы эффективно инициировать реакцию, столкновения должны быть достаточно энергичными (кинетическая энергия), чтобы разорвать химические связи; эта энергия известна как энергия активации.
- По мере повышения температуры молекулы движутся быстрее и сталкиваются более энергично, что значительно увеличивает вероятность разрыва связи при столкновении.
Ключевые термины
- энергия активации : минимальная энергия, с которой реагенты должны столкнуться, чтобы реакция произошла.
Теория столкновений дает качественное объяснение химических реакций и скорости их протекания. Основной принцип теории столкновений состоит в том, что для реакции молекулы должны столкнуться. Это фундаментальное правило направляет любой анализ обычного механизма реакции.
Рассмотрим простейшую бимолекулярную реакцию: [латекс] \ text {A} + \ text {B} \ rightarrow \ text {products} [/ latex]
Если две молекулы A и B должны вступить в реакцию, они должны вступить в контакт с достаточной силой, чтобы химические связи разорвались.Мы называем такую встречу столкновением. Если и A, и B являются газами, частота столкновений между A и B будет пропорциональна концентрации каждого газа. Если мы удвоим концентрацию A, частота столкновений A-B удвоится, и удвоение концентрации B будет иметь тот же эффект. Следовательно, согласно теории столкновений, скорость, с которой сталкиваются молекулы, будет влиять на общую скорость реакции.
Молекулярные столкновения : Чем больше молекул присутствует, тем больше столкновений произойдет.
Энергия активации и температура
Когда два бильярдных шара сталкиваются, они просто отскакивают друг от друга. Это также наиболее вероятный исход, когда две молекулы, A и B, вступают в контакт: они отскакивают друг от друга, совершенно неизменные и незатронутые. Чтобы столкновение было успешным, привело к химической реакции, A и B должны столкнуться с достаточной энергией, чтобы разорвал химические связи. Это происходит потому, что в любой химической реакции химические связи в реагентах разрываются, и образуются новые связи в продуктах.Следовательно, чтобы эффективно инициировать реакцию, реагенты должны двигаться достаточно быстро (с достаточной кинетической энергией), чтобы они сталкивались с силой, достаточной для разрыва связей. Эта минимальная энергия, с которой должны двигаться молекулы, чтобы столкновение привело к химической реакции, известна как энергия активации .
Как мы знаем из кинетической теории газов, кинетическая энергия газа прямо пропорциональна температуре. С повышением температуры молекулы получают энергию и движутся все быстрее и быстрее.Следовательно, чем выше температура, тем выше вероятность того, что молекулы будут двигаться с энергией активации, необходимой для возникновения реакции при столкновении.
Молекулярная ориентация и эффективные столкновения
Даже если две молекулы сталкиваются с достаточной энергией активации, нет гарантии, что столкновение будет успешным. Фактически, теория столкновений гласит, что не каждое столкновение бывает успешным, даже если молекулы движутся с достаточной энергией. Причина этого в том, что молекулы также должны сталкиваться с правильной ориентацией , , чтобы правильные атомы выстраивались друг с другом, а связи могли разорваться и переформироваться необходимым образом.Например, в газофазной реакции оксида диазота с оксидом азота кислородный конец N 2 O должен попасть в азотный конец NO; если какая-либо молекула выстроена неправильно, при их столкновении не произойдет никакой реакции, независимо от того, сколько энергии они имеют. Однако, поскольку молекулы в жидкой и газовой фазах находятся в постоянном, случайном движении, всегда существует вероятность того, что две молекулы столкнутся именно так, чтобы они отреагировали.
Конечно, чем более критичным является это требование ориентации, как и для более крупных или более сложных молекул, тем меньше будет столкновений, при которых будет эффективное .Эффективное столкновение определяется как столкновение, при котором молекулы сталкиваются с достаточной энергией и правильной ориентацией , так что происходит реакция.
Заключение
Согласно теории столкновений, для возникновения химической реакции должны быть выполнены следующие критерии:
- Молекулы должны сталкиваться с достаточной энергией, известной как энергия активации, чтобы химические связи могли разорваться.
- Молекулы должны сталкиваться с правильной ориентацией.
- Столкновение, которое соответствует этим двум критериям и которое приводит к химической реакции, известно как успешное столкновение или эффективное столкновение.
Объяснение теории столкновений : Теория столкновений дает объяснение того, как частицы взаимодействуют, вызывая реакцию и образование новых продуктов.
Факторы, влияющие на скорость реакции
Скорость химической реакции зависит от факторов, которые влияют на то, могут ли реагенты сталкиваться с достаточной энергией для того, чтобы реакция могла произойти.
Цели обучения
Объясните, как концентрация, площадь поверхности, давление, температура и добавление катализаторов влияют на скорость реакции
Основные выводы
Ключевые моменты
- При повышении концентрации реагентов реакция протекает быстрее. Это связано с увеличением количества молекул, обладающих минимально необходимой энергией. Для газов повышение давления имеет тот же эффект, что и повышение концентрации.
- Когда твердые вещества и жидкости вступают в реакцию, увеличение площади поверхности твердого вещества увеличивает скорость реакции. Уменьшение размера частиц вызывает увеличение общей площади поверхности твердого тела.
- Повышение температуры реакции на 10 ° C может удвоить или утроить скорость реакции. Это связано с увеличением количества частиц, обладающих минимально необходимой энергией. Скорость реакции снижается с понижением температуры.
- Катализаторы могут снизить энергию активации и увеличить скорость реакции, не расходясь при этом.
- Различия в собственных структурах реагентов могут привести к различиям в скоростях реакции. Молекулы, соединенные более прочными связями, будут иметь более низкие скорости реакции, чем молекулы, соединенные более слабыми связями, из-за повышенного количества энергии, необходимого для разрыва более сильных связей.
Ключевые термины
- катализатор : Вещество, которое увеличивает скорость химической реакции, но не расходуется в процессе.
- энергия активации : минимальное количество энергии, которое должны иметь молекулы, чтобы реакция произошла при столкновении.
Концентрации реагентов
Повышение концентрации реагентов ускоряет реакцию. Чтобы химическая реакция произошла, должно быть определенное количество молекул с энергией, равной или большей, чем энергия активации. С увеличением концентрации количество молекул с минимально необходимой энергией будет увеличиваться, а значит, и скорость реакции увеличится. Например, если одна из миллиона частиц имеет достаточную энергию активации, то из 100 миллионов частиц только 100 будут реагировать.Однако, если у вас есть 200 миллионов таких частиц в одном объеме, то 200 из них вступают в реакцию. Удвоение концентрации также увеличивает вдвое скорость реакции.
Интерактивное: концентрация и скорость реакции : В этой модели два атома могут образовывать связь, образуя молекулу. Поэкспериментируйте с изменением концентрации атомов, чтобы увидеть, как это влияет на скорость реакции (скорость, с которой происходит реакция).
Площадь
В реакции между твердым телом и жидкостью площадь поверхности твердого вещества в конечном итоге влияет на скорость протекания реакции. 2 [/ latex].2 [/ латекс].
Это показывает, что общая открытая площадь поверхности увеличится, когда более крупное тело разделено на более мелкие части. Следовательно, поскольку реакция происходит на поверхности вещества, увеличение площади поверхности должно увеличивать количество вещества, которое может вступить в реакцию, и, таким образом, также увеличивает скорость реакции.
Площадь поверхности более мелких молекул по сравнению с более крупными молекулами : На этом рисунке показано, как разборка кирпича на более мелкие кубики приводит к увеличению общей площади поверхности.
Давление
Увеличение давления для реакции с участием газов увеличивает скорость реакции. По мере увеличения давления газа вы уменьшаете его объем (PV = nRT; P и V обратно пропорциональны), в то время как количество частиц ( n ) остается неизменным. Следовательно, увеличение давления увеличивает концентрацию газа ( n / V ) и обеспечивает более частое столкновение молекул газа. Имейте в виду, что эта логика работает только для газов, которые сильно сжимаются; изменение давления для реакции, в которой участвуют только твердые вещества или жидкости, не влияет на скорость реакции.
Температура
Экспериментально обнаружено, что повышение температуры на 10 ° C обычно удваивает или утраивает скорость реакции между молекулами. Минимальная энергия, необходимая для протекания реакции, известная как энергия активации, остается неизменной при повышении температуры. Однако среднее увеличение кинетической энергии частиц, вызванное поглощенным теплом, означает, что большая часть молекул реагента теперь имеет минимальную энергию, необходимую для столкновения и реакции.Повышение температуры вызывает повышение уровней энергии молекул, участвующих в реакции, поэтому скорость реакции увеличивается. Точно так же скорость реакции будет снижаться с понижением температуры.
Interactive: температура и скорость реакции : исследуйте роль температуры на скорости реакции. Примечание: в этой модели любое тепло, выделяемое самой реакцией, удаляется, поддерживая постоянную температуру, чтобы изолировать влияние температуры окружающей среды на скорость реакции.
Наличие или отсутствие катализатора
Катализаторы — это вещества, которые увеличивают скорость реакции за счет снижения энергии активации, необходимой для протекания реакции. Катализатор не разрушается и не изменяется во время реакции, поэтому его можно использовать снова. Например, в обычных условиях H 2 и O 2 не сочетаются. Однако они объединяются в присутствии небольшого количества платины, которая действует как катализатор, и реакция затем происходит быстро.
Природа реагентов
Вещества заметно различаются по скорости химического изменения.Различия в реакционной способности между реакциями можно отнести к разной структуре используемых материалов; например, имеет значение, находятся ли вещества в растворе или в твердом состоянии. Другой фактор связан с относительной прочностью связи в молекулах реагентов. Например, реакция между молекулами с атомами, которые связаны прочными ковалентными связями, будет происходить медленнее, чем реакция между молекулами с атомами, которые связаны слабыми ковалентными связями.Это связано с тем, что для разрыва прочно связанных молекул требуется больше энергии.
Уравнение Аррениуса
Уравнение Аррениуса — это формула, описывающая зависимость скорости реакции от температуры.
Цели обучения
Объясните уравнение Аррениуса и значение переменных, содержащихся в нем.
Основные выводы
Ключевые моменты
- Уравнение связывает k , константу скорости данной химической реакции, с температурой, T , энергией активации реакции, E a , предэкспоненциальным множителем A и универсальная газовая постоянная, R .
- Высокая температура и низкая энергия активации способствуют увеличению констант скорости и, следовательно, ускоряют реакцию.
- Уравнение представляет собой комбинацию понятий энергии активации и распределения Максвелла-Больцмана.
Ключевые термины
- Экспоненциальный спад : Когда количество уменьшается со скоростью, пропорциональной его значению.
Уравнение Аррениуса — это простая, но удивительно точная формула для температурной зависимости константы скорости реакции и, следовательно, скорости химической реакции.{- \ frac {\ text {E} _ \ text {a}} {\ text {RT}}} [/ latex]
В этом уравнении k — константа скорости, T — абсолютная температура, E a — энергия активации, A — предэкспоненциальный множитель, а R — универсальный газ. постоянный.
Найдите минутку, чтобы сосредоточиться на значении этого уравнения, пока пренебрегайте коэффициентом A . Во-первых, обратите внимание, что это еще одна форма закона экспоненциального затухания.Здесь «затухает» не концентрация реагента как функция времени, а величина константы скорости как функция показателя степени — Ea / RT .
Какое значение имеет это количество? Если вы вспомните, что RT — это средняя кинетическая энергия, будет очевидно, что показатель степени — это просто отношение энергии активации, E a , к средней кинетической энергии. Чем больше это соотношение, тем меньше коэффициент, поэтому он включает в себя отрицательный знак.Это означает, что высокие температуры и низкие энергии активации благоприятствуют более высоким константам скорости , и, следовательно, эти условия будут ускорять реакцию. Поскольку эти члены выражаются в экспоненте, их влияние на скорость довольно существенно.
Построение уравнения Аррениуса в неэкспоненциальной форме
Уравнение Аррениуса может быть записано в неэкспоненциальной форме, которая часто более удобна для использования и графической интерпретации. Взяв натуральный логарифм от обеих сторон и разделив экспоненциальный и предэкспоненциальный члены, получим: [latex] \ text {ln} (\ text {k}) = \ text {ln} (\ text {A}) — \ frac { \ text {E} _ {\ text {a}}} {\ text {RT}} [/ latex]
Обратите внимание, что это уравнение имеет форму [latex] \ text {y} = \ text {mx} + \ text {b} [/ latex] и создает график зависимости ln (k) от 1/ T даст прямую линию с наклоном –Ea / R .
График ln (k) в зависимости от 1 / T для разложения диоксида азота : Наклон линии равен -Ea / R.
Это дает простой способ определения энергии активации по значениям k , наблюдаемым при различных температурах. Мы можем построить график ln (k) по сравнению с 1/ T, и просто определить наклон для решения для E a .
Предэкспоненциальный фактор
Давайте посмотрим на предэкспоненциальный множитель A в уравнении Аррениуса.{\ frac {- \ text {E} _ \ text {a}} {\ text {RT}}} [/ latex]) выражает долю молекул реагентов, которые обладают достаточной кинетической энергией для реакции, как это регулируется Максвелловским Распределение Больцмана. В зависимости от величин E a и температуры эта доля может варьироваться от нуля, когда у молекул нет достаточной энергии для реакции, до единицы, когда все молекулы имеют достаточно энергии для реакции.
Если бы дробь равнялась единице, закон Аррениуса уменьшился бы до k = A .Следовательно, A представляет максимально возможную константу скорости; это то, какой была бы константа скорости, если бы каждое столкновение между любой парой молекул приводило к химической реакции. Это могло произойти только в том случае, если либо энергия активации была равна нулю, либо если кинетическая энергия всех молекул превышала E a — оба эти сценария крайне маловероятны. Хотя наблюдались «безбарьерные» реакции с нулевой энергией активации, они случаются редко, и даже в таких случаях молекулам, скорее всего, придется столкнуться с правильной ориентацией, чтобы вступить в реакцию.{\ frac {- \ text {E} _ \ text {a}} {\ text {RT}}} [/ latex] будет меньше единицы.
Теория переходного состояния
В данной химической реакции гипотетическое пространство, которое возникает между реагентами и продуктами, известно как переходное состояние.
Цели обучения
Обобщите три основных характеристики теории переходных состояний
Основные выводы
Ключевые моменты
- Теория переходного состояния успешно рассчитала стандартную энтальпию активации, стандартную энтропию активации и стандартную энергию Гиббса активации.
- Между продуктами и реагентами существует переходное состояние.
- Активированный комплекс представляет собой гибрид реагента и продукта с более высокой энергией. Он может превращаться в продукты или превращаться в реагенты.
Ключевые термины
- Теория переходного состояния : Постулирует, что гипотетическое переходное состояние возникает после состояния, в котором химические вещества существуют как реагенты, но до состояния, в котором они существуют как продукты.
- активированный комплекс : вещество с более высокой энергией, которое образуется во время переходного состояния химической реакции.
Теория переходного состояния (TST) описывает гипотетическое «переходное состояние», которое возникает в пространстве между реагентами и продуктами химической реакции. Виды, которые образуются во время переходного состояния, известны как активированный комплекс. TST используется для описания того, как происходит химическая реакция, и основан на теории столкновений. Если константа скорости реакции известна, TST можно успешно использовать для расчета стандартной энтальпии активации, стандартной энтропии активации и стандартной энергии Гиббса активации.TST также называют «теорией активированного комплекса», «теорией абсолютной скорости» и «теорией абсолютной скорости реакции».
Теория переходного состояния : Активированный комплекс, который представляет собой своего рода гибрид реагента и продукта, существует на пике координаты реакции, в так называемом переходном состоянии.
Постулаты теории переходного состояния
Согласно теории переходного состояния, между состоянием, в котором молекулы существуют как реагенты, и состоянием, в котором они существуют как продукты, существует промежуточное состояние, известное как переходное состояние.Виды, которые образуются во время переходного состояния, представляют собой частицы с более высокой энергией, известные как активированный комплекс. TST постулирует три основных фактора, которые определяют, произойдет ли реакция. Эти факторы:
- Концентрация активированного комплекса.
- Скорость, с которой активированный комплекс распадается.
- Механизм распада активированного комплекса; его можно либо превратить в продукты, либо «вернуться» обратно в реагенты.
Этот третий постулат действует как своего рода уточнение того, что мы уже исследовали в нашем обсуждении теории столкновений. Согласно теории столкновений, успешное столкновение — это такое столкновение, при котором молекулы сталкиваются с достаточной энергией и с правильной ориентацией, так что происходит реакция. Однако, согласно теории переходного состояния, успешное столкновение не обязательно приведет к образованию продукта, а только к образованию активированного комплекса. Как только активированный комплекс образуется, он может продолжить свое превращение в продукты или снова превратиться в реагенты.
Приложения в биохимии
Теория переходных состояний наиболее полезна в области биохимии, где она часто используется для моделирования реакций, катализируемых ферментами в организме. Например, зная возможные переходные состояния, которые могут образоваться в данной реакции, а также зная различные энергии активации для каждого переходного состояния, становится возможным предсказать ход биохимической реакции и определить скорость и скорость ее реакции. постоянный.
6.2.2: Изменение скорости реакции в зависимости от температуры
Подавляющее большинство реакций зависит от термической активации, поэтому основным фактором, который следует учитывать, является доля молекул, обладающих достаточной кинетической энергией для реакции при данной температуре. Согласно кинетической молекулярной теории, популяция молекул при данной температуре распределена по множеству кинетических энергий, что описывается законом распределения Максвелла-Больцмана.
Два графика распределения, показанные здесь, относятся к более низкой температуре T 1 и более высокой температуре T 2 .Площадь под каждой кривой представляет собой общее количество молекул, энергия которых попадает в определенный диапазон. Заштрихованные области указывают количество молекул, обладающих достаточной энергией для удовлетворения требований, продиктованных двумя показанными значениями E и .
Из этих графиков видно, что доля молекул, кинетическая энергия которых превышает энергию активации, довольно быстро увеличивается с повышением температуры. Это причина того, что практически все химические реакции (и все элементарные реакции) протекают быстрее при более высоких температурах.
Температура считается основным фактором, влияющим на скорость химической реакции. Он считается источником энергии для протекания химической реакции. Сванте Аррениус, шведский химик, полагал, что реагентам в химической реакции необходимо получить небольшое количество энергии, чтобы стать продуктами. Он назвал этот вид энергии энергией активации. Известно, что количество энергии, используемой в реакции, превышает энергию активации реакции. Аррениус придумал уравнение, показывающее, что константы скорости различных видов химических реакций меняются в зависимости от температуры.Это уравнение указывает константу скорости, которая пропорциональна температуре. Например, когда константа скорости увеличивается, температура химической реакции обычно также увеличивается. Результат представлен ниже:
\ [\ ln \ frac {k_2} {k_1} = \ frac {E_a} {R} \ left (\ frac {1} {T_1} — \ frac {1} {T_2} \ справа) \]
Это уравнение известно как уравнение Аррениуса. T 1 и T 2 — это температурные переменные, выраженные в Кельвинах. T 1 можно выразить как начальную или более низкую температуру реакции, а T 2 — конечную или более высокую температуру реакции.Константы скорости, k 1 и k 2 , являются значениями в T 1 и T 2 . E a — энергия активации, выраженная в (Дж / моль) = (Дж / моль). R — газовая постоянная, выраженная как 8,3145 (Дж / моль × Кельвин) = (Дж / моль × K)
. Некоторые могут спросить, как температура на самом деле влияет на скорость химической реакции. Ответ на этот вопрос заключается в том, что это явление связано с теорией столкновений. Молекулы реагируют только в том случае, если у них достаточно энергии для реакции.{- \ frac {E_a} {RT}} \]
Некоторые интересные примеры:
- Соль или пищевой краситель добавляется в холодную воду, воду комнатной температуры и горячую воду. Когда вещество смешивается с горячей водой, высокие температуры позволяют ему превратиться в однородную смесь. Это связано с тем, что молекулы воды движутся быстрее при более высокой температуре и ускоряют реакцию растворения.
- Другой вид энергии — свет. Одним из примеров влияния температуры на скорость химических реакций является использование световых палочек или палочек.Световая палочка подвергается химической реакции, которая называется хемилюминесценцией; но эта реакция не требует тепла и не производит тепла. Однако его скорость зависит от температуры. Если поместить лайтстик в холодную среду, химическая реакция замедлится, что позволит дольше излучать свет. Если лайтстик находится в горячей среде, реакция ускоряется, в результате чего свет быстрее изнашивается. (Этот пример взят из книги «Как все работает — световые палочки» с сайта chemistry.about.com)
14.1: Факторы, влияющие на скорость реакции
Цели обучения
- Чтобы получить общий обзор некоторых важных факторов, влияющих на скорость химических реакций.
Есть много факторов, которые влияют на скорость химических реакций, включая концентрацию реагентов, температуру, физическое состояние реагентов и их дисперсию, растворитель и присутствие катализатора.
Хотя сбалансированное химическое уравнение реакции описывает количественные отношения между количествами присутствующих реагентов и количествами продуктов, которые могут быть образованы, оно не дает нам информации о том, будет ли протекать данная реакция и как быстро она будет происходить.Эта информация получается путем изучения химической кинетики реакции, которая зависит от различных факторов: концентрации реагентов, температуры, физического состояния и площади поверхности реагентов, а также свойств растворителя и катализатора, если таковые присутствуют. Изучая кинетику реакции, химики понимают, как контролировать условия реакции для достижения желаемого результата.
Эффекты концентрации
Два вещества не могут вступать в реакцию друг с другом, если составляющие их частицы (молекулы, атомы или ионы) не вступят в контакт.Если контакта нет, скорость реакции будет равна нулю. И наоборот, чем больше частиц реагента сталкивается в единицу времени, тем чаще между ними может происходить реакция. Следовательно, скорость реакции обычно увеличивается с увеличением концентрации реагентов.
Температурные эффекты
Повышение температуры системы увеличивает среднюю кинетическую энергию составляющих ее частиц. По мере увеличения средней кинетической энергии частицы движутся быстрее и чаще сталкиваются в единицу времени и обладают большей энергией при столкновении.Оба эти фактора увеличивают скорость реакции. Следовательно, скорость реакции практически всех реакций увеличивается с повышением температуры. И наоборот, скорость практически всех реакций уменьшается с понижением температуры. Например, охлаждение замедляет рост бактерий в пищевых продуктах, снижая скорость биохимических реакций, которые позволяют бактериям размножаться.
В системах, где возможно более одной реакции, одни и те же реагенты могут давать разные продукты в разных условиях реакции.Например, в присутствии разбавленной серной кислоты и при температуре около 100 ° C этанол превращается в диэтиловый эфир:
\ [\ mathrm {2CH_3CH_2OH} \ xrightarrow {\ mathrm {H_2SO_4}} \ mathrm {CH_3CH_2OCH_2CH_3} + \ mathrm {H_2O} \ label {14.1.1} \]
Однако при 180 ° C происходит совершенно другая реакция, в результате которой образуется этилен в качестве основного продукта:
\ [\ mathrm {CH_3CH_2OH} \ xrightarrow {\ mathrm {H_2SO_4}} \ mathrm {C_2H_4} + \ mathrm {H_2O} \ label {14.1.2} \]
Влияние фазы и площади поверхности
Когда два реагента находятся в одной и той же жидкой фазе, их частицы сталкиваются чаще, чем когда один или оба реагента являются твердыми веществами (или когда они находятся в разных жидкостях, которые не смешиваются).Если реагенты равномерно диспергированы в одном гомогенном растворе, то, как мы только что видели, количество столкновений в единицу времени зависит от концентрации и температуры. Однако, если реакция гетерогенная, реагенты находятся в двух разных фазах, и столкновения между реагентами могут происходить только на границах раздела фаз. Количество столкновений между реагентами в единицу времени существенно снижается по сравнению с гомогенным случаем, а, следовательно, и скорость реакции.Скорость гетерогенной реакции зависит от площади поверхности более конденсированной фазы.
Автомобильные двигатели используют эффекты площади поверхности для увеличения скорости реакции. Бензин впрыскивается в каждый цилиндр, где он воспламеняется при воспламенении от искры свечи зажигания. Бензин впрыскивается в виде микроскопических капель, потому что в этой форме он имеет гораздо большую площадь поверхности и может гореть намного быстрее, чем если бы его подавали в цилиндр в виде потока. Точно так же куча мелко измельченной муки горит медленно (или не горит совсем), но распыление мелко измельченной муки в пламя вызывает бурную реакцию .
Эффекты растворителя
Природа растворителя также может влиять на скорость реакции растворенных частиц. Например, раствор ацетата натрия реагирует с метилиодидом в реакции обмена с образованием метилацетата и иодида натрия.
\ [CH_3CO_2Na _ {(soln)} + CH_3I _ {(l)} \ rightarrow CH_3CO_2CH_ {3 \; (soln)} + NaI _ {(soln)} \ label {14.1.3} \]
Эта реакция протекает в 10 миллионов раз быстрее в органическом растворителе диметилформамиде [DMF; (CH 3 ) 2 NCHO], чем в метаноле (CH 3 OH).Хотя оба являются органическими растворителями с аналогичной диэлектрической проницаемостью (36,7 для ДМФА против 32,6 для метанола), метанол способен образовывать водородные связи с ионами ацетата, тогда как ДМФА — нет. Водородная связь снижает реакционную способность атомов кислорода в ацетат-ионе.
Вязкость растворителя также важна для определения скорости реакции. В высоковязких растворителях растворенные частицы диффундируют намного медленнее, чем в менее вязких растворителях, и могут сталкиваться реже в единицу времени. Таким образом, скорость большинства реакций быстро снижается с увеличением вязкости растворителя.
Эффекты катализатора
Катализатор — это вещество, которое участвует в химической реакции и увеличивает скорость реакции, не подвергаясь при этом чистым химическим изменениям. Рассмотрим, например, разложение перекиси водорода в присутствии и в отсутствие различных катализаторов. Поскольку большинство катализаторов обладают высокой селективностью, они часто определяют продукт реакции, ускоряя только одну из нескольких возможных реакций, которые могут произойти.
Большинство химических веществ, производимых в промышленности, образуются в результате каталитических реакций.Последние оценки показывают, что около 30% валового национального продукта США и других промышленно развитых стран прямо или косвенно зависит от использования катализаторов.
химических взрывчатых веществ
химических взрывчатых веществ
Введение в
Военно-морская техника
Химические взрывчатые вещества
Основное назначение любой боеголовки — нанести урон
цель.Способ причинения ущерба может отличаться в зависимости от
типы боеголовок, но в самом общем смысле повреждения наносятся
за счет передачи энергии от боевой части к цели. В
энергия обычно механическая по своей природе и принимает форму
ударная волна или кинетическая энергия осколков. В любом случае,
необходимо высвободить большое количество энергии. Для многих боеголовок
эта энергия хранится в виде химических взрывчатых веществ.
Взрывные реакции
Есть много химических реакций, которые высвобождают энергию.Они известны как экзотермических реакций. Если реакция
происходит медленно, высвободившаяся энергия будет рассеиваться и там
будет несколько заметных эффектов, кроме повышения температуры.
С другой стороны, если реакция идет очень быстро, то
энергия не рассеивается. Таким образом, большое количество
энергия может быть вложена в относительно небольшой объем, а затем проявится
сам по себе за счет быстрого расширения горячих газов, которые, в свою очередь, могут создавать
ударная волна или выбрасывание осколков наружу с высокой скоростью.Химическая
взрывы можно отличить от других экзотермических реакций
чрезвычайной быстротой их реакции. В добавок к
насильственное высвобождение энергии, химические взрывы должны обеспечивать
означает перевод энергии в механическую работу. Это выполнено
за счет расширения газообразных продуктов реакции. Если нет газов
произведенная, то энергия останется в продуктах в виде тепла.
Большинство химических взрывов связано с ограниченным набором простых
реакции, все из которых включают окисление (реакцию с кислородом).Относительно простой способ сбалансировать уравнения химического взрыва
состоит в том, чтобы предположить, что следующие частичные реакции имеют место
их максимальная степень (что означает, что один из реагентов полностью
израсходовано) и в порядке старшинства:
Таблица
1. Приоритеты взрывных реакций.
| Приоритет | Реакция (до завершения) |
| 1 | Металл + O Оксид металла (например, ZnO или PbO) |
| 2 C + | |
| 3 | 2H + OH 2 O (газ) |
| 4 | CO + O CO 2 (газ) (CO образуется в результате реакции (2)) |
| 5 | Избыток O, H и NO 2 , N 2 и H 2 (газы) |
Пример — баланс горения тротила: C 7 H 5 N 3 O 6 .
Никаких металлов, поэтому начните с приоритета 2:
6C + 60 6CO, оставляя 1C, 5H, 3N;
Кислорода не осталось, пропустите приоритеты 3 и 4.
Наконец, объедините газы:
3N 3/2 N 2
5H 5/2 H 2 , в результате чего 1 C не израсходован.
Общий:
C 7 H 5 N 3 O 6 6CO + 5/2 h3
+ 3/2 N 2 + С.
Общее количество энергии, высвобождаемой в реакции, равно
назвал теплотой взрыва . Его можно рассчитать по формуле
сравнение теплоты образования до и после реакции
DE = DE f (реактивы)
— DE f (изделия). Заплывы
образования продуктов и многих обычных взрывчатых веществ (реагентов)
приведены в таблице 2. Теплота взрыва определяется таким образом, чтобы
он будет положительным при экзотермической реакции.
Таблица 2. Плавки пласта.
| Название | Формула | МВт (г / моль) | DE f (кДж / моль) | ||||
| CO 2 | 44 | -393,5 | |||||
| H 2 O | 18 | -240.6 | |||||
| Нитроглицерин | C 3 H 5 N 3 O 9 | 227 | -333,66 | ||||
| RDX 99 C 9 C 6 O 6 | 222 | +83.82 | |||||
| HMX | C 4 H 8 N 8 O 8 | 296 | + | ТЭН | C 5 H 8 N 4 O 12 | 316 | -514.63 |
| TNT | C 7 H 5 N 3 O 6 | 227 | -54,39 | ||||
| TETRYL | C 7 7 N 5 O 8 | 287 | +38.91 |
Примечания:
1) Предполагается, что CO, CO 2 и H 2 O
находиться в газообразной форме.
2) DE f для N 2 , H 2 , O 2
а все остальные элементы равны нулю.
Пример: найти теплоту взрыва для TNT.
Раньше: DE f = -54,4 кДж / моль
После: DE f = 6 (-111,8)
+ 5/2 (0) + 3/2 (0) + 1 (0) = -670,8 кДж / моль
ДЭ = (-54,4) + 670,8 — = 616,4 кДж / моль,
Поскольку DE> 0, реакция экзотермическая,
а теплота взрыва +616.4 кДж / моль.
Выражаясь массово, ТНТ выпускает
кДж / моль) (1000 Дж / 1 кДж) (1 моль / 227 г) = 2175 Дж / г.
1 кг тротила выделяет 2,175 x 10 6 Дж энергии.
Поскольку большая часть энергии выделяется при окислении
количество доступного кислорода является критическим фактором.
Если кислорода недостаточно для реакции с имеющимся углеродом
и водород, взрывчатое вещество считается дефицитным по кислороду.Обратное считается богатым кислородом. Количественная мера
это называется кислородным балансом, определяемым как:
OB = — (100%) MW (O) / MW (взрывчатое вещество) [2C + H / 2 + M — O]
где:
C, H, M & O — количество молей углерода, водорода, металла.
и кислород в сбалансированной реакции, а MW — молекулярная масса
кислорода (= 16 г / моль) или взрывчатого вещества.
Пример — найти кислородный баланс для TNT.
OB = — (100%) (16/227) [2 (7) + 5/2 — 6] = -72%
Как правило, кислородный баланс должен быть близким к нулю.
чтобы получить максимальное количество энергии. Другие проблемы, такие как
стабильность или летучесть часто ограничивают кислородный баланс для химических
соединения. TNT — пример относительно мощного взрывного устройства.
то есть недостаток кислорода.
Некоторые взрывчатые вещества представляют собой смеси химикатов, которые не вступают в реакцию и
известны как композитов .Типичный пример — составной
B-3, который состоит из смеси гексогена 64/36 (C 3 H 6 N 6 O 6 )
и TNT. Если записать в том же обозначении, это будет C 6,851 H 8,750 N 7,650 O 9,300
и будет иметь кислородный баланс OB = -40,5%. ANFO, который
смесь нитрата аммония и мазута 94/6 имеет -0,6% кислорода
остаток средств. Композитные взрывчатые вещества обычно имеют кислородный баланс.
что ближе к идеальному случаю нуля.Вот смеси
используется для некоторых обычных композитных взрывчатых веществ:
Таблица 3. Композитные взрывчатые вещества.
| Название | Состав | Формула |
| AMATOL | 80/20 Аммиачная селитра / TNT | C 4,46 H 0,62 3,53 |
| ANFO | 94/6 Аммиачная селитра / # 2 Дизельное масло | C 0.365 H 4,713 N 2,000 O 3,000 |
| COMP A-3 | 91/9 RDX / WAX | C 1,87 H 3,74 N 2,46 O 2,46 |
| COMP B-3 | 64/36 RDX / TNT | C 6,851 H 8,750 N 7,650 O 9,300 |
| COMP C-4 | 91 / 5,3 / 2,1 / 1,6 гексоген / ди (2-этигексил) себацинат / полиизобутилен / моторное масло | C 1.82 H 3,54 N 2,46 O 2,51 |
| ДИНАМИТ | 75/15/10 RDX / TNT / пластификаторы | — |
Сила взрывчатых веществ
Определяющий фактор в преобразовании теплоты взрыва
в механическую работу — количество доступных продуктовых газов
для расширения. В случае тротила производится 10 моль газа.
за каждый моль взрывчатого вещества.Мы можем использовать этот факт, чтобы
предсказания о фактической взрывной силе других химикатов.
Это известно как приближение Бертло , которое гласит:
что относительная взрывная прочность материала (по сравнению с
в тротил в массовом порядке) может быть рассчитан на основе двух
факторы:
изменение внутренней энергии (ДЭ)
а также
количество добытого газа.Если объединить эти факторы и положить
в значениях для нашей справки, TNT, получаем:
Относительная прочность (%) = 840 Dn DE
/ МВт 2
где:
Dn = количество молей газа на
моль взрывчатого вещества
DE = теплота взрыва в кДж / моль
MW = молекулярная масса взрывчатого вещества в г / моль
Коэффициент 840 учитывает единицы и значения DE
и Dn для TNT.
Пример — расчет относительной силы Бертло для RDX
RDX: C 3 H 6 N 6 O 6 3CO + 3h3 O
+ 3N 2
MW = 222 г / моль
Dn = 9 моль
DE f (ранее) = 83.82 кДж / моль
DE f (после) = 3 (-111,8)
+ 3 (-240,6) = -1057,2 кДж / моль
Следовательно:
RS = 840 (9) (83,82 + 1057,2) / 222 2
RS = 175%
Относительная взрывная сила, рассчитанная таким образом
имеет ограниченное использование. Что действительно важно, так это фактическая сила
что можно измерить только экспериментально. Есть множество
стандартных тестов, большинство из которых связано с прямым измерением
выполненной работы.Вот несколько примеров измерений для
RDX:
Испытание баллистическим минометом: 140%
Тест блока Траузля: 186%
Испытание на раздавливание песком: 136%
, все они выгодно отличаются от нашего приближения Бертло.
Категории взрывчатых веществ
Мало того, что взрывчатые материалы должны быть высокоэнергетичными,
характеризуются относительной силой, но они также должны
бурно реагировать.Скорость реакции жизненно важна для сборки
из большого количества энергии в небольшой объем. Реакции
которые происходят медленно, позволяют рассеивать высвобождаемую энергию
(это соображение, связанное с взаимодействием скачка
волна с целями). Взрыв создаст либо ударную волну, либо
кидаем фрагменты наружу, наши оба. Если выделение энергии происходит медленно,
ударная волна будет постепенной и растянутой, а скорость осколка
низкий.С другой стороны, бурная реакция будет характеризоваться
очень резкой (короткой продолжительностью, высоким давлением) ударной волной и
большие скорости осколков. Такая быстрота реакции называется
brisance , или разрушительный потенциал взрыва.
Это свойство материала и степень удержания.
Если изначально сдержать взрыв, он может создать большой
давление и добиться того же эффекта. Скорость реакции
используется как метод классификации взрывчатых материалов.
Взрывчатые вещества, которые очень бурно реагируют (бризантны)
известны как взрывчатых веществ . Они используются исключительно для
их разрушительная сила. Напротив, есть некоторые материалы
которые реагируют медленнее. Они известны как маловзрывчатых веществ .
Они выделяют большое количество энергии, но из-за относительно
низкая скорость реакции энергия более полезна в качестве топлива
где расширение газов используется для перемещения снарядов.Примером может служить порох, который, хотя и весьма энергичен,
классифицируется как легкое взрывчатое вещество и используется в основном в качестве метательного взрывчатого вещества.
Это правда, что заключение увеличит блеск пороха.
но существует множество материалов, которые гораздо сильнее реагируют
быстрее и жестче, чем порох.
Инициирование взрывной реакции.
Хотя реакции окисления, высвобождающие энергию в
взрывные реакции энергетически возможны, они не происходят
спонтанно.Обычно есть небольшой барьер, который должен
быть преодоленным подачей энергии, которая запустит реакцию,
который затем будет продолжаться сам по себе до завершения. Вход
энергии для преодоления барьера называется инициированием (или детонацией).
Иногда требуется только механическое усилие, как в случае
нитроглицерина. В других ситуациях требуется тепло, например
от спички или электричества. Легкость, с которой взрывчатое вещество может
быть взорванным — это его чувствительность .Из соображений безопасности
взрывчатые материалы делятся на три категории:
которые легко взорвутся, называются чувствительными или первичными взрывчатыми веществами ;
те, для взрыва которых требуется немного больше энергии, называемые промежуточным звеном .
взрывчатые вещества ; и те, которые требуют относительно большего количества энергии
для детонации, называются нечувствительными или вторичными взрывчатыми веществами .
Термины относятся к физическому состоянию различных материалов.
настроен на работающее взрывное устройство.
Таблица 4. Обычные взрывчатые вещества и их использование.
| Первичный H.E. (детонаторы) | Промежуточный H.E. (бустеры) | Вторичный H.E. (главные заряды) | |
| Молниеносная ртуть | Тетритол | RDX | |
| Азид свинца | PETN | Comp-A, B, C | Циклотол |
| Тетрацен | TNT | HBX-1,3 | |
| DDNP | H-6 | ||
| MIN |
Первичные взрывчатые вещества используются для детонации всего
взрывное устройство.То есть они обычно связаны с некоторыми
внешнее устройство, запускающее детонацию. В этом качестве
первичное взрывчатое вещество называется взрывателем. Энергия от
взрывная детонация первичного материала используется для взрыва
бустер, который, в свою очередь, отключает основной заряд, производимый
вверх из вторичного (нечувствительный материал). Это сочетание
небольшое количество чувствительного материала, используемого для взрыва большого количества
вторичного материала известен как взрывной поезд.это
называется поездом, потому что события происходят последовательно. Главный
заряд должен быть изготовлен из нечувствительного материала для безопасности
тех, кто работает с устройством. На практике предохранитель срабатывает редко.
хранится вместе с устройством до тех пор, пока оно не понадобится для использования В этом
Таким образом, устройство остается относительно безопасным, так как оно производится только
состоит из вторичного (нечувствительного) материала и не может взорваться.
Фигура 1.Фугасное вещество
тренироваться.
После установки предохранителя все устройство требует особого ухода.
в обращении, чтобы предотвратить непреднамеренную детонацию. Часто устройство
настроен таким образом, что поезд взрывчатых веществ должен проходить через
небольшой физический порт, который соединяет предохранитель с основным зарядом.
Этот порт можно заблокировать до тех пор, пока устройство не будет использовано. Как
Например, порт может состоять из двух вращающихся пластин со смещенными от центра
дыры.Когда пластины выровнены, два отверстия выровняются.
и разрешить работу. Это называется постановкой устройства на охрану. Иначе,
отверстия не будут совмещены, и устройство будет в безопасности. В
Механизм с пластинами называется предохранительно-взводящим устройством.
Существуют и другие конфигурации, но все они выполняют одно и то же
функция: предотвратить непреднамеренную детонацию и разрешить детонацию
при авторизации.
Исчезающая пищевая сода — Scientific American
Ключевые концепции
Химия
Газы
Химическая реакция
Термическое разложение
Введение
Пищевая сода не только отлично подходит для приготовления пищи, но и является полезным химическим веществом для научных проектов.Вы, наверное, слышали о реакции пищевой соды и уксуса, и, возможно, даже использовали ее, чтобы вызывать извержения самодельных вулканов, запускать в воздух ракеты из бутылок или обнаруживать кислоты и основания. Однако существует множество других химических реакций, которые можно исследовать с помощью пищевой соды. Одна из них называется реакцией разложения, которая заставляет пищевую соду худеть! Хотите узнать, как это работает?
Фон
Химические вещества могут подвергаться множеству различных реакций, таких как реакции синтеза, в результате которых образуются новые вещества, или реакции горения, в которых вещество обычно вступает в реакцию с кислородом и генерирует энергию в виде тепла.Другой тип реакции — это реакция разложения, которая противоположна реакции синтеза. Когда химическое вещество разлагается, оно распадается с образованием двух или более отдельных соединений. Большинство химических соединений довольно стабильны и не разлагаются самопроизвольно. Вы должны вложить много энергии, чтобы разорвать их химические связи. Однако, когда химические вещества подвергаются воздействию достаточного количества энергии, которая может быть в виде тепла, излучения, электричества или света, они разлагаются.
Реакции разложения являются причиной того, что некоторые химические вещества или лекарства, отпускаемые по рецепту, хранятся во флаконах из темного стекла.Часто вы не хотите, чтобы химическое вещество разлагалось, потому что его химическая природа изменится. Темное стекло уменьшает количество света, попадающего на химическое вещество или лекарство, и, следовательно, предотвращает разложение химического вещества под действием света.
Пищевая сода или бикарбонат натрия (NaHCO 3 ) — это химическое вещество, которое может подвергаться реакции разложения при нагревании. При температуре выше 176 градусов по Фаренгейту (80 градусов Цельсия) бикарбонат натрия начинает распадаться на три соединения, образуя карбонат натрия (Na 2 CO 3 ), воду (H 2 O) и диоксид углерода (CO ). 2 ).Вы используете эту реакцию каждый раз, когда готовите и запекаете. Произведенный углекислый газ заставляет выпечку расти! Чем выше температура бикарбоната натрия, тем быстрее он разлагается. Только карбонат натрия останется твердым продуктом. И углекислый газ, и вода при высокой температуре газообразны, а это означает, что они исчезнут в окружающем воздухе. Вы действительно можете измерить эту потерю — возьмите немного пищевой соды и узнайте, как это сделать!
Материалы
- Две плиты, пригодные для использования в духовке
- Ложка
- Сода пищевая
- Цифровая шкала (желательно с 0.С шагом 1 грамм)
- Духовка
- Прихватки для духовки
- Помощник для взрослых
- Жаростойкая поверхность
- Таймер
- Бумага и ручка или карандаш
Подготовка
- Разогрейте кухонную духовку до 200 градусов F (около 93 градусов C).
- Включите весы и обнулите их.
- Поместите первую тарелку на весы. Запишите его точную массу.
- Затем снова обнулите шкалу и добавьте ложкой 15 грамм пищевой соды.
- Добавьте массу пустой тарелки к массе пищевой соды, чтобы рассчитать их общий вес. Запишите результат на листе бумаги.
- Повторите эти шаги со второй пластиной. Обязательно запомните, какая тарелка какая. Вы можете пометить их, если хотите.
Процедура
- Когда духовка достигнет заданной температуры (200 градусов по Фаренгейту), попросите вашего взрослого помощника поставить первую тарелку с пищевой содой в духовку.Запишите, какой именно.
- Установите таймер на 15 минут и оставьте тарелку в духовке, пока таймер не сработает. Как вы думаете, что будет с пищевой содой в духовке?
- Попросите вашего взрослого помощника осторожно достать тарелку с пищевой содой из духовки. Обязательно наденьте прихватки для духовки! Как выглядит пищевая сода? Изменился ли внешний вид при нагревании?
- Установите пластину на жаропрочную поверхность рабочего места и дайте ей остыть в течение 5–10 минут.
- Установите духовку на 400 градусов F (около 204 градусов C).
- Снова включите весы, обнулите их и установите на весы остывшую тарелку с пищевой содой. Запишите его точную массу. Как соотносится масса с массой до того, как вы поместили тарелку с пищевой содой в духовку? Он стал тяжелее, легче или остался прежним?
- Когда духовка достигнет новой целевой температуры, попросите вашего взрослого помощника поставить вторую тарелку с пищевой содой внутри.
- Снова установите таймер на 15 минут и оставьте пищевую соду в духовке на все время. Как вы думаете, вы получите другой результат при 400 градусах по Фаренгейту? Что будет с пищевой содой на этот раз?
- Через 15 минут попросите вашего взрослого помощника при помощи прихваток осторожно вынуть тарелку с пищевой содой из духовки. Как выглядит пищевая сода на этот раз? Он изменил цвет или все еще выглядит?
- Отложите и дайте пластине остыть в течение 5–10 минут.
- Затем снова включить весы, обнулить и поставить на весы вторую остывшую пластину. Запишите его точную массу. Как изменяется масса пищевой соды (плюс пластина) при нагревании до 400 градусов по Фаренгейту в течение 15 минут?
- Рассчитайте разницу масс пищевой соды до и после нагрева при 200 и 400 градусах F. Вычтите массу пластины и пищевой соды после нагрева из массы пластины и пищевой соды перед нагревом. Сколько массы было потеряно или набрано в процессе нагрева? Была ли разница между двумя температурами?
- Вы также можете выразить изменение массы пищевой соды, вычислив ее потерю в процентах (разница массы пищевой соды до и после нагревания, умноженная на 100 и затем разделенная на исходную массу пищевой соды). Какой процент массы пищевая сода потеряла или набрала в процессе нагрева при обеих температурах? Было то же самое? Если нет, то можете ли вы объяснить разницу?
- Extra : вы можете проверить, как изменяется масса пищевой соды при других температурах.Повторите тот же тест, но установите в духовке другую температуру (например, 250, 300 или 350 градусов по Фаренгейту). Как вы думаете, ваши результаты будут разными для разных температур или одинаковыми? Почему?
- Extra : Можете ли вы найти на кухне другие вещества, которые могут разлагаться? Узнайте, при каких температурах разлагаются эти соединения, и, если возможно (и безвредно), проверьте сами!
Наблюдения и результаты
Вы видели, как ваша пищевая сода похудела? Вы должны — по крайней мере, для более высокой температуры в 400 градусов по Фаренгейту.При более низкой температуре масса пищевой соды после нагрева, вероятно, была такой же (или почти такой же), как и до того, как вы поместили ее в духовку. Пищевая сода начинает разлагаться при температуре около 176 градусов по Фаренгейту. Однако при этих температурах разложение будет относительно медленным. Пятнадцать минут в духовке при температуре 200 градусов по Фаренгейту — недостаточно, чтобы значительно разложить пищевую соду.
При повышении температуры до 400 градусов по Фаренгейту реакция разложения будет происходить намного быстрее.Пятнадцати минут достаточно, чтобы разложить пищевую соду на карбонат натрия, воду и углекислый газ. Газообразные продукты (вода и углекислый газ) улетучиваются в воздух, поэтому полученный продукт должен быть значительно легче того, что вы кладете в духовку.
Внешний вид пищевой соды не изменится ни при каких температурах. Хотя вы делаете новый продукт — карбонат натрия — из пищевой соды во время реакции разложения, он все равно будет выглядеть так же.Оба вещества представляют собой белый порошок.
Очистка
Обязательно выключите духовку. Дайте обеим пластинам остыть до комнатной температуры. Затем вы можете выбросить использованную пищевую соду в мусорное ведро. Вымойте руки теплой водой с мылом и очистите рабочее место.
Больше для изучения
Термическое разложение, от BBC Bitesize
Химия для детей, химические реакции, с сайта Ducksters Education
Уравнение разложения бикарбоната натрия или пищевой соды от ThoughtCo.
Эта деятельность предоставлена вам в сотрудничестве с Science Buddies
Chemistry Online @ UTSC
Что такое рефлюкс?
Многие органические химические реакции требуют очень много времени для завершения, и для ускорения
до этих реакций прикладывается тепло. Органические соединения часто летучие с высоким содержанием
давление пара и низкие температуры кипения. При нагревании до определенной степени они будут
становятся легковоспламеняющимися и приводят к взрывам.Таким образом, прикладывание тепла должно производиться
особым образом, чтобы решить проблему испарения слишком большого количества растворителя и высыхания
реакционный сосуд.
Reflux включает нагревание химической реакции в течение определенного времени, в то время как
постоянное охлаждение производимого пара обратно в жидкую форму с помощью конденсатора.
Пары, образующиеся над реакцией, постоянно конденсируются, возвращаясь
в колбу в виде конденсата. Таким образом, это гарантирует, что температура
реакция остается постоянной.
Реагенты для экспериментов с обратным холодильником могут быть твердыми и жидкими, либо одновременно жидкими.
Температура, при которой нагревается реакция, зависит от температуры кипения
растворители, а также обратное кольцо (см. ниже).
Если реагенты, добавляемые в круглодонную колбу, не слишком вязкие, можно использовать магнитную мешалку.
во избежание резких ударов кипящей жидкости и обеспечения равномерного нагрева.Как показано на рисунке 2,
при использовании магнитной мешалки вместо нагревательного кожуха следует использовать горячую плиту, потому что
он содержит магнитную мешалку, позволяющую автоматически вращать стержень во время рефлюкса
Конденсатор всегда полностью заполнен водой для обеспечения эффективного охлаждения.
Пары, выделяющиеся из жидкой реакционной смеси, переходят из газовой
фаза обратно в жидкую фазу из-за потери тепла. Это затем заставляет жидкую смесь
упасть обратно в круглодонную колбу.
Во время реакции часть растворителя поднимается по трубке конденсатора, прежде чем
конденсируясь обратно в
колба. Выше этой точки внутренняя рубашка конденсатора будет казаться сухой. Ниже этой точки
растворитель течет обратно в колбу. Граница между этими двумя частями — обратное кольцо. В
температура реакции должна быть установлена так, чтобы кольцо флегмы составляло от одной трети до половины.
вверх по конденсатору.
Чтобы знать, что точка кипения достигнута, внутри образуются пузырьки пара.
жидкость.Если увеличить скорость нагрева, температура реагентов не изменится.
изменяются, но скорость, с которой кипящая жидкость переходит в парообразную форму, увеличивается.
Это увеличение вызвано увеличенным запасом энергии, что способствует увеличению количества жидкости.
молекулы преодолевают межмолекулярные взаимодействия и переходят в газовую фазу.
При нагревании смеси двух или более летучих соединений общее давление пара
(PT) смеси равна сумме давлений паров соединения 1 и 2 (P1 и P2)
в смеси.Величина давления пара, оказываемого каждым соединением, определяется.
давлением паров этого соединения (P0) и мольными долями обоих соединений 1
и 2 присутствуют в смеси (X1 и X2).
Для идеального двухкомпонентного раствора решение
Давление пара выражается законом Рауля, представленным в уравнении ниже:
PT = X1P10 + X2P20 [1]
Температура кипения варьируется в зависимости от смеси.Гомогенные смеси кипятят при
температура между точками кипения чистых соединений, но точное значение зависит
от количества (массы или объема) каждого соединения.
Например, жидкая смесь при кипячении будет давать пар, который будет содержать больше
процентов более летучего соединения. В смеси циклогексана и толуола циклогексан
является более летучим между двумя и жидкостью, состоящей на 50 процентов из циклогексана и
50-процентный толуол закипает при 90 ° C и дает пар, состоящий на 70 процентов из циклогексана.
и 30 процентов толуола.
Когда дело доходит до разделения соединений — общий метод, используемый в органической химии.
это дистилляция, которая разделяет соединения в зависимости от разницы в точках кипения.
В более сложных экспериментах кипячение и дистилляция могут проводиться одновременно.
время. Например, при кипячении с обратным холодильником можно проводить микромасштабную дистилляцию.
выходят на специализированное оборудование. Микромасштабная дистилляция сокращает путь дистилляции
чтобы уменьшить вероятность материальных потерь в процессе.
Примечание: Пары нагретой жидкости поднимаются вверх и охлаждаются, чтобы конденсироваться на любом из
внутри стенок головки Хикмана или на стенках конденсатора.
Жидкость, стекающая вниз, собирается в круглом колодце на дне дистиллятора.
1. Коническая пробирка должна быть надежно прикреплена к дистилляционной головке Hickman и
воздушный конденсатор с помощью компрессионного колпачка и металлического зажима.Все части должны иметь
стык с матовым стеклом и хорошо подогнаны друг к другу, чтобы не было серьезных утечек.
2. Вращающуюся лопатку следует поместить в конический флакон и направить вниз.
Плоская перегородка и небольшой компрессионный колпачок используются для закрытия бокового порта
Голова Хикмана. Вся установка помещается в соответствующее отверстие в алюминиевом блоке или
песка и центрируйте конфорку перед началом перемешивания (в противном случае отжим
лопасть перевернется и будет неправильно вращаться).
3. Головку Хикмана и воздушный конденсатор необходимо охладить влажным бумажным полотенцем.
Источник тепла должен быть установлен так, чтобы интересующее соединение медленно перегонялось.
В приведенной выше схеме дистилляционная головка Hickman действует как воздушный конденсатор.
и емкость для сбора конденсата для простой или фракционной перегонки. Хикман
head можно разделить на два типа: портированные и непортированные.
С перенесенной головкой Хикмана проще собирать фракции. Для этого необходимо открыть порт.
для удаления жидкости из лунки с помощью пипетки Пастера (см. «C» на рисунке 3).
Для непереносимой головки Хикмана используется пипетка Пастера для отвода жидкости сверху. (см’).
Если используется конденсатор или внутренний термометр, перегонный аппарат должен быть частично разобран в
чтобы сделать это. В некоторых кадрах внутренний диаметр головки настолько мал, что до нее трудно дотянуться.
вставьте под углом к пипетке и войдите в контакт с жидкостью.Чтобы решить эту проблему, наконечник пипетки
следует слегка согнуть в огне.
После удаления жидкость переносится в небольшой флакон и закрывается тефлоновым колпачком.
Если во флаконе более одного летучего соединения, для дистилляции необходимо будет начать с медленного нагрева.
сначала соединение с более низкой температурой кипения. Таким образом, компаунды с разницей температур кипения не менее 50 oC могут
быть разделенными относительно чисто.
Напоследок несколько советов:
1.Конический флакон не должен быть заполнен более чем наполовину, чтобы оставалось достаточно места.
чтобы жидкость закипела. В противном случае раствор выльется или выльется наружу, когда закипит.
2. Хорошее уплотнение между стыками сводит к минимуму потерю целевого соединения во время
перегонка. Это также предотвращает попадание состава на конфорку и возможное возгорание.
несчастный случай.
3. Необходимо использовать соответствующую настройку температуры. Часто водяная или масляная баня
используется для лучшего контроля температуры.Если в качестве источника тепла используется нагревательный кожух, он должен
быть подключенным к регулятору мощности.
1.3 Физические и химические свойства — Химия
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения вещества как физические или химические
- Определять свойства материи как экстенсивные или интенсивные
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами.Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи). Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными бирками для защиты от кражи) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета).В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Рис. 1. (a) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (б) Конденсация пара внутри кастрюли — это физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит а: модификация работы «95jb14» / Wikimedia Commons; кредит б: модификация работы «mjneuby» / Flickr)
Изменение одного типа вещества в другой (или невозможность изменения) — это химическое свойство .Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Рис. 2. (a) Одно из химических свойств железа — то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что это не так.(кредит а: модификация работы Тони Хисгетта; кредит б: модификация работы «Атома» / Wikimedia Commons)
Чтобы определить химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества.Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Рис. 3. (a) Медь и азотная кислота претерпевают химические изменения с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара.(c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи делятся на две категории. Если свойство зависит от количества присутствующего вещества, это обширное свойство .Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества. Если свойство образца вещества не зависит от количества присутствующего вещества, это свойство интенсивно . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C.В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Алмаз опасности
Вы могли видеть символ, показанный на Рисунке 4, на контейнерах с химическими веществами в лаборатории или на рабочем месте.Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», предоставляет ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рис. 4. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ.Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки). Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д.Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 4). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 4. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным.
Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории.Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Химия: упражнения в конце главы
- Классифицируйте шесть подчеркнутых свойств в следующем абзаце как химические или физические:
Фтор — бледно-желтый газ , реагирует с большинством веществ .Свободный элемент плавится при −220 ° C и кипит при −188 ° C . Мелкодисперсные металлы горят во фторе ярким пламенем. Девятнадцать граммов фтора вступят в реакцию с 1,0 граммами водорода .
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) конденсация пара
(б) сжигание бензина
(в) сквашивание молока
(г) растворение сахара в воде
(д) плавка золота
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) сжигание угля
(б) таяние льда
(c) смешивание шоколадного сиропа с молоком
(г) взрыв петарды
(д) намагничивание отвертки
- Объем пробы газообразного кислорода изменился с 10 мл до 11 мл при изменении температуры.Это химическое или физическое изменение?
- 2,0-литровый объем газообразного водорода в сочетании с 1,0 литром газообразного кислорода для получения 2,0 литров водяного пара. Кислород претерпевает химические или физические изменения?
- Объясните разницу между экстенсивными и интенсивными свойствами.
- Определите следующие свойства как экстенсивные или интенсивные.
(а) том
(б) температура
(в) влажность
(г) тепло
(е) точка кипения
- Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
.
