Содержание
Тепловой эффект химической реакции. Термохимическое уравнение / Справочник :: Бингоскул
Когда исходные вещества начинают реагировать друг с другом, то происходит взаимодействие молекул между собой. При этом выделяется большое количество энергии, после образования окончательных продуктов. Во время разрушения кристаллической решетки, поглощается тепло. Оно имеет разные формы: энергию, свет, фотоны, звук.
Тепловой эффект химической реакции
Тепловой эффект – это количества тепла или энергии, которое выделилось или поглотилось во время химической реакции, относительно 1 моль вещества. В химии тепловой эффект обозначают символом Q, измеряют в ккал/моль или кДж/моль. Согласно определению выделяют два типа процессов:
- Экзотермические реакции – протекают с выделением тепла, процесс происходит быстро, в конце реакции записывается, как +Q.
- Эндотермические реакции – протекают с поглощением тепла.
 Чтобы получить конечный продукт, реагенты нагревают. Процессы занимают много времени. В конце реакции обозначаются, как –Q.
Чтобы получить конечный продукт, реагенты нагревают. Процессы занимают много времени. В конце реакции обозначаются, как –Q.
Чем больше прореагирует химического вещества, тем больше выделиться энергии. Следовательно, тепловой эффект зависит от химического вещества в моль вступившего в реакцию.
Экзотермическая реакция |
|
| Эндотермическая реакция |
|
По энергии ионизации реагенты в эндотермической реакции находятся выше оси нулевой энергии, т.е. скорость прямой реакции выше, чем обратной и наоборот, в эндотермических реакциях – скорость обратной реакции выше, чем прямой.
Термохимическое уравнение
Химические уравнения, в которых отображается тепловой эффект называются термохимическими. При записи в скобках обязательно указывают агрегатное состояние вещества: твердое, жидкое, газообразное и другое. Коэффициенты прописываются в условии: дробные или цельные числа.
При записи в скобках обязательно указывают агрегатное состояние вещества: твердое, жидкое, газообразное и другое. Коэффициенты прописываются в условии: дробные или цельные числа.
При расчете учитывают температуру и давление, при которых протекает процесс. Если в условиях задачи не прописаны значения, то их принимают как стандартные: температура 278К, а давление 110,3 кПа.
В конце записи химического уравнения записывают значение Q0, которое берут в справочнике, отдельно для каждого вещества. Энергия представлена в кДж в стандартных условиях. Применяется для расчета по формулам.
Расчеты по термохимическим уравнениям
Термохимические уравнения записываются в готовом виде с коэффициентами, представленной энергией. Целью задачи обычно стоит выяснить массу прореагировавшего вещества или выяснить потраченную энергию до десятых.
Для правильного расчета необходимо знать правила составления пропорции и формулу для расчета химического количества вещества в 1 моле.
Примеры задач
Задача 1
45 г глюкозы (С6Н12О6) подвергли обработке избытком кислорода, в результате чего выделилось 700 кДж энергии. Выясните значение теплового эффекта? Реакция протекала по следующей формуле:
С6Н12О6 (тв) + 6О2(газ) = 6СО2(газ) + 6Н2О(газ) + 700 кДж
Решение:
Найдем химическое количество глюкозы:
n(C6H12O6) = m(C6H12O6) : M(C6H12O6) = 45 г : 180 г/моль = 0,25 моль;
Получается, что при взаимодействии 0,25 моль вещества образуется 700 кДж энергии. Тепловой эффект приравнивают к значению 1 моль. Следовательно, составим пропорцию:
0,25 моль – 700 кДж
1 моль – Q кДж
Q = (1* 700) : 0,25 = 700 : 0,25 = 2800 кДж
Задача 2
Представлено термохимическое уравнение, в процессе которого выделилось 3330 кДж энергии, образовалось 68 г Al2O3. Рассчитайте какое количества тепла выделилось, уравнение имеет следующий вид:
Рассчитайте какое количества тепла выделилось, уравнение имеет следующий вид:
3Fe3O4 (тв) + 8A(тв)l = 9 Fe(тв) + 4Al2O3(тв) + 3300Дж
Решение:
Найдем химическое количество оксида алюминия(III):
n(Al2O3)= m(Al2O3 : M(Al2O3) = 68 г : 102 г/моль = 0,677 моль;
Исходя из исходного уравнения, для получения 4 моль оксида алюминия(III) расходуется 3330 кДж энергии, для того, чтобы выяснить, сколько выделяется тепла для 68 г, нужно составить пропорцию:
4 моль – 3330 кДж
0,667 моль – Q кДж
Q = (0,667 * 3330) : 4 = 2,221 : 4 = 555 кДж;
Закон Гесса
В 1840 году русский ученый описал закон термохимии, который до сих пор используется. Его называют законом Гесса:
- Тепловой эффект зависит от агрегатного состояния начальных и конечных продуктов, промежуточные стадии, не влияют.
Это правило помогает узнать тепловой эффект промежуточных стадий. Он будет равен разнице между начальным и конечным значением. По сумме переходных реакций выясняют общий тепловой эффект.
Он будет равен разнице между начальным и конечным значением. По сумме переходных реакций выясняют общий тепловой эффект.
Тепловой эффект химических реакций
Количество теплоты, которые выделяется или поглощается в результате реакции, называют тепловым эффектом данной реакции.
Смотри также:
В НГАСУ (Сибстрин) прошло заседание Попечительского совета 20 мая 2021 года в Новосибирском государственном архитектурно-строительном университете (Сибстрин) состоялось очередное заседание Попечительского совета вуза. Члены совета и руководство НГАСУ (Сибстрин) обсудили основные результаты работы за 2020 год и наметили направления дальнейшего сотрудничества.
|
НГАСУ (Сибстрин) отпраздновал свой 91-й день рождения 20 мая 2021 года преподаватели, сотрудники, студенты и партнеры отметили 91-й день рождения Новосибирского государственного архитектурно-строительного университета (Сибстрин). За эти годы вуз прошел большой и яркий путь развития и подготовил более 50 тысяч специалистов для отрасли. Сегодня Сибстрин – один из ведущих строительных вузов СФО и России.
|
Объявление о конкурсе на замещение вакантных должностей профессорско-преподавательского состава Квалификационные требования по должностям педагогических работников, относящихся к профессорско-преподавательскому составу (в соответствии с приказом Минздравсоцразвития РФ от 11.01.2011 № 1н)
|
Приглашаем на «Открытый урок» в рамках федерального просветительского марафона «Новое знание» С 20 по 22 мая 2021 года российское общество «Знание» проводит просветительский марафон «Новое знание».
|
Задача по химии №472
Решение.
1. В химической реакции, протекающей по уравнению:
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г)
Тепловой эффект реакции (∆Нх.р.), исходя из следствия закона Гесса, равен сумме теплот образования ∆Нобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
∆Нх.р.= ∑Нобр.прод. — ∑Нобр.исх.
∆Нх.р.= (2 ∆Н°Fe(к) +3∆Н°Н2О (г)) – (∆Н° Fe2O3(к) + 3 ∆Н°Н2г)
— теплоты образования простых веществ условно приняты равными нулю;
— теплота образования Н2О (г) равна -241.83 (по табл. №5)
— теплота образования Fe2O3(к) равна -822.10 (см.табл.№5)
Исходя из указанных данных:
∆Нх.р.= 3(-241.83) – (-822.10) = -725.49 – (-822.10) = 96.61 кДж
Ответ: ∆Нх.р.= 96.61 кДж
Примечание: в условии задачи №113 (стр. 51 методических указаний) в праой части уравнения перед молекулой воды проставлен коэффициент 2, считаю, что коэффициент должен быть 3.
2. Изменение энтропии продуктов химической реакции, протекающей по уравнению
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г),
Рассчитывается по формуле:
∆Sх.р.= ∑Sпрод. — ∑Sисх.
∆Sх.р.= (2 ∆S°Fe(к) +3∆S°Н2О (г)) – (∆S° Fe2O3(к) + 3 ∆S°Н2г), где:
∆S°Fe(к)= 27.2 Дж/(моль*К)
∆S°Н2О (г))= 188.72 Дж/(моль*К)
∆S° Fe2O3(к) = 89.96 Дж/(моль*К)
∆S° O/h3(г) = 130.59 Дж/(моль*К)
(данные из табл.7)
С учетом этих данных:
∆Sх.р.= (2*27.2 +3*188.72) – (89.96+3*130.59) = 620.56-481.73 = 138.83 Дж/(моль*К)
Ответ: ∆Sх.р.= 138.83 Дж/(моль*К)
3. Мерой химического сродства (∆G°) является убыль энергии Гиббса (изменение изобарно- термического потенциала или энергии Гиббса).
Убыль энергии Гиббса ∆G°х.р. в химической реакции
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г)
вычисляем по формуле:
∆G°х. р = ∆Н° — Т*∆S°
р = ∆Н° — Т*∆S°
∆G°х.р = 96.61 – 298*0.13883 = 96.61-41.37 = +55.24кДж
Ответ: ∆G°х.р = +55.24кДж
Т.к. ∆G°х.р. > 0, то реакция при стандартных условиях невозможна; при этих условиях пойдет обратная реакция — окисление железа (коррозия).
Определяем температуру, при которой ∆G°х.р.= 0
∆Н = Т*∆S, отсюда Т = ∆Н/∆S = 96.61/0.13883 = 695.9°К,
отсюда находим убыль энергии при 500°К :
∆G500 =96.61-500*0.13883 кДж = +27.19 кДж
Таким образом, ∆G при температуре 500°К составляет +27.19 кДж,
т.е. ∆G > 0 и реакция невозможна.
При температуре 2000°К находим ∆G2000 аналогично:
∆G2000 = 96.61 – 2000*0.13883 = 96.61 -277.66 = — 181.кДж
∆G2000 = — 181.кДж
∆G2000 <0, значит при температуре 2000°К реакция возможна.
Примечание:
Поскольку изначальная температура, при которой начинается реакция по уравнению
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г),
из вышеприведенных расчетов равна 695. 9°К, то путем сравнения температур можно сразу определить, что при температуре 500°К реакция не пойдет, а при температуре выше 695.9, т.е. при 2000°К пойдет с получением продуктов согласно уравнению.
9°К, то путем сравнения температур можно сразу определить, что при температуре 500°К реакция не пойдет, а при температуре выше 695.9, т.е. при 2000°К пойдет с получением продуктов согласно уравнению.
1. | |
а) раздел химии, изучающий тепловые эффекты химических реакций и фазовых | б) раздел химии, изучающий кинетические закономерности реакции |
в) раздел химии, изучающий таутомерные и изомерные превращения | г) раздел химии, изучающий неорганические кристаллы |
2. | |
б) температура | |
г) концентрация | |
3. | |
а) теплотой сгорания этого вещества; | б) теплотой возгонки этого вещества |
в) теплотой адсорбции этого вещества | г) теплотой десорбции этого вещества |
4. | |
а) увеличивается в 2–4 раза; | б) увеличивается в 5–10 раз |
в) уменьшается в 2–4 раза; | г) уменьшается в 5–10 раз |
5. | |
а) адсорбция – экзотермический процесс; | б) адсорбция увеличивается с увеличением температуры |
в) адсорбция уменьшается с увеличением концентрации адсорбирующихся | г) адсорбция – эндотермический |
6. | |
а) частицы, энергия которых ниже энергии активации, называют активными; | б) с увеличением энергии активации уменьшается доля активных молекул |
в) с увеличением энергии активации увеличивается скорость реакции | г) все вышеперечисленные |
7. | |
а) запасом ее внутренней энергии; | б) запасом ее потенциальной энергии |
в) запасом произведения внутренней, кинетической и потенциальной энергий | г) запасом ее кинетической энергии |
8. | |
9. | |
а) оба – кислоты; | б) основания и кислоты |
в) кислоты и основания | г) оба – основания |
10. | |
а) увеличение запаса | б) уменьшение запаса внутренней энергии |
в) уменьшение запаса кинетической энергии | г) уменьшение запаса потенциальной энергии |
Примеры решения задач
При решении задач
этого раздела следует пользоваться
табл. I
I
приложения Б.
Пример 3.1. Вычислить
тепловой эффект и написать термохимическое
уравнение реакции горения ацетилена,
в результате которой образуются пары
воды и диоксид углерода. Сколько теплоты
выделится при сгорании 10 л ацетилена
(н.у.)?
Решение.
Реакция горения ацетилена протекает
по уравнению
С2Н2
(г)+ 5½О2
(г)=
2СО2 (г)+ Н2О
(г).
Пользуясь
следствием из закона Гесса и справочными
данными из табл.I,
вычисляем тепловой эффект реакции:
DH0х.р.
= (2
+
)
− (+
5½)
DH0х.р.
= [2(-393,5) +
(-241,8)] − (226,8 + 5½
∙ 0) = -1255,6
кДж.
Термохимическими
называются уравнения химических реакций,
в которых указано изменение энтальпии.
Изменение энтальпии (тепловой эффект)
записывают в правой части уравнения
после запятой.
Термохимическое
уравнение реакции горения ацетилена
имеет вид:
С2Н2
(г) + 5½О2
(г)=
2СО2 (г)+ Н2О
(г),DH0х. р.
р.
= –1255,6 кДж.
Тепловой эффект
обычно относят к одному молю вещества.
Следовательно, при сжигании 1 моль С2Н2
выделяется 1255,6 кДж. Однако по условию
задачи сжигается 10 л ацетилена, что
составляет 10 / 22,4 = 0,446 моль С2Н2,
где 22,4 л/моль – мольный объем любого
газа при нормальных условиях. Таким
образом, при сгорании 0,446 моль (10 л) С2Н2
выделится 0,446×(1255,6)
= 560 кДж теплоты.
Пример 3.2.
Реакция идет по уравнению Fe2O3
+ 2Al
= 2Fe
+ Al2O3.
При восстановлении
48 г Fe2O3
выделяется 256,1 кДж теплоты. Вычислить
тепловой эффект реакции и стандартную
энтальпию образования Fe2O3.
Решение.
Число
молей Fe2O3,
содержащихся в 48 г Fe2O3,
составляет 48 / 160 = 0,3 моль, где 160
г/моль – молярная масса Fe2O3.
Так как тепловой эффект относят к 1 моль
вещества, то тепловой эффект данной
реакции равен –256,1 / 0,3 = –853,7 кДж.
Запишем термохимическое уравнение этой
реакции:
Fe2O3
+ 2Al
= 2Fe
+ Al2O3,
DH0х.р.=
–853,8 кДж/
Формула для расчета
теплового эффекта данной реакции имеет
вид
DH0х.р.=
(2+)
– (+ 2),
отсюда находим
=
2+
– 2
–
.
После подстановки справочных данных из табл.Iполучаем:
= 2
×
0 – 1676 – 2
×
0 + 853,8 =
–822,2 кДж/моль.
Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
Пример 3.3.
Исходя
из термохимических уравнений
Н2
(г)+ О2
(г) = Н2О2
(ж),
=
–187 кДж; (1)
Н2О2
(ж) + Н2
(г) = 2Н2О
(г),
= –297 кДж;
(2)
Н2О
(г) = Н2О
(ж),
=
– 44 кДж,
(3)
рассчитать
значение стандартной энтальпии реакции
образования Н2О
(ж).
Решение.
Запишем
уравнение реакции, тепловой эффект
которой необходимо определить: Н2
(г)+
½О2
(г) = Н2О
(ж),
–?
(4)
В уравнения (1),
(2), (3) входят Н2О2
(ж) и Н2О
(г), которые не входят в уравнение (4).
Чтобы исключить их из уравнений (1), (2),
(3), умножим уравнение (3) на 2 и сложим все
три уравнения:
Н2
(г) + О2
(г) + Н2О2
(ж)+ Н2
(г)+ 2Н2О
(г) = Н2О2
(ж)+ 2Н2О
(г)+
2Н2О
(ж). (5)
После
преобразования уравнения (5) и деления
его на 2 получаем искомое уравнение (4).
Аналогичные действия проделаем с
тепловыми эффектами:
.=
В результате
получаем
Дж;
т.е. энтальпия
образования Н2О
(ж).
= –286 кДж/моль.
Пример 3.4. В
каком направлении будет протекать
реакция при стандартных условиях
СН4 (г)
+ СО2 (г)
↔ 2СО (г) + 2Н2
(г)
Решение.
Направление
протекания химической реакции определяет
энергия Гиббса (∆G).
Изменение энергии Гиббса в
результате химической реакции
равно сумме энергий Гиббса образования
продуктов реакции за вычетом суммы
энергий Гиббса образования исходных
веществ с учетом стехиометрических
коэффициентов.
Формула для расчета изменение энергии
Гиббса изучаемой реакции имеет вид:
Значения
берем из табл. 1 приложения и получаем:
[2
∙ (-137,1) + 2 ∙ 0] − [(-50,8) + (-394,4)] = +171 кДж.
При р=const,
T=constреакция
самопроизвольно протекает в том
направлении, которому отвечает убыль
энергии Гиббса. Если ∆G< 0,
то реакция
самопроизвольно
протекает в прямом направлении. Если
Если
∆G> 0,
то
самопроизвольное протекание процесса
в прямом направлении невозможно. Если
∆G
= 0, то
реакция может протекать как в прямом
направлении, так и в обратном, и система
находится в состоянии равновесия.
Так как ∆G0х.р
= +171 кДж, т.е. > 0, то самопроизвольное
протекание данной реакции в прямом
направлении в стандартных условиях
невозможно.
Пример 3.5.
Определить изменение энтропии в
стандартных условиях для реакции
С (графит)
+ 2Н2 (г)
= СН4 (г)
Решение.
Изменение
энтропии системы
в результате протекания химической
реакции (∆S)
(энтропия реакции) равно
сумме энтропий продуктов реакции за
вычетом суммы энтропий исходных веществ
с учетом стехиометрических коэффициентов:
\ ominus_f \; (реагенты) \]
Поскольку энтальпия является функцией состояния, теплота реакции зависит только от конечного и начального состояний, а не от пути, по которому идет реакция. Например, реакция \ (A \ rightarrow B \) проходит через промежуточные этапы (т.е. \ (C \ rightarrow D \)), но A и B остаются нетронутыми.
Например, реакция \ (A \ rightarrow B \) проходит через промежуточные этапы (т.е. \ (C \ rightarrow D \)), но A и B остаются нетронутыми.
Следовательно, можно измерить энтальпию реакции как сумму ΔH трех реакций, применив закон Гесса.
Пример \ (\ PageIndex {1} \): сжигание ацетилена
Вычислить изменение энтальпии при сгорании ацетилена (\ (\ ce {C2h3} \))
Решение
1) Первый шаг — убедиться, что уравнение сбалансировано и верно.Помните, что для сгорания углеводорода требуется кислород, что приводит к образованию углекислого газа и воды.
\ [\ ce {2C2h3 (г) + 5O2 (г) -> 4CO2 (г) + 2h3O (г)} \]
2) Затем найдите таблицу стандартных энтальпий образования, чтобы найти значения для компонентов реакции (таблица 7.2, текст Петруччи)
3) Сначала найдите энтальпии продуктов:
ΔHº f CO 2 = -393,5 кДж / моль
Умножьте это значение на стехиометрический коэффициент, который в данном случае равен 4 молям.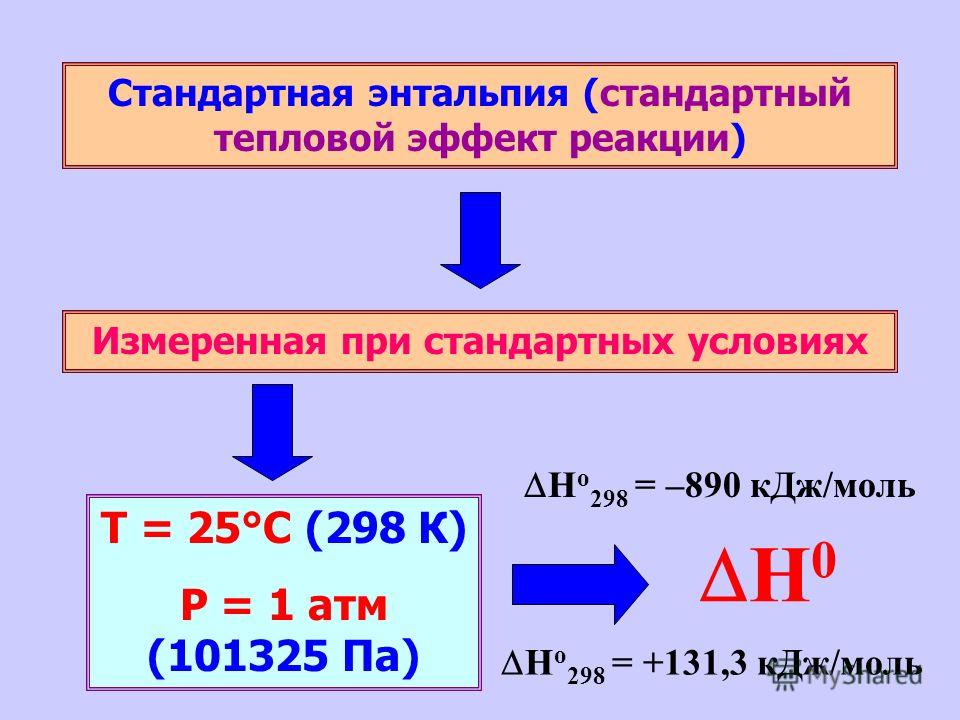
v p ΔH º f CO 2 = 4 моль (-393,5 кДж / моль)
= -1574 кДж
ΔH º f H 2 O = -241,8 кДж / моль
Стехиометрический коэффициент этого соединения равен 2 молям. Итак,
v p ΔH º f H 2 O = 2 моль (-241,8 кДж / моль)
= -483,6 кДж
Теперь сложите эти два значения, чтобы получить сумму произведений
Сумма произведений (Σ v p ΔHº f (продукты)) = (-1574 кДж) + (-483.6 кДж) = -2057,6 кДж
Теперь найдите энтальпии реагентов:
ΔHº f C 2 H 2 = +227 кДж / моль
Умножьте это значение на стехиометрический коэффициент, который в данном случае равен 2 молям.
v p ΔHº f C 2 H 2 = 2 моль (+227 кДж / моль)
= +454 кДж
ΔHº f O 2 = 0,00 кДж / моль
Стехиометрический коэффициент этого соединения равен 5 моль. Итак,
Итак,
v p ΔHº f O 2 = 5 моль (0,00 кДж / моль)
= 0,00 кДж
Сложите эти два значения, чтобы получить сумму реагентов
Сумма реагентов (Δ v r ΔHº f (реагенты)) = (+454 кДж) + (0,00 кДж) = +454 кДж
Сумму реагентов и продуктов теперь можно подставить в формулу:
ΔHº = Δ v p ΔHº f (продукты) -? v r ΔHº f (реагенты)
= -2057.6 кДж — +454 кДж
= -2511,6 кДж
Энтальпия и химические реакции — Вводная химия — 1-е канадское издание
Цели обучения
- Определите энтальпии .
- Правильно выразите изменение энтальпии химических реакций.
- Объясните, как изменения энтальпии измеряются экспериментально.
Теперь, когда мы показали, как связаны энергия, работа и тепло, мы готовы рассмотреть изменения энергии в химических реакциях. Фундаментальная концепция состоит в том, что каждая химическая реакция происходит с одновременным изменением энергии . Теперь нам нужно научиться правильно выражать эти энергетические изменения.
Фундаментальная концепция состоит в том, что каждая химическая реакция происходит с одновременным изменением энергии . Теперь нам нужно научиться правильно выражать эти энергетические изменения.
Наше исследование газов в главе 6 «Газы» и наше определение работы в разделе 7.2 «Работа и тепло» показывают, что такие условия, как давление, объем и температура, влияют на энергосодержание системы. Что нам нужно, так это определение энергии, которое имеет место, когда указаны некоторые из этих условий (что-то вроде нашего определения стандартной температуры и давления в нашем исследовании газов).Мы определяем изменение энтальпии (Δ H ) как тепло процесса при постоянном давлении:
ΔH ≡ q при постоянном давлении
Буква H означает «энтальпию», вид энергии, а Δ означает изменение количества. Нас всегда будет интересовать изменение H , а не абсолютное значение самого H .
Когда происходит химическая реакция, наблюдается характерное изменение энтальпии. Изменение энтальпии реакции обычно записывается после сбалансированного химического уравнения и в той же строке.Например, когда два моля водорода реагируют с одним молем кислорода с образованием двух моль воды, характерное изменение энтальпии составляет 570 кДж. Запишем уравнение как
Изменение энтальпии реакции обычно записывается после сбалансированного химического уравнения и в той же строке.Например, когда два моля водорода реагируют с одним молем кислорода с образованием двух моль воды, характерное изменение энтальпии составляет 570 кДж. Запишем уравнение как
2 H 2 (г) + O 2 (г) → 2 H 2 O (ℓ) Δ H = −570 кДж
Химическое уравнение, которое включает изменение энтальпии, называется термохимическим уравнением. Предполагается, что термохимическое уравнение относится к уравнению в молярных количествах, что означает, что его следует интерпретировать с точки зрения молей, а не отдельных молекул.
Пример 5
Напишите термохимическое уравнение реакции PCl 3 (г) с Cl 2 (г), чтобы получить PCl 5 (г), у которого изменение энтальпии составляет -88 кДж.
Решение
Термохимическое уравнение
PCl 3 (г) + Cl 2 (г) → PCl 5 (г) Δ H = −88 кДж
Проверьте себя
Напишите термохимическое уравнение реакции N 2 (г) с O 2 (г) с образованием 2NO (г) с изменением энтальпии 181 кДж.
Ответ
N 2 (г) + O 2 (г) → 2 NO (г) Δ H = 181 кДж
Вы могли заметить, что Δ H для химической реакции может быть положительным или отрицательным. Число считается положительным, если у него нет знака; знак + можно добавить явно, чтобы избежать путаницы. Химическая реакция с положительной Δ H называется эндотермической, а химическая реакция с отрицательной Δ H — экзотермической.
Что означает положительное значение Δ H процесса? Это означает, что система, в которой происходит химическая реакция, набирает энергию. Если рассматривать энергию системы в виде высоты на вертикальном графике энергии, изменение энтальпии, которое сопровождает реакцию, можно представить в виде диаграммы в части (а) на рисунке 7.3 «Энергия реакции»: энергия реагентов имеет немного энергии, и система увеличивает свою энергию по мере того, как она переходит в продукты. Продукты выше по вертикали, чем реагенты. Таким образом, эндотермический режим означает, что система получает или поглощает энергию.
Таким образом, эндотермический режим означает, что система получает или поглощает энергию.
Противоположная ситуация существует для экзотермического процесса, как показано в части (b) на Рисунке 7.3 «Энергия реакции». Если изменение энтальпии реакции отрицательное, система теряет энергию, поэтому продукты имеют меньше энергии, чем реагенты, а продукты ниже по вертикальной шкале энергии, чем реагенты. Таким образом, экзотермический эффект означает, что система теряет или отдает энергию.
Рисунок 7.3 Энергия реакции
(a) При эндотермической реакции энергия системы увеличивается (т. Е. Перемещается выше по вертикальной шкале энергии). (б) При экзотермической реакции энергия системы уменьшается (т.е. перемещается ниже по вертикальной шкале энергии).
Пример 6
Рассмотрим это термохимическое уравнение.
2 CO (г) + O 2 (г) → 2 CO 2 (г) Δ H = −565 кДж
Экзотермический или эндотермический? Сколько энергии выделяется или поглощается?
Решение
По определению, химическая реакция с отрицательной Δ H является экзотермической, что означает, что такая большая энергия — в данном случае 565 кДж — выделяется реакцией.
Проверьте себя
Рассмотрим это термохимическое уравнение.
CO 2 (г) + H 2 (г) → CO (г) + H 2 O (г) Δ H = 42 кДж
Экзотермический или эндотермический? Сколько энергии выделяется или поглощается?
Ответ
эндотермический; Поглощается 42 кДж.
Как экспериментально измеряются значения Δ H ? На самом деле Δ H не измеряется; q измеряется.Но измерения проводятся в условиях постоянного давления, поэтому Δ H равно измеренному q .
Экспериментально q измеряется с помощью уравнения
q = мк Δ T
Мы предварительно измеряем массу химикатов в системе. Затем мы позволяем протекать химической реакции и измеряем изменение температуры (Δ T ) системы. Если мы знаем удельную теплоемкость материалов в системе (как правило, мы это знаем), мы можем вычислить q . Это значение q численно равно Δ H процесса, которое мы можем масштабировать до молярной шкалы. Контейнер, в котором находится система, обычно изолирован, поэтому любое изменение энергии идет на изменение температуры системы, а не на утечку из системы. Контейнер называется калориметром, а процесс измерения изменений энтальпии называется калориметрией.
Это значение q численно равно Δ H процесса, которое мы можем масштабировать до молярной шкалы. Контейнер, в котором находится система, обычно изолирован, поэтому любое изменение энергии идет на изменение температуры системы, а не на утечку из системы. Контейнер называется калориметром, а процесс измерения изменений энтальпии называется калориметрией.
Рисунок 7.4 Калориметры
Простой калориметр может быть построен из нескольких вложенных друг в друга поролоновых кофейных чашек, крышки, термометра и мешалки.
Например, предположим, что 4,0 г NaOH или 0,10 моль NaOH растворяются для получения 100,0 мл водного раствора, а 3,65 г HCl или 0,10 моль HCl растворяются для получения еще 100,0 мл водного раствора. Два раствора смешивают в изолированном калориметре, вставляют термометр и накрывают калориметр (см. Рисунок 7.4 «Калориметры» для примера установки). Термометр измеряет изменение температуры, поскольку происходит следующая химическая реакция:
NaOH (водн. ) + HCl (водн.) → NaCl (водн.) + H 2 O ()
) + HCl (водн.) → NaCl (водн.) + H 2 O ()
Наблюдатель отмечает, что температура повышается с 22.От 4 ° C до 29,1 ° C. Предполагая, что теплоемкость и плотность растворов такие же, как у чистой воды, теперь у нас есть информация, необходимая для определения изменения энтальпии химической реакции. Общее количество раствора составляет 200,0 мл, а при плотности 1,00 г / мл мы получаем 200,0 г раствора. Используя уравнение для q , мы заменяем наши экспериментальные измерения и удельную теплоемкость воды (Таблица 7.1 «Удельная теплоемкость различных веществ»):
Решая для q , получаем
q = 5,600 Дж ≡ ΔH для реакции
Теплота q равна Δ H для реакции, потому что химическая реакция происходит при постоянном давлении.Однако реакция выделяет такое количество энергии, поэтому фактический знак Δ H отрицательный:
Δ H = −5,600 Дж для реакции
Таким образом, мы имеем следующее термохимическое уравнение химической реакции, протекающей в калориметре:
Коэффициенты 1/10 присутствуют, чтобы напомнить нам, что мы начали с одной десятой моля каждого реагента, поэтому мы получаем одну десятую моля каждого продукта. Однако обычно мы приводим термохимические уравнения в молях, а не в одной десятой части моля.Чтобы перейти к молярным величинам, мы должны умножить коэффициенты на 10. Однако, когда мы это сделаем, мы получим в 10 раз больше энергии. Таким образом, имеем
Однако обычно мы приводим термохимические уравнения в молях, а не в одной десятой части моля.Чтобы перейти к молярным величинам, мы должны умножить коэффициенты на 10. Однако, когда мы это сделаем, мы получим в 10 раз больше энергии. Таким образом, имеем
NaOH (водн.) + HCl (водн.) → NaCl (водн.) + H 2 O (ℓ) Δ H = −56000 Дж
Δ H может быть преобразовано в единицы кДж, поэтому окончательное термохимическое уравнение составляет
.
NaOH (водн.) + HCl (водн.) → NaCl (водн.) + H 2 O (ℓ) Δ H = −56 кДж
Мы только что взяли наши экспериментальные данные из калориметрии и определили изменение энтальпии химической реакции.Аналогичные измерения других химических реакций могут определить значения Δ H любой химической реакции, которую вы хотите изучить.
Пример 7
100 мл раствора 0,25 моль Ca 2+ (водн.) Смешали с 0,50 моль ионов F — (водн.), И выпал CaF 2 :
Ca 2+ (водн. ) + 2 F — (водн.) → CaF 2 (s)
) + 2 F — (водн.) → CaF 2 (s)
Температура раствора увеличилась на 10,5 ° C. Как изменилась энтальпия химической реакции? Каково изменение энтальпии при производстве 1 моля CaF 2 ? Предположим, что раствор имеет ту же плотность и удельную теплоемкость, что и вода.
Решение
Поскольку нам дано Δ T напрямую, мы можем определить теплоту реакции, которая равна Δ H :
Решая для q , получаем
q = 4400 Дж
Следовательно, Δ H = −4 400 Дж.
Согласно стехиометрии реакции, образуется точно 0,25 моль CaF 2 , поэтому это количество тепла составляет 0,25 моль. Для 1 моля CaF 2 нам нужно увеличить тепло в четыре раза:
q = 4400 Дж × 4 = 17600 Дж на 1 моль CaF 2
Изменение энтальпии на молярной основе составляет
Δ H = −17600 Дж = −17.6 кДж
Проверьте себя
В калориметре при постоянном давлении реагируют 0,10 моль CH 4 (г) и 0,20 моль O 2 (г).
CH 4 (г) + 2 O 2 (г) → CO 2 (г) + 2 H 2 O (ℓ)
Реакция нагревает 750,0 г H 2 O на 28,4 ° C. Что такое Δ H для реакции в молярном масштабе?
Ответ
−891 кДж
Основные выводы
- Каждая химическая реакция происходит с одновременным изменением энергии.
- Изменение энтальпии равняется теплу при постоянном давлении.
- Изменения энтальпии можно выразить с помощью термохимических уравнений.
- Изменения энтальпии измеряют калориметрическим методом.
Упражнения
При каких обстоятельствах q и Δ H одинаковы?
При каких обстоятельствах q и Δ H отличаются?
Газообразный водород и газообразный хлор реагируют с образованием газообразного хлористого водорода с соответствующим изменением энтальпии на –184 кДж.
 Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Напишите правильно сбалансированное термохимическое уравнение для этого процесса.Пропан (C 3 H 8 ) реагирует с газообразным элементарным кислородом с образованием диоксида углерода и жидкой воды с сопутствующим изменением энтальпии на -2 220 кДж. Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Газообразный азот реагирует с газообразным кислородом с образованием NO (г) при поглощении 180 кДж. Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Твердый натрий реагирует с газообразным хлором с образованием твердого хлорида натрия с выделением 772 кДж. Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Газообразный водород и газообразный хлор реагируют с образованием газообразного хлористого водорода с соответствующим изменением энтальпии на –184 кДж. Это эндотермический или экзотермический процесс?
Пропан (C 3 H 8 ) реагирует с газообразным элементарным кислородом с образованием диоксида углерода с выделением 2220 кДж энергии.
 Это эндотермический или экзотермический процесс?
Это эндотермический или экзотермический процесс?Газообразный азот реагирует с газообразным кислородом с образованием NO (г) при поглощении 180 кДж. Это экзотермический или эндотермический процесс?
Металлический натрий может реагировать с азотом с образованием азида натрия (NaN 3 ) с Δ H 21,72 кДж. Это экзотермический или эндотермический процесс?
В 250 мл раствора смешивают 0,25 моль КОН (водн.) И 0,25 моль HNO 3 (водн.).Температура раствора повышается с 22,5 ° C до 35,9 ° C. Предположим, что раствор имеет ту же плотность и теплоемкость, что и вода. Какова теплота реакции и каково молярное значение Δ H реакции?
В растворе объемом 600 мл смешивают 0,50 моль Ca (OH) 2 (водн.) И 0,50 моль H 2 SO 4 (водн.). Температура раствора повышается на 22,3 ° C. Какова теплота реакции и каково молярное значение Δ H реакции? Предположим, что раствор имеет ту же плотность и теплоемкость, что и вода.

Для нагревания 400,0 г H 2 O сжигают 0,050 моль этанола (C 2 H 5 OH). Вода прогревается от 24,6 ° C до 65,6 ° C. Какова теплота реакции и каково молярное значение Δ H реакции?
Для нагревания 100,0 г H 2 O сжигают 0,066 моль пчелиного воска. Вода прогревается от 21,4 ° C до 25,5 ° C. Какова теплота реакции и каково молярное значение Δ H реакции?
Ответы
1.
в условиях постоянного давления
3.
H 2 (г) + Cl 2 (г) → 2HCl (г) Δ H = −184 кДж
5.
N 2 (г) + O 2 (г) → 2NO (г) Δ H = 180 кДж
7.
экзотермический
9.
эндотермический
11.
13.
теплота реакции = -14,0 кДж; Δ H = −56,0 кДж / моль реагентов
15.
теплота реакции = -68,6 кДж; Δ H = -1,370 кДж / моль этанола
CHM1045 Лекция по энтальпии
CHM1045 Лекция по энтальпии
Энтальпия
Нижеследующее содержание является сутью лекции по общей химии 23. В этой лекции мы дополнительно обсуждаем энтальпию и вводим ее расчет с использованием теплоты образования и закона Гесса.
Подробнее об энтальпии
Как мы определили в предыдущей лекции, энтальпия — это мера тепла, получаемого или теряемого системой при постоянном давлении. Это также функция состояния, то есть ее значение связано только с текущим статусом. Таким образом, изменение энтальпии определяется начальным и конечным количеством тепла, и его не волнует, как проходил процесс между этими двумя точками. Мы говорим, что значение «не зависит от пути»
Другие свойства энтальпии:
1.
Энтальпия — обширное свойство. Величина ΔH зависит от количества потребляемых реагентов. Удвоение количества реагентов увеличивает вдвое энтальпию.
2. Обращение химической реакции приводит к тому же значению энтальпии, но противоположного знака.
3. Изменение энтальпии реакции зависит от состояния реагентов и продуктов. Должны быть указаны состояния (т.е. g, l, s или aq).
Пример проблемы с использованием значения энтальпии:
CH 4 (г) + 2O 2 (г) -> CO 2 (г) + 2H 2 O (г) ΔH = -802 кДж
Учитывая вышеприведенное термохимическое уравнение для горения метана, сколько тепловой энергии выделяется при сжигании 4,5 граммов метана (в системе постоянного давления)?
Сначала определите количество молей метана: 4,5 г x 1 моль / 16 г метана = 0.28125 моль Ч5
Затем умножьте количество молей на известное значение энтальпии на моль: 0,28125 * -802 кДж = -225,56 кДж или -2,3e2 кДж
Вы можете заметить, что единицы измерения энтальпии показаны только в кДж, а не в кДж / моль в реакции. Этот недостаток единицы на моль является довольно обычным явлением, но считается, что единица на моль присутствует, даже если она не записана, что-то вроде коэффициента 1 в сбалансированной химической реакции. Глядя на приведенную выше реакцию, вы можете видеть, что значение энтальпии для реакции составляет 1 моль метана, 2 моля кислорода или 1 моль диоксида углерода и т. Д.
Этот недостаток единицы на моль является довольно обычным явлением, но считается, что единица на моль присутствует, даже если она не записана, что-то вроде коэффициента 1 в сбалансированной химической реакции. Глядя на приведенную выше реакцию, вы можете видеть, что значение энтальпии для реакции составляет 1 моль метана, 2 моля кислорода или 1 моль диоксида углерода и т. Д.
Значения энтальпии
Значения энтальпии для многих веществ уже определены экспериментально и легко доступны в таблицах физических констант. Значения обычно берутся в так называемом «стандартном состоянии». Это наиболее стабильное состояние вещества при давлении 1 атм и заданной температуре, обычно 25 o C и концентрации 1M для всех веществ в растворе.
Стандартное термодинамическое состояние определяется таким образом, чтобы разные ученые могли сравнивать результаты
Стандартная энтальпия реакции — ΔH o Rxn — изменение энтальпии при стандартных условиях 1 атм и 298. 15 К.
15 К.
Будьте осторожны, чтобы не путать «Стандартное состояние» с STP, поскольку это два разных состояния.
Есть много других типов энтальпий:
Энтальпии физических изменений
- ΔHfus — энтальпия плавления — количество тепла, необходимое для превращения твердого вещества в жидкость
- ΔHvap — энтальпия парообразования — количество тепла, необходимое для превращения жидкости в газ
- ΔHsub — энтальпия сублимации — тепло, необходимое для превращения твердого тела в газ
Одной из наиболее используемых энтальпий является энтальпия образования.Стандартная энтальпия образования (ΔH o F ) — это изменение тепла, которое происходит, когда один моль соединения образуется из его элементов (в наиболее стабильной / естественной форме) при давлении 1 атм. Стандартная энтальпия образования любого элемента в его наиболее стабильной форме равна нулю.
Обратите внимание, что элементы в их наиболее стабильной или естественной элементной форме имеют ΔH o F , равное нулю, в то время как те формы, которые нестабильны или требуют процесса для образования, имеют значение ΔH o F .
Стандартная энтальпия реакции
Стандартная энтальпия реакции (ΔH o Rxn ) — это энтальпия реакции, проводимой при 1 атм. Мы уже узнали об одном процессе, с помощью которого мы можем вычислить энтальпию реакции в калориметрии. Сейчас мы изучим еще два метода:
1) Теплота реакции от стандартных плавок образования
2) Теплота реакции из расчета закона Гесса
Расчет теплоты реакции по стандартной теплоте образования основан на следующих уравнениях:
Теплота реакции может быть рассчитана на основе теплоты образования каждой молекулы в реакции.Приведенное выше уравнение показывает, что значение ΔH o Rxn рассчитывается как сумма молей продуктов, умноженных на их значения ΔH o F минус сумма молей реагентов, умноженная на их ΔH . o F значений.
Закон Гесса: Когда реагенты превращаются в продукты, изменение энтальпии одинаково, независимо от того, протекает ли реакция в одну стадию или в серию стадий. Помните, что энтальпия — это функция состояния.Неважно, как вы туда доберетесь, только то, где вы начинаете и заканчиваете.
Помните, что энтальпия — это функция состояния.Неважно, как вы туда доберетесь, только то, где вы начинаете и заканчиваете.
Вот пример того, как выполнить расчет этого типа:
Третий процесс, с помощью которого вы можете вычислить теплоту реакции, — это использование процесса, называемого законом Гесса. Другой способ сформулировать закон Гесса: изменение энтальпии всего процесса — это сумма изменений энтальпии его отдельных шагов.
Процесс, необходимый для ответа на вышеприведенный вопрос, основан на том принципе, что если вы добавляете два или более уравнений, чтобы получить новое уравнение, вы должны добавить ΔH, чтобы получить ΔH для нового уравнения.
Перед тем, как мы начнем, пара правил:
1) Если вы умножаете уравнение на значение, чтобы получить количество молей, которое соответствует необходимой реакции, вы должны умножить ΔH на то же значение.
2) Если вы перевернете реакцию, чтобы получить молекулу с правильной стороны, соответствующей нужной реакции, вы измените знак значения ΔH для этой реакции.
«Целевая» реакция: S (т) + 3/2 O 2 (г) → SO 3 (г) ΔH =?
В двух приведенных нам реакциях сера находится в уравнении 1 и имеет правильную форму, поэтому мы просто копируем это уравнение как есть.Второе уравнение содержит необходимый нам триоксид серы, но в неправильном количестве. Поскольку в уравнении два, нам придется разделить все уравнение на два, чтобы привести его в правильную форму, не забывая также сократить значение энтальпии вдвое:
S (т) + O 2 (г) → SO 2 (г) H 1 = -296,0 кДж
1/2 (2 SO 2 (г) + O 2 (г) → 2SO 3 (г) H 2 = -198,2 кДж)
После деления два уравнения готовы к сложению. Мы можем отменить все, что появляется в обеих частях уравнения в равных количествах:
Мы можем отменить все, что появляется в обеих частях уравнения в равных количествах:
S (т.) + O 2 (г) → SO 2 (г) H 1 = -296,0 кДж
SO 2 (г) +1/2 O 2 (г) → SO 3 (г) H 2 = -99,1 кДж
S (т.) + 3/2 O 2 (г) → SO 3 (г) ΔH = -395,1 кДж
Вот веб-сайт с множеством практических викторин по всем трем типам вычислений энтальпии: Здесь
В заключение, на данный момент мы узнали 3 способа расчета теплоты реакции:
Примерно через месяц, когда мы научимся рисовать структуры Льюиса, вы научитесь четвертому методу, использующему значения энергии связи.
КОНСТАНТЫ СКОРОСТИ И УРАВНЕНИЕ АРРЕНИЯ На этой странице показано, как константы скорости изменяются в зависимости от температуры и энергии активации, как показано уравнением Аррениуса. | |
Примечание: Если вы не уверены, что такое константа скорости, вам следует прочитать страницу о порядках реакции, прежде чем продолжить. Эта страница находится на самом краю скорости реакции на этом сайте.Если вы не уверены в базовых показателях скорости реакции, сначала изучите меню скоростей реакции. | |
Уравнение Аррениуса Константы скорости и уравнения скорости Вы помните, что уравнение скорости реакции между двумя веществами A и B выглядит так: | |
Примечание: Если вы этого не помните, вы, , должны прочитать страницу о порядках реакции, прежде чем продолжить.Используйте кнопку НАЗАД в вашем браузере, чтобы вернуться на эту страницу. | |
Уравнение скорости показывает влияние изменения концентраций реагентов на скорость реакции. Все они включены в так называемую константу скорости , которая фактически постоянна только в том случае, если вы меняете только концентрацию реагентов.Если вы измените температуру или катализатор, например, константа скорости изменится.> Это показано математически в уравнении Аррениуса. Уравнение Аррениуса Что означают различные символы Начиная с простых. . .
| |
Примечание: Если вы не уверены в энергии активации, прочтите | |
А потом посложнее. . .
К этому времени вы, вероятно, уже забыли, как выглядело исходное уравнение Аррениуса! Вот он снова: Вы также можете встретить его в другой форме, созданной математической операцией над стандартной: «ln» — это форма логарифма.Не беспокойтесь о том, что это значит. Если вам нужно использовать это уравнение, просто найдите кнопку «ln» на своем калькуляторе. Использование уравнения Аррениуса Эффект изменения температуры Вы можете использовать уравнение Аррениуса, чтобы показать влияние изменения температуры на константу скорости — и, следовательно, на скорость реакции. Что произойдет, если вы увеличите температуру на 10 ° C, скажем, с 20 до 30 ° C (с 293 K до 303 K)? Коэффициент частоты A в уравнении приблизительно постоянен для такого небольшого изменения температуры. Нам нужно посмотреть, как изменяется e — (E A / RT) — доля молекул с энергией, равной или превышающей энергию активации. Предположим, что энергия активации равна 50 кДж / моль -1 .В уравнении мы должны записать это как 50000 Дж / моль -1 . Значение газовой постоянной R составляет 8,31 Дж К -1 моль -1 . При 20 ° C (293 K) значение дроби составляет: При небольшом повышении температуры (до 303 K) это увеличивается: Вы можете видеть, что доля молекул, способных реагировать, почти удвоилась при повышении температуры на 10 ° C. | |
Примечание: Это приближение (о скорости удвоения реакции при повышении температуры на 10 градусов) работает только для реакций с энергией активации около 50 кДж моль -1 , довольно близкой к комнатной температуре. Если вас это беспокоит, используйте уравнение, чтобы выяснить, что произойдет, если вы увеличите температуру, скажем, с 1000 K до 1010 K. Составьте выражение — (E A / RT), а затем используйте кнопку e x на вашем калькуляторе, чтобы закончить работу. Константа скорости продолжает увеличиваться при повышении температуры, но скорость увеличения довольно быстро спадает при более высоких температурах. | |
Эффект катализатора Катализатор обеспечит путь реакции с более низкой энергией активации. Если вы сравните это с соответствующим значением, при котором энергия активации составляла 50 кДж / моль -1 , вы увидите, что произошло резкое увеличение доли молекул, способных реагировать.В присутствии катализатора может реагировать почти в 30000 раз больше молекул по сравнению с отсутствием катализатора (исходя из наших предположений об энергиях активации). Неудивительно, что катализаторы ускоряют реакцию! | |
Примечание: Если вы внимательно прочитаете это, вы должны заметить, что я , а не , говоря, что реакция будет в 30000 раз быстрее. Может быть, в 30000 раз больше молекул, которые могут реагировать, но весьма вероятно, что частотный фактор изменится в присутствии катализатора.А константа скорости k — лишь один из факторов в уравнении скорости. Тем не менее, каталитическая реакция все еще будет намного быстрее, чем некаталитическая, из-за огромного увеличения достаточно энергичных молекул. | |
Прочие расчеты с использованием уравнения Аррениуса Если у вас есть значения скорости реакции или константы скорости при разных температурах, вы можете использовать их для расчета энергии активации реакции.Только одна комиссия по сдаче экзаменов уровня A ‘в Великобритании ожидает, что вы сможете произвести эти расчеты. Они включены в мою книгу расчетов по химии, и я не могу повторить материал на этом сайте. | |
Примечание: Невозможно сделать это в достаточной степени отличным от того, что в книге, чтобы избежать нарушения контракта с моими издателями, если я включу это на этот сайт. Если вас интересует моя книга расчетов по химии, вы можете перейти по этой ссылке. | |
В меню ставок реакции. . . В меню «Физическая химия». . . В главное меню. . . © Джим Кларк, 2002 г. (изменено в октябре 2013 г.) | |
ChemTeam: Закон Гесса — с использованием двух уравнений и их энтальпий
ChemTeam: Закон Гесса — использование двух уравнений и их энтальпий
Закон суммирования постоянной теплоты Гесса
Использование двух уравнений и их энтальпий
Жермен Анри Гесс в 1840 году открыл очень полезный принцип, названный в его честь:
Энтальпия данной химической реакции постоянна, независимо от того, происходит ли реакция в одну или несколько стадий.

Другой способ сформулировать закон Гесса:
Если химическое уравнение можно записать как сумму нескольких других химических уравнений, изменение энтальпии первого химического уравнения равно сумме изменений энтальпии в других химических уравнениях.
Краткое обсуждение того, как используется закон Гесса, с некоторыми примерами.
Какова энтальпия следующей реакции?
C (s, графит) —> C (s, алмаз) ΔH ° = ??? кДж
Кстати, обратите внимание на наличие знака градуса ° у энтальпии.Это указывает на то, что реакция протекает в стандартных условиях. Все примеры в этом руководстве будут выполнены в стандартных условиях.
В обычной химической лаборатории эту реакцию нельзя исследовать напрямую. Это связано с тем, что, несмотря на низкую энтальпию, для реакции требуется очень и очень высокая энергия активации, и в данном случае это означает как высокую температуру, так и высокое давление. Следствием этого является то, что значение энтальпии не может быть определено напрямую почти во всех лабораториях, а в тех, где это возможно, процесс очень и очень сложен.
Следствием этого является то, что значение энтальпии не может быть определено напрямую почти во всех лабораториях, а в тех, где это возможно, процесс очень и очень сложен.
Однако закон Гесса предлагает выход. Если бы у нас было две (или более) реакции, которые можно было бы сложить, то мы можем сложить соответствующие энтальпии реакций, чтобы получить то, что мы хотим. Вот две реакции, которые нам нужны:
C (т, графит) + O 2 (г) —> CO 2 (г) ΔH ° = -393,5 кДж C (т, алмаз) + O 2 (г) —> CO 2 (г) ΔH ° = -395,4 кДж
Я собираюсь перевернуть нижнее уравнение.Это поместит C (s, ромб) на сторону продукта, где он нам нужен. Кроме того, когда я складываю два уравнения вместе, кислород и углекислый газ уравновешиваются. Это, конечно, то, что мы хотим, поскольку эти два вещества не входят в окончательное желаемое уравнение. Вот снова два уравнения с обратным вторым:
C (т, графит) + O 2 (г) —> CO 2 (г) ΔH ° = -393,5 кДж CO 2 (г) —> C (т, алмаз) + O 2 (г) ΔH ° = +395.4 кДж
Я хочу, чтобы вы обратили внимание на другое изменение, которое я внес. Посмотрите на энтальпию для второго уравнения, которое я перевернул. Обратите внимание, как изменился и знак. Это абсолютное требование использования закона Гесса: изменение уравнения на противоположное означает изменение знака значения энтальпии.
Причина? Первое, необратимое уравнение экзотермическое. Мы знаем это из негатива перед 395,4. Это означает, что противоположное, обратное уравнение является эндотермическим.Ввод энтальпии (эндотермический) является обратным, противоположным экзотермическому (выдача энтальпии). Следовательно, мы меняем знак КАЖДЫЙ раз, когда переворачиваем уравнение.
Теперь я готов сложить уравнения. Когда я делаю это, я также складываю энтальпии. Вот добавленное уравнение без каких-либо изъянов:
CO 2 (г) + C (т, графит) + O 2 (г) —> CO 2 (г) + C (т, алмаз) + O 2 (ж) ΔH ° = (-393.5 кДж) + (+395,4 кДж)
Обратите внимание на одинаковые элементы с обеих сторон и удалите их:
C (s, графит) —> C (s, алмаз) ΔH ° = +1,9 кДж
Теперь у нас есть ответ, который мы желаем, используя косвенные средства закона Гесса и два относительно простых эксперимента. Таким образом мы избегаем сложных, дорогостоящих и, возможно, опасных экспериментов. Однако благодаря открытию Гесса мы знаем, что наш косвенно полученный ответ так же верен, как если бы мы провели эксперимент напрямую.
Пример 1: Используйте следующие данные для определения энтальпии (ΔH °) реакции для:
NO 2 (г) + 7 ⁄ 2 H 2 (г) —> 2H 2 O (ℓ) + NH 3 (г) ΔH ° = ??? кДж
Используя следующие два уравнения:
2NH 3 (г) —> N 2 (г) + 3H 2 (г) ΔH ° = +92 кДж 1 ⁄ 2 N 2 (г) + 2H 2 O (ℓ) —> NO 2 (г) + 2H 2 (г) ΔH ° = +170 кДж
Решение:
1) Обратите внимание, что в целевом уравнении есть только один NH 3 , и он находится в правой части.Это означает, что нам нужно перевернуть наше первое уравнение и разделить его на два. Как это:
1 ⁄ 2 N 2 (г) + 3 ⁄ 2 H 2 (г) —> NH 3 (г) ΔH ° = −46 кДж Обратите внимание, что знак ΔH изменился, а его числовое значение уменьшилось вдвое.
2) У целевого уравнения есть один НЕТ 2 , и он находится в левой части, поэтому нам нужно перевернуть второе уравнение.Как это:
NO 2 (г) + 2H 2 (г) —> 1 ⁄ 2 N 2 (г) + 2H 2 O (ℓ) ΔH ° = -170 кДж Обратите внимание, что знак ΔH изменился.
3) Сложите два уравнения данных вместе, чтобы получить целевое уравнение. Сложите две энтальпии, чтобы получить ΔH для целевого уравнения:
−46 + −170 = −216 кДж
Пример 2: Рассчитайте энтапию следующей реакции:
N 2 (г) + 2O 2 (г) —> 2НО 2 (г) ΔH ° = ??? кДж
Используя следующие два уравнения:
N 2 (г) + O 2 (г) —> 2NO (г) ΔH ° = +180 кДж 2НО 2 (г) —> 2НО (г) + O 2 (г) ΔH ° = +112 кДж
Решение:
1) Чтобы решить эту проблему, мы должны перевернуть хотя бы одно уравнение, и оказывается, что второе требует обращения.Вот оба уравнения данных с обращением ко второму:
N 2 (г) + O 2 (г) —> 2NO (г) ΔH ° = +180 кДж 2НО (г) + O 2 (г) —> 2НО 2 (г) ΔH ° = -112 кДж Обратите внимание, что я также изменил знак энтальпии с положительного на отрицательный.
2) Затем мы складываем два уравнения и удаляем идентичные элементы.Мы также складываем две энтальпии вместе, чтобы получить ответ.
N 2 (г) + 2O 2 (г) —> 2NO 2 (г) ΔH ° = +68 кДж
3) Задачи 10a-d и бонусная задача в этом файле являются дополнительными примерами использования комбинаций N 2 / O 2 / NO / NO 2 .
Пример № 3: Даны следующие данные:
2НО (г) —> N 2 (г) + O 2 (г) ΔH = -180.6 кДж N 2 (г) + O 2 (г) + Cl 2 (г) —> 2NOCl (г) ΔH = +103,4 кДж
Найдите ΔH следующей реакции:
2NOCl (г) —> 2NO (г) + Cl 2 (г)
Решение:
1) Перевернуть первую реакцию, перевернуть вторую реакцию:
N 2 (г) + O 2 (г) —> 2NO (г) ΔH = +180,6 кДж 2NOCl (г) —> N 2 (г) + O 2 (г) + Cl 2 (г) ΔH = -103.4 кДж
2) Сложите уравнения и значения ΔH:
+180,6 + (-103,4) = +77,2
2NOCl (г) —> 2NO (г) + Cl 2 (г) ΔH = +77,2 кДж
Комментарий: вы также можете просто сложить две реакции, не переворачивая их, а затем перевернуть ответ (не забывая менять знак на ΔH, когда вы это делаете).
Пример № 4: Составной недокись углерода, C 3 O 2 , представляет собой газ при комнатной температуре.Используйте предоставленные данные для расчета теплоты образования недооксида углерода.
2CO (г) + C (т) —> C 3 O 2 (г) ΔH ° = +127,3 кДж CO (г) ΔHfo
= −110,5 кДж
Решение:
1) Целевое уравнение таково:
3C (т) + O 2 (г) —> C 3 O 2 (г)
2) Напишите реакцию образования CO:
C (с) + 1 ⁄ 2 O 2 (г) —> CO (г) ΔHfo = -110.5 кДж затем умножьте его на два (чтобы отменить 2CO при сложении уравнений):
2C (т) + O 2 (г) —> 2CO (г) ΔH = −221,0 кДж
3) Напишите два уравнения, которые нужно добавить:
2CO (г) + C (т) —> C 3 O 2 (г) ΔH ° = +127,3 кДж 2C (т) + O 2 (г) —> 2CO (г) ΔH = −221.0 кДж
4) Два приведенных выше уравнения нужно только сложить, чтобы получить желаемый ответ:
+127,3 кДж + (−221,0 кДж) = −93,7 кДж
3C (т) + O 2 (г) —> C 3 O 2 (г) ΔHfo = -93,7 кДж
Комментарий: обратите внимание, что в задаче не было приведено химическое уравнение. Причина в том, что энтальпия находится под индексом «f». Это означает, что энтальпия является энтальпией образования и, как таковая, уже имеет химическое уравнение в определении энтальпии образования.
Пример № 5: При разрядке свинцово-кислотной аккумуляторной батареи происходит следующая химическая реакция:
Pb + PbO 2 + 2H 2 SO 4 —> 2PbSO 4 + 2H 2 O
Используя следующие две реакции:
(1) Pb + PbO 2 + 2SO 3 —> 2PbSO 4 ΔH ° = −775 кДж (2) SO 3 + H 2 O —> H 2 SO 4 ΔH ° = −113 кДж
Определите энтальпию реакции разряда, описанной выше.
Решение:
1) Умножьте химическое уравнение (2) на 2:
2SO 3 + 2H 2 O —> 2H 2 SO 4 ΔH = −226 кДж
2) Переключите реагенты и продукты в химической реакции (2). Из-за этого знак изменения энтальпии становится положительным. Пронумеруем следующее химическое уравнение (3):
(3) 2H 2 SO 4 —> 2SO 3 + 2H 2 O ΔH ° = 226 кДж
3) Добавьте химические уравнения (1) и (3):
Pb + PbO 2 + 2SO 3 + 2H 2 SO 4 —> 2PbSO 4 + 2SO 3 + 2H 2 O
4) Затем добавьте изменения энтальпии из уравнений (1) и (3):
Pb + PbO 2 + 2H 2 SO 4 —> 2PbSO 4 + 2H 2 O ΔH ° = −549 кДж
Не забудьте отменить 2SO 3 , потому что он появляется как на стороне реагента, так и на стороне продукта, оставляя вас с желаемой химической реакцией.
Пример 6: Рассчитайте ΔH для реакции:
CO (г) + 2H 2 (г) —> CH 3 OH (г)
Имеется следующая информация:
2C (т) + O 2 (г) —> 2CO (г) ΔH = −221,0 кДж 2C (s) + O 2 (g) + 4H 2 (g) —> 2CH 3 OH (g) ΔH = −402,4 кДж
Решение № 1:
1) Вычтем первое уравнение из второго:
2C (s) + O 2 (g) + 4H 2 (g) — [2C (s) + O 2 (g)] —> 2CH 3 OH (g) — 2CO (г) ΔH = -402.4 кДж — (−221,0 кДж
2) Упростить:
4H 2 (г) —> 2CH 3 OH (г) — 2CO (г) ΔH = −181,4 кДж
3) Переставить:
2CO (г) + 4H 2 (г) —> 2CH 3 OH (г) ΔH = −181,4 кДж
4) Разделить на 2:
CO (г) + 2H 2 (г) —> CH 3 OH (г) ΔH = -90,7 кДж
Решение № 2:
Это обычный способ, который ChemTeam использует для решения проблем, связанных с законом Гесса.
1) Внесите следующие изменения в уравнения данных:
Обратное первое уравнение данных и разделение на 2 (это дает один CO слева).
Разделите второе уравнение данных на 2 (это дает нам 2H 2 и один CH 3 OH).
2) Результаты шага 1:
CO (г) —> C (т) + 1 ⁄ 2 O 2 (г) ΔH = +110,5 кДж C (т) + 1 ⁄ 2 O 2 (г) + 2H 2 (г) —> CH 3 OH (г) ΔH = −201.2 кДж
3) Сложите два уравнения. C и 1 ⁄ 2 O 2 будут отменены, и целевое уравнение останется. Для окончательного ответа сложите две энтальпии.
CO (г) + 2H 2 (г) —> CH 3 OH (г) ΔH = -90,7 кДж
Пример № 7: Стандартные изменения энтальпии горения глюкозы и этанола представлены как -2820 и -1368 кДж моль ¯ 1 соответственно.Глюкоза, C 6 H 12 O 6 , может быть превращена в этанол.
C 6 H 12 O 6 (с) —> 2C 2 H 5 OH (ℓ) + 2CO 2 (г)
Какое стандартное изменение энтальпии для указанной выше реакции?
Решение:
1) Напишите уравнения горения глюкозы и этанола:
C 6 H 12 O 6 (s) + 6O 2 (g) —> 6CO 2 (g) + 6H 2 O (ℓ) ΔH = −2820 кДж C 2 H 5 OH (ℓ) + 3O 2 (г) —> 2CO 2 (г) + 3H 2 O (ℓ) ΔH = −1368 кДж Обратите внимание, что я не включаю моль ¯ 1 , когда энтальпия связана с химическим уравнением.
2) Измените наши два уравнения данных так, чтобы их сложение привело к целевому уравнению:
C 6 H 12 O 6 (s) + 6O 2 (g) —> 6CO 2 (g) + 6H 2 O (ℓ) ΔH = −2820 кДж 4CO 2 (г) + 6H 2 O (ℓ) —> 2C 2 H 5 OH (ℓ) + 6O 2 (г) ΔH = +2736 кДж Второе уравнение данных было перевернуто и умножено на 2.Обратите внимание, что энтальпия была увеличена вдвое, а знак изменился.
3) Добавление полученных уравнений данных даст нам наше целевое уравнение. Сложите энтальпии для окончательного ответа:
C 6 H 12 O 6 (с) —> 2C 2 H 5 OH (ℓ) + 2CO 2 (г) ΔH = −84 кДж Обратите внимание, что все O 2 и H 2 O компенсируются, а также 4 CO 2 , когда два уравнения данных складываются вместе.
Пример 8: Даны следующие термохимические уравнения:
4NH 3 (г) + 7O 2 —> 4NO 2 (г) + 6H 2 O (г) ΔH = −1132 кДж 6NO 2 (г) + 8NH 3 (г) —> 7N 2 (г) + 12H 2 O (г) ΔH = −2740 кДж
Определите ΔH для этой реакции:
4NH 3 (г) + 3O 2 —> 2N 2 (г) + 6H 2 O (г)
Решение:
Ключ (по мнению ChemTeam) к решению этой проблемы лежит в NO 2 .Мы знаем, что это не фигурирует в окончательном ответе, так что же тогда коэффициенты NO 2 будут равны? Ответ — использовать коэффициент 2 и коэффициент 3.
1) Управляйте уравнениями данных:
12NH 3 (г) + 21O 2 —> 12NO 2 (г) + 18H 2 O (г) ΔH = -3396 кДж 12NO 2 2 2 (г) + 16NH 3 (г) —> 14N 2 (г) + 24H 2 O (г) ΔH = -5480 кДж Два и три помогают получить NO 2 с коэффициентом 12, который оказывается наименьшим общим кратным между 4 и 6, которые были исходными коэффициентами NO 2 .
Также обратите внимание, что никакое уравнение не следует переворачивать. NH 3 и O 2 находятся на стороне реагента (а НЕ на стороне продукта) в обоих уравнениях данных. N 2 и H 2 O оба находятся на стороне продукта (а НЕ на стороне реагента) в обоих уравнениях данных.
Это означает, что NO 2 будет единственным веществом, которое нейтрализует действие.
2) Добавить:
28NH 3 (г) + 21O 2 —> 14N 2 (г) + 42H 2 O (г) ΔH = -8876 кДж
3) Разделить на 7:
4NH 3 (г) + 3O 2 —> 2N 2 (г) + 6H 2 O (г) ΔH = −1268 кДж
Пример № 9: Используйте данную информацию, чтобы найти стандартную молярную теплоту образования пентахлорида фосфора.
P 4 (с) + 6Cl 2 (г) —> 4PCl 3 (с) ΔH = −1270,7 кДж PCl 3 (с) + Cl 2 (г) —> PCl 5 (с) ΔH = −137,1 кДж Решение № 1:
1) Мы ищем следующее уравнение:
1 ⁄ 4 P 4 (s) + 5 ⁄ 2 Cl 2 (g) —> PCl 5 (s)
2) Умножьте первое уравнение на 1 ⁄ 4 :
1 ⁄ 4 P 4 (s) + 3 ⁄ 2 Cl 2 (g) —> PCl 3 (s) ΔH = — 317.675 кДж PCl 3 (с) + Cl 2 (г) —> PCl 5 (с) ΔH = −137,1 кДж 3) Когда два приведенных выше уравнения складываются, формируется целевое уравнение. Сложите две энтальпии и округлите, если необходимо, чтобы получить ответ -454,8 кДж.
Решение № 2:
1) Умножьте второе уравнение на 4:
P 4 (с) + 6Cl 2 (г) —> 4PCl 3 (с) ΔH = −1270.7 кДж 4PCl 3 (s) + 4Cl 2 (g) —> 4PCl 5 (s) ΔH = −548,4 кДж 2) Добавьте две реакции:
P 4 (с) + 10Cl 2 (г) —> 4PCl 5 (с) ΔH = −1819,1 кДж
3) Определите стандартную теплоту образования пентахлорида фосфора:
−1819,1 кДж ––––––––– = −454.775 кДж / моль = -454,8 кДж / моль (для четырех сигнатур) 4 моль Пример № 10: Определите стандартную энтальпию образования монооксида углерода, используя следующие два уравнения данных:
CO 2 (г) —> C (s, gr) + O 2 (г) ΔH = +393,5 кДж CO (г) + 1 ⁄ 2 O 2 (г) —> CO 2 (г) ΔH = −283.0 кДж Решение:
1) Целевое уравнение таково:
C (s, gr) + 1 ⁄ 2 O 2 (г) —> CO (г) ΔH = ???
2) Переставьте два уравнения данных следующим образом:
C (т, графит) + O 2 (г) —> CO 2 (г) ΔH = -393,5 кДж CO 2 (г) —> CO (г) + 1 ⁄ 2 O 2 (г) ΔH = +283.0 кДж 3) Добавление двух преобразованных уравнений сократит CO 2 и 1 ⁄ 2 O 2 . Для окончательного ответа сложите две энтальпии.
Гиббс Свободная энергия
Свободная энергия Гиббса
Движущие силы и свободная энергия Гиббса
Некоторые реакции являются спонтанными, потому что они испускаются
энергия в виде тепла ( H <0).Другие являются спонтанными, потому что приводят к увеличению
беспорядок в системе ( S > 0). Вычисления H и S можно использовать для исследования движущей силы, стоящей за конкретной реакцией.
Что происходит, когда одна из потенциальных движущих сил химического
реакция благоприятная, а другая нет? Мы можем ответить на этот вопрос, определив новый
величина, известная как свободная энергия Гиббса ( G ) системы, которая отражает
баланс между этими силами.
Свободная энергия Гиббса системы в любой момент времени определяется как
энтальпия системы минус произведение температуры на энтропию
система.
G = H — TS
Свободная энергия Гиббса системы является функцией состояния, потому что она
определены в терминах термодинамических свойств, которые являются функциями состояния. Изменение в
Следовательно, свободная энергия Гиббса системы, возникающая во время реакции, равна
изменение энтальпии системы за вычетом изменения произведения температуры
раз больше энтропии системы.
G
= H — ( TS )
Если реакция протекает при постоянной температуре, это уравнение может быть
написано следующим образом.
G
= H — TS
Изменение свободной энергии системы, происходящее во время реакции
можно измерить при любых условиях. Если данные собираются в
в стандартных условиях, результатом является свободная энергия реакции в стандартном состоянии
( G или ).
G или
= H o — TS o
Красота уравнения, определяющего свободную энергию системы, заключается в том, что
способность определять относительную важность терминов энтальпии и энтропии как движущих сил
силы, стоящие за той или иной реакцией. Изменение свободной энергии системы, которая
происходит во время реакции, измеряет баланс между двумя движущими силами, которые
определить, является ли реакция спонтанной.Как мы видели, энтальпия и энтропия
термины имеют разные обозначения.
| Благоприятный | Неблагоприятные | |
| H o <0 | H или > 0 | |
| S o > 0 | S или <0 |
Таким образом, член энтропии вычитается из члена энтальпии, когда
расчет G o
для реакции.
Из-за способа определения свободной энергии системы G o отрицательно
для любой реакции, для которой H o отрицательно, а S o положительно. G o , следовательно, отрицательный для любого
реакция, которой благоприятствуют как энтальпия, так и энтропия. Таким образом, мы можем сделать вывод
что любая реакция, для которой G o является отрицательной, должна быть благоприятной или спонтанной.
| Благоприятные или спонтанные реакции : | G или <0 |
И наоборот, G o положительно для любой реакции, для которой H o положительно
и S или
отрицательный. Следовательно, любая реакция, для которой G o является положительной, является неблагоприятной.
| Неблагоприятные или несамопроизвольные реакции : | G или > 0 |
Реакции классифицируются как экзотермические ( H <0) или эндотермические
( H > 0) на
в зависимости от того, излучают они или поглощают тепло.Реакции также можно отнести к экзэргоническим
( G <0) или эндергонический
( G > 0) на
основание того, уменьшается или увеличивается свободная энергия системы во время реакции.
Когда реакция поддерживается как энтальпией ( H o <0), так и
энтропия ( S o
> 0), нет необходимости вычислять значение G o , чтобы решить, должна ли реакция
продолжить.То же самое можно сказать и о реакциях, не одобряемых ни одним из
энтальпия ( H o
> 0) ни энтропии ( S o
<0). Расчеты свободной энергии становятся важными для реакций, одобренных только одним из
эти факторы.
Влияние температуры на свободную энергию
Реакция
Баланс между взносами
члены энтальпии и энтропии к свободной энергии реакции зависят от температуры при
которая запускает реакцию.
Уравнение, используемое для определения свободной энергии, предполагает, что энтропийный член
станет более важным при повышении температуры.
G или
= H o — TS o
Поскольку энтропийный член неблагоприятен, реакция
должен стать менее благоприятным при повышении температуры.
Стандартные свободные энергии реакции
G или
для реакции можно рассчитать из табличных данных о свободной энергии в стандартном состоянии. С
нет абсолютного нуля на шкале свободной энергии, самый простой способ свести такие данные в таблицу
выражается в единицах свободных энергий формации в стандартном состоянии , G f o .
Как и следовало ожидать, свободная энергия образования вещества в стандартном состоянии равна
разница между свободной энергией вещества и свободными энергиями его элементов
в их термодинамически наиболее стабильных состояниях при 1 атм, все измерения проводились при
нормативно-государственные условия.
Интерпретация стандартной свободной энергии
Данные реакции
Теперь мы готовы задать очевидный вопрос: что говорит нам значение G o
насчет следующей реакции?
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г ) G или
= -32.96 кДж
По определению, значение G o для реакции измеряет разницу между
свободные энергии реагентов и продуктов , когда все компоненты реакции
присутствует в нормативных условиях .
G или
поэтому описывает эту реакцию только тогда, когда все три компонента присутствуют при 1 атм.
давление.
Знак из G или указывает нам направление, в котором должна сместиться реакция.
приходят в равновесие. Тот факт, что G o отрицателен для этой реакции при 25 o C, означает, что
система в условиях нормального состояния при этой температуре должна была бы перейти в
справа, превращая некоторые из реагентов в продукты, прежде чем они смогут достичь равновесия.
Величина из G o для реакции говорит нам, насколько далеко стандартное состояние от
равновесие.Чем больше значение G или , тем дальше должна идти реакция, чтобы получить
от условий стандартного состояния к равновесию.
Предположим, например, что мы начинаем со следующей реакции при
стандартные условия, как показано на рисунке ниже.
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Значение G в этот момент времени будет равно стандартной свободной энергии
для этой реакции G или .
Когда Q p = 1: G = G или
По мере того, как реакция постепенно смещается вправо, преобразование N 2
и H 2 в NH 3 , значение G для реакции уменьшится.Если бы мы могли найти
каким-то образом обуздать тенденцию этой реакции прийти к равновесию, мы могли бы получить
реакция на работу. Поэтому свободная энергия реакции в любой момент времени называется
быть мерой энергии, доступной для выполнения работы.
Связь между свободной энергией и
Константы равновесия
Когда реакция выходит из стандартного состояния из-за изменения соотношения
концентрации продуктов по отношению к реагентам, мы должны описать систему в
термины нестандартных свободных энергий реакции.Разница между G o и G для реакции составляет
важный. Существует только одно значение G o для реакции при данной температуре, но есть
— бесконечное количество возможных значений G .
На рисунке ниже показана взаимосвязь между G для следующих
реакции и логарифм по основанию e отношения реакции
реакция между N 2 и H 2 с образованием NH 3 .
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Данные в левой части этого рисунка соответствуют относительно небольшим значениям.
из Q п . Поэтому они описывают системы, в которых гораздо больше
реагент, чем продукт. Знак G для этих систем отрицательный, а величина G большая. Система
поэтому относительно далеки от равновесия, и реакция должна сместиться вправо, чтобы
достичь равновесия.
Данные в правой части этого рисунка описывают системы, в которых
больше продукта, чем реагента. Знак G теперь положительный, а величина G умеренно большая. В
знак G говорит нам
что реакция должна сместиться влево, чтобы достичь равновесия. Величина G говорит нам, что мы не
Чтобы достичь равновесия, нужно зайти так далеко.
Точки, в которых прямая линия на приведенном выше рисунке пересекает
особенно важны горизонтальная и вертикальная оси этой диаграммы.Прямая линия
пересекает вертикальную ось, когда коэффициент реакции системы равен 1. Это
Таким образом, точка описывает условия стандартного состояния, и значение G в этой точке равно
к стандартной свободной энергии реакции, G o .
Когда Q p = 1 : G = G или
Точка, в которой прямая линия пересекает горизонтальную ось, описывает
система, для которой G
равно нулю.Поскольку за реакцией не стоит движущая сила, система должна
быть в равновесии.
Когда Q p = K p : G = 0
Связь между свободной энергией реакции в любой момент времени
( G ) и
свободная энергия реакции в стандартном состоянии ( G o ) описывается следующим уравнением.
G
= G или + RT
ln Q
В этом уравнении R — постоянная идеального газа в единицах Дж / моль-К, T
— температура в кельвинах, ln представляет собой логарифм по основанию e , и Q
коэффициент реакции в данный момент времени.
Как мы видели, движущая сила химической реакции равна нулю ( G = 0), когда реакция
находится в состоянии равновесия ( Q = K ).
0 = G или
+ RT ln K
Таким образом, мы можем решить это уравнение для связи между G o и K .
G или
= — RT ln K
Это уравнение позволяет вычислить константу равновесия для любого
реакция от стандартной свободной энергии реакции, или наоборот.
Ключ к пониманию взаимосвязи между G o и K
признает, что величина G o говорит нам, насколько далеко стандартное состояние от
равновесие.Чем меньше значение G o , тем ближе стандартное состояние к равновесию.
Чем больше значение G или , тем дальше должна идти реакция, чтобы достичь равновесия.
Связь между G o и константой равновесия химической реакции имеет вид
проиллюстрировано данными в таблице ниже.
Значения G o и K для общих реакций при 25 o C
Константу равновесия реакции можно выразить двумя способами: K c
и K p .Мы можем записать выражения для констант равновесия через
парциальные давления реагентов и продуктов или их концентрации в
единиц молей на литр.
Для газофазных реакций константа равновесия
получено из G o
основано на парциальных давлениях газов ( K p ). Для реакций в
решения, константа равновесия, полученная в результате расчета, основана на
концентрации ( K c ).
Температурная зависимость равновесия
Константы
Константы равновесия не являются строго постоянными, потому что они меняются с изменением
температура. Теперь мы готовы понять, почему.
Свободная энергия реакции в стандартном состоянии является мерой того, насколько далеко
стандартное состояние происходит от равновесия.
G или
= — RT ln K
Но величина G o зависит от температуры реакции.
G или
= H o — TS o
В результате константа равновесия должна зависеть от температуры
Реакция.
Хорошим примером этого явления является реакция, в которой NO 2
димеризуется с образованием N 2 O 4 .
2 НЕТ 2 ( г ) N 2 O 4 ( г )
Этой реакции способствует энтальпия, потому что она образует новую связь, которая
делает систему более стабильной.Энтропия не способствует реакции, потому что она приводит к
уменьшение неупорядоченности системы.
NO 2 — коричневый газ, а N 2 O 4 — бесцветный.
Таким образом, мы можем отслеживать степень, в которой NO 2 димеризуется с образованием N 2 O 4
исследуя интенсивность коричневого цвета в запечатанной трубке с этим газом. Что должно
произойдет равновесие между NO 2 и N 2 O 4 как
температура понижена?
Предположим, что существенных изменений нет.
либо H или
или S o
по мере охлаждения системы.Вклад в свободную энергию реакции от
член энтальпии поэтому постоянен, но вклад энтропийного члена становится
меньше при понижении температуры.
G или
= H o — TS o
По мере того, как трубка охлаждается, и энтропийный член становится менее важным,
чистый эффект — сдвиг равновесия вправо. На рисунке ниже показано, что
происходит с интенсивностью коричневого цвета, когда запаянная трубка, содержащая NO 2
газ погружен в жидкий азот.Резко уменьшилась сумма NO 2
в трубе по мере ее охлаждения до -196 o С.
Взаимосвязь между свободной энергией и клеткой
Потенциалы
Значение G для реакции в любой момент времени говорит нам о двух вещах. Знак G говорит нам, в чем
направление реакции должно измениться, чтобы достичь равновесия. Величина G говорит нам, насколько далеко
реакция идет из равновесия в этот момент.
Потенциал электрохимической ячейки — это мера того, насколько далеко
окислительно-восстановительная реакция идет от равновесия. Уравнение Нернста описывает
взаимосвязь между потенциалом ячейки в любой момент времени и ячейкой в стандартном состоянии
потенциал.
Перепишем это уравнение следующим образом.
nFE = nFE o — RT ln Q
Теперь мы можем сравнить его с уравнением, используемым для описания взаимосвязи
между свободной энергией реакции в любой момент времени и стандартным состоянием свободного
энергия реакции.
G
= G или + RT
ln Q
Эти уравнения похожи, потому что уравнение Нернста является частным случаем
более общего отношения свободной энергии. Мы можем преобразовать одно из этих уравнений в
другой, воспользовавшись следующими соотношениями между свободной энергией
реакция и потенциал ячейки реакции, когда она работает как электрохимическая ячейка.
G = — nFE
Как рассчитать время нагрева объекта
Различные материалы нагреваются с разной скоростью, и расчет времени, необходимого для повышения температуры объекта на заданную величину, является общей проблемой для студентов-физиков.Чтобы рассчитать его, вам нужно знать удельную теплоемкость объекта, массу объекта, изменение температуры, которое вы ищете, и скорость, с которой к нему подводится тепловая энергия. Посмотрите этот расчет, выполненный для воды, и вы сможете понять процесс и то, как он рассчитывается в целом.
TL; DR (слишком долго; не читал)
Рассчитайте необходимое количество тепла ( Q ) по формуле:
Q = mc ∆ T
Где м обозначает массу объекта, c обозначает удельную теплоемкость, а ∆ T обозначает изменение температуры.Время, необходимое ( t ) для нагрева объекта при подаче энергии на мощность P , определяется по формуле:
t = Q ÷ P
Формула количества тепла энергия, необходимая для определенного изменения температуры:
Где м означает массу объекта, c — удельная теплоемкость материала, из которого он сделан, а ∆ T — изменение температуры.Сначала рассчитайте изменение температуры по формуле:
∆ T = конечная температура — начальная температура
Если вы нагреваете что-то от 10 ° до 50 °, это дает:
Обратите внимание, что while Цельсий и Кельвин — разные единицы измерения (и 0 ° C = 273 K), изменение на 1 ° C равно изменению на 1 K, поэтому в этой формуле они могут использоваться как взаимозаменяемые.
Каждый материал имеет уникальную удельную теплоемкость, которая показывает, сколько энергии требуется, чтобы нагреть его на 1 градус Кельвина (или 1 градус Цельсия) для определенного количества вещества или материала.Для определения теплоемкости вашего конкретного материала часто требуется обратиться к онлайн-таблицам (см. Ресурсы), но вот некоторые значения для c для обычных материалов, в джоулях на килограмм и на Кельвин (Дж / кг · К):
Алкоголь (питьевой ) = 2,400
Лед (при −10 ° C) = 2,050
Выберите значение, соответствующее вашему веществу. В этих примерах основное внимание будет уделено воде ( c = 4,186 Дж / кг K) и свинцу ( c = 128 Дж / кг K).
Окончательная величина в уравнении составляет м для массы объекта. Короче говоря, для нагрева большего количества материала требуется больше энергии. Итак, для примера представьте, что вы вычисляете количество тепла, необходимое для нагрева 1 килограмма (кг) воды и 10 кг свинца на 40 К. Формула гласит:
Итак, для примера с водой:
Q = 1 кг × 4186 Дж / кг K × 40 K
Таким образом, для нагрева 1 кг воды на 40 K или 40 ° C требуется 167,44 килоджоулей энергии (т.е. более 167000 джоулей).
Q = 10 кг × 128 Дж / кг K × 40 K
Таким образом, для нагрева 10 кг свинца на 40 K или 40 ° C требуется 51,2 кДж (51 200 джоулей) энергии. Обратите внимание, что для нагрева в десять раз больше свинца на такое же количество требуется меньше энергии, потому что свинец легче нагреть, чем воду.


 У нас открыта уникальная кафедра ЮНЕСКО «Экологически безопасные технологии природообустройства и водопользования», которых всего лишь 8 в России и 32 в мире, и лаборатория ЮНЕСКО международного уровня. Об этом рассказал ректор Юрий Леонидович…
У нас открыта уникальная кафедра ЮНЕСКО «Экологически безопасные технологии природообустройства и водопользования», которых всего лишь 8 в России и 32 в мире, и лаборатория ЮНЕСКО международного уровня. Об этом рассказал ректор Юрий Леонидович… Высшее профессиональное образование и стаж работы в образовательном учреждении не менее 1 года, при наличии послевузовского …
Высшее профессиональное образование и стаж работы в образовательном учреждении не менее 1 года, при наличии послевузовского … ..
..




 А как насчет всего остального (например, температуры и катализаторов), которые также изменяют скорость реакции? Как они вписываются в это уравнение?
А как насчет всего остального (например, температуры и катализаторов), которые также изменяют скорость реакции? Как они вписываются в это уравнение? Чтобы соответствовать этому уравнению, оно должно быть выражено в джоулях на моль, а не в кДж / моль -1 .
Чтобы соответствовать этому уравнению, оно должно быть выражено в джоулях на моль, а не в кДж / моль -1 . Ниже на странице вы найдете простой расчет, связанный с этим.
Ниже на странице вы найдете простой расчет, связанный с этим. Если, например, константа скорости удвоится, то увеличится и скорость реакции.Вернитесь к уравнению ставок в верхней части этой страницы, если вы не уверены, почему это так.
Если, например, константа скорости удвоится, то увеличится и скорость реакции.Вернитесь к уравнению ставок в верхней части этой страницы, если вы не уверены, почему это так. Это увеличивает скорость реакции почти вдвое.Это значение в практическом правиле, которое часто используется при работе с простой скоростью реакции.
Это увеличивает скорость реакции почти вдвое.Это значение в практическом правиле, которое часто используется при работе с простой скоростью реакции.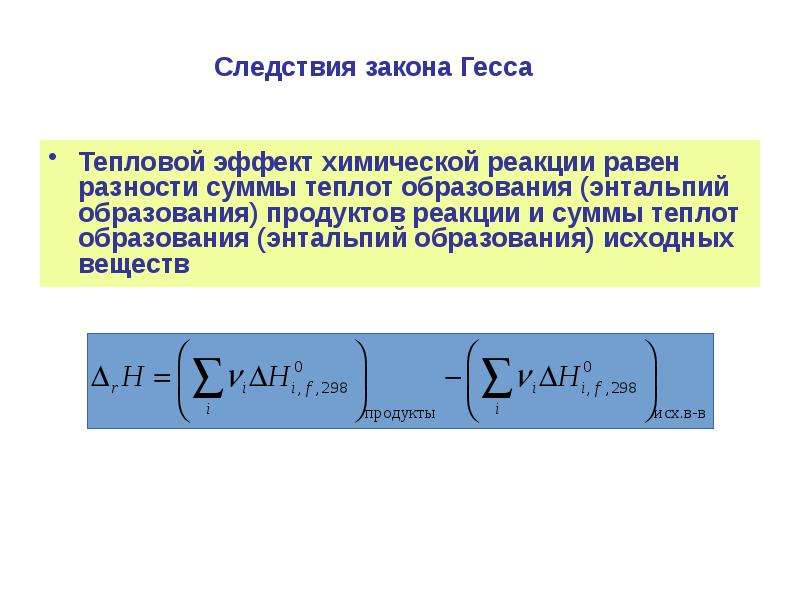 Предположим, что в присутствии катализатора энергия активации падает до 25 кДж / моль -1 . Повторный расчет при 293 К:
Предположим, что в присутствии катализатора энергия активации падает до 25 кДж / моль -1 . Повторный расчет при 293 К: У вас не будут просто присутствовать исходные реагенты, как раньше. Катализатор обязательно должен участвовать в медленной стадии реакции, и новое уравнение скорости должно будет включать термин, относящийся к катализатору.
У вас не будут просто присутствовать исходные реагенты, как раньше. Катализатор обязательно должен участвовать в медленной стадии реакции, и новое уравнение скорости должно будет включать термин, относящийся к катализатору.