Содержание
Карбонат натрия | Химическая промышленность | erzkontor
информация
Карбонат натрия (также известный как промывочная сода, кальцинированная сода и кристаллы соды), Na2CO3, является водорастворимой натриевой солью угольной кислоты.
| Условия хранения: | Хранить в прохладном и сухом месте. |
|---|---|
| Срок годности: | 2 года |
| Внешний вид: | Чистый карбонат натрия представляет собой белый порошок без запаха, который является гигроскопичным (поглощает влагу из воздуха) |
| Упаковка: | Мешки по 25кг и мешки по 1 метрической тоне |
Спецификация
| NaCl (на сухой основе): | ≤ 0.7% |
|---|---|
| Na2CO3 (на сухой основе): | ≥ 99.2% |
| LOD: | 0.8% |
| Fe (на сухой основе): | ≤ 0. 0035% 0035% |
| Нерасстворимость в воде: | ≤ 0,03% |
| CAS номер: | 497-19-8 |
Приложения
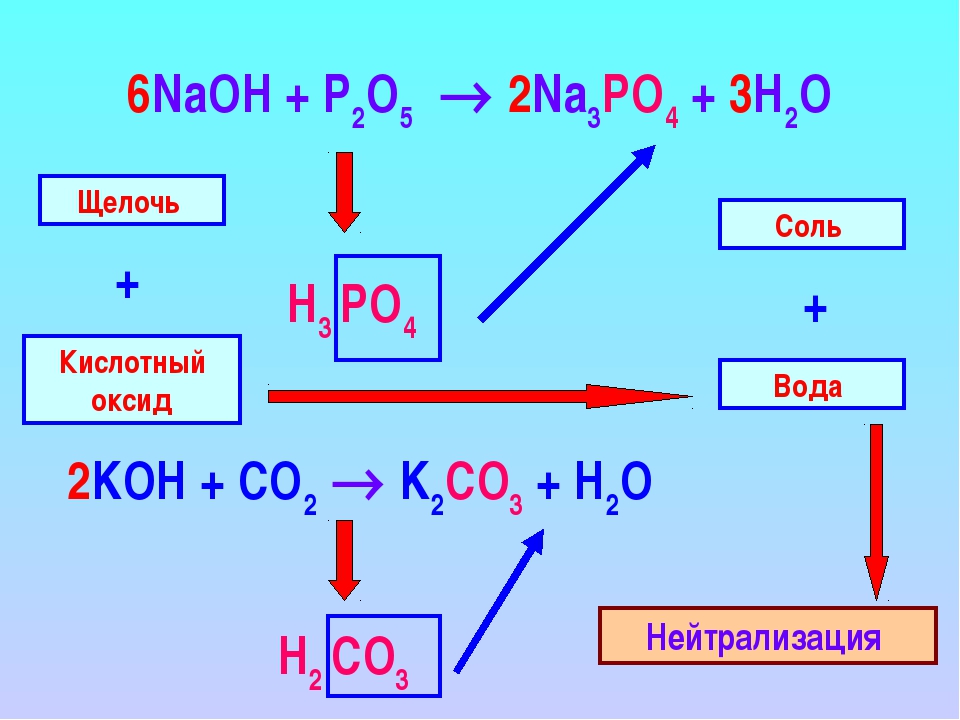
Производство стекла является одним из наиболее важных применений карбоната натрия. Карбонат натрия действует как флюс для диоксида кремния, понижая температуру плавления смеси до чего-то достижимого без специальных материалов. Другими применениями карбоната натрия, являются производство бумаги, вискозы, мыла и моющих средств. Он также используется в качестве смягчителя воды, так как карбонат может осаждать ионы кальция и магния, присутствующие в «жесткой» воде.
Соли средние, кислые, основные | Решаем химию: вопросы и ответы
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Фото: shutterstock.com
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты h4PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте h3CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в h3CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в h3CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Кислые соли. Номенклатура
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты h3SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты h4PO4, но у нас соль кислая, поэтому добавляем «гидро»),
Nah3PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты h4PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль.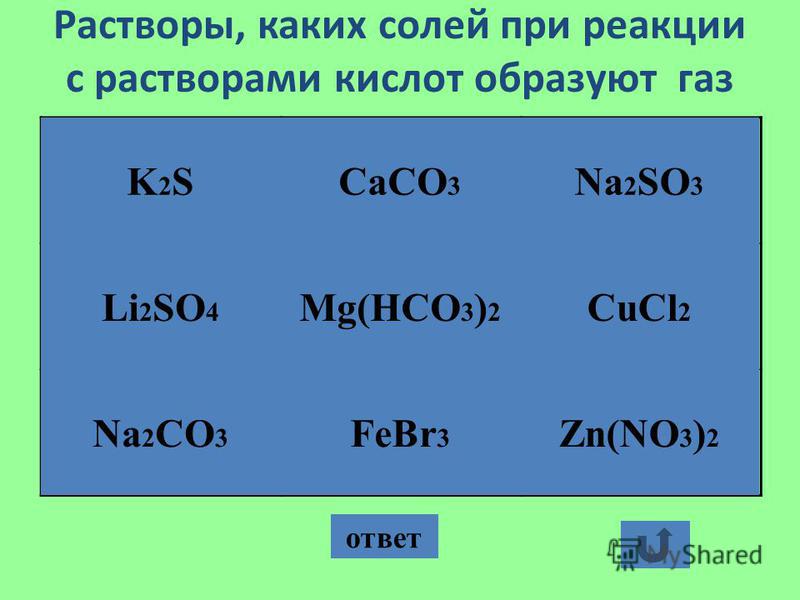 Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных — частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. Номенклатура
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты h3SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
И тогда следующая статья будет рассказывать именно об этой проблеме.
Соли угольной кислоты. 9-й класс
Цели урока: изучить свойства солей
угольной кислоты карбонатов и гидрокарбонатов.
Задачи урока:
– отработать навыки в решении
расчетных и экспериментальных задачах;
– повторить свойства и строение
угольной кислоты, гидролиз солей и реакции
обмена;
– воспитывать коммуникативную
культуру, уверенность в себе и своих знаниях,
навыки контроля и самоконтроля.
Тип урока: изучение новой темы
Методические приемы: рассказ,
демонстрации опытов.
Оборудование: раствор Na2CO3; раствор
HCl, h3SO4, Ca(OH)2, Na2CO3 твердая, индикатор –
фенолфталеин, штатив, газоотводная трубка;
карточки – задания
Ход урока
I.
 Оргмомент.
Оргмомент.
II. Проверка домашнего задания.
Сегодня на уроке мы должны изучить
соли угольной кислоты. Но прежде чем отправимся в
увлекательный мир карбонатов, нам надо повторить
свойства и строение h3CO3.
(2 человека у доски, 3 человека на
рабочем месте)
У доски
1. Дать характеристику угольной
кислоте: сила, основность, содержание кислорода.
Составить уравнение диссоциации.
2. Химические свойства угольной
кислоты.
На месте.
- Дать характеристику аллотропным модификациям
углерода. - Дать сравнительную характеристику физических и
химических свойств оксида углерода (VI) и оксида
углерода (II): строение молекул, физические и
химические свойства. - Допишите определения:
а) адсорбция – это процесс – …
б) процесс выделения поглощенных
веществ называется …
Пока ребята готовят ответы на вопрос,
мы проведем небольшую письменную работу (10
вопросов)
- Разновидности простого вещества, образованного
одним и тем же химическим элементом? (Аллотропные
видоизменения) - Электронная формула атома углерода.
 (1s22s22p2)
(1s22s22p2) - Количество электронов на внешнем уровне у
элементов IV группы главной подгруппы (четыре) - Летучие водородные соединения С и Si? (СН4 –
метан, SiН4 – силан) - Формула высших оксидов элементов IV группы
главной подгруппы? (RО2) - Масса 0,5 моль СО2 ? (22г)
- Объем 2 моль СН4 при н.у.? (44,8 л)
- Чего больше по массе в угарном газе углерода или
кислорода? (кислорода С:О=3:4) - Степень окисления углерода в угарном газе и
углекислом газе? (+2;+ 4) - Что такое сухой лед?
Проверка (правильные ответы на доске)
Ребята проверяют исправляют ошибки,
выставляют себе оценки.
Проверка ответов у доски: рассмотрим
свойства h3CO3.
III. Объяснение нового материала.
h3CO3 диссоциирует в две стадии. Сколько
Сколько
типов солей образует данная соль?
(По ходу опроса записывают схему на
доске)
h3CO3
В повседневной жизни мы часто
сталкиваемся с солями угольной кислоты (питьевая
сода, известняк, мрамор, мел и т.п.)
Списывают с доски в тетрадь
тривиальные названия солей.
Стихотворение о карбонатах. (Пока
учащиеся пишут)
На земле живут три брата
Из семейства карбонатов.
Старший брат красавец – мрамор.
Славен именем каррары
Превосходный зодчий он
Строил Рим и Парфенон.
Всем известен известняк
Потому и назван так.
Знаменит своим трудом
Возводя за домом дом.
И способен и умел младший
Мягкий братец мел.
Как рисует посмотри
Этот …СаСО3.
CaCO3 – мел, известняк, мрамор
NaHCO3 – питьевая сода
Na2CO3 – кальцинированная сода
Na2CO3·10h3O – кристаллическая сода
CaCO3 – жемчуг (минерал арагонит)
Получение солей: назовите
лабораторный способ получения солей.
(кислота + основание–> соль + вода –
реакция нейтрализации)
Для получения солей угольной кислоты
используют –>C02
2NaOH+CO2–>Na2CO3+h3O,
если избыток CО2
получаются кислые соли
Na2CO3+CO2+h3O–>2NaHCO3
Химические свойства.
- Отношение к нагреванию.
- Реагирует солями (тип реакций?)
- С кислотами
- Гидролизу подвергаются соли угольной кислоты
образуя в результате кислые соли в щелочной
среде.
CaCO3–> CaO + CO2
CaHCO3–>CaCO3+CO2+h3O
(Это свойство позволяет использовать
гидрокарбонаты в пищевой промышленности в
качестве разрыхлителя теста)
В результате реакций выделяется CO2, как его обнаружить?
– лучина тухнет.
— через раствор известковой воды (Ca (OH)2)
образуется осадок белого цвета.
Ca(OH)2+CO2–>CaCO3+h3O,
но если дальше пропускать CO2 осадок растворяется
CaCO3+CO2+h3O–>Ca(HCO3)2
Na2CO3+CaSO4–>K2SO4+CaCO3
(На доске расписывает ученик полное и
сокращенное ионное уравнение)
Na2CO3+2HCl–>2NaCl+CO2+h3O
Наблюдение “вскипание”.
Реакция взаимодействия солей h3CO3 с
кислотами – качественная.
Геологи используют это свойство для
определения карбонатных минералов.
Опыт. | Na2CO3+HCl
Na2CO3(р-р)+HCl
CaCO3(мел)+HCl | вскипание |
Самостоятельно составьте уравнения
химических реакций.
Испытать раствор Na2CO3 индикатором
фенолфталеином (раствор малинового цвета)
Вывод: соли угольной кислоты имеют
общие свойства солей и специфические: 1)
взаимодействие с кислотами; 2) гидролиз.
IV. Решение задачи
Какой объем СО2 выделится (при н.у.) при
обжиге 230 кг известняка, содержащего 10 % примесей.
V. Подведение итогов урока
(выставление оценок).
VI. Домашнее задание
§ 33, № 21-22 (с. 91-92)
устно, задача 3 (с.92).
Гидролиз солей
Тема: «Гидролиз солей»
Предмет: химия.
Класс: 11 класс.
Условия для реализации данной методики: в классе должен быть компьютер, мультимедийный проектор, экран, по возможности интерактивная доска.
Цель: изучить сущность гидролиза солей в водных растворах.
Задачи:
Образовательная
Научиться объяснять химические процессы, протекающие в водных растворах солей, записывать уравнения реакций гидролиза;
Предсказывать и объяснять тип гидролиза, изменение кислотности среды и образование кислых и основных солей в этом процессе;
Формировать умение определять тип соли, тип гидролиза, реакцию среды растворов;
Показать биологическую роль гидролиза в процессах жизнедеятельности живых организмов.
Развивающая
Развивать познавательный интерес в процессе приобретения химических знаний, научить самостоятельно оценивать наблюдаемые явления;
Закрепить умения и навыки химического эксперимента, работы с таблицами и справочными материалами.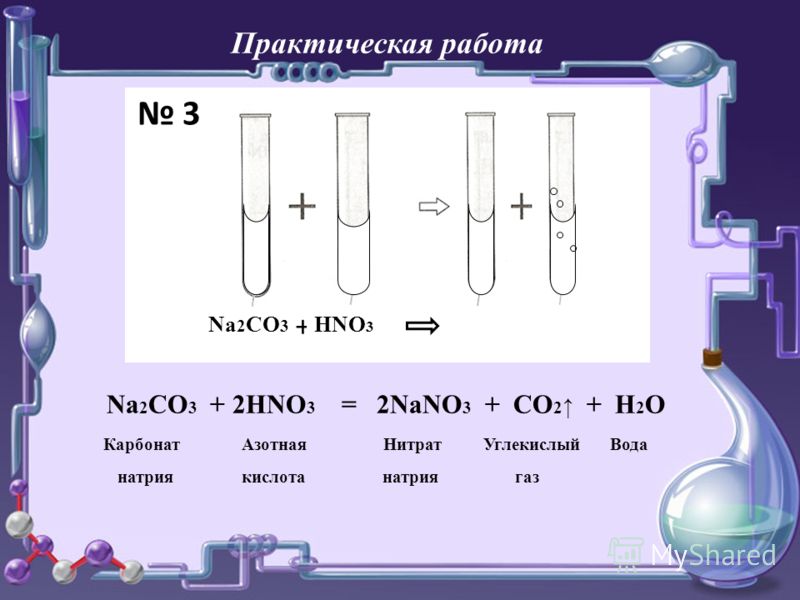
Воспитательная
Воспитывать убеждённость в необходимости химически грамотного отношения к своему здоровью.
Тип урока:
Урок совершенствования знаний, умений, навыков на основе проблемно-исследовательской технологии с использованием презентации.
Оборудование и реактивы:
Таблицы «Окраска индикаторов», «Растворимость солей, кислот и оснований в воде»; демонстрационные пробирки; растворы солей, индикатор лакмус, штатив для пробирок.
Планируемые результаты обучения.
На изученных примерах уметь объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и определять, по какому иону протекает гидролиз;
Знать биологическую роль гидролиза в процессах жизнедеятельности живых организмов;
Уметь экспериментально подтверждать гидролиз соли слабого основания и сильной кислоты и соли сильного основания и слабой кислоты.
Описание работы:
Актуальность выбранной мною темы заключается в том, что понятие «гидролиза» сложное. Оно развивается на основе понятий о реакциях ионного обмена, обратимости реакций, химическом равновесии и способах го смещения, а также степени диссоциации электролитов, точнее, понятий о сильных и слабых электролитах (схема 1).
С
Реакции ионного обмена
Обратимые реакции Гидролиз солей Химическое равновесие
Сильные и слабые электролиты
хема 1. Взаимосвязь понятия «гидролиз» с опорными понятиями.
Исходя из опыта, именно из-за сложности этого понятия у обучающихся зачастую возникают трудности в его усвоении. Кроме того, в школьном курсе химии оно рассматривается как понятие теоретическое. Первое упоминание термин получает в теме «Электролитическая диссоциация» в курсе 9 класса, затем оно постепенно дополняется, эволюционирует во всех предыдущих темах и приобретает качественно новые характеристики в курсе органической химии. Поскольку сам термин «гидролиз» впервые вводится в курсе органической химии в 10 классе и рассматривается эпизодически в темах: жиры, белки, углеводы, углеводороды на примере единичных свойств отдельных соединений. Поэтому знания, получаемые обучающимися, не систематизированы. Как самостоятельная тема гидролиз рассматривается в 11 классе в разделе «Химические реакции». По программе базового уровня отводится 1 час.
Поскольку сам термин «гидролиз» впервые вводится в курсе органической химии в 10 классе и рассматривается эпизодически в темах: жиры, белки, углеводы, углеводороды на примере единичных свойств отдельных соединений. Поэтому знания, получаемые обучающимися, не систематизированы. Как самостоятельная тема гидролиз рассматривается в 11 классе в разделе «Химические реакции». По программе базового уровня отводится 1 час.
Важность знаний этой темы обусловлена прежде всего тем, что все части ЕГЭ по химии содержат вопросы по гидролизу. Поэтому необходимо, чтобы ученики за короткое время усвоили знания по теме и легко ориентировались в ней. Кроме того, знания гидролиза важны для целостного представления природы человеческого организма и формирования осознанной здоровьесберегающей позиции учеников.
Все вышесказанное объясняет тот факт, что изучение данного понятия необходимо вести проблемно. В связи с этим в своей разработке использовала проблемную технологию.
Кроме того, нужно учитывать также и методические особенности преподавания химии – обеспечение практической ориентированности предметного знания. Это означает необходимость выявления тесной взаимосвязи между изучаемыми теоретическими положениями и практикой, демонстрации теоретических знаний по данной тематике. То есть я использовала проблемную технологию, в которой проблема ставиться с помощью химического эксперимента.
Для увеличения наглядности, понимания сущности процесса гидролиза урок сопровождается презентацией в формате Power Point, сопровождающая все его этапы.
Предлагаю вашему вниманию урок по теме «Гидролиз» в 11 классе с использованием ИКТ на основе проблемной технологий (Приложение 1).
Ход урока:
I этап урока — Постановка проблемы.
Учитель: Наш сегодняшний урок мы начнем с решения задачи, текст которой вы видите на своих столах (приложение 2). Внимательно прочитаем и решим у доски эту задачу.
Внимательно прочитаем и решим у доски эту задачу.
Ученик записывает условия задачи и уравнения реакции обмена:
ν (FeCl3) =5 моль 2FeCl3 + 3Na2CO3 → 6NaCl + Fe2(CO)3
m(осадка)=?
Ученики констатируют факт, что среди продуктов нет газа. Учитель рекомендует проверить по таблице растворимости соль Fe2(CO)3.ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк.
Учитель: может быть условия задачи ошибочны? Проверим это опытным путем.
Ученики выполняют химический эксперимент: сливают растворы хлорида железа (III) и карбоната натрия. Один из учеников напоминает при этом правила техники безопасности.
Учитель: Что мы наблюдаем? (выделяется бесцветный газ и выпадает осадок коричневого цвета, лакмусовая бумажка синеет)
Учитель: Таким образом, проведя эксперимент, мы пришли к выводу, что в условии задачи все сформулировано правильно. А вот мы при составлении уравнения реакции чем — то пренебрегли (взаимодействием солей с водой при получении раствора).
А вот мы при составлении уравнения реакции чем — то пренебрегли (взаимодействием солей с водой при получении раствора).
Учитель: Правильно! Мы этого не учли – поэтому, у нас не получается решение задачи. На этом уроке мы рассмотрим, как различные соли взаимодействуют с водой, а затем попробуем вернуться к решению этой задачи. Запишем тему урока.
II этап урока — Актуализация знаний и опыта, подготовка к изучению нового материала.
Содержание урока | Формы и методы работы учителя | Виды деятельности |
1.Опорные вопросы: Какие вещества называются электролитами и неэлектролитами? Их примеры? Что такое кислоты, основания с позиции ТЭД? Как опытным путем определить кислоту и основание? Как индикаторы изменяют свой цвет в различных средах? Какие ионы за это отвечают? | Фронтальный опрос в форме беседы со слайдами на экране. Слайд со схемой На экране показываем цвета индикаторов в разных средах | Устные ответы на вопросы учителя
Делается вывод о том, какие ионы отвечают за цвет индикаторов |
2.Подготовка таблицы | Таблица заранее имеется на слайде | Построение таблицы 1 в тетради |
Таблица 1.Изменение окраски индикаторов в разных средах.
Ве-щество | Ионы | Индикаторы | Реакция среды | |||
катионы | Анио-ны | лакмус | Метил-оранж | Фенол-фталеин | ||
Кис-лота | Н+ | Крас-ный | Розо-вый | Бесцвет-ный | Кислая | |
Основа-ние | ОН— | синий | Жёл-тый | Малино-вый | Щелоч-ная | |
Вода | Фиоле-товый | Оран-жев | Бесцвет-ный | нейтральная | ||
AlCl3 | ? | ? | ? | ? | ? | ? |
Na2CO3 | ? | ? | ? | ? | ? | ? |
NaCl | ? | ? | ? | ? | ? | ? |
III этап урока — Изучение нового материала.
Учитель задает вопросы:
Есть ли эти ионы в солях?
Как образуются в растворе солей ионы Н+ и ОН-?
Является ли вода электролитом?
На какие ионы диссоциирует вода?
Учитель: Вспомним, что вода – слабый электролит и в чистой воде происходит процесс: НОН ↔ Н+ + ОН- и существует равенство концентрации: [H+] = [OH –] = 10 – 7 моль/л, и в этом случае pH = 7.
Обучающиеся знают, что они исследовали водные растворы солей и делают вывод, что вода участвует в гидролизе и дает ионы водорода и гидроксогруппы, избыток которых изменяет цвет индикаторов, поэтому исходный раствор окрасил лакмус в синий цвет.
Учитель формулирует вопрос: «Что же называется гидролизом?», если «гидро» — вода, «лизис» — разложение.
Делается вывод, что гидролиз солей – это обменное взаимодействие солей с водой, приводящее к их разложению (записывают определение в тетрадях).
IV этап урока – составление схем гидролиза солей, формулирование выводов
Учитель: любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей:
соли, образованные сильным основанием и слабой кислотой
соли, образованные слабым основанием и сильной кислотой
соли, образованные сильным основанием и сильной кислотой
соли, образованные слабым основанием и слабой кислотой
Рассмотрим, что же происходит при взаимодействии различных типов солей с водой?
На этом этапе урока учитель ставит экспериментальную задачу: исследовать реакцию среды растворов солей: NaCl, Na2CO3, AlСl3 , результаты занести в таблицу и на основании наблюдений сделайте вывод о типе соли, типе гидролиза (по какому иону) и образующейся среде.
Наблюдения ученики вносят в заранее подготовленные таблицы, дополняя предыдущую вместо вопросительных знаков:
Вещество | катионы | анионы | лакмус | Метил-оранж | Фенол-фталеин | Вывод |
Кислота | Н+ | красный | розовый | бесцветный | Кислая | |
Основание | ОН— | синий | жёлтый | малиновый | Щелочная | |
Вода | фиолет | оранжев | бесцветный | нейтральная | ||
NaCl | Na+ | Cl- | фиолет | оранжев | бесцветный | нейтральная |
Na2CO3 | К+ | CO32- | синий | жёлтый | малиновый | Щелочная |
Al2(SO4)3 | Mg2+ | Cl- | красный | розовый | бесцветный | Кислая |
А затем демонстрирует упрощенную схему пошагового составления уравнений гидролиза на экране компьютера с заранее созданными слайдами.
AlCl3
Al(OH)3 HCl
слабое основание сильная кислота
[ ОН]- < [H]+
Составим уравнение реакции: молекулярное, полное и сокращенное ионные.
AlCl3 + HOH ↔ HCl + AlOHCl2
Al3+ + 3Cl – + HOH ↔ H+ + Cl – + AlOh3+ + 2Cl –
Al3+ + HOH ↔ AlOh3+ + H+
pH<7,
[H+] > [OH –].
Ученики делают обобщение:
Гидролиз идёт по слабому иону
Реакция среды определяется по сильному иону.
Вывод: Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, так как в растворе избыток ионов водорода, гидролиз идет по катиону (выводы записывают в тетрадях).
Аналогично составляются схемы по другим солям и делаются соответствующие выводы.
Na2CO3
NaOH h3CO3
сильное основание слабая кислота
[ ОН]- > [H]+
Предлагаю одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
Na2CO3 + HOH ↔ NaOH + NaHCO3
2Na+ + CO32 – + HOH ↔ Na+ + OH – + Na+ + HCO3 –
CO32 – + HOH ↔ OH – + HCO3 –
pH>7,
[H+] < [OH –].
Вывод: Соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов, гидролиз идет по аниону .
Далее учитель просит ребят самостоятельно составить аналогичную схему для хлорида натрия.
NaCl
NaOH HCl
сильное основание сильная кислота
[H+] = [OH –].
Предлагаем одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
NaCl + HOH ↔ NaOH + HCl
Na+ + Cl – + HOH ↔ Na+ + OH – + H+ + Cl –
HOH ↔ OH – + H+
pH=7,
[H+] = [OH –].
Учащиеся делают вывод: силы электролитов равны и записывают определение: Раствор соли, образованной сильным основанием и сильной кислотой имеет нейтральную среду, т.к. равенство концентраций ионов водорода и гидроксид-ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.
Можно сказать, что такие соли гидролизу не подвергаются.
Учитель: А какой еще может быть случай образования солей? (Соль может быть образованна слабым основанием и слабой кислотой)
Учитель: Обратимся к тексту учебника. (Учащиеся читают текст учебника и выписывают уравнение реакции гидролиза сульфида алюминия).
Учитель: Очевидно, такому же необратимому гидролизу подвергается соль карбонат железа (III):
Fe2(CO3)3 + 3HOH → 2Fe(OH)3↓+ 3CO2↑
Учащийся делает вывод:
Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются с образованием осадка и выделением газа, гидролиз идет и по катиону и по аниону.
V этап урока — Разрешение проблемы (решение задачи).
Вернемся к задаче, в решении которой мы зашли в тупик. Что нужно изменить в написании уравнения реакции?
Что нужно изменить в написании уравнения реакции?
В левую часть добавить вещество h3O, в правой части соль карбонат железа (III) заменить на осадок гидроксида железа (III) и углекислый газ. Соль хлорид натрия образованна сильным основанием и сильной кислотой, поэтому гидролизу не подвергается, в уравнении реакции остается без изменений.
Приглашаем того же ученика закончить решение задачи.
Ученик изменяет уравнение реакции и производит расчеты:
2FeCl3 + 3Na2CO3 + 3h3O → 2Fe(OH)3↓+ 3CO2↑+ 6NaCl.
ν (Fe(OH)3) = ν (FeCl3) = 5 моль.
m (Fe(OH)3) = M* ν = 107г/моль*5моль = 535г.
Ответ: масса выпавшего осадка составляет 535г.
Вот мы и решили эту задачу, определили газ, наш массу осадка
VI этап урока – Закрепление («учимся говорить»).Подведение итогов.
Итак, сегодня мы познакомились с явлением гидролиза солей. Прошу дать краткие ответы на мои вопросы:
Что такое гидролиз?
На какие группы мы разделили все соли?
Как происходит гидролиз каждой группы?
(обучающиеся устно отвечают)
Проверим результативность нашей совместной исследовательской деятельности: определите тип соли, тип гидролиза, реакцию среды по алгоритму (находится на слайде):
Алгоритм выполнения задания | Примеры |
1. Определяем, каким основанием и какой кислотой образована соль | Al Cl3 Слабое осн. |
2. Выбираем слабый ион, т.к. гидролиз идёт по слабому иону | 3+ Al — катион |
3. Выбираем сильный ион, т.к. он определяет реакцию среды | Сильная кислота Кислая среда |
4. Формулируем вывод: соль образована слабым основанием и сильной кислотой, гидролизуется по катиону с образованием кислой среды. | |
Помните:
Тип гидролиза определяем по слабому иону (катион или анион)
Реакцию среды устанавливаем по сильному иону (кислая, щелочная, нейтральная)
Например: карбонат натрия Na2CO3 – соль образована сильным основанием и слабой кислотой, гидролизуется по аниону с образованием щелочной среды
Устные задания: AlCl3 Fe2S3 K2 SO4 FeBr2 CaCl2 Na3PO4 Сu(NO3)2
VI этап урока –Домашнее задание.
§18, упражнение №3, 7, 8 (письменно), подготовить небольшой доклад на тему «Роль гидролиза в природе и жизни человека»
Приложение 2.
Задача.
При сливании раствора, содержащего 5моль хлорида железа (III), с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определить массу выпавшего осадка.
Способы получения кислых, основных и комплексных солей — урок. Химия, 8–9 класс.
Способы получения кислых солей
1. Кислые соли образуются при взаимодействии средних солей с кислотами.
Например, если к раствору сульфата натрия добавить раствор серной кислоты, из полученного раствора можно выкристаллизовать гидросульфат натрия:
Na2SO4+h3SO4→2NaHSO4.
Нерастворимые в воде природные карбонаты (известняк и другие) в присутствии воды и углекислого газа (угольной кислоты) превращаются в растворимые гидрокарбонаты.
Например, карбонат кальция превращается в гидрокарбонат:
CaCO3+h3O+CO2⏟h3CO3→CaHCO32.
В результате этой химической реакции возрастает жёсткость природной воды, обусловленная присутствием растворимых солей кальция и магния, образуются карстовые пещеры, а также происходит разрушение коралловых рифов.
Видеофрагмент:
Взаимопревращение карбонатов и гидрокарбонатов |
2. Кислые соли образуются при неполной нейтрализации многоосновных кислот.
Например, при взаимодействии гидроксида натрия с серной кислотой в соотношении количества вещества \(1 : 1\) образуется гидросульфат натрия:
NaOH+h3SO4→NaHSO4+h3O.
Если гидроксид кальция взаимодействует с фосфорной (ортофосфорной) кислотой в
соотношении количества вещества \(1 : 2\), образуется дигидрофосфат кальция:
CaOh3+2h4PO4→Cah3PO42+2h3O.
3. Кислые соли образуются при действии избытка кислотного оксида на основание.
Например, если гидроксид натрия реагирует с оксидом углерода(\(IV\)) в соотношении количества вещества \(1 : 1\), образуется гидрокарбонат натрия:
NaOH+CO2→NaHCO3.
Способы получения основных солей
1. Основные соли образуются при взаимодействии щелочей с растворимыми в воде солями.
Например, если смешать растворы хлорида кальция и гидроксида кальция, из полученного раствора можно выкристаллизовать гидроксохлорид кальция:
CaOh3+CaCl2→2CaOHCl.
2. Основные соли образуются при взаимодействии избытка основания с кислотой.
Например, гидроксохлорид кальция образуется при неполной нейтрализации гидроксида кальция соляной кислотой:
CaOh3+HCl→CaOHCl+h3O.
3. Гидроксокарбонат меди(\(II\)), свинца(\(II\)), цинка и некоторых других металлов образуется при взаимодействии растворов солей этих металлов с растворами карбонатов.
Например, при взаимодействии раствора сульфата меди(\(II\)) (медного купороса) с раствором карбоната натрия (соды) образуется осадок гидроксокарбоната меди:
2CuSO4+2Na2CO3+h3O→CuOh3CO3↓+CO2↑+2Na2SO4.
Видеофрагмент:
Получение основного карбоната меди |
Получение комплексных солей
1. Комплексные соли образуются при действии растворов щелочей на амфотерные гидроксиды.
Например, при действии раствора гидроксида калия на гидроксид цинка образуется тетрагидроксоцинкат калия:
2KOH+ZnOh3→K2ZnOh5.
При действии разбавленного раствора гидроксида натрия на гидроксид алюминия образуется тетрагидроксоалюминат натрия:
NaOH+AlOh4→NaAlOh5.
2. Ещё один способ получения комплексных солей — действие растворов щелочей на амфотерные оксиды.
Ещё один способ получения комплексных солей — действие растворов щелочей на амфотерные оксиды.
Например, при действии раствора гидроксида натрия на оксид цинка образуется тетрагидроксоцинкат натрия:
2NaOH+ZnO+h3O→Na2ZnOh5.
Комплексные соли образуются также при растворении в щёлочи цинка или алюминия.
Одним из продуктов реакции в этом случае является водород:
2NaOH+Zn+2h3O→Na2ZnOh5+h3↑,
2NaOH+2Al+6h3O→2NaAlOh5+3h3↑.
Карбонатные соли | CAMEO Chemicals
Лист данных реактивной группы
Что такое реактивные группы?
Реактивные группы — это категории химических веществ, которые обычно реагируют одинаково.
способами, потому что они похожи по своей химической структуре. Каждое вещество с
химическая таблица была отнесена к одной или нескольким реакционным группам, и
CAMEO Chemicals использует назначения реактивных групп для определения своей реакционной способности.
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа
он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы
чтобы увидеть прогнозы реактивности.
Есть
13 химических паспортов
назначен этой реактивной группе.
Описание
Воспламеняемость
Карбонатные соли — негорючие материалы.
Реакционная способность
Карбонатные соли действуют как слабые основания и поэтому участвуют в кислотно-основных реакциях, которые выделяют тепло и выделяют углекислый газ.Производство CO2 может вызвать повышение давления в сосудах, содержащих карбонаты.
Токсичность
В целом нетоксичен. Бикарбонат натрия используется как антикислотное лекарство.
Прочие характеристики
Карбонаты образуются в результате реакции между угольной кислотой (водный диоксид углерода) и основанием (или щелочью). Они имеют формулу Mx (CO3) y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями, и они становятся синей лакмусовой бумажкой.Карбонаты находят множество применений в стекольном производстве, производстве целлюлозы и бумаги, химикатах для очистки воды, текстильном производстве, чистящих составах, пищевых добавках и т. Д.
Они имеют формулу Mx (CO3) y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями, и они становятся синей лакмусовой бумажкой.Карбонаты находят множество применений в стекольном производстве, производстве целлюлозы и бумаги, химикатах для очистки воды, текстильном производстве, чистящих составах, пищевых добавках и т. Д.
Примеры
Бикарбонат аммония, карбонат бария, карбонат кальция, магнезит, перкарбонаты натрия, карбонат натрия, бикарбонат натрия.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любыми
реактивных групп в базе данных.
Прогнозируемые опасности и побочные газы для каждой пары реактивных групп будут
отображаться, а также документация и ссылки, которые использовались для
сделать прогнозы реактивности.
Смешайте Карбонатные соли с:
- Ацетали, кеталы, полуацетали и полуацетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окисления
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины без ацетиленового водорода
- Амиды и имиды
- Ароматы ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо, диазо, азидо, гидразин и азидные соединения
- Основания, Strong
- Базы, слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды неорганические
- Соли диазония
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Фторидные соли растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды алифатические ненасыщенные
- Углеводороды ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементы и порошок, активный
- Металлы, менее реактивные
- Соединения нитратов и нитритов, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Неокислительно-восстановительные неорганические соединения
- Не реагирует химически
- Металлоорганические
- Окисляющие агенты, сильные
- Окислители, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные соли аммония и фосфония
- Восстановители сильные
- Восстанавливающие агенты, слабые
- Соли кислотные
- Соль, основная
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Сложные эфиры и соли тиокарбамата / сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
| Карбикарб для инъекций | Карбонат натрия (35 мг) + бикарбонат натрия (28 мг) | Жидкость | Внутривенно | International Medication Systems, Limited | 1992-12-31 | 1997-08-15 | Канада | |
| ENO | Карбонат натрия (10%) + лимонная кислота (43. 6%) + бикарбонат натрия (46,4%) 6%) + бикарбонат натрия (46,4%) | Порошок для раствора | Устный | ПРЕПАРАТ СТЕРЛИНГ (МАЛАЯ) SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ENO (ИНДОНЕЗИЯ) | Карбонат натрия (10%) + лимонная кислота (43,6%) + бикарбонат натрия (46,4%) | Порошок, для раствор | пероральный | СТЕРЛИНГОВЫЙ ПРЕПАРАТ (МАЛАЯ) SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ENO (со вкусом лимона) | Карбонат натрия (10%) + лимонная кислота (43.1%) + бикарбонат натрия (45,55%) | Порошок для раствора | Устный | ПРЕПАРАТ СТЕРЛИНГ (МАЛАЯ) SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ENO (со вкусом апельсина) | карбонат натрия (10%) + лимонная кислота (43,6%) + бикарбонат натрия (45,49%) | порошок, для решения | Устный | СТЕРЛИНГ (МАЛАЯ) SDN. BHD. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ENO (ОРАНЖЕВЫЙ) | Карбонат натрия (10%) + лимонная кислота (43.6%) + бикарбонат натрия (45,49%) | Порошок для раствора | Устный | ПРЕПАРАТ СТЕРЛИНГ (МАЛАЯ) SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ФРУКТОВАЯ СОЛЬ ENO | Карбонат натрия (10%) + лимонная кислота (43,6%) + бикарбонат натрия (46,4%) | Порошок для раствора | Устный | GLAXOSMITHKLINE CONSUMER HEALTHCARE SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ФРУКТОВАЯ СОЛЬ ЭНО (СО ВКУСОМ ЛИМОНА) (АВСТРАЛИЯ) | Карбонат натрия (0.43 г) + лимонная кислота (1,85 г) + сахарин натрия (0,003 г) + бикарбонат натрия (1,96 г) | Порошок, для раствора | Устный | ПРЕПАРАТ ДЛЯ СТЕРЛИНГА (MALAYA) SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ENO FRUIT SALT GINGER | Карбонат натрия (9,89%) + лимонная кислота (42,64%) + бикарбонат натрия (45,32%) | раствор | Устный | GLAXOSMITHKLINE CONSUMER HEALTHCARE SDN. BHD. BHD. | 2020-09-08 | Неприменимо | Малайзия | |
| ЭНО ФРУКТОВАЯ СОЛЬ ЛИМОН | Карбонат натрия (10%) + Лимонная кислота (43,1%) + Бикарбонат натрия (45,55%) | Порошок, для раствор | Устный | GLAXOSMITHKLINE CONSUMER HEALTHCARE SDN. BHD. | 2020-09-08 | Неприменимо | Малайзия |
Моногидрат карбоната натрия (неактивный ингредиент)
- Неактивные ингредиенты
- моногидрат карбоната натрия
Наполнитель (фармакологически неактивное вещество)
Проведено медицинское освидетельствование Drugs.com. Последнее обновление: 29 октября 2020 г.
Что это?
Карбонат натрия (Na2CO3) представляет собой натриевую соль угольной кислоты. Карбонат натрия также известен как сода, стиральная сода, кальцинированная сода и кристаллы соды. Он существует в виде белого порошка, поглощает влагу из воздуха и образует сильный щелочной водный раствор. Карбонат натрия обычно используется в качестве смягчителя воды и используется для изготовления стекла. Карбонат натрия может существовать в природе из золы определенных растений, а также может быть получен синтетическим путем в лаборатории из хлорида натрия (соли) и известняка с помощью хорошо известного процесса Сольвея.Карбонат натрия обычно используется в химических реакциях в фармацевтической промышленности как часть кислотно-основных реакций. Карбонат натрия также можно найти в зубных пастах в качестве абразива, в смягчителях воды, используемых для стирки, в мыле для автоматических посудомоечных машин и некоторых растворах для пены для ванн. [1] [2] [3] Моногидрат карбоната натрия (Na2CO3 h3O) имеет добавленную молекулу воды и также используется в качестве буфера.
Карбонат натрия обычно используется в качестве смягчителя воды и используется для изготовления стекла. Карбонат натрия может существовать в природе из золы определенных растений, а также может быть получен синтетическим путем в лаборатории из хлорида натрия (соли) и известняка с помощью хорошо известного процесса Сольвея.Карбонат натрия обычно используется в химических реакциях в фармацевтической промышленности как часть кислотно-основных реакций. Карбонат натрия также можно найти в зубных пастах в качестве абразива, в смягчителях воды, используемых для стирки, в мыле для автоматических посудомоечных машин и некоторых растворах для пены для ванн. [1] [2] [3] Моногидрат карбоната натрия (Na2CO3 h3O) имеет добавленную молекулу воды и также используется в качестве буфера.
Лучшие лекарства с этим вспомогательным веществом
Список литературы
[1] Наркотики.com Карбонат натрия. По состоянию на 2 марта 2015 г. http://www.drugs. com/dict/sodium-carbonate.html
com/dict/sodium-carbonate.html
.
[2] Medline Plus. Отравление карбонатом натрия. По состоянию на 2 марта 2015 г. http://www.nlm.nih.gov/medlineplus/ency/article/002486.htm
.
[3] Колумбийская электронная энциклопедия, 6-е изд. Авторские права © 2012, Columbia University Press. По состоянию на 2 марта 2015 г. http://www.infoplease.com/encyclopedia/science/sodium-carbonate.html#ixzz3THgDLzvu
.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Быстрый ответ: Na2co3 — это кислота или основание?
Каков pH раствора Na2CO3?
12Na2CO3 представляет собой соль слабой кислоты (угольная кислота) и сильного основания NaOH.
Значение pH довольно крепкого раствора Na2CO3 будет близко к 12 ..
Является ли Na2CO3 основным?
Слегка простой. Когда вы добавляете Na2CO3 в воду, он диссоциирует, оставляя ионы Na + и CO3 (2+) в растворе. … Из-за этого в солевом растворе присутствует некоторое количество ОН (-), и раствор очень слабо щелочной.
Когда вы добавляете Na2CO3 в воду, он диссоциирует, оставляя ионы Na + и CO3 (2+) в растворе. … Из-за этого в солевом растворе присутствует некоторое количество ОН (-), и раствор очень слабо щелочной.
Как называется Na2CO3?
Карбонат натрия Карбонат натрия | Na2CO3 — PubChem.
Каково химическое название Na2CO3 10h3o?
Карбонат натрия Формула промывочной соды записывается как Na2CO3. 10х3О. Химическое название стиральной соды — карбонат натрия.
Что такое Na2CO3?
Процентный состав по элементам Элемент Символ Кол-во атомов Натрий Na2 УглеродC1 КислородO3
Каково химическое название Наох?
Гидроксид натрия Оксиданид натрия Гидроксид натрия / IUPAC ID
Является ли Na2CO3 сильным или слабым основанием?
Карбонаты образуются в результате реакции угольной кислоты (водный диоксид углерода) и основания (или щелочи). Они имеют формулу Mx (CO3) y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями, и они становятся синей лакмусовой бумажкой.
Они имеют формулу Mx (CO3) y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями, и они становятся синей лакмусовой бумажкой.
Является ли NaCl основанием или кислотой?
Соль, полученная в результате реакции сильной кислоты с сильным основанием, образует раствор с pH 7. Примером является хлорид натрия, образующийся в результате нейтрализации HCl с помощью NaOH. Раствор NaCl в воде не обладает ни кислотными, ни основными свойствами, поскольку ни один ион не способен гидролизоваться.
Является ли KBR кислотой или основанием?
Ну бромид калия — это соль сильной кислоты и сильного основания …….
KCl — это кислота или основание?
Ионы KCl образуются из сильной кислоты (HCl) и сильного основания (KOH). Следовательно, ни один ион не повлияет на кислотность раствора, поэтому KCl является нейтральной солью.
Является ли Na2CO3 кислотной или основной солью?
если основная часть сильная, то соль будет основной по природе, а если кислотная часть сильная, то соль будет кислой по природе. ясно, что Na2CO3 образован сильным основанием и слабой кислотой. Итак, Na2CO3 имеет основную природу или является основной солью.
ясно, что Na2CO3 образован сильным основанием и слабой кислотой. Итак, Na2CO3 имеет основную природу или является основной солью.
Является ли Nh5Cl кислотой или основанием?
Обозначается символом Nh5Cl и в природе находится в твердой кристаллической форме. Это соединение представляет собой водорастворимую соль аммиака, а водный раствор хлорида аммония является слабокислым.
Карбонат натрия | 497-19-8
Карбонат натрия Химические свойства, применение, производство
Описание
Карбонат натрия, Na2CO3, представляет собой натриевую соль угольной кислоты.Чистый продукт на некоторое время выглядит как порошок без запаха с сильным щелочным вкусом. Обладает высокой гигроскопичностью. Он легко растворяется в воде с образованием водного раствора с умеренной щелочностью.
Карбонат натрия находит широкое применение в различных областях по всему миру. Одно из наиболее важных применений карбоната натрия — производство стекла. Согласно статистическим данным, около половины всего объема производства карбоната натрия используется для производства стекла.При производстве стекла карбонат натрия действует как флюс при плавлении кремнезема. Кроме того, как сильная химическая основа, он используется в производстве целлюлозы и бумаги, текстиля, питьевой воды, мыла и моющих средств, а также в качестве очистителя канализации. Кроме того, он также может использоваться для переваривания тканей, растворения амфотерных металлов и соединений, приготовления пищи, а также в качестве чистящего средства.
Обычно есть два способа производства карбоната натрия. Один из них — через реакции между хлоридом натрия и карбонатом кальция (через процесс аммиачной соды (Solvay)).Другой — из карбонатных и гидрокарбонатных руд натрия (трона и нахколит).
Физические свойства
Карбонат натрия — неорганическая соль, поэтому давление пара можно считать незначительным. Он имеет температуру плавления 851 ° C (CRC Handbook, 1986; The Merck Index, 1983), он разлагается при нагревании до> 400 ° C, и поэтому температуру кипения определить невозможно. растворим в воде; не растворим в спирте; растворяется в кислотах, высвобождая CO2. Коэффициент распределения октанола в воде (log Pow) не имеет отношения к неорганическому веществу, которое диссоциирует.Средний диаметр частиц (d50) легкого карбоната натрия находится в диапазоне от 90 до 150 мкм, а плотного карбоната натрия находится в диапазоне от 250 до 500 мкм.
Он имеет температуру плавления 851 ° C (CRC Handbook, 1986; The Merck Index, 1983), он разлагается при нагревании до> 400 ° C, и поэтому температуру кипения определить невозможно. растворим в воде; не растворим в спирте; растворяется в кислотах, высвобождая CO2. Коэффициент распределения октанола в воде (log Pow) не имеет отношения к неорганическому веществу, которое диссоциирует.Средний диаметр частиц (d50) легкого карбоната натрия находится в диапазоне от 90 до 150 мкм, а плотного карбоната натрия находится в диапазоне от 250 до 500 мкм.
Моногидрат состоит из бесцветных и не имеющих запаха мелких кристаллов или цисталинового порошка; орторомбическая структура; показатель преломления 1,420; твердость 1,3 по шкале Мооса; плотность 2,25 г / см3; теряет воду при 100 ° C, становясь безводным; хорошо растворяется в воде; не растворим в этаноле.
Декагидрат состоит из прозрачных кристаллов; высолы на воздухе; плотность 1.46 г / см3; разлагается при 34 ° C; хорошо растворяется в воде; не растворим в этаноле.
Водный раствор карбоната натрия сильно щелочной.
Химические свойства
Карбонат натрия представляет собой белый кристаллический гигроскопичный порошок чистотой> 98%. Доступны две формы карбоната натрия: легкая сода и плотная сода. Примеси карбоната натрия могут включать воду (
Карбонат натрия — сильнощелочное соединение с pH 11.6 для 0,1 М водного раствора (The Merck Index, 1983; Johnson and Swanson, 1987). PKa CO3 2- составляет 10,33, что означает, что при pH 10,33 карбонат и бикарбонат присутствуют в равных количествах.
использует
Карбонат натрия является важным сырьем для химической промышленности с широким применением. Это важное сырье для изготовления стекла, мыла, моющих средств, текстиля, кожи, специй, красителей, лекарств и т. Д.
Его можно использовать для анализа реагентов, а также для фармацевтической промышленности и фото гравировки.
Он широко используется в стекольной, химической, бумажной, металлургической, фармацевтической и текстильной, а также пищевой промышленности.
Это реагент, предназначенный для ТВ.
Его можно использовать в пищевой промышленности в качестве нейтрализующего агента, разрыхлителей, например, для производства аминокислот, соевого соуса и макаронных изделий, таких как хлеб, хлеб и т. Д. Его также можно обработать щелочью и добавить в пасту для повышения гибкости и пластичности.
В качестве моющего средства можно использовать для полоскания шерсти.Его также можно наносить на соли для ванн и в фармацевтике, а также использовать в качестве щелочного агента для загара.
Карбонат натрия чаще всего используется в промышленности, а небольшая часть используется в гражданском секторе. В кальцинированной соде промышленного назначения она в основном применяется в легкой, строительной и химической промышленности, на долю которой приходится около 2/3: затем идут металлургия, текстильная, нефтяная, оборонная и фармацевтическая промышленность. Стекольная промышленность является крупнейшим сектором потребления соды, где на каждую тонну стекла приходится 0.2 тонны кальцинированной соды. В химической промышленности его можно использовать для производства силиката натрия, дихромата натрия, нитрата натрия, фторида натрия, пищевой соды, буры и тринатрийфосфата. В металлургической промышленности он в основном используется в качестве флюса, минерального флотационного агента и агента обессеривания стали и сурьмы. Его также можно использовать в качестве смягчителя воды в полиграфической и красильной промышленности. В кожевенной промышленности он может использоваться для обезжиривания кожевенного сырья, нейтрализации кожи хромового дубления и повышения щелочности хромовой жидкости.Он также используется в производстве синтетической моющей добавки триполифосфата натрия и других натриевых солей.
Может использоваться как буфер, нейтрализатор и кондиционер для теста. Его можно использовать в тортах и макаронных изделиях. Используйте его надлежащим образом в соответствии с фактическими требованиями производства.
Применяется в основном для флоат-стекла, воронок, оптического стекла. Его также можно использовать в других отраслях химической и металлургической промышленности. Это может уменьшить летающее щелочную пыль путем применения тяжелой кальцинированной соды, и, таким образом уменьшая расход материала, улучшение условий труда, а также повышение качества продукции при одновременном снижении ее эрозии на огнеупорном материале, чтобы продлить срок службы печи.
Это разновидность основного химического сырья, которое широко используется в медицине, производстве бумаги, металлургии, стекольной, текстильной, красочной и других отраслях промышленности, а также в качестве разрыхлителя в пищевой промышленности.
Может использоваться в качестве аналитических реагентов, дегидратирующего агента и добавок для аккумуляторов.
Биологические функции
Карбонат натрия используется в качестве буферного компонента в таких приложениях, как хроматография, капиллярный электрофорез и ферментный катализ. Карбонат натрия широко используется для выделения клеточных мембран, мембранных белков и гидрофобных белков.Опубликован протокол выделения полиаминов из среды для культивирования клеток.
Токсичность
ADI (допустимое суточное потребление) не имеет ограничений (ФАО / ВОЗ в 1985 г.). LD50 (средняя летальная доза) составляет около 6 г / кг (мыши перорально).
Пыль кальцинированной соды раздражает кожу, органы дыхания и глаза. Длительное воздействие содового раствора может вызвать экзему и дерматит. Его концентрированные растворы могут вызвать ожоги, некроз и даже помутнение роговицы. Максимально допустимая концентрация пыли кальцинированной соды в воздухе — 2 мг / м3.Операторы должны носить спецодежду, дверные чехлы, перчатки, обувь и другую защитную одежду для защиты органов дыхания и кожи.
Метод производства
Карбонат натрия в настоящее время добывается в основном из его природных месторождений. Он также производится синтетически методом Solvay (или аммиачно-содовой). В настоящее время естественное производство карбоната натрия превосходит его синтетическое.
Процесс Сольвея включает в себя ряд частичных реакций. Первым шагом является прокаливание карбоната кальция с образованием извести и СО2.Известь превращается в гидроксид кальция. Самая важная стадия процесса включает реакцию солевого раствора с диоксидом углерода и аммиаком с образованием бикарбоната натрия и хлорида аммония. Бикарбонат натрия превращается в карбонат натрия. Гидроксид кальция и хлорид аммония реагируют с образованием хлорида кальция в качестве побочного продукта. Парциальные реакции показаны ниже:
CaCO3 → CaO + CO2
CaO + h3O → Ca (OH) 2
2NaCl + 2CO2 + 2Nh4 + 2h3O → 2NaHCO3 + 2Nh5Cl
2NaHCO3 → Na2CO3 + h3O + CO2
Ca (OH) 2 + 2Nh5Cl → CaCl2 + 2Nh4 + 2h3O
Общая реакция:
CaCO3 + 2NaCl → Na2CO3 + CaCl2
Карбонат натрия исторически производился по методу Леблана.Первое коммерческое производство было осуществлено по технологии Leblanc. В этом процессе хлорид натрия обрабатывали серной кислотой для получения сульфата натрия и соляной кислоты. При нагревании сульфата натрия с углем и известняком образуется «черная зола», содержащая карбонат натрия, сульфид кальция, непрореагировавший уголь и карбонат кальция. Карбонат натрия отделяли от черной золы выщелачиванием водой. Общая реакция следующая:
Na2SO4 + 2C + CaCO3 → Na2CO3 + CaS + 2CO2
Список литературы
https: // ru.wikipedia.org/wiki/Sodium_hydroxide#Uses
http://www.essentialchemicalindustry.org/chemicals/sodium-carbonate.html
Описание
Карбонат натрия, известный как кальцинированная сода или стиральная сода, является широко используемым неорганическим соединением. Около 45 миллионов тонн кальцинированной соды производится в мире как естественным, так и синтетическим путем. Кальцинированная сода получается естественным образом в основном из минеральной троны, но ее также можно получить из нахколита (NaHCO3) и солевых отложений.Trona — это пресноводный эвапорит из карбоната-бикарбоната натрия с формулой Na3CO3HCO3 .2h3O. Самое крупное известное месторождение троны находится в районе Грин-Ривер в Вайоминге, а другие крупные месторождения находятся в долине Нила в Египте и в бассейне Сирлза в Калифорнии вокруг города Трона. Кальцинированная сода производится из добытой троны путем дробления и просеивания руды с последующим ее нагреванием. При этом образуется кальцинированная сода, смешанная с примесями. Чистая кальцинированная сода получается растворением продукта и осаждением примесей в сочетании с процессами фильтрации.
Химические свойства
Карбонат натрия, Na2C03, также известный как сода или кальцинированная сода, является наиболее важным из промышленных щелочей. Это белый или серовато-белый комковатый водорастворимый порошок, который при нагревании теряет кристаллизационную воду. Он разлагается при температуре около 852 ° C (1560 ° F). Он существует только в растворе. Он готовится из смеси углекислого газа и воды.
появление
Ясень — дерево, которое растет в регионах Северной Америки.
История
Карбонат натрия Na 2 CO 3 исторически использовался для производства стекла, мыла и пороха.Наряду с карбонатом калия, известным как поташ, карбонат натрия был основой щелочной промышленности, которая была одной из первых крупных химических отраслей промышленности. На протяжении всей истории щелочи получали из природных источников. Кальцинированная сода также производилась путем сжигания древесины и выщелачивания золы водой для получения раствора, который давал кальцинированную соду при кипячении воды. Название кальцинированная сода происходит от растения барилла, который использовался для производства кальцинированной соды. Научное название этого растения — сода солянка, но оно носит общие названия натренированный или стеклянный зверобой, потому что произведенная из него сода использовалась при производстве стекла.Барилла — обычное растение, которое встречается в соленых водах Средиземного моря в Испании и Италии.
Барилла сушили и сжигали для получения кальцинированной соды. Истощение европейских лесов и
международные споры сделали доступность солей щелочных металлов все более неопределенной во время
вторая половина 18 века. LeBlanc
предложила процедуру в 1783 году, а завод, основанный на методе Леблана, был открыт в 1791 году.
К сожалению, связь Леблана с французской королевской семьей привела к конфискации завода.
во времена Французской революции.Кроме того, противоречивые утверждения о методе Леблана
были сделаны несколькими другими химиками, и он так и не получил награды.
использует
Кальцинированная сода используется в производстве стекла, в производстве химикатов натрия (таких как хроматы, фосфаты и силикаты натрия), в целлюлозно-бумажной промышленности, в производстве мыла и моющих средств, в нефтепереработке, в умягчении воды и при рафинировании Цветные металлы. В своей водной кристаллизованной форме (Na2C03.10h3O) он известен как соляная сода, стиральная сода или кристаллы соды, не путать с пищевой содой, которая представляет собой гидрокарбонат натрия или бикарбонат натрия (NaHC03).Его моногидратная форма (Na2C03 · h30) является стандартным соединением для чистящих растворов.
В растворе карбонат натрия создает меньшую щелочность, чем гидроксиды. 0,1% раствор создает pH 11; полностью насыщенный раствор 35%, который имеет pH 12,5.
Требования безопасности для карбоната натрия из-за его более низкой щелочности можно считать менее строгими, чем для соответствующих бикарбонатов.
использует
Карбонат натрия — это щелочь, которая существует в виде кристаллов или кристаллического вещества.
порошок и легко растворяется в воде.он имеет множество функций:
антиоксидант, отвердитель и травильный агент, ароматизатор,
вспомогательное средство для обработки, секвестрант и агент для контроля pH. Это использовано
в супах быстрого приготовления для нейтрализации кислотности. он используется в дес-
серт гели, чтобы изолировать кальций, позволяя альгинату раствориться.
он также используется в пудингах, соусах и выпечке.
использует
Карбонат натрия также известен как стиральная сода или карбонат соды, натрия
карбонат — это белый кристалл или порошок, полученный путем преобразования
соль в сульфат натрия с последующим обжариванием с
известняк и уголь.Он растворим в воде и глицерине, но
не алкоголь. Карбонат натрия использовали в качестве модификатора pH в
тонизирующие ванны и как основная щелочь в проявителях, используемых для
желатиновые эмульсии.
Определение
А
двухосновная кислота образуется в небольших количествах в растворе
когда углекислый газ растворяется в
вода:
CO 2 + H 2 O? H 2 CO 2
Образует две серии солей: гидрокарбонаты.
(HCO 3 -) и карбонаты (CO 3 2-).Чистую кислоту выделить невозможно.
Определение
карбонат натрия: безводный карбонат натрия (кальцинированная сода, сода) представляет собой белый порошок, который слеживается и скапливается на воздухе из-за образования гидратов. Моногидрат Na 2 CO 3 · H 2 O, представляет собой белое кристаллическое вещество, растворимое в воде и нерастворимое в спирте; р. д. 2,532; теряет воду при 109 ° C; m.p. 851 ° С.
Декагидрат Na 2 CO 3 · 10H 2 O (сода для стирки), представляет собой полупрозрачное светящееся кристаллическое твердое вещество; р.d. 1,44; теряет воду при 32–34 ° C с образованием моногидрата; m.p. 851 ° С.
Карбонат натрия может быть произведен с помощью процесса Сольве или подходящих процедур кристаллизации из любого из ряда природных отложений, таких как:
трона (Na 2 CO 3 · NaHCO 3 · 2H 2 O ),
натрон (Na 2 CO 3 · 10H 2 O),
ранксит (2Na 2 CO 3 · 9Na 2 SO 4 · Na KCl),
пирсоннит
3 · CaCO 3 · 2H 2 O),
гайлюссит (Na2CO3 · CaCO 3 · 5H 2 O).
Метод добычи очень чувствителен к относительным затратам на энергию и транспортным расходам в соответствующем регионе. Карбонат натрия используется в фотографии, при очистке, в контроле pH воды, при обработке текстиля, стекол и глазури, а также в качестве пищевой добавки и реагента для измерения объема.
Методы производства
Карбонат натрия производят на всех континентах мира.
из его минералов. Он присутствует в крупных месторождениях в Африке и США в виде карбоната или троны, смешанной руды.
равные молярные количества карбоната и бикарбоната.Тем не мение,
около 70% мирового производства карбоната натрия составляет
производятся по технологии Solvay (сода аммиака),
при этом аммиак добавляется к раствору хлорида натрия.
Затем барботируют диоксид углерода для осаждения
бикарбонат (NaHCO3), который разлагается при выделении тепла
карбонат натрия. В Соединенных Штатах. все производство
на основе минералов, содержащих карбонат натрия. Разные
Карбонат натрия изготавливается по качеству: технический,
пищевые и фармацевтические сорта.
Профиль безопасности
Отравление внутрибрюшинным путем. Умеренно токсичен при вдыхании и подкожном введении. Сильно токсичен при проглатывании. Экспериментальные репродуктивные эффекты. Раздражает кожу и глаза. Он переходит в продукты питания из упаковочных материалов. Может бурно реагировать с Al, P2O5, h3SO4, F2, Li, 2,4,6-тринитротолуолом. При нагревании до разложения выделяет токсичные пары Na2O.
Методы очистки
Он кристаллизуется из воды в виде декагидрата, который повторно растворяется в воде с образованием почти насыщенного раствора.При барботировании CO2 осаждается NaHCO3. Его отфильтровывают, промывают и зажигают в течение 2 часов при 280 ° [MacLaren & Swinehart J Am Chem Soc 73 1822 1951]. Перед использованием в качестве объемного стандарта материал аналитической чистоты следует высушить путем нагревания при 260-270 ° в течение 0,5 часа и дать ему остыть в эксикаторе. Он имеет точку перехода при 450 °, а его растворимость в воде составляет 21,58% при 20 ° (декагидрат в твердой фазе), 49,25% при 35 ° (гептагидрат в твердой фазе) и 44,88% при 75 ° (моногидрат в твердой фазе) [D.nges in Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 987-988 1963]. После трех перекристаллизации технический Na2CO3 содержал Cr, Mg, K, P, Al, W, Sc и Ti при 32, 9,4, 6,6, 3,6, 2,4, 0,6, 0,2 и 0,2 частей на миллион соответственно; другой технический источник содержал Cr, Mg, Mo, P, Si, Sn и Ti в концентрациях 2,6, 0,4, 4,2, 13,4, 32, 0,6, 0,8 частей на миллион соответственно.
Продукты и сырье для получения карбоната натрия
Сырье
Препараты
Карбонат натрия | Энциклопедия.com
Производство карбоната натрия
Свойства карбоната натрия
Использование карбоната натрия
Ресурсы
Карбонат натрия, также известный как стиральная сода, представляет собой натриевую соль кабоновой кислоты с химическим составом, соответствующим общим формула: Na 2 CO 3 .
Его обычно называют кальцинированной содой, потому что он был первоначально получен из золы сожженных морских водорослей. Уже более ста лет кальцинированная сода производится главным образом методом, известным как процесс Сольвея (также называемый аммиачно-содовым процессом).В настоящее время это один из ведущих промышленных химикатов по объему производства в Соединенных Штатах. Он в основном используется в производстве стекла, но также используется в производстве других продуктов и является важным предшественником многих соединений натрия, используемых в промышленности.
Процесс получения карбоната натрия со временем значительно изменился. Первоначально его производили горящие водоросли, которые были богаты натрием. Когда сорняки сжигались, в золе оставался натрий в виде карбоната натрия.Хотя этот процесс был эффективным, его нельзя было использовать для производства больших объемов. Карбонат натрия использовался в различных формах с древних времен. В Древнем Египте, например, добывали натрон, который представляет собой минерал карбоната натрия и бикарбоната натрия, чтобы его можно было использовать для изготовления стекла и в качестве ингредиента для мумификации мертвых тел.
Первым процессом, который позволил производить значительные количества карбоната натрия, был синтетический процесс, известный как процесс Леблана, разработанный французским химиком Николя Лебланом (1742–1806).В этом процессе соль (хлорид натрия) реагировала с серной кислотой с образованием сульфата натрия и соляной кислоты. Сульфат натрия нагревали в присутствии известняка и угля, и полученная смесь содержала сульфат кальция и карбонат натрия, которые затем экстрагировали.
Две существенные проблемы с процессом LeBlanc, высокая стоимость и значительное загрязнение, вдохновили бельгийского инженера-химика Эрнеста Сольвея (1838–1922) на разработку более совершенного процесса создания карбоната натрия.В процессе Solvay аммиак и диоксид углерода используются для производства карбоната натрия из соли и известняка. Первоначально аммиак и диоксид углерода реагируют с водой с образованием гидроксида аммония и угольной кислоты со слабыми электролитами. Эти ионы вступают в дальнейшую реакцию и образуют бикарбонат натрия. Поскольку бикарбонат почти не растворяется в воде, он отделяется от раствора. На этом этапе бикарбонат натрия фильтруется и превращается в карбонат натрия при нагревании.
Синтетическое производство — не единственный способ получения карбоната натрия.Значительное количество добывается непосредственно из природных источников. Крупнейшие природные источники карбоната натрия в Соединенных Штатах находятся в районе Грин-Ривер, штат Вайоминг, и в высохшем озере Сирлс в пустыне Мохаве в Калифорнии.
При комнатной температуре карбонат натрия (Na 2 CO 3 ) представляет собой гигроскопичный серовато-белый порошок без запаха. Это свойство означает, что при контакте с воздухом он может самопроизвольно поглощать молекулы воды. Еще одно известное соединение, обладающее такими гигроскопичными свойствами, — это сахар.Карбонат натрия имеет точку плавления 1564 ° F (851 ° C), плотность 2,53 г / см 3 и растворим в воде. Водный раствор кальцинированной соды имеет щелочной pH и сильный щелочной вкус. Когда его помещают в слабокислый раствор, он разлагается и образует пузырьки. Этот эффект, называемый вспениванием, обнаруживается во многих коммерческих антацидных продуктах, в которых в качестве активного ингредиента используется карбонат натрия.
Безводный (без воды) карбонат натрия может абсорбировать различное количество воды и образовывать гидраты с немного разными характеристиками.Когда одна молекула воды на молекулу карбоната натрия абсорбируется, полученное вещество, моногидрат карбоната натрия, представляется химической формулой Na 2 CO 3 • H 2 O. Это соединение имеет немного меньшую плотность, чем безводный вариант. Другой распространенный гидрат образуется в результате поглощения десяти молекул воды на молекулу карбоната натрия. Это соединение, Na 2 CO 3 • 10H 2 O, известное как декагидрат карбоната натрия, существует в виде прозрачных кристаллов, которые легко вскипают при контакте с воздухом.
Карбонат натрия используется во многих отраслях промышленности при производстве различных продуктов. Наиболее значительным пользователем является стекольная промышленность, которая использует карбонат натрия для разложения силикатов при производстве стекла. Косметическая промышленность использует его для производства мыла. В химической промышленности он используется в качестве прекурсора для множества натрийсодержащих реагентов. Это также важно в фотографии, текстильной промышленности и очистке воды. Помимо этих промышленных применений, карбонат натрия используется в медицине в качестве антацида.В доме карбонат натрия используют в качестве смягчителя воды для стирки, поэтому его иногда называют стиральной содой. Используемый для этой цели, он помогает удалить пятна от спирта, жира, масла и т. Д.
КЛЮЧЕВЫЕ УСЛОВИЯ
Безводный —Соединение, не содержащее абсорбированной воды.
Гидрат — соединение, которое содержит определенное количество абсорбированной воды.
Гигроскопичный —Соединение, которое имеет тенденцию поглощать молекулы воды.
Процесс ЛеБлана — способ производства карбоната натрия с использованием соли, известняка и угля.
Кальцинированная сода — название карбоната натрия, которое отражает его первоначальный источник — пепел сожженных морских водорослей.
Процесс Solvay — Текущий синтетический метод производства карбоната натрия из аммиака, диоксида углерода, соли и известняка.
КНИГИ
Кэри, Фрэнсис А. Органическая химия . Дубьюк, ИА: McGraw-Hill, 2006.
Фейт, У.Л., Дональд Киз и Рональд Кларк. Промышленная химия . Нью-Йорк: John Wiley & Sons, 1966.
Hester, R.E. и Р. Харрисон, ред. Химические вещества в окружающей среде: оценка и управление рисками . Кембридж, Великобритания: Королевское химическое общество, 2006.
Хоффман, Роберт В. Органическая химия: промежуточный текст . Хобокен, Нью-Джерси: Wiley-Interscience, 2004.
Lide, Дэвид Р., изд. CRC Handbook of Chemistry and Physics Boca Raton, FL: CRC Press, 2005.
Индекс Merck . Станция Уайтхаус, Нью-Джерси: Merck, 2001.
Snyder, C.H. Необычная химия обычных вещей . 4-е изд. Нью-Йорк: John Wiley and Sons, 2002.
Perry Romanowski
Объяснение кислотно-основных проблем
ПРОБЛЕМЫ ТИТРАЦИИ И pH
СЛЕДУЮЩИЕ СОЛИ В ВОДНОМ РАСТВОРЕ ИМЕЮТ pH 7, -7 (менее 7), +7 (более
чем 7) ИЛИ УКАЗАТЬ (I). ДЛЯ КАЖДОГО ПРОГНОЗИРУЙТЕ pH РЕШЕНИЯ.
1. Na 2 CO 3
является основной солью, потому что NaOH является сильным основанием, а H 2 CO 3 является слабой кислотой. pH выше 7.
2. FeCl 3 является кислой солью, потому что
Fe (OH) 3 — слабое основание, а HCl — сильная кислота.pH менее 7.
3. KNO 3 — нейтральный
соль. Оба HNO 3 и КОН являются сильными. pH = 7.
4. NH 4 C 2 H 3 O 2
неопределенно. Оба NH 4 OH
и HC 2 H 3 O 2
слабые.На самом деле pH лишь немного превышает 7.
5. ZnSO 4 — кислотная соль. Первая ионизация
H 2 SO 4
сильный и Zn (OH) 2
слабый. pH менее 7.
6. Ba (НЕТ 3 ) 2
нейтрален, поскольку оба Ba (OH) 2
и HNO 3 сильны.pH = 7.
7. RbF является щелочной солью, потому что RbOH сильный, а HF слабый. pH более 7.
8. CaBr 2 нейтральный, потому что
оба Ca (OH) 2 и HBr являются
сильный. pH = 7.
9. Каков pH 0,0115 M раствора HCl?
Единственные два вещества в растворе — это вода и HCl. Только вода
обеспечит 1 молярный ион водорода E-7.HCl — сильная растворимая кислота,
Таким образом, вся кислота находится в форме ионов, обеспечивая 0,0115 молярных ионов водорода.
Нет необходимости рассматривать ион водорода из воды, так как он намного меньше, чем
пять процентов от общей концентрации ионов водорода.
Концентрация иона водорода адекватно оценивается в 0,0115 М.
Это только pH-бокс
проблема. В качестве окончательного ответа
Мы предлагаем округлять значения pH до одного десятичного знака. Несколько pH-метров
настолько точны.
10.Найдите pH 0,0815 М раствора NaOH.
Единственные два вещества в растворе — это вода и NaOH. Только вода
обеспечит 1 молярный гидроксид-ион E-7. NaOH — сильное и растворимое основание,
так что все основание находится в форме ионов, обеспечивая 0,0815 молярного гидроксид-иона.
Ион гидроксида является наиболее важным в этой проблеме. Ион гидроксида из
диссоциация воды намного меньше пяти процентов гидроксид-иона от
гидроксид натрия, поэтому концентрация
гидроксид-иона равно 0.0815 M. Это только pH-бокс
проблема. Ответ был округлен до одного десятичного знака.
11. Найдите pH раствора 0,00372 M Ba (OH) 2 .
Ba (OH) 2 — сильная база,
то есть до пределов растворимости соединение будет полностью ионизировано.
в водном растворе. [(ОН) — ]
вдвое больше [Ba (OH) 2 ]
потому что на каждый моль Ba (OH) 2
есть два моля гидроксид-иона.Ионизация воды, единственная
другой возможный источник гидроксид-ионов, не дает
пять процентов гидроксид-иона, доступного из
Ba (OH) 2 , и так:
[(OH) — ] = 2
[Ba (OH) 2 ] = 2 (0,00372 M) =
0,00744 M Теперь, когда мы знаем [(OH) — ],
это только проблема шкалы pH.Ответ в
pH, поэтому он округляется до одного десятичного знака.
12. Найдите pH 0,12 M HC 2 H 3 O 2
В этом растворе есть только две составляющие: вода и уксусная кислота, слабая кислота. В
k A уксусной кислоты составляет 1,74 E-5.
Вода и уксусная кислота могут вносить в эту смесь ионы водорода.Если вода
были единственным возможным участником, это дало бы 1 ион водорода E-7 M. Если
уксусная кислота была единственным источником, мы могли рассчитать ее из равновесия
выражение. Поскольку ион водорода из уксусной кислоты будет точно
та же концентрация, что и у ацетат-иона, [H + ]
= [(C 2 H 3 O 2 )
9069И мы можем упростить, заменив [H + ] 2
для [H + ]
[(C 2 H 3 O 2 )
Теперь мы можем заменить наши числа на
к А
и [HC 2 H 3 O 2 ]
чтобы найти, что [H + ] =
квадратный корень из (0,12 x 1,74 E-5). [H + ]
из-за уксусной кислоты — 1.4450 Е-3 м.
[H + ] от
уксусная кислота составляет менее пяти процентов>
[уксусная кислота], поэтому нет необходимости получать более точный ответ, вычитая
[H + ] из
[уксусная кислота]. Найдя [H + ],
мы рассчитываем pH с помощью шкалы pH.PH
составляет 2,840134, округленное до 2,8.
13. Рассчитайте pH 0,0000135 M H 3 BO 3
О нет. У нас сложность. H 2 CO 3
имеет такой маленький k A (5,37
E-10 для первой ионизации) и кислота в таких малых концентрациях
что [H + ] из
кислота будет не намного больше, чем [H + ]
от ионизации воды.Другие возможные источники
[H + ] являются вторыми
и третья ионизация борной кислоты, но обе они имеют
k A , которые далеки от
первая ионизация, поэтому они не должны иметь никакого значения.
Что вы найдете, если предположить, что ионизация воды незначительна,
это глупый ответ. Вы попробуете это. Используйте стандартный квадратный корень из (
k A раз
[H 3 BO 3 ]).Вы получаете pH БОЛЕЕ семи. (pH = 7,1) Нелепо. Борная кислота — это кислота
и должен иметь pH менее семи.
Есть несколько способов сделать это. Один из способов — последовательные приближения.
Сначала используйте формулу константы ионизации, чтобы вычислить
[H + ]
из кислоты, затем используйте это [H + ]
чтобы найти [OH — ].Поскольку [H + ] из
вода равна [OH — ],
вы можете добавить этот номер обратно в [H + ]
от кислоты, чтобы получить результат первого раунда [H + ].
Используйте сумму первого раунда [H + ]
в уравнении диссоциации кислоты, чтобы найти концентрацию ацетат-иона и
это будет равно оценке второго раунда [H + ]
от кислоты.Продолжайте двигаться по этому кругу, пока не получите три стабильных
значащие цифры для общего числа [H + ].
Другой способ — подстановки в известные уравнения. Ваши уравнения
формула для k w ,
формула для [H + ]
слабой кислоты, равенство [H + ]
из воды с [OH — ],
и заявление о том, что общая сумма [H + ]
равно [H + ] из
вода плюс [H + ]
от ионизации кислоты.
Или вы можете заменить на [OH — ]
ион и решить для [H + ].
Бросьте числа и сделайте математику. Это грязно, утомительно и отвратительно
использовать квадратное уравнение, но оно даст вам ответ
[OH — ] = 6,6115 E-8
что приводит к pH 6.8203, округленное до 6,8, вероятный ответ.
14. pH 0,255 M NH 4 OH
К B
NH 4 OH составляет 1,78 E-5.
Выражение ионизационного равновесия для NH 4 OH
или любое другое слабое основание аналогично выражению ионизационного равновесия для слабого
кислоты, но на этот раз уравнение будет решено для концентрации гидроксид-иона.
Гидроксид-ион в избытке. Два источника гидроксид-иона
являются [H + ] и
вода, но вклад воды незначителен.
Другое предположение, что количество диссоциированного иона незначительно, —
также справедливо, потому что концентрация основания очень велика. (Попробуйте, если вы
не верю.)
Теперь подставляем числа и производим математические вычисления.
15.0,578 M H 3 PO 4
В растворе, состоящем только из воды и фосфорной кислоты, есть четыре возможных
источники ионов водорода, вода и три ионизации фосфорной
кислота. У каждой ионизации свой
к А .
| H 3 PO 4 ===> (H 2 PO 4 ) — + H + | первая ионизация | к A = 6.92 E-3 |
| ( — ===> (HPO 4 ) 2 — + H 5 Вторая ионизация | к A = 6,17 E-8 | |
| (HPO 4 ) 2 — ===> (PO 4 ) Н + | третья ионизация | k A = 2.09 E-12 |
Понятно, что первая ионизация фосфорной кислоты на этом
концентрация намного больше, чем у третьего
ионизация фосфорной кислоты, но большой вопрос заключается в том, можем ли мы
нужно учитывать вторую ионизацию фосфорной кислоты или ионизацию воды.
Концентрация ионов водорода от первой ионизации может быть вычислена.
на обычный квадратный корень из ([кислота] k A )
чтобы получить первоначальную оценку.
Исходя из первоначальной оценки, [H + ]
от первой ионизации (0,063243656 М) будет более 5% от
концентрация кислоты (0,578 М). Нам придется использовать более точную форму уравнения, которая включает
снижение концентрации неионизированной кислоты ионизированными формами.
Придется ли нам также учитывать вторую ионизацию? Число, которое мы нашли
в качестве первой оценки для [H + ]
также может служить оценкой [H 2 PO 4 ) — ],
анион при первой ионизации.Но анион первой ионизации
исходная кислота во второй ионизации и оценка
[H + ] также может быть
используется во втором уравнении ионизации. Если мы решим для аниона
второе уравнение ионизации, мы получили бы оценку иона водорода, который
второе уравнение даст.
Это интересный результат. Обратите внимание на [H + ]
от второй ионизации очень близко ко второй k A
когда в растворе нет ничего, кроме воды и фосфорной кислоты.Что бы
бывает при других концентрациях фосфорной кислоты? При других значениях pH при таком же
начальная концентрация фосфорной кислоты?
Оценка концентрации иона водорода от второй ионизации
намного меньше 5% иона водорода от первой ионизации, поэтому вторая
ионизацию не нужно учитывать. Но нам нужно учитывать
снижение концентрации кислоты из-за ионизации первой реакции, поэтому мы
используйте квадратичную форму уравнения, замененного
в квадратное уравнение.
Когда вы подставляете числа, математика выглядит так:
Как вы можете видеть при выполнении математических расчетов, [H + ]
составляет 0,059878231, что более чем на 5% отличается от первоначальной оценки. Теперь мы можем
уверенно измените это [H + ]
к pH по шкале pH.
Если вы действительно сообразительны, то заметили, что исходная оценка с использованием
упрощенный метод расчета [H + ]
производит число 0.063243656, и что pH этого [H + ]
это ТО ЖЕ, что и число из более сложного вычисления при округлении до
одна десятичная точка.
16. Каков pH 0,16 M HCl и 0,072 M фосфорной кислоты?
В этом растворе пять источников ионов водорода. Посчитай их. Воды,
HCl и три ионизации фосфорной кислоты. Скорее всего, вода и
две меньшие из трех ионизаций фосфорной кислоты существенно не
вносят вклад в концентрацию ионов водорода.
Поскольку HCL является сильной кислотой, он вносит 0,16 молярный ион водорода в
раствор, но фосфорная кислота является слабой кислотой и [H + ]
из него нельзя вычислить квадратный корень из (k A
[H 3 PO 4 ])
потому что [H + ] является
не равно [H 2 PO 4 ].Мы должны вернуться к уравнению ионизационного равновесия для первой ионизации.
фосфорной кислоты.
Мы можем найти k A .
[H + ] такой же
как [HCl], и дана концентрация фосфорной кислоты. В
[H 2 PO 4 ]
будет равна концентрации иона водорода, вносимой первым
ионизация фосфорной кислоты.
Значит, pH зависит только от [HCl].
17. Найдите pH 1,25 М уксусной кислоты и 0,75 М ацетата калия.
Уксусная кислота k A
= 1,74 E-5 pK A
= 4,76.
Это настоящая проблема с буфером. В воду добавляют слабую кислоту и
соль, содержащая анион кислоты.
Есть два хороших способа решения проблем с буфером, с помощью Хендерсона-Хассельбаха.
уравнение или с выражением ионизационного равновесия слабой кислоты или основания.Лично у меня есть ментальный барьер против уравнения HH, потому что я никогда не могу
запомните, использует ли он положительный или отрицательный логарифм и какая концентрация
идет сверху. Вы можете использовать его, если хотите. В частности, если вам нужно рассчитать
часто, вы должны выгравировать его на сером веществе. Если тебе это действительно нужно
и не можете вспомнить, вы можете вывести это из ионизационного равновесия
выражение.
Есть три предостережения, которые следует соблюдать при любом уравнении: (1) Сделайте
убедитесь, что вы используете правильную концентрацию для каждой переменной, (2) проверьте
чтобы узнать, будут ли числа, которые вы предлагаете использовать, в пределах правила 5%
для упрощения и (3) оцените ответ на основе того, что вы знаете, и убедитесь, что
ваш окончательный ответ разумен.
Прежде чем приступить к решению задачи, оцените ответ, исходя из собственных рассуждений.
В этом случае ПК A уксусной
кислота — 4,76. Правило состоит в том, что эквимолярный буфер имеет pH, равный
pk A и в этой задаче
ацетата калия меньше, чем уксусной кислоты, поэтому pH должен быть ниже
(более кислотный), чем ПК A
в пределах единицы pH или около того.Если бы уксусная кислота была единственным растворенным веществом, оценка pH
будет квадратным корнем из (концентрация кислоты, умноженная на k A ).
Ответ должен быть где-то между pH от 2,3 до 4,8
Большая часть иона ацетата будет из ацетата калия. Это
правильно, что общая концентрация ацетат-иона будет равна концентрации
ацетата калия? Или концентрация ацетат-иона из
ионизация уксусной кислоты более 5%? Ацетат калия
концентрация равна 0.75 М. Концентрация ацетат-иона из уксусной кислоты будет
быть 0,00466 M, менее 5% от 0,75 M даже без эффекта обычных ионов.
Мы можем смело использовать 0,75 в качестве концентрации иона ацетата.
Будет ли концентрация неионизированной кислоты проблемой? Измеренная концентрация
составляет 1,25 M, а ионизированное количество составляет 0,00466 M, что намного меньше, чем 5% от 1,25 M.
Как уже было сказано, мы можем использовать выражение ионизационного равновесия уксусной кислоты.
кислотой для основного уравнения этой задачи, заменяя
k A , заменяя
концентрация ацетата калия для концентрации ацетата,
подставив концентрацию уксусной кислоты и решив вместо водорода
концентрация ионов, чтобы получить pH.
Ответ pH = 4,5, по нашей оценке, является разумным, потому что он
больше кислоты, чем ПК A 4,76.
Немного проще решить эту задачу с помощью
Уравнение Хендерсона-Хассельбаха, если вы уверены, что знаете его. Вы все еще должны
убедитесь, что вы выполняете замену правильно и что ваши предположения
допущены упрощения (в пределах 5%). Уравнение HH не очень хорошо для
растворы, в которых концентрация кислоты или ионов превышает десять
раз друг друга или в которых концентрация того или иного материала меньше
чем в сто раз больше k A
потому что его нелегко адаптировать к квадратичной форме.
18. 0,788 М молочной кислоты и 1,27 М лактата кальция.
Молочная кислота k A
= 8,32 E-4 pK A
= 3,08.
Вот еще одна буферная пара кислота — конъюгат оснований. На этот раз больше
сопряженного аниона, чем концентрация кислоты, поэтому мы ожидаем, что pH будет несколько
выше (больше щелочи), чем у pK A .Как и в предыдущей задаче, похоже, нет никаких сложностей ни с одним из них.
компонентов со слишком малой концентрацией или
слишком близко к K A ,
поэтому квадратное уравнение не требуется.
Концентрация лактата кальция должна быть удвоена (!), Чтобы представить
концентрация иона лактата, потому что кальций двухвалентный и имеет два
ионы лактата на формулу лактата кальция.Концентрация кислоты больше
чем в 100 раз больше K A ,
поэтому концентрация кислоты достаточно близка к концентрации неионизированных
разновидность.
По уравнению ионизационного равновесия:
Или, используя уравнение HH, вы получите тот же ответ.
19. 0,590 М гидроксид аммония и 1,57 М хлорид аммония.
гидроксид аммония k B
= 1.78 E-5 pK B
= 4,75.
Здесь слабое основание и сопряженный с ним катион. Мы можем использовать ионизацию
равновесное выражение, но оно отличается от выражения кислотной ионизации.
Гидроксид аммония ионизируется на ион гидроксида и ион аммония, поэтому он
лучше всего найти концентрацию гидроксид-иона.
Ионизация
выражение равновесия должно иметь k B , а не
k A , или Хендерсон-
Уравнение Хассельбаха должно иметь все компоненты, адаптированные к щелочам, но оно
полностью аналогичен кислотному расчету.В любом случае
проблема, вам придется изменить ответ на pH с помощью окна pH.
Сможем ли мы использовать наши стандартные ярлыки? Концентрация базы составляет
более чем в 100 раз k A ,
поэтому измеренное количество гидроксида аммония в растворе достаточно хорошее.
число для концентрации неионизированных видов. Концентрация слабых
основание и ион конъюгата будут находиться в пределах 1:10 друг от друга, поэтому количество
сопряженный ион может быть адекватно оценен по концентрации аммония
хлористый.Достаточно высокая концентрация основания, чтобы ионизация
воды существенно не меняет концентрацию гидроксида.
Или, используя уравнение HH, вы получите тот же ответ.
Есть ли в ответе смысл? Комбинация представляет собой базовый буфер, а pH равен
слегка база. Концентрация хлорида аммония почти в три раза выше.
чем гидроксид аммония, поэтому pH смеси более кислый, чем
быть, если буфер был эквимолярным.(pH = 9,25)
20. Объясните, как приготовить 5 л 0,15 М буфера уксусная кислота-ацетат натрия при
pH 5,00, если у вас 1,00 молярная уксусная кислота и кристаллический ацетат натрия.
Вот проблема, которую вам, возможно, придется однажды использовать. В биохимии некоторые
ферменты должны иметь определенный pH, чтобы работать на максимуме. Вы бы выбрали
слабая кислота с пк A закрыть
до необходимого вам pH. (ПК A
уксусной кислоты — 4.76.) Осмолярность (общее молярное количество растворенных
материалы) могут быть указаны. (Он здесь. Сумма уксусной кислоты и натрия
ацетата должно быть 0,15 моль.)
Для этого удобнее всего использовать уравнение Хендерсона — Хассельбаха,
поскольку у него есть термин, который может быть соотношением двух материалов. Форма
Уравнение HH не имеет значения, но концентрация сопряженного иона будет
должно быть больше, чем концентрация кислоты, потому что pH
больше чем pk A из
слабая кислота.
Из уравнения HH мы получаем соотношение двух составляющих. Мы можем
использовать это соотношение как одно из уравнений в уравнении два — два — неизвестных
установка для замены одного в другой и расчета концентрации
уксусная кислота, [HA], и концентрация ацетата натрия,
[A _ ].
Но мы до сих пор не ответили на вопрос: «Объясните, как сделать 5 л
pH 5,0.Буфер 15 М уксусная кислота-ацетат натрия «. У нас 1,00 молярный раствор.
уксусной кислоты и кристаллы (твердого) ацетата натрия. Как мы должны
измерить уксусную кислоту, измерив объем более концентрированной
решение. Способ измерения ацетата натрия — его взвесить. Нам понадобится
(54,7885 x 5 = 273,9425) мл уксусной кислоты и (82,04 x 0,0952115 x 5 =
39,055757) граммов ацетата натрия.
Настоящий ответ заключается в том, что вам нужно взвесить 39,1 г ацетата натрия,
Отмерьте 274 мл 1.00 молярной уксусной кислоты и налейте их в 5-литровый
мерную колбу с водой, достаточной для растворения ацетата натрия. Затем заполните
довести объемную промывку до линии дистиллированной водой и перемешать раствор.
СЛЕДУЮЩИЕ ПРОБЛЕМЫ ТИТРАЦИИ. ПРИНЯТЬ, ЧТО ИНДИКАТОР pH БУДЕТ ПРАВИЛЬНЫМ.
БАЛАНСИРУЙТЕ КОЛИЧЕСТВО КИСЛОТЫ И ОСНОВАНИЯ. НЕКОТОРЫЕ ТИТРАЦИИ НЕ ЯВЛЯЮТСЯ КИСЛОТНЫМИ ОСНОВАМИ
ТИТРАЦИИ. ЕЩЕ РАЗ ПРЕДПОЛАГАЕМ, ЧТО ЕСТЬ ИНДИКАТОР, КОТОРЫЙ УКАЗЫВАЕТ, КОГДА МОЛЯРНЫЕ СУММЫ
СООТВЕТСТВУЕТ.
21. 23,45 мл 0,275 М гидроксида натрия использовали для титрования против 1 мл уксусной кислоты.
Какова была концентрация уксусной кислоты в M?
22.



 Сильная к-та
Сильная к-та