Содержание
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Li→Li2O→LiOH →LiCI→LiNO3
Решение:
1) 4 Li + O2 = 2Li 2O
2) Li2O + H2O = 2LiOH
3) LiOH + HCI = LiCI + H2O
4) LiCI + AgNO3 = LiNO3 + AgCI↓
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Na→Na2O→NaOH →NaCI→NaNO3
Решение:
1) 4 Na + O2 = 2 Na 2O
2) Na2O + H2O = 2 NaOH
3) NaOH + HCI = Na CI + H2O
4) NaCI + AgNO3 = NaNO3 + AgCI↓
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Na→NaOH→NaHCO3→Na2CO3 →Na2SO4→NaCI→Na
Решение:
1) 2Na + 2H2O à 2NaOH + H2
2) NaOH + CO2 (артық мөлш. ) à NaHCO3
) à NaHCO3
3) 2NaHCO3 à Na2CO3 + CO2↑ + H2O
4) Na2CO3+ H2SO4 →Na2SO4+ CO2↑ + H2O
5) Na2SO4+ BaCI2 → 2Na CI + BaSO4↓
6) Na CI электролиз-à Na+ + CI—
— K │ Na+ + 1е → Na0 бөлінеді
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения K→K2O→KOH →KCI→KNO3
Решение:
1) 4K + O2 = 2K2O
2) K2O + H2O = 2KOH
3) KOH + HCI = KCI + H2O
4) KCI + AgNO3 = KNO3 + AgCI↓
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения K→ KOH → K2CO3 → KHCO3
Решение:
1) 2K + 2H2O à 2KOH + 2H2↑
2) KOH + CO2 à K2CO3 + H2O
3) K2CO3 + H2O à KHCO3+ KOH
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Ca → CaH2 →Ca(OH)2 → Ca(HCO3 )2→ CaCО3 → CaCI2 → Ca3(PО4)2
Решение:
1) Ca + H2 à CaH2
2) CaH2 + 2H2O à Ca(OH)2 + 2H2↑ сумен тез әр-ді
3) Ca(OH)2+ 2H2СO3 → Ca(HCO3 )2 + 2H2O
4) Ca(HCO3 )2 →СaСO3↓+ CO2↑ + H2O
5) СaСO3 + 2HCI →СaСI2 + CO2↑ + H2O
6) 3 СaСI2 + 2Н3PО4 à Ca3(PО4)2+ 6HCI
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Ca → CaO → Ca(OH)2 → CaCО3 → Ca(HCO3 )2 → CО2
Решение:
1) 2Ca + O2 à 2CaO
2) CaO + H2O à Ca(OH)2
3) Ca(OH)2 + CО2 → CaCО3↓ + H2O
4) CaCО3+ CO2 + H2O→ Ca(HCO3 )2
5) Ca(HCO3 )2+ Ca(OH)2 →2СaСO3↓ + H2O
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения MgCI2→ Mg→ MgSO4 → Mg3(PО4)2
Решение:
1) MgCI2 à Mg + CI2↑
2) Mg + H2SO4 → MgSO4 + H2↑
3) 3MgSO4 + 2Na3PO4 à Mg3(PО4)2↓ + 3Na2SO4
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения BaO → Ba(OH)2 → BaCI2 → BaSO4
Решение:
1) BaO + H2O à Ba(OH)2
2) Ba(OH)2 + 2HCI → BaCI2 + 2H2O
3) BaCI2+ H2SO4 à BaSO4+ 2HCI
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Al→Al2O3→Al2( SO4)3 → AI(OH)3 → AICI3
↓
NaAIO2
Решение:
1) 4AI + 3O2 à 2AI2O3
2) AI2O3 + 3H2SO4 à AI2(SO4)3 + 3H2O
3) AI2(SO4)3 + 3NaOH à 2AI(OH)3↓ + 3NaSO4
4) AI(OH)3 + 3HCI à AICI3 + 3H2O
5) AI2O3 + 2NaOHà 2NaAIO2 + H2O
AI2O3 + Na2CO3à 2NaAIO2 + CO2↑
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Al→Al2O3→ AICI3 →Al(NO3)3 → AI(OH)3 → Al2O3→Al
Решение:
1) 4AI + 3O2 à 2AI2O3
2) AI2O3+ 6HCI→ 2AICI3+ 3H2O
3) AICI3+ 3 NaOH à AI(OH)3↓ + 3NaCI
4) 2AI(OH)3 à AI2O3+ 3H2O
5) 2AI2O3 → 4AI + 3O2
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Cu → CuO → CuCI2→Cu(OH)2 → СuO → CuSO4
Решение:
1) 2Cu+ O2 = 2CuO
2) CuO + HCI= CuCI2 + H2O
3) CuCI2 + 2NaOH = Cu(OH)2 + 2NaCI
4) Cu(OH)2 à CuO+ H2O
5) CuO + H2SO4 à CuSO4+ H2O
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Cu → х → CuCI2→ у → CuSO4
Решение:
1) 2Cu+ O2 = 2CuO
2) CuO + 2 HCI= CuCI2 + H2O (X)
3) CuCI2 + 2NaOH = Cu(OH)2 + 2NaCI
4) Cu(OH)2 + H2SO4 à CuSO4+ H2O
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Zn → ZnO → ZnSO4 → Zn(OH)2 →Zn(NO3)2 → Zn(PO4)2
Решение:
1) 2 Zn + O2 = 2ZnO
2) ZnO + H2SO4 =ZnSO4 + H2O
3) ZnSO4 + 2KOH = Zn(OH)2+ K2SO4
4) Zn(OH)2 +2HNO3 = Zn(NO3)2 + 2H2O
5) 3Zn(NO3)2 +2H3PO4 = Zn3(PO4)2↓ + 6HNO3
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Cr →CrCI3 → Cr(OH)3 → NaCrO2
↓
Na3[Cr(OH)6]
Решение:
1) 2Cr + 3CI2 à 2CrCI3
2) CrCI3+ 3NaOH = Cr(OH)3↓ + 3NaCI
3) Cr(OH)3+ NaOH = NaCrO2 + 2H2O
4) Cr(OH)3+ 3NaOH à Na3[Cr(OH)6]
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Cr(OH)3 →Cr2 (SO4)3 →K2Cr2O→ K2CrO4
Решение:
1) 2Cr(OH)3 + 3 H2SO4 à Cr2 (SO4)3 + 3H2O
2) Cr2 (SO4)3 + 2KMnO4 + 7H2O à K2Cr2O + 2Mn(OH)4 + 3 H2SO4
3) K2Cr2O + 2KOH à 2 K2CrO4 + H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Zn → K2ZnO2; б) S → H2 SO3; в) Cu → CuS; г) Fe → Fe(OH)2.
Решение.
а) Zn → K2ZnO2
Zn + 2 HCl = ZnCl2 + H2↑
При добавлении избытка щелочи:
ZnCl2 + 4 KOH = K2ZnO2 + 2 KCl + 2 Н2О
б) S → H2 SO3
S + О2 = SО2↑
SО2 + Н2О = H2 SO3
в) Cu → CuS
Cu + О2 + 4 HCl = CuCl2 + Cl2↑ + 2 Н2О
CuCl2 + Na2S = CuS ↓ + 2 NaCl
г) Fe → Fe(OH)2
при добавлении раствора соляной кислоты:
Fe + 2 HCl = FeCl2 + H2↑
FeCl2 + 2 NaOH = Fe(OH)2↓+ 2 NaCl
Задача 6. Как доказать амфотерный характер ZnО, Cr(OH)3. Напишите уравнения реакций.
Решение. К амфотерным относятся такие оксиды и гидроксиды, которые взаимодействуют, как с кислотами, так и со щелочами.
1) ZnО – амфотерный оксид, так как растворяется, как в кислотах, так и в щелочах. При взаимодействии с кислотой он проявляет свойства основного оксида:
ZnО + 2 HCl = ZnCl2 + H2О
При взаимодействии со щелочью ZnО проявляет свойства кислотного оксида:
ZnО + 2 NaOH = Na2 ZnO2 + Н2О
или:
ZnО + 2 NaOH + Н2О = Na2[Zn(OH)4]
2) Cr(OH)3 амфотерный гидроксид, так как растворяется, как в кислотах, так и в щелочах:
Cr(OH)3 + 3 HCl = CrCl3 + 3 Н2О
основание
Cr(OH)3 + 3 NaOH = Na3[Cr (OH)6]
кислота
Задания 32 (C3). Взаимосвязь органических соединений.
Задание №1
942ACC
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
1) Дегидрогалогенирование хлорбутана при действии спиртового раствора щелочи:
2) Окисление двойной связи бутена-1 подкисленным раствором перманганата калия (разрыв двойной связи):
3) Реакция этерификации – образование сложного эфира из спирта и карбоновой кислоты:
4) Щелочной гидролиз изопропилпропионата с образованием пропионата натрия и изопропилового спирта:
5) Сплавление соли пропионовой кислоты с щелочью с образованием этана и карбоната натрия:
Задание №2
372960
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Пояснение:
1) Из ацетата натрия метан получают по реакции декарбоксилирования, которая протекает при его сплавлении со щелочью, например, гидроксидом натрия:
2) При взаимодействии метана с хлором в мольном соотношении один к одному образуются преимущественно монохлорметан (Х1) и хлороводород:
3) При обработке монохлорметана водным раствором щелочи протекает нуклеофильное замещение атома хлора на гидроксильную группу с образованием метилового спирта (Х2):
4) Получить метаналь (формальдегид) из метилового спирта можно, действуя слабым окислителем – оксидом меди (II) при нагревании:
5) Перманганат калия, подкисленный серной кислотой, окисляет метаналь до углекислого газа и воды. При этом, так как среда раствора кислая, перманганат-ион восстанавливается до двухвалентного марганца:
Задание №3
D33737
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.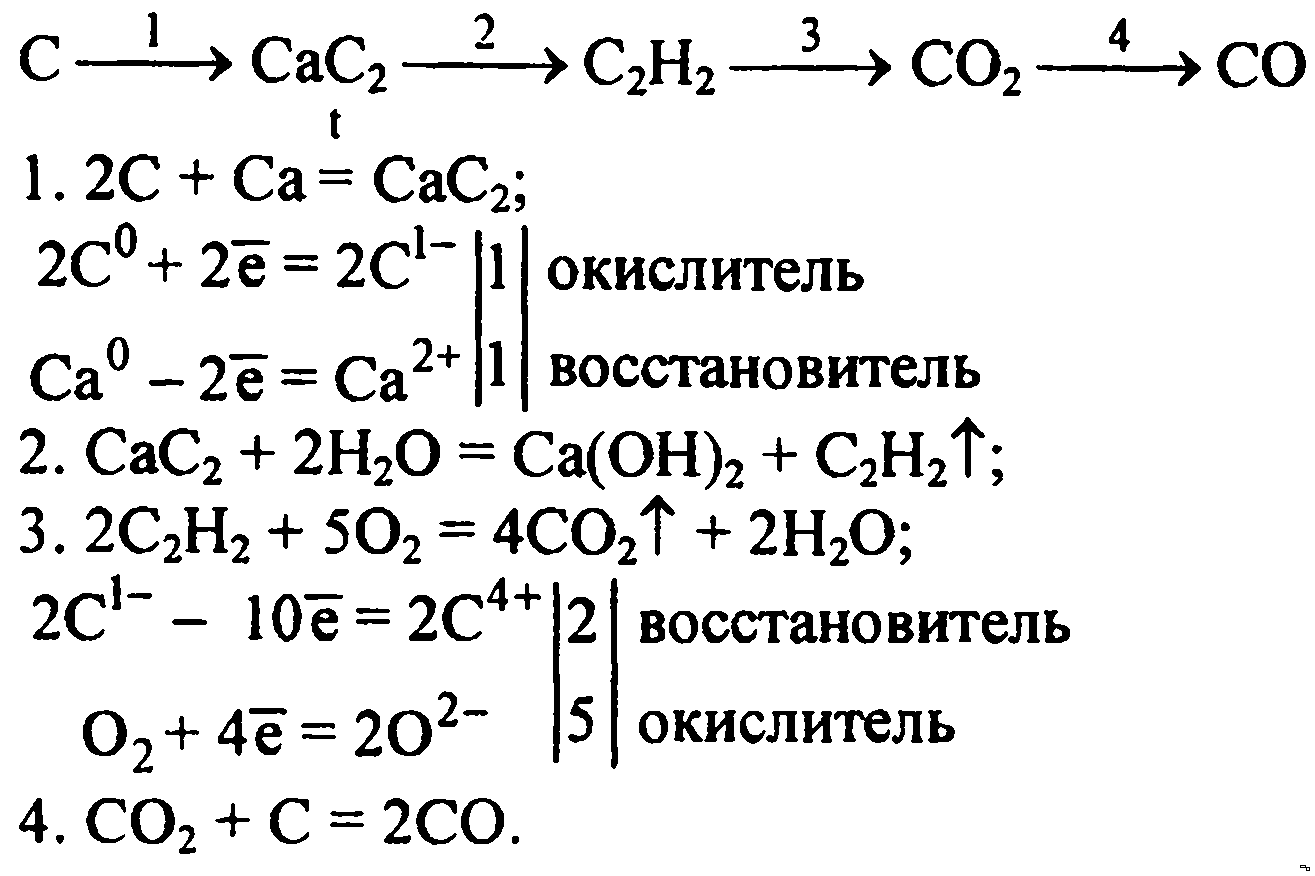
Решение
Пояснение:
1) При действии на пропанол-1 бромоводорода происходит реакция замещения гидроксильной группы в спирте на атом брома с образованием 1-бромпропана (Х1)
2) Получить пропен из 1-бромпропана можно по реакции дегидробромирования со спиртовым раствором щелочи, например, гидроксидом натрия:
3) В кислой среде пропен может вступить в реакцию с водой в соответствии с правилом Марковникова – водород идет к наиболее гидрогенизированному атому, а гидроксильная группа к наименее гидрогенизированному. При этом образуется изопропиловый спирт:
<
4) Изопропиловый спирт (Х2) при окислении перманганатом калия в водном растворе превращается в ацетон, при этом, так как среда раствора нейтральная, перманганат-ион восстанавливается со степени окисления +7 до степени окисления +4 – образуется диоксид марганца:
5) Ацетон можно превратить в изопропанол (X2) по реакции гидрирования при нагревании, с использованием катализатора гидрирования, например, никеля:
Задание №4
E6C6A4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.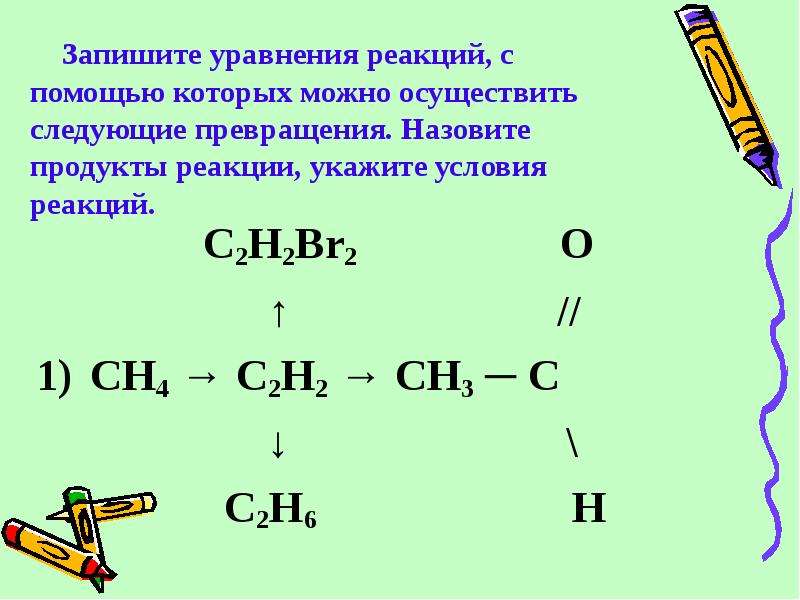
Решение
1) При прокаливании соли карбоновой кислоты с избытком щелочи образуется углеводород, в данном конкретном случае – бензол (Х1):
2) Бензол вступает с реакцию алкилирования с пропеном в присутствии кислотных катализаторов, при этом образуется кумол (Х2):
3) Кумол вступает в реакцию с хлором на свету по цепному радикальному механизму. При недостатке хлора в основном происходит замещение атома водорода при третичном атоме углерода:
4) При действии на хлорпроизводное спиртовым раствором щелочи происходит отщепление хлороводорода:
5) В последней реакции, на первый взгляд, можно подумать, протекает превращение углеводорода с двойной связью в соответствующий диол, но, чтобы образовался гликоль, нужно охлаждение (0-10 оС), а не нагрев. При нагревании будет происходить глубокое окисление до бензоата калия и карбоната калия.
Проблема в том, что по всей видимости, в этом задании банка ФИПИ, которое кстати попалось некоторым на досрочном экзамене ЕГЭ в апреле 2016-го, опечатка, и имелось ввиду 0оС, а не нагрев.
Задание №5
995FCC
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) При действии на бромэтан водного раствора щелочи протекает нуклеофильное замещение атома брома на гидроксид-ион, при этом образуется этиловый спирт (Х1):
2) Этиловый спирт (Х1) можно превратить в уксусную кислоту, окислив его водным раствором перманганата калия в кислой среде при нагревании:
3) Уксусная кислота вступает в реакцию нейтрализации с щелочами, например, с гидроксидом натрия, при этом образуется ацетат натрия (Х2):
4) После выпаривания водного раствора ацетата натрия (Х2) и сплавления полученного твердого ацетата натрия с твердым гидроксидом натрия происходит реакция декарбоксилирования с образованием метана (X3) и карбоната натрия:
5) Пиролиз метана при 1500оC приводит к образованию ацетилена (X4) и водорода:
Задание №6
1C6CBE
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) Пропилацетат, являясь сложным эфиром, подвергается щелочному гидролизу с образованием ацетата калия (X1) и пропанола:
2) Из ацетата калия по реакции декарбоксилирования, которая протекает при его сплавлении с щелочью, получают метан:
3) При температуре 1200oC и быстром охлаждении (для предотвращения разложения ацетилена до простых веществ) метан разлагается на ацетилен (X2) и водород:
4) Димеризация ацетилена происходит в присутствии катализаторов – солянокислого раствора хлоридов меди (I) и аммония – с образованием винилацетилена:
5) При пропускании винилацетилена через бромную воду наблюдается обесцвечивание бромной воды за счет присоединения брома к кратным связям с образованием насыщенного бромпроизводного бутана – 1,1,2,2,3,4-гексабромбутана (X3):
Задание №7
26D1FD
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) В промышленности формальдегид получают окислением метана на катализаторе фосфате алюминия при температуре 450oC и давлении 1-2 МПа:
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа формальдегида восстанавливается до гидроксильной, т.е. альдегид превращается в спирт – метанол (X1):
3) Металлический натрий взаимодействует с метанолом с образованием метилата натрия (X2) и выделением водорода:
4) Реагируя с соляной кислотой, метилат натрия обратно превращается в метанол (X1):
5) Перманганат калия в кислой среде при нагревании окисляет метиловый спирт до углекислого газа (X3) (Mn+7 → Mn+2; C-2 → C+4):
Задание №8
6C53D6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) В присутствии оксида алюминия при температуре 400oC происходит дегидратация спирта с образованием этилена (X1) и воды:
2) Перманганат калия в нейтральной среде окисляет этилен до этиленгликоля (X2) (Mn+7 → Mn+4; 2C-2 → 2C-1):
3) При действии избытка бромоводорода на этиленгликоль происходит замещение гидроксильных групп на анионы брома, в результате чего образуется 1,2-дибромэтан (X3):
4) Этин (или ацетилен) можно получить действием на 1,2-дибромэтан спиртовым раствором щелочи:
5) По реакции М. Г. Кучерова в присутствии солей ртути в кислой среде (в водном или спиртовом растворе) ацетилен превращается в этаналь:
Г. Кучерова в присутствии солей ртути в кислой среде (в водном или спиртовом растворе) ацетилен превращается в этаналь:
Задание №9
5B7666
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Получить ацетон (пропанон) можно по реакции М.Г. Кучерова, действуя на пропин (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе):
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа кетона восстанавливается до гидроксильной, т.е. кетон превращается во вторичный спирт – изопропанол (X2):
3) При действии бромоводорода на изопропанол происходит нуклеофильное замещение гидроксильной группы на анион брома, в результате чего образуется 2-бромпропан:
4) При действии спиртового раствора щелочи 2-бромпропан превращается в ненасыщенный углеводород – пропилен (X3):
5) Дегидрированием пропилена на катализаторе (Pt, Pd, Ni) можно получить пропин (X1):
Задание №10
EE403A
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Получить бромметан можно действием брома на метан (X1) на свету. Реакция замещения протекает по свободнорадикальному механизму:
Реакция замещения протекает по свободнорадикальному механизму:
2) При взаимодействии бромметана с аммиаком вначале образуется соль амина, которая при избытке аммиака превращается в свободный амин. В случае метиламина образуются метиламин (X2) и бромид аммония:
3) Азотистая кислота неустойчива, поэтому ее получают в ходе реакции, действуя на подкисленный раствор амина нитритом натрия. В случае первичного амина – метиламина — наблюдается выделение азота, а в растворе образуется метанол (X3):
4) Действием на метиловый спирт оксидом меди (II) при нагревании получим формальдегид, при этом Cu+2 восстановится до Cu0:
5) При окислении формальдегида перманганатом калия в кислой среде выделяется углекислый газ (X4) (Mn+7 → Mn+2; C0 → C+4):
Задание №11
11E9DF
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Алканы с основной цепью 6 и более атомов углерода способны вступать в реакцию дегидроциклизации, при этом образующийся шестичленный цикл далее дегидрируется и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода. В данном случае образующийся циклогексан дегидрируется в бензол (X1):
В данном случае образующийся циклогексан дегидрируется в бензол (X1):
2) Алкилирование ароматических углеводородов алкилгалогенидам
3) При действии на толуол избытком хлора на свету все атомы водорода в метильном радикале толуола замещаются на хлор. Реакция замещения протекает по свободнорадикальному механизму:
4) При щелочном гидролизе тригалогенидов с атомами хлора при одном атоме углерода с высокими выходами образуются соли карбоновых кислот (в данном случае бензоат калия (X3)):
5) Из бензоата калия по реакции декарбоксилирования, которая протекает при его сплавлении с щелочью, получают бензол (X1):
Задание №12
AC20AD
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) 1,2-дихлорэтан является геминальным дихлорпроизводным этана. В условиях водного раствора щелочи 1,2-дихлорэтан превращается в карбонильное соединение – ацетальдегид:
В условиях водного раствора щелочи 1,2-дихлорэтан превращается в карбонильное соединение – ацетальдегид:
2) При восстановлении карбонильных соединений водородом образуются спирты. Так, пропуская смесь паров ацетальдегида и водорода над никелевым катализатором, можно получить этанол (X1):
3) Замещение гидроксильной группы спирта на аминогруппу происходит в жестких условиях. Пропуская пары этанола и аммиак над нагретым оксидом алюминия, получают этиламин:
4) При пропускании через водный раствор этиламина углекислого газа происходит образованием гидрокарбоната этиламмония (X2):
5) При нагревании гидрокарбонат этиламмония разлагается на углекислый газ, этиламин (X3) и воду:
Примечание: правильным может считаться вариант, в котором веществом Х2 является не гидрокарбонат, а карбонат этиламмония.
Задание №13
7EAE60
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Ацетилен (этин) вступает в реакцию гидратации в присутствии солей ртути в водном растворе с образованием ацетальдегида (реакция Кучерова) (Х1):
2) Ацетальдегид при действии на него подкисленного водного раствора перманганата калия превращается в уксусную кислоту:
3) Уксусная кислота вступает в реакцию нейтрализации с гидроксидом натрия, при этом образуется ацетат натрия (Х2) и вода:
4) Ацетат натрия взаимодействует с галогеналканами с образованием сложных эфиров, в данном случае образуется метиловый эфир уксусной кислоты (метилацетат)(Х3):
5) Сложные эфиры в присутствии кислот могут вступать в реакцию гидролиза. При гидролизе метилацетата в кислой среде образуется уксусная кислота и метанол:
При гидролизе метилацетата в кислой среде образуется уксусная кислота и метанол:
Задание №14
7E4C51
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии спиртового раствора щелочи на любой из изомеров дибромэтана образуется ацетилен (X1):
или
2) Действуя на ацетилен (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетальдегид (X2) (реакция М.Г.Кучерова):
3) При окислении ацетальдегида перманганатом калия в кислой среде образуется уксусная кислота (Mn+7 → Mn+2; C+1 → C+3):
4) Получить хлоруксусную кислоту можно действием хлора на уксусную кислоту на свету. Реакция замещения протекает по свободнорадикальному механизму, в результате чего атом водорода при алкильном радикале замещается на хлор (X3):
5) При обработке хлоруксусной кислоты аммиаком образуется аминокислота – глицин:
Задание №15
39882С
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При температуре выше 140 0C в присутствии концентрированной серной кислоты спирты подвергаются внутримолекулярной дегидратации с образованием алкена и воды. В данном случае при 180 0C и действии конц. H2SO4 пропанол-1 превращается в пропилен (X1):
В данном случае при 180 0C и действии конц. H2SO4 пропанол-1 превращается в пропилен (X1):
2) При пропускании пропилена через бромную воду наблюдается обесцвечивание бромной воды за счет присоединения брома к двойной связи с образованием 1,2-дибромпропана (X2):
3) При действии спиртового раствора щелочи на 1,2-дибромпропан образуется пропин:
4) Действуя на пропин водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетон (X3) (реакция М.Г.Кучерова):
5) Пропуская смесь паров ацетона и водорода над палладиевым катализатором, получают пропанол-2 (или изопропанол) (X4):
Задание №16
A8F8C2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Циклопропан присоединяет бромоводород с раскрытием цикла, в результате чего образуется 1-бромпропан:
2) В лабораторных условиях алканы получают по реакции Вюрца из галогеналканов. Частичный положительный заряд на атоме углерода при галогене в галогенопроизводных делает возможной реакцию этих соединений с активными металлами. Моногалогеналканы уже при комнатной температуре взаимодействуют с натрием, превращаясь в алканы с удвоенным углеродным скелетом. Таким образом, из двух молекул 1-бромпропана получается н-гексан (X1):
Частичный положительный заряд на атоме углерода при галогене в галогенопроизводных делает возможной реакцию этих соединений с активными металлами. Моногалогеналканы уже при комнатной температуре взаимодействуют с натрием, превращаясь в алканы с удвоенным углеродным скелетом. Таким образом, из двух молекул 1-бромпропана получается н-гексан (X1):
3) Алканы, имеющие в молекуле шесть и более атомов углерода, могут вступать в более сложные реакции дегидрирования, в ходе которых отщепление водорода сопровождается замыканием цепи в цикл: реакции дегидрирования – циклизации. В данном случае гексан превращается в бензол (X2):
4) Толуол получают алкилированием бензола метилгалогенидом в присутствии катализатора AlCl3 (электрофильное замещение, механизм SE):
5) Метильная группа толуола окисляется перманганатом калия в кислой среде до карбоксильной группы, следовательно, толуол превращается в бензойную кислоту (X3) (Mn+7 → Mn+2; C-3 → C+3):
Задание №17
92C355
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) В лабораторных условиях пропан можно получить по реакции Вюрца из галогеналканов – хлорэтана и хлорметана, однако данная реакция сопряжена с образованием двух побочных продуктов – бутана и этана. Моногалогеналканы при комнатной температуре способны взаимодействовать с натрием:
Моногалогеналканы при комнатной температуре способны взаимодействовать с натрием:
2) Дегидрированием пропана на катализаторе (Pt, Pd, Ni) можно получить пропилен (X1):
3) При окислении алкена перманганатом в нейтральной среде на холоду образуется двухатомный спирт, щелочь и оксид марганца (IV). В данном случае из пропилена образуется пропандиол-1,2 (X2) (Mn+7 → Mn+4; C-2 → C-1, C-1 → C0):
4) Многоатомные спирты способны вступать в реакции нуклеофильного замещения с галогеноводородами. Действуя избытком бромоводорода на пропандиол-1,2 получается 1,2-дибромпропан (X3):
5) При действии спиртового раствора щелочи на дигалогеналкан – 1,2-дибромпропан – образуется пропин (X4):
Задание 33
Задание 33.1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
1) При указанных условиях (H2SO4, 180 ᴼC) происходит внутримолекулярная дегидратация пропанола-1
с образованием пропилена (вещество Х1):
2) Взаимодействие пропилена с HCl приводит к образованию 2-хлорпропана (вещество Х2) (реакция гидрогалогенирования):
3) При взаимодействии 2-хлорпропана с водным раствором NaOH происходит замещение –Cl на гидроксильную группу,
образуется изопропанол (вещество Х3):
4) Изопропанол под действием H2SO4 при нагревании (180 ᴼC) подвергается внутримолекулярной дегидратации
с образованием пропилена (вещество Х1):
5) При воздействии водного раствора KMnO4 пропилен вступает в реакцию гидроксилирования
с образованием пропиленгликоля (вещество Х4):
Задание 33. 2
2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Щелочной гидролиз 1,1-дибромпропана приведет к образованию альдегида — пропаналя:
2) При взаимодействии с подкисленным раствором дихромата калия пропаналь окисляется в пропановую кислоту:
3) В результате реакции пропановой кислоты с хлором в присуствии красного фосфора образуется 2-хлорпропановая кислота:
4) 2-Хлорпропановая кислота взаимодействует с гидрокарбонатом натрия с образованием соответствующей натриевой соли:
5) Взаимодействие натриевой соли 2-хлорпропановой кислоты с иодэтаном приводит к образованию соответствующего сложного эфира —
этилового эфира 2-хлорпропановой кислоты:
Задание 33.3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Метилциклогексан в присутствии платины при нагревании вступит в реакцию дегидрирования с образованием толуола:
2) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия:
3) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола:
4) Нитробензол получают нитрованием бензола смесью концентрированных азотной и серной кислот:
5) Нитробензол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до анилина.
Последний далее может взаимодействовать с HCl с образованием соответствующей соли — хлорида фениламмония:
Суммарное уравнение реакции:
Задание 33.4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) н-Бутан в присутствии катализатора AlCl3 изомеризуется в изобутан:
2) Взаимодействие изобутана с бромом на свету приведет к образованию 2-бром-2-метилпропана:
3) 2-Бром-2-метилпропан под действием спиртового раствора гидроксида калия дегидрогалогенируется с образованием изобутена (изобутилена):
4) Реакция изобутена с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода
с образованием ацетона и углекислого газа:
5) Гидрирование ацетона на никеле приведет к образованию изопропилового спирта (изопропанола):
Задание 33.5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) В результате взаимодействия бензола с хлорметаном в присутствии катализатора AlCl3 протекает реакция алкилирования с образованием толуола:
2) Бромирование толуола в присутствии катализатора FeBr3 приводит к образованию 4-бромтолуола (п-бромтолуола) и
2-бромтолуола (о-бромтолуола):
3) Реакция 4-бромтолуола (п-бромтолуола) с бромметаном и металлическим натрием приводит к образованию п-ксилола (реакция Вюрца-Фиттига):
4) Окисление п-ксилола по действием подкисленного серной кислотой раствора перманганата калия приведет к образованию терефталевой кислоты:
5) Терефталевая кислота с этиловым спиртом в присутствии катализатора H2SO4 вступит в реакцию этерификации
с образованием сложного эфира — диэтилового эфира терефталевой кислоты (диэтилтерефталата):
Задание 33. 6
6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Термическое разложение метана (температура около 1000о С) приводит к образованию ацетилена:
2) Ацетилен присоединяет воду в присутствии катионов двухвалентной ртути с образованием ацетальдегида (реакция Кучерова):
3) Образовавшийся этаналь (ацетальдегид) взаимодействует с аммиачным раствором оксида серебра (I) (реакция серебряного зеркала),
в результате окисления альдегида образуется ацетат аммония:
4) Последующее взаимодействие с гидроксидом кальция переводит ацетат аммония в ацетат кальция:
5) Разложение ацетата кальция при нагревании приведет к образованию ацетона:
Задание 33.7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Каталитическое гидрирование дивинила (бутадиена-1,3) приводит к образованию бутена-2:
2) Реакция бутена-2 с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода
с образованием уксусной кислоты:
3) Хлорирование уксусной кислоты в присутствии красного фосфора приведет к образованию хлоруксусной кислоты:
4) Хлоруксусная кислота взаимодействует с избытком аммиака с образованием аминоуксусной кислоты (глицина):
Cl-CH2-C(O)OH + 2NH3 → H2N-CH2-C(O)OH + NH4Cl
5) Последующее взаимодействие аминоуксусной кислоты с гидроксидом магния переводит аминокислоту в соответствующую магниевую соль:
2H2N-CH2-C(O)OH + Mg(OH)2 → [H2N-CH2-C(O)O]2Mg + 2H2O
Задание 33. 8
8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Тримеризация этина (ацетилена) при нагревании в присутствии активированного угля приводит к образованию бензола:
2) В результате алкилирования бензола хлорметаном в присутствии хлорида алюминия (III) образуется толуол:
3) Хлорирование толуола на свету приведет к образованию бензилхлорида:
4) Бензилхлорид реагирует с водным раствором гидроксида натрия с образованием бензилового спирта:
5) Подкисленный серной кислотой раствор дихромата калия окисляет бензиловый спирт в бензойную кислоту:
Задание 33.9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.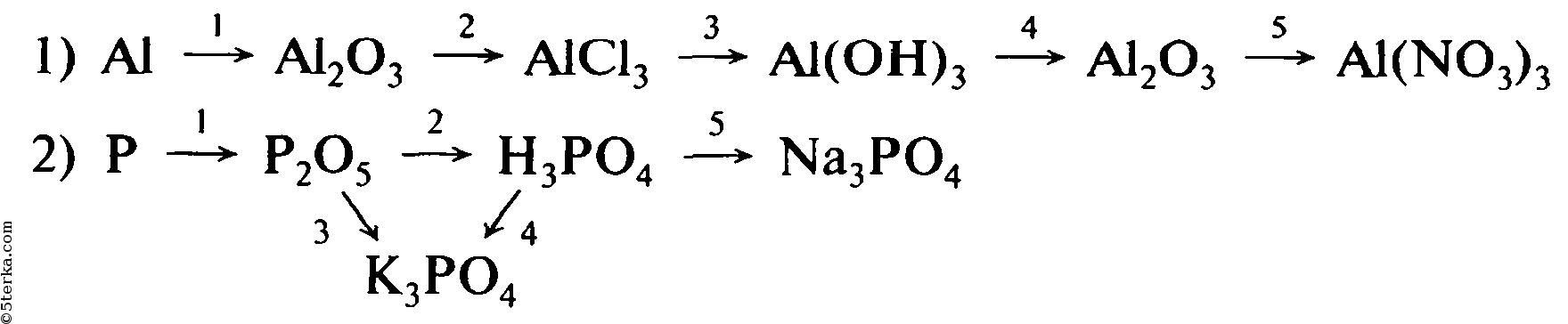
Источник — Открытый банк заданий ЕГЭ
Решение
1) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия:
2) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола:
3) В результате алкилирования бензола пропиленом в присутствии хлорида алюминия (III) и хлороводорода образуется изопропилбензол (кумол):
4) Изопропилбензол хлорируется на свету с получением 2-хлор-2-фенилпропана:
5) 2-Хлор-2-фенилпропан реагирует с водным раствором гидроксида натрия с образованием 2-фенилпропанола-2:
Задание 33.10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Бензол гидрируется избытком водорода в присутствии платины до циклогексана:
2) Циклогексан бромируется на свету с образованием бромциклогексана:
3) Бромциклогексан под действием спиртового раствора гидроксида калия дегидробромируется с образованием циклогексена:
4) Циклогексен присоединяет воду с образованием циклогексанола:
5) Циклогексанол окиcляется под действием подкисленного серной кислотой раствора дихромата калия в циклогексанон:
Задание 33. 11
11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Метилпропионат вступает в реакцию гидролиза с образованием пропионовой кислоты и метанола:
2) Метанол взаимодействует с хлороводородом с образованием хлорметана:
3) Хлорметан алкилирует бензол с образованием толуола:
4) В результате нитрования толуола смесью концентрированных азотной и серной кислот получают 4-нитротолуол (п-нитротолуол):
5) 4-Нитротолуол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до 4-метиланилина (п-толуидин).
Последний далее взаимодействует с HCl с образованием соответствующей соли:
Суммарное уравнение реакции:
Запись химических уравнений | Введение в химию
Цель обучения
- Укажите символы, используемые для обозначения состояний вещества в химическом уравнении.
Ключевые моменты
- В химическом уравнении реагенты написаны слева, а продукты — справа.
- Коэффициенты рядом с символами сущностей указывают количество молей вещества, производимого или используемого в химической реакции.
- Реагенты и продукты разделены стрелкой, обычно читаемой вслух как «выходы».
- Химические уравнения должны содержать информацию о свойствах состояния продуктов и реагентов, будь то водные (растворенные в воде — водн.), Твердые (е), жидкие (ж) или газовые (г).
Условия
- продукт Соединения, полученные в результате химической реакции.
- Реагент Исходные вещества в химической реакции.
- химическое уравнениеСимволическое представление химической реакции; реагенты представлены слева, а продукты — справа.
Химическое уравнение — это символическое представление химической реакции. Реагенты (исходные вещества) написаны слева, а продукты (вещества, обнаруженные в химической реакции) написаны справа. Коэффициенты рядом с символами сущностей указывают количество молей вещества, произведенного или использованного в химической реакции.
Коэффициенты рядом с символами сущностей указывают количество молей вещества, произведенного или использованного в химической реакции.
Обозначение для химического уравнения
Химическое уравнение состоит из химических формул реагентов (слева) и продуктов (справа).Они разделены символом стрелки («→» обычно читается вслух как «урожайность»). Химическая формула каждого отдельного вещества отделена от других знаком плюс. Состояние вещества каждого соединения или молекулы указывается в нижнем индексе рядом с соединением в виде аббревиатуры в круглых скобках. Например, соединение в газообразном состоянии будет обозначаться (g), твердым (ыми), жидким (l) и водным (водным). Водное средство растворяется в воде; это обычное состояние вещества для кислот, оснований и растворенных ионных соединений.
В качестве примера формулу сжигания метана можно записать так:
[латекс] CH_ {4 \ 🙁 g)} + 2 \: O_ {2 \ 🙁 g)} \ rightarrow CO_ {2 \ 🙁 g)} + 2 \: H_ {2} O _ {(g) } [/ латекс]
Это уравнение будет читаться как «CH четыре плюс два O два дает два CO и два H2O». Для уравнений, включающих сложные химические вещества, прочитайте химические формулы, используя номенклатуру ИЮПАК, а не букву и ее нижний индекс. Используя номенклатуру ИЮПАК, это уравнение будет читаться как «метан плюс кислород дает диоксид углерода и воду.”
Для уравнений, включающих сложные химические вещества, прочитайте химические формулы, используя номенклатуру ИЮПАК, а не букву и ее нижний индекс. Используя номенклатуру ИЮПАК, это уравнение будет читаться как «метан плюс кислород дает диоксид углерода и воду.”
Это уравнение показывает, что кислород и CH 4 реагируют с образованием H 2 O и CO 2 . Это также указывает на то, что для каждой молекулы метана требуются две молекулы кислорода, и что реакция будет формировать две молекулы воды и одну молекулу углекислого газа для каждого метана и двух молекул кислорода, которые вступают в реакцию. Уравнение также указывает на то, что все соединения находятся в газообразном состоянии. Стехиометрические коэффициенты (числа перед химическими формулами) являются результатом закона сохранения массы и закона сохранения заряда (см. Раздел «Уравновешивание химических уравнений» для получения дополнительной информации).Также обратите внимание, что, как и в математическом свойстве коммутативности сложения, химические уравнения коммутативны. Реагенты и продукты можно указывать в любом порядке, при условии, что они находятся на соответствующей стороне стрелки реакции.
Общие символы
Символы используются для различения различных типов реакций. Иногда для обозначения реакции используются разные стрелки. Например:
[латекс] \ rightarrow [/ latex] указывает, где предпочтительна прямая реакция: другими словами, производится больше продукта.
[латекс] \ leftarrow [/ latex] указывает, где предпочтительна обратная реакция: другими словами, образуется больше реагента.
[латекс] \ leftrightharpoons [/ latex] или [латекс] \ leftrightarrow [/ latex] используется для обозначения системы в равновесии.
Если реакция требует энергии, это часто указывается над стрелкой. Заглавная греческая буква дельта (Δ) написана над стрелкой реакции, чтобы показать, что к реакции добавляется энергия в виде тепла; hv записывается, если энергия добавляется в виде света.
Когда вулкан пищевой соды получают путем смешивания уксуса (разбавленной водной уксусной кислоты) и пищевой соды (бикарбоната натрия), в результате происходит выделение газа посредством следующей реакции:
[латекс] HCH_3CO_ {2 (водный)} + NaHCO_ {3 (s)} \ rightarrow CH_3CO_2Na _ {(водный)} + H_2O _ {(l)} + CO_ {2 (g)} [/ латекс]
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Уравнения реакций — Chemistry LibreTexts
Ключевые слова
- Энергия, экзотермическая реакция, эндотермическая реакция
- Физические реакции, химические реакции, фазовые переходы
- Реагенты, продукты
- Стехиометрия реакции
Навыки для развития
- Чтобы отличить химические изменения от физических изменений.
- Написать химические уравнения для описания химической реакции.
- Для уравновешивания химических уравнений.
- Для расчета необходимых количеств реагентов или количеств, образующихся в химической реакции.
Изменения в материале или системе называются реакциями , и они делятся на химические и физические реакции. Энергия — движущая сила всех изменений, как физических, так и химических реакций. В этих реакциях всегда участвует энергия.Если система более устойчива за счет потери некоторой энергии, происходит реакция с высвобождением энергии. Такая реакция называется экзотермической . Подача энергии в систему также вызывает реакцию. Реакции поглощения энергии называются эндотермическими реакциями . Иногда количество энергии, участвующей в реакции, может быть настолько малым, что изменение энергии не сразу заметно.
Уравнение может использоваться для описания физической реакции , которая включает изменение состояний.Например, плавление , сублимация, испарение и конденсация могут быть представлены следующим образом. В этих уравнениях (s) обозначает твердое тело, (l) — жидкость (l) и (g) — газ.
- плавление: \ (\ mathrm {H_2O (s) \ rightarrow H_2O (l)} \)
- сублимация: \ (\ mathrm {H_2O (s) \ rightarrow H_2O (g)} \)
- испарение: \ (\ mathrm {C_2H_5OH (l) \ rightarrow C_2H_5OH (g)} \)
- конденсация: \ (\ mathrm {NH_3 (g) \ rightarrow NH_3 (l)} \)
При этих изменениях химические связи не разрываются и не образуются, а молекулярная идентичность веществ не изменилась.
Является ли фазовый переход между графитом и алмазом химической или физической реакцией?
\ (\ mathrm {C (графит) \ rightarrow C (алмаз)} \).
Кристаллическая структура алмаза и графита очень различается, и связь между атомами углерода также различается в двух твердых состояниях. Поскольку химические связи разрываются и образуются новые связи, фазовый переход алмаза и графита является химической реакцией.
Химические вещества или вещества изменяются, превращаясь в одно или несколько других веществ, и эти изменения называются химическими реакциями .На молекулярном уровне атомы или группы атомов перестраиваются, что приводит к разрыву и образованию некоторых химических связей в химической реакции. Вещества, претерпевающие изменения, называются реагентами , а вновь образованные вещества называются продуктами . Внешний вид продуктов часто отличается от реагентов. Химические реакции часто сопровождаются появлением газа, огня, осадка, цвета, света, звука или запаха. Эти явления связаны с энергией и свойствами реагентов и продуктов.Например, при окислении пропана выделяется тепло и свет, а быстрая реакция — взрыв,
\ (\ mathrm {C_3H_8 + 5 O_2 \ rightarrow 3 CO_2 + 4 H_2O} \)
Сбалансированное уравнение также показывает макроскопическую количественную зависимость. Это сбалансированное уравнение реакции показывает, что пять моль кислорода реагируют с одним моль пропана, образуя три моля диоксида углерода и четыре моля воды, всего 7 моль продуктов реакции сгорания.
На молекулярном уровне это уравнение показывает, что для каждой молекулы пропана требуется 5 молекул кислорода.Три атома углерода превращаются в три молекулы диоксида углерода, тогда как 8 атомов водорода в пропане окисляются до 4 молекул воды. Количество атомов \ (\ ce {H} \), \ (\ ce {C} \) и \ (\ ce {O} \) одинаково в обеих частях уравнения.
Мы изучаем свойства веществ, чтобы знать, как их использовать. Склонность вещества реагировать сама по себе или с другими важными химическими свойствами. Под свойствами мы понимаем химические реакции, которые лучше всего изучать путем экспериментов и наблюдений.Проведя множество экспериментов, вы можете обобщить определенные правила и факты. Знание этих правил и фактов позволяет вам решать проблемы, с которыми вы еще не сталкивались.
Самым важным аспектом химической реакции является знание реагентов и продуктов. Для этого лучше всего описать реакцию написать уравнение реакции. Уравнение химической реакции дает реагенты и продукты, а сбалансированное уравнение химической реакции показывает мольные отношения реагентов и продуктов.Часто указывается количество энергии, участвующей в реакции. Количественный аспект химических реакций называется стехиометрией реакции .
Например, при нагревании раскладушек \ (\ ce {CaCO3} \) выделяется газ \ (\ ce {CO2} \), оставляя белый порошок (твердое вещество \ (\ ce {CaO} \) ) за. Уравнение реакции записывается как:
\ [\ mathrm {CaCO_3 \ rightarrow CaO + CO_2} \]
Уравнение показывает, что один моль \ (\ ce {CaCO3} \) дает по одному моль каждого из \ (\ ce {CaO} \) и \ (\ ce {CO2} \).Количества веществ, представленные химическими формулами, были введены на двух предыдущих страницах, и эти концепции должны помочь выяснить стехиометрию реакций, когда дано уравнение реакции.
Пример 1
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \ (\ ce {CaO} \), сколько оксида кальция должно быть получено? Если получено только 5,0 грамма \ (\ ce {CaO} \), каков фактический выход?
СОВЕТ
В идеальных условиях количество вещества в уравнении реакции указано ниже:
\ (\ begin {alignat} {2}
\ ce {& CaCO_3 \ rightarrow && CaO + && CO_2} \\
& \: 100.0 && \: \: 56 && \: 44 \: \: \: \ mathrm {г / моль \: (формула \: веса)}
\ end {alignat} \)
\ [\ mathrm {10.0 \: g \: CaCO_3 \ times \ dfrac {1 \: mol \: CaCO_3} {100 \: g \: CaCO_3} \ times \ dfrac {1 \: mol \: CaO} {1 \: mol \: CaCO_3} \ times \ dfrac {56 \: g \: CaO} {1 \: mol \: CaO} = 5.6 \: g \: CaO} \]
ОБСУЖДЕНИЕ
Здесь приводится неэффективное преобразование, но метод показывает детали рассмотрения. Если полученное количество \ (\ ce {CaO} \) не составляет 5,6 г, можно сделать вывод, что образец не может быть чистым.
Пример 2
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \ (\ ce {CaO} \), сколько \ (\ ce {CO2} \) выделяется при стандартных условиях?
СОВЕТ
\ [\ mathrm {CaCO_3 \ rightarrow CaO + CO_2} \]
\ [\ mathrm {10.0 \: g \: CaCO_3 \ times \ dfrac {1 \: mol \: CO_2} {100 \: g \: CaCO_3} \ times \ dfrac {22.4 \: L \: CO_2} {1 \: моль \: CO_2} = 2,24 \: L \: CO_2} \]
ОБСУЖДЕНИЕ
Мы сделали более короткий путь в этой рецептуре по сравнению с примером 1.Примеры 1 и 2 иллюстрируют оценку количеств в граммах и л.
Написание уравнений для химических реакций
Уравнения химических реакций действительно отражают изменения материалов. Для многих реакций мы можем написать уравнения только для общих реакций. Например, здравый смысл подсказывает нам, что когда сахар полностью окисляется, конечными продуктами являются углекислый газ и вода. Реакция окисления такая же, как реакция горения. Таким образом, мы пишем
\ [\ ce {C12h32O11 + 12 O2 \ rightarrow 12 CO2 + 11 h3O} \]
Это иллюстрирует методы, используемые для написания уравнений сбалансированной реакции:
- Определите реагенты и продукты : В этом случае продуктами являются \ (\ ce {CO2} \) и \ (\ ce {h3O} \), определенные здравым смыслом.Мы знаем это.
- Применяйте фундаментальный принцип сохранения атомов. Число атомов каждого сорта должно быть одинаковым до и после реакции.
- Уравновесить один тип атомов в момент времени : Для начала мы можем использовать \ (\ ce {H} \) или \ (\ ce {C} \). Поскольку слева находится 12 атомов \ (\ ce {C} \), коэффициент для \ (\ ce {CO2} \) равен 12. Точно так же 22 \ (\ ce {H} \) атома производят 11 \ (\ ce {h3O} \) молекул.
- Сбалансируйте атомы кислорода с обеих сторон: Всего 35 атомов \ (\ ce {O} \) с правой стороны, а коэффициент для \ (\ ce {O2} \) должен быть 11.
Пример 3
Соединение \ (\ ce {N2O5} \) неустойчиво при комнатной температуре. Он разлагается с образованием коричневого газа \ (\ ce {NO2} \) и кислорода. Напишите сбалансированное уравнение химической реакции его разложения.
СОВЕТ
Первый шаг — написать несбалансированное уравнение, указывающее только реагент и продукты:
\ [\ ce {N2O5 \ rightarrow NO2 + O2} \]
Молекула \ (\ ce {N2O5} \) распадается на две молекулы \ (\ ce {NO2} \) и половину \ (\ ce {O2} \).
\ [\ ce {N2O5 \ rightarrow 2 NO2 + \ dfrac {1} {2} O2} \]
Чтобы дать уравнению целое число стехиометрических коэффициентов , мы умножаем все стехиометрические коэффициенты на 2.
\ [\ ce {2 N2O5 \ rightarrow 4 NO2 + O2} \]
ОБСУЖДЕНИЕ
Этот пример иллюстрирует шаги, используемые для написания сбалансированного уравнения химической реакции. Это сбалансированное уравнение не говорит нам, как распадается молекула \ (\ ce {N2O5} \), оно только иллюстрирует общую реакцию.
Пример 4
При смешивании растворов \ (\ ce {CaCl2} \) и \ (\ ce {AgNO3} \) образуется белый осадок. Такой же осадок наблюдается при смешивании раствора \ (\ ce {NaCl} \) с раствором \ (\ ce {AgCh4CO2} \). Напишите сбалансированное уравнение реакции между \ (\ ce {CaCl2} \) и \ (\ ce {AgNO3} \).
СОВЕТ
Общие ионы между \ (\ ce {NaCl} \) и \ (\ ce {CaCl2} \) являются ионами \ (\ ce {Cl -} \), а ионы \ (\ ce {Ag +} \) являются общими между двумя серебросодержащими соединениями.2 +} \) и \ (\ ce {NO3 -} \) — ионов-наблюдателей.
Химические реакции
Одной из важнейших тем в химии является химическая реакция . На этой странице мы сосредоточимся только на стехиометрии, выраженной уравнениями реакции. Другие темы, связанные с химическими реакциями:
- Избыточные и ограничивающие реагенты или реагенты, оставшиеся или использованные
- Особенности химических реакций или классификация реакций
- Химическая кинетика или скорость реакции
- Механизм реакции или как на самом деле протекает реакция
Балансировка окислительно-восстановительных реакций
Уравновешивание уравнений реакции окисления и восстановления немного сложнее, чем то, что мы обсуждали здесь.Вы должны уметь определять степени окисления, объяснять окисление и восстановление с точки зрения изменения степени окисления и писать уравнения половинных реакций. Тогда вы сможете сбалансировать окислительно-восстановительные реакции. Все это описано в следующем модуле по химическим реакциям.
Проблемы развития навыков
- Какие продукты содержат углерод, когда метан, \ (\ ce {Ch5} \) , сжигается на воздухе?
Подсказка: \ (\ ce {CO2} \)
Обобщение:
Сжигание \ (\ ce {C} \) — содержащих соединений превращает все \ (\ ce {C} \) в \ (\ ce {CO2} \).
- Воспользуйтесь методом здравого смысла, чтобы найти молекулярную формулу сероводорода, молекулярная масса которого составляет 34,1. (Атомный вес, \ (\ ce {H} \) , 1,008; \ (\ ce {S} \) , 32,066)
Подсказка: \ (\ ce {h3S} \)
Обобщение:
Сера и кислород являются элементами группы 6, и они образуют \ (\ ce {h3O} \) и \ (\ ce {h3S} \).
- Когда 30,0 г \ (\ ce {Al} \) (атомная масса 27,0) нагревается в кислороде (атомная масса 16.0) образуется оксид алюминия \ (\ ce {Al2O3} \) . Сколько оксида должно быть получено?
Подсказка: 56,7 г
A Вариант:
Сколько (в г) кислорода требуется?
- При нагревании \ (\ ce {KClO3} \) он разлагается с образованием твердого вещества \ (\ ce {KCl} \) и газообразного кислорода. Если собрать 0,500 моль \ (\ ce {O2} \) , сколько граммов \ (\ ce {KCl} \) должно получиться? (Атомный вес: \ (\ ce {K} \) , 39.098; \ (\ ce {Cl} \) , 35.453)
Подсказка: 24,9 г
Предложенный метод:
Для реакции: \ (\ ce {2 KClO3 \ rightarrow 2 KCl + 3 O2} \)
, предлагаемая рецептура:
\ (\ mathrm {0.50 \: mol \: O_2 \ times \ dfrac {2 \: mol \: KCl} {3 \: mol \: O_2} \ times \ dfrac {74.6 \: g \: KCl} {1 \: моль \: KCl} = \: ??.? \: g \: KCl} \)
- Раствор, содержащий чистый \ (\ ce {BaCl2} \) , обрабатывают избыточным количеством \ (\ ce {h3SO4} \) , а осадок \ (\ ce {BaSO4} \) собирается и сушится.Если собрать 13,2 г \ (\ ce {BaSO4} \) , сколько молей ионов \ (\ ce {Cl -} \) останется в растворе?
Атомный вес: \ (\ ce {H} \) , 1,008; \ (\ ce {O} \) , 16,00; \ (\ ce {S} \) , 32,06; \ (\ ce {Cl} \) , 35,45; \ (\ ce {Ba} \) , 137,33.
Подсказка: 0,113 моль
Варианты:
Сколько (в г) \ (\ ce {BaCl2} \) присутствует в растворе?
Сколько нитрата серебра требуется для осаждения всех хлорид-ионов?
Реакция: \ (\ mathrm {BaCl_2 + H_2SO_4 \ rightarrow BaSO_4 + 2 H ^ + + 2 Cl ^ -} \).-} {1 \: mol \: BaSO_4} = 0,113 \: mol} \)
- Электростанция сжигает уголь, и этот процесс эквивалентен сжиганию 999 кг серы в день. Сколько кг \ (\ ce {SO2} \) выбрасывается в день, если на электростанции нет устройств контроля загрязнения для извлечения серы? Атомный вес: \ (\ ce {C} \) , 12,00; \ (\ ce {O} \) , 16,00; \ (\ ce {S} \) , 32.06.
Подсказка: 1998 кг
Дальнейшее рассмотрение:
Молекулярная масса \ (\ ce {SO2} \) примерно в два раза больше атомной массы \ (\ ce {S} \).Таким образом, вес \ (\ ce {SO2} \) вдвое больше веса \ (\ ce {S} \).
Варианты: Сколько (в молях и литрах) \ (\ ce {SO2} \) вырабатывается в день?
Если весь \ (\ ce {SO2} \) преобразовать в \ (\ ce {h3SO4} \), сколько (в моль и кг) серной кислоты образуется? (3055 кг)
- Сколько молей воды образуется, когда один моль пропана \ (\ ce {C3H8} \) сгорает в избыточном количестве воздуха?
Намек: 4 моля; \ (\ ce {C3H8 + 5 O2 \ rightarrow 3 CO2 + 4 h3O} \)
Skill:
Составьте уравнение реакции.
Варианты:
Сколько граммов воды будет произведено?
Сколько молей \ (\ ce {CO2} \) будет произведено?
- Смесь, содержащая \ (\ ce {Na2SO4} \) , но не содержащий других сульфатов, анализируют путем осаждения с помощью \ (\ ce {BaCl2} \) . Образец смеси 2,37 г дает 2,57 г осадка \ (\ ce {BaSO4} \) . Какое процентное содержание \ (\ ce {Na2SO4} \) в смеси?
Подсказка: 66.0%
Навык:
Задача иллюстрирует стратегию химического анализа.
- Предположим, что 2,33 г смеси \ (\ ce {CaCl2} \) и \ (\ ce {Ca (NO3) 2} \) дает 2,22 г \ (\ ce {AgCl} \) когда \ (\ ce {Ag (NO3)} \) используется в качестве реагента для осаждения ионов хлорида \ (\ ce {Cl -} \) . Какое процентное содержание \ (\ ce {CaCl2} \) в смеси?
Подсказка: 36.9%
Атомный вес: \ (\ ce {N} \) , 14,0; \ (\ ce {O} \) , 16,0; \ (\ ce {Cl} \) , 35.5; \ (\ ce {Ca} \) , 40,1; \ (\ ce {Ag} \) , 107,9.
Навык:
Эта проблема также иллюстрирует стратегию химического анализа.
Авторы и авторство
Как написать химическое уравнение?
Как написать химическое уравнение?
Все химические реакции представлены химическими уравнениями . Химическое уравнение — это сокращенное представление химической реакции с использованием символов и формул вещества, участвующего в химической реакции.
Символы и формулы веществ (элементов или соединений) расположены так, чтобы показать реагенты и продукты химической реакции.
Химическая реакция происходит, когда исходные вещества реагируют с образованием новых веществ.
(a) Исходные вещества называются реагентами .
(b) Новые образовавшиеся вещества называются продуктами .
В уравнении реагенты записываются в левой части, а продукты записываются в правой части.
Например:
Люди тоже спрашивают
Построение химических уравнений
1.Согласно закону сохранения массы, материя не может быть ни создана, ни разрушена. Это означает, что количество атомов до и после химической реакции одинаково. Следовательно, химическое уравнение должно быть сбалансировано.
2. В таблице ниже показано, как можно построить химическое уравнение.
Таблица: Построение химического уравнения.
| Реакция: Железные опилки реагируют с хлоридом меди (II) с образованием раствора хлорида железа (III) и меди. | |
| Шаг | Пояснение и пример |
| Укажите реагенты, продукты и их формулы. | Реагенты: хлорид железа, Fe и меди (II), CuCl 2 Продукты: хлорид железа (III), FeCl 3 и медь, Cu |
| Напишите основную часть уравнения. | Fe + CuCl 2 ⟶ FeCl 3 + Cu Реагенты Продукты |
| Определите количество атомов каждого элемента по обе стороны уравнения. | Левая сторона Правая сторона Атом Fe: 1 атом Fe: 1 Атом Cu: 1 атом Cu: 1 Атом Cl: 2 атома Cl: 3 Число атомов не сбалансировано. |
| Выровняйте уравнение, настроив коэффициенты. (Примечание: коэффициенты — это числа перед формулами.) | Атомы Cl уравновешены. Fe + 3CuCl 2 ⟶ 2FeCl 3 + Cu В результате количество атомов Fe и Cu не сбалансировано. Затем атомы Fe уравновешиваются. 2Fe + 3CuCI 2 ⟶ 2FeCI 3 + Cu Наконец, атомы Cu уравновешены. 2Fe + 3CuCI 2 ⟶ 2FeCI 3 + 3Cu |
| Убедитесь, что уравнение сбалансировано. | Левая сторона Правая сторона Атом Fe: 2 атома Fe: 2 Атом Cu: 3 атома Cu: 3 Атом Cl: 6 Атом Cl: 6 Теперь уравнение сбалансировано. |
| Поместите государственный символ каждого вещества. | 2Fe (s) + 3CuCl 2 (водн.) ⟶ 2FeCl 3 (водн.) + 3Cu (s) |
3. Символы состояния, (l) и (g) представляют твердое, жидкое и газообразное состояния соответственно.Символ (водный) представляет водный раствор.
4. Иногда символ «↑» используется для обозначения выпуска газа.
5. Иногда над стрелкой пишут «», чтобы показать, что нагревание необходимо для начала химической реакции.
Правила написания химического уравнения:
При написании химического уравнения необходимо соблюдать определенные правила.
- Реагенты, участвующие в реакции, записаны в виде их символов или молекулярных формул в левой части уравнения.
- Знак плюс (+) добавлен между формулами реагентов.
- Продукты реакции записаны в виде их символов или молекулярных формул в правой части уравнения.
- Знак плюс (+) добавлен между формулами продуктов.
- Между реагентами и продуктами вставлена стрелка (⟶), показывающая, в каком направлении происходит реакция.
A + B ⟶ C + D
В этом химическом уравнении A и B — реагенты, а C и D — продукты.Стрелка указывает, что реакция идет в сторону образования C и D.
Как сбалансировать химические уравнения?
Первый шаг в уравновешивании уравнения — подсчитать количество атомов каждого элемента по обе стороны уравнения. Например, реагенты X и Y 2 реагируют с образованием соединения XY. Словесное уравнение для этой реакции будет
X + Y 2 ⟶ XY
Число атомов элементов X и Y в вышеупомянутом уравнении показано ниже.
| Элемент | Число атомов в LHS | Число атомов в RHS |
| х | 1 | 1 |
| Y | 2 | 1 |
Чтобы сбалансировать Y с обеих сторон, умножьте RHS на 2, т.е.
X + Y 2 ⟶ 2XY
Теперь уравновешивается количество атомов Y, но не количество атомов X. Следовательно, умножьте X на левой стороне на 2. Таким образом, уравнение принимает вид
2X + Y 2 ⟶ 2XY
Это сбалансированное уравнение, поскольку количество атомов X и Y с обеих сторон равно.
Имея в виду эти шаги, давайте теперь запишем химическое уравнение для образования оксида магния.
Шаг 1: Магний сгорает в кислороде с образованием оксида магния. Здесь реагентами являются магний и кислород. Продукт — оксид магния.
Шаг 2: Таким образом, словесное уравнение:
Магний + Кислород ⟶ Оксид магния
Шаг 3: Заменяя названия символами и формулами, мы получаем химическое уравнение как
Mg + O 2 ⟶ MgO
Шаг 4: Число атомов элементов
| Элемент | Число атомов в LHS | Число атомов в RHS |
| Магний | 1 | 1 |
| Кислород | 2 | 1 |
Чтобы уравновесить кислород с обеих сторон, умножьте RHS на 2, т.е.е.,
Mg + O 2 ⟶ 2MgO
Теперь количество атомов кислорода уравновешено, а количество атомов магния — нет. Следовательно, умножьте магний на LHS на 2. Таким образом, уравнение принимает вид
2Mg + O 2 ⟶ 2MgO
Это вычисленное химическое уравнение.
Построение сбалансированных химических уравнений
Цель: Построить сбалансированные химические уравнения.
Материалы: Порошок карбоната меди (II), известковая вода, концентрированная соляная кислота, концентрированный раствор аммиака
, раствор нитрата свинца (II) и раствор йодида калия.
Аппарат: Пробирки, пробки, резиновая пробка с подающей трубкой, держатель пробирок, горелка Бунзена и стеклянная пробирка.
Процедура:
A. Нагревание карбоната меди (II)
- Половину шпателя порошка карбоната меди (II) помещают в пробирку.
- Устройство настроено, как показано на рисунке.
Рисунок: Нагревание карбоната меди (II) - Карбонат меди (II) нагревают, а полученный газ пропускают через известковую воду.
- Наблюдаются изменения карбоната меди (II) и известковой воды.
- Когда реакция завершается, подающую трубку вынимают из известковой воды и снимают горелку Бунзена.
B. Образование хлорида аммония
- Используя стеклянную пробирку, в пробирку капают три или четыре капли концентрированной соляной кислоты. Пробирку закрывают пробкой и оставляют на несколько минут.
- Шаг 1 повторяется с использованием чистой стеклянной пробирки с использованием концентрированного раствора аммиака.
- Обе пробки удаляются, и горловины пробирок соединяются, как показано на рисунке.
- Все наблюдения записываются.
C. Осаждение иодида свинца (II)
- 2 см 3 раствора йодида калия добавляют к 2 см 3 раствора нитрата свинца (II), как показано на рисунке.
- Смесь встряхивают и наблюдают за любыми изменениями.
Наблюдения:
| Раздел | Наблюдение | Вывод |
| А | Карбонат меди (II) меняет цвет с зеленого на черный. Известковая вода становится молочной. | Карбонат меди (II) разлагается на оксид меди (II) черного цвета. Выделяется углекислый газ. |
| B | Густые белые пары выделяются на входе в пробирки. | Белый дым — твердый хлорид аммония. |
| С | Образуется желтый осадок. | Желтый осадок — иодид свинца (II). |
Обсуждение:
- При нагревании карбонат меди (II) разлагается на оксид меди (II) и диоксид углерода.Присутствие углекислого газа определяется известковой водой.
- Следовательно, вычисленное уравнение нагрева карбоната меди (II):
- Концентрированную соляную кислоту и концентрированный раствор аммиака оставляют на несколько минут для получения газообразного хлористого водорода и газообразного аммиака соответственно.
- Когда газообразный хлористый водород и газообразный аммиак объединяются, они реагируют с образованием мелких белых твердых частиц хлорида аммония. Они выглядят как густые белые пары.
- Вычисленное уравнение образования хлорида аммония:
- При добавлении бесцветного раствора нитрата свинца (II) к бесцветному раствору иодида калия образуется желтый осадок иодида свинца (II). Одновременно производится также бесцветный раствор нитрата калия.
- Вычисленное уравнение осаждения иодида свинца (II):
Качественные и количественные аспекты химических уравнений
- Химические уравнения дают нам следующую качественную информацию.
(а) Реагенты и продукты химической реакции.
(b) Физические состояния реагентов и продуктов. - В качестве примера возьмем следующее уравнение.
2C (s) + O 2 (г) ⟶ 2CO (г)
Из уравнения мы знаем, что реагентами являются твердый углерод и газообразный кислород. Продуктом реакции является газообразный оксид углерода. - Количественно , коэффициенты в сбалансированном уравнении говорят нам точные пропорции реагентов и продуктов в химической реакции.
В качестве примера возьмем следующее уравнение.Из уравнения мы знаем, что 2 моля нитрата меди (II) разлагаются на 2 моля оксида меди (II), 4 моля газообразного диоксида азота и 1 моль газообразного кислорода.
- На микроскопическом уровне коэффициенты химической реакции говорят нам о количестве частиц 1, участвующих в реакции.
- Химическое уравнение играет важную роль; коммуникативный инструмент для химиков.
(a) Химическое уравнение точно описывает химическую реакцию.
(b) Химики используют химические уравнения для решения количественных задач.
Примечание:
- В качественном отношении газообразный водород реагирует с газообразным кислородом с образованием воды.
- Качественно 2 молекулы (или 2 моля) газообразного водорода реагируют с 1 молекулой (или 1 моль) газообразного кислорода с образованием 2 молекул (или 2 моль) воды.
химических реакций
химических реакций
Химическая промышленность
Реакция
Поскольку атомы не создаются и не разрушаются в химическом
реакции, общая масса продуктов в реакции должна быть
такая же, как и общая масса реагентов.
Химические уравнения
Химические реакции описываются химическими уравнениями.
Пример: реакция между водородом и кислородом с образованием
вода представлена следующим уравнением.
2 ч 2 + O 2
2 H 2 O
Часто бывает полезно указать, реагенты или
продукты являются твердыми телами, жидкостями или газами, записав s , l ,
или г в скобках после символа реагентов или
продукты, как показано в следующих уравнениях.
2 H 2 ( г ) + O 2 ( г )
2 H 2 O ( г )
2 Al ( s ) + Fe 2 O 3 ( s )
Al 2 O 3 ( с ) + 2 Fe ( л )
Потому что так много реакций происходит, когда решения двух
растворенные в воде вещества смешиваются, специальный символ aq ,
используется для описания этих водных растворов .
Процесс растворения образца в воде будет
обозначается следующими уравнениями.
| H 2 O | ||
| C 12 H 22 O 11 ( s ) | C 12 H 22 O 11 ( водн. ) |
Химическое уравнение — это утверждение того, что может произойти ,
не обязательно что произойдет .Следующее уравнение,
например, не гарантирует, что водород будет реагировать с
кислород с образованием воды.
2 H 2 ( г ) + O 2 ( г )
2 H 2 O ( г )
Можно наполнить баллон смесью водорода.
и кислород, и вы обнаружите, что никакой реакции не происходит, пока вы не коснетесь
воздушный шар с пламенем.Сбалансированное уравнение этой реакции
описывает соотношение между количествами водорода и
потребляется кислорода и образуется вода, если или когда эта реакция
инициирован.
Уравнения атомного
и макроскопическая шкала
Химические уравнения могут использоваться для представления того, что происходит на
либо в атомном, либо в макроскопическом масштабе.
2 H 2 ( г ) + O 2 ( г )
2 H 2 O ( г )
Это уравнение можно прочитать одним из следующих способов.
- Если или когда водород вступает в реакцию с кислородом, две молекулы
водорода и одна молекула кислорода расходуются на
каждые две молекулы воды. - Если или когда водород вступает в реакцию с кислородом, два моля
водород и один моль кислорода расходуются на каждый
произведено два моля воды.
Химические уравнения должны быть сбалансированы — они должны иметь то же самое
количество атомов каждого элемента в обеих частях уравнения.В виде
в результате масса реагентов должна быть равна массе
продукты реакции. В атомном масштабе следующие
уравнение сбалансировано, поскольку общая масса реагентов равна
равняется массе изделий.
| 2 H 2 ( г ) | + | O 2 ( г ) | 2 H 2 O ( г ) | |
| 2 x 2 а.е.м. | + | 32 а.е.м. | 2 x 18 а.е.м. | |
| 36 а.е.м. | 36 а.е.м. | |||
В макроскопическом масштабе он уравновешен, потому что масса
два моля водорода и один моль кислорода равны массе
двух молей воды.
| 2 H 2 ( г ) | + | O 2 ( г ) | 2 H 2 O ( г ) | |
| 2 x 2 г | + | 32 г | 2 x 18 г | |
| 36 г | 36 г | |||
Химическая балансировка
Уравнения
Не существует последовательности правил, которым можно было бы слепо следовать, чтобы
получить сбалансированное химическое уравнение.Управляйте коэффициентами
написано перед формулами реагентов и продуктов
пока количество атомов каждого элемента по обе стороны от
уравнения такие же.
Обычно неплохо взяться за самую легкую часть
проблема первая.
Пример: рассмотрим, что происходит, когда пропан (C 3 H 8 )
горит на воздухе с образованием CO 2 и H 2 О. Первый
то, что нужно искать, когда балансирующие уравнения являются отношениями
между двумя сторонами уравнения.
_____ C 3 H 8 + _____ O 2
_____ CO 2 + _____ H 2 O
Легче сбалансировать атомы углерода и водорода в
уравнения, чем атомы кислорода в этой реакции, потому что все
атомы углерода в пропане попадают в CO 2 и все
атомы водорода попадают в H 2 O, но некоторые из
атомы кислорода попадают в каждое соединение. Это означает, что нет
способ предсказать количество молекул O 2 , которые
расходуется в этой реакции, пока вы не узнаете, сколько CO 2
и H 2 O образуются молекулы.
Для начала отметим, что в
каждая молекула C 3 H 8 . Таким образом, три CO 2
молекулы образуются для каждого C 3 H 8
молекула израсходована.
1 C 3 H 8 + _____ O 2
3 CO 2 + _____ H 2 O
Если в каждом восемь атомов водорода C 3 H 8
молекулы должно быть восемь атомов водорода, или четыре H 2 O
молекулы в правой части уравнения.
1 C 3 H 8 + _____ O 2
3 CO 2 + 4 H 2 O
Теперь, когда атомы углерода и водорода уравновешены, мы можем
попробуйте уравновесить атомы кислорода. В нем шесть атомов кислорода.
три молекулы CO 2 и четыре атома кислорода в четырех H 2 O
молекулы. Чтобы сбалансировать 10 атомов кислорода в продуктах этого
реакции нам понадобится пять молекул O 2 среди
реагенты.
1 C 3 H 8 + 5 O 2
3 CO 2 + 4 H 2 O
Теперь есть три атома углерода, восемь
атомы водорода и 10 атомов кислорода с каждой стороны уравнения.
Таким образом, сбалансированное уравнение этой реакции записывается как
следует.
C 3 H 8 ( г ) + 5 O 2 ( г )
3 CO 2 ( г ) + 4 H 2 O ( г )
Мольные отношения
Сбалансированное химическое уравнение позволяет предсказать, что произойдет.
когда происходит реакция.Мольное отношение
преобразует моль одного соединения в сбалансированное химическое уравнение
в моли другого соединения.
Пример: фейерверк, освещающий небо каждую четверть
Июль основан на реакции магния и кислорода на
образуют оксид магния.
2 мг ( с ) + O 2 ( г )
2 MgO ( с )
Вычисленное уравнение реакции можно использовать для
построить два единичных коэффициентов , которые описывают
соотношение между количеством потребляемого магния и кислорода
в этой реакции.
Сосредоточив внимание на элементах этой проблемы, мы можем выбрать
правильное мольное соотношение для преобразования молей магния в
эквивалентное количество молей кислорода. Предположим, например, что
мы хотим рассчитать количество молей кислорода, необходимое для сжигания
0,40 моль металлического магния.
| 0.40 моль Mg | х | 1 моль O 2 | = | 0,20 моль O 2 |
| 2 моль Mg |
Прогноз массы
Потребляемые реагенты или продукты, выделяемые в химической реакции
Сбалансированные химические уравнения могут использоваться для прогнозирования
соотношение между количествами израсходованных реагентов и
количества продуктов, образующихся в химической реакции.
Пример: чтобы спрогнозировать количество кислорода, которое необходимо вдохнуть.
чтобы переварить 10,0 грамм сахара, мы можем предположить, что сахар в нашем
диета приходит к нам как C 12 H 22 O 11
молекулы и что наши тела сжигают этот сахар в соответствии с
следующее уравнение.
C 12 H 22 O 11 ( s )
+ 12 O 2 ( г )
12 CO 2 ( г ) + 11 H 2 O ( л )
Возможно, лучший способ начать — это спросить: «Что мы
пытаетесь найти? «, а затем резюмируйте важные части
информация в проблеме.
Цель : Узнать, сколько граммов O 2
расходуется при сжигании 10,0 граммов сахара.
Факт : Начнем с 10 граммов сахара.
Факт : Сахар имеет формулу C 12 H 22 O 11 .
Факт : Рассчитанное уравнение этой реакции может быть
написано следующим образом.
C 12 H 22 O 11 + 12
О 2
12 CO 2 + 11 H 2 O
Поскольку мы знаем молекулярную массу сахара, мы можем преобразовать
известную массу сахара на количество молей сахара.
Теперь у нас есть сбалансированное химическое уравнение, и мы знаем
количество молей сахара в образце . Как шаг к
цель задачи мы можем вычислить количество молей
кислорода израсходовано в реакции. Уравнение для этого
реакция предполагает, что 12 моль O 2 расходуются на
каждый моль сахара в этой реакции. Таким образом, мы можем вычислить
количество молей кислорода, необходимое для сжигания 0.02921 моль
сахар следующим образом.
Теперь у нас есть необходимая информация для достижения цели
наш расчет. Нам известно количество O 2 , израсходованное в
эта реакция выражается в молях, и мы можем вычислить массу
0,3505 моль O 2 от молекулярной массы
кислород.
Согласно этому расчету требуется
11,2 грамма O 2 для сжигания 10.0 грамм сахара.
Ограничивающие реагенты
Требуется 1,70 г аммиака и 4,00 г кислорода, чтобы
получают 3,00 грамма оксида азота по следующей реакции.
4 NH 3 ( г ) + 5 O 2 ( г )
4 НО ( г ) + 6 H 2 O ( г )
Что произойдет с количеством NO, произведенного в этом
реакция, если оставить количество O 2 прежним (4.00 г)
но увеличивает количество присутствующего NH 3
первоначально? Выход реакции останется прежним. Нет
сколько бы NH 3 мы ни добавили в систему, не более НЕТ
образуется, потому что в реакции заканчивается O 2 перед
расходуется весь NH 3 . Когда это происходит,
реакция должна прекратиться. Независимо от того, сколько NH 3 добавлено в
система, мы не можем получить более 3,00 граммов NO с 4,00
граммы кислорода.
Когда O 2 не хватает для использования всего NH 3
в реакции количество O 2 ограничивает количество
НЕТ, что может быть произведено. Таким образом, кислород ограничивает
реагент в этой реакции. Потому что там еще NH 3
чем нам нужно, это избыток реагента .
Концепция ограничивающего реагента важна, потому что химики
часто запускаются реакции, в которых только ограниченное количество одного из
реагенты присутствует.
Ключом к ограничению проблем с реагентами является следующая последовательность
шагов.
|
|
|
|
|
|
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов.Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горение
Полено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу.
© chrispecoraro / iStock.com
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии.Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару. Аммиак — пример основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции.Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы. Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстановителя к окислителю.Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и, по сути, самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение, производство вина и сыра — вот многие примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий.Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, которые происходят во всех живых системах.
Следует отличать химические реакции от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода.Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
тающий лед
Тающий лед, водопад Нижнее Чистилище, на притоке реки Соухеган между Мон Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-Гэмпшира
Исторический обзор
Концепция химической реакции возникла около 250 лет назад.Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы. Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Первые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли.Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, который подтвердил важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом.Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием в области химических реакций было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который в начале XIX века постулировал свою атомную теорию. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ.Такой взгляд на химические реакции точно определяет текущую тему. Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций.Сегодня экспериментальная химия дает бесчисленное количество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
При создании нового вещества из других веществ химики говорят, что они либо проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и этот процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS).Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Состояние вещества реагентов и продуктов обозначается символами (s) для твердых веществ, (l) для жидкостей и (g) для газов.
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Сорт 8Б
8 класс (A и B вместе)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного обозначения)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
4.1 Написание и балансирование химических уравнений — Химия 2e
Задачи обучения
К концу этого раздела вы сможете:
- Получите химические уравнения из повествовательных описаний химических реакций.
- Записывайте и уравновешивайте химические уравнения в молекулярном, общем ионном и чистом ионном форматах.
В более ранней главе этого текста было введено использование символов элементов для представления отдельных атомов. Когда атомы приобретают или теряют электроны, чтобы образовать ионы, или объединяются с другими атомами для образования молекул, их символы изменяются или объединяются для создания химических формул, которые надлежащим образом представляют эти частицы.Расширение этой символики для представления как идентичностей, так и относительных количеств веществ, подвергающихся химическим (или физическим) изменениям, включает в себя написание и уравновешивание химического уравнения. Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двумя молекулами двухатомного кислорода (O 2 ) с образованием одной молекулы диоксида углерода (CO 2 ) и двух молекул воды (H 2 O). . Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка 4.2, с молекулярными моделями, заполняющими пространство, показанными в нижней половине рисунка.
Рис. 4.2. Реакция между метаном и кислородом с образованием диоксида углерода и воды (показана внизу) может быть представлена химическим уравнением с использованием формул (вверху).
Этот пример иллюстрирует фундаментальные аспекты любого химического уравнения:
- Вещества, вступающие в реакцию, называются реагентами, и их формулы помещаются в левую часть уравнения.
- Вещества, образующиеся в результате реакции, называются продуктами, а их формулы помещаются в правую часть уравнения.
- Знаки плюс (+) разделяют формулы отдельных реагентов и продуктов, а стрелка (⟶) (⟶) разделяет реагент и продукт (левую и правую) части уравнения.
- Относительные количества реагентов и продуктов представлены коэффициентами (числа, помещенные непосредственно слева от каждой формулы). Коэффициент 1 обычно не указывается.
Обычно в химическом уравнении используются минимально возможные целочисленные коэффициенты, как это сделано в этом примере.Однако следует понимать, что эти коэффициенты представляют собой относительных чисел реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения. Метан и кислород реагируют с образованием диоксида углерода и воды в соотношении 1: 2: 1: 2. Это соотношение выполняется, если количество этих молекул равно 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и так далее (рисунок 4.3). Аналогичным образом, эти коэффициенты можно интерпретировать относительно любой единицы количества (числа), и поэтому это уравнение можно правильно прочитать многими способами, включая:
- Одна молекула метана и две молекулы кислорода вступают в реакцию с образованием одной молекулы диоксида углерода и двух молекул воды .
- Одна дюжина молекул метана и две дюжины молекул кислорода вступают в реакцию с образованием одной дюжины молекул углекислого газа и двух дюжин молекул воды.
- Один моль молекул метана и 2 моля молекул кислорода реагируют с образованием 1 моль молекул диоксида углерода и 2 моля молекул воды.
Рис. 4.3. Независимо от абсолютного числа задействованных молекул, отношения между количеством молекул каждого вида, которые вступают в реакцию (реагенты), и молекулами каждого вида, которые образуются (продукты), одинаковы и задаются уравнением химической реакции.
Балансировочные уравнения
Химическое уравнение, описанное в разделе 4.1, сбалансировано, что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено на сторонах реагента и продукта. Это требование, которому уравнение должно удовлетворять, чтобы соответствовать закону сохранения материи. Это можно подтвердить, просто суммируя количество атомов по обе стороны от стрелки и сравнивая эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на нижний индекс элемента в формуле.Если элемент присутствует более чем в одной формуле на данной стороне уравнения, количество атомов, представленных в каждой, необходимо вычислить, а затем сложить. Например, оба продукта реакции, CO 2 и H 2 O, содержат элемент кислород, поэтому количество атомов кислорода на стороне продукта уравнения составляет
.
(1 молекула CO2 × 2 атома O молекула CO 2) + (2 молекулы h3O × 1 атом O молекула h3O) = 4 атома O (молекула 1CO2 × 2 атома O молекула CO2) + (2 молекулы h3O × 1 атом O молекула h3O) = 4 атома O
Уравнение реакции между метаном и кислород для получения диоксида углерода и воды, как подтверждено, сбалансированы в соответствии с этим подходом, как показано здесь:
Ch5 + 2O2⟶CO2 + 2h3OCh5 + 2O2⟶CO2 + 2h3O
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| С | 1 × × 1 = 1 | 1 × × 1 = 1 | 1 = 1, да |
| H | 4 × × 1 = 4 | 2 × × 2 = 4 | 4 = 4, да |
| O | 2 × × 2 = 4 | (1 × × 2) + (2 × × 1) = 4 | 4 = 4, да |
Сбалансированное химическое уравнение часто можно получить из качественного описания некоторой химической реакции с помощью довольно простого подхода, известного как балансирование путем осмотра.Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированным химическим уравнением :
h3O⟶h3 + O2 (несимметричный) h3O⟶h3 + O2 (несимметричный)
Сравнение количества атомов H и O по обе стороны от этого уравнения подтверждает его дисбаланс:
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 1 × × 2 = 2 | 1 × × 2 = 2 | 2 = 2, да |
| O | 1 × × 1 = 1 | 1 × × 2 = 2 | 1 ≠ 2, № |
Количество атомов H в реакционной и производной частях уравнения одинаково, а количество атомов O — нет.Для достижения баланса коэффициенты уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что индексы формулы частично определяют идентичность вещества, и поэтому они не могут быть изменены без изменения качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 приведет к сбалансированному количеству атомов, но при этом также изменится идентичность реагента (теперь это перекись водорода, а не вода).Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2.
2h3O⟶h3 + O2 (несимметричный) 2h3O⟶h3 + O2 (несимметричный)
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × × 2 = 4 | 1 × × 2 = 2 | 4 ≠ 2, № |
| O | 2 × × 1 = 2 | 1 × × 2 = 2 | 2 = 2, да |
Баланс атомов H был нарушен этим изменением, но его легко восстановить, изменив коэффициент для продукта H 2 на 2.
2h3O⟶2h3 + O2 (сбалансированный) 2h3O⟶2h3 + O2 (сбалансированный)
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × × 2 = 4 | 2 × × 2 = 4 | 4 = 4, да |
| O | 2 × × 1 = 2 | 1 × × 2 = 2 | 2 = 2, да |
Эти коэффициенты дают равное количество атомов H и O на сторонах реагента и продукта, поэтому сбалансированное уравнение имеет вид:
2h3O⟶2h3 + O22h3O⟶2h3 + O2
Пример 4.1
Балансировка химических уравнений
Напишите сбалансированное уравнение реакции молекулярного азота (N 2 ) и кислорода (O 2 ) с образованием пятиокиси азота.
Решение
Сначала напишите несбалансированное уравнение.
N2 + O2⟶N2O5 (несимметричный) N2 + O2⟶N2O5 (несимметричный)
Затем подсчитайте количество атомов каждого типа, присутствующих в несбалансированном уравнении.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 1 × × 2 = 2 | 1 × × 2 = 2 | 2 = 2, да |
| O | 1 × × 2 = 2 | 1 × × 5 = 5 | 2 ≠ 5, № |
Хотя азот сбалансирован, необходимо изменить коэффициенты, чтобы сбалансировать количество атомов кислорода.Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O индексы в этих двух формулах).
N2 + 5O2⟶2N2O5 (несимметричный) N2 + 5O2⟶2N2O5 (несимметричный)
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 1 × × 2 = 2 | 2 × × 2 = 4 | 2 ≠ 4, № |
| O | 5 × 2 = 10 | 2 × × 5 = 10 | 10 = 10, да |
Баланс атомов азота был нарушен этим изменением; восстанавливается изменением коэффициента для реагента N 2 на 2.
2N2 + 5O2⟶2N2O52N2 + 5O2⟶2N2O5
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 2 × × 2 = 4 | 2 × × 2 = 4 | 4 = 4, да |
| O | 5 × × 2 = 10 | 2 × × 5 = 10 | 10 = 10, да |
Число атомов N и O по обе стороны уравнения теперь равно, и уравнение сбалансировано.
Проверьте свои знания
Напишите сбалансированное уравнение разложения нитрата аммония с образованием молекулярного азота, молекулярного кислорода и воды. (Подсказка: балансируйте кислород в последнюю очередь, поскольку он присутствует более чем в одной молекуле в правой части уравнения.)
Ответ:
2Nh5NO3⟶2N2 + O2 + 4h3O2Nh5NO3⟶2N2 + O2 + 4h3O
Иногда удобно использовать дроби вместо целых чисел в качестве промежуточных коэффициентов в процессе балансировки химического уравнения. Когда баланс достигнут, все коэффициенты уравнения можно затем умножить на целое число, чтобы преобразовать дробные коэффициенты в целые числа без нарушения атомного баланса.Например, рассмотрим реакцию этана (C 2 H 6 ) с кислородом с образованием H 2 O и CO 2 , представленных несбалансированным уравнением:
C2H6 + O2⟶h3O + CO2 (несбалансированный) C2H6 + O2⟶h3O + CO2 (несбалансированный)
Следуя обычному подходу к проверке, можно сначала уравновесить атомы C и H, изменив коэффициенты для двух видов продукта, как показано:
C2H6 + O2⟶3h3O + 2CO2 (несимметричный) C2H6 + O2⟶3h3O + 2CO2 (несимметричный)
Это приводит к семи атомам O на стороне продукта уравнения, нечетному числу — нельзя использовать целочисленный коэффициент с реагентом O 2 для получения нечетного числа, поэтому вместо этого используется дробный коэффициент 72,72. чтобы получить предварительное сбалансированное уравнение:
C2H6 + 72O2⟶3h3O + 2CO2C2H6 + 72O2⟶3h3O + 2CO2
Обычное сбалансированное уравнение с коэффициентами только для целых чисел получается путем умножения каждого коэффициента на 2:
2C2H6 + 7O2⟶6h3O + 4CO22C2H6 + 7O2⟶6h3O + 4CO2
Наконец, что касается сбалансированных уравнений, напомним, что соглашение диктует использование наименьших целочисленных коэффициентов .Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
3Н2 + 9х3⟶6Нх43Н2 + 9х3⟶6Нх4
коэффициенты не являются наименьшими возможными целыми числами, представляющими относительное количество молекул реагента и продукта. Разделив каждый коэффициент на наибольший общий множитель, 3, мы получим предпочтительное уравнение:
Н2 + 3х3⟶2Нх4Н2 + 3х3⟶2Нх4
Ссылка на обучение
Воспользуйтесь этим интерактивным учебным пособием, чтобы попрактиковаться в уравнениях балансировки.
Дополнительная информация по химическим уравнениям
Физические состояния реагентов и продуктов в химических уравнениях очень часто указываются с аббревиатурой в скобках после формул. Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и водн. для веществ, растворенных в воде ( водных растворов , как было введено в предыдущей главе). Эти обозначения проиллюстрированы здесь в примере уравнения:
2Na (s) + 2h3O (l) ⟶2NaOH (водн.) + H3 (g) 2Na (s) + 2h3O (l) ⟶2NaOH (водн.) + H3 (g)
Это уравнение представляет реакцию, протекающую при помещении металлического натрия в воду.Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистой форме, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначают написанием слова или символа над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена прописной греческой буквой дельта (Δ) над стрелкой.
CaCO3 (т) ⟶ΔCaO (т) + CO2 (г) CaCO3 (т) ⟶ΔCaO (т) + CO2 (г)
Другие примеры этих особых условий будут рассмотрены более подробно в следующих главах.
Уравнения для ионных реакций
Учитывая обилие воды на Земле, само собой разумеется, что очень много химических реакций происходит в водных средах. Когда ионы участвуют в этих реакциях, химические уравнения могут быть записаны с различными уровнями детализации, соответствующими их предполагаемому использованию. Чтобы проиллюстрировать это, рассмотрим реакцию между ионными соединениями, протекающую в водном растворе. При смешивании водных растворов CaCl 2 и AgNO 3 происходит реакция с образованием водного Ca (NO 3 ) 2 и твердого AgCl:
.
CaCl2 (водный) + 2AgNO3 (водный) ⟶Ca (NO3) 2 (водный) + 2AgCl (s) CaCl2 (водный) + 2AgNO3 (водный) ⟶Ca (NO3) 2 (водный) + 2AgCl (s)
Это сбалансированное уравнение , полученное обычным способом, называется молекулярным уравнением, потому что оно не представляет явным образом ионные частицы, присутствующие в растворе.Когда ионные соединения растворяются в воде, они могут диссоциировать на составляющие ионы, которые впоследствии гомогенно диспергируются по всему полученному раствору (подробное обсуждение этого важного процесса приведено в главе, посвященной растворам). Ионные соединения, растворенные в воде, поэтому более реалистично представлены как диссоциированные ионы, в данном случае:
CaCl2 (водный) ⟶Ca2 + (водный) + 2Cl− (водный) 2AgNO3 (водный) ⟶2Ag + (водный) + 2NO3– (водный) Ca (NO3) 2 (водный) ⟶Ca2 + (водный) + 2NO3– (водный) CaCl2 (aq) ⟶Ca2 + (aq) + 2Cl− (aq) 2AgNO3 (aq) ⟶2Ag + (aq) + 2NO3− (aq) Ca (NO3) 2 (aq) ⟶Ca2 + (aq) + 2NO3− (aq)
В отличие от Эти три ионных соединения AgCl не растворяются в воде в значительной степени, о чем свидетельствует обозначение его физического состояния s .
Явное представление всех растворенных ионов приводит к полному ионному уравнению. В этом конкретном случае формулы растворенных ионных соединений заменяются формулами их диссоциированных ионов:
Ca2 + (водный) + 2Cl− (водный) + 2Ag + (водный) + 2NO3− (водный) ⟶Ca2 + (водный) + 2NO3− (водный раствор) + 2Ag Cl (s) Ca2 + (водный раствор) + 2Cl− (водный раствор) + 2Ag + (водн.) + 2NO3− (водн.) ⟶Ca2 + (водн.) + 2NO3− (водн.) + 2Ag Cl (s)
Изучение этого уравнения показывает, что два химических вещества присутствуют в идентичной форме по обе стороны стрелки: Ca 2+ ( водн., ) и NO3- (водн.).NO3- (водн.). Эти ионы-наблюдатели — ионы, присутствие которых требуется для поддержания нейтральности заряда — ни химически, ни физически не изменяются в процессе, поэтому их можно исключить из уравнения, чтобы получить более сжатое представление, называемое чистым ионным уравнением:
Ca2 + (aq) + 2Cl− (aq) + 2Ag + (aq) + 2NO3− (aq) ⟶Ca2 + (aq) + 2NO3− (aq) + 2AgCl (s) 2Cl− (aq) + 2Ag + (aq) ⟶2AgCl ( s) Ca2 + (aq) + 2Cl− (aq) + 2Ag + (aq) + 2NO3− (aq) ⟶Ca2 + (aq) + 2NO3− (aq) + 2AgCl (s) 2Cl− (aq) + 2Ag + (aq) ⟶ 2AgCl (т)
Следуя соглашению об использовании наименьших возможных целых чисел в качестве коэффициентов, это уравнение записывается:
Cl− (водн.) + Ag + (водн.) ⟶AgCl (s) Cl− (водн.) + Ag + (aq) ⟶AgCl (s)
Это чистое ионное уравнение показывает, что твердый хлорид серебра может быть получен из растворенных ионов хлорида и серебра (I), независимо от источника этих ионов.Эти молекулярные и полные ионные уравнения предоставляют дополнительную информацию, а именно об ионных соединениях, используемых в качестве источников Cl — и Ag + .
Пример 4.2
Молекулярные и ионные уравнения
Когда диоксид углерода растворяется в водном растворе гидроксида натрия, смесь реагирует с образованием водного карбоната натрия и жидкой воды. Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.
Решение
Начните с определения формул для реагентов и продуктов и их правильного оформления в форме химического уравнения:
CO2 (водн.) + NaOH (вод.) ⟶Na2CO3 (водн.) + H3O (л) (несбалансированный) CO2 (водн.) + NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л) (несбалансированный)
В этом случае баланс легко достигается путем изменения коэффициента для NaOH на 2, в результате чего получается молекулярное уравнение для этой реакции:
CO2 (водн.) + 2NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л) CO2 (водн.) + 2NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л)
Два растворенных ионных соединения, NaOH и Na 2 CO 3 , можно представить как диссоциированные ионы, чтобы получить полное ионное уравнение:
CO2 (водн.) + 2Na + (водн.) + 2OH− (водн.) ⟶2Na + (водн.) + CO32− (водн.) + H3O (l) CO2 (водн.) + 2Na + (водн.) + 2OH− (вод.) ⟶2Na + (водн. ) + CO32− (водн.) + H3O (l)
Наконец, определите ион-наблюдатель, в данном случае Na + ( водн. ), и удалите его с каждой стороны уравнения, чтобы получить чистое ионное уравнение:
CO2 (водн.) + 2Na + (водн.) + 2OH− (водн.) ⟶2Na + (водн.) + CO32− (водн.) + H3O (л) CO2 (водн.) + 2OH− (водн.) ⟶CO32− (вод. л) CO2 (водн.) + 2Na + (водн.) + 2OH− (водн.) ⟶2Na + (водн.) + CO32− (водн.) + h3O (l) CO2 (водн.) + 2OH− (водн.) ⟶CO32− (водн.) + h3O (л)
Проверьте свои знания
Двухатомный хлор и гидроксид натрия (щелок) являются товарными химическими веществами, которые производятся в больших количествах вместе с двухатомным водородом путем электролиза рассола в соответствии со следующим несбалансированным уравнением:
NaCl (водный) + h3O (l) → электричество NaOH (водный) + h3 (g) + Cl2 (g) NaCl (водный) + h3O (l) → электричество NaOH (водный) + h3 (g) + Cl2 (g)
Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.
Ответ:
2NaCl (водн.) + 2h3O (ж) ⟶2NaOH (водн.) + H3 (г) + Cl2 (г) (молекулярный) 2NaCl (водн.) + 2h3O (ж) ⟶2NaOH (водн.) + H3 (г) + Cl2 (г ) (молекулярный)
2Na + (aq) + 2Cl− (aq) + 2h3O (l) ⟶2Na + (aq) + 2OH− (aq) + h3 (g) + Cl2 (g) (полный ионный) 2Na + (aq) + 2Cl− (aq) + 2h3O (l) ⟶2Na + (aq) + 2OH− (aq) + h3 (g) + Cl2 (g) (полностью ионный)
2Cl− (водный) + 2h3O (l) ⟶2OH− (водный) + h3 (g) + Cl2 (g) (чистый ионный) 2Cl− (водный) + 2h3O (l) ⟶2OH− (водный) + h3 (g ) + Cl2 (г) (чистый ионный)
.
