Содержание
h3SO4 его название помогите пажалуйста
Нужна помощь
Очень срочно
???? Хто шарит по химиии
Дать характеристику элементу с порядковым номером 20 по положению его в передовой системе.
Закончить уравнение возмещение реакций и расставьте коэффициенты
ДАЮ 35 БАЛЛОВ4. Позначте речовини, які можна використати для добування магній броміду:А) неметал і основний оксидБ) кислотний оксид і основаВ) метал і
…
неметалГ) метал і кислотний оксид5. Позначте речовини, які можна використати для одержання барій карбонату:А) метал і неметалБ) метал і кислотний оксидВ) основа і кислотний оксидГ) основа і неметал6. Позначте речовини, які можна використати для добування натрій хлориду:A) метал і кислотний оксидБ) основа і кислотний оксидB) основний оксид і кислотний оксидГ) основа і кислота7. Сіль утвориться внаслідок взаємодії:А) Na2O і SO3Б) N2O і CO2В) Na2O і CaCO3Г) CO2і h3O8. Кальцій сульфат утворюється внаслідок взаємодії:А) барій сульфату з кальцій нітратом у розчиніБ) сульсфур(ІV) оксиду з кальціємВ) сульфур(VІ) оксиду з кальцій гідроксидомГ) сульфур(VІ) оксиду з калій гідроксидом9. Позначте речовини, в результаті взаємодії яких можна одержати калій сульфат:A) калій + цинк сульфатБ) барій сульфат + калій гідроксидB) калій оксид + магній сульфатГ) калій гідроксид + сульфатна кислота10. Позначте речовини, у результаті взаємодії яких можна одержати купрум(ІІ) нітрат:А) барій нітрат + мідьБ) аргентум(І) нітрат + мідьВ) алюміній нітрат + мідьГ) натрій нітрат + мідь11. У якому варіанті відповіді вказано реакції, у результаті взаємодії яких можна одержати купрум(ІІ) сульфат:1) CuO + SO2 →2) CuO + h3SO4 →3) Cu2O + h3SO4 →4) Cu(OH)2 + h3SO4 →5) Cu2O + SO2→Варіанти відповіді.А) 1, 3Б) 2, 4В) 1, 4Г) 2, 512. У якому варіанті відповіді вказано реакції, у результаті взаємодії яких можна одержати ферум(ІІ) хлорид?1) NaCl + FeSO4 →2) Fe(OH)2 + HCl →3) BaCl2 + FeSO4 →4) Fe2O3 + HCl →5) Fe(OH)3 + HCl →Варіанти відповіді.А) 2, 3Б) 1, 4В) 1, 2Г) 3, 513. Установіть відповідність між сіллю і оксидами, з яких вона утворена:Сіль1) CrSO42) Cr2(SO4)33) K2SO44) K2SO3ОксидиА) Cr2O3, SO3Б) K2O, SO2В) K2O, SO3Г) Cr2O3, SO2Д) CrO, SO314.
Позначте речовини, в результаті взаємодії яких можна одержати калій сульфат:A) калій + цинк сульфатБ) барій сульфат + калій гідроксидB) калій оксид + магній сульфатГ) калій гідроксид + сульфатна кислота10. Позначте речовини, у результаті взаємодії яких можна одержати купрум(ІІ) нітрат:А) барій нітрат + мідьБ) аргентум(І) нітрат + мідьВ) алюміній нітрат + мідьГ) натрій нітрат + мідь11. У якому варіанті відповіді вказано реакції, у результаті взаємодії яких можна одержати купрум(ІІ) сульфат:1) CuO + SO2 →2) CuO + h3SO4 →3) Cu2O + h3SO4 →4) Cu(OH)2 + h3SO4 →5) Cu2O + SO2→Варіанти відповіді.А) 1, 3Б) 2, 4В) 1, 4Г) 2, 512. У якому варіанті відповіді вказано реакції, у результаті взаємодії яких можна одержати ферум(ІІ) хлорид?1) NaCl + FeSO4 →2) Fe(OH)2 + HCl →3) BaCl2 + FeSO4 →4) Fe2O3 + HCl →5) Fe(OH)3 + HCl →Варіанти відповіді.А) 2, 3Б) 1, 4В) 1, 2Г) 3, 513. Установіть відповідність між сіллю і оксидами, з яких вона утворена:Сіль1) CrSO42) Cr2(SO4)33) K2SO44) K2SO3ОксидиА) Cr2O3, SO3Б) K2O, SO2В) K2O, SO3Г) Cr2O3, SO2Д) CrO, SO314. Установіть відповідність між сіллю і реагентами, з яких вона утворена:Сіль1) FeCl22) FeCl33) Fe(NO3)24) Fe(NO3)3РеагентиA) FeSO4, Ba(NO3)2Б) Fe(OH)3, HNO3B) FeO, HClГ) Fe2O3, HClД) Fe2(SO4)3, KNO3
Установіть відповідність між сіллю і реагентами, з яких вона утворена:Сіль1) FeCl22) FeCl33) Fe(NO3)24) Fe(NO3)3РеагентиA) FeSO4, Ba(NO3)2Б) Fe(OH)3, HNO3B) FeO, HClГ) Fe2O3, HClД) Fe2(SO4)3, KNO3
2-метил пропан.2-метил бутан.3-метил гексан.2,2,4-триметил пентан.3-метил 5-этил гептан.
Вывод о применении важнейших кислот!!!!ПОЖАЛУЙСТА ПОМОГИТЕ!!!!!
Найдите массу соли, которая образуется при взаимодействии 45 г алюминия с азотной кислотой.
1. Які сполуки називають білками? Охарактеризуйте якісний склад білків.
2. Скільки амінокислот бере участь у синтезі більшості природних білків? Які
а
…
мінокислоти називають незамінними (перерахуйте їх назви)?
3. Охарактеризуйте фізичні властивості білків.
4. Під дією яких чинників відбувається денатурація білка?
5. Опишіть функції білків в живих організмах.
Розрахункова задача
6. Обчисліть масу 4,5 моль амінокислоти фенілаланіну. Структурна формула
фенілаланіну:
NH 2 − CH − COOH
CH 2 − C 6 H 5
ПОМОГИТЕ СРОЧНО!!!Як експериментально виявити, що під час розчинення основних оксидів утворюється основа, а кислотних-кислота?
Окно в Тифлис 1920-х.
 Кураторский гид по выставке грузинского книжного авангарда
Кураторский гид по выставке грузинского книжного авангарда
1920-е годы и первая половина 1930-х стали самым плодотворным временем в культуре и искусстве РСФСР и союзных республик. Галерея «На Шаболовке» предлагает познакомиться с этим малоизученным периодом истории Грузии. На выставке «Левее левизны. Грузинский авангард в книге», которая пройдет здесь с 24 апреля по 30 июня, будет представлено более 100 книг и журналов, оформленных известными грузинскими художниками с 1922 по 1937 год. Все издания были найдены историком книги и букинистом Павлом Чепыжовым во время поездок в Тбилиси.
Самое важное о выставке — в совместном материале mos.ru и агентства «Мосгортур».
Почему грузинский книжный авангард — это интересно
Тифлис (название «Тбилиси» в русском языке принято после 1936 года) всегда был местом особой продуктивности для художников, поэтов и вообще людей искусства. Один из самых концентрированных моментов этой продуктивности пришелся на период с 1917 по 1922 год, когда в Грузии возникла независимая республика.
В России шла Гражданская война, и многие представители русского авангарда уезжали из страны, в том числе и в Грузию. В Тифлисе появилось много литературных кафе, творческих объединений, выходило большое число экспериментальных книг, творили поэты и художники с мировыми именами. И этот период хорошо изучен с разных сторон — Алексей Крученых делал тогда свои самые новаторские книги, тогда же начинал теоретик русского авангарда писатель и художник Илья Зданевич, известный благодаря своим работам с Пикассо, Миро и Шанель.
В 1922 году возникла Грузинская Советская Социалистическая Республика, и большая часть людей, составлявших богемную жизнь вольного Тифлиса, разъехались. Период 1920–1930-х годов до сих пор оставался малоизученным — все внимание исследователей оттянул на себя предыдущий.
На самом же деле в грузинском авангарде после 1922 года было много интересного. Продолжали возникать авангардные группировки — действовала местная ячейка «Левого фронта искусств» («ЛЕФ»), к участникам которой регулярно приезжал Владимир Маяковский. Илья Зданевич уехал в Париж в 1921 году, но в Тифлисе остался его брат Кирилл Зданевич. В 1913 году Зданевичи вместе с искусствоведом Михаилом Ле-Дантю открыли художника Нико Пиросмани. После отъезда брата Кирилл Зданевич продолжал выступать связующим звеном между молодыми художниками и миром.
Илья Зданевич уехал в Париж в 1921 году, но в Тифлисе остался его брат Кирилл Зданевич. В 1913 году Зданевичи вместе с искусствоведом Михаилом Ле-Дантю открыли художника Нико Пиросмани. После отъезда брата Кирилл Зданевич продолжал выступать связующим звеном между молодыми художниками и миром.
Жизнь бурлила. Двадцатые годы XX века — время относительной творческой свободы, когда все передовые движения в искусстве поддерживались на государственном уровне. Это была очень благотворная среда. Красивые книги с потрясающим оформлением левых грузинских художников, чей дизайн перекликается с книжным дизайном того времени, но при этом самобытные и нестандартные, — вот о них мы и хотим рассказать московской публике посредством выставки.
Про название
Название выставки отражает представленное на ней направление. Нас интересует левый фланг искусств — именно там, на наш взгляд, шла самостоятельная художественная деятельность.
«Левее левизны» — так называется одна из книг на выставке. Идеи левого искусства фактически были введены в 1920-е годы в Москве Владимиром Маяковским, Алексеем Ганом и Осипом Бриком. Они понимали под этим искусство, направленное в массы. Не элитарное буржуазное искусство дореволюционной России, а такое, которое должно влиять на жизнь простого человека и делать его гражданином советской страны и советских республик. Эта идея сильно прижилась в Грузии. Большая часть людей, о которых рассказываем на выставке, приняли большевистскую власть. Доходило до того, что они соревновались между собой, кто более левый художник и кто ближе к условным заветам Маяковского.
Уже в 1931–1932 годах именно в книжных художественных объединениях проявил себя диктат того, что потом стало официальной грузинской литературой и искусством. Многие из сторонников левого искусства ушли в театр — в Грузии он был оплотом авангарда до середины 1930-х годов. Точка ставится на 1937 году, потому что в это время был расстрелян Сандро Ахметели, руководитель Грузинского театра имени Шота Руставели, да и в книжном дизайне к этому времени все стало довольно стандартным.
В чем уникальность выставки
Такого еще никогда не делали ни в Грузии, ни за ее пределами. Никто не выделял этот феномен целиком, известны лишь отдельные издания этого периода. Самое знаменитое, представленное на выставке, — журнал H2SO4 («Серная кислота»), напечатанный в 1924 году, каждая страница и разворот которого — произведения искусства. Это эксперименты с типографским набором, со шрифтами, наложенными на репродукции картин грузинских кубистов и модернистов. Плюс очень своеобразная и нахальная поэзия, часть которой мы перевели (переводы тоже будут представлены в экспозиции).
Нам повезло найти разброшюрованный экземпляр журнала. Его развесили на выставке по разворотам, потому что каждый представляет собой нечто особенное. Подобного тоже никогда не делали. Исследователи не знали, к чему отнести этот журнал — то ли к русскому авангарду, то ли к восточноевропейскому. А на самом деле он демонстрирует все те разнообразные процессы, которые шли в Грузии.
А на самом деле он демонстрирует все те разнообразные процессы, которые шли в Грузии.
Ценность выставки в том, что феномен грузинского книжного авангарда рассмотрен и описан целиком, и можно посмотреть, как это выглядело, и вдохновиться именно тем, что делали грузинские дизайнеры в 1920-е годы. Эти идеи не использовались больше нигде.
Мы даем полную картину — рассказываем о периоде, берем интересные графические работы из частных коллекций, чтобы показать переход от того, что чаще всего называют русским авангардом в Тифлисе, к грузинскому конструктивизму 1920-х годов.
Это такое окно в грузинский мир начала 1920-х годов, редкая возможность посмотреть, что там происходило, через книгу. Выставка дает полное погружение в атмосферу Тбилиси — абсолютно книжного города, где до сих пор все парапеты завалены советскими изданиями, где в каждой уважающей себя интеллигентной семье есть своя библиотека. Книга — очень важная часть грузинской идентичности, и неслучайно, что именно в книжном дизайне, книжных изданиях происходили такие важные авангардные эксперименты.
Что увидят посетители
Гости увидят графику художников, оригиналы изданий, которые больше нигде не посмотреть в России, плакаты и отдельные развороты, если они представляют художественную ценность. Мы сделали также авангардную карту Тифлиса — ее можно брать с собой в Тбилиси и гулять с ней. На карте — основные типографии, театры, люди, которые жили не так далеко друг от друга. Тбилиси не сильно изменился с тех пор. Он перестроен, но общая структура города не изменилась.
Посетитель сможет познакомиться и с теорией вопроса — на выставке много текстов, объясняющих, что происходило в тот период. Одними экспонатами выставка не ограничится — в пространстве галереи пройдут лекции по темам «Грузия и Маяковский», «Авангардный театр в Тбилиси 1920-х годов», «Конструктивистская книга в СССР в 1920-е годы», а в последние выходные апреля, мая и июня состоятся три кураторские экскурсии.
Основное, что сможет вынести человек, который придет на выставку, это, безусловно, идеи. Графические и дизайнерские идеи, которые были в Грузии того времени, абсолютно уникальны и ни с чем несравнимы. Эта неповторимость связана с большой «эластичностью» грузинского алфавита. Его буквы можно вписывать в совершенно разные очертания — они могут быть более угловатыми или более округлыми. Они могут быть разнообразными. Грузинский алфавит по сравнению с кириллическим больше поддается экспериментам — это может быть интересно любому человеку, который интересуется визуальной составляющей и дизайном.
Как появилась коллекция
Она собиралась в Тбилиси, какое-то количество книжек было найдено в Москве, во Франции и Америке. Речь идет о 110–115 экспонатах, которые я собирал в течение пяти лет. Когда начинал ездить в Тбилиси, я был достаточно интегрирован в местный рынок. Я видел издания, часто оформленные относительно известными грузинскими художниками, про которые не существовало никаких сведений.
Я стал их потихонечку подбирать, и по мере роста коллекции понял, что нащупал интересный феномен. В результате был создан каталог всего найденного. Это одновременно и исследование того, что происходило в Грузии в то время, и библиографический каталог. Теперь вся коллекция приехала в Москву, где первый раз будет полностью выставляться. Плюс ее дополнит графика из частного собрания Петра Навашина.
404 — Документ не найден
Документ не найден.
Пожалуйста, воспользуйтесь поиском или нижним меню.
Обжимные фитинги
муфты, штуцера, адаптеры, уголки, кресты, тройники
Резьбовые фитинги
ниппели, муфты, тройники..
Приварные фитинги
VCR, VCO, БРС
Фитинги
Запорная арматура
Игольчатые вентили
Шаровые краны
Мембранные клапаны
Сильфонные вентили
Манометрические вентили
Клапаны
Баллонные
Общепромышленные
Высокоточные
До себя
Для чистых сред
Двухступенчатые
Регуляторы давления
Фильтры и фильтрующие элементы
фильтры финишной очистки
Промышленные фильтры
Микронные фильтры
Фильтры
Калиброванные бесшовные трубки
Инструмент для труб
полимерные трубки
зажимы и крепления для труб
гибкие рукава
Зажимы, трубы, рукава и аксессуары
Изделия собственного производства
газоразрядные рампы
атмосферные испарители
газовые шкафы
устройства отбора пробы
Изделия
Поточные нагреватели жидкостей и газов
Нагреватели
Расходомеры
Ротаметры
Средства контроля расхода
Уровнемеры
Смотровые стёкла
Средства измерения уровня
Манометры
Преобразователи давления
Реле давления
Разделительные мембраны
Средства измерения давления
Средства измерения температуры
Анализаторы газов
Алюминиевые газовые баллоны:
— Одногорловые
— Двугорловые
Баллоны и Сосуды
Кабельные вводы
Покупайте качество h3so4 химическое название по выгодной цене
.
h3so4 химическое название, продаваемые на Alibaba.com, неизбежно представляют собой химические катализаторы и промежуточные продукты, широко используемые в красителях, фотографии, деревообрабатывающей, нефтяной и текстильной промышленности. Извлечен из одного или нескольких неорганических соединений. h3so4 химическое название представляют собой оксокислоты или не содержат кислорода. Магазин с самым большим портфолио. h3so4 химическое название разработан для сохранения стабильности при стандартных температурах и оригинальности в течение многих лет использования.
Найдите растворимые в воде и нерастворимые в растворителях. h3so4 химическое название, например соляная, серная и азотная кислоты, подходящие для лабораторных целей. Откройте для себя доступные и эффективные. h3so4 химическое название доступны в разбавленном или концентрированном виде, чтобы находчиво завершить ваши проекты предварительной обработки.
Если вы ищете высококонцентрированный и суперсильный. h3so4 химическое название или слабые, вы найдете сотни высококачественных продуктов премиум-класса, соответствующих вашим потребностям.
Покупайте. h3so4 химическое название, разработанные с учетом всех отраслевых стандартов безопасности, качества и надежности, продукты обеспечивают качественные результаты при использовании в агрохимии, промышленности и фармацевтике. Откройте для себя на Alibaba.com. h3so4 химическое название в безводном, газообразном и водном форматах, каждый из которых достаточно силен для различных проектов синтеза. Получено от мировых лидеров в области химического производства. h3so4 химическое название обладают разными свойствами и потенциями.
Вы искали разные? h3so4 химическое название безрезультатно или с минимальным успехом в вашем розничном или оптовом магазине? Просмотрите Alibaba.com, чтобы увидеть невероятно большую коллекцию продуктов, созданных для обеспечения безопасности, экологичности и устойчивости.
Благодаря ценам и составам, подходящим для уникальных применений, найдите продукты, подходящие для ваших проектов. Вам не нужно покупать оптом, чтобы получать товары по сниженным ценам, потому что цены соответствуют бюджетам клиентов.
серной кислоты: OSH Answers
Вдыхание: Примите меры для обеспечения собственной безопасности перед попыткой спасения (например, наденьте соответствующее защитное снаряжение). Переместите пострадавшего на свежий воздух. Сохраняйте покой в удобном для дыхания положении. Если дыхание затруднено, обученный персонал должен дать кислород в экстренной ситуации. НЕ позволяйте жертве без необходимости перемещаться. Симптомы отека легких могут проявиться позже. Немедленно позвоните в токсикологический центр или к врачу.Срочно требуется лечение. Транспорт в больницу.
Контакт с кожей: Избегайте прямого контакта. При необходимости используйте одежду для химической защиты. Быстро снимите зараженную одежду, обувь и изделия из кожи (например, ремешки для часов, ремни). Быстро и аккуратно промокните или удалите излишки химикатов. Немедленно промойте слегка теплой проточной водой в течение не менее 30 минут. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. Если это можно сделать безопасно, продолжайте промывание во время транспортировки в больницу. Немедленно позвоните в токсикологический центр или к врачу.Срочно требуется лечение. Транспорт в больницу. Сделайте двойной пакет, запечатайте, заклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте для безопасной утилизации.
Быстро и аккуратно промокните или удалите излишки химикатов. Немедленно промойте слегка теплой проточной водой в течение не менее 30 минут. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. Если это можно сделать безопасно, продолжайте промывание во время транспортировки в больницу. Немедленно позвоните в токсикологический центр или к врачу.Срочно требуется лечение. Транспорт в больницу. Сделайте двойной пакет, запечатайте, заклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте для безопасной утилизации.
Контакт с глазами: Избегайте прямого контакта. При необходимости используйте перчатки химической защиты. Быстро и аккуратно промокните или смахните химические вещества с лица. Немедленно промойте загрязненный глаз (а) теплой, слегка проточной водой в течение не менее 30 минут, удерживая веки открытыми. При наличии контактных линз НЕ откладывайте промывку и не пытайтесь снять линзу.Можно использовать нейтральный физиологический раствор, как только он станет доступен. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. При необходимости продолжайте промывание во время транспортировки в больницу. Следите за тем, чтобы не смывать загрязненную воду непораженным глазом или лицом. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. При необходимости продолжайте промывание во время транспортировки в больницу. Следите за тем, чтобы не смывать загрязненную воду непораженным глазом или лицом. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Проглатывание: Попросите пострадавшего прополоскать рот водой. Если рвота происходит естественным путем, попросите пострадавшего наклониться вперед, чтобы снизить риск аспирации.Попросите потерпевшего снова прополоскать рот водой. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Комментарии по оказанию первой помощи: Некоторые из рекомендуемых здесь процедур первой помощи требуют углубленного обучения навыкам оказания первой помощи. Все процедуры первой помощи следует периодически пересматривать врач, знакомый с химическим веществом и условиями его использования на рабочем месте.
Argus серная кислота | Аргус Медиа
Служба Argus Sulfuric Acid — это ваш надежный и полезный источник еженедельной информации о мировом рынке серной кислоты и связанных с ней рынках.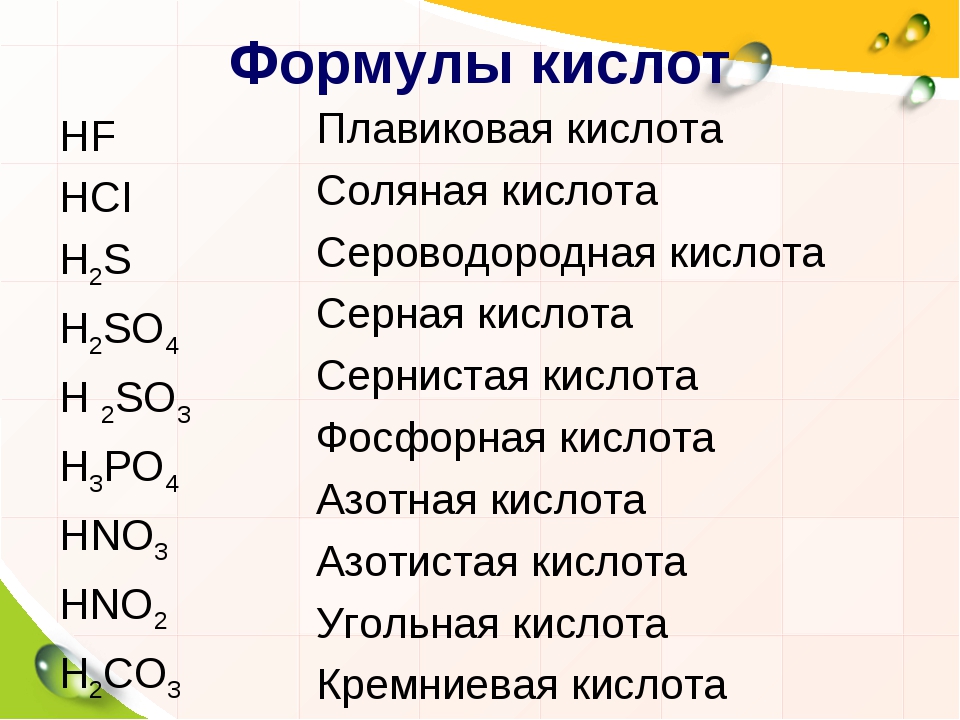
Эта важная услуга обеспечивает оценку и анализ основных мировых цен на серную кислоту, используемую на рынках удобрений и промышленности. Сервис, созданный нашей специализированной глобальной командой экспертов, публикует 13 оценок спотовых и контрактных цен, а также анализ и комментарии о развитии рынка, продажах и торговой статистике. Он включает подробную информацию о глобальных остановках заводов по производству серной кислоты и индикаторы спотовых ставок фрахта для 11 основных торговых маршрутов.
В разделе фундаментальных показателей службы анализируется влияние предложения металлов и серы, а также спроса со стороны проектов по выщелачиванию и сектора удобрений.
Основные характеристики
- Рыночные цены и комментарии для 13 центров спотового и контрактного ценообразования
- Статистика импорта / экспорта и данные отгрузки
- Фундаментальный анализ и обновленная информация о глобальных остановках заводов по производству серной кислоты
- Оценка фрахта для основных морских маршрутов, включая указание спотовых ставок для 11 основных торговых маршрутов
- Рыночная методология
- Загружаемые данные о рынке серной кислоты, включая глобальные остановки и сокращения производства, экспорт Южной Кореи, экспорт Японии, данные о торговле США, данные о торговле Бразилии, данные о торговле в Европе, линейку судов Индии и линейку судов Jorf Lasfar
- Широкое использование графики, карт и визуальных элементов для улучшения доступа к ключевой информации
Преимущества выбора Argus
- Надежная методология предоставления справедливой и точной информации о ценах
- Соответствие и аудит для обеспечения надежности
- Глобальное редакционное освещение с репортерами на ключевых рынках, включая США, Бразилию и Индию
Клиенты, которые получают выгоду
Сервис Argus Sulfuric Acid является важным чтением для всех участников глобального рынка серной кислоты. Ниже приведены примеры того, как некоторые клиенты используют эту услугу:
Ниже приведены примеры того, как некоторые клиенты используют эту услугу:
- Производители удобрений зависят от международных отчетов о рынке серной кислоты и анализа цен, поскольку серная кислота является важным компонентом при производстве фосфорных удобрений. Серная кислота также используется в производстве сульфата аммония и NPK (азотные, фосфатные и калийные).
- Производители серной кислоты, включая металлургические заводы и установки для сжигания серы, используют отчет для отслеживания динамики мировых цен и торговых потоков, а также для оценки новых возможностей.Отчет предоставляет ценные данные, которые могут помочь в принятии решений.
- Торговцы серной кислотой полагаются на жизненно важную и своевременную информацию для принятия торговых решений. Отчет отслеживает движение судов в режиме реального времени и содержит самые свежие новости о новых продажах и нарушениях спроса и предложения.

- Промышленные пользователи и операторы горнодобывающей промышленности , использующие процессы кислотного выщелачивания, используют отчет для понимания цен и торговых потоков. Серная кислота является ключевым сырьем для производства целлюлозы и бумаги, пигментов, каучуков и специальных химикатов, а также топливных добавок для широкого спектра промышленных применений.
ответов — Названия кислот
ответов — Названия кислот
| Арканзас Государственный университет Отдел химии и Физика |
Напишите формулы для каждой из кислот, перечисленных ниже:
| Азотная кислота | HNO 3 |
| Синильная кислота | HCN (водн.) |
| Хлорная кислота | HClO 3 |
| Уксусная кислота | CH 3 COOH |
| Бромоводородная кислота | HBr (водн. ) ) |
| Сернистая кислота | H 2 SO 3 |
| Хлористая кислота | HClO 2 |
| Борная кислота | H 3 BO 3 |
| Соляная кислота | HCl (водн.) |
| Фосфорная кислота | H 3 PO 4 |
| Азотистая кислота | HNO 2 |
| Плавиковая кислота | HF (водн.) |
| Хлорная кислота | HClO 4 |
| Йодоводородная кислота | HI (водн.) |
| Фосфорная кислота | H 3 PO 3 |
| Угольная кислота | H 2 CO 3 |
| Серная кислота | H 2 SO 4 |
| Муравьиная кислота | HCOOH |
Назовите каждую из следующих кислот:
| HClO 4 | хлорная кислота |
| HCOOH | муравьиная кислота |
| H 3 PO 4 | фосфорная кислота |
HCl (водн. ) ) | соляная кислота |
| H 3 BO 3 | борная кислота |
| H 2 SO 4 | серная кислота |
| HNO 2 | азотистая кислота |
| HI (водн.) | иодистоводородная кислота |
| CH 3 COOH | уксусная кислота |
| HF (водн.) | плавиковая кислота |
| H 3 PO 3 | фосфорная кислота |
| HCN (водн.) | синильная кислота |
| HClO 3 | хлорная кислота |
| H 2 CO 3 | угольная кислота |
| H 2 SO 3 | сернистая кислота |
| HClO 2 | хлорноватистая кислота |
| HNO 3 | азотная кислота |
HBr (водн. ) ) | бромистоводородная кислота |
Серная кислота | 7664-93-9
Серная кислота Химические свойства, использование, производство
Химическая структура
Структура Льюиса
Шаровая диаграмма
Модель, заполняющая пространство. Химическая формула серной кислоты — h3SO4, а ее молекулярный вес — 98.079 г / моль. Его химическая структура показана выше. Атом серы связан с двумя атомами кислорода двойными связями и двумя гидроксильными группами (ОН) одинарными связями. Это дипротонная кислота, так как она может выделять два протона.
История
Хотя серная кислота в настоящее время является одним из наиболее широко используемых химикатов, до 16 века о ней, вероятно, было мало известно. Он был приготовлен Иоганном Ван Гельмонтом (около 1600 г.) путем деструктивной перегонки зеленого купороса (сульфата железа) и сжигания серы. Первым крупным промышленным потребителем серной кислоты был процесс Леблана для производства карбоната натрия (разработанный около 1790 г.). Серная кислота производилась в Нордхаузене из зеленого купороса, но была дорогой. Процесс его синтеза путем сжигания серы с селитрой (нитратом калия) был впервые использован Иоганном Глаубером в 17 веке до н.э. и коммерчески разработан Джошуа Уордом в Англии около 1740 года. Вскоре на смену ему пришла технология свинцовой камеры, изобретенная Джоном Робаком в 1746 году и с тех пор усовершенствованная многими другими.Процесс контакта был первоначально разработан около 1830 года Перегрин Филлипс в Англии; он мало использовался, пока не возникла потребность в концентрированной кислоте, особенно для производства синтетических органических красителей.
Первым крупным промышленным потребителем серной кислоты был процесс Леблана для производства карбоната натрия (разработанный около 1790 г.). Серная кислота производилась в Нордхаузене из зеленого купороса, но была дорогой. Процесс его синтеза путем сжигания серы с селитрой (нитратом калия) был впервые использован Иоганном Глаубером в 17 веке до н.э. и коммерчески разработан Джошуа Уордом в Англии около 1740 года. Вскоре на смену ему пришла технология свинцовой камеры, изобретенная Джоном Робаком в 1746 году и с тех пор усовершенствованная многими другими.Процесс контакта был первоначально разработан около 1830 года Перегрин Филлипс в Англии; он мало использовался, пока не возникла потребность в концентрированной кислоте, особенно для производства синтетических органических красителей.
появление
Серная кислота образуется естественным путем в результате окисления сульфидных минералов в горных породах. Разбавленная серная кислота также образуется в атмосфере в результате окисления диоксида серы (в результате сжигания топлива) в присутствии влаги, в конечном итоге выпадая в виде «кислотного дождя».
Физические свойства
h3SO4 — бесцветная или слегка желтоватая вязкая жидкость с резким запахом. Он имеет плотность 1,84 г / мл, температуру кипения 337 ° C и точку плавления 10 ° C. «Концентрированная» серная кислота на 98% находится в воде и является наиболее стабильной формой. Многие другие концентрации с другими названиями доступны для различных целей. Аккумуляторная кислота составляет 29–32%, камерная кислота — 62–70%, а кислотная — 78–80%.
Химические свойства
Серная кислота — очень сильная дипротонная кислота.Он гигроскопичен и легко впитывает влагу из воздуха. Это мощный окислитель, вступающий в реакцию со многими металлами при высоких температурах. Концентрированный h3SO4 также является сильным дегидратирующим агентом. Добавление воды к концентрированной серной кислоте является очень экзотермической реакцией и может привести к взрывам.
C (т) + h3SO4 (водн.) → 2SO2 (г) + 2h3O (ж)
Fe (т.) + H3SO4 (водн.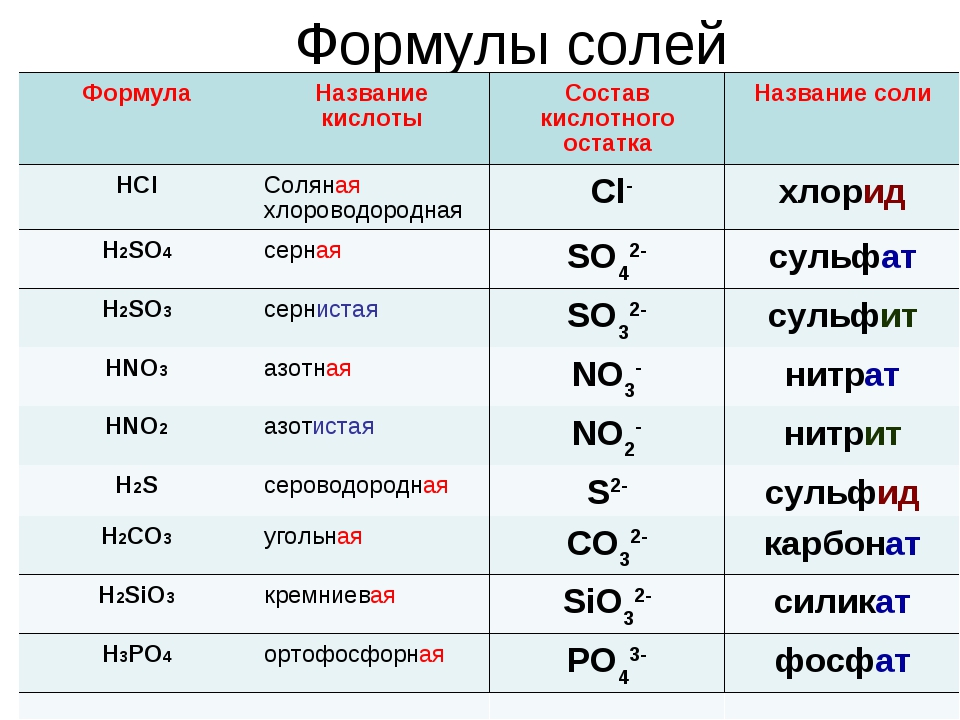 ) → h3 (г) + FeSO4 (водн.)
) → h3 (г) + FeSO4 (водн.)
Sn (s) + 2 h3SO4 (водн.) → SnSO4 (водн.) + 2 h3O (l) + SO2 (g)
Рис.2 Окислительная способность серной кислоты
Инжир.3 Обезвоживание серной кислоты
Рис.4 Реакция серной кислоты с водой
Использует
Промышленность
Заявление
Роль / выгода
Химическое производство
Производство соляной кислоты, азотной кислоты, фосфорной кислоты и многих других промышленных химикатов.
Сырье
Удобрения
Производство сульфата аммония и сульфата алюминия
Сырье
Водород
Серно-йодный цикл для производства водорода
Сырье / углеводороды не требуются
Уборка
Удаление окисления, ржавчины и окалины с листового проката и заготовок
Чистящее средство
Приготовление раствора пираньи (мощный очищающий раствор)
Сырье
Кислотные очистители канализации
Главный ингридиент
Производство нейлона
Катализирование превращения оксима циклогексанона в капролактам
Кислотный катализатор
нефтепереработка
СААУ или установка алкилирования серной кислоты
Электрохимия
Свинцово-кислотные аккумуляторы
Электролит
Медицина
Производство алкилирующих противоопухолевых средств
Сырье
Производство мази для местного применения под названием Дебактерол
Ключевой ингредиент
Другие
Картофель
Раствор для опрыскивания / помогает высушить стебель
Производство вискозы
Реагент Pcocessing
Производство взрывчатых веществ
Составная часть
Производство кислотных красителей
Сырье / помогает установить цвет красителя
Годовое производство серной кислоты
Эти цифры относятся к 2011-2012 гг. Ожидалось, что к 2012 году мировое производство превысит 250 миллионов тонн (mcgroup.com) и 260 миллионов тонн к 2018 году (marketandmarkets.com) с прогнозируемой тенденцией к росту как минимум до 2023 года (Transparencymarketresearch.com).
Ожидалось, что к 2012 году мировое производство превысит 250 миллионов тонн (mcgroup.com) и 260 миллионов тонн к 2018 году (marketandmarkets.com) с прогнозируемой тенденцией к росту как минимум до 2023 года (Transparencymarketresearch.com).
Табл. 1 Годовое производство серной кислоты (данные получены по: Merchant Research & Consulting Ltd.)
Способы производства серной кислоты
Процесс обедненной камеры
Инжир.5 Свинцовые камеры для крупносерийного производства серной кислоты 1874
В 1746 году в Бирмингеме, Англия, Джон Робак начал производить серную кислоту в камерах, облицованных свинцом, которые были более прочными и менее дорогими, и их можно было сделать намного больше, чем стеклянные емкости, которые использовались ранее. Это позволило эффективно индустриализировать производство серной кислоты, и с некоторыми усовершенствованиями этот процесс оставался стандартным методом производства в течение почти двух столетий. Процесс был настолько надежен, что уже в 1946 году на камерный процесс приходилось 25% производимой серной кислоты.
Процесс был настолько надежен, что уже в 1946 году на камерный процесс приходилось 25% производимой серной кислоты.
Контактный процесс
Рис.6 Контактный процесс получения серной кислоты
Контактный процесс (процесс DCDA) — это современный метод производства серной кислоты в высоких концентрациях, необходимых для промышленных процессов. Этот процесс был запатентован в 1831 году британским торговцем уксусом Перегрин Филлипс. Помимо того, что контактный процесс является гораздо более экономичным процессом производства концентрированной серной кислоты, чем предыдущий процесс с ведущей камерой, он также производит триоксид серы и олеум.В процессе контакта очищенный диоксид серы и воздух смешиваются, нагреваются примерно до 450 ° C и пропускаются через катализатор; диоксид серы окисляется до триоксида серы. Катализатором обычно является платина на носителе из диоксида кремния или асбеста или пятиокись ванадия на носителе из диоксида кремния. Трехокись серы охлаждают и пропускают через две башни. В первой башне его промывают олеумом (дымящей серной кислотой, 100% серной кислотой с растворенным в ней триоксидом серы). Во второй башне его промывают 97% -ной серной кислотой; В этой башне обычно производится 98% -ная серная кислота.Отработанные газы обычно сбрасываются в атмосферу. Кислота любой желаемой концентрации может быть получена путем смешивания или разбавления продуктов этого процесса.
В первой башне его промывают олеумом (дымящей серной кислотой, 100% серной кислотой с растворенным в ней триоксидом серы). Во второй башне его промывают 97% -ной серной кислотой; В этой башне обычно производится 98% -ная серная кислота.Отработанные газы обычно сбрасываются в атмосферу. Кислота любой желаемой концентрации может быть получена путем смешивания или разбавления продуктов этого процесса.
Мокрая серная кислота
Рис.7 Схема мокрой серной кислоты
Процесс мокрой серной кислоты (процесс WSA) является сегодня одним из ключевых процессов десульфуризации газа на рынке. С тех пор, как датская компания-производитель катализаторов Haldor Topsoe представила и запатентовала эту технологию в конце 1980-х годов, она была признана эффективным способом извлечения серы из различных технологических газов в виде серной кислоты промышленного качества (h3SO4) с одновременным получением высокого давления. готовить на пару.Процесс WSA применяется во всех отраслях промышленности, где удаление серы является проблемой.
Использует
Серная кислота имеет множество применений в различных отраслях промышленности, таких как производство удобрений, производство металлов, переработка полезных ископаемых, нефтепереработка, обработка сточных вод и т. Д. Она также используется в производстве чистящих средств, красителей, пигментов, лекарств, моющих средств и взрывчатых веществ. Обычно он используется в качестве электролита в свинцово-кислотных аккумуляторах.
Инжир.8 Использование серной кислоты.
Удобрения
Безусловно, наибольшее количество серной кислоты используется для производства фосфорной кислоты, которая, в свою очередь, используется для производства фосфорных удобрений, дигидрофосфата кальция и фосфатов аммония. Он также используется для производства сульфата аммония, который является особенно важным удобрением при дефиците серы.
3.2 Промышленное чистящее средство
Серная кислота в больших количествах используется в черной металлургии и сталелитейной промышленности для удаления окисления, ржавчины и окалины с листового проката и заготовок перед их продажей автомобильной промышленности и промышленности по производству крупной бытовой техники. Перекись водорода (h3O2) может быть добавлена к серной кислоте для получения раствора пираньи, мощного, но очень токсичного очищающего раствора, с помощью которого можно очищать поверхности субстрата. Раствор Piranha обычно используется в микроэлектронной промышленности, а также в лабораторных условиях для очистки стеклянной посуды.
Перекись водорода (h3O2) может быть добавлена к серной кислоте для получения раствора пираньи, мощного, но очень токсичного очищающего раствора, с помощью которого можно очищать поверхности субстрата. Раствор Piranha обычно используется в микроэлектронной промышленности, а также в лабораторных условиях для очистки стеклянной посуды.
Рис.9 Раствор Пираньи
Обработка металлов
Он широко используется в обработке металлов, например, при производстве меди и цинка, а также для очистки поверхности стального листа, известного как «травление», перед тем, как он будет покрыт тонким слоем олова, используемого для изготовления банок. для продуктов питания.
Катализатор
Серная кислота может использоваться в качестве кислотных катализаторов во многих органических реакциях. Он охватывает нитрование бензола, гидратацию этена для производства этанола и реакции как для получения сложных эфиров, так и для их гидролиза в кислых условиях.
Электролит
Серная кислота действует как электролит в свинцово-кислотных аккумуляторах (свинцово-кислотный аккумулятор):
На аноде:
Pb + SO42−? PbSO4 + 2 е —
На катоде:
PbO2 + 4 H + + SO42− + 2 e−? PbSO4 + 2 h3O
Всего:
Pb + PbO2 + 4 H + + 2 SO42-? 2 PbSO4 + 2 h3O
Инжир.10 Свинцово-кислотный аккумулятор
Бытовое использование
Серная кислота в высоких концентрациях часто является основным ингредиентом кислотных очистителей канализации [9], которые используются для удаления жира, волос, папиросной бумаги и т. Д. Подобно их щелочным версиям, такие открыватели канализации могут растворять жиры и белки путем гидролиза. Кроме того, поскольку концентрированная серная кислота обладает сильным обезвоживающим свойством, она также может удалять папиросную бумагу в процессе обезвоживания. Поскольку кислота может бурно реагировать с водой, такие кислые открыватели стока следует добавлять в очищаемую трубу медленно.
Рис.11 Кислотный очиститель канализации
Прочее
Фторапатит обрабатывают 93% -ной серной кислотой для получения сульфата кальция, фтороводорода (HF) и фосфорной кислоты. HF удаляют в виде плавиковой кислоты. Общий процесс можно представить как:
Ca5F (PO4) 3 + 5 h3SO4 + 10 h3O → 5 CaSO4 • 2 h3O + HF + 3 h4PO4
Еще одно важное применение серной кислоты — это производство сульфата алюминия, также известного как квасцы для бумагоделателей.
2 AlO (OH) + 3 h3SO4 → Al2 (SO4) 3 + 4 h3O
Серная кислота также важна при производстве растворов красителей, пигментов и лекарств.Более того, серную кислоту можно использовать при переработке полезных ископаемых, нефтепереработке и очистке сточных вод.
Информация о токсичности
Уровень токсичности
Высокая токсичность
Острая токсичность
Орально-крыса LD50: 2140 мг / кг; Вдыхание — мышь LC50: 320 мг / м3 / 2 ч
Опасности
Опасности для здоровья
Разъедает все ткани тела. Вдыхание паров может вызвать серьезное повреждение легких.Попадание в глаза может привести к полной потере зрения. Контакт с кожей может вызвать тяжелый некроз. Смертельное количество для взрослого: от 1 чайной ложки до половины унции концентрированного химического вещества. Даже несколько капель могут быть смертельными, если кислота попадет в трахею. Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит и гастрит. Могут возникнуть перфорация желудка и перитонит, за которыми может последовать коллапс кровообращения. Циркуляторный шок часто является непосредственной причиной смерти. Пациенты с хроническими респираторными, желудочно-кишечными или нервными заболеваниями, а также с любыми глазными и кожными заболеваниями подвергаются большему риску.
Вдыхание паров может вызвать серьезное повреждение легких.Попадание в глаза может привести к полной потере зрения. Контакт с кожей может вызвать тяжелый некроз. Смертельное количество для взрослого: от 1 чайной ложки до половины унции концентрированного химического вещества. Даже несколько капель могут быть смертельными, если кислота попадет в трахею. Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит и гастрит. Могут возникнуть перфорация желудка и перитонит, за которыми может последовать коллапс кровообращения. Циркуляторный шок часто является непосредственной причиной смерти. Пациенты с хроническими респираторными, желудочно-кишечными или нервными заболеваниями, а также с любыми глазными и кожными заболеваниями подвергаются большему риску.
Опасность возгорания
Серная кислота обладает высокой реакционной способностью и способна воспламенить мелкодисперсные горючие материалы при контакте. При нагревании серная кислота выделяет высокотоксичные пары. Избегайте тепла; вода и органические материалы. Серная кислота взрывоопасна или несовместима с огромным количеством веществ. Может подвергаться резким химическим изменениям при повышенных температурах и давлении. Может бурно реагировать с водой. При нагревании серная кислота выделяет высокотоксичные пары. Опасная полимеризация может не произойти.
Избегайте тепла; вода и органические материалы. Серная кислота взрывоопасна или несовместима с огромным количеством веществ. Может подвергаться резким химическим изменениям при повышенных температурах и давлении. Может бурно реагировать с водой. При нагревании серная кислота выделяет высокотоксичные пары. Опасная полимеризация может не произойти.
Хранение и транспортировка
Серная кислота производится каталитическим окислением диоксида серы либо контактным способом, либо процессом свинцовой камеры, хотя контактный процесс в настоящее время является основным процессом, используемым для производства серной кислоты. Кислота, полученная при преобразовании триоксида серы в контактном процессе, является концентрированной (от 98 до 99%) и чистой. Поскольку безводную серную кислоту трудно транспортировать из-за ее высокой температуры замерзания, 10.При температуре 5 ° C (50 OF) серная кислота обычно поставляется с концентрацией 93,19%, которая обозначается как купоросное масло. Эта концентрация имеет низкую температуру замерзания -34 ° C (-29 OF) и не вызывает коррозии стальных контейнеров при обычных температурах.
Эта концентрация имеет низкую температуру замерзания -34 ° C (-29 OF) и не вызывает коррозии стальных контейнеров при обычных температурах.
В процессе со свинцовой камерой диоксид серы, кислород, водяной пар и оксиды азота смешиваются в больших камерах, облицованных свинцом, а жидкие продукты, стекающие с дна камер, называются кислотой камеры. Камерная кислота имеет концентрацию серной кислоты от 60 до 70% по массе и содержит значительные примеси.Он вступает в реакцию со стальными транспортными контейнерами и редко поставляется в больших количествах. Хотя готовятся более разбавленные кислоты, они должны транспортироваться в дорогих стеклянных бутылках. Камерная кислота может быть сконцентрирована до 77% путем испарения в кастрюлях, облицованных свинцом, и отправлена в районы, где допустима ее точка замерзания -10,8 ° C (12,6 ° F). В холодном климате концентрация может быть снижена до 76% для понижения точки замерзания. Серная кислота с концентрацией 76–78% не вызывает серьезной коррозии стальных цистерн и является экономичным источником суперфосфата для производства удобрений.
Информация об опасностях и безопасности
Категория: Коррозионные предметы
Классификация токсичности: высокотоксичный
Острая токсичность:
Орально-крыса LD50: 2140 мг / кг; Вдыхание — мышь LC50: 320 мг / м 3/2 ч
Данные стимуляции: Глаз кролика 5 мг / 30 с Тяжелые
Опасные свойства взрывчатых веществ: взорвался после контакта с водой; поддержка горения после столкновения с горючими веществами; реагирует с металлом с образованием легковоспламеняющегося взрывоопасного водорода
Огнеопасно опасного характера: сгорел после контакта с органическими веществами; выделять горючий водород после встречи с металлом
Характеристики хранения и транспортировки: вентиляция; низкая температура; сухой; хранить отдельно с органическими веществами, восстановителями и легковоспламеняющимися материалами
Огнетушащее вещество: диоксид углерода, сухой песок; запретить использование столбчатой воды
Профессиональный стандарт: TWA 1 мг / м3; СТЭЛ 3 мг / м3
Список литературы
http: // www. Essentialchemicalindustry.org/chemicals/sulfuric-acid.html
Essentialchemicalindustry.org/chemicals/sulfuric-acid.html
https://en.wikipedia.org/wiki/Sulfuric_acid#Uses
http://www.encyclopedia.com/science-and-technology/chemistry/compounds-and-elements/sulfuric-acid
http://www.qsstudy.com/chemistry/uses-sulphuric-acid
Химические свойства
Серная кислота представляет собой прозрачную маслянистую жидкость без цвета и запаха. это
очень коррозийный и имеет большое сродство к воде.
USP32 – NF27 указывает, что серная кислота содержит не менее
от 95% до 98% по массе h3SO4; в
остаток — вода.
Химические свойства
прозрачная бесцветная маслянистая жидкость; впитывает влагу из атмосферы; может обугливать органические материалы, например сахар; смешивается с водой, выделяет тепло; энтальпия плавления 10,71 кДж / моль; удельная проводимость 1,044 × 10? 2 при 25 ° C; диэлектрическая проницаемость 110 при 20 ° C [MER06] [COT88] [CRC10]
Химические свойства
Серная кислота представляет собой маслянистую жидкость от бесцветного до темно-коричневого цвета без запаха, которая продается в коммерческих целях с содержанием h3SO4 от 93% до 98%, остальное — вода.
История
Серная кислота — это бесцветная, маслянистая, плотная жидкость, которая является одним из важнейших промышленных химикатов. Ежегодно в США производится более 40 миллионов тонн, а во всем мире производится около 170 миллионов тонн. Серная кислота имеет долгую историю и была впервые произведена древними алхимиками. Его открытие приписывают персидскому врачу Мохаммаду ибн Закария ар-Рази (Разес, 854 925), который получил серную кислоту путем сухой перегонки минералов.Сухая перегонка обычно включает нагревание вещества в закрытом контейнере для ограничения содержания кислорода и горения. Когда вещество нагревается, оно разлагается, и летучие компоненты могут улавливаться. Поскольку серная кислота была получена при перегонке минералов, ее называют минеральной кислотой. Древний метод производства серной кислоты включал нагревание либо гептагидрата сульфата железа (II) (FeSO4 7h3O), который назывался зеленым купоросом, либо пентагидрата сульфата меди (II) (CuSO4 5h3O), называемого голубым купоросом. Когда минералы, содержащие эти соединения, нагревали, продукты включали триоксид серы (SO3) и воду. Комбинация триоксида серы и воды дает серную кислоту: SO3 (г) + h3O (л) h3SO4 (водн.). Производство серной кислоты из природных минералов, называемых купоросами, и его маслянистый вид привели к тому, что серная кислота получила общее название — масло купороса.
Когда минералы, содержащие эти соединения, нагревали, продукты включали триоксид серы (SO3) и воду. Комбинация триоксида серы и воды дает серную кислоту: SO3 (г) + h3O (л) h3SO4 (водн.). Производство серной кислоты из природных минералов, называемых купоросами, и его маслянистый вид привели к тому, что серная кислота получила общее название — масло купороса.
Использует
Серная кислота является ведущим химическим веществом в мире с точки зрения производства и потребления. Он используется в производстве фосфорных удобрений, красителей, взрывчатых веществ, клеев и ряда сульфатов.Он также используется для очистки нефти, очистки стальных поверхностей (травление металлов) и в качестве обезвоживающего агента. Коммерчески продаваемый концентрированный h3SO4 содержит 98% кислоты с оставшейся водой; нормальность 36.
Использует
Сильные туманы неорганических кислот, содержащие серную кислоту, сами по себе не используются в промышленности или в коммерческих продуктах, а образуются как из природных, так и из промышленных источников. В частности, туманы серной кислоты могут образовываться во время производства или использования серной кислоты, триоксида серы или олеума.Триоксид серы в основном используется для производства серной кислоты, но он также используется в качестве сульфирующего или окисляющего агента. Олеум используется как сульфирующий или дегидратирующий агент, при переработке нефти и как лабораторный реагент. Серная кислота — одно из наиболее широко используемых промышленных химикатов; однако большая его часть используется как реагент, а не как ингредиент. Следовательно, большая часть используемой серной кислоты оказывается отработанной кислотой или сульфатными отходами. Высокие степени чистоты требуются для использования в аккумуляторных батареях, а также для производства вискозы, красок и фармацевтической промышленности.Серные кислоты, используемые в сталелитейной, химической промышленности и производстве удобрений, имеют менее строгие стандарты (IARC 1992b, ATSDR 1998, HSDB 2009).
В частности, туманы серной кислоты могут образовываться во время производства или использования серной кислоты, триоксида серы или олеума.Триоксид серы в основном используется для производства серной кислоты, но он также используется в качестве сульфирующего или окисляющего агента. Олеум используется как сульфирующий или дегидратирующий агент, при переработке нефти и как лабораторный реагент. Серная кислота — одно из наиболее широко используемых промышленных химикатов; однако большая его часть используется как реагент, а не как ингредиент. Следовательно, большая часть используемой серной кислоты оказывается отработанной кислотой или сульфатными отходами. Высокие степени чистоты требуются для использования в аккумуляторных батареях, а также для производства вискозы, красок и фармацевтической промышленности.Серные кислоты, используемые в сталелитейной, химической промышленности и производстве удобрений, имеют менее строгие стандарты (IARC 1992b, ATSDR 1998, HSDB 2009).
Серная кислота используется в следующих отраслях: производство удобрений, нефтепереработка, горнодобывающая и металлургическая промышленность, переработка руды, неорганические и органические химические вещества, синтетический каучук и пластмассы, целлюлоза и бумага, мыло и моющие средства, очистка воды, целлюлозные волокна и пленки, а также неорганические пигменты. и краски. От 60% до 70% серной кислоты, используемой в Соединенных Штатах, используется в производстве удобрений для преобразования фосфоритной руды в фосфорную кислоту.На все другие виды индивидуального использования приходится от менее 1% до менее 10% от общего потребления. В некоторых отраслях промышленности использование серной кислоты сокращается. В сталелитейной промышленности наблюдается тенденция к использованию соляной кислоты вместо серной при травлении, а фтористоводородная кислота заменила серную кислоту в некоторых случаях применения в нефтяной промышленности. Основным потребительским товаром, содержащим серную кислоту, является свинцово-кислотная батарея; однако это составляет небольшую долю от общего использования. Серная кислота также используется в качестве пищевой добавки общего назначения (IARC 1992b, ATSDR 1998).
и краски. От 60% до 70% серной кислоты, используемой в Соединенных Штатах, используется в производстве удобрений для преобразования фосфоритной руды в фосфорную кислоту.На все другие виды индивидуального использования приходится от менее 1% до менее 10% от общего потребления. В некоторых отраслях промышленности использование серной кислоты сокращается. В сталелитейной промышленности наблюдается тенденция к использованию соляной кислоты вместо серной при травлении, а фтористоводородная кислота заменила серную кислоту в некоторых случаях применения в нефтяной промышленности. Основным потребительским товаром, содержащим серную кислоту, является свинцово-кислотная батарея; однако это составляет небольшую долю от общего использования. Серная кислота также используется в качестве пищевой добавки общего назначения (IARC 1992b, ATSDR 1998).
Использует
Серная кислота — это подкислитель, который представляет собой прозрачную жидкость без цвета и запаха.
с большой любовью к воде. его получают путем реакции диоксида серы
его получают путем реакции диоксида серы
кислородом и смешиванием полученного триоксида серы с водой, или
за счет реакции оксида азота с диоксидом серы в воде. это очень кор-
розовое. он используется как модификатор пищевого крахмала и используется в карамели
производство и в алкогольных напитках.
Использует
Серную кислоту также называют купоросным маслом, эта бесцветная маслянистая жидкость была произведена
обжиг пирита или серы в свинцовой печи.Серная кислота была
смешанный с азотной кислотой или нитратом калия для лечения
хлопок при производстве нитроцеллюлозы. Нитроцеллюлоза была
затем растворяют в эфире и спирте для получения коллодия.
Использует
Фармацевтическое средство (подкисляющий агент).
Определение
Серная кислота, h3S04, также известная как купоросное масло и кислота для окунания, представляет собой бесцветную, токсичную маслянистую жидкость. При смешивании концентрированной серной кислоты и воды выделяется большое количество тепла; поэтому кислоту всегда следует добавлять в воду с Достаточное перемешивание, чтобы предотвратить разбрызгивание и кипение. Серная кислота имеет сильное притяжение к воде и образует четыре кристаллогидрата. Это сродство к воде делает серную кислоту эффективным осушающим агентом для таких газов, как водород, кислород, азот и углекислый газ, но приводит к обугливанию органических соединений, содержащих углерод, водород и кислород, таких как целлюлоза, сахар, бумага и древесина. . Серная кислота участвует в двух типах реакций окисления. Одна из них — типичная реакция сильной кислоты, которая зависит от окислительной способности иона водорода, например, реакция активного металла с разбавленной кислотой с образованием водорода.Серная кислота является сильным электролитом и используется в гальванических ваннах, для травления и других операций при производстве чугуна и стали. Во втором типе реакции окисления сульфатная часть молекулы реагирует с образованием кислых сульфатов или бисульфатов и нормальных сульфатов. Серная кислота используется в производстве удобрений, органических пигментов, взрывчатых веществ, вискозы и пленки, серная кислота имеет низкую летучесть, свойство, используемое при производстве летучих кислот, таких как азотная, соляная и фтористоводородная, где летучая кислота испаряется.
Серная кислота имеет сильное притяжение к воде и образует четыре кристаллогидрата. Это сродство к воде делает серную кислоту эффективным осушающим агентом для таких газов, как водород, кислород, азот и углекислый газ, но приводит к обугливанию органических соединений, содержащих углерод, водород и кислород, таких как целлюлоза, сахар, бумага и древесина. . Серная кислота участвует в двух типах реакций окисления. Одна из них — типичная реакция сильной кислоты, которая зависит от окислительной способности иона водорода, например, реакция активного металла с разбавленной кислотой с образованием водорода.Серная кислота является сильным электролитом и используется в гальванических ваннах, для травления и других операций при производстве чугуна и стали. Во втором типе реакции окисления сульфатная часть молекулы реагирует с образованием кислых сульфатов или бисульфатов и нормальных сульфатов. Серная кислота используется в производстве удобрений, органических пигментов, взрывчатых веществ, вискозы и пленки, серная кислота имеет низкую летучесть, свойство, используемое при производстве летучих кислот, таких как азотная, соляная и фтористоводородная, где летучая кислота испаряется. когда одна из его солей нагревается с серной кислотой.
когда одна из его солей нагревается с серной кислотой.
Методы производства
Серная кислота может быть получена промышленным способом либо контактным способом, либо камерным способом.
Связаться с процессом
2SO 2 + O 2 → 2SO 3
SO 3 + H 2 O → H 2 SO 4
Камерный процесс
2НО + O 2 → 2НО 2
НЕТ 2 + SO 2 + H 2 O → H 2 SO 4 + NO
Реакции воздуха и воды
Реакция с водой незначительна, если концентрация кислоты не превышает 80-90%, тогда тепло от гидролиза является очень сильным, может вызвать серьезные ожоги [Merck, 11-е изд.1989]. Во время сульфирования мононитробензола дымящей серной кислотой утечка из внутреннего охлаждающего змеевика позволила воде попасть в реакционный резервуар. Сильное извержение произошло из-за высокой температуры раствора [История болезни MCA 944, 1963].
Профиль реактивности
Серная кислота сильно кислая. Интенсивно Реагирует с пентафторидом брома [Mellor 2 Supp. 1: 172 1956]. Взрывался пара-нитротолуолом при 80 ° C [Chem. Англ. News 27: 2504]. Взрыв произошел при смешивании концентрированной серной кислоты с кристаллическим перманганатом калия в сосуде, содержащем влагу.Образовался гептоксид марганца, который взрывается при 70 ° C [Delhez 1967]. Смесь акрилонитрила с концентрированной серной кислотой необходимо держать хорошо охлажденной, в противном случае происходит интенсивная экзотермическая реакция [Chem. Паспорт безопасности SD-31: 8. 1949]. Смешивание серной кислоты (96%) в равных частях с любым из следующих веществ в закрытом контейнере вызывает повышение температуры и давления: ацетонитрил, акролеин, 2-аминоэтанол, гидроксид аммония (28%), анилин, н-бутиральдегид, хлорсульфоновая кислота. кислота, этилендиамин, этиленимин, эпихлоргидрин, этиленциангидрин, соляная кислота (36%), фтористоводородная кислота (48. 7%), пропиолактон, оксид пропилена, гидроксид натрия, мономер стирола [NFPA 1991]. Серная кислота (концентрированная) чрезвычайно опасна при контакте с карбидами, броматами, хлоратами, фульминатами, пикратами и порошками металлов [Haz. Chem. Данные 1966 г.]. Аллилхлорид может бурно полимеризоваться в условиях с участием кислотного катализатора, такого как серная кислота [Ventrone 1971]. Экзотермическая реакция с гипохлоритом натрия с образованием газообразного хлора. При смешивании хлорсерной кислоты и 98% серной кислоты может выделяться HCl [Subref: Anon, Loss Prev.Бык. 1977, (013), 2-3]. Иодид цинка бурно реагирует с h3SO4. (Паскаль, 1962, т. 5, 168).
7%), пропиолактон, оксид пропилена, гидроксид натрия, мономер стирола [NFPA 1991]. Серная кислота (концентрированная) чрезвычайно опасна при контакте с карбидами, броматами, хлоратами, фульминатами, пикратами и порошками металлов [Haz. Chem. Данные 1966 г.]. Аллилхлорид может бурно полимеризоваться в условиях с участием кислотного катализатора, такого как серная кислота [Ventrone 1971]. Экзотермическая реакция с гипохлоритом натрия с образованием газообразного хлора. При смешивании хлорсерной кислоты и 98% серной кислоты может выделяться HCl [Subref: Anon, Loss Prev.Бык. 1977, (013), 2-3]. Иодид цинка бурно реагирует с h3SO4. (Паскаль, 1962, т. 5, 168).
Опасность
Сильно раздражает ткани. Легочная функция
ингибитор. Подтвержденный канцероген.
Опасность для здоровья
Разъедает все ткани тела. Вдыхание паров может вызвать серьезное повреждение легких. Попадание в глаза может привести к полной потере зрения. Контакт с кожей может вызвать тяжелый некроз. Смертельное количество для взрослого: от 1 чайной ложки до половины унции концентрированного химического вещества.Даже несколько капель могут быть смертельными, если кислота попадет в трахею. Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит и гастрит. Могут возникнуть перфорация желудка и перитонит, за которыми может последовать коллапс кровообращения. Циркуляторный шок часто является непосредственной причиной смерти. Пациенты с хроническими респираторными, желудочно-кишечными или нервными заболеваниями, а также с любыми глазными и кожными заболеваниями подвергаются большему риску.
Смертельное количество для взрослого: от 1 чайной ложки до половины унции концентрированного химического вещества.Даже несколько капель могут быть смертельными, если кислота попадет в трахею. Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит и гастрит. Могут возникнуть перфорация желудка и перитонит, за которыми может последовать коллапс кровообращения. Циркуляторный шок часто является непосредственной причиной смерти. Пациенты с хроническими респираторными, желудочно-кишечными или нервными заболеваниями, а также с любыми глазными и кожными заболеваниями подвергаются большему риску.
Опасность для здоровья
Концентрированная серная кислота — это очень едкая жидкость, которая может вызвать серьезные глубокие ожоги при контакте с кожей.Концентрированная кислота разрушает ткани из-за своего обезвоживающего действия, а разбавленная H 2 SO 4 действует как раздражитель кожи из-за своего кислотного характера. Попадание в глаза концентрированного h3SO4 вызывает серьезные ожоги, которые могут привести к необратимой потере зрения; контакт с разбавленным h3SO4 приводит к более кратковременным эффектам, от которых восстановление может быть полным. Туман серной кислоты сильно раздражает глаза, дыхательные пути и кожу. Из-за низкого давления паров основная опасность при вдыхании серной кислоты связана с вдыханием кислотного тумана, что может привести к раздражению верхних дыхательных путей и эрозии поверхностей зубов.Более высокие уровни воздействия при вдыхании могут привести к временному раздражению легких с затрудненным дыханием. Проглатывание серной кислоты может вызвать сильные ожоги слизистых оболочек рта и пищевода. Испытания на животных с серной кислотой не продемонстрировали канцерогенных, мутагенных, эмбриотоксических или репродуктивных эффектов. Хроническое воздействие тумана серной кислоты может привести к бронхиту, поражениям кожи, конъюнктивиту и эрозии зубов.
Туман серной кислоты сильно раздражает глаза, дыхательные пути и кожу. Из-за низкого давления паров основная опасность при вдыхании серной кислоты связана с вдыханием кислотного тумана, что может привести к раздражению верхних дыхательных путей и эрозии поверхностей зубов.Более высокие уровни воздействия при вдыхании могут привести к временному раздражению легких с затрудненным дыханием. Проглатывание серной кислоты может вызвать сильные ожоги слизистых оболочек рта и пищевода. Испытания на животных с серной кислотой не продемонстрировали канцерогенных, мутагенных, эмбриотоксических или репродуктивных эффектов. Хроническое воздействие тумана серной кислоты может привести к бронхиту, поражениям кожи, конъюнктивиту и эрозии зубов.
Опасность для здоровья
Концентрированная серная кислота — это очень едкая жидкость, которая может вызвать серьезные глубокие ожоги тканей.Он может проникать через кожу и вызывать некроз тканей. Эффект может быть похож на термический ожог. Попадание в глаза может вызвать необратимую потерю зрения.
Попадание в глаза может вызвать необратимую потерю зрения.
Вдыхание его паров или тумана может вызвать сильное сужение бронхов. Поскольку давление паров серной кислоты незначительно, 3 в воздухе вызывает кашель. При концентрации 3 раздражения не было. Хроническое воздействие тумана с серной кислотой может вызвать бронхит, конъюнктивит, поражения кожи и эрозию зубов. Частый контакт с разбавленной кислотой может вызвать дерматит кожи.
Величина ЛД50, перорально (крысы): 2140 мг / кг
Величина ЛК50, вдыхание (крысы): 510 мг / м 3 /2 ч.
Пожарная опасность
Серная кислота негорючая, но может вызвать воспламенение мелкодисперсных горючих веществ. Серная кислота реагирует с большинством металлов, особенно в разбавленном виде, с образованием горючего и потенциально взрывоопасного газообразного водорода.
Пожарная опасность
Серная кислота обладает высокой реакционной способностью и способна воспламенить мелкодисперсные горючие материалы при контакте.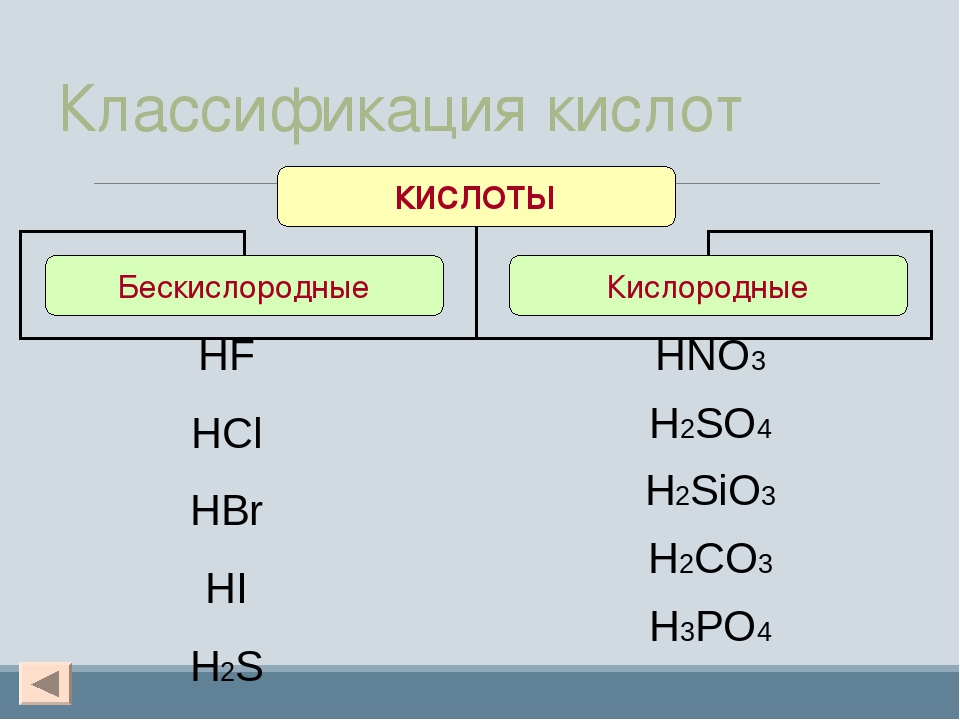 При нагревании серная кислота выделяет высокотоксичные пары. Избегайте тепла; вода и органические материалы. Серная кислота взрывоопасна или несовместима с огромным количеством веществ. Может подвергаться резким химическим изменениям при повышенных температурах и давлении. Может бурно реагировать с водой. При нагревании серная кислота выделяет высокотоксичные пары. Опасная полимеризация может не произойти.
При нагревании серная кислота выделяет высокотоксичные пары. Избегайте тепла; вода и органические материалы. Серная кислота взрывоопасна или несовместима с огромным количеством веществ. Может подвергаться резким химическим изменениям при повышенных температурах и давлении. Может бурно реагировать с водой. При нагревании серная кислота выделяет высокотоксичные пары. Опасная полимеризация может не произойти.
Воспламеняемость и взрывоопасность
Серная кислота негорючая, но может образовывать мелкодисперсные горючие вещества.
зажечь.Серная кислота реагирует с большинством металлов, особенно в разбавленном виде, с образованием
легковоспламеняющийся и потенциально взрывоопасный водород.
Применение в фармацевтике
Серная кислота используется в качестве подкисляющего агента в различных
фармацевтические и пищевые препараты. Его также можно использовать для
приготовить разбавленную серную кислоту, которая, помимо использования в качестве
вспомогательное вещество, имеет терапевтическое применение для лечения желудочного
пониженная кислотность, как вяжущее средство при диарее или для стимуляции аппетита. Серная кислота использовалась парентерально, перорально, местно и
Серная кислота использовалась парентерально, перорально, местно и
офтальмологические фармацевтические составы.
Промышленное использование
Серная кислота (H 2 SO 4 ) является наиболее широко используемой кислотой для контроля pH при флотации минералов.
Серную кислоту можно производить несколькими способами, включая сжигание чистой
сера, обжиг пирита и извлечение дымового газа SO 2 в плавильном заводе.
Серная кислота — это бесцветная или янтарная, слегка мутная маслянистая жидкость со специфическим
гравитация 1.84 при 95% прочности.
При флотации минералов серная кислота используется практически во всех областях, связанных с кислотным pH.
контроль. Он также используется в качестве химиката для предварительной обработки пульпы во время флотации оксидных и
промышленные полезные ископаемые. Предварительная обработка пульпы серной кислотой улучшает флотацию ильменита,
перовскит, фенакит, берилл и другие минералы.
Профиль безопасности
Подозрение на канцероген для человека при содержании в сильном неорганическом тумане. Человеческий яд. Экспериментальный яд при вдыхании.Умеренно токсичен при проглатывании. Сильный раздражитель глаз. Чрезвычайно раздражающий, разъедающий и токсичный для тканей, приводящий к быстрому разрушению тканей, вызывая тяжелые ожоги. Если поражена большая часть кожи, воздействие сопровождается шоком, коллапсом и симптомами, аналогичными тем, которые наблюдаются при тяжелых ожогах. Повторный контакт с разбавленными растворами может вызвать дерматит, а повторное или продолжительное вдыхание тумана серной кислоты может вызвать воспаление верхних дыхательных путей, что приведет к хроническому бронхиту.Чувствительность к серной кислоте, ее туманам или парам зависит от человека. Обычно 0,125–0,50 частей на миллион может слегка раздражать, 1,5–2,5 частей на миллион может быть определенно неприятным, а 10-20 частей на миллион — невыносимым. Рабочие, подвергающиеся воздействию пара низкой концентрации, постепенно теряют чувствительность к его раздражающему действию. Вдыхание концентрированного пара или тумана горячей кислоты или олеума может вызвать быструю потерю сознания с серьезным повреждением легочной ткани. Тяжелое воздействие может вызвать химический пневмонит; эрозия зубов из-за воздействия сильных кислотных паров была восстановлена в промышленности.Экспериментальный тератоген. Это очень мощный кислотный окислитель, который может воспламениться или взорваться при контакте со многими материалами, например, уксусной кислотой, ацетонциангидрином, (ацетон + HNO3), (ацетон + K2Cr207), ацетонитрил, акролеин, акрилонитрил, (акрилонитрил). + h30), (спирты + h3O2), аллиловый спирт, аллилхлорид, Nh5OH, 2-аминоэтанол, Nh5, триперхромат, anhe, (броматы + металлы), BrF5, н-бутиральдегид, карбиды, CoHC2, хлораты, (металлы + хлораты), ClF3, хлорсульфоновая кислота, Cu3N, диизобутилен, (диметилбензилкарбинол + h304, эпихлоргидрин, этиленциангидрин, этилендиамин, этиленгликоль, этиленимин, фульминаты, HCl, h3, IF7, (инден + HNO3), Fe, изопрен, LisSiz, Hg3N2, оксид мезитила, металлы, (HNO3 + глицериды), п-нитротолуол, перхлораты, HClO4, (C6H6 + перманганаты), тригидроксидиаминофосфат пентасеребря, (1-фенил-2-метилпропиловый спирт + h3O2), P, (OCN) 3, пикраты, третбутоксид калия, KClO3, KMnO4 + KCl), (KMnO4 + h3O), п-пропиолактон, RbHC2, пропил оксид ена, пиридин, Na, Na2CO3, NaOH, сталь, мономер стирола, вода, винилацетат, (HNO3 + толуол).При нагревании выделяет высокотоксичные пары; wdl реагирует с водой или паром с выделением тепла; может реагировать с окислителями или восстановителями. При нагревании до разложения выделяет токсичные пары SOX. См. Также СУЛЬФАТЫ.
Человеческий яд. Экспериментальный яд при вдыхании.Умеренно токсичен при проглатывании. Сильный раздражитель глаз. Чрезвычайно раздражающий, разъедающий и токсичный для тканей, приводящий к быстрому разрушению тканей, вызывая тяжелые ожоги. Если поражена большая часть кожи, воздействие сопровождается шоком, коллапсом и симптомами, аналогичными тем, которые наблюдаются при тяжелых ожогах. Повторный контакт с разбавленными растворами может вызвать дерматит, а повторное или продолжительное вдыхание тумана серной кислоты может вызвать воспаление верхних дыхательных путей, что приведет к хроническому бронхиту.Чувствительность к серной кислоте, ее туманам или парам зависит от человека. Обычно 0,125–0,50 частей на миллион может слегка раздражать, 1,5–2,5 частей на миллион может быть определенно неприятным, а 10-20 частей на миллион — невыносимым. Рабочие, подвергающиеся воздействию пара низкой концентрации, постепенно теряют чувствительность к его раздражающему действию. Вдыхание концентрированного пара или тумана горячей кислоты или олеума может вызвать быструю потерю сознания с серьезным повреждением легочной ткани. Тяжелое воздействие может вызвать химический пневмонит; эрозия зубов из-за воздействия сильных кислотных паров была восстановлена в промышленности.Экспериментальный тератоген. Это очень мощный кислотный окислитель, который может воспламениться или взорваться при контакте со многими материалами, например, уксусной кислотой, ацетонциангидрином, (ацетон + HNO3), (ацетон + K2Cr207), ацетонитрил, акролеин, акрилонитрил, (акрилонитрил). + h30), (спирты + h3O2), аллиловый спирт, аллилхлорид, Nh5OH, 2-аминоэтанол, Nh5, триперхромат, anhe, (броматы + металлы), BrF5, н-бутиральдегид, карбиды, CoHC2, хлораты, (металлы + хлораты), ClF3, хлорсульфоновая кислота, Cu3N, диизобутилен, (диметилбензилкарбинол + h304, эпихлоргидрин, этиленциангидрин, этилендиамин, этиленгликоль, этиленимин, фульминаты, HCl, h3, IF7, (инден + HNO3), Fe, изопрен, LisSiz, Hg3N2, оксид мезитила, металлы, (HNO3 + глицериды), п-нитротолуол, перхлораты, HClO4, (C6H6 + перманганаты), тригидроксидиаминофосфат пентасеребря, (1-фенил-2-метилпропиловый спирт + h3O2), P, (OCN) 3, пикраты, третбутоксид калия, KClO3, KMnO4 + KCl), (KMnO4 + h3O), п-пропиолактон, RbHC2, пропил оксид ена, пиридин, Na, Na2CO3, NaOH, сталь, мономер стирола, вода, винилацетат, (HNO3 + толуол).При нагревании выделяет высокотоксичные пары; wdl реагирует с водой или паром с выделением тепла; может реагировать с окислителями или восстановителями. При нагревании до разложения выделяет токсичные пары SOX. См. Также СУЛЬФАТЫ.
Безопасность
Серная кислота широко используется в различных фармацевтических
составы. Хотя концентрированная серная кислота очень агрессивна,
он обычно используется в составах в хорошо разведенном виде. Концентрированный
серная кислота бурно реагирует с водой и выделяет много тепла.
сгенерировано.При разбавлении серной кислоты кислота всегда должна быть
добавлен к другой жидкости с большой осторожностью.
Концентрированный раствор чрезвычайно агрессивен и может вызвать
серьезные повреждения или некроз при попадании в глаза и на кожу.
Проглатывание может привести к серьезным травмам или смерти. Вдыхание
концентрированные пары могут вызвать серьезное повреждение легких.
LD50 (крыса, перорально): 2,14 г / кг
Возможное воздействие
Используется как химическое сырье при производстве уксусной кислоты, соляной кислоты; лимонная кислота; фосфорная кислота; сульфат алюминия; сульфат аммония, сульфат бария; сульфат меди; фенол, суперфосфаты, диоксид титана; а также синтетические удобрения, нитратные взрывчатые вещества; искусственные волокна; красители, фармацевтические препараты, моющие средства, клей, краска и бумага.Он находит применение в качестве дегидратирующего агента для сложных и простых эфиров из-за его высокого сродства к воде; как электролит в аккумуляторных батареях; для гидролиза целлюлозы с получением глюкозы; при рафинировании минерального и растительного масла; и в кожевенной промышленности. Другие виды использования включают переработку меха и пищевых продуктов; карбонизация шерстяных тканей; осушка газа; извлечение урана из урана; и лабораторный анализ. Серная кислота — одно из самых производимых химических веществ в Соединенных Штатах.
Канцерогенность
Сильные туманы неорганической кислоты, содержащие серную кислоту, известны как канцерогены для человека на основании достаточных доказательств канцерогенности.
из исследований на людях.
хранилище
Серная кислота устойчива, но очень агрессивна и гигроскопична. Так и будет
извлекать влагу из атмосферы. Серную кислоту следует хранить
в плотно закрытой таре во взрывозащищенной зоне. Контейнеры
следует хранить вдали от прямых солнечных лучей и источников тепла. Избегать
тепло и влага. Изолировать от несовместимых материалов.
хранилище
Защитные очки и резиновые перчатки следует надевать, когда
работы с этой кислотой, а емкости с серной кислотой следует хранить в хорошо вентилируемом
место, отдельно от органических веществ и других горючих материалов.
материалы.Емкости с серной кислотой следует хранить во вторичных пластиковых лотках, чтобы
Избегайте коррозии металлических полок для хранения из-за капель или разливов. Вода никогда не должна
добавляется к серной кислоте, так как это может привести к разбрызгиванию; всегда добавляйте кислоту в воду
Доставка
UN1830 Серная кислота с содержанием кислоты 51% или серная кислота с содержанием кислоты не более 51%, Класс опасности: 8; Этикетки: 8-Коррозийный материал. UN1831 Кислота серная дымящая с 30% или более свободного триоксида серы и Серная кислота дымящая с free 30% свободного триоксида серы, Класс опасности: 8; Этикетки: 8-Коррозийный материал.UN1832 Кислота серная отработанная, Класс опасности: 8; Этикетки: 8-Коррозийный материал.
Методы очистки
Серную кислоту, а также 30% дымящую h3SO4 можно перегонять в системе, полностью состоящей из пирекса, необязательно из персульфата калия. Он был очищен фракционной кристаллизацией моногидрата из жидкости. Обладает очень сильным обезвоживающим действием и воздействует на кожу — немедленно смойте холодной водой; в противном случае на коже могут остаться рубцы на всю жизнь. Он очень гигроскопичен и использовался в качестве осушителя в эксикаторах.Разбавление с помощью h3O очень экзотермично, и поскольку концентрированная кислота намного более плотная, чем h3O, ее разбавляют, пропуская концентрированную кислоту по стенке емкости с h3O при медленном перемешивании при одновременном охлаждении внешней стороны емкости. Если эти меры не будут приняты, h3O может сильно закипеть.
Несовместимость
Сильная кислота и окислитель. Реагирует бурно с водой с опасным разбрызгиванием и выделением тепла. Реагирует бурно с горючими материалами и восстановителями; основы, органические материалы; хлораты, карбиды, пикраты, фульминаты, вода, порошки металлов.Разъедает большинство металлов, образуя взрывоопасный водород.
Несовместимость
Избегайте хранения в непосредственной близости от воды, наиболее распространенных металлов,
органические материалы, сильные восстановители, горючие материалы,
сильные основания, карбонаты, сульфиды, цианиды, сильные окислители,
и карбиды.
Серная кислота является мощным окислителем и может воспламениться или взорваться на
контактировать со многими материалами.
Он может бурно реагировать с выделением большого количества
нагревать.Оксиды серы и водорода могут образовываться во время
реакции.
При смешивании с другими жидкостями необходимо соблюдать особую осторожность.
Всегда с большой осторожностью добавляйте в разбавитель серную кислоту.
Вывоз мусора
Медленно добавить к раствору кальцинированной соды и гашеной извести при перемешивании; промойте в канализацию большим количеством воды. Рекуперация и повторное использование отработанной серной кислоты может быть жизнеспособной альтернативой утилизации, и существуют соответствующие процессы.
Нормативный статус
ГРАС внесен в список.Принято к применению в качестве пищевой добавки в Европе.
Включен в базу данных неактивных ингредиентов FDA (IM, IV и IP
инъекции, ингаляционные растворы, ирригационные растворы, назальные, офтальмологические
растворы и суспензии, растворы для перорального применения и эмульсии для местного применения
и кремы). Входит в состав непарентеральных и парентеральных препаратов
лицензирован в Европе. Включен в Канадский список приемлемых
Немедикаментозные ингредиенты.
Конвенция Организации Объединенных Наций о борьбе с незаконным оборотом
«Наркотические средства и психотропные вещества» (1988) перечисляет серные
кислота как химическое вещество, часто используемое при незаконном изготовлении
наркотические средства или психотропные вещества.В США серная
кислота включена в список основных химических веществ или химических веществ-прекурсоров
создана в соответствии с Законом об утечке и незаконном обороте химических веществ.
Соответственно, операции с серной кислотой, такие как импорт, экспорт,
продажи и передачи подлежат регулированию и контролю со стороны
Отдел по борьбе с наркотиками.
Продукты и сырье для получения серной кислоты
Сырье
Препараты
Серная кислота Формула — использование серной кислоты, свойства, структура и формула
Формула и структура: Химическая формула серной кислоты H 2 SO 4 , а ее молекулярный вес 98.079 г / моль. Его химическая структура показана ниже. Атом серы связан с двумя атомами кислорода двойными связями и двумя гидроксильными группами (ОН) одинарными связями. Это дипротонная кислота, так как она может выделять два протона.
Прохождение: Серная кислота образуется естественным путем в результате окисления сульфидных минералов в горных породах. Разбавленная серная кислота также образуется в атмосфере в результате окисления диоксида серы (в результате сжигания топлива) в присутствии влаги, в конечном итоге выпадая в виде «кислотного дождя».
Получение: Серную кислоту коммерчески получают реакцией воды с триоксидом серы.
SO 3 + H 2 O → H 2 SO 4
Триоксид серы (SO 3 ) образуется в результате реакции диоксида серы и кислорода, катализируемой оксидом ванадия, в процессе контактного или камерного процесса.
Физические свойства: H 2 SO 4 представляет собой бесцветную или слегка желтоватую вязкую жидкость с резким запахом.Он имеет плотность 1,84 г / мл, температуру кипения 337 ° C и точку плавления 10 ° C. «Концентрированная» серная кислота на 98% находится в воде и является наиболее стабильной формой. Многие другие концентрации с другими названиями доступны для различных целей. Аккумуляторная кислота составляет 29–32%, камерная кислота — 62–70%, а кислотная — 78–80%.
Химические свойства: Серная кислота — очень сильная дипротонная кислота. Он гигроскопичен и легко впитывает влагу из воздуха. Это мощный окислитель, вступающий в реакцию со многими металлами при высоких температурах.Концентрированный H 2 SO 4 также является сильным дегидратирующим агентом. Добавление воды к концентрированной серной кислоте является очень экзотермической реакцией и может привести к взрывам.
Области применения: Серная кислота имеет множество применений в различных отраслях промышленности, таких как переработка полезных ископаемых, нефтепереработка, производство удобрений, очистка сточных вод и т. Д. Она также используется в производстве чистящих средств, красителей, пигментов, лекарств, моющих средств и взрывчатых веществ. Обычно он используется в качестве электролита в свинцово-кислотных аккумуляторах.
Опасность для здоровья / воздействие на здоровье: Концентрированный H 2 SO 4 очень едкий и может серьезно повредить ткани при контакте. Как сильная кислота, окислитель, коррозионный агент и дегидратирующий агент, он более опасен, чем другие минеральные кислоты. При контакте с кожей вызывает сильные химические ожоги. Попадание в глаза может привести к необратимым повреждениям и слепоте. Проглатывание кислоты может даже привести к смерти.
h3SO4 Структура Льюиса, молекулярная геометрия и гибридизация
h3SO4 представляет собой химическую формулу серной кислоты, которая широко известна как масло купороса.Это минеральная кислота, состоящая из таких элементов, как кислород, водород и сера. Он имеет молекулярную массу 98,079 г / моль. h3SO4 действует как окислитель и дегидратирующий агент. Кроме того, он дипротический по своей природе, который обладает способностью высвобождать два протона вместе.
Бесцветный, без запаха и чрезвычайно коррозийный по своей природе. Он имеет широкий спектр промышленных применений, также используется в нефтепереработке для вымывания примесей из продуктов нефтепереработки. Чтобы понять его структуру, форму и полярность, продолжайте читать статью.
Свойства серной кислоты
| h3SO4 | Серная кислота |
| Молекулярная масса / молярная масса | 98,079 г / моль |
| Плотность | 1,84 г / см³ |
| Температура кипения | 337 ° С |
| Точка плавления | 10 ° С |
Что такое структура Льюиса?
Структуры Льюиса, широко известные как точечные диаграммы Льюиса или электронные точечные диаграммы, представляют собой электроны валентной оболочки в молекуле, в которых электроны показаны точками.
Это полезно знать о геометрии молекул.
Почему важна структура Льюиса?
Они играют жизненно важную роль в предсказании типа и количества связей, которые могут образоваться вокруг атома.
Рисование структуры Льюиса — это первый шаг к предсказанию трехмерной формы молекул.
Это дополнительно помогает понять, как атомы связываются, физические свойства молекулы, а также играет важную роль в том, как биологические молекулы взаимодействуют друг с другом.
Шаги для рисования точечной структуры Льюиса
При рисовании точечной структуры Льюиса для любой химической формулы необходимо учитывать следующие моменты, чтобы избежать ошибок.
- Найдите общее количество валентных электронов атомов водорода, серы и кислорода.
- Найдите общее количество электронных пар.
- Выбор центрального атома.
- Теперь присвоение неподеленных пар выполняется для каждого атома молекулы.
- После распределения пар проверяйте устойчивость, пока не получите наиболее устойчивую структуру.
Примечание — Одинокие пары можно конвертировать в облигации, пока мы не получим стабильную структуру.
Точечная структура Льюиса h3SO4
Следуйте пошаговой процедуре, чтобы нарисовать точечную структуру Льюиса h3SO4.
Шаг 1 — валентные электроны h3SO4
Атомы кислорода и серы имеют шесть электронов в валентных оболочках.Оба они подпадают под группу VIA в периодической таблице.
Прочитав ниже, вы можете проверить, как мы можем вычислить общее количество валентных электронов в молекуле.
Так как одна молекула серной кислоты имеет 2 атома водорода (H), 1 атом серы (S) и 4 атома кислорода (0).
Из которых атом серы и кислорода дает в общей сложности 6 электронов, а водород дает 1 электрон. Таким образом, вычисляя, мы получаем количество валентных электронов серной кислоты.
- Полная валентность электрона, связанная с водородом — 2 * 1 = 2
- Суммарный валентный электрон, полученный от серы — 6 * 1 = 6
- Полный валентный электрон определяется кислородом — 6 * 4 = 24
Всего валентных электронов = 2 + 6 + 24 = 32
Шаг 2 — Мы можем найти общее количество электронных пар, разделив общее количество валентных электронов на 2.Следовательно, 32/2 дает результат 16. Это означает, что общее количество пар электронов равно 16.
Шаг 3 — Зная общее количество электронных пар, мы должны выбрать центральный атом, так как нам нужно выбрать атом с наивысшей валентностью. Для молекулы h3SO4 наивысшей валентностью обладает сера.
Шаг 4 — Теперь отметьте неподеленные пары вне атомов кислорода.
Шаг 5 — Чтобы определить устойчивость структуры, проверьте заряд атома.Оба атома кислорода получат заряд -1, а сера получит заряд +2. Отсюда получаем (-1 * 2 + (+2)) = 0.
Шаг 6 — Последний шаг — проверка стабильности заряда. Чтобы сделать его стабильным, нам нужно снизить расходы. Как мы знаем, кислород имеет более высокую электроотрицательность, чем сера, поэтому он держит на себе отрицательный заряд.
Знаете ли вы? Эта сера может вместить более восьми валентных электронов.
Молекулярная форма и полярность h3SO4
Молекулярная форма молекулы и ее полярность зависят от атомов, участвующих в ее образовании.Электронная конфигурация, включающая неподеленные пары, придает молекуле наиболее стабильную форму.
Электроотрицательность атомов и тип образования связи определяет, имеет ли молекула полярную или неполярную природу.
Молекулярная форма
в молекуле h3SO4, сера, являющаяся центральным атомом, имеет четыре спаренных электрона и 0 неспаренных электронов.
Следовательно, его структура классифицируется как тетраэдр с 109,5 градусами между серой и четырьмя атомами кислорода.
Водород и кислород образуют линейную связь под углом 180 градусов.
Молекулярная полярность
Молекула h3SO4 полярна по природе из-за присутствующих в ней изогнутых связей H-O-S. В результате распределение заряда по молекуле становится неоднородным.
Гибридизация h3SO4
Это процесс, в котором атомные орбитали сливаются с образованием новых гибридизированных орбиталей, что, в свою очередь, влияет на геометрию молекул.
Новые орбитали известны как гибридизированные орбитали. Это происходит только при образовании связей, а не в газообразном виде.
Атомы серы связаны с четырьмя другими атомами в молекулах.
Согласно теории отталкивания электронных пар валентной оболочки (VSEPR), атомы будут разделены настолько далеко, насколько это возможно, что приведет к образованию связей, находящихся на расстоянии 109,5 градусов друг от друга.
Рассчитать гибридизацию любого соединения легко, просто следуя приведенной ниже формуле.
H = ½ (количество валентных электронов в центральном атоме + количество одновалентных атомов — катион + анион)
= ½ (6 + 2) = 4
Мы знаем это, когда есть четыре гибридных орбитали.
Следовательно, гибридизация имеет sp3-структуру, т.е. тетраэдрическую.
Молекулярная геометрия h3SO4
Серная кислота имеет тетраэдрическую геометрию. Именно из-за центрального атома серы существует связь четырех групп, включая две из О и две из -ОН.
Кроме того, в нем нет неподеленной пары электронов.
Согласно теории VSEPR, геометрия с наименьшей энергией для этого типа молекул называется геометрией тетраэдра.
Тип соединения в h3SO4
Это бисульфат-анион, который забирает электроны у других металлов. Атомы водорода, серы и кислорода образуют ковалентные полярные связи.
Это также означает, что действует дипольный момент, в результате чего соединение имеет положительный и отрицательный заряд.
В дополнение к этому сера, как и кислород, обладает высокой электроотрицательностью. Это причина того, что электроны ближе к этим двум элементам, а не к водороду.
Как видно из структуры Льюиса, h3SO4 принимает серу в качестве центрального атома.
Два атома кислорода связаны двойной связью с атомом серы, а остальные два связаны одинарной связью.
Аналогично, атом водорода присоединен к каждому атому кислорода с одинарной связью.
Межмолекулярные силы h3SO4
Молекула
h3SO4 сильно полярна, и ее диполи также расположены ближе друг к другу.Это из-за малогабаритных атомов водорода.
По сравнению с другими молекулами, водород, скорее всего, связывается с атомами кислорода, создавая прочную связь.
Связь считается прочной, поскольку для ее преобразования в газообразную и жидкую форму требуется большое количество энергии.
Следовательно, h3SO4 имеет высокие температуры плавления и кипения.
Здесь также может быть указана одна причина для определения прочности связей, потому что, как мы знаем, кислород очень электроотрицателен по отношению к водороду, заставляя молекулы удерживаться прочно.
серной кислоты (купоросное масло) | Кодекс химикатов воды
К сожалению, эту книгу нельзя распечатать из OpenBook. Если вам нужно распечатать страницы из этой книги, мы рекомендуем загрузить ее в формате PDF.
Посетите NAP.edu/10766, чтобы получить дополнительную информацию об этой книге, купить ее в печатном виде или загрузить в виде бесплатного PDF-файла.
«Предыдущая: Полифосфат натрия, цинка, калия, стекловидный
Рекомендуемая ссылка: «Серная кислота (купоросное масло).»Институт медицины и Национальный исследовательский совет. 1982. Кодекс химикатов воды . Вашингтон, округ Колумбия: The National Academies Press. Doi: 10.17226 / 159.
×
Рекомендуемое цитирование: «Серная кислота (купоросное масло)». Институт медицины и Национальный исследовательский совет. 1982. Кодекс химикатов воды . Вашингтон, округ Колумбия: The National Academies Press.DOI: 10.17226 / 159.
×
Ниже приведен неисправленный машинно-читаемый текст этой главы, предназначенный для предоставления нашим собственным поисковым системам и внешним машинам богатого, репрезентативного для каждой главы текста каждой книги с возможностью поиска. Поскольку это НЕПРАВИЛЬНЫЙ материал, пожалуйста, рассматривайте следующий текст как полезный, но недостаточный прокси для авторитетных страниц книги.
70
Название: СЕРНАЯ КИСЛОТА (МАСЛО ВИТРИОЛА)
Номер CAS: 7664-93-9
Химическая формула: h3SO4
Описание:
Гигроскопичная, сиропообразная коррозионная жидкость.
Использовать:
NAS / CWTC 038/82
Вес формулы: 98,0
Используется для регулировки мощности после размягчения извести. Подготовить
Получение активированного кремнезема из силиката натрия. Регенера-
ция смол.
Требования к чистоте
.
Анализ имеющихся марок серной кислоты показывает
присутствие селена, мышьяка и свинца. Для мышьяка и
привести уровни намного ниже того, что потребовало бы
Значения RMIC основаны на максимальной дозировке 50 мг / литр.Если
фактическая дозировка отличается от 50 мг / литр, пользователь
Рекомендуется обращаться к Таблице 2 для получения соответствующих значений RMIC.
Примесь
Селен
Подготовка аналитических проб:
РМИЦ мг / примесей / кг
Серная кислота
20
В промытую кислотой мерную колбу вместимостью 500 мл добавьте примерно
примерно 250 мл деионизированной воды. Медленно и с
перемешивая, добавьте 5 мл пробы в воду в колбе.
Осторожно: во время этой процедуры необходимо надевать средства защиты глаз.
cedure ‘Чрезмерное тепловыделение может произойти, если образец
добавлен в воду слишком быстро.
71
Образцы анализов:
Анализируйте раствор серной кислоты в соответствии с
Стандарты методов исследования воды и сточных вод.
вода, 15-е издание, Американская ассоциация общественного здравоохранения,
Вашингтон, округ Колумбия (1980).
Хром
Вести
Селен
Раздел 304
Раздел 304
Раздел 304
Далее: Пирофосфат натрия »
.
