Содержание
Неметаллы: простые вещества — свойства неметаллов, история открытия — химия 9 класс
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
Физические свойства неметаллов.
 Аллотропия
Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
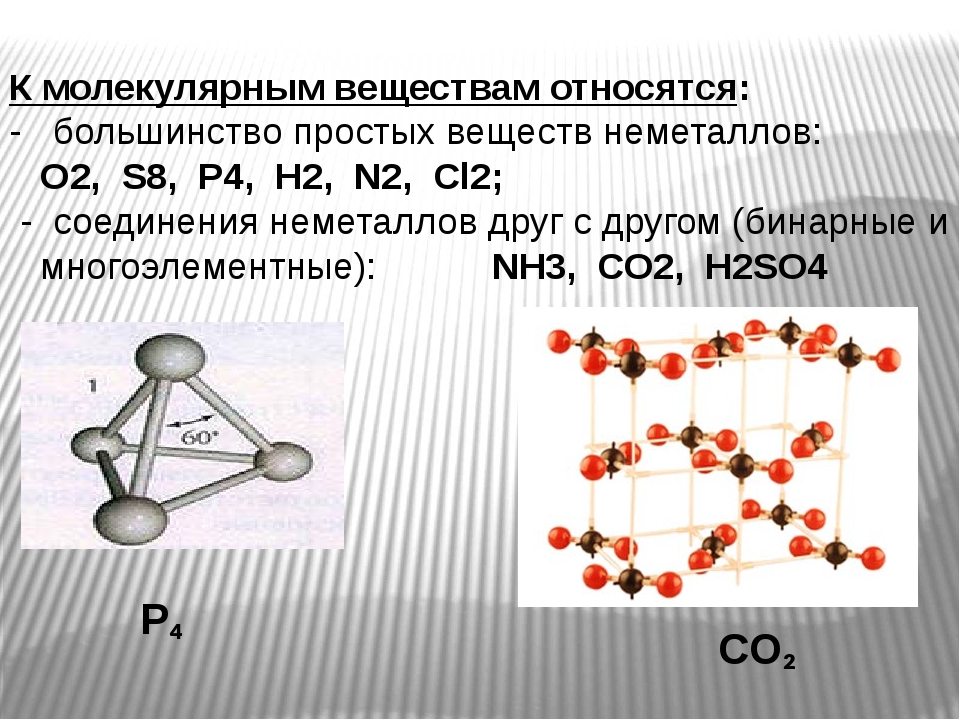
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
Неметаллы образуют кислотные или несолеобразующие оксиды.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева.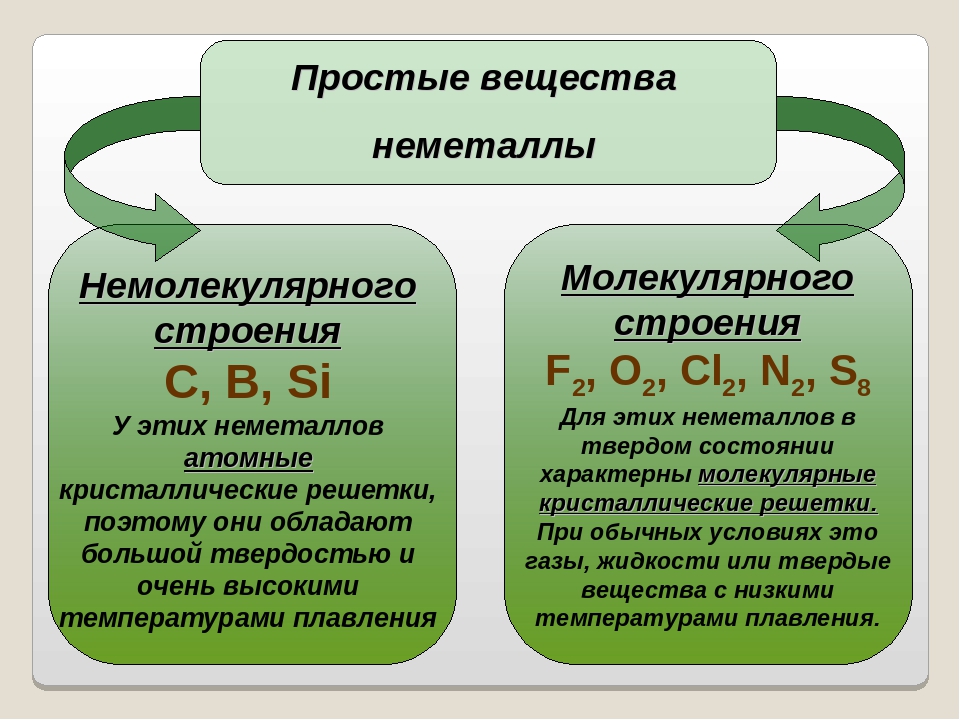 Интересные факты из жизни великого химика
Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
Неметаллы, свойства неметаллов, химия и характеристики неметаллов
Неметаллы, Неметаллы. Неметаллы — Категория неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал. Благодаря высоким значениям энергии ионизации неметаллов их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода четыре формы — графит, алмаз, карбин, фуллерен.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. Неметаллы существенно различаются по распространённости в земной различаются. Наиболее распространёнными являются кислород, кремний, водород, к редким относятся мышьяк, селен, иод.
Нас находят по запросам:
— неметаллы
— металлы и неметаллы
— свойства неметаллов
— химия неметаллы
— презентация неметаллы
— тема неметаллы
— характеристика неметаллов
— соединения неметаллов
— генетический ряд неметалла
— типичные неметаллы
— химические свойства неметаллов
Металлы и неметаллы — урок. Химия, 8–9 класс.
Простые вещества по их свойствам делят на металлы и неметаллы.
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Рис. \(1\). Ртуть
Рис. \(2\). Железо
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Рис. \(3\). Хлор
Рис. \(4\). Бром
Рис. \(5\). Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Рис. \(6\). Уголь
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Рис. \(7\). Периодическая таблица
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
Страница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл., г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.
- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).

- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.
- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.

- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
Простые вещества — неметаллы. Строение. Физические свойства — Общая характеристика неметаллов
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов F2, Br2, I2), двойные (например, в молекулах серы S2), тройные (например, в молекулах азота N2) ковалентные связи.
— ЗАПОМНИ. Многие химические элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций.
Простые вещества — неметаллы могут иметь:
1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8), и лишь один-единственный бром (Br2) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8), и лишь один-единственный бром (Br2) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. Атомное строение. Эти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
— ЗАПОМНИ. Все неметаллы — диэлектрики, т. к. их внешние электроны использованы на образование химических связей.
Все неметаллы — диэлектрики, т. к. их внешние электроны использованы на образование химических связей.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул (O2, О3), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Чтобы выявить свойства, характерные для всех неметаллов, надо обратить внимание на их расположение в периодической системе элементов и определить конфигурацию внешнего электронного слоя (табл. 5).
Таблица 5
Конфигурация внешнего электронного слоя атомов неметаллов
|
Номер периода
|
Номер группы
|
Элементы
|
Число электронов на внешнем слое
|
|
1
|
I
|
Н
|
1s1
|
|
2
|
III
|
В
|
2s22р1
|
|
3
|
IV
|
С, Si
|
ns2np2
|
|
4
|
V
|
N, P, As
|
ns2np3
|
|
5
|
VI
|
O, S, Se, Te
|
ns2np4
|
|
6
|
VII
|
F, Cl, Br, I, At
|
ns2np5
|
В периоде:
· заряд ядра увеличивается;
· радиус атома уменьшается;
· число электронов внешнего слоя увеличивается;
· электроотрицательность увеличивается;
· окислительные свойства усиливаются;
· неметаллические свойства усиливаются.
В главной подгруппе:
· заряд ядра увеличивается;
· радиус атома увеличивается;
· число электронов на внешнем слое не изменяется;
· электроотрицательность уменьшается;
· окислительные свойства ослабевают;
· неметаллические свойства ослабевают.
Для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: P, Seаморф. — желтые; Bаморф. — коричневый; О2(ж) — голубой; Si, Asмет. — серые; Р4 — бледно-желтый; I1(г.) — фиолетово-черный с металлическим блеском;Br2(ж.) — бурая жидкость; Cl2(г.) — желто-зеленый; F2(г.) — бледно-зеленый; S8(тв.) — желтая. Кристаллы неметаллов непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.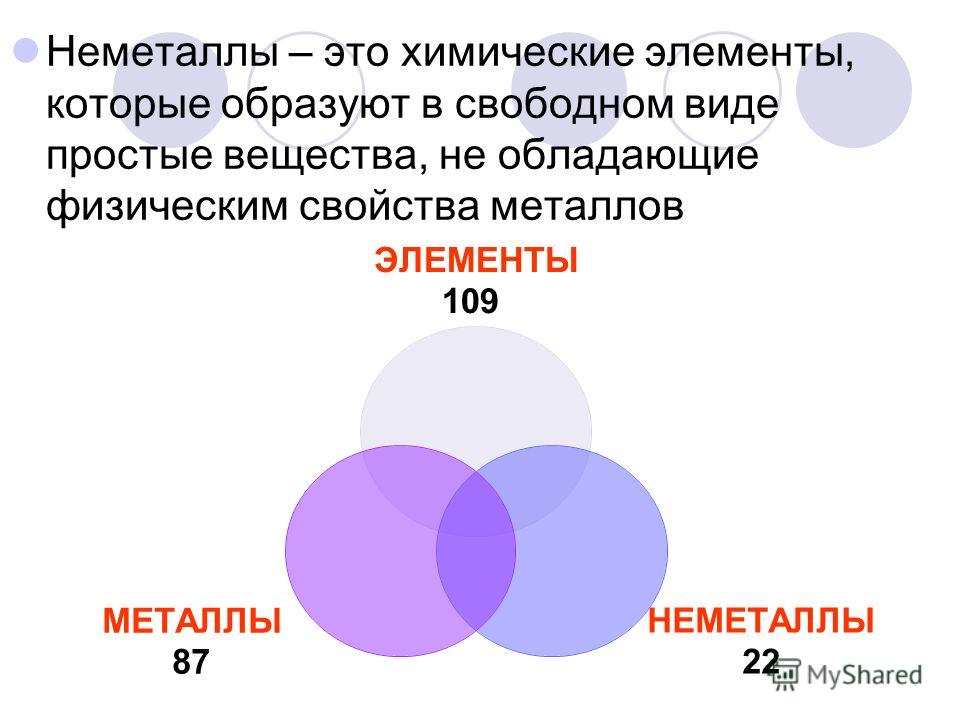
Химические свойства простых веществ
Химические свойства металлов
Металл + Кислород
С кислородом большинство металлов образует оксиды — амфотерные и основные:
- 4Li + O2= 2Li2O
- 4Al + 3O2 = 2Al2O3
Щелочные металлы, за исключением лития, образуют пероксиды:
Металл + галогены
С галогенами металлы образуют соли галогеноводородных кислот:
Металл + Водород
С водородом самые активные металлы образуют ионные гидриды — солеподобные вещества, в которых водород имеет степень окисления -1.
Металл + Сера
С серой металлы образуют сульфиды — соли сероводородной кислоты
Металл + Азот
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании
Металл + Углерод
С углеродом образуются карбиды
Металл + Фосфор
С фосфором — фосфиды
Металл + вода
С водой — гидроксиды. Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода
Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода
- 2Nа + 2Н2О = 2NаОН + Н2
- Са + 2Н2О = Са(ОН)2 + Н2
Химические свойства неметаллов
Взаимодействие с металлами. В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
- 2Na + Cl2 = 2NaCl
- Fe + S = FeS
- 6Li + N2 = 2Li3N
- 2Ca + O2 = 2CaO
Взаимодействие с другими неметаллами. Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды.
- 3h3 + N2 = 2Nh4
- h3 + Br2 = 2HBr
Взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства.
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
При взаимодействии с фтором фтор является окислителем, а кислород — восстановителем.
Неметаллы взаимодействуют между собой: более электроотрицательный металл играет роль окислителя, менее электроотрицательный — роль восстановителя.
- S + 3F2 = SF6
- C + 2Cl2 = CCl4
Полезные ссылки
Источник материала
Презентация «Простые вещества — неметаллы»
Слайды и текст этой онлайн презентации
Слайд 1
Простые вещества — неметаллы
Автор: учитель химии
МКОУ «Касторенская СОШ №1»,
п.г.т. Касторное
Парамонов А.Ю., 2014
Слайд 2
Цели урока:
1)Познакомить учащихся с простыми веществами – неметаллами;
2)изучить практическое значение неметаллов;
3)продолжить формирование знаний учащихся по изучению простых веществ;
4)продолжить воспитывать культуру работы с учебной литературой.
Слайд 3
Неметаллы
Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Например:
а – углерод
б – сера
в – красный фосфор
г – хлор
Слайд 4
Из 114 химических элементов 22 являются неметаллами.
Слайд 5
Агрегатное состояние неметаллов
ТВЕРДЫЕ НЕМЕТАЛЛЫ (СЕРА, УГЛЕРОД)
ЖИДКИЕ НЕМЕТАЛЛЫ (БРОМ)
ГАЗООБРАЗНЫЕ НЕМЕТАЛЛЫ
(ФТОР, ХЛОР, КИСЛОРОД)
Слайд 6
Пример газообразных неметаллов
хлор азот
фтор
Слайд 7
Практическое значение газообразных неметаллов
Воздушные шары Неон используют для
заполняют гелием изготовления световой
рекламы
Слайд 8
Практическое значение газообразных неметаллов
Применение кислорода:
Медицина;
металлургия;
ракетное топливо;
сельское хозяйство;
биологическое значение;
пищевая промышленность;
химическая промышленность;
Слайд 9
Жидкие неметаллы
Слайд 10
Слайд 11
Пример твердых неметаллов
сера кремний
фосфор
Слайд 12
Практическое значение кремния
Слайд 13
Практическое значение серы
Слайд 14
Обобщение темы:
Тест: «Проверка знаний»
1) Сколько химических элементов — неметаллов в периодической системе Д. И.Менделлева
а) 24 б) 23
в) 22 г) 21
2) Какой химический элемент – неметалл при обычных условиях является жидкостью
а) хлор б) бром
в) фтор г) сера
3) Для изготовления световой рекламы используется
а) неон б) гелий
в) бром г) углерод
И.Менделлева
а) 24 б) 23
в) 22 г) 21
2) Какой химический элемент – неметалл при обычных условиях является жидкостью
а) хлор б) бром
в) фтор г) сера
3) Для изготовления световой рекламы используется
а) неон б) гелий
в) бром г) углерод
Слайд 15
4) Какой химический элемент – неметалл при обычных условиях является газом а) бром б) фосфор в) сера г) фтор 5) В фотоэлементах и полупроводниках используется а) азот б) кремний в) фтор г) хлор
Слайд 16
Ответы:
1. в
2. б
3. а
4. г
5. б
Слайд 17
Домашнее задание:
§ 14 Упр. 1, 3.
Слайд 18
Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил.
Использованы фотографии:
http://galina.shh.com.ua/?p=1455
пример неметаллов
http://eduportal. uz/ebooks/himiya8/html/420.html
размещение неметаллов в периодической системе Менделеева
http://chemistry-chemists.com/N3_2012/U3/Cl.html
хлор
http://skand.ru/production/gazi/azot/lnitro/
азот
http://aleks-7zklass.narod.ru/p162aa1.html
фтор
uz/ebooks/himiya8/html/420.html
размещение неметаллов в периодической системе Менделеева
http://chemistry-chemists.com/N3_2012/U3/Cl.html
хлор
http://skand.ru/production/gazi/azot/lnitro/
азот
http://aleks-7zklass.narod.ru/p162aa1.html
фтор
Слайд 19
http://newsgreat.ru/interesnye-vozdushnye-shary/ использование гелия http://ru.paperblog.com/7-stylish-ways-to-use-trendy-neon-in-your-look-420821/ использование неона http://ppt4web.ru/khimija/galogeny3.html описание жидкого неметалла – брома http://ppt4web.ru/khimija/galogeny.html применение брома http://neftegaz.ru/analisis/view/8140 сера http://chemistry-chemists.com/N3_2012/U3/img/Si1.html кремний
Слайд 20
http://fosfor.ucoz.ru/photo фосфор http://miroslavv.livejournal.com/81286.html применение кремния http://www.myshared.ru/slide/339402/ применение серы
Неметаллы, простые вещества, хлор, фтор, бром, йод
Неметаллы
Йод в кристаллах Хлор. Попадание в лабораторию йода в спиртовом растворе (справа), переход йода в органическое вещество справа) Хлор, бром, йод собраны в колбы (слева направо) — представители галогенов Хлор в колбе
Попадание в лабораторию йода в спиртовом растворе (справа), переход йода в органическое вещество справа) Хлор, бром, йод собраны в колбы (слева направо) — представители галогенов Хлор в колбе
> Неметаллы — это простых веществ . Типичные неметаллы включают газы и жидкости.Неметаллы в отличие от металлов намного хуже проводят электрический ток, имеют отличия физико-механических свойств и температуры перехода в агрегатном состоянии.
Однако некоторые неметаллы обладают сильными металлическими свойствами — блеском (например, кристаллическая сера, кристаллического йода, , углерод и т. Д.).
В периодической таблице металлические свойства простых веществ (или химических элементов) уменьшаются слева направо, а неметаллические свойства увеличиваются.По своей природе это можно объяснить изменением (увеличением!) Количества электронов на последнем орбитальном уровне (также называемых валентными электронами). Чем более выражены неметаллические свойства химического элемента, тем он «легче» вступает в химические реакции с типичными металлами, заполняя свои последние орбитальные недостающие электроны и образуя прочные (с точки зрения химии) химические соединения.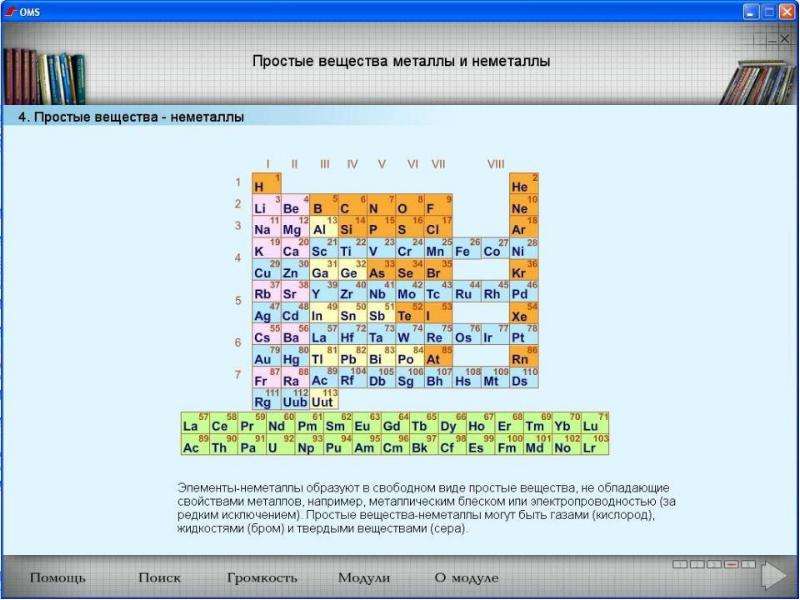
Хлор
Типичные неметаллы — это газы.При нормальных условиях они не проявляют аналогичных свойств металлов.
хлор (кл. 2 ). При нормальных условиях хлор представляет собой желтовато-зеленый газ с резким удушающим запахом. Хлор очень токсичен даже при такой низкой концентрации, как 0,001 мг на 1 DM 3 воздуха. Этот газ в 2,5 раза тяжелее воздуха, поэтому всегда будет находиться у земли в виде желтовато-зеленого тумана.
При содержании хлора в воздухе 0.9 мл / л смерть наступает в течение пяти минут. В небольших количествах (мы чувствуем хлор уже при концентрации в воздухе 0,003 мл / л) он сильно раздражает слизистые оболочки дыхательных путей и вызывает кашель.
Хлор не взаимодействует напрямую с кислородом, азотом, углеродом и инертными газами. Окислительные свойства хлора проявляются в реакциях с простыми веществами (металлический натрий Na, железо Fe, фосфор P сера S) и некоторыми сложными веществами.
Хлор содержится в земной коре массой 0.017%. В некоторых горных районах он покрывает основание почвы и поэтому приводит к гибели насекомых, мелких грызунов и микроорганизмов. Температура кипения хлора равна (-33,6 ° C) и точка плавления (-100,98 ° C).
Хлор относится к числу галогенов ( фтора F 2 , хлора Cl 2 , брома Br 2 , йода I 2 , Ат 2 , Ат 2 ), что придает ему некоторые особенности в химических реакциях.Он заменяет любой из галогенов в реакциях с другими галогенами, стоящими после него ( бром , йод и астат ).
газообразный хлор прекрасно растворяется в холодной воде, 1 объем воды растворяет около 2 объемов хлора с образованием двух кислот: соляной кислоты (HCl) и хлорноватистой (HClO), последняя не стабильна и разлагается на атомарный кислород и соляную кислоту. Полученная кислота — одна из сильных кислот.
Хлор обладает отличными дезинфицирующими свойствами. Он уничтожает практически все живые организмы в сфере своего воздействия, что делает его полезным в медицине и в домашнем хозяйстве (порошки, отбеливатель — та же хлорная вода, сода хлорированная). У сухого хлора такой способности нет. Хлор обладает отличными дезинфицирующими свойствами. Он уничтожает практически все живые организмы в сфере своего воздействия, что делает его полезным в медицине и в домашнем хозяйстве (порошки, хлорная вода, хлористая вода, сода хлорированная).Сухой хлор такой способностью не имеет. Раствор хлора в воде называется «хлорная вода», которая имеет превосходные свойства отбеливания материалов (ткани, дерева, бумаги и т. Д.). Раствор хлора «разрушает» краску на одежде, поэтому, если вы не хотите, чтобы ваша блузка или рубашка были покрыты белыми пятнами — не используйте эту воду при стирке цветных вещей. Просто опустите влажную окрашенную ткань в струю хлора, как только она потеряет цвет и превратится в чисто-белую.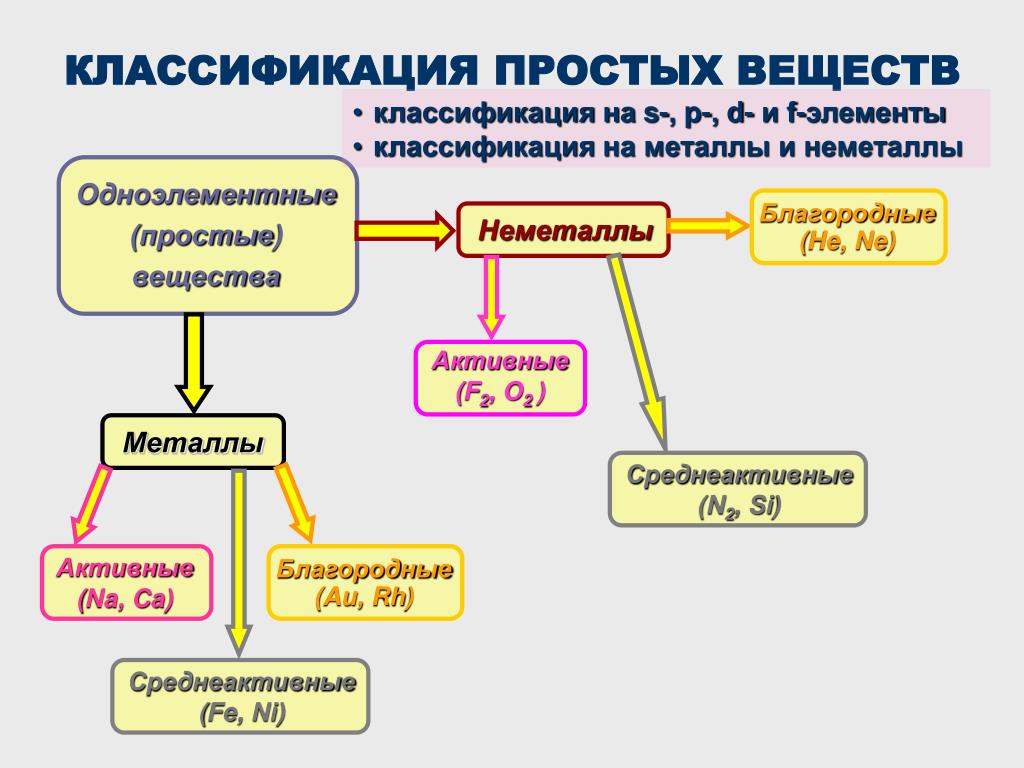
Как хлорированная вода действует на волосы, например, при купании в бассейне (можно найти на странице Состав шампуня).
Получение хлора
Хлор — ядовитый газ, который тяжелее воздуха, поэтому в результате реакции он скапливается на дне колбы.
Для химических реакций нам понадобится перманганат калия (перманганат калия) и соляная кислота.
В одну колбу насыпьте немного перманганата калия, присоедините трубку для удаления хлора, который будет выделяться при реакции перманганата калия с соляной кислотой.Другой конец трубки опустить в пустую колбу (не вдыхать!). Желательно такой дизайн как на картинке слева. Если все готово, запускаем:
Добавьте соляную кислоту к перманганату калия. Следите за выделением желто-зеленого газа, это хлор. Реакция протекает следующим образом:
2KMnO 4 + 16HCl = 2KCl + 2MnCl 2 + 5Cl 2 + 8H 2 O
Вещества, которые образуются при реакции (кроме хлора) — 2 соли — хлорид калия KCl и хлорид марганца MnCl 2 и вода.
фтор
Фтор в трубе
Фтор F 2 — газ ярко-желтый с оранжевым оттенком (t пл -220 ° С, t кип -188 ° С).
По поводу истинного цвета фтора было много отличий: из-за необычайно высокой реакционной способности тех немногих, кто решился получить этот газ в достаточном количестве в прозрачном сосуде. Но последующие исследования подтвердили цвет фторида.
Фтор взаимодействует практически со всеми простыми веществами, включая тяжелые инертные газы (Kg (криптон), Xe (ксенон)). Фтор как хлор относится к количеству галогенов.
Бром
Бром Br 2 — летучая жидкость темно-красного цвета (t плавления -7 ° C, t кипения + 59 ° C), растворимая в воде (при 20 ° C растворено 3,6 г брома (Br 2 ) в 100 мл воды и органических растворителей. Пара брома очень токсична. Ожоги бромом очень болезненны и долго не заживают. При попадании на кожу брома или бромной воды следует немедленно промыть ожог большим количеством водой, а затем раствором пищевой соды, нейтрализующей бром.
.
Йод
кристаллический йод
Йод (I 2 ) (Тпл = 114 ° С, точка кипения = 185 ° С) знаком каждому с детства: 5% -ный водно-спиртовой раствор йода применяется для дезинфекции ран и порезов. Если вылить раствор йода в фарфоровую чашку и оставить на несколько часов, спирт испарится и выделится кристаллического йода в виде серых кристаллов с металлическим блеском, растворимых в органических растворителях.Нагреватель представляет собой небольшой кристалл возгона йода, образующий пару пурпурного цвета.
Как хлор, фтор, бром , йод — также относится к галогенам. В нормальном состоянии йод — темно-серые кристаллы с металлическим блеском. Таким способом можно плавить, нагревая до температуры 133,5 ° C.
Йод кристаллический не растворяется в воде, хорошо растворяется в спирте. Спиртовой раствор йода имеет коричневый цвет (продается в аптеках в виде 5-10% раствора йода).Пары йода имеют темно-фиолетовый цвет.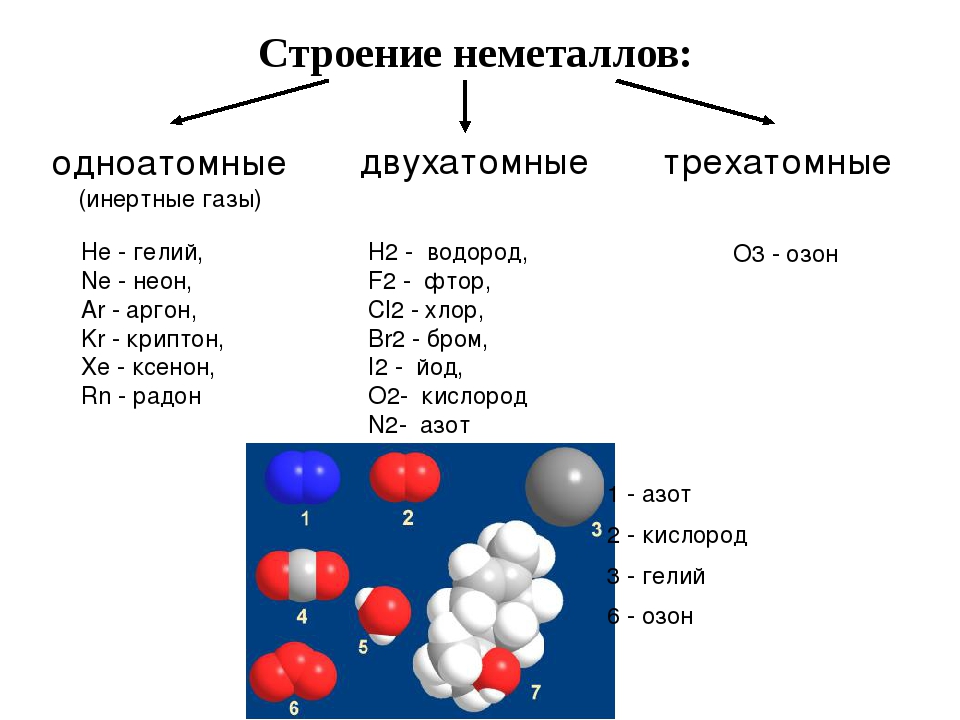
Йод — отличное профилактическое средство от радиации. Добавка в пищу способствует укреплению щитовидной железы, которая более подвержена радиоактивному воздействию. Для усвоения йода организмом с пищей используют йодированную соль (KI — йодид калия ). Эту соль в качестве добавки к поваренной соли (NaCl) можно купить в продуктовых магазинах.
Интересно, что реакционная способность йода в «цветных» растворах (пурпурном и коричневом) — разная.Так, в коричневых растворах йод намного активнее, чем в фиолетовых, например, быстрее реагирует с медью. Это связано с тем, что молекулы йода могут взаимодействовать с молекулами растворителя, образуя комплексы, в которых йод более активен. Именно растворитель играет главную роль в проявлении активности йода!
Добавляя в раствор йода растительное масло, можно наблюдать переход йода из водной фазы в органическую (экстракция). Процесс экстракции будет намного быстрее, если смесь встряхнуть.
Кое-что о пользе йода:
Йод — один из очень важных элементов для человеческого организма. Нормальная доза для потребления человеком измеряется микрограммами, но ее отсутствие в организме опасно для жизни человека. Йод участвует в синтезе гормонов щитовидной железы, которые, в свою очередь, отвечают за нормальный рост человеческого организма; йод тоже отвечает за правильную работу мозга!
Нормальная доза для потребления человеком измеряется микрограммами, но ее отсутствие в организме опасно для жизни человека. Йод участвует в синтезе гормонов щитовидной железы, которые, в свою очередь, отвечают за нормальный рост человеческого организма; йод тоже отвечает за правильную работу мозга!
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции в металлах и свойствах металлов
- Атрибуция
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Ковкий и пластичный (гибкий) в твердом виде | Хрупкий, твердый или мягкий |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле. - Пластичность: Металлы можно втянуть в проволоку. Например, 100 г серебра можно протянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения.
 Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакций Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в подоболочке s )
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), а также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1. {-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами имеют ионную природу . Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (водн.)} \ Label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (водн. ) \ Rightarrow 2Al (NO3) 3 (водн.) + 3h3O (l)} \ nonumber \]
) \ Rightarrow 2Al (NO3) 3 (водн.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). При комнатной температуре в жидком виде существует только бром.
- Не податливые и ковкие : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.

- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию получать электроны или делиться ими с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами:
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабокислый характер (углекислый газ).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни податливым, ни пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента в этой группе может колебаться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению при движении вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации). Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и авторство
Определение и свойства неметаллов
Неметалл — это просто элемент, который не проявляет свойств металла. Он определяется не тем, что это такое, а тем, чем он не является.Он не выглядит металлическим, его нельзя превратить в проволоку, придать ему форму или согнуть, он плохо проводит тепло или электричество и не имеет высокой температуры плавления или кипения.
Неметаллы составляют меньшинство в периодической таблице, в основном они расположены в правой части таблицы Менделеева. Исключение составляет водород, который ведет себя как неметалл при комнатной температуре и давлении и находится в верхнем левом углу таблицы Менделеева. Предполагается, что в условиях высокого давления водород будет вести себя как щелочной металл.
Неметаллы в таблице Менделеева
Неметаллы расположены в верхней правой части таблицы Менделеева. Неметаллы отделены от металлов линией, которая по диагонали пересекает область периодической таблицы, содержащую элементы с частично заполненными орбиталями p . Галогены и благородные газы являются неметаллами, но группа неметаллических элементов обычно состоит из следующих элементов:
- водород
- углерод
- азот
- кислород
- фосфор
- сера
- селен
Галогенные элементы:
- фтор
- хлор
- бром
- йод
- астатин
- Возможно, элемент 117 (теннессин), хотя большинство ученых считает, что этот элемент будет вести себя как металлоид.
Элементами благородного газа являются:
- гелий
- неон
- аргон
- криптон
- ксенон
- радон
- элемент 118 (оганессон).
 Предполагается, что этот элемент будет жидким, но все же неметаллом.
Предполагается, что этот элемент будет жидким, но все же неметаллом.
Свойства неметаллов
Неметаллы обладают высокими энергиями ионизации и электроотрицательностью. Как правило, они плохо проводят тепло и электричество. Твердые неметаллы обычно хрупкие, с небольшим металлическим блеском или без него.Большинство неметаллов обладают способностью легко приобретать электроны. Неметаллы обладают широким спектром химических свойств и реакционной способности.
Обзор общих свойств
- Высокая энергия ионизации
- Высокая электроотрицательность
- Плохая теплопроводность
- Плохие электрические проводники
- Хрупкие твердые вещества — не податливые или пластичные
- Слабый металлический блеск или совсем без него
- Легко набирать электроны
- Тусклый, без металлического блеска, хотя может быть красочным
- Более низкие температуры плавления и кипения, чем у металлов
В таблице ниже показано сравнение физических и химических свойств металлов и неметаллов. Эти свойства применимы к металлам в целом (щелочные металлы, щелочноземельные металлы, переходные металлы, основные металлы, лантаноиды, актиниды) и неметаллам в целом (неметаллы, галогены, благородные газы).
Эти свойства применимы к металлам в целом (щелочные металлы, щелочноземельные металлы, переходные металлы, основные металлы, лантаноиды, актиниды) и неметаллам в целом (неметаллы, галогены, благородные газы).
| Металлы | Неметаллы | |
| химические свойства | легко теряют валентные электроны | легко делится или получает валентные электроны |
| 1-3 электрона (обычно) во внешней оболочке | 4-8 электронов во внешней оболочке (7 для галогенов и 8 для благородных газов) | |
| образуют основные оксиды | образуют кислые оксиды | |
| хорошие восстановители | хорошие окислители | |
| имеют низкую электроотрицательность | имеют более высокую электроотрицательность | |
| физические свойства | твердое при комнатной температуре (кроме ртути) | может быть жидкостью, твердым телом или газом (благородные газы — это газы) |
| с металлическим блеском | без металлического блеска | |
| хороший проводник тепла и электричества | плохой проводник тепла и электричества | |
| обычно ковкий и пластичный | обычно хрупкий | |
| непрозрачный в тонком листе | прозрачный в тонком листе |
Список неметаллов
Выделенные элементы являются неметаллическими элементами.
Неметаллические элементы занимают верхний правый угол периодической таблицы. Неметаллы включают неметаллическую группу, галогены и благородные газы. Эти элементы имеют схожие химические свойства друг с другом, что отличает их от элементов, которые считаются металлами.
Группы неметаллов
Группа неметаллических элементов — это подмножество неметаллов. Группа неметаллических элементов состоит из водорода, углерода, азота, кислорода, фосфора, серы и селена. Водород действует как неметалл при нормальных температурах и давлении и обычно считается частью группы неметаллов.
Галогены — неметаллы 7 группы Периодической таблицы Менделеева. Атомы этих элементов имеют степень окисления -1. Элементы в верхней части группы — это газы, но они становятся жидкостями и твердыми телами, движущимися вниз по группе. Галогены — это фтор, хлор, бром, йод и астат. Свойства теннессина малоизвестны. Теннесин может быть галогеном или металлоидом.
Благородные газы — это относительно инертные газы, находящиеся в группе 8 (последний столбец) таблицы периодов. Благородные газы — гелий, неон, аргон, криптон, ксенон, радон и оганессон. Скорее всего, оганессон не является газом при комнатной температуре.
Благородные газы — гелий, неон, аргон, криптон, ксенон, радон и оганессон. Скорее всего, оганессон не является газом при комнатной температуре.
Список неметаллов
Это список неметаллических элементов в порядке возрастания атомного номера.
Свойства неметаллов
Свойства неметаллов включают:
- тусклый, не блестящий
- плохой проводник тепла
- плохой проводник электричества
- высокая энергия ионизации
- высокая электроотрицательность
- не податливый, хрупкий или пластичный
- более низкая плотность (по сравнению с металлами)
- более низкая температура плавления и кипения (по сравнению с металлами)
- приобретение электронов в реакциях (отрицательная степень окисления)
- часто красочный в твердом состоянии
Список областей применения неметаллов
В отличие от металлов, неметаллы не имеют универсального применения.Но в некоторых приложениях они встречаются вместе:
- Необходимы для жизни (углерод, водород, азот, кислород, сера, хлор, фосфор)
- Удобрения (водород, азот, фосфор, сера, хлор, селен)
- Хладагенты и криогенная техника (водород, гелий, азот, кислород, фтор, неон)
- Промышленные кислоты (углерод, азот, фтор, фосфор, сера, хлор)
- Лазеры и лампы
- Медицина и фармацевтика
Неметаллы образуют множество соединений. Фактически, большинство соединений, с которыми вы сталкиваетесь, содержат неметаллы. Они встречаются в воде, продуктах питания, тканях, пластмассах и других предметах повседневного обихода.
Фактически, большинство соединений, с которыми вы сталкиваетесь, содержат неметаллы. Они встречаются в воде, продуктах питания, тканях, пластмассах и других предметах повседневного обихода.
Список литературы
- Аддисон У. Э. (1964) Аллотропия элементов . Oldbourne Press: Лондон.
- Bettelheim, F.A .; Brown, W.H .; Кэмпбелл, М.К .; Farrell, S.O .; Торрес, О. (2016). Введение в общую, органическую и биохимию (11-е изд.). Cengage Learning: Бостон. ISBN 978-1-285-86975-9.
- Эмсли, Дж.(1971). Неорганическая химия неметаллов . Methuen Educational: Лондон. ISBN 0423861204.
- Steudel, R. (1977). Химия неметаллов: введение в атомную структуру и химические связи . Английское издание F.C. Наход и Дж. Дж. Цукерман. Берлин: Вальтер де Грюйтер. ISBN 3110048825.
Неметаллы — Таблица Менделеева — KS3 Chemistry Revision
Кислород, углерод, сера и хлор являются примерами неметаллических элементов.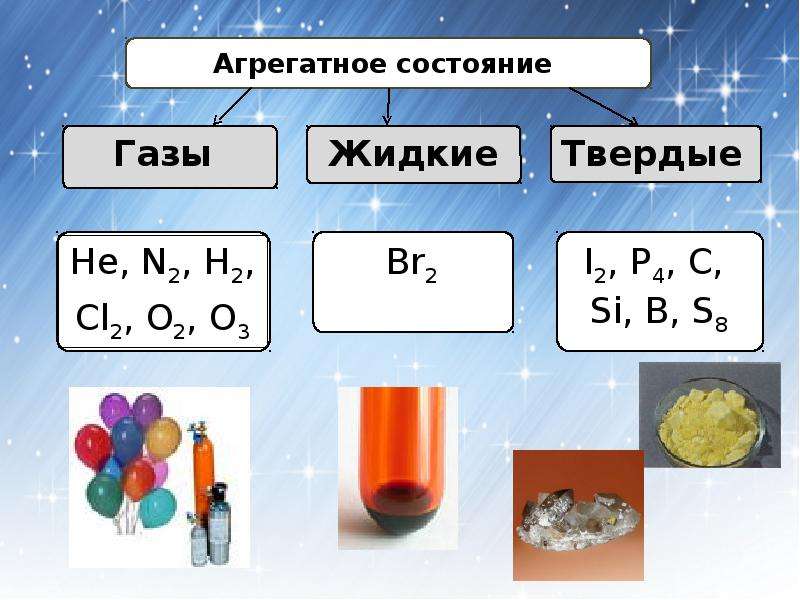 Неметаллы обладают общими свойствами. Это:
Неметаллы обладают общими свойствами. Это:
- тусклые (не блестящие)
- плохие проводники тепла и электричества (они изоляторы)
- слабые и хрупкие (они легко ломаются или ломаются в твердом состоянии)
Большинство неметаллов также обладают следующими свойствами:
- они имеют низкую плотность (они кажутся легкими для своего размера)
- Они НЕ звучат (при ударе не издают звона)
Одиннадцать неметаллов являются газами при комнатной температуре, включая кислород и хлор.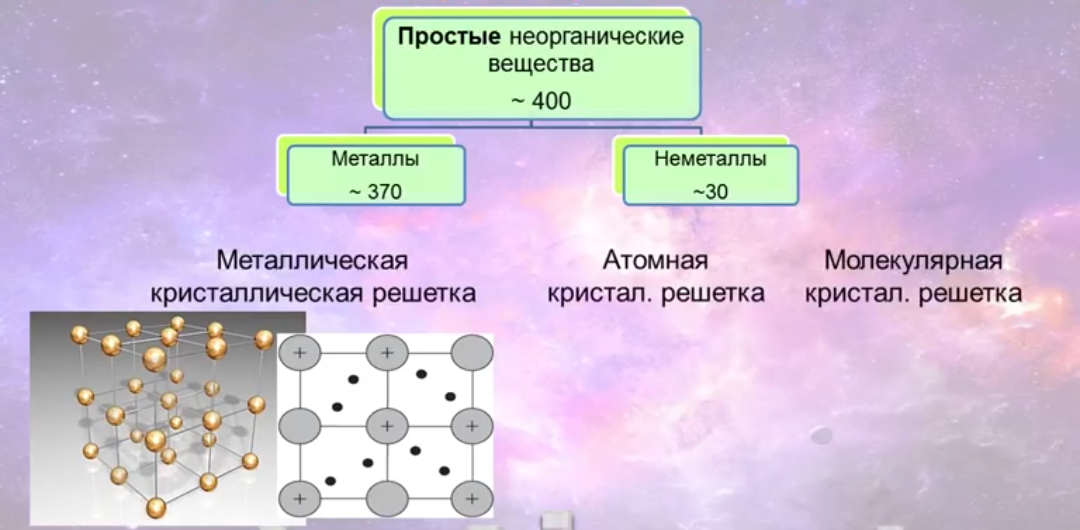
Неметалл, бром, при комнатной температуре является жидкостью.
Другие неметаллы представляют собой твердые вещества при комнатной температуре, включая углерод и серу.
Реакции неметаллов
Неметаллы реагируют с кислородом с образованием оксидов неметаллов. Например, сера реагирует с кислородом с образованием диоксида серы. Реакция может быть представлена этим словесным уравнением:
сера + кислород → диоксид серы
Оксиды неметаллов реагируют с основаниями и нейтрализуют их.Некоторые оксиды неметаллов растворяются в воде и при этом образуют кислые растворы.
Алмаз и графит
1qx3sehgop4.0.0.0.1:0.1.0.$0.$3.$1″> Углерод — твердый неметаллический элемент. Чистый углерод может существовать в самых разных формах. Самые распространенные два — это алмаз и графит . В таблице показаны некоторые различия между ними.
| Алмаз | Графит |
|---|---|
| 0.0.1:0.1.0.$0.$3.$2.$2.$0.$0″> Прозрачный и бесцветный | Непрозрачный и черный |
| Твердый | Мягкий |
Алмаз — самое твердое вещество на земле хрупкий и расколется при ударе молотком.
Графит необычен, потому что это неметалл, проводящий электричество.
Алмазы используются в ювелирных изделиях и режущих инструментах
Химия неметаллов
Химия
Неметаллы
Какие
Неметаллы?
Более 75% известных элементов имеют характеристику
свойства металлов (см.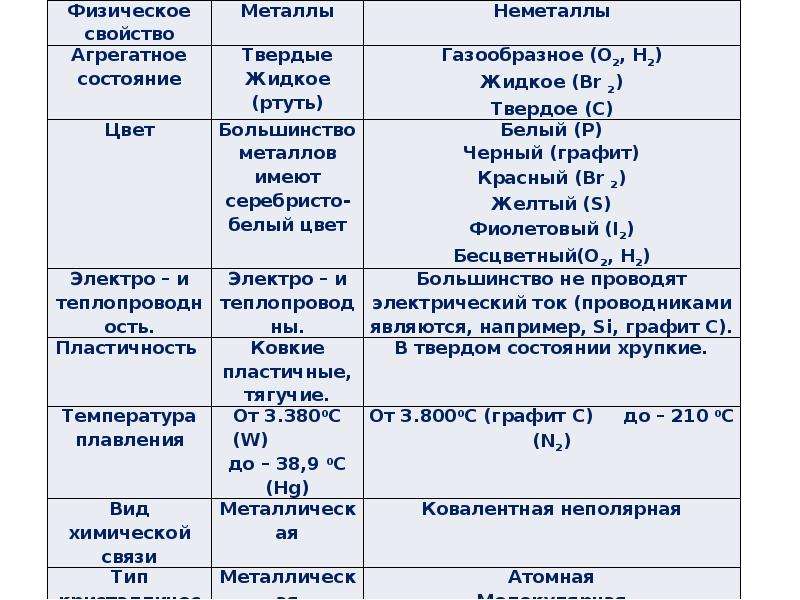 рисунок ниже). У них есть
рисунок ниже). У них есть
металлический блеск; они податливы и пластичны; и они проводят
тепло и электричество.Восемь других элементов (B, Si, Ge, As, Sb,
Te, Po и At) лучше всего описать как полуметаллы или металлоиды .
Они часто выглядят как металлы, но имеют тенденцию быть хрупкими и
они скорее будут полупроводниками, чем проводниками
электричество.
После исключения металлов и полуметаллов из списка
Из известных элементов осталось только 17, которые можно отнести к неметаллам .Шесть из этих элементов относятся к семейству инертных газов Группы
VIIIA, большинство из которых практически инертны к химическим реакциям.
Поэтому дискуссии о химии неметаллов имеют тенденцию
сосредоточиться на следующих элементах: H, C, N, O, F, P, S, Cl, Se, Br,
Я и Кси.
Неметаллы
В химии основной группы прослеживается четкая закономерность.
металлов: Металлы основной группы окисляются во всех
их химические реакции. Эти металлы окисляются при
они реагируют с неметаллическими элементами. Алюминий, например,
окисляется бромом.
Химия неметаллов более интересна, потому что
эти элементы могут подвергаться как окислению, так и восстановлению.
Например, фосфор окисляется при взаимодействии с кислородом.
сформировать P 4 O 10 .
Но он уменьшается, когда он вступает в реакцию с кальцием с образованием кальция.
фосфид.
Эти реакции можно понять, взглянув на относительную
электроотрицательности этих элементов. Фосфор ( EN =
2.19) менее электроотрицателен, чем кислород ( EN = 3,44).
Когда эти элементы реагируют, электроны притягиваются к
больше электроотрицательных атомов кислорода. Таким образом, фосфор
окисляется в этой реакции, а кислород восстанавливается. Кальций ( EN
Кальций ( EN
= 1.00), с другой стороны, значительно менее электроотрицательный
чем фосфор ( EN = 2.19). Когда эти элементы реагируют,
электроны тянутся к более электроотрицательным
атомы фосфора. В результате происходит окисление кальция и фосфора.
уменьшен.
Поведение неметаллов можно резюмировать следующим образом.
1. Неметаллы склонны окислять металлы.
| 2 мг ( с ) | + | O 2 ( г ) | 2 MgO ( с ) |
2.Неметаллы с относительно большой электроотрицательностью (например,
как кислород и хлор) окисляют вещества, с которыми они вступают в реакцию.
| 2 H 2 S ( г ) | + | 3 O 2 ( г ) | 2 SO 2 ( г ) | + | 2 H 2 O ( г ) |
| PH 3 ( г ) | + | 3 Класс 2 ( г ) | PCl 3 ( л ) | + | 3 HCl ( г ) |
3. Неметаллы с относительно небольшими
Неметаллы с относительно небольшими
электроотрицательность (например, углерод и водород) может уменьшить
другие вещества.
| Fe 2 O 3 ( с ) | + | 3 C ( с ) | 2 Fe ( с ) | + | 3 CO ( г ) |
| CuO ( с ) | + | H 2 ( г ) | Cu ( с ) | + | H 2 O ( г ) |
Nonmetal — обзор | Темы ScienceDirect
Введение
Неметаллические токсичные химические вещества вызывают заболевания практически всех органов человеческого тела и практически у всех животных, включая рыб, земноводных, рептилий, птиц и млекопитающих. Кроме того, такие химические вещества могут изменять микробиом в почве и воде, а также в желудочно-кишечном тракте животных. Такие токсичные химические вещества поступают из нескольких источников, включая воздух, воду, продукты питания, фармацевтические препараты, косметику, чистящие средства, а также лекарства, отпускаемые по рецепту и без рецепта. В косметике используется около 13 000 химикатов, из которых только 10% прошли надлежащую оценку безопасности.
Кроме того, такие химические вещества могут изменять микробиом в почве и воде, а также в желудочно-кишечном тракте животных. Такие токсичные химические вещества поступают из нескольких источников, включая воздух, воду, продукты питания, фармацевтические препараты, косметику, чистящие средства, а также лекарства, отпускаемые по рецепту и без рецепта. В косметике используется около 13 000 химикатов, из которых только 10% прошли надлежащую оценку безопасности.
Дорис Рапп, врач и пионер в области медицины окружающей среды, сообщила, что в 1998 году было обнаружено более 80 000 различных химических веществ с общим весом 1.2 миллиарда фунтов были использованы в Соединенных Штатах. 1 При населении в то время около 300 миллионов человек, это составляет 4 фунта химикатов на каждого человека в стране. Более того, менее 10% используемых химических веществ были даже частично оценены на предмет безопасности, а в большинстве из них не проводилась оценка безопасности для женщин и детей. Книги доктора Раппса Is This Your Childs World? 2 и Our Toxic World 1 — отличные комплексные работы по клиническим эффектам металлических и неметаллических токсичных химикатов.
Книги доктора Раппса Is This Your Childs World? 2 и Our Toxic World 1 — отличные комплексные работы по клиническим эффектам металлических и неметаллических токсичных химикатов.
Более того, сегодня подавляющее большинство людей подвергаются воздействию не одного химического вещества, а целого ряда химических веществ. В таких случаях кумулятивные эффекты многократного химического воздействия в течение длительных периодов времени намного больше, чем просто аддитивные эффекты таких химикатов. В рамках исследования Рабочей группы по окружающей среде пять лабораторий провели исследование пуповинной крови 10 детей афроамериканского, латиноамериканского и азиатского происхождения, и в каждом новорожденном было обнаружено более 200 химических веществ. 3
Результаты широкомасштабного европейского исследования токсического загрязнения человека показывают, что в крови испытуемых присутствовали 76 стойких, способных к биоаккумуляции и токсичных промышленных химикатов. 4 Всемирный фонд дикой природы (WWF) и Кооперативный банк собрали и проанализировали кровь 47 человек со всей Европы. В их число вошли 39 членов Европейского парламента (MEP), 4 наблюдателей от присоединяющихся стран, 1 бывший член Европейского парламента и 3 сотрудника WWF, представляющие 17 стран Европы. 4 Образцы крови были проанализированы на беспрецедентный 101 химикат из пяти групп: хлорорганические пестициды, такие как дихлордифенилтрихлорэтан (ДДТ), полихлорированные бифенилы (ПХБ), бромированные антипирены, фталаты и перфторированные соединения (ПФУ). В крови испытуемых было обнаружено 76 различных химических веществ из 101 искомого.
4 Всемирный фонд дикой природы (WWF) и Кооперативный банк собрали и проанализировали кровь 47 человек со всей Европы. В их число вошли 39 членов Европейского парламента (MEP), 4 наблюдателей от присоединяющихся стран, 1 бывший член Европейского парламента и 3 сотрудника WWF, представляющие 17 стран Европы. 4 Образцы крови были проанализированы на беспрецедентный 101 химикат из пяти групп: хлорорганические пестициды, такие как дихлордифенилтрихлорэтан (ДДТ), полихлорированные бифенилы (ПХБ), бромированные антипирены, фталаты и перфторированные соединения (ПФУ). В крови испытуемых было обнаружено 76 различных химических веществ из 101 искомого.
Наибольшее количество химикатов, обнаруженных у одного человека, было 54, а среднее количество обнаруженных химикатов — 41.По крайней мере, 13 одинаковых химических веществ были обнаружены у каждого человека, прошедшего тестирование, включая химические вещества, запрещенные в Европе более 20 лет назад, а также химические вещества, широко используемые сегодня, такие как фталаты и ПФУ.