Содержание
Кислоты неорганические — Справочник химика 21
В состав всех углей обязательно входит неорганическая, золообразующая часть, которая тонко или дискретно распределена в органической части угля. Она обычно представлена такими минеральными включениями, как силикаты, кварц, карбонаты и др. В углях низких стадий метаморфизма значительная доля неорганических компонентов присутствует в виде катионов натрия, кальция, магния, железа, алюминия, ассоциированных с карбоновыми кислотами. Неорганическая часть углей отличается также многообразием микроэлементов из обнаруженных 84 элементов периодической системы большая часть присутствует в количествах, не превышающих 0,01% (масс.) [65]. [c.64]
Высокая специфичность внутренней мембраны в отношении проницаемости для разных веществ привела к представлению о существовании в ней ферментов-переносчиков. Так как многие субстраты ферментов, локализованных внутри митохондрий, при физиологических значениях pH являются ионами (нуклеотиды, субстраты цикла трикарбоновых кислот, неорганический фосфат, катионы и т.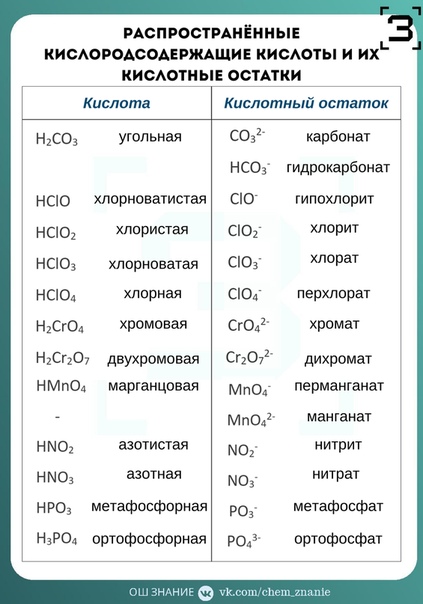 д.), представляет интерес идентификация ионных форм транспортируемых веществ. Такие данные важны для понимания конкретного механизма переноса субстрата через мембрану. [c.458]
д.), представляет интерес идентификация ионных форм транспортируемых веществ. Такие данные важны для понимания конкретного механизма переноса субстрата через мембрану. [c.458]
ТИОЦИАНАТЫ (роданиды) — производные тиоциановой (родановой) кислоты. Неорганические Т.— см. Роданиды. Среди органических Т. наибольшее значение имеют эфиры родановой кислоты — алкил-, арилтиоцианаты общей формулы RS N. Важным свойством Т. является их способность изомеризоваться при на гревании в изотиоцианаты, т. наз. гор чичные масла, которые являются основ ной составной частью эфирного масла полученного из семян черной горчицы где оно содержится в виде гликозида си нигрина. Горчичные масла токсичны пары их раздражают слизистую оболоч ку, жидкие вызывают на коже пузыри Горчичные масла обладают бактерицид ными и инсектицидными свойствами применяются в медицине (горчичный спирт) и как антиоксидант для смазок (см. Горчичные масла). [c.250]
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, сложные в-ва, образуемые всеми хим. элементами (исключение — большинство соед. углерода, к-рые относят к органическим соединениям). По функциональному признаку выделяют след, осн. типы Н. с. оксиды, гидроксиды, кислоты неорганические, соли. По составу различают обычно двухэлементные, или бинарные, Н. с. (чапр., оксиды, гидриды, неорганические галогениды, халькогенидьг, нитриды, фосфиды, металлиды) и Н. с., содержащие больше двух элементов (гидроксиды, оксокислоты, амиды металлов и др.). В отдельную группу выделяют неорг. комплексные соединения. Число известных Н. с. составляет ок. 300 тыс. Они образуют практически всю литосферу, гидросферу и атмосферу Земли. [c.373]
элементами (исключение — большинство соед. углерода, к-рые относят к органическим соединениям). По функциональному признаку выделяют след, осн. типы Н. с. оксиды, гидроксиды, кислоты неорганические, соли. По составу различают обычно двухэлементные, или бинарные, Н. с. (чапр., оксиды, гидриды, неорганические галогениды, халькогенидьг, нитриды, фосфиды, металлиды) и Н. с., содержащие больше двух элементов (гидроксиды, оксокислоты, амиды металлов и др.). В отдельную группу выделяют неорг. комплексные соединения. Число известных Н. с. составляет ок. 300 тыс. Они образуют практически всю литосферу, гидросферу и атмосферу Земли. [c.373]
Кислоты неорганические Азотная [c.210]
В качестве адсорбентов было испытано более сотни веществ, выбранных в разнообразных группах химической системы —от фильтровальной бумаги, до окисей и гидратов окисей, солей различных кислот — неорганических и органических, многоатомных спиртов, амидов, производных бензола, алкалоидов, костяного и кровяного угля.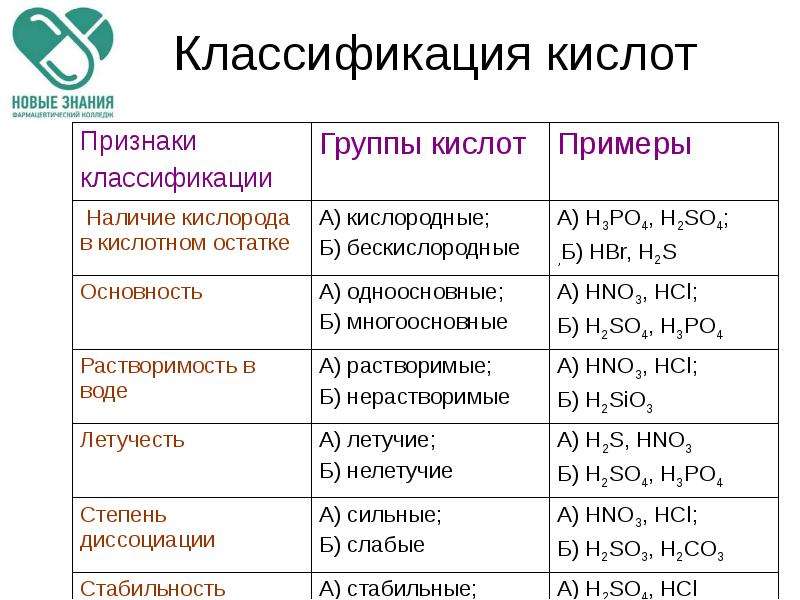 [c.138]
[c.138]
Светло-желтый или желтый мелкокристаллический порошок со слабым запахом ванилина, без вкуса, почти не растворим в воде и спирте, легко растворим в ледяной уксусной кислоте, неорганических кислотах и щелочах. [c.187]
Обмен метаболитами (интермедиатами цикла трикарбоновых кислот, неорганическим фосфатом и некоторыми аминокислотами) между внутренним митохондриальным пространством и цитоплазмой катализируется специальными ферментами, получившими название переносчиков. [c.447]
Количественное определение мышьяка по методу Руппа основано на сравнительно быстро и нацело протекающей реакции мышьяковой кислоты (неорганической) с иодистым калием в кислой среде [c.98]
Минеральные материалы вата 2/327 4/1041, 1042 волокна 2/327, 328 вяжущие 1/870, 871 кислоты, см. Кислоты неорганические клеи 2/800, 801 красящие, см. Пигменты масла, см. Нефтяные масла туки, см. Минеральные удобрения угольные настовые электроды 1/810 Минеральные удобрения 3/171, 172, [c.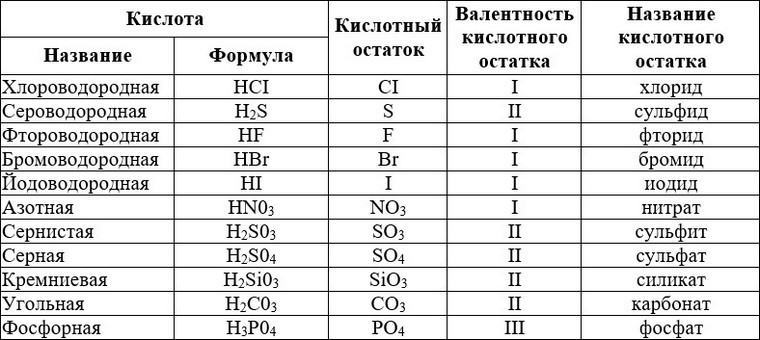 651]
651]
Для обеспечения минерального питания растений в условиях гидропоника применяются различные питательные вещества, включая микроэлементы я железо В качестве железосодержащих компонентов применяют соли серной, хлороводородной и лимонной кислот Неорганические соли быстро осаждаются в виде фосфатов из питательных растворов, поэтому последние приходится корректировать Цитрат железа более устойчив по отношению к фосфатам, но и он недолговечен [c.477]
Кислоты неорганические и их соли [c.375]
Агрессивные индивидуальные среды, приведенные в табл. П.1— П.З, разделены на классы 1) кислоты неорганические и органические, 2) соли и основания, 3) прочие неорганические среды и органические соединения. [c.252]
Неорганические высокое содержание сульфатов дву — и трехвалентного железа, образующихся в результате удаления окалины кислота Неорганические токсичные тяжелые металлы и цианид [c.272]
Все значения /С приводятся в шкале молярно-массовых концентраций (шкала моляль остей). Таблицы расположены в следующем порядке иеоргаин-ческие кислоть , неорганические основания, органические кислоты, органические основания. Констаиты диссоциации веществ, способных диссоциировать как по типу кислоты, так и по типу основания, приводятся соответственно в двух таблицах. [c.232]
Таблицы расположены в следующем порядке иеоргаин-ческие кислоть , неорганические основания, органические кислоты, органические основания. Констаиты диссоциации веществ, способных диссоциировать как по типу кислоты, так и по типу основания, приводятся соответственно в двух таблицах. [c.232]
При дальнейших исследованиях селекции бактериальных деструкторов были получены микроорганизмы, способные к очистке сточных вод и от других токсичных веществ органических спиртов, жирных кислот, неорганических соединений и др. Для глубокого обезвреживания сточных вод многокомпонентного состава можно использовать ступенчатую очистку специфической для каждой ступени микрофлорой либо одноступенчатую очистку сочетанием различных по ферментативной способности микроорганизмов или одноступенчатую — монокультурами бактерий с широким спектром ферментов биодеградации и др. [13]. [c.305]
Кроме сахарной промышленности, угли такого типа применяются для обесцвечивания напитков (коньяков, вин, фруктовых соков), лекарств и наркотиков (ацетанилида, алколоидов, кофеина, салициловой кислоты), неорганических кислот (борной, фосфорной), органических кислот (лимонной молочной, уксусной) и других органических веществ (ацето. г, спирты, глицерин), компонентов средств чистки (четыреххлористый углерод, бензин, эфирные масла), жпров и масел (например, воска), смол (агар, желатина, пектин), солей и неорганических веществ (бура, сульфат натрия, хлорид свинца, сульфат цинка). В ряде случаев одновременно с обесцвечиванием происходит удаление из продуктов запаха, привкуса, коллоидных и иных примесей. Этот тип угля эффективен и в процессах водоочистки. [c.296]
г, спирты, глицерин), компонентов средств чистки (четыреххлористый углерод, бензин, эфирные масла), жпров и масел (например, воска), смол (агар, желатина, пектин), солей и неорганических веществ (бура, сульфат натрия, хлорид свинца, сульфат цинка). В ряде случаев одновременно с обесцвечиванием происходит удаление из продуктов запаха, привкуса, коллоидных и иных примесей. Этот тип угля эффективен и в процессах водоочистки. [c.296]
ПОЛИ КИСЛОТЫ — неорганические кислородные кислоты, молекулы которых содержат более одного кислотного остатка. П.— комплексные соединения. П., молекулы которых содержат остатки одной кислоты, например тетрахро-мовая Нз [Сг01 (СгОо)з], называются изо-поликислотами. П. различных кислот, например, фос4юрно-вольфрамовая [c.197]
ОСНОВАНИЯ [ еорганические. К соед. этого типа относят гидроксиды, группы он к-рых могут быть замещены на кислотные остатки (см. Кислоты неорганические), а также аек-рые соед. , не содержащие ОН-групп, например Nh4, HiN—Nh3. О раэл. толкованиях термина — основание см. Кислоты и основания. [c.419]
, не содержащие ОН-групп, например Nh4, HiN—Nh3. О раэл. толкованиях термина — основание см. Кислоты и основания. [c.419]
Кислоты неорганические. Азотная кнслота. Борная кислота. Броыистоводород-ная кислота. Бромистый водород. Йодная кислота. Ионообменные смолы. Полифосфорная кислота. Серная кислота. Соляная кислота. Фосфорная кислота. Фтористый водород. Фтористый водород — бора трифторид. Хлориридневая кислота. Хлористый водород. [c.665]
Общую щелочность вод определяют их титрованием в соляной кислоте. Общая щелочность, характеризуемая наличием анионов слабых кислот неорганического и органического происхождения (НСОз , СОз , Н5 , Н510з , 5 ), выражается в мг-зкв/л. [c.92]
В свете электронной теория К. и о. в-ва, рассматриваемые как к-ты, протонной теорией не выделяются среди прочих Однако с учетом научной традиции и специфич. св-в протона понятие к-ты обычно используют применительно к реагентам, отщепляющим ион водорода, см.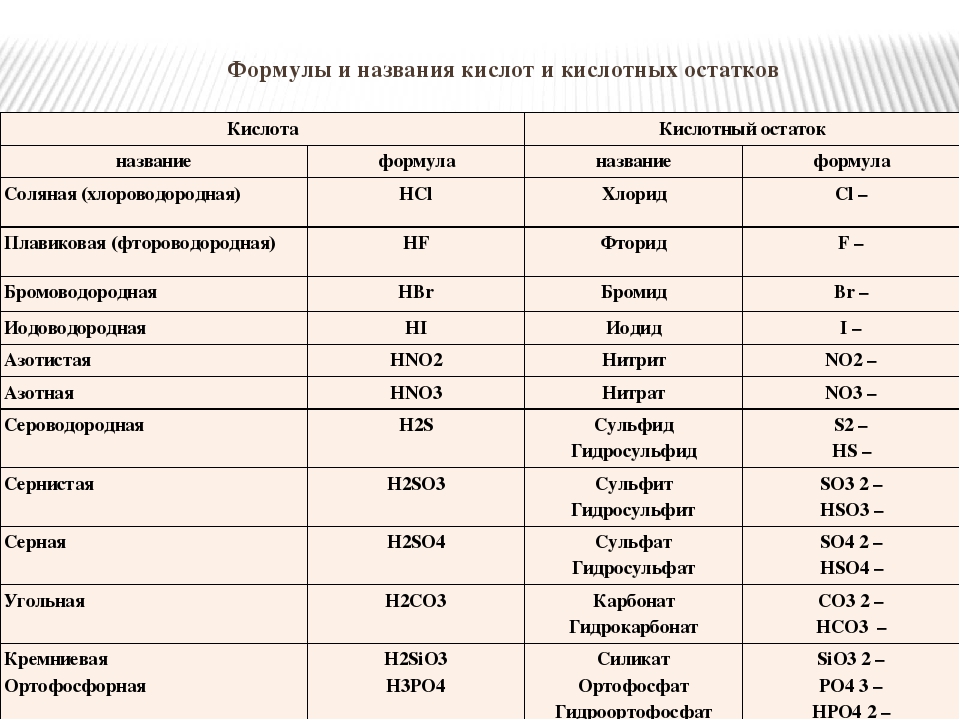 , иапр.. Карбоновые кислоты, СН-Кислоты, Кислоты неорганические. Когда шппут о кислотно-основном взаимод. в-в, не содержащик протонов, то такие в-ва наз. апротонными к-тами, льюисовскими к-тами, кяслотоподобными в-вами, антиоснованиями или просто акцепторами. [c.395]
, иапр.. Карбоновые кислоты, СН-Кислоты, Кислоты неорганические. Когда шппут о кислотно-основном взаимод. в-в, не содержащик протонов, то такие в-ва наз. апротонными к-тами, льюисовскими к-тами, кяслотоподобными в-вами, антиоснованиями или просто акцепторами. [c.395]
Доноры протонов в П.-к-ты Брёнстеда (см. Кислоты и основания), в частности ОН-, NH-, СН- и вообще ЭН-кис-лоты (см. СН-кислоты), акцепторы-разл. осиования. Возможность протекания П. обусловлена относит, силой к-ты и основания. Напр., для таких сильных оснований, как карбанионы или амидные анионы, донорами протонов могут служить весьма слабые СН-кислоты сильные протонные к-ты и особенно сверхкислоты (см. Кислоты неорганические) позволяют осуществить протонирование таких молекул, как карбоновые к-ты и даже насьпц. углеводороды, иапр. [c.126]
СВЕРХКИСЛбТЫ, см . Кислоты неорганические. СВЕРХПРОВОДНИКЙ, в-ва, в к-рых при понижении т-ры до нек-рой критич. величины 7 обнаруживается явление сверхпроводимости-их электрич. сопротивление полностью исчезает. При этом С. ведут себя как вдеальные диамагнети-ки с аномально большой магн. восприимчивостью % = = — 1 11, следствием чего является выталкивание магн. поля из объема С. (эффект Мейснера). При увеличении напряженности магн. поля до нек-рой критич. величины происходит разрушение сверхпроводящего состояния. [c.296]
сопротивление полностью исчезает. При этом С. ведут себя как вдеальные диамагнети-ки с аномально большой магн. восприимчивостью % = = — 1 11, следствием чего является выталкивание магн. поля из объема С. (эффект Мейснера). При увеличении напряженности магн. поля до нек-рой критич. величины происходит разрушение сверхпроводящего состояния. [c.296]
КИСЛОТЫ неорганические, подразделяются на кислородсодержащие (оксокислоты) НЛОи и бескислородные [c.258]
Серии, этаноламии, холии (эти соединения структурно взаимосвязаны, поскольку этаноламии и холин образуются из серина). Сфингозин (частично является производным жирной кислоты). Неорганический фосфат и сульфат, а также органические сульфонаты н фосфонаты. [c.147]
В табл. УА (реакции р-пропиолактона) принят следуюпц произвольный порядок расположения реагентов вода, спирт фенолы, тиофенолы, меркаптаны и другие серусодержащие орг нические соединения, аммиак и амины, третичные амины, сш неорганических и органических кислот, неорганические и орган] ческие кислоты и их производные, магнийорганические соедини ния, соединения с активной метиленовой группой и, наконец, в[c. 420]
420]
Интересный метод разработан [473] для определения ангидридов и хлорангидрндов в присутствии неорганических и органических кислот. Неорганическую кислоту определяют титрованием в среде диоксана затем раствор нагревают с этиловым спиртом и хлорангидрид определяют титрованием выделившейся соляной кислоты. Содержание органической кислоты определяют по разности после определения общей кислотности. При анализе смеси ангидрида и органической кислоты исследуемое вещество титруют в среде диоксана спиртовым раствором метилата натрия, причем ангидрид титруется как одноосновная кислота. Другую часть раствора нагревают с пиридином и титруют раствором гидроокиси триметилбензиламмония в присутствии тимолового синего, причем ангидрид титруется как двухосновная кислота. Из двух титрований вычисляют содержание ангидрида и кислоты. Определение ангидридов в присутствии кислот описано и в других работах [474]. [c.137]
Многочисленными исследованиями [8 20 41, с. 38 50 51 68—72] было установлено, что защитное действие ряда органических азотсодержащих ингибиторов углеродистой стали в кислых средах можно значительно повысить введением в раствор кислоты неорганических анионов С -, Вг-, 1-, NS, НЗ» нли анпон активных органических соединений (карбоновых и сульфокислот). Наиболее детально изучено синергетическое действие галогеиид-ионов, которые по-видимому, являются универсальными синергетиками для органических катионов. Образование последних легко протекает в кислых растворах по схеме [c.38]
Наиболее детально изучено синергетическое действие галогеиид-ионов, которые по-видимому, являются универсальными синергетиками для органических катионов. Образование последних легко протекает в кислых растворах по схеме [c.38]
Первые биохимические установки были введены в эксплуатацию в начале 40-х гг. 20 в. и затем получили илирокое распространение на металлургических и коксохимических предприятиях. Удаление фенолов на них достигает 99,5-99,9%. В дальнейшем селекцией бактериальных деструкторов получены микроорганизмы, способные к очистке сточных вод и от других токсичных вещест (спиртов, жирных кислот, неорганических соединений и др.). [c.268]
Смешивание растворов гидроксосолей алюминия с нормальными солями многовалентных металлов или пептизация гидроксида алюминия в их растворах приводит к образованию полимерных солей сложного состава, обладающих свойствами катионов металлов. Изменяя природу кислот (неорганическая или органическая), валентность и радиус катионов металлов, можно получать полимеры, представляющие собой органо-минеральные системы, полиионы которых состоят из химически связанных катионов и анионов органического и неорганического присхож-деийя.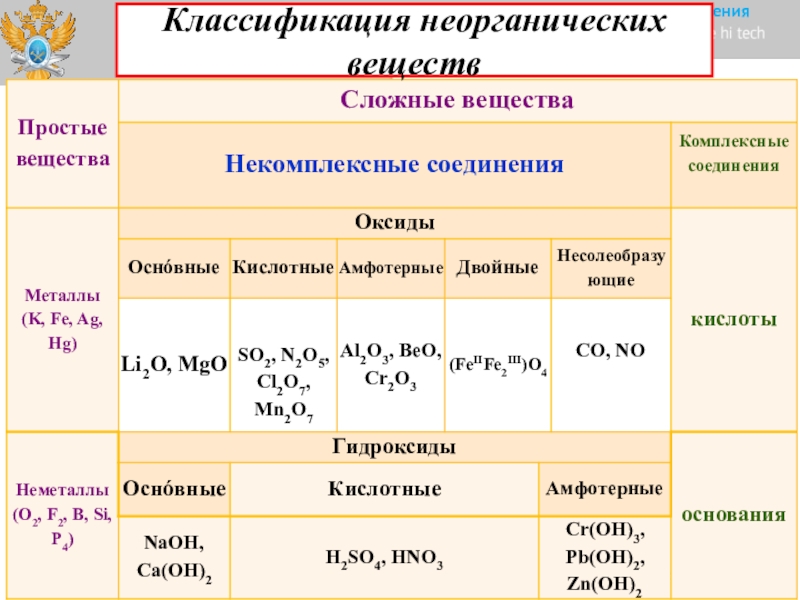 [c.84]
[c.84]
Древесина состоит из трех основных компонентов целлюлозы, лигнина и пемицеллюлоз. Кроме того, в ее состав входят жиры, воск, органические кислоты, неорганические соли и т.д Вьщеление из древесины целлюлозного материала, пригодного для сиитеза ацетатов, задача сложная. [c.21]
ОСНОВАНИЯ неорганические. К соед. этого типа относят гидроксиды, группы ОН к-рых могут быть замещены на кислотные остатки (см. Кислоты неорганические), а -сакже век-рые соед., не содержащие ОН-групп, например КНз, [c.419]
Урок химии в 11 классе по теме: «Кислоты органические и неорганические»
Тема урока: Кислоты неорганические и органические.
Цель: Изучение и закрепление знаний о кислотах и их свойствах.
Задачи.
Образовательные: выработать представление о наличие общих химических свойств кислот; закрепить умения пользоваться рядом напряжения металлов и таблицей растворимости.
Развивающие: выяснить причины общности химических свойств кислот;
прогнозировать возможные химические реакции кислот с использованием ряда напряжений металлов и таблицы растворимости; установить закономерности и отработать умения писать уравнения реакций взаимодействия кислот с основаниями, основными оксидами, металлами и солями; отработать навыки работы с лабораторным оборудованием.
Воспитательные: осознание учащимися места неорганических кислот в системе естествознания наряду с организмами; понимание взаимосвязи полученных знаний о химических свойствах кислот с функционированием организма человека, применение в быту.
Оборудование: микролаборатория для химического эксперимента, влажные салфетки, аскорбиновая кислота, лимон, NaOH, Na2CO3, HCl, CaO, Zn, фенолфталеин, индикаторная бумага, пробирки
Ход урока
1. Организационный момент
Организационный момент
2.Изучение нового
Учитель: Тема нашего урока: «Кислоты органические и неорганические».
Мы с вами сегодня повторим, обобщим, систематизируем и углубим знания о неорганических и органических кислотах, об их составе, свойствах и применении. Во время работы на уроке будут проводится лабораторные опыты. Работу вы будете выполнять в группах по инструкции, которая находится у вас на столах. Результаты работы вы запишите в таблицу «Общие химические свойства кислот», которую вы подпишите и сдадите на проверку. Каждая группа будет отчитываться за выполненное задание.
Учитель: В повседневной жизни, в быту и природе мы часто сталкиваемся с кислотами. Скажите, где вы используете, и встречаются кислоты?
Ученики:
Если ты проглотил аскорбинку,
Твой организм получил витаминку.
Она закрывает болезни врата –
Аскорбиновая кислота.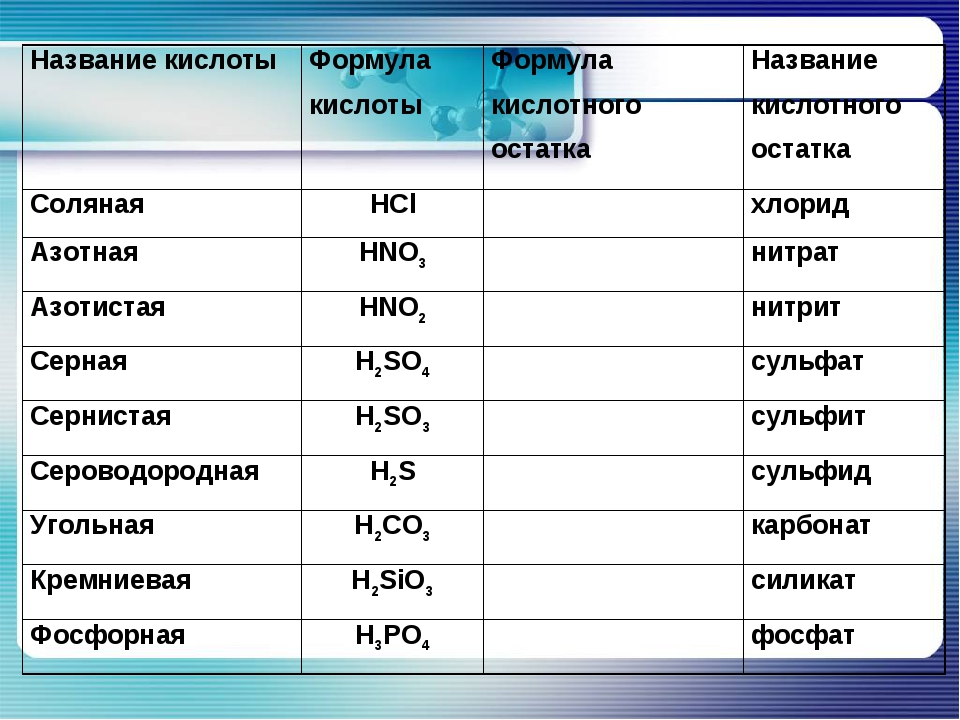
Вы простудились – болит голова,
Вас аспирин выручает всегда.
Ну, и бесспорно, полезен лимон,
Кислотою, лимонной наполнен он.
Жуйте лимон, если горло болит,
Сок чудотворный вас исцелит.
Яблоко ешь – кислый вкус, красота,
В яблоке яблочная кислота.
Яблочный уксус по ложечке пейте,
Вы обязательно похудеете.
Уксус в столовой на кухне хранится
Для консервации он пригодится.
Ну и компресс из него помогает,
Быстро он жар при простуде снижает.
Фрукты и овощи, щавель, крапива
Содержат кислоты – это не диво.
Есть в муравьях и крапиве – невинная,
С пользой для нас кислота муравьиная.
Жжёт она кожу, но есть в ней и прок-
Ваш ревматизм она вылечит в срок.
Лучше не жуйте косточки вишни,
Косточки сливы – это всё лишнее.
Будет вам плохо – диагноз такой:
Отравились синильной вы кислотой.
Учитель: Вы просто молодцы, знаете, где встречаются кислоты в природе.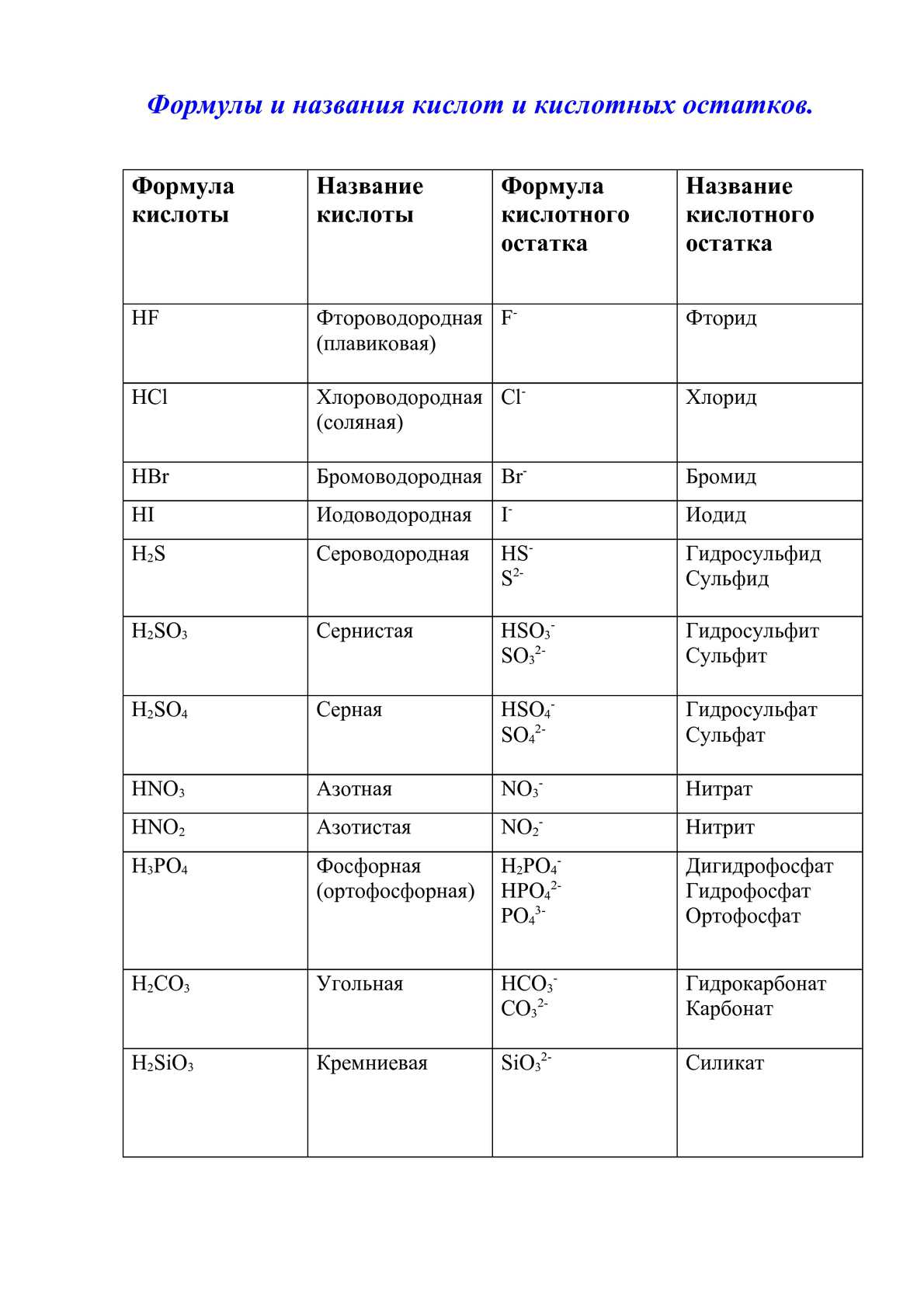
Я лишь хочу добавить, что в желудке человека содержится сильная бескислородная одноосновная кислота — своеобразный санитарный кордон для микробов, которые попадают в организм с пищей.
При скисании виноградного сока получается уксусная кислота, а при скисании молока или квашении капусты и при силосовании кормов для скота – молочная кислота.
Учитель: в 8, 9и 10 классах вы уже говорили о кислотах, поэтому я прошу вас вспомнить определение кислоты.
Ученики: Кислоты — это сложные вещества, в молекулах которых один или несколько атомов соединены с кислотными остатками.
Кислоты – это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотного остатка.
Какое определение можно дать органическим кислотам?
Учитель: Как и в биологии в химии существует классификация. Кислоты можно классифицировать по нескольким признакам, классификация кислот распечатана и лежит на ваших столах. Как же классифицируют кислоты? Каковы принципы классификации?
Как же классифицируют кислоты? Каковы принципы классификации?
Ученики: рассказывают о классификации кислот.
Учитель: А теперь рассмотрим химические свойства кислот. Какими же свойствами будут обладать кислоты?
Ученики: кислый вкус, действие на индикаторы, электрическая проводимость растворов, взаимодействие с металлами, оксидами металлов, основаниями, солями – все эти свойства характерны как для органических, так и для неорганических кислот.
Учитель: проведём лабораторную работу по инструкциям, которые находятся на ваших столах.
Инструкция для выполнения лабораторной работы
Инструкция к заданию 1
Цель: сравнить взаимодействие неорганических и органических кислот с металлами.
Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, магний, цинк.
Возьмите пробирку и налейте в неё 1мл соляной кислоты и поместите туда 1-2 гранулы цинка.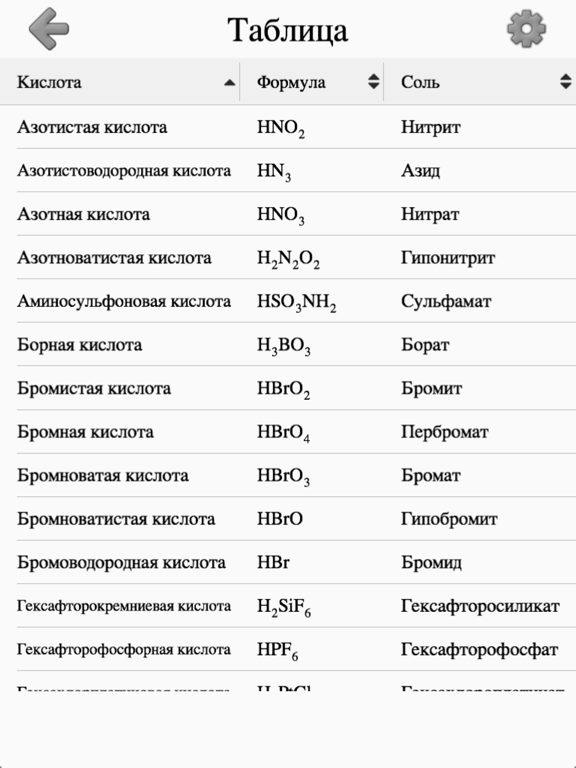 Что наблюдаете? Во вторую пробирку поместите 1-2 гранулы цинка и добавьте 1мл уксусной кислоты. Что наблюдаете? Повторите опыте с магнием соляной и уксусной кислотами. Сделайте запись в таблице. Запишите уравнения реакций.
Что наблюдаете? Во вторую пробирку поместите 1-2 гранулы цинка и добавьте 1мл уксусной кислоты. Что наблюдаете? Повторите опыте с магнием соляной и уксусной кислотами. Сделайте запись в таблице. Запишите уравнения реакций.
Инструкция к заданию 2
Цель: сравнить взаимодействие неорганических и органических кислот с оксидами металлов.
Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, оксид кальция.
В 2 пробирки поместите немного оксида кальция. Прилейте к нему растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения химических реакций.
Инструкция к заданию 3
Цель: сравнить взаимодействие неорганических и органических кислот с солями
Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, раствор карбоната натрия
В 2 пробирки налейте по 1-2 мл раствора карбоната натрия, затем к нему прилейте растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения химических реакций.
Инструкция к заданию 4
Цель: сравнить взаимодействие неорганических и органических кислот с основаниями
Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, растворы гидроксида натрия и фенолфталеин.
В пробирку налейте 1мл гидроксида натрия, добавьте в него несколько капель фенолфталеина. Что наблюдаете? Затем по каплям прилейте соляной кислоты. Что наблюдаете? Во второй пробирке проведите такую же реакцию с уксусной кислотой. Сделайте соответствующую запись в таблицу
Учитель: результаты опытов учащиеся вносят в таблицу « Свойства кислот».
Учитель: Давайте подведём итог урока и ответим на вопросы.
1.В чём проявляется сходство органических и неорганических кислот?
2.Чем определяются свойства органических и неорганических кислот?
3.Как можно определить наличие кислот в продуктах питания?
4.Почему при изжоге медики советуют применять растворы пищевой соды или лекарственные препараты, содержащие карбонат кальция, гидроксиды алюминия или магния?
5.Каково применение кислот в быту? Какие кислоты находят наибольшее применение в быту?
Учитель : итак, кислоты органические и неорганические имеют сходства в химических свойствах, т.к.они имеют черты сходства в строении.
3.Рефлексия
Учитель: как вам понравился урок? Выразите своё отношение к уроку путём выбора картинки №1 или №2 на слайде презентации. А теперь для закрепления выполните тесты.
4.Закрепление
Выбери правильный ответ.
А-1
С какими из приведённых веществ не будет взаимодействовать соляная кислота:
а) Al
б) Hg
в) Zn
А-2
В какой цвет окрасится лакмус в растворе соляной кислоты:
а) синий
б) малиновый
в) красный
А-3
Реакция взаимодействия кислот со щелочами называется:
а) замещения
б) нейтрализации
в) соединения
А -4
В результате взаимодействия соляной кислоты с нитратом серебра выпадает :
а) чёрный осадок
б) красный осадок
в) белый осадок
А -5
За общие свойства кислот отвечает:
а) ион водорода
б) ион металла
в) ион кислотного остатка.
А-6 С какими веществами реагирует уксусная кислота:
А) оксид магния б) углекислый газ в) соляная кислота
А-7 Реакция этерификации – взаимодействие кислоты с
А) металлом б) спиртом в) основанием
А-8 Первые представители кислот при н.у. по агрегатному состоянию
А)твердые б)газы в) жидкости
А-9кислотные остатки карбоновых кислот имеют заряд
А)-2 б)+1 в)-1
А-10 Кислотам изомерны
А)спирты б)сложные эфиры в) альдегиды
5.Задание на дом: п 22.№1-7
Открытый урок по теме: «Кислоты органические и минеральные» 11 класс
КИСЛОТЫ ОРГАНИЧЕСКИЕ И НЕОРГАНИЧЕСКИЕ.
Урок изучения нового материала
Цели:
— обобщить, систематизировать и углубить знания учащихся о кислотах органических и неорганических, об их составе, свойствах и применении;
— научить учащихся определять принадлежность веществ к кислотам, характеризовать общие химические свойства кислот, объяснять зависимость свойств кислот от их состава и строения;
— научить учащихся использовать приобретенные знания и умения в практической деятельности и повседневной жизни для объяснения химических явлений, происходящих в быту, природе и на производстве, для экологически грамотного поведения в окружающей среде, безопасного обращения с веществами и лабораторным оборудованием.
Тип урока: комбинированный;
Основные понятия: NaOH, Na2CO3, HCl, фенолфталеин, CaO, индикатор бумага, Zn; пробирки, таблица «Окраска индикаторов в различных средах», инструкции по выполнению лабораторной работы, таблица «Общие химические свойства органических и неорганических кислот», бутылочка с газированной водой.
Ход урока
- Организационный момент (2 мин.)
Сообщение темы, цели урока, методов, формы работы.
Учитель: Тема нашего урока – «Кислоты органические и неорганические». Мы с вами должны повторить, обобщить, систематизировать и углубить знания о неорганических и органических кислотах, об их составе, свойствах и применении.
Во время работы на уроке будут проводиться лабораторные опыты. Работу выполнять вы будете в группах, по инструкции, которая находится у вас на столах. Результаты лабораторной работы я попрошу записать в таблицу «Общие химические свойства органических и неорганических кислот», которую вы подпишите и сдадите на проверку. По итогам проверки будут выставлены оценки. Каждая группа будет работать со своим заданием. Один человек от группы отчитывается за проведенную работу, делает выводы и записывает молекулярные и сокращенные ионные уравнения реакции на доске. В группе выбирается консультант, который будет следить за выполнением работы, проверять и оценивать работу участников группы. Оценку консультант ставит на листке. При оценке за урок будут учитываться оценка, выставленная консультантом, правильность выполнения работы и ответы на уроке.
- Изучение нового материала (30 мин.)
Учитель: В повседневной жизни, быту и природе мы часто сталкиваемся с кислотами. Скажите, где используются и встречаются кислоты?
Ученики: Этот класс соединений широко распространен в природе. Например, в желудке человека содержится сильная бескислородная одноосновная соляная кислота – своеобразный санитарный кордон для микробов, которые попадают в желудок вместе с пищей. Соляная кислота желудка создает благоприятную среду для работы пищеварительного фермента пепсина, который расщепляет белки. Следовательно, соляная кислота – необходимое для пищеварения вещество. При недостаточной кислотности желудочного сока больным предписывают принимать аптечные препараты, содержащие соляную кислоту. Однако и избыток соляной кислоты в желудке грозит дискомфортом, который известен под названием изжога. В этом случае нередко избыток кислоты гасится с помощью минеральных карбонатных и гидрокарбонатных вод.
В природе наблюдается многообразие органических кислот: лимонная кислота содержится в лимонах, яблочная – в яблоках, щавелевая – в листьях щавеля. Муравьи защищаются от врагов, разбрызгивая жидкость, содержащую муравьиную кислоту. Эта кислота содержится в пчелином яде и в жгучих волосках крапивы. Помогает сохранять свежими ягоды клюквы или брусники в течение многих месяцев содержавшаяся в них бензойная кислота.
При скисании виноградного сока получается уксусная кислота, а при скисании молока, при квашении капусты и при силосовании кормов для скота – молочная кислота.
Учитель: В 8,9 и 10 классах вы уже говорили о кислотах, поэтому я попрошу вас вспомнить определение кислот (по составу или с точки зрения ТЭД).
Ученики: Кислоты – это сложные вещества, в молекулах которых один или более атомов водорода соединены с кислотным остатком.
Кислоты – это электролиты, которые диссоциироют с образованием катионов водорода и анионов кислотного остатка.
Учитель: Вспомните, какое определение вы давали органическим кислотам.
Ученики: Вещества, содержащие в молекуле одну или несколько карбоксильных групп, соединенных с углеводородным радикалом, называются карбоновыми кислотами.
В 1923 году была создана протолитическая теория кислот и оснований Бренстеда–Лоури. Согласно этой теории, кислоты – это молекулы или ионы которые являются в данной реакции донорами катионов водорода, то есть отдают их; основания – это молекулы или ионы, которые принимают катионы водорода, то есть являются акцепторами водорода.
Учитель: Как в биологии, так и в химии существуют принципы систематизации и классификации. Кислоты как одну из групп химических веществ можно классифицировать по различным признакам. Откройте учебник на с. 182, изучите таблицу 6 «Классификация кислот», выявите признаки классификации кислот.
Назовите общие признаки классификации кислот. Определите особые признаки классификации органических и неорганических кислот.
Ученики: Для органических кислот характерна классификация по строению углеводородного радикала – на предельные, непредельные и ароматические. А для неорганических кислот характерна классификация по наличию кислорода – бескислородные и кислородосодержащие. Для органических кислот эта классификация нехарактерна, т.к. органические кислоты все кислородосодержащие: карбоксильная группа имеет состав – COOH.
Учитель: Рассмотрим строение кислот. В неорганических кислотах связь водорода с галогеном и кислородом сильно полярна, в результате чего водород становится подвижным и может отщепиться в виде протона. В органических в результате взаимного влияния атомов в карбоксильной группе атом водорода группы – OH очень подвижен. Электронная плотность связи О–Н сильно смещена к атому кислорода.
А теперь рассмотрим химические свойства кислот.
На основании строения и классификации кислот давайте спрогнозируем, какими общими химическими свойствами могут обладать кислоты. Кислый вкус, действие на индикаторы, электрическая проводимость растворов, взаимодействие с металлами, оксидами металлов, основаниями и солями, основание сложных эфиров со спиртами – все эти свойства являются общими как для неорганических, так и для органических кислот. Так как свойства являются общими, то принципиального значения не имеет, какую кислоту мы возьмем для эксперимента.
Проведем лабораторную работу по доказательству данного утверждения. Возьмем из неорганических кислот соляную кислоту, а из органических – уксусную кислоту. Работу выполним в группах по инструкции, которая находится на ваших столах. Результаты лабораторной работы я попрошу записать в таблицу «Общие химические свойства органических и неорганических кислот», которую вы подпишите и сдадите на проверку. Группа выполняет один опыт, консультант проверяет, ставит оценки и отчитывается сам или предлагает одного из участников группы для отчета у доски, который делает выводы по проделанной работе и записывает молекулярные и сокращенные уравнения реакций.
Инструкции для выполнения лабораторной работы по группам.
Инструкция группе 1
Цель: сравнить взаимодействие неорганических и органических кислот с металлами.
Оборудование и реактивы: растворы соляной и уксусной кислот, Mg, Zn; пробирки.
Возьмите пробирку и налейте в нее 1 мл соляной кислоты, затем поместите в нее 1-2 гранулы цинка. Что наблюдаете? Во вторую пробирку поместите магниевую стружки и прилейте 1 мл уксусной кислоты. Что наблюдаете? Сделайте соответствующую запись в таблице. Запищите уравнения реакции.
Инструкция группе 2
Цель: сравнить взаимодействие неорганических и органических кислот с оксидами металлов.
Оборудование и реактивы: растворы соляной и уксусной кислот, оксид кальция, пробирки.
В 2 пробирки поместите немного оксида кальция. Прилейте к нему растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения реакций.
Инструкция группе 3
Цель: сравнить взаимодействие неорганических и органических кислот с солями.
Оборудование и реактивы: растворы соляной и уксусной кислот, раствор карбоната натрия, пробирки.
В 2 пробирки налейте по 1-2 мл раствора карбоната натрия, затем к нему прилейте растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Запишите уравнения реакций.
Инструкция группе 4
Цель: сравнить взаимодействие неорганических и органических кислот с основаниями.
Оборудование и реактивы: растворы соляной и уксусной кислот, растворы гидроксида натрия и фенолфталеина, пробирки.
В пробирку налейте 1 мл гидроксида натрия, добавьте в него несколько капель фенолфталеина. Что наблюдаете? Затем по каплям прилейте соляной кислоты. Что наблюдаете? Во второй пробирке проведите такую же реакцию с уксусной кислотой. Сделайте соответствующую запись в таблице. Запишите уравнения реакций.
Инструкция группе 5
В дополнительной литературе найти сведения об ангидридах, их получении из кислот; найти примеры этерификации с участием органических и неорганических кислот.
Группы выносят результаты своей работы на доску и озвучивают. По мере работы каждый ученик заполняет таблицу сравнения свойств кислот.
Неорганические | Органические | Доп. балл |
1. Молекулы кислот в водном растворе диссоциируют на катионы водорода и анионы кислотных остатков, растворы кислот изменяют цвет индикаторов. | ||
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. | ||
3. Кислоты реагируют с оксидами металлов при условии, что образуется растворимая соль. | ||
4. Кислоты реагируют с солями летучих и нерастворимых кислот. | ||
5. Кислоты реагируют с основаниями. | ||
6. Кислоты могут образовывать ангидриды. | ||
7. Кислоты реагируют со спиртами. | ||
В результате у учащихся должна получиться такая таблица.
Общие химические свойства органических
и неорганических кислот
Неорганические кислоты | Органические кислоты |
1. Молекулы кислот в водном растворе диссоциируют на катионы водорода и анионы кислотных остатков, растворы кислот изменяют цвет индикаторов. | |
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. | |
3. Кислоты реагируют с оксидами металлов при условии, что образуется растворимая соль. | |
4. Кислоты реагируют с солями при условии, что образуется осадок, газ или другое мало диссоциирующее вещество. | |
5. Кислоты реагируют с основаниями. | |
6. Кислоты могут образовывать ангидриды. | |
Некоторые кислоты разлагаются с образованием кислотных оксидов. | Для органических кислот также характерно образование ангидридов, только данная реакция идет сложнее, под действием водоотнимающих веществ, например оксида фосфора. |
7. Кислоты могут реагировать со спиртами. | |
- Выводы (5мин.)
Учитель задает учащимся следующие вопросы:
- В чем проявляется сходство органических и неорганических кислот?
- Чем определяются общие свойства органических и неорганических кислот?
- Как можно определить наличие кислоты в продуктах питания?
- Почему медики советуют при изжоге применять раствор пищевой соды или лекарственные препараты, содержащие карбонат кальция, гидроксиды алюминия или магния?
- Каково применение кислот в быту? Какие кислоты находят наиболее широкое применение в быту?
(Соляная кислота – желудочный сок, паяльная кислота; серная кислота – электролит для аккумуляторов, «хлеб химической промышленности», производство удобрений, лекарственный препаратов и т.д.; лимонная, уксусная кислота – консервирование, изготовление напитков, хлебопечение и кондитерские изделия; муравьиная – елочные игрушки (реакция «серебряного зеркала»), лекарственное средство).
Учитель: А теперь я попрошу вас дать мне совет. Мне для консервирования необходимо 200 граммов 6%-ного раствора уксусно1 кислоты. Но в магазине продается только 70%-ный раствор, объемом 200 мл и плотностью 1,07 г/мл – эссенция. Сколько мне необходимо взять эссенции, чтобы приготовить раствор для консервирования?
Домашнее задание: §22; письменно упр. 4, 5 и задачи 7 – 8. Инструкции для выполнения лабораторной работы по группам.
«Кислоты органические и неорганические. Классификация и общие свойства кислот»
Конспект открытого урока химии в 11 классе
«Кислоты органические и неорганические. Классификация и общие свойства кислот»
Тема урока | Кислоты |
Место урока в теме | Раздел «Вещества и их свойства»,, урок 12 |
Тип урока | Систематизация и обобщение знаний |
Вид урока | Комбинированный |
Цели урока: образовательные | Систематизировать и обобщить знания о номенклатуре, классификации и свойствах неорганических и органических кислот, их роли в хозяйственной деятельности и повседневной жизни человека |
развивающие | Развивать: учебно-информационные навыки: умение извлекать информацию из устного сообщения, наблюдаемых процессов, схем, таблиц; учебно-логические: умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы; учебно-организационные: организовывать самостоятельную деятельность. |
воспитательные | Совершенствовать коммуникативные умения в ходе коллективного обсуждения. Продолжить формирование естественнонаучной картины мира. Продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию свойств веществ и их обоснованного и безопасного использования. |
Содержание урока | Номенклатура, классификация и общие свойства кислот. Закономерности изменения кислотных свойств от состава кислот. Нахождение в природе, роль в живом организме, применение в хозяйственной деятельности человека. |
Требования к знаниям и умениям учащихся: | Должны знать: определение, номенклатуру, принципы классификации кислот, основные химические свойства неорганических и органических кислот, закономерности изменения свойств кислот, образованных элементами одного периода, одной подгруппы Периодической системы, закономерности изменения свойств кислородсодержащих кислот, образованных элементом в разной степени окисления. |
Должны уметь: подтверждать изученные свойства и закономерности уравнениями химических реакций. Осуществлять химический эксперимент, выполняя правила ТБ. | |
Этапы | Организационный этап – 2 мин Вводная часть: мотивация, тема и цели урока – 8 мин Систематизация и обобщение знаний – 20 мин Первичная проверка степени усвоения материала – 8 мин Контроль и самопроверка знаний – 4 мин. Подведение итогов – 2 мин Домашнее задание – 1 мин |
Средства обучения | Компьютер, мультимедийное сопровождение, оборудование и реактивы для лабораторных опытов, таблица растворимости, Периодическая система химических элементов, ряд активности металлов |
Методы и приемы обучения | Репродуктивный, метод поисковой беседы, лабораторно- практический |
Способы мотивации учения | Связь темы с повседневной жизнью и кругом интересов учащихся (использование компьютерных технологий для выполнения творческого домашнего задания) |
Формы организации учебной деятельности | Коллективная, групповая, индивидуальная, |
Виды познавательной деятельности | Участие в беседе, выполнение лабораторных опытов |
Способы управления познавательной деятельностью | Ознакомление с целями и задачами урока, сообщение плана урока, информирование о виде контроля. |
Способы отслеживания результатов | Тестовое задание, два варианта. Лист самоконтроля |
Домашнее задание | О.С.Габриелян, «Химия -11», § 20 ч 1, с 251, в 1. Творческое задание – составить опорный конспект или компьютерную обучающую программу «Классификация и свойства кислот» |
Организационный этап – 1 мин
Вводная часть: мотивация, тема и цели урока – 2 мин
Изучили классификацию органических и неорганических веществ. На сегодняшнем уроке подробно изучаем 1 из классов неорганических веществ. Какой – вы можете сказать самостоятельно, прослушав информацию.
Эти вещества содержатся во всех живых организмах. Много их в овощах и фруктах. У человека вещество этого класса входит в состав желудочного сока. Другое – содержится в листьях крапивы и выделениях муравьёв.
(вывод учащихся по теме урока, сообщение темы)
О кислотах мы говорили в 8,9,10 классах. Каковы же цели сегодняшнего урока? что мы хотим узнать, чему научиться?
(выводы учащихся по целям урока, сообщение целей урока)
Насколько важны для нас эти знания? Сталкиваемся ли мы в обычной жизни с кислотами?
(ответы учащихся)
Кислоты содержатся в организмах животных: молочная кислота образуется в мышцах при физической нагрузке, соляная кислота, находящаяся в желудке, помогает переваривать пищу.
Кислоты применяются в медицине: аскорбиновая, фолиевая, липоевая, ацетил-салициловая и другие кислоты
Кислоты применяются в кулинарии: уксусная и лимонная
Образование кислотных дождей в природе.
эпиграф: «День прожит не зря, если ты узнал что-то новое».
Актуализация и проверка знаний – 10 мин
Прежде чем перейти к новому материалу, проверим, как вы усвоили материал предыдущего урока и вспомним основные моменты, которые пригодятся нам при изучении нового темы.
Фронтальный опрос (закончить предложение)
Неорганические вещества делятся на 2 группы — …
Простые вещества состоят …
Сложные вещества состоят …
Сложные вещества делятся на ….
Оксиды – это …
Оксиды делятся на …
Гидроксиды делятся на …
Основания – это …
Основания делятся на …
Кислоты – это …
Органические кислоты – это …
Амфотерные гидроксиды – это …
Соли – это …
Тест (объяснение правил работы с листами самоконтроля)
Выписать № формул, соответствующих:
А. Основным оксидам
Б. Кислотным оксидам
В. Амфотерным оксидам
Г. Растворимым основаниям
Д. Нерастворимым основаниям
Е. Кислотам
Ж. Солям
HCl
NaOH
CaO
Cu(OH)2
CO2
FeO
Fe2O3
H2SO4
Ca(OH)2
SO3
Al (OH)3
Na2CO3
ZnO
NaHCO3
Fe(OH)3
SO2
Ba(OH)2
MgO
K2SO4
H3PO4
Al2O3
(проверка теста – ответы на экране, дать названия веществам)
1 балл за каждую правильно названную группу
Систематизация и обобщение знаний – 20 мин
Понятие «кислоты»
Что такое кислоты? (ответы учащихся)
Структурная теория: сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотного остатка.
Теория электролитической диссоциации: электролиты, при диссоциации которых в качестве катионов образуются катионы водорода (HCl = H+ + Cl—)
Протолитическая теория кислот и оснований (теория Бренстеда-Лоури): вещества – доноры протонов (HCl + H2O = H3O+ + Cl—).
Теория Льюиса: акцепторы электронной пары (NH3 + BF3 = NH3BF3)
Чаще используются 1,2,3 теории. Они близки между собой.
Классификация кислот
Вспомним признаки классификации кислот (учебник § 22 — таблица). Выполнить тестовое задание (СР в листах самоконтроля)
1 вариант Соотнесите: | 2 вариант Соотнесите: | ||
Тип кислот: | Формула вещества: | Тип кислот: | Формула вещества: |
| а) H2SiO3 б) HCOOH в) H2SO4 г) HBr д) HNO3 |
| а) H3PO4 б) HClO4 в) CH3COOH г) HCl д) H2CO3 |
(проверка теста – ответы на экране, дать названия веществам)
0,5 балла за каждую правильно названную группу
Общие химические свойства кислот
Какие общие химические свойства характерны для органических и неорганических кислот?
Почему кислоты обладают общими химическими свойствами? (ответы учащихся)
Доказать и уточнить эти свойства нам поможет лабораторный опыт. Будете работать в группах. Каждая группа получит своё задание и будет работать с определённым свойством кислот. Необходимо провести опыты в соответствии с инструкцией, ответить на вопросы, составить уравнения реакций в молекулярной, полной и сокращённой ионной формах в листах самоконтроля. По завершении работы 1 человек отчитывается о работе группы, 1- составляет уравнения реакций на доске в молекулярной форме.
Лабораторный опыт. Химические свойства органических и неорганических кислот.
Отчёт групп, проверка уравнений реакций (1 балл за каждое правильное уравнение)
Реакция этерификации.
Специфические свойства кислот
Кроме общих кислоты обладают и специфическими свойствами. Какие специфические свойства кислот вы знаете? (ответы учащихся)
Подробнее будем говорить об этих свойствах на следующих уроках.
Контроль и самопроверка знаний – 6 мин.
Определить вероятность протекания реакций разб. H2SO4 с веществами:
Pb
Ag
Ba
PbO
Ag2O
BaO
Pb(OH)2
Ba(OH)2
H3PO4
Na2SO3
NaCH3COO
NaCl
(проверка теста – ответы на экране, дать названия веществам)
1 балл за каждое правильно названное вещество
Подведение итогов, рефлексия – 3 мин
Вернёмся к целям урока. всего ли мы достигли? Какие вопросы остались? Подсчитать баллы в листах самоконтроля, поставить оценку за урок:
«3» — 17-22б, «;» — 23-29б, «5» — 30-34б.
Заполнить таблицу «Знаю — не знаю, умею – не умею»
№ | Знания, умения, навыки | Знаю, умею | Не знаю, не умею | Могу допускать ошибки |
1 | Определение «кислоты» с точки зрения разных теорий | |||
2 | Признаки классификации кислот | |||
3 | Проклассифицировать кислоту | |||
4 | Общие химические свойства кислот | |||
5 | Составление уравнений реакций : Молекулярных; | |||
Полных ионных; | ||||
Сокращённых ионных | ||||
6 | Определение «реакция нейтрализации» | |||
7 | Определение «реакция этерификации» | |||
8 | Определение вероятности протекания реакции кислоты с разными веществами | |||
9 | Работа с химическими реактивами | |||
10 | Правила техники безопасности при проведении хим.эксперимента |
Домашнее задание – 1 мин
О.С.Габриелян, «Химия -11», § 22, в 5.
Творческое задание – составить опорный конспект или компьютерную презентацию «Классификация и свойства кислот»
ПРИЛОЖЕНИЯ
Лист самопроверки
«День прожит не зря, если ты узнал что-то новое».
Тема урока: Кислоты
Цели урока: Систематизировать и обобщить знания о номенклатуре, классификации и свойствах неорганических и органических кислот, их роли в хозяйственной деятельности и повседневной жизни человека. Совершенствование навыков составления уравнений химических реакций, проведения химического эксперимента.
Этапы урока
Актуализация и проверка знаний
Выписать № формул, соответствующих:
А. Основным оксидам
Б. Кислотным оксидам
В. Амфотерным оксидам
Г. Растворимым основаниям
Д. Нерастворимым основаниям
Е. Кислотам
Ж. Солям
HCl
NaOH
CaO
Cu(OH)2
CO2
FeO
Fe2O3
H2SO4
Ca(OH)2
SO3
Al (OH)3
Na2CO3
ZnO
NaHCO3
Fe(OH)3
SO2
Ba(OH)2
MgO
K2SO4
H3PO4
Al2O3
Ответ:
А___________________
Б___________________
В___________________
Г___________________
Д___________________
Е___________________
Ж___________________
(1 балл за каждую правильно названную группу) Баллы:___________
Классификация кислот
Соотнесите:
Тип кислот: Формула вещества:
Кислородсодержащие а) H2SiO3
бескислородные б) HCOOH
одноосновные в) H2SO4
двухосновные г) HBr
сильные д) HNO3
слабые
Ответ: 1) 2) 3) 4) 5) 6) . (0,5 балла за каждую правильно названную группу)
Баллы:__________
Общие химические свойства кислот
Лабораторный опыт. Химические свойства органических и неорганических кислот. Допишите возможные уравнения реакций в молекулярном виде. Для двух первых реакций в каждом опыте составьте полные и сокращённые уравнения реакций.
Опыт 1. Изменение окраски индикаторов. Реакция нейтрализации.
HCl + NaOH =
CH3COOH + NaOH =
HCl + Cu(OH)2 =
CH3COOH + Cu(OH)2 =
Опыт 2. Взаимодействие кислот с металлами.
HCl + Zn =
CH3COOH + Mg =
HCl + Cu =
CH3COOH + Cu =
Опыт 3. Взаимодействие кислот с оксидами.
HCl + CaO =
CH3COOH + CaO =
HCl + CuO =
CH3COOH + CuO =
HCl + CO2 =
CH3COOH + CO2 =
Опыт 4. Взаимодействие кислот с солями.
HCl + CaCO3 =
CH3COOH + CaCO3 =
HCl + Na2SO4 =
CH3COOH + Na2SO4 =
(1 балл за каждое правильное уравнение) Баллы:___________
Реакция этерификации.
Допишите возможные уравнения реакций в молекулярном виде.
CH3COOH + CH3OH =
H2SO4 + CH3OH =
Контроль и самопроверка знаний
Определить вероятность протекания реакций разб. H2SO4 с веществами (выписать № вещества, способного взаимодействовать с разб.H2SO4):
Pb
Ag
Ba
PbO
Ag2O
BaO
Pb(OH)2
Ba(OH)2
H3PO4
Na2SO3
NaCH3COO
NaCl
Ответ: ___________________________________________
(1 балл за каждое правильно названное вещество) Баллы:___________
Итог (просуммировать баллы за все задания): ______________________
«3» — 17-22б, «4» — 23-29б, «5» — 30-34б.
Заполнить таблицу «Знаю — не знаю, умею – не умею» (поставить знак в 1 из колонок)
№ | Знания, умения, навыки | Знаю, умею | Не знаю, не умею | Могу допускать ошибки |
1 | Определение «кислоты» с точки зрения разных теорий | |||
2 | Признаки классификации кислот | |||
3 | Проклассифицировать кислоту | |||
4 | Общие химические свойства кислот | |||
5 | Составление уравнений реакций : Молекулярных; | |||
Полных ионных; | ||||
Сокращённых ионных | ||||
6 | Определение «реакция нейтрализации» | |||
7 | Определение «реакция этерификации» | |||
8 | Определение вероятности протекания реакции кислоты с разными веществами | |||
9 | Работа с химическими реактивами | |||
10 | Правила техники безопасности при проведении хим.эксперимента |
Домашнее задание – 1 мин
О.С.Габриелян, «Химия -11», § 22, в 5.
Творческое задание – составить опорный конспект или компьютерную презентацию «Классификация и свойства кислот»
Лабораторный опыт «Свойства кислот»
Опыт 1. Изменение окраски индикаторов. Реакция нейтрализации.
Цель: выяснить,
— все ли кислоты изменяют окраску индикаторов,
— все ли кислоты реагируют с основаниями,
— все ли основания реагируют с кислотами.
Вспомнить: индикаторы, кислоты органические и неорганические, кислоты растворимые и нерастворимые в воде, щёлочи, нерастворимые основания.
Испытайте растворы соляной, кремниевой и уксусной кислот индикаторами (налейте в пробирку 1-2 мл кислоты и добавьте несколько капель индикатора). Отметьте окраску индикатора в каждом случае.
Индикатор Кислота | Лакмус | Метилоранж | Фенолфталеин |
Соляная кислота | |||
Уксусная кислота | |||
Кремневая кислота |
Сделайте вывод об изменении окраски индикаторов органическими и неорганическими кислотами.
В пробирки с кислотами и метилоранжем добавьте щёлочь 2-4 мл. Отметьте изменения. Сделайте вывод о взаимодействии органических и неорганических кислот со щелочами. Составьте уравнения реакций в молекулярном, полном и сокращённом ионном видах.
В двух пробирках получите гидроксид меди (II). Для этого к 2 мл раствора сульфата меди (II) добавьте 1 мл раствора щёлочи. Отметьте цвет образовавшегося гидроксида меди (II). В одну пробирку добавьте 1-2 мл уксусной кислоты, в другую – 1-2 мл соляной. Отметьте изменения. Сделайте вывод о взаимодействии органических и неорганических кислот с нерастворимыми основаниями. Составьте уравнения реакций в молекулярном, полном и сокращённом ионном видах.
Что такое реакция нейтрализации?
Опыт 2. Взаимодействие кислот с металлами.
Цель: выяснить,
— все ли кислоты взаимодействуют с металлами;
— все ли металлы взаимодействуют с кислотами.
Вспомнить: кислоты органические и неорганические, активные и неактивные металлы, определение водорода.
В пробирку с цинком прилейте соляной кислоты, в пробирку с порошком магния – уксусной. Отметьте изменения. Докажите выделение водорода в каждом случае. Составьте уравнения реакций в молекулярном, полном и сокращённом ионном видах.
В пробирку с кусочком свинца прилейте 2 мл серной кислоты. Наблюдайте за протеканием реакции в течение нескольких минут. Отметьте изменения.
Сделайте вывод о взаимодействии кислот с металлами.
Опыт 3. Взаимодействие кислот с оксидами.
Цель: выяснить, с какими оксидами взаимодействуют кислоты.
Вспомнить: кислоты органические и неорганические, активные и неактивные металлы, основные и кислотные оксиды.
Проведите реакции между веществами:
Оксид Кислота | CaO | CuO | CO2 |
Соляная кислота | |||
Уксусная кислота | нагреть |
Примечание: CO2 получите взаимодействием мрамора и соляной кислоты в пробирке с газоотводной трубкой. Пропускайте газ через раствор кислоты 1 минуту.
Отметьте изменения. Сделайте вывод о взаимодействии органических и неорганических кислот с оксидами. Составьте уравнения реакций в молекулярном, полном и сокращённом ионном видах.
Опыт 4. Взаимодействие кислот с солями.
Цель: выяснить,
— все ли кислоты взаимодействуют с солями;
— все ли соли взаимодействуют с кислотами.
Вспомнить: кислоты органические и неорганические, кислоты сильные и слабые, признаки реакций обмена.
В пробирки с уксусной и соляной кислотами добавьте мел. Отметьте изменения.
В пробирки с уксусной и соляной кислотами добавьте метилоранж. Отметьте изменения. В каждую пробирку добавьте раствор сульфата натрия. Что наблюдаете? Объясните результаты опыта. Сделайте вывод о взаимодействии органических и неорганических кислот с солями. Составьте уравнения реакций в молекулярном, полном и сокращённом ионном видах.
Наименование | Фасовка |
| азотная кислота, хч азотная кислота, хч азотная кислота, хч | 13,5 1,4 13,5 |
| барбитуровая кислота, ч | 0,1 |
| борная кислота, тех борная кислота, тех борная кислота, тех | 50 1 0,1 |
| борфтористоводородная кислота, хч | 6 |
| бромистоводородная кислота, хч | 1,3 |
| масляная кислота, ч масляная кислота, ч | 1 0,1 |
| молибденовая кислота, ч молибденовая кислота, ч | 1 0,1 |
| муравьиная кислота (85%), ч муравьиная кислота (85%), ч | 5,6 1,2 |
| олеиновая кислота (Чехия) олеиновая кислота (Чехия) | 4,5 0,9 |
| ортофосфорная кислота (85%), пищ. ортофосфорная кислота (85%), пищ. | 8,5 1,8 |
| пикриновая кислота, ч пикриновая кислота, ч | 1 0,1 |
| плавиковая кислота, осч плавиковая кислота, хч плавиковая кислота, ч | 10,5 10,5 22 |
| пропионовая кислота, чда | 1 |
| салициловая кислота, чда салициловая кислота, чда салициловая кислота, чда | 25 1 0,1 |
| сульфосалициловая кислота, чда сульфосалициловая кислота, чда сульфосалициловая кислота, чда сульфосалициловая кислота, чда | 25 5 1 0,1 |
| тиобарбитуровая кислота, чда | 0,1 |
| трихлоруксусная, чда трихлоруксусная, чда | 1 0,1 |
| уксусная кислота ледяная, хч уксусная кислота ледяная, хч | 10 1 |
| фосфорновольфрамовая кислота, чда фосфорновольфрамовая кислота, чда | 1 0,1 |
| фосфорномолибденовая кислота, чда | 0,1 |
| хлорная кислота (70%), хч | 1,5 |
| хлорная кислота (60,4%), чда | 1,5 |
| щавелевая кислота, тех щавелевая кислота, тех щавелевая кислота, тех | 25 1 0,1 |
| янтарная кислота, хч янтарная кислота, хч | 1 0,1 |
Неорганические кислоты вина
Неорганические кислоты, содержащиеся в вине.
В виноградном сусле минеральных (неорганических) кислот нет. В вине, в отличие от сусла, 1-2 % кислот представлены минеральными соединениями. Только угольная кислота образуется при спиртовом или других видах брожения. Остальные минеральные кислоты вносятся в вино извне.
Угольная кислота H2CO3. Является основным продуктом алкогольного брожения, влияет на вкус вина. В тихих винах h3CO3 достигает 0,4 – 1,5 г/дм3, в белых игристых – 6 г/дм3 , в красных игристых может быть 8 г/дм3. Искусственное введение углекислоты в столовые вина делает их газированными; при этом улучшается вкус и биологическая стабильность столовых вин, имеющих невысокую (9-10 %) объемную долю спирта.
Ортофосфорная кислота H3PO4. Источник питания дрожей при брожении в виде монофосфатов. Повышенное содержание солей фосфорной кислоты может вызвать помутнение вина.
Сернистая кислота H2SO3. Присутствует в вине в виде в свободном состоянии или в связанном в виде кислых солей, а также в виде альдегидо — и кетосернистых соединений. Сернистая кислота обладает ингибирующим и антиоксидантным действием. Водные 1-2 %-ные растворы сернистой кислоты обладают антисептическим свойством, что используется для мойки винодельческой посуды, для протирания поверхностей, соприкасающихся с вином.
Ингибирующее действие на бактерии и дрожжи оказывает свободная сернистая кислота, количество которой определяется величиной рН, температурой и количеством веществ – сахаров, альдегидов, антоцианов и других соединений, связывающих её в неактивное состояние.
Сернистая кислота положительно влияет на качество нежных белых столовых вин, так как связывает ацетальдегид, ухудшающий вкус вина:
Искусство виноделия состоит в умении дробно и очень деликатно вводить в вино небольшие дозы сернистой кислоты. Незначительное увеличение доз SO2 (пересульфитация) вызывает резкое ухудшение окраски, вкуса и аромата вина. Готовое вино в пересульфитированном виде теряет свою пищевую и диетическую ценность.
В готовом вине существуют нормы (верхний предел) сернистой кислоты по допустимому уровню и по требованиям высшего качества. Для различных типов вин эти нормы могут быть представлены в следующем виде (табл.):
Таблица Верхний предел допустимого содержания Н2SO3 в готовом вине, мг/дм3
|
Категории вин
|
по НТД
|
по требованиям
высшего качества вина
| ||
|
Общее
|
в т.ч. свободной
|
Общее
|
в т.ч. свободной
| |
|
Сухие столовые
|
200
|
20
|
100
|
15
|
|
Полусухие, полусладкие столовые вина
|
250
|
30
|
150
|
20
|
|
Игристые
|
200
|
20
|
150
|
20
|
|
Десертные
|
200
|
20
|
100
|
15
|
|
Крепкие
|
200
|
20
|
75
|
10
|
Совершенно недопустимо выпускать марочные и высококачественные местные или выдержанные вина с высоким уровнем сульфитации. Сортовые столовые вина при этом теряют свои сортовые качества. И даже самые простые ординарные вина при пересульфитации лишаются своей привлекательности и пищевкусовых достоинств.
Серная кислота H2SO4 Находится в виде средних солей K, Na, Ca. Пересульфитация молодого вина с последующим окислением так же может привести к накоплению солей серной кислоты.
Добавить комментарий
Урок на тему «Химические свойства карбоновых кислот. Применение уксусной кислоты на основе свойств»
2) Химические свойства
карбоновых кислот
Посмотрите на свойства
неорганических кислот. Какую бы вы выдвинули
гипотезу применимую к нашей проблеме.
Я закрою центр схемы. Как вы думаете, свойства
органических кислот будут другими или такими же?
Итак, гипотеза: свойства неорганических и
органических кислот одинаковые (или свойства
неорганических и органических кислот разные).
Следующий этап: сбор данных и проведение
исследовательских действий. Для работы вам дана
карта исследований. Обратитесь к карте
исследований (Приложение 1) и
выполните 1 задание. Аналитики ведут записи в
тетради. Практики, следуя карте-исследований (Приложение 2) и, соблюдая правила
охраны труда, выполняют своё исследование.
Рассмотрим 1 свойство – действие на
индикаторы.
Составьте уравнение диссоциации уксусной
кислоты опираясь на схему учебника (параграф12
cтр.89, 3-й абзац).
CH3COOH <—> CH3COOH— + H+
(карбоновые кислоты являются слабыми
электролитами, а потому диссоциируют обратимо)
1) Почему лакмус и метилоранж окрашивают
уксусную кислоту в красный цвет? (из-за наличия
катионов водорода)
2) Какую среду определяют данные индикаторы?
(кислую среду)
Предоставляю слово практикам, а кто-то из
аналитиков в этот момент представляет
результаты на доске.
Аналитики сформулируйте вывод по 1 свойству
органических кислот.
Вывод: 1 свойство органических кислот –
действие на индикаторы
2 свойство — Взаимодействие с активными
металлами
Составьте уравнение реакций
взаимодействия уксусной кислоты с магнием и
медью. Назовите продукты реакции.
Что получилось у аналитиков?
| 2СН3СООН +Mg —> | (СН3СОО)2 Mg + | Н2 |
| ацетат магния | водород |
СН3СООН +Cu —>
— Какие металлы способны вытеснить водород из
растворов карбоновых кислот? (металлы, стоящие в
ряду напряжений до водорода)
Слово практикам.
К какому выводу мы пришли?
Вывод: органические кислоты
взаимодействуют с активными металлами с
образованием соли и водорода.
3 свойство — Взаимодействие с оксидами
металлов
Составьте уравнение реакции
взаимодействия уксусной кислоты с оксидом меди
(II). Назовите продукты реакции.
| 2СН3СООН + CuO —> | (СН3СОО)2 Сu + | Н2О |
| ацетат меди (II) | вода |
Что получилось у аналитиков и практиков?
Аналитики сформулируйте вывод по 3 свойству
органических кислот.
Вывод: органические кислоты
взаимодействуют с оксидами металлов с
образованием соли и воды.
4 свойство — Взаимодействие с основаниями
Составьте уравнение реакции
взаимодействия уксусной кислоты с гидроксидом
натрия. Назовите продукты реакции.
| СН3СООН + NaOН —> | СН3СООNa + | Н2О |
| ацетат натрия | вода |
— Как называется реакция взаимодействия
кислоты и основания с образованием соли и воды?
(реакция нейтрализации)
К какому выводу мы пришли?
Вывод: органические кислоты взаимодействуют с
основаниями с образованием соли и воды.
5 свойство – Взаимодействие с солями
Составьте уравнение реакции
взаимодействия уксусной кислоты с карбонатом
кальция. Назовите продукты реакции.
2СН3СООН + CaCO3 —> (СН3СОО)2Ca
+ Н2О + CO2
— Будут ли карбоновые кислоты
взаимодействовать с солями сильных
неорганических кислот? Почему? (нет, так сами
являются слабыми кислотами)
Вывод: органические кислоты
взаимодействуют с солями слабых неорганических
кислот с образованием соли и слабой
неорганической кислоты
Возвращаемся к схеме. Вспоминаем гипотезу.
Подтвердилась ли наша гипотеза: свойства
неорганических и органических кислот одинаковые
(свойства органических и неорганических кислот
разные). Сформулируйте общий вывод.
Вывод: неорганические и органические кислоты
обладают общими свойствами.
— Чем объясняются общие свойства
неорганических и органических кислот? (наличием
катиона водорода)
Неужели мы не найдём хотя бы 1 свойство
отличающее органические кислоты от
неорганических? В рамках 1 урока мы эту работу
выполнить не сможем. Прикрепляю чистый лист к
схеме со знаком вопроса. Ответите вы на этот
вопрос дома, пользуясь учебником и
дополнительными источниками и выполнив домашнее
задание.
Мы рассмотрели химические функции предельных
одноосновных карбоновых кислот. Переходим к
следующему вопросу.
Неорганическая кислота — обзор
8.14.8 Поглотители кислоты
Поглотители кислоты (другое техническое выражение «антациды») обычно представляют собой соли металлов слабых органических или неорганических кислот. Соответствующие им свободные основания способны эффективно нейтрализовать кислотность. Эффективность акцептора кислоты определяется реакционной способностью соли, достигаемой в полярной полимерной матрице, а также кислотностью примесей, которые вытесняют более слабую кислоту из ее соли. Помимо традиционных солей жирных кислот, например, стеарата кальция и стеарата цинка, часто используются неорганические соединения, такие как гидроталькиты или еще оксид цинка.Основными причинами использования антацидов являются наличие остатков катализатора в полимерных матрицах, которые могут создавать свободную кислотность во время или после дезактивации катализатора отгонкой паром или обработкой растворителем. Антациды нейтрализуют эту кислотность и предотвращают несколько нежелательных побочных эффектов, таких как коррозия технологического оборудования. 51 Кроме того, особенно стеаратные типы акцепторов кислоты могут выполнять функцию агентов скольжения за счет снижения сил сдвига, которые могут быть важны, особенно при переработке высокомолекулярных полимеров.Кроме того, натриевые и кальциевые соли жирных кислот, такие как стеарат Са, влияют на поведение кристаллизации некоторых технических полимеров, таких как полиолефины, полиэтилентерефталат и полиамиды, проявляя эффекты зародышеобразования, ускоряя кинетику кристаллизации и улучшая механические свойства соответствующих изделий. Помимо таких основных эффектов, стеараты металлов также действуют как смазки и антиадгезионные средства.
Наконец, следует упомянуть улучшение характеристик HA (L) S на основе пиперидина, а также их ректифицированной устойчивости к разложению внешними загрязнителями, например, пестицидами в теплицах. 52
Недостатки процессов разложения полимеров могут быть ограничены использованием подходящих стабилизаторов, как уже обсуждалось выше. Эти стабилизаторы и комбинации стабилизаторов обычно используются вместе с дополнительными добавками, используемыми для стабилизации данного сорта полимера. Пакеты базовых добавок, необходимые для стабилизации полимеров, особенно полиолефинов, обычно содержат комбинации фенольных антиоксидантов, фосф (он )итов и акцепторов кислоты. Совместная работа таких комбинаций присадок, безусловно, зависит от правильного выбора и концентрации всех отдельных компонентов. 53
Известно, что добавление стеарата цинка технически является лучшим поглотителем кислоты, поскольку помогает избежать преждевременного обесцвечивания полимерных композиций большого количества, но это справедливо, поскольку является физически раздражающим для человека. 54 При длительном воздействии стеарата цинка может развиться обширный фиброз. Хотя нет конкретной информации о концентрации воздействия, приводящей к такому состоянию, считается, что она очень высока. Более того, аспирация стеарата цинка младенцами может быть связана с респираторной недостаточностью и острым пневмонитом. 55
Другая группа органических антацидов представлена лактатами металлов, особенно лактатом кальция (, рис. 26, ) и стеароил-2-лактилатом кальция. Помимо своего принципа действия в качестве акцепторов кислоты, эти производные способны образовывать хелатные комплексы даже со следами остаточного алюминия и титана в полимерных матрицах. Их добавление может помочь избежать обесцвечивания полимерных композиций, особенно в сочетании с фенолами.
Рисунок 26. Химическая структура лактата кальция.
Синтетические гидроталькиты 56 в качестве поглотителей неорганических кислот недавно стали важным со-стабилизатором в полимерных составах. Они в основном используются для замены стабилизирующих компонентов на основе тяжелых металлов, таких как стеарат свинца, фосфит свинца, двухосновный фталат свинца или трехосновный сульфат свинца и соответствующие соли кадмия.
В основном два типа гидроталькитов доказали свою превосходную эффективность в долгосрочной стабилизации полимеров, а именно чистый гидротальцит Mg / Al, эмпирическая формула [Mg 6 Al 2 (OH) 16 CO 3 · 4H 2 O], (например,g., коммерческие продукты Sorbacid® 911 и Hycite® 713, доступные от Süd-Chemie AG) и цинксодержащее производное, [Zn 2 Mg 4 Al 2 (OH) 16 CO 3 · 4H 2 O] (например, Sorbacid® 944 от Süd-Chemie AG).
Общими для всех типов являются их слоистая структура (см. , рис. 27, ) и небольшой размер частиц (обычно 80% <1 мкм), обеспечивающие отличную диспергируемость в полимерной матрице.
Рисунок 27. Слоистая структура гидротальцитов (схематический вид).
Гидротальциты поглощают продукты кислотного разложения галогенированных полимеров, таких как ПВХ, полихлоропрен (CR), хлорсульфированный полиэтилен (CSM), хлорированный полиэтилен (CPE), эпихлоргидрин (ECO), фторэластомеры (FKM) и галогенбутиловый каучук (BIR). ), хлорбутилкаучук (CIIR)).
В полипропилене и полиэтилене гидроталькиты служат для иммобилизации и нейтрализации кислотных остатков катализатора, полученных в процессе полимеризации Циглера-Натта.
Гидротальциты были добавлены в огнезащитные системы в качестве неорганического стабилизатора и средства подавления дыма, особенно в галогенированных системах.Эти добавки также используются в электротехнике из-за их противоскользящих свойств. 57
Антациды служат нескольким целям в составах добавок для полимеров, таких как нейтрализация свободной кислотности остатков катализатора после их дезактивации паровой отгонкой или обработкой растворителем.
Но эти соединения также действуют как внутренние агенты скольжения, чтобы уменьшить усилия сдвига во время экструзии, что особенно важно для обработки высокомолекулярных полиолефинов и производства полиолефиновых пленок в целом, влияя на кристаллизационные свойства полимеров, таких как полиолефины. как некоторые инженерные пластики, такие как полиэтилентерефталат и полиамиды.Следовательно, они проявляют определенные эффекты зародышеобразования, то есть ускорение кристаллической кинетики и улучшение механических свойств готовых полимерных изделий. Другая функция — улучшение диспергирования стабилизаторов в полимерной матрице. Кроме того, акцепторы кислоты могут играть важную роль для сохранения вязкости расплава во время обработки, а также для долговременной стабильности конечного полимерного изделия.
Неорганические кислоты — Alfa Aesar
Гидрат 12-молибдофосфорной кислоты, ACS
Гидрат 12-молибдофосфорной кислоты, Мо> 47.5%
Амидосульфоновая кислота 99,99% (мет. Мет.)
Кислота борная, 98%
Кислота борная, 99 +%
Борная кислота, 99.8%
Кислота борная, 99,99% (мет. Мет.)
Борная кислота, Puratronic®, 99.9995% (мет. Мет.)
Хлорсульфоновая кислота, обычно 99%
Холевая кислота, 97%
Гексафторкремниевая кислота, 23% водн.солн.
Гексафторкремниевая кислота, 35% водн. солн.
Гуминовая кислота
Йодоводородная кислота, 57% водн.раствор, укол 1,5% фосфорной кислотой
Кислота водородная, ACS, 47%, стаб. с 1,5% фосфорной кислотой
Водоводородная кислота, ACS, 55-58%
Бромистоводородная кислота, 48% водн.солн.
Бромистоводородная кислота, 99,9999% (мет. Мет.), 48% вод. солн.
Кислота бромистоводородная, ACS, 47.0-49,0%
Соляная кислота, 0,01 н. Стандартизованный раствор
Кислота соляная, 0.Стандартное решение 05N
Соляная кислота, 0,1н стандартизованный раствор
Кислота соляная, 0.Стандартное решение 5N
Соляная кислота, 1,0н стандартизованный раствор
Соляная кислота, 10% об. / Об. Вод.солн.
Соляная кислота, 36% водн. солн.
Кислота соляная, 5.Стандартное решение 0N
Соляная кислота, 50% об. / Об. Водн. солн.
Соляная кислота, 5% об. / Об. Водн.солн.
Соляная кислота, 6,0 н стандартизованный раствор
Кислота соляная, 99.999999% (металлы), 33% min
Кислота соляная, 99.999% (мет.), Не менее 36,5%
Соляная кислота, стандартный объемный раствор Acculute, конечная концентрация 1.0N
Кислота соляная, ACS, HCl 36,5-38,0%
Кислота соляная, экологическая, 34-37.5%
Кислота плавиковая 99,99% (мет.) 40% мин.
Плавиковая кислота, ACS, 48-51%
Плавиковая кислота, класс защиты окружающей среды Plus, 47-51%
Бромистый водород, 33% масс. (45% масс.) Раствор.в уксусной кислоте
Хлористый водород, 4M в 1,4-диоксане, 99%
ВНИМАНИЕ. Рак — https://www.p65warnings.ca.gov/
Гипофосфористая кислота, 50% водн. солн.
Йодная кислота, 99%
Йодная кислота, ACS, 99.5% мин.
Метафосфорная кислота, 39-43%, бал. NaPO 3 (стабилизатор)
Метафосфорная кислота, ACS, 33.5-36,5%, бал. NaPO 3 (стабилизатор)
Молибденовая кислота, ACS, MoO 3 85% мин.
Молибденовая кислота, MoO3 не менее 85%
Азотная кислота, 0.Стандартное решение 1N
Азотная кислота, 1,0н стандартизованный раствор
Азотная кислота, 2.Стандартное решение 0N
Общее название | Формула | Константа кислотности | pK a |
|---|---|---|---|
серная кислота | H 2 SO 4 | К 1 = 2.4 * 10 6 | -6,62 |
хромовая кислота | H 2 CrO 4 | К 1 = 3,55 | -0.55 |
сернистая кислота | H 2 SO 3 | К 1 = 1,71 * 10 -2 | 1,77 |
фосфорная кислота | H 3 PO 4 | К 1 = 7.1 * 10 -3 | 2,15 |
фосфорная кислота | H 3 PO 3 | К 1 = 1.6 * 10 -2 | 1,8 |
пирофосфорная кислота | H 4 P 2 O 7 | К 1 = 3 * 10 -2 | 1,52 |
угольная кислота | H 2 CO 3 | К 1 = 4.35 * 10 -7 | 6,36 |
сероводород | H 2 S | K 1 = 9 * 10 -8 | 6.97 |
кислота борная | H 3 BO 3 | K 1 = 7,2 * 10 -10 | 9.14 |
Свойства органических и неорганических кислот.
Контекст 1
… сопровождалось окислением неорганическими или органическими кислотами. Испытанными неорганическими кислотами были: HNO 3, HCl, смесь HF и HNO 3. Таблица 3. После кислотного окисления кислотный остаток промывали горячей водой до pH = 6, а затем промывали метанолом. …
Контекст 2
… приводит к образованию радикалов на поверхностях нанопор, которые трудно удалить с помощью вакуумного отжига при температурах до 1000 C. Азотная кислота, вероятно, является наихудшим в этом смысле, давая наноразмерные покрытия, которые труднее удалить. Таблица 1 Полные данные по очистке материала нанотрубок, изготовленных с помощью лазера Таблица 2 Полные данные по очистке материала нанотрубок, полученных с помощью дуги Таблица 3 Свойства органических и неорганических кислот Таблица 4 Свойства органических растворителей Рисунок 1 Материал как полученный Рисунок 2 Карты элементов инкапсулированного материала частица катализатора Рисунок 3 EDS лазерного материала Рисунок 4 Примеси в образце, полученном с помощью лазера Рисунок 5a Характеристика дифракции рентгеновских лучей образца лазера после последующих рефлюксов Рисунок 5b Характеристика дифракции рентгеновских лучей образца лазера после очистки различными методами Рисунок 6 Данные ТГА Рисунок 7 Данные ВЭЖХ Рисунок 8 Данные экстракции фуллерена Рисунок 9 Данные ЯМР Рисунок 10a Спектры комбинационного рассеяния лазерного образца после последовательных обратных флегм Рисунок 10b Спектры комбинационного рассеяния лазерного образца после очистки различными методами Рисунок 11 Спектры комбинационного рассеяния лазерного образца после очистки различными методами и суспендированных в различных органических растворители Рис. 12 «Метод старого риса» Рис. 13 «Метод нового риса» Рис. re 14 Образец лазера после экстракции растворителем Рисунок 15 Образец лазера после последующего кипячения в HNO 3 (фотографии SEM) Рисунок 16 Образец лазера после последующего кипячения в HNO 3 (фотографии ПЭМ) Рисунок 17 Образец лазера после экстракции растворителем и кипячения с обратным холодильником в HF с добавлением HNO 3 Рисунок 18 Образец лазера после экстракции растворителем и кипячения в HCl Рисунок 19 Образец лазера после экстракции растворителем и кипячения с обратным холодильником в H 2 S 2 O 8 Рисунок 20 Образец лазера после экстракции растворителем и кипячения с обратным холодильником в H 2 O 2 Рисунок 21 Образец лазера после экстракции растворителем и Флегма в CF 3 COOH Рисунок 22 Лазерный образец после экстракции растворителем и дефлегмации в CF 3 COOOH Рисунок 23 Лазерный образец после вакуумного отжига Рисунок 24 Лазерный образец после экстракции растворителем, флегмы в HNO 3 и отжига в потоке Ar Рисунок 25 Лазерный образец после экстракции растворителем , флегма в HCl и вакуумный отжиг Рис. 26 Лазерный образец, обработанный различными окислителями после вакуумного отжига Рис. 27 Лазерный образец после вакуумного отжига, окисления H 2 O 2 и Отжиг в потоке Ar Рис. 28 Лазерный образец после вакуумного отжига и последующего диспергирования в различных органических растворителях Рис. 29 Лазерный образец после вакуумного отжига и последующего диспергирования в различных органических растворителях Таблица 1.Полные данные по очистке материала нанотрубок, полученных с помощью лазера. …
Контекст 3
… данные по очистке материала нанотрубок, полученных с помощью лазера. Промывка Сублимация Нейтрализация Промывка Сухой отжиг Испытание Взвешивание 5 2 / HNO3 h3O отжиг на воздухе SEM 5 …
Список и определение минеральных кислот
Минеральные кислоты обычно бесцветны в чистом виде, хотя есть исключения.
Минеральная кислота — это неорганическая кислота из минерального или другого неорганического источника, которая диссоциирует в воде с образованием иона водорода (H + или протон) и сопряженного основания.Минеральные кислоты важны в химии и промышленности, потому что в эту группу входит много полезных кислотных кислот. Кроме того, многие из этих кислот служат сырьем для производства как органических, так и неорганических химикатов.
Список минеральных кислот
Минеральные кислоты варьируются от очень слабых (борная кислота) до суперкислот (хлорная кислота). Некоторые кислоты являются монопротонными (соляная кислота), другие — дипротонными (серная кислота) или даже трипротонными (борная кислота). Вот список минеральных кислот:
- Царская водка (смесь соляной и азотной кислоты)
- Борная кислота (H 3 BO 3 )
- Бромистоводородная кислота (HBr)
- Соляная кислота (HCl)
- Плавиковая кислота (HF)
- Йодоводородная кислота (HI)
- Азотная кислота (HNO 3 )
- Хлорная кислота (HClO 4 )
- Фосфорная кислота (H 3 PO 4 )
- Сера кислота (H 2 SO 4 )
- Ксениновая кислота (H 2 XeO 4 )
Свойства минеральной кислоты
В отличие от минеральных кислот, существуют другие кислоты, которые являются либо органическими, либо неорганическими. Не дает водорода.По большей части вы можете идентифицировать минеральные кислоты по водороду в их формуле, но без углерода. Например, фульвокислота (C 135 H 182 O 95 N 5 S 2 ) представляет собой органическую кислоту, а не минеральную кислоту, даже если она получена из почвы. Это связано с тем, что фульвокислота поступает из органической части почвы (гумуса), содержит углерод и диссоциирует с образованием катионов водорода.
Два заслуживающих внимания свойства минеральных кислот — растворимость и коррозионная активность.Минеральные кислоты обычно растворяются в воде, но не растворяются в органических растворителях. Они очень едкие.
Ссылки
- Белл Р. П. (1973). Протон в химии (2-е изд.). Итака, Нью-Йорк: Издательство Корнельского университета.
- Зумдал, Стивен С. (2009). Химические принципы (6-е изд.). Компания Houghton Mifflin. ISBN 978-0-618-94690-7.
2.10: Органические кислоты и органические основания
Сила кислоты сильно коррелирует со стабильностью конъюгированного основания, которое образуется при удалении протона.Чтобы проанализировать, насколько кислой может быть молекула, вам необходимо оценить стабильность ее конъюгированного основания.
Стабилизация конъюгированной основы — четыре основных момента:
- Размер и электроотрицательность атома, держащего заряд
- Может ли заряд быть делокализован резонансом?
- Есть ли индукционные эффекты?
- Гибридизация орбитального удерживающего заряда
Эти соображения перечислены в порядке важности и объясняются индивидуально, но должны рассматриваться вместе.
Влияние размера и электроотрицательности на кислотность
При сравнении элементов это зависит от взаимного расположения элементов в периодической таблице. При перемещении периода (иначе говоря, по строке) элементов основной группы валентные электроны все занимают орбитали в одной и той же оболочке. Эти электроны имеют сопоставимую энергию, поэтому этот фактор не помогает нам различить относительную стабильность. Различия в электроотрицательности теперь являются доминирующим фактором.Эта тенденция проявляется при сравнении значений pKa этана, метиламина и метанола, которые отражают относительную электроотрицательность C
(метоксид)
Внутри группы (также известный как столбец вниз) По мере того, как мы движемся вниз по таблице Менделеева, электроны занимают подоболочки с более высокой энергией, создавая атомы большего размера и объема.По мере увеличения объема элемента любой присутствующий отрицательный заряд имеет тенденцию становиться более рассеянным, что снижает электронную плотность и увеличивает стабильность. На рисунке ниже показаны сферы, представляющие атомы блоков s и p периодической таблицы в масштабе, показывая две тенденции для атомного радиуса.
Рисунок \ (\ PageIndex {1} \): Тенденции атомных радиусов в Периодической таблице. Хотя в тенденции есть некоторые развороты (например, см. Po в нижнем ряду), атомы обычно становятся меньше, когда вы пересекаете периодическую таблицу, и больше, когда вы спускаетесь по любому столбцу.Цифры — это радиусы в пм.
Эта взаимосвязь между размером атома и электронной плотностью проиллюстрирована, когда мы сравниваем относительную кислотность метанола, CH 3 OH, с метантиолом, CH 3 SH. Более низкое значение pKa 10,4 для метантиола указывает на то, что это более сильная кислота, чем метанол, со значением pKa 15,5. Важно помнить, что ни одно из соединений не считается кислотой. Эти отношения становятся полезными при попытке депротонировать соединения для увеличения их химической реакционной способности в неводных условиях реакции.
ионизация метанола
ионизация метантиола
Разницу в размере можно легко увидеть, взглянув на карты электростатического потенциала для метанола (слева) и метантиола (справа). Атом серы метантиола больше, чем атом кислорода в метаноле. Сера большего размера будет лучше способна делокализовать и стабилизировать отрицательный заряд в ее сопряженном метантиолате основания.
Резонансные эффекты в кислотности
В этом разделе основное внимание уделяется тому, как резонансные структуры различных органических групп влияют на их относительную кислотность, даже если один и тот же элемент действует как донор протонов.При оценке сопряженных оснований на наличие вкладчиков резонанса не забывайте искать подвижные электроны (неподеленные пары и пи-связывающие электроны). Делокализация электронов по двум или более атомам приводит к расширению электронной плотности, увеличению стабильности сопряженного основания и увеличению кислотности соответствующей кислоты. Классический пример сравнивает относительную кислотность этанола и уксусной кислоты, но выводы, к которым мы пришли, будут одинаково справедливы для всех групп спирта и карбоновых кислот.Несмотря на то, что обе являются кислородными кислотами, значения pK и этанола и уксусной кислоты сильно различаются.
У обоих видов отрицательный заряд конъюгированного основания удерживается кислородом, поэтому периодические тенденции не могут быть вызваны. Однако для уксусной кислоты есть ключевое различие: можно нарисовать резонансный вклад, в котором отрицательный заряд переносится на второй кислород группы. Две резонансные формы для сопряженного основания равны по энергии в соответствии с нашими «правилами резонанса» (Раздел 2.5). Это означает, что отрицательный заряд ацетат-иона не находится ни на одном кислороде, ни на другом: он распределяется между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В этоксид-ионе, напротив, отрицательный заряд «заблокирован» на единственном кислороде. Эта стабилизация приводит к заметно повышенной кислотности.
Делокализация заряда за счет резонанса оказывает очень сильное влияние на реакционную способность органических молекул, достаточно, чтобы учесть разницу почти в 12 pK a единиц между этанолом и уксусной кислотой (и помните, pK a — это логарифмическое выражение , поэтому мы говорим о разнице между константами кислотности двух молекул более 10 12 ).Ацетат-ион намного более стабилен, чем этоксид-ион, из-за эффектов резонансной делокализации.
Эффекты конъюгации можно увидеть при сравнении карт электростатического потенциала этанола и уксусной кислоты. Конъюгация создает большую поляризацию связи O-H в уксусной кислоте, о чем свидетельствует ее темно-синий цвет.
Почему фенол кислый?
Соединения, подобные спиртам и фенолу, которые содержат группу -ОН, присоединенную к углеводороду, являются очень слабыми кислотами.Спирты настолько слабо кислые, что в обычных лабораторных целях их кислотность можно практически игнорировать. Однако фенол достаточно кислый, чтобы обладать узнаваемыми кислотными свойствами, даже если это все еще очень слабая кислота. Ион водорода может оторваться от группы -ОН и перейти на основание. Например, в водном растворе:
Поскольку фенол является очень слабой кислотой, положение равновесия находится значительно левее. Однако фенол может потерять ион водорода, потому что образующийся феноксид-ион (или фенолят-ион — эти два термина могут использоваться взаимозаменяемо) стабилизируется из-за резонанса.Отрицательный заряд атома кислорода делокализован вокруг кольца, поскольку одна из неподеленных пар атома кислорода может находиться на p-орбитали и перекрываться с пи-электронами бензольного кольца.
Это перекрытие приводит к делокализации, которая распространяется от кольца на атом кислорода. В результате отрицательный заряд больше не локализуется полностью на кислороде, а распространяется вокруг всего иона. Распространение заряда вокруг делает ион более стабильным, чем если бы весь заряд оставался на кислороде.Однако кислород является наиболее электроотрицательным элементом в ионе, и делокализованные электроны будут притягиваться к нему. Это означает, что вокруг кислорода по-прежнему будет много заряда, который будет снова притягивать ионы водорода. Вот почему фенол — очень слабая кислота.
Это объясняет, почему фенол является намного более сильной кислотой, чем циклогексанол. Как видно на следующей энергетической диаграмме, резонансная стабилизация увеличивается для конъюгированного основания фенола по сравнению с циклогексанолом после удаления протона.
Резонансная стабилизация в этих двух случаях сильно различается. Важный принцип резонанса состоит в том, что разделение зарядов уменьшает важность вкладов в резонансный гибрид. Структуры, способствующие фенольному гибриду, страдают разделением зарядов, что приводит к очень скромной стабилизации этого соединения. С другой стороны, фенолят-анион уже заряжен, и канонические вкладчики действуют для рассеивания заряда, что приводит к существенной стабилизации этого вида.Конъюгированные основания простых спиртов не стабилизируются делокализацией заряда, поэтому кислотность этих соединений аналогична кислотности воды. Энергетическая диаграмма, показывающая влияние резонанса на кислотность циклогексанола и фенола, показана справа. Поскольку резонансная стабилизация основания фенолятного конъюгата намного больше, чем стабилизация самого фенола, кислотность фенола по сравнению с циклогексанолом увеличивается. Подтверждение того, что отрицательный заряд фенолята делокализован на орто- и парауглеродах бензольного кольца, является результатом влияния электроноакцепторных заместителей на этих участках.
Кислотность водорода α (альфа) до карбонила
Алкильные атомы водорода, связанные с атомом углерода в α (альфа) положении (непосредственно рядом) относительно группы C = O, обладают необычной кислотностью. В то время как значения pKa для алкильных связей C-H обычно составляют порядка 40-50, значения pKa для этих альфа-атомов водорода больше порядка 19-20. Это происходит почти исключительно из-за резонансной стабилизации карбаниона продукта, называемого енолатом, как показано на диаграмме ниже.Эффект стабилизирующего C = O виден при сравнении pKa для α-атомов водорода альдегидов (~ 16-18), кетонов (~ 19-21) и сложных эфиров (~ 23-25).
Индуктивные эффекты
Эффект индукции — это экспериментально наблюдаемый эффект передачи заряда через цепочку атомов в молекуле, в результате чего образуется постоянный диполь в связи. Например, в группе карбоновой кислоты присутствие хлора на соседних атомах углерода увеличивает кислотность группы карбоновой кислоты.Атом хлора более электроотрицателен, чем водород, и, таким образом, способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. Это дополнительно увеличивает электронную плотность сопряженного основания, что оказывает стабилизирующий эффект. В этом контексте заместитель хлора называется электроноакцепторной группой . Обратите внимание, что эффект понижения pK a для каждого атома хлора, хотя и значительный, не так драматичен, как эффект делокализационного резонанса, проиллюстрированный разницей в значениях pK a между спиртом и карбоновой кислотой.В общем, резонансные эффекты более мощные, чем индуктивные эффекты .
Сравните значения pK a уксусной кислоты и ее моно-, ди- и трихлорированных производных:
Индуктивные эффекты хлора можно ясно увидеть, если посмотреть на карты электростатического потенциала уксусной кислоты (слева) и трихлоруксусной кислоты (справа). Связь O-H в трихлоруксусной кислоте сильно поляризована, что показано темно-синим цветом.Это показывает, что трихолоруксусная кислота является намного более сильной кислотой, чем уксусная кислота.
Поскольку индукционный эффект зависит от электроотрицательности, фторсодержащие заместители обладают более выраженным эффектом понижения рК и , чем хлорные заместители.
Кроме того, индукция происходит за счет ковалентных связей, и ее влияние заметно уменьшается с расстоянием — таким образом, хлор на расстоянии двух атомов углерода от группы карбоновой кислоты имеет меньший эффект по сравнению с хлором, находящимся на расстоянии одного атома углерода.2-хлорпропановая кислота имеет pK a , равное 2,8, в то время как для 3-хлорпропановой кислоты pK a составляет 4,0.
Алкильные группы (углеводороды) являются слабыми индуктивными донаторами электронов. В этом случае индукционный эффект толкает электронную плотность на сопряженное основание, заставляя электронную плотность становиться более концентрированной и производя дестабилизирующий эффект.
Индуктивные эффекты алкильных групп вызывают значительное изменение кислотности различных карбоновых кислот.Обратите внимание, что индуктивный эффект снижается после того, как длина алкильной цепи составляет около трех атомов углерода.
| pK a | |
| HCOOH (метановая кислота) | 3,75 |
| CH 3 COOH (этановая кислота или уксусная кислота) | 4,76 |
| CH 3 CH 2 COOH (пропановая кислота) | 4.87 |
| CH 3 CH 2 CH 2 COOH (бутановая кислота) | 4,82 |
Орбитальная гибридизация
Гибридизация орбитали влияет на ее электроотрицательность. Внутри оболочки s-орбитали занимают область ближе к ядру, чем p-орбитали. Следовательно, сферические s-орбитали более электроотрицательны, чем лопастные p-орбитали.Относительная электроотрицательность гибридизированных орбиталей sp> sp 2 > sp 3 , поскольку процент s-символа уменьшается по мере того, как к гибридам добавляется больше p-орбиталей. Эта тенденция указывает на то, что sp-гибридизированные орбитали более стабильны с отрицательным зарядом, чем sp 3 гибридизированные орбитали. В таблице ниже показано, как орбитальная гибридизация влияет на относительную кислотность.
Органические каркасы с водородными связями на основе неорганической кислоты для образования богатых азотом нитридов углерода для фотокаталитического выделения водорода
Органические каркасные материалы с водородной связью (HOF), которые имеют уникальную структуру, обычно используются для разделения газов.Для изготовления прекурсоров, подобных HOF, с различной морфологией и дальнейшего расширения их применения для выделения водорода, меламин подвергали реакции с неорганическими кислотами (H 2 SO 4 , HNO 3 и HCl) в этом Работа. После прокаливания каркасная структура может сохранять свои основные характеристики, превращаясь в пористые, богатые азотом нитриды углерода. Кроме того, было исследовано влияние различных кислотных радикалов на «эффект обогащения азота».Результаты показывают, что процедура реакции увеличивает содержание азота во всех вновь синтезированных продуктах нитрида углерода по сравнению с объемным нитридом углерода. Это обогащение объясняется преимущественным образованием триазина с высоким N-отношением по сравнению с гептазином. Нитриды углерода, полученные из предшественников HOF, содержат больше активных центров [N- (C) 3] и регулируют ширину запрещенной зоны, стабилизируя энергетический уровень зоны проводимости. Более того, гетерогенное легирование серой с использованием H 2 SO 4 является еще одним ключевым фактором в изменении структуры энергетических уровней.Таким образом, наш метод обеспечивает реальный способ получения материалов из графитового нитрида углерода с выдающейся фотокаталитической активностью.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
.
