Содержание
Аквабланк химия О2 гранулированный 5кг
Артикул 0591005
Активный кислород в гранулах для дезинфекции воды в бассейнах
Приготовленно с использованием пероксомоносульфата калия
Свойства
- Быстрорастворимый гранулят
- Дезинфецирует воду в бассейнах
- Безупречное качество воды без запаха хлора
- Рекомендуется для закрытых бассейнов
- Аквабланк О2 в сочетании с активатором Аквабланк А заботятся о кристально-чистом состоянии воды
Применение
Для первичной обработки необходимо 200 грамм препарата на 10 м3 воды. Ударную обработку застоявшейся воды следует провести посредством Кемохлор-T-быстрорастворимых таблеток (не кидать таблетки в бассейн — опасность обезцвечивания материалов), а предварительно растворить их в отдельной ёмкости или положить в скиммер, или Кемохлор T-65 гранулированный. Для последующей дезинфекции необходимо еженедельно добавлять по 100 грамм препарата (в зависимости от температуры) на 10 м3 воды. Уровень рН и содержание кислорода следует регулярно проверять pH / O? тестером. Оптимальный уровень pH 7,0-7,4; содержание кислорода не менее 5 мг / л.
Уровень рН и содержание кислорода следует регулярно проверять pH / O? тестером. Оптимальный уровень pH 7,0-7,4; содержание кислорода не менее 5 мг / л.
Рекомендации:
При помутнении воды или образования налёта водорослей рекомендуется провести ударное хлорирование Кемохлор T-65 гранулированным (Гранулят растворить в ведре с водой, потом вылить в бассейн). Для оптимального действия хлора ударную обработку следует проводить при содержании кислорода менее 5 мг / л.
В открытых бассейнах при атмосферных осадках и высоких температурах, а так же при более интенсивном использовании бассейна образуется скользкий налёт, которого можно избежать путём добавления большего количества препарата Аквабланк О2 гранулированный.
Цель применения | Дозировка на 10 м3 воды |
Длительная дезинфекция | 100 г в неделю |
Первичная обработка | 200 г |
Меры предосторожности:
Соблюдайте меры по безопасности, указанные на этикетке продукта и в паспорте безопасности. Продукт хранить в оригинальной упаковке в прохладном и защещённом от солнца месте. Не закрывать плотно! Хранить в недоступном для детей месте!
Продукт хранить в оригинальной упаковке в прохладном и защещённом от солнца месте. Не закрывать плотно! Хранить в недоступном для детей месте!
Хранение: Хранить при температуре выше 0оС. Срок хранения 10 лет. Продукт хранить и перевозить стоя! Опустошённая и вымытая тара подлежит переработке.
Внимание: Не смешивать с другими химикатами!
Химия для бассейнов до 20 м.куб. на основе активного кислорода (О2)
На складе:
В наличии
Технические характеристики
Для дезинфекции воды бассейнов до 20 м. куб. в ручную Без хлора
куб. в ручную Без хлора
Расход: Приблизительно 2-а месяца
В комплекте: Тестер байроклар — 1 шт. — для измерения ровня РН и О2 в воде бассейна.
PH минус 0,5 кг — 6 шт. — для понижения уровня РН, порошок, в комплекте мерный стаканчик.
Софт энд изи 1,12 кг — 2 шт. — для дезинфекции воды и против водорослей, порошок.
Вес: 5,5 кг.
Описание товара
Химия для бассейнов до 20 м.куб. на основе активного кислорода (О2) — это набор средств, для дезинфекции воды без хлора. Предназначен для обеспечения прозрачной и чистой воды при ручном добавлении в воду бассейна один раз в неделю. Каждый бассейн требует разный расход дезинфицирующих средств, по этому здесь указан приблизительный расход.
1. Дезинфекция на основе активного кислорода предназначена для очистки воды бассейна и борьбы против водорослей без применения хлора. Она идеально подходит для тех, у кого аллергия на хлор. В упаковке Софт энд Изи находится четыре дозы по 280г. Каждая доза состоит из двух компонентов: один содержит активный кислород для дезинфекции; второй предотвращает рост водорослей в бассейне. Одна доза (280г.) предназначена для обработки до 20 м3 воды бассейна в неделю.
Она идеально подходит для тех, у кого аллергия на хлор. В упаковке Софт энд Изи находится четыре дозы по 280г. Каждая доза состоит из двух компонентов: один содержит активный кислород для дезинфекции; второй предотвращает рост водорослей в бассейне. Одна доза (280г.) предназначена для обработки до 20 м3 воды бассейна в неделю.
2. Регулирование PH воды бассейна является необходимым условием правильного ухода за водой. Средства для дезинфекции будут работать, только в воде с нейтральным РН. Значение PH воды должно быть в пределах от 7 до 7,4 единиц. Как правило, РН воды всегда повышается, для его понижения применяют препарат для бассейна РН-минус. Необходимо не реже одного раза в неделю измерять РН воды тестером и понижать его относительно измерения до показания 7,2. Для понижения РН воды на 0,1 в воду бассейна необходимо добавить, предварительно растворив его, 100 грамм РН-минуса на 10 м.куб.
Не забывайте: химия для бассейна работает только в паре с фильтрацией. Для сбора загрязнений на дне бассейна применяйте ручной пылесос.
Товар добавлен!
Активный кислород в гранулах для дезинфекции воды в бассейне Аквабланк О2, 5 кг
Активный кислород в гранулах для дезинфекции воды в бассейнах
Приготовленно с использованием пероксомоносульфата калия
Свойства
Быстрорастворимый гранулят
Дезинфецирует воду в бассейнах
Безупречное качество воды без запаха хлора
Рекомендуется для закрытых бассейнов
Аквабланк О2 в сочетании с активатором Аквабланк А заботятся о кристально-чистом состоянии воды
Применение
Для первичной обработки необходимо 200 грамм препарата на 10 м3 воды. Ударную обработку застоявшейся воды следует провести посредством Кемохлор-T-быстрорастворимых таблеток (не кидать таблетки в бассейн — опасность обезцвечивания материалов), а предварительно растворить их в отдельной ёмкости или положить в скиммер, или Кемохлор T-65 гранулированный.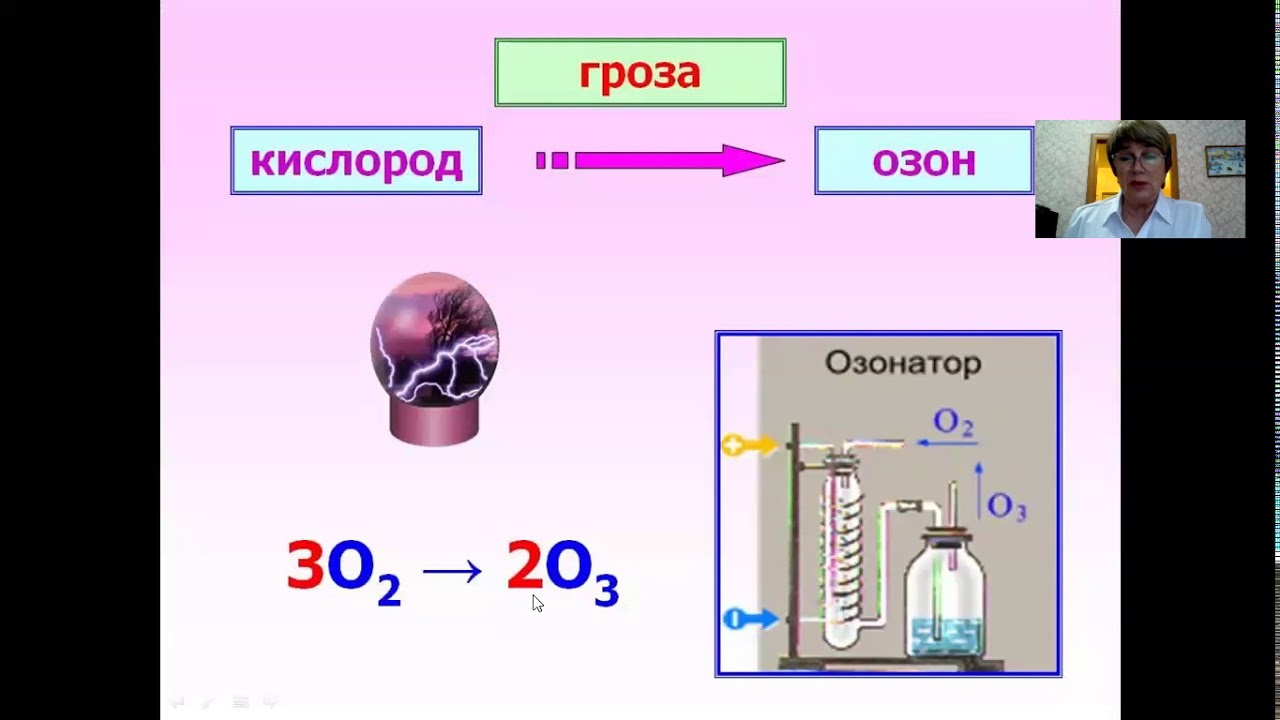 Для последующей дезинфекции необходимо еженедельно добавлять по 100 грамм препарата (в зависимости от температуры) на 10 м3 воды. Уровень рН и содержание кислорода следует регулярно проверять pH / O² тестером. Оптимальный уровень pH 7,0-7,4; содержание кислорода не менее 5 мг / л.
Для последующей дезинфекции необходимо еженедельно добавлять по 100 грамм препарата (в зависимости от температуры) на 10 м3 воды. Уровень рН и содержание кислорода следует регулярно проверять pH / O² тестером. Оптимальный уровень pH 7,0-7,4; содержание кислорода не менее 5 мг / л.
Рекомендации:
При помутнении воды или образования налёта водорослей рекомендуется провести ударное хлорирование Кемохлор T-65 гранулированным (Гранулят растворить в ведре с водой, потом вылить в бассейн). Для оптимального действия хлора ударную обработку следует проводить при содержании кислорода менее 5 мг / л.
В открытых бассейнах при атмосферных осадках и высоких температурах, а так же при более интенсивном использовании бассейна образуется скользкий налёт, которого можно избежать путём добавления большего количества препарата Аквабланк О2 гранулированный.
Меры предосторожности:
Соблюдайте меры по безопасности, указанные на этикетке продукта и в паспорте безопасности. Продукт хранить в оригинальной упаковке в прохладном и защещённом от солнца месте. Не закрывать плотно! Хранить в недоступном для детей месте!
Не закрывать плотно! Хранить в недоступном для детей месте!
Хранение: Хранить при температуре выше 0оС. Срок хранения ограничен. Продукт хранить и перевозить стоя! Опустошённая и вымытая тара подлежит переработке.
Внимание: Не смешивать с другими химикатами!
Расчеты адсорбции кислорода на комплексах наночастицы оксида церия с атомами, тримерами и тетрамерами серебра методом функционала плотности
Author:
Наслузов, В.A
Нейман, K.M.
Шор, A.M.
Лалетина, C.C.
Иванова-Шор, E.A.
Nasluzov, Vladimir A.
Neyman, Konstantin M.
Shor, Aleksey M.
Laletina, Svetlana S.
Ivanova-Shor, Elena A.
Journal Name:
Журнал Сибирского федерального университета. Химия. Journal of Siberian Federal University. Chemistry;2016 9 (3)
Abstract:
В статье рассмотрены продукты молекулярной адсорбции (МА) и диссоциативной адсорбции
(ДА) молекулы О2 на комплексах модельной наночастицы Ce21O42 (NP) с атомом
и небольшими кластерами серебра. Согласно данным расчетов методом функционала
Согласно данным расчетов методом функционала
плотности энергии образования координированных с O2 мономеров, тримеров и тетрамеров
серебра (относительно невзаимодействующих NP, Agn и О2) составляют 2.0–4.4 эВ. Энергия
адсорбции молекулы O2 (Ead(O2)) в наиболее стабильном атомарном AgOO{Ce}-комплексе с
молекулой О2 в мостиковом положении между атомами Ce и Ag на поверхности нанограни
{111} достигает ~1.3 эВ. AgnOO{Ce}- и OAgnO{Ce}-мостиковые структуры образуются
и в наиболее стабильных изомерах МА- и ДА-комплексов Ag3 на {100} и {111} и Ag4 на {100}
наногранях. Характеристики химической связи О-О в AgnOO{Ce}-структурах указывают на
образование стабильных супероксидных группировок
О2
–. Ead(О2) для наиболее стабильных
МА и ДА комплексов на кластерах серебра и ограничиваются величинами 0.5–1.1 и 1.4–2.0 эВ
соответственно. Барьеры активации диссоциации молекулы O2 в AgnOO{Ce}-комплексах с
n = 3 и 4 составляют 1.5–2.1 эВ, что свидетельствует о низких скоростях протекания данных
окислительных перегруппировок
Molecular adsorption (MA) and dissociative adsorption (DA) of O2 on complexes of a model
nanoparticle Ce21O42 (NP) with an atom and small clusters of silver have been addressed. According
According
to results of density functional calculations formation energies of such systems (with respect to the
non-interacting NP, Agn and O2) are calculated to be 2.0–4.4 eV. O2 adsorption energy (Ead(O2)) in
the lowest-energy atomic complex with О2 in a bridging position between Ce ion and Ag bound on the
{111} nanofacet (AgOO{Ce}-complex) is as high as ~1.3 eV. AgnOO{Ce}- and OAgnO{Ce}- bridging
structures are formed in MA and DA lowest-energy complexes of Ag3 on {100} and {111} as well as
Ag4 on {100} nanofacets. Bonding characteristics of the AgnOO{Ce}-structures match those for stable
superoxo groups О2
–. Ead(О2) of the lowest-energy МА and DA complexes of O2 with Ag clusters are in
the range of 0.5–1.1 and 1.4–2.0 eV, respectively. Activation energies for O2 dissociation in AgnOO{Ce}-
complexes (n=3, 4) calculated to be 1.5–2.1 eV indicate low rates of these oxidation rearrangements
Химия для бассейнов — AquaDoctor WaterShock О2, 5 кг — LAGUNA
Описание
Дезинфектант на основе активного кислорода
Препарат AquaDoctor WaterShock O2 предназначен для первичной (шоковой) и регулярной дезинфекции воды в бассейне. Эффективно и быстро уничтожает бактерии, грибки, вирусы и другие органические вещества, вызывающие помутнение и загрязнение воды в бассейне. Рекомендован для всех типов бассейнов и применяется при любой жесткости воды, не обесцвечивает поверхности из полиэстера или винила. В состав WaterShock O2 входит Моноперсульфат калия (Potassium Monopersulfate Compound). Это твердое вещество белого цвета, с содержанием активного кислорода, не менее 4.5%. В процессе растворения, Моноперсульфат калия ионизируется и образует анион, имеющий окислительные способности, схожие с хлором. Препарат не содержит хлора, не раздражает глаза и слизистые, не сушит волосы и кожу, не оставляет неприятный запах а также не влияет на уровень pH воды в бассейне. Бистро растворяемый препарат AquaDoctor WaterShock O2 не оставляет осадков и не засоряет систему фильтрации бассейна, что является важным фактором при выборе химии для бассейнов. Препарат рекомендуется использовать в вечернее время суток. Перед использованием необходимо замерять и откорректировать, при необходимости, уровень рН до нормы 7.
Эффективно и быстро уничтожает бактерии, грибки, вирусы и другие органические вещества, вызывающие помутнение и загрязнение воды в бассейне. Рекомендован для всех типов бассейнов и применяется при любой жесткости воды, не обесцвечивает поверхности из полиэстера или винила. В состав WaterShock O2 входит Моноперсульфат калия (Potassium Monopersulfate Compound). Это твердое вещество белого цвета, с содержанием активного кислорода, не менее 4.5%. В процессе растворения, Моноперсульфат калия ионизируется и образует анион, имеющий окислительные способности, схожие с хлором. Препарат не содержит хлора, не раздражает глаза и слизистые, не сушит волосы и кожу, не оставляет неприятный запах а также не влияет на уровень pH воды в бассейне. Бистро растворяемый препарат AquaDoctor WaterShock O2 не оставляет осадков и не засоряет систему фильтрации бассейна, что является важным фактором при выборе химии для бассейнов. Препарат рекомендуется использовать в вечернее время суток. Перед использованием необходимо замерять и откорректировать, при необходимости, уровень рН до нормы 7. 2 – 7.4 Первичная (шоковая) обработка выполняется 1 раз в 40-60 дней, из расчета 30 грамм препарата на 1 м3 воды. Необходимое количество WaterShock O2 размешивается в емкости с водой и равномерно добавляется в бассейн по периметру, после чего запускается фильтрационная система на 6-8 часов. После применения препарата не рекомендуется использовать бассейн, на протяжении 10-12 часов. Регулярная обработка бассейна, осуществляется аналогичным способом, используя 15 г / 1 м³ еженедельно. Химия для бассейнов AquaDoctor, является лидером на рынке средств по уходу за водой. Специалисты, обслуживающие гидротехнические конструкции, также как и владельцы частных бассейнов, отдают предпочтение химсредствам торговой марки AquaDoctor
2 – 7.4 Первичная (шоковая) обработка выполняется 1 раз в 40-60 дней, из расчета 30 грамм препарата на 1 м3 воды. Необходимое количество WaterShock O2 размешивается в емкости с водой и равномерно добавляется в бассейн по периметру, после чего запускается фильтрационная система на 6-8 часов. После применения препарата не рекомендуется использовать бассейн, на протяжении 10-12 часов. Регулярная обработка бассейна, осуществляется аналогичным способом, используя 15 г / 1 м³ еженедельно. Химия для бассейнов AquaDoctor, является лидером на рынке средств по уходу за водой. Специалисты, обслуживающие гидротехнические конструкции, также как и владельцы частных бассейнов, отдают предпочтение химсредствам торговой марки AquaDoctor
Кислородная химия для бассейна O2 Water Shock AquaDoctor, 5 кг
Быстрая ‘’бесхлорная‘’ дезинфекция в форме гранул использующая активный кислород для дезинфекции и ухода за водой бассейна. Препарат немедленно действует против широкого спектра бактерий, вирусов, микробов.
AquaDoctor O2 — бесхлорное средство для дезинфекции воды, содержит в своем составе не менее 10% активного кислорода. Препарат эффективно уничтожает вирусы, бактерии, микробы и грибок в воде бассейна.
Отличительной особенностью препарата является то, что кислотность воды не влияет на свойства препарата и в случае отклонений уровня pH от нормы AquaDoctor O2 эффективно дезинфицирует воду в бассейне. Также немаловажен тот факт, что активный кислород не вступает в реакцию с органическим азотом, благодаря чему вода после обработки не имеет неприятных запахов, не раздражает слизистые, не сушит кожу и волосы.
Особенности:
- Наиболее эффективен в закрытых бассейнах
- Не содержит хлора
- Не чувствителен к уровню pH
- Начинает действовать сразу после попадания в воду бассейна
Дозировка:
Первичная обработка: для первичной (шоковой) обработки воды бассейна необходимо использовать 30 гр. препарата на 1 м3 воды.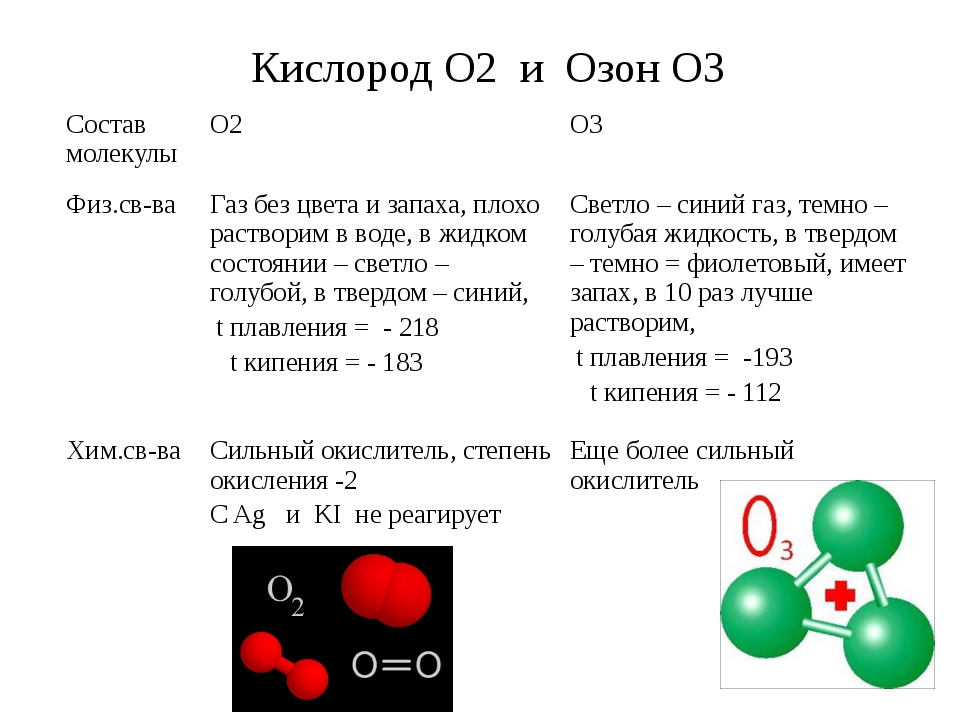 Добавьте необходимое количество препарата в емкость с водой и растворите его. После полного растворения вылейте раствор по периметру бассейна и включите фильтровальную установку. Пользоваться бассейном нельзя в течение 2 часов. Первичную обработку воды бассейна необходимо повторять каждые 40-60 дней.
Добавьте необходимое количество препарата в емкость с водой и растворите его. После полного растворения вылейте раствор по периметру бассейна и включите фильтровальную установку. Пользоваться бассейном нельзя в течение 2 часов. Первичную обработку воды бассейна необходимо повторять каждые 40-60 дней.
Регулярная обработка: для регулярной дезинфекции воды необходимо добавлять 15 гр. Aquadoctor Water Shock на каждый 1 м3 воды бассейна еженедельно. Растворите в воде необходимое количество препарата в отдельной емкости и вылейте по периметру бассейна. Для завершения химической реакции, не купайтесь в бассейне в последующие 2 часа. Уровень активного кислорода в воде бассейна должен быть 8мг/л, при меньших значениях необходимо добавить средство в воду.
Регулярная обработка: дозировка составляет 15 грамм на 1 м3 воды бассейна еженедельно. Добавьте необходимое количество средства в отдельную емкость с водой и дождитесь растворения. Затем полученный раствор вылейте по периметру бассейна и включите фильтрационную установку. После дозирования препарата необходим технический перерыв не менее 2 часов, купаться в течение этого времени запрещено.
После дозирования препарата необходим технический перерыв не менее 2 часов, купаться в течение этого времени запрещено.
Также рекомендуем периодически (раз в 1-2 месяца) проводить ударную обработку воды из расчета 30 грамм на 1 м3 воды.
Магазин X-MEDICA.ru не несет ответственности за содержание опубликованных на сайте отзывов о товарах, так как они выражают мнение автора и не являются официальным мнением магазина и производителя товара.
Отзывы отсутсвуют
Оставлять отзывы могут только зарегистрированные пользователи.
Зарегистрироваться очень просто, сделайте это и пребывание у нас будет еще приятнее.
неорганической химии — Почему мы называем O2 кислородом?
Я думаю, что для вас наиболее полезным будет узнать немного об истории открытия элементов и теории атома.
Первым чистым веществом, содержащим только элементарный кислород, который необходимо выделить, был дикислород ($ \ ce {O2} $) в 1774 году, хотя он назывался «дефлогистированным воздухом» до 1777 года, когда Лавуазье впервые использовал термин «кислород». . Это было примерно за 30 лет до того, как Джон Далтон даже предложил первую эмпирическую атомную теорию.В то время у нас почти не было понимания стехиометрии, так что Дальтон, как известно, заявил, что молекулярная формула воды была $ \ ce {HO} $. Тот факт, что дикислород представляет собой вещество, состоящее из молекул, содержащих два атома кислорода, вероятно, не был широко известен, по крайней мере, до 1811 года, после экспериментов Амадео Авогадро по газовой стехиометрии.
. Это было примерно за 30 лет до того, как Джон Далтон даже предложил первую эмпирическую атомную теорию.В то время у нас почти не было понимания стехиометрии, так что Дальтон, как известно, заявил, что молекулярная формула воды была $ \ ce {HO} $. Тот факт, что дикислород представляет собой вещество, состоящее из молекул, содержащих два атома кислорода, вероятно, не был широко известен, по крайней мере, до 1811 года, после экспериментов Амадео Авогадро по газовой стехиометрии.
По сути, какое-то время мы знали, что существует субстанция, состоящая из одного типа атомов, которую невозможно разбить на что-то более простое.Это соответствовало распространенному тогда определению элемента; « чистое вещество, которое не может быть разложено на более простое вещество ». Мы знали, что «кислород» Лавуазье должен составлять $ \ ce {O_n} $ для некоторого n, но у нас не было причин предполагать $ n \ neq 1 $ на протяжении десятилетий. К тому времени, как мы выяснили, что $ n = 2 $, название «кислород» уже широко использовалось для обозначения двуокиси кислорода. Тот факт, что $ n = 3 $ также образует стабильное соединение в условиях окружающей среды (озон), также не был известен до 1867 года. Аналогичная история произошла с (ди) азотом (окта) серой, (тетра) фосфором и так далее.Единственные элементы, которые в разумных условиях образуют стабильные одноатомные вещества, — это благородные газы.
Тот факт, что $ n = 3 $ также образует стабильное соединение в условиях окружающей среды (озон), также не был известен до 1867 года. Аналогичная история произошла с (ди) азотом (окта) серой, (тетра) фосфором и так далее.Единственные элементы, которые в разумных условиях образуют стабильные одноатомные вещества, — это благородные газы.
За всем этим стоит рассмотреть один интересный аспект. Некоторые (например, Эрик Шерри) утверждают, что мы оказываем химию медвежью услугу, смешивая свойства элементов и чистых веществ, которые они производят. В настоящее время наше определение элемента зависит исключительно от количества протонов внутри атомного ядра, без учета реакционной способности или того, в какой форме можно найти чистое вещество.В этом смысле элементы не обладают «реакционной способностью», «температурами плавления» и т.д .; все это свойства чистых веществ. Единственными истинными свойствами элементов являются такие вещи, как электронное распределение, энергии ионизации и так далее. Тем не менее, часто можно увидеть периодические таблицы, в которых указаны точки плавления и кипения чистых веществ каждого химического элемента, и даже Википедия связывает физические свойства дикислорода с атомными свойствами элементарного кислорода. Хорошо это или плохо, но мы застряли в этой тонкой двусмысленности в номенклатуре.
Тем не менее, часто можно увидеть периодические таблицы, в которых указаны точки плавления и кипения чистых веществ каждого химического элемента, и даже Википедия связывает физические свойства дикислорода с атомными свойствами элементарного кислорода. Хорошо это или плохо, но мы застряли в этой тонкой двусмысленности в номенклатуре.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Окислительно-восстановительная химия кислорода без избыточных ионов щелочных металлов в Na 2/3 [Mg 0,28 Mn 0,72] O 2
Уиттингем, М. С. Литиевые батареи и катодные материалы. Chem. Ред. . 104 , 4271–4302 (2004).
CAS
PubMed
Google Scholar
Croguennec, L. & Palacin, M. R. Последние достижения в области неорганических электродных материалов для литий-ионных батарей. J. Am. Chem. Soc . 137 , 3140–3156 (2015).
CAS
PubMed
Google Scholar
Ларчер, Д. и Тараскон, Ж.-М. На пути к более экологичным и устойчивым батареям для хранения электроэнергии. Nat. Chem . 7 , 19–29 (2015).
Nat. Chem . 7 , 19–29 (2015).
CAS
PubMed
Google Scholar
Seo, D.-H. и другие. Структурно-химическая природа окислительно-восстановительной активности кислорода в слоистых и катионно-неупорядоченных катодных материалах с избытком Li. Nat. Chem . 8 , 692–697 (2016).
CAS
PubMed
Google Scholar
Lu, Z. & Dahn, JR Влияние замещения Ni на Co на структуру и электрохимическое поведение T2- и O2-структуры Li2 / 3 [Co x Ni1 / 3– x Mn2 / 3] O2. J. Electrochem. Soc . 148 , А237 (2001).
CAS
Google Scholar
Ким, Дж.-S. и другие. Электрохимические и структурные свойства электродов x Li2M′O3 (1− x ) LiMn0,5Ni0,5O2 для литиевых батарей (M ′ = Ti, Mn, Zr; 0 ⩽ x ⩽ 0,3). Chem. Материал . 16 , 1996–2006 (2004).
CAS
Google Scholar
Koga, H. et al. Различное окислительно-восстановительное участие кислорода для объема и поверхности: возможное глобальное объяснение механизма циклирования Li1.20Mn0.54Co0.13Ni0.13O2. J. Источники энергии 236 , 250–258 (2013).
CAS
Google Scholar
Луо, К. и др. Компенсация заряда в интеркаляционных катодах из оксида переходного металла 3 d посредством генерации локализованных электронных дырок на кислороде. Nat. Chem . 8 , 684–691 (2016).
CAS
PubMed
Google Scholar
Перес, А.J. et al. Сильное участие кислорода в окислительно-восстановительном процессе, определяющем структурные и электрохимические свойства слоистого оксида Na2IrO3 с высоким содержанием натрия. Chem. Матер. 28 , 8278–8288 (2016).
CAS
Google Scholar
McCalla, E. et al. Визуализация O – O пероксоподобных димеров в слоистых оксидах большой емкости для литий-ионных аккумуляторов. Наука 350 , 1516–1521 (2015).
CAS
PubMed
Google Scholar
Сатья, М.и другие. Обратимая анионная окислительно-восстановительная химия в высокоемких электродах из слоистого оксида. Nat. Материал . 12 , 827–835 (2013).
CAS
PubMed
Google Scholar
Saubanère, M., McCalla, E., Tarascon, J.-M. & Дублет, М.-Л. Интригующий вопрос анионного окислительно-восстановительного потенциала в катодах с высокой плотностью энергии для литий-ионных аккумуляторов. Energy Environ. Sci . 9 , 984–991 (2016).
Google Scholar
Кога, Х. и другие. Обратимое участие кислорода в окислительно-восстановительных процессах выявлено для Li1.20Mn0.54Co0.13Ni0.13O2. J. Electrochem. Soc . 160 , A786 – A792 (2013).
и другие. Обратимое участие кислорода в окислительно-восстановительных процессах выявлено для Li1.20Mn0.54Co0.13Ni0.13O2. J. Electrochem. Soc . 160 , A786 – A792 (2013).
CAS
Google Scholar
Oishi, M. et al. Прямое наблюдение обратимой компенсации заряда ионами кислорода в материале положительного электрода из слоистого оксида марганца Li1.16Ni0.15Co0.19Mn0.50O2. J. Источники энергии 276 , 89–94 (2015).
CAS
Google Scholar
Луо, К. и др. Окислительно-восстановительная химия анионов в электроде интеркаляции оксида переходного металла без кобальта 3 d Li [Li0.2Ni0.2Mn0.6] O2. J. Am. Chem. Soc . 138 , 11211–11218 (2016).
CAS
PubMed
Google Scholar
Rozier, P. et al. Анионная окислительно-восстановительная химия в Na2Ru1- y Sn y O3 материал положительного электрода для Na-ионных аккумуляторов. Электрохим. Коммуна . 53 , 29–32 (2015).
Электрохим. Коммуна . 53 , 29–32 (2015).
CAS
Google Scholar
Du, K. et al. Изучение обратимого окисления кислорода в оксиде марганца. Energy Environ. Sci . 6 , 3–5 (2016).
Google Scholar
Castel, E., Berg, EJ, El Kazzi, M., Novák, P. & Villevieille, C. Дифференциально-электрохимическое масс-спектрометрическое исследование границы раздела x Li2MnO3 · (1− x ) LiMO2 (M = Ni, Co, Mn) материал в качестве положительного электрода в литий-ионных батареях. Chem. Материал . 26 , 5051–5057 (2014).
CAS
Google Scholar
Ябуучи Н. и др. Новый электродный материал для натриевых аккумуляторных батарей: Na2 / 3 [Mg0,28Mn0,72] O2 типа P2 с аномально высокой обратимой емкостью. J. Mater. Chem. А 2 , 16851–16855 (2014).
CAS
Google Scholar
Фрейре, М.и другие. Новое активное соединение Li – Mn – O для литий-ионных аккумуляторов с высокой плотностью энергии. Nat. Материал . 15 , 173–177 (2015).
PubMed
Google Scholar
Meng, Y. S. et al. Упорядочение катионов в слоистых соединениях O3 Li [Ni x Li1 / 3−2 x / 3Mn2 / 3− x /3] O2 (0 ≤ x ≤ 1/2). Chem. Материал . 17 , 2386–2394 (2005).
CAS
Google Scholar
Ябуучи, Н.и другие. Новые слоистые оксиды марганца с избытком лития типа O2 / P2 как многообещающие многофункциональные электродные материалы для перезаряжаемых Li / Na аккумуляторов. Adv. Энергетика . 4 , 1301453 (2014).
Google Scholar
Стоянова Р. и др. Стабилизация сверхстехиометрического Mn 4+ в слоистом Na2 / 3MnO2. J. Химия твердого тела . 183 , 1372–1379 (2010).
и др. Стабилизация сверхстехиометрического Mn 4+ в слоистом Na2 / 3MnO2. J. Химия твердого тела . 183 , 1372–1379 (2010).
CAS
Google Scholar
Чжоу Т., Чжан Д., Баттон Т. В., Райт А. Дж. И Гривз К. Влияние скорости охлаждения на структуру и состав Na x CoO2 ( x ∼0,65). J. Mater. Chem . 19 , 1123–1128 (2009).
CAS
Google Scholar
Сатья, М., Хемалата, К., Рамеша, К., Тараскон, Ж.-М. & Пракаш, А.С. Синтез, структура и электрохимические свойства слоистого материала катода с введением натрия: NaNi1 / 3Mn1 / 3Co1 / 3O2. Chem. Материал . 24 , 1846–1853 (2012).
CAS
Google Scholar
Даффорт В., Талаи Э., Блэк Р. и Назар Л. Ф. Поглощение CO2 слоистым P2-Na0,67Mn0,5Fe0,5O2: введение карбонатных анионов. Chem. Материал . 27 , 2515–2524 (2015).
Материал . 27 , 2515–2524 (2015).
CAS
Google Scholar
Лу, З. и Дан, Дж. Р. In situ Рентгеноструктурное исследование P2-Na2 / 3 [Ni1 / 3Mn2 / 3] O2. J. Electrochem. Soc . 148 , А1225 (2001).
CAS
Google Scholar
Hong, J. et al. Важнейшая роль кислорода принадлежит слоистым оксидам металлов с избытком Li в литиевых аккумуляторных батареях. Chem. Материал . 24 , 2692–2697 (2012).
CAS
Google Scholar
Аурбах, Д. Взаимосвязь между химией поверхности, морфологией поверхности и эффективностью циклирования литиевых электродов в нескольких полярных апротонных системах. J. Electrochem. Soc . 136 , 3198–3205 (1989).
CAS
Google Scholar
McCalla, E.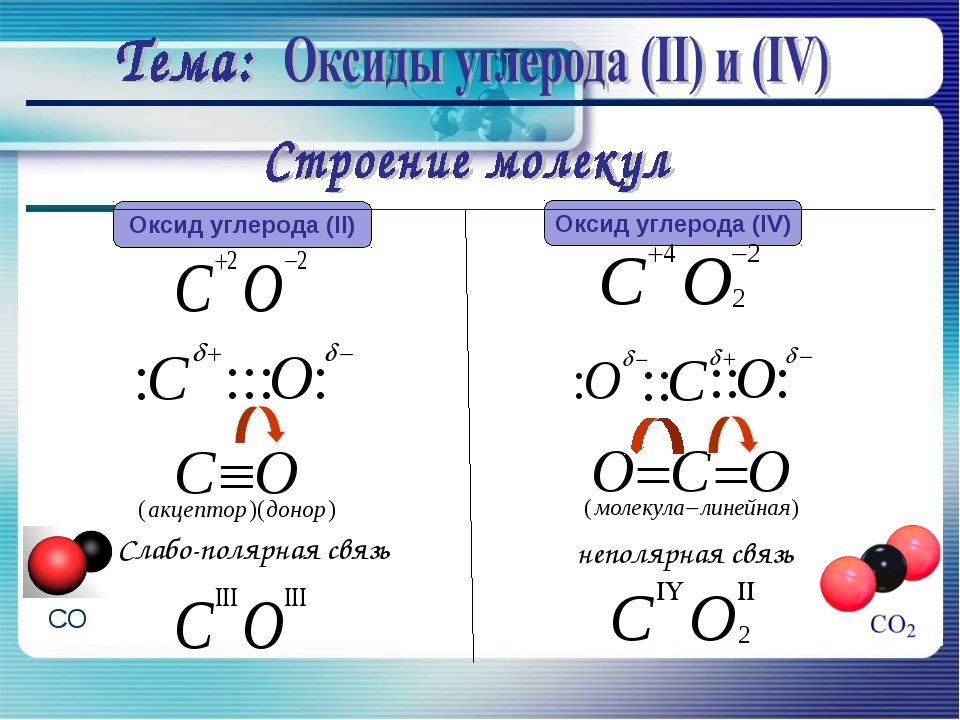 et al. Понимание роли анионного окислительно-восстановительного потенциала и выделения кислорода во время электрохимического циклирования слоистого Li4FeSbO6 с высоким содержанием лития. J. Am. Chem. Soc . 137 , 4804–4814 (2015).
et al. Понимание роли анионного окислительно-восстановительного потенциала и выделения кислорода во время электрохимического циклирования слоистого Li4FeSbO6 с высоким содержанием лития. J. Am. Chem. Soc . 137 , 4804–4814 (2015).
CAS
PubMed
Google Scholar
де ла Ллав, Э.и другие. Повышение плотности энергии и структурной стабильности катодов из оксида марганца для Na-ионных аккумуляторов путем структурного замещения лития. Chem. Материал . 28 , 9064–9076 (2016).
CAS
Google Scholar
Sathiya, M. et al. Высокоэффективные катодные материалы Li2Ru1− y Mn y O3 (0,2 ≤ y ≤ 0,8) для литий-ионных аккумуляторных батарей: их понимание. Chem.Материал . 25 , 1121–1131 (2013).
CAS
Google Scholar
Армстронг, А. Р. и др. Демонстрация потери кислорода и связанной с этим структурной реорганизации в катоде литиевой батареи Li [Ni0.2Li0.2Mn0.6] O2. J. Am. Chem. Soc . 128 , 8694–8698 (2006).
Р. и др. Демонстрация потери кислорода и связанной с этим структурной реорганизации в катоде литиевой батареи Li [Ni0.2Li0.2Mn0.6] O2. J. Am. Chem. Soc . 128 , 8694–8698 (2006).
CAS
PubMed
Google Scholar
Ли, К. Т. К.T. et al. Na типа P2 x [Fe1 / 2Mn1 / 2] O2, изготовленный из землистых элементов для аккумуляторных батарей Na. Chem. Материал . 26 , 820–829 (2014).
Google Scholar
Mortemard De Boisse, B., Carlier, D., Guignard, M., Bourgeois, L. & Delmas, C. P2-Na x Фаза Mn1 / 2Fe1 / 2O2, используемая в качестве положительного электрода в Na-батареях : структурные изменения, вызванные электрохимическим (де) процессом интеркаляции. Inorg. Chem . 53 , 11197–11205 (2014).
CAS
PubMed
Google Scholar
Jiang, M. , Key, B., Meng, YS & Gray, CP Электрохимическое и структурное исследование слоистого материала электрода литий-ионной батареи с «избытком лития» Li [Li1 / 9Ni1 / 3Mn5 / 9 ] O2. Chem. Материал . 21 , 2733–2745 (2009).
, Key, B., Meng, YS & Gray, CP Электрохимическое и структурное исследование слоистого материала электрода литий-ионной батареи с «избытком лития» Li [Li1 / 9Ni1 / 3Mn5 / 9 ] O2. Chem. Материал . 21 , 2733–2745 (2009).
CAS
Google Scholar
Сюй Дж.и другие. Определение критической роли замещения Li в P2-Na x [Li y Ni z Mn1− y −z] O2 (0 & lt; x , y , z & lt; 1 ) интеркаляционные катодные материалы для высокоэнергетических Na-ионных аккумуляторов. Chem. Материал . 26 , 1260–1269 (2014).
CAS
Google Scholar
Enkovaara, J. et al. QUANTUM ESPRESSO: модульный программный проект с открытым исходным кодом для квантового моделирования материалов. J. Phys. Конденс. Дело 21 (2009).
Пердью, Дж. П., Берк, К. и Эрнцерхоф, М. Обобщенное приближение градиента стало проще. Phys. Rev. Lett. 77 (1996).
Phys. Rev. Lett. 77 (1996).
Schlipf, M. & Gygi, F. Алгоритм оптимизации для генерации псевдопотенциалов ONCV. Comput. Phys. Commun. 196 , 36–44 (2015).
CAS
Google Scholar
Кокоччони, М.и де Жиронколи, С. Подход с линейным откликом к расчету эффективных параметров взаимодействия в методе LDA + U. Phys. Ред. B 71 , 035105 (2005).
Google Scholar
Ли, Д. Х., Сюй, Дж. И Мэн, Ю. С. Усовершенствованный катод для Na-ионных аккумуляторов с высокой производительностью и превосходной структурной стабильностью. Phys. Chem. Chem. Phys. 15 , 3304–3312 (2013).
CAS
PubMed
Google Scholar
Гирингелли, Г., Брайкович, Л., Шмитт, Т. и Строчов, В. RIXS с высоким разрешением со спектрометром SAXES на канале ADRESS швейцарского источника света. Synchrotron Radiat. Новости 25 , 16–22 (2012).
Synchrotron Radiat. Новости 25 , 16–22 (2012).
Google Scholar
Строков В.Н. и др. ADRESS по линии передачи мягкого рентгеновского излучения высокого разрешения в швейцарском источнике света для резонансного неупругого рассеяния рентгеновских лучей и фотоэлектронной спектроскопии с угловым разрешением. Дж.Синхротрон Радиат . 17 , 631–643 (2010).
CAS
PubMed
PubMed Central
Google Scholar
Ghiringhelli, G. et al. SAXES, спектрометр высокого разрешения для резонансного рентгеновского излучения в диапазоне энергий 400-1600 эВ. Rev. Sci. Инструмент . 77 , 113108 (2006).
Google Scholar
Кислород | Безграничная химия
Свойства кислорода
Кислород — неметаллический элемент с высокой реакционной способностью; он является сильным окислителем с высокой электроотрицательностью и образует O 2 при стандартной температуре и давлении (STP).
Цели обучения
Просмотрите свойства кислорода.
Основные выводы
Ключевые моменты
- При стандартной температуре и давлении (STP) два атома элемента связываются с образованием дикислорода — двухатомного газа без цвета, запаха и вкуса с формулой O 2 .
- Кислород входит в группу халькогенов периодической таблицы Менделеева и является высокореактивным неметаллическим элементом. Таким образом, он легко образует соединения (особенно оксиды) почти со всеми другими элементами.
- Кислород является сильным окислителем и имеет второе место по электроотрицательности среди всех реакционноспособных элементов, уступая только фтору.
- Растворимость кислорода в воде зависит от температуры; конденсируется при 90,20 К и замерзает при 54,36 К.
Ключевые термины
- кислород : химический элемент (символ O) с атомным номером 8 и атомной массой 15,9994 а.е.м.
- озон : аллотроп кислорода (обозначение O3), имеющий в молекуле три атома вместо обычных двух; это голубой газ, образующийся из кислорода электрическим разрядом; он ядовит и обладает высокой реакционной способностью, но он защищает жизнь на Земле, поглощая солнечное ультрафиолетовое излучение в верхних слоях атмосферы.

- парамагнитный : демонстрирует парамагнетизм (склонность магнитных диполей выравниваться с внешним магнитным полем).
Кислород является важной частью атмосферы и необходим для поддержания жизни на Земле. Поскольку он составляет большую часть массы воды, он также составляет большую часть массы живых организмов. Все основные классы структурных молекул в живых организмах, такие как белки, углеводы и жиры, содержат кислород, как и основные неорганические соединения, из которых состоят панцири, зубы и кости животных.Элементарный кислород (O 2 ) вырабатывается цианобактериями, водорослями и растениями в процессе фотосинтеза и используется в клеточном дыхании большинства живых организмов на Земле. Кислород токсичен для облигатных анаэробных организмов (организмов, которым требуется , не хватает кислорода для выживания), которые были доминирующей формой ранней жизни на Земле, пока O 2 не начал накапливаться в атмосфере.
Химические свойства кислорода
При стандартной температуре и давлении (STP) два атома элемента связываются с образованием дикислорода — двухатомного газа без цвета, запаха и вкуса с формулой O 2 .Кислород входит в группу халькогенов периодической таблицы Менделеева и является высокореактивным неметаллическим элементом. Таким образом, он легко образует соединения (особенно оксиды) почти со всеми другими элементами. Кислород является сильным окислителем и занимает второе место по электроотрицательности среди всех реакционноспособных элементов, уступая только фтору. По массе кислород является третьим по распространенности элементом во Вселенной после водорода и гелия и самым распространенным элементом по массе в земной коре, составляя почти половину массы коры.Свободный кислород слишком химически реактивен, чтобы появиться на Земле без фотосинтетического действия живых организмов, которые используют энергию солнечного света для производства элементарного кислорода из воды.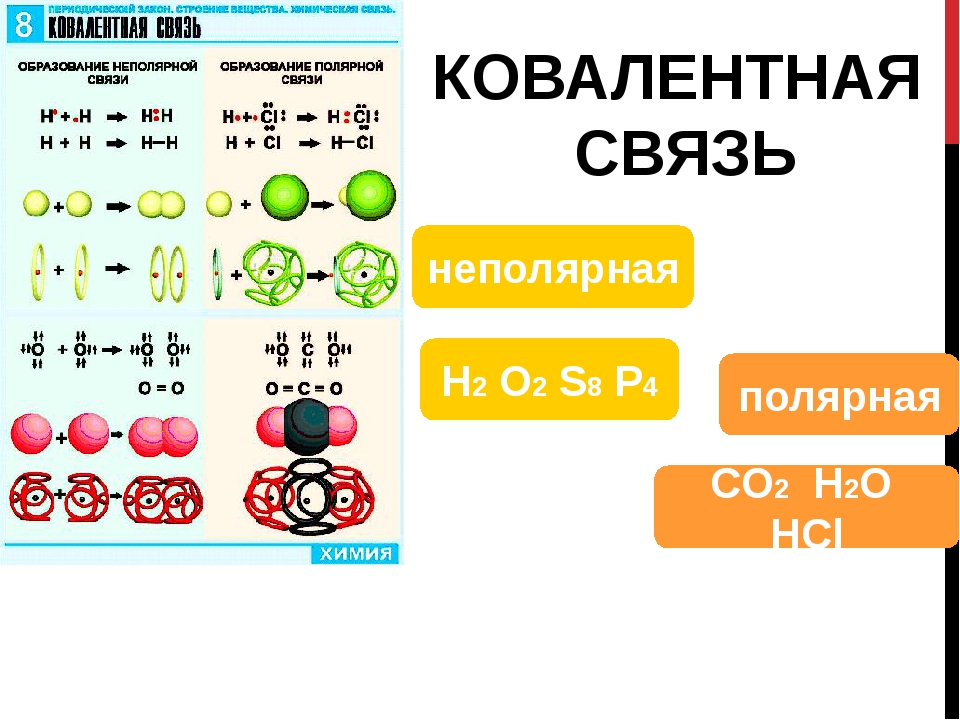 Элементный O 2 начал накапливаться в атмосфере только после эволюционного появления фотосинтезирующих организмов, примерно 2,5 миллиарда лет назад. Двухатомный кислород в настоящее время составляет 20,8% от объема воздуха.
Элементный O 2 начал накапливаться в атмосфере только после эволюционного появления фотосинтезирующих организмов, примерно 2,5 миллиарда лет назад. Двухатомный кислород в настоящее время составляет 20,8% от объема воздуха.
Двухатомный кислород
Два атома кислорода в двухатомном кислороде химически связаны друг с другом со спиновой триплетной электронной конфигурацией.Эта связь имеет порядок связи два и часто упрощается в описании как двойная связь или как комбинация одной двухэлектронной связи и двух трехэлектронных связей. Триплетный кислород (не путать с озоном, O 3 ) является основным состоянием молекулы O 2 . Электронная конфигурация молекулы имеет два неспаренных электрона, занимающих две вырожденные молекулярные орбитали. Эти орбитали классифицируются как разрыхляющие (ослабление порядка связи с трех до двух), поэтому связь двухатомного кислорода слабее, чем тройная связь двухатомного азота, в которой все связывающие молекулярные орбитали заполнены, а некоторые антисвязывающие орбитали — нет.
В нормальной триплетной форме молекулы O 2 парамагнитны. Это означает, что они ведут себя как магниты в присутствии внешнего магнитного поля из-за спиновых магнитных моментов неспаренных электронов в молекуле. Жидкий кислород притягивается к магниту в достаточной степени, чтобы в лабораторных экспериментах мостик жидкого кислорода мог поддерживаться против собственного веса между полюсами мощного магнита. Синглетный кислород — это название, данное нескольким более высокоэнергетическим разновидностям молекулярного O 2 , в котором все спины электронов спарены.Он гораздо более реактивен по отношению к обычным органическим молекулам, чем триплетная форма молекулярного кислорода.
Физические свойства кислорода
Жидкий кислород : Пузырьки кислорода поднимаются сквозь бледно-голубой жидкий кислород.
Кислород более растворим в воде, чем азот; вода содержит приблизительно одну молекулу O 2 на каждые две молекулы N 2 , по сравнению с атмосферным отношением приблизительно один к четырем. Растворимость кислорода в воде зависит от температуры и примерно вдвое больше (14.6 мг / л) растворяется при 0 ° C, чем при 20 ° C (7,6 мг / л). При 25 ° C и 1 стандартной атмосфере (101,3 кПа) воздуха пресная вода содержит около 6,04 миллилитра (мл) кислорода на литр, тогда как морская вода содержит около 4,95 мл на литр. При 5 ° C растворимость увеличивается до 9,0 мл (на 50 процентов больше, чем при 25 ° C) на литр для воды и 7,2 мл (на 45 процентов больше) на литр для морской воды.
Растворимость кислорода в воде зависит от температуры и примерно вдвое больше (14.6 мг / л) растворяется при 0 ° C, чем при 20 ° C (7,6 мг / л). При 25 ° C и 1 стандартной атмосфере (101,3 кПа) воздуха пресная вода содержит около 6,04 миллилитра (мл) кислорода на литр, тогда как морская вода содержит около 4,95 мл на литр. При 5 ° C растворимость увеличивается до 9,0 мл (на 50 процентов больше, чем при 25 ° C) на литр для воды и 7,2 мл (на 45 процентов больше) на литр для морской воды.
Кислород конденсируется при 90,20 К (-182,95 ° C, -297,31 ° F) и замерзает при 54,36 К (-218,79 ° C, -361,82 ° F). И жидкий, и твердый O 2 — прозрачные вещества светло-голубого цвета, вызванные поглощением в красном (в отличие от голубого цвета неба, который возникает из-за рэлеевского рассеяния синего света).
Жидкость высокой чистоты O 2 обычно получают фракционной перегонкой сжиженного воздуха. Жидкий кислород также может быть получен путем конденсации из воздуха с использованием жидкого азота в качестве хладагента. Это высокореактивное вещество, которое необходимо отделить от горючих материалов.
Это высокореактивное вещество, которое необходимо отделить от горючих материалов.
Оксиды
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент в своей химической формуле.
Цели обучения
Обсудите химические свойства оксидов.
Основные выводы
Ключевые моменты
- Оксиды металлов обычно содержат анион кислорода в степени окисления -2.
- Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем.
- Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха.
- Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).

Ключевые термины
- пассивация : Самопроизвольное образование твердой нереактивной поверхностной пленки (обычно оксида или нитрида), которая препятствует дальнейшей коррозии.
- оксид : бинарное химическое соединение кислорода с другим химическим элементом.
- кокс : твердый остаток от обжига угля в коксовой печи; используется в основном в качестве топлива и при производстве стали, а ранее в качестве бытового топлива.
Химические свойства оксидов
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент в своей химической формуле.Оксиды металлов обычно содержат анион кислорода в степени окисления -2. Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды. При сжигании углеводородов образуются два основных оксида углерода: монооксид углерода (CO) и диоксид углерода (CO 2 ). Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкую пленку из Al 2 O 3 (называемую пассивирующим слоем), которая защищает фольгу от дальнейшей коррозии.
Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкую пленку из Al 2 O 3 (называемую пассивирующим слоем), которая защищает фольгу от дальнейшей коррозии.
Кислород демонстрирует высокую реакционную способность
Из-за своей электроотрицательности кислород образует прочные химические связи почти со всеми элементами с образованием соответствующих оксидов. Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем. Двумя независимыми путями коррозии элементов являются гидролиз и окисление кислородом. Сочетание воды и кислорода еще более агрессивно.Практически все элементы горят в атмосфере кислорода или богатой кислородом среде. В присутствии воды и кислорода (или просто воздуха) некоторые элементы, например натрий, быстро и даже опасно реагируют с образованием гидроксидных продуктов. Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической форме. Цезий настолько реактивен с кислородом, что используется в качестве геттера в электронных лампах. Растворы калия и натрия используются для дезоксигенации и обезвоживания некоторых органических растворителей.
Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической форме. Цезий настолько реактивен с кислородом, что используется в качестве геттера в электронных лампах. Растворы калия и натрия используются для дезоксигенации и обезвоживания некоторых органических растворителей.
Пассивация
Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха. Как упоминалось выше, хорошо известным примером является алюминиевая фольга, покрытая тонкой пленкой оксида алюминия, которая пассивирует металл, замедляя дальнейшую коррозию. Слой оксида алюминия может быть увеличен с помощью процесса электролитического анодирования. Хотя твердый магний и алюминий медленно реагируют с кислородом в STP, они, как и большинство металлов, горят на воздухе, создавая очень высокие температуры.
Сравнение полимерных и мономерных молекулярных структур
Оксиды большинства металлов имеют полимерную структуру с поперечными связями M-O-M. Поскольку эти поперечные связи являются прочными, твердые вещества, как правило, нерастворимы в растворителях, хотя они подвержены воздействию кислот и оснований. Формулы часто обманчиво просты. Многие из них нестехиометрические. В этих оксидах координационное число оксидного лиганда составляет 2 для большинства электроотрицательных элементов и 3–6 для большинства металлов.
Поскольку эти поперечные связи являются прочными, твердые вещества, как правило, нерастворимы в растворителях, хотя они подвержены воздействию кислот и оснований. Формулы часто обманчиво просты. Многие из них нестехиометрические. В этих оксидах координационное число оксидного лиганда составляет 2 для большинства электроотрицательных элементов и 3–6 для большинства металлов.
Диоксид кремния : Диоксид кремния (SiO2) — один из наиболее распространенных оксидов на поверхности Земли.Как и большинство оксидов, он имеет полимерную структуру.
Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами. Самые известные молекулярные оксиды — это углекислый газ и окись углерода. Пятиокись фосфора — более сложный молекулярный оксид с обманчивым названием, формула которого P 4 O 10 . Некоторые полимерные оксиды (диоксид селена и триоксид серы) деполимеризуются с образованием молекул при нагревании. Тетроксиды редки, и известно только пять примеров: четырехокись рутения, четырехокись осмия, четырехокись гассия, четырехокись иридия и четырехокись ксенона.Известно много оксианионов, таких как полифосфаты и полиоксометаллаты. Оксикатионы встречаются реже, например, нитрозоний (NO + ). Конечно, известно много соединений как с оксидами, так и с другими группами. Для переходных металлов известно много оксо-комплексов, а также оксигалогенидов.
Кислотно-основные реакции
Оксиды подвержены действию кислот и оснований. Те, на кого воздействуют только кислоты, являются основными оксидами; те, на которые воздействуют только основания, являются кислыми оксидами. Оксиды, которые реагируют как с кислотами, так и с основаниями, являются амфотерными.Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Другие окислительно-восстановительные реакции
Металлы «извлекаются» из оксидов путем химического восстановления. Распространенным и дешевым восстановителем является углерод в виде кокса. Наиболее ярким примером является выплавка железной руды.
Оксиды, такие как оксид железа (III) (или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 · nH 2 O и оксид-гидроксид железа (III) FeO (OH), Fe (OH) 3 ), образуются при соединении кислорода с железом.
Оксиды металлов можно восстанавливать органическими соединениями. Этот окислительно-восстановительный процесс является основой многих важных преобразований в химии, таких как детоксикация лекарств с помощью ферментов P450 и производство оксида этилена, который превращается в антифриз. В таких системах металлический центр передает оксидный лиганд органическому соединению с последующей регенерацией оксида металла, часто кислородом воздуха.
Использование кислорода
Кислород необходим всем аэробным организмам; обычное медицинское использование включает кислородную терапию, гипербарическую медицину и космические костюмы.
Цели обучения
Приведите примеры некоторых распространенных видов использования кислорода в медицинских целях.
Основные выводы
Ключевые моменты
- Кислород используется в митохондриях для выработки аденозинтрифосфата (АТФ) во время окислительного фосфорилирования.
- Активные формы кислорода, такие как супероксид-ион (O 2 — ) и пероксид водорода (H 2 O 2 ), являются опасными побочными продуктами использования кислорода в организмах.
- Кислородная терапия не только увеличивает уровень кислорода в крови пациента, но также снижает сопротивление кровотоку во многих типах больных легких, облегчая рабочую нагрузку на сердце. Он используется для лечения эмфиземы, пневмонии и некоторых сердечных заболеваний (застойной сердечной недостаточности).
- Гипербарическая медицина (высокое давление) использует специальные кислородные камеры для повышения парциального давления O 2 вокруг пациента.
Ключевые термины
- Гипербарический : относящийся к давлению, превышающее нормальное (например, для кислорода), или использующее его.
- аэробные : организмы, живущие в присутствии кислорода (например, аэробные бактерии).
Молекулярный кислород, O 2 , необходим для клеточного дыхания у всех аэробных организмов. Кислород используется в митохондриях для выработки аденозинтрифосфата (АТФ) во время окислительного фосфорилирования. Активные формы кислорода, такие как супероксид-ион (O 2 — ) и пероксид водорода (H 2 O 2 ), являются опасными побочными продуктами использования кислорода в организмах.Однако части иммунной системы высших организмов используют реактивный перекись, супероксид и синглетный кислород для уничтожения вторгшихся микробов. Активные формы кислорода также играют важную роль в гиперчувствительной реакции растений на атаку патогенов. Взрослый человек в состоянии покоя вдыхает от 1,8 до 2,4 граммов кислорода в минуту. Это составляет более 6 миллиардов тонн кислорода, вдыхаемого человечеством в год.
Кислородная терапия
Одно из медицинских применений кислорода — кислородная терапия.Поглощение O 2 из воздуха является основной целью дыхания, поэтому в медицине используется добавка кислорода. Лечение не только увеличивает уровень кислорода в крови пациента, но и имеет вторичный эффект снижения сопротивления кровотоку во многих типах больных легких, облегчая рабочую нагрузку на сердце. Кислородная терапия используется для лечения эмфиземы, пневмонии, некоторых сердечных заболеваний (застойная сердечная недостаточность), некоторых заболеваний, вызывающих повышение давления в легочной артерии, а также любых заболеваний, которые ухудшают способность организма поглощать и использовать газообразный кислород.Лечение достаточно гибкое, чтобы его можно было использовать в больницах, дома у пациента или все чаще с помощью портативных устройств. Когда-то кислородные палатки обычно использовались для добавления кислорода, но с тех пор их заменили в основном кислородные маски или носовые канюли.
Концентратор кислорода : Концентратор кислорода для пациента с эмфиземой.
Гипербарическая медицина
Гипербарическая медицина (высокого давления) использует специальные кислородные камеры для повышения парциального давления O 2 вокруг пациента и, при необходимости, медицинского персонала.С помощью этих устройств иногда лечат отравление угарным газом, газовую гангрену и декомпрессионную болезнь («изгибы»). Повышенная концентрация O 2 в легких помогает вытеснить окись углерода из гемовой группы гемоглобина. Газообразный кислород ядовит для анаэробных бактерий, вызывающих газовую гангрену, поэтому повышение его парциального давления помогает их убить. Декомпрессионная болезнь возникает у дайверов, которые слишком быстро декомпрессируются после погружения, в результате чего в их крови образуются пузырьки инертного газа, в основном азота и гелия.Повышение давления O 2 как можно скорее является частью лечения. Кислород также используется в медицине для пациентов, которым требуется искусственная вентиляция легких, часто в концентрациях выше 21% в окружающем воздухе.
Использование в космических костюмах и костюмах для подводного плавания
Заметное применение O 2 в качестве дыхательного газа низкого давления — это современные скафандры, которые окружают тело человека, находящегося в нем, сжатым воздухом. Эти устройства используют почти чистый кислород при давлении около одной трети нормального, что приводит к нормальному парциальному давлению крови O 2 .Этот компромисс между более высокой концентрацией кислорода и более низким давлением необходим для сохранения гибкости скафандров.
Аквалангисты и подводники также полагаются на искусственно доставленный O 2 , но чаще всего используют нормальное давление и / или смеси кислорода и воздуха. O 2 использование в дайвинге при давлении выше уровня моря обычно ограничивается использованием ребризера, декомпрессии или экстренной помощи на относительно небольших глубинах (глубина ~ 6 метров или меньше). Для более глубокого погружения требуется значительное разбавление O 2 другими газами, такими как азот или гелий, для предотвращения кислородного отравления.Люди, которые поднимаются в горы или летают на самолетах без давления, иногда имеют дополнительные запасы O 2 .
Герметичные коммерческие самолеты
Пассажирам, путешествующим на коммерческих самолетах под давлением, предоставляется аварийный запас O 2 , который автоматически подается им в случае разгерметизации салона. Внезапная потеря давления в салоне активирует химические генераторы кислорода над каждым сиденьем, в результате чего кислородные маски падают. При надевании масок, «чтобы запустить поток кислорода», как предписывают инструкции по безопасности в кабине, железные опилки попадают в образец хлората натрия внутри канистры, где происходит реакция.В результате экзотермической реакции образуется устойчивый поток газообразного кислорода.
Озон
Озон (O 3 ) диамагнитен (все его электроны спарены) и является мощным окислителем.
Цели обучения
Обсудите свойства озона.
Основные выводы
Ключевые моменты
- Озон образуется из O 2 под действием ультрафиолетового света, а также атмосферных электрических разрядов. Он присутствует в низких концентрациях в атмосфере Земли.
- Озон слабо растворим в воде и гораздо лучше растворим в инертных неполярных растворителях, таких как четыреххлористый углерод (CCl 4 ) или фторуглероды, где он образует голубой раствор.
- Озон окисляет большинство металлов (кроме золота, платины и иридия) до оксидов металлов в их наивысшей степени окисления.
- Алкены могут быть окислительно расщеплены озоном в процессе, называемом озонолизом. При восстановительной обработке (например, цинк в уксусной кислоте или диметилсульфиде) будут образовываться кетоны и альдегиды.При окислительной обработке (например, водной или спиртовой перекисью водорода) образуются карбоновые кислоты.
- Озон, наряду с реактивными формами кислорода, такими как супероксид, синглетный кислород, перекись водорода и ионы гипохлорита, естественным образом вырабатывается лейкоцитами и другими биологическими системами как средство уничтожения инородных тел.
Ключевые термины
- озон : трехатомная молекула, также называемая трехкислородом, состоящая из трех атомов кислорода (O3).
- Алкены : В органической химии алкен, олефин, представляет собой ненасыщенное химическое соединение, содержащее по крайней мере одну двойную связь углерод-углерод.
- диамагнетик : проявляющий диамагнетизм; отталкивается магнитом.
Свойства озона
Озон (O 3 ), или триоксислород, представляет собой трехатомную молекулу, состоящую из трех атомов кислорода. Это аллотроп кислорода, который намного менее стабилен, чем двухатомный аллотроп (O 2 ), распадаясь с периодом полураспада около получаса в нижних слоях атмосферы до O 2 .Озон диамагнитен, что означает, что все его электроны спарены. Напротив, O 2 является парамагнитным, содержащим два неспаренных электрона.
Резонансные структуры озона : Показаны две резонансные структуры O 3 .
Озон в атмосфере
Озон образуется из двуокиси кислорода под действием ультрафиолетового света, а также атмосферных электрических разрядов. Он присутствует в низких концентрациях в атмосфере Земли.Всего озон составляет всего 0,6 частей на миллион атмосферы. Озон имеет резкий запах, напоминающий запах хлора, и многие люди могут уловить его при концентрации всего 10 частей на миллиард в воздухе. В стандартных условиях озон представляет собой бледно-голубой газ, который конденсируется при постепенно снижающихся температурах до темно-синей жидкости и, наконец, до фиолетово-черного твердого вещества. Озон является мощным окислителем (в гораздо большей степени, чем дикислород) и имеет множество промышленных и бытовых применений, связанных с окислением. Однако этот же высокий окислительный потенциал заставляет озон повреждать слизь и респираторные ткани животных, а также ткани растений, когда он существует в концентрациях выше 100 частей на миллиард.Это делает озон потенциально опасным для дыхательных путей и загрязняющим веществом вблизи земли. Однако так называемый озоновый слой (часть стратосферы с более высокой концентрацией озона, от двух до восьми частей на миллион) полезен. Он предотвращает попадание вредного ультрафиолетового света на поверхность Земли, что приносит пользу всем живым организмам.
Структура озона : Озон представляет собой трехатомную молекулу без неспаренных электронов и изогнутой молекулярной формы. Показаны длины связи и угол, образованный тремя атомами O.
Физические свойства озона
Озон слабо растворим в воде и гораздо лучше растворим в инертных неполярных растворителях, таких как четыреххлористый углерод или фторуглероды, где он образует голубой раствор. При 161 K (-112 ° C) он конденсируется с образованием темно-синей жидкости. Давать этой жидкости нагреваться до точки кипения опасно, поскольку как концентрированный газообразный озон, так и жидкий озон могут взорваться. При температуре ниже 80 К (-193 ° C) он образует фиолетово-черное твердое вещество. Он также нестабилен при высоких концентрациях, распадаясь на обычный двухатомный кислород (с периодом полураспада около получаса в атмосферных условиях):
[латекс] 2 \ text {O} _3 \ rightarrow 3 \ text {O} _2 [/ латекс]
Эта реакция протекает быстрее при повышении температуры и давления.{2+} +3 {\ text {H}} _ {2} \ text {O} + {\ text {O}} _ {2} [/ latex]
Алкены могут быть окислительно расщеплены озоном в процессе, называемом озонолизом, с образованием спиртов, альдегидов, кетонов и карбоновых кислот, в зависимости от второго этапа обработки.
Озонолиз : На этом рисунке показан разрыв двойных связей углерод-углерод посредством O 3 .
Обычно озонолиз проводят в растворе дихлорметана при температуре -78 o C.После последовательности расщепления и перегруппировки образуется органический озонид. При восстановительной обработке (например, цинк в уксусной кислоте или диметилсульфиде) будут образовываться кетоны и альдегиды. При окислительной обработке (например, водной или спиртовой перекисью водорода) будут образовываться карбоновые кислоты.
Роль озона в биологических процессах
Озон, наряду с реактивными формами кислорода, такими как супероксид, синглетный кислород, перекись водорода и ионы гипохлорита, естественным образом вырабатывается лейкоцитами и другими биологическими системами (такими как корни бархатцев) как средство уничтожения инородных тел.Озон напрямую реагирует с органическими двойными связями.
Когда озон распадается на дикислород, он производит свободные радикалы кислорода, которые обладают высокой реакционной способностью и способны повредить многие органические молекулы. Более того, считается, что мощные окислительные свойства озона могут быть фактором воспаления. Причинно-следственная связь того, как озон создается в организме и что он делает, все еще рассматривается и по-прежнему подлежит различным интерпретациям, поскольку другие химические процессы в организме могут запускать некоторые из тех же реакций.
Молекулярный кислород — Energy Education
Рис. 1. Модель молекулярного или двухатомного кислорода, состоящего из двух атомов кислорода, связанных вместе. [1]
Молекулярный кислород (O 2 ) — двухатомная молекула, состоящая из двух атомов кислорода, удерживаемых вместе ковалентной связью. Молекулярный кислород необходим для жизни, так как он используется для дыхания многих организмов. Это также важно для сжигания ископаемого топлива.
Молекулярный кислород очень химически активен и имеет тенденцию легко образовывать оксидов путем реакции с другими элементами и соединениями.Мы полагаемся на фотосинтез растений для пополнения молекулярного кислорода в атмосфере — если фотосинтез прекратится, в конечном итоге содержание кислорода в атмосфере упадет почти до нуля.
Поскольку животные (включая человека) дышат молекулярным кислородом и нуждаются в нем для обмена веществ, это важно с медицинской точки зрения. Молекулярный кислород терапевтически предоставляется в кислородной терапии и барокамерах, а также входит в состав дыхательного газа для исследования космоса и подводного плавания с аквалангом.
В промышленности кислород используется для удаления примесей серы и углерода во время плавки.Кислород (как сжатый газ) также широко используется при сварке и резке металлов и как окислитель в ракетных двигателях. Кислород также важен для создания многих видов химического сырья, например оксида этилена. [2]
Недвижимость
Некоторые физические свойства молекулярного кислорода:
Горение
Молекулярный кислород важен для горения, особенно при сжигании топлива для получения энергии. Горение — это реакция соединения (топлива) с окислителем (которым обычно является молекулярный кислород) с образованием оксидов.Третий компонент сгорания — это «прилив» энергии, необходимой для начала реакции — энергия активации . Все три компонента (топливо, окислитель, энергия) должны присутствовать для того, чтобы произошла реакция горения.
При сжигании ископаемого топлива, такого как метан, показанного на Рисунке 2 ниже, образуется диоксид углерода, водяной пар и энергия. Сжигание ископаемого топлива обеспечивает около 95% первичной энергии в мире. Сжигание углеводородов также способствует изменению климата, производя такие выбросы, как двуокись углерода.
Рис. 2. Метан соединяется с кислородом с образованием диоксида углерода, воды и тепла. [5]
В то время как другие вещества (например, фтор) могут действовать как окислители при горении [6] , кислород является наиболее распространенным. Окислители поддерживают горение, принимая электроны от молекулы топлива, облегчая разрыв химических связей в реакции. Хотя фтор на самом деле является лучшим акцептором электронов, чем кислород, окисление фтором слишком интенсивно, чтобы быть полезным для большинства применений.Кислорода также больше, и его легче найти, что делает его наиболее распространенным окислителем для этих реакций.
Список литературы
Кислород (O) — химические свойства, воздействие на здоровье и окружающую среду
Газообразный химический элемент, символ: O, атомный номер: 8 и атомный вес 15,9994. Он представляет большой интерес, поскольку является важным элементом дыхательных процессов большинства живых клеток и процессов горения. Это самый распространенный элемент в земной коре.Почти пятая часть (по объему) воздуха — кислород. Несвязанный газообразный кислород обычно существует в форме двухатомных молекул, O 2 , но он также существует в трехатомной форме, O 3 , называемой озоном.
В нормальных условиях кислород представляет собой безвкусный газ без цвета, запаха и запаха; он конденсируется в голубой жидкости. Кислород входит в небольшую группу газов, буквально парамагнитных, и это самый парамагнитный из всех. Жидкий кислород также немного парамагнитен.
Кислород реакционноспособен и образует оксиды со всеми другими элементами, кроме гелия, неона, аргона и криптона.Умеренно растворим в воде (растворяется 30 см 3 на 1 литр воды) при 20 градусах Цельсия.
Приложения
Кислород можно отделить от воздуха путем фракционированного ожижения и дистилляции. Основными применениями кислорода в порядке важности являются: 1) плавка, рафинирование и производство стали и других металлов; 2) производство химикатов путем контролируемого окисления; 3) ракетная двигательная установка; 4) медико-биологическое жизнеобеспечение; 5) добыча, производство и производство изделий из камня и стекла.
Аварийная подача кислорода автоматически становится доступной для пассажира в самолете при внезапном падении давления. Этот кислород хранится не в виде газообразного кислорода, а в виде химического хлората натрия.
Кислород в окружающей среде
Земная кора состоит в основном из кремний-кислородных минералов, и многие другие элементы присутствуют в них в виде их оксидов.
Газообразный кислород составляет пятую часть атмосферы, что составляет более миллиона миллиардов тонн.Кислород в атмосфере Земли образуется в результате фотосинтеза растений и накапливался за долгое время, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.
Кислород хорошо растворяется в воде, что делает возможной жизнь в реках, озерах и океанах. Вода в реках и озерах должна регулярно снабжаться кислородом, поскольку, когда он истощится, вода больше не будет поддерживать рыбу и другие водные виды.
Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений.Вода H 2 O и кремнезем SiO 2 , основной компонент песка, относятся к числу наиболее распространенных бинарных кислородных соединений. Среди соединений, содержащих более двух элементов, наиболее распространены силикаты, образующие большую часть горных пород и почв. Другими соединениями, которые широко распространены в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (боксит) и различные оксиды железа, которые используются в качестве источников металла.
Кислород необходим для всех форм жизни, поскольку он является составной частью ДНК и почти всех других биологически важных соединений.Неужели это еще более важно, поскольку животные должны получать поминутный запас газа, чтобы выжить. Кислород в легких улавливается атомом железа в центре гемоглобина в крови и, таким образом, транспортируется туда, где это необходимо.
Каждому человеку нужен кислород для дыхания, но, как и во многих случаях, слишком много кислорода не есть хорошо. Если человек подвергается воздействию большого количества кислорода в течение длительного времени, может произойти повреждение легких. Вдыхание 50–100% кислорода при нормальном давлении в течение длительного периода времени вызывает повреждение легких.Те люди, которые работают с частым или потенциально высоким воздействием чистого кислорода, должны пройти функциональные тесты легких перед началом работы и после нее. Кислород обычно хранится при очень низких температурах, поэтому следует носить специальную одежду, чтобы предотвратить замерзание тканей тела.
Высококонцентрированные источники кислорода способствуют быстрому сгоранию и, следовательно, представляют опасность пожара и взрыва в присутствии топлива.
