Содержание
Конспект урока по химии на тему «Валентность химических элементов. Определение валентности элементов по формулам их соединений.» (8 класс)
Класс 8 А, В, Г Дата 07.11.20г.
Тема урока: Валентность химических элементов. Определение валентности элементов по формулам их соединений.
Цели урока: сформировать представления о валентности как свойстве атомов одного элемента присоединять, или замещать определённое число атомов другого элемента.
Задачи:
Образовательные: сформировать представление о валентности, как о свойстве атома. Развивающие: продолжать выработку умений самостоятельно приобретать, применять знания, переносить их в новые условия.
Воспитательные: формировать умение ставить цель, выделять существенное, главное, подводить итоги, работать в оптимальном темпе, беречь время.
Здоровьесберегающие: профилактика переутомления учащихся без потери объема учебной информации.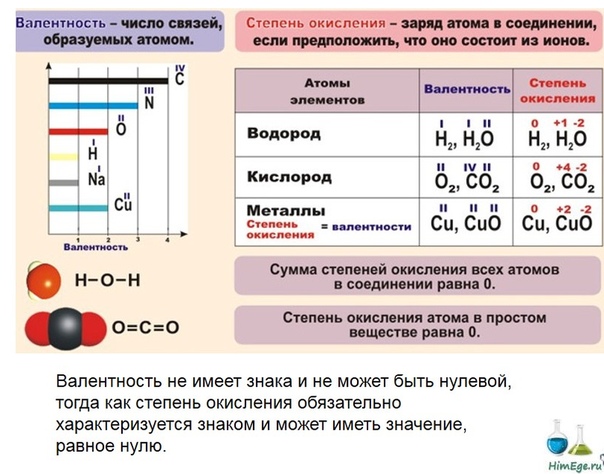
Планируемые результаты обучения
Предметные: умение определять валентность элементов по формулам бинарных соединений.
Метапредметные:
регулятивные: самостоятельно определять цель учебной деятельности, искать пути решения проблемы и средства достижения цели; организовывать свою учебную деятельность;
коммуникативные: слушать товарища и обосновывать свое мнение; выражать свои мысли.
познавательные: работать с учебником; формировать умения устанавливать аналогии, использовать алгоритмы для решения учебных и познавательных задач.
Личностные. Формировать мотивацию к целенаправленной познавательной деятельности. Осознавать потребность и готовность к самообразованию.
Оборудование: учебник Г.Е. Рудзитис, Ф.Г. Фельдман. Химия 8. Москва «Просвещение» 2014; презентация.
ХОД УРОКА
Организационный этап
Мотивация учебной деятельности учащихся
Ещё 200 лет назад учёные установили, что атомы соединяются в молекулы посредством особых связей, которые называют химическими. Тогда атомы представляли в виде шариков, на поверхности которых имеются «крючки», с помощью которых атомы соединяются друг с другом, как звенья одной цепи. Только спустя много лет была установлена истинная причина природы химической связи.
Тогда атомы представляли в виде шариков, на поверхности которых имеются «крючки», с помощью которых атомы соединяются друг с другом, как звенья одной цепи. Только спустя много лет была установлена истинная причина природы химической связи.
Демонстрация графических формул HCl, H2O, NH3, CH4
Обсуждение качественного и количественного состава этих веществ.
В молекуле HCl атом хлора удерживает один атом водорода, в молекуле H2O атом кислорода удерживает два атома водорода, в молекуле NH3 атом азота удерживает три атома водорода, в молекуле CH4 атом углерода удерживает четыре атома водорода.
Проблемный вопрос. Почему атомы разных элементов удерживают неодинаковое число атомов водорода?
У атомов разная способность удерживать определённое количество других атомов в соединениях. Это свойство называется валентностью. Запишите тему урока: Валентность химических элементов. Определение валентности элементов по формулам их соединений.
Определение валентности элементов по формулам их соединений.
Актуализация знаний
Фронтальная беседа.
— Какие по составу вещества вам известны? (Простые и сложные).
— Чем различаются простые и сложные вещества? (Количеством входящих в них элементов).
-Что такое химическая формула? (Химическая формула – это запись, выражающая качественный и количественный состав данного вещества).
— Что называют индексом? (Индекс обозначает число атомов элемента, входящих в состав данного вещества).
-Какую информацию можно получить о веществе по его химической формуле? (Качественный состав – это какие элементы входят в состав данного вещества, а количественный – в каком соотношении).
— Что необходимо для того, чтобы вывести химическую формулу вещества? (Необходимо знать массовые доли химических элементов).
Индивидуальное задание. (Выполняется на местах).
Выведите простейшую формулу соединения, в котором массовая доля натрия равна 32,4%, серы – 22,5%, кислорода – 45,1%
Решение.
Из условия задачи следует, что в 100 единицах массы вещества 32,4 единицы натрия, 22,5 единицы серы и 45,1 единицы кислорода. Находим число атомов каждого элемента в 100 единицах вещества:
32,4 : 23 = 1,4 атома натрия
22,5 : 32 = 0,7 атома серы
45,1 : 16 = 2,8 атома кислорода
Следовательно, можно определить соотношение чисел атомов в формуле вещества:
x: y: z = 1,4: 0,7 : 2,8 = 2: 1: 4
Эти числа принимаются в качестве индексов в формуле вещества – Na2SO4. (Учащийся читает формулу, называет качественный и количественный состав вещества).
Числовые индексы в химических формулах указывают на то, что атомы соединяются друг с другом не произвольно, а в определенных соотношениях.
Первичное усвоение новых знаний
1. Работа с текстом учебника (стр. 55-56)
55-56)
Что такое валентность химических элементов?
Валентность – это способность атомов удерживать при себе определенное число атомов других элементов.
Почему валентность водорода принята за единицу?
HCl – атом хлора удерживает один атом водорода, значит, хлор одновалентен.
H2O – атом кислорода удерживает два атома водорода, значит, кислород двухвалентен.
NH3 – атом азота удерживает три атома водорода, следовательно, азот трехвалентен.
CH4 – атом углерода удерживает четыре атома водорода, следовательно, углерод четырехвалентен.
Валентность обозначается римской цифрой, которая ставится над знаком химического элемента в формуле вещества.
Чему равна валентность кислорода?
Валентность кислорода во всех соединениях равна II
Всегда ли элементы проявляют одну и ту же валентность?
Назовите элементы, которые всегда двухвалентны.
Какие валентности может проявлять железо?
2. Анализ алгоритма определения валентности элементов по формуле бинарного соединения.
Анализ алгоритма определения валентности элементов по формуле бинарного соединения.
Правила определения валентности элементов в соединениях (алгоритм определения валентности по формуле бинарного соединения (§ 16 с.57- 58)):
1. Записать химическую формулу вещества и указать валентность известного элемента.
Например, углекислый газ имеет формулу – СО2, валентность кислорода постоянна и равна двум, записываем над символом кислорода II.
II
СО2
2. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента.
Для этого умножаем валентность известного элемента на индекс при этом элементе:
2 × II = 4 – это и есть НОК
II
С О2
3. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. Индекс при атоме углерода равен 1, значит:
Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. Индекс при атоме углерода равен 1, значит:
4 : 1 = IV – это и есть валентность атома углерода.
IV II
СО2
Разберем еще один пример:
II
Fe2O3
1. Валентность кислорода постоянна и равна II.
2. НОК: 3 × II = 6
3. 6 : 2 = III – это и есть валентность атома железа.
III II
Fe2O3
3. Работа у доски по цепочке.
Определите валентность атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO, Na2S, KBr, Al2O3,
Mg3N2, MgO.
Первичная проверка понимания и закрепление.

Определите валентность элементов в соединениях с кислородом:
Определите валентность элементов в соединениях с водородом:
Определите валентность элементов в следующих соединениях:
1. Выполните задание на выбор:
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: Na2O FeO P2O5 .
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом.
2. Самопроверка по эталону (запись на доске). Коррекция знаний и умений
Коррекция знаний и умений
Информация о домашнем задании, инструктаж по его выполнению: изучить § 16, выучить определение; выполнить на выбор: тестовые задания, упр. 5 стр. 58;
Рефлексия (подведение итогов занятия)
Учащимся необходимо выбрать 3 слова из 12, которые наиболее точно передают его состояние на уроке:
Раздражение
Злость
Радость
Равнодушие.
Удовлетворение
Вдохновение
Скука.
Тревога.
Покой.
Уверенность
Неуверенность.
Наслаждение.
Урок №14-15. Валентность химических элементов. Определение валентности элементов по формулам бинарных соединений. Составление химических формул бинарных соединений по валентности
Валентность – это способность
атомов присоединять к себе определенное число других атомов.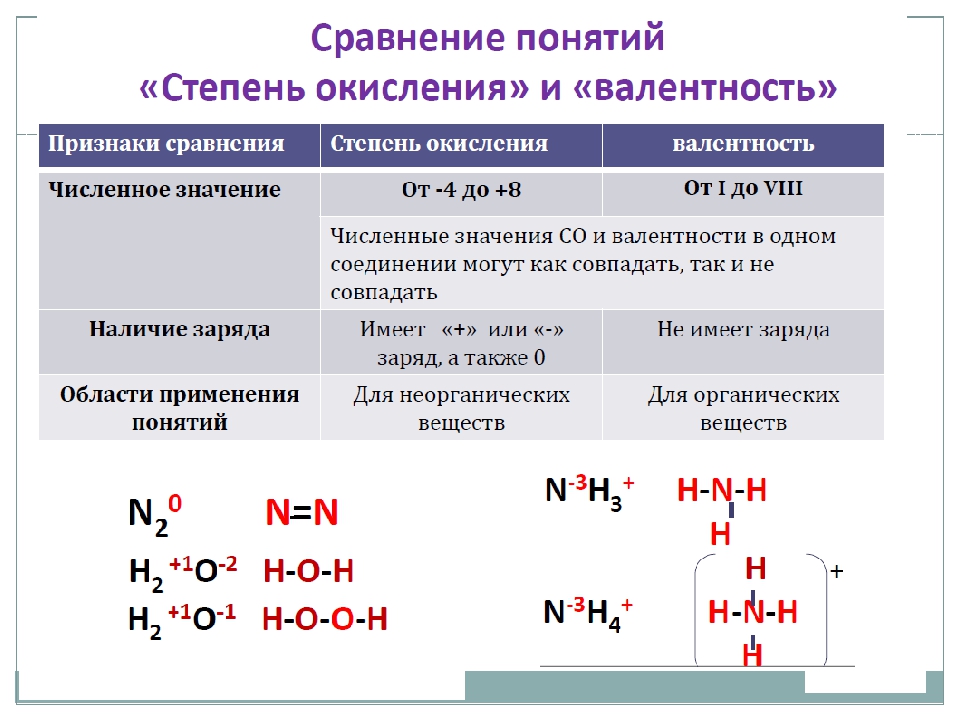
Валентность
– определяется номером группы (число химических связей
в структурной формуле вещества).
Валентность элементов необходимо знать, чтобы составлять
химические формулы соединений (валентность обозначается римскими цифрами
I, II, III – VIII).
Структурная формула вещества отображает порядок | |
Na – одновалентен (одна связь) H – одновалентен (одна связь) O – двухвалентен (две связи у S – шестивалентна (образует шесть | |
Правила
определения валентности элементов в соединениях
1. Валентность водорода принимают
за I (единицу).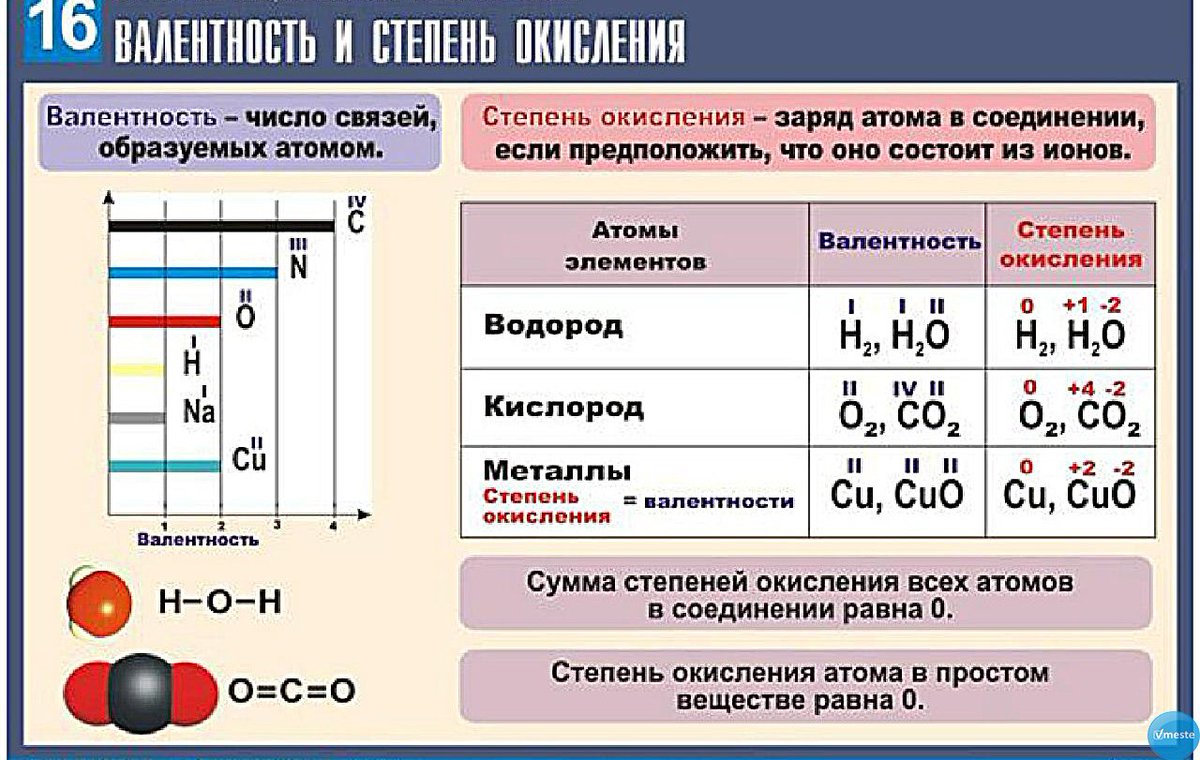
2. Кислород в своих соединениях проявляет
валентность II.
3. Высшая
валентность равна номеру группы Nгруппы (исключения, N, O, F — для этих элементов характерна только низшая валентность).
4. Низшая валентность равна
разности между числом 8 (количество групп в таблице) и номером группы, в
которой находится данный элемент, т.е. 8 — Nгруппы
Определение
валентности металлов
(характерны
валентности – постоянная и переменная)
Металлы главных (А) подгрупп I(А), II(А), III(А) | Характерна В = Nгруппы | Металл в формуле всегда занимает первую |
Металлы побочных (Б) подгрупп I(Б)-VIII(Б) | Характерна В – Например, оксид марганца (VII), |
Определение валентности неметаллов
(характерны валентности – высшая, низшая,
переменная)
Характерны В = N группы | Неметалл ставится в этом случае на первое |
Характерна 8 — N группы | Неметалл ставится в этом случае на второе |
Характерна В – Например, оксид серы (IV), | Неметалл ставится в этом случае на первое |
Запомните! Низшую
валентность проявляет тот элемент — неметалл, который находится в
таблице Менделеева правее и выше, а высшую валентность – элемент, расположенный
левее и ниже.
Если данное правило не работает. То
следует воспользоваться информацией о бинарных
формулах веществ (оксидах, хлоридах, сульфидах и др.).
Бинарная химическая | ||
ОКСИДЫ | СУЛЬФИДЫ | ХЛОРИДЫ |
Оксид – это сложное вещество, Na2О | Сульфид – это сложное K2S | Хлорид – это сложное FeCl3 |
Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента |
* Другие
бинарные соединения: ЭxFy — фторид; ЭxBry —бромид; ЭxIy
–йодид; ЭxNy –нитрид; ЭxPy
–фосфид; ЭxHy –гидрид (у элемента на второй позиции низшая валентность).
Алгоритм составления формулы соединения оксида
фосфора
Последовательность | Составление |
1. Написать символы элементов | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
4. Найти соотношения между атомами элементов путем деления | 10 : 5 = 2 10 : 2 = 5 P |
5. | Р2 О5 |
6. Формула соединения (оксида) | Р2О5 |
Для
составления формулы вещества можно воспользоваться следующим алгоритмом:
В=Nгруппы | В=8-Nгруппы |
Ах | Ву |
Запомните! Если элемент А – металл побочной
подгруппы или неметалл с переменной валентностью, валентность А определяем не
по таблице Менделеева, а согласно названию вещества. Например, оксид серы (IV), сульфид фосфора (III).
Например, оксид серы (IV), сульфид фосфора (III).
Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Содержание:
Определение валентности элементов по формулам их соединений. Составление химических формул по валентности Определение валентности элементов по формулам их соединений
- Определение валентности элемента по формуле соединения. Составление химических формул по валентности определение валентности элементов по химическим формулам соединений. Знать формулу вещества, состоящего из 2 элементов, и 1 скобка римской цифры указывает на валентность этого элемента. Вы можете определить их 1 валентность, валентность другогоэлемента.
- Например, если формула дана о оксиде меди CuO, то валентность меди можно определить следующим образом: валентность кислорода равна 2,1 атома, имеет 1 атом меди, поэтому валентность меди также равна 2.
 Определить валентность с помощью химической формулы, содержащей не 1.
Определить валентность с помощью химической формулы, содержащей не 1.
Несколько атомов 2 различных химических элементов, довольно сложно.
Людмила Фирмаль
Например, чтобы определить валентность железа оксида железа fe203, мы утверждаем: валентность кислорода равна 2.Но так как эта молекула содержит 3 атома кислорода, то общее число валентностей всех 3 атомов кислорода равно 6(2 * 3).Эти 6 валентностей попадают под 2 железа atoms. As в результате на каждый атом железа приходится 3 единицы валентности (6: 2).
- Приведенный выше пример позволяет вывести простое правило. Число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента. Эти соображения позволяют использовать следующие схемы при определении валентности элемента с помощью формул: 1.Напишите химическую формулу вещества и обратите внимание на валентность известных элементов. н я н н н н н ЦУО Н2Ѕ Fe203 С03 2.

Найдите и запишите общее количество валентностей этого элемента. 0 W E) И ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ ЦУО Н2Ѕ Fe203 С03 3. Валентность 2-го элемента вычисляется и помещается над химическим символом. Для этого сумма валентностей делится на индекс 2-го элемента. Это II и II и II и Врил III и II с CuO H9S SOo Fe » A л20 OV73 я t2W3
При определении валентности элемента по формуле необходимо обратить внимание на следующие моменты:
Людмила Фирмаль
2) Значение валентности не превышает 8. 3) Некоторые химические элементы имеют переменную валентность. Получение химических формул путем Valence. To составляя химическую формулу, нужно знать валентность элементов, образующих это соединение. Валентности наиболее важных элементов приведены в таблице 3. Таблица 3.Валентность атомов некоторых элементов в соединении
Примеры формул валентных элементных оксигенатов Е / 1 II и III Эл и Н II к II и III II и IV, III и V II, в III и VI ч. , IV и VI элементы, постоянное бесплодное н. н, К. ли о,, мг, Са ва, ЗН Л1, переменной валентности КР ФК, со, Ni СН, ПБ п з пр добыча Н20, Na20 ГГО, САО, AI2O3 tnost размере 20,ЦУО Фео, Fe2Os СНО, Sn02 РН3,Р2О5 Кро, Cr203h3s, Сг203, ЅО2, ѕо3 При создании химической формулы используйте следующую схему: 1.
, IV и VI элементы, постоянное бесплодное н. н, К. ли о,, мг, Са ва, ЗН Л1, переменной валентности КР ФК, со, Ni СН, ПБ п з пр добыча Н20, Na20 ГГО, САО, AI2O3 tnost размере 20,ЦУО Фео, Fe2Os СНО, Sn02 РН3,Р2О5 Кро, Cr203h3s, Сг203, ЅО2, ѕо3 При создании химической формулы используйте следующую схему: 1.
Затем напишите химические символы элементов, которые составляют соединение. Ко A1CI Аю 2.Над знаками химического элемента добавляется его валентность. |Привет, привет КО AIC1 АЙ 3.Определите минимальное кратное число, представляющее валентность обоих элементов. W•0 Я в в п 。Ко Айти Аю 4.Найдите индекс, разделив наименьшее кратное на валентность соответствующего элемента(не записывайте индекс » 1): [В случае ГД I II III III III II K20 AlCIg Al203
При создании химической формулы для элемента с переменной валентностью, рядом с названием вещества, напишите в скобках цифру, указывающую валентность этого элемента в данном соединении. Например, оксид меди (II) — это CuO, оксид. * Ди(я) — размере 20, хлорида железа (II) — Компьютерная FeCl2,хлорида железа (III) — fecl3 обеспечивает. Упражнение 5-8 (стр. 29).Решите задачу I и 2(стр. 29).
* Ди(я) — размере 20, хлорида железа (II) — Компьютерная FeCl2,хлорида железа (III) — fecl3 обеспечивает. Упражнение 5-8 (стр. 29).Решите задачу I и 2(стр. 29).
Смотрите также:
Решение задач по химии
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
§ 1.6. Валентность элементов. Структурные формулы веществ.
В предыдущей главе, вы уже могли заметить, что атомы, группируясь друг с другом, не обязательно образуют двухатомные молекулы, т.е. соединяются в соотношении один к одному. В молекуле воды, например, к одному атома кислорода прикрепляется два атома водорода. Количество связей, которые атом химического элемента образует с другими атомами, называется его валентностью.
Обозначается валентность римскими цифрами — I,II, III и т.д. в соответствии со своим значением. Давайте в качестве примера рассмотрим такие соединения как хлороводород HCl, воду Н2О, аммиак NH3 и метан CH4. Смотри рисунок 7.
Смотри рисунок 7.
Рисунок 7. Трехмерные модели молекул HCl (a), H2O (б), NH3 (в) и CH4 (г)
Если схематично изобразить строение этих молекул, обозначая атомы химических элементов соответствующими им символами, а связь между ними отрезком,
получаются формулы следующего вида, называемые структурными:
Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Из представленных на рисунке ХХ структурных формул можно сделать вывод о том, что валентность водорода и хлора равна I, кислорода II, азота — III, углерода -IV.
Валентность химических элементов в соединениях принято указывать надстрочным индексом справа от символа химического элемента, либо над ним, как, например, это сделано ниже:
Для некоторых элементов характерна постоянная валентность, то есть в соединениях их валентность равна всегда одному и тому же числу.
Так, например, постоянная валентность, равная единице, наблюдается для ряда металлов, называемых щелочными — лития, натрия, калия, рубидия и цезия, Постоянная валентность, равная двум, наблюдается у кислорода, магния, кальция, стронция, бария, цинка. Постоянная валентность равная трем наблюдается у алюминия Al.
Постоянная валентность равная трем наблюдается у алюминия Al.
Элементы с переменной валентностью — это элементы, которые в разных соединениях могут иметь различные значения валентности. Следовательно, атомы этих элементов в разных соединениях могут образовывать различное число химических связей (таблица 2).
Таблица 2. Наиболее характерные значения валентности некоторых элементов
Химические элементы | Их основные валентности |
Cl, Br, I | I, III, V, VII |
S, Se | II, IV, VI |
C, Si, Sn, Pb | II, IV |
P | III, V |
Cu | I, II |
Fe | II, III |
Cr | II, III, VI |
Часто в определении валентности таких элементов в каждом отдельном случае может помочь так называемое правило валентности, согласно которому, в соединениях, образованных только двумя химическими элементами практически всегда произведение валентности одного химического элемента на количество его атомов в молекуле равно произведению валентности на количество атомов в молекуле второго элемента. Другими словами для вещества формулу которого в общем виде можно записать как AxBy с валентностями элементов А и В равными n и m соответсвенно, справедливо выражение:
Другими словами для вещества формулу которого в общем виде можно записать как AxBy с валентностями элементов А и В равными n и m соответсвенно, справедливо выражение:
X*n = y*m
Давайте в качестве примера установим валентность серы в соединениях SO2 (диоксид серы) и Al2S3 (сульфид алюминия). Как уже было сказано выше, кислород и алюминий являются элементами с постоянными валентностями. Для кислорода валентность во всех его соединениях равна двум, а алюминия трем.
Рассчитаем валентность серы в диоксиде серы обозначив ее как «х»:
Аналогично рассчитаем валентность серы в сульфиде алюминия:
Следует отметить, что правило валентности не применимо для некоторых соединений, в которых есть связи между атомами одного химического элемента. В частности, нельзя использовать правило валентности в случе такого соединения как перекись водорода поскольку его структурную формулу можно записать как Н-О-О-Н, то есть в каждой молекуле данного соединения есть связь кислород-кислород.
Очевидно, что правило валентности может быть использовано не только для нахождения валентности какого-либо элемента, но также и для составления формулы соединения, если известны валентности образующих его элементов.
Рассмотрим в качестве примера следующую задачу:
«Определите формулу соединения образованного атомами хлора и кислорода, если валентность хлора в данном соединении VII »
Решение:
Кислород имеет только одно значение валентности, равное двум, соответственно можем записать:
Наименьшее общее кратное (НОК) чисел 7 и 2 равно 14.
Индекс, относящийся к хлору, будет равен х = 14:7 = 2,
Индекс, относящийся к кислороду, будет равен y = 14:2 = 7.
Т.е. искомая формула Cl2O7.
Следует отметить тот факт, что в большинстве сложных веществ атомы одного химического друг с другом не связаны, например:
Рисунок 9. Структурные формулы молекул фосфорной кислоты, фосфина, серной кислоты и оксида хлора (VII)
Валентность химических элементов.
 Определение валентности элементов по формулам их соединений. | Презентация к уроку по химии (8 класс):
Определение валентности элементов по формулам их соединений. | Презентация к уроку по химии (8 класс):
Презентация к уроку химии 8 класс Тема: Валентность. Определение валентности по формулам. Составила: Донгак О.О. учитель химии
Слайд 2
Задание: Что здесь написано? NaCl, K 2 O, CuO, SO 2 . CH 4 SnF 2
Слайд 3
. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2. Справочные данные: Аr (Cu) = 64 Аr (O) = 16 Аr (S) =3 2
Слайд 4
Что общего в составе молекул? Чем они отличаются друг от друга? Задание: сравните качественный и количественный состав в молекулах: HCl , h3O, Nh4, Ch5.
Слайд 5
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это называется валентностью. Слово “валентность” происходит от лат. valentia – сила.
Слайд 6
Тема: Валентность Валентность – это способность химического элемента образовывать определенное количество химических связей с другими элементами. Нахождение валентности по периодической системе, для элементов главных подгрупп. – Для металлов валентность совпадает с номером группы. — Для неметаллов определяют две валентности: высшую – валентность совпадает с номером группы. низшую – находят действием, из 8 отнимают высшую валентность.
Нахождение валентности по периодической системе, для элементов главных подгрупп. – Для металлов валентность совпадает с номером группы. — Для неметаллов определяют две валентности: высшую – валентность совпадает с номером группы. низшую – находят действием, из 8 отнимают высшую валентность.
Слайд 7
Валентность обозначается римскими цифрами I I I II I III I IV HCl h3O h4 N h5C Пример : Na — I S – высшая VI, низшая (8 – 6 = 2) II
Слайд 8
Тема: Валентность. 13 Август, 2014 Определить валентность химических элементов. Валентность Элемент Al Al III Cl С l VII, I Ba Si K Ca I Pb N Br C
Слайд 9
20.10.20 справочник по химии Составление химических формул по валентности научимся составлять химические формулы
Слайд 10
1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Пример: Составить химическую формулу оксида бора. B O Оксиды — это сложные вещества, которые состоят из двух элементов один из которых кислород. Первый пункт выполнили переходим ко второму
Слайд 11
2 . Над знаками химических элементов поставь их валентность. Пример: Составить химическую формулу оксида бора. B O III II Второй пункт выполнили переходим к третьему
Над знаками химических элементов поставь их валентность. Пример: Составить химическую формулу оксида бора. B O III II Второй пункт выполнили переходим к третьему
Слайд 12
7 42 35 28 21 14 7 VII 42 6 30 12 6 6 6 VI 35 30 5 20 15 10 5 V 28 24 20 4 12 4 4 IV 21 6 15 12 3 6 3 III 14 6 10 4 6 2 2 II 7 6 5 4 3 2 1 I VII VI V IV III II I Таблица для определения Н.О.К. 3. Определи Н.О.К. чисел выражающих валентность этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример: Составить химическую формулу оксида бора. B O III II 6 Третий пункт выполнили переходим ко четвертому Н.О.К. (наименьшее общее кратное) – это число, которое делится на исходные числа без остатка.
Слайд 13
4. Раздели Н.О.К. на валентность каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу оксида бора. B O III II 2 3 6 2 3 Формула составлена 6 6 III II : : = =
Слайд 14
Тема: Валентность. I. Валентность – это способность химического элемента образовывать определенное количество химических связей. Нахождение валентности по периодической системе, для элементов главных подгрупп. — Для металлов валентность совпадает с номером группы. Для неметаллов определяют две валентности: высшую – валентность совпадает с номером группы. низшую – находят действием, из 8 отнимают высшую валентность. Пример: Na — I S – высшая VI, низшая (8 – 6 = 2) II
Слайд 15
Задание 1.Определите валентность атомов химических элементов по формулам соединений: Nh4, Au2O3, Sih5, CuO. Оценка «3» 2.Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, Саh3. Оценка «4» 3. Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом. Оценка «5»
Слайд 16
Домашнее задание: §11, 12 в.1-3 с.37
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
таблица или схема постоянной валентности в соединениях и как ее определить по формулам в 8 классе
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | Beh3 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, Ch5 |
| 7 | Азот / Nitrogen | N | III, IV | Nh4 |
| 8 | Кислород / Oxygen | O | II | h3O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | Ph4, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | h3S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | Cah3 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, Tih5 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, h4AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | h3SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, Sbh4 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | Teh3, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | Lah4 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, Pbh5 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Источник: https://infotables.ru/khimiya/1071-valentnost-khimicheskikh-elementov
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония Nh5+, азотная кислота и д.р).
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektrootricatelnost-stepen-okislenija-valentnost
Как можно рассчитать валентность каждого элемента?
Валентность
Валентность — это количество электронов, которые атом приобретает, теряет или даже разделяет во время химической реакции. Валентность — это количество электронов, которые атом должен получить или потерять для достижения электронной конфигурации благородного газа.
В химической реакции атомы пытаются достичь стабильного состояния, теряя свои внешние электроны (как в случае с металлами) или разделяя некоторое количество электронов с другими атомами (как в случае неметаллов).
Валентность элементов или ионов для записи химической формулы соединения. Хлор имеет валентность 1, так как ему нужно получить 1 электрон для достижения электронной конфигурации благородного газа.
Атомы пытаются достичь стабильного состояния, набирая количество электронов, чтобы заполнить внешнюю оболочку (8) электронами (как в случае неметаллов).
Вычислить валентность
Внешние электроны атома определяют его валентность, валентность элемента измеряет его способность объединяться с другими элементами. Валентность определяется количеством электронов во внешней оболочке атома. каждый атом элемента.
Валентность некоторых элементов в современной таблице Менделеева
Элементы в группе (1 A) в современной периодической таблице имеют один валентный электрон на своей внешней оболочке, они очень активны, они являются одновалентными элементами, поскольку имеют только один электрон на своих внешних энергетических уровнях.
Валентность элементов в периодической таблице
Валентность щелочноземельных металлов в группе (2 A) двухвалентная, это двухвалентные элементы, поскольку они имеют два электрона на их внешних энергетических уровнях.
Элементы группы (7 A) являются одновалентными элементами, так как их внешние энергетические уровни содержат (7) электроны. Элементы в группе (18) в современной периодической таблице представляют собой благородные газы с нулевой валентностью. поскольку валентная оболочка насыщена 8 электронами.
Чтобы определить валентность ионной молекулы тетраоксида фосфора (PO4, четыре атома кислорода и один атом фосфора), вы должны умножить общую валентность четырех атомов кислорода (валентность 2) и вычесть ее из валентности фосфора. атом (валентность 5), что показывает валентность (PO4) 3.
Валентность элемента всегда является целым числом, и некоторые элементы проявляют более одной валентности, у них более одной валентности, например, сера (S) двухвалентная, четырехвалентная и шестивалентная.
Азот (N) трехвалентный и пятивалентный, а фосфор (P) трехвалентный и пятивалентный. Валентность меди I одновалентная, а валентность меди II двухвалентная.
Валентность сульфата железа [II] или сульфата двухвалентного железа является двухвалентной, как в FeSO 4 , валентность железа равна двум, а валентность сульфата железа [III] или сульфата железа является трехвалентной, как в Fe 2 (SO 4 ) 3 , валентность железа равна трем.
Что такое валентность? Валентности некоторых металлических, неметаллических элементов и групп атомов
Современная таблица Менделеева и классификация элементов
Квантовые числа и принципы распределения электронов
Металлические и неметаллические свойства, Кислотные и основные свойства в периодической таблице Менделеева
Теории, объясняющие ковалентную связь, правило октета и концепцию перекрывающихся орбиталей
Валентность элементов, @ = КАК НАЙТИ ВАЛЕНТНОСТЬ? = @
Валентность элементов — это свойство, которое проявляется, когда один атом элемента объединяется с атомами других элементов.
В целом валентность валентности равна
количество электронов, которые каждый атом приобретает и теряет при объединении,
то есть количество электронов, которые приобретают и теряют, когда элемент достигает
стабильная структура, которая часто определяется электронным расположением
элемент, в основном крайние электроны.
Теория валентной связи
Химическая связь и молекулярная структура
Конечно, компоновка может также включать метастабильные структуры, состоящие из подслоев, которые могут быть достигнуты внешним подслоем.
Это компенсируется количеством электронов.
или общие электронные пары атомов в материале.
Валентность элементов означает количество атомов, получающих и теряющих электроны, когда атомы соединяются друг с другом.
Валентность также является
свойство, которое элементы проявляют при образовании соединений.
Когда элементы комбинируются друг с другом, соотношение количества реагирующих атомов не фиксируется, а определяется в соответствии с количеством электронов во внешнем слое атома.Например, ион натрия (с валентностью +1 и потерянным электроном) должен быть объединен с ионом хлорида (с валентностью -1 и получается электрон).
Ион магния (с валентностью +2 и двумя потерянными электронами) должен быть связан с двумя ионами хлорида. Если валентно-алгебраическая сумма ионов образованного соединения не равна нулю, самый внешний электронный слой аниона и катиона, составляющих ионное соединение, и атом молекулы ковалентного соединения не может быть преобразован в стабильную структуру.Таким образом не могут быть образованы стабильные соединения.
Понятие валентности исходит из этого, тогда количество элементов вне ядерных электронов, объединенных друг с другом, определяет валентность этого элемента. Валентность установлена для облегчения выражения количества атомов, которые объединены друг с другом. Изучая валентность, вы должны понимать правила валентности элементов в соединениях.
Заданная элементарная молекула, валентность которой равна ноль ,
независимо от ионных соединений или
ковалентные соединения, алгебра n-валентных анионов и ее состав
нуль.Ионные соединения, Пример: NaOH (натрий n-1 — валентность
двухвалентный, гидроксид-ион валентность является отрицательной одновалентной, взаимно компенсируется на a
нулевое соединение , такое как формулировка на
учреждение)
Валентность — способность атомов к
образуют химические связи. Это
химическое свойство, которое образует друг друга элементы в стабильной
сложный. (То есть способность достичь способности каждого элемента к
образуют устойчивую конструкцию)
Примечание: «Валентность» элемента — важное свойство элемента, которое проявляется только в сочетании с другими элементами.То есть, когда элемент существует в свободном состоянии, то есть когда он не объединен с другими элементами для образования соединения, валентность элементарного элемента равна «0». Например, , металлы, такие как железо, неметаллы, такие как углерод, и инертные газы, такие как гелий.
Валентность элементов
+1
H, Li, Na, K, Rb, Cs, Ag, Au, Hg, In, Tl, N
+2
Be, Mg, Ca, Sr, Ba, Cu, Ra, Zn, Cd, Hg, Cr, Mn, Fe,
Co, Ni, C, Sn, Pb, N, S, O
+3
B, Al, Ga, In, Tl, Sc, Y, La-Lu, N, P, As, Sb, Bi,
Cr, Fe, Co, Ni, Au; Ce, Ac
+4
C, Si, Ge, Sn, Pb, Ti, Zr, Hf, Ce, Th, Mn, Tb, N, S
+5
N, P, As, Sb, Bi, V, Nb, Ta
+6
S, Se, Te, Cr, Mo, W, U, Mn, Fe
+7
Cl, Br, I, Mn, Tc, Re
+8
Xe, Ru, Os
-1
F, Cl, Br, I, O
-2
O, S, Se, Te
-3
Н, П, Ас, Сб
(Примечание: валентность атомов в элементе равна
0)
Особая атомная группа
Нитратный корень NO 3 — : одновалентный -1
Сульфит SO 3 2-: -2
Бисульфит HSO 3 — : одновалентный -1
Сульфат SO 4 2-: -2
Карбонат CO 3 2-: -2
Перхлорат ClO 3 — :
одновалентный -1
Гидроксид OH — : одновалентный -1
Аммоний NH 4 + : +1
Валентность
Фосфат PO 4 3- : -3
Бикарбонат HC03 3 — :
одновалентный -1
Манганат MnO 4 2-: -2
Пермангановая кислота корня
MnO 4 — : одновалентный -1
Корневой супероксид O 2 — :
одновалентный -1
Пероксид кислорода 2 2-: -2
Ацетат CH 3 COO-: -1
Дигидрофосфат H 2 PO 4 — : — 1 валентность
(Примечание: формула тот же, но не обязательно тот же корень, поскольку перманганат марганца был +6, перманганат марганца как двухвалентный +7)
Фтор, хлор, бром и йод: -1 (кислоты плавиковой кислоты, соляной кислоты, бромистоводородной кислоты и йодистоводородной кислоты)
Неметаллическая Валентность элементов
Поскольку количество электронов во внешнем слое металлического элемента в основном меньше 4, очень легко потерять самый внешний электрон в химической реакции и показать положительную валентность, то есть валентность металлического элемента обычно положительна. (очень немногие металлы могут иметь отрицательную валентность (например, сурьма, -3 валентность в InSb).Когда неметаллический элемент сочетается с металлическим элементом, обычно получается электрон с отрицательной валентностью.
Однако при объединении нескольких неметаллических элементов элементы с более низкой электроотрицательностью будут иметь положительную валентность. Например, , кислород является вторым по величине элементом электроотрицательности и обычно имеет валентность -2. Но когда он встречает наиболее электроотрицательный фтор, он показывает валентность +2, образуя OF2 и дифторид кислорода.
Закон о расчетах
После указания формулы, если вы знаете валентность
элемента, вы можете умножить валентность на количество атомов в
молекула. Поскольку электрическое свойство валентности равно нулю, произведение
валентности предыдущей валентности и количество атомов элемента делится на количество атомов другого элемента в
молекула, чтобы получить валентность другого элемента.
Учитывая валентность двух элементов, найдите наименьшее общее кратное абсолютного значения валентности.Затем разделите наименьшее общее кратное на абсолютное значение валентности, чтобы найти количество атомов в молекуле.
Представительство
валентности: положительные и отрицательные валентности должны быть отмечены прямо над
символ элемента с +1,
+2, +3, -1, -2… 0 и т. Д. (Например, Na +1 )
Определите валентность элементов в
соединение
(1) Есть положительная и отрицательная валентности
(2) Кислородный элемент обычно имеет валентность -2.
(3) Водородный элемент обычно имеет валентность +1.
(4) Когда металлический элемент сочетается с неметаллическим элементом, металлический элемент показывает положительную цену, а неметаллический элемент показывает отрицательную цену (как правило, положительная цена указывается спереди, а отрицательная. цена написана сзади).
(5) Некоторые элементы могут иметь существенно разные валентности в одном и том же веществе.
(6) Алгебраическая сумма положительной и отрицательной валентностей в соединении равна 0.
(7) Валентность элемента — это свойство, которое атом элемента проявляет при образовании соединения. Следовательно, в элементарных молекулах валентность элемента равна 0,
.
Как найти валентность элементов
Валентность — это свойство элемента,
проявляется только тогда, когда элементы сливаются друг с другом. Алгебраический
сумма положительных и отрицательных валентностей в соединении равна нулю, что составляет
критерий валентности. Вообще говоря, есть следующие
методы:
Химическая формула или радикальная формула
1.Формула валентности элементов A в соединении AmBn:
(Валентность элемента B × количество атомов
B) / число атомов A
2. Найдите формулу валентности неизвестного.
валентный элемент в многокомпонентном соединении:
(Алгебраическая сумма валентностей элементов известных
валентность) / Число атомов элементов неизвестной валентности
3.Определите валентность элементов (или атомной группы) на основе количества положительных и отрицательных зарядов.
В радикальной формуле алгебраическая сумма
общая валентность положительной и отрицательной валентностей равна количеству
положительные и отрицательные заряды, переносимые радикальной формулой.
Exercise1: Химическая формула (молекулярная формула) соли — Rm (SO4) n. Какова валентность R?
Соотношение масс элемента
1. (Относительная атомная масса элемента A × валентность элемента B) / (относительная атомная масса элемента B × Валентность элементов) = отношение масс элемента A / отношение масс элемента B
2.Массовое соотношение (или процентный состав)
элемента A × валентность A / относительная атомная масса A = отношение масс
(или процентный состав) элемента B × валентность B / относительная атомная
масса B
Exercise2: В массе 7: 4
соотношение азота и кислорода, какова валентность азота?
Массовая доля
(валентность B × отношение атомных масс A) / (валентность A ×
относительное атомное отношение масс B) = массовое отношение элемента A / массовое отношение
элемент B
Exercise3: Отношение относительной атомной массы элементов A и B составляет 2: 1. В соединении, состоящем только из этих двух элементов, соотношение масс элементов A и B составляет 2: 3, где B отрицательно. валентно, то в этом соединении находится А. Какова валентность элементов?
Найдите валентность
1.Если B равно -2 и C равно -1, когда A нечетное, то
А есть:
(количество типа 2AC — количество типа AB) / (тип C
количество x цена B-тип количество B x цена A)
2. Если B равно -2 и C равно -1, когда A четное,
тогда A:
2 (количество типа AC-количество типа AB) / (тип C
количество x цена B-тип количество B x цена A)
3. Если валентности B и C равны
то же самое, валентность A равна: (количество в формуле AC — количество в формуле AB) / (C
количество по формуле-B количество по формуле)
Метод определения
В химическом отношении валентность используется для обозначения
количество межатомных соединений.Это важное свойство элементов.
Определение валентности элемента — это базовый навык, который получают в средней школе.
студенты должны освоить. Теперь это обобщено в рамках неполной средней школы.
чтобы помочь студентам учиться.
Метод другого элемента
Пример 1: — Определить
валентность элемента Mn в соединении K2MnO4.
Анализ: Пусть валентность
элемента Mn в соединении иметь валентность + x, в соответствии с принципом
нулю и алгебраической сумме валентности каждого элемента в соединении, там
равны 2 × (+1) + 1 × (+ x) + 4 × (-2) = 0 Решение: x = 6
Следовательно, валентность элемента Mn в K2MnO4 равна +6.
Метод структуры электронного слоя
Пример 2: — Есть один
электрон на самом внешнем слое атома элемента X и шесть электронов на
самый внешний слой атома элемента Y. Химическая формула
соединение, которое может быть образовано двумя элементами X и Y?
A. XY B. X2Y C. XY2 D. X3Y
Анализ: Можно сказать, что ключ к этому вопросу состоит в том, чтобы сначала определить валентность двух элементов X и Y при образовании соединения.Поскольку самый внешний слой X имеет только один электрон, самая высокая положительная цена равна +1, а самый внешний слой Y составляет 6 электронов, что на 2 расстояния от стабильной структуры из 8 электронов.
Следовательно, наименьшая отрицательная цена равна -2, поэтому X, Y Молекулярная формула образованного соединения — X2Y, и следует выбрать B.
Метод массовой доли
Пример 3: — Относительная атомная масса элемента 59, масса
доля элемента в оксиде составляет 71%, а его валентность составляет?
А.+1 Б. +2 С. +3 Д. +4
Анализ: Пусть
химическая формула оксида этого элемента должна быть RxOy
59x / (59x + 16y) * 100% = 71%
Решить x / y = 2: 3
Следовательно, химическая формула R2O3, а R
валентность +3, поэтому выберите C.
Сохранение массы
Пример 4: — Оксид металла
реагирует с достаточным количеством соляной кислоты, и соотношение
количество молекул хлорида к воде составляет 2: 3, то валентность металла
является?
А.+ 1Б. + 2С. + 3D. +4
Анализ: Предположим, что химическая формула образовавшегося хлорида — RClx, согласно соотношению количества молекул в заголовке RClx: h3O = 2: 3 Согласно закону сохранения массы, можно знать, что атомный тип и номер каждого элемента до и после реакции не изменяются, а H и Cl в продукте не изменяются.
Соотношение количества атомов в нем также должно быть 1: 1, поэтому значение x равно 3, тогда валентность R равна +3, выберите C.
Относительная молекулярная масса
Пример 5: — Родственник
молекулярная масса оксида металлического элемента равна M, а относительная молекулярная масса
масса хлорида в том же валентном состоянии равна N, тогда значение валентности
элемент есть?
Анализ: Пусть стихия
валентность будет + x, а относительная атомная масса будет MR
(1) Если x — нечетное число, химическая формула оксида — R2Ox, а химическая формула хлорида — RClx.
2MR + 16x = M (1)
MR + 35,5x = N (2)
(2) * 2- (1) Значение x равно
(2) Когда x — четное число, химическая формула оксида — ROx / 2, а химическая формула хлорида — RClx.
MR + 35,5x = N (4)
Таким образом, следует выбрать A и D.
Метод отношения качества
Пример 6: — Металлический элемент
ag с относительной атомной массой M реагирует с достаточным количеством разбавленного
серной кислоты для образования водорода Bg, а валентность металлического элемента в
реакция есть?
Анализ: Пусть металл
валентность в реакции равна + x валентность, то металлический элемент имеет следующие отношения с
образование H 2 :
2R ~ xH 2
2M 2x
ab
Следовательно, следует выбрать B.
Обсуждение сопутствующих факторов
Пример 7: — Наибольшее электронное число атома М элемента меньше 5, химическая формула его оксида — MxOy, а химическая формула хлорида — MClz. Когда y: z = 1: 2, может быть, валентность M?
А. +1 Б. +2 С. +3 Д. +4
Анализ: Валентность
M численно равно значению z
Например, y = 1z = 2 (разумно)
y = 2z = 4 (разумно)
y = 3z = 6 (не соответствует крайнему электрону
число меньше 5)
Следовательно, следует выбрать B и D.
| валентность | |
Что такое валентность? | |
| Чтобы писать химические формулы, нам нужно понимать, как элементы сочетаются друг с другом, образуя молекулы или ионные соединения. Ионные соединения — это вещества, состоящие из комбинации заряженных (положительных и отрицательных) частиц. | |
Валентность относится к способности атома или группы химически связанных атомов образовывать химические связи с другими атомами или группами атомов. Давайте не будем усложнять это и сразу перейдем к таблице Менделеева и тому, как мы можем определить валентность элемента. | |
Таблица Менделеева, показанная слева, может многое рассказать нам о валентности элементов. Элементы помещены в группы (столбцы) в периодической таблице в соответствии с количеством валентных электронов, поэтому, естественно, положение элемента в периодической таблице должно дать нам представление о его валентности. Все элементы в группе 1 имеют 1 валентный электрон, поэтому они имеют валентность +1, поскольку они будут иметь тенденцию отдавать 1 электрон. То же самое для группы 2, которая отдаст два электрона, и группы 3, которая отдаст 3 электрона. Элементы группы 5, однако, имеют 5 валентных электронов и, как правило, принимают 3 электрона и, следовательно, имеют валентность -3. | |
Валентности очень полезны, когда мы хотим написать формулы соединений, образованных из атомов металлов и неметаллов.Например, возьмем реакцию между атомами натрия и хлора. Литий имеет валентность +1, а азот — валентность -3 Следуйте этому очень простому методу. | |
| Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами нижние индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите любой нижний индекс, равный «1» | |
| Давайте посмотрим на другой пример, запишем формулу соединения, образованного между кислородом и алюминием (оксидом алюминия) | |
| Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами нижние индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите любой нижний индекс, равный «1» | |
Напишите формулу соединения, образованного между кальцием и углеродом, под названием карбид кальция. Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами нижние индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите любой нижний индекс, равный «1» | |
Попробуйте сами.Напишите формулу соединения, образованного между: а) кальций и азот (нитрид кальция), | |
б) бор и кислород (оксид бора) в) фтор и алюминий (фторид алюминия) | |
г) олово и азот (нитрид олова) | |
д) кислород и литий (оксид лития) | |
| е) фосфор и кальций (фосфид кальция) Растворы | |
Стивена попросили написать формулу соединения, образующегося при соединении атомов бора и кислорода.Он написал формулу как «O 3 B 2 ». Это правильно? Объяснить | |
Валентность — Химические формулы — Национальная 5 Химическая редакция
Валентность — это объединяющая сила элемента. Элементы в одной группе периодической таблицы имеют одинаковую валентность. Валентность элемента связана с количеством электронов во внешней оболочке.
| Номер группы | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|
| 905 905 | 2 | 2 | 1 | 0 |
Благородные газы имеют валентность 0, поскольку они обычно не сочетаются с другими элементами.
Чтобы написать химическую формулу соединения, лучше всего использовать
S.V.S.D.F
система.
- S — запишите символов обоих задействованных элементов.
- V — под каждым символом напишите его валентность . Полезно запомнить приведенную выше таблицу.
- S — поменять местами валентностей.
- D — если валентности можно упростить, разделите их на меньшее из двух чисел.Если одно из чисел уже равно единице, то их нельзя далее делить и упрощать.
- F — напишите формулу .
Пример
Какова формула оксида калия?
- Вопрос
Какова формула оксида алюминия?
- Показать ответ
- Вопрос
Какая формула для сероуглерода?
- Показать ответ
4.4: Валентность — Chemistry LibreTexts
Возможно, самая важная функция таблицы Менделеева состоит в том, что она помогает нам предсказывать химические формулы часто встречающихся соединений. В верхней части каждой группы Менделеев представил общую формулу для оксидов элементов в группе.
Заголовок R 2 O над группой I, например, означает, что мы можем ожидать найти такие соединения, как H 2 O, Li 2 O, Na 2 O и т. Д. Аналогично, общая формула RH 3 выше, группа V предполагает, что должны существовать соединения NH 3 , PH 3 , VH 3 и AsH 3 (среди прочих).Чтобы обеспечить основу для проверки этого прогноза, в следующей таблице показаны формулы для соединений, в которых H, O или Cl объединены с каждым из первых двух дюжин элементов (в порядке атомных весов). Даже среди групп элементов, описательная химия которых мы не обсуждали, вы можете легко подтвердить, что большинство предсказанных формул соответствуют соединениям, которые действительно существуют. И наоборот, более 40 процентов формул известных соединений O согласуются с общими формулами Менделеева и выделены цветом в таблице.
| Элемент | Атомный вес | Водородные соединения | Кислородные соединения | Соединения хлора |
|---|---|---|---|---|
| Водород | 1,01 | H 2 | H 2 O, H 2 O 2 | HCl |
| Гелий | 4.00 | Не сформировано | Не сформировано | Не сформировано |
| Литий | 6,94 | LiH | Li 2 O, Li 2 O 2 | LiCl |
| Бериллий | 9,01 | BeH 2 | BeO | BeCl 2 |
| Бор | 10.81 | B 2 H 6 | B 2 O 3 | BCl 3 |
| Углерод | 12,01 | CH 4 , C 2 H 6 , C 3 H 8 † | CO 2 , CO, C 2 O 3 | CCl 4 , C 2 Класс 6 |
| Азот | 14.01 | NH 3 , N 2 H 4 , HN 3 | N 2 O, NO, NO 2 , N 2 O 5 | NCl 3 |
| Кислород | 16,00 | H 2 O, H 2 O 2 | О 2 , О 3 | |
| фтор | 19.00 | HF | ИЗ 2 , О 2 F 2 | ClF, ClF 3 , ClF 5 |
| Неон | 20,18 | Не сформировано | Не сформировано | Не сформировано |
| Натрий | 22,99 | NaH | Na 2 O, Na 2 O 2 | NaCl |
| Магний | 24.31 | мг / ч 2 | MgO | MgCl 2 |
| Алюминий | 26,98 | AlH 3 | Al 2 O 3 | AlCl 3 |
| Кремний | 28,09 | SiH 4 , Si 2 H 6 | SiO 2 | SiCl 4 , Si 2 Cl 6 |
| фосфор | 30.97 | PH 3 , P 2 H 4 | P 4 O 10 , P 4 O 6 | PCl 3 , PCl 5 , P 2 Класс 4 |
| сера | 32,06 | H 2 S, H 2 S 2 | СО 2 , СО 3 | S 2 Класс 2 , SCl 2 , SCl 4 |
| Хлор | 35.45 | HCl | Класс 2 O, ClO 2 , Класс 2 O 7 | Класс 2 |
| Калий | 39,10 | KH | K 2 O, K 2 O 2 , KO 2 | KCl |
| Аргон | 39,95 | Не сформировано | Не сформировано | Не сформировано |
| Кальций | 40.08 | CaH 2 | СаО, СаО 2 | CaCl 2 |
| Скандий | 44,96 | Относительно нестабильно | Sc 2 O 3 | ScCl 3 |
| Титан | 47,90 | TiH 2 | TiO 2 , Ti 2 O 3 , TiO | TiCl 4 , TiCl 3 , TiCl 2 |
| Ванадий | 50.94 | VH 2 | V 2 O 5 , V 2 O 3 , VO 2 , VO | VCl 4 , VCl 3 , VCl 2 |
| Хром | 52,00 | CrH 2 | Cr 2 O 3 , CrO 2 , CrO 3 | CrCl 3 , CrCl 2 |
* Для каждого элемента соединения перечислены в порядке уменьшения стабильности.В некоторых случаях известны дополнительные соединения, но они относительно нестабильны.
† Известно очень много стабильных соединений углерода и водорода, но нехватка места не позволяет перечислить их все.
Периодическое повторение подобных формул еще более выражено в случае соединений Cl. Это очевидно, когда список состоит из индексов для Cl в сочетании с каждым из первых 24 элементов. Просматривая приведенную выше таблицу, мы находим HCl (индекс 1), отсутствие соединения с He (индекс 0), LiCl (индекс 1) и т. Д.
За двумя исключениями, выделенными курсивом, по крайней мере одна формула для соединения каждого элемента соответствует последовательности индексов, которые регулярно колеблются от 0 до 4 и снова до 0. (Необычное поведение K и Ar будет обсуждено немного позже.) Число атомов Cl, которые объединяются с одним атомом каждого другого элемента, изменяется довольно регулярно, поскольку атомный вес другого элемента увеличивается. Экспериментально определенные формулы в первой таблице и общие формулы в периодической таблице Менделеева подразумевают, что каждый элемент обладает характерной способностью к химическому соединению.Эта емкость называется валентностью и периодически изменяется с увеличением атомного веса. Все благородные газы имеют валентность 0, потому что они почти никогда не соединяются с другими элементами. H и Cl имеют одинаковую валентность. Они соединяются друг с другом в соотношении 1: 1 с образованием HCl, каждый из которых соединяется с Li в том же соотношении 1: 1 (LiH и LiCl), каждый соединяется с Be в том же соотношении (BeH 2 , BeCl 2 ), и так далее. Поскольку H и Cl имеют одинаковую валентность, мы можем предсказать, что большое количество соединений H будет иметь формулы, идентичные формулам соединений Cl, за исключением, конечно, того, что символ H заменит символ Cl.Правильность этого прогноза можно проверить, изучив формулы, выделенные серой штриховкой в первой таблице. Комбинирующая способность или валентность O, по-видимому, в два раза выше, чем у H или Cl. Два атома H соединяются с одним атомом O в H 2 O То же самое происходит с двумя атомами Cl или двумя атомами Li (Cl 2 O и Li 2 O). Количество атомов, объединяющихся с одним атомом O, обычно , вдвое больше , чем число, которое объединяется с одним атомом H или Cl. (Опять же, просмотр формул в первой таблице, закрашенных серым, подтвердит это утверждение.) После тщательного изучения формул в таблице также можно сделать вывод, что ни один из элементов (кроме инертных благородных газов) не имеет меньшую валентность, чем H или Cl. Следовательно, мы приписываем валентность 1 H и Cl. Валентность O вдвое больше, поэтому мы присваиваем значение 2.
Пример \ (\ PageIndex {1} \): прогноз формулы
Используйте данные в первой таблице, чтобы предсказать, какую формулу можно ожидать от соединения, содержащего (а) натрий и фтор; (б) кальций и фтор.
Решение
а) Из таблицы можно получить следующие формулы для наиболее распространенных соединений натрия:
- NaH Na 2 O NaCl
Все это означает, что натрий имеет валентность 1. Для соединений фтора мы имеем
- HF OF 2 ClF
, что означает, что фтор также имеет валентность 1.Следовательно, формула, вероятно,
- NaF
b) Мы уже знаем, что валентность фтора равна 1. Для кальция формулы
- CaH 2 CaO CaCl 2
аргументируют в пользу валентности 2. Следовательно, формула, скорее всего, имеет вид
- CaF 2
В некоторых случаях один элемент может сочетаться с другим более чем одним способом.Например, вы уже встречались с соединениями HgBr 2 и Hg 2 Br 2 . В первой таблице есть много других примеров такой переменной валентности. Тем не менее в своих наиболее распространенных соединениях каждый элемент обычно проявляет одну характерную валентность, независимо от того, каков его партнер. Следовательно, можно использовать эту валентность для предсказания формул. Переменная валентность элемента может рассматриваться как исключение из правила конкретной объединяющей способности для каждого элемента.Экспериментальное наблюдение, что данный элемент обычно имеет определенную валентность, можно объяснить, если мы предположим, что каждый из его атомов имеет фиксированное количество валентных узлов. Один из этих сайтов потребуется для соединения с одним сайтом на другом атоме. Другими словами, у атома благородного газа, такого как Ar или Ne, не будет никаких объединяющих узлов, у атомов H и Cl будет по одному валентному сайту, у атома O будет два и так далее. Переменная валентность должна включать атомы, в которых одни валентные узлы используются легче, чем другие.В случае F-соединений Cl (ClF, ClF 3 , ClF 5 ), например, формулы подразумевают, что на Cl доступны по меньшей мере пять валентных сайтов. Только один из них используется в ClF и в большинстве соединений хлора, указанных в таблице. Остальные, по-видимому, менее доступны. Включение Менделеевым общих формул над столбцами его периодической таблицы указывает на то, что эту таблицу можно использовать для предсказания валентностей элементов и формул их соединений. Можно соблюдать два общих правила:
- В периодических группах с I по IV номер группы является наиболее распространенной валентностью.
- В периодических группах с V по VII наиболее распространенная валентность равна 8 минус номер группы или сам номер группы.
Для групп с V по VII номер группы дает валентность только тогда, когда рассматриваемый элемент объединен с кислородом, фтором или, возможно, одним из других галогенов. В противном случае 8 минус номер группы — это правило.
Пример \ (\ PageIndex {2} \): формулы соединений
Используйте современные периодические методы для предсказания формул соединений, образованных из (а) алюминия и хлора; (б) фосфор и хлор.Используйте таблицу на этой странице, чтобы проверить свой прогноз.
Решение
a) Алюминий находится в группе III, и поэтому правило 1 предсказывает валентность 3. Хлор находится в группе VII и не соединяется с кислородом или фтором, поэтому его валентность составляет 8-7 = 1 по правилу 2. Каждый алюминий имеет три валентных центра, в то время как каждый хлор имеет только одно, поэтому для удовлетворения одного алюминия требуется три атома хлора, и формула AlCl 3 .
b) Снова хлор имеет валентность 1.Фосфор находится в группе V и может иметь валентность 5 или 8 — 5 = 3. Поэтому мы предсказываем формулы PCl 5 или PCl 3 . Примечание: Все три прогнозные формулы отображаются в таблице на этой странице.
Авторы и авторство
химических формул | Безграничная химия
Молекулярные формулы
Молекулярные формулы — это компактные химические обозначения, которые описывают тип и количество атомов в одной молекуле соединения.
Цели обучения
Определите молекулярную формулу соединения по его названию или структурной формуле.
Основные выводы
Ключевые моменты
- Молекулярная формула состоит из химических символов составляющих элементов, за которыми следуют числовые индексы, описывающие количество атомов каждого элемента, присутствующего в молекуле.
- Эмпирическая формула представляет собой простейшее целочисленное отношение атомов в соединении.Молекулярная формула соединения может быть такой же или кратной эмпирической формуле соединения.
- Молекулярные формулы компактны и просты в передаче; однако им не хватает информации о связи и расположении атомов, которая содержится в структурной формуле.
Ключевые термины
- молекулярная формула : формула, которая описывает точное количество и тип атомов в одной молекуле соединения.
- эмпирическая формула : Формула, которая указывает простейшее целочисленное отношение всех атомов в молекуле.
- структурная формула : Формула, указывающая не только количество атомов, но и их расположение в пространстве.
Молекулярные формулы описывают точное количество и тип атомов в одной молекуле соединения. Составляющие элементы представлены своими химическими символами, а количество атомов каждого элемента, присутствующего в каждой молекуле, показано нижним индексом, следующим за символом этого элемента. Молекулярная формула выражает информацию о пропорциях атомов, составляющих конкретное химическое соединение, с использованием одной строки символов и чисел химических элементов.Иногда он также включает другие символы, такие как круглые скобки, тире, квадратные скобки, а также знаки плюс (+) и минус (-).
Для органических соединений углерод и водород указаны как первые элементы в молекулярной формуле, а за ними следуют остальные элементы в алфавитном порядке. Например, для бутана молекулярная формула C 4 H 10 . Для ионных соединений катион предшествует аниону в молекулярной формуле. Например, молекулярная формула фторида натрия — NaF.
Молекулярная формула — это не химическое название, и оно не содержит слов. Хотя молекулярная формула может подразумевать определенные простые химические структуры, это не то же самое, что полная химическая структурная формула. Молекулярные формулы более ограничивают, чем химические названия и структурные формулы.
Эмпирические и молекулярные формулы
Самые простые типы химических формул называются эмпирическими формулами, которые указывают соотношение каждого элемента в молекуле. Эмпирическая формула — это простейшее целочисленное отношение всех атомов в молекуле.Например:
- Молекулярная формула глюкозы: C 6 H 12 O 6 . Молекулярная формула указывает точное количество атомов в молекуле.
- Эмпирическая формула выражает наименьшее целочисленное отношение атомов в элементе. В этом случае эмпирическая формула глюкозы: CH 2 O.
Чтобы преобразовать эмпирическую формулу в молекулярную, эмпирическую формулу можно умножить на целое число, чтобы получить молекулярную формулу.В этом случае эмпирическая формула должна быть умножена на 6, чтобы получить молекулярную формулу.
Примеры эмпирических и молекулярных формул
- Соединение гексоксида дихлора имеет эмпирическую формулу ClO 3 и молекулярную формулу Cl 2 O 6
- Соединение перекиси водорода имеет эмпирическую формулу HO и молекулярную формулу H 2 O 2
Молекулярные формулы и структурные формулы
Молекулярные формулы не содержат информации о расположении атомов.По этой причине одна молекулярная формула может описывать несколько различных химических структур. Структурная формула используется для обозначения не только количества атомов, но и их расположения в пространстве. Структурная формула не так компактна и проста в передаче, но она предоставляет информацию, которую молекулярная формула не касается относительного расположения атомов и связи между атомами. Соединения, которые имеют общую химическую формулу, но имеют различную химическую структуру, известны как изомеры, и они могут иметь совершенно разные физические свойства.
Структурная формула бутана : Химическая структура бутана указывает не только на количество атомов, но и на их расположение в пространстве.
Эмпирические формулы
Эмпирические формулы описывают простейшее целочисленное соотношение элементов в соединении.
Цели обучения
Вывести эмпирическую формулу молекулы с учетом ее массового состава
Основные выводы
Ключевые моменты
- Эмпирические формулы — самая простая форма записи.
- Молекулярная формула соединения равна его эмпирической формуле или является целым числом, кратным ей.
- Подобно молекулярным формулам, эмпирические формулы не уникальны и могут описывать ряд различных химических структур или изомеров.
- Для определения эмпирической формулы массовый состав ее элементов может использоваться для математического определения их соотношения.
Ключевые термины
- эмпирическая формула : Обозначение, показывающее соотношения различных элементов, присутствующих в соединении, без учета фактических чисел.
Химики используют различные обозначения для описания и обобщения атомных составляющих соединений. Эти обозначения, которые включают эмпирические, молекулярные и структурные формулы, используют химические символы для элементов вместе с числовыми значениями для описания атомного состава.
Эмпирические формулы — самая простая форма записи. Они обеспечивают наименьшее целочисленное соотношение между элементами в составе. В отличие от молекулярных формул, они не предоставляют информацию об абсолютном количестве атомов в одной молекуле соединения.Молекулярная формула соединения равна его эмпирической формуле или является целым числом.
Структурные формулы против эмпирических формул
Эмпирическая формула (например, молекулярная формула) не содержит какой-либо структурной информации о расположении или связывании атомов в молекуле. Таким образом, он может описывать ряд различных структур или изомеров с различными физическими свойствами. Для бутана и изобутана эмпирическая формула для обеих молекул: C 2 H 5 , и они имеют одну и ту же молекулярную формулу, C 4 H 10 .Однако одно структурное представление для бутана — CH 3 CH 2 CH 2 CH 3 , в то время как изобутан можно описать с помощью структурной формулы (CH 3 ) 3 CH.
Бутан : Структурная формула бутана.
Изобутан : структурная формула изобутана.
Определение эмпирических формул
Эмпирические формулы могут быть получены с использованием данных о массовом составе. Например, анализ горения можно использовать следующим образом:
- Анализатор CHN (инструмент, который может определять состав молекулы) может использоваться для определения массовых долей углерода, водорода, кислорода и других атомов в образце неизвестного органического соединения.
- Как только относительные массовые доли элементов известны, эту информацию можно преобразовать в моли.
- Эмпирическая формула — это наименьшее возможное целочисленное отношение элементов.
Пример 1
Предположим, вам дали такое соединение, как метилацетат, растворитель, обычно используемый в красках, чернилах и клеях. Когда метилацетат был химически проанализирован, было обнаружено, что он содержит 48,64% углерода (C), 8,16% водорода (H) и 43,20% кислорода (O).Для определения эмпирических формул мы предполагаем, что у нас есть 100 г соединения. В этом случае проценты будут равны массе каждого элемента в граммах.
Шаг 1: Измените каждый процент на выражение массы каждого элемента в граммах. То есть 48,64% C превращается в 48,64 г C, 8,16% H превращается в 8,16 г H, а 43,20% O превращается в 43,20 г O, потому что мы предполагаем, что у нас есть 100 г всего соединения.
Шаг 2: Преобразуйте количество каждого элемента в граммах в его количество в молях.
[латекс] \ left (\ frac {48.64 \ mbox {g C}} {1} \ right) \ left (\ frac {1 \ mbox {mol}} {12.01 \ mbox {g C}} \ right) = 4.049 \ \ text {mol} [/ латекс]
[латекс] \ left (\ frac {8.16 \ mbox {g H}} {1} \ right) \ left (\ frac {1 \ mbox {mol}} {1.008 \ mbox {g H}} \ right) = 8.095 \ \ text {mol} [/ латекс]
[латекс] \ left (\ frac {43.20 \ mbox {g O}} {1} \ right) \ left (\ frac {1 \ mbox {mol}} {16.00 \ mbox {g O}} \ right) = 2.7 \ \ text {mol} [/ латекс]
Шаг 3: Разделите каждое мольное значение на наименьшее из мольных значений.
[латекс] \ frac {4.049 \ mbox {mol}} {2.7 \ mbox {mol}} = 1.5 [/ латекс]
[латекс] \ frac {8.095 \ mbox {mol}} {2.7 \ mbox {mol}} = 3 [/ латекс]
[латекс] \ frac {2.7 \ mbox {mol}} {2.7 \ mbox {mol}} = 1 [/ latex]
Шаг 4: При необходимости умножьте эти числа на целые, чтобы получить целые числа; если операция выполняется с одним из номеров, она должна выполняться со всеми ними.
[латекс] 1,5 \ раза 2 = 3 [/ латекс]
[латекс] 3 \ раза 2 = 6 [/ латекс]
[латекс] 1 \ times 2 = 2 [/ латекс]
Таким образом, эмпирическая формула метилацетата C 3 H 6 O 2 .
Пример 2
Эмпирическая формула декана: C 5 H 11 . Его молекулярная масса составляет 142,286 г / моль. Какова молекулярная формула декана?
Шаг 1. Рассчитайте молекулярную массу по эмпирической формуле (молекулярная масса C = 12,011 г / моль и H = 1,008 г / моль)
5 (12,0111 г / моль) + 11 (1,008 г / моль) = C 5 H 11
60,055 г / моль + 11,008 г / моль = 71,143 г / моль на C 5 H 11
Шаг 2: Разделите молекулярную массу молекулярной формулы на молекулярную массу эмпирической формулы, чтобы найти соотношение между ними.
[латекс] \ frac {142,286 \ г / моль} {71,143 \ г / моль} = 2 [/ латекс]
Поскольку вес молекулярной формулы в два раза больше веса эмпирической формулы, должно быть вдвое больше атомов, но в том же соотношении. Следовательно, если эмпирическая формула декана C 5 H 11 , молекулярная формула декана вдвое больше, или C 10 H 22 .
От молекулярной формулы к эмпирической формуле — YouTube : Это видео показывает, как перейти от молекулярной формулы соединения к его соответствующей эмпирической формуле.
Формулы ионных соединений
Ионная формула должна удовлетворять правилу октетов для составляющих атомов и электрической нейтральности для всего соединения.
Цели обучения
Создайте эмпирическую формулу ионного соединения, учитывая его молекулярные составляющие.
Основные выводы
Ключевые моменты
- Общая ионная формула соединения должна быть электрически нейтральной, то есть не иметь заряда.
- При написании формулы ионного соединения сначала идет катион, затем анион, оба с числовыми индексами, указывающими количество атомов каждого.
- Многоатомные ионы представляют собой набор ковалентно связанных атомов, которые имеют общий заряд, что делает их ионами.
- Многоатомные ионы образуют ионные связи обычным образом, балансируя таким образом, чтобы все соединение было электрически нейтральным.
Ключевые термины
- многоатомный ион : набор ковалентно связанных атомов, которые имеют общий заряд, что делает их ионом.
- одноатомный ион : Ион, состоящий только из одного атома, например Cl-.
Ионные связи образуются за счет переноса одного или нескольких валентных электронов между атомами, обычно между металлами и неметаллами. Перенос электронов позволяет атомам эффективно достигать гораздо более стабильной электронной конфигурации с восемью электронами на внешней валентной оболочке (правило октетов). Когда натрий отдает валентный электрон фтору, чтобы стать фторидом натрия, это является примером образования ионной связи.
Образование фторида натрия : перенос электронов между двумя атомами с образованием двух ионов, которые притягиваются друг к другу, потому что они заряжены противоположно.
Написание ионных формул
Ионные соединения могут быть описаны с помощью химических формул, которые представляют собой отношения взаимодействующих элементов, которые находятся в ионном твердом веществе или соли. Ионные твердые тела обычно представлены их эмпирическими формулами. В обозначениях формул элементы представлены своими химическими символами, за которыми следуют числовые индексы, которые указывают относительные соотношения составляющих атомов. Полная формула ионного соединения может быть определена при выполнении двух условий:
- Во-первых, заряд составляющих ионов может быть определен на основе переноса валентных электронов, необходимого для выполнения правила октетов.
- Во-вторых, катионы и анионы соединяются таким образом, что образуется электрически нейтральное соединение.
Например, при реакции кальция и хлора соединение называется хлоридом кальция. Он состоит из катионов Ca 2+ и анионов Cl — ; эти ионы стабильны, поскольку они заполнили валентные оболочки. Его ионная формула записывается как CaCl 2 , нейтральная комбинация этих ионов. В конечном соединении потребовались два иона хлорида, потому что кальций имел заряд 2+.Чтобы создать нейтральное соединение, CaCl 2 , потребовались два иона 1- хлорида, чтобы сбалансировать заряд 2+ от кальция.
Многоатомные ионы
Многоатомные ионы — это набор ковалентно связанных атомов, имеющих общий заряд, что делает их ионами. Например, гидроксид-ион имеет формулу OH -1 . Гидроксид — это соединение, состоящее из кислорода и водорода, которые связаны вместе. В процессе превращения в соединение гидроксид откуда-то получил дополнительный электрон, что сделало его OH -1 .Создавая ионные соединения с этими многоатомными ионами, относитесь к ним так же, как к обычным одноатомным ионам (только один атом).
Например, гидроксид кальция имеет формулу Ca (OH) 2 , потому что гидроксид имеет заряд -1, а кальций имеет заряд 2+. Два гидроксида были необходимы, чтобы уравновесить +2 заряда кальция. Скобки использовались, чтобы указать, что ОН был многоатомным ионом и предлагался как «комплексное решение». Два гидроксида нельзя было записать как O 2 H 2 , потому что это совершенно другое соединение, чем (OH) 2 .Скобки всегда используются, когда соединение содержит многоатомные ионы, кратные числу.
Вот список обычных многоатомных ионов:
- Аммоний, NH 4 +
- Карбонат, CO 3 2-
- Бикарбонат, HCO 3 —
- Цианид, CN —
- Фосфат, PO 4 3-
- Гидроксид, OH —
- Нитрат, NO 3 —
- Перманганат, MnO 4 —
- Сульфат, SO 4 2-
- Тиоцианат, SCN —
- Пероксид, O 2 2-
Серия видео «Введение в ионные соединения» от Leah5sci — YouTube : Это видео объясняет основы работы с ионами.
Образование катионов и анионов — Ионные соединения, часть 2 — YouTube : Это видео показывает, как моноатомные ионы получают свой заряд и как быстро определить заряд ионов, глядя на периодическую таблицу.
Как определить валентность комплексных соединений. Что такое валентность?
Электроотрицательность, как и другие свойства атомов химических элементов, периодически изменяется с увеличением порядкового номера элемента:
На графике выше показана частота изменения электроотрицательности элементов основных подгрупп в зависимости от порядкового номера элемента. .
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, а при движении вправо по периоду увеличивается.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем больше неметаллических свойств проявляется в элементе.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Есть элементы, которые проявляют постоянную степень окисления в сложных веществах:
3) Существуют химические элементы, которые демонстрируют постоянную степень окисления в подавляющем большинстве соединений. Эти элементы включают:
Элемент | Степень окисления почти всех соединений | Исключения |
| водород H | +1 | Гидриды щелочных и щелочноземельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фтористый кислород — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Наивысшая (максимальная) степень окисления равна номеру группы. Исключениями, не подпадающими под это правило, являются элементы боковой подгруппы группы I, элементы боковой подгруппы группы VIII, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (необходимо помнить)
6) Наинизшая степень окисления металлов всегда равна нулю, а наименьшая степень окисления неметаллов рассчитывается по формуле :
наименьшая скорость окисления неметалла = номер группы — 8
Исходя из приведенных выше правил, можно установить степень окисления химического элемента в любом веществе.
Определение степени окисления элементов в различных соединениях
Пример 1
Определите степень окисления всех элементов в серной кислоте.
Решение:
Записываем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех комплексных веществах -2 (кроме пероксидов и фторида кислорода OF 2). Разместим известные степени окисления:
Степень окисления серы обозначим как x :
Молекула серной кислоты, как и молекула любого вещества, обычно электрически нейтральна, потому что сумма степеней окисления всех атомов в молекуле равно нулю.Схематично это можно представить так:
Т.е. мы получили следующее уравнение:
Решаем:
Таким образом, степень окисления серы в серной кислоте +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расположить степени окисления водорода и кислорода:
Однако мы видим, что степени окисления двух химических элементов, азота и хром, сразу неизвестны.Следовательно, мы не можем найти степени окисления аналогично предыдущему примеру (одно уравнение с двумя переменными не имеет единственного решения).
Обращаем внимание на то, что это вещество относится к классу солей и, соответственно, имеет ионную структуру. Тогда можно с полным правом сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд этого катиона можно увидеть в таблице растворимости). Следовательно, поскольку в формульной единице дихромата аммония присутствуют два положительных однозарядных катиона NH 4 +, заряд дихромат-иона равен -2, поскольку вещество в целом электрически нейтрально.Те. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2-.
Нам известны степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначая степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т. мы получаем два независимых уравнения:
Решая которые, мы находим x и y :
Таким образом, в дихромате аммония степень окисления азота составляет -3, водорода +1, хрома +6 и кислорода — 2.
Как определить степень окисления элементов в органических веществах можно прочитать.
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т. Д.
Валентность атома зависит от количества:
1) неспаренных электронов
2) неподеленных электронных пар в орбитали валентных уровней
3) пустые валентные уровни электронные орбитали
Валентность атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что три фактора могут влиять на валентные потенциалы — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне и наличие вакантных (пустых) орбиталей внешнего уровня.Мы видим на внешнем (и единственном) уровне энергии один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне существует только один подуровень — с т.н. атом водорода на внешнем уровне не имеет ни неподеленных электронных пар, ни пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, — это I.
Валентность атома углерода
Рассмотрим электронную структуру атома углерода.В основном состоянии электронная конфигурация его внешнего уровня следующая:
Тех. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находятся 2 неспаренных электрона. В этом состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при передаче ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то, что на процесс затрачивается определенное количество энергии возбуждения атома углерода, отходы более чем компенсируются образованием четырех ковалентных связей.По этой причине валентность IV гораздо более характерна для атома углерода. Так, например, углерод валентности IV имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар, наличие вакантных () орбиталей валентного уровня также влияет на валентные потенциалы. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может действовать как акцептор электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.Так, например, вопреки ожиданиям, в молекуле монооксида углерода связь CO не двойная, а тройная, что ясно показано на следующем рисунке:
Валентность атома азота
Запишем электронно-графический формула внешнего энергетического уровня атома азота:
Как видно из рисунка выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, и поэтому логично предположить его способность проявлять валентность, равную III .Действительно, валентность три наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), трихлорида азота (NCl 3) и т. Д.
Выше говорилось, что валентность атома химического элемента зависит от не только от количества неспаренных электронов, но и от наличия неподеленных электронных пар. Это связано с тем, что ковалентная химическая связь может образовываться не только тогда, когда два атома предоставляют друг другу один электрон, но и когда один атом, имеющий неподеленную пару электронов — донор () предоставляет ее другому атому с вакантным ( ) уровень орбитальной валентности (акцептор).Те. валентность IV также возможна для атома азота за счет дополнительной ковалентной связи, образованной донорно-акцепторным механизмом. Так, например, при образовании катиона аммония наблюдается четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму:
Несмотря на то, что одна из ковалентных связей образована по донорно-акцепторному механизму , все связи N — H в катионе аммония абсолютно идентичны и не отличаются друг от друга.
Валентность, равная V, атом азота показать не может.Это связано с тем, что для атома азота невозможен переход в возбужденное состояние, в котором происходит спаривание двух электронов с переходом одного из них на ближайшую по энергии свободную орбиталь. Атом азота не имеет d подуровня, и переход на 3s-орбиталь настолько энергоемкий, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, какова же тогда валентность азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5? Как ни странно, валентность там тоже IV, как видно из следующих структурных формул:
Пунктирная линия на иллюстрации изображает так называемый делокализованный π
-подключение.По этой причине концевые связи NO можно назвать «полуторными». Подобные полуторные связи присутствуют также в молекулах озона O 3, бензола C 6 H 6 и др.
Валентность фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, структура внешнего слоя у атома фосфора в основном состоянии и атома азота одинакова, поэтому логично ожидать, что для атома фосфора, как и для атома азота, возможные валентности равны к I, II, III и IV, что наблюдается на практике.
Однако, в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне также d -подуровень с 5 вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние за счет запаривания электронов 3 s -орбиталей:
Таким образом, валентность V, недоступная азоту для атома фосфора, возможна. Так, например, валентность пять — это атом фосфора в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т. Д.
Валентность атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, поэтому для кислорода возможна валентность II. Следует отметить, что такая валентность атома кислорода наблюдается практически во всех соединениях. Обсуждая валентные потенциалы атома углерода, мы обсуждали образование молекулы монооксида углерода. Связь в молекуле CO тройная; следовательно, кислород здесь трехвалентный (кислород является донором электронной пары).
Из-за того, что атом азота не имеет внешнего уровня d -подуровневое спаривание электронов s и p- орбиталей невозможно, из-за чего валентность атома кислорода ограничена в сравнении с другими элементами своей подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
Атом серы, как и атом кислорода, имеет два неспаренных электрона в обычном состоянии, поэтому мы можем заключить, что валентность из двух возможно для серы.Действительно, валентность серы II находится, например, в молекуле сероводорода H 2 S.
Как видим, атом серы на внешнем уровне оказывается d -подуровнем с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные потенциалы, в отличие от кислорода, за счет перехода в возбужденные состояния. Так, при пропаривании неподеленной электронной пары 3 p -подслойный атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В этом состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявление атомами серы валентности, равной IV.Действительно, валентность IV серы присутствует в молекулах SO 2, SF 4, SOCl 2 и т. Д.
При пропаривании второй неподеленной пары электронов, расположенной на подуровне 3 с , внешний энергетический уровень принимает конфигурацию:
В этом состоянии становится возможным проявление VII валентности. Примерами соединений VI валентной серы являются SO 3, H 2 SO 4, SO 2 Cl 2 и т. Д.
Аналогичным образом можно рассмотреть валентный потенциал других химических элементов.
Определение
Валентность подразумевает свойство атома данного элемента присоединять или заменять определенное количество атомов другого элемента.
Следовательно, мерой валентности может быть количество химических связей, образованных данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле, мера его способности) образовывать химические связи (рис. 1). В представлении метода валентных связей численное значение валентности соответствует количеству ковалентных связей, которые образует атом.
Рис. 1. Схема образования молекул воды и аммиака.
Таблица валентности химических элементов
Изначально за валентность принималась валентность водорода. В этом случае валентность другого элемента выражалась числом атомов водорода, которые присоединены или замещают один атом этого элемента (так называемая валентность водорода). Например, в соединениях состава HCl, H 2 O, NH 3, CH 4 валентность хлористого водорода равна единице, кислорода — двум, азота — трем, углерода — четырем.
Тогда было решено, что валентность искомого элемента также может определяться по кислороду, валентность которого, как правило, равна двум.В этом случае валентность химического элемента рассчитывается как удвоенное количество атомов кислорода, которые может присоединить один атом этого элемента (так называемая валентность кислорода). Например, в соединениях состава N 2 O, CO, SiO 2, SO 3 валентность кислорода равна единице, углерода — двум, кремния — четырем, серы — шести.
На самом деле оказалось, что большинство химических элементов имеют разные валентности в водороде и кислородных соединениях: например, валентность серы в водороде равна двум (H 2 S), а в кислороде — шести (SO 3).Кроме того, большинство элементов проявляют разную валентность в своих соединениях. Например, углерод образует два оксида: монооксид CO и диоксид CO 2. В первом из которых валентность углерода равна II, а во втором — четыре. Отсюда следует, что, как правило, невозможно охарактеризовать валентность элемента каким-либо одним числом.
Высшие и низшие валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить с помощью Периодической таблицы D.И. Менделеев. Наивысшая валентность элемента совпадает с номером группы, в которой он находится, а наименьшая представляет собой разницу между числом 8 и номером группы. Например, бром находится в группе VIIA, поэтому его самая высокая валентность — VII, а самая низкая — I.
Есть элементы с т.н. постоянная валентность (металлы IA и IIA групп, алюминий, водород, фтор, кислород), которые в своих соединениях проявляют единую степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Менделеева, в которой они находятся).
Элементы, для которых характерно несколько значений валентности (а это не всегда высшая и низшая валентности), называются чередующимися. Например, сера характеризуется валентностями II, IV и VI.
Чтобы упростить запоминание того, сколько и какие валентности характерны для конкретного химического элемента, используются таблицы валентностей химических элементов, которые выглядят следующим образом:
Примеры решения задач
ПРИМЕР 1
| Задача | Валентность III характерна для: а) Са; б) П; в) О; г) Si? |
| Решение | а) Кальций — это металл.Он характеризуется единственно возможным значением валентности, которое совпадает с номером группы в Периодической таблице Менделеева, в которой он находится, т.е. валентность кальция равна II. Ответ неверный. б) Фосфор — неметалл. Относится к группе химических элементов с переменной валентностью: самая высокая определяется номером группы в Периодической таблице Менделеева, в которой она находится, т.е. равна V, а самая низкая — это разница между числом 8 и группой. номер, т.е. равно III. Это правильный ответ. |
| Ответ | Вариант (б) |
ПРИМЕР 2
| Задача | Валентность III характерна для: а) Ве; б) F; в) Al; Округ Колумбия? |
| Решение | Чтобы дать верный ответ на этот вопрос, мы рассмотрим каждый из предложенных вариантов в отдельности. а) Бериллий — металл. Он характеризуется единственно возможным значением валентности, которое совпадает с номером группы в Периодической таблице Менделеева, в которой он находится, т.е.е. валентность бериллия равна II. Ответ неверный. б) Фтор не является металлом. Для него характерно единственно возможное значение валентности, равное I. Ответ неверный. в) Алюминий — это металл. Он характеризуется единственно возможным значением валентности, которое совпадает с номером группы в Периодической таблице Менделеева, в которой он находится, т.е.валентность алюминия равна III. Это правильный ответ. |
| Ответ | Вариант (в) |
Инструкция по эксплуатации
Таблица — это структура, в которой расположены химические элементы в соответствии с их принципами и законами.То есть можно сказать, что стол — это многоэтажный «дом», в котором «живут» химические элементы, у каждого из которых есть своя квартира под определенным номером. «Этажи» расположены горизонтально — периоды, которые могут быть маленькими и большими. Если период состоит из двух строк (на что указывает нумерация сбоку), то такой период называется большим. Если в нем всего одна строка, то она называется маленькой.
Стол также разделен на «веранды» — групп, которых всего восемь. Как в любом подъезде квартиры расположены слева и справа, так и здесь химические элементы расположены по одному принципу.Только в этом варианте их распределение неравномерное — с одной стороны элементов больше, а потом они говорят об основной группе, с другой — меньше, и это указывает на то, что группа вторична.
Валентность — это способность элементов образовывать химические связи. Существует постоянная валентности, которая не изменяется, и переменная, которая имеет другое значение в зависимости от того, какое вещество содержит элемент. При определении валентности по таблице Менделеева необходимо обращать внимание на следующие характеристики: количество элементов группы и ее тип (то есть основная или второстепенная группа).Постоянная валентность в этом случае определяется групповым номером основной подгруппы. Чтобы узнать значение переменной валентности (если есть и обычно неметаллы), то нужно вычесть номер группы, в которой находится элемент, из 8 (всего 8 групп — отсюда и эта цифра).
Пример № 1. Если посмотреть на элементы первой группы основной подгруппы (щелочные металлы), можно сделать вывод, что все они имеют валентность, равную I (Li, Na, K, Rb, Cs, Fr). .
Пример №2. Элементы второй группы основной подгруппы (щелочноземельные металлы) соответственно имеют валентность II (Be, Mg, Ca, Sr, Ba, Ra).
Пример №3. Если говорить о неметаллах, например, P (фосфор) находится в V группе основной подгруппы. Следовательно, его валентность будет равна V. Кроме того, у фосфора есть другое значение валентности, и для его определения необходимо выполнить действие 8 — номер элемента. Итак, 8 — 5 (номер группы фосфора) = 3. Следовательно, вторая валентность фосфора — III.
Пример №4. Галогены находятся в VII группе основной подгруппы. Таким образом, их валентность будет равна VII. Однако, учитывая, что это неметаллы, необходимо выполнить арифметическую операцию: 8-7 (номер группы элементов) = 1. Следовательно, другая валентность галогенов равна I.
Для элементов вторичных подгрупп (а к ним относятся только металлы) необходимо помнить валентность, тем более что в большинстве случаев она равна I, II, реже III. Вам также нужно будет запомнить валентности химических элементов, которые имеют более двух значений.
Со школы или даже раньше всем известно, что все вокруг, включая нас самих, состоит из их атомов — мельчайших и неделимых частиц. Из-за способности атомов соединяться друг с другом разнообразие нашего мира огромно. Способность этого химического элемента элемент образовывать связи с другими атомами называется валентностью элемента .
Инструкция по эксплуатации
Например, можно использовать два вещества — HCl и h3O.Всем хорошо известны соляная кислота и вода. Первое вещество содержит один атом водорода (H) и один атом хлора (Cl). Это говорит о том, что в этом соединении они образуют одну связь, то есть удерживают рядом с собой один атом. Следовательно, валентность и один и другой равны 1. Также легко определить валентность элемента, составляющих молекулу воды. Он содержит два атома водорода и один атом кислорода. Следовательно, атом кислорода образует две связи для присоединения двух атомов водорода, а они, в свою очередь, образуют одну связь.Означает валентность кислород 2, а водород 1.
Но иногда приходится сталкиваться с веществом, более сложным по строению и свойствам составляющих их атомов. Есть два типа элементов: с постоянной (кислород, водород и др.) И нестабильной валентностью у.е. Для атомов второго типа это количество зависит от соединения, в которое они входят. Пример — сера (S). Он может иметь валентности 2, 4, 6, а иногда даже 8. Определить способность таких элементов, как сера, удерживать другие атомы вокруг себя, немного сложнее.Для этого необходимо знать свойства других компонентов вещества .
Помните правило: произведение количества атомов на валентность одного элемента в смеси должно соответствовать тому же произведению для другого элемента. Это можно проверить, снова обратившись к молекуле воды (h3O):
2 (количество водорода) * 1 (его валентность ) = 2
1 (количество кислорода) * 2 (его валентность ) = 2
2 = 2 — значит все определяется правильно.
Теперь протестируйте этот алгоритм на более сложном веществе, например, N2O5 — оксиде азота. Ранее было указано, что кислород имеет постоянную валентность 2, следовательно, мы можем составить уравнение:
2 ( валентность кислорода) * 5 (его количество) = X (неизвестно валентность азота) * 2 (его количество)
Путем несложных арифметических расчетов можно определить, что валентность азота в составе этого соединения равна 5.
Валентность — это способность химических элементов удерживать определенное количество атомов других элементов.В то же время это количество связей, образованных данным атомом с другими атомами. Определить валентность довольно просто.
Инструкция по эксплуатации
Обратите внимание, что валентность атомов одних элементов постоянна, а других — переменная, то есть имеет тенденцию к изменению. Например, водород во всех соединениях одновалентен, так как образует только одну связь. Кислород может образовывать две связи, будучи двухвалентным. Но сера может иметь валентность II, IV или VI.Все зависит от элемента, с которым он соединяется. Таким образом, сера — это элемент с переменной валентностью.
Обратите внимание, что в молекулах соединений водорода вычислить валентность очень просто. Водород всегда одновалентен, и этот показатель для связанного с ним элемента будет равен количеству атомов водорода в данной молекуле. Например, в Cah3 кальций будет двухвалентным.
Запомните главное правило определения валентности: произведение валентности атома элемента и числа его атомов в молекуле всегда равно произведению валентности атома второго элемента и числа его атомов. атомы в данной молекуле.
Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V — валентность атомов элементов, а K — количество атомов в молекуле. С его помощью легко определить индекс валентности любого элемента, если известны другие данные.
Рассмотрим молекулу оксида серы SO2. Кислород во всех соединениях двухвалентный, поэтому подставляя значения в пропорцию: V кислорода x Кислород = V серы x Xer, получаем: 2 x 2 = V серы x 2.Отсюда V сера = 4/2 = 2. Таким образом, валентность серы в этой молекуле равна 2.
Похожие видео
Открытие периодического закона и создание упорядоченной системы химических элементов Менделеевым стало кульминацией развития химии в 19 веке. Ученый обобщил и систематизировал обширный материал знаний о свойствах элементов.
Инструкция по эксплуатации
В XIX веке не существовало представлений о строении атома.Дискавери Д.И. Менделеев был лишь обобщением экспериментальных фактов, но их физический смысл долгое время оставался непонятным. Когда появились первые данные о строении ядра и распределении электронов в атомах, это позволило по-новому взглянуть на периодический закон и систему элементов. Таблица D.I. Менделеев дает возможность наглядно проследить периодичность свойств элементов, встречающихся в природе.
Каждому элементу в таблице присвоен определенный порядковый номер (H — 1, Li — 2, Be — 3 и т. Д.).). Это число соответствует заряду ядра (количеству протонов в ядре) и количеству электронов, вращающихся вокруг ядра. Таким образом, количество протонов равно количеству электронов, и это говорит о том, что в нормальных условиях атом электрически нейтрален.
Разделение на семь периодов происходит согласно количеству энергетических уровней атома. Атомы первого периода имеют одноуровневую электронную оболочку, второго — двухуровневую, третьего — трехуровневую и т. Д.При заполнении нового энергетического уровня начинается новый период.
Первые элементы любого периода характеризуются атомами, имеющими один электрон на внешнем уровне — это атомы щелочных металлов. Периоды заканчиваются тем, что атомы благородных газов имеют внешний энергетический уровень, полностью заполненный электронами: в первом периоде инертные газы имеют 2 электрона, в последующих — 8. Именно из-за схожего строения электронных оболочек группы элементов обладают схожими физико-химическими свойствами.
В таблице Д.И. Менделеев имеет 8 основных подгрупп. Это число связано с максимально возможным количеством электронов на уровне энергии.
В основании периодической системы лантаноиды и актиниды выделяются как независимые ряды.
Используя таблицу D.I. Менделеев может наблюдать периодичность следующих свойств элементов: радиуса атома, объема атома; потенциал ионизации; силы сродства к электрону; электроотрицательность атома; степень окисления; физические свойства потенциальных соединений.
Четко прослеживаемая частота расположения элементов в таблице Д.И. Менделеева рационально объясняется последовательным характером заполнения энергетических уровней электронами.
Источники:
Периодический закон, лежащий в основе современной химии и объясняющий законы изменения свойств химических элементов, был открыт Д.И. Менделеева в 1869 году. Физический смысл этого закона раскрывается при изучении сложной структуры атома.
Одной из важных тем в изучении школьных предметов является курс валентности. Об этом и пойдет речь в статье.
Валентность — что это?
Валентность в химии означает свойство атомов одного химического элемента связывать с собой атомы другого элемента. В переводе с латинского — власть. Выражается в цифрах. Например, валентность водорода всегда будет равна единице. Если взять формулу вода — h3O, ее можно представить как H — O — N.Один атом кислорода мог связать с собой два атома водорода. Это означает, что количество связей, создаваемых кислородом, равно двум. И валентности этого элемента будет два.
В свою очередь, водород будет двухвалентным. Его атом может быть связан только с одним атомом химического элемента. В данном случае с кислородом. Более конкретно, атомы, в зависимости от валентности элемента, образуют пары электронов. Сколько таких пар образуется — такова будет валентность. Числовое значение называется индексом. Кислород имеет индекс 2.
Как определить валентность химических элементов по таблице Дмитрия Менделеева
Глядя на периодическую таблицу элементов, можно заметить вертикальные ряды. Их называют группами элементов. Валентность также зависит от группы. Элементы первой группы имеют первую валентность. Второй есть второй. Третий — третий. И так далее.
Есть также элементы с постоянным индексом валентности. Например, водород, галогенная группа, серебро и так далее.Их нужно выучить обязательно.
Как определить валентность химических элементов по формулам?
Иногда бывает сложно определить валентность по таблице Менделеева. Тогда вам нужно посмотреть на конкретную химическую формулу. Возьмем оксид FeO. Здесь, как в железе, так и в кислороде, показатель валентности будет равен двум. А вот в оксиде Fe2O3 — по-другому. Железо будет трехвалентным.
Всегда нужно помнить о разных методах определения валентности и не забывать о них.Знайте его постоянные числовые значения. Какие элементы у них есть. И, конечно же, воспользуйтесь таблицей химических элементов. А также изучить отдельные химические формулы. Лучше представить их в схематическом виде: H — O — H, например. Тогда связи видны. А количество тире (тире) будет числовым значением валентности.
.

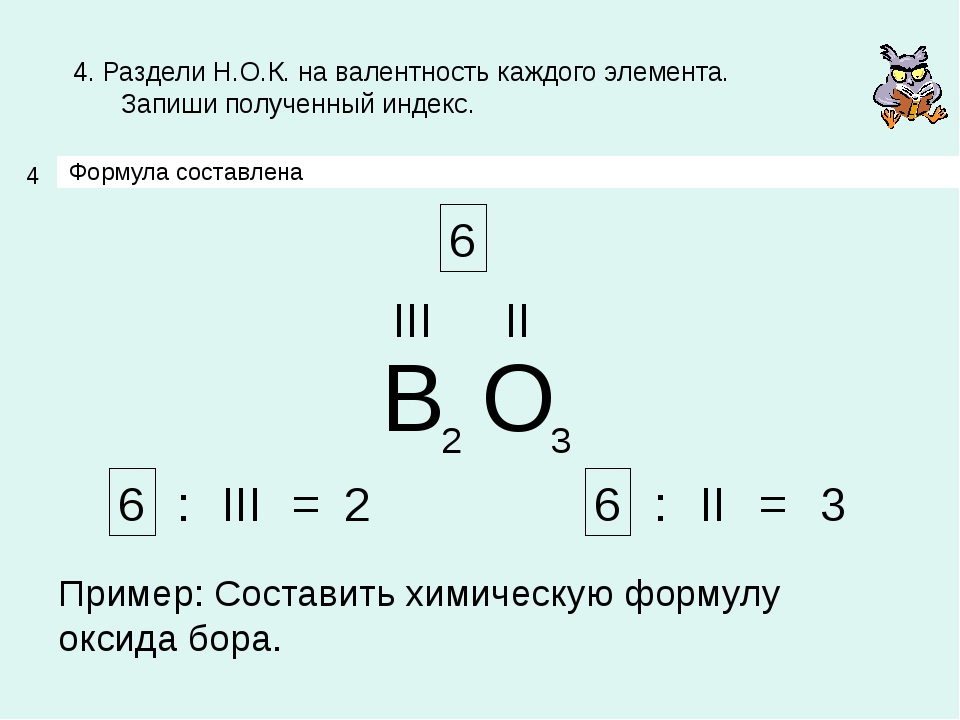


 Записать индексы при символах элементов
Записать индексы при символах элементов