Содержание
Соли: химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например, оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например, гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.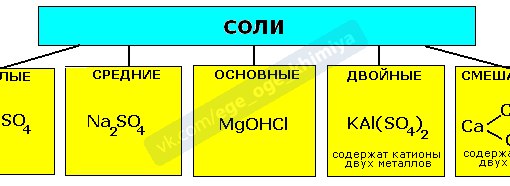
Например, гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например, гидроксид меди (II) реагирует с серной кислотой:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например, гидроксид цинка (II) реагирует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например, аммиак реагирует с соляной кислотой:
NH3 + HCl → NH4Cl
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например, соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например, гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
2NaOH + CO2 → Na2CO3 + H2O
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например, при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например, гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
Cu(OH)2 + CO2 ≠
Cu(OH)2 + SO3 → CuSO4 + H2O
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например, кислород окисляет сульфит натрия до сульфата натрия:
2Na2SO3 + O2 → 2Na2SO4
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
Таким способом можно получить только соли бескислородных кислот.
Например, сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например, железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например, хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
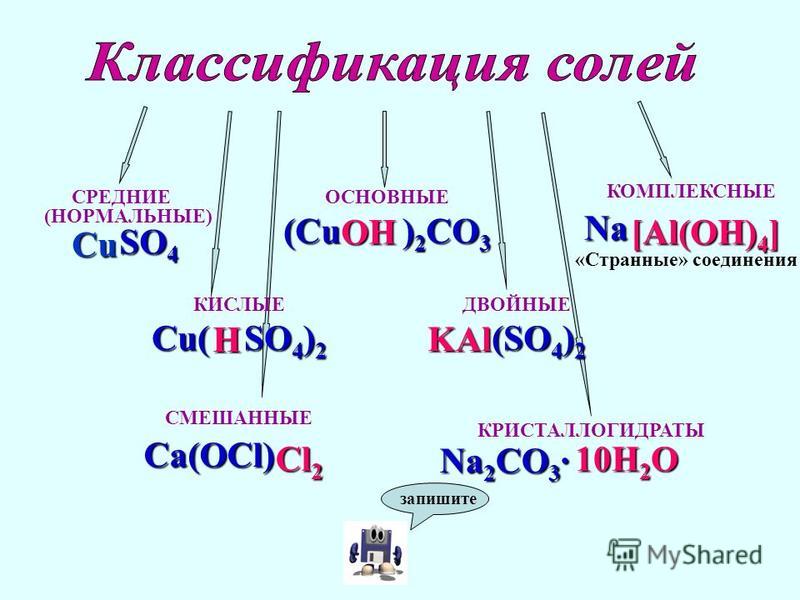
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например, хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca2+ + 2Cl–
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например, гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na+ + HCO3–
HCO3– → H+ + CO32–
Основные соли также диссоциируют ступенчато.
Например, гидроксокарбонат меди (II) диссоциирует в две ступени:
(CuOH)2CO3 → 2CuOH+ + CO32–
CuOH+ → Cu2+ + OH–
Двойные соли диссоциируют в одну ступень.
Например, сульфат алюминия-калия диссоциирует в одну ступень:
KAl(SO4)2 → K+ + Al3+ + 2SO42–
Смешанные соли диссоциируют также одноступенчато.
Например, хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca2+ + Cl— + ClO–
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например, тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
K[Al(OH)4] → K+ + [Al(OH)4]–
2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например, карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
K2CO3 + SiO2 → K2SiO3 + CO2↑
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
K2CO3 + Al2O3 → 2KAlO2 + CO2↑
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например, сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Хлорид аммония взаимодействует с гидроксидом натрия:
(NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например, гидрокарбонат калия взаимодействует с гидроксидом калия:
KHCO3 + KOH → K3CO3 + H2O
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например, сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например, гидрокарбонат калия взаимодействует с гидросульфатом калия:
KHSO4 + KHCO3 = H2O + CO2↑ + K2SO4
Некоторые кислые соли могут реагировать со своими средними солями.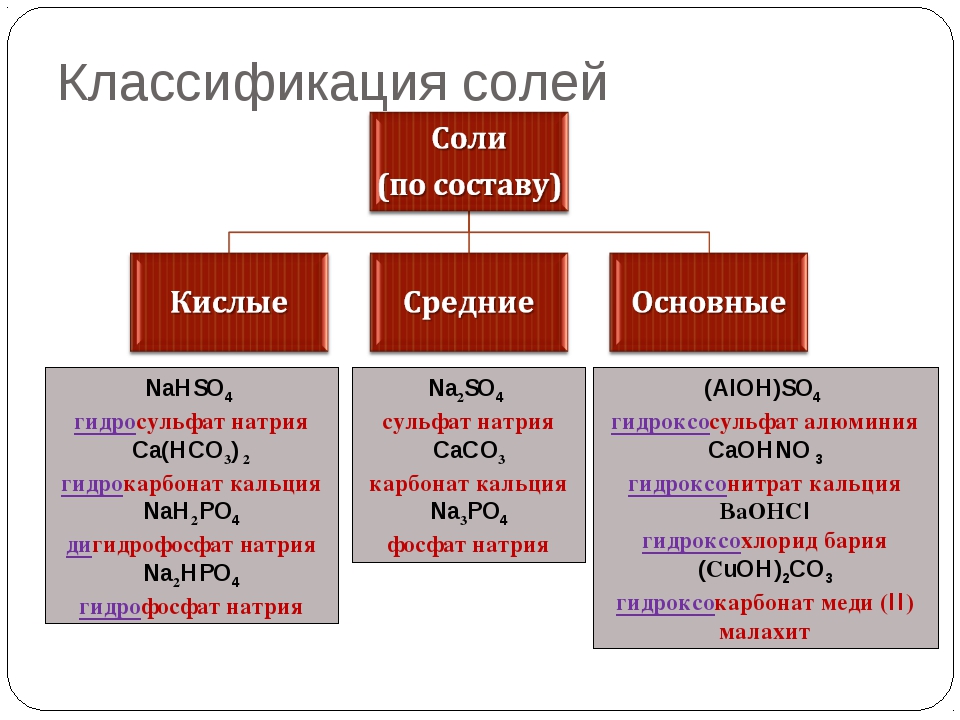
Например, фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
K3PO4 + KH2PO4 = 2K2HPO4
6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например, железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Соль1 + металл1 = соль2 + металл2
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например, при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например, нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
Cu(NO3)2, (расплав) + Fe ≠
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
7. Некоторые соли при нагревании разлагаются.
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2→ N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов.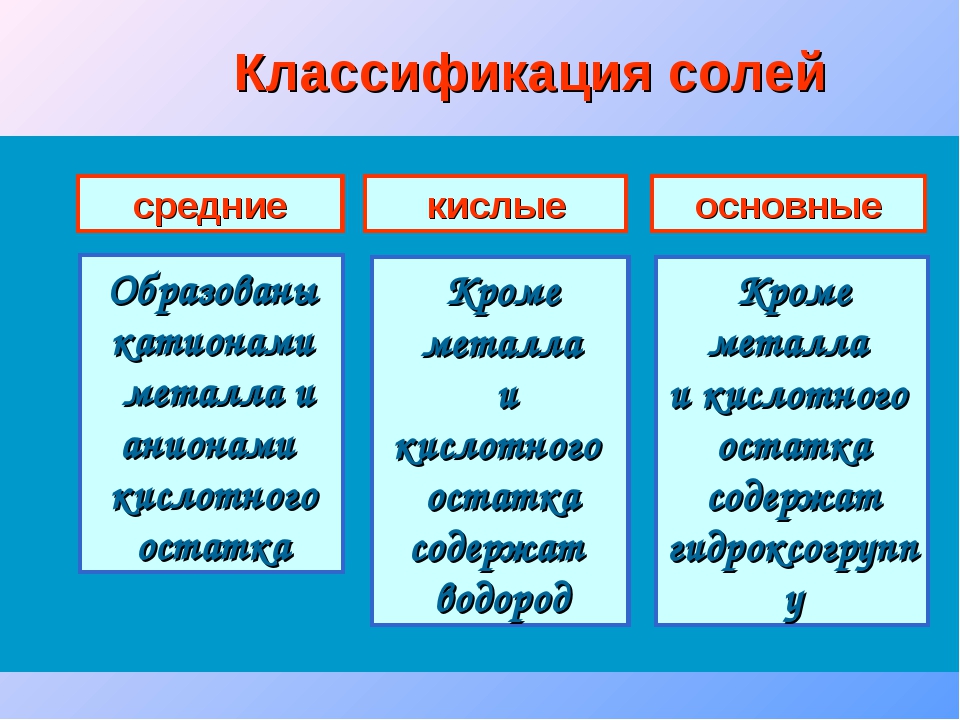 К ним относятся:
К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3+ HCl
(NH4)2CO3 → 2NH3+ CO2 + H2O
(NH4)2SO4→ NH4HSO4+ NH3
7. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например, йодид калия окисляется хлоридом меди (II):
4KI— + 2Cu+2 Cl2 → 4KCl + 2Cu+l + I20
8. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Химические свойства солей | Дистанционные уроки
26-Май-2013 | комментариев 6 | Лолита Окольнова
Задание А 11 ЕГЭ по химии —
Характерные химические свойства солей: средних, кислых, оснoвных, комплексных
Темы, которые нужно знать:
Сначала давайте рассмотрим классификацию солей:
Сначала рассмотрим общие химические свойства солей, затем разберем особенности кислых и основных.
1. Взаимодействие с металлами: реакция будет идти, если металл стоит в ряду напряжений левее катиона соли:
Na + AgCl = NaCl + Ag↓
2. Взаимодействие с основаниями: идет в том случае, если выделяется осадок, газ или малодиссоциирующее вещество:
Na2SO4 + Ba(OH)2 = BaSO4 ↓+ 2NaOH
3. Взаимодействие с кислотами: то же условие — выделение осадка, газа или малодиссоциирующего вещества:
CuS + 2HCl = CuCl2 + H2S↑
4. Cоли могут взаимодействовать между собой на тех же условиях: осадок, газ, малодиссоциирующее вещество:
СaCl2 + Na2CO3 = CaCO3 + 2NaCl
В химические свойства солей также входит диссоциация.
Диссоциация солей
В воде соли полностью (теоретически) или частично диссоциируют на ионы.
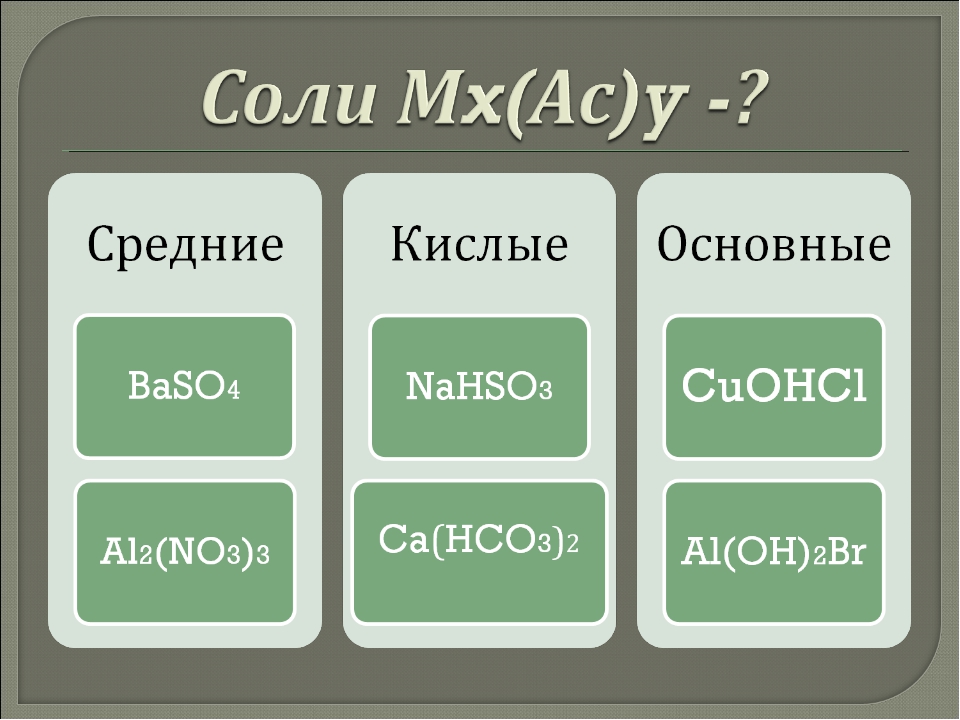
- Диссоциация средних солей: XA → X+ + A—
Na2SO4 → 2Na+ + SO42- - Диссоциация кислых солей: ХHA → X+ + HA— — первая ступень, вторая ступень: HA— = H + + A 2-
NaHSO4 → Na+ + HSO4—HSO4— = SO42- + H + - Диссоциация основных солей: Х(OH)A → X(OH)+ + A— — первая ступень, вторая ступень: X(OH)+ = X 2+ + OH —
MgOHCl → MgOH++Cl—
MgOH+ → Mg 2+ + OH —
Получение кислой соли из средней: средняя соль + соответствующая кислота: Na2CO3 + H2CO3 = 2NaHCO3
Получение основной соли из средней: средняя соль + соответствующее основание: CuCl2 + Cu(OH)2 = 2Cu(OH)Cl
Получение средней соли из основной: основная соль + соответствующая кислота: Cu(OH)Cl + HCl = CuCl2 + H2O
Получение средней соли из кислой: кислая соль + соответствуящее основание: NaHCO3 + NaOH = Na2CO3 + H2O
Химические свойства солей — гидролиз
Гидролиз средних солей мы уже рассматривали раньше (см. лекцию)
лекцию)
Химические свойства двойных солей
У двойных солей есть небольшая особенность — в реакцию всегда вступают оба катиона:
KCr(SO4)2 + 3KOH = Cr(OH)3 + 2K2SO4
Кстати, давайте разберем наш вопрос: с чем будет реагировать карбонат бария BaCO3
1) H2SO4 + NaOH — осадообразуется только с сульфат-ионом;
2) NaCl и CuSO4 — осадообразуется только с сульфат-ионом;
3) HCl и СH3COOH — BaCO3 + 2HCl = H2CO3 (= CO2 ↑+ H3 O)+ BaCl2
2CH3 COOH + BaCO3 = (CH3 COO)2 Ba + CO2 ↑+ H3 O
в обоих реакциях — выделение газа;
4) NaHCO3 и HNO3 — газ выделется только при взаимодействии с кислотой
Ответ: 3) HCl и СH3COOH
[TESTME 44]
Еще на эту тему:
Обсуждение: «Химические свойства солей»
(Правила комментирования)
Основные соли, Средние соли растворимость
Сероводородная кислота может реагировать с основаниями, основными окислами или солями, образуя два ряда солей средние — сульфиды, кислые — бисуль фиды (или гидросульфиды). Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды, как соли очень слабой кислоты подвергаются гидролизу. Например, сульфид натрия очень сильно гидролизуется, давая щелочной раствор (см. 6, гл. VH). [c.294]
Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды, как соли очень слабой кислоты подвергаются гидролизу. Например, сульфид натрия очень сильно гидролизуется, давая щелочной раствор (см. 6, гл. VH). [c.294]
При действии соды на растворимые соли магния получается не средняя соль, а смесь основных карбонатов. Эта смесь применяется в медицине под названием белой магнезии. [c.391]
При разложении смешанного алкоголята магния водой с выделением спирта образуется нерастворимая в воде осно ная соль магния. Это затрудняет отделение эфирного раствора спирта и последуюш,ую экстракцию эфиром водного слоя. Для перевода основной соли в растворимую среднюю обычно при разложении пользуются разбавленными растворами (5—10%) серной или соляной кислот. В случае третичных спиртов необходимо учитывать легкость замеш,ения гидроксильной группы на галоген при взаимодействии их с галогеноводородными кислотами, а также легкую дегидратацию под действием серной кислоты. Поэтому при синтезе третичных спиртов разложение реакционного комплекса рекомендуется проводить насыщенным раствором хлористого аммония. [c.216]
Поэтому при синтезе третичных спиртов разложение реакционного комплекса рекомендуется проводить насыщенным раствором хлористого аммония. [c.216]
Поскольку основные соли обычно менее растворимы, чем средние соли сильных кислот, равновесие гидролиза и осаждения будет смещаться, приводя к получению средних солей. [c.257]
Карбонат-ион является анионом угольной кислоты, которая принадлежит к числу слабых кислот Ki = = 4,5-10 , /(2=4,8-10- ). Карбонаты щелочных металлов в водных растворах, подвергаясь сильному гидролизу, имеют высокое значение pH (8,5—12,0). Из средних солей растворимы в воде только соли калия, натрия и аммония. Остальные катионы образуют с СО3- нерастворимые средние и основные соли. Катионы в степени окисления — -3 и выше, как правило, с карбонатами щелочных металлов образуют гидроксиды А1(0Н)з, Ре(ОН)з и др. [c.268]
Угольная кислота образует средние соли — карбонаты и кислые — бикарбонаты. Из средних солей растворимы в воде только соли калия,, натрия и аммония. Бикарбонаты щелочных металлов менее растворимы, чем средние соли. Остальные катионы осаждаются ионом СО » в виде не растворимых в воде средних или основных солей или в виде гидроксидов (АР+, Сг +). [c.302]
Бикарбонаты щелочных металлов менее растворимы, чем средние соли. Остальные катионы осаждаются ионом СО » в виде не растворимых в воде средних или основных солей или в виде гидроксидов (АР+, Сг +). [c.302]
Обработанный соляной кислотой остаток оставляют на 10—15 мин. в покое, для того чтобы нерастворимые основные соли возможно полнее перешли в растворимые средние соли. Затем наливают в чашку около 50 мл горячей воды, тш,ательно перемешивают содержимое чашки стеклянным пестиком и приступают к фильтрованию. [c.465]
Следует отметить, что соли кислые и основные обычно существенно отличаются по растворимости от средних солей. Так, кислые соли щелочно-земельных металлов имеют значительно большую растворимость, чем средние соли, а основные —наоборот. [c.136]
При разложении смешанного алкоголята магния водой с выделением спирта образуется нерастворимая в воде основная соль магния. Это затрудняет отделение эфирного раствора спирта и последующую экстракцию эфиром водного слоя. Для перевода основной соли в растворимую среднюю обычно при разложении пользуются разбавленными растворами (5—10%) серной или соляной кислот. В случае третичных спиртов необходимо учитывать легкость замещения гидроксильной группы на галоген при взаимодействии их с галогеноводородными кислотами, а также легкую дегидратацию под действием [c.201]
Для перевода основной соли в растворимую среднюю обычно при разложении пользуются разбавленными растворами (5—10%) серной или соляной кислот. В случае третичных спиртов необходимо учитывать легкость замещения гидроксильной группы на галоген при взаимодействии их с галогеноводородными кислотами, а также легкую дегидратацию под действием [c.201]
К малорастворимым, более конденсированным системам можно прийти через растворы солей, которые существуют. в кислой или щелочной среде. Минимальная степень полимеризации (ассоциации), достаточно высокая подвижность системы, наличие функциональных групп НзО» «, ОН и другие факторы обеспечивают этим солям и высокие адгезионные свойства менее растворимые соединения в момент выпадения обладают максимальной дисперсностью, а поэтому и максимальной адгезией. Если с таких позиций рассмотреть ряд химических соединений средняя соль — основная соль — гидроксид, то, опираясь на подход Тило и принцип аналогии, можно прогнозировать новые связки [96]. В качестве последних можно применять растворы гидроксосолей, которые способны образовывать в растворе многоядерные комплексные соединения, относящиеся к группе координационных полимеров. В зависимости от pH раствора, концентрации, температуры можно получать от средней соли Мд А до гидроксида [М(ОН)р непрерывный ряд полимерных солей состава М (ОН)рЛ и далее, переходя к более щелочной среде,— растворимые гидроксосоли состава К [М (ОН)р] и те, и другие можно использовать как минеральные связующие. [c.63]
В качестве последних можно применять растворы гидроксосолей, которые способны образовывать в растворе многоядерные комплексные соединения, относящиеся к группе координационных полимеров. В зависимости от pH раствора, концентрации, температуры можно получать от средней соли Мд А до гидроксида [М(ОН)р непрерывный ряд полимерных солей состава М (ОН)рЛ и далее, переходя к более щелочной среде,— растворимые гидроксосоли состава К [М (ОН)р] и те, и другие можно использовать как минеральные связующие. [c.63]
Средняя азотномедная соль Си№0 ЗНЮ получается в виде расплывающейся и растворимой в спирте соли голубого цвета, при испарении растворов меди или окиси меди в азотной кислоте. Она столь легко разлагается при действии жара, что из нее нет возможности выделить кристаллизационную воду до начала разложения. При накаливании средней соли, образующаяся окись меди вступает в соединение с остальною нераз-ложившеюс.ч среднею солью и дает основную соль uN-0 2 u№0 . Та же самая основная соль получается, если к раствору средней соли прибавить некоторое количество щелочи или водной окисн меди, а также углемедвой соли даже при кипячении с металлическою медью средняя соль разлагается, образуя основную соль в виде зеленого порошка, легко разлагающегося при действии жара и остав. яющего окись меди. Соль, имеющая состав u№0 3 u№0 , в воде почти нерастворима. [c.638]
яющего окись меди. Соль, имеющая состав u№0 3 u№0 , в воде почти нерастворима. [c.638]
АЦЕТАТЫ — соли и эфиры уксусной к-ты ниже рассмотрены только соли. Щелочные и щелочноземельные металлы об]разуют с уксусной к-той средние сопи, металлы больпгей валентности образуют обычно основные соли.. А. легко растворимы в воде, за иск,шо-чением ацетата серебра и нек-рых основных солей, нанр. Сн , Ti,Zг, В1. Растворимость нек-рых А. [c.171]
Карбонат-ион является анионом угольной кислоты Н2СО3. Эта кислота в свободном состоянии неизвестна. При получении ее в свободном состоянии она почти полностью распадается на ангидрид СОг и воду. Так как Н2СО3 весьма слабая кислота, карбонаты щелочных металлов имеют щелочную реакцию. Из средних солей растворимы в воде только соли калия, натрия и аммония Катионы остальных групп осаждаются ионом СОа в виде средних или основных солей, а некоторые (например, А1+ , Сг , Т » ) — в виде гидроокисей. Ион СОз бесцветен. [c.322]
[c.322]
При кипячении водного раствора таурина с избытком суспензии окиси ртути получается не растворимая в воде основная соль состава Nh3Gh3 HiSO,)2Hg HgO, но при избытке таурина образуется растворимая средняя соль. Ланг [174] приготовил различные соли других тяжелых металлов. [c.135]
Основные механизмы выведения тяжелых металлов из атмосферы -вымывание с атмосферньпэлементы присутствуют в растворимой (соли, комплексные ионы) и малорастворимой формах. Соединения ртуги в атмосферных осадках классифицируются на две фуппы Первая группа п]эедставлена ее элементной формой и органическими соединениями (например, Hg( Hз)2), а вторая — неорганическими производными (например, Hg2 l2). Основное количество ртути в осадках содержится в виде металлорганических соединений. Следует заметить, что в атмосферных осадках, как правило, преобладают водорастворимые формы тяжелых металлов, что, вероятно, обусловлено наличием в атмосфере кислых оксидов серы и азота, способствующих образованию растворимых соединений.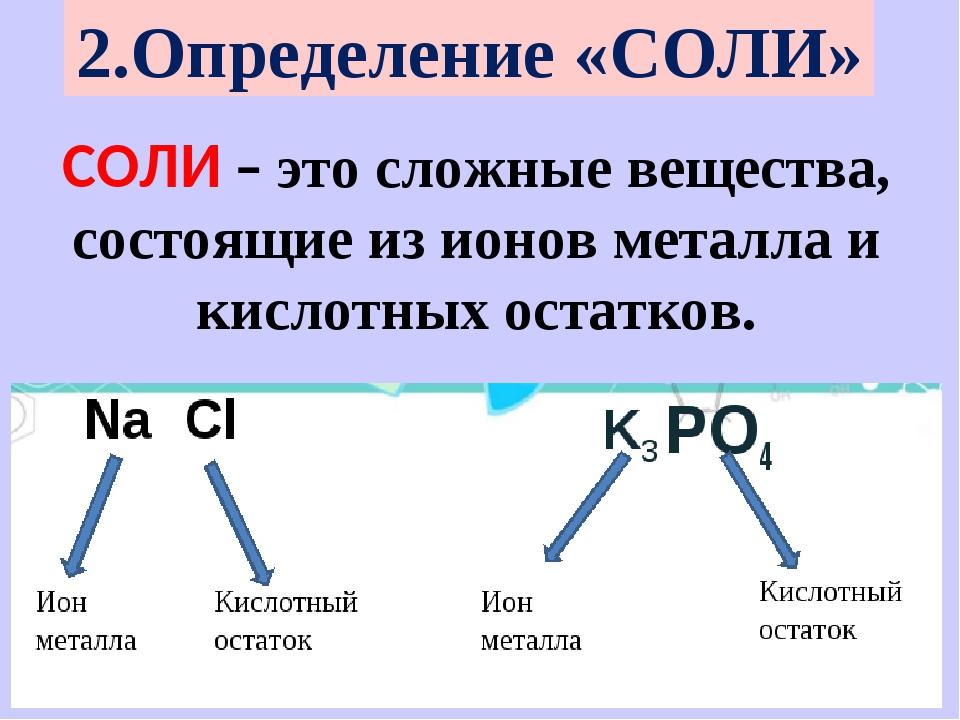 По степени обогащения атмосферных осадков металлы располагаются в следующем порядке 7п > РЬ > Сё > N1 В работе [197] показано, что средние уровни свинца в осадках составляют 12 мкг/л, адя сельских районов (не подверженных урбанизации) 0,09 мкг/л для полярных областей и акваторий океанов 44 мкг/л для урбанизированных районов. [c.105]
По степени обогащения атмосферных осадков металлы располагаются в следующем порядке 7п > РЬ > Сё > N1 В работе [197] показано, что средние уровни свинца в осадках составляют 12 мкг/л, адя сельских районов (не подверженных урбанизации) 0,09 мкг/л для полярных областей и акваторий океанов 44 мкг/л для урбанизированных районов. [c.105]
В инженерной практике следует помнить, что растворы средних солей далеко не всегда имеют нейтральную реакцию и pH может быть больше или меньше 7 а это определяет агрессивность среды при коррозионных процессах. Кроме того, для создания оптически прозрачных растворов некоторых солей, например uSO , следует подавлять обратимую реакцию гидролиза добавлением кислоты, так как основные соли, а тем более гидроксиды металлов трудно растворимы и будут создавать рассеяние света. [c.215]
Большая часть алкалоидов — кристаллические вещества с определенной температурой плавления, реже встречаются жидкие алкалоиды, например никотин, анабазин, обладающие летучестью. В виде свободных оснований алкалоиды обычно мало растворимы в воде, но легко растворяются в органических растворителях (спирт, эфир, хлороформ и др.). Почти все алкалоиды не обладают запахом, исключение представляют кониин, никотин, анабазнн и некоторые другие. Многие алкалоиды оптически активны. С кислотами алкалоиды образуют соли, большей частью растворимые в воде. Прн наличии одного атома азота в молекуле они присоединяют одну молекулу одноосновной кислоты при наличии двух атомов азота они способны присоединять одну или две молекулы одноосновной кислоты, образуя кислые и средние соли, что сказывается на константах их диссоциации. Являясь слабыми основаниями, алкалоиды образуют с кислотами легко диссоциирующие соли, разлагающиеся под влиянием едких щелочей, аммиака, а иногда карбонатов и окиси магния при этом выделяются свободные основания. Некоторые алкалоиды, помимо основных свойств, характеризуются реакциями, зависящими от наличия в их молекуле функциональных групп, например фенольной (у морфина, сальсолина), кетонной (у лобелина), ви-нильной (у хгнина) и др.
В виде свободных оснований алкалоиды обычно мало растворимы в воде, но легко растворяются в органических растворителях (спирт, эфир, хлороформ и др.). Почти все алкалоиды не обладают запахом, исключение представляют кониин, никотин, анабазнн и некоторые другие. Многие алкалоиды оптически активны. С кислотами алкалоиды образуют соли, большей частью растворимые в воде. Прн наличии одного атома азота в молекуле они присоединяют одну молекулу одноосновной кислоты при наличии двух атомов азота они способны присоединять одну или две молекулы одноосновной кислоты, образуя кислые и средние соли, что сказывается на константах их диссоциации. Являясь слабыми основаниями, алкалоиды образуют с кислотами легко диссоциирующие соли, разлагающиеся под влиянием едких щелочей, аммиака, а иногда карбонатов и окиси магния при этом выделяются свободные основания. Некоторые алкалоиды, помимо основных свойств, характеризуются реакциями, зависящими от наличия в их молекуле функциональных групп, например фенольной (у морфина, сальсолина), кетонной (у лобелина), ви-нильной (у хгнина) и др.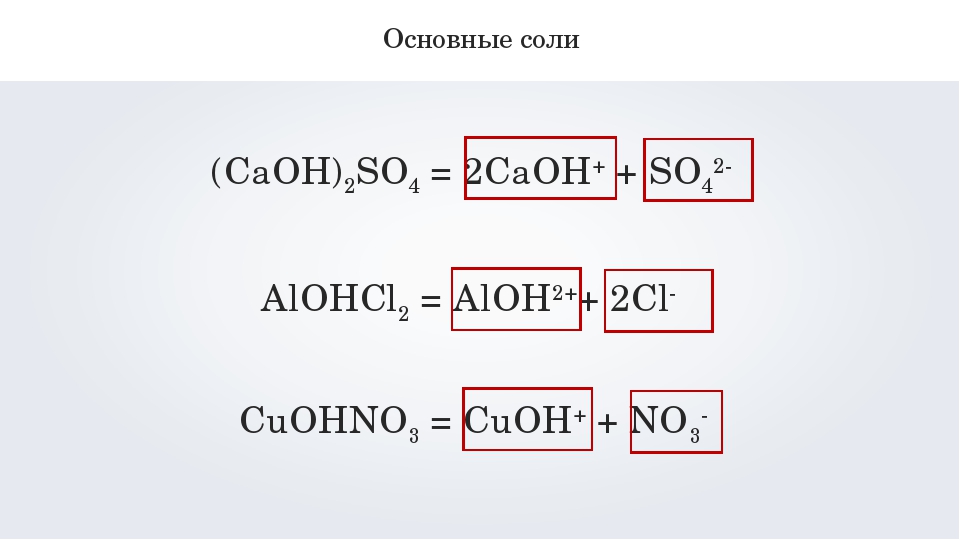 , что отражается на нх химических свойствах. Напрнмер, морфин растворяется в растворах едких щелочей, лобелии образует карбонильные производные, хинин присоединяет водород, галогены и др. [c.418]
, что отражается на нх химических свойствах. Напрнмер, морфин растворяется в растворах едких щелочей, лобелии образует карбонильные производные, хинин присоединяет водород, галогены и др. [c.418]
В качестве ингибитора коррозии углеродистой стали в рассолах a lj хорошо зарекомендовали себя сахараты кальция [6, 21, 29]. Щелочноземельные металлы в большинстве случаев образуют плохо растворимые в воде сахараты за исключением кальция, который дает хорошо растворимые средние — СаСх, кислые — Са (НСх)а и основные — (СаОН)аСх соли. Сахараты могут быть получены растворением в воде, содержащей 7—10 % сахарозы ( jaHaaOn). При ЭТОМ растворимость СаО возрастает с увеличением концентрации сахарозы и уменьшается с повышением температуры [30]. [c.332]
Серная кислота образует два ряда солей — средние (или нормальные сульфаты) и кислые (или бисульфаты). Нормальные сульфаты — в основном бесцветные, легкокристаллизующиеся и легкорастворимые в воде вещества труднорастворимы из практически важных солей являются сульфаты кальция и свинца, практически нерастворим сульфат бария. Кислые сульфаты известны только для щелочных металлов, оки хорошо растворимы в воде. Растворы смесей сульфатов с бисульфатами обладают буферными свойствами. [c.28]
Кислые сульфаты известны только для щелочных металлов, оки хорошо растворимы в воде. Растворы смесей сульфатов с бисульфатами обладают буферными свойствами. [c.28]
На рис. 4.4 представлена оптическая модель структурных характеристик тропосферного аэрозоля для летних условий в средних широтах. Она включает вертикальные профили оптической плотности фонового аэрозоля, представленного его тонкодисперсной фракцией, растворимых соединений солей (в основном (Nh5)2S04), фракций грубодисперсного пылевого аэрозоля и пылевого аэрозоля средней дисперсности. Оптические характеристики фонового тонкодисперсного аэрозоля затабулированы в табл. 4.9, а солевого — в табл. 4.11. Грубодисперсная фракция пылевого аэрозоля отвечает модели 9 микроструктуры (по табл. 2.6), а фракция средней дисперсности — модели 3 (по табл. 2.6). [c.168]
В исследованиях АКХ МЖКХ РСФСР и ВНИИ ВОДГЕО выяснилось что полнота извлечения коагулянта из осадков при обработке их кислотами зависит от их химического состава, структуры и формы содержащегося в них оксида алюминия.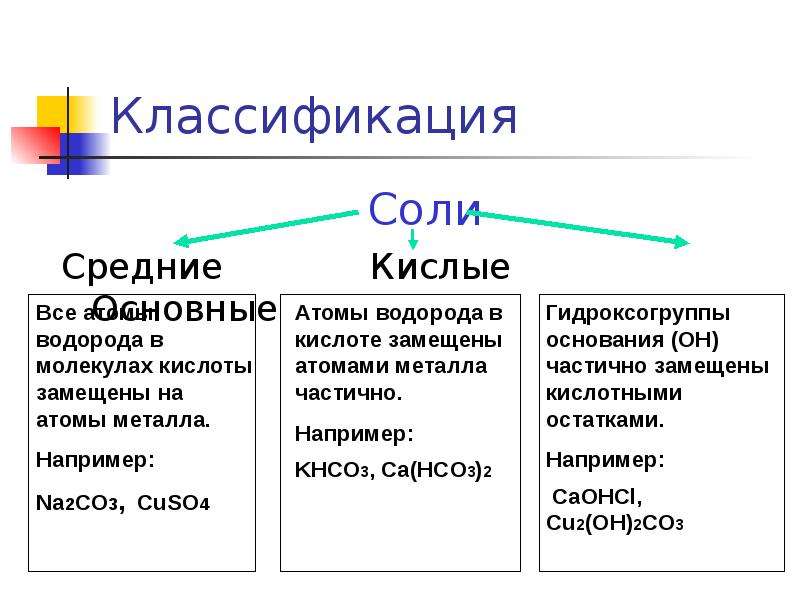 Аморфный осадок легко, а кристаллический — трудно растворим в кислотах. Хорошо растворимые в кислотах формы оксида алюминия сохраняются в осадках в течение 15—30 дней после их образования. При обработке осадков серной или соляной кислотой образуется А1г(504)з или А1С1з в определенных условиях могут быть получены основные соли А12(0Н)5С1 и А12(0Н)4304, которые обладают более эффективным действием, чем средние соли. [c.933]
Аморфный осадок легко, а кристаллический — трудно растворим в кислотах. Хорошо растворимые в кислотах формы оксида алюминия сохраняются в осадках в течение 15—30 дней после их образования. При обработке осадков серной или соляной кислотой образуется А1г(504)з или А1С1з в определенных условиях могут быть получены основные соли А12(0Н)5С1 и А12(0Н)4304, которые обладают более эффективным действием, чем средние соли. [c.933]
Твердый основной хлорид алюминия получают периодическим нагреванием и охлаждением водного раствора А1С1з (пат. 49—43478 Япония). При охлаждении горячего раствора до 70 °С отделяют избыток средней соли. При О °С образуются затравочные кристаллы, на которых при 30—40 °С кристаллизуется продукт состава А1з(0Н)5С14-пН20 п = = 9- 11). Кипячением растворов хлорида алюминия в течение 2—4 ч в сосуде с обратным холодильником и последующей сушкой распылением получают основные хлориды алюминия, растворимые в спиртах. Содержание воды в продукте составляет 18—20 %, отношение А1/С1 изменяется в пределах от 1/2 до 2/1 (пат. 3904741 США). Процесс получения основных хлоридов алюминия можно представить как направленный гидролиз по реакциям [c.93]
3904741 США). Процесс получения основных хлоридов алюминия можно представить как направленный гидролиз по реакциям [c.93]
Показано также [63, 64], что полнота извлечения коагулянта из осадков при обработке их кислотами зависит от химического состава осадков и структуры содержащейся в них окиси алюминия, которая может находиться в аморфной и кристаллической форме. Первая форма хорошо, а вторая — плохо растворяется в кислотах. Хорошо растворимые в кислотах формы окиси алюминия сохраняются в осадках в течение 15—30 дней. При обработке осадков серной или соляной кислотами образуются средние соли А12(504)з или А1С1з, в определенных условиях могут быть получены основные соли А12(ОН)5С1 и А12(0Н)45 04, обладающие более эффективным действием, чем средние соли. [c.154]
Уравнение (4.17) было решено методом проб и ошибок для значения pH, соответствующего минимуму растворимости фосфата, около 6. При рНтвердая фаза состоит главным образом из основного фосфата алюминия, при больших значениях pH более стабилен гидроксид алюминия.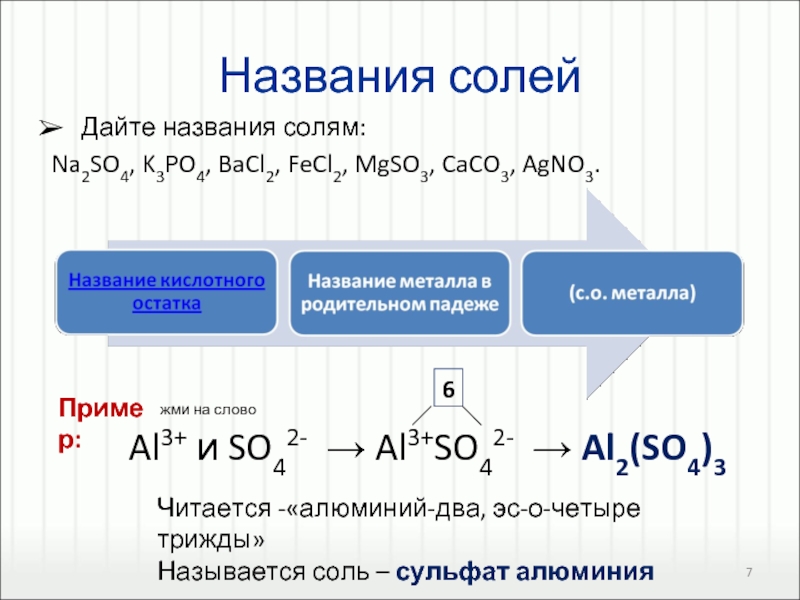 Концентрации различных соединений фосфата и иона алюминия при значении pH, соответствующем минимуму растворимости фосфата, приведены в табл. 4.5. Стумм [23] вычислил, что для минимума растворимости фосфата рНя= 6. Однако его расчет базировался на химической модели системы, которая включала среднюю соль. [c.62]
Концентрации различных соединений фосфата и иона алюминия при значении pH, соответствующем минимуму растворимости фосфата, приведены в табл. 4.5. Стумм [23] вычислил, что для минимума растворимости фосфата рНя= 6. Однако его расчет базировался на химической модели системы, которая включала среднюю соль. [c.62]
И стехиометрический состав осаждаемого фосфата алюминия не могут быть определены только из данных о растворимости. Кроме того, в нескольких исследованиях, в которых данные о растворимости были получены для интервала pH, не совпадающего с интервалом pH осаждения гидроксида алюминия, рассчитанное произведение растворимости среднего фосфата было значительно больше. Например, Макитис [25] вычислил рПР для средней соли равным 18,6 в области рН = 4—5 и 23,7 при pH = 2,9. В этой работе вывод об образовании основной соли был сделан на основании данных о растворимости и данных об изменении pH при титровании, полученных вне области pH осаждения гидроксида алюминия. [c.63]
[c.63]
В кислых растворах с избытком алюминия наиболее устойчивой твердой фазой является основной фосфат алюминия. Если значение pH больше, чем pH, соответствующее минимуму растворимости фосфата (pH = 6), то основная соль гидролизуется до гидроксида алюминия, на поверхности которого сорбируется фосфат. При большой концентрации фосфата выделяется в осадок таранакит, который переходит в среднюю соль, если pH системы возрастает. [c.63]
Сокращение потребления соли
Наращивание производства пищевых продуктов все более глубокой переработки, быстрая урбанизация и изменение образа жизни меняют тенденции в области питания. Доступность и ценовая приемлемость продуктов, прошедших глубокую технологическую переработку, повышаются.
Во всем мире население потребляет все больше высококалорийной пищи со значительным содержанием насыщенных жиров, трансжиров, сахаров и соли. Соль является основным источником натрия, при этом установлена связь между повышенным потреблением натрия
и гипертонией, а также увеличением риска сердечно-сосудистых заболеваний и инсульта.
Одновременно, по мере отхода от привычных схем питания снижается потребление ключевых составляющих здорового рациона — фруктов, овощей и пищевых волокон (в частности, цельных злаков). Фрукты и овощи содержат калий, способствующий снижению кровяного
давления.
Роль переработанных пищевых продуктов как источника соли в рационе объясняется тем, что содержание соли в них особенно высоко (в случае готовых блюд, мясопродуктов, таких как бекон, ветчина и сырокопченая колбаса, сыров, соленых снеков, лапши быстрого
приготовления и т.д.), а также тем, что они потребляются часто и в больших количествах (в случае хлеба и переработанных зерновых продуктов). Соль также добавляется в пищу во время приготовления (в виде бульонных кубиков) или уже на столе (в виде соевого
или рыбного соуса и пищевой соли).
Вместе с тем многие производители меняют рецептуру своей продукции для сокращения содержания соли, и потребителям рекомендуется обращать внимание на этикетки продуктов и выбирать продукты с низким содержанием натрия.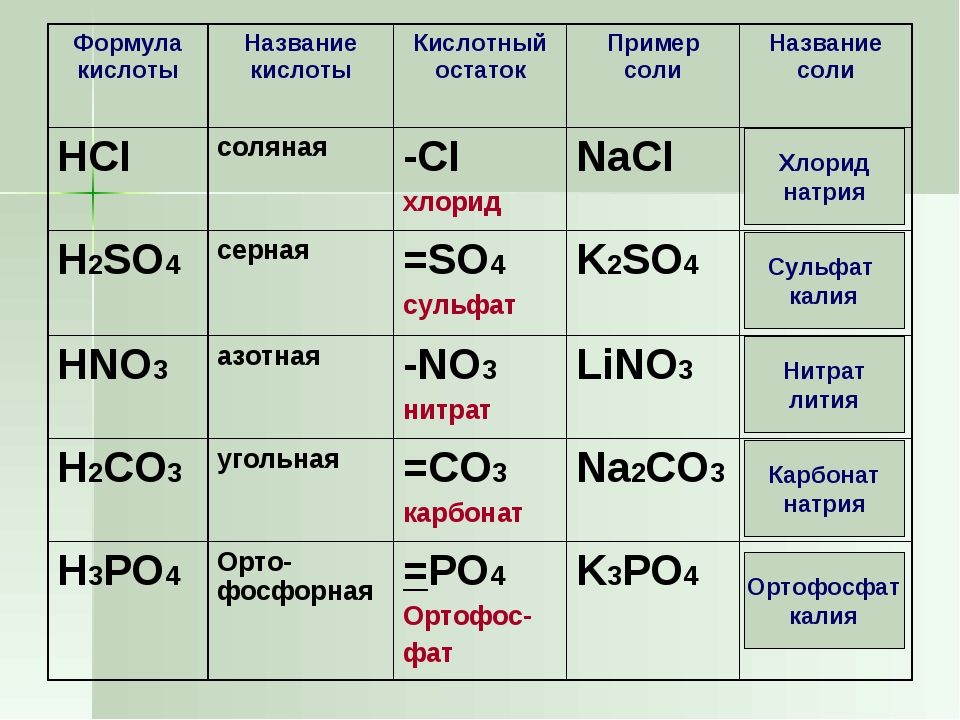
Рекомендации по снижению потребления соли
- Взрослые. ВОЗ рекомендует взрослым потреблять менее 5 г соли в день (чуть меньше одной чайной ложки) (1).
- Дети. Для детей в возрасте от двух до 15 лет ВОЗ рекомендует корректировать рекомендованное максимальное потребление соли в сторону уменьшения исходя из их потребностей в энергии по сравнению с взрослыми. Эта рекомендация в отношении детей не
охватывает период исключительно грудного вскармливания (0–6 месяцев) или период прикорма при продолжающемся грудном вскармливании (6–24 месяца). - Вся потребляемая соль должна быть йодированной, т.е. обогащенной йодом, который имеет важнейшее значение для здорового развития головного мозга у плода и у детей младшего возраста и общего укрепления психических функций у всех людей.
Информация о соли, натрии и калии
- Натрий является важнейшим биогенным элементом, необходимым для поддержания объема плазмы крови и водно-щелочного баланса, передачи нервных импульсов и нормального функционирования клеток.

- Избыток натрия сопровождается негативными последствиями для здоровья, в том числе повышением кровяного давления.
- Основные источники потребления натрия в пище определяются культурными особенностями и кулинарными предпочтениями населения.
- Натрий естественным образом содержится в целом ряде продуктов питания, таких как молоко, мясо и морепродукты. Он нередко встречается в большом количестве в переработанных пищевых продуктах, таких как хлебобулочные изделия, мясопродукты и снеки, а
также во вкусовых добавках к пище (например, соевом и рыбном соусах). - Натрий содержится также в глутамате натрия, который используется в качестве пищевой добавки во многих регионах мира.
- Калий — важнейший микроэлемент, необходимый для поддержания общего объема жидкостей в организме, кислотного и водно-электролитного баланса и нормального функционирования клеток.
- Калий содержится в самых разнообразных необработанных пищевых продуктах, особенно фруктах и овощах.

- Установлено, что увеличение потребления калия снижает систолическое и диастолическое давление у взрослых людей.
Как сократить потребление соли с продуктами питания
Государственная политика и стратегии должны обеспечивать создание условий, позволяющих населению потреблять достаточное количество безопасных и питательных продуктов, составляющих основу здорового рациона, к которым относятся продукты с низким содержанием
соли. Оздоровление привычек в области питания является обязанностью не только общества, но и каждого человека. Эта задача должна решаться с учетом характеристик и культурных особенностей населения и с участием целого ряда секторов.
Можно выделить следующие ключевые стратегии общего характера по сокращению потребления соли:
- политика государства, в том числе надлежащая налоговая политика и регулирование, обеспечивающие поставку производителями и розничными предприятиями более здоровых продуктов питания и расширение ассортимента доступной и недорогой здоровой пищевой продукции;
- взаимодействие с частным сектором для обеспечения поставок и повышения доступности продуктов с низким содержанием соли;
- информирование и расширение прав и возможностей потребителей методами социального маркетинга и мобилизации для повышения их осведомленности о необходимости сокращать потребление соли;
- создание благоприятных предпосылок для сокращения потребления соли за счет инициатив в области местной политики и содействие формированию «сред здорового питания», в частности на уровне школ, общин и городов;
- мониторинг потребления соли населением, источников соли в рационе питания, а также уровня осведомленности, установок и поведения людей в отношении этой проблемы для учета полученных данных при принятии решений о мерах политики.

Программы сокращения потребления соли и программы, направленные на обогащение соли, вкусовых добавок и приправ с высоким содержанием соли (бульонных кубиков, соевого и рыбного соусов) питательными микроэлементами, могут дополнять друг друга.
Потребление соли дома можно сократить, если:
- не солить блюда во время их приготовления;
- не держать на обеденном столе солонку;
- ограничить потребление соленых снеков;
- выбирать продукты с низким содержанием натрия.
Сокращению потребления соли способствует целый ряд других практических мер местного уровня:
- включение вопросов сокращения потребления соли в программы обучения работников пищевой промышленности и общественного питания;
- изъятие солонок и соевого соуса со столов на предприятиях общественного питания; размещение уведомлений о том, что определенная продукция содержит много натрия на упаковке или на полках магазинов;
- предоставление специальных рекомендаций в отношении питания посетителям учреждений здравоохранения;
- разъяснительная работа о необходимости сокращения потребления соли и ограниченном ее использовании при приготовлении пищи;
- разъяснительная работа с детьми и создание для детей обстановки, способствующей формированию у них привычки к низкосолевому рациону уже в молодом возрасте.

Действия пищевой промышленности должны включать в себя:
- постепенное сокращение содержания соли в продукции с течением времени, с тем чтобы потребители привыкли к ее вкусу постепенно, не переходя на альтернативную продукцию;
- пропаганду преимуществ употребления продуктов питания с пониженным содержанием соли в рамках информационных мероприятий для потребителей на предприятиях общественного питания и в магазинах;
- сокращение содержания соли в пищевых продуктах и блюдах, предлагаемых ресторанами и службами питания, и указание содержания натрия в них.
Заблуждения о сокращении потребления соли
- «В жаркий и влажный день человек потеет, и в его пище должно быть больше соли». Потея, организм теряет совсем немного соли, поэтому даже в условиях жары и высокой влажности лишняя соль не нужна; однако важное значение имеет обильное
питье. - Морская соль не «полезнее» промышленно произведенной лишь потому, что «создана природой».
 Независимо от происхождения соли, негативные последствия для здоровья вызывает содержащийся в ней натрий.
Независимо от происхождения соли, негативные последствия для здоровья вызывает содержащийся в ней натрий. - Добавление соли при приготовлении пищи — не основной источник потребляемой соли. Во многих странах примерно 80% соли в рационе потребляется в составе промышленно переработанных пищевых продуктов.
- Чтобы придать пище приятный вкус, не обязательно использовать соль. Вкусовые рецепторы человека адаптируются не сразу, но, привыкнув к пониженному потреблению соли, он с большей вероятностью будет получать удовольствие от пищи и чувствовать
более широкий диапазон вкусов. - «Пища без соли кажется пресной». Поначалу это может быть и так, однако вскоре вкусовые рецепторы адаптируются к уменьшению содержания соли, и человек привыкает ценить менее соленую, но более выраженную во вкусовом отношении пищу.
- «Пища, в которой много соли, соленая на вкус». Некоторые продукты питания с высоким содержанием соли не имеют выраженного соленого вкуса, потому что он сочетается с другими, маскирующими соленость ингредиентами, например, сахарами.
Чтобы выяснить содержание натрия в продуктах питания, необходимо обращать внимание на этикетки. - «Беспокоиться о количестве потребляемой соли стоит только пожилым людям». Избыточное потребление соли может приводить к повышению кровяного давления у лиц любого возраста.
- «Сокращение потребления соли может плохо повлиять на мое здоровье». Потреблять слишком мало соли очень трудно, потому что она содержится в большом количестве повседневных продуктов питания.
Деятельность ВОЗ
В руководствах ВОЗ о потреблении натрия и калия определены предельные значения их потребления без ущерба для здоровья. В руководствах также описываются меры по оздоровлению питания и профилактике НИЗ у взрослых и детей.
В 2004 г. Всемирная ассамблея здравоохранения приняла Глобальную стратегию по питанию, физической активности и здоровью. Она содержит призыв к правительствам, ВОЗ, международным партнерам, частному сектору и гражданскому обществу принимать меры в
поддержку здорового питания и физической активности на глобальном, региональном и местном уровнях.
В 2010 г. Всемирная ассамблея здравоохранения одобрила свод рекомендаций в отношении маркетинга продуктов питания и безалкогольных напитков, ориентированного на детей. Рекомендации служат странам ориентиром при выработке новых и укреплении существующих
мер политики по уменьшению негативных последствий маркетинга вредных для здоровья продуктов питания для детей. ВОЗ также содействует разработке модели профилей питательных веществ, которая может использоваться странами в качестве инструмента при выполнении
рекомендаций, касающихся маркетинга.
В 2011 г. мировые лидеры взяли на себя обязательство сокращать негативное воздействие нездорового питания на людей. Данное обязательство было провозглашено в Политической декларации Совещания высокого уровня Генеральной Ассамблеи по профилактике
НИЗ и борьбе с ними.
В 2012 г. Всемирная ассамблея здравоохранения утвердила шесть глобальных целей в области питания, включающих сокращение числа детей, страдающих задержкой роста, истощением и ожирением, повышение показателей грудного вскармливания и уменьшение числа
случаев анемии и низкой массы тела при рождении.
В 2013 г. Всемирная ассамблея здравоохранения согласовала девять глобальных добровольных целей в области профилактики НИЗ и борьбы с ними, которые, в частности, предусматривают прекращение распространения диабета и ожирения, а также сокращение потребления
соли на 30% к 2025 г. Глобальный план действий по профилактике неинфекционных заболеваний и борьбе с ними на 2013–2020 гг. содержит руководящие указания и набор вариантов политики для достижения этих целей государствами-членами, ВОЗ
и другими учреждениями ООН.
В мае 2014 г., ввиду быстрого роста распространенности ожирения среди младенцев и детей, ВОЗ учредила комиссию по ликвидации детского ожирения. Комиссия подготовила доклад за 2015 г., в котором уточнила, какие подходы и действия с большой вероятностью
будут наиболее эффективны в условиях различных стран мира.
(1) Эти рекомендации применимы ко всем лицам, независимо от того, страдают ли они повышенным кровяным давлением (включая беременных и кормящих грудью женщин), за исключением лиц, которые страдают заболеваниями или принимают лекарства, которые могут
приводить к снижению уровня натрия или резкому накоплению воды в организме, либо лиц, нуждающихся в специальной диете под наблюдением врача (например, пациентов с сердечной недостаточностью или диабетом первого типа). Для этих подгрупп населения может
Для этих подгрупп населения может
быть установлена специфическая взаимосвязь между потреблением натрия и показателями здоровья (Руководство ВОЗ о потреблении натрия для взрослых и детей, 2012 г.).
Классификация и номенклатура неорганических веществ
ЗАДАНИЯ 5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
1.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-4; Б-1; В-3
КЛАСС/ГРУППА
А) Nh5HCO3
Б) KF
В) NО
1) соль средняя
2) оксид кислотный
3) оксид несолеобразующий
4) соль кислая
2.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-3; Б-1; В-4
КЛАСС/ГРУППА
А) CrO3
Б) (CuOH)2CO3
В) (Nh5)2HPO4
1) основная соль
2) оксид амфотерный
3) оксид кислотный
4) кислая соль
3.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-1; Б-3; В-4
КЛАСС/ГРУППА
А) CO
Б) P2O5
В) HCOOK
1) оксид несолеобразующий
2) оксид амфотерный
3) оксид кислотный
4) соль средняя
4.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-3; Б-4; В-1
КЛАСС/ГРУППА
А) SO3
Б) BeO
В) Ca(OH)Cl
1) основная соль
2) средняя соль
3) кислотный оксид
4) амфотерный оксид
5.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-1; В-4
КЛАСС/ГРУППА
А) Be(OH)2
Б) Fe(OH)2
В) Ca(OH)Cl
1) основание
2) амфотерный гидроксид
3) комплексная соль
4) основная соль
6.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-3; В-1
КЛАСС/ГРУППА
А) h3[SiF6]
Б) KAl(SO4)2
В) Na[Al(OH)4]
1) комплексная соль
2) бескислородная кислота
3) двойная соль
4) основание
7.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.А-2; Б-4; В-4
КЛАСС/ГРУППА
А) Cr2O3
Б) HCOONh5
В) Ch4Nh4Cl
1) основный оксид
2) амфотерный оксид
3) кислая соль
4) средняя соль
8.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-3; В-1
КЛАСС/ГРУППА
А) Ch4COONa
Б) KCl × MgCl2 × 6h3O
В) ClCh3COOH
1) кислота
2) средняя соль
3) двойная соль
4) комплексная соль
9.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-3; В-1
КЛАСС/ГРУППА
А) HClO3
Б) NaHCO3
В) Cu(OH)2
1) основание
2) кислота
3) соль кислая
4) соль средняя
10.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-4; Б-1; В-2
КЛАСС/ГРУППА
А) h3CrO4
Б) NO
В) Al2O3
1) оксид несолеообразующий
2) оксид амфотерный
3) основание
4) кислота
11.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-1; Б-3; В-4
КЛАСС/ГРУППА
А) KHC2O4
Б) Cu2O
В) Cr2O3
1) кислая соль
2) средняя соль
3) основный оксид
4) амфотерный оксид
12.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-4; Б-3; В-1
КЛАСС/ГРУППА
А) HCl
Б) Fe(OH)2
В) Fe(OH)Cl
1) основная соль
2) смешанная соль
3) основание
4) кислота
13.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-4; Б-1; В-2
КЛАСС/ГРУППА
А) h3SO4
Б) Nh5HSO4
В) (Nh5)2SO4
1) кислая соль
2) средняя соль
3) двойная соль
4) кислота
14.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-1; Б-2; В-3
КЛАСС/ГРУППА
А) HClO
Б) CaCl2
В) Cl2O7
1) кислота
2) средняя соль
3) кислотный оксид
4) гидроксид
15.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-3; В-1
КЛАСС/ГРУППА
А) CO
Б) CrO
В) KAlO2
1) средняя соль
2) несолеобразующий оксид
3) основный оксид
4) амфотерный оксид
16.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-3; В-1
КЛАСС/ГРУППА
А) KMnO4
Б) Cr(OH)3
В) NaHSO4
1) кислая соль
2) средняя соль
3) амфотерный гидроксид
4) основание
17.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-4; В-3
КЛАСС/ГРУППА
А) Fe2O3
Б) K2C2O4
В) Cl2O
1) основный оксид
2) амфотерный оксид
3) кислотный оксид
4) средняя соль
18.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-4; Б-2; В-3
КЛАСС/ГРУППА
А) h4BO3
Б) Zn(OH)2
В) Na2ZnO2
1) основание
2) амфотерный гидроксид
3) соль
4) кислота
19.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-4; Б-3; В-1
КЛАСС/ГРУППА
А) Cr(OH)3
Б) h3CrO4
В) Cr2O3
1) амфотерный оксид
2) основание
3) кислота
4) амфотерный гидроксид
20.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-1; Б-3; В-4
КЛАСС/ГРУППА
А) MnO
Б) HMnO4
В) K2MnO4
1) основный оксид
2) кислотный оксид
3) кислота
4) средняя соль
21.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-1; Б-2; В-4
КЛАСС/ГРУППА
А) Fe(OH)2
Б) HBrO2
В) NaAlO2
1) основание
2) кислота
3) соль кислая
4) соль средняя
22.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-1; Б-4; В-2
КЛАСС/ГРУППА
А) HMnO4
Б) Be(OH)2
В) NaOH
1) кислоты
2) щёлочи
3) соли
4) амфотерные гидроксиды
23.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-3; Б-1; В-2
КЛАСС/ГРУППА
А) HNO2
Б) Nh5Cl
В) Nh5HSO4
1) средние соли
2) кислые соли
3) кислоты
4) амфотерные гидроксиды
24.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-1; В-4
КЛАСС/ГРУППА
А) Ca(HCO3)2
Б) Са(OН)2
В) Са(OCl)2
1) основания
2) кислые соли
3) основные оксиды
4) средние соли
25.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой. А-2; Б-1; В-4
КЛАСС/ГРУППА
А) сульфид натрия
Б) гидрокарбонат кальция
В) гидроксид меди(II)
1) кислые соли
2) средние соли
3) щёлочи
4) нерастворимые основания
ЗАДАНИЯ 5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
1.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Nh5HCO3
Б) KF
В) NО
1) соль средняя
2) оксид кислотный
3) оксид несолеобразующий
4) соль кислая
2.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) CrO3
Б) (CuOH)2CO3
В) (Nh5)2HPO4
1) основная соль
2) оксид амфотерный
3) оксид кислотный
4) кислая соль
3.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) CO
Б) P2O5
В) HCOOK
1) оксид несолеобразующий
2) оксид амфотерный
3) оксид кислотный
4) соль средняя
4.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) SO3
Б) BeO
В) Ca(OH)Cl
1) основная соль
2) средняя соль
3) кислотный оксид
4) амфотерный оксид
5.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Be(OH)2
Б) Fe(OH)2
В) Ca(OH)Cl
1) основание
2) амфотерный гидроксид
3) комплексная соль
4) основная соль
6.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) h3[SiF6]
Б) KAl(SO4)2
В) Na[Al(OH)4]
1) комплексная соль
2) бескислородная кислота
3) двойная соль
4) основание
7.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Cr2O3
Б) HCOONh5
В) Ch4Nh4Cl
1) основный оксид
2) амфотерный оксид
3) кислая соль
4) средняя соль
8.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Ch4COONa
Б) KCl × MgCl2 × 6h3O
В) ClCh3COOH
1) кислота
2) средняя соль
3) двойная соль
4) комплексная соль
9.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) HClO3
Б) NaHCO3
В) Cu(OH)2
1) основание
2) кислота
3) соль кислая
4) соль средняя
10.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) h3CrO4
Б) NO
В) Al2O3
1) оксид несолеообразующий
2) оксид амфотерный
3) основание
4) кислота
11.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) KHC2O4
Б) Cu2O
В) Cr2O3
1) кислая соль
2) средняя соль
3) основный оксид
4) амфотерный оксид
12.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) HCl
Б) Fe(OH)2
В) Fe(OH)Cl
1) основная соль
2) смешанная соль
3) основание
4) кислота
13.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) h3SO4
Б) Nh5HSO4
В) (Nh5)2SO4
1) кислая соль
2) средняя соль
3) двойная соль
4) кислота
14.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) HClO
Б) CaCl2
В) Cl2O7
1) кислота
2) средняя соль
3) кислотный оксид
4) гидроксид
15.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) CO
Б) CrO
В) KAlO2
1) средняя соль
2) несолеобразующий оксид
3) основный оксид
4) амфотерный оксид
16.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) KMnO4
Б) Cr(OH)3
В) NaHSO4
1) кислая соль
2) средняя соль
3) амфотерный гидроксид
4) основание
17.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Fe2O3
Б) K2C2O4
В) Cl2O
1) основный оксид
2) амфотерный оксид
3) кислотный оксид
4) средняя соль
18.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) h4BO3
Б) Zn(OH)2
В) Na2ZnO2
1) основание
2) амфотерный гидроксид
3) соль
4) кислота
19.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Cr(OH)3
Б) h3CrO4
В) Cr2O3
1) амфотерный оксид
2) основание
3) кислота
4) амфотерный гидроксид
20.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) MnO
Б) HMnO4
В) K2MnO4
1) основный оксид
2) кислотный оксид
3) кислота
4) средняя соль
21.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Fe(OH)2
Б) HBrO2
В) NaAlO2
1) основание
2) кислота
3) соль кислая
4) соль средняя
22.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) HMnO4
Б) Be(OH)2
В) NaOH
1) кислоты
2) щёлочи
3) соли
4) амфотерные гидроксиды
23.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) HNO2
Б) Nh5Cl
В) Nh5HSO4
1) средние соли
2) кислые соли
3) кислоты
4) амфотерные гидроксиды
24.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) Ca(HCO3)2
Б) Са(OН)2
В) Са(OCl)2
1) основания
2) кислые соли
3) основные оксиды
4) средние соли
25.Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
А) сульфид натрия
Б) гидрокарбонат кальция
В) гидроксид меди(II)
1) кислые соли
2) средние соли
3) щёлочи
4) нерастворимые основания
Классификация и номенклатура неорганических веществ. Часть 1
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Задание 5
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) SO
2 1) оксид основный
Б) CО 2) оксид кислотный
В) Cs
2O 3) оксид амфотерный
4) оксид несолеобразующий
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) NaHCO
3 1) кислота
Б) NH
4Cl 2) кислая соль
В) HClO
4 3) средняя соль
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) SiO 1) основный оксид
Б) KOH 2) несолеобразующий оксид
В) NH
4NO3 3) средняя соль
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) оксид магния 1) амфотерный оксид
Б) сульфид цинка 2) кислая соль
В) гидрокарбонат натрия 3) средняя соль
4) основный оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) KHCO
3 1) кислота
Б) Cu(OH)
2 2) кислая соль
В) HClO
3 3) средняя соль
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) H
2CrO4 1) кислота
Б) NO 2) несолеобразующий оксид
В) ZnO 3) амфотерный оксид
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид железа (II) 1) кислота
Б) оксид азота (V) 2) основный оксид
В) оксид кальция 3) кислотный оксид
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) сульфид натрия 1) несолеобразующий оксид
Б) гидроксид хрома (II) 2) кислая соль
В) дигидрофосфат калия 3) средняя соль
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) Fe
2O3 1) кислота
Б) ZnO 2) основный оксид
В) HCl 3) средняя соль
4) амфотерный оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид магния 1) кислотный оксид
Б) гидрофосфат натрия 2) кислая соль
В) гидрокарбонат кальция 3) основный оксид
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА ФОРМУЛА
А) соль 1) SiO
Б) амфотерный оксид 2) SiO
2
В) основный оксид 3) Al
2O3
4) Al(OH)
3
5) NaAlO
2
6) Ag
2O
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и группой, к которой эта соль принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ГРУППА
А) (CuOH)
2CO3 1) средние соли
Б) MgCl(ClO) 2) кислые соли
В) NaAl(SO
4)2 3) основные соли
4) двойные соли
5) смешанные соли
6) комплексные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА ФОРМУЛА
А) соль 1) NO
2
Б) кислотный оксид 2) K
2O
В) основный оксид 3) KO
2
4) OF
2
5) NCl
3
6) Na
3[Al(OH)6]
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и его тривиальным названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CO 1) угарный газ
Б) Fe
3O4 2) негашеная известь
В) CaO 3) железная окалина
4) гипс
5) известковое молоко
6) нашатырь
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CaO
2 1) пероксид
Б) FeO 2) основный оксид
В) H
2O2 3) кислотный оксид
4) амфотерный оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) Cr(OH)
3 1) щёлочь
Б) Ca(OH)
2 2) соль кислая
В) Be(OH)
2 3) гидроксид кислотный
4) гидроксид амфотерный
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) NH
4HSO3 1) соли средние
Б) NaI 2) оксиды кислотные
В) CO 3) оксиды несолеобразующие
4) соли кислые
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид алюминия 1) средние соли
Б) гидроксид хрома (VI) 2) кислые соли
В) хлорид аммония 3) амфотерные гидроксиды
4) основания
5) кислоты
6) смешанные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид магния 1) средние соли
Б) гидроксид меди (II) 2) кислые соли
В) гидросульфид калия 3) амфотерные гидроксиды
4) основания
5) кислоты
6) смешанные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) нитрат натрия 1) средние соли
Б) гидроксид хрома (II) 2) кислые соли
В) гидрофосфат калия 3) амфотерные гидроксиды
4) основания
5) кислоты
6) двойные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) оксид азота (V) 1) основные оксиды
Б) гидроксид серы (VI) 2) кислотные оксиды
В) оксид магния 3) амфотерные оксиды
4) основания
5) кислоты
6) несолеобразующие оксиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) N
2O3 1) основные гидроксиды
Б) BeO 2) кислотные гидроксиды
В) HClO 3) оксиды несолеобразующие
4) оксиды амфотерные
5) оксиды основные
6) оксиды кислотные
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) HClO
3 1) основания
Б) KHS 2) кислоты
В) Cu(OH)
2 3) комплексные соли
4) средние соли
5) кислые соли
6) основные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) (NH
4)2HAsO4 1) основания
Б) NH
4H2AsO4 2) кислоты
В) NaNO
2 3) оксиды
4) средние соли
5) кислые соли
6) основные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CuS 1) основания
Б) H
2SiO3 2) кислоты
В) Fe(OH)
2NO3 3) оксиды
4) средние соли
5) кислые соли
6) основные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) кварцевый песок 1) амфотерные гидроксиды
Б) гидроксид серы (VI) 2) водородные соединения
В) гидроксид алюминия 3) щёлочи
4) несолеобразующие оксиды
5) двухосновные кислоты
6) кислотные оксиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) ортофосфорная кислота 1) амфотерные гидроксиды
Б) фосфин 2) водородные соединения
В) гидроксид цезия 3) щёлочи
4) несолеобразующие оксиды
5) трёхосновные кислоты
6) кислотные оксиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА ФОРМУЛА
А) соли 1) CO
Б) оксиды 2) HClO
В) кислоты 3) NaAlO
2
4) Fe(OH)
3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CaOHCl 1) основание
Б) NO
2 2) амфотерный гидроксид
В) Al(OH)
3 3) кислотный оксид
4) основная соль
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) Fe(OH)
3 1) основание
Б) NO 2) амфотерный гидроксид
В) SO
2 3) кислотный оксид
4) несолеобразующий оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответы:
- 241
- 231
- 243
- 432
- 241
- 123
- 432
- 342
- 441
- 422
- 536
- 354
- 612
- 132
- 121
- 414
- 413
- 351
- 442
- 142
- 251
- 642
- 251
- 554
- 426
- 651
- 523
- 312
- 432
- 243
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Урок «Соли.Решение тренировочных упражнений»
Соли.
Решение тренировочных упражнений.
11 класс.
План работы.
Мини-модуль 1.
Работа у доски
Проблемный вопрос
Беседа
Тест
Подумать
Удиви меня
Данные о классе вещества
СОСТАВ
МЕТАЛЛ+
КИСЛОТНЫЙ
ОСТАТОК
Свойства
Применение
Установить соответствие
Формула соли
А . NaHCO 3
Б . (CuOH)2 CO3
В . CuSO 4 * 5 h3 O
Г . NaCl
Д .KCl* NaCl
Класс соли
1 . Комплексная (кристаллогидрат)
Кислая
Средняя
Основная
Двойная
Классификация солей
Средняя
NaCl
галит
Кислая
NaHCO3
гидрокарбонат натрия
Основная
(CuOH)2CO3
малахит
Комплексная
CuSO4*5h3O
Медный купорос
Двойная
KCl*NaCl
сильвинит
Подумать и дать ответ
Определить класс солей и дать им названия :
K H SO4 ПОДСКАЗКА
AlCl3 нитрат
Cu (NO3)2 хлорид карбонат
Al(OH)2Cl гидросульфат
Nah3PO4 дигидроксохлорид
СаСО3 дигидрофосфат
План работы.
Мини-модуль2
Просмотр презентации
Химическая лаборатория
Решение задач
Гидрокарбонат натрия
питьевая сода
Профессии
ПОВАР
КОСМЕТОЛОГ
ГАСТРОЭНТЕРОЛОГ
ДОМОХОЗЯЙКА
СТОМАТОЛОГ
МЕДНЫЙ КУПОРОС
Профессии
АГРОНОМ
СЕЛЕКЦИОНЕР
СТРОИТЕЛЬ
НАРОДНАЯ МЕДИЦИНА
Поваренная соль, питьевая соль, галит
Повар
кулинар
консервация
приправа
Металлурги
химики
Обработка мехов
Варка мыла, получение кальцинированной соды
медицина
Физиологический раствор
Йодированная пищевая соль
Основной карбонат меди, гидрокарбонат меди, малахит
Бажов «Малахитовая шкатулка»
Метрополитены
Малахитовая комната
Драгоценности
Сильвинит
медицина
Соляные комнаты
Химические свойства солей, получение
СОЛЬ
Соль
+
металл
соль
+
щёлочь
Соль
+
кислота
Соль
+
соль
План работы.
Мини-модуль 3
Видеоролик
Лабораторный опыт
На приёме у врача
Физпауза
Химический диктант
Высказывание мнения
Гидролиз солей
Гидролиз солей
Гидролиз-процесс взаимодействия соли с водой, приводящий к образованию малодиссоциирующего вещества.
Среда раствора определяется наличием в ней катиона металла или аниона кислотного остатка сильного основания или сильной кислоты.
NaCl — сильное основание +сильная кислота-гидролиз не идёт
NaHCO3- сильное основание +слабая кислота-гидролиз идёт
CuSO4- слабое основание + сильная кислота-гидролиз идёт
Нахождение солей в организме человека
Физпауза
Химический диктант
1.В состав солей входят атомы….
2.Кислая соль должна содержать в составе кислотного остатка атомы….
3.Основная соль содержит в составе кислотного остатка атомы…
4.Лакмус в кислой среде…. цвета
5.Среда раствора соли определяется наличием ионов, характеризующих …. (слабое или сильное) вещество .
6.Соли реагируют с …. с образованием новой соли и металла .
7. Карбонат кальция имеет несколько названий. Мрамор, известняк,…..
8.Соли реагируют с ….. с образованием новой соли и новой кислоты .
9.Название соединения, формула которого CaSO4*2 h3O .
10. Соли каких катионов могут иметь запах?
Упоминание соли в устном народном творчестве
«Без соли -нет застолья»
«Без хлеба, без соли — худая беседа»
«За хлебом-солью всякая шутка хороша»
«Чтобы узнать человека -нужно с ним пуд соли съесть»
Продолжи фразу…
Мне пригодятся….
Я узнал….
В жизни я могу применить….
Я повысил свой интеллектуальный запас….
Я не понял….
Я оцениваю свою работу на уроке…..
Применю ли я материал данного урока на последующих занятиях…
Состав среды: соли и осмоляльность
Основными компонентами среды для культивирования эмбрионов являются соли, которые в водном растворе диссоциируют на составляющие неорганические ионы. Все среды для культивирования эмбрионов содержат одни и те же шесть неорганических ионов: Na (+), K (+), Cl (-), Ca (2+), Mg (2+) и SO (4) (2-), в то время как большинство также содержат ПО (4) (2-). Соли, которые используются для приготовления сред для культивирования эмбрионов, восходят к классическим солевым растворам, в частности, к бикарбонату Кребса-Рингера (KRB), которые были разработаны для соматических клеток в первой половине двадцатого века.Концентрации солей и неорганических ионов в первой успешно определенной культуральной среде эмбрионов мыши, среде Уиттенса, были идентичны таковым в KRB. Они оставались в значительной степени неизменными в среде для культивирования эмбрионов в течение десятилетий, при этом аналогичные уровни были обнаружены в стандартной культуральной среде для эмбрионов мыши, M16, разработанной в 1970-х годах. Первоначально человеческие эмбрионы культивировали в неопределенных средах для соматических клеток, таких как Earles and Hams F-10, с добавлением сыворотки. Ситуация изменилась в середине 1980-х годов, однако, с разработкой Quinns HTF, определенной среды, специально разработанной для культивирования человеческих эмбрионов, в которой концентрации неорганических ионов аналогичны концентрациям в M16 и Whittens.Хотя эти среды были полезны как для экспериментальной работы, так и в клинической практике, эмбрионы страдали блокировкой развития во всех из них, при этом эмбрионы мыши блокировались на стадии 2 клеток, а человеческие эмбрионы — на стадии 4-8 клеток. Однако, начиная с конца 1980-х годов, были впервые разработаны среды для культивирования эмбрионов мыши, которые облегчили эти блоки развития. Эти среды, CZB и KSOM, имели гораздо более низкие осмолярности, чем предыдущие среды, в основном из-за более низких концентраций неорганических ионов. Действительно, снижение общей концентрации неорганических ионов и осмоляльности оказалось ключом к пониманию того, как могут быть составлены среды, поддерживающие полное доимплантационное развитие in vitro.Последующим усовершенствованием было добавление аминокислот в культуральную среду как для мышиных, так и для человеческих эмбрионов. По крайней мере частично, их положительный эффект на стадиях развития расщепления обусловлен наличием у ранних доимплантационных эмбрионов механизмов регуляции клеточного объема, которые зависят от накопления аминокислот в виде органических осмолитов для обеспечения внутриклеточной осмотической поддержки. Эти аминокислоты, в основном глицин, заменяют часть внутриклеточных неорганических ионов, которая в противном случае была бы необходима для поддержания размера клетки, предотвращая рост внутриклеточной ионной силы до вредных уровней и блокируя развитие.Таким образом, оптимальные уровни солей, осмоляльность и содержание аминокислот в культуральной среде не являются независимыми, но сильно взаимодействуют из-за их роли в регуляции объема клеток. В отсутствие соединений, которые доимплантационные эмбрионы могут использовать в качестве органических осмолитов, эмбрионы будут развиваться только при более низких осмоляльностях и концентрациях солей в среде. Однако, когда присутствуют органические осмолиты, такие как некоторые аминокислоты, эмбрионы будут развиваться в культуре с более высокой осмолярностью, аналогичной той, которую они испытывают в трубной жидкости in vivo.
(PDF) Питательные среды с добавлением неорганических солей улучшают рост и жизнеспособность некоторых бактериальных штаммов
Том 60 (2): 151-156, 2016
Acta Biologica Szegediensis
http: //www2.sci.u-szeged .hu / ABS
СТАТЬЯ
1 Кафедра микробиологии, Факультет естественных наук и информатики, Сегедский университет, Сегед, Венгрия
2 Национальный центр сельскохозяйственных исследований и инноваций, Научно-исследовательский институт виноградарства и энологии, Кечкемет, Венгрия
Добавленные питательные среды с неорганическими солями улучшают
рост и жизнеспособность нескольких штаммов бактерий
Эльвира Накса-Фаркас1 *, Эрика Бета Керекес1, Фанни Харгитаи1, Чаба Вагвёльджи1, Эрно Сегеди2
РЕЗЮМЕ
РЕЗЮМЕ
9000 для улучшения условий роста бактерий и условий хранения 9000 для улучшения бактериальных культур и условий хранения , com-
обычно используемые основные питательные среды, бульон Лурия-Бертани (LB) и глюкозно-дрожжевой экстракт (GY) были протестированы
вместе с их дополненными версиями (LBS и GYS), содержащими сложный набор органических солей IN-
, необходимых для общих физиологических процессов.Кинетику роста и жизнеспособность
15 репрезентативных штаммов сравнивали на LB / LBS или GY / GYS. Кинетику роста
исследовали в течение 24 часов. Пять из 15 штаммов показали усиленный рост на LBS и GYS. Три штамма
показали очень низкую жизнеспособность (3 месяца или меньше) как на основной, так и на солевой среде
. Шесть штаммов можно было одинаково восстановить через 6 или 12 месяцев как из LB / LBS, так и из
GY / GYS. Шесть из 15 протестированных бактериальных штаммов показали значительно лучшую скорость восстановления на средах с неорганическими добавками
LBS или GYS, чем на основных LB или GY.Эти результаты показывают, что неорганическая добавка
к основной среде может значительно улучшить рост и жизнеспособность
нескольких штаммов бактерий. Acta Biol Szeged 60 (2): 151-156 (2016)
КЛЮЧЕВЫЕ СЛОВА
кинетика роста
неорганические добавки
условия хранения
жизнеспособность
Представлено 30 ноября 2016 г .; Принята в печать 29 декабря 2016 г.
* Автор, ответственный за переписку. E-mail: [email protected]
151
Введение
Эффективное культивирование и надежное хранение бактериальных культур
— основная предпосылка в нескольких областях, связанных с микробиологией,
, включая медицину человека и ветеринарию, окружающую среду. ,
промышленная и сельскохозяйственная микробиология, а также приложения для молекулярной биологии и биотехнологии
.Для этих целей используются в основном простые лабораторные среды, основанные на
гидролизованных белках (например, мясных экстрактах), дрожжах или экстрактах различных
растений. Общей особенностью этих широко используемых сред
(например, бульона Лурия-Бертани, картофельного агара с декстрозой и среды
с глюкозой / дрожжевым экстрактом) является то, что они богаты органическими соединениями
, но не содержат или содержат только следовые количества inor-
ганические питательные вещества. С другой стороны, среды для культивирования тканей растений
всегда содержат сложный набор неорганических веществ (макроэлементы
,
и микроэлементы), необходимых для роста и метаболизма
(George et al.2012).
Во время хранения различных штаммов Allorhizobium vitis (для —
merly Agrobacterium vitis) мы наблюдали, что
они утратили свою жизнеспособность через несколько месяцев при 4 ° C на скошенном агаре с глюкозой / дрожжевым экстрактом
(GY). , даже если он был дополнен
CaCO3 для буферного образования кислоты из глюкозы. Когда эта среда
была дополнена солями AB (Lichtenstein и
Draper 1986), жизнеспособность штаммов A. vitis увеличилась до
до десяти месяцев или дольше.Аналогичным образом, опубликованная среда 3-кетолактозы
(Bernaerts and De Ley, 1963), содержащая только 1,0% лактозы
(мас. / Об.) И 0,1% (мас. / Об.) Дрожжевого экстракта, была лишь слабо подходящей для этого биохимического анализа для A. vitis, если
не был дополнен солями AB (наше неопубликованное наблюдение).
Эти данные позволили нам предположить, что обычно используемые лабораторные среды
не содержат необходимого количества неорганических питательных веществ
. В раннем исследовании Тартоф и Хоббс (1987) обнаружили
, что добавка фосфата значительно увеличивала выход
клеток и, следовательно, выход плазмиды Escherichia coli.Более недавнее исследование
показало, что определенные моно- (Na, K) и
двухвалентные (Ca, Mg) катионы
оказали положительное влияние на рост
и жизнеспособность A. vitis, хотя данные не были представлены
по их действию (Tanaka et al. 2009). Они могут способствовать транспорту
или другим основным физиологическим процессам, или они являются
компонентами основных витаминов и коферментов.
Бульон Лурия-Бертани (LB) и глюкозно-дрожжевой экстракт
Среда
(GY) широко используются для бактериальных культур.В этом исследовании
мы сравнили влияние исходных LB и GY и
их модифицированных формул с добавлением неорганических солей на
рост и сохраняемость различных бактериальных культур. Наши результаты
показывают, что неорганические добавки
могут значительно повысить жизнеспособность определенных штаммов.
базовый pdf dicto.indd
% PDF-1.3
%
1 0 obj
>] / Pages 3 0 R / Type / Catalog / ViewerPreferences >>>
эндобдж
2 0 obj
> поток
uuid: b6492e13-a958-dc49-af3a-4a864d86f513adobe: docid: indd: 1197ade8-993a-11de-a5d8-adeba9a08cb4adobe: docid: indd: 1197ade8-993a-11de-a516adf8.iid: F77F1174072068118F62981E9A746FD62009-09-07T13: 29: 32 + 02: 00Adobe InDesign 6.0 /
2009-09-09T14: 33: 41 + 02: 002009-09-09T14: 33: 41 + 02: 002009-09-09T14: 33: 41 + 02: 00Adobe InDesign CS4 (6.0.3)
AQBIAAAAAQAB / + 4AE0Fkb2JlAGQAAAAAAQUAAo6g / 9sAhAAKBwcHBwcKBwcKDgkJCQ4RDAsLDBEU
EBAQEBAUEQ8RERERDxERFxoaGhcRHyEhISEfKy0tLSsyMjIyMjIyMjIyAQsJCQ4MDh8XFx8rIx0j
KzIrKysrMjIyMjIyMjIyMjIyMjIyMjI + Pj4 + PjJAQEBAQEBAQEBAQEBAQEBAQEBAQED / wAARCAEA
ALUDAREAAhEBAxEB / 8QBogAAAAcBAQEBAQAAAAAAAAAABAUDAgYBAAcICQoLAQACAgMBAQEBAQAA
AAAAAAABAAIDBAUGBwgJCgsQAAIBAwMCBAIGBwMEAgYCcwECAxEEAAUhEjFBUQYTYSJxgRQykaEH
FbFCI8FS0eEzFmLwJHKC8SVDNFOSorJjc8I1RCeTo7M2F1RkdMPS4ggmgwkKGBmElEVGpLRW01Uo
GvLj88TU5PRldYWVpbXF1eX1ZnaGlqa2xtbm9jdHV2d3h5ent8fX5 / c4SFhoeIiYqLjI2Oj4KTlJ
WWl5iZmpucnZ6fkqOkpaanqKmqq6ytrq + hEAAgIBAgMFBQQFBgQIAwNtAQACEQMEIRIxQQVRE2Ei
BnGBkTKhsfAUwdHhI0IVUmJy8TMkNEOCFpJTJaJjssIHc9I14kSDF1STCAkKGBkmNkUaJ2R0VTfy
o7PDKCnT4 / OElKS0xNTk9GV1hZWltcXV5fVGVmZ2hpamtsbW5vZHV2d3h5ent8fX5 / c4SFhoeIiY
qLjI2Oj4OUlZaXmJmam5ydnp + So6SlpqeoqaqrrK2ur6 / 9oADAMBAAIRAxEAPwCbeU / KflW58q6L
cXGi6fNNNp9rJJJJaws7u0MbMzM0ZJJJ3OKpt / gzyf8A9WHTf + kOD / qnirv8GeT / APqw6b / 0hwf9
U8Vd / gzyf / 1YdN / 6Q4P + qeKu / wAGeT / + rDpv / SHB / wBU8Vd / gzyf / wBWHTf + kOD / AKp4q7 / Bnk //
AKsOm / 8ASHB / 1TxV3 + DPJ / 8A1YdN / wCkOD / qnirv8GeT / wDqw6b / ANIcH / VPFXf4M8n / APVh03 / p
Dg / 6p4q7 / Bnk / wD6sOm / 9IcH / VPFXf4M8n / 9WHTf + kOD / qnirv8ABnk // qw6b / 0hwf8AVPFXf4M8
n / 8AVh03 / pDg / wCqeKu / wZ5P / wCrDpv / AEhwf9U8Vd / gzyf / ANWHTf8ApDg / 6p4q7 / Bnk / 8A6sOm
/ wDSHB / 1TxV3 + DPJ / wD1YdN / 6Q4P + qeKu / wZ5P8A + rDpv / SHB / 1TxV3 + DPJ // Vh03 / pDg / 6p4q7 /
AAZ5P / 6sOm / 9IcH / AFTxV3 + DPJ // AFYdN / 6Q4P8Aqnirv8GeT / 8Aqw6b / wBIcH / VPFXeTP8AlD9B
/ wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYqkvkz / lD9
B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiqS + TP + UP0
H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiqS + TP + UP
0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiqS + TP8A
lD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYqkvkz
/ lD9B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiqS + TP
+ UP0H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiqS + T
P + UP0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiqS +
TP8AlD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq
kvkz / lD9B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdiq
S + TP + UP0H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdi
qS + TP + UP0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVd
iqS + TP8AlD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7
FXYqkvkz / lD9B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirs
VdiqS + TP + UP0H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdir
sVdiqS + TP + UP0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdi
rsVdiqS + TP8AlD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7F
XYq7FXYqkvkz / lD9B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsV
dirsVdiqS + TP + UP0H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirs
VdirsVdiqS + TP + UP0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdir
sVdirsVdiqS + TP8AlD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FX
Yq7FXYq7FXYqkvkz / lD9B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVd
irsVdirsVdiqS + TP + UP0H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirsV
dirsVdirsVdiqS + TP + UP0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdirs
VdirsVdirsVdiqS + TP8AlD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXY
q7FXYq7FXYq7FXYqkvkz / lD9B / 7Ztn / yYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVdi
rsVdirsVdirsVdiqS + TP + UP0H / tm2f8AyYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsVd
irsVdirsVdirsVdiqS + TP + UP0H / tm2f / ACYjxVOsVdirsVdirsVdirsVdirsVdirsVdirsVdirsV
dirsVdirsVdirsVdiqS + TP8AlD9B / wC2bZ / 8mI8VTrFXYq7FXYq7FXYq7FXYq7FXYq7FXYq7FXYq
7FXYq7FUDfaolnIsCQyXM7qXEUIBIUbcjUjKc2oGM1RJ8nJ0 + kOUEkiI7yhLvzRptnb29zKsxW6Z
40WOJnZXiRpXV1XoQqMfoy7Tfv43H7WrPhlhnwlbD5u0ae5W3VpQHMKrO0TiEtcqrwD1ONBzDCla
b7dctOnmBbVadZUlvFUl8mf8ofoP / bNs / wDkxHiqdYqkNx5ThubiW4Op6jGZnaQpHOFReRLcVHpm
gFdsVUv8Gwf9XXU / + kgf9U8Vd / g2D / q66n / 0kD / qnirv8Gwf9XXU / wDpIH / VPFXf4Ng / 6uup / wDS
QP8AqniqZ6TpCaSsqpdXN16pBJupPUK0r9n4Vp1xVMMVdirsVdirsVdirsVdirsVdirH9c8sfpTU
I9Vtrh7a5WH6s5R5Ii0YLstHhdGHEyN4g5diz8EaIRSDm8iWsuk22mespMN1JeyPJCsySSSpLE1Y
5mbYCT4aknYVqd8kNURImulLStF5NSOVVe + mlswbNpIGVS0r2KosLSSnenKMMwAFTgOpsct9 / tWm
S5QlvFWH + U / NnlW28q6Lb3GtafDNDp9rHJHJdQq6OsMasrK0gIII3GKpt / jPyf8A9X7Tf + kyD / qp
irv8Z + T / APq / ab / 0mQf9VMVd / jPyf / 1ftN / 6TIP + qmKu / wAZ + T / + r9pv / SZB / wBVMVd / jPyf / wBX
7Tf + kyD / AKqYq7 / Gfk // AKv2m / 8ASZB / 1UxV3 + M / J / 8A1ftN / wCkyD / qpirv8Z + T / wDq / ab / ANJk
H / VTFXf4z8n / APV + 03 / pMg / 6qYq7 / Gfk / wD6v2m / 9JkH / VTFXf4z8n / 9X7Tf + kyD / qpirv8AGfk /
/ q / ab / 0mQf8AVTFXf4z8n / 8AV + 03 / pMg / wCqmKu / xn5P / wCr9pv / AEmQf9VMVd / jPyf / ANX7Tf8A
pMg / 6qYq7 / Gfk / 8A6v2m / wDSZB / 1UxV3 + M / J / wD1ftN / 6TIP + qmKu / xn5P8A + r9pv / SZB / 1UxV3 +
M / J // V + 03 / pMg / 6qYq7 / ABn5P / 6v2m / 9JkH / AFUxV3 + M / J // AFftN / 6TIP8Aqpirv8Z + T / 8Aq / ab
/ wBJkH / VTFX / 2Q ==
883application / pdf
Библиотека Adobe PDF 9.0FalsePDF / X-3: 2002PDF / X-3: 2002PDF / X-3: 2002
конечный поток
эндобдж
3 0 obj
>
эндобдж
6 0 obj
> / ExtGState> / Font> / ProcSet [/ PDF / Text] >> / TrimBox [0,0 0,0 595,276 841,89] / Type / Page >>
эндобдж
7 0 объект
> поток
HWM $
? e}
Водные растворы солей — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Когда солевой раствор является основным или кислым?
- Соли полипротонных кислот
- Вопросы
- Ответы
- Практические вопросы
- Ссылки
- Участники и атрибуты
Соли, помещенные в воду, часто реагируют с водой с образованием H 3 9025 + или OH — .Это известно как реакция гидролиза. В зависимости от того, насколько сильно ион действует как кислота или основание, он будет производить различные уровни pH. Когда вода и соли вступают в реакцию, появляется много возможностей из-за различной структуры солей. Соль может состоять из слабой кислоты и сильного основания, сильной кислоты и слабого основания, сильной кислоты и сильного основания или слабой кислоты и слабого основания. Реагенты состоят из соли и воды, а сторона продуктов состоит из конъюгированного основания (от кислоты стороны реакции) или конъюгата кислоты (от основания стороны реакции).В этом разделе химии мы обсуждаем значения pH солей на основе нескольких условий.
Когда солевой раствор бывает щелочным или кислым?
Есть несколько руководящих принципов, которые подводят итог:
- Соли сильных оснований и сильных кислот не гидролизуются. pH останется нейтральным при 7. Галогениды и щелочные металлы диссоциируют и не влияют на H + , поскольку катион не изменяет H + , а анион не притягивает H + из воды.Вот почему NaCl — нейтральная соль. Общее: Соли, содержащие галогениды (кроме F — ) и щелочные металлы (кроме Be 2 + ), будут диссоциировать на ионы-зрители.
- Соли, состоящие из сильных оснований и слабых кислот, гидролизуются, что дает им pH более 7. Анион в соли является производным слабой кислоты, скорее всего, органической, и будет принимать протон из вода в реакции. Это заставит воду действовать как кислота, которая в этом случае будет оставлять гидроксид-ион (OH — ) .Катион будет происходить из сильного основания, то есть из щелочных или щелочноземельных металлов, и, как и прежде, он будет диссоциировать на ион и не повлияет на H + .
- Соли слабых оснований и сильных кислот гидролизуются, что дает им pH менее 7 . Это связано с тем, что анион станет ионом-наблюдателем и не сможет привлечь H + , в то время как катион из слабого основания будет отдавать протон воде, образуя ион гидроксония.
- Соли слабого основания и слабой кислоты также гидролизуются, как и другие, но немного более сложные и требуют учета K a и K b . Какая из кислот сильнее, она будет доминирующим фактором при определении, является ли она кислотной или основной. Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Соли полипротонных кислот
Не пугайтесь солей полипротонных кислот.Да, они больше и «круче», чем большинство других солей. Но с ними можно обращаться так же, как и с другими солями, только с немного большей математикой. Прежде всего, мы знаем несколько вещей:
- Это все еще просто соль. Все вышеперечисленные правила по-прежнему действуют. К счастью, поскольку мы имеем дело с кислотами, pH соли полипротонной кислоты всегда будет больше 7.
- Таким же образом, как полипротонные кислоты теряют H + ступенчато, соли полипротонных кислот приобретают H + таким же образом, но в обратном порядке полипротонной кислоты.{-11} \).
Это означает, что при вычислении значений для K b CO 3 2 — , K b первой реакции гидролиза будет \ (K_ {b1} = \ dfrac {K_w} { K_ {a2}} \), поскольку он пойдет в обратном порядке.
Сводка кислотно-основных свойств солей Тип решения Катионы Анионы pH Кислый Из слабых оснований NH 4 + , Al 3 + , Fe 3+
Из сильных кислот: Cl — , Br — , I — , NO 3 — , ClO 4 —
<7 Базовый Из сильных баз: Группа 1 и Группа 2, но не Be 2+ Из слабых кислот: F —, NO 2 —, CN —, CH 3 COO —
> 7 Нейтраль Из сильных баз: Группа 1 и Группа 2, но не Ве 2 + .
Из сильных кислот: Cl — , Br — , I — , NO 3 — , ClO 4 —
= 7 Вопросы
- Предскажите, будет ли pH каждой из следующих солей, помещенных в воду, кислотным, основным или нейтральным.
- NaOCl (т)
- KCN (т)
- NH 4 NO 3 (s)
- Найдите pH раствора.200 M NH 4 NO 3 где (K a = 1,8 * 10 -5 ).
- Найдите pH раствора .200 M Na 3 PO 4 где (K a 1 = 7,25 * 10 -5 , K a2 = 6,31 * 10 -8 , К а3 = 3,98 * 10 -3 ). -_ {(aq)} \)
В то время как Na + не будет гидролизоваться, OCl — будет (помните, что это сопряженное основание HOCl).-] \]
\ [pH = 12,77 \]
Практические вопросы
- Почему соль, содержащая катион сильного основания и анион слабой кислоты, образует щелочной раствор?
- Почему соль, содержащая катион слабого основания и анион сильной кислоты, образует кислый раствор?
- Как значения K a или K b помогают определить, будет ли слабая кислота или слабое основание доминирующей движущей силой реакции?
Ответы на эти вопросы можно найти в разделе прикрепленных файлов внизу страницы.
Список литературы
- Петруччи, Ральф Х., Уильям С. Харвуд, Ф. Г. Херринг и Джеффри Д. Мадура. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2007.
- Тимберлейк, Карен К. Химия 101 Введение в химию. 2-е изд. Сан-Франциско: Pearson Education, 2007. Печать.
Авторы и указание авторства
- Кристофер Ву (UCD), Кристиан Доуэлл (UCD), Николь Хупер (UCD)
Crafter’s Choice ™ Розовая морская соль — средняя
Колония • Грузия
Дата отправки: 01.09.2021
Я рекомендую этот товар!
«Отличный продукт» КОММЕНТАРИИ: Я использую эту продукцию в различных товарах в своем интернет-магазине.Отличная цена за размер. Я получаю от этого много пользы за такую цену. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Отшелушивающие и сахарные скрабы Криста • Монтана
Дата отправки: 24.07.2019
Я рекомендую этот товар!
«Идеальная соль» КОММЕНТАРИИ: Мы использовали это в соли для ванн вместе с солями других цветов и размеров.Он красив и отлично тает в теплой воде. Безусловно, фаворит клиентов! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: газированные напитки и соль для ванн, эксфолианты и сахарные скрабы. гимн • Грузия
Дата отправки: 18.07.2019
Я рекомендую этот товар!
«Соль для ванн» КОММЕНТАРИИ: Этот продукт придает приятный цвет моим солям для ванн.Очень доволен. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Лесли • Индиана
Дата отправки: 08.04.2019
Я рекомендую этот товар!
«Великолепный цвет.« КОММЕНТАРИИ: Эта солидная соль самого красивого розового оттенка! Я никогда не куплю сумку у другого поставщика, основываясь только на оттенке. Супер мило и потрясающе смотрится на фоне трав и растений. Гранулы тоже идеального размера. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн ЧТО МНЕ НРАВИТСЯ ЧТО Я НУЖНО ИЗМЕНИТЬ • Оттенок.
• Розовый цвет.
• Грубый.Шавонн • Флорида
Дата отправки: 03.04.2019
Я рекомендую этот товар!
«красивый» КОММЕНТАРИИ: Это будет использовано для моих солей для ванн. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Мюриэль • Техас
Дата отправки: 14.12.2018
Я рекомендую этот товар!
«Очень красиво» КОММЕНТАРИИ: Приятный среднезернистый и красивый розовый цвет.Отлично подходит для солевых скрабов, ванн и поверх холодного мыла. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло для холодного приготовления, газированные напитки и соли для ванн, отшелушивающие средства и сахарные скрабы. ЧТО МНЕ НРАВИТСЯ ЧТО Я НУЖНО ИЗМЕНИТЬ • Размер и цвет • Ничего не найдено Саманта • Нью-Йорк
Дата отправки: 19.11.2018
Я рекомендую этот товар!
«Соли расслабляющие» КОММЕНТАРИИ: Мне это понравилось! Я использовала эту соль в наборе розовой соли для ванн.Выглядит так красиво! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Дом • Алабама
Дата отправки: 11.06.2018
Я рекомендую этот товар!
«Идеальный размер» КОММЕНТАРИИ: Очень хорошо отшелушивает кожу, делая ее красивой и гладкой. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Отшелушивающие и сахарные скрабы Алия • Мэриленд
Дата отправки: 29.10.2018
Я рекомендую этот товар!
«Crafters Choice ™ Pink Sea Salt — Medium» КОММЕНТАРИИ: Мне нравится Pink Sea Salt от Crafters Choice.Я обычно добавляю соль поверх холодного мыла. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло — CPOP, газированные напитки и соли для ванн. Шелби • Техас
Дата отправки: 20.10.2018
Я рекомендую этот товар!
«Великая розовая соль очень чистая» КОММЕНТАРИИ: Отличная розовая морская соль.Хорошая средняя зернистость, отлично подходит для солевых скрабов и ванн. Хорошо растворяется в воде. Красивый красивый розовый цвет! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: газированные напитки и соль для ванн, эксфолианты и сахарные скрабы. Спенсер • Пенсильвания
Дата отправки: 29.05.2018
Я рекомендую этот товар!
«Обожаю.« КОММЕНТАРИИ: Я использую это для солей для ванн и мыла, мне это нравится! Великолепный размер зерна и великолепный естественный цвет. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло для холодного приготовления, газированные напитки и соли для ванн, отшелушивающие средства и сахарные скрабы. Натали • Вирджиния
Дата отправки: 10.04.2018
Я рекомендую этот товар!
«Великое дополнение» КОММЕНТАРИИ: к моей специальной соли для ванн.Мне нравится размер этих зерен, и они прекрасно смотрятся в сочетании с другими ингредиентами моей соли для ванн! Плюс и буду продолжать покупать эти! Спасибо ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Стейси • Нью-Джерси
Дата отправки: 09.04.2018
Я рекомендую этот товар!
«Красотка в розовом» КОММЕНТАРИИ: С приближением дня матери я приготовила кучу солей для ванн и разложила их в банки Hermes.Я объединил три разные соли, которые купил в WSP, и Розовая морская соль была одной из них. Их цвет добавляет то немногое, что действительно делает соли такими же особенными, поскольку они полезны для кожи. Буду покупать их снова. Получил много комплиментов. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн ЧТО МНЕ НРАВИТСЯ ЧТО Я НУЖНО ИЗМЕНИТЬ • цвет
• преимущества
• простота использованияНиколь • Колорадо
Дата отправки: 19.03.2018
Я рекомендую этот товар!
«Отлично подходит для ванн и солей» КОММЕНТАРИИ: Очень красивое дополнение к моим новым солям для ванн ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Карен • Невада
Дата отправки: 03.03.2018
Я рекомендую этот товар!
«Любите соль розового моря !!!» КОММЕНТАРИИ: Отличные розовые соли среднего размера для моих соляных пирогов и солей для ванн ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Янтарь • Флорида
Дата отправки: 24.01.2018
Я рекомендую этот товар!
«Именно то, что я искал!» КОММЕНТАРИИ: Эта розовая гималайская морская соль — ИМЕННО то, что я искал! Среднее зерно — ИДЕАЛЬНЫЙ размер, чтобы добавить этот особый оттенок декаданса верху хлеба CP! Размер и текстура зерна делают ее идеальной добавкой для придания привлекательности продуктам, а закругленные (не острые) края делают эту соль эффективным, но нежным натуральным эксфолиантом! Разные оттенки великолепного розового делают продукты привлекательными и гламурными! Я искал эту соль на местном уровне, и, хотя я нашел много, ни одна из них не обладала теми качествами, которые я искал… Некоторые были слишком большими по размеру зерна и / или слишком резкими по текстуре. Другие были слишком малы. Большинству из них не хватало той красивой вариации броского цвета, которую я хотел, а те, которые не были, поставлялись в упаковке, в которой невозможно было извлечь соль, не отрывая крышку шлифовальной машины и надеясь со всей надеждой, что я случайно не сломаюсь. стеклянная бутылка в процессе! Я ТАК РАД, что решил купить эту соль у WSP, а не на месте, так как ВСЕ проблемы, которые у меня были с местными поставщиками, здесь не применимы! С такой невероятной ценой и огромными размерами WSP этот продукт я больше нигде не куплю! Спасибо вам, WSP, за то, что всегда решаете мои дилеммы и нуждаетесь в расходных материалах! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Мыло — холодный процесс. ЧТО МНЕ НРАВИТСЯ ЧТО Я НУЖНО ИЗМЕНИТЬ • Идеальный размер и текстура для топпинга CP!
• Прекрасные оттенки розового!
• Выдающееся количество, количество и цена!Teela • Вашингтон
Дата отправки: 16.11.2017
Я рекомендую этот товар!
«идеальный» КОММЕНТАРИИ: Используется в смесях соли для ванн.Добавляет красивый цвет в смесь. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Агнес • Нью-Йорк
Дата отправки: 02.11.2017
Я рекомендую этот товар!
«Хорошая соль» КОММЕНТАРИИ: Очень нравится все размеры розовой гималайской соли.Красивых цветов и придает особую привлекательность при использовании в качестве основного ингредиента в солях для ванн. Могу назначить высокую цену за эти смеси. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Хорхе • Нью-Джерси
Дата отправки: 11.09.2017
Я рекомендую этот товар!
«Отличный продукт во всем!» КОММЕНТАРИИ: Доволен продуктом и услугами ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло — шампунь для бритья, жидкое мыло и средства для стирки. sammi • Массачусетс
Дата отправки: 09.04.2017
Я рекомендую этот товар!
«Хорошо смотрится» КОММЕНТАРИИ: Я использовал эту соль в банках с солью для ванн.В баночке очень красиво смотрится розовый. Покупатели много говорили о красивом виде розовой соли в банке. Я куплю это снова. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн ЧТО МНЕ НРАВИТСЯ ЧТО Я НУЖНО ИЗМЕНИТЬ • Размер
• Цвет
• Внешний видМэри • Нью-Йорк
Дата отправки: 09.06.2017
Я рекомендую этот товар!
«Отличный товар!» КОММЕНТАРИИ: Это такие красивые розовые кристаллы соли! Мне нравится смешивать их с белыми солями в солях для ванн и чаях для ванн для получения красивого цвета, розовая соль также имеет удивительное содержание минералов. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Белла • Грузия
Дата отправки: 26.05.2017
Я рекомендую этот товар!
«РОЗОВАЯ МОРСКАЯ СОЛЬ» КОММЕНТАРИИ: Я ПОСТАВЛЯЮ ЭТУ СОЛЬ В БУТЫЛКИ ИЗ ФРАНЦУЗСКОГО СТЕКЛА объемом 4 унции и мне это очень нравится !! Я СДЕЛАЛ ЭТУ СОЛЬ С НЕКОТОРОЙ ЧЕРНОМОРСКОЙ СОЛИ И АРОМАТИЧЕСКИМ МАСЛОМ, И ПОКУПАТЕЛЯМ ЕЕ НРАВИТСЯ! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн cgawlik • Грузия
Дата отправки: 31.03.2017
Я рекомендую этот товар!
«соль» КОММЕНТАРИИ: зерно похоже на то, что можно найти в продуктовых магазинах за БОЛЬШИЕ деньги.Цвет больше похож на обожженный оранжево-коричневый. Ничего, немного слюды, не может помочь ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Christie • Джорджия
Дата отправки: 24.03.2017
Я рекомендую этот товар!
«Прекрасная соль» КОММЕНТАРИИ: Эти соли идеально подходят для добавления в мыло. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло — холодный процесс, мыло — горячий процесс. Дайна • Индиана
Дата отправки: 03.03.2017
Я рекомендую этот товар!
«приятное прикосновение» КОММЕНТАРИИ: Я использую это в холодных рецептах и рецептах бомб для ванн, а также в качестве декоративного элемента.хорошее качество и дает ощущение высококлассного качества. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло — холодного приготовления, газированные напитки и соли для ванн. Дана • Нью-Йорк
Дата отправки: 26.02.2017
Я рекомендую этот товар!
«Розовая морская соль — средняя» КОММЕНТАРИИ: Я использую это в сочетании с другими солями в солях для ванн. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Cidalia • Грузия
Дата отправки: 16.01.2017
Я рекомендую этот товар!
«Хорошая крупность» КОММЕНТАРИИ: Этот размер был отличным, чтобы положить его поверх моих бомбочек для ванны по индивидуальному заказу.Они такие красивые. Буду заказывать больше в качестве украшения для буханки CP ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло — растопить и разлить, мыло — холодный процесс, газированные напитки и соль для ванн, эксфолианты и сахарные скрабы. дженнифер • Калифорния
Дата отправки: 28.12.2016
Я рекомендую этот товар!
«Соль морская розовая» КОММЕНТАРИИ: Мне очень нравится моя соль для ванн, в которую я добавляю эфирное масло. ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Кейси • Техас
Дата отправки: 29.10.2016
«Завод» КОММЕНТАРИИ: Работы ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн Шарин • Кентукки
Дата отправки: 12.08.2016
Я рекомендую этот товар!
«Розовая морская соль» КОММЕНТАРИИ: Идеально подходит для моих рецептов солевого скраба для ванн! Продолжу покупать эту смесь снова и снова !! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: Газированные напитки и соль для ванн ЧТО МНЕ НРАВИТСЯ ЧТО Я НУЖНО ИЗМЕНИТЬ • Насыщенный цвет
• Размер кристаллаКерри • Техас
Дата отправки: 31.07.2016
Я рекомендую этот товар!
«Спасибо!» КОММЕНТАРИИ: Я так взволнован тем, что сейчас это несет WSP.Розовые оттенки прекрасны, и мне не терпится использовать их в своих продуктах! ИСПОЛЬЗУЕМЫЙ ПРОДУКТ: мыло — растопить и разлить, газированные напитки и соль для ванн, отшелушивающие средства и сахарные скрабы. Сбалансированный солевой раствор Хэнка | Научно-исследовательские лаборатории ScienCell
Сбалансированный солевой раствор Хэнкса (HBSS) состоит из неорганических солей и дополнен глюкозой.Раствор можно использовать для промывания клеток и тканей и для поддержания клеток в жизнеспособном состоянии. Раствор забуферен фосфатом и поддерживает физиологический pH и осмотическое давление. HBSS стерильно фильтруется через мембрану 0,2 мкм.
Состав
Неорганические соли г / л
CaCL 2 дигидрат 0,185
MgSO 4 (безводный) 0.09767
KCl 0,4
KH 2 PO 4 (безводный) 0,06
NaHCO 3 0,35
NaCl 8,0
Na 2 PO 4 (безводный) 0,04788
Другое
D-глюкоза 1.0
Технические характеристики
pH 7,4 ± 0,2
Осмоляльность (мОсм) 290 ± 20
Эндотоксин (ЕС / мл) <0,1
Пропуск на стерильность
Паспорта продуктов
0313
Паспорта безопасности
Пожалуйста, войдите или зарегистрируйтесь, чтобы получить доступ к Паспорту безопасности сбалансированного солевого раствора Хэнка
Сертификаты анализа
Для конкретного номера партии, пожалуйста, выполните поиск ниже:
Напишите свой собственный отзыв
Только зарегистрированные пользователи могут оставлять отзывы.Пожалуйста, авторизуйтесь или зарегистрируйтесь
В настоящее время публикации отсутствуют
Индекс СМИ для BAM | FDA
M1 A-1 Средний M29a Агар Абейта-Хант-Барк м2 Ацетамид средний М3 Ацетатный агар М4 Кислотный бульон M5 Среда для споруляции AE, модифицированная [для C.perfringens ] M6 Агаровая среда P М7 AKI средний M8 Щелочной пептонный агар M9 Щелочной пептонно-солевой бульон (APS) M10 Щелочная пептонная вода M10a Среда ALOA (Agar Listeria Ottavani & Agosti) M11 Анаэробный агар M12 Анаэробный агар с яичным желтком M13 Углеводный бульон Андраде и индикатор M14 Антибиотическая среда №1 (агаровая среда A) M15 Антибиотическая среда № 4 (агаровая среда B) M16 Аргинин-глюкозный наклон (AGS) M17 Среда Бэрда-Паркера, pH 7,0 M17a Хромогенная среда биосинта (BCM) [для Listeria monocytogenes ] M18 Желчный эскулиновый агар M19 Висмут-сульфитный агар (Уилсон и Блэр) M20 Кровяной агар M20a База с кровяным агаром M21 Основа кровяного агара (инфузионный агар) M22 База кровяного агара № 2 (Difco) M23 Агар для инфузии мозга и сердца (BHI) (0.7%) [для стафилококкового энтеротоксина] M24 Бульон и агар Brain Heart Infusion (BHI) M25 Лактозный желчный бульон с бриллиантовым зеленым M26 Бромкрезоловый пурпурный бульон M27 Бромкрезоловый пурпурный бульон с декстрозой (BCP) M52 Буфер Listeria Обогащающий бульон, pH 7,3 ± 0,1 M192 Буферная пептонная вода (BPW) M192a Модифицированная забуференная пептонная вода с добавлением пирувата (mBPWp) и акрифлавин-цефсулодин-ванкомицин (ACV) M192b Модифицированная забуференная пептонная вода (mBPW) M28a Обогащенный бульон Campylobacter (формула Болтона) М31 Транспортная среда Кэри-Блэра M32 Бульон казаминокислоты-дрожжевой экстракт (CYE) M34 Казаминокислоты-дрожжевой экстракт-соли (CA-YE) Бульон (Горбач) M35 Цефсулодин-Иргасан Новобиоцин (CIN) Агар M36 Среда для роста клеток M189 Агар с целлобиозо-колистином (CC) M187 Раствор целлюлазы M37 Цетримидный агар M38 Отвар из рубленой печени M39 Цитратный агар Кристенсена M40 Агар мочевины Кристенсена M40a CHROMagar Listeria M40b Хромогенный Listeria Агар M41 Агароза Congo Red BHI (CRBHO), среда * M42 Приготовленное мясо Средняя M43 Приготовленное мясо Средне (модифицированное) M44 Базальная среда декарбоксилазы (аргинин, лизин, орнитин) M193 Бульон Дея-Энгли M184 Дихлоран 18% глицерин (DG18) агар M183 Агар с дихлорановой розой и бенгальским хлорамфениколом (DRBC) M45 Среда для споруляции Duncan-Strong (DS), модифицированная [для C.perfringens ] M46 Минимально необходимая среда Орла (цМем) (с солями Эрла и заменителями аминокислот) M47 Сбалансированные соли Эрла (без фенолового красного) M48 EB Среда подвижности M49 EC Бульон M50 EC-MUG средний M51 Эмульсия яичного желтка, 50% M196 mEndo MF Medium (BD # 274930) M197 LES Endo Agar (BD # 273620) M198 агар mTEC (BD # 233410) M53 Эскулиновый агар, модифицированный (CDC) M30b Морозильная среда. M54 Желатиновый агар (GA) M55 Желатиновый солевой агар (GS) M57 Раствор сульфата гентамицина M58 Ham’s F-10 средний M59 Сердечный инфузионный агар (HIA) (Difco) M60 Бульон и агар для сердечных инфузий (HI) [для Vibrio ] M61 Hektoen Enteric (HE) Agar M62 HC (Геморрагический колит E.coli ) Agar M63 Глюкозный бульон Хью-Лейфсона (HLGB) M64 Индол средний M65 Индольная среда (CDC) M66 Среда индола нитрита (триптический нитрат) M67 Иргасан-тикарциллин-хлоратный бульон M68 Железо-молочная среда (модифицированная) M69 King’s B Medium M70 King’s O / F Базальная среда М71 Железный агар Клиглера M72 Цитратный бульон Козера M73 L-15 средний (модифицированный) Leibovitz M74 Лактозный бульон M75 Лактозно-желатиновая среда [для C.perfringens ] M76 Бульон лаурилтриптозы (LST) M77 Лаурилтриптозная кружка (LST-MUG) Бульон M78 Агар Летин (модифицированный) M79 Бульон Летин (модифицированный) M80 Агар Левина с эозин-метиленовым синим (L-EMB) M81 Хлорид лития-фенилэтанол-моксалактам (LPM) Средняя M82 Хлорид лития-фенилэтанол-моксалактам LPM Plus, эскулин и трехвалентное железо M83 Печеночно-телячий агар M84 Агар с печенью, телятиной и яичным желтком M85 Среда для длительного хранения M86 Лизин-аргинин-железный агар (LAIA) M87 Бульон лизин декарбоксилазы (Falkow) [для Salmonella ] M88 Среда для лизиндекарбоксилазы (LDC) [для грамотрицательных неферментативных бактерий] M89 Лизиновый железный агар (Эдвардс и Файф) M90 Лизоцимный бульон M91 Агар МакКонки M92 Малонатный бульон M185 Солодовый агар (Массачусетс) M93 Агар с солодовым экстрактом (Косметика, общая микробиология) M182 Агар с солодовым экстрактом (дрожжи и плесень) (MEAYM) M94 Бульон с солодовым экстрактом (Difco) M95 Агар маннитол-яичный желток-полимиксин (MYP) M96 Маннитол Мальтозный агар M97 Маннитовый солевой агар M30a Основа модифицированного бескровного селективного агара Campylobacter (CCDA) M98 Агар модифицированный целлобиоза-полимиксин B-колистин (mCPC) M103a Modified Oxford Listeria Selective Agar M99 Среда подвижности-индола-орнитина (МИО) M100 Подвижная среда для B.cereus) M101 Нитрат подвижности средний (для косметики) M102 Среда с подвижными нитратами, забуференная [для C. perfringens ] M103 Среда для определения подвижности (полутвердая) M104 Бульон MR-VP M105 Бульон мукате M106 Бульон для контроля слизи M107 Агар Мюллера-Хинтона M108 Нитратный бульон M109 Нитратный бульон, обогащенный (CDC) M110 Среда для восстановления нитратов и реагенты M111 Обезжиренное сухое молоко (восстановленное) M112 Питательный агар M113 Питательный агар (для B.cereus) M114 Питательный бульон M115 Питательный желатин (CDC) [для грамотрицательных неферментативных бактерий] M116 OF Глюкозная среда, полутвердая M118 Оксфорд, средний M117 Окислительно-ферментативная (OF) испытательная среда M118a PALCAM Listeria Selective Agar M56a Раствор папаина, 5% M119 Раствор пенициллин-стрептомицин M120 Пептон Сорбитол желчный бульон M121 Феноловый красный углеводный бульон M122 Феноловый красный глюкозный бульон M123 Агар фенилаланиндезаминазы M124 Агар для подсчета на чашках (стандартные методы) M125 Бульон PMP M126 Бульон с цианидом калия (KCN) M127 Картофельный агар с декстрозой M128 Агар Pseudomonas F (для производства флуоресцеина) M129 Агар Pseudomonas P (для производства пиоцианина) M130 Пурпурный углеводный бульон M130a Основа для ферментационного бульона с пурпурными углеводами M131 Пиразинамидазный агар * M131a Rapid ‘ л.моно средний M132 Средний Раппапорта-Вассилиадиса M133 Декстрозный бульон и агар Сабуро M134 Селенитно-цистиновый бульон M30d Полутвердая среда, модифицированная, для биохимической идентификации M30c Полутвердая среда, модифицированная, для хранения культур M135 Агар с овечьей кровью M195 Компоненты и инструкции SHIBAM M136 Бульон шигелл M137 SIM Motility Medium M138 Цитратный агар Симмонса M139 Сорбитол-агар МакКонки M140 Бульон споруляции (для C.perfringens) M141 Среда для ферментации в опрыскивании [для C. perfringens ] M142 Staphylococcus Agar No. 110 M143 Крахмальный агар M144 T 1 N 1 Средний M194 Теллурит, цефиксим — сорбитовый агар МакКонки (TC-SMAC) M145 Тетратионатный бульон M146 Тиогликолатная среда (жидкость) (FTG) M147 Агар тиосульфат-цитрат-желчные соли-сахароза (TCBS) M148 Толуидиновый синий ДНК-агар M149 Тройной сахарный железный агар (TSI) M150 Бульон с триптиказой и новобиоцином (TN) M151 Бульон триптиказо-пептон-глюкоза-дрожжевой экстракт (TPGY) M151a Бульон триптиказо-пептон-глюкоза-дрожжевой экстракт с трипсином (TPGYT) M152 Триптиказный (триптический) соевый агар M152a Триптиказо-соевый агар-сульфат магния-NaCl (TSAMS) M153 Триптиказо-соевый агар с 0.6% дрожжевой экстракт (TSAYE) M154 Триптиказ (триптик) соевый бульон M156 Триптиказо-соевый бульон, модифицированный (mTSB) M186 Триптиказный (триптический) соевый бульон (TSB) с сульфатом железа M155 Триптиказный (триптический) соевый бульон (TSB) с глицерином M154a Триптиказный (триптический) соевый бульон с 10% NaCl и 1% пирувата натрия M157 Триптиказо-соевый бульон с 0.6% дрожжевой экстракт (TSBYE) M158 Триптиказо-соево-полимиксиновый бульон M159 Триптиказо-соевый агар с овечьей кровью M160 Триптиказо-соево-триптозный бульон M164 Триптоновый (триптофановый) бульон, 1% M161 Триптоновый бульон и бульоны с триптонной солью M162 Триптонфосфатный бульон M163 Триптонная соль (T 1 N 1 ) Агар и T 1 N 2 Агар M165 Триптонный агар с дрожжевым экстрактом M166 Основа триптозного кровяного агара M167 Триптозный бульон и агар (для серологии) M168 Триптозофосфатный бульон (TPB) M169 Триптозо-сульфит-циклосериновый агар (TSC) M170 Тирозиновый агар M188 Универсальный обогатительный бульон M188a Универсальный бульон для обогащения (без цитрата железа и аммония) M171 Бульон мочевины M172 Бульон мочевины (Rapid) M173 Агар и бульон для инфузии телятины M191 Vibrio parahaemolyticus сахарозный агар (VPSA) M190 Vibrio vulnificus Агар (VVA) M174 Фиолетово-красный желчный агар (VRBA) M175 Фиолетово-красный агар желчных кружек (VRBA-MUG) M176 Агар Фогеля-Джонсона (VJ) M177 Среда Фогеса-Проскауэра (модифицированная) M178 Агар Вагацума M179 Агар с ксилозолизин-дезоксихолатом (XLD) M180 Y-1 Среда для роста клеток надпочечников M181 Агар с дрожжевым экстрактом (YE) .
- Предскажите, будет ли pH каждой из следующих солей, помещенных в воду, кислотным, основным или нейтральным.
