Содержание
Химические свойства амфотерных оксидов | CHEMEGE.RU
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.

- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Оксиды. Химические свойства и способы получения » HimEge.ru
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2.
По способности образовывать соли оксиды делят на солеобразующие и несолеобразующие (СО,SiO,NO,N2О). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li2О, Na2О, К2О, Cs2О, Rb2О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu2O, CuO, Ag2O, СrO, FeO, MnO, СоO, NiO).
Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO3,Сl2O7,Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2). Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый газ NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Аl2O3 и ZnO, другие — бесцветные (H2O, CO2, SO2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества молекулярного строения (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества молекулярного строения (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Химические свойства оксидов
Al2O3+6KOH+3H2O=2K3[Al(OH)6] — гексагидроксоалюминат калия;
ZnO+2NaOH+H2O=Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
Смотрите также:
Основные оксиды — получение и химические свойства
Кислотные оксиды — получение и химические свойства
Химические свойства амфотерных оксидов
Задания 8 ЕГЭ по химии тест онлайн
Адрес этой страницы (вложенность) в справочнике dpva. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | |||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||
Химия
ОКСИДЫ
Оглавление:
1. Определение
Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Задания
7. Ответы
|
Оксиды – это сложные
|
КЛАССИФИКАЦИЯ
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Оксиды не диссоциируют на ионы.
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ
1. Взаимодействие металлов с кислородом:
4Li+O2= 2Li2O
2. Взаимодействие неметаллов с кислородом:
S+O2=
SO2
3. Разложение оснований при нагревании:
Разложение оснований при нагревании:
Cu(OH)2=CuO+H2O
4. Разложение некоторых солей при нагревании:
CaCO3=
CaO+ CO2
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
Основные оксиды:
1. Основный оксид + вода = основание
Na2O + H2O = 2NaOH
2. Основный оксид + кислота = соль + вода
CaO + 2HCl
= CaCl2 +H2O
3. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
Кислотные оксиды:
1. Кислотный оксид + вода = кислота
P2O5+3H2O = 2H3PO4
2. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH
= Na2SO4
+ H2O
3. Кислотный оксид + основный оксид = соль
Кислотный оксид + основный оксид = соль
CaO + SO3 = CaSO4
Амфотерные оксиды:
1. Амфотерный оксид + кислота = соль(1 типа) + вода
ZnO +H2SO4
= ZnSO4 + H2O
2. Амфотерный оксид + щёлочь = соль(2 типа) +
вода
ZnO + 2NaOH = Na2ZnO2
+ H2O
Оксиды некоторых металлов можно восстановить до
металла при нагревании с углём, оксидом углерода(II),
водородом или алюминием (алюминотермия).
Fe2O3 + 3C = 2Fe + 3CO
CuO + H2 = Cu + H2O
Fe2O3 + 2Al = 2Fe + Al2O3
NiO + CO = Ni + CO2
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
оксиды, назовите их, определите тип.
1)Na2O2 2)
Li2O 3) Al 2O3
4) FeO 5) P2O5 6) CO2 7) OF2
8) MgO
Задание 2. С
С
какими из перечисленных веществ может реагировать а)
Li2O
б)CO2 в)Al2O3
1)Na2O 2)SO3 3)H2O
4)NaOH 5)H2SO4 6)Na2SO4
7)O2 8) AlCl3
ОТВЕТЫ.
Наверх
Химическая основа деления оксидов на кислотные, основные и амфотерные группы Текст научной статьи по специальности «Химические науки»
УДК 541.6
О. С. Сироткин, Р. О. Сироткин, Д. Ю. Павлов, А. М. Трубачева
ХИМИЧЕСКАЯ ОСНОВА ДЕЛЕНИЯ ОКСИДОВ
НА КИСЛОТНЫЕ, ОСНОВНЫЕ И АМФОТЕРНЫЕ ГРУППЫ
Ключевые слова: оксиды, химическая природа, химическая связь, степени ковалентности, металличности и ионности, кислотность, основность, амфотерность.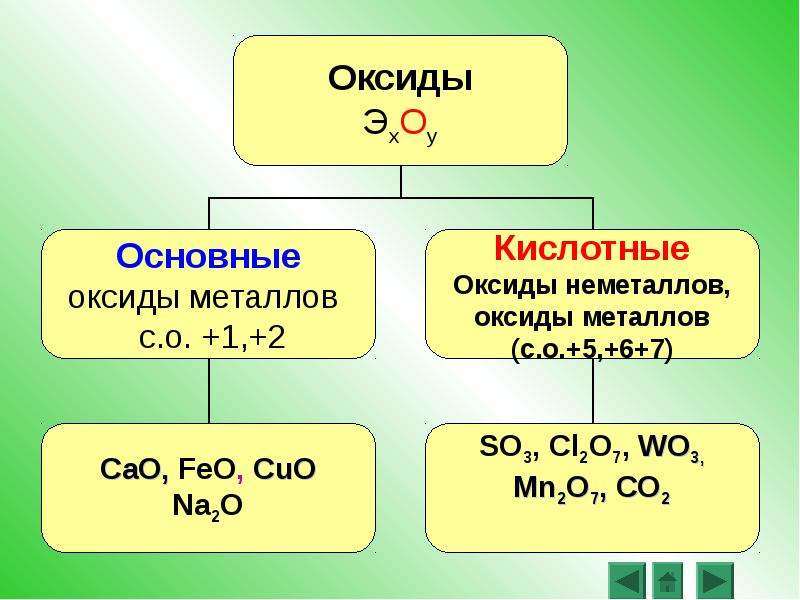
На основании данных о соотношении компонент (степеней ковалентности, металличности и ионности) гетероя-дерных связей Э-О вскрыта специфика химической природы кислотных, амфотерных и основных оксидов.
Key words: oxides, chemical nature, covalent character, metallic character, ionic character, acidity, basicity, amphoterism.
On the basis of ratio of heteronuclear bonds’ components (covalent, metallic and ionic characters), the specificity of chemical nature of acidic, amphoteric and basic oxides was shown.
Традиционно в химии разделение бинарных оксидных соединений на кислотные, основные и амфотерные группы опирается на их способность при взаимодействии с водой образовывать разные типы соединений. То есть, кислотные оксиды (например, серы, фосфора и кремния) при взаимодействии с водой образуют кислоты (1), основные оксиды (например, магния и натрия) — гидроксиды — основания (2), а амфотерные оксиды являются промежуточными соединениями [1,2]. При этом, кислотные оксиды образуют соли при взаимодействии с основаниями, основные — с кислотами, а амфотер-ные оксиды, типа оксида алюминия не взаимодействуя с водой, образуют соли и выступают при взаимодействии с кислотами в качестве основных оксидов (3), а при взаимодействии с щелочами в качестве кислотных оксидов (4). Например,
При этом, кислотные оксиды образуют соли при взаимодействии с основаниями, основные — с кислотами, а амфотер-ные оксиды, типа оксида алюминия не взаимодействуя с водой, образуют соли и выступают при взаимодействии с кислотами в качестве основных оксидов (3), а при взаимодействии с щелочами в качестве кислотных оксидов (4). Например,
БОз + Н2О = Н28С>4 (1)
кислотный
МдО + Н2О = Мд(ОН)2 (2)
основной
АЬОз + 6НС1 + 9Н2О = 2{А1 (ОН2)б}С1з (3) основной
АЬОз + 6№ОН + ЗН2О = 2№з{А! (ОН)б} (4)
кислотный
При этом трансформация сильно-, средне-слабокислотных оксидов в амфотерные и далее в слабо- и сильноосновные связывается либо с эффективным зарядом кислорода [2,с. 300], либо с прочностью связи между кислородом и элементом в оксиде или между кислородом и водородом в кислотах и гидроксидах [1, с.250].
300], либо с прочностью связи между кислородом и элементом в оксиде или между кислородом и водородом в кислотах и гидроксидах [1, с.250].
Однако до сих пор отсутствуют исследования по оценке влияния специфики химической природы этих бинарных соединений на эти их свойства, то есть специфики химических связей, образующих эти оксиды и их химического строения в целом. Это связано, по мнению авторов, прежде всего с тем, что традиционные подходы диктуют поиск физического смысла, как якобы фундаментального во всех материальных объектах и не только в классических химических явлениях, но и в других биологических, механических и т. д. процессах, где и искать его некорректно. Ведь в рамках парадигмы многоуровне-
вой организации материи, вещества, материальных тел и Системы Мироздания в целом [3,4] современный смысл понятия фундаментальности изменился [3-5]. Сегодня в рамках интегрально-дифференциального этапа развития знания предлагается не поиск влияния одних более низких уровней строения вещества на другие более высокие (например, физического элементарного или атомного на химический или биологический уровни и т. д.), а смешанный подход. Хотя и эта интегральная составляющая исследования тоже важна. Но это проблема, прежде всего, философии и естествознания в целом, а не физики [4-7]. А вот нахождение ответа на вопрос об индивидуальных особенностях строения (состав, тип связи и пространственная структура) и свойств каждого из этих разных уровней организации материи (дифференциальная составляющая познания), вещества физического, химического, биологического и т. д. и раскрывает их фундаментальность. И это, в свою очередь, и составляет специфику (фундаментальность отличий) объекта и предмета исследования таких наук как физика, химия, биология и т.д. [3-7]. Поэтому естественней было бы в нашем случае поискать все-таки именно химический фундаментальный смысл, определяющий специфику природы этих различных по свойствам оксидов. А это, возможно, прежде всего, через оценку специфики химических связей в соответствующих соединениях, определяющих их структуру и свойства [3,8,9]. А физический смысл, необходимо искать, прежде всего, в классических физических явлениях, связанных с полевой формой существования материи, а также в элементарных и атомарных веществах, структура и свойства которых определяется фундаментальными физическими взаимодействиями элементов их составляющих.
д.), а смешанный подход. Хотя и эта интегральная составляющая исследования тоже важна. Но это проблема, прежде всего, философии и естествознания в целом, а не физики [4-7]. А вот нахождение ответа на вопрос об индивидуальных особенностях строения (состав, тип связи и пространственная структура) и свойств каждого из этих разных уровней организации материи (дифференциальная составляющая познания), вещества физического, химического, биологического и т. д. и раскрывает их фундаментальность. И это, в свою очередь, и составляет специфику (фундаментальность отличий) объекта и предмета исследования таких наук как физика, химия, биология и т.д. [3-7]. Поэтому естественней было бы в нашем случае поискать все-таки именно химический фундаментальный смысл, определяющий специфику природы этих различных по свойствам оксидов. А это, возможно, прежде всего, через оценку специфики химических связей в соответствующих соединениях, определяющих их структуру и свойства [3,8,9]. А физический смысл, необходимо искать, прежде всего, в классических физических явлениях, связанных с полевой формой существования материи, а также в элементарных и атомарных веществах, структура и свойства которых определяется фундаментальными физическими взаимодействиями элементов их составляющих. Отметим, что на качественном уровне в учебнике [10], в отличие от физических объяснений данного явления [1,2], отмечается, что в периодах Периодической системы слева направо свойства оксидов и гидроксидов изменяются в направлении: основные — амфотерные -кислотные. Причем «В этом же направлении усиливается ковалентность связи Э-О в оксидах и ион-ность связи О-Н в гидроксидах» [10]. Однако до последнего времени не было возможности для проведения исследований по количественной оценке
Отметим, что на качественном уровне в учебнике [10], в отличие от физических объяснений данного явления [1,2], отмечается, что в периодах Периодической системы слева направо свойства оксидов и гидроксидов изменяются в направлении: основные — амфотерные -кислотные. Причем «В этом же направлении усиливается ковалентность связи Э-О в оксидах и ион-ность связи О-Н в гидроксидах» [10]. Однако до последнего времени не было возможности для проведения исследований по количественной оценке
вклада различных составляющих в химическую связь, пока в 2003 году [3] не была создана единая модель химической связи в гомо- и гетероядерных соединениях, а также затем и методики количественного учета в них трех компонент — ковалентной (СК), металлической (СМ) и ионной (СИ), выражаемой в процентах [9,11].
Целью настоящей работы является оценка влияния химической природы бинарных соединений, типа оксидов, через соотношение ковалентной, металлической и ионной составляющих связи Э-Она их способность к образованию кислотных, основных или амфотерных по свойствам соединений.
В качестве объекта исследования выбраны бинарные гетероядерные соединения со связями Э-О (оксиды), где основой химического элемента Э являются атомы 3-го периода Периодической системы Д.И. Менделеева. Это ряд оксидов натрия, магния, алюминия, кремния, фосфора, серы и хлора. В соответствии с единой моделью химической связи [3] гомо- и гетероядерных соединений, а также с методикой количественного расчета в них двух (СК и СМ в %) или трех компонент (СК, СМ и СИ, в %) ее составляющих [9,11], приведем значения этих компонент для вышеотмеченного ряда оксидов в табл. 1.
Таблица 1 — Значения компонент связи оксидов
Ыа2О МдО АЬОз Э1О2 Р2О5 ЭОз
СК (%): 32,6 38,6 46,7 51,7 57,9 67,7
СМ (%): 25,7 24,4 23,1 22,4 21,4 19,6
Си (%): 41,7 37,0 30,2 25,9 20,7 12,7
Уменьшение основных и рост кислотных свойств оксидов в этом ряду с химической точки зрения в рамках единой модели химической связи определяется следующим образом: [3] это связано с постепенным ростом локализации обобществленных (валентных) электронов (ОЭ) в межъядерном пространстве на оси У, соединяющей Э и О с одновременным симбатным уменьшением металлической (делокализация ОЭ вдоль оси X) и ионной (локализация ОЭ на кислороде) компонент связи Э-О [9,11]. Причем именно промежуточное по СК, СМ и СИ (между сильно основным оксидом натрия и сильно кислотным оксидом серы) положение А!2О3 и объясняет его амфотерные свойства. Это в итоге, приводит к минимальной энергии связи Э-О в основных оксидах (по мере роста СМ и СИ) и максимуму роста энергии связи в оксиде кремния. Причем далее по мере роста СК и уменьшению СМ и СИ в оксидах фосфора и серы энергии связи Э-О начинают уменьшаться [12]. Это можно связать со следующим характером влияния в гетероядерных соединениях специфики химической связи на ее длину [3,14], и, следовательно, энергию. У существенно ковалентных соединений по мере увеличения ион-ности связи межъядерное расстояние уменьшается (правило Шомэкера-Стивенсона), в преимущественно ионных соединениях — растет (правило Полинга).
Причем именно промежуточное по СК, СМ и СИ (между сильно основным оксидом натрия и сильно кислотным оксидом серы) положение А!2О3 и объясняет его амфотерные свойства. Это в итоге, приводит к минимальной энергии связи Э-О в основных оксидах (по мере роста СМ и СИ) и максимуму роста энергии связи в оксиде кремния. Причем далее по мере роста СК и уменьшению СМ и СИ в оксидах фосфора и серы энергии связи Э-О начинают уменьшаться [12]. Это можно связать со следующим характером влияния в гетероядерных соединениях специфики химической связи на ее длину [3,14], и, следовательно, энергию. У существенно ковалентных соединений по мере увеличения ион-ности связи межъядерное расстояние уменьшается (правило Шомэкера-Стивенсона), в преимущественно ионных соединениях — растет (правило Полинга).
В работе [15] было показано, что правила Шомэке-ра-Стивенсона и Полинга — это следствия более общего закона нелинейного изменения длины химической связи в зависимости от степени ее ионности. Поскольку связи между ядрами молекулярных соединений всегда имеют преимущественно кова-лентный характер, можно считать, что для них вполне приемлемо уравнение Шомэкера-Стивенсона.
Поскольку связи между ядрами молекулярных соединений всегда имеют преимущественно кова-лентный характер, можно считать, что для них вполне приемлемо уравнение Шомэкера-Стивенсона.
В результате, мы имеем две различные по химической структуре и свойствам группы оксидов (и еще одну промежуточную между ними), первая из которых является немолекулярной (преимущественно ионной) бертоллидного типа (Ыа2О и МдО), а вторая молекулярной (преимущественно ковалент-ной) дальтонидного дискретного типа(Б1О2, Р2О5 иЭО3) [3], характеризуемой постоянным составом. Это связано с четким пониманием химического смысла понятия молекулы (моно-, олиго- или макромолекула), как индивидуального преимущественно ковалентного гомо- или гетероядерного соединения в котором число химических элементов (ядер или атомных остовов) ввиду насыщаемости и направленности данного типа взаимодействия конечно. Например, молекула О2, как индивидуальное молекулярное химическое гомоядерное соединение построенное преимущественно ковалентной связью О-О (СК =89,4 и СМ =10,60%), при добавлении еще одного атомного остова кислорода превращается уже в озон, имеющий другую химическую структуру и комплекс свойств.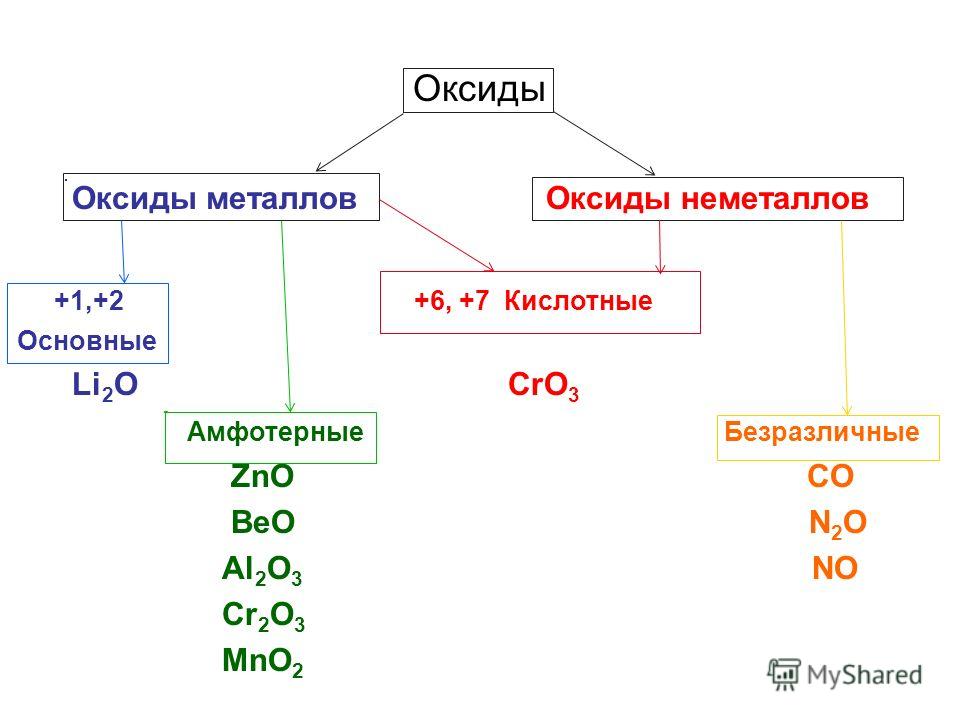 То же самое можно сказать о молекулах Н2О и Н2О2. В свою очередь, ни Ыа2О или ЫаО! (как преимущественно ионные соединения), ни чистые металлы (как преимущественно металлические соединения) не имеют в своей структуре молекул, а добавление или убавление в структуре их кристаллических решеток одной или нескольких элементарных ячеек не изменяет их химической структуры и свойств. А меняется только масса ионного или металлического химического вещества.
То же самое можно сказать о молекулах Н2О и Н2О2. В свою очередь, ни Ыа2О или ЫаО! (как преимущественно ионные соединения), ни чистые металлы (как преимущественно металлические соединения) не имеют в своей структуре молекул, а добавление или убавление в структуре их кристаллических решеток одной или нескольких элементарных ячеек не изменяет их химической структуры и свойств. А меняется только масса ионного или металлического химического вещества.
В результате, кислотные молекулярные оксиды, характеризуемые более прочной ковалентной связью Э-О, при взаимодействии с водой (например, реакция 1) образуют дополнительно гидроксильные -ОН группы, связанные с Э (серой, фосфором или кремнием), где звено Э-О-Н составлено из 2-х кова-лентных связей Э-О и О-Н. Однако эти две связи не равноценны по соотношению химических компонент. Если для связи О-Н СК равна 54,50 %, СМ = 21,94, а СИ = 23,56 [9], то для исследуемых кислотных оксидов серы и фосфора значения СК связи Э-О являются большими, а значения СИ, как показано выше, значительно меньшими. БО3ионность связи Э-О монотонно падает(25,9; 20,7 и 12,7%, соответственно), определяя рост кислотности через облегчение диссоциации кислот на их основе с отщеплением от них ионов водорода, а не гидроксид — ионов. Особо следует отметить важность оценки влияния соотношения компонент химических связей в различных химических соединениях на разницу величин констант диссоциации одних и тех же групп в составе одного соединения, в том числе и катионов водорода (Н+), гидроксид -ионов (ОН ) и т.д.
БО3ионность связи Э-О монотонно падает(25,9; 20,7 и 12,7%, соответственно), определяя рост кислотности через облегчение диссоциации кислот на их основе с отщеплением от них ионов водорода, а не гидроксид — ионов. Особо следует отметить важность оценки влияния соотношения компонент химических связей в различных химических соединениях на разницу величин констант диссоциации одних и тех же групп в составе одного соединения, в том числе и катионов водорода (Н+), гидроксид -ионов (ОН ) и т.д.
Таким же образом становится понятным и фундаментальная химическая основа специфических свойств основных оксидов, определяемая через соотношение трех компонент связи, особенности химического взаимодействия элементов соединений и их структуру. Например, рост и преобладание СИ связи Э-Ов паре МдО (37,0%) и №2О (41,7%), по сравнению со связью О-Н (СИ = 23,6%), являющейся к тому же и преимущественно ковалентной (54,50 %), определяет большую вероятность диссоциации гидроксидов на их основе с отщеплением от них уже не ионов водорода (Н ), а гидроксид-ионов (ОН ). Что очевидно связано с большей потенциальной способностью гетеролитического разрыва связи Э+п(ОН)-т (где, Э -№, Мд и т.д.) с отрывом аниона ОН (гидроксильная группа), а не Н+от кислотного соединения типа Н+п(ЭО) т (где, Э -Б1, Р, Б и т. д.).
РК1> рКй
Д.1С О! # АЮ (НАЮг) ЯЮ Ж..ЯЮ л
!А1 Н1. > ■ +■
Л90
1 Мд(ОН): РО (Н.РО }
1МяП (МаОН)
■ )-
4
П 1ГЬ М ¥1 411 VI ГЛ 711 НИ СК, %
Рис. 1 — Влияние СК связи Э-О в оксидах на показатели констант кислотности (рКа) и основности (рКЬ) их систем с водородом
Ход влияния этих трех компонент связи (таблица и рисунок) для исследуемых оксидов и их тройных систем с водородом в периоде слева направо напоказатель константы кислотности первой ступени в гидроксиде (ОН ) или кислоте (Н ) приведен на вышеприведенном рисунке. Главный вывод из
этого очевиден, с ростом СК и симбатным уменьшением СМ и СИ изменение константы кислотности протекает в этом ряду через экстремум. Амфотер-ные оксиды, типа А12О3,находятся в середине этой зависимости, так как характеризуются промежуточными между основными и кислотными оксидами значениями всех трех компонент химической связи (см. табл. 1 и рис. 1) и как следствие невысокой вероятностью диссоциации в тройных системах с водородом. То есть, этот максимум характерен для слабоосновных и слабокислотных оксидов (середина зависимости рисунка).
Совокупность полученных данных по соотношению компонент химических связей Э-О в разных соединениях свидетельствует о прямом влиянии химической природы оксидов на их разделение на группы: кислотные, амфотерные и основные.
Литература
1. Глинка, Н.Л.Общая химия / Н.Л. Глинка. — М.: КноРус, 2010. — 752 с.
2. Ахметов, Н.С.Общая и неорганическая химия / Н.С. Ахметов. — М.: Высшая школа, 1988. — 640 с.
3. Сироткин, О. С. Начала единой химии (Унитарность как основа формирования индивидуальности, раскрытия уникальности и фундаментальности химической науки) / О. С. Сироткин. — Казань: изд. АН РТ «Фэн», 2003. -252 с.
4. Карпенков СХ.Концепции современного естествознания. М.: Высшая школа, 2003, 488с.
5. СироткинО. С. Интегрально-дифференциальные основы унитарной концепции естествознания (Парадигма многоуровневой организации материи как естественная основа многообразия и единства природы объектов системы Мироздания). Казань: КГЭУ. 2011. 268 с.
6. Сироткин О.С. Химия на своем месте // Химия и жизнь. 2003, № 5. — С. 26-29.
7. Сироткин О. С. Единая парадигма химического и физического межмолекулярного взаимодействий / О. С. Сироткин, Р.О. Сироткин, П.Б.Шибаев // Вестник Казанского технологического университета. — 2011. — №1. — С.22 — 32.
8. Сироткин Р.О. Электронно-ядерная, молекулярная и надмолекулярная структура полимерных материалов и их физико-механические свойства («Состав — тип связи — структура — свойства» в полимерах и металлах). — Казань: Казан. гос. энерг. ун-т, 2006. — 240 с.
9. Сироткин,О. С.Характеристики гомо- и гетероядерных связей тонкой электронно-ядерной структуры и их влияние на свойства металлических и неметаллических материалов / О. С. Сироткин, Р. О. Сироткин, А. М. Трубачева — Казань: КГЭУ, 2009. — 304 с.
10. КоровинН.В., Масленникова Г.Н, Гуськова Л.Г. и ср.Курс общей химии/ под ред. Н.В. Коровина. — М.: Высшая школа, 1981. — 431 с.
11. Сироткин, О. С. О необходимости и методике учета металлической компоненты гетероядерной связи / О. С. Сироткин, Р. О. Сироткин,А. М. Трубачева // Журнал неорганической химии. 2005, Т. 50. №1. С. 71.
12. Сироткин, О. С. Неорганические полимерные вещества и материалы (Безуглеродные макромолекулы и полимеры) / О. С. Сироткин. — Казань: КГЭУ, 2002. — 288 с.
13. Сироткин О.С. Основы теоретического материаловедения/О. С. Сироткин, Р. О. Сироткин — Казань: КГЭУ, 2010. — 300 с.
14. Паулинг Л. Природа химической связи. М.-Л.: Гос. Н./т. изд. хим. лит-ры, 1947, 440 с.
15. Бацанов С.С., Пахомов В.И. Кристаллография, — М.: Мир, 1957, 183 с.
16. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Справ. изд. /Под ред. А.А. Потехина и А.И. Ефимова., 3 изд.,перераб. и доп. Л.: Химия. 1991, 432 с.
17. Новый справочник химика и технолога. Химическое равновесие. Свойства растворов. С.-Пб.:АНО НПО «Профессионал», 2004 — 998 с.
© О. С. Сироткин — д-р техн. наук, проф., зав. каф. материаловедения и технологии материалов КГЭУ, [email protected]; Р. О. Сироткин — канд. хим. наук, доц. каф. технологии пластических масс КНИТУ; доц. каф. химии КГЭУ, [email protected]; Д. Ю. Павлов — асп. каф. материаловедения и технологии материалов КГЭУ; А. М. Трубачева — канд. техн. наук, ст. преп. той же кафедры.
Подготовка к ЦТ и ЕГЭ по химии
Классификация и свойства оксидов
Как вы уже знаете, все вещества делятся на простые и сложные. В свою очередь сложные вещества делятся на четыре класса: оксиды, основания, кислоты и соли. Каждое из неорганических соединений так или иначе является представителем какого-либо одного класса веществ, хотя есть и исключения. Так, например, пероксид бария BaO2 хотя и относится к классу оксидов, проявляет свойства солей.
Оксидами же называются сложные вещества, состоящие из двух элементов, один из которых кислород, т.е. оксид – это соединение элемента с кислородом.
Название оксидов образуется от названия элемента, входящего в состав оксида. Например, BaO – оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой. Например, FeO – оксид железа (I), Fe2О3 – оксид железа (III).
Элементы, обладающие постоянной валентностью, образуют только основные, кислотные или амфотерные оксиды. Элементы с переменной валентностью могут образовывать различные оксиды.
Все оксиды делятся на солеобразующие и несолеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота N2O (I), оксид азота NO (II), оксид кремния (II) и оксид углерода (II).
По своим химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H2SO4 = CuSO4 + H2O
Растворимые в воде основные оксиды (оксиды металлов I и IIA группы из периодической системы) вступают в реакцию с водой, образуя основания:
CaO + H2O = Ca(OH) 2
Большинство основных оксидов с водой не взаимодействуют, но им также соответствуют основания, которые можно получить косвенным путем.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na2O + SO3 = Na2SO4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B2O3; Mn2O7).
Многие кислотные оксиды соединяются с водой, образуя кислоты:
N2O3 + H2O = 2HNO2
SO3 + H2O = H2SO4
Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.
Кислотные оксиды реагируют с основными оксидами с образованием соли:
CO2 + CaO = CaCO3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + Ba(ОН)2= BaCO3 + H2O
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например – Al2O3, Cr2O3, MnO2; Fe2O3 ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O (при нагревании)
ZnO + 2NaOH + H2O= Na2[Zn(OH)4] (в растворе)
Так как далеко не все амфотерные оксиды растворимы в воде, то доказать амфотерность таких оксидов заметно сложнее. Например, оксид алюминия (III) в реакции сплавления его с дисульфатом калия проявляет основные свойства, а при сплавлении с гидроксидами – кислотные:
Al2O3 + 3K2S2O7 = 3K2SO4 + A12(SO4)3
Al2O3 + 2KOH = 2KAlO2 + H2O
У различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) – Fe2O3 – обладает преимущественно основными свойствами.
Способы получения оксидов из простых веществ – это либо прямая реакция элемента с кислородом:
2Ca + O2 = 2CaO
либо разложение сложных веществ:
а) оксидов
4CrO3 = 2Cr2O3 + 3O2
б) гидроксидов
Ca(OH)2 = CaO + H2O
в) кислот
H2CO3 = H2O + CO2
г) солей
CaCO3 = CaO +CO2
А также взаимодействие кислот – окислителей с металлами и неметаллами:
Cu + 4HNO3(конц) = Cu(NO3) 2 + 2NO2 + 2H2O
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Оксидами
называются сложные вещества, которые
состоят из кислорода (в степени окисления
-2) и другого элемента.
Основные
– это оксиды, которым соответствуют
основания. К2О
– КОН; ВаО – Ва(ОН)2;
La2O3
– La(OH)3.
Кислотные
– это оксиды, которым соответствуют
кислоты. SO3
–H2SO4;
CO2
– H2CO3;
SO2
– H2SO3
и
т.д.
Амфотерные
– это оксиды, которым соответствуют
амфотерные основания. ZnO
– Zn(OH)2;
Al2O3
– Al(OH)3.
Из
основных, кислотных и амфотерных оксидов
можно получать соли, поэтому их называют
солеобразующими,
но имеется небольшая группа оксидов,
которые солей не образуют. У них нет
соответствующих кислот и оснований,
поэтому они называются несолеобразующими
(безразличными). К ним относятся СО,
N2O,
NO,
SiO.
Неметаллы
образуют кислотные
и несолеобразующие оксиды, а металлы,
в зависимости от степени
их окисления,
могут образовывать и основные, и
амфотерные, и кислотные оксиды.
Если
степень окисления металла +1
и +2,
то оксиды обладают основными
свойствами, за исключением
ZnO,
BeO,
SnO,
PbO.
Слабыми амфотерными свойствами обладают
Ag2O
и Cu2O.
Если
степень окисления металла +3
и +4,
то оксиды обладают амфотерными
свойствами, за исключением
La2O3,
Bi2O3,
Tl2O3,
которые обладают основными свойствами.
При степени окисления металла больше
+4
оксиды являются кислотными.
Химические
свойства оксидов
определяются их взаимодействием с
водой, кислотами и основаниями.
1.
Основные оксиды
наиболее активных металлов (щелочных
и щелочно-земельных) взаимодействуют
с водой с образованием сильных оснований
– щелочей.
Основные
оксиды менее активных металлов с водой
при обычных условиях не взаимодействуют.
Все
основные оксиды взаимодействуют с
кислотами с образованием соли и воды.
С
основаниями основные оксиды не
взаимодействуют.
2.
Многие кислотные оксиды
взаимодействуют с водой с образованием
кислот:
Некоторые
кислотные оксиды при обычных условиях
с водой не взаимодействуют.
Все
кислотные оксиды взаимодействуют с
основаниями с образованием соли и воды.
С
кислотами кислотные оксиды не
взаимодействуют.
3.
Основные и кислотные
оксиды
взаимодействуют между собой с образованием
соли.
4.
Амфотерные оксиды
обладают и основными и кислотными
свойствами, поэтому реагируют и с
кислотами, и с основаниями. В этих
реакциях образуются соль и вода.
Амфотерный оксид Al2O3
реагирует с кислотой:
Он
же взаимодействует с основаниями. При
взаимодействии с расплавленными
щелочами образуется алюминат натрия,
а в водном растворе щелочи – комплексная
соль (тетрагидроксоалюминат(III)
натрия).
5.
Амфотерные оксиды
взаимодействуют с кислотными и основными
оксидами, а также между собой. Обычно
эти реакции идут при нагревании с
образованием солей.
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
С
точки зрения теории электролитической
диссоциации основаниями
называются электролиты, при диссоциации
которых в качестве анионов образуются
только гидроксид-ионы.
КОН
К+
+ ОН— NH4OH
NH4+
+ OH—
Гидроксид
щелочных и щелочно-земельных металлов
являются растворимыми и называются
щелочами. К растворимым основаниям
относится и гидроксид аммония, но это
слабый электролит.
По
взаимодействию с другими веществами
основания подразделяются на типичные
и амфотерные. К типичным основаниям
относятся все щелочи, а также Mg(OH)2,
Mn(OH)2,
La(OH)3,
Bi(OH)3
и некоторые другие.
Все
гидроксиды (вещества, содержащие в
своем составе ОН-группу) подразделяются
на основные, амфотерные и кислотные.
Это зависит от заряда катиона металла.
Если заряд катиона металла +1 или +2, то
гидроксид обладает основными свойствами,
но есть исключения La(OH)3,
Bi(OH)3,
Tl(OH)3
– являются основаниями, а Be(OH)2,
Sn(OH)2,
Pb(OH)2,
Zn(OH)2,
Ge(OH)2
хотя и имеют заряд катиона металла +2,
являются амфотерными основаниями.
В
Na
– OН
заряд катиона натрия +1, он слабо
притягивает кислород ОН-группы и связь
Na
– O
слабая. Происходит разрыв по этой связи
при диссоциации электролита в воде.
Na
– OН
Na+
+ ОН—
Амфотерными
основаниями являются гидроксиды,
катионы металла которых имеют заряд
+3 и +4, за некоторым исключением,
приведенным выше.
В
зависимости от условий опыта их
диссоциация может происходить как по
основному, так и по кислотному типу.
H+
+ HZnO2—
HO
– Zn – OH
ZnOH+
+ OH—
основных и амфотерных гидроксидов | Введение в химию
Цель обучения
- Укажите условия, при которых амфотерные гидроксиды действуют как кислоты.
Ключевые моменты
- Амфотерные молекулы могут действовать как кислоты или основания.
- Гидроксиды с сильно заряженными катионами металлов часто являются амфотерными.
- Амфотерные гидроксиды действуют как основания Бренстеда-Лоури (принимающие протоны) или кислоты Льюиса (принимающие электронную пару), в зависимости от условий реакции.
Условия
- акцептор протона
- основа или донор электронной пары
- Ацидан Льюиса акцептор электронной пары
В нашем обсуждении кислот и оснований гидроксиды всегда были синонимами оснований. Теперь мы рассмотрим амфотерные гидроксиды, то есть гидроксидные соли, которые могут действовать как кислота или основание, в зависимости от условий реакции. Начнем с известного случая, когда гидроксид действует как основание.
Реакция амфотерных гидроксидов в кислом растворе
Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия, Al (OH) 3 .Из наших правил растворимости мы знаем, что Al (OH) 3 в значительной степени нерастворим в нейтральной воде; однако в сильнокислом растворе ситуация меняется. Например, рассмотрим реакцию Al (OH) 3 с HCl:
[латекс] HCl (водн.) + Al (OH) _3 (водн.) \ Rightarrow AlCl_3 (водн.) + 3H_2O (l) [/ латекс]
Это классическая реакция кислотно-щелочной нейтрализации: HCl полностью протонирует все три гидроксида на моль Al (OH) 3 , давая чистую воду и соль AlCl 3 .- (водн.) [/ латекс]
Здесь гидроксид алюминия захватывает ион гидроксида из раствора, тем самым действуя как кислота Льюиса. Как это возможно? Рассмотрим структуру Льюиса для Al (OH) 3.
Гидроксид алюминия Гидроксид алюминия может действовать как основание Бренстеда-Лоури, принимая протоны из кислого раствора, или как кислота Льюиса, принимая электронную пару от гидроксид-ионов в основном растворе.
Центральный атом алюминия электронодефицитный — он образует только три связи, и правило октета не выполняется; таким образом, Al 3+ вполне счастлив принять пару электронов и образовать еще одну связь при правильных условиях.В щелочном растворе он образует связь с ионом OH —, вытягивая его из раствора и понижая pH раствора.
Заключение
Гидроксиды металлов с сильно заряженным центральным атомом металла могут быть амфотерными. Помимо алюминия, такие металлы, как цинк, олово, свинец и бериллий, также могут образовывать амфотерные оксиды или гидроксиды. Ведут себя такие гидроксиды как кислоты или основания, зависит от pH окружающего раствора.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Начальная активность кислотных, основных и амфотерных оксидов в реакции CO 2 с CS 2 с образованием COS
М. Сугиока, А. Икеда, К. Амура: J. Japan Petrol. Inst. , 22, , 120 (1979).
CAS
Google Scholar
L. Németh, G. Gáti, S. Horváth, I. Szabados, A. Gaál, S. László, P. Pelyva, L. Vécsey, L. Nagy: Hung.Патент 185 221 (1980).
L. Németh, T. Mároly, E. Grovcsik, J. Kerti, A. Kerekes: Hung. Патент 189 188; Патент России 1 355120; Патент ГДР 230885 (1985).
Л. Немет, Г. Гати, А. Гервасини, А. Ору, Г. Минк, И.С. Пап, Т. Секели: J. Applied Catal. , 64, , 143 (1990).
Артикул
Google Scholar
Г. Минк, И. Бертоти, Л.Немет, Г. Гати, М. Мохай, Т. Секели: Surf. Интерфейс Anal. , 12, , 262 (1988).
Артикул
Google Scholar
A. Auroux, A. Gervasini, L. Németh, G. Gáti, I.S. Пап, Г. Минк: Прибой. Интерфейс Anal. , 19 , 529 (1992).
CAS
Статья
Google Scholar
г. Норка: React. Кинет. Катал. Lett., 68, , 221 (1999).
CAS
Google Scholar
A. Auroux, A. Gervasini: J. Phys. Chem. , 94, , 6371 (1990).
CAS
Статья
Google Scholar
A. Gervasini, A. Auroux: J. Catal. , 131 , 190 (1991).
CAS
Статья
Google Scholar
Термохимические таблицы JANAF , третье издание, часть I – II. (1985).
R.T. Sanderson: Chemical Periodicity , Рейнхольд, Нью-Йорк, 1960.
Google Scholar
A.L. Allred: J. Inorg. Nucl. Chem. , 17, , 215 (1961).
CAS
Статья
Google Scholar
Группа 1, 2 и 13 оксиды и гидроксиды Виды в водном растворе
| Группа 1 | Группа 2 | Группа 13 | низкий pH высокий pH Be 2+ , Be (OH) 4 2– амфотерный оксид (BeO ) | низкий pH высокий pH B (OH) 3 , B (OH) 4 — кислый оксид (B 2 O 3 ) |
| Na + при всех pH основной оксид (Na 2 O) | низкий pH высокий pH Mg 2+ Mg (OH) 2 основной оксид (MgO) | низкий pH высокий pH Al 3+ , Al (OH) 4 90 066 — амфотерный оксид (Al 2 O 3 ) |
| K + при всех pH основной оксид (K 2 O) | низкий pH, высокий pH Ca 2+ Ca (OH) 2 основной оксид (CaO) | низкий pH высокий pH Ga 3+ , Ga (OH) 4 — амфотерный оксид (Ga 2 O 3 ) |
| Rb + при всех pH основной оксид (Rb 2 O) | Sr 2+ при всех pH основной оксид (SrO) | низкий pH высокий pH In 3+ In (OH) 4 — амфотерный оксид (In 2 O 3 ) (более щелочной, чем кислотный) |
| Cs + при всех pH основной оксид (Cs 2 O) | Ba 2+ при всех pH основной оксид (BaO) | Tl + при всех pH основных оксидов (Tl 2 O и Tl 2 O 3 ) |
Группа Элементы 1, 2 и 13 существуют в своих соединениях в максимальной степени окисления, которая является последней цифрой номера группы.Как показано в таблице справа, нижние элементы в группе 13 также имеют степень окисления +1.
В таблице показана диагональная тенденция кислотно-основных свойств оксида / гидроксида и природы частиц в водном растворе.
Электроположительные металлы (белый)
- имеют ионы, которые существуют в виде гидратов катионов при всех pH
- имеют основные оксиды (растворяются в воде с образованием OH — или, если они нерастворимы, растворяются в водной кислоте)
Менее электроположительные металлы (желтый)
- существуют в виде нерастворимых оксидов / гидроксидов около pH 7.
- существуют в своих положительных степенях окисления в виде гидратов катионов в водных растворах с низким pH и в виде гидроксоанионов при высоком pH.Гидратированные катионы представляют собой слабые кислоты.
- содержат амфотерные оксиды, растворяющиеся как в водной кислоте, так и в основании.
Бор — неметаллический элемент (зеленый)
- , который не образует дискретный катион, но существует в виде гидроксида при низком pH и гидроксоаниона при высоком pH.
- имеет кислый оксид, который реагирует с гидроксид-ионом.
p-блочных элементов образуют кислотные, основные и амфотерные оксиды. Explani
Решение:
В p-блоке, когда мы движемся слева направо в периоде, кислотный характер оксидов увеличивается из-за увеличения электроотрицательности.Например. i) 2-й период `B_ (2) O_ (3) lt CO_ (2) lt N_ (2) O_ (3)` кислотный характер увеличивается. ii) 3-й период `Al_ (2) O_ (3) lt SiO_ (2) lt P_ (4) O_ (10) lt SO_ (3) ltCl_ (2) O_ (7)` Кислый характер увеличивается. При движении вниз по группе кислотный характер уменьшается, а основной — увеличивается, например: а) Природа оксидов 13 элементов группы. б) Природа оксидов 15 элементов группы. `underset (» Сильно кислый «) (N_ (2) O_ (5))` underset («Умеренно кислый») (P_ (4) O_ (10)) `underset (» Амфотерный «) (As_ (4) O_ (10)) `underset (« Амфотерный ») (Sb_ (4) O_ (1))` underset («Basic») (Bi_ (2) O_ (3)) `Среди оксидов того же элемента, выше степень окисления элемента hte, более сильная кислота, e.(+) « Al_ (2) O_ (3) ‘амфотерный по своей природе. Он не растворяется в воде, но растворяется в щелочах и реагирует с кислотами. `(« Триоксид алюминия ») Al_ (2) O_ (3) + 2NaOH от избытка (Delta) до недостатка (« метаалюминат натрия ») 2NaAlO_ (2) + H_ (2) O larr Al_ (2) O_ (3) + От избытка 6HCl (Дельта) до недостатка («Алюминиевый хлороид») 2AlCl_ (3) + 3H_ (2) O` `Ti_ (2) O` является основным в качестве NaOH из-за его более низкой степени окисления` (+1) `TI_ (2) O + 2HCl в 2TICl + H_ (2) O » P_ (4) O_ (10) ‘при реакции с водой дает ортофосфорную кислоту. `underset (» Пятиокись фосфора «) (P_ (4) O_ (10)) + 6H_ (2) O to underset (» Ортофосфорная кислота «) (4H_ (3) PO_ (4))` Cl_ (2) O_ ( 7) «имеет сильную кислоту по природе и при растворении в воде дает хлорную кислоту в нижней части (« Гептоксид дихлора ») (Cl_ (2) O_ (7)) + H_ (2) O в нижней части (« Хлорная кислота ») 2HCIO_ (4) `
Уровень химии — Типы оксидов — Химия уровня О и химия IP Заметки автора 10-летней серии
Это еще один раздел в Уровень химии , где учащимся трудно понять.Давайте раскроем здесь секреты.
Оксид — это соединение кислорода и другого элемента (например, в процессе сгорания)
? Металлы образуют Оксиды металлов и Неметаллы образуют Неметаллические оксиды
? Оксиды могут быть классифицированы как Кислые, Основные, Амфотерные или Нейтральные
? Природа оксидов элементов в периодической таблице слева направо изменяется от? Основной -> Амфотерный -> Кислый
КИСЛОТЫ ОКСИДЫ
Примеры:
SO2, SO3, CO2, NO2
Недвижимость:
1.Не вступайте в реакцию с кислотами.
2. Реагировать с основаниями и щелочами с образованием соли и воды.
3. Растворить в воде с образованием кислых растворов.
4. Обычно газы при комнатной температуре.
ОСНОВНЫЕ ОКСИДЫ
Примеры:
Na2O, CaO, MgO, FeO, CuO
Свойства:
1. Не вступать в реакцию с основаниями.
2. Реагировать с кислотами с образованием соли и воды.
3. Основные оксиды обычно нерастворимы в воде. Те, что растворяются в воде, образуют щелочные растворы.
НЕЙТРАЛЬНЫЕ ОКСИДЫ
Примеры:
CO, NO, h3O
Свойства:
1. Нейтральный pH
АМФОТЕРНЫЕ ОКСИДЫ
Примеры:
Оксиды, образованные с металлами в районе? STEPS ? , например ZnO, Al2O3, PbO,
Свойства:
1. Реагирует с кислотами и основаниями с образованием соли и воды
Для тех, кто изучает программу уровня GCE «O», в этом разделе, посвященном типам оксидов, возникает множество вопросов.
Давайте взглянем на некоторые экзаменационные вопросы.
Quick Check 1:
Что из следующего реагирует с разбавленной серной кислотой с образованием газа и воды в качестве двух продуктов?
A. цинк
B. карбонат цинка
C. гидроксид цинка
D. оксид цинка
Quick Check 2:
Какой элемент образует оксид, который реагирует с водой с образованием кислого раствора?
A. алюминий
B. натрий
C. сера
D.цинк
Quick Check 3:
Какой элемент горит на воздухе с образованием оксида, который при встряхивании с водой дает раствор с pH более 7?
A. углерод
B. водород
C. магний
D. сера
PS: Оставляйте предлагаемые ответы в «Раздел комментариев» непосредственно под этим сообщением.
PPS: Этот пост принадлежит к серии постов, связанных с Секретами «Кислоты, основания, соли и качественный анализ раскрыты»
Статьи по теме:
Многие знают меня как автора книги десятилетней серии JC A-Level h3 Chemistry и O-Level Pure Chemistry.Мой более чем 19-летний опыт коучинга (с 1999 г.) с более чем 1500 учениками из 180+ JC и средних школ позволил мне понять истинные причины, по которым ученики не могут хорошо учиться по химии. Самое главное, что моя сила заключается в использовании повседневных аналогий (даже бабушки могут понять!) Для упрощения абстрактных понятий. Кроме того, моя методика преподавания была разработана таким образом, чтобы доставлять удовольствие моим ученикам, приносить удовольствие и быть эффективной. Если вы хотите весело провести время, изучая химию и иметь мотивацию к преуспеванию в химии, свяжитесь со мной сегодня по телефону 98287357
простых оксидов — учебный материал для IIT JEE
Оксиды неметаллов имеют тенденцию быть кислотными, оксиды металлов имеют тенденцию быть основными, а оксиды элементов в или рядом с угловой полосой полуметаллов в целом являются амфотерными.
Оксид представляет собой бинарное соединение , получаемое при взаимодействии кислорода с другим элементом. Исходя из содержания в них кислорода, оксиды могут быть широко распределены в смешанные оксиды и простые оксиды.
Простые оксиды
Простые оксиды — это оксиды, содержащие только то количество атомов кислорода, которое допускается нормальной валентностью его металла.
Пример : H 2 O, MgO и Al 2 O 3.
Смешанные оксиды
Два простых оксида соединяются с образованием смешанных оксидов.
Пример : Диоксид свинца (PbO 2 ) и монооксид свинца (PbO) вместе образуют смешанный оксид Красный свинец (Pb 3 O 4 ).
Оксид железа (Fe 2 O 3 ) и закись железа (FeO) вместе образуют смешанный оксид Оксид железа и железа (Fe 3 O 4 ).
Классификация простых оксидов
Простые оксиды на основе их химического поведения могут быть далее классифицированы на кислые оксиды, основные оксиды, амфотерные оксиды и нейтральные оксиды .
Кислый оксид
Оксид, который реагирует с водой с образованием кислоты, называется Кислый оксид . Пример: оксиды неметаллов, такие как SO 2, CO 2 , SO 3 , Cl 2 O 7, P 2 O 5 , & N 2 O 5 или оксиды металлов с высокими степенями окисления, такие как CrO 3, Mn 2 O 7 , & V 2 O 5 , имеют кислотную природу.
- Диоксид серы растворяется и реагирует в воде с образованием серной кислоты.
SO 2 + h3O → H 2 SO 3
Сернистый газ Вода Сернистая кислота
- Хромовый ангидрид реагирует с водой с образованием хромовой кислоты.
Cr 2 O 3 + H 2 O → H 2 Cr 2 O 4
Хромовый ангидрид Вода Хромовая кислота
Основной оксид
Оксид, который реагирует с водой с образованием основания, называется основным оксидом .
Пример : Оксиды большинства металлов, таких как Na 2 O, CaO, BaO, являются основными по природе.
- Оксид кальция реагирует с водой с образованием гидроксида кальция, основания.
CaO + H 2 O → Ca (OH) 2
Оксид кальция Вода Гидроксид кальция
Амфотерные оксиды
Некоторые оксиды металлов проявляют двойное поведение, т. Е. Проявляют свойства как кислоты, так и основания.Эти оксиды металлов известны как Амфотерные оксиды . Они могут реагировать как с щелочами, так и с кислотами.
Пример : Оксид цинка при взаимодействии с концентрированным гидроксидом натрия ведет себя как кислый оксид, но при взаимодействии с соляной кислотой действует как основной оксид.
ZnO + 2H 2 O + 2NaOH → Na 3 Zn [OH] 4 + H 2
Оксид цинка Вода NaOH (конц) Цинкат натрия Водород
ZnO + 2HCl → ZnCl 2 + H 2 O
Оксид цинка Соляная кислота Хлорид цинка Вода
Оксид алюминия — еще один пример, который реагирует как со щелочами, так и с кислотами.
Al 2 O 3 (т) + 6NaOH (водн.) + 3H 2 O (л) → 2Na 3 [Al (OH) 6 ] (водн.)
Al 2 O 3 (т) + 6HCl (водн.) + 9H 2 O (л) → 2 [Al (H 2 O) 6 ] 3+ (водн.) + 6Cl — (водн.)
Нейтральные оксиды
Нейтральные оксиды, как следует из названия, не проявляют склонности к образованию солей с кислотами или основаниями.
Пример : Закись азота и окись углерода являются нейтральными оксидами.
Посмотрите это видео, чтобы получить дополнительную информацию
Дополнительная информация
Простые оксиды
видов оксидов, основных оксидов, кислых оксидов. Получение оксидов. Оксиды азота
Свойства оксидов
Оксиды — сложные химические вещества, представляющие собой простые химические соединения элементов с кислородом.Они солеобразующие и солей не образуют .
Существует 3 типа солеобразующих оксидов: Основные оксиды (от слова «Основа»), кислые оксиды и Амфотерные оксиды .
Примером оксидов, не образующих соли, могут быть: NO (оксид азота) — бесцветный газ без запаха. Его образуют электрические бури в атмосфере. CO (окись углерода) газ без запаха, образуется при сгорании угля. Обычно его называют оксидом углерода.
Есть и другие оксиды, не образующие солей.
Теперь рассмотрим каждый тип солеобразующих оксидов.
Основные оксиды
Основные оксиды — оксиды сложного химического вещества, образующие соли при химической реакции с кислотами или кислыми оксидами и не вступающие в реакцию с основаниями или основными оксидами. Например, к основным оксидам относятся следующие:
K 2 O (оксид калия), CaO (оксид кальция), FeO (двухвалентный оксид железа).
Рассмотрим химических свойств оксидов на примерах.
1.Реакция с водой:
— реагируют с водой и образуют основание (или щелочь)
CaO + H 2 O → Ca (OH) 2 (реакция, известная как известкование, выделяет большое количество тепла!)
2. реагирует с кислотами:
реакция с кислотой и форма соли и воды (раствор соли в воде)
CaO + H 2 SO 4 → CaSO 4 + H 2 O (Кристаллы этого вещества CaSO 4 повсеместно известны как «гипс Парижа»).
3. реагирует с кислыми оксидами: образует соли
CaO + CO 2 → CaCO 3 (Это вещество, известное как мел!)
Кислые оксиды
Кислотные оксиды — это сложные химические оксиды, которые образуют соли при химических реакциях с основаниями или основными оксидами и не вступают в реакцию с кислотными оксидами.
Примеры кислых оксидов могут быть:
CO 2 (всем известный углекислый газ), P 2 O 5 — оксид фосфора (образуется в воздухе, если горит белый фосфор), SO 3 — оксид серы (VI) — вещество, используемое для серной кислота
— химическая реакция с водой
CO 2 + H 2 O → H 2 CO 3 — это вещество — угольная кислота — одна из слабых кислот, ее добавляют в газированную воду для «пузырьков» газа.С повышением температуры растворимость газа в воде уменьшается, а избыток выходит в виде пузырьков.
— реакция со щелочами (основаниями):
CO 2 + 2NaOH → Na 2 CO 3 + H 2 O — образующееся вещество (соль) широко используется в сельском хозяйстве. Это называется кальцинированной сода или стиральная сода, это отличное очищающее средство от пригоревших кастрюль, жира, ожогов. Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO 2 + MgO → MgCO 3 получается соль — карбонат магния, также называемая «горькой солью».
Амфотерные оксиды
Амфотерные оксиды — это сложное химическое вещество, также оксиды, которые образуют соли при химических реакциях с кислотами (или кислотных оксидов ) и с основаниями (или основных оксидов ). Чаще всего используется слово «амфотерный» для оксидов металлов .
Пример амфотерные оксиды могут быть:
ZnO — оксид цинка (белый порошок, часто используемый в медицине для изготовления масок и кремов), Al 2 O 3 — оксид алюминия (также называемый «глиноземом»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химическую реакцию, подходящую как основания и кислоты. Например:
— реакция с кислым оксидом:
ZnO + H 2 CO 3 → ZnCO 3 + H 2 O — Образующееся вещество, состав соли карбоната цинка в воде.
— основание реакции:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 О — полученное вещество представляет собой двойную соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическими и химическими методами. Самый простой способ — химическая реакция простых элементов с кислородом. Например, в результате процесса горения одним из продуктов этой химической реакции являются оксидов .
Например, если раскаленные железные стержни (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, это на самом деле то, что у вас есть) поместить в колбу с кислородом, произойдет химическая реакция окисления, которая сопровождается яркой вспышкой и искрами.Продукт реакции — черный порошок оксида железа FeO (Например, если бы это было железо):
2Fe + O 2 → 2FeO
Совершенно аналогичные химические реакции окисления для других металлов и неметаллов, такие как:
Цинк горит в кислороде с образованием оксида цинка
2Zn + O 2 → 2ZnO
При сжигании угля образуются два оксида: оксид углерода и диоксид углерода
2C + O 2 → 2CO — образование окиси углерода.
C + O 2 → CO 2 — образование диоксида углерода.Этот газ образуется, когда кислород доступен в более чем достаточных количествах, то есть в любом случае сначала происходит реакция с образованием монооксида углерода, а затем монооксид углерода окисляется до диоксида углерода.
Получение оксидов можно осуществить другим способом — реакцией химического разложения.
Например, для получения оксида железа или оксида алюминия необходимо поджечь соответствующую основу этих металлов в огне.
Fe (OH) 2 → FeO + H 2 O
Оксид алюминия — оксид корунда-железа (III).Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в почве оксида железа (III). Оксид алюминия — корунд Растворы оксидов
2Al (OH) 3 → Al 2 O 3 + 3H 2 O,
а также разложение отдельных кислот:
H 2 CO 3 → H 2 O + CO 2 — разложение угольной кислоты
H 2 SO 3 → H 2 O + SO 2 — разложение серной кислоты
Производство оксидов может осуществляться из солей металлов при сильном нагреве:
CaCO 3 → CaO + CO 2 — при поджиге мела получают оксид кальция (или известь) и диоксид углерода.
2Cu (NO 3 ) 2 → 2CuO + 4NO 2 + O 2 — в этой реакции разложения получается два оксида: CuO (черный цвет) и азот NO 2 (его еще называют коричневый газ, потому что он действительно коричневый).
Другой способ получения оксидов с помощью окислительно-восстановительной реакции, например
Cu + 4HNO 3 (конц.) → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
S + 2H 2 SO 4 (конц.) → 3SO 2 + 2H 2 O
Оксиды хлора
Молекула ClO 2 Молекула Cl 2 O 7 Закись азота N 2 ON Диоксид азота N 2 O 3 Ангидрид азота N 2 O 5 Коричневый газ NO 2
Известны оксидов хлора : Cl 2 O, ClO 2 , Cl 2 O 6 , Cl 2 O 7 .
Все они, кроме Cl 2 O 7 , имеют желтый или оранжевый цвет и не являются экологичными, особенно ClO 2 Cl 2 O 6 .Все оксидов хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорные кислоты:
Итак, Cl 2 O — оксид хлора хлорноватистой кислоты.
Cl 2 O + H 2 O → 2HClO — Хлорноватистая кислота
ClO 2 — кислота оксид хлора хлорноватистая и чарнаватная кислота в результате химической реакции с водой образует две кислоты:
ClO 2 + H 2 O → HClO 2 + HClO 3
Cl 2 O 6 также представляет собой кислый оксид хлора чарнавати и хлорную кислоту:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
Наконец, Cl 2 O 7 представляет собой бесцветную жидкость кислый оксид хлора хлорноватой кислоты:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
а, Cl 2 O 7 — жидкость бесцветная — оксид хлора кислый кислота хлорная:
Cl 2 O 7 + H 2 O → 2HClO 4
Оксиды азота
Азот — это газ, образующий с кислородом 5 различных соединений — 5 оксидов .Например:
— N 2 O — азот восстановленный . Имеет другое название, известен в медицине как веселящий газ или закись азота Газ бесцветен, сладок и приятен на вкус.
NO окись азота — бесцветный, без запаха и вкуса газ.
— N 2 O 3 — азотистый ангидрид — бесцветное кристаллическое вещество
— НЕТ 2 — диоксид азота .Другое его название — коричневый газ — газ действительно имеет ржаво-коричневый цвет
.
— N 2 O 5 — ангидрид азота голубая жидкость, кипящая при температуре 3,5 0 C
Из всех перечисленных соединений азота наибольший интерес для промышленности представляют NO — монооксид азота, а NO 2 — диоксид азота. Окись азота (NO) Закись азота N 2 O не реагирует с водой и щелочами. Азотистый ангидрид (N 2 O 3 ) при реакции с водой образует слабую и нестабильную азотистую кислоту HNO 2 , которая на воздухе постепенно превращается в более стабильное химическое вещество азотную кислоту
Рассмотрим некоторые из химических свойств оксидов азота :
Реакция с водой:
2NO 2 + H 2 O → HNO 3 + HNO 2 образуются 2 кислоты: азотная кислота HNO 3 и азотистая кислота.
Реакция с щелочью:
2NO 2 + 2NaOH → NaNO 3 + NaNO 2 + H 2 O — образование двух солей: нитрата натрия NaNO 3 и нитрита натрия
Реакция с солями:
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2 — образовались две соли: нитрат натрия и нитрит натрия, а также диоксид углерода.
Получите диоксид азота (NO 2 ) из оксида азота (NO) химической реакцией соединения c кислород:
2НО + O 2 → 2НО 2
Оксиды железа
Железо образует два оксида : FeO — оксид железа (2-валентный) — черный порошок, который получают восстановлением оксида железа (3-валентный) оксида углерода в соответствии со следующей химической реакцией:
Fe 2 O 3 + CO → 2FeO + CO 2
Это основной оксид, легко вступающий в реакцию с кислотами.Обладает восстанавливающими свойствами и быстро окисляется до оксида железа (3-валентный).
4FeO + O 2 → 2Fe 2 O 3
Оксиды железа (3-валентные) — красно-коричневый порошок (гематит), обладающий амфотерными свойствами (вступает в реакцию с кислотами и щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что чаще всего его используют в качестве основного оксида .
Также существует смешанного оксида железа Fe 3 O 4 .Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным гематитом или магнетитом).
Если железо сжигается, в реакции образуются два оксида: оксид железа (III) и валентность (II).
Диоксид серы
Диоксид серы SO 2
Диоксид серы SO 2 — или сернистый газ — это кислые оксиды , но он не образует кислоту, хотя прекрасно растворяется в воде — 40 л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называется серной кислотой).
В норме это бесцветный газ с резким удушающим запахом горящей серы. При температуре -10 0 C он может быть переведен в жидкое состояние.
В присутствии катализатора оксида ванадия (V 2 O 5 ) диоксид серы присоединяет кислород и превращается в триоксид серы
2SO 2 + O 2 → 2SO 3
Растворенный в воде диоксид серы — SO 2 очень медленно окисляется, в результате чего превращается в серную кислоту
Если диоксида серы пропустить через раствор щелочи, например гидроксид натрия, то через сульфит натрия (или гидросульфит, это зависит от того, сколько вы берете щелочи и диоксида серы)
NaOH + SO 2 → 2NaHSO 3 — диоксид серы взято больше, чем необходимо
2NaOH + SO 2 → Na 2 SO 3 + H 2 O
Если диоксид серы не реагирует с водой, то почему его водный раствор дает кислую реакцию ?! Да не реагирует, но он сам окисляется в воде и добавляет кислород.

 ru: главная страница / / Техническая информация / / Химический справочник / / Кислотные оксиды, неорганические кислоты, кислотные остатки. Основные оксиды, основания и их растворимость. Амфотерные оксиды и соответствующие им гироксиды. Таблица.
ru: главная страница / / Техническая информация / / Химический справочник / / Кислотные оксиды, неорганические кислоты, кислотные остатки. Основные оксиды, основания и их растворимость. Амфотерные оксиды и соответствующие им гироксиды. Таблица. Введите свой запрос:
Введите свой запрос: