Содержание
Тема:Кислотность и основность органических соединений
6
Цель занятия:
Сформировать у студентов представление
о влиянии кислотно-основных свойств
органических соединений на многие
физико-химические и биологические
процессы, протекающие в условиях
организма.Научить студентов определять
кислотно-основные свойства спиртов,
фенолов, тиолов, и аминов в зависимости
от их строения.
Студент должен знать:типы кислот
и оснований Бренстеда.
Студент должен уметь: определять
кислотные и основные свойства органических
соединений.
Современные представления о кислотах и основаниях. Бренстеда и Лоури
Важными аспектами реакционной способности
органических соединений является их
кислотные и основные свойства. Для
Для
описания кислотных и основных свойств
химических соединений существует
несколько теорий – теория Бренстеда и
Лоури, теория Льюиса и ряд других.
Наиболее распространенной является
теория Бренстеда и Лоури, или протолитическая
теория.
По теории Бренстеда – Лоурикислоты
– это нейтральные молекулы или ионы,
способные отдавать протон (доноры
протона), а основания — это нейтральные
молекулы или ионы, способные присоединять
протон (акцепторы протона).
По теории Льюисакислоты – это
нейтральные молекулы или ионы, способные
присоединять электронную пару
(акцепторы электронной пары), а
основания – это нейтральные молекулы
или ионы, способные отдавать электронную
пару (доноры электронной пары).
Из этого следует, что теоретически любое
соединение, в состав которого входит
атом водорода может его отдавать в виде
протона и, проявлять свойства кислоты.
Способность отдавать протон могут
проявлять не только нейтральные молекулы,
но заряженные частицы – катионы (NH4+)
и анионы кислот, напримерHCl,ROH,HSO4—и др.
В роли основаниймогут выступать
анионы – частицы, несущие отрицательный
заряд, например С1—,OH—,HSO4,NH3.Основаниями могут быть и нейтральные
молекулы, в состав которых входит
гетероатом, например, азот, сера, кислород,
содержащие неподелённую пару электронов,
например спиртыROH.
Нейтральные молекулы или заряженные
ионы, способные в зависимости от природы
второго компонента проявлять свойства
кислот или оснований называются
амфотерными.
Теория Бренстеда – Лоури. Сопряженные кислоты и основания.
Кислоты и основания проявляют свои
свойства только в присутствие друг
друга, Ни одно вещесвто не будет отдавать
протон, если в системе нет акцептора
протона – основания, и наоборот.т.е. они
образуют сопряжённую кислотно-основную
пару в которой чем сильнее кислота,
тем слабее сопряженное ей основание, и
чем сильнее основание, тем слабее
сопряженная ему кислота.
Кислота, отдавая протон, превращается
в сопряженное основание, а основание
приняв протон, превращается в сопряженную
кислоту. Кислоту обычно обозначают АН,
а основание – В
Например: НС1↔ Н++ С1—, НС1 –
сильная кислота; С1—ион – сопряженное
слабое основание;
СН3СООН ↔ СН3СОО—+ Н+,
СН3СООН – слабая кислота, а СН3СОО—— ион сопряженное сильное основание.
Общий вид можно представить так: Н+│
: А + В ↔ Н:В+ + А:—
к-та основ сопр. сопр.
к-та основ-е
Мы уже сказали, что кислотные свойства
соединений обнаруживаются только в
присутствие основания, а основные
свойства – в присутствие кислоты, т.е.
в соединениях существует определённое
кислотно — основное равновесие, для
изучения которого в качестве растворителя
используется Н2О. По отношению
По отношению
к Н2О как к кислоте или как
основанию определяют кислотно-основные
свойства соединений.
Для слабых электролитов кислотность
количественно оценивается Крав
реакции, которая заключается в переносе
Н+от кислоты к Н2О как
основанию.
СН3СООН + Н2О ↔ СН3СОО—+ Н3О+
к-та основ-е основание кислота
СН3СОО—— ацетат ион, сопряженное
основание;
Н3О+— ион гидроксония,
сопряженная кислота.
Используя значение константы равновесия
этой реакции и учитывая, что концентрация
Н2О практически постоянна, можно
определить произведение К ·[H2O]
называемое константой кислотностиК
кислотности (Ка).
;
Чем больше Ка, тем сильнее кислота.
Для СН3СООН Ка= 1,75 · 10-5.
такие малые величины неудобны в
практической работе, поэтому Кавыражают черезрКа (рК
= -ℓg Ка).
Для СН3СООН рКа= 4,75. Чем
меньше величина рКа, тем сильнее
кислота.
Сила оснований определяется величиной
рКВН+.
2.2. Кислотно-основные свойства органических соединений
Ключевые слова к разделу 2.2 :
теория
Бренстеда-Лоури, кислота, основание,
сопряженная кислота, сопряженное
основание .
В 1928г. ученые Бренстед и Лоури выдвинули
протолитическую теорию сопряженных
кислот и оснований применительно к
органическим соединениям. С этой точки
С этой точки
зрения, фактически, любое органическое
соединение амфотерное, т.е. обладает
кислотными и основными свойствами в
зависимости от условий.
Кислоты в соответствии
с теорией Бренстеда-Лоури
Кислотойбыло предложено называть
соединение, способное отдавать протон(
Н+),
основанием— соединение, способное
присоединять протон.
Кислота при удалении протона
превращается в сопряженное основание,
основание после присоединения
протона — в сопряженную кислоту.
Н А + В А —
+ ВН+
Кислота Основание
Сопряженное сопряженная
Основание
Кислота
Кислота Н-А(Аозначает
сокращение отacid)
содержит поляризованную связь.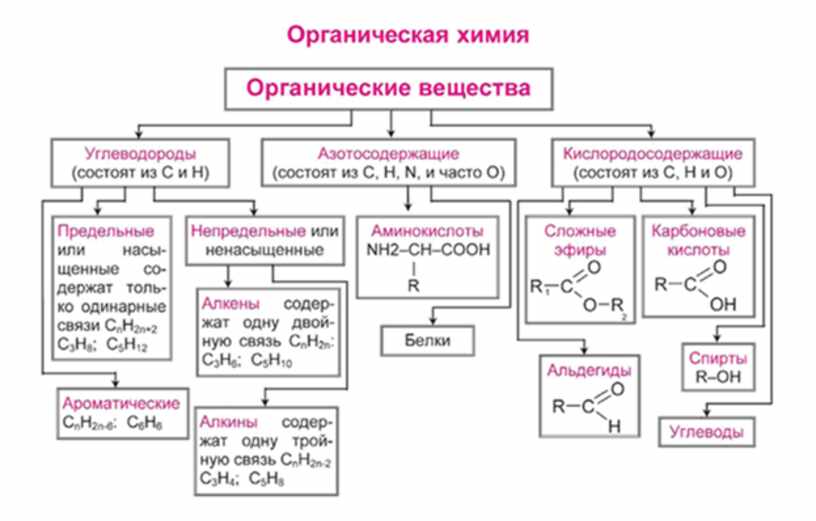
Атом водорода связан с более
электроотрицательными атомами:
кислородом, азотом, галогенами, серой,
углеродом. Чем больше электроотрицательность
атома, тем сильнее поляризована связь.
Органические соединения АНможно подразделить на несколько типов
зависимости от природы кислотного
центра:
НО-кислоты, HS-кислоты,
NH— кислоты,
СН-кислоты
Карбоновые кислоты R-СООН,
фенолы Аг-ОН, спиртыR-ОН
, относятся к группе
ОН- кислот. В ряду названных соединений
кислотные свойства убывают.
Силу
кислоты( acid ) НХв воде, т.е. степень ее диссоциации ,
можно определить, рассматривая равновесие:
Н2О + Н- Х Н3О++ Х—
Константа равновесия выражается
уравнением :
[ Н3О+] [ Х—]
Ка=-
———————
[ Н- Х ]
Обычно
пользуются величиной
рКа =-lg
Ка
Чем
больше кислотные свойства, тем меньше
значение величины рКа
.
Кислоты,
у которых рКа > 7, не изменяют
цвета нейтральной индикаторной бумаги,
если
рКа > 10, то такие вещества не
имеют кислого вкуса.
Кислотные свойства зависят от
нескольких факторов:
полярности связи в кислотном центре
устойчивости образующегося сопряженного
основанияприроды растворителя.
На полярность связи влияет природа
гетероатома и природа заместителя в
углеводородном радикале.
Полярность связи уменьшается в ряду(
при условии одинакового радикала):
R–О — Н >R–N- Н >R-S-Н >R– С -Н
Присутствующие в радикале акцепторные
заместители всегда увеличивают, а
донорные всегда уменьшают кислотные
свойства. Поэтому в гомологическом
Поэтому в гомологическом
ряду кислотные свойства всегда
убывают.
СН 3О Н > С2Н5ОН
> С3Н7ОН
НСООН > СН 3СООН > С2Н5СООН
НООС-СН2-СН2-СООН <
НООС-СН2-СООН < НООС-СООН
СН 3СООН < НООС-СН2-СООН
CН3-CН2-СООН
< СН3— СН-СООН < СН-С-СООН
|
||
OHO
Устойчивость сопряженного
основания
Донорные заместители увеличивают
величину отрицательного заряда
аниона, и этим увеличивают способность
присоединять протон – степень
диссоциации.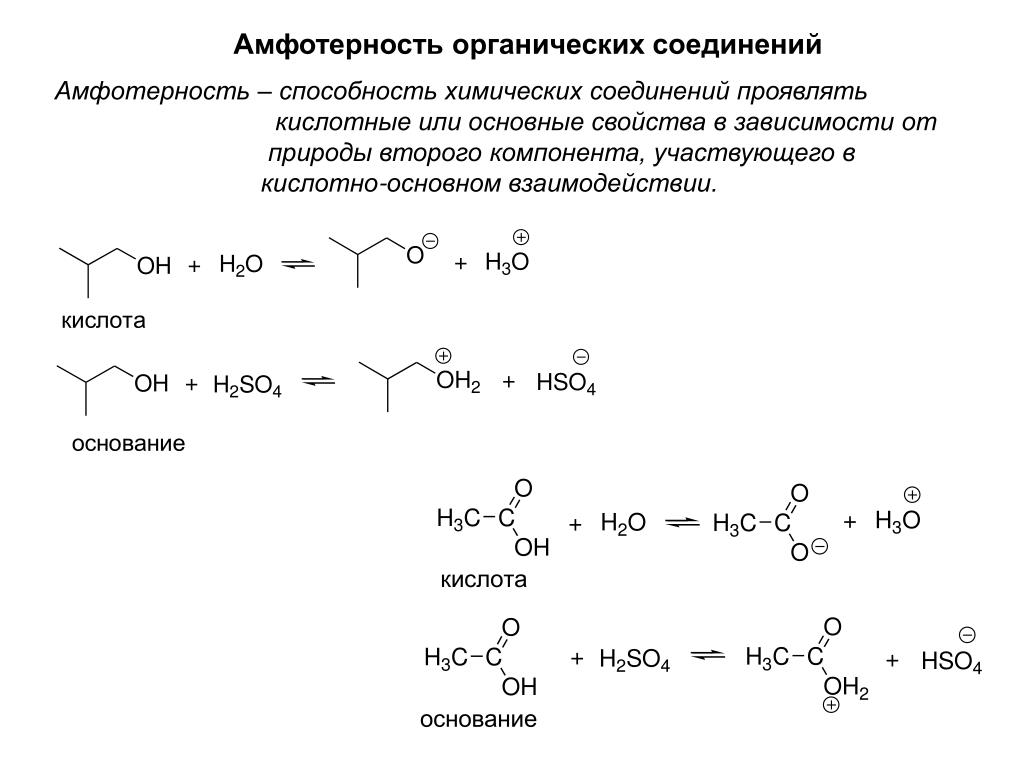 уменьшается, кислотные
уменьшается, кислотные
свойства убывают
Д Х —
группадонор кислотный
центр
локализация
отрицательного
заряда
Акцепторные заместители уменьшают
величину отрицательного заряда аниона
и
этим уменьшают способность присоединять
протон – степень диссоциации
увеличивается, кислотные свойства
увеличиваются.
— Х А
Кислотный центр группа акцептор
Локализация отрицательного заряда
Способность
делокализовать (распределять отрицательный
заряд в анионе ) носит название
поляризуемость атома-), связана с
увеличением радиусом атома и наличием
свободных электронных орбиталей.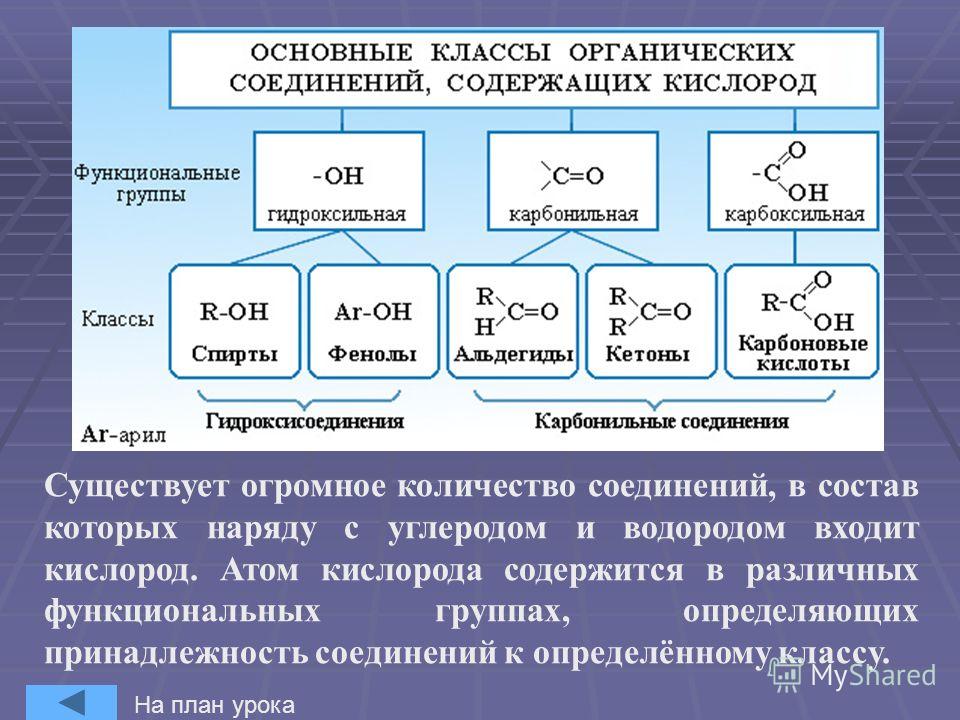
Поляризуемость атома серы больше,
чем атома кислорода. Поэтому тиолы
всегда обладают более сильными кислотными
свойствами, чем спирты, так же как
сероводород обладает более сильными
кислотными свойствами по сравнению с
водой.
Сравнительный ряд изменения кислотных
свойств соединений, содержащих различные
кислотные центры и одинаковые радикалы:
С2Н5SН
> С2Н5О Н > С2Н5NH2
Обратите внимание, что ряд изменения
кислотноститиолов, спиртов и аминовне совпадает с рядом изменения
полярности связи Х-Н в этих соединениях.
Основания( в соответствии с теорией
Бренстеда-Лоури)
Основание( В— сокращение отbase) присоединяет протон, потому что
в молекуле имеется атом с неподеленной
парой электронов ( азот, кислород, сера
), двойная связь или вся частица несет
отрицательный заряд ( ОН —,RО —,RS —).
Протон присоединяется к атому с
неподеленной парой электронов за счет
донорно-акцепторной связи, молекула
приобретает положительный заряд. Чем
выше основные свойства, тем легче
протекает протонирование.
( В
слове осн’овные ударение
следует сделать на букве «о» во втором
слоге)
| |
-N- +H+
—> —N + —H( аммониевое основание
)
|
— О — + H +—> — О+— Н ( оксониевое
основание )
|
-S- +H
+ —> —S+—H( сульфониевое
основание )
|
С = С + H + —>
> С =|=С< ( π -основание )
H
+
Силу
основания В ( base
)в воде можно оценить, рассматривая
равенство:
В + НОН ВН + + ОН
–
Константа равновесия выражается
уравнением
[ ВН +] [ ОН –]
КВ=- ———————рК
В = —lg
К В
[ В ]
Величину
рК
В в воде можно
перевести в рКа
.
рК
В +
рКа =
14 ( при 250
С )
Чем
больше основные свойства , тем меньше
значение величины рКВ .
Основные свойства зависят от
нескольких факторов:
Электроотрицательности атома,
несущего неподеленную пару электронов.
Чем больше электроотрицательность,
тем выше основные свойства.
Так как электроотрицательность О
> S, то основные
свойства
С2Н5О
Н > С2Н5SН
2. Устойчивости сопряженной кислоты,
возникающей после присоединения протона
к основанию.
RNH2
+ H
+ —> RN H3+
ROH + H
+ —> R O+
–H
|
H
Ион аммония более устойчив, чем ион
оксония , поскольку присоединение
про-
тона Н +к электронной паре
энергетического уровня 2s2
атома азота энергетически более
выгодно, чем к паре электронов
энергетического уровня 2 р2атома
кислорода ( хотя атом кислорода обладает
большей электроотрицательностью).
Влияние природы заместителя
Заместители- доноры увеличивают
электронную плотность в основном
центре и этим увеличивают основные
свойства.
СН3
NH 2
< C 2H
5 NH2
< ( C 2H
5 )
2 NH
Заместители акцепторы уменьшают
электронную плотность в основном центре
и
уменьшают основные свойства.
НО-СН2— СН2-NH2<СН 3— СН2-NH2
акцептор донор
Основные свойства ароматических аминов
ниже, чем алифатических, поскольку
неподеленная пара электронов атома
азота взаимодействует с электронной
системой бензольного цикла, и
электронная плотность на атоме азота
снижается.
С6Н5-NH2< СН3NH2
анилин метиламин
Таким
образом, спирты , амины обладают
кислотными и основными свойствами.
У
спиртов преобладают кислотные над
основными, а у аминов- основные над
кислотными.
Следует помнить :
кислотные и основные свойства
одного вещества изменяются всегда в
противоположных направлениях.
Можно
составить ряды закономерных изменений :
А.
кислотные свойства : R-СООН
> R—SH
> R—OH
> R—NH2
Б.
основные свойства : R—NH2
> R—OH
> R—SH
В амидах
R-СОNH2
аминогруппа практически теряет
основные свойства.
Важное
биологически активное вещество мочевина
NH2 — CO
— NH2 —
однокислотное основание.
По
современным данным протон присоединяется
к атому кислорода и положительный.
заряд равномерно распределяется(
делокализуется) между четырьмя атомами.
Мочевина
–конечный продукт обмена пищевых
белков, белков организма и аминокислот.
Содержится во всех биологических
жидкостях организма, стабилизирует
структуры белков, нуклеиновых кислот,
участвует в поддержании постоянства
значения рН внутренней среды организма.
Выделяется в составе мочи в количестве
до
30 г/ сутки
R- С=ОNH2
-C-NH2
+ НNO3 —>NH2 -C-NH2
| ||
|| . NO3—
NO3—
NH2O+ОН
амид мочевина ( карбамид)
соль нитрат мочевины
хорошо растворима
плохо растворима
в воде
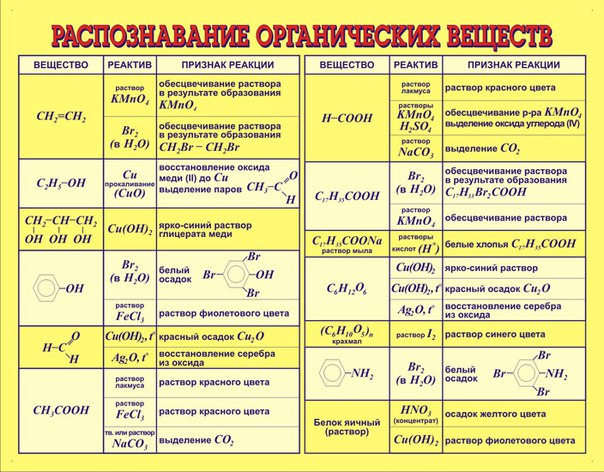
Кислотные свойства органических соединений — Справочник химика 21
Кислотные свойства органических соединений 2J9 [c.219]
КИСЛОТНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ [c.216]
КИСЛОТНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Влияние замещающих групп на силу органических кислот [c.198]
Кислотные свойства органических соединений 217 [c.217]
Помимо кратности, для кислотных свойств органических соединений весьма сушественно наличие в скелете молекулы полярных атомов, которые приводят к увеличению ЭО углерода и полярности гидроксильного водорода. По этой причине трихлоруксусная кислота будет более сильной, чем уксусная, и т.д. [c.217]
По этой причине трихлоруксусная кислота будет более сильной, чем уксусная, и т.д. [c.217]
Интересно, что метиланилин, и особенно диметиланилин, обладают более сильными основными свойствами, чем сам анилин. Это легко объяснить в соответствии с теорией А. М. Бутлерова. Если представить анилин как аммиак, где водород замещен ароматическим радикалом фенилом, который усиливает кислотные свойства органических соединений и ослабляет основные, то станет ясно, что анилин — более слабое основание, чем аммиак. Замещение водорода в аммиаке или ароматическом амине жирным радикалом усиливает их основные свойства. [c.165]
Нитрогруппа, являясь сильным электроноакцептором, усиливает кислотные свойства органических соединении, наличие ее затрудняет проведение реакций нитрования, сульфирования, хлорирования, Фриделя — Крафтса и т. п. [c.18]
Кислотные свойства органических соединений связаны с наличием в их составе карбоксильной —СООН и сульфогруппы —SO3H, причем константы диссоциации имеют, как правило, порядок 10 —10 . Основной характер имеют алифатические -и ароматические амины. В протолитические реакции вступают также сложные эфиры, вещества, содержащие гидроксильные и карбонильные группы. Например, альдегиды и кетоны реагируют с гидрохлоридом гидроксиламина с образованием НС1, которую затем оттитровывают раствором гидроксида натрия или калия R R [c.213]
Основной характер имеют алифатические -и ароматические амины. В протолитические реакции вступают также сложные эфиры, вещества, содержащие гидроксильные и карбонильные группы. Например, альдегиды и кетоны реагируют с гидрохлоридом гидроксиламина с образованием НС1, которую затем оттитровывают раствором гидроксида натрия или калия R R [c.213]
Карбоксильная и сульфогруппа. Наиболее обычными функциональными группами, обусловливающими кислотные свойства органических соединений, являются карбоксильная и сульфогруппа. Большинство карбоновых кислот имеют константы диссоциации от 10 4 до 10 и поэтому легко титруются. Для фиксации конечной точки необходим индикатор с переходом окраски в щелочной области широкое применение находит фенолфталеин. [c.277]
Нитрогруппа обычно усиливает кислотные свойства органических соединении, придавая илн усиливая полярность. Наличие нитрогрупп затрудняет проведение реакций нитрования, сульфироваиня, хлорирования, Фриделя-Крафтса и т. п. В интросоединениях ароматического ряда иитрогруппа направляет заместители главны.м образом в мста-папожение. [c.9]
п. В интросоединениях ароматического ряда иитрогруппа направляет заместители главны.м образом в мста-папожение. [c.9]
Кислотные и основные свойства органических соединений
Кислотные и основные
свойства
органических соединений
учебное пособие для студентов
фармацевтического факультета
2. Кислотные и основные свойства являются важными аспектами реакционной способности органических соединений.
Многие биохимические
процессы
протекают с переносом протона водорода
Важную роль в химических процессах
также играет кислотный или основный
катализ.
3. Существует несколько концепций кислот и оснований:
• Теория Аррениуса. Кислоты – соединения,
при диссоциации которых отщепляется
протон водорода H+; основания –
соединения, при диссоциации которых
-. Эта
• отщепляется
Более универсальной
являетсяOHтеория
гидроксид-анион
Бренстеда-Лоури,
согласно
которой
теория
применима только
к электролитам.
кислотность и основность соединений
связывается с переносом протона водорода
• Еще
более общей
теорией,называют
касающейся
и
H+ (поэтому
теорию
ещё
апротонных
соединений (не имеющих
протолитической).
протона водорода), является теория
Льюиса.
4. Для оценки кислотных и основных свойств органических соединений наибольшее значение имеют теории Бренстеда-Лоури и Льюиса.
Кислоты Бренстеда – это нейтральные
молекулы и ионы, способные отщепить
протон водорода (доноры протонов).
Основания Бренстеда – это нейтральные
молекулы
и
ионы,
способные
присоединить протон водорода (акцепторы
протонов).
Взаимодействие кислоты и основания может
быть представлено схемой:
A- H
кислота
+ B
основание
A — + B+-H
сопряженные
основание кислота
Кислота A-H отдает протон и превращается в анион A-,
основание B присоединяет протон и превращается в
катион BH+. Исходя из определения кислот и оснований
Исходя из определения кислот и оснований
Бренстеда, анион A- является основанием (может присоединить протон), катион BH+ — кислотой (может отщепить
протон). Их называют сопряженными основанием и
кислотой.
7. Кислотные и основные свойства взаимосвязаны: кислотные свойства проявляются только в присутствии оснований, основные – в
присутствии
кислот.
Например, хлороводород сам по себе не проявляет
кислотных свойств, но в водном растворе – это
кислота, т.к. вода проявляет по отношению к нему
основные свойства.
H Cl + h3O
кислота
основание
Cl — + h4O+
сопряженные
основание кислота
8. Понятия «кислотность» и «основность» относительны: в зависимости от условий одно и то же соединение может проявлять кислотные
или основные свойства
Например, в присутствии воды как основания
уксусная
кислота
проявляет
кислотные
свойства, а в присутствии серной кислоты она
является основанием.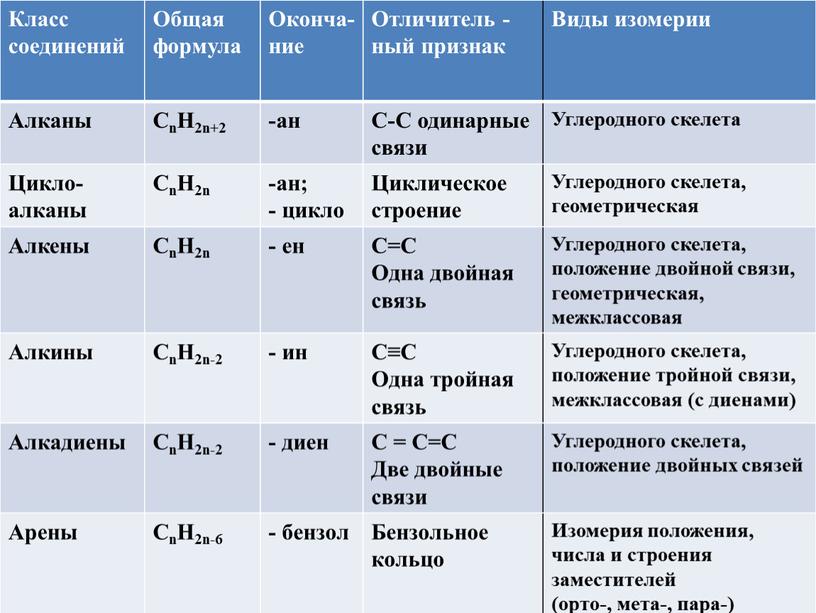
O
Ch4-C
OH
кислота
..
+ h3O
основание
O
+
+
H
O
Ch4-C
3
O-
+
OH
O:
+ h3SO4
Ch4-C
OH
основание
кислота
Ch4-C
+ HSO4OH
10. Кислоты Бренстеда
11. Так как в биохимических процессах растворителем обычно является вода, то кислотные и основные свойства органических соединений
мы будем
рассматривать
по
отношению
к
воде.
Тогда в схему кислотно-основного взаимодействия
A-H + B
A- + B+H
вместо основания B подставим воду:
A-H + h3O
A — + H 3O +
12. Сила кислоты количественно выражается константой равновесия реакции (K):
Сила
кислоты
количественно
константой равновесия реакции (K):
A-H + h3O
выражается
A- + h4O+
[A-] [h4O+]
K=
[A-H] [h3O]
13. Учитывая, что концентрация воды практически не изменяется, можно определить произведение K[h3O] – константу кислотности Ka (от
слова acid –
кислота)
[A-] [h4O+]
Ka = K [h3O] =
[A-H]
Чем выше константа кислотности Ka, тем сильнее
кислота
14.
 Величины Ka органических соединений малы (например Ka уксусной кислоты равна 1,75·10-5), такими величинами неудобно
Величины Ka органических соединений малы (например Ka уксусной кислоты равна 1,75·10-5), такими величинами неудобно
пользоваться, поэтому
введено понятие «показатель константы кислотности» pKa.
.
pKa = — lg Ka
Например, pKa (Ch4COOH) = 4,75
Чем выше показатель константы кислотности pKa,
тем слабее кислота
15. Примеры кислот Бренстеда Обратите внимание! Кислотами могут быть не только нейтральные молекулы, но и катионы.
Нейтральные
молекулы:
h3O Ch4-OH
h3S Ch4-SH
Nh4 Ch4-Nh3
Ch5
Катионы
h4O+ Nh5+
16. Кислоты Бренстеда классифицируют по природе кислотного центра
Типы кислот Бренстеда:
OH-кислоты
h3 O Ch4 OH
спирт
SH-кислоты
фенол
OH
O
Ch4 -C
OH
карбоновая кислота
O
SH
Ch4 SH
тиоспирт
Ch4 -C
тиофенол
SH
тиокислота
17. Типы кислот Бренстеда
O
NH-кислоты
Nh4 Ch4 -Nh3
аммиак
CH-кислоты
амины
Ch4 -C
Nh3
амиды кислот
N
H
пиррол
углеводороды и их производные
18.
 Типы кислот Бренстеда
Типы кислот Бренстеда
• OH-кислоты
• SH-кислоты
• NH-кислоты
• CH-кислоты
производные)
OH
O
Ch4 -C
OH
h3 O Ch4 OH
O
SH
Ch4 SH
Ch4 -C
SH
O
Nh4 Ch4 -Nh3
Ch4 -C
(углеводороды
Nh3
и
N
H
их
19. Образующийся в результате отщепления протона водорода анион может вновь присоединить протон, т.е. процесс кислотно-основного
A-H + h3O
A- + h4O+
Образующийся в результате отщепления протона
водорода анион может вновь присоединить протон,
т.е. процесс кислотно-основного взаимодействия
обратим. Чем стабильнее анион кислоты, тем труднее
он присоединяет протон, тем сильнее проявятся
кислотные свойства.
Чем стабильнее сопряженное основание
(анион кислоты), тем сильнее кислота
Стабильность аниона определяется
степенью делокализации заряда, которая
зависит от следующих факторов:
• природа атома кислотного центра
• влияние заместителя (особенно сопряженной
системы)
• сольватация
21.
 Природа атома кислотного центра
Природа атома кислотного центра
• Чем более электроотрицателен атом, тем сильнее
он удерживает отрицательный заряд, тем труднее
протону присоединиться к аниону кислоты, тем
сильнее проявятся кислотные свойства.
• Чем выше поляризуемость атома, тем легче
отрицательный
заряд
рассредоточивается
(делокализуется),
тем
труднее
протону
присоединиться к аниону кислоты, тем сильнее
проявятся кислотные свойства.
22. Электроотрицательность атомов (способность удерживать электроны) можно сравнить, используя таблицу Менделеева: она
увеличивается в периоде слева направо и в ряду
снизу вверх.
Поляризуемость
(способность
рассредоточивать заряд) зависит от размера
атома: чем больше радиус атома, тем выше
поляризуемость. Радиусы атомов увеличиваются
с увеличением номера периода.
23. Природа атома кислотного центра
период
Электроотрицательность C
N
O
возрастает
Кислотные свойства :
Поляризуемость
г
р
у
п
п
а
O
S
OH > NH > CH
в
о
з
р
а
с
т
а
е
т
SH > OH
То, что тиолы являются более сильными кислотами,
можно подтвердить реакцией со щелочью: тиолы
вступают в эту реакцию, а спирты – нет.
C2H5-OH + NaOH
этанол
pKa=18,00
C2H5-SH + NaOH
этантиол
pKa=10,50
C2H5-SNa + h3O
этантиолят
натрия
25. При сравнении кислотных свойств различных типов кислот Бренстеда необходимо рассматривать фактор влияния заместителя и особенно
сопряженной
системы на стабилизацию аниона.
Сравним, например кислотные свойства метанола и
фенола
26. Сравнение кислотных свойств спиртов и фенолов
O — + H+
OH
pKa = 10,00
Ch4-OH
Ch4
O — + H+
pKa = 16,00
Чем стабильнее анион кислоты, тем сильнее её
кислотные свойства. Фенолят-анион стабилизирован за
счёт p,π-сопряжения.
27. Фенол проявляет слабые кислотные свойства: он взаимодействует с сильным основанием (щелочью), но не может вытеснить угольную
кислоту из ее
солей. Это значит, что даже слабая угольная кислота
является более сильной, чем фенол.
ONa + h3O
OH + NaOH
фенолят натрия
OH + NaHCO3
29.
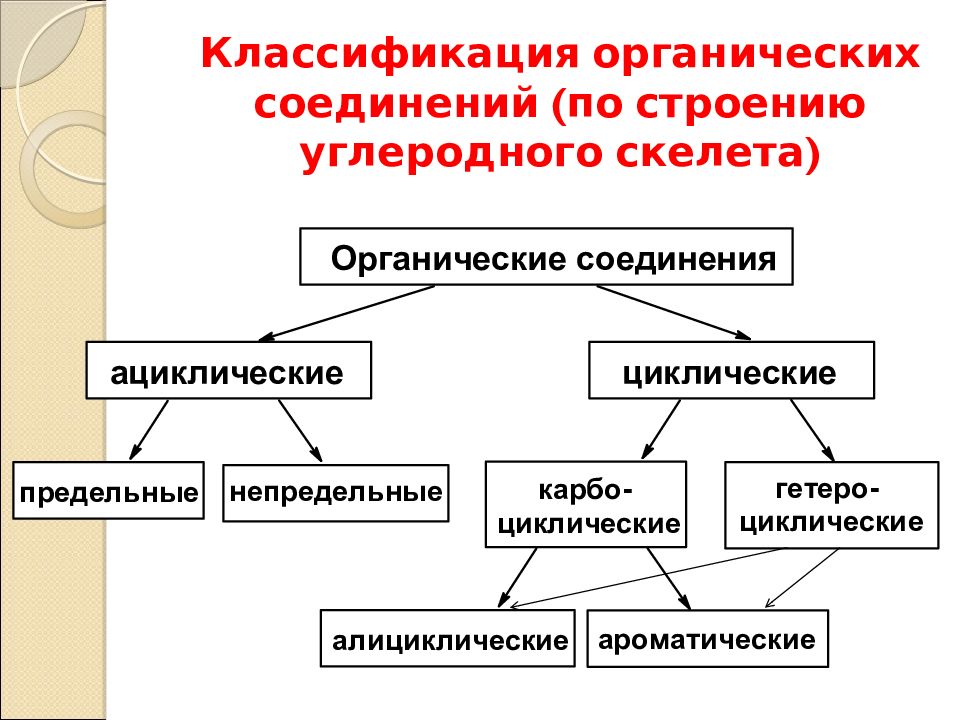 Карбоновые кислоты являются более сильными кислотами, чем фенолы. Это связано с повышенной стабильностью карбоксилат-иона:
Карбоновые кислоты являются более сильными кислотами, чем фенолы. Это связано с повышенной стабильностью карбоксилат-иона:
отрицательный
заряд рассредоточивается по p,π-сопряженной
системе
и
«делится»
между
двумя
электроотрицательными атомами кислорода.
O
Ch4-C
OH
O
Ch4-C
O-
+ H+
pKa=4,75
O-½
Ch4-C
O-½
31. Карбоновые кислоты взаимодействуют со щелочами, а также с солями угольной кислоты. Это доказывает, что карбоновые кислоты более
сильные
кислоты, чем угольная кислота.
Ch4-COOH + NaOH
Ch4-COOH + NaHCO3
Ch4-COONa + h3O
Ch4-COONa +
CO2 + h3O
33. Влияние заместителей в радикале на кислотные свойства
• Электроноакцепторные
заместители
способствуют делокализации заряда в
анионе,
следовательно,
повышают
кислотные свойства
• Электронодонорные
заместители
препятствуют делокализации заряда в
анионе,
следовательно,
понижают
кислотные свойства
34.
 Сравним кислотные свойства масляной (бутановой), α-хлормасляной (2-хлорбутановой) и β-хлормасляной (3-хлорбутановой) кислот.
Сравним кислотные свойства масляной (бутановой), α-хлормасляной (2-хлорбутановой) и β-хлормасляной (3-хлорбутановой) кислот.
Сравним кислотные свойства масляной (бутановой),
α-хлормасляной
(2-хлорбутановой)
и
βхлормасляной
(3-хлорбутановой)
кислот.
Запишем
формулы
соединений,
покажем
отщепление
протона
водорода,
отметим
электронные эффекты. Сделаем вывод о влиянии
заместителя на стабильность аниона кислоты.
O
O
Ch4-Ch3-Ch3-C
OH
Ch4-Ch3-Ch3-C
OO
O
Ch4-Ch3-CH-C
Cl
OH
Cl
Ch4-Ch3-CH-C
O
+
+
H
—
Cl
O
Ch4-CH-Ch3-C
+ H+
OH
O
Ch4-CH-Ch3-C
Cl
O
+
+
H
—
36. Хлор из-за высокой электроотрицательности проявляет отрицательный индуктивный эффект, он смещает электронную плотность на себя
и
способствует делокализации отрицательного заряда.
Индуктивный эффект передается с затуханием,
поэтому чем дальше хлор находится от
карбоксильной группы, тем слабее его влияние.
Значит, самые сильные кислотные свойства
проявляет α-хлормасляная кислота, затем – βхлормасляная кислота, и наконец, масляная кислота,
в радикале которой нет электроноакцепторного
заместителя.
O
Ch4-Ch3-CH-C
Cl
pKa=2,84
OH
O
Ch4-CH-Ch3-C
Cl
OH
pKa=4,06
Различие в кислотных
свойствах подтверждается
значениями pKa (чем ниже
pKa, тем сильнее кислота)
O
Ch4-Ch3-Ch3-C
pKa=4,80
OH
38. Сравним кислотные свойства фенола, п-нитрофенола и п-аминофенола. Запишем формулы соединений, покажем отщепление протона
Сравним
кислотные
свойства
фенола,
пнитрофенола и п-аминофенола. Запишем формулы
соединений,
покажем
отщепление
протона
водорода, отметим электронные эффекты. Сделаем
вывод о влиянии заместителя на стабильность
аниона кислоты
— +
OH
— +
OH
фенол
N
O
O
— +
OH
: Nh3
п-аминофенол
п-нитрофенол
-I -M
-I
40.
 Нитро-группа проявляет отрицательный индуктивный эффект и отрицательный мезомерный эффект, значит, является
Нитро-группа проявляет отрицательный индуктивный эффект и отрицательный мезомерный эффект, значит, является
электроноакцепторным заместителем и
способствует стабилизации аниона за счет более
полной делокализации отрицательного заряда с атома
кислорода.
Амино-группа проявляет отрицательный индуктивный
эффект,
но
более
сильный
положительный
мезомерный
эффект,
значит,
она
является
электронодонорным заместителем и препятствует
делокализации
отрицательного
заряда.
Итак, п-нитрофенол является самой сильной кислотой,
затем идет фенол, а самая слабая кислота – паминофенол.
OH
OH
OH
Значения pKa подтверждают наш вывод
NO2
pKa=7,16
pKa=10,00
Nh3
pKa=10,68
42. Итак, мы сравнили силу различных OH-кислот и пришли к следующему выводу:
Карбоновые кислоты
Угольная кислота
Фенолы
Спирты
У
Б
Ы
В
А
Н
И
Е
К
И
С
Л
О
Т
Н
О
С
Т
И
Электронодонорные заместители понижают
кислотные свойства,
электроноакцепторные — повышают
44.
 Основания Бренстеда
Основания Бренстеда
45. Основания Бренстеда – это нейтральные молекулы и ионы, способные присоединить протон водорода (акцепторы протонов).
46. Нейтральные молекулы могут присоединять протон водорода за счет неподелённой электронной пары (n-электронов) или за счет пары
электронов π-связи.
Поэтому основания Бренстеда классифицируют на
• n-основания
• π-основания
47. Классификация оснований Бренстеда
O:
R-C
R’(H)
альдегиды, кетоны
..
R-Nh3
амины
• сульфониевые основания
..
..
R-SH
R-S-R
тиолы
сульфиды
N
..
пиридин
n-основания
• оксониевые основания
O:
..
..
R-OH R-O-R R-C
спирты простые эфиры
O-R’
сложные эфиры
• аммониевые основания
48. Классификация оснований Бренстеда
• π-основания
алкены, алкины
Ch3= Ch3 + H+
Ch3= Ch3
H+
49. π-основания – слабые, т.к. протонирование происходит не за счет свободной пары электронов, а за счет электронов π-связи.

Сила основания
pKBH+ .
выражается
величиной
pKBH+ — это pKa сопряженной с данным
основанием кислоты.
Чем больше pKBH+ , тем сильнее основание
51. Факторы, влияющие на основные свойства
• С увеличением электроотрицательности атома
основного центра основность уменьшается. (Чем
выше электроотрицательность, тем труднее атом
отдает неподелённую электронную пару протону
водорода). Поэтому аммониевые основания сильнее
оксониевых.
Спирты образуют соли только при взаимодействии с
сильными
кислотами
–
концентрированными
минеральными кислотами:
H
..
+
Ch4-Ch3-O-H + h3SO4
Ch4-Ch3-O-H HSO4
этилоксония гидросульфат
Алифатические амины взаимодействуют даже с такой
слабой кислотой как вода:
..
Ch4-Ch3-Nh3 + h3O
+
Ch4-Ch3-Nh4 OH
этиламмония гидроксид
53. Факторы, влияющие на основные свойства
• С увеличением поляризуемости атома основного
центра основность уменьшается. (Чем выше
(Чем выше
поляризуемость атома основного центра, тем более
рассредоточена неподелённая электронная пара, и
протону водорода труднее к ней присоединиться).
Поэтому
оксониевые
основания
сильнее
сульфониевых.
54. Факторы, влияющие на основные свойства
• Влияние
заместителей,
особенно
наличие
сопряженной системы.
• Электронодонорные
заместители
повышают
основность, а электроноакцепторные – понижают
(чем выше электронная плотность на основном
центре, тем легче он предоставит свою электронную
пару протону)
55. Сравнение основных свойств алифатических и ароматических аминов
Неподелённая электронная пара азота участвует в p,πсопряжении с электронным облаком ароматического
кольца, поэтому протону водорода труднее присоединиться к ней. Ароматические амины более слабые
основания, чем алифатические.
..
NH
2
Ch4
..
Nh3
pKBH+ 10,65
pKBH+ 4,62
56.
 Как сильные основания алифатические амины образуют соли и с сильными, и со слабыми кислотами:
Как сильные основания алифатические амины образуют соли и с сильными, и со слабыми кислотами:
Ch4-Nh3 + HCl
+
Ch4-Nh4 Clметиламмония хлорид
Ch4-Nh3 + Ch4-COOH
Ch4-C
O
+
O- Nh4-Ch4
метиламмония ацетат
Ch4-Nh3 + h3O
+
Ch4-Nh4
OH
метиламмония гидроксид
57. Как слабые основания ароматические амины образуют соли только с сильными минеральными кислотами:
Nh3 + HCl
+
Nh4
Cl-
фениламмония хлорид
анилиния хлорид
Электронодонорные заместители в кольце
повышают основные свойства, электроноакцепторные — понижают
..
Nh3
..
Nh3
O
анилин
N
..
Nh3
O
Ch4
п-толуидин
п-нитроанилин
pKBH+ =1,00
pKBH+ =4,60
pKBH+ =5,10
Учебное
пособие
И.В. Зубковой
составлено
доцентом
Кислотно-основные свойства органических соединений — презентация онлайн
1. Лекция 3
2. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
3.
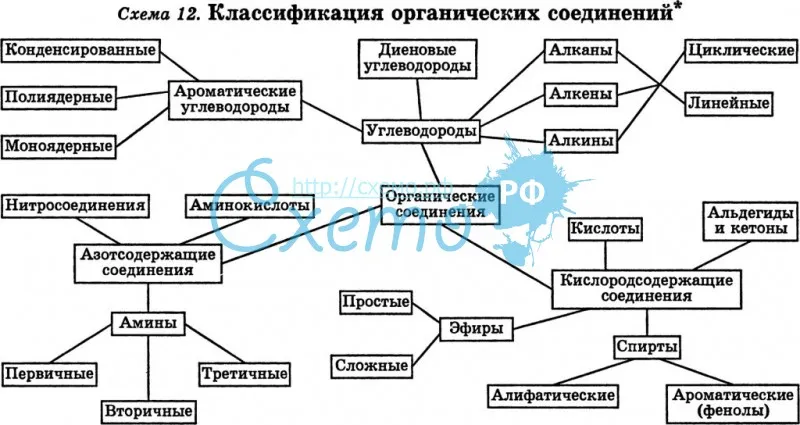 Протонная теория Бренстеда-Лоури Кислоты – нейтральные молекулы или ионы, способные отдавать протон Н+(доноры протона)
Протонная теория Бренстеда-Лоури Кислоты – нейтральные молекулы или ионы, способные отдавать протон Н+(доноры протона)
Кислотность — способность отдавать протон.
Основания — нейтральные молекулы или ионы,
способные присоединять протон Н+(акцепторы
протона)
Основность – способность присоединять протон.
Кислота ↔ Н+ + Основание
4. Элемент и связанный с ним потенциально способный к отщеплению атом Н называют кислотным центром (КЦ). Типы органических кислот
1) SH-кислоты: тиолы СН3-SH
2) ОН-кислоты: спирты СН3-ОH
3) NН-кислоты: амины СН3-Nh3,
амиды, имиды
4) CН-кислоты: углеводороды и их
производные RСН2-Сh4,
RСН = СН2, RС ≡ СН
5. Силу кислоты определяют стабильностью аниона, остающегося после отщепления протона Н+ (чем стабильнее анион, тем сильнее
кислота):
RSH → RS- + H+
O
R–C
O
+ H+
→R–C
OH
O-
6. Факторы, влияющие на стабильность аниона
7. 1) Электрооторицательность атома в КЦ Чем больше ЭО атома в КЦ, тем стабильней анион (сильнее кислота) ЭО атома C < N < O < F
1) Электрооторицательность атома в КЦ
Чем больше ЭО атома в КЦ, тем стабильней анион
(сильнее кислота)
ЭО атома
C
Сила кислот
CH-кис.
(с одинаковым R у кислотного центра)
На ЭО влияет состояние гибридизации атома C:
С sp3
С sp2
С sp
Увеличение ЭО атома
Увеличение силы СН-кислот:
RСН2-Сh4
8. 2) Размер атома Чем > радиус атома у КЦ, тем сильнее кислота: RSH > ROH тиолы спирты 3) Природа радикала R (заместителя),
2) Размер атома
Чем > радиус атома у КЦ, тем сильнее кислота:
RSH > ROH
тиолы спирты
3) Природа радикала R (заместителя),
связанного с КЦ
а) ЭА заместители ↑ кислотность в пределах одного
ЭД заместители↓ кислотность класса орг. соедин.
>
>
CCl3COOH > CHCl2COOH > Ch3ClCOOH > Ch4COOH
9. б) Размер R: чем длиннее углеводородный R, тем слабее кислота HCOOH > Ch4COOH > Ch4Ch3COOH Уменьшение силы кислоты
б) Размер R: чем длиннее углеводородный R,
тем слабее кислота
HCOOH > Ch4COOH > Ch4Ch3COOH
Уменьшение силы кислоты
10. 4) Растворитель Чем лучше гидратирован ион (чем меньше его размер), тем сильнее кислота: RCOOH > Ar-OH > R-SH > R-OH > R-Nh3 >
4) Растворитель
Чем лучше гидратирован ион (чем меньше его
размер), тем сильнее кислота:
RCOOH > Ar-OH > R-SH > R-OH > R-Nh3 > R-H
карбоновые
кислоты
фенолы
тиолы
спирты
амины
На силу оснований Бренстеда влияют те же
факторы, но в обратном направлении
у/в
11.
 Электронная теория кислот и оснований (теория Льюиса) Кислоты — соединения, принимающие е пару (акцепторы е-в) Основания —
Электронная теория кислот и оснований (теория Льюиса) Кислоты — соединения, принимающие е пару (акцепторы е-в) Основания —
соединения, предоставляющие
е пару (доноры е-в)
BF3 + R – – R →
кислота
СН3 –
основание
основание
+ AlCl3 →
кислота
R – O+ – R
BF3Ch4 – Cl+ — -AlCl3
12. РЕАКЦИОННАЯ СПОСОБНОСТЬ СПИРТОВ, ЭФИРОВ, ФЕНОЛОВ И ИХ ТИОАНАЛОГОВ
13. Спирты (алкоголи) – производные углеводородов, содержащие одну или несколько функциональных групп -ОН
14. Классифицируют: 1) по числу ОН-групп (одно-, двух-, многоатомные) 2) по строению углеводородного R R м. б. алкильным или
циклического строения, м.
содержать двойные или тройные связи
15. Фенолы — органические соединения, содержащие ОН-группу, непосредственно связанную с атомом С ароматического ядра Ar-OH –
моноядерные
Фенол
(карболовая кислота)
Резорцин
β-Нафтол
16. Химические свойства фенолов и спиртов определяются наличием полярных связей С — О и О — Н
Химические свойства
фенолов и спиртов
определяются наличием полярных связей
С-О и
О-Н
17.
 Кислотные свойства О — Н 1) Алифатические одноатомные спирты — нейтральные соединения, реагируют только с активными Ме 2С2Н5ОН
Кислотные свойства О — Н 1) Алифатические одноатомные спирты — нейтральные соединения, реагируют только с активными Ме 2С2Н5ОН
Кислотные свойства О — Н
1) Алифатические одноатомные спирты нейтральные соединения, реагируют только с
активными Ме
2С2Н5ОН + 2Na → 2C2H5ONa + h3↑
этилат Na
алкоголяты (алканоляты)
Кислотные св-ва ↓ при переходе от первичных к третичн.
СН3ОН > RCh3OH > R2CHOH > R3COH
метанол
первичный
вторичный
третичный
18. В 2-х атомных (гликолях) и 3-х атомных (глицеринах) Н замещается легче, чем в одноатом.
19. Фенолы – слабые кислоты, реагируют как с металлами, так и со щелочами, образуя феноляты: ф
20. Реакция этерификации (образование сложных эфиров)
22. Дегидратация характерна для одноатомных спиртов 1) Межмолекулярная — с образованием простых эфиров h3SO4 СН3– ОН + СН3– ОН СН3–
Дегидратация
характерна для одноатомных спиртов
1) Межмолекулярная — с образованием простых эфиров
h3SO4
СН3– О – СН3 + Н2О
СН3– ОН + СН3– ОН
t
2) Внутримолекулярная (по правилу Зайцева) – с
образованием алкенов
СН3
Н3С – С – СН – СН3
ОН Н
h3SO4
СН3
Н3С – С = СН – СН3 + Н2О
t > 140 0C
23.
 Реакции окисления Третичные спирты не окисляются Фенолы + [О] → Кетоны:
Реакции окисления Третичные спирты не окисляются Фенолы + [О] → Кетоны:
24. Реакция SN с разрывом связи R — OH: СН3 – ОН + HCl → Ch4 — Cl + h3O Фенол — с HCl не реагирует — вступает в реакцию SЕ по
бензольному кольцу (ОНгруппа ЭД):
25. Простые эфиры — производные спиртов и фенолов, в которых атом водорода ОН-группы замещен на углеводородный радикал: R – O – R1;
Простые эфиры производные спиртов и фенолов, в которых атом
водорода ОН-группы замещен на углеводородный
радикал:
R – O – R 1;
R – O – Ar
H+
С2Н5 – О – С2Н5 + HI
С2Н5 I + С2Н5OH
t
Простые Э – слабые нейтральные О–основания
Образуют оксониевые соли:
С2Н5 – О – С2Н5 + h3SO4
конц.
[С2Н5 – О+– С2Н5 ]HSO4H
26. Тиолы (тиоспирты, меркаптаны) – серусодержащие аналоги спиртов и фенолов (S вместо О) Тиолы Сульфиды Дисульфиды R – SH Ar – SH
Тиолы (тиоспирты, меркаптаны) –
серусодержащие аналоги спиртов и фенолов (S вместо О)
Тиолы
R – SH Ar – SH
2С2Н5SН + 2Na
Сульфиды
R – S – R1
Дисульфиды
R – S – S – R1
→
+
2C2H5SNa
этантиолят натрия
СН3SН + NaOH → Ch4ONa
h3↑
+ h3O
метантиолят натрия
27.
 Сульфиды с галогеналканами образуют сульфониевые соли: СН3 – S – Ch4 + Ch4I → [ СН3 – S+– СН3 ]I- Ch4 [O] 2СН3SН СН3 – S — S –
Сульфиды с галогеналканами образуют сульфониевые соли: СН3 – S – Ch4 + Ch4I → [ СН3 – S+– СН3 ]I- Ch4 [O] 2СН3SН СН3 – S — S –
Сульфиды с галогеналканами образуют
сульфониевые соли:
СН3 – S – Ch4 + Ch4I → [ СН3 – S+– СН3 ]ICh4
[O]
СН3 – S — S – Ch4 + h3O
2СН3SН
[H]
КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. КЛАССИФИКАЦИЯ РЕАГЕНТОВ И ХИМИЧЕСКИХ РЕАКЦИЙ
Кислотно-основные свойства
Кислотно-основные свойства органических соединений 3 Теории кислот и оснований теория Бренстеда-Лоури теория Льюиса 4 Теория Бренстеда-Лоури Кислота донор протона. Основание акцептор протона.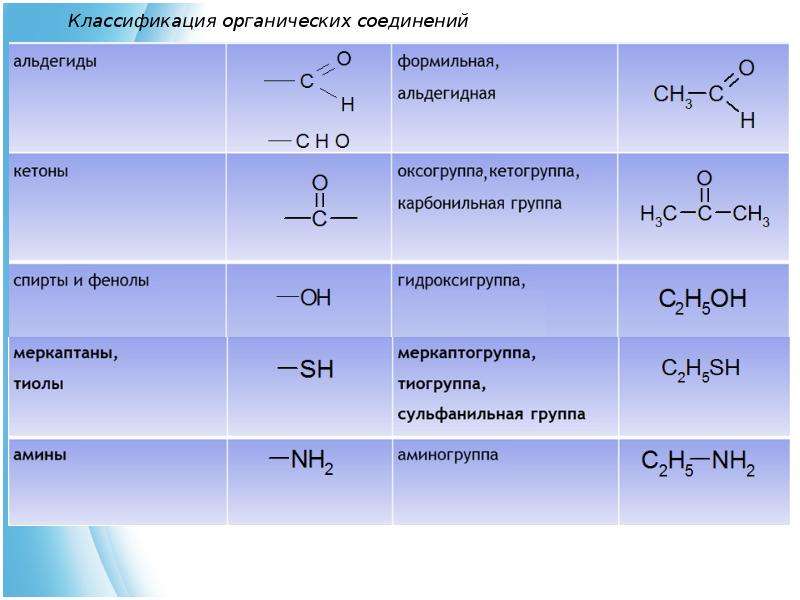 Кислота Основание
Кислота Основание
Подробнее
Азотсодержащие соединения
Азотсодержащие соединения Известно множество природных и синтетических органических соединений, содержащих в своем составе атомы азота: нитросоединения R-NO 2 нитраты R-O-NO 2 (сложные эфиры спирта и азотной
Подробнее
ГАЛОГЕНАЛКАНЫ СТРОЕНИЕ ГАЛОГЕНАЛКАНОВ
ГАЛОГЕНАЛКАНЫ Галогеналканы находят широкое применение в индустрии, всё началось с открытия ДДТ (дихлор-дифенил-трихлорэтан) — дешёвого инсектицида. Тетрахлорметан используется для приготовления фреонов
Подробнее
Лекции по органической химии
Лекции по органической химии Лектор Сарычева Тамара Александровна, к.х.н., доцент кафедры биотехнологии и органической химии Ну, начнем. Дойдя до конца, мы будем знать больше. Г.Х.Андерсен Рекомендуемая
Г.Х.Андерсен Рекомендуемая
Подробнее
СПИРТЫ Дегтярёва М.О. МОУ ЛНИП
СПИРТЫ Дегтярёва М.О. МОУ ЛНИП С n Н 2n+1 OH Определение Спирты органические соединения, содержащие одну или несколько гидроксильных групп ОН Простейшие спирты Название Формула Модели Метиловый спирт (метанол)
Подробнее
NH 3, t, p (CH 3 CO) 2 O HNO 3. бензол
Вариант 1 1. Получите изопропанол из соответствующего: а) алкена, б) галогенопроизводного, в) кетона. 2. Напишите реакции изопропанола со следующими реагентами: а) К, б), 140 0, в) PCl 5. 3. Получите фенол
Подробнее
Галогенопроизводные алканов
алканов R lg (F, l, Br, I) 3 2 Br 3 3 бромэтан (первичный галогеналкан) l 2-хлорпропан (вторичный галогеналкан) 3 3 3 I 2-иод-2-метилпропан (третичный галогеналкан) 1 2 F 2 2 Номенклатура и изомерия галогеналканов
Подробнее
ID_8814 1/6 neznaika.
 pro
pro
1 Химические свойства кислородсодержащих соединений Ответами к заданиям являются слово, словосочетание, число или последовательность слов, чисел. Запишите ответ без пробелов, запятых и других дополнительных
Подробнее
ID_2362 1/6 neznaika.pro
1 Классификация и номенклатура органических веществ Ответами к заданиям являются слово, словосочетание, число или последовательность слов, чисел. Запишите ответ без пробелов, запятых и других дополнительных
Подробнее
Теоретические основы органической химии
Теоретические основы органической химии 1. Строение органических соединений Классическая теория химического строения и качественная квантово-механическая интерпретация ее основных положений. Метод локализованных
Подробнее
ОГЛАВЛЕНИЕ ПРЕ ДИ СЛО ВИЕ
ОГЛАВЛЕНИЕ ПРЕДИСЛОВИЕ ко второму изданию. ………………………………. 9 ПРЕДИСЛОВИЕ к первому изданию……………………………….. 11 От автора……………………………………………………..
………………………………. 9 ПРЕДИСЛОВИЕ к первому изданию……………………………….. 11 От автора……………………………………………………..
Подробнее
Задания В1 по химии
Задания В1 по химии 1. Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит. НАЗВАНИЕ СОЕДИНЕНИЯ А) бутан Б) ацетилен В) бутадиен-1,3 Г)
Подробнее
3) гомологи 4) одно и то же вещество
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ 1. Органическое вещество, молекулярная формула которого С 7 Н 8, относится к гомологическому ряду 1) метана 2) этилена 3) бензола 4) ацетилена 2. К алкенам относится
Подробнее
Функциональные г р у п п ы
С п и р т ы R Функциональные г р у п п ы Функц. группа Класс органических веществ Гидроксил Карбонил Карбоксил C С п и р т ы и фенолы Альдегиды Кетоны C Карбоновые кислоты Пример 3 C C 2 C 2 3 C C C 3
Подробнее
Реакции β-элиминирования
Реакции βэлиминирования Лекция 10 Реакции элиминирования Реакции элиминирования (отщепления) реакции, при которых происходит расщепление тех или иных связей в молекуле с образованием новых устойчивых молекул,
Подробнее
БИЛЕТЫ ПО ХИМИИ КЛАСС.
БИЛЕТЫ ПО ХИМИИ 10-11 КЛАСС. БИЛЕТ 1 1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периоди- ческого закона для
Подробнее
КАРБОНИЛЬНАЯ ГРУППА. АЛЬДЕГИДЫ И КЕТОНЫ
КАРБОНИЛЬНАЯ ГРУППА. АЛЬДЕГИДЫ И КЕТОНЫ Органическая функциональная группа С=O носит название «карбонильная группа», она состоит из двойной связи углерод-кислород и является основой для таких соединений,
Подробнее
Презентация «КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ» – проект, доклад
Слайд 1
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Слайд 2
кислоты — вещества, способные в растворах отдавать протон основания — вещества, способные присоединять протон
теория Бренстеда-Лоури
протолитическая теория
кислота
сопряженная кислота
основание
сопряженное основание
Слайд 3
Классификация органических кислот
ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты SH-кислоты: тиоспирты, SH-содержащие соединения NH-кислоты: амины, имины, гетероциклические соединения с атомом азота СН-кислоты: углеводороды, радикалы гетерофункциональных соединений
Кислотность
Слайд 4
алкилоксониевый ион алкиламмониевый ион
Положительно заряженные ионы:
Слайд 5
pKa — количественная характеристика кислотных свойств
; pKa = -lg Ka
Слайд 6
Качественная характеристика кислотности – стабильность аниона, образующегося при диссоциации кислоты
чем стабильнее анион, тем сильнее кислота
Слайд 7
Стабильность аниона зависит:
от природы атома: электроотрицательности и поляризуемости (радиуса)
от степени делокализации отрицательного заряда в анионе
от способности к сольватации
Слайд 8
Электроотрицательность элементов кислотного центра
учитывается, если кислоты имеют одинаковые радикалы и элементы кислотного центра расположены в одном периоде
1 2 R-OH > R-Nh3 > R-Ch4
Слайд 9
Радиус атома
учитывается, если кислоты имеют одинаковые радикалы и элементы кислотного центра расположены в одной группе
Rs > Ro
Слайд 10
Если радикалы кислот одинаковы
R-SH > R-OH > R-Nh3 > R-Ch4
Слайд 11
Реакции замещения
тиолы используют как антидоты при отравлении соединениями мышьяка, ртути, хрома, висмута
Слайд 12
Слайд 13
2,3-димеркапто- пропанол-1 БАЛ
+
нетоксичное производное
люизит
Слайд 14
Степень делокализации отрицательного заряда в анионе
учитывается, если кислоты имеют одинаковые кислотные центры
наличие сопряжения, электроноакцепторных заместителей увеличивает стабильность аниона
наличие электронодонорных заместителей уменьшает стабильность аниона
Слайд 15
Сравнение кислотности этанола и фенола
Слайд 16
сравнение кислотности этанола и этановой кислоты
+ H+
делокализация заряда
Слайд 17
сравнение кислотности этанола и этандиола
-IOH
Слайд 18
сравнение кислотности фенола, п-аминофенола, п-нитрофенола
Nh3 -ЭД NО2 — ЭА 3
Слайд 19
сравнение кислотности этановой кислоты, этандиовой кислоты
H+ — ICOOH + ICh4
Слайд 20
сравнение кислотности п-гидроксибензойной кислоты и о- п-гидроксибензойной кислоты
рКа 4,58 рКа 2,98
Слайд 21
кислотность гетероциклов
Слайд 23
Влияние сольватации
чем меньше размер иона, чем больше локализован заряд, тем лучше ион сольватируется
Слайд 24
Слайд 25
Основность по Бренстеду
Ch4OH молекулы
— это способность присоединять протон
основания анионы Ch4O-
Слайд 26
В зависимости от природы гетероатома
n-основания π-основания
аммониевые оксониевые тиониевые
Слайд 27
чем выше рКвн+, тем сильнее основание
рКвн+ = -lg Квн+
рКвн+ — количественная характеристика основности
Слайд 28
Качественная характеристика основности – величина электронной плотности на основном центре
Чем выше электронная плотность на основном центре, тем сильнее основание
Слайд 29
Природа атома ЭON RО
Слайд 30
Влияние радикала
электронодонорные заместители повышают основность, электроноакцепторные — понижают
Слайд 31
+IСН3 метиламин диметиламин ..
Слайд 32
сопряжение
Слайд 33
Основность гетероциклов
ЭА свойства второго атома азота
Слайд 34
Слайд 35
НОН НСl
Реакции кислотно-основного взаимодействия
Слайд 36
новокаин
Слайд 37
Новокаина гидрохлорид
Слайд 38
амиды кислот
Слайд 39
Амфотерность органических соединений
спирты гидроксикислоты фенолокислоты аминокислоты пуриновые и пиримидиновые основания
Слайд 40
Водородные связи- проявление амфотерности
Слайд 41
основный центр кислотный центр
амфотерность спиртов
Слайд 42
амфотерность аминокислот
Слайд 43
гуанин цитозин
Слайд 44
Слайд 45
Электронная теория Льюиса
кислота — акцептор пары электронов основание — донор пары электронов
Слайд 46
Кислоты жесткие мягкие
малый R высокая ЭО низкая поляризуемость
большой R низкая ЭО высокая поляризуемость
h4C+
Слайд 47
Основания
трудно окисляются высокая ЭО низкая поляризуемость
легко окисляются низкая ЭО высокая поляризуемость
OH- h3O ROH RNh3 H- RS- RSH
Слайд 48
ПЖМКО –принцип жестких и мягких кислот и оснований (Пирсона): жесткие кислоты будут преимущественно связываться с жесткими основаниями, а мягкие кислоты – с мягкими основаниями
Слайд 49
С2Н5О- Ж.О. С2Н5S- M.О.
Слайд 50
Кислотность, основность в биологических системах
Большинство БВС и лекарственных средств – слабые кислоты или основания
Важное значение имеет степень ионизации соединения в определенной среде
Различия в степени ионизации обеспечивают избирательность действия
Слайд 51
ацетилсалициловая кислота рКа 3,5
При рН = 3,5 50% — в ионизированном состоянии
При ↑ рН (7,4) 99,99% ацетилсалициловой кислоты будет находиться в ионизированной форме При рН = 1 — в неионизированном состоянии
Слайд 52
Слайд 53
Классификация органических реакций
Слайд 54
В органической химии субстрат – это соединение, молекула которого поставляет атом углерода для образования связи
Реагент – это действующее на субстрат вещество
Механизм реакции – детальное описание процесса в результате которого исходные вещества превращаются в конечные продукты
Слайд 55
Для того чтобы осуществилась реакция, необходимо столкновение двух частиц, обладающих энергией, достаточной для преодоления энергетического барьера реакции
Энергия необходимая для образования активированного комплекса называется энергией активации (Еа)
Слайд 56
Слайд 57
По направлению реакций с учетом конечного результата:
р. замещения Substitution — S
р. присоединения Addition -A
р. отщепления Elimination -E
р. перегруппировки Isomerisation -I
Слайд 58
р. окислительно-восстановительные
р. кислотно-основного взаимодействия
Слайд 59
мономолекулярные бимолекулярные
По числу молекул, участвующих в стадии, определяющей скорость реакции:
Слайд 60
По характеру изменений связей в субстрате и реагенте
радикальные ионные согласованные
Слайд 61
Радикальные реакции Гомолитический разрыв связи
свободные радикалы:
sp2-гибридизация плоскостное строение
Слайд 62
Признаки радикальных реакций
1.гомолитически разрывается неполярная ков. связь 2.реакции протекают в газовой фазе или в неполярных растворителях 3.инициируются физическими (излучения, t), а также химическими факторами (R-O-O-R, Fe2+)
Слайд 63
4. чувствительны к действию акцепторов электронов 5. являются цепными самоускоряющимися рекциями Стадии радикальных реакций: 1. инициирование радикалов 2. рост цепи 3. обрыв цепи
Слайд 64
Ионные реакции Гетеролитический разрыв связи
Слайд 65
Реагенты:
Нуклеофильные реагенты Nu Образуют новые ковалентные связи с партнером, предоставляя для этого пару электронов а) отрицательно заряженные ионы :Н :Вr :ОН :OR :SН :SR
б) молекулы, имеющие неподеленную пару электронов HOH ROH RNh3 RSH
Слайд 66
Электрофильные Е Образуют новые ковалентные связи за счет пары электронов партнера а) положительно заряженные ионы Н+ Н3С + Н5С2+
б) молекулы с частичным положительным зарядом на одном из атомов
Слайд 67
Признаки ионных реакций
1. гетеролитически разрывается полярная ков. связь 2. реакции протекают в полярных растворителях 3. катализируются кислотами или основаниями
Слайд 69
Слайд 70
Окисление спиртов
Слайд 71
тиолы в мягких условиях окисляются до дисульфидов
тиолы окисляются легко
[O] диалкилдисульфид
Антиоксиданты – вещества, препятствующие окислению
Слайд 72
Слайд 73
Степень ионизации зависит от рН раствора и рКа кислоты (или рКвн+ основания)
Степень ионизации кислоты = (% анионной формы)
Степень ионизации основания = (% катионной формы)
Слайд 74
Собственная кислотность проявляется в газовой фазе Определяется только структурой соединения
8: Свойства органических соединений
- Последнее обновление
- Сохранить как PDF
- Участники
Водород, кислород, азот и ряд других элементов также прочно связываются с углеродом, что может привести к огромному разнообразию соединений.На заре химии такие соединения получали из растений или животных, а не синтезировали химики, и поэтому они стали известны как органические соединения. Это отличало их от неорганических соединений, доступных из неживых частей земной поверхности. Сегодня буквально миллионы углеродных соединений могут быть синтезированы в лабораториях, и поэтому это историческое различие больше не действует. Тем не менее изучение углеродных соединений по-прежнему называют органической химией.
- 8.1: Введение в органические соединения
- Водород, кислород, азот и ряд других элементов также прочно связываются с углеродом, что может привести к огромному разнообразию соединений. На заре химии такие соединения получали из растений или животных, а не синтезировали химики, и поэтому они стали известны как органические соединения. Это отличало их от неорганических соединений, доступных из неживых частей земной поверхности.
- 8.2: Ковалентные соединения и межмолекулярные силы
- Почти все ионные соединения представляют собой твердые вещества с температурами плавления выше 600 ° C. Напротив, большинство веществ, которые содержат простые молекулы, являются газами или жидкостями при комнатной температуре. Их можно уговорить затвердеть только при довольно низких температурах. Причина такого контрастного поведения легко объясняется на микроскопическом уровне.
- 8.3: Дипольные силы
- Полярные молекулы притягиваются друг к другу, когда наиболее близкие друг к другу заряды имеют противоположный знак.Возникающие таким образом силы между полярными молекулами называются дипольными силами.
- 8.4: Силы Лондона
- Объяснение этих сил притяжения было впервые дано в 1930 году австрийским физиком Фрицем Лондоном (1900–1954). Согласно его теории, когда две молекулы приближаются друг к другу очень близко, движение электронов в одной из молекул мешает движению электронов в другой, и в конечном итоге возникает сила притяжения.
- 8.5: Органические соединения — углеводороды
- Углеводороды содержат только водород и углерод. Они предоставляют простейшие примеры того, как катенация в сочетании с валентностью углерода 4 приводит к огромному разнообразию молекулярных структур, даже если задействованы только два элемента
- 8,6: Алканы
- Большая часть углеводородов в нефти принадлежат к семейству соединений, называемых алканами, в которых все атомы углерода связаны одинарными связями.
- 8.7: Циклоалканы
- Циклоалканы характеризуются кольцом из атомов углерода.
- 8.8: Свойства алканов
- 8.9: Ароматические углеводороды
- Ароматические углеводороды являются одним из трех классов соединений, содержащихся в нефти. Их меньше, чем алканов и циклоалканов, и они составляют лишь несколько процентов от общего количества, но они довольно важны с коммерческой точки зрения.
- 8.10: Ненасыщенные углеводороды
- 8.11: Водородная связь — вода
- 8.12: Лед и вода
- Самый важный пример водородной связи — это образование водородных связей. в \ (H_2O \).
- 8.13: Органические соединения — некоторые дополнительные классы
- 8.14: Спирты
- 8.15: Эфиры
- 8.16: Альдегиды и кетоны
- 8.17: Карбоновые кислоты
- Соединения
- 8.18: Сложные эфиры
- 8.20: Макромолекулярные вещества
- 8.21: Алмаз и графит
- 8.22: Диоксид кремния
- 8.23: Синтетические макромолекулы — некоторые прикладные органические химические вещества
- 8.24: Аддитивные полимеры
- Аддитивные полимеры обычно получают из мономера, содержащего двойную связь.
- 8.25: Конденсационные полимеры
- При образовании конденсационного полимера образуется \ (H_2O \), \ (HCl \) или другая простая молекула, которая улетучивается в виде газа. Знакомым примером конденсационного полимера является нейлон, который получают в результате реакции двух мономеров.
- 8.26: Сшивание
- Образование ковалентных связей, которые удерживают вместе части нескольких полимерных цепей, называется сшивкой. Обширное сшивание приводит к случайной трехмерной сети взаимосвязанных цепочек.
Свойства органических соединений
Органические соединения — это соединения, химическая формула которых содержит по крайней мере один атом углерода, а также часто содержит атом водорода.Связи, образующиеся между атомами углерода и водорода с образованием углеводорода, очень прочные, и образующееся в результате соединение часто важно для живых существ.
Свойства органических соединений
1. Трудно выделить свойства органических соединений, поскольку единственным требованием является наличие атома углерода. Важно отметить, что есть несколько неорганических соединений, которые все еще содержат углерод, хотя связь очень слабая; это отсутствие единства в определении и классификации органических соединений лежит в основе проблемы, когда дело доходит до описания их свойств.
2. Таким образом, термин «органические соединения» действительно применяется к молекулам, которые содержат «значительное» количество атомов углерода, которое все же не является точным и измеримым числом.
3. Некоторые исследователи считают, что органические соединения должны содержать связи углерод-углерод или углерод-водород, чтобы соответствовать требованиям.
4. Теория витализма применима к свойствам органических соединений, которая утверждает, что существует жизненная сила, присутствующая в органических соединениях, которые необходимы для живых существ, и эта сила отсутствует в неживых (и, следовательно, неорганических ) вещи.
5. Свойства органических соединений настолько разнообразны, что они были разделены на разные классы.
6. Углеводороды, например, содержат алканы и алкены и имеют высокую склонность к горению; по этой причине большинство известных нам источников топлива — это углеводороды.
7. Органические соединения содержат так называемые функциональные группы, структурную единицу, состоящую из групп атомов в молекуле, которые связаны с остальной частью молекулы ковалентной связью; эта связь образуется между функциональной группой и атомом углерода основной части молекулы.
8. Эти функциональные группы присутствуют во всех органических соединениях и помогают создавать химические свойства молекулы.
9. Размер — еще одно свойство органических соединений, которое может сильно варьироваться от одного соединения к другому.
10. Органические соединения, особенно те, которые важны для различных областей биологии, часто содержат длинные цепочки атомов углерода, которые могут вращаться друг вокруг друга; различные атомы могут образовывать связи с этими атомами углерода, создавая вариации в молекуле и ее функциональных группах.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Физические свойства органических соединений — Видео и стенограмма урока
Кипение и точка плавления
Два очень популярных способа идентифицировать органическое соединение или узнать о нем больше — это посмотреть на его температуру плавления и температуру кипения. Эти физические свойства связаны с температурой. Точка плавления относится к температуре, при которой соединение меняет состояние с твердого на жидкое. Точка кипения — это температура, при которой соединение меняет состояние с жидкости на газ.
Как показывает практика, чем выше температура плавления и / или кипения, тем сильнее межмолекулярная сила для данного соединения. Межмолекулярная сила — это притяжение или отталкивание, которое проявляется между атомами. В этом термине префикс inter- означает между. Если сжать слово «молекулярный», получится фраза «между молекулами». Таким образом, зная эти физические свойства, вы можете больше узнать о межмолекулярных силах, существующих в органическом соединении.
Растворимость
Как вы думаете, что произойдет, если мы бросим столовую ложку соли в воду? Со временем соль растворяется в воде, образуя соленый раствор. Этот процесс описывает растворимость. Растворимость — это действие растворения вещества в растворе. Растворимость — это физическое свойство органических соединений, поскольку химический состав или природа соединения не изменяется при растворении в растворе.
Общее правило растворимости — «подобное растворяется в подобном».Это означает, что органические соединения любят смешиваться с подобными соединениями. Например, если соединение полярно или несет заряд, оно растворяется в полярном и заряженном растворе. Когда вы видите слово полярный, подумайте о соединении, которое содержит неравномерное распределение электронов. Заряженные соединения — это просто соединения, которые имеют отрицательный или положительный заряд из-за их накопления или потери электронов. И снова мы смогли взять физическое свойство и использовать эту информацию, чтобы узнать больше об органических соединениях.
Запах
Есть несколько органических соединений, которые имеют характерный запах. Например, известно, что сероводород пахнет тухлыми яйцами. Органическое соединение метилбутират имеет запах сладкого ананаса. Наблюдая за этим физическим свойством запаха, мы можем идентифицировать соединение, а также узнать о нем больше.
Плотность
Плотность вещества — это масса на единицу объема. Мы можем измерить плотность органического соединения, не меняя его химический состав или состав.Вот почему плотность классифицируется как физическое свойство. Каждое органическое соединение имеет уникальную плотность. Например, плотность этанола, разновидности спирта, составляет 0,789 г / мл, а плотность уксуса, уксусной кислоты, составляет 1,05 г / мл. Как мы видим, каждое органическое соединение имеет свою уникальную плотность. Таким образом, это физическое свойство весьма полезно при идентификации органических соединений.
Резюме урока
Физические свойства — это свойства органического соединения, которые не меняют его химический состав. Материя — это все, что занимает пространство. Существует три физических состояния вещества, которые можно связать с физическим свойством соединения: твердое, жидкое и газообразное. Физические свойства наблюдаемы и могут быть измерены. Примеры варьируются от запаха соединения до его цвета. Два очень общих физических свойства органических соединений: , точка кипения, и растворимость. Растворимость — это способность растворять вещество в растворе. Другое физическое свойство — плотность , которая определяется как масса на единицу объема вещества.
Кислотно-основные свойства органических соединений
Что такое органические соединения?
Не существует универсально согласованного простого определения понятия «органическое соединение». Когда-то этот термин означал любое углеродсодержащее соединение, входящее в состав живого вещества или вещества, которое когда-то было живым. До начала 1800-х годов считалось, что органические соединения могут быть синтезированы в живых организмах только под действием «жизненной силы» ( vis vitalis) , которая присутствует только в таких живых организмах.Сейчас существует множество синтетических органических соединений, которые никогда не были частью чего-либо живого. Большинство определений «органического соединения» включают тот факт, что оно содержит углерод и обычно имеет углеродную связь с водородом и кислородом. Также необходимо отметить, что некоторые углеродсодержащие соединения считаются неорганическими, а не органическими соединениями. Это включает монооксид углерода, диоксид углерода, карбонаты, цианиды, цианаты, карбиды и тиоцианаты.
Что такое кислотно-основные свойства?
Кислотные и основные свойства органических соединений во многом аналогичны кислотным и основным свойствам неорганических соединений.Свойства кислот (органических или неорганических кислот) включают:
- Они имеют pH менее 7.
- Они имеют кислый вкус.
- При растворении в воде выделяют ионы водорода.
- Они разъедают человеческие ткани (т. Е. «Сжигают» вашу кожу).
- Они реагируют с основаниями с образованием соли и воды.
Общие свойства оснований (органических или неорганических) включают:
- Они имеют pH более 7.
- Они кажутся «мыльными».
- Имеют горький вкус.
- Они разъедают человеческие ткани (т. Е. «Сжигают» вашу кожу).
- Они реагируют с кислотами с образованием соли и воды.
Органические кислоты
Органические кислоты, как правило, являются слабыми кислотами. То есть они не ионизируются почти полностью в слабом водном растворе. Некоторые неорганические кислоты (также известные как минеральные кислоты) являются сильными кислотами. То есть они почти полностью ионизируются в слабом водном растворе.Некоторые распространенные сильные минеральные кислоты — соляная кислота, серная кислота и азотная кислота. Перечисленные выше кислотные свойства «сильнее» или более заметны для сильных минеральных кислот, чем для слабых органических кислот. Сильные кислоты (в водном растворе) будут иметь pH намного ниже 7, будут производить много ионов водорода и будут очень разъедающими кожу. С другой стороны, слабые органические кислоты будут иметь pH ближе к 7, чем сильная кислота; при растворении в воде образует некоторое количество ионов водорода, но не так много, как сильная кислота; и не будет так разъедать кожу, как сильная кислота.
Наиболее распространенные органические кислоты содержат карбоксильную группу, обычно обозначаемую как — COOH. Структура карбоксильной группы показана на диаграмме слева. Связь водород-кислород в ОН является самой слабой связью в карбоксильной группе, поэтому ионы водорода высвобождаются из карбоксила
, содержащего органические кислоты, когда они растворяются в воде.
Одной из наиболее простых органических кислот является уксусная кислота (уксус) с формулой: Ch4COOH (или C2h5O2). Расширенная версия формулы, показывающая карбоксильную группу, показана на диаграмме справа.Некоторые другие распространенные органические кислоты:
- пропионовая кислота — Ch4Ch3COOH (или C3H6O2)
- молочная кислота — Ch4CH (OH) COOH (или C3H6O3)
- муравьиная кислота — HCOOH (или Ch3O2)
- щавелевая кислота (COOHCOOH). h3C2O4)
- лимонная кислота — COOHCh3C (OH) COOHCh3COOH (или C6H8O7)
Формулы для каждой из этих органических кислот показаны сначала в формате, который подчеркивает функциональные группы (включая COOH хотя бы один раз в каждой из них) и затем в более компактном, менее наглядном формате, который вы часто будете видеть.
Органические основания
Органические основания обычно не ионизируются почти полностью в слабом водном растворе, поэтому они классифицируются как слабые основания. Это контрастирует с сильными основаниями, такими как гидроксид натрия или гидроксид калия, которые почти полностью ионизируются в слабом водном растворе. Так же, как и слабые и сильные кислоты, слабые органические основания не проявляют таких «сильных» свойств оснований, как сильные основания.
Органические основания проявляют свое основное поведение, притягивая ионы водорода, обычно через один или несколько атомов азота в молекуле.Некоторые распространенные органические основания:
- метиламин — Ch4Nh3 (или CH5N)
- пиридин — C5H5N
- имидазол — C3h5N2
- глицин — C2H5NO2
Резюме
Кислотные и основные свойства органических соединений такие же, как и у органических соединений. свойства неорганических кислот и оснований. Однако существуют как сильные, так и слабые неорганические кислоты и основания, в то время как органические кислоты и основания всегда являются слабыми кислотами и слабыми основаниями. Таким образом, неорганические кислоты и основания не обладают такими «сильными» кислотными и основными свойствами, как сильные минеральные кислоты и неорганические основания.
Ссылки
1. Виртуальный текст органической химии 1999 Интерактивный учебник
2. Йодер, Ч., Лебер, П.А., Томсен, М.В., Мост к органической химии: концепции и номенклатура, (2010), Hoboken, Нью-Джерси, Джон Уайли и сыновья.
3. Хорнби М. и Пич Дж., Основы органической химии (Oxford Chemistry Primers), (1993), Oxford, Oxford University Press.
HSC Chemistry: Свойства органических химических соединений (точка кипения и растворимость)
Это часть курса химии HSC по теме «Реакции органических кислот и оснований».
В этом посте мы исследуем структурные формулы, свойства и функциональную группу, в том числе:
- Спирты первичные, вторичные и третичные
- Альдегиды и кетоны
- Амины и амиды
- Карбоновые кислоты
Свойства органических соединений
В этом видео исследуются структурные формулы, свойства и функциональные группы органических молекул.
Температура кипения
Видео Академии Хана о температурах кипения органических соединений и о том, как структура и связи молекулы связаны с общей температурой кипения органических соединений.
Видео о температурах кипения органических соединений и о том, как структура и связи молекулы связаны с общей температурой кипения органических соединений.
Растворимость
Видео Академии Хана о растворимости органических соединений и о том, как структура и связи молекулы связаны с общей растворимостью органических соединений.
Общие классы органических соединений
24.5 общих классов органических соединений
Цель обучения
- Для понимания общих свойств функциональных групп и различий в их реакционной способности.
Общие свойства и реакционная способность каждого класса органических соединений (Рисунок 24.1 «Основные классы органических соединений») в значительной степени определяется его функциональными группами. В этом разделе мы описываем взаимосвязь между структурой, физическими свойствами и реакционной способностью для основных классов органических соединений.Мы также покажем вам, как применить эти отношения, чтобы понять некоторые общие реакции, которые химики используют для синтеза органических соединений.
Алканы, алкены и алкины
Температура кипения алканов плавно увеличивается с увеличением молекулярной массы. Они похожи на соответствующие алкены и алкины из-за сходства по молекулярной массе между аналогичными структурами (Таблица 24.1 «Точки кипения (в ° C) алканов, алкенов и алкинов с сопоставимой молекулярной массой»).Напротив, точки плавления алканов, алкенов и алкинов с аналогичными молекулярными массами демонстрируют гораздо более широкий разброс, потому что точка плавления сильно зависит от того, как молекулы складываются в твердом состоянии. Следовательно, он чувствителен к относительно небольшим различиям в структуре, таким как расположение двойной связи и то, является ли молекула цис или транс .
Таблица 24.1 Точки кипения (в ° C) алканов, алкенов и алкинов с сопоставимой молекулярной массой
| Длина углеродной цепи | |||
|---|---|---|---|
| Класс | Два атома C | Три атома углерода | Четыре атома C |
| алкан | −88.6 | −42,1 | -0,5 |
| алкен | −103,8 | −47,7 | −6,3 |
| алкин | −84,7 | −23,2 | 8,1 |
Поскольку алканы содержат только связи C – C и C – H, которые являются прочными и не очень полярными (электроотрицательности C и H аналогичны; Рисунок 7.15 «Значения электроотрицательности Полинга»), их нелегко атаковать нуклеофилы или электрофилы. Следовательно, их реакционная способность ограничена, и часто их реакции происходят только в экстремальных условиях. Например, каталитический крекинг можно использовать для превращения алканов с прямой цепью в сильно разветвленные алканы, которые являются лучшим топливом для двигателей внутреннего сгорания. Каталитический крекинг является одним из примеров реакции пиролиза, реакции высокотемпературного разложения, которая может быть использована для образования волокон синтетических полимеров.(от греческого pyros , что означает «огонь» и lysis , что означает «разрыхление»), в котором алканы нагреваются до достаточно высокой температуры, чтобы вызвать разрыв самых слабых связей: одинарных связей C – C. В результате получается смесь радикалов, образованных по существу в результате случайного разрыва различных связей C – C в цепи. Пиролиз n -пентана, например, неспецифичен и может давать следующие четыре радикала:
Уравнение 24.7
2Ch4Ch3Ch3Ch3Ch4 → ΔCh4⋅ + Ch3Ch3Ch3⋅ + Ch4Ch3 + Ch4Ch3Ch3⋅
Рекомбинация этих радикалов (стадия обрыва) может дать этан, пропан, бутан, n -пентан, n -гексан, n -гептан и n -октан. Радикалы, которые образуются в середине цепи в результате разрыва связи C – H, имеют тенденцию к образованию разветвленных углеводородов. При каталитическом крекинге более легкие алканы удаляются из смеси перегонкой.
Радикалы также образуются при сжигании алканов, конечными продуктами которых являются CO 2 и H 2 O.Как обсуждалось в разделе 24.3 «Реакционная способность органических молекул», радикалы стабилизируются наличием нескольких углеродных заместителей, которые могут передавать электронную плотность электронно-дефицитному углероду. Химическое объяснение октанового числа, описанное в главе 2 «Молекулы, ионы и химические формулы», раздел 2.6 «Промышленно важные химические вещества», частично основывается на стабильности радикалов, образующихся из различных углеводородных топлив. Напомним, что n -гептан, который не горит плавно, имеет октановое число 0, а 2,2,4-триметилпентан («изооктан»), который горит довольно плавно, имеет рейтинг 100 (Рисунок 2.25 «Октановые числа некоторых углеводородов и обычных присадок»). Изооктан имеет разветвленную структуру и способен образовывать сравнительно стабильные третичные радикалы.
Напротив, радикалы, образующиеся при сгорании n -гептана, будь то первичный или вторичный, менее стабильны и, следовательно, более реактивны, что частично объясняет, почему горение n -гептана вызывает преждевременное воспламенение и детонацию двигателя.
В разделе 24.2 «Изомеры органических соединений», мы объяснили, что вращение вокруг кратных углерод-углеродных связей алкенов и алкинов не может происходить без разрыва π-связи, которая, следовательно, представляет собой большой энергетический барьер для вращения (Рис. 24.15 «Углерод-углеродная связь в алкенах. и взаимное преобразование «). Следовательно, изомеры цис и транс алкенов обычно ведут себя как отдельные соединения с различными химическими и физическими свойствами. Четырехуглеродный алкен имеет четыре возможных изомерных формы: три структурных изомера, которые различаются связностью, плюс пара геометрических изомеров из одного структурного изомера (2-бутена).Эти два геометрических изомера представляют собой цис -2-бутен и транс -2-бутен. Четыре изомера имеют существенно разные физические свойства.
Рисунок 24.15 Углеродно-углеродная связь в алкенах и взаимное превращение цис и транс изомеров
В бутане существует лишь небольшой энергетический барьер для вращения вокруг σ-связи C2 – C3. При образовании цис, — или транс, -2-бутена из бутана, p -орбитали на C2 и C3 перекрываются, образуя π-связь.Чтобы преобразовать цис -2-бутен в транс -2-бутен или наоборот посредством вращения вокруг двойной связи, π-связь должна быть разорвана. Поскольку это взаимное превращение является энергетически невыгодным, изомеры цис и транс представляют собой разные соединения, которые обычно имеют разные физические и химические свойства.
Алкины, в которых тройная связь расположена на одном конце углеродной цепи, называются концевыми алкинами и содержат атом водорода, присоединенный непосредственно к трехсвязанному углероду: R – C≡C – H.Терминальные алкины необычны тем, что атом водорода может быть удален относительно легко, как H + , образуя ацетилид-ион (R – C≡C — ). Ионы ацетилида являются мощными нуклеофилами, которые являются особенно полезными реагентами для образования более длинных углеродных цепей посредством реакции нуклеофильного замещения. Как и в предыдущих примерах таких реакций, нуклеофил атакует частично положительно заряженный атом в полярной связи, который в следующей реакции является углеродом связи Br – C:
Алкены и алкины чаще всего получают реакциями элиминирования (Рисунок 24.13). Типичным примером является получение 2-метил-1-пропена, производное которого 3-хлор-2-метил-1-пропен используется в качестве фумиганта и инсектицида. Исходное соединение может быть получено либо из 2-гидрокси-2-метилпропана, либо из 2-бром-2-метилпропана:
Реакция слева протекает путем удаления элементов воды (H + плюс OH — ), поэтому это реакция дегидратации. Реакция, которая протекает путем удаления элементов воды (H + и OH-).. Если алкан содержит две правильно расположенные функциональные группы , такие как –OH или –X, обе из них могут быть удалены как H 2 O или HX с образованием тройной углерод-углеродной тройной связи:
Обратите внимание на узор
Алкены и алкины чаще всего получают реакциями элиминирования.
Арены
Большинство аренов, содержащих одно шестичленное кольцо, представляют собой летучие жидкости, такие как бензол и ксилолы, хотя некоторые арены с заместителями в кольце являются твердыми веществами при комнатной температуре.В газовой фазе дипольный момент бензола равен нулю, но присутствие электроотрицательных или электроположительных заместителей может привести к суммарному дипольному моменту, который увеличивает силы межмолекулярного притяжения и повышает температуры плавления и кипения. Например, 1,4-дихлорбензол, соединение, используемое в качестве альтернативы нафталину при производстве нафталиновых шаров, имеет точку плавления 52,7 ° C, что значительно выше температуры плавления бензола (5,5 ° C). (Дополнительную информацию о 1,4-дихлорбензоле см. В главе 11 «Жидкости», раздел 11.5 «Изменения состояния».)
Некоторые ароматические углеводороды, такие как бензол и бенз [a] пирен, являются сильнодействующими токсинами и канцерогенами для печени. В 1775 году британский врач Персиваль Потт описал высокую заболеваемость раком мошонки среди маленьких мальчиков, которых использовали в качестве трубочистов, и объяснил это воздействием сажи. Его выводы были правильными: бенз [a] пирен, компонент дымовой сажи, мяса, приготовленного на углях, и сигаретного дыма, был первым химическим канцерогеном, который был идентифицирован.
Хотя арены обычно рисуются с тремя связями C = C, бензол примерно на 150 кДж / моль более стабилен, чем можно было бы ожидать, если бы он содержал три двойные связи. Эта повышенная стабильность обусловлена делокализацией электронной плотности π по всем атомам кольца. (Для получения дополнительной информации о делокализации см. Главу 9 «Молекулярная геометрия и модели ковалентной связи», раздел 9.3 «Делокализованная связь и молекулярные орбитали».) По сравнению с алкенами арены являются плохими нуклеофилами.Следовательно, они не подвергаются реакциям присоединения, как алкены; вместо этого они подвергаются множеству реакций электрофильного ароматического замещения — реакции, в которой -H арена заменяется (замещается) электрофильной группой в двухстадийном процессе. которые включают замену -H на арене группой -E, такой как -NO 2 , -SO 3 H, галоген или алкильная группа, в двухстадийном процессе. Первый этап включает добавление электрофила (E) к π-системе бензола с образованием карбокатиона.На втором этапе протон теряется из соседнего углерода на кольце:
Карбокатион, образованный на первом этапе, стабилизируется за счет резонанса.
Обратите внимание на узор
Арены претерпевают реакции замещения, а не отщепления из-за повышенной стабильности, возникающей из-за делокализации их π-электронной плотности.
Многие замещенные арены обладают сильной биологической активностью.Некоторые примеры включают обычные лекарства и антибиотики, такие как аспирин и ибупрофен, запрещенные наркотики, такие как амфетамины и пейот, аминокислота фенилаланин и гормоны, такие как адреналин (рис. 24.16 «Биологически активные замещенные арены»).
Рисунок 24.16 Биологически активные замещенные арены
Аспирин (жаропонижающее действие), ибупрофен (жаропонижающее и противовоспалительное действие) и амфетамин (стимулятор) обладают фармакологическими эффектами.Фенилаланин — это аминокислота. Адреналин — это гормон, вызывающий реакцию «бей или беги» на стресс. Хиральные центры отмечены звездочкой.
Спирты и эфиры
Как спирты, так и простые эфиры можно рассматривать как производные воды, в которых по крайней мере один атом водорода замещен органической группой, как показано здесь. Из-за электроотрицательного атома кислорода отдельные диполи связи O – H в спиртах не могут компенсировать друг друга, что приводит к значительному дипольному моменту, который позволяет спиртам образовывать водородные связи.Следовательно, спирты имеют значительно более высокие температуры кипения, чем алканы или алкены сравнимой молекулярной массы, тогда как простые эфиры без полярной связи O – H имеют промежуточные точки кипения из-за наличия небольшого дипольного момента (Таблица 24.2 «Точки кипения алканов, простых эфиров , и спирты сравнимой молекулярной массы »). Однако чем больше алкильная группа в молекуле, тем более «алканоподобный» спирт по своим свойствам. Из-за своей полярной природы спирты и простые эфиры, как правило, являются хорошими растворителями для широкого спектра органических соединений.
Таблица 24.2 Температуры кипения алканов, простых эфиров и спиртов с сопоставимой молекулярной массой
| Имя | Формула | Молекулярная масса (а.е.м.) | Точка кипения (° C) | |
|---|---|---|---|---|
| алкан | пропан | С 3 В 8 | 44 | −42.1 |
| n -пентан | С 5 В 12 | 72 | 36,1 | |
| n -гептан | С 7 В 16 | 100 | 98,4 | |
| эфир | диметиловый эфир | (канал 3 ) 2 O | 46 | −24.8 |
| диэтиловый эфир | (канал 3 канал 2 ) 2 O | 74 | 34,5 | |
| di- n -пропиленовый эфир | (канал 3 канал 2 канал 2 ) 2 O | 102 | 90.1 | |
| спирт | этанол | Канал 3 Канал 2 ОН | 46 | 78,3 |
| n -бутанол | Канал 3 (Канал 2 ) 3 ОН | 74 | 117.7 | |
| n -гексанол | Канал 3 (Канал 2 ) 5 ОН | 102 | 157,6 |
Спирты обычно получают путем добавления воды через двойную связь углерод-углерод или путем реакции нуклеофильного замещения алкилгалогенида с использованием гидроксида, сильного нуклеофила (рис.12). Как вы увидите в разделе 24.6 «Молекулы жизни», спирты можно также получить восстановлением соединений, содержащих карбонильную функциональную группу (C = O; часть (a) на рисунке 24.14 «Состояние окисления углерода в кислороде и кислороде»). Азотсодержащие функциональные группы »). Спирты классифицируются как первичные, вторичные или третичные, в зависимости от того, связана ли группа –ОН с первичным, вторичным или третичным углеродом. Например, соединение 5-метил-3-гексанол представляет собой вторичный спирт.
Простые эфиры, особенно с двумя разными алкильными группами (ROR ‘), могут быть получены реакцией замещения, в которой нуклеофильный алкоксид-ион (RO —) атакует частично положительно заряженный атом углерода полярной связи C – X соединения алкилгалогенид (R′X):
Хотя и спирты, и фенолы имеют функциональную группу –ОН, фенолы на 10 6 –10 8 более кислые, чем спирты.Это в значительной степени связано с тем, что простые спирты имеют -ОН-звено, присоединенное к гибридизированному углероду sp 3 , тогда как фенолы имеют sp 2 гибридизированный атом углерода, связанный с атомом кислорода. Таким образом, отрицательный заряд иона феноксида может взаимодействовать с π-электронами в кольце, тем самым делокализуя и стабилизируя отрицательный заряд через резонанс. (Для получения дополнительной информации о резонансе см. Главу 8 «Ионное и ковалентное связывание», раздел 8.5 «Структуры Льюиса и ковалентное связывание».) Напротив, отрицательный заряд на ионе алкоксида не может быть стабилизирован этими типами взаимодействий.
Спирты претерпевают два основных типа реакций: реакции с разрывом связи O – H и реакции с разрывом связи C – O. Разрыв связи O – H является реакцией, характерной для кислоты, но спирты даже более слабые кислоты, чем вода. Кислотная сила фенолов, однако, примерно в миллион раз выше, чем у этанола, что делает фенол p K сравнимым с ионом NH 4 + (9.89 против 9,25 соответственно):
Уравнение 24.8
C6H5OH + h3O⇌h4O ++ C6H5O−
Обратите внимание на узор
Спирты подвергаются двум основным типам реакций: разрыв связи O – H и разрыв связи C – O.
В спиртах разрыв связи C – O происходит в кислой среде. Сначала протонируется –OH, и следует нуклеофильное замещение:
Однако в отсутствие нуклеофила может происходить отщепление с образованием алкена (Рисунок 24.13).
В эфирах отсутствует звено –ОН, которое играет центральную роль в реакционной способности спиртов, поэтому они сравнительно инертны. Их низкая реакционная способность делает их очень подходящими в качестве растворителей для проведения органических реакций.
Альдегиды и кетоны
Ароматические альдегиды, которые обладают интенсивным и характерным вкусом и ароматом, являются основными компонентами таких хорошо известных ароматизаторов, как ваниль и корица (Рисунок 24.17 «Некоторые знакомые альдегиды и их применение»).Многие кетоны, такие как камфора и жасмин, также обладают интенсивным ароматом. Кетоны содержатся во многих гормонах, ответственных за дифференциацию пола у людей, таких как прогестерон и тестостерон. (Для получения дополнительной информации об альдегидах и кетонах см. Главу 4 «Реакции в водном растворе», раздел 4.1 «Водные растворы».)
Рисунок 24.17 Некоторые известные альдегиды и их применение
В соединениях, содержащих карбонильную группу, нуклеофильная атака может происходить по атому углерода карбонила, тогда как электрофильная атака происходит по кислороду.
Альдегиды и кетоны содержат карбонильную функциональную группу, которая имеет заметный дипольный момент из-за полярной связи C = O. Присутствие карбонильной группы приводит к сильным межмолекулярным взаимодействиям, в результате которых альдегиды и кетоны имеют более высокие температуры кипения, чем алканы или алкены сравнимой молекулярной массы (Таблица 24.3 «Точки кипения алканов, альдегидов и кетонов с сопоставимой молекулярной массой»). По мере увеличения массы молекулы карбонильная группа становится менее важной для общих свойств соединения, и точки кипения приближаются к температурам кипения соответствующих алканов.
Таблица 24.3 Точки кипения алканов, альдегидов и кетонов с сопоставимой молекулярной массой
| Имя | Формула | Молекулярная масса (а.е.м.) | Точка кипения (° C) | |
|---|---|---|---|---|
| алкан | n -бутан | С 4 В 10 | 58 | −0.5 |
| n -пентан | С 5 В 12 | 72 | 36,1 | |
| альдегид | пропиональдегид (пропаналь) | С 3 В 6 О | 58 | 48.0 |
| бутиральдегид (бутаналь) | С 4 В 8 О | 72 | 74,8 | |
| кетон | ацетон (2-пропанон) | С 3 В 6 О | 58 | 56,1 |
| метилэтилкетон (2-бутанон) | С 4 В 8 О | 72 | 79.6 |
Альдегиды и кетоны обычно получают окислением спиртов (часть (а) на Рисунке 24.14 «Состояние окисления углерода в кислород- и азотсодержащих функциональных группах»). В их реакциях частично положительно заряженный атом углерода карбонильной группы является электрофилом, который подвергается нуклеофильной атаке. И наоборот, неподеленные пары электронов на атоме кислорода карбонильной группы допускают электрофильную атаку.Следовательно, альдегиды и кетоны могут подвергаться как нуклеофильной атаке (по атому углерода), так и электрофильной атаке (по атому кислорода).
Обратите внимание на узор
Нуклеофильная атака происходит на частично положительно заряженном атоме углерода карбонильной функциональной группы. Электрофильная атака происходит по неподеленным парам электронов на атоме кислорода.
Альдегиды и кетоны реагируют со многими металлоорганическими соединениями, содержащими стабилизированные карбанионы.Одним из наиболее важных классов таких соединений являются реагенты Гриньяра — металлоорганическое соединение, содержащее стабилизированные карбанионы, общая формула которого — RMgX, где X представляет собой Cl, Br или I., магнийорганические соединения с формулой RMgX (X представляет собой Cl, Br, или I), которые настолько сильно поляризованы, что их можно рассматривать как содержащие R — и MgX + . Эти реагенты названы в честь французского химика Виктора Гриньяра (1871–1935), получившего Нобелевскую премию по химии в 1912 году за их разработку.В реакции Гриньяра карбонильная функциональная группа превращается в спирт, и углеродная цепь карбонильного соединения удлиняется путем добавления группы R из реактива Гриньяра. Одним из примеров является взаимодействие хлорида циклогексилмагния, реактива Гриньяра, с формальдегидом:
Нуклеофильный карбанион циклогексильного кольца атакует электрофильный атом углерода карбонильной группы. Подкисление раствора приводит к протонированию промежуточного продукта с образованием спирта.Альдегиды также могут быть получены путем восстановления группы карбоновой кислоты (–CO 2 H) (часть (a) на Рисунке 24.14 «Состояние окисления углерода в кислородных и азотсодержащих функциональных группах»), и могут быть получены кетоны. путем взаимодействия производного карбоновой кислоты с реактивом Гриньяра. Первая реакция требует мощного восстановителя, такого как гидрид металла.
Пример 7
Объясните, как протекает каждая реакция с образованием указанного продукта.
Дано: химическая реакция
Спросил: как формируются изделия
Стратегия:
A Определите функциональную группу и классифицируйте реакцию.
B Используйте описанные механизмы, чтобы предложить начальные шаги в реакции.
Решение:
A Одним из реагентов является спирт, который подвергается реакции замещения.
B В продукте бромидная группа замещена гидроксильной группой. Следовательно, первой стадией этой реакции должно быть протонирование -ОН группы спирта H + HBr с последующим отщеплением воды с образованием карбокатиона:
Ион бромида является хорошим нуклеофилом, который может реагировать с карбокатионом с образованием алкилбромида:
A Один реагент представляет собой реактив Гриньяра, а другой содержит карбонильную функциональную группу.Карбонильные соединения действуют как электрофилы, подвергаясь нуклеофильной атаке карбонильного углерода.
B Нуклеофилом является фенилкарбанион реактива Гриньяра:
Продукт — бензиловый спирт.
Упражнение
Предскажите продукт каждой реакции.
Ответ:
Карбоновые кислоты
Резкий запах многих карбоновых кислот является причиной запахов, которые мы ассоциируем с такими разнообразными источниками, как швейцарский сыр, прогорклое масло, навоз, козье молоко и кислое молоко.Точки кипения карбоновых кислот обычно несколько выше, чем можно было бы ожидать, исходя из их молекулярных масс, из-за сильных водородных связей между молекулами. Фактически, большинство простых карбоновых кислот образуют димеры в жидкости и даже в паровой фазе. (Для получения дополнительной информации о паровой фазе см. Главу 11 «Жидкости», раздел 11.2 «Межмолекулярные силы».) Четыре легчайшие карбоновые кислоты полностью смешиваются с водой, но по мере удлинения алкильной цепи они становятся более «алканоподобными», ”Поэтому их растворимость в воде уменьшается.
Соединения, содержащие карбоксильную функциональную группу, являются кислотными, потому что карбоновые кислоты могут легко потерять протон: отрицательный заряд в карбоксилат-ионе (RCO 2 — ) стабилизируется делокализацией π-электронов:
В результате карбоновые кислоты примерно в 10 10 раз более кислые, чем соответствующие простые спирты, анионы которых (RO — ) не стабилизируются посредством резонанса.
Карбоновые кислоты обычно получают окислением соответствующих спиртов и альдегидов (часть (а) на рисунке 24.14 «Состояние окисления углерода в кислород- и азотсодержащих функциональных группах»). Их также можно получить реакцией реактива Гриньяра с CO 2 с последующим подкислением:
Уравнение 24.9
CO2 + RMgCl → → h4O + RCO2H + Mg2 ++ Cl− + h3O
Начальная стадия реакции — нуклеофильная атака группой R — реактива Гриньяра на электрофильный углерод CO 2 :
Делокализация π-связи по трем атомам (O – C – O) делает карбоновые кислоты и их производные менее восприимчивыми к нуклеофильной атаке, чем альдегиды и кетоны с их одинарной π-связью.В реакциях карбоновых кислот доминируют два фактора: их полярная группа –CO 2 H и их кислотность. Реакция с сильными основаниями, например, дает карбоксилатные соли, такие как стеарат натрия:
Уравнение 24.10
RCO 2 H + NaOH → RCO 2 — Na + + H 2 O
, где R означает CH 3 (CH 2 ) 16 . Как вы узнали из главы 13 «Решения», раздел 13.6 «Агрегатные частицы в водном растворе», длинноцепочечные карбоксилатные соли используются в качестве мыла.
Обратите внимание на узор
Делокализация π-связи по трем атомам делает карбоновые кислоты и их производные менее восприимчивыми к нуклеофильной атаке по сравнению с альдегидами и кетонами.
Производные карбоновых кислот
Замена –OH в карбоновой кислоте группами, которые имеют различную тенденцию участвовать в резонансе с функциональной группой C = O, дает производные с довольно разными свойствами.Резонансные структуры оказывают значительное влияние на реакционную способность производных карбоновых кислот, но их влияние существенно варьируется, наименее важно для галогенидов и наиболее важно для азота амидов. В этом разделе мы кратко рассмотрим химию двух наиболее известных и важных производных карбоновых кислот: сложных эфиров и амидов.
Сложные эфиры
Сложные эфиры
имеют общую формулу RCO 2 R ‘, где R и R’ могут означать практически любую алкильную или арильную группу.Сложные эфиры часто получают реакцией спирта (R’OH) с карбоновой кислотой (RCO 2 H) в присутствии каталитического количества сильной кислоты. (Для получения дополнительной информации о сложных эфирах и катализаторах см. Главу 3 «Химические реакции», раздел 3.5 «Классификация химических реакций».) Назначение кислоты (электрофила) — протонировать атом кислорода с двойной связью карбоновой кислоты (нуклеофил). ), чтобы получить соединение, которое на более электрофильно на , чем исходная карбоновая кислота.
Нуклеофильный атом кислорода спирта атакует электрофильный атом углерода протонированной карбоновой кислоты с образованием новой связи C – O. Общую реакцию можно записать так:
Рисунок 24.18
Поскольку вода удаляется, это реакция дегидратации. Если нагреть водный раствор сложного эфира и сильной кислоты или основания, обратная реакция будет происходить с образованием исходного спирта R’OH и либо карбоновой кислоты RCO 2 H (в сильнокислых условиях), либо карбоксилатного аниона RCO . 2 — (в базовых условиях).
Как указывалось ранее, сложные эфиры знакомы большинству из нас как ароматизаторы, такие как банан и ананас. Другие сложные эфиры с интенсивным ароматом действуют как сексуальные аттрактанты или феромоны , такие как феромон восточной плодовой мушки. Исследования по использованию синтетических феромонов насекомых в качестве более безопасной альтернативы инсектицидам для борьбы с популяциями насекомых, таких как тараканы, являются быстро развивающейся областью органической химии.
Амиды
В общем составе амида,
, два заместителя у амидного азота могут быть атомами водорода, алкильными группами, арильными группами или любой комбинацией этих разновидностей.Хотя кажется, что амиды являются производными кислоты и амина, на практике они обычно не могут быть получены этим синтетическим путем. В принципе, может произойти нуклеофильная атака неподеленной электронной пары амина на углерод карбоновой кислоты, но поскольку карбоновые кислоты являются слабыми кислотами, а амины — слабыми основаниями, вместо этого обычно происходит кислотно-основная реакция:
Уравнение 24.11
RCO 2 H + R’NH 2 → RCO 2 — + R’NH 3 +
Амиды поэтому обычно получают нуклеофильной реакцией аминов с более электрофильными производными карбоновых кислот, такими как сложные эфиры.
Неподеленная пара электронов на атоме азота амида может участвовать в π-связывании с карбонильной группой, тем самым снижая реакционную способность амида (Рисунок 24.19 «Электронная структура амида») и подавляя свободное вращение вокруг C– Связь N. Следовательно, амиды наименее реакционноспособны из производных карбоновых кислот. Стабильность амидной связи критически важна в биологии, потому что амидные связи образуют основы пептидов и белков. (Для получения дополнительной информации о пептидах и белках см. Главу 12 «Твердые вещества», раздел 12.8 «Полимерные твердые вещества».) Амидная связь также обнаруживается во многих других биологически активных и коммерчески важных молекулах, включая пенициллин; мочевина, которая используется как удобрение; сахарин, заменитель сахара; и валиум, мощный транквилизатор. (Для получения дополнительной информации о структуре пенициллина см. Главу 3 «Химические реакции», раздел 3.2 «Определение эмпирических и молекулярных формул».)
Обратите внимание на узор
Амиды являются наименее реакционно-способными из производных карбоновой кислоты, поскольку амиды участвуют в π-связывании с карбонильной группой.
Рисунок 24.19 Электронная структура амида
(a) Негибридизированная орбиталь 2 p z на азоте, содержащая неподеленную электронную пару электронов, может взаимодействовать с π-орбиталью карбонильной группы с образованием трехцентровой четырехэлектронной связи. Это взаимодействие снижает реакционную способность амида, делая амиды наименее реакционноспособными из производных карбоновой кислоты.(b) Сравнение карт электростатического потенциала ацетальдегида и формамида показывает, что отрицательный заряд (обозначенный синим цветом) более локализован на атоме кислорода ацетальдегида, чем в формамиде. Поэтому формамид менее реакционноспособен.
Амины
Амины представляют собой производные аммиака, в которых один или несколько атомов водорода заменены алкильными или арильными группами. Поэтому они аналогичны спиртам и эфирам. Как и спирты, амины подразделяются на первичные, вторичные или третичные, но в этом случае обозначение относится к количеству алкильных групп, связанных с атомом азота, а не к количеству соседних атомов углерода.В первичных аминах азот связан с двумя атомами водорода и одной алкильной группой; во вторичных аминах азот связан с одним водородом и двумя алкильными группами; а в третичных аминах азот связан с тремя алкильными группами. Имея одну неподеленную пару электронов и связи C – N, которые менее полярны, чем связи C – O, аммиак и простые амины имеют гораздо более низкие температуры кипения, чем вода или спирты с аналогичными молекулярными массами. Первичные амины обычно имеют промежуточные температуры кипения между соответствующими спиртом и алканом.Более того, вторичные и третичные амины имеют более низкие температуры кипения, чем первичные амины сопоставимой молекулярной массы.
Третичные амины образуют катионы, аналогичные иону аммония (NH 4 + ), в котором все четыре атома H замещены алкильными группами. Такие вещества, называемые солями четвертичного аммония. Соль, состоящая из аниона и катиона, в которых все четыре атома H иона аммония (Nh5 +) заменены алкильными группами, могут быть хиральными, если все четыре заместителя различны.(Амины с тремя разными заместителями также являются хиральными, поскольку неподеленная пара электронов представляет четвертый заместитель.)
Алкиламины могут быть получены реакциями нуклеофильного замещения алкилгалогенидов аммиаком или другими аминами:
Уравнение 24.12
RCl + NH 3 → RNH 2 + HCl
Уравнение 24,13
RCl + R’NH 2 → RR’NH + HCl
Уравнение 24.14
RCl + R′R ″ NH → RR′R ″ N + HCl
Первичный амин, образованный в первой реакции (уравнение 24.12), может реагировать с большим количеством алкилгалогенида с образованием вторичного амина (уравнение 24.13), который, в свою очередь, может реагировать с образованием третичного амина (уравнение 24.14). Следовательно, реальная реакционная смесь содержит первичные, вторичные и третичные амины и даже соли четвертичного аммония.
В реакциях аминов преобладают два свойства: их способность действовать как слабые основания и их склонность действовать как нуклеофилы, оба из которых связаны с присутствием неподеленной пары электронов на атоме азота.Амины обычно действуют как основания, принимая протон от кислоты с образованием соли аммония, как в реакции триэтиламина (этильная группа представлена как Et) с водным HCl (показана неподеленная пара электронов на азоте):
Уравнение 24,15
Et 3 N: (l) + HCl (водн.) → Et 3 NH + Cl — (водн.)
, который дает хлорид триэтиламмония. Амины могут реагировать практически с любым электрофилом, включая карбонильный углерод альдегида, кетона или сложного эфира.Ариламины, такие как анилин (C 6 H 5 NH 2 ), являются гораздо более слабыми основаниями, чем алкиламины, потому что неподеленная пара электронов на азоте взаимодействует с π-связями ароматического кольца, делокализуя неподеленную пару через резонанс ( Рисунок 24.20 «Структуры и основность анилина и циклогексиламина»).
Обратите внимание на узор
В реакциях аминов преобладают их способность действовать как слабые основания и их склонность действовать как нуклеофилы.
Рисунок 24.20 Структуры и основность анилина и циклогексиламина
Делокализация неподеленной электронной пары на N по бензольному кольцу снижает основность ариламинов, таких как анилин, по сравнению с основностью алкиламинов, таких как циклогексиламин. Эти карты электростатического потенциала показывают, что электронная плотность на N циклогексиламина более локализована, чем в анилине, что делает циклогексиламин более сильным основанием.
Пример 8
Предскажите продукты, образующиеся в каждой реакции, и покажите начальный участок атаки и, для части (b), конечные продукты.
- C 6 H 5 CH 2 CO 2 H + KOH →
Дано: реактивы
Запрошено: продукты и механизм реакции
Стратегия:
Используйте стратегию, описанную в Примере 7.
Решение:
- Протон функциональной группы карбоновой кислоты является кислым. Таким образом, реакция карбоновой кислоты с сильным основанием представляет собой кислотно-щелочную реакцию, продуктами которой являются соли — в данном случае C 6 H 5 CH 2 CO 2 — K + — и вода.
- Азот циклогексиламина содержит неподеленную пару электронов, что делает его отличным нуклеофилом, тогда как карбонильный углерод этилацетата является хорошим электрофилом.Поэтому мы ожидаем реакции, в которой нуклеофильная атака на карбонильный углерод сложного эфира дает амид и этанол. Начальный очаг атаки и продукты реакции следующие:
Упражнение
Предскажите продукты каждой реакции. Укажите первоначальный сайт атаки.
- уксусная кислота с пропанолом-1
- анилин (C 6 H 5 NH 2 ) с пропилацетатом [CH 3 C (= O) OCH 2 CH 2 CH 3 ]
Ответ:
Начальная атака происходит при протонировании кислорода карбонила.Товаров:
Начальная атака происходит у углерода карбонильной группы. Товаров:
Реакции, подобные тем, которые мы обсуждали в этом разделе и разделе 24.4 «Общие классы органических реакций», используются для синтеза широкого спектра органических соединений. Однако, когда химики планируют синтез органической молекулы, они должны принимать во внимание различные факторы, такие как доступность и стоимость реагентов, необходимость минимизировать образование нежелательных продуктов и правильную последовательность реакций для максимального увеличения выхода молекулы-мишени и сводят к минимуму образование нежелательных продуктов.Поскольку синтез многих органических молекул требует нескольких этапов, при разработке схемы синтеза таких молекул химики часто должны работать в обратном направлении от желаемого продукта в процессе, называемом ретросинтезом . Используя этот процесс, они могут определить стадии реакции, необходимые для синтеза желаемого продукта из доступных реагентов.
Сводка
Между структурой, физическими свойствами и реакционной способностью соединений, содержащих основные функциональные группы, существуют сильные связи.Углеводороды, представляющие собой алканы, подвергаются каталитическому крекингу, который может превращать алканы с прямой цепью в алканы с высокой степенью разветвления. Каталитический крекинг является одним из примеров реакции пиролиза , в которой самая слабая связь разрывается при высокой температуре, образуя смесь радикалов. Кратная связь алкена дает геометрические изомеры ( цис и транс ). Терминальные алкины содержат атом водорода, непосредственно связанный с трехсвязанным углеродом. При удалении водорода образуется ацетилид-ион, мощный нуклеофил, используемый для образования более длинных углеродных цепей.Арены подвергаются замещению, а не устранению из-за повышенной стабильности из-за делокализации их π-электронной плотности. Спирт часто получают добавлением элементов воды через двойную связь или реакцией замещения. Спирты претерпевают два основных типа реакций: реакции с разрывом связи O – H и реакции с разрывом связи C – O. Фенолы являются кислыми из-за π-взаимодействий между атомом кислорода и кольцом. Эфиры сравнительно инертны. Альдегиды и кетоны обычно получают окислением спиртов.Их химия характеризуется нуклеофильной атакой по атому углерода карбонильной функциональной группы и электрофильной атакой по атому кислорода. Реагенты Гриньяра (RMgX, где X представляет собой Cl, Br или I) превращают карбонильную функциональную группу в спирт и удлиняют углеродную цепь. Соединения, которые содержат карбоксильную функциональную группу, являются слабокислотными из-за делокализации π-электронов, которая заставляет их легко терять протон и образовывать карбоксилат-анион. Карбоновые кислоты обычно получают окислением спиртов и альдегидов или взаимодействием реактива Гриньяра с CO 2 .Производные карбоновых кислот включают сложные эфиры, полученные взаимодействием карбоновой кислоты и спирта, и амиды, полученные нуклеофильной реакцией аминов с более электрофильными производными карбоновой кислоты, такими как сложные эфиры. Амиды относительно инертны из-за π-связывающих взаимодействий между неподеленной парой азота и карбонильной группой. Амины также могут быть первичными, вторичными или третичными, в зависимости от количества алкильных групп, связанных с амином. Соли четвертичного аммония имеют четыре заместителя, присоединенные к азоту, и могут быть хиральными.Амины часто получают реакцией нуклеофильного замещения между полярным галогенидом алкила и аммиаком или другими аминами. Они являются нуклеофилами, но их основная сила зависит от их заместителей.
Ключевые вынос
- Физические свойства и реакционная способность соединений, содержащих общие функциональные группы, тесно связаны с их структурой.
Концептуальные проблемы
Почему алканы с разветвленной цепью имеют более низкие температуры плавления, чем алканы с прямой цепью сопоставимой молекулярной массы?
Опишите алканы с точки зрения их орбитальной гибридизации, полярности и реакционной способности.Какова геометрия каждого атома углерода линейного алкана?
Почему алкены образуют изомеры цис и транс , а алканы — нет? Формируют ли алкины цис и транс изомеры? Почему или почему нет?
Какие соединения могут существовать в виде цис- и транс-изомеров ?
- 2,3-диметил-1-бутен
- 3-метил-1-бутен
- 2-метил-2-пентен
- 2-пентен
Какие соединения могут существовать в виде цис- и транс-изомеров ?
- 3-этил-3-гексен
- 1,1-дихлор-1-пропен
- 1-хлор-2-пентен
- 3-октеновые
Какие соединения имеют чистый дипольный момент?
- o -нитротолуол
- p -бромонитробензол
- p -дибромбензол
Почему точка кипения спирта намного выше, чем у алкана сопоставимой молекулярной массы? Почему низкомолекулярные спирты являются достаточно хорошими растворителями для некоторых ионных соединений, а алканы — нет?
Алкоголь — это нуклеофил или электрофил? От чего зависит реакционная способность алкоголя? Чем реакционная способность спирта отличается от реакционной способности ионного соединения, содержащего ОН, такого как КОН?
Какова реакционная способность эфиров по сравнению со спиртами? Почему? Эфиры могут расщепляться в сильнокислой среде.Объясните, как это может происходить.
Какая функциональная группа является общей для альдегидов, кетонов, карбоновых кислот и сложных эфиров? Эта функциональная группа может реагировать как с нуклеофилами, так и с электрофилами. Где происходит нуклеофильная атака на эту функциональную группу? Где происходит электрофильная атака?
Какая ключевая особенность реактива Гриньяра позволяет ему проводить нуклеофильную атаку на карбонильный углерод?
Ожидаете ли вы, что карбоновые кислоты будут более или менее растворимы в воде, чем кетоны сопоставимой молекулярной массы? Почему?
Поскольку амиды формально являются производными кислоты и амина, почему их нельзя получить реакцией кислоты с амином? Как они вообще готовятся?
Подвержен ли амид нуклеофильной атаке, электрофильной атаке или обоим? Укажите, где происходит атака.
Какие факторы определяют реакционную способность аминов?
ответов
Наличие нуклеофильного C δ- в результате высокополярного взаимодействия с электроположительным Mg
Их способность действовать как слабые основания и их склонность действовать как нуклеофилы
Структура и реакционная способность
Что является продуктом реакции 2-бутина с избытком HBr?
Какой продукт реакции 3-гексина с избытком HCl?
Какие элементы удаляются при дегидрогалогенировании алкилгалогенида? Какие продукты вы ожидаете от дегидрогалогенирования 2-хлор-1-пентена?
Какие элементы удаляются при обезвоживании спирта? Какие продукты вы ожидаете от обезвоживания этанола?
Предскажите продукты каждой реакции.
- феноксид натрия с этилхлоридом
- 1-хлорпропан с NaOH
Покажите механизм и предскажите органический продукт каждой реакции.
- 2-пропанол + HCl
- циклогексанол + H 2 SO 4
Реагент Гриньяра можно использовать для получения карбоновой кислоты.Покажите механизм первой стадии этой реакции, используя CH 3 CH 2 MgBr в качестве реактива Гриньяра. Какова геометрия углерода -CH 2 промежуточных частиц, образованных на этом первом этапе?
Изобразите молекулярную орбитальную картину, показывающую связь в амиде. Какая орбиталь используется для неподеленной пары электронов азота?
Что является продуктом реакции
- кислота уксусная с аммиаком?
- метилацетата с этиламином с последующим нагреванием?
Разработайте синтетическую схему для генерации
- 1,1-дихлорэтан из 1,1-дибромэтана.
- 2-бром-1-гептен из 1-бромпентана.
ответов
- C 6 H 5 OC 2 H 5 + NaCl
- 1-пропанол + NaCl
- CH 3 CO 2 — NH 4 + (кислотно-основная реакция)
- CH 3 CONHC 2 H 5 + CH 3 OH
.
