Содержание
Составление уравнений реакций окисления-восстановления
Для протекания окислительно-восстановительных реакций (ОВР) необходимо одновременное присутствие веществ, взаимно противоположных по своей способности отдавать или присоединять электроны. Кроме этого, протекание некоторых реакций окисления-восстановления возможно лишь при определенных условиях (реакция среды, температура, катализатор, концентрация веществ и др).
Чтобы определить вероятность протекания ОВР обычно пользуются значениями ионизационных потенциалов, сродства к электрону и электроотрицательностей. При количественном определении направления окислительно-восстановительных реакций удобно пользоваться стандартными значениями энергии Гиббса образования исходных или конечных веществ, а также изменением энергии Гиббса или Гельмгольца реакции.
Мерой интенсивности реакций окисления-восстановления являются стандартные окислительно-восстановительные потенциалы.
Алгоритм cоставления уравнений реакций окисления-восстановления
При составлении уравнений реакций окисления-восстановления необходимо придерживаться определенной последовательности:
- Найти среди исходных веществ окислитель и восстановитель
- Записать продукты реакции
- Подобрать коэффициенты
1.
 Найти среди исходных веществ окислитель и восстановитель
Найти среди исходных веществ окислитель и восстановитель
Для этого прежде всего необходимо расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Например:
KBr + KMnO4 + H2SO4 =
Расставим степени окисления:
K+Br— + K+Mn+7O4-2
В кислой среде Br— окисляется до Br2, т.е. отдает 2 электрона и является восстановителем, а Mn+7 восстанавливается до Mn+2 и является окислителем.
2. Записать продукты реакции
Правильно определить продукты реакции помогут ваши знания о строении атомов элементов, их свойствах и свойствах их соединений.
Важно помнить, что в реакциях межатомного и межмолекулярного окисления-восстановления, свободный кислород, как правило, не выделяется.
Выделение кислорода
Выделение кислорода происходит при взаимодействии пероксидов с сильными окислителями, а также в некоторых реакциях с участием озона и фтора. Например,
Например,
2KMnO4 + 5Na2O2 + 8H2SO4 = 2MnSO4 + 5O2↑ + 5Na2SO4 + K2SO4 + 8H2O
SiO2 + 2F2 = SiF4 + O2↑
PbS + 4O3 = PbSO4 + 4O2↑
В других случаях атомы кислорода, входящие в состав молекул окислителя (или восстановителя) связываются в молекулы воды при участии ионов водорода H+, например
HNO2 + HI = NO + I2 + H2O
Характер среды
Кислая среда
При написании продуктов реакции необходимо учитывать характер среды. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов – хлориды, бромиды, сульфаты, нитраты.
Для создания кислой среды, как правило используют разбавленную серную кислоту. Соляная и азотная кислоты для подкисления используются реже, т.к. азотная кислота сама является окислителем, а соляная кислота в присутствии сильных окислителей обладает восстановительными свойствами.
Соляная и азотная кислоты для подкисления используются реже, т.к. азотная кислота сама является окислителем, а соляная кислота в присутствии сильных окислителей обладает восстановительными свойствами.
Щелочная среда
Щелочную среду создают, как правило, растворами KOH или NaOH. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Чтобы не ошибиться при написании продуктов реакций, вначале следует написать продукты окисления и восстановления, а потом только другие вещества, степень окисления которых не изменяется в процессе реакции.
Итак, образуемые в результате реакции продукты, определяются условиями проведения реакции и природой окислителя и восстановителя. Ниже представлены схемы окислительно-восстановительных реакций соединений марганца и хрома в различных средах, а также азотной и серной кислот.
Схема ОВР соединений марганцаСхема ОВР соединений хрома
Азотная кислота
В результате реакции азотной кислоты с металлами, в зависимости от ее концентрации и активности металла, образуются нитраты, вода и различные продукты восстановления кислоты, указанные в таблице ниже. См. также химические свойства азотной кислоты
См. также химические свойства азотной кислоты
Серная кислота
Разбавленная серная кислота не является окислителем и реагирует с металлами, как обычная кислота. Если металл стоит в электрохимическом ряду напряжения металлов до водорода, то при его взаимодействии с кислотой происходит выделение водорода. Если металл находится после водорода в этом ряду, то взаимодействия не происходит.
Концентрированная серная кислота активными металлами (до Zn) восстанавливается до S и H2S, а менее активными (расположенные после водорода и в непосредственной близости от него в ряду напряжения металлов) до SO2. См. также химические свойства серной кислоты
Благородные металлы — золото Au и платина Pt не окисляются даже концентрированной серной кислотой.
А такие достаточно активные металлы, как Al, Fe, Cr при обычных условиях пассивируются и не взаимодействуют с концентрированной H2SO4, однако при нагревании реакции становятся возможными.
3. Подобрать коэффициенты
Коэффициенты в ОВР подбирают, учитывая число отданных и принятых электронов. Следует помнить, что общее число электронов, отданных восстановителем, должно равняться общему числу электронов, принятых окислителем.
Существует несколько методов подбора коэффициентов, из которых чаще всего используют Метод электронного баланса и ионно-электронный метод (метод полуреакций). В соответствующих разделах, а также в разделе Задачи к разделу Окислительно-восстановительные реакции приведены примеры составления окислительно-восстановительных реакций.
Урок «ОВР» алгоритм составления окислительно -восстановительных реакций
Алгоритм составления окислительно — восстановительных реакций.
1. Составляем уравнение химической реакции
железо взаимодействует с сульфатом меди с образованием сульфата железа(2) и меди
Fe+ CuSO4=FeSO4 +Cu
2. Ставим степени окисления над химическими элементами.
Ставим степени окисления над химическими элементами.
Fe0+ Cu+2 S+6 O4-2=Fe+2 S+6 O4-2 +Cu0
3. Обратите внимание, что есть элементы, у которых меняется степень окисления
Fe0+ Cu+2 S+6 O4-2=Fe+2 S+6 O4-2 +Cu0
4. Если у химических элементов меняется степень окисления, значить это окислительно- восстановительная реакция.
5. Сейчас нужно определить исходя из названия данного типа реакции, какой из элементов является окислителем, а какой восстановителем.
6. Записываем у каких элементов как меняется степень окисления.
Fe0 = Fe+2
Cu+2 = Cu0
7. Восстановитель — химический элемент, у которого степень окисления по оси координат возрастает.
Восстановитель — химический элемент, у которого степень окисления по оси координат возрастает.
Окислитель- химический элемент, у которого степень окисления по оси координат уменьшается
8.Согласно определения видим, что степень окисления возрастает у железа. Значить оно является восстановителем, а у меди степень окисления уменьшается- окислитель.
Fe0 = Fe+2 — восстановитель
Cu+2 = Cu0 — окислитель
9. Восстановитель всегда отдает электроны, а окислитель всегда принимает.
10. Находим разницу между степенью окисления у железа
Fe0 = Fe+2 — восстановитель
разница равна 2
Fe0 — 2 e = Fe+2 — восстановитель
11. Находим разницу между степенью окисления у меди
Cu+2 = Cu0 — окислитель
Разница между степенью окисления у меди равна 2
Cu+2 +2e = Cu0 — окислитель
12. Получили следующую запись
Получили следующую запись
Fe0 — 2 e = Fe+2 — восстановитель
Cu+2 +2e = Cu0 — окислитель
13. Находим наименьшее кратное отданных и принятых электронов
Fe0 — 2 e = Fe+2 — восстановитель
Cu+2 +2e = Cu0 — окислитель
14. Наименьшее кратное для этих двух уравнений 2
15. Fe0 — 2 e = Fe+2 — восстановитель
2 наименьшее
кратное
Cu+2 +2e = Cu0 — окислитель
16. Наименьшее кратное 2 делим на число отданных электронов железом и принятых медью.
Fe0 — 2 e = Fe+2 — восстановитель 2:2=1
2
Cu+2 +2e = Cu0 — окислитель 2:2=1
17. Получив эти числа 1 у железа и 1 у меди из данной записи следует, что мы должны поставить коэффициент 1 у железа в левой и правой части уравнения. Так же следует поставить 1 у меди в обоих частях уравнения.
Получив эти числа 1 у железа и 1 у меди из данной записи следует, что мы должны поставить коэффициент 1 у железа в левой и правой части уравнения. Так же следует поставить 1 у меди в обоих частях уравнения.
1 Fe+ CuSO4=1FeSO4 +Cu
Fe+1 CuSO4=FeSO4 +1Cu
Как мы знаем коэффициент 1 мы не ставим.
18. Посчитайте количество атомов серы в левой и правой части
Fe+ CuSO4=FeSO4 +Cu
Количество атомов серы по одному
19. Посчитайте количество атомов кислорода в левой и правой части
Fe+ CuSO4=FeSO4 +Cu
Количество атомов кислорода по 4.
20. Количество атомов всех элементов одинаково. Мы с вами с помощью электронов отданных и принятых (электронный баланс) уравняли данное химическое уравнение.
Уравнения для самостоятельной работы по данной теме по отработке навыков составления окислительно-восстановительных реакций (ОВР). Определите какой из элементов является окислителем и восстановителем, составьте электронный баланс и расставьте коэффициенты.
а) СuO + NH3 = N2 + Cu + H 2O
б) NH3 + O2 = NО + H 2O
в) Li + N2 = Li 2N
Окислительно-восстановительные реакции
В учебниках, написанных авторским коллективом МГУ имени М. В. Ломоносова [1, 2], развитие представлений об окислительно-восстановительных реакциях включает несколько этапов.
На начальном этапе у обучающихся формируется фундаментальное понятие «степень окисления» как условный заряд на атоме в молекуле или кристалле, вычисленный из предположения, что все ковалентные полярные связи имеют ионный характер [1]. Здесь важно подчеркнуть условность этого понятия, но в то же время его универсальность, так как его можно применить к соединениям всех классов независимо от вида химических связей. Авторы УМК вводят новое понятие
Здесь важно подчеркнуть условность этого понятия, но в то же время его универсальность, так как его можно применить к соединениям всех классов независимо от вида химических связей. Авторы УМК вводят новое понятие
«степень окисления» в сопоставлении с уже известным обучающимся понятием «валентность». Содержание материала и предлагаемые задания позволяют школьникам уже на первом этапе осознанно применять понятия «заряд иона», «степень окисления», «валентность». Так как в большинстве соединений, с которыми обучающиеся встречаются в курсе неорганической химии, абсолютные
значения степени окисления и валентности равны, у многих школьников создаётся представление об их полной идентичности. На формирование умения различать эти понятия, усвоение порядка действия при определении степеней окисления, осознанное применение полученных знаний направлены предлагаемые ниже задания.
- Изобразите структурные формулы следующих молекул: О2, h3O, OF2, h3O2.
 Определите валентности и степени окисления кислорода в этих молекулах [1].
Определите валентности и степени окисления кислорода в этих молекулах [1]. - Основываясь на положении элемента в Периодической системе, обоснуйте расстановку степеней окисления в формулах веществ [2].
В ходе следующего этапа вычленяется важнейший признак ОВР — изменение степени окисления элементов. На основе его раскрывается содержание основных понятий и даются определения. Любая ОВР представлена как совокупность двух взаимосвязанных процессов (полуреакций). Таким образом
формируется представление об окислении как процессе потери электронов, сопровождающемся увеличением степени окисления, и восстановлении как процессе присоединения электронов, сопровождающемся уменьшением степени окисления. Данное суждение визуализировано цветными схемами и фотографиями рассматриваемых процессов [2].
Учитель может дополнить предложенные схемы терминами «восстановленная форма окислителя» и «окисленная форма восстановителя».
Химия в таблицах. 8–11 классы. Справочное пособие
Пособие содержит справочные материалы школьного курса химии в компактной форме таблиц и схем. Для удобства пользователя приведён предметный указатель. Предназначено для школьников 8-11 классов, абитуриентов, а также может быть полезно учителям химии.
Купить
С целью более наглядного представления процессов окисления и восстановления можно использовать так называемые оси степеней окисления, на которых обучающиеся на примере реакции оксида железа(III) с угарным газом отмечают направление изменения степеней окисления и подписывают все формы:
В итоге у школьников формируется устойчивое понятие о том, что восстановитель в ходе реакции окисляется, а окислитель — восстанавливается.
На этом же этапе для расстановки коэффициентов в уравнениях ОВР рассматривается метод электронного баланса, в основе которого лежит правило: число электронов, отданных восстановителем, равно числу электронов, приобретённых окислителем. Целесообразно организовать работу обучающихся с опорой на таблицу, в которой указана последовательность действий [2]. Предложенные авторами разнообразные задания позволяют закрепить навыки расстановки коэффициентов методом электронного баланса как в простых схемах реакций, так и в более сложных, а также развивать умение преобразовывать словесную информацию о химических явлениях в язык символов и знаков, что является одним из требований к планируемым результатам освоения учебного предмета «Химия».
Целесообразно организовать работу обучающихся с опорой на таблицу, в которой указана последовательность действий [2]. Предложенные авторами разнообразные задания позволяют закрепить навыки расстановки коэффициентов методом электронного баланса как в простых схемах реакций, так и в более сложных, а также развивать умение преобразовывать словесную информацию о химических явлениях в язык символов и знаков, что является одним из требований к планируемым результатам освоения учебного предмета «Химия».
Следующий этап — совершенствование умений составления уравнений окислительно-восстановительных реакций, определения степеней окисления, решения проблемных задач. На примере взаимодействия металлов с растворами солей углубляется понятие о том, что при протекании ОВР происходит перенос электронов от восстановителя к окислителю, поэтому их можно использовать для создания электрического тока. А как это сделать? Обучающиеся приходят к выводу, что надо разделить в пространстве процессы окисления и восстановления. Ставится эксперимент по получению гальванического элемента, осуществляется межпредметная связь с физикой.
Ставится эксперимент по получению гальванического элемента, осуществляется межпредметная связь с физикой.
Основное внимание следует обратить на изучение электрохимического ряда напряжений, характеризующего восстановительную способность металлов в водных растворах. Зная положение металла в электрохимическом ряду напряжений, обучающиеся могут предсказать протекание той или иной реакции с его участием. Глубокому пониманию сущности окислительно-восстановительных реакций и развитию химического мышления способствуют следующие задания.
- Некоторый металл вступает в реакцию с раствором нитрата серебра, но не реагирует с разбавленной серной кислотой. Какой это металл? [2].
- Определите металлы, которые: а) вытесняют и медь, и железо из водных растворов их солей; б) вытесняют медь, но не вытесняют железо из водных растворов их солей; в) не вытесняют ни медь, ни железо.
Химия. 9 класс. Рабочая тетрадь (С тестовыми заданиями ЕГЭ)
Предлагаемая тетрадь — часть учебного комплекса к учебнику О. С. Габриеляна «Химия. 9 класс». Учебник соответствует Федеральному государственному образовательному стандарту основного общего образования. Также тетрадь может использоваться с учебником, соответствующим Федеральному компоненту государственного образовательного стандарта. Помимо тетради в состав УМК входят электронное приложение к учебнику, методическое пособие и рабочая программа. Бесплатный доступ к электронному приложению и рабочей программе можно получить на сайте www.drofa.ru. Специальными знаками отмечены задания, направленные на формирование метапредметных умений (планировать деятельность, выделять различные признаки, сравнивать, классифицировать, устанавливать причинно-следственные связи, преобразовывать информацию и др.) и личностных качеств учеников.
С. Габриеляна «Химия. 9 класс». Учебник соответствует Федеральному государственному образовательному стандарту основного общего образования. Также тетрадь может использоваться с учебником, соответствующим Федеральному компоненту государственного образовательного стандарта. Помимо тетради в состав УМК входят электронное приложение к учебнику, методическое пособие и рабочая программа. Бесплатный доступ к электронному приложению и рабочей программе можно получить на сайте www.drofa.ru. Специальными знаками отмечены задания, направленные на формирование метапредметных умений (планировать деятельность, выделять различные признаки, сравнивать, классифицировать, устанавливать причинно-следственные связи, преобразовывать информацию и др.) и личностных качеств учеников.
Купить
Переходя к рассмотрению процесса электролиза, обучающиеся продолжают знакомиться с практической значимостью окислительно-восстановительных реакций, совершенствовать навыки составления уравнений реакций.
- Для диагностики желудочно-кишечных кровотечений лаборатории необходим хром, который получают электролизом расплава хлорида хрома(III).
 Дополните рисунок, указав названия электродов, названия процессов, протекающих на них, а также формулы частиц, движущихся к электродам [3].
Дополните рисунок, указав названия электродов, названия процессов, протекающих на них, а также формулы частиц, движущихся к электродам [3].
Развитие представлений об ОВР продолжается при изучении химии элементов. Рассматривается зависимость окислительно-восстановительных свойств элементов от строения атома: металлы обладают только восстановительными свойствами, неметаллы в отличие от металлов могут быть окислителями и восстановителями. Обучающиеся приходят к выводу о способности элементов в низшей степени окисления повышать её, отдавая электроны и проявляя при этом свойства восстановителей, а в высшей — понижать её, принимая электроны и проявляя свойства окислителей.
Применить знания для объяснения свойств как простых веществ, так и соединений элементов обучающиеся могут при выполнении предложенных заданий.
- Если через иодную настойку пропустить ток сероводорода, бурая окраска исчезает, а раствор становится мутным. Объясните это явление [2].

- Напишите уравнения реакций, иллюстрирующие схему:
N0—>N+2—>N+4—>N+5—>N+5—>N+3 [3].
При изучении химических свойств неорганических веществ полезно использовать оси степеней окисления, представленные в приложениях «Характерные степени окисления некоторых элементов» и «Важнейшие окислители и восстановители» [2].
Рассматривая свойства концентрированной серной кислоты и азотной кислоты любой концентрации, школьники осваивают способы деятельности по определению продуктов ОВР, составлению уравнений и подбору коэффициентов.
Таким образом, в процессе изучения курса химии основной школы средствами данного УМК формируется достаточно полное представление об окислительно-восстановительных процессах и их важнейшей роли как в живой природе, так и на производстве и в технике. Обучающиеся усваивают важнейшие понятия, приобретают умения составлять уравнения ОВР и объяснять причины их протекания.
Обучающиеся усваивают важнейшие понятия, приобретают умения составлять уравнения ОВР и объяснять причины их протекания.
Химия в формулах.8-11кл. Справ.пособие
Справочное пособие в краткой форме знакомит с основными понятиями и законами химии, с формулами и химическими уравнениями, охватывающими все разделы школьного курса химии. Книга предназначена для школьников 8-11 классов, абитуриентов, а также может быть полезна учителям химии.
Купить
В. И. Махонина
СОШ № 66, Пенза
О. Ю. Симонова
Гимназия № 42, Пенза
Составление уравнений окислительно-восстановительных реакции — Справочник химика 21
Для составления уравнений окислительно-восстановительных реакций используют два метода метод электронного баланса и метод полуреакций (электронно-ионный метод). [c.86]
[c.86]
Метод электронного баланса достаточно прост, и составление уравнений окислительно-восстановительных реакций не вызывает затруднений, когда в качестве исходных веществ и продуктов реакции выступают вещества, не диссоциирующие на ионы. Однако составление уравнений окислительно-восстановительных реакций значительно осложняется, если в реакции принимают участие соединения с ионной связью. В этом случае одни элементы, входящие в состав ионов, участвуют в окислительно-восстановительных процессах, а другие — в реакциях обмена. Поэтому метод электронного баланса, рассматривающий лишь переход электронов от восстановителя к окислителю, не позволяет непосредственно определить коэффициенты в окислительно-восстановительном уравнении без дополнительного использования приема проб и ошибок. Это достигается при использовании электронно-ионного метода, или метода полуреакций. [c.87]
Составление уравнений окислительно-восстановительных реакций. Метод учета изменений степеней окисления. Метод составления полуреакций. [c.415]
Метод учета изменений степеней окисления. Метод составления полуреакций. [c.415]
Составление уравнений окислительно-восстановительных реакций методом электронного баланса осуществляется в несколько стадий [c.86]
При составлении уравнений окислительно-восстановительных реакций рекомендуется придерживаться следующего порядка [c.167]
Метод полуреакций более универсален по сравнению с методом электронного баланса и имеет несомненные преимущества при составлении уравнений окислительно-восстановительных реакций с участием, в частности, органических соединений, пероксида водорода, некоторых соединений серы и т. д. [c.89]
Составление уравнений окислительно-восстановительных реакций. Применяют два метода составления уравнений реакций окисления — восстановления. Один из методов основан на использовании степеней окисления элементов. Составим уравнение реакции взаимодействия хрома с серой [c. 160]
160]
Составление уравнений окислительно-восстановительных реакций легче провести в несколько стадий 1) установление формул исходных веществ и продуктов реакции 2) определение степени окисления элементов в исходных веществах и продуктах реакции 3) определение числа электронов, отдаваемых восстановителем и принимаемых окислителем и коэффициентов при восстановителях и окислителях 4) определение коэффициентов, при всех исходных веществах и продуктах реакции исходя из баланса атомов в левой и правой частях уравнения. Например, составим уравнение реакции окисления сульфата железа (II) перманганатом калия в кислой среде. [c.181]
Ионно-электронный метод. Ионно-электронный метод составления уравнений окислительно-восстановительных реакций применяется для ионных окислительно-восстановительных процессов и основан на составлении частных уравнений реакций восстановления иона (молекулы) — окислителя и окисления иона (молекулы) — восстановителя с последующим суммированием их в общее уравнение. Для этого необходимо составить ионную схему реакции, руководствуясь общими правилами составления ионных уравнений, т. е. записать сильные электролиты в виде ионов, а неэлектролиты, слабые электро- [c.246]
Для этого необходимо составить ионную схему реакции, руководствуясь общими правилами составления ионных уравнений, т. е. записать сильные электролиты в виде ионов, а неэлектролиты, слабые электро- [c.246]
Для составления уравнения окислительно-восстановительной реакции надо знать химические формулы реагентов и продуктов реакции (они часто определяются на основании опыта). Сначала подбирают стехиометрические коэффициенты для соединений, атомы которых меняют степень окисления. При этом исходят из того, 410 число электронов, отданных восстановителем, должно быть равио числу электронов, полученных окислителем. [c.204]
Составление уравнений окислительно-восстановительных реакций. Окислительно-восстановительные реакции обычно уравнивают одним из двух ниже рассмотренных. методов методом электронного баланса и методом полуреакций. [c.263]
СОСТАВЛЕНИЕ УРАВНЕНИИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИИ [c.86]
Способы составления уравнений окислительно-восстановительных реакций и уравнений равновесных потенциалов окислительно-восстановительных процессов рассмотрены в учебнике. Приведем пример решения задачи по определению потенциала окислительно-восстановительного электрода. [c.393]
Приведем пример решения задачи по определению потенциала окислительно-восстановительного электрода. [c.393]
ОСОБЫЕ СЛУЧАИ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ [c.129]
Методика составления уравнений окислительно-восстановительных реакций, для которых заведомо известны их начальные и конечные продукты, представляет собой лишь первый этап их изучения. [c.146]
Л. Составление уравнений окислительно-восстановительных реакций 267 [c.267]
Составление уравнений окислительно-восстановительных реакций 369 3 второе на 3 [c.269]
Составление уравнений реакций в трех рассмотренных примерах проведено в определенном порядке. Его можно придерживаться и в других случаях при составлении уравнений окислительно-восстановительных реакций. Последовательность действий при этом следующая [c.269]
Реакции с переносом заряда. Реакции с переносом атомов. Составление уравнений окислительно-восстановительных реакций. Направление окислительно-восстановительных реакций. Электродный потенциал. Электролиз. [c.159]
Составление уравнений окислительно-восстановительных реакций. Направление окислительно-восстановительных реакций. Электродный потенциал. Электролиз. [c.159]
Для составления уравнения окислительно-восстановительной реакции, протекающей в водном растворе, удобно использовать метод электронно-ионного баланса. В этом методе сначала составляют по отдельности уравнения реакций окисления и восстановления, а затем их объединяют в уравнение окислительно-восстановительной реакции. В этом методе знание валентных состояний (степеней окисления) атомов элементов, участвующих в реакции, не обязательно. [c.259]
Составление уравнения окислительно-восстановительной реакции в молекулярном виде [c.89]
В большинстве случаев трудно или даже невозможно экспериментально различить, протекает ли реакция с переносом заряда или с переносом атома. Поэтому при составлении уравнений окислительно восстановительных реакций удобно использовать понятие степень окисления . [c.160]
[c.160]
Составление уравнения окислительно-восстановительной реакции рассмотрим на примере окисления сероводорода перманганатом калия в кислой среде. В результате проведения этой реакции малиновый раствор обесцвечивается вследствие перехода марганца нз состояния +7 в состояние +2, кроме того, раствор мутнеет (выпадение серы). Следовательно, схема реакции отвечает записи [c.219]
Для составления уравнений окислительно-восстановительных реакций используют два метода электронный и электронно-ионный. Электронный метод рекомендуется для уравнивания окислительно-восстановительных реакций, протекающих в газовой или твердой фазах. Здесь будет разобран электронно-ионный метод, применяемый для составления уравнений окислительно-восстановительных реакций, протекающих в растворах. [c.130]
Классификация окислительно-восстановительных реакций. Составление уравнений окислительно-восстановительных реакций [c. 94]
94]
Составление уравнений окислительно-восстановительных реакций проводится в такой последовательности [c.108]
При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель или окислитель и число отдаваемых и принимаемых ими электронов. Для этого необходимо знать окислительно-восстановительную характеристику реагирующих веществ, что можно установить, руководствуясь периодическим законом Д. И. Менделеева, зная строение атомов- и молекул,, зная величины потенциалов ионизации, сродство к электрону,» электроотрицательность элементов, окислптельно-восстано-вительные потенциалы и стандартные изменения энергии Гиббса образования веществ. [c.116]
При составлении уравнений окислительно-восстановительных реакций (ОВР) важно уверенно находить окислитель и восстановитель. Для облегчения этой задачи в табл. 2 приведены некоторые типичные окислители и восстановители, часто встречающиеся в химических уравнениях, а также соответствующие процессы восстановления и окисления (запись этих процессов иногда называют электронными уравнениями). [c.92]
[c.92]
Для составления уравнения окислительно-восстановительной реакции надо знать, от каких атомов, молекул или ионов и к каким атомам, молекулам или ионам переходят электроны и в каком количестве. Эти данные часто находят экспериментально. [c.51]
В заключение следует отметить, что рассмотренный метод составления уравнений окислительно-восстановительных реакций, основанный на изменении степени окисления, применим для любых систем. Он может быть использован для окислительно-восстанови-тельных процессов, протекающих как в растворах и расплавах, так и в твердых системах гомогенного и гетерогенного характера, например при сплавлении, обжиге, горении и т. д. Вместе с тем вследствие формального характера самого понятия степень окисления используемые при этом схемы также являются формальными и применительно к растворам не отражают реально протекающих в них процессов. Более правильное представление о процессах окисления — восстановления в растворах дает метод электронно-ионных уравнений, который, как видно из самого названия, рассматривает изменения реально существующих в растворах молекул и ионов. [c.118]
[c.118]
Составление уравнения окислительно-восстановительной реакции рассмотрим на примере окисления сероводорода перманганатом калия в кислой среде. [c.94]
Рассмотренный многоступенчатый метод составления уравнений окислительно-восстановительных реакций приведен для понимания логики решения этой относительно сложной задачи. По мере появления опыта число промежуточных уравнений может быть уменьшено, а в пределе все ступени могут быть выполнены при написании лишь одного уравнения. [c.182]
Этот прием при составлении уравнений окислительно-восстановительных реакций целесообразно распространить и на процессы, в которых происходит изменение степени окисления различных атомов в одной и той же молекуле, например 4 -Хе [c.220]
Составление уравнений окислительно-восстановительных реакций. Уравнения окислительно-восстановительных реакций имеют очень сложный характер, и составление их представляет весьма трудную задачу. Предложено несколько методов составления этих уравнений. Рассмотрим метод электронного баланса, при котором учитывается а) сумма электронов, отдаваемых всеми восстановителями, которая равна сумме электронов, принимаемых всеми окислителями б) число одноименных атомов в левой и правой частях урав- [c.180]
Предложено несколько методов составления этих уравнений. Рассмотрим метод электронного баланса, при котором учитывается а) сумма электронов, отдаваемых всеми восстановителями, которая равна сумме электронов, принимаемых всеми окислителями б) число одноименных атомов в левой и правой частях урав- [c.180]
Для составления уравнения окислительно-восстановительной реакции необходимо прежде всего знать химические формулы исходных и получающихся веществ. Исходные вещества мы знаем, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. В левой и правой частях уравнения реакции должно быть одинаковое число одних и тех же атомов. Следовательно, правильно записанная реакция является выражением закона сохранения массы вещества. Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Для составления уравнений окислительно-восстановительных реакций (см. ч. И) необходимо знать их сущность, стехиометрические законы, строение вещества, периодический закон Д. И. Менделеева, окислительно-восстановительные свойства простых и сложных веществ (восстановители и окислители), правила и методы их составления, стандартные электродные потенциалы, законы химической термодинамики. [c.27]
ч. И) необходимо знать их сущность, стехиометрические законы, строение вещества, периодический закон Д. И. Менделеева, окислительно-восстановительные свойства простых и сложных веществ (восстановители и окислители), правила и методы их составления, стандартные электродные потенциалы, законы химической термодинамики. [c.27]
Перераспределение электронной плотности (перестройка электронных орбиталей и изменение электронного состояния участвующих веществ) приводит к образованию новых веществ с присущим им строением и химическими свойствами. Для составления уравнений окислительно-восстановительных реакций не имеет большого значения, какая связь при этих реакциях образуется — ионная или ковалентная. Поэтому для простоты говорят о присоединении или отдаче электронов независимо от типа связи. Для упрощения записи указывают степень окисления только тех атомов, у которых она меняется. [c.89]
Атомам в соединениях и комплексных ионах приписывают степень окислении, чтобы иметь возможность описывать перенос электронов при химических реакциях.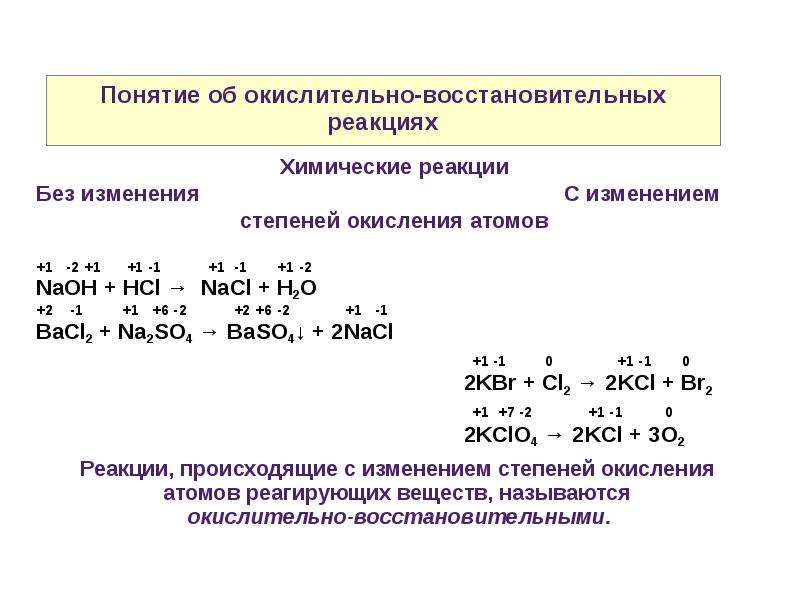 Составление уравнения окислительно-восстановительной реакции основывается на требовании выполнения закона сохранения заряда (электронов). Высшая степень окисления атома, как правило, увеличивается с ростом порядкового номера элемента в пределах периода. Например, в третьем периоде наблюдаются такие степени окисления На + ( + 1), Мя» + ( + 2), А1 -» ( + 3), 81Си( + 4), РР5(5), 8Рв( + 6) и СЮЛ + 7). Степень окисления атома часто называется состоянием окисления атома (или элемента) в соединении. Реакции, в которых происходят изменения состояний окисления атомов, называются окислительно-восстановительными реакциями. В таких реакциях частицы, степень окисления которых возрастает, называются восстановителями, а частицы, степень окисления которых уменьшается, называются окислителями. В окислительно-восстановительной реакции происходит перенос электронов от восстановителя к окислителю. Частицы, подверженные самопроизвольному окислению — восстановлению, называются диспропорционирующими. В полном уравнении окислительно-восстановительной реакции суммарное число электронов, теряемых восстановителем, равно суммарному числу электронов, приобретаемых окислителем.
Составление уравнения окислительно-восстановительной реакции основывается на требовании выполнения закона сохранения заряда (электронов). Высшая степень окисления атома, как правило, увеличивается с ростом порядкового номера элемента в пределах периода. Например, в третьем периоде наблюдаются такие степени окисления На + ( + 1), Мя» + ( + 2), А1 -» ( + 3), 81Си( + 4), РР5(5), 8Рв( + 6) и СЮЛ + 7). Степень окисления атома часто называется состоянием окисления атома (или элемента) в соединении. Реакции, в которых происходят изменения состояний окисления атомов, называются окислительно-восстановительными реакциями. В таких реакциях частицы, степень окисления которых возрастает, называются восстановителями, а частицы, степень окисления которых уменьшается, называются окислителями. В окислительно-восстановительной реакции происходит перенос электронов от восстановителя к окислителю. Частицы, подверженные самопроизвольному окислению — восстановлению, называются диспропорционирующими. В полном уравнении окислительно-восстановительной реакции суммарное число электронов, теряемых восстановителем, равно суммарному числу электронов, приобретаемых окислителем. Грамм-эквивалент окислителя или восстановителя равен отношению его молекулярной массы к изменению степени окисления в рассматриваемой реакции. Нормальность раствора окислителя или восстановителя определяется как число его эквивалентов в 1 л раствора. Следовательно, нормальность раствора окислителя или восстановителя зависит от того, в какой реакции участвует это вещество. [c.456]
Грамм-эквивалент окислителя или восстановителя равен отношению его молекулярной массы к изменению степени окисления в рассматриваемой реакции. Нормальность раствора окислителя или восстановителя определяется как число его эквивалентов в 1 л раствора. Следовательно, нормальность раствора окислителя или восстановителя зависит от того, в какой реакции участвует это вещество. [c.456]
Алгебраическая сумма всех зарядов на атомах (или алгебраическая сумма произведений чисел атомов на их степень окисления), входящих в состав молекулы, равна нулю. Очевидно, что неизвестная степень окисления одного из атомов в молекуле может быть определена с помоц ью подобного равенства, чем широко пользуются в практике составления уравнения окислительно-восстановительных реакций, [c.114]
Для составления уравнения окислительно-восстановительной реакции, протекающей в водном растворе, удобно использоват1> метод электронно-ионного баланса. Этот метод рассмот )ен ниже на примере составления уравнения реакции между пе 1маи-ганатом калия и нитритом калия в водном растворе. [c.325]
[c.325]
Урок химии в 11-м классе по теме «Составление уравнений окислительно-восстановительных реакций различными способами»
Цели урока:
- углубить знания по составлению уравнений ОВР
методом электронного баланса; - изучить ионно-электронный метод составлению
уравнений ОВР, показать его преимущества в
формировании умений прогнозирования
направления протекания ОВР в растворах. - закрепить умения по составлению уравнений ОВР,
протекающих в различных средах;
Задачи урока.
Познакомить учащихся ещё с одним способом
составления уравнений ОВР.
Оборудование и реактивы:
- персональный компьютер, проектор, презентация;
- раствор соляной кислоты и кусочки цинка,
железные гвозди и раствор медного купороса,
пробирки в штативе на каждом столе; - инструкция “Алгоритм составления уравнений
ОВР методом электронного баланса”; - инструкции “Алгоритм составления уравнений
ОВР ионно-электронным методом”; - таблицы: “Окислители и восстановители”.

Тип урока: усвоение новых знаний с
применением имеющихся знаний и умений с
последующим обобщением и систематизацией.
Методы.
- Словесные (беседа, объяснение).
- Наглядные (компьютерная презентация,
инструкции, таблицы). - Практические (демонстрация и выполнение
опытов).
План урока.
- Актуализация знаний.
- Повторение основных теоретических понятий
темы: ОВР, окислители, восстановители, процессы
окисления и восстановления. - Составлению уравнений ОВР методом электронного
баланса, его недостатки. - Ионно-электронный метод составления уравнений
ОВР, его преимущества.
Ход урока
1. Актуализация знаний.
Окислительно-восстановительные реакции
представляют собой единство двух
противоположных процессов — окисления и
восстановления. В этих реакциях число
В этих реакциях число
электронов, отдаваемых восстановителями, равно
числу электронов, присоединяемых окислителями.
При этом независимо от того, переходят ли
электроны с одного атома на другой полностью или
лишь частично, оттягиваются к одному из атомов,
условно говорят только об отдаче или
присоединении электронов.
Окислительно-восстановительные процессы
принадлежат к числу наиболее распространенных
химических реакций и имеют огромное значение в
теории и практике. С ними связаны процессы обмена
веществ, протекающие в живом организме, гниение и
брожение, фотосинтез.
Окислительно-восстановительные процессы
сопровождают круговороты веществ в природе. Их
можно наблюдать при сгорании топлива, в
процессах коррозии металлов, при электролизе и
выплавке металлов. С их помощью получают щёлочи,
кислоты и другие ценные продукты. Они лежат в
основе преобразования энергии
взаимодействующих химических веществ в
электрическую энергию в гальванических и
топливных элементах. Человечество давно
Человечество давно
пользовалось ОВР, вначале не понимая их сущности.
Лишь к началу 20-го века была создана электронная
теория окислительно-восстановительных
процессов.
Повторение основных теоретических
понятий темы: ОВР, окислители, восстановители,
процессы окисления и восстановления. (Слайд 4). Презентация
Какие химические реакции относятся к
окислительно-восстановительным, мы узнали в 8
классе, тогда же научились составлять уравнения
этих реакций методом электронного баланса. В
последствии, в 9 и 10 классе, мы отмечали, что в
любой ОВР один из участников – восстановитель
отдает электроны, окисляется, то есть
повышает свою степень окисления, а другой – окислитель
принимает электроны, восстанавливается, то
есть понижает степень окисления. Поэтому, если
оба её участника находятся в высшей (окислители:
КМn+7О4 + HN+5O3) или
низшей степени окисления (восстановители: H2S-2
+ HCl-1), то реакция невозможна. . Если же
. Если же
один из участников может повысить, а другой
понизить свои степени окисления, реакция в
принципе возможна (HCl-1 + HN+5O3—>).
Поэтому, прежде чем написать уравнение реакции,
протекающей в смеси заданных веществ, нужно
ответить на следующие вопросы:
- Возможна ли в принципе ОВР между данными
веществами? - Если да, то установить продукты реакции.
- Подобрать коэффициенты в уравнении реакции.
Задание №1. Определите, возможна ли в принципе
ОВР между данными веществами? Если да, то определите
восстановитель и окислитель в реакции.
(Слайд 5)
KMnO4 + FeS O4 + h3SO4 —> FeCl3 + HNO3
(конц.) —>
.P + HNO3 + Н2О —> … K2Cr2O7
+ HCl —>
K2Cr2O7 + HNO3 —>
Выполнение лабораторных опытов.
- Взаимодействие раствора соляной кислоты с
цинком; - Взаимодействие железного гвоздя и раствора
медного купороса
Вывод после проведения опытов: к ОВР
обязательно относятся все реакции замещения и
реакции, в которых присутствуют простые
вещества.
2. Составление уравнений ОВР методом
электронного баланса, его недостатки.
Метод электронного баланса основан на
сравнении степеней окисления в исходных и
конечных веществах, когда известны все исходные
вещества и продукты реакции. (Слайд 6) Этот метод
хорошо знают и используют все учащиеся при
расстановке коэффициентов. И данным методом
действительно удобно пользоваться и в
неорганической и органической химии, конечно,
если даны полные схемы реакций.
Алгоритм составления уравнений ОВР
методом электронного баланса. (Приложение
1)
Работа у доски: (Слайд 7)
1. Записать схему реакции:
Записать схему реакции:
2. Определить, атомы, каких элементов изменяют
степень окисления:
3. Составить электронные уравнения процессов
окисления и восстановления:
4. Умножить полученные электронные уравнения на
наименьшие множители для установления баланса
по электронам:
5. Перенести множители из электронных уравнений
в молекулярное уравнение реакции:
6. Проверить выполнение закона сохранения массы
(число атомов каждого элемента в левой и правой
части уравнения должно быть одинаковым) и, если
требуется, ввести новые или изменить полученные
коэффициенты:
Вывод: Данным способом расстановки
коэффициентов удобно пользоваться, если
известны исходные вещества и продукты реакции,
т.е. даны полные схемы реакций.
3. Ионно-электронный метод составления
уравнений ОВР, его преимущества.
Если ОВР протекает в водных растворах и
участники реакции не очевидны, то удобнее
использовать метод электронно-ионного баланса
(другое название – метод полуреакций). А именно
А именно
такие схемы реакций, в которых не известны
некоторые исходные вещества и продукты реакции,
даны в заданиях С1 единого государственного
экзамена. Сегодня мы познакомимся с
особенностями протекания ОВР в водных растворах,
научимся определять продукты реакции, используя
специфический для таких реакций метод
составления их уравнений. (Слайд 8).
Метод полуреакций, или ионно-электронный метод
составления ОВР заключается в том, что для
окислительных и восстановительных процессов в
отдельности записываются уравнения полуреакций.
Затем их уравнивают отдельно, умножают на
коэффициенты, чтобы получить общее уравнение, в
котором соблюдены законы сохранения массы и
заряда, и складывают. Метод на первый взгляд
кажется громоздким, но он имеет жесткий алгоритм
исполнения, что удобно и полезно.
Алгоритм составления уравнения ОВР
методом электронно-ионного баланса
(Слайд 9) (Приложение 2):
- Составить перечень веществ и частиц,
присутствующих в системе до начала реакции.
- Найти среди них окислитель и восстановитель;
определить реакцию среды. - Составить уравнение полуреакции окислителя.
- Составить уравнение полуреакции
восстановителя. - Уравнять число принятых и отданных электронов.
- Составить ионное уравнение.
- Составить молекулярное уравнение.
Составляя этим методом уравнений ОВР,
необходимо учитывать следующие основные
правила:
1) при составлении уравнений полуреакций можно
использовать только те вещества и частицы,
которые присутствуют в данной системе;
2) продуктами полуреакций могут быть только те
вещества и частицы, которые устойчивы в данной
системе;
3) при составлении уравнения полуреакции
окислителя нельзя использовать частицы
восстановителя и, наоборот, при составлении
уравнения полуреакции восстановителя нельзя
использовать частицы окислителя.
Рассмотрим взаимодействие дихромата калия К2Сг207
с соляной кислотой. (Работа у доски)
1. Запишим в левой части уравнения формулы
исходных веществ.
Для создания в растворах кислой среды обычно
пользуются серной кислотой. Соляная и азотная
кислоты применяются редко, так как первая (НСl)
способна окисляться, а вторая (НNО3) сама —
сильный окислитель.
2. Определим окислитель и восстановитель.
Ион Сг2072-, содержащий хром в
его высшей степени окисления, может быть только
окислителем. В кислой среде степень окисления
хрома понижается — он восстанавливается в Сг3+.
Ионы С1— могут только окисляться – он
восстановитель.
3. Составим схемы электронно-ионных уравнений
полуреакций для процессов окисления и
восстановления.
Полуреакция окисления: 2СГ — 2е = С12.
Полурсакция восстановления. Начинать подбор ее
коэффициентов следует с уравнивания числа
атомов элемента, который меняет свою степень
окисления, в данном случае — хрома: Сг2072-—>
2Сг3+.
4. Проверим число атомов кислорода в каждом
уравнении полуреакции слева и справа и уравняйте
их. Уравниваем число атомов кислорода. Они
превращаются в молекулы воды, степень окисления
кислорода в которых та же, что и в Сг2072-.
Для этого необходимо в левую часть добавить ионы
Н+, которые заведомо имеются в растворе
(среда кислая): Сг2072- + 14Н+ =
2Сг3+ + 7Н20.
Одновременно с атомами кислорода при этом
уравнивается и число атомов водорода.
5. Проверим число атомов каждого элемента в
левой и правой частях схем уравнений окисления и
восстановления.
6. Проверим равенство сумм зарядов до и
после реакции, в соответствии с законом
электронейтральности — суммарное число зарядов
продуктов реакции должно быть равно
суммарному числу зарядов исходных веществ.
В нашей записи суммарный заряд всех ионов слева
+12, а справа +6, поэтому для баланса нужно добавить
в левую часть нашего выражения 6 электронов,
каждый из которых несет заряд — 1. В результате
получим уравнение: Сг2072- + 14Н+
+ бе = 2Сг3+ + 7Н20.
7. Подберем коэффициенты для окислителя и
восстановителя согласно закону сохранения
энергии (материи) — общее число электронов,
отданных восстановителем и принятых
окислителем, должно быть равным.
Сг2072— + 14H+ + 6e= 2Cr3+ +
7Н20 1
2С1— — 2е = С12
3
8. Суммируйте правые и левые части
Суммируйте правые и левые части
электронно-ионных уравнений, предварительно
умножив соответствующие части на подобранные
коэффициенты. Сг2072— + 14Н+ +
6СГ = 2Cr3++ 7Н20 + ЗС12,
9. Сократим подобные члены в правой и левой
частях уравнения.
10. Перепишем ионное уравнение.
11. По ионному уравнению составим молекулярное,
для этого необходимо в правой и левой частях
уравнения каждому аниону приписать
соответствующее число катионов, а
каждому катиону приписать соответствующее
число анионов. Скомпонуйте ионы в молекулы.
В данном случае источником ионов Сг2072-
была соль К2Сг207, поэтому с
каждым молем Сг2072- в раствор
попадает 2 моль ионов К+. В реакции они
участия не принимают, поэтому в неизмененном
виде должны перейти в правую часть. Вместе с 14
Вместе с 14
моль ионов Н+ в раствор вносится 14 моль
ионов СГ. Из них 6 участвует в реакции в качестве
восстановителя, а остальные 8, как и ионы К+,
в неизмененном виде остаются после реакции, т. е.
дописываются в правую часть. Проделав это,
получим:
Сг2072- + 14Н+ + 6СГ + 2К+
+ 8С1— = 2Сг3+ + 7Н20 + ЗС12 + 2К+
+ 8С1—
После этого можно объединить ионы в формулы
реальных веществ:
К2Сг207 + 14НС1 = 2СгС13 + ЗС12
+ 2КС1 + 7Н20.
Правила уравнивания атомов
кислорода и водорода при составлении
полуреакций: (Слайд 10)
Преимущества электронно-ионного метода:
1. Рассматриваются реально существующие ионы:
2. Не нужно знать все получающиеся вещества, они
появляются при его выводе.
3. При использовании этого метода нет
необходимости определять степени окисления
атомов отдельных элементов, что особенно важно в
случае ОВР, протекающих с участием органических
соединений, для которых подчас очень сложно
сделать это.
4. Этот метод дает не только сведения о числе
электронов, участвующих в каждой полуреакции, но
и о том, как изменяется среда.
5. Сокращенные ионные уравнения лучше передают
смысл протекающих процессов и позволяют делать
определенные предположения о строении продуктов
реакции.
6. Видна роль среды как активного участника
всего процесса.
Самостоятельная работа (15 мин.): (Слайды 11, 12, 13, 14)
Закрепление. Составьте уравнение одной из 2
предложенных ОВР ионно-электронным методом или
методом электронного баланса.
KMnO4 + FeSO4 + H2SO4—> Fe2(SO4)3
+ …
CrCl3 + Br2 + КОН > К2CrO4 + KBr +
…
(Анализ самостоятельной работы показал, что с
работой справились все учащиеся, отдавая
предпочтение ионно-электронному методу подбора
продуктов реакции и коэффициентов).
Вывод: Если в ОВР не указаны продукты реакции,
то удобнее использовать метод
электронно-ионного баланса, который позволяет
подобрать их, используя четкий алгоритм
исполнения, что удобно и полезно.
Домашнее задание: (Слайд 15, 16)
Задание 2. Используя метод электронного
баланса (или метод электронно-ионного баланса),
составьте уравнения любых 3 реакций.
Определите окислитель и восстановитель.
K2Cr2O7 + HCl —> Cl2 + KCl + … + …
KMnO4 + H2S + H2SO4 —> Mn SO4
+ S + …+ …
KMnO4 + … —> Cl2 + MnCl2 + … + …
H2S + HMnO4 —> S + MnO2 + …
KMnO4 + KBr + H2SO4 —> MnSO4 + Br2
+ … + …
Вывод по итогам занятия: Учащиеся
проявляют повышенный интерес к данной теме, они
осознают важность и необходимость владения
рассмотренным материалом, понимают, что
полученные знания помогут им успешно выполнить
задания ЕГЭ.
Анализ самостоятельной работы показал, что с
работой справились все учащиеся, отдавая
предпочтение ионно-электронному методу подбора
продуктов реакции и коэффициентов.
Используемые информационные источники:
- Л.С. Гузей. Материалы курса “Фундаментальные
понятия общей химии в школьном курсе”. Лекции 1-8.
М.: Педагогический университет “Первое
сентября”, 2006. - Н.Б. Сухоржевская. Применение метода
полуреакций в органической химии..//Приложение к
газете “Первое сентября”, Химия .№ 20, 1996 г. - http://www.chem.msu.su/rus/school/zhukov/18.html
- http://cor.edu.27.ru/dlrstore/0000002e-1000-4ddd-97d5-460046642032/2109440o2.pdf
- http://e-ypok.ru/ege_chemistries_c1
- http://c-vs.edusite.ru/DswMedia/sistemarabotyi.doc
- https://urok.1sept.ru/articles/500378
Приложение 3
Составление уравнений окислительно-восстановительных реакций — HimHelp.
 ru
ru
Метод электронного балланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах. Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления: Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь – восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции: Cu + Pd(NO3)2 = Cu(NO3)2…
Окончательное уравнение реакции: Cu + Pd(NO3)2 = Cu(NO3)2…
Метод полуреакций
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса: Н2S → S + 2H+ Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства: Н2S – 2е– = S + 2H+ Это первая полуреакция – процесс окисления восстановителя Н2S. Обесцвечивание раствора связано с переходом иона MnO4– (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой MnO4– → Mn2+ В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так: MnO4– + 8Н+→ Мn2+ + 4Н2О Чтобы стрелку заменить на знак равенства,…
Поэтому процесс перехода записываем так: MnO4– + 8Н+→ Мn2+ + 4Н2О Чтобы стрелку заменить на знак равенства,…
Презентация «Окислительно-восстановительные реакции» — химия, презентации
1. Вспомнить понятия окислитель и восстановитель
2. Какие реакции называют ОВР
3. Алгоритм составления ОВР
4. Тренировка в составлении ОВР
5. Демонстрационные опыты
6. Подведение итогов урока
7. Домашнее задание
Окислитель – принимает электроны
(в результате он восстанавливается). Как правило это элементы в высших С.О. Mn+7 + 5ē = Mn+2
Восстановитель – отдает электроны
(в результате он окисляется).
Как правило это элементы в низших С.О. Zn0 — 2ē = Zn+2
Окислительновосстановительные реакции
Реакции, в которых 2 и более элементов изменяют свою степень окисления, называются окислительно-восстановительными (ОВР). 4 Al 0 + 3O20 = 2 Al2+3 O3-2
4 Al 0 + 3O20 = 2 Al2+3 O3-2
Что происходит в ходе реакции:
Al0 → Al+3 O20 → 2O-2
1. Составить схему реакции
2. Определить степени окисления для всех атомов до и после реакции
3. Находим элементы, степень окисления которых до и после реакции различны
4. Записываем полуреакции окисления и восстановления
5. Находим общее кратное
6. Записываем суммарное уравнение с учетом общего кратного
7. Полученные коэффициенты в суммарной полуреакции переносим в исходную схему и уравниваем до конца.
8. Указываем окислитель и восстановитель.
9. Показываем стрелочкой переход электронов от восстановителя к окислителю, указываем общее число ē.
1. Составим схему реакций:
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + h3O
2. Определим степени окисления всех атомов до и после реакции:
Определим степени окисления всех атомов до и после реакции:
Cu0 + H+1 N+5 O-23 (конц) → Cu+2 (N+5 O-23)2 + N+4 O-22+ H+12O-2
3. Находим элементы, степень окисления которых до и после реакции различны: Cu0 → Cu+2 ; N+5 → N+4
Алгоритм составления ОВР
4. Записываем полуреакции окисления и восстановления: Cu0 — 2 ē = Cu+2 N+5 + 1 ē = N+4
5. Находим наименьшее общее кратное:
для 1 и 2 НОК = 2, тогда:
1 Cu0 — 2 ē = Cu+2восстановитель, окисление
2 N+5 + 1 ē = N+4окислитель, восстановление
Алгоритм составления ОВР
6. Записываем суммарное уравнение с учетом умножающих коэффициентов:
Cu
0 + 2 N+5 = Cu+2 + 2 N+4
7. Полученные коэффициенты в суммарной полуреакции переносим в исходную схему и уравниваем до конца:
Полученные коэффициенты в суммарной полуреакции переносим в исходную схему и уравниваем до конца:
Cu + 2HNO3(конц) → Cu(NO3)2 + 2NO2 ↑ + H2O
Уравниваем:
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
Алгоритм составления ОВР
8. Указываем окислитель и восстановитель:
Cu + 4HNO3(конц)= Cu(NO3)2 + 2NO2 ↑ + 2H2O
Вос-ль Ок-ль
9. Показываем стрелочкой переход электронов от восстановителя к окислителю, указываем общее число ē:
2ē
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
Вос-ль Ок-ль
Суммарно получаем следующее:
2ē
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
Вос-ль Ок-ль
1 Cu0 — 2 ē = Cu+2восстановитель (окисл-ся)
2 N+5 + 1 ē = N+4окислитель (восст-ся)
Тренировка в составлении ОВР и подведение итогов урока
Составьте и уравняйте следующие реакции самостоятельно:
1. Cu + HNO3(разб) →
Cu + HNO3(разб) →
2. KMnO4 + H2SO4 + Na2SO3 →
3. KMnO4 + H2O + Na2SO3 →
4. KMnO4 + NaOH+ Na2SO3 →
Параграф 22, упражнения 2 – 4.
Оптимизация итераций сборки для приложений Android
Процесс сборки — один из важных процессов жизненного цикла разработки приложения. Время, необходимое системе для сборки … развертывания … запуска … повторения, известно как время итерации . Для разработчиков сокращение времени итерации имеет решающее значение при внесении изменений в приложение. Прежде чем вы сможете протестировать малейшее изменение на устройстве Oculus, система должна упаковать и развернуть это изменение на устройстве. Это может занять много времени, учитывая количество итераций, которые приложение может пройти перед окончательной сборкой.
Чтобы ускорить итерационный процесс, мы разработали инструменты сборки, OVR Build APK и Run и OVR Quick Scene Preview , для приложений Android и объединили их в пакет интеграции Oculus.
Примечание : Эти инструменты ускоряют циклы итераций и создают сборку в режиме разработки. Следовательно, вы не должны использовать файл .apk, созданный этими инструментами, в качестве окончательного файла .apk. Чтобы сгенерировать окончательный доступный для поставки файл .apk, вы должны использовать функции Unity Build или Build and Run.
Предварительные требования
Перед использованием этих инструментов проверьте следующие предварительные условия.
- Используйте Unity 2018.1 и новее.
- Используйте для разработки операционную систему Windows. (Платформа разработки macOS не поддерживает эти функции.)
- Включите устройство Oculus для тестирования и отладки.
- Включите режим разработчика на устройстве Oculus в разделе Настройки > Устройство > сдвиньте переключатель Developer Mode .
OVR Build APK and Run
Инструмент OVR Build APK and Run запускает команду, которая использует кеш Gradle для ускорения процесса сборки.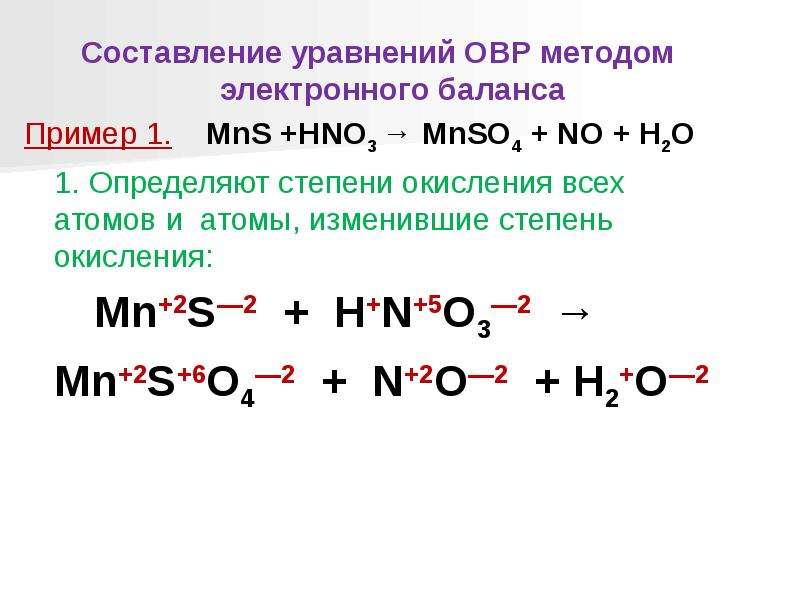 Он начинается с запуска функций сборки и экспорта Unity, а когда начальная сборка скомпилирована, она использует кеш Gradle только для обновления разницы между сборками. Таким образом, он не восстанавливает файлы, которые не являются частью изменения, и, следовательно, сокращает время сборки и развертывания на 10–50% по сравнению со временем сборки Unity. В финале изменений нет.apk, и он идентичен тому, который создается сборкой Unity. Однако для публикации окончательного .apk необходимо использовать функции сборки Unity.
Он начинается с запуска функций сборки и экспорта Unity, а когда начальная сборка скомпилирована, она использует кеш Gradle только для обновления разницы между сборками. Таким образом, он не восстанавливает файлы, которые не являются частью изменения, и, следовательно, сокращает время сборки и развертывания на 10–50% по сравнению со временем сборки Unity. В финале изменений нет.apk, и он идентичен тому, который создается сборкой Unity. Однако для публикации окончательного .apk необходимо использовать функции сборки Unity.
Чтобы использовать OVR Build APK и запустить:
- В меню перейдите к File > Build Settings > выберите сцены, которые вы хотите построить.
- Убедитесь, что Android является целевой платформой сборки. Если нет, выберите Android и щелкните Switch Platform .
В меню выберите Oculus > OVR Build > OVR Build APK и запустите .

OVR Quick Scene Preview
OVR Scene Quick Preview использует систему Unity Asset Bundle для сокращения времени развертывания за счет горячей перезагрузки изменений. При первом построении файла .apk файл содержит код проекта вместе со сценарием загрузчика пакета ресурсов. В зависимости от типа ресурса он разбивает ресурсы на отдельные пакеты ресурсов и развертывает их во внешней папке на устройстве. Например, комплекты ресурсов могут быть моделями, текстурами, звуком или всей сценой. В следующий раз, когда вы вносите изменение в актив, он создает и развертывает только пакеты, содержащие изменения, и, следовательно, сокращает общее время итерации.
Чтобы использовать OVR Quick Scene Preview:
- Чтобы создать и развернуть APK сцены перехода на свое устройство, щелкните Build and Deploy App . Сцена перехода загружает сцены как пакеты ресурсов.
- Чтобы добавить разрабатываемые сцены, нажмите Открыть настройки сборки >. Одиночные сцены работают лучше всего, но если ваш проект загружает сцены аддитивно или вы хотите увидеть переход между двумя сценами, добавьте все сцены. Для нескольких сцен убедитесь, что ваш проект загружает сцены по имени, а не по индексу.Если сцены загружаются по индексу, подумайте о том, чтобы изменить его на имя.
- Чтобы встроить сцены в устройство, щелкните Построить и развернуть сцены . При первой сборке процесс идет медленнее, чем при последующих сборках. При необходимости у вас есть возможность принудительно перезапустить приложение. По умолчанию сцена в переходном APK пытается перезагрузить ваши изменения в горячем режиме.
- Предварительный просмотр сцены на устройстве Oculus.
В следующий раз, когда вы будете вносить изменения в сцену, сохраните все и щелкните Построить и развернуть сцену (и) .
Инструмент также содержит несколько полезных опций в разделе «Утилиты»:
- Удалить пакеты устройств — удаление всех пакетов ресурсов, развернутых на устройстве.
- Удалить локальные пакеты — удалить все пакеты активов, которые были созданы локально.
- Использовать необязательное имя пакета APK — если этот флажок установлен, имя пакета Transition APK изменяется на com.your.project.transition.
- Запустить приложение — запускает приложение на устройстве.
- Открыть настройки сборки — открывает настройки сборки Unity.
- Удалить APK — удаляет переходный APK с устройства.
- Очистить журнал — очищает журнал в инструменте.
OVR Builder: дорожная карта для пространственной паутины
Мы рады сообщить, что сегодня наконец-то вышла бета-версия нашего WebGL Builder! Маленький шаг в нашей дорожной карте для разработчиков, огромный шаг в реализации видения OVR. Все пользователи смогут взаимодействовать с OVR Builder, загружая свои 3D-ресурсы или импортируя их прямо из Sketchfab.В ближайшие недели можно будет опубликовать это содержимое в ваших OVRLands. Не могу дождаться, чтобы увидеть, что будут создавать авторы !!!
Но это только первый шаг … весь потенциал пространственной веб-платформы OVR будет раскрыт в 3 основных этапа. Каждый новый этап открывает новый уровень выразительности и взаимодействия:
1 этап
Current — WebGL Builder позволяет всем членам сообщества создавать и выгружать трехмерное содержимое на своих землях.Этот 3D-редактор доступен из веб-браузера, поэтому устанавливать какое-либо программное обеспечение не требуется. Благодаря интеграции со Sketchfab можно быстро импортировать из библиотеки более 300 тыс. 3D-ресурсов. Конструктор OVR позволяет создавать впечатления как в виртуальной, так и в дополненной реальности, охватывая все основные области применения, такие как электронный магазин, развлечения, образование, телеприсутствие, игры и многие другие…
2 этап
Инструмент редактора Unity3D для управления экспортом сцен и написанием сценариев для создания динамических и интерактивных взаимодействий.Таким образом, все разработчики сообщества Unity3D могут создавать интерфейсы OVR прямо из главного редактора и загружать контент владельцу OVRLands.
Поскольку мобильная платформа не допускает JIT-компиляцию, это ограничение сценариев управляется путем внедрения системы моддинга, в которой создатель контента может использовать заранее определенные вызовы движка OVR для управления опытом. Одно важное и постоянное мероприятие будет сосредоточено на надстройках над этой системой моддинга, где, например, такая функция, как Avatar AI, становится объектом plug-n-play.
3 этап
Узлы OVR, которые управляют постоянным взаимодействием и осуществляют потоковую передачу взаимодействия между пользователями и средой. Децентрализованная инфраструктура узла OVR позволяет управлять как хранением контента, так и взаимодействиями в реальном времени внутри сцены. Постоянный опыт — это будущее Метавселенной, где Создатели OVR могут решить создавать ситуации, в которых изменение окружающей среды является постоянным. Миры AR / VR будут иметь свою жизнь и развитие.Еще одна важная ценность заключается в том, что вся логика взаимодействия управляется узлами, избегая ограничений точно в срок (JIT).
И это всего лишь дорожная карта высокого уровня, в разработке также находятся крутые сквозные функции: создавайте NFT из 3D-активов, визуализируйте свои коллекции NFT в AR, plug-play версии поиска сокровищ, электронный магазин, художественные галереи, и многое другое !!
Изучите и воссоздайте интерактивные возможности 3D AR с помощью OVR SDK на основе WebGL (OVR Builder)
Изучите и воссоздайте интерактивные возможности 3D AR с помощью OVR SDK на основе WebGL (OVR Builder)
Ожидание почти закончилось, так как мы очень близки к выпуску OVR SDK! Вы сможете исследовать захватывающий мир дополненной реальности и создавать интерактивные и приятные впечатления от 3D-дополненной реальности на своей виртуальной собственности.Если у вас уже есть виртуальная земля, то вы один из тех, кому «повезло», и вы сможете создать столько интерактивных 3D OVRE-впечатлений на своей виртуальной земле благодаря SDK на основе WebGL.
С выпуском SDK вы не только сможете создавать эти впечатления, но и пассивно зарабатывать на них. Как художник, вы можете создать копию выставки картинной галереи с вашими работами, полностью выставленными на вашей виртуальной земле. Кроме того, вы можете получать вознаграждение в токенах OVR, когда посетители платят за то, чтобы увидеть ваши работы, отображаемые в вашей галерее, или даже предлагают приобрести одну из них.
Другие возможности, такие как игры с дополненной реальностью, музейные настройки могут быть воспроизведены на вашей виртуальной собственности, просто импортировав их. Изображения и содержимое на основе WebGL также не исключены из возможностей, достижимых с помощью SDK на основе WebGL.
Почему мы выбрали SDK на основе WebGL?
Мы выбираем SDK на основе WebGL из-за его гибкости и простоты, с помощью которой он помогает реализовать OVRExperience на вашей виртуальной собственности. Кроме того, это позволит пользователям сообщества заниматься созданием опыта прямо внутри платформы.
WebGL также совместим с Unity3D, который является одной из лидирующих сред разработки 3D в реальном времени на рынке. И предпочтительнее из-за своей универсальности, распространения и способности управлять кроссплатформенной компиляцией проектов. Таким образом, поддерживаются мобильные устройства и умные очки.
Мы уже в восторге от этого и надеемся создать историю с выпуском SDK в ближайшие дни после того, как все тесты будут удовлетворены. Так что будьте готовы запачкать руки и строить с OVR SDK!
О.Скачать музыку V.R — Beatport
Рекорды Eternal Eclipse: Лучшее за 2017 год
Амир Ашаери,
AMTi,
Анфармы,
Арсен и Эдо,
BassBasket,
Димайзер,
Марко Станго,
ТИБЕРИЙ,
Дуков,
Макси Св,
ЭлектроДан,
IDeUS,
Катукан,
Константин Лев,
Кайесс,
Махеш 64,
Макс Форворд,
Макси Ватт,
Мик Ли,
Визуальный,
Майк Пауэр,
НикитоС,
Ни-Моисей,
О.В.Р.,
Оззи,
Нара,
ПРЗДНТ, г.
Р-Кросс,
Диверсант,
Винт глаз
StreetOwlz,
Тремпид,
Тревор Грей,
Верджил Хилл,
Тюдор Вольф,
Белый-Макс,
Зегакс,
Райан Рая
Рекорды Вечного Затмения
26.12.2017
Условия обслуживания — OVR Technology
Условия обслуживания и Политика конфиденциальности
Перед использованием ovrtechnology внимательно прочтите эти условия обслуживания («условия», «условия обслуживания»).com («услуга»), управляемая OVR Tech LLC («нас», «мы», «наш»).
Условия использования
Мы будем предоставлять вам их услуги в соответствии с условиями указано ниже в этом документе. Каждый раз, когда вы посещаете этот веб-сайт, пользуетесь его услугами или совершаете покупку, вы принимаете следующие условия. Вот почему мы настоятельно рекомендуем вам внимательно их прочитать.
Политика конфиденциальности
Перед тем, как продолжить использование На нашем веб-сайте мы рекомендуем вам ознакомиться с нашей политикой конфиденциальности (ниже) в отношении сбора наших пользовательских данных.Это поможет вам лучше понять нашу практику.
Авторские права
Содержимое, опубликованное на этом веб-сайте (цифровые загрузки, изображения, тексты, графика, логотипы), является собственностью OVR Tech LLC и / или его создателей и защищено международными законами об авторском праве. Вся подборка контента, представленного на этом веб-сайте, является исключительной собственностью OVR Tech LLC, с авторским правом на эту подборку OVR Tech LLC.
Связь
Вся связь с нами осуществляется в электронном виде.Каждый раз, когда вы отправляете нам электронное письмо или посещаете наш веб-сайт, вы будете общаться с нами. Настоящим вы соглашаетесь получать от нас сообщения. Если вы подпишетесь на новости на нашем сайте, вы будете получать от нас регулярные электронные письма. Мы продолжим общаться с вами, публикуя новости и уведомления на нашем веб-сайте, а также отправляя вам электронные письма. Вы также соглашаетесь с тем, что все уведомления, раскрытия информации, соглашения и другие сообщения, которые мы предоставляем вам в электронном виде, соответствуют юридическим требованиям, согласно которым такие сообщения должны быть в письменной форме.
Применимое право
Посещая этот веб-сайт, вы соглашаетесь с тем, что законы штата Вермонт, без учета принципов коллизионного права, будут регулировать эти условия обслуживания или любые споры любого рода, которые могут возникнуть между OVR Tech LLC и вы или его деловые партнеры и партнеры.
Споры
Любой спор, каким-либо образом связанный с вашим посещением этого веб-сайта или с продуктами, которые вы покупаете у нас, разрешается в арбитражном суде штата или федеральном суде Вермонта, и вы соглашаетесь с исключительной юрисдикцией и местом проведения таких судов.
Комментарии, обзоры и электронные письма
Посетители могут публиковать контент, если он не является непристойным, незаконным, дискредитирующим, угрожающим, нарушающим права интеллектуальной собственности, вторгающимся в частную жизнь или каким-либо другим образом причиняющим вред третьим лицам. Контент не должен содержать программных вирусов, политических кампаний и коммерческих предложений.
Мы оставляем за собой все права (но не обязательства) на удаление и / или редактирование такого содержания. Публикуя свой контент, вы предоставляете OVR Tech LLC неисключительное, бесплатное и безотзывное право использовать, воспроизводить, публиковать, изменять такой контент во всем мире на любых носителях.
Лицензия и доступ к сайту
Мы предоставляем вам ограниченную лицензию на доступ и личное использование этого сайта. Вам не разрешено скачивать или изменять его. Это может быть сделано только с нашего письменного согласия.
Учетная запись пользователя
Если вы являетесь владельцем учетной записи на этом веб-сайте, вы несете единоличную ответственность за сохранение конфиденциальности ваших личных данных пользователя (имя пользователя и пароль). Вы несете ответственность за все действия, которые происходят под вашей учетной записью или паролем.
Мы оставляем за собой все права на прекращение действия учетных записей, редактирование или удаление содержимого и отмену заказов по их собственному усмотрению.
Политика конфиденциальности OVR Technology
Эта политика конфиденциальности объясняет, как наша организация использует личные данные, которые мы получаем от вас, когда вы используете наш веб-сайт.
Темы:
- Какие данные мы собираем?
- Как мы собираем ваши данные?
- Как мы будем использовать ваши данные?
- Как мы храним ваши данные?
- Маркетинг
- Каковы ваши права на защиту данных?
- Что такое файлы cookie?
- Как мы используем файлы cookie?
- Какие типы файлов cookie мы используем?
- Как управлять своими файлами cookie
- Политики конфиденциальности других веб-сайтов
- Изменения в нашей политике конфиденциальности
- Как с нами связаться
- Как связаться с соответствующими органами
Какие данные мы собираем?
Мы собираем следующие данные:
- Личная идентификационная информация (имя, адрес электронной почты, номер телефона и т. Д.))
- Местоположение и использование без личных идентификаторов
Как мы собираем ваши данные?
Вы напрямую предоставляете нам большую часть данных, которые мы собираем. Мы собираем и обрабатываем данные, когда вы:
- Регистрируетесь онлайн или размещаете заказ на любой из наших продуктов или услуг.
- Добровольно заполните опрос клиентов или оставьте отзыв на любой из наших досок объявлений или по электронной почте.
- Используйте или просматривайте наш веб-сайт с помощью файлов cookie вашего браузера.
Наша Компания может также получать ваши данные косвенно из следующих источников:
- Google Analytics, которая может собирать и анализировать ваши данные журнала
- Как и многие операторы сайтов, мы собираем информацию, которую ваш браузер отправляет всякий раз, когда вы посещаете наш сайт ( «Данные журнала»). Эти данные журнала могут включать такую информацию, как IP-адрес вашего компьютера, тип браузера, версия браузера, страницы нашего Сайта, которые вы посещаете, время и дата вашего посещения, время, проведенное на этих страницах, и другие статистика.
Как мы будем использовать ваши данные?
Наша компания собирает ваши данные, чтобы мы могли:
- Обработать ваш заказ и управлять вашей учетной записью.
- Отправьте вам электронное письмо со специальными предложениями по другим продуктам и услугам, которые, по нашему мнению, могут вам понравиться.
- [Добавьте, как еще ваша компания использует данные]
Когда Наша Компания обрабатывает ваш заказ, она может отправлять ваши данные в агентства кредитных историй, а также использовать полученную от них информацию для предотвращения мошеннических покупок.
Как мы храним ваши данные?
Наша компания надежно хранит ваши данные по адресу [введите местоположение и опишите принятые меры безопасности].
Наша компания будет хранить ваши [введите тип данных] в течение [введите период времени]. По истечении этого периода мы удалим ваши данные, указав [укажите способ удаления данных пользователей].
Маркетинг
Наша компания хотела бы присылать вам информацию о наших продуктах и услугах, которые, по нашему мнению, могут вам понравиться.
Если вы согласились получать маркетинговую информацию, вы всегда можете отказаться от нее позже. Нажав «Отписаться» в любой переписке или отправив нам электронное письмо по адресу [email protected].
Вы имеете право в любой момент запретить нам связываться с вами в маркетинговых целях.
Каковы ваши права на защиту данных?
Наша компания хотела бы убедиться, что вы полностью осведомлены обо всех своих правах на защиту данных. Каждый пользователь имеет право на следующее:
Право доступа — Вы имеете право запросить у нашей компании копии ваших личных данных.Мы можем взимать небольшую плату за эту услугу.
Право на исправление — Вы имеете право потребовать от нашей компании исправления любой информации, которую вы считаете неточной. Вы также имеете право запросить у нашей компании заполнение информации, которую вы считаете неполной.
Право на удаление — Вы имеете право потребовать, чтобы Наша Компания удалила ваши личные данные при определенных условиях.
Право на ограничение обработки — Вы имеете право потребовать, чтобы Наша Компания ограничила обработку ваших персональных данных при определенных условиях.
Право на возражение против обработки — Вы имеете право возражать против обработки нашей Компанией ваших личных данных при определенных условиях.
Право на переносимость данных — Вы имеете право потребовать от нашей компании передачи собранных нами данных другой организации или непосредственно вам при определенных условиях.
Если вы сделаете запрос, у нас будет один месяц, чтобы ответить вам. Если вы хотите воспользоваться любым из этих прав, свяжитесь с нами по электронной почте:
Позвоните нам по телефону: 802-391-4192
Или напишите нам: info @ ovrtechnology.com
Cookies
Cookies — это текстовые файлы, размещаемые на вашем компьютере для сбора стандартной информации интернет-журнала и информации о поведении посетителей. Когда вы посещаете наши веб-сайты, мы можем автоматически собирать информацию от вас с помощью файлов cookie или аналогичных технологий.
Для получения дополнительной информации посетите allaboutcookies.org.
Как мы используем файлы cookie?
Наша компания использует файлы cookie различными способами, чтобы улучшить ваше взаимодействие с нашим веб-сайтом, в том числе:
- Сохранение вашей подписи в системе
- Понимание того, как вы используете наш веб-сайт
Какие типы файлов cookie мы используем?
Существует несколько различных типов файлов cookie, однако наш веб-сайт использует:
- Функциональность — Наша компания использует эти файлы cookie, чтобы мы могли узнавать вас на нашем веб-сайте и запоминать ваши ранее выбранные предпочтения.Они могут включать, какой язык вы предпочитаете и где находитесь. Используются как собственные, так и сторонние файлы cookie.
- Реклама — Наша компания использует эти файлы cookie для сбора информации о вашем посещении нашего веб-сайта, просмотренном вами контенте, ссылках, по которым вы переходили, и информации о вашем браузере, устройстве и вашем IP-адресе. Наша Компания иногда передает некоторые ограниченные аспекты этих данных третьим лицам в рекламных целях. Мы также можем передавать онлайн-данные, собранные с помощью файлов cookie, нашим рекламным партнерам.Это означает, что когда вы посещаете другой веб-сайт, вам может быть показана реклама на основе ваших шаблонов просмотра на нашем веб-сайте.
Как управлять файлами cookie
Вы можете настроить свой браузер так, чтобы он не принимал файлы cookie, и указанный выше веб-сайт расскажет вам, как удалить файлы cookie из вашего браузера. Однако в некоторых случаях некоторые функции нашего веб-сайта могут не работать.
Политики конфиденциальности других веб-сайтов
Веб-сайт OVR Tech LLC содержит ссылки на другие веб-сайты.Наша политика конфиденциальности применяется только к нашему веб-сайту, поэтому, если вы переходите по ссылке на другой веб-сайт, вам следует ознакомиться с его политикой конфиденциальности.
Изменения в нашей политике конфиденциальности
Наша компания регулярно пересматривает свою политику конфиденциальности и размещает все обновления на этой веб-странице. Эта политика конфиденциальности последний раз обновлялась 24 июля 2019 года.
Как с нами связаться
Если у вас есть какие-либо вопросы о политике конфиденциальности нашей компании, данных, которые мы храним о вас, или вы хотели бы воспользоваться одним из способов защиты своих данных прав, не стесняйтесь обращаться к нам.
Напишите нам по электронной почте: [email protected]
Позвоните нам: 802-391-4192
Или напишите нам по адресу:
OVR Tech LLC
Attn: Website
208 Flynn Ave, Ste 3E
Burlington , VT 05401
| ovrBoundaryLookAndFeel | Внешний вид системы границ |
| ovrBoundaryTestResult | Предоставляет информацию о граничных испытаниях |
| ovrColorf | Цвет RGBA с нормализованными компонентами |
| ovrDetectResult | Возвращаемые значения для |
| ovrErrorInfo | Предоставляет информацию о последней ошибке. |
| ovrEyeRenderDesc | Отображение информации для каждого глаза.Вычислено |
| оврФовПорт | Описывает верхний, нижний, левый и правый углы поля зрения. |
| ovrGraphicsLuid | Определяет графическое устройство в зависимости от платформы.Для Windows это тип LUID. |
| ovrHapticsBuffer | Дескриптор тактильного буфера, содержит образцы амплитуды, используемые для вибрации касания |
| ovrHapticsPlaybackState | Состояние воспроизведения тактильных ощущений при сенсорной вибрации |
| ovrHmdDesc | Это полный дескриптор HMD. |
| ovrInitParams | Параметры для |
| ovrInputState | |
| ovrLayerEyeFov | Описывает слой, определяющий моноскопический или стереоскопический вид. |
| ovrLayerEyeMatrix | Описывает слой, определяющий моноскопический или стереоскопический вид. |
| ovrLayerHeader | Определяет свойства, общие для всех |
| ovrLayerQuad | Описывает слой типа Quad, который представляет собой один квадрат в мире или пространстве просмотра. |
| ovrMatrix4f | Матрица 4×4 с |
| ovrMirrorTextureDesc | Описание, используемое для создания зеркальной текстуры. |
| ovrPerfStats | Это полный дескриптор статистики производительности, предоставляемой SDK . |
| ovrPerfStatsPerCompositorFrame | Содержит статистику производительности для данного кадра композитора SDK |
| ovrPoseStatef | Конфигурация полной позы (твердое тело) с первой и второй производными. |
| оврПосеф | Положение и ориентация вместе. |
| ovrQuatf | Кватернионное вращение. |
| ovrRecti | Двухмерный прямоугольник с положением и размером.Все компоненты целые. |
| ovrSessionStatus | Задает информацию о состоянии текущего сеанса. |
| овр Размер | 2D-размер с целочисленными компонентами. |
| ovrTextureSwapChainDesc | Описание, используемое для создания цепочки обмена текстурой. |
| ovrTimewarpProjectionDesc | Информация о проекции для |
| ovrTouchHapticsDesc | Описывает движок Touch Haptics. |
| ovrTrackerDesc | Задает описание одного датчика. |
| ovrTrackerPose | Задает позу для одного датчика. |
| ovrTrackingState | Состояние отслеживания в заданное абсолютное время (описывает прогнозируемую позу HMD и т. Д.). |
| ovrVector2i | Двумерный вектор с целочисленными компонентами. |
| ovrVector2f | 2D-вектор с |
| ovrVector3f | Трехмерный вектор с |
| ovrViewScaleDesc | Содержит данные, необходимые для правильного расчета информации о положении для различных типов слоев. |
| OVR_BUILD_VERSION | |
| OVR_DEBUG_HUD_STEREO_GUIDE_COLOR | |
| OVR_DEBUG_HUD_STEREO_GUIDE_INFO_ENABLE | |
| OVR_DEBUG_HUD_STEREO_GUIDE_POSITION | |
| OVR_DEBUG_HUD_STEREO_GUIDE_SIZE | |
| OVR_DEBUG_HUD_STEREO_GUIDE_YAWPITCHROLL | |
| OVR_DEBUG_HUD_STEREO_MODE | |
| OVR_DEFAULT_EYE_HEIGHT | |
| OVR_DEFAULT_GENDER | |
| OVR_DEFAULT_NECK_TO_EYE_HORIZONTAL | |
| OVR_DEFAULT_NECK_TO_EYE_VERTICAL | |
| OVR_DEFAULT_PLAYER_HEIGHT | |
| OVR_FORMAT_B4G4R4A4_UNORM | В настоящее время не поддерживается на ПК.Потребуется устройство DirectX 11.1. |
| OVR_FORMAT_B5G5R5A1_UNORM | В настоящее время не поддерживается на ПК. Потребуется устройство DirectX 11.1. |
| OVR_FORMAT_B5G6R5_UNORM | В настоящее время не поддерживается на ПК.Потребуется устройство DirectX 11.1. |
| OVR_FORMAT_B8G8R8A8_UNORM | |
| OVR_FORMAT_B8G8R8A8_UNORM_SRGB | Не поддерживается для приложений OpenGL |
| OVR_FORMAT_B8G8R8X8_UNORM | Не поддерживается для приложений OpenGL |
| OVR_FORMAT_B8G8R8X8_UNORM_SRGB | Не поддерживается для приложений OpenGL |
| OVR_FORMAT_BC1_UNORM | |
| OVR_FORMAT_BC1_UNORM_SRGB | |
| OVR_FORMAT_BC2_UNORM | |
| OVR_FORMAT_BC2_UNORM_SRGB | |
| OVR_FORMAT_BC3_UNORM | |
| OVR_FORMAT_BC3_UNORM_SRGB | |
| OVR_FORMAT_BC7_UNORM | |
| OVR_FORMAT_BC7_UNORM_SRGB | |
| OVR_FORMAT_BC6H_SF16 | |
| OVR_FORMAT_BC6H_UF16 | |
| OVR_FORMAT_D16_UNORM | |
| OVR_FORMAT_D32_FLOAT | |
| OVR_FORMAT_D24_UNORM_S8_UINT | |
| OVR_FORMAT_D32_FLOAT_S8X24_UINT | |
| OVR_FORMAT_R11G11B10_FLOAT | Введено в v1.10 |
| OVR_FORMAT_R16G16B16A16_FLOAT | |
| OVR_FORMAT_R8G8B8A8_UNORM | |
| OVR_FORMAT_R8G8B8A8_UNORM_SRGB | |
| OVR_FORMAT_UNKNOWN | |
| OVR_KEY_EYE_HEIGHT | |
| OVR_KEY_EYE_TO_NOSE_DISTANCE | |
| OVR_KEY_GENDER | |
| OVR_KEY_NAME | |
| OVR_KEY_NECK_TO_EYE_DISTANCE | |
| OVR_KEY_PLAYER_HEIGHT | |
| OVR_KEY_USER | |
| OVR_LAYER_HUD_CURRENT_LAYER | |
| OVR_LAYER_HUD_MODE | |
| OVR_LAYER_HUD_SHOW_ALL_LAYERS | |
| OVR_MAJOR_VERSION | |
| OVR_MINOR_VERSION | |
| OVR_PERF_HUD_MODE | |
| OVR_PRODUCT_VERSION | |
| ovrBoundary_Outer | Внешняя граница — близко представляет стены, установленные пользователем |
| ovrBoundary_PlayArea | Игровая зона — безопасная прямоугольная зона внутри внешней границы, которую можно дополнительно использовать для ограничения взаимодействия и движений пользователя. |
| ovrButton_A | Кнопка A на контроллерах XBox и правом сенсорном контроллере. Нажмите кнопку на Oculus Remote. |
| ovrButton_B | Кнопка B на контроллерах XBox и правом сенсорном контроллере.Кнопка возврата на Oculus Remote. |
| ovrButton_Back | Снова на контроллере Xbox 360. Кнопка просмотра на контроллере XBox One. Отсутствует на сенсорных контроллерах или Oculus Remote. |
| ovrButton_Down | Кнопка «Вниз» на контроллерах XBox и Oculus Remote.Отсутствует на сенсорных контроллерах. |
| ovrButton_Enter | Запуск на контроллере XBox 360. Меню на контроллере XBox One и контроллере Left Touch. В документации для пользователя должна называться кнопка «Меню». |
| ovrButton_Home | Кнопка «Домой» на контроллерах XBox.Кнопка Oculus на сенсорных контроллерах и пульте Oculus Remote. |
| ovrButton_LMask | Битовая маска всех кнопок слева Сенсорный контроллер |
| ovrButton_LShoulder | Кнопка на левом плече на контроллерах XBox.Отсутствует на сенсорных контроллерах или Oculus Remote. |
| ovrButton_LThumb | Левый мини-джойстик на контроллерах XBox и сенсорных контроллерах. Отсутствует на Oculus Remote. |
| ovrButton_Left | Левая кнопка на контроллерах XBox и Oculus Remote.Отсутствует на сенсорных контроллерах. |
| ovrButton_Private | Битовая маска всех кнопок, предназначенных для частного использования Oculus |
| ovrButton_RMask | Битовая маска всех кнопок справа Сенсорный контроллер |
| ovrButton_RSПлечо | Кнопка на правом плече на контроллерах XBox.Отсутствует на сенсорных контроллерах или Oculus Remote. |
| ovrButton_RThumb | Правый мини-джойстик на контроллерах XBox и сенсорных контроллерах. Отсутствует на Oculus Remote. |
| ovrButton_Right | Правая кнопка на контроллерах XBox и Oculus Remote.Отсутствует на сенсорных контроллерах. |
| ovrButton_Up | Кнопка «Вверх» на контроллерах XBox и Oculus Remote. Отсутствует на сенсорных контроллерах. |
| ovrButton_VolDown | Кнопка громкости на Oculus Remote.Отсутствует на контроллерах XBox или Touch. |
| ovrButton_VolUp | Кнопка громкости на Oculus Remote. Отсутствует на контроллерах XBox или Touch. |
| ovrButton_X | Кнопка X на контроллерах XBox и левом контроллере Touch.Отсутствует на Oculus Remote. |
| ovrButton_Y | Кнопка Y на контроллерах XBox и левом контроллере Touch. Отсутствует на Oculus Remote. |
| ovrControllerType_Active | Выполнить или запросить любой активный контроллер. |
| ovrControllerType_LTouch | |
| ovrControllerType_None | |
| ovrControllerType_RTouch | |
| ovrControllerType_Remote | |
| ovrControllerType_Touch | |
| ovrControllerType_XBox | |
| ovrDebugHudStereo_CrosshairAtInfinity | Визуализирует перекрестие в пространстве экрана на бесконечность для отладки стерео |
| ovrDebugHudStereo_Off | Отключает стерео отладочный HUD |
| ovrDebugHudStereo_Quad | Отображает Quad в мире для отладки стерео |
| ovrDebugHudStereo_QuadWithCrosshair | Отображает Quad + прицел в мире для отладки стерео |
| ovrError_ApplicationInvisible | Приложение объявило себя невидимым типом, и ему не разрешено отправлять кадры. |
| ovrError_AudioComError | Общая ошибка COM. |
| ovrError_AudioDeviceNotFound | Неспособность найти указанное аудиоустройство. |
| ovrError_ClientSkippedDestroy | Клиенту не удалось вызвать |
| ovrError_ClientSkippedShutdown | Клиенту не удалось позвонить по номеру |
| ovrError_ClientVersion | Версия клиента слишком старая для подключения к службе |
| ovrError_ContentProtectionNotAvailable | Защита содержимого недоступна для дисплея |
| ovrError_DeviceUnavailable | Указанный тип устройства недоступен. |
| ovrError_DisabledOrDefaultAdapter | Поддерживаемая система отображения VR не найдена, но отключен или найден адаптер без драйвера. |
| ovrError_Disallowed | Данный запрос отклонен в текущих условиях. |
| ovrError_DisplayInit | Невозможно инициализировать дисплей HMD. |
| ovrError_DisplayLost | В случае общесистемного сброса графики или отсоединения кабеля он возвращается в приложение. |
| ovrError_DisplayManagerInit | Ошибка инициализации DisplayManager. |
| ovrError_DisplayPlugged Неправильно | Часть дисплея HMD подключена к несовместимому порту (например, IGP) |
| ovrError_DisplayRemoved | HMD снят с адаптера дисплея |
| ovrError_GraphicsDeviceReset | Графическое устройство было сброшено (TDR и т. Д…) |
| ovrError_HybridGraphicsNotSupported | В системе используется гибридная графика (Optimus и т. Д.), Которая не поддерживается. |
| ovrError_IncompatibleGPU | Графическое оборудование не поддерживается |
| ovrError_IncompatibleOS | Несовместимая версия операционной системы. |
| ovrError_Initialize | Общая ошибка инициализации. |
| ovrError_InvalidHeadsetOrientation | Гарнитура была в неправильной ориентации для запрошенной операции (например, была ориентирована вертикально во время |
| ovrError_InvalidOperation | Вызов функции недопустим для текущего состояния объекта |
| ovrError_InvalidParameter | Указан неверный параметр. См. Информацию об ошибке или журнал для подробностей. |
| ovrError_InvalidSession | Указан неверный параметр |
| ovrError_LeakingResources | Вызывающее приложение имеет утечку ресурсов |
| ovrError_LibLoad | Не удалось загрузить LibOVRRT. |
| ovrError_LibPath | Ошибка пути LibOVRRT. |
| ovrError_LibSignCheck | Ошибка проверки подписи LibOVRRT. |
| ovrError_LibSymbols | Ошибка разрешения символа LibOVRRT. |
| ovrError_LibVersion | Несовместимость версий LibOVRRT. |
| ovrError_MemoryAllocationFailure | Ошибка выделения памяти. |
| ovrError_MisformattedBlock | Результат неправильного калибровочного блока из-за длины |
| ovrError_Mismatched Адаптеры | Выбранные адаптеры рендеринга между клиентом и службой не совпадают |
| ovrError_NoCalibration | Результат отсутствия калибровочного блока |
| ovrError_NoHmd | Данный шлем не существует. |
| ovrError_NoValidVRDisplaySystem | Не найдено действующей системы отображения VR. |
| ovrError_NotInitialized | Система или компонент не инициализированы. |
| ovrError_Obsolete | Функция или API устарели и больше не поддерживаются. |
| ovrError_OldVersion | Результат старого калибровочного блока |
| ovrError_OutOfDateGfxDriver | Драйвер видеокарты устарел. |
| ovrError_OutOfDateOS | Операционная система устарела. |
| ovrError_Reinitialization | Попытка повторно инициализировать другую версию. |
| ovrError_RemoteSession | Не удалось подключиться к службе, поскольку удаленные подключения к службе запрещены. |
| ovrError_RuntimeException | Произошла исключительная ситуация во время выполнения. Приложение должно завершить работу LibOVR и повторно инициализировать ее, прежде чем это состояние ошибки будет очищено. |
| ovrError_ServerStart | Невозможно запустить сервер.Он уже запущен? |
| ovrError_ServiceConnection | Не удалось подключиться к службе OVR. |
| ovrError_ServiceDeadlockDetected | Сторожевой таймер службы обнаружил тупик. |
| ovrError_ServiceError | Общая ошибка службы.См. Информацию об ошибке или журнал для подробностей. |
| ovrError_ServiceVersion | Несовместимость версии службы OVR. |
| ovrError_TextureSwapChainFull | |
| ovrError_TextureSwapChainInvalid | |
| ovrError_Timeout | Время ожидания операции истекло. |
| ovrError_TrackerDriverInit | Не удалось получить интерфейс для подключенного трекера |
| ovrError_Unsupported | Функциональный вызов не поддерживается данным аппаратным / программным обеспечением |
| ovrEye_Count | \ internal Количество пронумерованных элементов. |
| ovrEye_Left | Левый глаз с точки зрения зрителя. |
| ovrEye_Right | Правый глаз с точки зрения зрителя. |
| ovr Ложь | |
| ovrHand_Count | |
| ovrHand_Left | |
| ovrHand_Right | |
| ovrHapticsBufferSubmit_Enqueue | Поставить в очередь буфер для последующего воспроизведения |
| ovrHmdCap_DebugDevice | (только чтение) Указывает, что HMD является виртуальным устройством отладки. |
| ovrHmd_CB | |
| ovrHmd_CV1 | |
| ovrHmd_DK1 | |
| ovrHmd_DK2 | |
| ovrHmd_DKHD | |
| ovrHmd_E3_2015 | |
| ovrHmd_ES06 | |
| ovrHmd_ES09 | |
| ovrHmd_ES11 | |
| ovrHmd_None | |
| ovrHmd_Другое | |
| ovrInit_Debug | Когда запрашивается библиотека отладки, более медленная версия библиотеки отладки будет |
| ovrInit_RequestVersion | Когда запрашивается версия, среда выполнения LibOVR учитывает RequestedMinorVersion. |
| ovrLayerFlag_HeadLocked | Обозначьте эту поверхность как «headlocked», что означает, что она указана. |
| ovrLayerFlag_HighQuality | |
| ovrLayerFlag_TextureOriginAtBottomLeft | |
| ovrLayerHud_Info | Показывает информацию об определенном слое |
| ovrLayerHud_Off | Отключает слой HUD |
| ovrLayerType_Disabled | Слой отключен. |
| ovrLayerType_EyeFov | Описание |
| ovrLayerType_EyeMatrix | Описание |
| ovrLayerType_Quad | Описание |
| ovrLogLevel_Debug | Событие журнала уровня отладки. |
| ovrLogLevel_Error | Событие журнала уровня ошибки. |
| ovrLogLevel_Info | Событие журнала информационного уровня. |
| ovrMaxLayerCount | Задает максимальное количество слоев, поддерживаемых |
| ovrMaxProvidedFrameStats | Максимальное количество кадров статистики производительности, возвращаемых вызывающей стороне |
| ovrPerfHud_AppRenderTiming | Показывает информацию о времени рендеринга для приложения |
| ovrPerfHud_CompRenderTiming | Показывает информацию о времени рендеринга для композитора OVR |
| ovrPerfHud_LatencyTiming | Показывает информацию о времени, связанную с задержкой |
| ovrPerfHud_Off | Отключает производительность HUD |
| ovrPerfHud_PerfSummary | Показывает сводку по производительности и запасу |
| ovrPerfHud_VersionInfo | Показывает информацию о версии SDK и HMD |
| ovrProjection_ClipRangeOpenGL | Включите, если приложение выполняет рендеринг с помощью OpenGL и ожидает матрицу проекции с диапазоном отсечения (от -w до w).Игнорируйте этот флаг, если ваше приложение уже выполняет преобразование из диапазона D3D (от 0 до w) в OpenGL. |
| ovrProjection_FarClipAtInfinity | Когда используется этот флаг, значение zfar, помещенное в |
| ovrProjection_FarLessThanNear | После применения преобразования проекции дальние значения, хранящиеся в буфере глубины, будут меньше, чем более близкие значения глубины. |
| ovrProjection_LeftHanded | Включите, если в вашем приложении используются левосторонние преобразования. |
| ovrProjection_None | Используется для создания матрицы проекции по умолчанию: |
| ovrStatus_OrientationTracked | Ориентация в настоящее время отслеживается (подключена и используется). |
| ovrStatus_PositionTracked | Позиция в настоящее время отслеживается (ложно, если вне допустимого диапазона). |
| овр Успех | |
| ovrSuccess_BoundaryInvalid | Граница недействительна из-за замены датчика или не была настроена. |
| ovrSuccess_DeviceUnavailable | Устройство недоступно для запрошенной операции. |
| ovrSuccess_NotVisible | Вернулся из вызова SubmitFrame. Вызов выполнен успешно, но какое приложение |
| ovrTextureBind_DX_DepthStencil | Буферы цепочки могут быть связаны как буферы глубины и / или трафарета |
| ovrTextureBind_DX_RenderTarget | Приложение может записывать в цепочку с помощью пиксельного шейдера |
| ovrTextureBind_DX_UnorderedAccess | Приложение может писать в цепочку с помощью вычислительного шейдера |
| ovrTextureBind_None | |
| ovrTextureMisc_AllowGenerateMips | Только DX: разрешить создание цепочки mip на графическом процессоре через GenerateMips. |
| ovrTextureMisc_DX_Typeless | Только DX: основная текстура создается с БЕЗ ТИПОВЫМ эквивалентом |
| ovrTextureMisc_None | |
| ovrTextureMisc_ProtectedContent | Цепочка обмена текстурой содержит защищенный контент и требует |
| ovrTexture_2D | 2D текстуры. |
| ovrTexture_2D_External | Внешняя 2D-текстура. Не используется на ПК |
| ovrTexture_Count | |
| ovrTexture_Cube | Кубические карты.В настоящее время не поддерживается на ПК. |
| ovrTouch_A | |
| ovrTouch_B | |
| ovrTouch_LButtonMask | Битовая маска всех касаний кнопок на левом контроллере |
| ovrTouch_LIndexPointing | |
| ovrTouch_LIndexTrigger | |
| ovrTouch_LPoseMask | Битовая маска всех левых позиций контроллера |
| ovrTouch_LThumb | |
| ovrTouch_LThumbRest | |
| ovrTouch_LThumbUp | |
| ovrTouch_RButtonMask | Битовая маска всех касаний кнопок на правом контроллере |
| ovrTouch_RIndexPointing | Состояние позы пальца |
| ovrTouch_RIndexTrigger | |
| ovrTouch_RPoseMask | Битовая маска всех правых позы контроллера |
| ovrTouch_RThumb | |
| ovrTouch_RThumbRest | |
| ovrTouch_RThumbUp | |
| ovrTouch_X | |
| ovrTouch_Y | |
| ovrTrackedDevice_All | |
| ovrTrackedDevice_HMD | |
| ovrTrackedDevice_LTouch | |
| ovrTrackedDevice_RTouch | |
| ovrTrackedDevice_Touch | |
| ovrTracker_Connected | Датчик присутствует, иначе датчик отсутствует или отключен. |
| ovrTracker_PoseTracked | Датчик имеет допустимую позу, иначе поза недоступна. Это будет установлено, только если установлено значение |
| ovrTrackingCap_MagYawCorrection | Поддерживает коррекцию дрейфа рыскания с помощью магнитометра или других средств. |
| ovrTrackingCap_Orientation | Поддерживает отслеживание ориентации (IMU). |
| ovrTrackingCap_Position | Поддерживает позиционное отслеживание. |
| ovrTrackingOrigin_EyeLevel | Сообщение о происхождении системы слежения на высоте глаза (HMD) |
| ovrTrackingOrigin_FloorLevel | Сообщение о происхождении системы слежения на высоте этажа |
| ovrTrue | |
| ovrinit_WritableBits | Эти биты доступны для записи пользовательским кодом. |
Congress.gov | Библиотека Конгресса
Секция записи Конгресса
Ежедневный дайджест
Сенат
жилой дом
Расширения замечаний
Замечания участников
Автор: Any House Member Адамс, Альма С.[D-NC] Адерхольт, Роберт Б. [R-AL] Агилар, Пит [D-CA] Аллен, Рик У. [R-GA] Оллред, Колин З. [D-TX] Амодеи, Марк Э. [R -NV] Армстронг, Келли [R-ND] Аррингтон, Джоди К. [R-TX] Auchincloss, Jake [D-MA] Axne, Cynthia [D-IA] Бабин, Брайан [R-TX] Бэкон, Дон [R -NE] Бэрд, Джеймс Р. [R-IN] Балдерсон, Трой [R-OH] Бэнкс, Джим [R-IN] Барр, Энди [R-KY] Барраган, Нанетт Диас [D-CA] Басс, Карен [ D-CA] Битти, Джойс [D-OH] Бенц, Клифф [R-OR] Бера, Ами [D-CA] Бергман, Джек [R-MI] Бейер, Дональд С., младший [D-VA] Байс , Стефани И. [R-OK] Биггс, Энди [R-AZ] Билиракис, Гас М.[R-FL] Бишоп, Дэн [R-NC] Бишоп, Сэнфорд Д., младший [D-GA] Блуменауэр, Эрл [D-OR] Блант Рочестер, Лиза [D-DE] Боберт, Лорен [R-CO ] Бонамичи, Сюзанна [D-OR] Бост, Майк [R-IL] Bourdeaux, Carolyn [D-GA] Bowman, Jamaal [D-NY] Бойл, Брендан Ф. [D-PA] Брэди, Кевин [R-TX ] Брукс, Мо [R-AL] Браун, Энтони Г. [D-MD] Браунли, Джулия [D-CA] Бьюкенен, Верн [R-FL] Бак, Кен [R-CO] Бакшон, Ларри [R-IN ] Бадд, Тед [R-NC] Берчетт, Тим [R-TN] Берджесс, Майкл С. [R-TX] Буш, Кори [D-MO] Бустос, Cheri [D-IL] Баттерфилд, GK [D-NC ] Калверт, Кен [R-CA] Каммак, Кэт [R-FL] Карбаджал, Салуд О.[D-CA] Карденас, Тони [D-CA] Карл, Джерри Л. [R-AL] Карсон, Андре [D-IN] Картер, Эрл Л. «Бадди» [R-GA] Картер, Джон Р. [ R-TX] Картер, Трой [D-LA] Картрайт, Мэтт [D-PA] Кейс, Эд [D-HI] Кастен, Шон [D-IL] Кастор, Кэти [D-FL] Кастро, Хоакин [D- TX] Cawthorn, Мэдисон [R-NC] Chabot, Стив [R-OH] Чейни, Лиз [R-WY] Чу, Джуди [D-CA] Cicilline, Дэвид Н. [D-RI] Кларк, Кэтрин М. [ D-MA] Кларк, Иветт Д. [D-NY] Кливер, Эмануэль [D-MO] Клайн, Бен [R-VA] Клауд, Майкл [R-TX] Клайберн, Джеймс Э. [D-SC] Клайд, Эндрю С. [R-GA] Коэн, Стив [D-TN] Коул, Том [R-OK] Комер, Джеймс [R-KY] Коннолли, Джеральд Э.[D-VA] Купер, Джим [D-TN] Корреа, Дж. Луис [D-CA] Коста, Джим [D-CA] Кортни, Джо [D-CT] Крейг, Энджи [D-MN] Кроуфорд, Эрик А. «Рик» [R-AR] Креншоу, Дэн [R-TX] Крист, Чарли [D-FL] Кроу, Джейсон [D-CO] Куэльяр, Генри [D-TX] Кертис, Джон Р. [R- UT] Дэвидс, Шарис [D-KS] Дэвидсон, Уоррен [R-OH] Дэвис, Дэнни К. [D-IL] Дэвис, Родни [R-IL] Дин, Мадлен [D-PA] ДеФазио, Питер А. [ D-OR] DeGette, Diana [D-CO] DeLauro, Rosa L. [D-CT] DelBene, Suzan K. [D-WA] Delgado, Antonio [D-NY] Demings, Val Butler [D-FL] DeSaulnier , Марк [D-CA] ДеДжарле, Скотт [R-TN] Дойч, Теодор Э.[D-FL] Диас-Баларт, Марио [R-FL] Дингелл, Дебби [D-MI] Доггетт, Ллойд [D-TX] Дональдс, Байрон [R-FL] Дойл, Майкл Ф. [D-PA] Дункан , Джефф [R-SC] Данн, Нил П. [R-FL] Эммер, Том [R-MN] Эскобар, Вероника [D-TX] Эшу, Анна Г. [D-CA] Эспайлат, Адриано [D-NY ] Эстес, Рон [R-KS] Эванс, Дуайт [D-PA] Фэллон, Пэт [R-TX] Feenstra, Рэнди [R-IA] Фергюсон, А. Дрю, IV [R-GA] Фишбах, Мишель [R -MN] Фицджеральд, Скотт [R-WI] Фитцпатрик, Брайан К. [R-PA] Флейшманн, Чарльз Дж. «Чак» [R-TN] Флетчер, Лиззи [D-TX] Фортенберри, Джефф [R-NE] Фостер, Билл [D-IL] Фокс, Вирджиния [R-NC] Франкель, Лоис [D-FL] Франклин, К.Скотт [R-FL] Фадж, Марсия Л. [D-OH] Фулчер, Расс [R-ID] Gaetz, Мэтт [R-FL] Галлахер, Майк [R-WI] Галлего, Рубен [D-AZ] Гараменди, Джон [D-CA] Гарбарино, Эндрю Р. [R-NY] Гарсия, Хесус Дж. «Чуй» [D-IL] Гарсия, Майк [R-CA] Гарсия, Сильвия Р. [D-TX] Гиббс, Боб [R-OH] Хименес, Карлос А. [R-FL] Гомерт, Луи [R-TX] Голден, Джаред Ф. [D-ME] Гомес, Джимми [D-CA] Гонсалес, Тони [R-TX] Гонсалес , Энтони [R-OH] Гонсалес, Висенте [D-TX] Гонсалес-Колон, Дженниффер [R-PR] Гуд, Боб [R-VA] Гуден, Лэнс [R-TX] Госар, Пол А. [R-AZ ] Gottheimer, Джош [D-NJ] Granger, Kay [R-TX] Graves, Garret [R-LA] Graves, Sam [R-MO] Green, Al [D-TX] Green, Mark E.[R-TN] Грин, Марджори Тейлор [R-GA] Гриффит, Х. Морган [R-VA] Гриджалва, Рауль М. [D-AZ] Гротман, Гленн [R-WI] Гость, Майкл [R-MS] Гатри, Бретт [R-KY] Хааланд, Дебра А. [D-NM] Хагедорн, Джим [R-MN] Хардер, Джош [D-CA] Харрис, Энди [R-MD] Харшбаргер, Диана [R-TN] Хартцлер, Вики [R-MO] Гастингс, Элси Л. [D-FL] Хейс, Джахана [D-CT] Херн, Кевин [R-OK] Херрелл, Иветт [R-NM] Эррера Бейтлер, Хайме [R-WA ] Хайс, Джоди Б. [R-GA] Хиггинс, Брайан [D-NY] Хиггинс, Клэй [R-LA] Хилл, Дж. Френч [R-AR] Хаймс, Джеймс А. [D-CT] Хинсон, Эшли [R-IA] Hollingsworth, Trey [R-IN] Horsford, Steven [D-NV] Houlahan, Chrissy [D-PA] Hoyer, Steny H.[D-MD] Хадсон, Ричард [R-NC] Хаффман, Джаред [D-CA] Хьюизенга, Билл [R-MI] Исса, Даррелл Э. [R-CA] Джексон, Ронни [R-TX] Джексон Ли, Шейла [D-TX] Джейкобс, Крис [R-NY] Джейкобс, Сара [D-CA] Jayapal, Pramila [D-WA] Джеффрис, Хаким С. [D-NY] Джонсон, Билл [R-OH] Джонсон, Дасти [R-SD] Джонсон, Эдди Бернис [D-TX] Джонсон, Генри К. «Хэнк» младший [D-GA] Джонсон, Майк [R-LA] Джонс, Mondaire [D-NY] Джордан, Джим [R-OH] Джойс, Дэвид П. [R-OH] Джойс, Джон [R-PA] Кахеле, Кайали [D-HI] Каптур, Марси [D-OH] Катко, Джон [R-NY] Китинг , Уильям Р.[D-MA] Келлер, Фред [R-PA] Келли, Майк [R-PA] Келли, Робин Л. [D-IL] Келли, Трент [R-MS] Кханна, Ро [D-CA] Килди, Дэниел Т. [D-MI] Килмер, Дерек [D-WA] Ким, Энди [D-NJ] Ким, Янг [R-CA] Kind, Рон [D-WI] Кинзингер, Адам [R-IL] Киркпатрик, Энн [D-AZ] Кришнамурти, Раджа [D-IL] Кустер, Энн М. [D-NH] Кустофф, Дэвид [R-TN] ЛаХуд, Дарин [R-IL] Ламальфа, Дуг [R-CA] Лэмб, Конор [D-PA] Лэмборн, Дуг [R-CO] Ланжевен, Джеймс Р. [D-RI] Ларсен, Рик [D-WA] Ларсон, Джон Б. [D-CT] Латта, Роберт Э. [R-OH ] Латернер, Джейк [R-KS] Лоуренс, Бренда Л.[D-MI] Лоусон, Эл, младший [D-FL] Ли, Барбара [D-CA] Ли, Сьюзи [D-NV] Леже Фернандес, Тереза [D-NM] Леско, Дебби [R-AZ] Летлоу , Джулия [R-LA] Левин, Энди [D-MI] Левин, Майк [D-CA] Льеу, Тед [D-CA] Лофгрен, Зои [D-CA] Лонг, Билли [R-MO] Лоудермилк, Барри [R-GA] Ловенталь, Алан С. [D-CA] Лукас, Фрэнк Д. [R-OK] Люткемейер, Блейн [R-MO] Лурия, Элейн Г. [D-VA] Линч, Стивен Ф. [D -MA] Мейс, Нэнси [R-SC] Малиновски, Том [D-NJ] Маллиотакис, Николь [R-NY] Мэлони, Кэролин Б. [D-NY] Мэлони, Шон Патрик [D-NY] Манн, Трейси [ R-KS] Мэннинг, Кэти Э.[D-NC] Мэсси, Томас [R-KY] Маст, Брайан Дж. [R-FL] Мацуи, Дорис О. [D-CA] МакБэт, Люси [D-GA] Маккарти, Кевин [R-CA] МакКол , Майкл Т. [R-TX] МакКлейн, Лиза К. [R-MI] МакКлинток, Том [R-CA] МакКоллум, Бетти [D-MN] МакИчин, А. Дональд [D-VA] Макговерн, Джеймс П. [D-MA] МакГенри, Патрик Т. [R-NC] МакКинли, Дэвид Б. [R-WV] МакМоррис Роджерс, Кэти [R-WA] Макнерни, Джерри [D-CA] Микс, Грегори В. [D- NY] Мейер, Питер [R-MI] Мэн, Грейс [D-NY] Meuser, Daniel [R-PA] Mfume, Kweisi [D-MD] Миллер, Кэрол Д. [R-WV] Миллер, Мэри Э. [ R-IL] Миллер-Микс, Марианнетт [R-IA] Мооленаар, Джон Р.[R-MI] Муни, Александр X. [R-WV] Мур, Барри [R-AL] Мур, Блейк Д. [R-UT] Мур, Гвен [D-WI] Морелль, Джозеф Д. [D-NY ] Моултон, Сет [D-MA] Мрван, Фрэнк Дж. [D-IN] Маллин, Маркуэйн [R-OK] Мерфи, Грегори [R-NC] Мерфи, Стефани Н. [D-FL] Надлер, Джерролд [D -NY] Наполитано, Грейс Ф. [D-CA] Нил, Ричард Э. [D-MA] Негусе, Джо [D-CO] Нелс, Трой Э. [R-TX] Ньюхаус, Дэн [R-WA] Ньюман , Мари [D-IL] Норкросс, Дональд [D-NJ] Норман, Ральф [R-SC] Нортон, Элеонора Холмс [D-DC] Нуньес, Девин [R-CA] О’Халлеран, Том [D-AZ] Обернолти, Джей [R-CA] Окасио-Кортес, Александрия [D-NY] Омар, Ильхан [D-MN] Оуэнс, Берджесс [R-UT] Палаццо, Стивен М.[R-MS] Паллоне, Фрэнк, младший [D-NJ] Палмер, Гэри Дж. [R-AL] Панетта, Джимми [D-CA] Паппас, Крис [D-NH] Паскрелл, Билл, мл. [D -NJ] Пейн, Дональд М., младший [D-NJ] Пелоси, Нэнси [D-CA] Пенс, Грег [R-IN] Перлмуттер, Эд [D-CO] Перри, Скотт [R-PA] Питерс, Скотт Х. [D-CA] Пфлюгер, Август [R-TX] Филлипс, Дин [D-MN] Пингри, Челли [D-ME] Пласкетт, Стейси Э. [D-VI] Покан, Марк [D-WI] Портер, Кэти [D-CA] Поузи, Билл [R-FL] Прессли, Аянна [D-MA] Прайс, Дэвид Э. [D-NC] Куигли, Майк [D-IL] Радваген, Аумуа Амата Коулман [R- AS] Раскин, Джейми [D-MD] Рид, Том [R-NY] Решенталер, Гай [R-PA] Райс, Кэтлин М.[D-NY] Райс, Том [R-SC] Ричмонд, Седрик Л. [D-LA] Роджерс, Гарольд [R-KY] Роджерс, Майк Д. [R-AL] Роуз, Джон В. [R-TN ] Розендейл старший, Мэтью М. [R-MT] Росс, Дебора К. [D-NC] Роузер, Дэвид [R-NC] Рой, Чип [R-TX] Ройбал-Аллард, Люсиль [D-CA] Руис , Рауль [D-CA] Рупперсбергер, Калифорния Датч [D-MD] Раш, Бобби Л. [D-IL] Резерфорд, Джон Х. [R-FL] Райан, Тим [D-OH] Саблан, Грегорио Килили Камачо [ D-MP] Салазар, Мария Эльвира [R-FL] Санчес, Линда Т. [D-CA] Сан-Николас, Майкл FQ [D-GU] Сарбейнс, Джон П. [D-MD] Скализ, Стив [R-LA ] Скэнлон, Мэри Гей [D-PA] Шаковски, Дженис Д.[D-IL] Шифф, Адам Б. [D-CA] Шнайдер, Брэдли Скотт [D-IL] Шрейдер, Курт [D-OR] Шриер, Ким [D-WA] Швейкерт, Дэвид [R-AZ] Скотт, Остин [R-GA] Скотт, Дэвид [D-GA] Скотт, Роберт С. «Бобби» [D-VA] Сешнс, Пит [R-TX] Сьюэлл, Терри А. [D-AL] Шерман, Брэд [D -CA] Шерилл, Мики [D-NJ] Симпсон, Майкл К. [R-ID] Sires, Альбио [D-NJ] Slotkin, Элисса [D-MI] Смит, Адам [D-WA] Смит, Адриан [R -NE] Смит, Кристофер Х. [R-NJ] Смит, Джейсон [R-MO] Смакер, Ллойд [R-PA] Сото, Даррен [D-FL] Спанбергер, Эбигейл Дэвис [D-VA] Спарц, Виктория [ R-IN] Шпейер, Джеки [D-CA] Стэнтон, Грег [D-AZ] Стаубер, Пит [R-MN] Стил, Мишель [R-CA] Стефаник, Элиза М.[R-NY] Стейл, Брайан [R-WI] Steube, В. Грегори [R-FL] Стивенс, Хейли М. [D-MI] Стюарт, Крис [R-UT] Стиверс, Стив [R-OH] Стрикленд , Мэрилин [D-WA] Суоззи, Томас Р. [D-NY] Swalwell, Эрик [D-CA] Такано, Марк [D-CA] Тейлор, Ван [R-TX] Тенни, Клаудия [R-NY] Томпсон , Бенни Г. [D-MS] Томпсон, Гленн [R-PA] Томпсон, Майк [D-CA] Тиффани, Томас П. [R-WI] Тиммонс, Уильям Р. IV [R-SC] Титус, Дина [ D-NV] Тлайб, Рашида [D-MI] Тонко, Пол [D-NY] Торрес, Норма Дж. [D-CA] Торрес, Ричи [D-NY] Трахан, Лори [D-MA] Трон, Дэвид Дж. .[D-MD] Тернер, Майкл Р. [R-OH] Андервуд, Лорен [D-IL] Аптон, Фред [R-MI] Валадао, Дэвид Г. [R-CA] Ван Дрю, Джефферсон [R-NJ] Ван Дайн, Бет [R-TX] Варгас, Хуан [D-CA] Визи, Марк А. [D-TX] Вела, Филемон [D-TX] Веласкес, Нидия М. [D-NY] Вагнер, Ann [R -MO] Уолберг, Тим [R-MI] Валорски, Джеки [R-IN] Вальс, Майкл [R-FL] Вассерман Шульц, Дебби [D-FL] Уотерс, Максин [D-CA] Уотсон Коулман, Бонни [D -NJ] Вебер, Рэнди К., старший [R-TX] Вебстер, Дэниел [R-FL] Велч, Питер [D-VT] Венструп, Брэд Р. [R-OH] Вестерман, Брюс [R-AR] Векстон, Дженнифер [D-VA] Уайлд, Сьюзан [D-PA] Уильямс, Никема [D-GA] Уильямс, Роджер [R-TX] Уилсон, Фредерика С.[D-FL] Уилсон, Джо [R-SC] Виттман, Роберт Дж. [R-VA] Womack, Steve [R-AR] Райт, Рон [R-TX] Ярмут, Джон А. [D-KY] Янг , Дон [R-AK] Зельдин, Ли М. [R-NY] Любой член Сената Болдуин, Тэмми [D-WI] Баррассо, Джон [R-WY] Беннет, Майкл Ф. [D-CO] Блэкберн, Марша [ R-TN] Блюменталь, Ричард [D-CT] Блант, Рой [R-MO] Букер, Кори А. [D-NJ] Бузман, Джон [R-AR] Браун, Майк [R-IN] Браун, Шеррод [ D-OH] Берр, Ричард [R-NC] Кантуэлл, Мария [D-WA] Капито, Шелли Мур [R-WV] Кардин, Бенджамин Л. [D-MD] Карпер, Томас Р. [D-DE] Кейси , Роберт П., Младший [D-PA] Кэссиди, Билл [R-LA] Коллинз, Сьюзан М. [R-ME] Кунс, Кристофер А. [D-DE] Корнин, Джон [R-TX] Кортес Масто, Кэтрин [D -NV] Коттон, Том [R-AR] Крамер, Кевин [R-ND] Крапо, Майк [R-ID] Круз, Тед [R-TX] Дейнс, Стив [R-MT] Дакворт, Тэмми [D-IL ] Дурбин, Ричард Дж. [D-IL] Эрнст, Джони [R-IA] Файнштейн, Dianne [D-CA] Фишер, Деб [R-NE] Гиллибранд, Кирстен Э. [D-NY] Грэм, Линдси [R -SC] Грассли, Чак [R-IA] Хагерти, Билл [R-TN] Харрис, Камала Д. [D-CA] Хассан, Маргарет Вуд [D-NH] Хоули, Джош [R-MO] Генрих, Мартин [ D-NM] Гикенлупер, Джон В.[D-CO] Хироно, Мази К. [D-HI] Хувен, Джон [R-ND] Хайд-Смит, Синди [R-MS] Инхоф, Джеймс М. [R-OK] Джонсон, Рон [R-WI ] Кейн, Тим [D-VA] Келли, Марк [D-AZ] Кеннеди, Джон [R-LA] Кинг, Ангус С., младший [I-ME] Klobuchar, Amy [D-MN] Ланкфорд, Джеймс [ R-OK] Лихи, Патрик Дж. [D-VT] Ли, Майк [R-UT] Леффлер, Келли [R-GA] Лухан, Бен Рэй [D-NM] Ламмис, Синтия М. [R-WY] Манчин , Джо, III [D-WV] Марки, Эдвард Дж. [D-MA] Маршалл, Роджер В. [R-KS] МакКоннелл, Митч [R-KY] Менендес, Роберт [D-NJ] Меркли, Джефф [D -ИЛИ] Моран, Джерри [R-KS] Мурковски, Лиза [R-AK] Мерфи, Кристофер [D-CT] Мюррей, Пэтти [D-WA] Оссофф, Джон [D-GA] Падилла, Алекс [D-CA ] Пол, Рэнд [R-KY] Питерс, Гэри К.[D-MI] Портман, Роб [R-OH] Рид, Джек [D-RI] Риш, Джеймс Э. [R-ID] Ромни, Митт [R-UT] Розен, Джеки [D-NV] Раундс, Майк [R-SD] Рубио, Марко [R-FL] Сандерс, Бернард [I-VT] Sasse, Бен [R-NE] Schatz, Брайан [D-HI] Шумер, Чарльз Э.
