Содержание
Выход продукта … — Учим химию вместе!
Они не учитывают примеси, которые могут содержаться в веществах, а также потери.
Однако на практике
продуктов реакции всегда образуется меньше, чем должно было получиться в
соответствии с расчетами.
Эти потери показывает величина практический выход продукта реакции η.
Ее можно рассчитать по количестве вещества, массе или по объему.
η = (mпракт : mтеор) х 100%, η = (Vпракт : Vтеор) х 100%,
где mпракт — масса вещества-продукта, получившегося практически,
а mтеор — масса продукта, рассчитанная теоретически (по
уравнению реакции).
Vпракт — масса вещества-продукта, получившегося практически, а Vтеор — масса продукта, рассчитанная теоретически (по уравнению реакции).
Пример решения задачи на выход продукта:
Задача: Вычислите объем оксида серы (IV) (н.у.), который может быть получен при сжигании 1.6 кг серы, если выход продукта составляет 80 % от теоретически возможного.
Решение:
1) Запишем уравнение химической реакции:
S+ O2 = SO2
2) Найдем количество вещества серы:
n(S)=m/M n(S)=1600 г/32 г/моль= 50 моль
3) Найдем количество вещества оксида серы (IV):
n(S)=n(SO2)=50 моль ( по уравнению реакции)
4) Найдем теоретический объем оксида серы (IV):
Vтеор = Vm* n Vтеор(SO2) = 22,4 л/моль * 50 моль= 1120 л
5) Найдем практический объем оксида серы (IV):
Vпракт= (η * Vтеор) / 100% Vпракт= 1120 л * 80%/100%=896 л
Ответ: может быть получен оксид серы (IV) объемом 896 л
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
 | Учебно-методический материал по химии (9 класс) по теме:
| Учебно-методический материал по химии (9 класс) по теме:
Урок №20. Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой (эта), измеряется в процентах или долях.
m практическая х100%
= m теоретичееская
V практический х100%
= V теоретичееский
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
1. Записываем краткое условие задачи
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
2. Запишем УХР. Расставим коэффициенты.
Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
4. Находим количество вещества реагента по формулам
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
= 120 г/моль · 0,05 моль = 6 г
6. Находим массовую (объёмную) долю выхода продукта по формуле
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.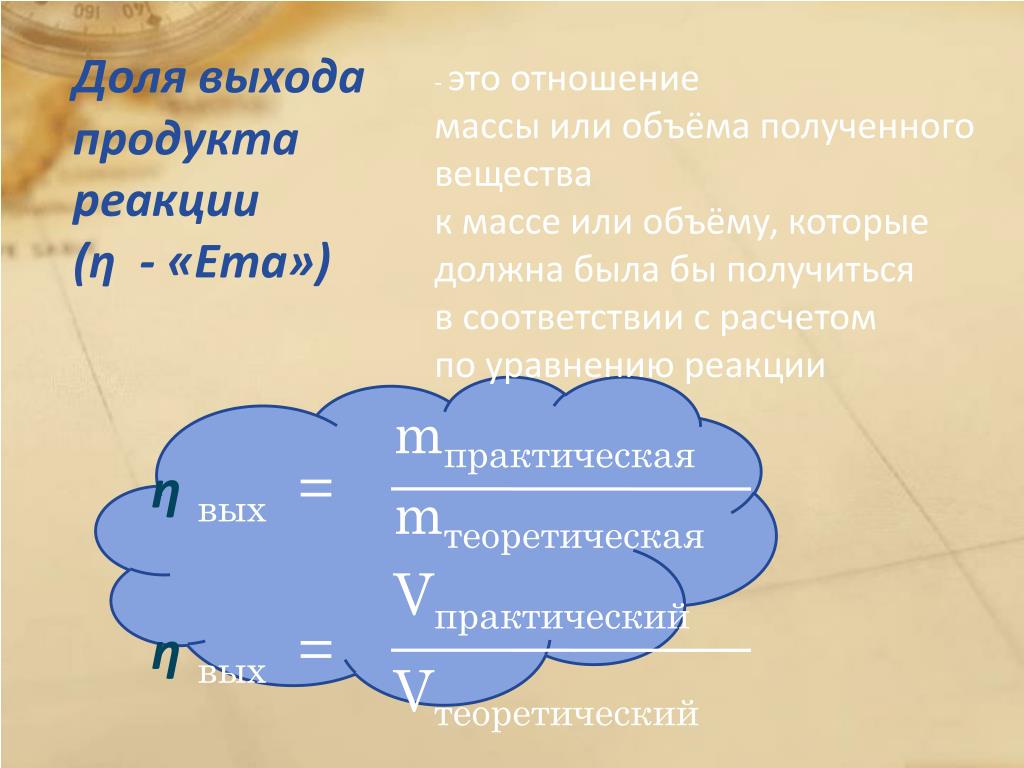
1. Записываем краткое условие задачи
Дано:
m(CaO) = 16,8 г
=80% или 0,8
_________________
Найти:
m практ (CaC2) = ?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. Записываем краткое условие задачи
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
____________________
Найти:
m(Na2CO3) =?
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
Vтеоретич(CO2) =
= 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
По УХР:
, следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
Определяем массу (объём) реагента по формуле:
m = ν · M
V = ν · Vm m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Секретная шпаргалка по химии. 3.5 Выход реакции | Репетитор Богунова В.Г.
Утром меня разбудил телефонный звонок. Звонила моя ученица Лена Д. Со слезами в голосе она начала говорить, что ЕГЭ по химии точно завалит, потому как даже «такая простая и понятная 35 задача» может включать фишку на выход реакции, не считая кучи других «садистских приколов». Лена скинула мне ВК условие злополучной 35-й задачи: «При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ»
Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ»
В своей практике я, действительно, столкнулась с парадоксом, когда очень толковые ребята, хорошо знающие химию, жутко боятся элементарных расчетов на степень превращения вещества и выход продукта реакции. Их начинает терзать сомнение: «А справлюсь ли я на ЕГЭ?!» Такие переживания могут зайти далеко и перерасти в никому не нужную депрессию. Думаю, вы тоже сталкивались с аналогичными проблемами. Что делать? Я предлагаю все трудности преодолевать вместе. Вначале мы повторим тему «Выход продукта реакции», поучимся решать задачи, обязательно разберем 35-ю задачу, предложенную моей ученицей, а в конце статьи я расскажу вам секретное упражнение, которое нужно выполнять всякий раз, когда вы начинаете сомневаться в собственных силах и способностях. Упражнение так и называется «У меня все получится!». Итак, поехали!
Выход продукта реакции (выход реакции) — это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Решим задачи на выход продукта реакции, используя Четыре Заповеди. Каждое действие обводится зеленым овалом. Читайте внимательно и обязательно записывайте решение каждой задачи. После проработки статьи попробуйте самостоятельно решить все разобранные задачи.
Задача 1
При действии алюминия на оксид цинка массой 32,4 г получили 24 г цинка. Определите выход продукта реакции
1) Первая Заповедь. Выписать данные задачи в разделе «Дано»
2) Вторая Заповедь. Написать уравнение реакции
Повторим теорию химии. Способ восстановления металлов алюминием — алюмотермия. Следует помнить: металлы, стоящие в ряду активности левее (более активные) восстанавливают металлы, стоящие правее, из расплавов оксидов или растворов солей
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→(H)→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
В условии задачи представлены данные по одному из реагентов (оксиду цинка) и по одному из реально полученных продуктов (цинку). Составляем два досье, в каждом — масса, молярная масса, количество вещества (моль). Для цинка (продукт), масса и количество вещества — практические, т.к. продукт был получен реально.
Теоретическое значение продукта рассчитываем по уравнению реакции. Точка расчета — количество вещества реагента (оксида цинка). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат. Выписывать отдельно пропорцию для расчетов не обязательно. Это — Легкие Расчеты по уравнениям реакций, которые не противоречат закону кратных отношений, но значительно упрощают решение задач по химии.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Составить алгоритм решения задачи.
Формулизируем вопрос задачи «Определите выход продукта реакции», — записываем соответствующую формулу и анализируем ее компоненты.
Подробно разберем решение обратной задачи: по известному выходу реакции определим неизвестное значение реагента или продукта.
Задача 2
Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.
1) Первая Заповедь. Выписать данные задачи в разделе «Дано».
2) Вторая Заповедь. Написать уравнение реакции.
Небольшой экскурс в теорию химии. Многие нерастворимые в воде гидроксиды разлагаются при нагревании. Продукты разложения — оксиды соответствующих металлов и вода.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
Составляем досье на реагент (гидроксид алюминия) — определяем его молярную массу и количество вещества (моль). По уравнению реакции рассчитываем теоретическое количество продукта (оксида алюминия). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат.
По уравнению реакции рассчитываем теоретическое количество продукта (оксида алюминия). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи «Определите массу оксида алюминия», т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу определяем по таблице Менделеева, количество вещества (практическое) рассчитываем по формуле выхода реакции.
Решим на закрепление еще несколько обратных задач с выходом реакции.
Задача 3
Карбонат натрия взаимодействует с соляной кислотой. Вычислите массу карбоната натрия для получения оксида углерода (IV) массой 56,1 г. Практический выход продукта 85%.
Задача 4
При действии оксида углерода (II) на оксид железа (III) получено железо массой 11,2 г. Найдите массу использованного оксида железа (III), если выход реакции составляет 80%.
Задача 5
При взаимодействии железа с хлором получено 10 г соли, что составляет 85% от теоретически возможного. Сколько граммов железа было взято для реакции с хлором?
В этой статье я не буду разбирать пошагово 35-ю задачу ЕГЭ, предложенную моей ученицей. На фото — подробное решение. Тот, кто уже решал аналогичные задачи, поймет без дополнительных объяснений. Для всех остальных — обязательно будем наслаждаться анализом этой задачи (и не только этой) в следующей статье. Обещаю ДРАЙВ!
Задача 35 ЕГЭ (восстановлена по памяти моей ученицы)
При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота.
Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ
Вернемся к проблеме, которую я затронула в начале статьи. Что делать, если резко упала самооценка, ты чувствуешь себя полным идиотом и боишься не справиться с трудными заданиями ЕГЭ? Все очень просто — выполни секретное упражнение «У меня все получится!» Я подсмотрела его на просторах Интернета (автора не знаю) и модифицировала это упражнение под себя и своих учеников:
1. Сядь в спокойной обстановке, закрой глаза, успокой дыхание. Сосредоточься на своей цели. Представь, что у тебя уже все получилось и ты достиг всего, к чему стремился.
2. Сожми ладони вместе перед собой и прижми их к груди. Обратись к Высшему Разуму (как ты его себе представляешь — Бог, Вселенная, Космос, Мир, Природа) с просьбой реализовать твою цель и мечты.
3. Побудь в таком состоянии несколько минут, затем встань, расправь плечи и стряхни с себя все плохое.
В конце статьи хочу привести цитату из стихотворения американского поэта Эдгара Геста, который был очень популярен 100 лет назад:
«И ты не верь тому, кто скажет: «Это слишком сложно!»
Не слушай тех, кто будет утверждать, что это невозможно,
Не бойся трудностей – скорей берись за дело,
Гони сомненья прочь – к мечте иди решительно и смело!»
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Алгоритм решения задач по химии на выход продукта реакции
Тема урока: Решение задач на определение выхода продукта реакции.
Алгоритм решения задач.
Составьте краткое условие задачи.
Составьте уравнение реакции, расставьте коэффициенты.
Подпишите над формулами веществ известные величины( массу или объем), неизвестную обозначьте как х.
Найдите неизвестную величину(массу или объем), используя метод пропорции- это будет теоретическая mилиv.
Определите практический выход продукта реакции по формуле
η = mпракт. / m теор. или φ = Vпракт./ Vтеор. |
Запишите ответ.
Расчёт выхода продукта реакции по отношению к теоретически возможному.
Помните:первым действием в решении задачи является определение массы (объема, количествавещества) продукта реакции по уравнению и исходным данным.
Порядок действий (пошаговый): | Пример: Определите выход продукта реакции синтеза аммиака, если при взаимодействии 6,72 л азота с избытком водорода получено 6,72 л аммиака. |
I.Запишите краткое условие задачи и уравнение химической реакции, подчеркните вещества, о которых идет речь в задаче. Переведите массу (объем) известного исходного вещества (реагента) в количество (моли): n = m : M (n = V : Vm) | Д а н о : Решение: V(N2) = 6.72 л N2 + 3 H2 = 2 NH3 Vпракт.(NH3)=6.72 л 1 моль 2 моль φ (NH3) = ? n (N2) = 6.72 л : 22.4 л/моль = 0,3 моль |
II. реакции. Т.е. теоретически возможное (если бы выход реакции составлял бы 100%) . | По уравнению: 1 моль (N2) → 2 моль (NH3) Следовательно: 0,3 моль (N2) → 0,6 моль(NH3) nтеорет. (NH3) = 0.6 моль (или 13,44 л) |
III.Определите, какую часть от теоретически возможного составляет практически полученная по условию масса (объем, количество) продукта. Воспользуйтесь формулой: η = mпракт. / mтеор. или φ = Vпракт./Vтеор. Запишите ответ. | Обратите внимание: Vпракт./Vтеор = nпракт. / nтеорет. = φ nпракт.(NH3) = 6.72 л : 22.4 л/моль = 0,3 моль φ (NH3) = 0,3моль (6,72 л) : 0,6моль (13,44л) = 0,5 (50%) Ответ:φ (NH3) = 50%. |
Решите задачи:
При взаимодействии 15 г. алюминия с серой образовалось 35 г. сульфида алюминия AL2 S 3 .Сколько это составляет процентов от теоретически возможного?
Сколько л водорода выделится при действии избытка соляной кислоты HCLна 2,7 г. алюминия, если выход водорода составляет 90% от теоретического?
При взаимодействии 60 г. железа с хлором образовалось 75 г. хлорида железа ( III ) . Сколько это составляет % от теоретически возможного?
Сколько это составляет % от теоретически возможного?
ОпределитVводорода,который может быть получен при взаимодействии с водой 5 г. кальция ,если выход водорода составляет 90 % от теоретически возможного .
При взаимодействии 5,4 г. алюминия с соляной кислотой было получено 6,384 л водорода. Сколько это составляет % теоретически возможного ?
Выход водорода в реакции взаимодействия натрия с водой составляет 95 %. Сколько л водорода получается при растворении в воде 2.3 г. Na ?
При обработке 35,1 г. хлорида натрия Na CL избытком концентрированной серной кислоты выделилось 10,08 л хлороводорода HCL.Найдите выход HCLв данной реакции. (ответ- 75 %).
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/41207-algoritm-reshenija-zadach-po-himii-na-vyhod-p
Задачи. Выход продукта реакции
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.
Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:
Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
1. | Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти: =? |
2. Запишем Под
|
|
3.
| M(Mg) = 24 г/моль M(MgSO4) = 24 |
4.
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
5. По |
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
6. Находим |
(MgSO4) = (5,5г
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
1. | Дано: m(CaO) = 16,8 г =80% или 0,8 ____________________ Найти: mпракт (CaC2) = ?
|
2. Запишем Под
|
|
3.
| M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
4.
|
ν(CaO) = 16,8 (г) / 56 |
5. По | |
6. Находим
|
mпрактич (CaC2) = 0,8
Ответ: mпрактич (CaC2) = 15,36
|
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. | Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =?
|
2. Находим
| M (Na2CO3) =2·23 +
|
3.
|
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6
|
4. Под
|
|
5.
| По УХР: , следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль
|
5. Определяем m V
|
m = ν · M
m (Na2CO3) = 106 |
Как найти выход вещества. Как найти массу вещества? «на выход продукта от теоретически возможного»
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ
Задача 1.
Через известковую воду, содержащую 3,7 г гидроксида кальция, пропустили углекислый газ. Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного.
Дано:
I способ.
Определим количества приведенных в условии задачи веществ:
v = m /
M = 3,7 г /
74 г/моль = 0,05 моль;
v = 0,05 моль
v(CaCO 3
) = m(CaCO 3
) /
M(CaCO 3
) = 4,75 г /
100 г/моль = 0,0475 моль;
v(CaCO 3
) = 0,0475 моль
Запишем уравнение химической реакции:
Ca(OH) 2
Из уравнения химической реакции следует, что из 1 моль Ca(OH) 2
образуется 1 моль CaCO 3
, а значит, из 0,05 моль Ca(OH) 2
теоретически должно получиться столько же, то есть 0,05 моль CaCO 3
. Практически же получено 0,0475 моль CaCO 3
, что составит:
w вых.
(CaCO 3
) = 0,0475 моль *
100 % /
0,05 моль = 95 %
w вых.
(CaCO 3
) = 95 %
II способ.
Принимаем во внимание массу исходного вещества (гидроксида кальция) и уравнение химической реакции:
Ca(OH) 2
Рассчитаем по уравнению реакции, сколько теоретически образуется карбоната кальция.
Из 74 г Ca(OH) 2
Отсюда х = 3,7 г
*
100 г
/
74 г = 5 г, m(CaCO
3
) = 5 г
Это означает, что из данных по условию задачи 3,7 г гидроксида кальция теоретически (из расчётов) можно было бы получить 5 г карбоната кальция, а практически получено лишь 4,75 г продукта реакции. Из этих данных определим выход карбоната кальция (в %) от теоретически возможного:
5 г CaCO 3
составляют 100% — ный выход
4,75 г CaCO 3
составляют х %
x = 4,75 моль
*
100 %
/
5 г = 95 % ;
w
вых.
(CaCO
3
) = 95 %
Ответ: выход карбоната кальция составляет 95 % от теоретически возможного.
Задача 2.
При взаимодействии магния массой 36 г с избытком хлора получено 128,25 г хлорида магния. Определить выход продукта реакции в процентах от теоретически возможного.
Дано:
Рассмотрим два способа решения этой задачи: с использованием величины количества вещества
и массы вещества
.
I способ.
Из данных по условию задачи значений масс магния и хлорида магния рассчитаем значения количества этих веществ:
v(Mg) = m(Mg) /
M(Mg) = 36 г /
24 г/моль = 1,5 моль; v(Mg) = 1,5 моль
v(MgCl 2
) = m(MgCl 2
)/
M(MgCl 2
) = 128,25 г /
95 г/моль = 1,35 моль;
v(MgCl 2
) = 1,35 моль
Составим уравнение химической реакции:
Mg
Воспользуемся уравнением химической реакции. Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
1,5 моль MgCl 2
х = 1,35 моль * 100%
/
1,5 моль = 90%, т.е. w
вых.
(MgCl
2
) = 90%
II способ.
Рассмотрим уравнение химической реакции:
Mg
В первую очередь по уравнению химической реакции определим, сколько граммов хлорида магния можно получить из данных по условию задачи 36 г магния.
Из 24 г Mg 2
Отсюда х = 36 г * 95 г
/
24 г = 142,5 г; m(MgCl
2
) = 142,5 г
Это означает, что из данного количества магния можно было бы получить 142,5 г хлорида магния (теоретический выход, составляющий 100%). А получено всего 128,25 г хлорида магния (практический выход).
Рассмотрим теперь, сколько процентов составляет практический выход от теоретически возможного:
142,5 г MgCl 2
х = 128,25 г * 100 %
/
142,5 г = 90 %, то есть
w
вых.
(MgCl
2
) = 90%
Ответ: выход хлорида магния составляет 90% от теоретически возможного.
Задача 3.
Металлический калий массой 3,9 г поместили в дистиллированную воду объемом 50 мл. В результате реакции получили 53,8 г раствора едкого кали с массовой долей вещества равной 10%. Вычислить выход едкого кали (в процентах) от теоретически возможного.
Дано:
2K
На основе этого уравнения химической реакции сделаем расчёты.
Вначале определим массу едкого кали, которую теоретически можно было бы получить из данной по условию задачи массы калия.
Из 78 г К
Отсюда: x = 3,9 г *
112 г /
78 г = 5,6 г m(KOH) = 5,6 г
Из этой формулы выражаем m в-ва:
m в-ва = m р-ра *
w в-ва /
100%
Определим массу едкого кали, находящегося в 53,8 г 10% -ного его раствора:
m(KOH) = m р-ра *
w(KOH) /
100% = 53,8 г *
10% /
100% = 5,38 г
m(KOH) = 5,38 г
Наконец, рассчитываем выход едкого кали в процентах от теоретически возможного:
w вых. (КОН) = 5,38 г /
(КОН) = 5,38 г /
5,6 г *
100% = 96%
w
вых.
(КОН) = 96%
Ответ: Выход едкого кали составляет 96% от теоретически возможного.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Рис. 1. Формула числа Авогадро.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.
Рис. 2. Расчет молярной массы.
Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H 2 SO 4 . Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Получается, что суммарная молекулярная масса равна 98 атомных единиц массы (1*2+32+16*4). Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Рис. 3. Формула единицы атомной массы углерода.
Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Задачи на практический выход.
1 .Вычислите объем аммиака, который можно получить, нагревая 20г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
2NH
4
Cl + Ca(OH)
2
= 2NH
3
+H
2
O; Mr(NH
4
Cl) =53,5
NH
4 Cl
+0,5Са(ОH
) 2 = NH
3 +0,5H
2 O
1)Рассчитаем теоретический выход
20/53,5=Х/22,4; Х=8,37л(это теоретический выход)
2) Рассчитаем практический выход
V
(практического)=V
(теоретического)/выход прдукта*100%
V
(практического)=8,37л*98%/(делим на) 100% = 8. 2л
2л
Ответ: 8,2 л N
Нз
2.Из 320г сернистого колчедана, содержащего 45% серы, было получено 405г серной кислоты (расчёт на безводную кислоту). Вычислите массовую долю выхода серной кислоты.
Составим схему производственного получения серной кислоты
320г 45% 405г, ή-?
FeS
2 →
S
→
H
2 SO
4
1)Рассчитаем долю серы в колчедане
2)Рассчитаем теоретический выход серной кислоты
3) Рассчитаем выход продукта в процентах
З.Вычислите массу фосфора необходимую для получения 200 кг фосфорной кислоты, если массовая доля выхода продукта составляет 90%.
Составим схему производственного получения фосфорной кислоты
Х 200кг,ή=90%
P
→
H
3 PO
4
1)Рассчитаем массу теоретического выхода фосфорной кислоты
m
т =
2) Рассчитаем массу фосфора
Ответ:70,Зкг
4.Юный химик на занятиях кружка решил получить азотную кислоту реакцией обмена между нитратом калия и концентрированной серной кислотой. Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
5.При нагревании нитрита аммония N
Н 4 NO
2 образуются азот и вода. Вычислите объем азота (н. у), который можно получить при разложении 6,4г нитрита аммония, если объемная доля выхода азота составляет 89%.
6.Вычислите объем оксида азота (II), который можно получит при каталитическом окислении в лаборатории 5,6л аммиака, если объемная доля выхода оксида азота (II
) равна 90%.
7.Металлический барий получают восстановлением его оксида металлическим алюминием c
образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг бария.
Ответ: 92,5%
8.Определите, какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 2,1 л (н. у) оксида азота (IV
), если объемная доля выхода оксида азота (IV
) равна 94%.
Ответ: 3,19
9.Какой объем оксида серы (IV
) надо взять для реакции окисления кислородом, чтобы получить оксид серы (V
I) массой 20г. если выход продукт равен 80% (н.у).?
если выход продукт равен 80% (н.у).?
2SO
2
+ O
2
= 2SO
3
; V.(SO
2
)
=22.4
л; Mr(SO
3
) =80
1) Рассчитаем теоретический выход
m
(теорет) =
2)Рассчитаем массу SO
2
10.При нагревании смеси оксида кальция массой 19,6г с коксом массой 20г получили карбид кальция массой 16г. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90%.
Ответ: 71.4%
11 .Через раствор массой 50г с массовой долей иодида натрия 15% пропустили избыток хлора, выделился йод массой 5,6г. Определите выход продукта реакции от теоретически возможного в %.
Ответ: 88,2%.
12.Определить выход силиката натрия в % к теоретическому, если при сплавлении 10 кг гидроксида натрия с оксидом кремния (IV
) получено 12,2 кг силиката натрия. Ответ 80%
13.Из 4 кг оксида алюминия удаётся выплавить 2 кг алюминия. Вычислите массовую долю выхода алюминия от теоретически возможного.
Ответ:94,3%
14.Вьичислите объем аммиака, который получается при нагревании смеси хлорида аммония массой 160,5 г и гидроксида кальция, если объемная доля выхода аммиака от теоретически возможного составляет 78%.
Ответ:52.4л
15.Какое количество аммиака потребуется для получения 8 т нитрата аммония, если выход продукта составляет 80% от теоретически возможного?
Ответ:2,IЗт
16.Какое количество уксусного альдегида может быть получено по реакции Кучерова, если в реакцию вступило 83,6 л ацетилена, а практический выход составил 80% от теоретически возможного?
Ответ: 131,З6г
17.Какое количество бензола потребуется для получения 738г нитробензола, если практический выход составляет 92% от теоретического.?
Ответ 508.75г
1 8.При нитрировании 46,8 бензола получено 66,42г нитробензола. Определите практический выход нитробензола в % от теоретически возможного.
19.Сколько граммов бензола можно получить из 22,4 л ацетилена, если практический выход бензола составил 40%.?
20.Какой объем бензола (ρ=0,9г/см 3) потребуется, чтобы получить 30,75г нитробензола, если выход при нитровании составляет 90% от теоретически возможного?
21 .Из 32г этилена было получено 44г спирта. Вычислите практический выход продукта в % от теоретически возможного.
Вычислите практический выход продукта в % от теоретически возможного.
22.Сколько граммов этилового спирта можно получить из 1м 3 природного газа, содержащего 6% этилена, если практический выход составил 80%?
23.Какое количество кислоты и спирта необходимо для получения 29,6г уксуснометилового эфира, если его выход составил 80% от теоретически возможного?
24.При гидролизе 500кг древесины, содержащей 50% целлюлозьг, получается 70кг глюкозы. Вычислите ее практический выход в % от теоретически возможного.
25.Сколько глюкозы получается из 250 кг опилок, содержащих 40% глюкозы. Какое количество спирта можно получить из этого количества глюкозы при 85%-ном практическом выходе?
Ответ:43,43г
26.Сколько граммов нитробензола нужно взять, чтобы восстановлением получить 186г анилина, выход которого составляет 92% от теоретического 27. Вычислите массу сложного эфира, который получили из 460г муравьиной кислоты и 460г этилового спирта. Выход эфира от теоретически возможного составляет 80%.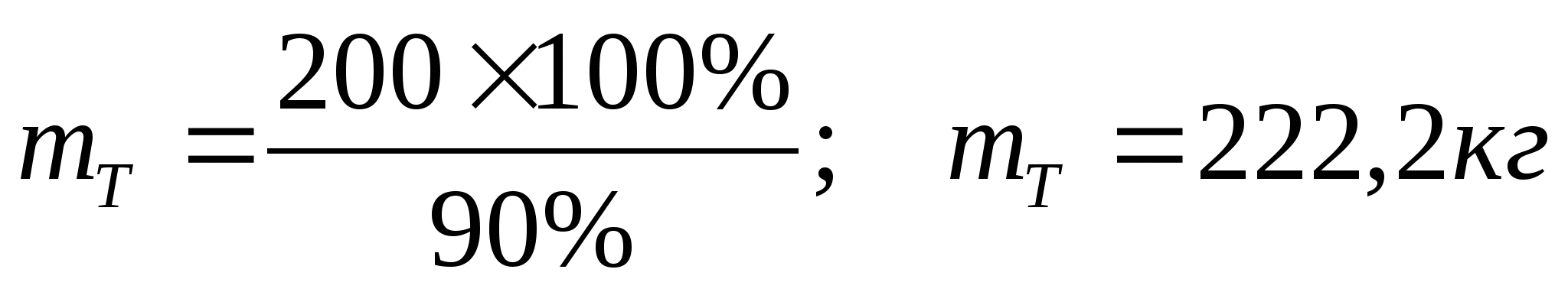
28.При обработке 1т фосфорита, содержащего 62% фосфата кальция, серной кислотой было получено 910,8кг суперфосфата. Определить выход суперфосфата в % по отношению к теоретическому.
Са 3 (РО 4) 2 + 2Н 2 S
0 4 = Са (Н 2 Р0 4) 2 + 2СаS
0 4
З0.Для получения кальциевой селитры, 1т мела обработали разбавленной азотной кислотой. При этом выход кальциевой селитры составил 85% по отношению к теоретическому. Сколько селитры было получено?
Ответ: 1394кг
31 .Из 56кг азота было синтезировано 48 кг аммиака. Каков выход аммиака в процентах к теоретическому.
Ответ: 70,5%
32. 34 кг аммиака пропустили через раствор серной кислоты. Выход сульфата аммония составил 90% от теоретического. Сколько килограммов сульфата аммония получено?
Ответ:118,8кг
З3.При окислении З4кг аммиака было получено 54кг окиси азота (II
).Вычислить выход окиси азота в % по отношению к теоретическому.
34.В лаборатории аммиак получают взаимодействием хлористого аммония с гашёной известью. Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Ответ:30,6г
35.Из 60кг водорода и соответствующего количества азота было синтезировано 272 кг аммиака. Каков выход аммиака в % к теоретически возможному?
36. Из 86,7г натриевой селитры, содержащей 2% примесей, получено 56,7г азотной кислоты, каков выход азотной кислоты в % к теоретически возможному?
Ответ: 90%.
37.При пропускания аммиака через 6Зкг 50% раствора азотной кислоты было получено З8кг аммиачной селитры. Каков выход ее в % к теоретически возможному?
38.Для получения фосфорной кислоты было израсходовано ЗI4кг фосфорита, содержащего 50% фосфата кальция. Выход фосфорной кислоты составил 95%.Сколько кислоты было получено?
Ответ:94,Зкг
39.
49кг 50% раствора серной кислоты было нейтрализовано гашёной известью, причем получилось 30,6кг сульфата кальция. Определить выход продукта в % к теоретическому.
40.Фосфор получают в технике по уравнению реакции;
Саз (Р0 4) 2 + 3SiО 2 +5С →ЗСaSi
О 3 + 2Р +5СО
Каков выход фосфора в % к теоретическому, если его получилось 12,4 кг из 77 кг фосфорнокислого кальция?
Ответ: 80,5%
41 .Вычислите выход карбида кальция в % к теоретическому, если 15,2кг его
были получены из I4кг окиси кальция.
42. Ацетилен получают взаимодействием.карбида кальция с водой
СаС 2 +2Н 2 0= Са(ОН) 2 +С 2 Н 2
Сколько граммов ацетилена получится, если израсходовано 33,7г карбида кальция, содержащего 5% примесей и выход ацетилена составил 90% к теоретическому?
Ответ: 11,7г
43.При действии соляной кислоты на 50г мела получилось 20г углекислого газа. Каков выход его в % к теоретическому?
Ответ: 90,9%
44.При обжиге 1т известняка, содержащего 10% примесей, выход углекислого газа составил 95%. Сколько килограммов углекислого газа было получен?
Ответ: 376,2 кг.
45. Определить выход силиката натрия в % к теоретическому, если при сплавлении 10кг едкого натра с песком получено 12,2 кг силиката натрия.
Элемента).
Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Обратите внимание
Единицами измерения массы могут быть миллиграммы, граммы, килограммы.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
Масса тела — это одна из важнейших его физических характеристик, которая показывает его гравитационные свойства. Зная объем вещества, а также его плотность, можно без труда вычислить и массу тела, в основе которого и лежит это вещество.
Вам понадобится
- Объем вещества V, его плотность p.
Инструкция
Пускай нам дано неоднородное с массой V и массой m. Тогда его можно будет рассчитать по формуле:
p = m/V.
Из этой следует, что для того, чтобы рассчитать массу , можно воспользоваться ее следствием:
m = p*V. Рассмотрим :Пусть нам дан платиновый брусок. Его объем равен 6 кубическим метрам. Найдем его массу.
Задача решается в 2 действия:
1) Согласно таблице плотности различных веществ, плотность платины составляет 21500 кг/куб. метров.
2) Тогда, зная плотность и объем этого вещества, рассчитаем его массу:
6*21500 = 129000 кг, или 129 тонн.
Видео по теме
Воду, как и любую жидкость, не всегда можно взвесить на весах. Но узнать массу воды
бывает необходимо как на некоторых производствах, так и в обычных житейских ситуациях, от расчета резервуаров до решения вопроса, какой запас воды вы можете взять с собой в байдарку или резиновую лодку. Для того, чтобы вычислить массу воды или любой жидкости, помещенной в тот или иной объем, прежде всего необходимо знать ее плотность.
Вам понадобится
- Мерная посуда
- Линейка, рулетка или любой другой измерительный прибор
- Сосуд для переливания воды
Инструкция
Если вам нужно вычислить массу воды в небольшом сосуде, это можно сделать с помощью обычных весов. Взвесьте сначала сосуд вместе с . Затем перелейте воду в другую посуду. После этого взвесьте пустой сосуд. Из полного сосуда вычтите массу пустого. Это и будет содержавшейся в сосуде воды. Таким образом можно массу не только жидких, но и сыпучих веществ, если есть возможность их пересыпать в другую посуду. Такой способ иногда еще можно наблюдать в некоторых магазинах, где нет современного оборудования. Продавец сначала взвешивает пустую банку или бутылку, затем заполняет ее сметаной, взвешивает снова, определяет вес сметаны и только после этого рассчитывает ее стоимость.
Для того, чтобы определить массу воды в сосуде, который невозможно взвесить, необходимо знать два параметра — плотность воды (или любой другой жидкости) и объем сосуда. Плотность воды составляет 1 г/мл. Плотность другой жидкости можно найти в специальной таблице, которая обычно бывает в справочниках по химии.
Плотность воды составляет 1 г/мл. Плотность другой жидкости можно найти в специальной таблице, которая обычно бывает в справочниках по химии.
Если нет мерной посуды, в которую можно перелить воду, вычислите объем сосуда, в котором она находится. Объем всегда равен произведению площади основания на высоту, и с сосудами постой формы обычно проблем не возникает. Объем воды в банке будет равен площади круглого основания на высоту, заполненную водой. Умножив плотность? на объем воды V, вы получите массу воды m: m=?*V.
Видео по теме
Обратите внимание
Определить массу можно и зная количество воды и ее молярную массу. Молярная масса воды равна 18, поскольку состоит из молярных масс 2 атомов водорода и 1 атома кислорода. Mh3O = 2MH+MO=2·1+16=18 (г/моль). m=n*M, где m – масса воды, n – количество, M – молярная масса.
Плотность есть отношение массы к занимаемому ей объему – для твердых тел, и отношением молярной массы к молярному объему – для газов. В самом общем виде объем (или молярный объем) будет отношением массы (или молярной массы) к ее плотности. Плотность известна. Что делать? Сперва определить массу, затем вычислить объем, затем внести необходимые поправки.
Плотность известна. Что делать? Сперва определить массу, затем вычислить объем, затем внести необходимые поправки.
Инструкция
Объем газа равен отношению произведения , умноженного на его – к уже известной плотности. Иными , даже зная , необходимо знать молярную массу газа и количество , то есть – сколько у вас есть моль газа. В принципе, зная, сколько моль газа у вас есть, можно вычислить его объем, даже не зная плотности – согласно закону Авогадро, один моль любого газа занимает объем 22,4 л. Если же обязательно вычислять объем через плотность, то вам понадобится узнать массу газа в неизвестном пока объеме.
Объем твердого тела можно определить, даже не зная плотности, просто измерив его, а в случае сложной и очень неправильной формы объем определяется, например, по объему вытесненной твердым телом жидкости. Однако, если необходимо вычислять объем именно через плотность, то объем твердого тела есть отношение массы тела к его плотности, а масса обычно определяется простым взвешиванием. Если же взвесить тело по каким-то причинам (например, оно слишком большое или движется) невозможно, то придется прибегать к довольно сложным косвенным расчетам. К примеру, для движущегося тела масса есть отношение удвоенной кинетической энергии к квадрату его скорости, или отношение силы, приложенной к телу, к его ускорению. Для очень большого покоящегося тела придется прибегать к расчетам по отношению к массе Земли, с использованием гравитационной постоянной и момента вращения. Или же – через вычисление удельной теплоемкости вещества; в любом случае знания только плотности для вычисления объема будет недостаточно.
Если же взвесить тело по каким-то причинам (например, оно слишком большое или движется) невозможно, то придется прибегать к довольно сложным косвенным расчетам. К примеру, для движущегося тела масса есть отношение удвоенной кинетической энергии к квадрату его скорости, или отношение силы, приложенной к телу, к его ускорению. Для очень большого покоящегося тела придется прибегать к расчетам по отношению к массе Земли, с использованием гравитационной постоянной и момента вращения. Или же – через вычисление удельной теплоемкости вещества; в любом случае знания только плотности для вычисления объема будет недостаточно.
Вычислив массу твердого тела, можно вычислить объем – простым делением массы на плотность.
Обратите внимание
1. Указанные выше методы более или менее применимы только в случае однородности вещества, из которого состоит твердое тело
2. Приведенные методы более или менее применимы в сравнительно узком промежутке температур – от минус 25 до плюс 25 градусов Цельсия. При изменении агрегатного состояния вещества плотность может меняться скачкообразно; в этом случае формулы и методы вычислений будут совсем другими.
При изменении агрегатного состояния вещества плотность может меняться скачкообразно; в этом случае формулы и методы вычислений будут совсем другими.
Масса как физическая величина — это параметр, характеризующий силу воздействия тела на гравитацию. Для расчета массы тела в физике требуется знать две его величины: плотность материала тела и его объем.
Инструкция
Пусть задано некое тело объемом V его p. Тогда его подсчитывают так:
m = p*V. Для наглядности приводится :
Пусть дан алюминиевый объемом 5 куб. метров. Плотность алюминия составляет 2700 кг./куб. метр. В таком случае масса бруска составит:
m = 2700/5 = 540 кг.
Обратите внимание
Понятие массы часто путают с другой, не менее редко встречающейся, физической величиной — весом. Вес измеряется в н/м³ и характеризует силу, которая воздействует на точку опоры. Масса же, по своей природе, не имеет какой бы то ни было точки опоры, и воздействует, как было отмечено, лишь на гравитацию Земли.
Масса какого-либо тела является его важнейшей физической характеристикой. В современной физической науке есть разграничение понятия «масса»: гравитационная масса (как степень воздействия тела на земную гравитацию) и инертная масса (какое усилие потребуется для того, чтобы вывести тело из состояния инерции). В любом случае найти массу очень легко, если известны плотность и объем тела.
Инструкция
Для наглядности можно привести . Требуется найти массу бетонной плиты, чей объем составляет 15 м³.
Решение: массы бетонной плиты требуется знать лишь его плотность. Для того, чтобы узнать эту информацию, нужно воспользоваться таблицей плотностей различных веществ.
Согласно этой таблице плотность бетона составляет 2300 кг/м³. Тогда для того, чтобы найти массу бетонной плиты, потребуется совершить простое алгебраическое действие: m = 15*2300 = 34500 кг, или 34.5 тонн. Ответ: масса бетонной плиты составляет 34.5 тонн
Измерение массы традиционным способом происходит при помощи одного из древнейших приборов человечества — с помощью весов. Это происходит благодаря сравнению массы тела с помощью эталонной массы груза — гирь.
Обратите внимание
Проводя расчет по указанной выше формуле, необходимо осознавать, что таким образом узнается масса покоя данного тела. Интересен факт того, что многие элементарные частицы обладают колеблющейся массой, которая зависит от скорости их движения. Если элементарная частица движется со скоростью тела, то эта частица является безмассовой (например, фотон). Если же скорость движения частицы ниже скорости света, то такая частица называется массивной.
Полезный совет
При измерении массы никогда нельзя забывать, в какой системе будет дан конечный результат. Имеется ввиду, что в системе СИ масса измеряется в килограммах, в то время как в системе СГС масса измеряется в граммах. Также масса измеряется в тоннах, центнерах, каратах, фунтах, унциях, пудах, а также во многих других единицах в зависимости от страны и культуры. В нашей стране, к примеру, массу издревле измеряли в пудах, берковцах, золотниках.
Источники:
- масса бетонной плиты
Все вещества имеют определенную плотность. В зависимости от занимаемого объема и заданной массы, вычисляется плотность. Она находится, исходя из экспериментальных данных и числовых преобразований. Кроме того, плотность зависит от множества различных факторов, в связи с которыми изменяется ее постоянное значение.
Инструкция
Представьте себе, что дан некоторый сосуд, до краев заполненный водой. В задаче необходимо найти плотность воды, при этом не зная ни массы, ни объема. Для того, чтобы вычислить плотность, следует найти оба параметра экспериментально. Начните с определения массы.
Возьмите сосуд и поставьте его на весы. Затем выльете из него воду, после чего снова поставьте сосуд на те же весы. Сравните результаты измерений и получите формулу для нахождения массы воды:
mоб.- mс.=mв., где mоб. — масса сосуда с водой (общая масса), mс — масса сосуда без воды.
Второе, что потребуется найти — воды.3. При изменении меняется и плотность. Помимо этого, к факторам, влияющим на плотность относят давление, минерализация и соленость воды. Наиболее ярко выражено влияние на плотность температуры.
Запомните, что плотность под действием температуры изменяется по параболическому закону. Значение t=4 °C является критической точкой данной параболы, на которой плотность воды достигает наибольшего значения. Любая температура, находящаяся выше или ниже этого значения, ведет к снижению плотности. При температуре 0 °C плотность воды значительно понижается.
Минерализация и давление действуют на плотность воды одинаково. При их повышении плотность растет. Также заметное плотность воды прямо пропорциональна концентрации в ней соли.
Существуют и другие факторы, от которых зависит плотность воды, но их влияние значительно слабее, чем у указанных выше.
Видео по теме
Масса вещества — это та мера, с помощью которой воздействует тело на свою опору. Она измеряется в килограммах (кг), граммах (г), тоннах (т). Найти массу вещества, если известен его объем, очень легко.
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, — теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( — “этта”) — это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества
и продукта
реакции
. Определить выход продукта.
2. Даны массы исходного вещества
и выход продукта
реакции.
Определить массу продукта.
3. Даны массы продукта
и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = V m * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH 3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.
Как найти выход реакции. Решение типовых задач по химии. Расчет массы вещества в растворе по его массовой доле
Окружающее нас пространство наполнено разными физическими телами, которые состоят из разных веществ с различной массой. Школьные курсы химии и физики, ознакомляющие с понятием и методом нахождения массы вещества, прослушали и благополучно забыли все, кто учился в школе. Но между тем теоретические знания, приобретенные когда-то, могут понадобиться в самый неожиданный момент.
Вычисление массы вещества с помощью удельной плотности вещества. Пример – имеется бочка на 200 литров. Нужно заполнить бочку любой жидкостью, скажем, светлым пивом. Как найти массу наполненной бочки? Используя формулу плотности вещества p=m/V, где p – удельная плотность вещества, m – масса, V – занимаемый объем, найти массу полной бочки очень просто:
- Меры объемов – кубические сантиметры, метры. То есть бочка на 200 литров имеет объем 2 м³.
- Мера удельной плотности находится с помощью таблиц и является постоянной величиной для каждого вещества. Измеряется плотность в кг/м³, г/см³, т/м³. Плотность пива светлого и других алкогольных напитков можно посмотреть на сайте . Она составляет 1025,0 кг/м³.
- Из формулы плотности p=m/V => m=p*V: m = 1025,0 кг/м³* 2 м³=2050 кг.
Бочка объемом 200 литров, полностью наполненная светлым пивом, будет иметь массу 2050 кг.
Нахождение массы вещества с помощью молярной массы. M (x)=m (x)/v (x) – это отношение массы вещества к его количеству, где M (x) – это молярная масса X, m (x) – масса X, v (x) – количество вещества X. Если в условии задачи прописывается только 1 известный параметр – молярная масса заданного вещества, то нахождение массы этого вещества не составит труда. Например, необходимо найти массу йодида натрия NaI количеством вещества 0,6 моль.
- Молярная масса исчисляется в единой системе измерений СИ и измеряется в кг/моль, г/моль. Молярная масса йодида натрия – это сумма молярных масс каждого элемента: M (NaI)=M (Na)+M (I). Значение молярной массы каждого элемента можно вычислить по таблице, а можно с помощью онлайн-калькулятора на сайте : M (NaI)=M (Na)+M (I)=23+127=150 (г/моль).
- Из общей формулы M (NaI)=m (NaI)/v (NaI) => m (NaI)=v (NaI)*M (NaI)= 0,6 моль*150 г/моль=90 грамм.
Масса йодида натрия (NaI) с массовой долей вещества 0,6 моль составляет 90 грамм.
Нахождение массы вещества по его массовой доле в растворе. Формула массовой доли вещества ω=*100%, где ω – массовая доля вещества, а m (вещества) и m (раствора) – массы, измеряемые в граммах, килограммах. Общая доля раствора всегда принимается за 100%, иначе будут погрешности в вычислении. Несложно из формулы массовой доли вещества вывести формулу массы вещества: m (вещества)=[ω*m (раствора)] /100%. Однако есть некоторые особенности изменения состава раствора, которые нужно учитывать при решении задач на эту тему:
- Разбавление раствора водой. Масса вещества растворенного X не изменяется m (X)=m’(X). Масса раствора увеличивается на массу добавленной воды m’ (р)=m (р)+m (H 2 O).
- Выпаривание воды из раствора. Масса растворенного вещества X не изменяется m (X)=m’ (X). Масса раствора уменьшается на массу выпаренной воды m’ (р)=m (р)-m (H 2 O).
- Сливание двух растворов. Массы растворов, а также массы растворенного вещества X при смешивании складываются: m’’ (X)=m (X)+m’ (X). m’’ (р)=m (р)+m’ (р).
- Выпадение кристаллов. Массы растворенного вещества X и раствора уменьшаются на массу выпавших кристаллов: m’ (X)=m (X)-m (осадка), m’ (р)=m (р)-m (осадка).
Алгоритм нахождения массы продукта реакции (вещества), если известен выход продукта реакции. Выход продукта находится по формуле η=*100%, где m (x практическая) – масса продукта х, которая получена в результате практического процесса реакции, m (x теоретическая) – рассчитанная масса вещества х. Отсюда m (x практическая)=[η*m (x теоретическая)]/100% и m (x теоретическая)=/η. Теоретическая масса получаемого продукта всегда больше практической, в связи с погрешностью реакции, и составляет 100%. Если в задаче не дается масса продукта, полученного в практической реакции, значит, она принимается за абсолютную и равна 100%.
Варианты нахождение массы вещества – небесполезный курс школьного обучения, а вполне применяемые на практике способы. Каждый сможет без труда найти массу необходимого вещества, применяя вышеперечисленные формулы и пользуясь предлагаемыми таблицами. Для облегчения задания прописывайте все реакции, их коэффициенты.
Три варианта задач: 1.Даны массы исходного вещества и продукта реакции. Определить выход продукта реакции. 2.Даны массы исходного вещества и выход продукта реакции. Определить массу продукта. 3.Даны массы продукта и выход продукта. Определить массу исходного вещества.
Дано: m(ZnO) = 32,4 г m пр (Zn) = 24 г Найти: ω вых (Zn) — ? Решение: 3ZnO + 2Al = 3Zn + Al 2 O 3 3 моль Прочитаем задачу, запишем условие (дано, найти),составим уравнение реакции (поставим коэффициенты), подчеркнем, что дано в задаче, что нужно найти, под подчеркнутыми веществами запишем их количество вещества по уравнению (моль) При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.
Дано: m(ZnO) = 32,4 г m пр (Zn) = 24 г Найти: ω вых (Zn) — ? М(ZnO)=81г/моль Решение: 0,4 моль х 3ZnO + 2Al = 3Zn + Al 2 O 3 3 моль Найдем количество вещества ZnO по формуле: =m/М. Подпишем его количество вещества над ним в уравнении. Над Zn подпишем х. Найдем х составив и решив пропорцию. (ZnО)=32,4/81 = 0,4 моль 0,4/3 = х/3 х = 0,4 моль – это теоретическое количество вещества найденное по уравнению
Дано: m(ZnO) = 32,4 г m пр (Zn) = 24 г Найти: ω вых (Zn) — ? М(ZnO)=81г/моль М(Zn)=65 г/моль Решение: 0,4 моль х 3ZnO + 2Al = 3Zn + Al 2 O 3 3 моль Переведем полученное количество вещества Zn в массу по формуле: m = M m(Zn) =0,4 моль × 65 г/моль = 26 г – это теоретическая масса Zn. В задаче в условии дана практическая масса 24 г. Теперь найдем долю выхода продукта от теоретического возможного. ω вых = = = 0, 92 (или 92%) m пр (Zn) m теор (Zn) 24 г 26 г Ответ: ω вых = 92 %
Дано: m (Al(OH) 3)= 23,4 г ω вых (Al 2 O 3) = 92% Найти: m пр (Al 2 O 3) — ? М(Al(OH) 3)= 78 г/моль Решение: 0,3 моль х 2Al(OH) 3 = Al 2 O 3 +3H 2 O 2 моль 1 моль Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного. М(Al 2 O 3) = 102 г/моль (Al(OH) 3)= 23,4 г/78 г/моль = 0,3 моль 0,3/2 = х/1 х = 0,15 моль m теор. (Al 2 O 3) = n M = 0,15 моль 102 г/моль = 15,3 г m пр. (Al 2 O 3) = 15,3 г× 0,92 = 14 г Ответ: m пр. (Al 2 O 3) = 14 г
При действии оксида углерода (II) на оксид железа (III) получено железо массой 11,2 г. Найдите массу использованного оксида железа (III), учитывая, что доля выхода продуктов реакции составляет 80% от теоретически возможного. Дано: m пр (Fe) = 11,2 г ω вых (Fe) = 80% Найти: M (Fe 2 O 3) — ? Решение: Fe 2 O 3 + 3CO = 2Fe + 3CO 2 1 моль 2 моль m теор = = =14 г m пр (Fe) ω вых (Fe) 11,2 г 0, 8
Дано: m пр (Fe) = 11,2 г ω вых (Fe) = 80% Найти: m(Fe 2 O 3) — ? M (Fe) = 56 г/моль М (Fe 2 O 3) =160 г/моль Решение: х 0,25 моль Fe 2 O 3 + 3CO = 2Fe + 3CO 2 1 моль 2 моль Найденную теоретическую массу железа переведем в количество вещества по формуле: = m/М ((Fe) = 14 г /56 г/моль = 0,25 моль Напишем это количество железа над ним в уравнении, над оксидом напишем х. Решим пропорцию: х/1 = 0,25/2, х = 0,125 моль Теперь переведем в массу по формуле: m = ×М m(Fe 2 O 3) = 0,125 моль × 160 г/моль = 20 г Ответ: m(Fe 2 O 3) = 20 г
Задачи для самостоятельного решения 1.Для получения осадка сульфата бария была взята серная кислота массой 490 г. Массовая доля выхода соли от теоретически возможного составила 60 %. Какова масса полученного сульфата бария? 2.Вычислить выход нитрата аммония в % от теоретически возможного, если при пропускании 85 г аммиака через раствор азотной кислоты, было получено 380 г соли 3.В результате каталитического окисления оксида серы (IV) массой 16 кг избытком кислорода образуется оксид серы (VI). Вычислите массу продукта реакции, если доля его выхода 80% от теоретически возможного. 4.Вычислите массу азотной кислоты, которую можно получить из 17 г нитрата натрия при его взаимодействии с концентрированной серной кислотой, если массовая доля выхода кислоты составляет 0,96. 5.На гашёную известь, взятую в необходимом количестве, подействовали 3,15 кг чистой азотной кислотой. Какую массу нитрата кальция получили, если практический выход в массовых долях составляет 0,98 или 98% по сравнению с теоретическим?
Определение
массовой или объемной доли выхода продукта реакции от теоретически
возможного
Количественную
оценку выхода продукта реакции от теоретически возможного выражают в долях
единицы или в процентах и рассчитывают по формулам:
M
практ
/
m
теорет
;
M
практ
/
m
теорет
*100
%,
где (этта)-
массовая доля выхода продукта реакции от теоретически возможного;
V
практ
/
V
теорет
;
V
практ
/
V
теорет
* 100
%,
где (фи) — объемная доля выхода продукта реакции от теоретически
возможного.
Пример
1.
При
восстановлении водородом оксида меди(II) массой 96 гполучена медь массой 56,4 г. Сколько это
составит оттеоретически возможного
выхода?
Решение:
1.Записываем
уравнение химической реакции:
CuO
+
H
2
=
Cu
+
Н 2 О
1
моль1 моль
2.
Вычисляем химическое количество оксида меди (II
):
М(С
u
О) =
80г/моль,
n
(CuO
) = 96/80
= 1,2 (моль).
3.
Вычисляем теоретический выход меди: исходя из уравнения реакции,
n
(Cu
) =
n
(CuO
) = 1,2
моль,
m
(С
u
) = 1,2 ·
64 = 76,8 (г),
т. к.
М(С
u
) = 64
г/моль
4.Вычисляем массовую долю выхода меди по
сравнению с теоретически возможным: = 56.4/76.8= 0,73 или 73 %
Ответ: 73 %
Пример 2.
Сколько йода может быть
получено при действии хлора найодид калия массой 132,8 кг, если потеривпроизводстве составляют 4 %?
Решение:
1.Записываем
уравнение реакции:
2KI
+ Cl 2 = 2KCl + I 2
2
кмоль
1
кмоль
2.
Вычисляем химическое количество йодида калия:
М(К
I
) = 166
кг/кмоль,
n
(К
I
) = 132.8/166= 0,8
(кмоль).
2.
Определяем теоретический
выход йода: исходя из уравнения реакции,
n(I 2)=
1/2n(KI) = 0,4
моль
,
М
(I 2)=
254
кг
/
кмоль
.
Откуда,
m
(I
2
) = 0,4
*
254 = 101,6 (кг).
3.
Определяем массовую долю
практического выхода йода:
=(100 — 4) = 96 % или0,96
4.
Определяем массу йода,
практически полученного:
m
(I
2
)= 101,6 * 0,96 = 97,54 (кг).
Ответ:97,54 кг йода
Пример 3.
При сжигании 33,6
дм 3 аммиака получен азот объемом 15 дм 3 . Вычислите
объемную долю выхода азота в % от теоретически возможного.
Решение:
1. Записываем уравнение
реакции:
4
NH
3
+ 3
O
2
= 2
N
2
+ 6
H
2
O
4 моль2 моль
2. Вычисляем теоретический
выход азота:согласно закону Гей
–Люссака
при сжигании 4
дм 3 аммиака получается 2 дм 3 азота,
а
при сжигании 33,6
дм 3 получаетсях дм 3 азота
х = 33.
6*2/4
= 16,8
(дм 3).
3.
Вычисляем объемную долю
выхода азота от теоретически возможного:
15/16.8
=0,89 или 89
%
Ответ:89 %
Пример 4.
Какая
массааммиака необходима для
получения 5 т азотной кислоты с массовой долей кислоты 60 %, считая, что потери
аммиака в производстве составляют 2,8 %?
Решение:
1.
Записываем уравнения реакций, лежащих в основе производства азотной
кислоты:
4NH 3
+ 5 O 2 = 4NO + 6H 2 O
2NO
+ O 2 = 2NO 2
4NO 2
+ O 2 + 2H 2 O = 4HNO 3
2. Исходя
из уравнений реакций видим, что из 4 моль аммиака получается
4 моль
азотной кислоты.Получаем
схему:
NH
3
HNO
3
1
тмоль1тмоль
3.Вычисляем
массуи химическое количество
азотной кислоты, которая необходима для получения 5 траствора с массовой долей кислоты 60
%:
m
(в-ва) =
m
(р-ра) *
w
(в-ва),
m
(HNO
3
)= 5 * 0,6 = 3 (т),
4.
Вычисляем
химическое количество кислоты:
n
(HNO
3
) = 3/63
= 0,048 (тмоль),
т. к. М(HNO
3
) = 63
г/моль.
5.
Исходя из
составленной схемы:
n
(NH
3
) = 0,048
тмоль,
а
m
(NH
3
) = 0,048
· 17 = 0,82 (т),
т. к. М(NH
3
) = 17
г/моль.
Но такое количество аммиака должно
вступить в реакцию, если не учитывать потери аммиака в
производстве.
6.
Вычисляем
массу аммиака с учетом потерь: примем массу аммиака, участвующего в реакции —
0,82 т- за97,2 %,
Избыток и недостаток реагентов
Далеко не всегда берут пропорциональные количества и массы реагирующих веществ. Часто один из реагентов для реакции берется с избытком
, а другой – с недостатком
. Очевидно, если в реакции 2Н 2 + О 2 = 2Н 2 О
для получения 2 моль Н 2 О
взять не 1 моль О 2
и 2 моль Н 2
, а 2 моль Н 2
и 2 моль О 2
, то 1 моль О 2
реагировать не будет и останется в избытке.
Определение реагента, взятого в избытке (например, В), проводят по неравенствам: n A / a , где n общ.В
– общее (взятое в избытке) количество вещества, n B
– необходимое для реакции количество вещества, т.е. стехиометрическое
, и n изб.В
– избыточное (не реагирующее) количество вещества В
, причем n общ.В = n B + n изб.В.
Вследствие того что избыточное количество реагента В
реагировать не будет, расчет получаемых количеств продуктов необходимо проводить только по количеству реагента
, взятого в недостатке.
Практический выход продукта
Теоретическим количеством
n теор.
называется количество продукта реакции, которое получается в соответствии с расчетом по уравнению реакции. Однако в конкретных условиях проведения реакции может произойти то, что продукта образуется меньше, чем ожидалось по результатам уравнения реакции; назовем эту величину практическим количеством n пр.
Практическим выходом продукта
называется отношение практического количества продукта В
(полученного реально) к теоретическому (рассчитанному по уравнению реакции). Практический выход продукта обозначается как ŋ В
: ŋ В = n пр.В /n теор.В
(аналогичный вид имеют выражения для массы любого продукта и объема газообразного продукта).
Практический выход продукта представлен долей от единицы или от 100 %.
На практике чаще всего ŋ В из-за того что n пр. Если в идеальных условиях n пр. = n теор,
то выход становится полным, то есть ŋ В = 1 (100 %)
; он часто называется теоретическим выходом.
Массовая доля вещества в смеси. Степень чистоты вещества
Чаще для проведения реакций берут не индивидуальные вещества, а их смеси, в том числе и природные – минералы и руды.
Содержание каждого вещества в смеси выражается посредством его массовой доли.
Отношение массы вещества (m B
) к массе смеси (m см
) получило название массовой доли вещества В (w В) в смеси: w В = m B /m см.
Массовая доля вещества в смеси – это доля от единицы или от 100 %.
Сумма массовых долей всех веществ смеси равна 1 (100 %).
В смеси мы сталкиваемся с двумя видами веществ – основным веществом
и примесями
. Основным веществом
называют вещество (В), которое в смеси находится в преобладающем количестве; все остальные вещества называются примесями
, а величину w В
считают степенью чистоты основного вещества.
Например, природный карбонат кальция
– известняк
– может содержать 82 % CaCO 3 .
Иными словами, 82 %
равна степень чистоты известняка по CaCO 3 .
На различные примеси (песок, силикаты и др.)
приходится остаток в 18 %.
В полезных ископаемых, рудах, минералах, горных породах, т.е. в природных соединениях, и в продуктах промышленного производства примеси содержатся всегда.
Степень очистки химических реагентов может быть разной. По уменьшению процентного содержания примесей качественно различают следующие типы реактивов: «чистые», «технические», «химически чистые», «чистые для анализа», «особо чистые».
Например, 99, 999 %
основного вещества (H 2 SO 4)
содержит «химически чистая» серная кислота
. Следовательно, в серной кислоте лишь 0,001 % примесей.
сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ
Задача 1.
Через известковую воду, содержащую 3,7 г гидроксида кальция, пропустили углекислый газ. Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного.
Дано:
I способ.
Определим количества приведенных в условии задачи веществ:
v = m /
M = 3,7 г /
74 г/моль = 0,05 моль;
v = 0,05 моль
v(CaCO 3
) = m(CaCO 3
) /
M(CaCO 3
) = 4,75 г /
100 г/моль = 0,0475 моль;
v(CaCO 3
) = 0,0475 моль
Запишем уравнение химической реакции:
Ca(OH) 2
Из уравнения химической реакции следует, что из 1 моль Ca(OH) 2
образуется 1 моль CaCO 3
, а значит, из 0,05 моль Ca(OH) 2
теоретически должно получиться столько же, то есть 0,05 моль CaCO 3
. Практически же получено 0,0475 моль CaCO 3
, что составит:
w вых.
(CaCO 3
) = 0,0475 моль *
100 % /
0,05 моль = 95 %
w вых.
(CaCO 3
) = 95 %
II способ.
Принимаем во внимание массу исходного вещества (гидроксида кальция) и уравнение химической реакции:
Ca(OH) 2
Рассчитаем по уравнению реакции, сколько теоретически образуется карбоната кальция.
Из 74 г Ca(OH) 2
Отсюда х = 3,7 г
*
100 г
/
74 г = 5 г, m(CaCO
3
) = 5 г
Это означает, что из данных по условию задачи 3,7 г гидроксида кальция теоретически (из расчётов) можно было бы получить 5 г карбоната кальция, а практически получено лишь 4,75 г продукта реакции. Из этих данных определим выход карбоната кальция (в %) от теоретически возможного:
5 г CaCO 3
составляют 100% — ный выход
4,75 г CaCO 3
составляют х %
x = 4,75 моль
*
100 %
/
5 г = 95 % ;
w
вых.
(CaCO
3
) = 95 %
Ответ: выход карбоната кальция составляет 95 % от теоретически возможного.
Задача 2.
При взаимодействии магния массой 36 г с избытком хлора получено 128,25 г хлорида магния. Определить выход продукта реакции в процентах от теоретически возможного.
Дано:
Рассмотрим два способа решения этой задачи: с использованием величины количества вещества
и массы вещества
.
I способ.
Из данных по условию задачи значений масс магния и хлорида магния рассчитаем значения количества этих веществ:
v(Mg) = m(Mg) /
M(Mg) = 36 г /
24 г/моль = 1,5 моль; v(Mg) = 1,5 моль
v(MgCl 2
) = m(MgCl 2
)/
M(MgCl 2
) = 128,25 г /
95 г/моль = 1,35 моль;
v(MgCl 2
) = 1,35 моль
Составим уравнение химической реакции:
Mg
Воспользуемся уравнением химической реакции. Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
1,5 моль MgCl 2
х = 1,35 моль * 100%
/
1,5 моль = 90%, т.е. w
вых.
(MgCl
2
) = 90%
II способ.
Рассмотрим уравнение химической реакции:
Mg
В первую очередь по уравнению химической реакции определим, сколько граммов хлорида магния можно получить из данных по условию задачи 36 г магния.
Из 24 г Mg 2
Отсюда х = 36 г * 95 г
/
24 г = 142,5 г; m(MgCl
2
) = 142,5 г
Это означает, что из данного количества магния можно было бы получить 142,5 г хлорида магния (теоретический выход, составляющий 100%). А получено всего 128,25 г хлорида магния (практический выход).
Рассмотрим теперь, сколько процентов составляет практический выход от теоретически возможного:
142,5 г MgCl 2
х = 128,25 г * 100 %
/
142,5 г = 90 %, то есть
w
вых.
(MgCl
2
) = 90%
Ответ: выход хлорида магния составляет 90% от теоретически возможного.
Задача 3.
Металлический калий массой 3,9 г поместили в дистиллированную воду объемом 50 мл. В результате реакции получили 53,8 г раствора едкого кали с массовой долей вещества равной 10%. Вычислить выход едкого кали (в процентах) от теоретически возможного.
Дано:
2K
На основе этого уравнения химической реакции сделаем расчёты.
Вначале определим массу едкого кали, которую теоретически можно было бы получить из данной по условию задачи массы калия.
Из 78 г К
Отсюда: x = 3,9 г *
112 г /
78 г = 5,6 г m(KOH) = 5,6 г
Из этой формулы выражаем m в-ва:
m в-ва = m р-ра *
w в-ва /
100%
Определим массу едкого кали, находящегося в 53,8 г 10% -ного его раствора:
m(KOH) = m р-ра *
w(KOH) /
100% = 53,8 г *
10% /
100% = 5,38 г
m(KOH) = 5,38 г
Наконец, рассчитываем выход едкого кали в процентах от теоретически возможного:
w вых. (КОН) = 5,38 г /
5,6 г *
100% = 96%
w
вых.
(КОН) = 96%
Ответ: Выход едкого кали составляет 96% от теоретически возможного.
12.9: Теоретическая доходность и процентная доходность
Мир фармацевтического производства дорог. Многие лекарства проходят несколько этапов синтеза и используют дорогостоящие химические вещества. Большое количество исследований проводится с целью разработки более эффективных способов более быстрого и эффективного производства лекарств. Анализ того, сколько соединения образуется в той или иной реакции, является важной частью контроля затрат.
Процентная доходность
Химические реакции в реальном мире не всегда протекают так, как запланировано на бумаге.В ходе эксперимента многие факторы будут способствовать образованию меньшего количества продукта, чем можно было бы прогнозировать. Помимо разливов и других экспериментальных ошибок, часто бывают потери из-за неполной реакции, нежелательных побочных реакций и т. Д. Химикам необходимо измерение, показывающее, насколько успешной была реакция. Это измерение называется процентной доходностью.
Чтобы вычислить процентный выход, сначала необходимо определить, какое количество продукта должно образоваться на основе стехиометрии.Это называется теоретическим выходом , максимальным количеством продукта, которое может быть образовано из данного количества реагентов. Фактический выход — это количество продукта, которое фактически образуется при проведении реакции в лаборатории. Доходность процентов — это отношение фактической доходности к теоретической доходности, выраженное в процентах:
\ [\ text {Процентная доходность} = \ frac {\ text {Фактическая доходность}} {\ text {Теоретическая доходность}} \ times 100 \% \]
Процентный доход очень важен при производстве продукции.Много времени и денег уходит на повышение процента выхода химического производства. Когда сложные химические вещества синтезируются с помощью множества различных реакций, одна стадия с низким процентным выходом может быстро привести к большим потерям реагентов и ненужным расходам.
Обычно процентная доходность по понятным причинам меньше \ (100 \% \) по причинам, указанным ранее. Однако процентные выходы, превышающие \ (100 \% \), возможны, если измеренный продукт реакции содержит примеси, из-за которых его масса будет больше, чем она была бы на самом деле, если бы продукт был чистым.Когда химик синтезирует желаемое химическое вещество, он или она всегда старается очистить продукты реакции.
Пример \ (\ PageIndex {1} \)
Хлорат калия разлагается при небольшом нагревании в присутствии катализатора в соответствии с реакцией, описанной ниже.
\ [2 \ ce {KClO_3} \ left (s \ right) \ rightarrow 2 \ ce {KCl} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \]
В одном эксперименте \ (40.0 \: \ text {g} \: \ ce {KClO_3} \) нагревают до полного разложения.Каков теоретический выход газообразного кислорода? Эксперимент проводится, кислород собирается, его масса равна \ (14.9 \: \ text {g} \). Каков процент выхода реакции?
Решение
Сначала мы рассчитаем теоретический выход на основе стехиометрии.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- Дано: Масса \ (\ ce {KClO_3} = 40.0 \: \ text {g} \)
- Молярная масса \ (\ ce {KClO_3} = 122,55 \: \ text {g / mol} \)
- Молярная масса \ (\ ce {O_2} = 32,00 \: \ text {g / mol} \)
Неизвестно
- Теоретический выход \ (\ ce {O_2} =? \: \ Text {g} \)
Примените стехиометрию для перевода массы реагента в массу продукта:
\ [\ text {g} \: \ ce {KClO_3} \ rightarrow \ text {mol} \: \ ce {KClO_3} \ rightarrow \ text {mol} \: \ ce {O_2} \ rightarrow \ text {g} \: \ ce {O_2} \ nonumber \]
Шаг 2: Решить.
\ [40.0 \: \ text {g} \: \ ce {KClO_3} \ times \ frac {1 \: \ text {mol} \: \ ce {KClO_3}} {122.55 \: \ text {g} \: \ ce {KClO_3}} \ times \ frac {3 \: \ text {mol} \: \ ce {O_2}} {2 \: \ text {mol} \: \ ce {KClO_3}} \ times \ frac {32,00 \: \ text {g} \: \ ce {O_2}} {1 \: \ text {mol} \: \ ce {O_2}} = 15.7 \: \ text {g} \: \ ce {O_2} \ nonumber \]
Теоретическая доходность \ (\ ce {O_2} \) составляет \ (15.7 \: \ text {g} \).
Шаг 3. Подумайте о своем результате.
Масса газообразного кислорода должна быть меньше \ (40.0 \: \ text {g} \) хлората калия, который разложился.
Теперь мы будем использовать фактическую и теоретическую доходность для расчета процентной доходности.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- Фактический урожай \ (= 14,9 \: \ text {g} \)
- Теоретическая доходность \ (= 15.7 \: \ text {g} \)
Неизвестно
\ [\ text {Процентная доходность} = \ frac {\ text {Фактическая доходность}} {\ text {Теоретическая доходность}} \ times 100 \% \ nonumber \]
Используйте приведенное выше уравнение процентной доходности.
Шаг 2: Решить.
\ [\ text {Percent Yield} = \ frac {14.9 \: \ text {g}} {15.7 \: \ text {g}} \ times 100 \% = 94.9 \% \ nonumber \]
Шаг 3. Подумайте о своем результате.
Поскольку фактическая доходность немного меньше теоретической, процентная доходность чуть меньше \ (100 \% \).
8.6: Ограничение реагента, теоретического выхода и процентного выхода от исходных масс реагентов
Мир фармацевтического производства дорог.Многие лекарства проходят несколько этапов синтеза и используют дорогостоящие химические вещества. Большое количество исследований проводится с целью разработки более эффективных способов более быстрого и эффективного производства лекарств. Изучение того, сколько соединения образуется в той или иной реакции, является важной частью контроля затрат.
Процентная доходность
Химические реакции в реальном мире не всегда протекают так, как запланировано на бумаге. В ходе эксперимента многие вещи будут способствовать образованию меньшего количества продукта, чем предполагалось.Помимо разливов и других экспериментальных ошибок, обычно бывают потери из-за неполной реакции, нежелательных побочных реакций и т. Д. Химикам необходимо измерение, показывающее, насколько успешной была реакция. Это измерение называется процентной доходностью.
Чтобы вычислить процентный выход, сначала необходимо определить, какое количество продукта должно образоваться на основе стехиометрии. Это называется теоретическим выходом , максимальным количеством продукта, которое может быть образовано из данного количества реагентов.Фактический выход — это количество продукта, которое фактически образуется при проведении реакции в лаборатории. Доходность процентов — это отношение фактической доходности к теоретической доходности, выраженное в процентах.
\ [\ text {Процентная доходность} = \ frac {\ text {Фактическая доходность}} {\ text {Теоретическая доходность}} \ times 100 \% \]
Процентный доход очень важен при производстве продукции. Много времени и денег уходит на повышение процента выхода химического производства.Когда сложные химические вещества синтезируются с помощью множества различных реакций, одна стадия с низким процентным выходом может быстро привести к большим потерям реагентов и ненужным расходам.
Обычно процентная доходность по понятным причинам меньше \ (100 \% \) по причинам, указанным ранее. Однако процентные выходы, превышающие \ (100 \% \), возможны, если измеренный продукт реакции содержит примеси, из-за которых его масса будет больше, чем она была бы на самом деле, если бы продукт был чистым. Когда химик синтезирует желаемое химическое вещество, он или она всегда старается очистить продукты реакции.Пример \ (\ PageIndex {1} \) иллюстрирует шаги для определения процентной доходности.
Пример \ (\ PageIndex {1} \): разложение хлората калия
Хлорат калия разлагается при небольшом нагревании в присутствии катализатора в соответствии с реакцией, приведенной ниже:
\ [2 \ ce {KClO_3} \ left (s \ right) \ rightarrow 2 \ ce {KCl} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \ nonumber \]
В одном эксперименте \ (40.0 \: \ text {g} \: \ ce {KClO_3} \) нагревают до полного разложения.Эксперимент проводится, кислород собирается, его масса равна \ (14.9 \: \ text {g} \).
- Каков теоретический выход газообразного кислорода?
- Каков процент выхода реакции?
Решение
а. Расчет теоретической доходности
Сначала мы рассчитаем теоретический выход на основе стехиометрии.
Шаг 1. Определите «данную» информацию и то, что проблема просит вас «найти».
Дано: Масса \ (\ ce {KClO_3} = 40,0 \: \ text {g} \)
Масса собранного O 2 = 14,9 г
Находка: теоретический выход, г O 2
Шаг 2: Составьте список других известных количеств и спланируйте проблему.
1 моль KClO 3 = 122,55 г / моль
1 моль O 2 -32,00 г / моль
Шаг 3: Примените стехиометрию для преобразования массы реагента в массу продукта:
Шаг 4: Решить.
\ [40.0 \: \ cancel {\ text {g} \: \ ce {KClO_3}} \ times \ frac {1 \: \ cancel {\ text {mol} \: \ ce {KClO_3}}} {122.55 \ : \ cancel {\ text {g} \: \ ce {KClO_3}}} \ times \ frac {3 \: \ cancel {\ text {mol} \: \ ce {O_2}}} {2 \: \ cancel { \ text {mol} \: \ ce {KClO_3}}} \ times \ frac {32.00 \: \ text {g} \: \ ce {O_2}} {1 \: \ cancel {\ text {mol} \: \ ce {O_2}}} = 15.7 \: \ text {g} \: \ ce {O_2} \ nonumber \]
Теоретический выход \ (\ ce {O_2} \) равен \ (15.7 \: \ text {g} \), 15. 6 7 g без округления.
Шаг 5. Подумайте о своем результате.
Масса газообразного кислорода должна быть меньше \ (40.0 \: \ text {g} \) хлората калия, который разложился.
г. Расчет процентной доходности
Теперь мы будем использовать фактическую и теоретическую доходность для расчета процентной доходности.
Шаг 1. Определите «данную» информацию и то, что проблема просит вас «найти».
Дано: Теоретическая доходность = 15. 6 7 г, используйте для расчета неокругленное число.
Фактический выход = 14,9 г
Находка: процентная доходность,% доходности
Шаг 2: Составьте список других известных количеств и спланируйте проблему.
Никаких других количеств не требуется.
Шаг 3: Используйте приведенное ниже уравнение процентной доходности.
\ (\ text {Процентная доходность} = \ frac {\ text {Фактическая доходность}} {\ text {Теоретическая доходность}} \ times 100 \% \)
Шаг 4: Решить.
\ (\ text {Процент доходности} = \ frac {14.9 \: \ text {g}} {15. \ underline {6} 7 \: \ text {g}} \ times 100 \% = 94.9 \% \)
Шаг 5. Подумайте о своем результате.
Поскольку фактическая доходность немного меньше теоретической, процентная доходность чуть меньше \ (100 \% \).
Пример \ (\ PageIndex {2} \): Окисление цинка
При взаимодействии 1,274 г сульфата меди с избытком металлического цинка было получено 0,392 г металлической меди в соответствии с уравнением:
\ (\ ce {CuSO4} (водн.) + \ Ce {Zn} (s) \ rightarrow \ ce {Cu} (s) + \ ce {ZnSO4} (водн.) \)
Какой процент доходности?
Решение
| Этапы решения проблем — метод продукта | Пример \ (\ PageIndex {1} \) |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти».» | Дано: 1,274 г CuSO4 Фактический выход = 0,392 г Cu Находка: процентная доходность |
| Перечислите другие известные количества. | 1 моль CuSO4 = 159,62 г / моль Поскольку количество продукта в граммах не требуется, необходима только молярная масса реагентов. |
| Выровняйте уравнение. | Химическое уравнение уже сбалансировано. Вычисленное уравнение обеспечивает отношение 1 моль CuSO4 к 1 моль Zn, 1 моль Cu к 1 моль ZnSO4. |
| Подготовьте концептуальную карту и используйте соответствующий коэффициент преобразования. | Предоставленная информация идентифицирует сульфат меди как ограничивающий реагент, поэтому теоретический выход (г Cu) определяется путем выполнения расчета масса-масса на основе начального количества CuSO 4 . |
| Отмените единицы и вычислите. | \ [\ mathrm {1.274 \: \ cancel {g \: Cu_SO_4} \ times \ dfrac {1 \: \ cancel {mol \: CuSO_4}} {159.62 \: \ cancel {g \: CuSO_4}} \ times \ dfrac {1 \: \ cancel {mol \: Cu}} {1 \: \ cancel {mol \: CuSO_4}} \ times \ dfrac {63.55 \: g \: Cu} {1 \: \ cancel {mol \: Cu}} = 0,5072 \: g \: Cu} \ nonumber \] Используя эту теоретическую доходность и предоставленное значение фактической доходности, рассчитанная процентная доходность составляет: \ [\ mathrm {процент \: yield = \ left (\ dfrac {фактический \: yield} {теоретический \: yield} \ right) \ times 100} \] \ [\ begin {align} |
| Подумайте о своем результате. | Поскольку фактический выход немного меньше теоретического, процентный выход чуть меньше \ (100 \% \). |
Упражнение \ (\ PageIndex {1} \)
Каков процентный выход реакции, в результате которой получается 12,5 г фреона CF 2 Cl 2 из 32.9 г CCl 4 и избыток HF?
\ [\ ce {CCl4 + 2HF \ rightarrow CF2Cl2 + 2HCl} \ nonumber \]
- Ответ
- 48,3%
4.4 Выходы реакций — Химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните концепции теоретического выхода и ограничения реагентов / реагентов.
- Определите теоретический выход реакции при указанных условиях.
- Рассчитайте процентный выход реакции.
Относительные количества реагентов и продуктов, представленные в сбалансированном химическом уравнении, часто называют стехиометрическими количествами . Во всех упражнениях предыдущего модуля использовались стехиометрические количества реагентов. Например, при расчете количества продукта, образованного из данного количества реагента, предполагалось, что любые другие требуемые реагенты были доступны в стехиометрических количествах (или больше).В этом модуле рассматриваются более реалистичные ситуации, в которых реагенты не присутствуют в стехиометрических количествах.
Рассмотрим другую аналогию с едой — приготовление жареных бутербродов с сыром (рис. 1):
[латекс] 1 \; \ text {кусок сыра} + 2 \; \ text {ломтики хлеба} \ longrightarrow 1 \; \ text {бутерброд} [/ латекс]
Стехиометрические количества ингредиентов сэндвича по этому рецепту представляют собой ломтики хлеба и сыра в соотношении 2: 1. Имея 28 ломтиков хлеба и 11 ломтиков сыра, можно приготовить 11 бутербродов по предоставленному рецепту, используя весь предоставленный сыр и оставив шесть ломтиков хлеба.В этом сценарии количество приготовленных бутербродов было , ограничено количеством ломтиков сыра, а количество ломтиков хлеба было предоставлено на сверх .
Рис. 1. Изготовление сэндвичей может проиллюстрировать концепции ограничения и избытка реагентов.
Теперь рассмотрим эту концепцию применительно к химическому процессу, реакции водорода с хлором с образованием хлористого водорода:
[латекс] \ text {H} _2 (s) + \ text {Cl} _2 (g) \ longrightarrow 2 \ text {HCl} (g) [/ latex]
Сбалансированное уравнение показывает реакцию водорода и хлора в стехиометрическом соотношении 1: 1.Если эти реагенты представлены в любых других количествах, один из реагентов почти всегда будет полностью израсходован, что ограничивает количество продукта, которое может образоваться. Это вещество является ограничивающим реагентом , а другое вещество — избыточным реагентом . Выявление ограничивающих и избыточных реагентов для данной ситуации требует вычисления молярных количеств каждого предоставленного реагента и сравнения их со стехиометрическими количествами, представленными в сбалансированном химическом уравнении.Например, представьте объединение 3 молей H 2 и 2 молей Cl 2 . Это представляет собой отношение водорода к хлору, присутствующего в реакции, 3: 2 (или 1,5: 1), что превышает стехиометрическое соотношение 1: 1. Следовательно, водород присутствует в избытке, а хлор является ограничивающим реагентом. На реакцию всего предоставленного хлора (2 моль) будет израсходовано 2 моль из 3 моль водорода, оставив 1 моль водорода непрореагировавшим.
Альтернативный подход к определению ограничивающего реагента включает сравнение количества продукта, ожидаемого для полной реакции каждого реагента.Количество каждого реагента используется для отдельного расчета количества продукта, которое могло бы образоваться в соответствии со стехиометрией реакции. Реагент, дающий меньшее количество продукта, является ограничивающим реагентом. В примере, приведенном в предыдущем абзаце, полная реакция водорода даст
[латекс] \ text {моль HCl} = 3 \; \ text {моль H} _2 \ times \ frac {2 \; \ text {моль HCl}} {1 \; \ text {моль H} _2} = 6 \; \ text {моль HCl} [/ латекс]
Полная реакция предоставленного хлора даст
[латекс] \ text {произведено моль HCl} = 2 \; \ text {моль Cl} _2 \ times \ frac {2 \; \ text {моль HCl}} {1 \; \ text {моль Cl} _2} = 4 \; \ text {моль HCl} [/ латекс]
Хлор будет полностью израсходован после того, как будет произведено 4 моля HCl.Поскольку было предоставлено достаточно водорода для получения 6 моль HCl, после завершения этой реакции останется непрореагировавший водород. Таким образом, хлор является ограничивающим реагентом, а водород — избыточным реагентом (рис. 2).
Рис. 2. Когда H 2 и Cl 2 объединяются в нестехиометрических количествах, один из этих реагентов ограничивает количество HCl, которое может быть произведено. На этой иллюстрации показана реакция, в которой водород присутствует в избытке, а хлор является ограничивающим реагентом.
Просмотрите это интерактивное моделирование, иллюстрирующее концепции ограничения и избытка реагентов.
Пример 1
Определение ограничивающего реагента
Нитрид кремния — это очень твердая, жаростойкая керамика, используемая в качестве компонента лопаток турбин в реактивных двигателях. Его готовят по следующему уравнению:
[латекс] 3 \ text {Si} (s) + 2 \ text {N} _2 (g) \ longrightarrow \ text {Si} _3 \ text {N} _4 (s) [/ latex]
Что является ограничивающим реагентом, когда 2.00 г Si и 1,50 г N 2 реагируют?
Раствор
Вычислите указанные молярные количества реагентов, а затем сравните эти количества со сбалансированным уравнением, чтобы определить ограничивающий реагент.
[латекс] \ text {mol Si} = 2,00 \; \ rule [0.5ex] {1.75em} {0.1ex} \ hspace {-1.75em} \ text {g Si} \ times \ frac {1 \; \ text {mol Si}} {28.09 \; \ rule [0.25ex] {1.25em} {0.1ex} \ hspace {-1.25em} \ text {g Si}} = 0,0712 \; \ text {mol Si} [/ латекс]
[латекс] \ text {mol N} _2 = 1.50 \; \ rule [0.5ex] {2em} {0.1ex} \ hspace {-2em} \ text {g N} _2 \ times \ frac {1 \; \ text {mol N} _2} {28.09 \ rule [ 0.25ex] {1.5em} {0.1ex} \ hspace {-1.5em} \; \ text {g N} _2} = 0,0535 \; \ text {mol N} _2 [/ latex]
Молярное соотношение Si: N 2 составляет:
[латекс] \ frac {0,0712 \; \ text {mol Si}} {0,0535 \; \ text {mol N} _2} = \ frac {1.33 \; \ text {mol Si}} {1 \ text {mol N } _2} [/ латекс]
Стехиометрическое соотношение Si: N 2 составляет:
[латекс] \ frac {3 \; \ text {mol Si}} {2 \; \ text {mol N} _2} = \ frac {1.5 \; \ text {mol Si}} {1 \; \ text {mol N} _2} [/ латекс]
Сравнение этих соотношений показывает, что Si присутствует в количестве меньше стехиометрического, как и ограничивающий реагент.
В качестве альтернативы вычислите количество продукта, ожидаемое для полной реакции каждого из предоставленных реагентов. 0,0712 моль кремния даст
моль.
[латекс] \ text {mol Si} _3 \ text {N} _4 \; \ text {producted} = 0,0712 \; \ text {mol Si} \ times \ frac {1 \; \ text {mol Si} _3 \ текст {N} _4} {3 \; \ text {mol Si}} = 0.0237 \; \ text {mol Si} _3 \ text {N} _4 [/ latex]
, в то время как 0,0535 моль азота даст
[латекс] \ text {mol Si} _3 \ text {N} _4 \; \ text {created} = 0,0535 \; \ text {mol N} _2 \ times \ frac {1 \; \ text {mol Si} _3 \ text {N} _4} {2 \; \ text {mol N} _2} = 0,0268 \; \ text {mol Si} _3 \ text {N} _4 [/ latex]
Поскольку кремний дает меньшее количество продукта, он является ограничивающим реагентом.
Проверьте свои знания
Какой ограничивающий реагент, когда 5,00 г H 2 и 10.0 г O 2 реагирует с образованием воды?
Количество продукта, которое может быть произведено в результате реакции в определенных условиях, как рассчитано на основе стехиометрии соответствующего сбалансированного химического уравнения, называется теоретическим выходом реакции. На практике количество полученного продукта называется фактическим выходом , и оно часто меньше теоретического выхода по ряду причин. Некоторые реакции по своей природе неэффективны и сопровождаются побочными реакциями, , которые приводят к образованию других продуктов.Другие по своей природе неполные (рассмотрим парциальные реакции слабых кислот и оснований, обсуждавшиеся ранее в этой главе). Некоторые продукты трудно собрать без потерь, поэтому неполное извлечение снизит фактический урожай. Степень, в которой достигается теоретический выход реакции, обычно выражается как выход процентов :
[латекс] \ text {процентная доходность} = \ frac {\ text {фактическая доходность}} {\ text {теоретическая доходность}} \ times 100 \% [/ latex]
Фактический и теоретический выходы могут быть выражены как массовые или молярные количества (или любое другое подходящее свойство; e.г., объем, если продукт — газ). Пока обе доходности выражаются в одних и тех же единицах, эти единицы отменяются при вычислении процентной доходности.
Пример 2
Расчет процентного выхода
При взаимодействии 1,274 г сульфата меди с избытком металлического цинка было получено 0,392 г металлической меди в соответствии с уравнением:
[латекс] \ text {CuSO} _4 (aq) + \ text {Zn} (s) \ longrightarrow \ text {Cu} (s) + \ text {ZnSO} _4 (aq) [/ latex]
Какой процент доходности?
Решение
Предоставленная информация идентифицирует сульфат меди как ограничивающий реагент, поэтому теоретический выход определяется с помощью подхода, проиллюстрированного в предыдущем модуле, как показано здесь:
[латекс] 1.274 \; \ rule [0.5ex] {3.75em} {0.1ex} \ hspace {-3.75em} \ text {g CuSO} _4 \ times \ frac {1 \; \ rule [0.25ex] {4em} {0.1 ex} \ hspace {-4em} \ text {mol CuSO} _4} {159.62 \; \ rule [0.25ex] {3em} {0.1ex} \ hspace {-3em} \ text {g CuSO} _4} \ times \ frac {1 \; \ rule [0.25ex] {2.5em} {0.1ex} \ hspace {-2.5em} \ text {mol Cu}} {1 \ rule [0.25ex] {3.5em} {0.1ex} \ hspace {-3.5em} \ text {mol CuSO} _4} \ times \ frac {63.55 \; \ text {g Cu}} {1 \; \ rule [0.25ex] {2.5em} {0.1ex} \ hspace { -2.5em} \ text {mol Cu}} = 0.5072 \; \ text {g Cu} [/ latex]
Используя эту теоретическую доходность и предоставленное значение фактической доходности, рассчитанная процентная доходность составляет
.
[латекс] \ text {процентный доход} = (\ frac {\ text {фактический доход}} {\ text {теоретический доход}}) \ умноженный на 100 [/ латекс]
[латекс] \ text {процентная доходность} = (\ frac {0.392 \; \ text {g Cu}} {0.5072 \; \ text {g Cu}}) \ times 100 [/ latex]
[латекс] = 77,3 \% [/ латекс]
Проверьте свои знания
Каков процентный выход реакции, в результате которой получается 12,5 г газа Фреон CF 2 Cl 2 из 32,9 г CCl 4 и избытка HF?
[латекс] \ text {CCl} _4 + 2 \ text {HF} \ longrightarrow \ text {CF} _2 \ text {Cl} _2 + 2 \ text {HCl} [/ latex]
Зеленая химия и атомная экономика
Целенаправленная разработка химических продуктов и процессов, сводящих к минимуму использование экологически опасных веществ и образование отходов, известна как зеленая химия .Зеленая химия — это философский подход, который применяется во многих областях науки и технологий, и его практика резюмируется руководящими принципами, известными как «Двенадцать принципов зеленой химии» (см. Подробности на этом веб-сайте). Один из 12 принципов направлен именно на максимальное повышение эффективности процессов синтеза химических продуктов. атомная экономия процесса является мерой этой эффективности, определяемой как процент по массе конечного продукта синтеза по отношению к массам всех используемых реагентов:
[латекс] \ text {atom economy} = \ frac {\ text {масса продукта}} {\ text {масса реагентов}} \ times 100 \% [/ latex]
Хотя определение атомной экономии на первый взгляд кажется очень похожим на определение процентного выхода, имейте в виду, что это свойство представляет собой разницу в теоретической эффективности различных химических процессов .С другой стороны, процентный выход данного химического процесса оценивает эффективность процесса путем сравнения выхода фактически полученного продукта с максимальным выходом, предсказанным стехиометрией.
Синтез распространенного безрецептурного обезболивающего, ибупрофена, хорошо иллюстрирует успех подхода зеленой химии (рис. 3). Впервые поступивший в продажу в начале 1960-х годов, ибупрофен был произведен с использованием шестистадийного синтеза, который требовал 514 г реагентов для получения каждого моля (206 г) ибупрофена, что составляет 40% атомной экономии.В 1990-х годах компанией BHC (ныне BASF Corporation) был разработан альтернативный процесс, который требует всего трех шагов и имеет атомную экономию ~ 80%, что почти вдвое больше, чем у исходного процесса. Процесс BHC производит значительно меньше химических отходов; использует менее опасные и перерабатываемые материалы; и обеспечивает значительную экономию средств для производителя (а, следовательно, и для потребителя). Признавая положительное воздействие процесса BHC на окружающую среду, в 1997 году компания получила награду Агентства по охране окружающей среды за экологически чистые синтетические пути.
Рис. 3. (a) Ибупрофен — популярное безрецептурное обезболивающее, обычно продаваемое в виде таблеток по 200 мг. (b) Процесс BHC для синтеза ибупрофена требует всего трех стадий и демонстрирует впечатляющую атомную экономию. (кредит а: модификация работы Деррика Кутзи)
Когда реакции проводятся с использованием количества реагентов меньше стехиометрического, количество образующегося продукта будет определяться ограничивающим реагентом. Количество продукта, образовавшегося в результате химической реакции, и есть его фактический выход.Этот выход часто меньше количества продукта, предсказываемого стехиометрией сбалансированного химического уравнения, представляющего реакцию (ее теоретический выход). Степень, в которой реакция дает теоретическое количество продукта, выражается как процент выхода продукта.
- [латекс] \ text {процентная доходность} = (\ frac {\ text {фактическая доходность}} {\ text {теоретическая доходность}}) \ раз 100 [/ латекс]
Химия: упражнения в конце главы
- В емкость помещается следующее количество: 1.5 × 10 24 атомов водорода, 1,0 моль серы и 88,0 г двухатомного кислорода.
(а) Какова общая масса в граммах всех трех элементов?
(б) Каково общее количество молей атомов у трех элементов?
(c) Если смесь трех элементов образовала соединение с молекулами, содержащими два атома водорода, один атом серы и четыре атома кислорода, какое вещество потребляется первым?
(d) Сколько атомов каждого оставшегося элемента осталось бы непрореагировавшим при изменении, описанном в (c)?
- Что является ограничивающим реагентом в реакции, при которой из 8 г натрия и 8 г двухатомного хлора образуется хлорид натрия?
- Какой из постулатов атомной теории Дальтона объясняет, почему мы можем рассчитать теоретический выход химической реакции?
- Студент выделил 25 г соединения, следуя процедуре, которая теоретически дала бы 81 г.Какова была его процентная доходность?
- Образец 0,53 г диоксида углерода получали путем нагревания 1,31 г карбоната кальция. Каков процент выхода этой реакции?
[латекс] \ text {CaCO} _3 (s) \ longrightarrow \ text {CaO} (s) + \ text {CO} _2 (s) [/ latex]
- Фреон-12, CCl 2 F 2 , получают из CCl 4 реакцией с HF. Другой продукт этой реакции — HCl. Обрисуйте шаги, необходимые для определения процентного выхода реакции, дающей 12.5 г CCl 2 F 2 из 32,9 г CCl 4 . Фреон-12 был запрещен и больше не используется в качестве хладагента, поскольку он катализирует разложение озона и имеет очень долгий срок службы в атмосфере. Определите процентную доходность.
- Лимонная кислота, C 6 H 8 O 7 , компонент джемов, желе и фруктовых безалкогольных напитков, производится промышленным способом путем ферментации сахарозы плесенью Aspergillus niger . Уравнение, представляющее эту реакцию, имеет вид
[латекс] \ text {C} _ {12} \ text {H} _ {22} \ text {O} _ {11} \; + \; \ text {H} _2 \ text {O} \; + 3 \ text {O} _2 \; {\ longrightarrow} \; 2 \ text {C} _6 \ text {H} _8 \ text {O} _7 \; + \; 4 \ text {H} _2 \ text {O } [/ латекс]
Какая масса лимонной кислоты производится из 1 метрической тонны (1.000 × 10 3 кг) сахарозы, если выход составляет 92,30%?
- Толуол, C 6 H 5 CH 3 , окисляется воздухом в тщательно контролируемых условиях до бензойной кислоты, C 6 H 5 CO 2 H, которая используется для приготовления пищевого консерванта бензоат натрия, C 6 H 5 CO 2 Na. Каков процент выхода реакции, в результате которой 1000 кг толуола превращаются в 1,21 кг бензойной кислоты?
[латекс] 2 \ text {C} _6 \ text {H} _5 \ text {CH} _3 \; + \; 3 \ text {O} _2 \; {\ longrightarrow} \; 2 \ text {C} _6 \ text {H} _5 \ text {CO} _2 \ text {H} \; + \; 2 \ text {H} _2 \ text {O} [/ latex]
- В лабораторном эксперименте реакция 3.0 моль H 2 с 2,0 моль I 2 дает 1,0 моль HI. Определите теоретический выход в граммах и процент выхода для этой реакции.
- Обрисуйте шаги, необходимые для решения следующей проблемы, затем выполните вычисления. Эфир (C 2 H 5 ) 2 O, который первоначально использовался в качестве анестетика, но был заменен более безопасными и более эффективными лекарствами, получают реакцией этанола с серной кислотой.
[латекс] 2 \ text {C} _2 \ text {H} _5 \ text {OH} \; + \; \ text {H} _2 \ text {SO} _4 \; {\ longrightarrow} \; (\ text {C} _2 \ text {H} _5) _2 \; + \; \ text {H} _2 \ text {SO} _4 {\ cdot} \ text {H} _2 \ text {O} [/ latex]
Каков процент выхода эфира, если 1.17 л (d = 0,7134 г / мл) выделяют из реакции 1,500 л C 2 H 5 OH
(d = 0,7894 г / мл)?
- Обрисуйте шаги, необходимые для определения ограничивающего реагента, когда 30,0 г пропана, C 3 H 8 , сжигается с 75,0 г кислорода.
Определите ограничивающий реагент.
- Обрисуйте шаги, необходимые для определения ограничивающего реагента, когда 0,50 моль Cr и 0,75 моль H 3 PO 4 вступают в реакцию согласно следующему химическому уравнению.
[латекс] 2 \ text {Cr} \; + \; 2 \ text {H} _3 \ text {PO} _4 \; {\ longrightarrow} \; 2 \ text {CrPO} _4 \; + \; 3 \ текст {H} _2 [/ latex]Определите ограничивающий реагент.
- Что является ограничивающим реагентом, когда 1,50 г лития и 1,50 г азота объединяются с образованием нитрида лития, компонента усовершенствованных батарей, в соответствии со следующим уравнением несбалансированного питания?
[латекс] \ text {Li} \; + \; \ text {N} _2 \; {\ longrightarrow} \; \ text {Li} _3 \ text {N} [/ latex] - Уран может быть выделен из руд путем растворения его в виде UO 2 (NO 3 ) 2 с последующим разделением его на твердый UO 2 (C 2 O 4 ) · 3H 2 О.Добавление 0,4031 г оксалата натрия, Na 2 C 2 O 4 , к раствору, содержащему 1,481 г нитрата уранила, UO 2 (NO 3 ) 2 , дает 1,073 г твердого вещества. UO 2 (C 2 O 4 ) · 3H 2 O.
[латекс] \ text {Na} _2 \ text {C} _2 \ text {O} _4 \; + \; \ text {UO} _2 (\ text {NO} _3) _2 \; + \; 3 \ text {H} _2 \ text {O} \; {\ longrightarrow} \; \ text {UO} _2 (\ text {C} _2 \ text {O} _4) {\ cdot} 3 \ text {H} _2 \ text {O} \; + \; 2 \ text {NaNO} _3 [/ латекс]
Определите ограничивающий реагент и процент выхода этой реакции.
- Сколько молекул C 2 H 4 Cl 2 можно получить из 15 молекул C 2 H 4 молекул и 8 молекул Cl 2 ?
- Сколько молекул подсластителя сахарина можно получить из 30 атомов C, 25 атомов H, 12 атомов O, 8 атомов S и 14 атомов N?
- Пятиокись фосфора, используемая для производства фосфорной кислоты для безалкогольных напитков кола, получают путем сжигания фосфора в кислороде.
(а) Каков ограничивающий реагент при 0.200 моль P 4 и 0,200 моль O 2 реагируют в соответствии с [латексом] \ text {P} _4 \; + \; 5 \ text {O} _2 \; {\ longrightarrow} \; \ text { P} _4 \ text {O} _ {10} [/ latex]
(b) Рассчитайте процентный выход, если из реакции выделено 10,0 г P 4 O 10 .
- Согласитесь ли вы купить 1 триллион (1 000 000 000 000) атомов золота за 5 долларов? Объясните, почему да или почему нет. Найдите текущую цену на золото на http://money.cnn.com/data/commodities/ (1 тройская унция = 31.1 г)
Глоссарий
- фактическая доходность
- количество продукта, образовавшегося в реакции
- избыток реагента
- реагент присутствует в количестве, превышающем требуемое по стехиометрии реакции
- ограничивающий реагент
- реагент присутствует в количестве ниже, чем требуется по стехиометрии реакции, что ограничивает количество образующегося продукта
- процентная доходность
- мера эффективности реакции, выраженная в процентах от теоретического выхода
- теоретический выход
- количество продукта, которое может быть получено из данного количества реагента (ов) в соответствии со стехиометрией реакции
Решения
Ответы на упражнения в конце главы по химии
2.Ограничивающий реагент — Cl 2 .
4. Процентная доходность = 31%
6. г CCl 4 моль CCl 4 моль CCl 2 F 2 г CCl 2 F 2 , выход в процентах = 48,3%
8. процентная доходность = 91,3%
10. Перевести массу этанола в моль этанола; соотнесите моль этанола с молями эфира, полученного с использованием стехиометрии сбалансированного уравнения. Перевести моль эфира в граммы; разделите фактические граммы эфира (определенные по плотности) на теоретическую массу, чтобы определить процентный выход; 87.6%
12. Требуется преобразование [latex] \ text {mol \; Cr} \; {\ longrightarrow} \; \ text {mol \; H} _3 \ text {PO} _4 [/ latex]. Затем сравните количество Cr с количеством присутствующей кислоты. Cr — ограничивающий реагент.
14. Na 2 C 2 O 4 — лимитирующий реагент. процентная доходность = 86,6%
16. Можно получить только четыре молекулы.
18. Эта сумма не может быть взвешена с помощью обычных остатков и не имеет ценности.
Определение процентной доходности
и формула
Процентный доход — это процентное отношение фактического урожая к теоретическому.Он рассчитывается как экспериментальный выход, деленный на теоретический выход, умноженный на 100%. Если фактическая и теоретическая доходность совпадают, процентная доходность составляет 100%. Обычно процентная доходность ниже 100%, потому что фактическая доходность часто меньше теоретического значения. Причины этого могут включать неполные или конкурирующие реакции и потерю образца во время восстановления. Процентный выход может превышать 100%, что означает, что в результате реакции было извлечено больше образца, чем прогнозировалось. Это может произойти, когда протекают другие реакции, которые также приводят к образованию продукта.Это также может быть источником ошибки, если избыток вызван неполным удалением воды или других примесей из образца. Процентная доходность — это всегда положительное значение.
Также известен как: процентная доходность
Формула процентной доходности
Уравнение процентной доходности:
процентная доходность = (фактическая доходность / теоретическая доходность) x 100%
Где:
- фактический выход — это количество продукта, полученного в результате химической реакции
- — это количество продукта, полученное из стехиометрического или сбалансированного уравнения с использованием ограничивающего реагента для определения продукта
Теоретический выход
Единицы измерения фактического и теоретического выхода должны быть одинаковыми (моль или грамм).
Пример расчета процентной доходности
Например, при разложении карбоната магния в эксперименте образуется 15 граммов оксида магния. Известно, что теоретический выход составляет 19 граммов. Каков процент выхода оксида магния?
MgCO 3 → MgO + CO 2
Расчет прост, если вы знаете фактическую и теоретическую урожайность. Все, что вам нужно сделать, это подставить значения в формулу:
процентная доходность = фактическая доходность / теоретическая доходность x 100%
процент выхода = 15 г / 19 г x 100%
процентная доходность = 79%
Обычно вам нужно рассчитать теоретическую доходность на основе сбалансированного уравнения.В этом уравнении молярное соотношение реагента и продукта составляет 1: 1, поэтому, если вы знаете количество реагента, вы знаете, что теоретический выход — это то же значение в молях (а не в граммах!). Вы берете количество граммов имеющегося у вас реагента, конвертируете его в моли, а затем используете это количество молей, чтобы узнать, сколько граммов продукта ожидать.
Расчет урожайности Учебное пособие по химии
Ключевые концепции
- Выход — это масса продукта, образовавшегося в результате химической реакции.
- Фактический выход — это масса продукта, образовавшегося в результате эксперимента или промышленного процесса.
- Теоретический выход — это масса продукта, рассчитанная на основе сбалансированного химического уравнения реакции.
- Доходность в процентах = (фактическая доходность ÷ теоретическая доходность) × 100
- Оптимальный выход — это максимально возможный выход, достигаемый для набора данных условий реакции.
- Для химической реакции, которая идет до завершения (1) :
фактическая доходность = теоретическая доходность
итак, процентная доходность = 100%
- Для химической реакции при равновесии (2) :
фактическая доходность <теоретическая доходность
итак, процентная доходность <100%
- Для химической реакции при равновесии фактический выход может зависеть от таких факторов, как:
⚛ температура
⚛ концентрация
⚛ давление и объем (газовые системы)
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Рабочий пример расчета процентной доходности: расчет процентной доходности
Вопрос: 112 г газообразного азота реагирует с газообразным водородом с образованием 40,8 г газообразного аммиака в соответствии с уравнением, приведенным ниже:
N 2 (г) + 3H 2 (г) ⇋ 2NH 3 (г)
Рассчитайте процентный выход аммиака.
Решение:
- Фактический выход — это масса аммиака, фактически производимая в ходе химической реакции.
Фактический выход аммиака (NH 3 ) = 40,8 г (указано в вопросе)
- Теоретический выход аммиака (NH 3 ) — это масса продукта, рассчитанная на основе вычисленного химического уравнения реакции.
Из сбалансированного химического уравнения мольное соотношение (стехиометрическое соотношение) N 2 : NH 3 составляет 1: 2.
, следовательно: моль NH 3 = 2 × моль N 2Если предположить, что ВСЕ доступный N 2 полностью вступает в реакцию, то максимальное количество NH 3 , которое может быть произведено, составляет:
моль NH 3 = 2 × (масса N 2 ÷ молярная масса N 2 ) = 2 × (112 ÷ [2 × 14]) = 2 × (112 ÷ 28) = 8 мольТеоретический выход NH 3 = расчетная масса NH 3
Прогнозируемая масса NH 3 = максимальная масса NH 3 , которая может быть произведена при условии, что ВСЕ N 2 полностью реагируют:
масса (NH 3 ) = моль (NH 3 ) × молярная масса (NH 3 )
расчетная масса NH 3 = 8 × (14 + 3 × 1) = 8 × 17 = 136 гТеоретический выход = расчетная масса = 136 г
- Процентный выход = ( фактический выход ÷ теоретический выход ) × 100
Подставляем значения фактического урожая и теоретического выхода в уравнение:
процентный выход NH 3 = ( 40.8 ÷ 136 ) × 100 = 30%
Рабочий пример расчета процентной доходности: расчет массы продукта на основе урожайности
Вопрос: Аммиак можно получить из газообразного водорода и газообразного азота в соответствии с приведенным ниже уравнением:
N 2 (г) + 3H 2 (г) ⇋ 2NH 3 (г)
Рассчитайте массу аммиака, если выход 168 г газообразного азота составляет 45%.
Решение:
- процентная доходность = (фактическая доходность ÷ теоретическая доходность) × 100
Процентная доходность = 45% (дано в вопросе)
процентный доход = (фактический доход ÷ теоретический доход) × 100 = 45% - Вычислите теоретический выход NH 3 (масса полученного NH 3 , как предсказано сбалансированным химическим уравнением реакции)
Из сбалансированного химического уравнения мольное соотношение (стехиометрическое соотношение) N 2 : NH 3 составляет 1: 2.
, следовательно, моль NH 3 = 2 × моль N 2Если предположить, что ВСЕ доступный N 2 полностью вступает в реакцию, то максимальное количество NH 3 , которое может быть произведено, составляет:
моль NH 3 = 2 × (масса N 2 ÷ молярная масса N 2 ) = 2 × (168 ÷ [2 × 14]) = 2 × (168 ÷ 28) = 12 мольтеоретический выход NH 3 = прогнозируемая масса NH 3
Прогнозируемая масса NH 3 = максимальная масса NH 3 , которая может быть произведена при условии, что ВСЕ N 2 полностью реагируют:
масса (NH 3 ) = моль (NH 3 ) × молярная масса (NH 3 )
расчетная масса NH 3 = моль NH 3 × молярная масса NH 3 = 12 × (14 + 3 × 1) = 12 × 17 = 204 г
теоретический выход NH 3 = расчетная масса NH 3 = 204 г - Рассчитайте фактическую доходность:
процентной доходности = (фактическая доходность ÷ теоретическая доходность) × 100
Изменение этого уравнения дает:
фактическая доходность = теоретическая доходность × ( процентная доходность ÷ 100)
Подставляя значения процентной и теоретической доходности в это уравнение:
фактический выход NH 3 = 204 × ( 45 ÷ 100) = 91.8 г
Факторы, влияющие на фактическую доходность
Принцип
Ле Шателье можно использовать для прогнозирования влияния изменений температуры, концентрации, давления и объема газа на фактический выход, как показано в таблице ниже:
| Фактор | Условия | Фактическая доходность | % Доходность |
|---|---|---|---|
| Увеличение концентрации реагента | прибавок | прибавок | |
| Уменьшение концентрации реагента | убавок | убавок | |
| Повышение температуры | экзотермическая реакция | убавок | убавок |
| эндотермическая реакция | прибавок | прибавок | |
| понижение температуры | экзотермическая реакция | прибавок | прибавок |
| эндотермическая реакция | убавок | убавок | |
| Повышение давления газа | моль реагента (газ) > моль продукта (газ) | прибавок | прибавок |
| моль реагента (газ) <моль продукта (газ) | убавок | убавок | |
| Падение давления газа | моль реагента (газ) > моль продукта (газ) | убавок | убавок |
| моль реагента (газ) <моль продукта (газ) | прибавок | прибавок | |
Обратите внимание, что если изменение системы равновесия приводит к увеличению фактического выхода продукта, то процент выхода этого продукта также должен увеличиваться.
Аналогичным образом, если изменение системы равновесия приводит к уменьшению фактического выхода продукта, то процентный выход этого продукта также должен уменьшиться.
Сноски:
(1) Завершающаяся реакция — это спонтанная необратимая реакция.
Стрелка, используемая для обозначения этого в химическом уравнении: →
(2) Равновесная реакция — обратимая реакция.
Стрелка, используемая для обозначения этого в химическом уравнении: ⇋
4.4 Выходы реакций | Химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните концепции теоретического выхода и ограничения реагентов / реагентов.
- Определите теоретический выход реакции при указанных условиях.
- Рассчитайте процентный выход реакции.
Относительные количества реагентов и продуктов, представленные в сбалансированном химическом уравнении, часто называют стехиометрическими количествами . Во всех упражнениях предыдущего модуля использовались стехиометрические количества реагентов. Например, при расчете количества продукта, образованного из данного количества реагента, предполагалось, что любые другие требуемые реагенты были доступны в стехиометрических количествах (или больше). В этом модуле рассматриваются более реалистичные ситуации, в которых реагенты не присутствуют в стехиометрических количествах.
Ограничивающий реагент
Рассмотрим другую аналогию с едой — приготовление жареных бутербродов с сыром (рис. 1):
[латекс] \ text {1 кусок сыра} + \ text {2 ломтика хлеба} \ rightarrow \ text {1 бутерброд} [/ латекс]
Стехиометрические количества ингредиентов сэндвича по этому рецепту представляют собой ломтики хлеба и сыра в соотношении 2: 1. Имея 28 ломтиков хлеба и 11 ломтиков сыра, можно приготовить 11 бутербродов по предоставленному рецепту, используя весь предоставленный сыр и оставив шесть ломтиков хлеба.В этом сценарии количество приготовленных бутербродов было , ограничено количеством ломтиков сыра, а количество ломтиков хлеба было предоставлено на сверх .
Рис. 1. Создание сэндвичей может проиллюстрировать концепции ограничения и избытка реагентов.
Теперь рассмотрим эту концепцию применительно к химическому процессу, реакции водорода с хлором с образованием хлористого водорода:
[латекс] {\ text {H}} _ {2} \ text {(} s \ text {)} + {\ text {Cl}} _ {2} \ text {(} g \ text {)} \ rightarrow \ text {2 HCl} \ text {(} g \ text {)}.[/ латекс]
Сбалансированное уравнение показывает реакцию водорода и хлора в стехиометрическом соотношении 1: 1. Если эти реагенты представлены в любых других количествах, один из реагентов почти всегда будет полностью израсходован, что ограничивает количество продукта, которое может образоваться. Это вещество является ограничивающим реагентом , а другое вещество — избыточным реагентом . Выявление ограничивающих и избыточных реагентов для данной ситуации требует вычисления молярных количеств каждого предоставленного реагента и сравнения их со стехиометрическими количествами, представленными в сбалансированном химическом уравнении.Например, представьте объединение 3 молей H 2 и 2 молей Cl 2 . Это представляет собой отношение водорода к хлору, присутствующего в реакции, 3: 2 (или 1,5: 1), что превышает стехиометрическое соотношение 1: 1. Следовательно, водород присутствует в избытке, а хлор является ограничивающим реагентом. На реакцию всего предоставленного хлора (2 моль) будет израсходовано 2 моль из 3 моль водорода, оставив 1 моль водорода непрореагировавшим.
Альтернативный подход к определению ограничивающего реагента включает сравнение количества продукта, ожидаемого для полной реакции каждого реагента.Количество каждого реагента используется для отдельного расчета количества продукта, которое могло бы образоваться в соответствии со стехиометрией реакции. Реагент, дающий меньшее количество продукта, является ограничивающим реагентом. В примере, приведенном в предыдущем абзаце, полная реакция водорода даст
[латекс] \ text {произведено моль HCl} = 3 \ text {моль H} _ {2} \ times \ frac {2 \ text {моль HCl}} {1 \ text {моль H} _ {2}} = \ text {6 моль HCl} [/ латекс]
Полная реакция предоставленного хлора даст
[латекс] \ text {произведено моль HCl} = 2 \ text {моль Cl} _ {2} \ times \ frac {\ text {2 моль HCl}} {\ text {1 моль Cl} _ {2}} = \ text {4 моль HCl} [/ латекс]
Хлор будет полностью израсходован после того, как будет произведено 4 моля HCl.Поскольку было предоставлено достаточно водорода для получения 6 моль HCl, после завершения этой реакции останется непрореагировавший водород. Таким образом, хлор является ограничивающим реагентом, а водород — избыточным реагентом (рис. 2).
Рис. 2. Когда H 2 и Cl 2 объединяются в нестехиометрических количествах, один из этих реагентов ограничивает количество HCl, которое может быть произведено. На этой иллюстрации показана реакция, в которой водород присутствует в избытке, а хлор является ограничивающим реагентом.
Просмотрите это интерактивное моделирование PhET, иллюстрирующее концепции ограничения и избытка реагентов.
Пример 1:
Определение ограничивающего реагента
Нитрид кремния — это очень твердая, жаростойкая керамика, используемая в качестве компонента лопаток турбин в реактивных двигателях. Его готовят по следующему уравнению:
[латекс] \ text {3Si} \ text {(} s \ text {)} + 2 {\ text {N}} _ {2} \ text {(} g \ text {)} \ rightarrow {\ text { Si}} _ {3} {\ text {N}} _ {4} \ text {(} s \ text {)} [/ latex]
Что является ограничивающим реагентом, когда 2.00 г Si и 1,50 г N 2 реагируют?
Покажи ответ
Вычислите указанные молярные количества реагентов, а затем сравните эти количества со сбалансированным уравнением, чтобы определить ограничивающий реагент.
[латекс] \ text {mol Si} = 2,00 \ cancel {\ text {g Si}} \ times \ frac {\ text {1 mol Si}} {28.09 \ cancel {\ text {g Si}}} = \ текст {0,0712 моль Si} [/ латекс]
[латекс] \ text {mol} {\ text {N}} _ {2} = 1.50 \ cancel {\ text {g} {\ text {N}} _ {2}} \ times \ frac {\ text { 1 моль} {\ text {N}} _ {2}} {28.09 \ cancel {\ text {g} {\ text {N}} _ {2}}} = \ text {0.0535 mol} {\ text {N}} _ {2} [/ latex]
Молярное соотношение Si: N 2 составляет:
[латекс] \ displaystyle \ frac {\ text {0,0712 моль Si}} {\ text {0,0535 моль} {\ text {N}} _ {2}} = \ frac {\ text {1,33 моль Si}} {\ текст {1 mol} {\ text {N}} _ {2}} [/ latex]
Стехиометрическое соотношение Si: N 2 составляет:
[латекс] \ displaystyle \ frac {\ text {3 mol Si}} {\ text {2 mol} {\ text {N}} _ {2}} = \ frac {\ text {1.5 mol Si}} {\ текст {1 mol} {\ text {N}} _ {2}} [/ latex]
Сравнение этих соотношений показывает, что Si присутствует в количестве меньше стехиометрического, как и ограничивающий реагент.
В качестве альтернативы вычислите количество продукта, ожидаемое для полной реакции каждого из предоставленных реагентов. 0,0712 моль кремния даст
моль.
[латекс] \ text {mol Si} _ {3} {\ text {N}} _ {4} \ text {created} = \ text {0,0712 mol Si} \ times \ frac {1 \ text {mol} { \ text {Si}} _ {3} {\ text {N}} _ {4}} {\ text {3 mol Si}} = 0,0237 \ text {mol} {\ text {Si}} _ {3} { \ text {N}} _ {4} [/ latex]
, в то время как 0,0535 моль азота даст
[латекс] \ text {mol} {\ text {Si}} _ {3} {\ text {N}} _ {4} \ text {producted} = \ text {0.0535 mol} {\ text {N}} _ {2} \ times \ frac {\ text {1 mol} {\ text {Si}} _ {3} {\ text {N}} _ {4}} {\ текст {2 моль} {\ text {N}} _ {2}} = \ text {0,0268 моль} {\ text {Si}} _ {3} {\ text {N}} _ {4} [/ latex]
Поскольку кремний дает меньшее количество продукта, он является ограничивающим реагентом.
Проверьте свои знания
Какой является ограничивающий реагент, когда 5,00 г H 2 и 10,0 г O 2 вступают в реакцию с образованием воды?
Процентная доходность
Количество продукта, которое может быть произведено в результате реакции в определенных условиях, как рассчитано на основе стехиометрии соответствующего сбалансированного химического уравнения, называется теоретическим выходом реакции.На практике количество полученного продукта называется фактическим выходом , и оно часто меньше теоретического выхода по ряду причин. Некоторые реакции по своей природе неэффективны и сопровождаются побочными реакциями, , которые приводят к образованию других продуктов. Другие по своей природе неполные (рассмотрим парциальные реакции слабых кислот и оснований, обсуждавшиеся ранее в этой главе). Некоторые продукты трудно собрать без потерь, поэтому неполное извлечение снизит фактический урожай.Степень, в которой достигается теоретический выход реакции, обычно выражается как выход процентов :
[латекс] \ text {процентная доходность} = \ frac {\ text {фактическая доходность}} {\ text {теоретическая доходность}} \ times 100 \% [/ latex]
Фактический и теоретический выходы могут быть выражены как массы или молярные количества (или любое другое подходящее свойство; например, объем, если продукт представляет собой газ). Пока обе доходности выражаются в одних и тех же единицах, эти единицы отменяются при вычислении процентной доходности.
Пример 2:
Расчет процентной доходности
При взаимодействии 1,274 г сульфата меди с избытком металлического цинка было получено 0,392 г металлической меди в соответствии с уравнением:
[латекс] {\ text {CuSO}} _ {4} \ text {(} aq \ text {)} + \ text {Zn} \ text {(} s \ text {)} \ rightarrow \ text {Cu} \ text {(} s \ text {)} + {\ text {ZnSO}} _ {4} \ text {(} aq \ text {)} [/ latex]
Какой процент доходности?
Покажи ответ
Предоставленная информация идентифицирует сульфат меди как ограничивающий реагент, поэтому теоретический выход определяется с помощью подхода, проиллюстрированного в предыдущем модуле, как показано здесь:
[латекс] 1.274 \ cancel {\ text {g} {\ text {CuSO}} _ {4}} \ times \ frac {1 \ cancel {\ text {mol} {\ text {CuSO}} _ {4}}} {159.62 \ cancel {\ text {g} {\ text {CuSO}} _ {4}}} \ times \ frac {1 \ cancel {\ text {mol Cu}}} {1 \ cancel {\ text {mol} {\ текст {CuSO}} _ {4}}} \ times \ frac {63.55 \ text {g Cu}} {1 \ cancel {\ text {mol Cu}}} = \ text {0,5072 г Cu} [/ латекс]
Используя эту теоретическую доходность и предоставленное значение фактической доходности, рассчитанная процентная доходность составляет
.
[латекс] \ text {процентная доходность} = \ left (\ frac {\ text {фактическая доходность}} {\ text {теоретическая доходность}} \ right) \ times 100 [/ latex]
[latex] \ begin {array } {c} \\ \ text {процентная доходность} = \ left (\ frac {\ text {0.392 г Cu}} {\ text {0,5072 г Cu}} \ right) \ times 100 \\ = 77,3 \% \ end {array} [/ latex]
Проверьте свои знания
Какой процентный выход реакции дает 12,5 г фреона CF 2 Cl 2 из 32,9 г CCl 4 и избытка HF?
[латекс] {\ text {CCl}} _ {4} +2 \ text {HF} \ rightarrow {\ text {CF}} _ {2} {\ text {Cl}} _ {2} +2 \ text {HCl} [/ латекс]
Зеленая химия и атомная экономика
Целенаправленная разработка химических продуктов и процессов, сводящих к минимуму использование экологически опасных веществ и образование отходов, известна как зеленая химия .Зеленая химия — это философский подход, который применяется во многих областях науки и технологий, и его практика резюмируется руководящими принципами, известными как «Двенадцать принципов зеленой химии» (см. Подробности на веб-сайте «Зеленая химия» Агентства по охране окружающей среды). Один из 12 принципов направлен именно на максимальное повышение эффективности процессов синтеза химических продуктов. атомная экономия процесса является мерой этой эффективности, определяемой как процент по массе конечного продукта синтеза по отношению к массам всех используемых реагентов:
[латекс] \ text {atom economy} = \ frac {\ text {масса продукта}} {\ text {масса реагентов}} \ times 100 \% [/ latex]
Хотя определение атомной экономии на первый взгляд кажется очень похожим на определение процентного выхода, имейте в виду, что это свойство представляет собой разницу в теоретической эффективности различных химических процессов .С другой стороны, процентный выход данного химического процесса оценивает эффективность процесса путем сравнения выхода фактически полученного продукта с максимальным выходом, предсказанным стехиометрией.
Синтез распространенного безрецептурного обезболивающего, ибупрофена, хорошо иллюстрирует успех подхода зеленой химии (рис. 3). Впервые поступивший в продажу в начале 1960-х годов, ибупрофен был произведен с использованием шестистадийного синтеза, который требовал 514 г реагентов для получения каждого моля (206 г) ибупрофена, что составляет 40% атомной экономии.В 1990-х годах компанией BHC (ныне BASF Corporation) был разработан альтернативный процесс, который требует всего трех шагов и имеет атомную экономию ~ 80%, что почти вдвое больше, чем у исходного процесса. Процесс BHC производит значительно меньше химических отходов; использует менее опасные и перерабатываемые материалы; и обеспечивает значительную экономию средств для производителя (а, следовательно, и для потребителя). Признавая положительное воздействие процесса BHC на окружающую среду, в 1997 году компания получила награду Агентства по охране окружающей среды за экологически чистые синтетические пути.
Рис. 3. (a) Ибупрофен — популярное безрецептурное обезболивающее, обычно продаваемое в виде таблеток по 200 мг. (b) Процесс BHC для синтеза ибупрофена требует всего трех стадий и демонстрирует впечатляющую атомную экономию. (кредит А: модификация работы Деррика Кутзи)
Ключевые концепции и резюме
Когда реакции проводятся с использованием количества реагентов меньше стехиометрического, количество образующегося продукта будет определяться ограничивающим реагентом.Количество продукта, образовавшегося в результате химической реакции, и есть его фактический выход. Этот выход часто меньше количества продукта, предсказываемого стехиометрией сбалансированного химического уравнения, представляющего реакцию (ее теоретический выход). Степень, в которой реакция дает теоретическое количество продукта, выражается как процент выхода продукта.
Ключевые уравнения
- [латекс] \ text {процентная доходность} = \ left (\ frac {\ text {фактическая доходность}} {\ text {теоретическая доходность}} \ right) \ times 100 [/ latex]
Упражнения
- В емкость помещается следующее количество: 1.5 × 10 24 атомов водорода, 1,0 моль серы и 88,0 г двухатомного кислорода.
- Какова общая масса в граммах для сбора всех трех элементов?
- Какое общее количество молей атомов у трех элементов?
- Если смесь трех элементов образовала соединение с молекулами, содержащими два атома водорода, один атом серы и четыре атома кислорода, какое вещество потребляется первым?
- Сколько атомов каждого оставшегося элемента осталось бы непрореагировавшим при изменении, описанном в (c)?
- Что является ограничивающим реагентом в реакции, при которой из 8 г натрия и 8 г двухатомного хлора образуется хлорид натрия?
- Какой из постулатов атомной теории Дальтона объясняет, почему мы можем рассчитать теоретический выход химической реакции?
- Студент выделил 25 г соединения, следуя процедуре, которая теоретически дала бы 81 г.Какова была его процентная доходность?
- Образец 0,53 г диоксида углерода получали путем нагревания 1,31 г карбоната кальция. Каков процент выхода этой реакции? [латекс] {\ text {CaCO}} _ {3} \ text {(} s \ text {)} \ rightarrow \ text {CaO} \ text {(} s \ text {)} + {\ text {CO} } _ {2} \ text {(} s \ text {)} [/ latex]
- Фреон-12, CCl 2 F 2 , получают из CCl 4 реакцией с HF. Другой продукт этой реакции — HCl. Обрисуйте шаги, необходимые для определения процентного выхода реакции, дающей 12.5 г CCl 2 F 2 из 32,9 г CCl 4 . Фреон-12 был запрещен и больше не используется в качестве хладагента, поскольку он катализирует разложение озона и имеет очень долгий срок службы в атмосфере. Определите процентную доходность.
- Лимонная кислота, C 6 H 8 O 7 , компонент джемов, желе и фруктовых безалкогольных напитков, производится промышленным способом путем ферментации сахарозы плесенью Aspergillus niger . Уравнение, представляющее эту реакцию: [латекс] {\ text {C}} _ {12} {\ text {H}} _ {22} {\ text {O}} _ {11} + {\ text {H}} _ {2} \ text {O} +3 {\ text {O}} _ {2} \ rightarrow 2 {\ text {C}} _ {6} {\ text {H}} _ {8} {\ text {O}} _ {7} +4 {\ text {H}} _ {2} \ text {O} [/ latex].Какую массу лимонной кислоты получают из 1 метрической тонны (1.000 × 10 3 кг) сахарозы, если выход составляет 92,30%?
- Толуол, C 6 H 5 CH 3 , окисляется воздухом в тщательно контролируемых условиях до бензойной кислоты, C 6 H 5 CO 2 H, которая используется для приготовления пищевого консерванта бензоат натрия, C 6 H 5 CO 2 Na. Каков процент выхода реакции, при которой 1.000 кг толуола на 1,21 кг бензойной кислоты? [латекс] 2 {\ text {C}} _ {6} {\ text {H}} _ {5} {\ text {CH}} _ {3} +3 {\ text {O}} _ {2} \ rightarrow 2 {\ text {C}} _ {6} {\ text {H}} _ {5} {\ text {CO}} _ {2} \ text {H} +2 {\ text {H}} _ {2} \ text {O} [/ latex]
- В лабораторном эксперименте реакция 3,0 моль H 2 с 2,0 моль I 2 дала 1,0 моль HI. Определите теоретический выход в граммах и процент выхода для этой реакции.
- Обрисуйте шаги, необходимые для решения следующей проблемы, затем выполните вычисления.Эфир (C 2 H 5 ) 2 O, который первоначально использовался в качестве анестетика, но был заменен более безопасными и более эффективными лекарствами, получают реакцией этанола с серной кислотой. [латекс] 2 {\ text {C}} _ {2} {\ text {H}} _ {5} \ text {OH} + {\ text {H}} _ {2} {\ text {SO}} _ {4} \ rightarrow {\ text {(} {\ text {C}} _ {2} {\ text {H}} _ {5} \ text {)}} _ {2} \ text {O} + {\ text {H}} _ {2} {\ text {SO}} _ {4} \ cdot {\ text {H}} _ {2} \ text {O} [/ latex] Каков процент выхода эфира, если 1,17 л (d = 0,7134 г / мл) выделяют из реакции 1.500 л C 2 H 5 OH (d = 0,7894 г / мл)?
- Обрисуйте шаги, необходимые для определения ограничивающего реагента, когда 30,0 г пропана, C 3 H 8 , сжигается с 75,0 г кислорода. [латекс] \ text {процент доходности} = \ frac {0,8347 \ cancel {\ text {g}}} {0,9525 \ cancel {\ text {g}}} \ times 100 \% = 87,6 \% [/ latex] Определить ограничивающий реагент.
- Обрисуйте шаги, необходимые для определения ограничивающего реагента, когда 0,50 г Cr и 0,75 г H 3 PO 4 реагируют в соответствии со следующим химическим уравнением? [латекс] 2 \ text {Cr} +2 {\ text {H}} _ {3} {\ text {PO}} _ {4} \ rightarrow 2 {\ text {CrPO}} _ {4} +3 { \ text {H}} _ {2} [/ latex] Определите ограничивающий реагент.
- Что является ограничивающим реагентом, когда 1,50 г лития и 1,50 г азота объединяются с образованием нитрида лития, компонента усовершенствованных батарей, в соответствии со следующим уравнением несбалансированного питания? [латекс] \ text {Li} + {\ text {N}} _ {2} \ rightarrow {\ text {Li}} _ {3} \ text {N} [/ latex]
- Уран может быть выделен из руд путем растворения его в виде UO 2 (NO 3 ) 2 с последующим разделением его на твердый UO 2 (C 2 O 4 ) [латекс] \ cdot [/ латекс] 3H 2 O.Добавление 0,4031 г оксалата натрия, Na 2 C 2 O 4 , к раствору, содержащему 1,481 г нитрата уранила, UO 2 (NO 2 ) 2 , дает 1,073 г твердого вещества. UO 2 (C 2 O 4 ) [латекс] \ cdot [/ latex] 3H 2 O. [латекс] {\ text {Na}} _ {2} {\ text {C}} _ {2} {\ text {O}} _ {4} + {\ text {UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} +3 {\ text {H}} _ {2} \ text {O} \ rightarrow {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2 } {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O} +2 {\ text {NaNO}} _ {3} [ / латекс] Определите ограничивающий реагент и процент выхода этой реакции.
- Сколько молекул C 2 H 4 Cl 2 можно получить из 15 молекул C 2 H 4 молекул и 8 молекул Cl 2 ?
- Сколько молекул подсластителя сахарина можно получить из 30 атомов C, 25 атомов H, 12 атомов O, 8 атомов S и 14 атомов N?
- Пятиокись фосфора, используемая для производства фосфорной кислоты для безалкогольных напитков кола, получают путем сжигания фосфора в кислороде.
- Какой ограничивающий реагент при 0.200 моль P 4 и 0,200 моль O 2 реагируют согласно [латексу] {\ text {P}} _ {4} +5 {\ text {O}} _ {2} \ rightarrow {\ text {P}} _ {4} {\ text {O}} _ {10} [/ latex]
- Рассчитайте процентный выход, если из реакции выделено 10,0 г P 4 O 10 .
- Согласитесь ли вы купить 1 триллион (1 000 000 000 000) атомов золота за 5 долларов? Объясните, почему да или почему нет. Найдите текущую цену на золото по адресу http://money.cnn.com/data/commodities/ [latex] \ text {(} \ text {1 тройская унция} = \ text {31.1 г} \ text {)} [/ латекс]
Показать выбранные ответы
2. Напишите сбалансированное химическое уравнение и определите количество молей каждого доступного реагента.
Реакция:
[латекс] 2 \ text {Na} + {\ text {Cl}} _ {2} \ rightarrow 2 \ text {NaCl} [/ latex]
[латекс] \ text {Родинки Na} = \ text {8 г Na} \ times \ frac {\ text {1 моль}} {\ text {23,0 г}} = \ text {0,3 моль Na} [/ latex]
[латекс] \ text {Моль} {\ text {Cl }} _ {2} = \ text {8 г} \ times \ frac {\ text {1 моль}} {\ text {70,9 г}} = \ text {0,1 моль} {\ text {Cl}} _ {2 } [/ латекс]
Стехиометрическое соотношение составляет 2 моль Na: 1 моль Cl 2 ; поскольку реагенты представлены в 0.Соотношение 3: 0,1 или 3: 1, Na присутствует в избытке, а Cl 2 является ограничивающим реагентом.
4. [латекс] \ text {Процентная доходность} = \ frac {\ text {25 г}} {\ text {81 г}} \ times 100 \% = 31 \% [/ latex]
6. Напишите и сбалансируйте уравнение реакции: [латекс] {\ text {CCl}} _ {4} +2 \ text {HF} \ rightarrow {\ text {CCl}} _ {2} {\ text { F}} _ {2} +2 \ text {HCl} [/ latex] Молярные массы: CCl 4 = 153,82 г / моль; CCl 2 F 2 = 120,89 г / моль. Требуемые преобразования: [latex] \ text {g} {\ text {CCl}} _ {4} \ rightarrow \ text {mol} {\ text {CCl}} _ {4} \ rightarrow \ text {mol} {\ текст {CCl}} _ {2} {\ text {F}} _ {2} \ rightarrow \ text {g} {\ text {CCl}} _ {2} {\ text {F}} _ {2}.[/ latex] Чтобы найти процентный выход, разделите 12,5 г CCl 2 F 2 на теоретическую массу и умножьте на 100%. Для полного преобразования
[латекс] \ text {mass} {\ text {CCl}} _ {2} {\ text {F}} _ {2} = 32.9 \ cancel {\ text {g} {\ text {CCl }} _ {4}} \ times \ frac {1 \ cancel {\ text {mol} {\ text {CCl}} _ {4}}} {153.82 \ cancel {\ text {g} {\ text {CCl} } _ {4}}} \ times \ frac {1 \ cancel {\ text {mol} {\ text {CCl}} _ {2} {\ text {F}} _ {2}}} {1 \ cancel { \ text {mol} {\ text {CCl}} _ {4}}} \ times \ frac {\ text {120,89 g} {\ text {CCl}} _ {2} {\ text {F}} _ {2 }} {1 \ cancel {\ text {mol} {\ text {CCl}} _ {2} {\ text {F}} _ {2}}} = \ text {25.86 г} {\ text {CCl}} _ {2} {\ text {F}} _ {2} [/ latex]
[латекс] \ text {процентная доходность} = \ frac {\ text {12,5 г}} {\ text {25,86 г}} \ times 100 \% = 48,3 \% [/ latex]
8. [латекс] \ begin {array} {l} 100 \ cancel {\ text {g} {\ text {C}} _ {6} {\ text {H}} _ {5} {\ text {CH }} _ {3}} \ times \ frac {1 \ cancel {\ text {mol toluene}}} {92.13 \ cancel {\ text {g} {\ text {C}} _ {6} {\ text {H }} _ {5} {\ text {CH}} _ {3}}} \ times \ frac {1 \ cancel {\ text {моль бензойной кислоты}}} {1 \ cancel {\ text {моль толуола}}} \ times \ frac {122.1 \ cancel {\ text {g бензойная кислота}}} {1 \ cancel {\ text {моль бензойной кислоты}}} \\ \ times \ frac {\ text {1 кг}} {1000 \ cancel {\ text {g бензойная кислота}}} = \ text {1.325 кг бензойной кислоты} \ text {(} \ text {теоретический выход} \ text {)} \ end {array} [/ latex]
[латекс] \ text {процентный выход} = \ frac {\ text {1,21 г} } {\ text {1,325 г}} \ times 100 \% = 91,3 \% [/ latex]
10. Перевести массу этанола в моль этанола; соотнесите моль этанола с молями эфира, полученного с использованием стехиометрии сбалансированного уравнения. Перевести моль эфира в граммы; разделите фактические граммы эфира (определенные по плотности) на теоретическую массу, чтобы определить процент выхода.{\ cancel {-1}} \ times 1500 \ cancel {\ text {mL}} = 1184 \ text {g} [/ latex]
Масса эфира = 1,184
[латекс] \ text {mass ether} = \ cancel {\ text {g ethanol}} \ times \ frac {1 \ cancel {\ text {моль этанола}}} {46.0688 \ cancel {\ text {g этанол}} } \ times \ frac {1 \ cancel {\ text {mol ether}}} {1 \ cancel {\ text {mol ethanol}}} \ times \ frac {74.1224 \ cancel {\ text {g ether}}} {1 \ cancel {\ text {mol ether}}} = \ text {0,9525 г} [/ латекс]
[латекс] \ text {процент доходности} = \ frac {0.8347 \ cancel {\ text {g}}} {0.9525 \ cancel {\ text {g}}} \ times 100 \% = 87.6 \% [/ латекс]
12. Требуется преобразование [latex] \ text {mol Cr} \ rightarrow \ text {mol} {\ text {H}} _ {2} {\ text {PO}} _ {4} \ text {.} [/ latex] Затем сравните количество Cr с количеством присутствующей кислоты.
[латекс] \ text {0,50 моль Cr} \ times \ frac {\ text {2 моль} {\ text {H}} _ {3} {\ text {PO}} _ {4}} {\ text {2 моль Cr}} = 0,50 {\ text {H}} _ {3} {\ text {PO}} _ {4} [/ latex]
Таким образом, 0,25 моль H 3 PO 4 является избыточным, поэтому Cr — ограничивающий реагент.
14. Используя сбалансированное уравнение, определите, какое количество реагента дает наименьший теоретический выход.Это количество представляет собой наибольшее количество продукта, которое может быть произведено. Затем рассчитайте процентную доходность. Конверсии для реакции 1 с использованием нитрата в качестве ограничивающего реагента равны.
[латекс] \ text {g} {\ text {UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} \ rightarrow { \ text {UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} +3 {\ text {H}} _ {2} \ text {O} \ rightarrow {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O} \ rightarrow \ text {g} {\ text {UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} \ cdot 3 {\ text {H}} _ {2} \ text {O} [/ latex]
Ответ на этот расчет следует сравнить с ответом из реакции 2, которая использует оксалат натрия в качестве ограничивающего реагента и требует следующих преобразований:
[латекс] \ text {g оксалат натрия} \ rightarrow \ text {моль оксалата натрия} \ rightarrow \ text {mol} {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O} \ rightarrow \ text {g} {\ text { UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O} [/ latex]
Молярные массы: UO 2 (NO 3 ) 2 = 394.04 г / моль
Na 2 C 2 O 4 = 134,00 г / моль
UO 2 (C 2 O 4 ) [латекс] \ cdot [/ латекс] 3H 2 O = 412,09 г / моль
Реакция 1:
[латекс] \ begin {array} {l} \ text {mass} \ text {(} \ text {product} \ text {)} = 1.48 \ cancel {\ text {g} {\ text { UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2}} \ times \ frac {1 \ cancel {\ text {mol} { \ text {UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2}}} {394.04 \ cancel {\ text {g} { \ text {UO}} _ {2} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2}}} \ times \ frac {1 \ cancel {\ text {mol} {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 { \ text {H}} _ {2} \ text {O}}} {1 \ cancel {\ text {mol} {\ text {UO}} _ {2} {\ text {(} {\ text {NO} } _ {3} \ text {)}} _ {2}}} \ times \ frac {\ text {412.09 g} {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 { \ text {H}} _ {2} \ text {O}} {1 \ cancel {\ text {mol} {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O}}} \\ = \ text {1.55 g} { \ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H }} _ {2} \ text {O} \ end {array} [/ latex]
Реакция 2:
[латекс] \ begin {array} {l} \ text {mass} \ text {(} \ text {product} \ text {)} = 0,403 \ cancel {\ text {g} {\ text { Na}} _ {2} {\ text {C}} _ {2} {\ text {O}} _ {4}} \ times \ frac {1 \ cancel {\ text {mol} {\ text {Na} } _ {2} {\ text {C}} _ {2} {\ text {O}} _ {4}}} {134.00 \ cancel {\ text {g} {\ text {Na}} _ {2} {\ text {C}} _ {2} {\ text {O}} _ {4}}} \ times \ frac {1 \ cancel {\ text {mol} {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {) } \ cdot 3 {\ text {H}} _ {2} \ text {O}}} {1 \ cancel {\ text {mol} {\ text {Na}} _ {2} {\ text {C}} _ {2} {\ text {O}} _ {4}}} \ times \ frac {412.09 \ text {g} {\ text {UO}} _ {2} \ text {(} {\ text {C} } _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O}} {1 \ cancel {\ text {mol } {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2} {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O}}} \\ = 1.239 \ text {g} {\ text {UO}} _ {2} \ text {(} {\ text {C}} _ {2 } {\ text {O}} _ {4} \ text {)} \ cdot 3 {\ text {H}} _ {2} \ text {O} \ end {array} [/ latex]
На основе двух масс, меньшая масса является ограничивающим реагентом.Таким образом, ограничивающим реагентом является Na 2 C 2 O 4 . Количество UO 2 (NO 3 ) 2 остается непрореагировавшим.
[латекс] \ text {процент доходности} = \ frac {1.073 \ cancel {\ text {g}}} {1.239 \ cancel {\ text {g}}} \ times 100 \% = 86.6 \% [/ latex]
16. Определите количество атомов каждого элемента в сахарине, а затем сравните эти числа с количеством имеющихся атомов. Количество атомов в сахарине — семь атомов C, пять атомов H, три атома O, один атом S и один атом N.{-10} \ text {g} [/ latex] Эта сумма не может быть взвешена на обычных балансах и не имеет никакой ценности.
Глоссарий
Фактический выход: количество продукта, образовавшегося в результате реакции
избыток реагента: реагент присутствует в количестве, превышающем требуемое по стехиометрии реакции
ограничивающий реагент: реагент присутствует в количестве ниже, чем требуется по стехиометрии реакции, таким образом ограничивая количество образующегося продукта
Выход процентов: мера эффективности реакции, выраженная в процентах от теоретического выхода
теоретический выход: количество продукта, которое может быть получено из данного количества реагента (ов) в соответствии со стехиометрией реакции
Выход реакции
| Протокол
4.3: Выход реакции
Теоретический выход реакции — это количество продукта, которое, по оценкам, образуется на основании стехиометрии сбалансированного химического уравнения. Теоретический выход предполагает полное превращение ограничивающего реагента в желаемый продукт. Количество продукта, которое получают при проведении реакции, называется фактическим выходом, и оно может быть меньше или (очень редко) равным теоретическому выходу.
Процентная доходность
В случае химических реакций фактический выход продукта часто меньше теоретического выхода, предсказанного на основе стехиометрии реакции.Когда реакции проводятся в заданном наборе условий, неизбежная потеря массы ожидается по нескольким причинам. Некоторые реакции по своей природе неэффективны, вызывая побочные реакции с образованием других нежелательных продуктов. Другие неполны из-за их обратимого характера, сопровождаемого состоянием равновесия между реагентами и продуктами. Иногда потеря массы продукта происходит из-за недостаточного извлечения желаемого продукта из реакционной смеси во время таких методов очистки, как кристаллизация, дистилляция, фильтрация и хроматография.В случаях, когда наблюдается потеря продукта, процентный выход используется для измерения степени, в которой достигается теоретический выход реакции.
Фактический и теоретический выходы могут быть выражены как массы или молярные количества (или любое другое подходящее свойство, например, объем, если продукт представляет собой газ). Пока обе доходности выражаются в одних и тех же единицах, эти единицы отменяются при вычислении процентной доходности.
Расчет процентной доходности
Рассмотрим превращение оксида азота в диоксид азота.
В конце реакции из 150 г оксида азота и избытка кислорода получают 180 граммов диоксида азота. Какой процент доходности?
Фактический выход реакции составляет 180 граммов. Зная, что оксид азота является ограничивающим реагентом, моль теоретического выхода получается на основе стехиометрии NO и NO 2 . Сначала масса NO преобразуется в моль NO. Затем применяется стехиометрическое соотношение NO: NO 2 (1: 1), что предполагает, что 5 моль NO 2 будут образованы из 5 моль NO.



 Определите количество продукта по уравнению
Определите количество продукта по уравнению


 Запишем
Запишем