Содержание
Назовите причины многообразия органических веществ.
3. Какова массовая доля (8) вещества в растворе, полученном придобавлении к раствору сульфата меди массой 360 г с массовойдалей 20 % валы массой 140 r
…
?
Не могу понять,почему в этой реакции N принимает 8 электронов?
вариант 31. Укажите название взвеси газа в жидкости:а) суспензия;в) аэрозоль;б) эмульсия;г) пена.
Установите соответствие между схемой реакции и изменением степени окисления Серы в ней.
ZnS + O2 → ZnO + SO2
SO2 + HNO3 → h3SO4 + NO2
Na + h3SO4 (конц
…
ентрированная) → Na2SO4 + h3S + h3O
h3SO4 (концентрированная) + Cu → CuSO4 + SO2 + h3O
Варианты ответа:
-2 → +4
+6 → +4
+4 → +6
+6→ -2
Приведите два примера экологически чистого вида топлива и отметьте положительные и отрицательные черты применения данного топлива Люди пж дайте ответ
…
формулу речовини, що містить 22,1 % Алюмінію, 25,4 % Фосфору, 52,5% Оксигену
Вычислите массу целлюлозы, которую сожгли, если при этом выделился карбон(IV) оксид объемом 2,688 л (н. у.).
у.).
Вычислите объем воздуха (н. у.), который потратится на горение смеси метана с этаном объемом 10 л, объемная доля этана в котором составляет 90%.
В результате смешивания 20 г раствора Гидроксид натрия с раствором, содержащим достаточное количество ферум(ІІ) хлорида, образовался осадок массой 4,5
…
г. Вычислите массовую долю натрий гидроксида в исходном растворе.
Определите степени окисления
1. в соединениях
KClO3, MnCl4, MnO2, h3O2, Nh5NO3, S8, K2FeO4, Pb(NO3)2, Mg3N2, NaHSO3, KMnO4, K2Cr2O7, Al(OH)SO4, Ph4,
…
CuI, CuS, Ca3(PO4)2, h3S2, NOCl, FeS2, Nh3OH, Ca(h3PO4)2, Cr2(SO4)3, Mg, CS2, NCl3, (Nh5)3PO4, H[AuCl4], NaHS, Fe4[Fe(CN)6]3, P4O6, Fe3[Fe(CN)6]2, FeSO3, Ch4Cl, Ca(ClO2)2, CaOCl2.
2. Определите степени окисления элементов в ионах:
NO3-, NO2-, VO2+, SO42-, Cr2O72-, [AuCl4]-, ClO3-, h3PO-, Cr2O7-, [AuCl4]-, ClO3-,
h3PO2-, CrOh3+, IO2-, SiO32-, MnO4-, MnO42-, Fe(OH)2+,
Решите тесты
1. В какой молекуле степень окисления элемента равна нулю, а валентность — двум:
1) P4;
2) h3S;
3) O2;
4) Br2;
2. В какой молекуле степень окисления элемента равна нулю, а валентность трем:
В какой молекуле степень окисления элемента равна нулю, а валентность трем:
1) P4;
2) OF2;
3) N2;
4) S8;
3. Одинаковую степень окисления железо проявляет в соединениях:
1) Fe(NO3)3, FeOHCl;
2) K2FeO4, K4[Fe(CN)6];
3) FeOHSO4, K3[Fe(CN)6];
4) FePO4, FeSO4;
4. Наименьшую степень окисления хром имеет в соединении:
1) CrS;
2) CrOHSO4;
3) K2Cr2O7;
4) Na2CrO4;
5. Наименьшую степень окисления сера имеет:
1) K2S2;
2) COS;
3) SO2;
4) FeS2;
Расставьте коэффициенты методом электронного баланса в следующих схемах реакций
1. KClO3 KCl + O2;
2. KClO KCl + O2;
3. KMnO4 + KOH K2MnO4 + O2 + h3O;
Причины многообразия органических веществ: химическое строение, качественный состав
К органическим веществам относят углеродсодержащие вещества, преимущественно образующиеся в живых организмах. На сегодня, многие органические вещества могут быть получены искусственно в лаборатории. Синтезировано большое количество органических соединений, не встречающихся в природе.
Общее число известных органических веществ превышает 10 миллионов, в то время как неорганических — около 100 тысяч. Такое многообразие органических соединений связано со способностью атомов углерода соединяться в цепи различной длины. Связи между атомами углерода могут быть одинарными и кратными: двойными, тройными. При этом вещества могут иметь одинаковую молекулярную формулу, но разное строение и свойства (это явление получило название изомери́и).
Такое многообразие органических соединений связано со способностью атомов углерода соединяться в цепи различной длины. Связи между атомами углерода могут быть одинарными и кратными: двойными, тройными. При этом вещества могут иметь одинаковую молекулярную формулу, но разное строение и свойства (это явление получило название изомери́и).
В состав органических веществ входят углерод, водород, кислород, а также азот, фосфор, сера. Кроме того, могут входить практически любые элементы.
Углеводороды — вещества, состоящие из двух элементов: углерода и водорода.
Метан (его также называют болотный, рудничный газ, т. к. он образуется при разложении органических остатков на дне болот, а также выделяется из пластов каменного угля в рудниках). Состоит из одного атома углерода, соединенного ковалентными связями с четырьмя атомами водорода. Молекулярная формула CH4. Структурная формула показывает порядок связи атомов в молекуле:
H
l
H – C – H
l
H
Чтобы правильно составлять структурные формулы органических веществ, нужно помнить, что атомы углерода образуют по 4 связи, изображаемые черточками (т. е. валентность углерода по числу связей равна четырем. В органической химии преимущественно используется именно валентность по числу связей).
е. валентность углерода по числу связей равна четырем. В органической химии преимущественно используется именно валентность по числу связей).
В 10–11 классах изучается, что молекула метана имеет форму треугольной пирамиды — тетраэдра, подобно знаменитым египетским пирамидам.
Этилен C2H4 состоит из двух атомов углерода, соединенных двойной связью:
Угол между связями составляет 120º (электронные пары,образующие связь
отталкиваются и располагаются на максимальном расстоянии друг от друга).
Ацетилен C2H2 содержит тройную связь:
H – C ≡ C – H
В качестве примера кислородсодержащих органических веществ можно назвать метиловый (древесный) спирт CH3OH (систематическое название метанол),
этиловый спирт C2H5OH (этанол),
уксусную кислоту CH3COOH
(кислотный остаток уксусной кислоты CH3COO− обычно находится в нижней строчке таблицы растворимости, поэтому если забудете формулу, возьмите таблицу растворимости — она должна быть на экзамене — и добавьте к кислотному остатку водород)
автор: Владимир Соколов
Причины многообразия органических веществ — Справочник химика 21
ПРИЧИНЫ многообразия органических веществ 77 [c. 77]
77]
В чем причина многообразия органических веществ [c.297]
Причины многообразия органических веществ [c.77]
Изомерия очень распространена в органической химии и служит одной из главных причин многообразия органических веществ. Сущность изомерии состоит в изменении последовательности соединения атомов углерода друг с другом и сопровождается различием строения углеродной цепи, например прямой и разветвленной. [c.234]
В одном случае атомы углерода образуют неразветвленную цепь (I), а во втором — разветвленную цепь (II). Вещества (I) и (II) имеют различное строение (различный порядок взаимосвязи атомов) и поэтому их свойства тоже будут отличаться друг от друга, т. е. будут изомерами (бутан, изобутан). Явление изомерии — одна из причин многообразия органических веществ. [c.299]
Теория химического строения А. М. Бутлерова дает возможность понять причины существования огромного числа органических веществ и необычайного их многообразия. Важнейшие из этих причин следующие [c.77]
Важнейшие из этих причин следующие [c.77]
Сейчас известно более 4 млн. углеродсодержащих соединений веществ же, не содержащих углерода, насчитывается всего несколько сотен тысяч. Общая причина многообразия органических соединений в том, что в их молекулы входят десятки (а иногда — сотни и тысячи) атомов, располагающихся в разном порядке. [c.219]
На самом деле это два различных вещества, имеющих одинаковый химический состав бутан и изобутан. Соединения, у которых один и тот же состав, но различный порядок связи атомов в молекуле, называются изомерами. Явление изомерии— также одна из причин многообразия органических соединений. [c.290]
Исходя из основных положений теории органических соединений А. М. Бутлерова, молено сказать, что основные причины многообразия органических веществ заключаются в способности атомов углерода соединяться друг с другом, образуя цепи, и в явлении изомерии. [c.155]
В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей.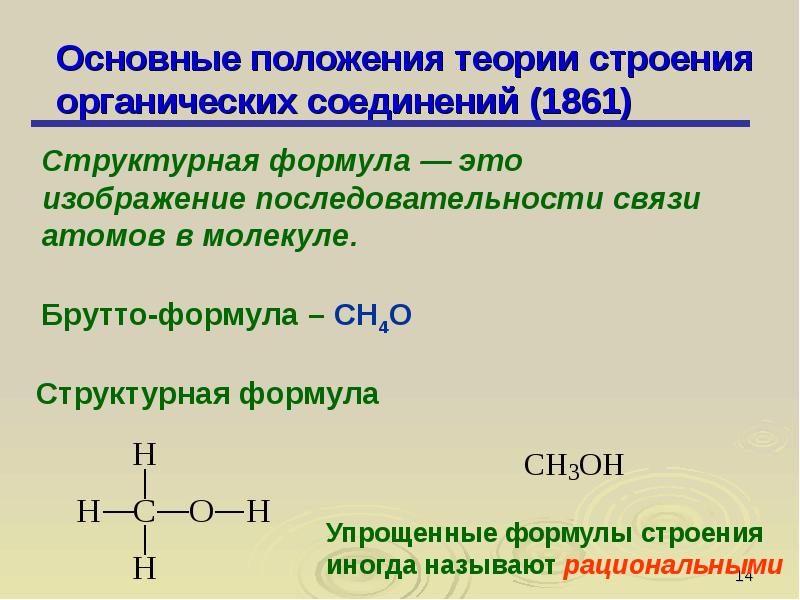 Прежде всего атомы углерода способны соединяться друг с другом, образуя цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений, [c.271]
Прежде всего атомы углерода способны соединяться друг с другом, образуя цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений, [c.271]
Но с 30-х годов XIX в. неорганическая химия начинает утрачивать свое ведущее положение, что было связано с отсутствием руководящего начала в открытии новых химических элементов и их соединений, обоснованных научных принципов систематизации большого многообразия неорганических веществ. Причина этого в том, что химическая промышленность в то время еще не проявляла большого интереса к неорганическим соединениям. Слабые практические запросы во многом и предопределили расстановку научных сил в химии 60—80-х годов XIX в. После открытия периодического закона Д. И. Менделеевым и создания им периодической системы химических элементов, неорганическая химия быстро стала догонять органическую химию. [c.261]
Органическая химия—химия соединений углерода. Свое название органические соединения получили в связи с тем, что первые описанные индивидуальные вещества имели растительное или животное происхождение. Со временем данное определение приобрело более широкий смысл, поскольку номенклатура соединений углерода не ограничивается только природными соединениями, а включает и вещества синтетического происхождения. Причиной многообразия органических [c.216]
Свое название органические соединения получили в связи с тем, что первые описанные индивидуальные вещества имели растительное или животное происхождение. Со временем данное определение приобрело более широкий смысл, поскольку номенклатура соединений углерода не ограничивается только природными соединениями, а включает и вещества синтетического происхождения. Причиной многообразия органических [c.216]
Среди многообразия органических и неорганических сред, в которых работают стеклопластиковые изделия, есть среды, не вступающие с компонентами стеклопластика в химическое взаимодействие и не являющиеся по отношению к нему поверхностно-активными веществами (например, нефть, насыщенные углеводороды, природный газ). Длительный контакт полиэфирных (на смолах общего назначения) и эпоксидных стеклопластиков с безводной нефтью и природным сухим газом приводит к некоторому понижению их прочностных свойств-остаточная прочность составляет 88-90% от исходной (рис. 5.29) [140]. Повышение температуры приводит даже к некоторому увеличению прочности (табл. 5.8), видимо, за счет дополнительного структурирования связующего. Присутствие воды в нефти сразу меняет картину поведения материала-прочность резко падает [112]. Причины этого явления были подробно рассмотрены в разд. 5.1.4.1. [c.143]
Повышение температуры приводит даже к некоторому увеличению прочности (табл. 5.8), видимо, за счет дополнительного структурирования связующего. Присутствие воды в нефти сразу меняет картину поведения материала-прочность резко падает [112]. Причины этого явления были подробно рассмотрены в разд. 5.1.4.1. [c.143]
А как обстоит вопрос с многообразием органических веществ В настоящее время описано более двух миллионов органических веществ и ежегодно ученые-химики всего мира синтезируют около 30 000 новых веществ, в то время как неорганических веществ насчитывается несколько сотен тысяч. В этой связи возникает существенный вопрос какими причинами можно объяснить такое многообразие органических веществ [c.229]
Поэтому изучение органической химии на базе теории строения углубляет представления учащихся о природе вещества и расширяет их представление о причинах многообразия окружающих нас веществ. [c.6]
Известно, что веществ, содержащих углерод (в большинстве— органических соединений), существует около пяти миллионов, тогда как веществ, содержащих все остальные элементы, в 17 раз меньше (примерно триста тысяч). Кроме того, ежегодно синтезируется огромное число (xi 250 ООО) новых соединений углерода число новых соединений остальных элементов, вместе взятых, значительно меньн1с. Объясните, в чем заключается химическая причина столь большого (практически неограниченного) многообразия органических соединений. Каковы возможные типы гибридизации орбиталей атома углерода Может ли атом углерода быть а) трехвалентным, б) пятивалентным [c.79]
Кроме того, ежегодно синтезируется огромное число (xi 250 ООО) новых соединений углерода число новых соединений остальных элементов, вместе взятых, значительно меньн1с. Объясните, в чем заключается химическая причина столь большого (практически неограниченного) многообразия органических соединений. Каковы возможные типы гибридизации орбиталей атома углерода Может ли атом углерода быть а) трехвалентным, б) пятивалентным [c.79]
Соединения, которые построены из бесконечных атомных объединений, называются кристаллическими соединениями независимо от того, состоят ли они из одного сорта атомов или из нескольких, построены ли они правильно или являются лишь псевдокристаллическими. В противоположность кристаллическим молекулярные соединения состоят из молекул. Оказывается, что классификацию обеих групп соединений — молекулярных и кристаллических — можно проводить по единому принципу, а именно по стереохимическому. Огромное знауние, которое имеют кристаллические соединения в неорганической химии, и важная роль, которую они играют в мире органических веществ наряду с молекулярными соединениями, являются причиной того, что мы сперва остановимся на классифит кации кристаллических соединений. Такой подход оправдывается еще тем, что многообразие структурных типов среди кристаллических соединений гораздо больше, чем среди молекулярных кроме того, новые перспективы, связанные с нашим подходом к проблеме, особенно резко выявляются при рассмотрении кристаллических соединений [7]. [c.303]
Такой подход оправдывается еще тем, что многообразие структурных типов среди кристаллических соединений гораздо больше, чем среди молекулярных кроме того, новые перспективы, связанные с нашим подходом к проблеме, особенно резко выявляются при рассмотрении кристаллических соединений [7]. [c.303]
Таким образом, запросы практики как внешний фактор явились определяюш,ей причиной появления работ советских химиков в области химии органических соединений тяжелых металлов и первым стимулом их интенсивного развития. Вместе с этим действовали и другие причины, присущие внутренней логике развития самой пауки — органической химии. Они состояли в том, что к тому времени был пакоплеп большой материал в области химии цинк- и магнийорганических соединепий, был завершен Шорыгиным комплекс работ по химии натрийорганических соединений, что исключительно расширило синтетические возможности органической химии и позволило по-новому оценить роль металлооргапических соединений. В то же время было очевидным еще совершенно недостаточное использование металлооргапических соединений тяжелых металлов, исследования которых обещали вскрыть богатство, таящееся в необыкновенном многообразии их, основанном на прочности их металлоуглеродной связи. Идея получения этих соединений, исследования их свойств и определение надлежащего места в химии напрашивалась стать первоочередной задачей. В особенности заманчивыми были органические производные элементов IV группы кремния, германия, олова и свинца, так как они естественно вызывали интерес к изучению аналогии их свойств со свойствами соответствующих соединений собственно углерода. Решению главным образом этих вопросов и были посвящены первые работы К. А. Кочешкова и его учеников, начавшиеся с 1928 г. Исключительный интерес вместе с тем представляли ртутноорганические соединения, устойчивость которых даже по отношению к сильным реагентам была поразительной, а это обещало дать исследователю большое количество новых веществ. По пути изучения этой важнейшей области были направлены первые шаги научной деятельности А. Н. Несмеянова. [c.157]
Идея получения этих соединений, исследования их свойств и определение надлежащего места в химии напрашивалась стать первоочередной задачей. В особенности заманчивыми были органические производные элементов IV группы кремния, германия, олова и свинца, так как они естественно вызывали интерес к изучению аналогии их свойств со свойствами соответствующих соединений собственно углерода. Решению главным образом этих вопросов и были посвящены первые работы К. А. Кочешкова и его учеников, начавшиеся с 1928 г. Исключительный интерес вместе с тем представляли ртутноорганические соединения, устойчивость которых даже по отношению к сильным реагентам была поразительной, а это обещало дать исследователю большое количество новых веществ. По пути изучения этой важнейшей области были направлены первые шаги научной деятельности А. Н. Несмеянова. [c.157]
Причины многообразия органических веществ.
Муниципальное бюджетное общеобразовательное учреждение “средняя общеобразовательная школа с. Тумутук”
Тумутук”
Азнакаевского района РТ.
Тема урока : Причины многообразия веществ.
Дата 20.10.2018 года для 11 класса
Учитель: биологии и химии Гафарова М.Ф.
Цель: опираясь на знания о строении веществ, раскрыть причины многообразия органических соединений; расширить представления обучающихся о многообразии неорганических веществ в природе.
Планируемые результаты: на данном уроке большинство учащихся на основе собственных знаний курса химии за 10 класс, а также изученных тем в 11 классе смогут установить причинно-следственные связи фактов, найти и дать характеристику основных понятий при работе с различными ресурсами и сделать соответствующие выводы о причинах многообразия веществ.
Оборудование к уроку: сера кристаллическая, (спиртовка ) или свеча железная ложка ,пробирка, стакан с холодной водой.
персональный компьютер, выход в ресурсы сети Интернет, мультимедийный проектор, экран, учебная литература
Прилагаемые медиаматериалы:
презентация в редакторе POWER POINT
Структура урока:
Организационный момент
Ориентировочно-мотивационный
Информационно-поисковый
Демонстрация опыта
Обобщение и систематизация
Рефлексия- ситуационная задача
Домашнее задание
Содержание этапов урока.
1.Организационный момент(2мин.)
Учитель:Доброе утро!
Кто из вас пробовал сделать ириски из сахара? (предположения учащихся). Если положить сахар на раскаленную сковороду сахар и соль? Сахар начнет плавиться, а поваренная соль останется без изменений.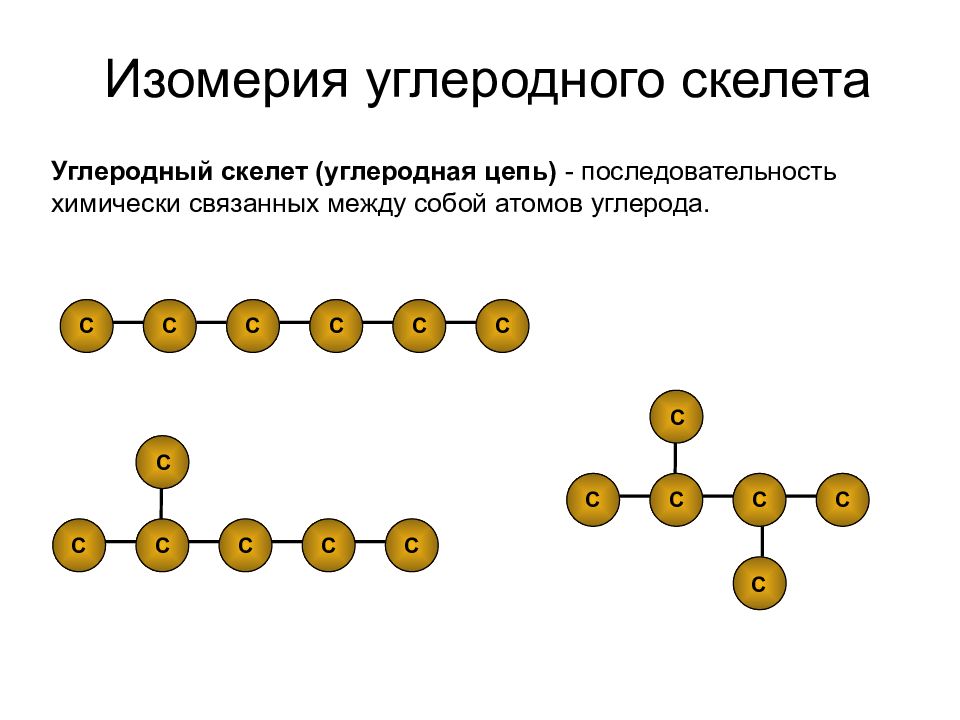 Как вы думаете, почему поваренная соль и сахар ведут себя по-разному при нагревании? Данные вещества имеют разное строение кристаллических решеток.
Как вы думаете, почему поваренная соль и сахар ведут себя по-разному при нагревании? Данные вещества имеют разное строение кристаллических решеток.
Какая кристаллическая решетка у поваренной соли и у сахара?
В поваренной соли NaCl – ионная кристаллическая решетка, а в сахаре – молекулярная.
2.Ориентировочно-мотивационный(4мин.)
В истории химии было много загадок. Возможно, кто-то из вас интересовался, сколько всего известно в мире веществ? (предположения учащихся).В прошлом ученые разделяли все вещества в природе на условно неживые и живые, включая в число последних царство животных и растений. Вещества первой группы получили название минеральных(неорганических), которых насчитывается приблизительно 500 тысяч. Например: атом кислорода встречается в виде кислорода и озона .А это какое явление? А те, что вошли во вторую, стали называть органическими веществами. Что под этим подразумевается? (ответы обучающихся) Какие элементы входят в состав органических соединений, кроме углерода? (Н, О, N, Р,S галогены). Класс органических веществ наиболее обширный среди всех химических соединений, известных современным ученым. Органических веществ насчитывается около 30 млн. К примеру, было известно около 80 разнообразных веществ, отвечающих составу C6H12O2. Углеводород состава С25Н52-имеет 588 изомеров. В 1861 году загадка была разгадана. Откуда берутся такие цифры, почему в общем насчитывается такое великое число веществ? В течение урока мы с вами должны ответить на данный вопрос.
Что под этим подразумевается? (ответы обучающихся) Какие элементы входят в состав органических соединений, кроме углерода? (Н, О, N, Р,S галогены). Класс органических веществ наиболее обширный среди всех химических соединений, известных современным ученым. Органических веществ насчитывается около 30 млн. К примеру, было известно около 80 разнообразных веществ, отвечающих составу C6H12O2. Углеводород состава С25Н52-имеет 588 изомеров. В 1861 году загадка была разгадана. Откуда берутся такие цифры, почему в общем насчитывается такое великое число веществ? В течение урока мы с вами должны ответить на данный вопрос.
Ученики -Информационно-поисковый (22 мин.)
Итак, запишем признаки (особенности) органических веществ.
Содержат углерод.
Горят и (или) разлагаются с образованием углеродсодержащих продуктов.
Связи в молекулах органических веществ ковалентные.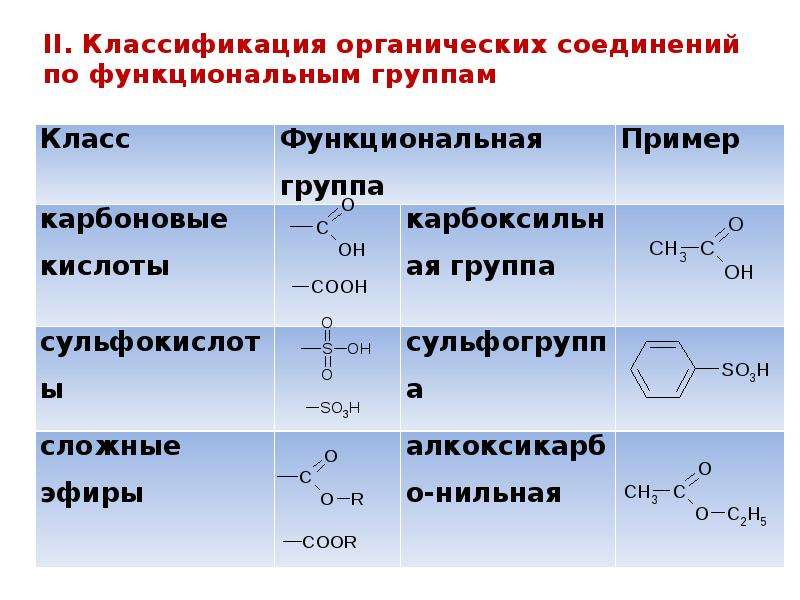
Кристаллическая решетка молекулярная
Кто из вас возьмет первое задание, связанное именно с этим понятием? (так формируется первая пара или идет индивидуальная работа)
Работа по маршрутным заданиям в группах.
Ученики 1 группа Задание №1
Получите готовую модель хлорбутена С4 Н7Сl и постройте модель 9 изомеров, дайте название по систематической номенклатуре ИЮПАК; дайте определение понятия «изомер» (запись на доске) Вещества, имеющие одинаковый состав и одинаковую молекулярную массу но различное строение молекул, а поэтому обладающие разными свойствами называются изомерами. (запишем)
Ученики 2 группа Задание №2Дайте определение понятию «гомолог» и перечислите гомологический ряд метана, приведите формулы 7-8 гомологов метана
Закончите предложения. (Блиц — конкурс).
Ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, имеющих одинаковый план строения и отвечающих единой общей формуле, называют …
Связь, возникающую по линии, связывающей центры атомов, называют…
Явление, при котором могут существовать вещества, имеющие одинаковый количественный и качественный состав, но разную структуру молекулы, называют…
Ученики 3 группа Задание №3. Найдите «родственные» пары.
Вспомните классификацию химических веществ и найдите среди приведённых здесь веществ «родственные» пары(у доски)
1 – вазелин; 2 – крахмал; 3 – гашёная известь; 4 – железо; 5 – йод; 6 – лимонная кислота;
7 – мел; 8 – медный купорос; 9 – нафталин; 10 – нашатырный спирт; 11 – поваренная соль;
12 – сахар; 13 – сода питьевая; 14 – уксус.
Демонстрация опыта .(4 мин)
Учитель ( демонстрационный опыт)Горение серы . Превращение серы из ромбической в пластическую форму (раздача карточки). (запишем — аллотропия).
Ученики 4 группа Задание №4
В природе не существует одного вида атома, например, существуют три разновидности атомов водорода: протий, дейтерий 2D, тритий 3T )Как же называют разновидности атомов одного и того же вида (в нашем случае – атомов водорода), имеющие один и тот же заряд ядра атома, но разные массы? (изотопы (“изос” – равный, одинаковый, “топос” – место), т. е. занимающие одно и то же место). Данное явление получило название изотопия, и это является одной из причин многообразия веществ (запишем -изотопия).
Ученики 5 группаЗадание №5
Вещества, которые нас окружают ,имеют не только природное происхождение. Огромное число веществ получают искусственным путем. Приведите примеры. Вюрц – разработал синтез фенолов, красителей и ряда лекарств; Зинин – синтезировал анилин и красители на его основе.
Огромное число веществ получают искусственным путем. Приведите примеры. Вюрц – разработал синтез фенолов, красителей и ряда лекарств; Зинин – синтезировал анилин и красители на его основе.
Обобщение и систематизация(7мин.)
Причины многообразия органических соединений.
1. Соединиение атомов углерода в цепи разной длины.
2. Образование атомами углерода простых, двойных и тройных связей с другими атомами и между собой.
3. Разный характер углеродных цепочек: линейные, разветвленные, циклические.
4. Множество элементов, входящих в состав органических веществ.
5. Явление изомерии органических соединений.
Наука не стоит на месте в химических лабораториях каждый день синтезируются сотни новых веществ. Открываются новые реакции, разрабатываются новые способы получения органических веществ, внедряются новые методы исследования химических соединений.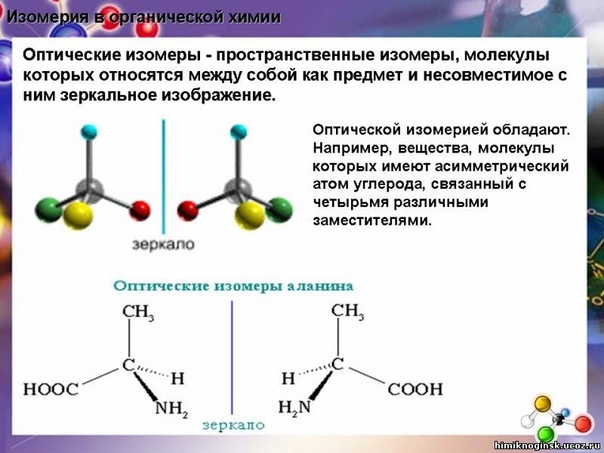 Говорят, что из известных веществ можно найти рейтинги самых дорогих, самых экстремальных. (презентация)
Говорят, что из известных веществ можно найти рейтинги самых дорогих, самых экстремальных. (презентация)
В заключение урока заполним( индивидуаоьно) кроссворд-углерод
Синквейн и Рефлексия-задача (3мин.)
Прочитайте отрывок из произведения А.К.Дойля «Собака Баскервилей»
-Боже мой!-прошептал баронет.Что это было? Где оно?
-Его уже нет,-сказал Холмс- С привидением,которое преследовало ваш род, покончено навсегда. Чудовище, лежавшее перед нами, поистине могло, кого угодно испугать своими размерами и мощью.Эта была нечистокровная ищейка ,а видимо,помесь-страшный пес величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем,глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой с ветящейся головы и ,отняв руку,увидел,что мои пальцы тоже засветились в темноте. Что сказал Холмс?Дайте описание элемента.
Домашнее задание(2мин.):
1Составьте структурные формулы неорганических и органических веществ.
2 подготовка сообщений о роли ферментов для здоровья человека?
Учитель .Выставление оценок за урок. Всего доброго!
Вещества органические и неорганические. Причины многообразия углеродных соединений. Классификация и основы номенклатуры органических соединений
Модуль состоит из пяти кадров, включающих текст, интерактивные схемы, фотографии, портреты ученых-органиков. В том числе, ученику предлагается просмотреть и прослушать интерактивную схему путем последовательного выбора активных зон для определения причин многообразия углеродных соединений.
Категория пользователей
Обучаемый, Преподаватель
Контактное время
15 минут
Интерактивность
Средняя
Дисциплины
Химия
/ Органическая химия
/ Понятия и определения органической химии
/ Предмет органической химии
/ Органическая химия как наука
/ Причины многообразия органических веществ
/ Классификация органических соединений
/ Номенклатура органических соединений
Уровень образования
Профессионально-техническая подготовка, повышение квалификации
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
информационный модуль
Место издания
Москва
Ключевые слова
вещество органическое
Автор
Морозов Михаил Николаевич
Марийский государственный технический университет
Издатель
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл.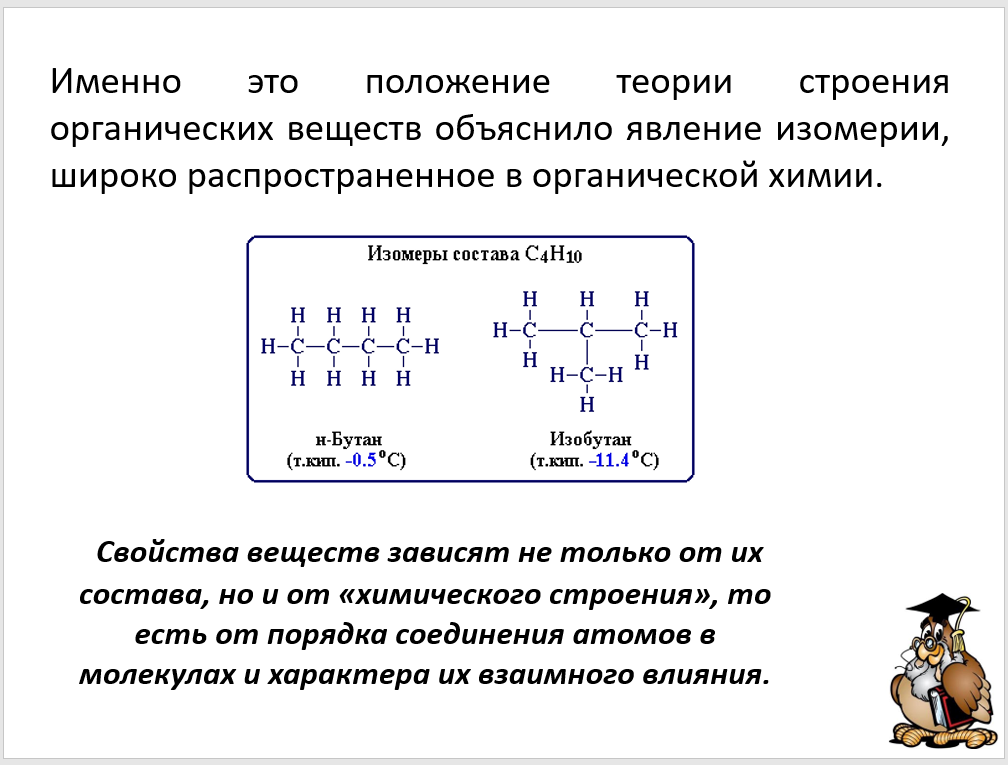 , 3,
, 3,
Сайт —
http://www.mmlab.ru
Эл. почта —
[email protected]
Правообладатель
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул., 51
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/html
Объем цифрового ИР
4 175 356 байт
Проигрыватель
OMS-player версии от 1.0
Категория модифицируемости компьютерного ИР
открытый
Признак платности
бесплатный
Наличие ограничений по использованию
есть ограничения
Рубрикация
Ступени образования
Среднее (полное) общее образование
Целевое назначение
Учебное
Тип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной школы
10
Уровень образовательного стандарта
Федеральный
Характер обучения
Базовое
Методическая разработка урока с использованием интерактивной доски по теме «Введение в органическую химию»
Методическая разработка урока с использованием интерактивной доски по теме «Введение в органическую химию»
Аннотация
Учебное пособие «Введение в органическую химию» предназначено для преподавателей химии, учащихся и студентов колледжа.
В данном пособии представлены слайд-презентация темы:
Введение в органическую химию.
Большое количество иллюстраций, анимации помогут преподавателю активизировать внимание учащихся, сделать уроки более наглядными и интересными.
Соответствует обязательному минимуму содержания образования. Даёт возможность использования с любыми учебниками.
Для создания авторской презентации использованы иллюстрации ресурсов Интернет и СD: Химия–8-11 («Учитель»), Проверь себя – Химия (Руссо-бит-М).
Составитель – Магомедова Ф .С.
Введение
На данном уроке учащиеся знакомятся и осваивают начальные понятия органической химии, необходимые для усвоения всего последующего материала. Учатся на основе углеродного скелета составлять структурные формулы углеводородов, знакомятся с теорией строения органических веществ М. А. Бутлерова. Выясняют, что свойства веществ определяются их строением, выявляют причины многообразия органических веществ.
А. Бутлерова. Выясняют, что свойства веществ определяются их строением, выявляют причины многообразия органических веществ.
Данный урок является начальным в начале изучения курса органической химии. Учащиеся узнают, что углеводороды могут быть не только насыщенными до предела валентных возможностей атомов углерода, но и с меньшим количеством атомов водорода.. Развивается понимание основных положений теории А.М. Бутлерова; высказывается предположение, которое затем реализуется на последующих уроках, — предположение о том, как строение углеводородов, отражается на их химических свойствах. Иначе говоря, закладываются основы темы, открывается логика предмета, развивается умение не фантазировать, а непосредственно видеть и понимать, что скрывается за химическими символами, структурами и формулами, давать им интерпретацию. Преподаватель вместе с учащимися размышляет, подводит их к пониманию взаимосвязи теории и экспериментальных данных о строении углеводородов. На основе уже полученных знаний учащиеся узнают, что, кроме разветвления углеродного скелета, наличие одной двойной или тройной связи предполагает существование и других видов изомерии.
Основной метод при изучении данной темы – беседа. Имеют место и элементы лекции с последующим обсуждением полученной информации. На уроке учащиеся должны уметь объяснять, как образуется структурная молекула с точки зрения электронного строения атомов (углерода и водорода), знать характеристики С-С-связи. Одновременно они расширяют свои представления о явлении изомерии. Ребята узнают о применении углеводородов. На уроке формулируется опережающее задание: составить структурные формулы органических веществ, основываясь на строении атома углерода.
Цели урока:
1.Обучающая: сформировать представление о составе органических соединений; рассмотреть особенности органических веществ; выявить причины их многообразия; продолжить формирование умения составлять структурные формулы на примере органических веществ; дать понятие об изомерии и изомерах.
2.Развивающая: Развивать умение формулировать гипотезы. Продолжить формирование умений оформления результатов заданий. Развивать способность к адекватному самоконтролю.
3.Воспитательная: Продолжить формирование научного мировоззрения учащихся.
Воспитывать культуру общения, наблюдательность, пытливость, инициативу.
Тип урока. Изучение нового материала.
Характер и форма организации учебно-познавательной деятельности учащихся:
проблемно-поисковый;
исследовательский и репродуктивный характер деятельности с применением ИКТ технологии;
самостоятельная работа.
Оборудование:
Персональный компьютер, медиапроектор, интерактивная доска, диск с презентацией «Введение в органическую химию». (Приложение 1), ЦОР (Приложение 2,3).
ТЕХНОЛОГИЧЕСКАЯ КАРТА УРОКА ПО ТЕМЕ
«ВВЕДЕНИЕ В ОРГАНИЧЕСКУЮ ХИМИЮ»
№ этапа | № слайда | Название раздела | Действие учителя (направляющие вопросы) | Действие учащегося (варианты ответов и выполнение необходимых записей в тетради) |
1. Актуализация знаний. | 1 | Введение в органическую химию. | — Наш урок посвящен знакомству с новым разделом химии — органической химией. 1.Какие вещества мы изучали ранее? — Все вещества делят на две группы: неорганические и органические. 2.Какие вещества ранее считали органическими, неорганическими? 3.Как вы думаете, почему встал вопрос о необходимости разделения веществ на органические и неорганические? 4.Как вы считаете для чего нам необходимо изучать органическую химию? | 1.Ранее мы изучали неорганические вещества. 2.Вещества считали органическими те, которые невозможно было получить в лаборатории. А неорганическими те, которые можно было получить в лаборатории. 3.В связи с развитием науки и накоплением новой информации о видах и способах получения органических веществ. 4.Знания по органической химии необходимы для того, чтобы правильно использовать свойства органических веществ. |
2. Изучение нового материала: Введение в органическую химию. | 2- главный | Содержит разделы по изучению темы «Введение в органическую химию» (алгоритм работы с презентацией по разделам) | Последовательность работы с презентацией: 1.Особенности органических веществ. 2.Состав органических веществ. 3.Многообразие органических веществ. 4.Типы связей между атомами углерода. 5.Причины многообразия органических веществ. 6.Химические свойства органических веществ. 7.Автор теории строения органических веществ. 8.Применение органических веществ. 9.Проверка знаний. | |
2- главный | Переход от слайда 2 к слайду 3 — раздел: Особенности органических веществ. | — Записываем тему урока «Введение в органическую химию» | Записывают тему урока: Введение в органическую химию» | |
3 | Раздел: Особенности органических веществ. | 1.На доске предложены формулы веществ. Выберите из них формула неорганических веществ и выпишите в столбик под соответствующим названием, а остальные в столбик слева. 2.Проверяем верно ли выполнено задание (клик курсором по рабочему столу -появляются формулы веществ, поделенные на две группы под соответствующими названиями) 3.Если вы допустили ошибки – исправляем их. 4.Найдите сходство и различие в этих группах веществ. 5.Какие вещества можно назвать органическими? — Разделять вещества на органические и неорганические стали в начале 19 века. 6.Предлжите классификацию органических веществ, которые мы теперь можем назвать углеводородами и составьте схему этой классификации. — Возврат к слайду 2-главному. | 1.Деление и запись формул органических и неорганических веществ.(работа с интерактивной доской) 2.Прверяют верно ли распределены вещества. 3.Исправляют допущенные ошибки. 4.Сходство – органические вещества имеют в составе молекул углерод и водород: различие- в одних есть кислород, в других нет. 5.Органические вещества — вещества, содержащие атомы углерода и водорода.(запись в тетради). 6.Органические вещества можно разделить на бескислородные и кислородсодержащие. Составляют схему классификации в тетради. | |
2- главный | Переход от слайда 2 к слайду 4 — раздел: Состав органических веществ. | |||
4 | Раздел: Состав органических веществ. | Обратите внимание на доске предложено уравнение реакции и ответьте: 1.Какого вещества недостает в левой части уравнения? 2.Допишите недостающее звено. (проверка – клик курсором по полю) 3.Какое вещество получилось в результате реакции — органическое или неорганическое и какой элемент оно содержит? 4.Можно ли, что утверждение «Между органическими и неорганическими веществами есть резкая граница» — Но тем не менее органические вещества имеют ряд особенностей. Сегодня мы их рассмотрим. — Возврат к слайду 2- главному. | 1.В левой части уравнения реакции недостает углерода. 2.Дописывают атом углерода и расставляют коэффициенты.(работа с интерактивной доской) 3.Неорганические вещества тоже могут содержать атомы углерода. 4.Между органическими и неорганическими веществами резкой границы нет | |
2- главный | Переход от слайда 2 к слайду 5 – раздел: Многообразие органических веществ. | |||
5 | Раздел: Многообразие органических веществ. | 1. Как вы думаете, сколько органических соединений сейчас известно? А неорганических? 2.Какая особенность характерна для органических веществ? 3.Какая особенность наблюдается при переходе в возбужденное состояние у атома углерода? — Возврат к слайду 2-главному. | 1.В настоящее время число известных органических соединений более 18 млн., в то время как неорганических – 600 тыс.) 2.Такая многочисленность является отличительной особенностью органических соединений. Делают запись: “ Многочисленность органических соединений”. 3.Углерод начинает проявлять валентность равную четырем.(работа с интерактивной доской) | |
2- главный | Переход от слайда 2 к слайду 6 — раздел: Типы связей между атомами углерода в органических веществах. | |||
6 | Раздел: Типы связей между атомами углерода в органических веществах. | 1.Какие виды связей между атомами углерода в молекулах органических веществ можно увидеть на рисунках? 2.Задание: нарисовать схемы различных видов связей между атомами углерода. 3.Какие формы углеродных цепей могут образовывать атомы углерода? 4.Задание: нарисовать схемы различных форм молекул органических веществ. — Возврат к слайду 2-главному. | 1.Соединяясь между собой, атом углерода способен образовывать различные химические связи – простые (одинарные), кратные (двойные и тройные). 2.Выполняют задание: нарисовать схемы различных видов связей между атомами углерода. 3.Главное, атом углерода способен соединяться друг с другом, образуя цепи любой длины и кольца самых причудливых конфигураций. 4.Выполняют задание: нарисовать схемы различных форм молекул органических веществ. | |
2- главный | Переход от слайда 2 к слайду 7 — раздел: Причины многообразия органических веществ. | |||
7 | Раздел: Причины многообразия органических веществ. | 1.Что является причиной многообразия органических веществ? 2. Какое явление называют изомерией? — Просмотр ЦОР (Приложение 2) — формы углеродных цепей. — Изомерия широко распространена в органической химии и является одной из особенностей органических соединений. Число изомеров с увеличением количества атомов углерода в молекуле быстро растет. Так, углеводород состава С6Н12 имеет 5 изомеров, С10Н22 – 75, С14Н30 –1858, а для углеводорода С20Н44 может существовать 366 319 изомеров! | 1.Делают вывод и запись: “Причина: атомы углерода могут соединяться друг с другом простыми и кратными связями и образовывать цепи (прямые, разветвленные и замкнутые) разной длины” 2.Явление существования изомеров называется изомерией. | |
8-10 | 1.Выполнить упражнения: Заполнить свободные валентности углерода атомами водорода. Слайд 10: — Просмотр ЦОР (Приложение 3) – название атомов углерода в углеродной цепи. — Возврат к слайду 2-главному. | Заполнение свободных валентностей углерода атомами водорода (работа на интерактивной доске с проверкой). | ||
2- главный | Переход от слайда 2 к слайду 11 — раздел: Химические свойства органических веществ. | |||
11 | Раздел: Химические свойства органических веществ. | 1.Сделайте вывод о горючести органических веществ рассмотрев предложенные рисунки. — Возврат к слайду 2-главному. | Делают вывод и запись: 1. Органические вещества обугливаются при нагревании. 2. Вывод: органические вещества горючи. | |
2- главный | Переход от слайда 2 к слайду 12 — раздел: Автор теории строения органических веществ. | |||
12 | Раздел: Автор теории строения органических веществ. | — Автором теории строения органических веществ является А.М.Бутлеров. — Возврат к слайду 2-главному. | Запись в тетради: «Автором теории строения органических веществ является А.М.Бутлеров- великий русский ученый». | |
2- главный | Переход от слайда 2 к слайду 13 — раздел: Применение органических веществ. | |||
13 | Раздел: Применение органических веществ. | — Рассмотрим применение органических веществ. — Возврат к слайду 2-главному. | Запись в тетради: Области применения органических веществ. | |
2 | Переход от слайда 2 к слайду 14 — раздел: Проверка знаний. | |||
14 | Раздел: Проверка знаний. | — Для того чтобы проверить полученные на уроке знания предлагаю выполнить тестовое задание. | Работа с интерактивной доской — выполнение тестового задания. | |
3.Рефлек-сия. | 15 | Итак, мы с вами выяснили, что органические вещества имеют ряд особенностей (повторяем их, приводим примеры). — Отмечаем работу учащихся на уроке, выставляем оценки. | Повторяют особенности органических соединений, приводят примеры. | |
4.Домаш-нее задание. | 15 | Введение в органическую химию по конспекту, § 1, 2 (Габриелян О.С., Химия 10). | Записывают домашнее задание: Введение в органическую химию по конспекту, § 1, 2 (Габриелян О.С., Химия 10). |
Основные причины многообразия органических веществ. Причины многообразия неорганических и органических веществ; взаимосвязь веществ
Слайд 1
Слайд 2
Цель урока:
рассмотреть состав, строение веществ и выявить причины их многообразия.
Слайд 3
Вещества (по строению)
молекулярные, или дальтониды (имеют постоянный состав, кроме полимеров)
немолекулярные, или бертоллиды (имеют переменный состав)
атомные ионные металлические h3, P4, Nh4 , Ch5,Ch4COOH P, SiO2 Cu, Fe NaCl, KOH
Слайд 4
Закон постоянства состава веществ
Жозеф Луи Пруст (1754 – 1826) – французский химик – аналитик. Исследование состава различных веществ, выполненное им в 1799-1803 годах, послужило основой открытия закона постоянства состава для веществ молекулярного строения.
Каждое химически чистое вещество независимо от местонахождения и способа получения имеет постоянный состав и свойства.
Слайд 5
Что показывает молекулярная формула СН4?
Вещество сложное, состоит из двух химических элементов(С,Н). Каждая молекула содержит 1 атом С, 4 атома Н. Вещество молекулярного строения, КПС. Mr= ω(С) = ω(Н) = m(С):m(H) =
12: 16= 0,75=75% 12+1 4=16 1-0,75=0,25=25% 12:4 =3:1
Слайд 6
Слайд 7
В начале XX века в Петербурге на складе военного оборудования произошла скандальная история: во время ревизии к ужасу интенданта выяснилось, что оловянные пуговицы для солдатских мундиров исчезли, а ящики, в которых они хранились, доверху заполнены серым порошком. И хотя на складе был лютый холод, горе-интенданту стало жарко. Еще бы: его, конечно, заподозрят в краже, а это ничего, кроме каторжных работ, не сулит. Спасло бедолагу заключение химической лаборатории, куда ревизоры направили содержимое ящиков: «Присланное вами для анализа вещество, несомненно, олово. Очевидно, в данном случае имело место явление, известное в химии под названием «оловянная чума».
Слайд 8
«Оловянная чума»
Белое олово устойчиво при t0 >130С
Серое олово устойчиво при t0
При t0 = -330С скорость максимальна
Слайд 9
Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Аллотропные модификации – это простые вещества, образованные атомами одного и того же химического элемента.
Слайд 10
Аллотропные модификации кислорода
О2- кислород бесцветный газ; не имеет запаха; плохо растворим в воде; температура кипения -182,9 С.
О3 – озон («пахнущий») газ бледно-фиолетового цвета; имеет резкий запах; растворяется в 10 раз лучше, чем кислород; температура кипения -111,9 С; наиболее бактерициден.
Слайд 11
Аллотропные модификации углерода
Графит Алмаз
Мягкий Имеет серый цвет Слабый металлический блеск Электропроводен Оставляет след на бумаге.
Твёрдый Бесцветный Режет стекло Преломляет свет Диэлектрик
Слайд 12
Фуллерен Карбин Графен
Твёрже и прочнее алмаза, но растягивается на четверть своей длины, точно резина. Графен не пропускает газы и жидкости, проводит тепло и электричество лучше, чем медь.
Мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), полупроводник.
Слайд 13
Ромбическая сера — вид октаэдров со срезанными углами. Светло – жёлтый порошок.
Моноклинная сера — в виде игольчатых кристаллов жёлтого цвета.
Пластическая сера- резинообразная масса тёмно –жёлтого цвета. Можно получить в виде нитей.
Слайд 14
Аллотропные модификации фосфора
Р(красный фосфор) (белый фосфор) Р4
Без запаха, не светится в темноте, не ядовит!
Имеет чесночный запах, светится в темноте, ядовит!
Слайд 15
Перед вами картина неизвестного художника. Приобрести её сможет тот, кто предложит больше всего изомеров. Стартовая цена – 2 изомера.
Слайд 16
СН2 = СН – СН2 – СН3 СН2 = С – СН3 Бутен-1 СН3 2-метилпропен-1 (метилпропен)
Тела, в которых атомы и молекулы расположены в правильном геометрическом порядке. Все кристаллические вещества имеют свою, строго определённую температуру плавления. тела, в которых атомы и молекулы расположены беспорядочно. При нагревании, не имеют определенной температуры, соответствующей переходу твердой фазы в жидкую. Кристаллические Аморфные Твёрдые вещества
Аморфные вещества Аморфные тела можно рассматривать как сильно охлажденные жидкости с очень высоким коэффициентом вязкости. У них наблюдаются слабо выраженные свойства текучести. Частицы совершенно беспорядочны и находятся на близком расстоянии друг к другу У аморфных тел нет теплового эффекта. Аморфные вещества, обладая большим запасом свободной энергии, химически более активны, чем кристаллические вещества такого же состава. Прочность аморфных веществ, ниже прочности кристаллических.
Применение аморфных веществ -осуществляется в области медицины (вещество аморфной структуры является отличным биоматериалом для имплантации в кости. Полученные специальные винты, пластины, штыри, булавки внедряют при тяжелых переломах) -осуществляется в области промышленности (изготовление стекла) -используются в качестве украшений (жемчуг, янтарь, опал) -применяются в пищевой промышленности (сахарные леденцы, жевательные резинки)
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле. Оптическая- молекулы оптических изомеров несовместимы в пространстве. Геометрическая, или цис- и- транс -характерна для веществ, содержащих двойные связи или циклические.
Аллотропные модификации кислорода Кислород Бесцветный газ; Не имеет запаха; Плохо растворим в воде; Температура кипения 182,9 С Озон Газ бледно-фиолетового цвета; Имеет резкий запах; Растворяется в 10 раз лучше, чем кислород; Температура кипения -111,9 С.
2014-06-04
Причины большого разнообразия веществ. Благодаря существованию более 100 видов атомов и их способности сочетаться между собой в разном количестве и последовательности образовались миллионы веществ. Среди них есть вещества природного происхождения. Это вода, кислород, масло, крахмал, сахароза и многие другие.
Благодаря достижениям химии стало возможным создание новых веществ даже с заранее определенными свойствами. Такие вещества вам тоже известны. Это полиэтилен, подавляющее большинство лекарств, искусственный каучук — основное вещество в составе резины, из которой изготавливают велосипедные и автомобильные шины. Поскольку веществ очень много, возникла потребность каким-то образом разделить их на отдельные группы.
Вещества разделяют на две группы — простые и сложные.
Простые вещества. Существуют вещества, в образовании которых участвуют атомы только одного вида, то есть одного химического элемента. Воспользуемся справочной табл. 4 (см. с. 39) и рассмотрим примеры. С атомов приведенного в ней химического элемента алюминия образована простое вещество алюминий. В составе этого вещества являются атомы только Алюминия. Как и алюминий, простое вещество железо образована только из атомов одного химического элемента — железа. Обратите внимание, что названия веществ принято писать со строчной буквы, а химических элементов — с большой.
Вещества, образованные атомами только одного химического элемента, называются простыми.
К простым веществам относится и кислород. Однако от алюминия и железа эта простая вещество отличается тем, что атомы кислорода, из которых она образована, соединены по два в одной молекуле. Основным веществом в составе Солнца является водород. Это простое вещество, молекулы которого состоят из двух атомов водорода.
В состав простых веществ входят или атомы, или молекулы. Молекулы простых веществ образованные из двух или более атомов одного химического элемента.
Сложные вещества. Простых веществ существует несколько сотен, тогда как сложных — миллионы. Они состоят из атомов различных элементов. И действительно, молекула сложного вещества воды содержит атомы водорода и кислорода. Метан образован атомами водорода и углерода. Обратите внимание, молекулы обоих веществ содержат атомы водорода. В молекуле воды один атом кислорода, зато в молекуле метана — один атом углерода.
Такая небольшая разница состав молекул и такие большие различия в свойствах! Метан — легковоспламеняющаяся огнеопасна вещество, вода не горит используется при тушении пожаров.
Последующим разделением веществ на группы является разделение на органические и неорганические вещества.
Органические вещества. Название этой группы веществ происходит от слова организм и касается сложных веществ, впервые были получены из организмов.
На сегодня известно более 10 млн органических веществ, и далеко не все они естественного происхождения. Примерами органических веществ являются белки, жиры, углеводы, которыми богаты продукты питания (рис. 20).
Многие органических веществ создал человек в лабораториях. Но само название «органические вещества» сохранилась. Теперь она распространяется почти на все сложные вещества, содержащие атомы углерода.
Органические вещества — это сложные вещества, молекулы которых содержат атомы углерода.
Неорганические вещества. Остальные сложных веществ, не относящихся к органическим, называются неорганическими веществами. Все простые вещества относятся к неорганическим. Неорганическими веществами является углекислый газ, питьевая сода и некоторые другие.
В телах неживой природы преобладают неорганические вещества, в телах живой природы большинство веществ — органические. На рис. 21 изображен тела неживой природы и рукотворные тела. Они образованы или неорганических веществ (рис. 21, а- г), или изготовленные из органических веществ природного происхождения искусственно созданных человеком (рис. 21, г -е).
Одна молекула сахарозы состоит из 12 атомов углерода, 22 атомов водорода, 11 атомов кислорода. Состав ее молекулы обозначают записью С12Н22О11. При пригорания обугливание) сахароза чернеет. Это происходит потому, что молекула сахарозы разлагается на простое вещество углерод (имеет черный цвет) и сложную вещество воду.
Будьте защитниками природы
Из органических веществ (полиэтилен) изготавливают разнообразные упаковочные материалы, например бутылки для газонной воды, пакеты, а также одноразовая посуда. Они прочны, легки, но не подвергаются разрушению в природе, а потому загрязняют окружающую среду. Особенно вредным является сжигание этих изделий, так как во время их горения образуются ядовитые вещества.
Защитите природу от таких загрязнений — бросать их в огонь изделия из пластмассы, собирайте их в специально отведенных местах. Советуйте своим родным и знакомым использовать биопакеты, Биопосуда, которые со временем разлагаются, не нанося вреда природе.
After a hard day, everyone wants to quickly relax on their favorite bed and get distracted by exciting videos. Any visitor to our site will be able to find an exciting video to their taste and interest. Even the most sophisticated viewer will find something worthy for himself. Our site allows each visitor to watch videos in the public domain, without any registration, and most importantly, all for free.
We offer you a wide variety of entertaining, informative, children»s, news, music, humorous videos in excellent quality, which is good news.
Informative videos will not leave anyone indifferent. They contain confirmed facts in which a detailed explanation is given in a certain subject. Such videos are lured by not only informativeness, but also by picturesqueness and picture quality. Movies about animals, nature and travel are watched with enthusiasm not only by adults, but also by children. After all, it is very interesting for everyone to follow the wildlife in the wild, thereby developing and learning something new for themselves.
Humorous videos are great for an evening out. More than ever, after a hard working day, humor will help you distract from life»s problems or laugh heartily in the company of friends. Here you can find various sketches, stand-ups, pranks, video jokes and various comedy shows.
Music in the life of every person is very important. It motivates each of us, uplifting, forcing us to move forward. For any visitor, we have excellent collections of music videos, including a large number of different genres and styles, foreign and domestic artists. Even if you»re passionate about something, music videos are great for listening in the background.
Video news is the most spectacular format of modern news. On our site you can find a variety of news videos on any topic that is fascinating to you. News from the official media, sports, science, technology, fashion news, politics news, scandalous events from the world of show business and much more. You will always be up to date with all the latest interesting, and most important news and events in the world.
Young children are very active, but sometimes they need to be interested in something to go about their business or just relax with a cup of coffee. In this matter, cartoons will help parents perfectly. After all, it is the cartoons that will help attract your child for several hours. We have a wide variety of old and new cartoons, short and full-length. For any age and any interests. Your child will be delighted, and you will be distracted.
We are very pleased that our site will be able to help you in various life situations. We tried to find suitable content for our viewers. We wish you a pleasant viewing.
На уроке будут рассмотрены типы кристаллических решеток, типы агрегатных состояний вещества и твердые тела с кристаллической структурой. Вводится понятие полиморфизма и аллотропии.
I. Повторение
Повторите из курса 8 класса:
II. Многообразие веществ в окружающем мире
В настоящее время известно более 100 химических элементов. Они образуют более 400 простых веществ и несколько миллионов самых разнообразных сложных химических соединений. Каковы причины такого многообразия?
1. Изотопия элементов и их соединений
Изотопы
— разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой.
Например, у атома водорода три изотопа: 1 1 Н — протий, 1 2 Н (D) — дейтерий и 1 3 Н (Т) — тритий. Они с кислородом образуют сложное вещество — воду различного состава: обычная природная вода — Н 2 О, тяжёлая вода — D 2 O(содержится в природной воде в соотношении Н: D = 6900: 1).
Изобары
,
атомы различных химических элементов с одинаковым массовым числом А.
Ядра изобары (в химии) содержат равное число нуклонов, но различные числа протонов Z и нейтронов N.
Например, атомы 4 10 Be, 5 10 B, 6 10 C представляют собой три Изобары (в химии) с A = 10.
2. Аллотропия
Аллотропия
— явление существования химического элемента в виде нескольких простых веществ (аллотропных видоизменений или аллотропных модификаций).
Например, атом кислорода встречается в виде кислорода и озона.
Аудио-определение: “
Аллотропия
”
Аллотропия объ-яс-ня-ет-ся раз-лич-ным со-ста-вом ве-ще-ства или раз-ли-чи-ем в их кри-стал-ли-че-ской ре-шет-ке. Кис-ло-род и озон — ал-ло-троп-ные мо-ди-фи-ка-ции хи-ми-че-ско-го эле-мен-та кис-ло-ро-да. Уг-ле-род об-ра-зу-ет гра-фит, алмаз, фул-ле-рен, кар-бин. Рас-по-ло-же-ние ато-мов в их кри-стал-ли-че-ских ре-шет-ках раз-ное, и по-это-му они про-яв-ля-ют раз-ные свой-ства. У фос-фо-ра ал-ло-троп-ные ве-ще-ства — крас-ный, белый и чер-ный фос-фор. Ал-ло-тро-пия ха-рак-тер-на и для ме-тал-лов. На-при-мер, же-ле-зо может су-ще-ство-вать в виде α, β, δ, γ.
Те-ку-честь аморф-ных ве-ществ
Одним из свойств, по ко-то-рым от-ли-ча-ют-ся аморф-ные тела от жид-ких, яв-ля-ет-ся их те-ку-честь. Если по-ло-жить ку-со-чек смолы на на-гре-тую по-верх-ность, то он по-сте-пен-но рас-те-чет-ся по этой по-верх-но-сти.
Вяз-кость
— это спо-соб-ность со-про-тив-лять-ся пе-ре-ме-ще-нию одних ча-стей тела от-но-си-тель-но дру-гих для жид-ко-стей и газов: чем она выше, тем слож-нее из-ме-нить форму тела. Окон-ные стек-ла — это ти-пич-ные аморф-ные ве-ще-ства. Тео-ре-ти-че-ски они долж-ны по-сте-пен-но сте-кать вниз. Но вяз-кость стек-ла вы-со-кая, и его де-фор-ма-ци-ей можно пре-не-бречь. Вяз-кость стек-ла при-мер-но в 1000 раз выше вяз-ко-сти смолы. За год де-фор-ма-ция стек-ла со-став-ля-ет 0,001%. За 1000 лет де-фор-ма-ция стек-ла со-став-ля-ет 1%.
Зависимость агрегатного состояния от дальнего и ближнего порядка расположения
В за-ви-си-мо-сти от дав-ле-ния и тем-пе-ра-ту-ры, все ве-ще-ства могут су-ще-ство-вать в раз-лич-ных аг-ре-гат-ных со-сто-я-ни-ях: твер-дом, жид-ком, га-зо-об-раз-ном или в виде плаз-мы. При низ-ких тем-пе-ра-ту-рах и вы-со-ком дав-ле-нии все ве-ще-ства су-ще-ству-ют в твёр-дом аг-ре-гат-ном со-сто-я-нии. Твер-дое и жид-кое со-сто-я-ние ве-ще-ства на-зы-ва-ют кон-ден-си-ро-ван-ным.
В твер-дых телах ча-сти-цы рас-по-ла-га-ют-ся ком-пакт-но, в опре-де-лен-ном по-ряд-ке. В за-ви-си-мо-сти от сте-пе-ни упо-ря-до-чен-но-сти ча-стиц в твер-дых телах опре-де-ля-ют 2 фа-зо-вых со-сто-я-ния: кри-стал-ли-че-ское и аморф-ное. Если ча-сти-цы рас-по-ла-га-ют-ся таким об-ра-зом, что между со-сед-ни-ми ча-сти-ца-ми есть неко-то-рая упо-ря-до-чен-ность в рас-по-ло-же-нии, а имен-но: по-сто-ян-ное рас-сто-я-ние и углы между ними
, такое яв-ле-ние на-зы-ва-ют на-ли-чие ближ-не-го по-ряд-ка в рас-по-ло-же-нии.
Рис. а.
A б
Рис. 1. На-ли-чие ближ-не-го и даль-не-го по-ряд-ка в рас-по-ло-же-нии ча-стиц
Если же ча-сти-цы рас-по-ло-же-ны таким об-ра-зом, что упо-ря-до-чен-ность на-блю-да-ет-ся и между бли-жай-ши-ми со-се-дя-ми, и на го-раз-до боль-ших рас-сто-я-ни-ях
, это на-зы-ва-ют на-ли-чие даль-не-го по-ряд-ка
. Рис. б.
Примеры аморфных веществ
Аморф-ное тело
(от греч А — не, morfe — форма) — бес-фор-мен-ные ве-ще-ства. В них су-ще-ству-ет толь-ко ближ-ний по-ря-док и нет даль-не-го по-ряд-ка.
При-ме-ры аморф-ных тел при-ве-де-ны на рис. 2.
Рис. 2. Аморф-ные тела
Это воск, стек-ло, пла-сти-лин, смола, шо-ко-лад.
Свой-ства аморф-ных ве-ществ
- Имеют толь-ко ближ-ний по-ря-док (как в жид-ко-стях).
- Твер-дое аг-ре-гат-ное со-сто-я-ние при нор-маль-ных усло-ви-ях.
- Нет чет-кой тем-пе-ра-ту-ры плав-ле-ния. Пла-вят-ся в ин-тер-ва-ле тем-пе-ра-тур.
Кристаллические вещества
В кри-стал-ли-че-ском
теле су-ще-ству-ет и ближ-ний, и даль-ний по-ря-док. Если мыс-лен-но со-еди-нить точки, обо-зна-ча-ю-щие линии, по-лу-чит-ся про-стран-ствен-ный кар-кас, ко-то-рый на-зы-ва-ет-ся кри-стал-ли-че-ской ре-шет-кой. Точки, в ко-то-рых раз-ме-ще-ны ча-сти-цы — ионы, атомы или мо-ле-ку-лы — на-зы-ва-ют уз-ла-ми кри-стал-ли-че-ской ре-шет-ки (рис. 3). Ча-сти-цы не жест-ко фик-си-ро-ва-ны в узлах, они могут немно-го ко-ле-бать-ся, не убе-гая из этих точек. В за-ви-си-мо-сти от того, какие ча-сти-цы на-хо-дят-ся в узлах кри-стал-ли-че-ской ре-шет-ки, вы-де-ля-ют её типы (табл. 1).
Рис. 3. Кри-стал-ли-че-ская ре-шет-ка
Зависимость свойств от типа кристаллической решетки
Фи-зи-че-ские свой-ства ве-ществ с раз-лич-ны-ми ти-па-ми кри-стал-ли-че-ских ре-ше-ток
Табл.1. Фи-зи-че-ские свой-ства ве-ществ
Су-ще-ству-ет несколь-ко под-ти-пов кри-стал-ли-че-ских ре-ше-ток, раз-ли-ча-ю-щих-ся рас-по-ло-же-ни-ем ато-мов в про-стран-стве.
В ве-ще-ствах с атом-ной, ион-ной, ме-тал-ли-че-ской кри-стал-ли-че-ской ре-шет-ка-ми нет мо-ле-кул — это немо-ле-ку-ляр-ные ве-ще-ства.
Мо-ле-ку-ляр-ные ве-ще-ства
— с мо-ле-ку-ляр-ной кри-стал-ли-че-ской ре-шет-кой.
Полиморфизм
По-ли-мор-физм
— это яв-ле-ние, при ко-то-ром слож-ные ве-ще-ства оди-на-ко-во-го со-ста-ва имеют раз-ные кри-стал-ли-че-ские ре-шет-ки.
На-при-мер, пирит и мар-ка-зит. Их фор-му-ла — FeS2.Но они и вы-гля-дят по-раз-но-му, и об-ла-да-ют раз-лич-ны-ми фи-зи-че-ски-ми свой-ства-ми. Ана-ло-гич-но, раз-лич-ны-ми фи-зи-че-ски-ми свой-ства-ми об-ла-да-ют ми-не-ра-лы со-ста-ва CaCO3: ара-го-нит, мра-мор, ис-ланд-ский шпат, мел.
25.1: Органическая химия — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Органическая химия
- Резюме
- Авторы и авторства
Сколько всего углеродсодержащих молекул? Текущая оценка составляет около 20 миллионов различных органических соединений, о которых мы знаем.Почему неопределенность? Каждый день ученые придумывают новые соединения. Некоторые из этих материалов представляют интерес для исследовательского проекта, тогда как другие предназначены для разработки для коммерческого рынка. Как только мы думаем, что знаем, сколько существует органических соединений, мы открываем новые, и наше количество быстро устаревает.
Органическая химия
Когда-то в истории считалось, что только живые существа были способны синтезировать углеродсодержащие соединения, присутствующие в клетках.По этой причине к этим соединениям был применен термин «органические». В конце концов было доказано, что углеродсодержащие соединения можно синтезировать из неорганических веществ, но термин «органические» остался. В настоящее время органических соединений определяются как соединения с ковалентной связью, содержащие углерод, за исключением карбонатов и оксидов. Согласно этому определению, такие соединения, как двуокись углерода \ (\ left (\ ce {CO_2} \ right) \) и карбонат натрия \ (\ left (\ ce {Na_2CO_3} \ right) \), считаются неорганическими. Органическая химия — это исследование всех органических соединений.
Органическая химия — очень обширный и сложный предмет. Есть миллионы известных органических соединений, что намного больше, чем количество неорганических соединений. Причина кроется в уникальности структуры углерода и его адгезионных способностях. Углерод имеет четыре валентных электрона и, следовательно, образует четыре отдельные ковалентные связи в соединениях. Углерод обладает способностью многократно связываться с самим собой, образуя длинные цепочки атомов углерода, а также кольцевые структуры.Эти связи могут быть одинарными, двойными или тройными ковалентными связями. Углерод легко образует ковалентные связи с другими элементами, в первую очередь с водородом, кислородом, азотом, галогенами и некоторыми другими неметаллами. На рисунках ниже показаны модели двух из множества органических соединений в виде шариков и клюшек.
Рисунок \ (\ PageIndex {1} \): Стеариновая кислота состоит из множества атомов углерода (черный) и водорода (белый), а также двух атомов кислорода (красный).
Родственная область биохимии до некоторой степени пересекается с органической химией. Биохимия — это исследование химии живых систем. Многие биохимические соединения считаются органическими химическими веществами. Обе молекулы, показанные выше, являются биохимическими материалами с точки зрения их использования в организме, но являются органическими химическими веществами с точки зрения их структуры и химической активности.
Рисунок \ (\ PageIndex {2} \): метионин состоит из атомов углерода, водорода, кислорода, азота (синий) и серы (желтый).
Сводка
- Органическая химия определяется.
- Описаны примеры органических химикатов.
Авторы и ссылки
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Органическая химия:
Органическая химия:
Состав и номенклатура углеводородов
Что такое органическое соединение?
Когда вы подъезжаете к насосу на некоторых заправках, вы сталкиваетесь с множеством
выбор.
Вы можете купить этилированный газ или различные формы неэтилированного газа,
имеют разные октановые числа. Когда вы наполняете резервуар, вы можете задаться вопросом: «Что такое
«этилированный» газ, и почему они добавляют свинец в газ? »Или:« Что я получу за свой
денег, если я купил бензин премиум-класса с более высоким октановым числом? »
Затем вы прекращаете покупать лекарства от боли в спине, которая вас беспокоит.
с тех пор, как вы помогли другу переехать в новую квартиру. И снова вы столкнулись с
варианты (см. рисунок ниже).Вы можете купить аспирин, который использовался почти
сотня лет. Или Тайленол, который содержит ацетаминофен. Или более современное обезболивающее,
например ибупрофен. Пока вы решаете, какой препарат купить, вы можете задаться вопросом: «Что
Чем отличаются эти препараты? »и даже« Как они действуют? »
Затем вы едете в кампус, где сидите на «пластиковом» стуле, чтобы съесть
сэндвич, завернутый в «пластик», не беспокоясь о том, почему один из
эти пластмассы гибкие, а другие жесткие.Пока вы едите, друг останавливается
и начинает дразнить вас о влиянии вашей диеты на уровень холестерина в
ваша кровь, что вызывает вопросы: «Что такое холестерин?» и почему
неужели так много людей беспокоятся об этом? «
Ответы на каждый из этих вопросов относятся к области, известной как органических
Химия . Более 200 лет химики разделили материалы на два
категории. Те, которые были выделены из растений и животных, были классифицированы как органические ,
в то время как те, которые восходят к минералам, были неорганическими .В свое время химики
считали, что органические соединения принципиально отличаются от тех, которые были
неорганические, потому что органические соединения содержат жизненной силы , которая была только
найдено в живых системах.
Первый шаг в упадке теории жизненной силы произошел в 1828 году, когда
Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Волер пытался
сделать цианат аммония (NH 4 OCN) из цианата серебра (AgOCN) и аммония
хлорид (NH 4 Cl).То, что он ожидал, описывается следующим уравнением.
AgOCN ( водн. ) + NH 4 Cl ( водн. ) AgCl ( с ) + NH 4 OCN ( водн. )
Продукт, который он выделил в этой реакции, не имел свойств цианата.
соединения. Это был белый кристаллический материал, идентичный мочевине, H 2 NCONH 2 ,
которые можно выделить из мочи.
Ни Велер, ни его современники не утверждали, что его результаты опровергают жизненно важные
теория силы.Но его результаты привели в действие серию экспериментов, которые привели к
синтез различных органических соединений из неорганических исходных материалов. Этот
неизбежно привело к исчезновению «жизненной силы» из списка теорий
это имело какое-либо отношение к химии, хотя и не привело к смерти теории,
у которого все еще были сторонники более 90 лет спустя.
Если разница между органическими и неорганическими соединениями не в наличии
таинственная жизненная сила, необходимая для их синтеза, на чем основано различение
между этими классами соединений? Большинство соединений, извлеченных из живых организмов, содержат
углерод.Поэтому возникает соблазн идентифицировать органическую химию как химию углерода.
Но это определение будет включать такие соединения, как карбонат кальция (CaCO 3 ),
а также элементарные формы углеродного алмаза
и графит, которые явно неорганические.
Поэтому мы определим органическую химию как химию соединений, содержащих
как углерод, так и водород .
Хотя органическая химия фокусируется на соединениях, содержащих углерод и водород,
более 95% соединений, выделенных из природных источников или синтезированных в
лаборатории органические.Особая роль углерода в химии элементов заключается в
результат комбинации факторов, включая количество валентных электронов на
нейтральный атом углерода, электроотрицательность углерода и атомный радиус углерода
атомов (см. таблицу ниже).
Физические свойства углерода
| Электронная конфигурация | 1 с 2 2 с 2 2 п 2 | |
| Электроотрицательность | 2.55 | |
| Ковалентный радиус | 0,077 нм |
Углерод имеет четыре валентных электрона 2 с 2
2 p 2 и он должен
либо получить четыре электрона, либо потерять четыре электрона, чтобы достичь конфигурации инертного газа. В
электроотрицательность углерода слишком мала, чтобы углерод мог получать электроны от большинства элементов
чтобы образовать ионы C 4-, и слишком большие, чтобы углерод терял электроны с образованием C 4+
ионы.Таким образом, углерод образует ковалентные связи с большим количеством других элементов,
включая водород, азот, кислород, фосфор и серу, обнаруженные в живых системах.
Поскольку они относительно малы, атомы углерода могут подходить достаточно близко друг к другу, чтобы образовать
сильные двойные связи C = C или даже CC
тройные связи. Углерод также образует прочные двойные и тройные связи с азотом и кислородом. Это
может даже образовывать двойные связи с такими элементами, как фосфор или сера, которые не образуют
двойные связи с собой.
Несколько лет назад на беспилотном космическом корабле «Викинг» были проведены эксперименты, призванные
поиск свидетельств жизни на Марсе. Эти эксперименты основывались на предположении, что
живые системы содержат углерод, и отсутствие каких-либо доказательств существования углеродной жизни на
Предполагалось, что эта планета означает, что жизни не существует. Несколько факторов делают углерод
необходимо для жизни.
- Легкость, с которой атомы углерода образуют связи с другими атомами углерода.
- Прочность одинарных связей CC и
ковалентные связи углерода с другими неметаллами, такими как N, O, P и S. - Способность углерода образовывать множественные связи с другими неметаллами, включая C, N, O, P,
и атомы S.
Эти факторы обеспечивают почти бесконечное разнообразие потенциальных структур для органических
соединения, такие как витамин C, показаны на рисунке ниже.
Никакой другой элемент не может обеспечить разнообразие комбинаций и перестановок, необходимых для
жизнь существовать.
Насыщенные углеводороды или алканы
Соединения, содержащие только углерод и водород, известны как углеводородов .
Те, которые содержат как можно больше атомов водорода, называются насыщенными .
Насыщенные углеводороды также известны как алканов .
Самый простой алкан — метан: CH 4 . Структура Льюиса метана может быть
генерируется путем объединения четырех электронов в валентной оболочке нейтрального атома углерода
с четырьмя атомами водорода, чтобы сформировать соединение, в котором атом углерода разделяет в общей сложности
восемь валентных электронов с четырьмя атомами водорода.
Метан является примером общего правила, согласно которому углерод четырехвалентный ; Это
образует всего четыре связи почти во всех своих соединениях. Чтобы свести к минимуму отталкивание
между парами электронов в четырех КД
связей, геометрия вокруг атома углерода является тетраэдрической, как показано на рисунке ниже.
Алкан, содержащий три атома углерода, известен как пропан, имеющий формулу
C 3 H 8 и следующую структуру скелета.
Четырехуглеродный алкан представляет собой бутан с формулой C 4 H 10 .
Наименования, формулы и физические свойства различных алканов с общим
Формула C n H 2 n +2 приведены в таблице ниже. В
точки кипения алканов постепенно увеличиваются с увеличением молекулярной массы этих алканов.
соединения. При комнатной температуре более легкие алканы являются газами; средние алканы
жидкости; а более тяжелые алканы — твердые вещества или смолы.
Насыщенные углеводороды или алканы
| Имя | Молекулярный Формула | Плавка Точка ( o C) | Кипячение Точка ( o C) | Состояние при 25 o C | ||||
| метан | CH 4 | -182.5 | –164 | газ | ||||
| этан | С 2 В 6 | -183,3 | -88,6 | газ | ||||
| пропан | С 3 В 8 | -189.7 | -42,1 | газ | ||||
| бутан | С 4 В 10 | -138,4 | -0,5 | газ | ||||
| пентан | С 5 В 12 | -129.7 | 36,1 | жидкость | ||||
| гексан | С 6 В 14 | -95 | 68,9 | жидкость | ||||
| гептан | С 7 В 16 | -90.6 | 98,4 | жидкость | ||||
| октановое число | С 8 В 18 | -56,8 | 124,7 | жидкость | ||||
| нонан | С 9 В 20 | -51 | 150.8 | жидкость | ||||
| декан | С 10 В 22 | -29,7 | 174,1 | жидкость | ||||
| ундекан | С 11 В 24 | -24,6 | 195.9 | жидкость | ||||
| додекан | С 12 В 26 | -9,6 | 216,3 | жидкость | ||||
| эйкозан | С 20 В 42 | 36,8 | 343 | цельный | ||||
| триаконтан | С 30 В 62 | 65.8 | 449,7 | цельный |
Все алканы в приведенной выше таблице представляют собой углеводороды с прямой цепью , в
атомы углерода образуют цепочку, идущую от одного конца молекулы до другого.
Общую формулу этих соединений можно понять, если предположить, что они содержат
цепочки групп CH 2 с дополнительным атомом водорода, блокирующим каждый конец
цепь.Таким образом, на каждые n атомов углерода должно приходиться 2 n + 2 водорода.
атомы: C n H 2 n +2 .
Поскольку две точки определяют линию, углеродный скелет молекулы этана является линейным,
как показано на рисунке ниже.
Поскольку валентный угол в тетраэдре равен 109,5, молекулы алканов, содержащие три
или четыре атома углерода больше нельзя рассматривать как «линейные», как показано на
рисунок ниже.
| Пропан | Бутан |
В дополнение к примерам с прямой цепью, рассмотренным до сих пор, алканы также образуют с разветвленной цепью
конструкции. Наименьший углеводород, в котором может быть разветвление, имеет четыре атома углерода.
Это соединение имеет ту же формулу, что и бутан (C 4 H 10 ), но
разная структура.Соединения с одинаковой формулой и разными структурами известны как
изомеров (от греческого isos , «равный» и meros ,
«части»). Когда он был впервые обнаружен, разветвленный изомер с формулой C 4 H 10
поэтому было дано название изобутан .
Изобутан
Лучший способ понять разницу между структурами бутана и
изобутан предназначен для сравнения шаровых моделей этих соединений, показанных на рисунке.
ниже.
| Бутан | Изобутан |
Бутан и изобутан называются конституционными изомерами , потому что они
буквально различаются по своему телосложению. Один содержит две группы CH 3 и две группы CH 2
группы; другой содержит три группы CH 3 и одну группу CH.
Существует три структурных изомера пентана: C 5 H 12 . В
первый — это «нормальный» пентан или n -пентан.
Также возможен разветвленный изомер, первоначально названный изопентаном. Когда больше
был открыт сильно разветвленный изомер, названный неопентаном (новый изомер
пентан).
Шаровидные модели трех изомеров пентана показаны на рисунке ниже.
| н-пентан | Изопентан |
| Неопентан |
Имеются два конституционных изомера с формулой C 4 H 10 ,
три изомера C 5 H 12 и пять изомеров C 6 H 14 .Количество изомеров соединения быстро увеличивается с добавлением дополнительных атомов углерода. Там
составляют более 4 миллиардов изомеров, например, для C 30 H 62 .
Циклоалканы
Если углеродная цепь, образующая основную цепь углеводорода с прямой цепью, длинная
достаточно, мы можем представить, как два конца соединяются, образуя циклоалкан .
Для образования связи CC, замыкающей кольцо, необходимо удалить по одному атому водорода с каждого конца углеводородной цепи.Циклоалканы
следовательно, имеют на два атома водорода меньше, чем исходный алкан, и общая формула C n H 2n .
Наименьшим алканом, который может образовывать кольцо, является циклопропан, C 3 H 6 ,
в котором три атома углерода лежат в одной плоскости. Угол между соседними связями CC составляет всего 60, что очень много.
меньше угла 109,5 в тетраэдре, как показано на рисунке ниже.
Циклопропан, следовательно, подвержен химическим реакциям, которые могут открыть
трехчленное кольцо.
Любая попытка заставить четыре атома углерода, которые образуют циклобутановое кольцо, перейти в плоскость
атомы образуют структуру, показанную на рисунке ниже, в которой угол между
смежные CC облигации будут 90.
Таким образом, один из четырех атомов углерода в циклобутановом кольце смещен из
плоскости трех других, чтобы сформировать «сморщенную» структуру, которая нечетко
напоминает крылья бабочки.
Угол между соседними связями CC в
плоская молекула циклопентана будет 108, что близко к идеальному углу вокруг
тетраэдрический атом углерода.Циклопентан не является плоской молекулой, как показано на рисунке.
ниже, потому что смещение двух атомов углерода из плоскости трех других
образует сморщенную структуру, которая частично снижает отталкивание между водородом.
атомы на соседних атомах углерода в кольце.
К тому времени, когда мы дойдем до шестичленного кольца в циклогексане, сморщенная структура может быть
образованный смещением пары атомов углерода на обоих концах кольца из плоскости
остальные четыре члена кольца.Один из этих атомов углерода наклонен вверх из
кольцо, в то время как другой наклоняется вниз, образуя структуру «стул», показанную на
рисунок ниже.
Вращение вокруг C C Связи
Если посмотреть на структуру молекулы этана, легко попасть в ловушку.
думать об этой молекуле, как если бы она была статичной. Ничего не может быть дальше от
правда.При комнатной температуре средняя скорость молекулы этана примерно на 500 м / с более чем в два раза превышает скорость Boeing 747.
Во время движения в пространстве молекула кувыркается вокруг своего центра тяжести, как
самолет вышел из-под контроля. В то же время связи CH и CC колеблются.
как пружина со скоростью 9 x 10 13 с -1 .
Есть еще один способ перемещения молекулы этана. Группы CH 3
на любом конце молекулы может вращаться относительно каждого вокруг связи CC.Когда это происходит, молекула проходит
через бесконечное количество конформаций , которые имеют немного разные
энергии. Наивысшая энергетическая конформация соответствует структуре, в которой водород
атомы «затмеваются». Если рассматривать молекулу вдоль связи CC, атомы водорода на одной CH 3
группа закроет другие, как показано на рисунке ниже.
Конформация с наименьшей энергией — это структура, в которой атомы водорода
«в шахматном порядке», как показано на рисунке ниже.
Разница между затменной и шахматной конформациями этана наилучшая.
проиллюстрировано просмотром этих молекул вдоль связи CC, как показано на рисунке ниже.
| Затмение | В шахматном порядке |
Разница между энергиями этих конформаций относительно
маленький, всего около 12 кДж / моль.Но он достаточно велик, чтобы вращение вокруг связи CC не было плавным. Хотя частота
этого вращения составляет порядка 10 10 оборотов в секунду, этан
молекула проводит немного больший процент времени в шахматной конформации.
Различные конформации молекулы часто описываются в терминах Newman
Ашхабад . Эти линейные рисунки показывают шесть заместителей на связи CC, как если бы структура молекулы
проецируется на лист бумаги, направляя яркий свет вдоль CC-связи в шарообразной модели
молекула.Показаны проекции Ньюмана для различных ступенчатых конформаций бутана.
на рисунке ниже.
Из-за легкости вращения вокруг связей CC, существует несколько конформаций некоторых циклоалканов.
описано в предыдущем разделе. Циклогексан, например, образует как
Соответствие «кресло» и «лодка» показано на рисунке ниже.
| Стул | Лодка |
Разница между энергиями конформации кресла, в котором водород
атомы расположены в шахматном порядке, и форма лодочки, в которой они затмеваются, составляет около 30
кДж / моль.В результате, даже если скорость, с которой эти две конформации обмениваются, равна
примерно 1 x 10 5 с -1 , можно предположить, что большинство молекул циклогексана на
в любой момент времени находятся в конформации стула.
Номенклатура алканов
Обычных названий, таких как пентан, изопентан и неопентан, достаточно для
различают три изомера по формуле C 5 H 12 .Они
становятся менее полезными, однако, по мере увеличения размера углеводородной цепи.
Международный союз теоретической и прикладной химии (IUPAC) разработал
Системный подход к названию алканов и циклоалканов основан на следующих этапах.
- Найдите самую длинную непрерывную цепочку атомов углерода в структуре скелета. Назовите
соединение как производное алкана с таким числом атомов углерода. Следующие
соединение, например, является производным пентана, потому что самая длинная цепь содержит пять
атомы углерода.
- Назовите заместители в цепи. Заместители, производные от алканов, названы
замена — ane заканчивая — yl . Это соединение содержит метил (CH 3 -)
заместитель.
- Пронумеруйте цепь, начиная с конца, ближайшего к первому заместителю, и укажите
атомы углерода, на которых расположены заместители. Используйте минимально возможные числа.Этот
соединение, например, 2-метилпентан, а не 4-метилпентан.
- Используйте префиксы di -, tri — и tetra — для описания
заместители, которые встречаются два, три или четыре раза в одной и той же цепи атомов углерода. - Расположите названия заместителей в алфавитном порядке.
Ненасыщенные углеводороды: алкены
и Алкины
Carbon не только образует прочный CC
одинарные связи, обнаруженные в алканах, он также образует прочные двойные связи C = C.Соединения, которые
содержат двойные связи C = C, когда-то были известны как олефины (буквально, «чтобы образовать
масло «), потому что они трудно кристаллизоваться (они, как правило, остаются маслянистыми жидкостями, когда
охлаждение.) Эти соединения теперь называются алкенами . Простейший алкен имеет
формула C 2 H 4 и следующая структура Льюиса.
Связь между алканами и алкенами можно понять по
думаю о следующей гипотетической реакции.Начнем с разрыва связи в H 2
молекулы, так что один из электронов попадает на каждый из атомов водорода. Мы делаем то же самое
одна из связей между атомами углерода в алкене. Затем мы позволяем
неспаренный электрон на каждом атоме водорода для взаимодействия с неспаренным электроном на углероде
атома с образованием новой связи CH.
Таким образом, теоретически мы можем превратить алкен в исходный алкан, добавив H 2
молекула через двойную связь C = C.На практике эта реакция происходит только при высоком
давления в присутствии подходящего катализатора, такого как кусок металлического никеля.
Поскольку алкен можно рассматривать как производное алкана, из которого H 2
молекула была удалена, общая формула для алкена с одной двойной связью C = C: C n H 2n .
Алкены являются примерами ненасыщенных углеводородов , поскольку они имеют
меньше атомов водорода, чем у соответствующих алканов.Когда-то они были названы добавлением
суффикс — ene к названию заместителя, имеющего такое же количество углерода
атомы.
В номенклатуре алкенов ИЮПАК эти соединения называются производными от исходного
алканы. На наличие двойной связи C = C указывает изменение — ane
окончание названия исходного алкана на -ен .
Расположение двойной связи C = C в каркасной структуре соединения
обозначается указанием номера атома углерода, с которого начинается связь C = C.
Затем названия заместителей добавляются в качестве префиксов к названию алкена.
Соединения, содержащие тройные связи CC, называются алкинами . Эти соединения имеют четыре
меньше атомов водорода, чем в исходных алканах, поэтому общая формула алкина с
одиночный CC
тройная связь — C n H 2n-2 . Простейший алкин имеет формулу C 2 H 2
и известен под общим названием ацетилен .
В номенклатуре IUPAC для алкинов эти соединения называются производными от исходного
алкан, с окончанием -yne вместо -ane .
Помимо соединений, содержащих одну двойную связь ( алкенов, ) или одну тройную
связь ( алкинов ), мы также можем представить себе соединения с двумя двойными связями ( диенов ),
три двойные связи ( триена, ) или комбинация двойных и тройных связей.
Органическая химия: структура и номенклатура углеводородов
Состав и номенклатура
Углеводороды |
Изомеры
| Реакции алканов, алкенов и алкинов
| Углеводороды
| Нефть и уголь
|
Хиральность и оптическая активность
Периодический
Стол |
Периодическая таблица |
Глоссарий
| Классные Апплеты
Обзор темы
Gen Chem
|
Главная страница справки по общей химии
|
Поиск:
веб-сайт общей химии.
органических соединений | Протокол
3.7: Органические соединения
Все живые существа состоят в основном из углеродных соединений, называемых органическими соединениями. В категорию органических соединений входят как природные, так и синтетические соединения, содержащие углерод. Хотя единого точного определения химическому сообществу еще предстоит найти, большинство согласны с тем, что определяющей чертой органических молекул является присутствие углерода в качестве основного элемента, связанного с водородом и другими атомами углерода.Однако некоторые углеродсодержащие соединения, такие как карбонаты, цианиды и простые оксиды (CO и CO 2 ), не классифицируются как органические соединения.
Органические соединения являются ключевыми компонентами пластмасс, мыла, парфюмерии, подсластителей, тканей, фармацевтических препаратов и многих других веществ, используемых ежедневно. Органические соединения включают соединения, происходящие от живых организмов и синтезированные химиками. Существование широкого спектра органических молекул является следствием способности атомов углерода образовывать до четырех прочных связей с другими атомами углерода, что приводит к образованию цепей и колец самых разных размеров, форм и сложности.
Углеводороды
Простейшие органические соединения содержат только элементы углерод и водород и называются углеводородами. Углеводороды могут различаться типами углерод-углеродных связей, присутствующих в их молекулах. Алканы, содержащие только одинарные связи, называются алканами, а те, которые содержат двойные или тройные связи, — алкенами и алкинами соответственно. Хотя все углеводороды состоят только из двух типов атомов (углерода и водорода), существует большое разнообразие углеводородов, поскольку они могут состоять из цепей разной длины, разветвленных цепей и колец из атомов углерода или комбинаций этих структур.
| Бутан (C 4 H 10 ) | Изобутан (C 4 H 10 ) | Циклобутан (C 4 H 8 ) |
Углеводороды используются каждый день, в основном в качестве топлива, такого как природный газ, ацетилен, пропан, бутан, а также основные компоненты бензина, дизельного топлива и топочного мазута.Алканы или насыщенные углеводороды содержат только одинарные ковалентные связи между своими атомами углерода. Такие свойства, как точка плавления и точка кипения, обычно изменяются предсказуемо, поскольку количество атомов углерода и водорода в молекулах изменяется.
Чтобы назвать простой алкан, сначала укажите имя основания в зависимости от количества атомов углерода в цепи (meth = 1, eth = 2, prop = 3, but = 4, pent = 5, hex = 6, hept = 7 , oct = 8, non = 9 и dec = 10). За именем основания следует суффикс — определяется тем, является ли углеводород алканом (-ан), алкеном (-ен) или алкином (-ин).Например, двухуглеродный алкан называется этаном; трехуглеродный алкан называется пропаном; а четырехуглеродный алкан называется бутаном. Более длинные цепи называются следующим образом: пентан (5-углеродная цепь), гексан (6), гептан (7), октан (8), нонан (9) и декан (10).
Алкены и алкины представляют собой ненасыщенные углеводороды, содержащие двойные и тройные связи, соответственно, по крайней мере между двумя атомами углерода. Их номенклатура повторяет те же шаги, что и у алкана: название основания + суффикс. Например, двухуглеродная алкеновая цепь называется этеном, а двухуглеродный алкин — этином; трехуглеродный алкен называется пропеном, трехуглеродный алкин называется пропином и так далее.
| Этан (C 2 H 6 ) | Этен (C 2 H 4 ) | Ethyne (C 2 H 2 ) |
Функционализированные углеводороды
Включение функциональной группы в углерод- и водородсодержащие молекулы приводит к новым семействам соединений, называемых функционализированными углеводородами.Функциональная группа — это характерный атом или группа атомов, которые в первую очередь определяют свойства производных углеводородов.
Одним из типов функциональных групп является группа –ОН. Соединения, содержащие функциональную группу –ОН, являются спиртами. Название спирта происходит от углеводорода, из которого он был получен. По соглашению углеводородная часть молекулы обозначается как «R»; Итак, общая формула спирта — R – OH. Конечный «–e» в названии углеводорода заменяется на «–ol».В случае разветвленного спирта атом углерода, с которым связана группа –ОН, обозначается числом перед названием. Другие общие функциональные группы перечислены ниже. Группа соединений, содержащих одну и ту же функциональную группу, образует семейство.
Простые эфиры — это соединения, содержащие функциональную группу –O– с общей формулой R – O – R ’.
Другой класс органических молекул содержит атом углерода, соединенный с атомом кислорода двойной связью, обычно называемой карбонильной группой.Углерод в карбонильной группе может присоединяться к двум другим заместителям, что приводит к нескольким подсемействам (альдегиды, кетоны, карбоновые кислоты и сложные эфиры).
Функциональные группы, относящиеся к карбонильной группе, включают группу –CHO альдегида, группу –CO– кетона, группу –CO 2 H карбоновой кислоты и группу –CO 2 R сложный эфир. Карбонильная группа, двойная связь углерод-кислород, является ключевой структурой в этих классах органических молекул. Альдегиды содержат по крайней мере один атом водорода, присоединенный к карбонильному атому углерода, кетоны содержат две углеродные группы, присоединенные к карбонильному атому углерода, карбоновые кислоты содержат гидроксильную группу, присоединенную к карбонильному атому углерода, а сложные эфиры содержат атом кислорода, присоединенный к другой углеродной группе. соединен с карбонильным атомом углерода.Все эти соединения содержат окисленные атомы углерода относительно атома углерода спиртовой группы.
Добавление азота в органический каркас приводит к двум семействам молекул, а именно аминам и амидам. Соединения, содержащие атом азота, связанный в углеводородный каркас, классифицируются как амины. Соединения, у которых атом азота связан с одной стороной карбонильной группы, классифицируются как амиды. Амины — основная функциональная группа. Амины и карбоновые кислоты могут объединяться в реакции конденсации с образованием амидов.
Этот текст адаптирован из Openstax, Chemistry 2e, Раздел 20: Введение, Openstax, Chemistry 2e, Раздел 20.1: Углеводороды, Openstax, Химия 2e, Раздел 20.2: Спирты и эфиры, Openstax, Химия 2e, Раздел 20.2: Альдегиды, Кетоны , Карбоновые кислоты и сложные эфиры, и Openstax, Chemistry 2e, раздел 20.2: Амины и амиды.
Глава 9 — Органические соединения кислорода — Химия
Глава 9 — Органические соединения кислорода
Вступительное эссе
9.1 Введение в соединения, содержащие кислород
9.2 Спирты и фенолы
Классификация спиртов
Свойства спиртов
Гликоли
Фенолы
9,3 эфиров
Свойства эфиров
9,4 Альдегиды и кетоны
Свойства альдегидов и кетонов
Альдегиды
Кетоны
Точки кипения и растворимость
Альдегиды и кетоны в природе
9.5 Карбоновые кислоты и сложные эфиры
Свойства карбоновых кислот и сложных эфиров
Карбоновые кислоты
Сложные эфиры
Точки кипения, точки плавления и растворимость
Обычно используемые карбоновые кислоты и сложные эфиры
9.6 Реакции кислородсодержащих соединений
Спирты
Реакции обезвоживания (устранения)
Реакции окисления
Альдегиды и кетоны
Реакции окисления
Реакции восстановления
Реакции присоединения со спиртами (полуацетали и гемикетали)
Реакции с образованием ацеталей или кетов
Карбоновые кислоты
9.8 Ссылки
Вступительное эссе
Фото: А. Савин
Вернуться к началу
9.1 Введение в составы, содержащие кислород
В этой главе вы познакомитесь с основными органическими функциональными группами, содержащими кислород. Сюда входят спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты и сложные эфиры. На рисунке 9.1 представлены основные органические функциональные группы для этих соединений и суффикс ИЮПАК, который используется для обозначения этих соединений.Хотя вам не нужно официально называть полные структуры, вы должны иметь возможность идентифицировать функциональные группы, содержащиеся в соединениях, на основе их названий IUPAC. Например, спирт представляет собой органическое соединение с гидроксильной (-ОН) функциональной группой на алифатическом атоме углерода. Поскольку -ОН является функциональной группой всех спиртов, мы часто представляем спирты общей формулой ROH, где R представляет собой алкильную группу. В рекомендациях по номенклатуре ИЮПАК суффикс «-ол» используется для обозначения простых соединений, содержащих спирты.Примером является этанол (CH 3 CH 2 OH).
Рис. 9.1 Общие органические функциональные группы, содержащие кислород. Суффиксы ИЮПАК, используемые для обозначения простых органических молекул, отмечены в таблице
Вернуться к началу
9.2 Спирты и фенолы
Классификация спиртов
Некоторые свойства и реакционная способность спиртов зависят от числа атомов углерода, присоединенных к конкретному атому углерода, который присоединен к группе -ОН.На этом основании спирты можно разделить на три класса.
- Первичный (1 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к одному другому атому углерода (синему). Его общая формула — RCH 2 OH.
- Вторичный (2 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к двум другим атомам углерода (синим цветом). Его общая формула: R 2 CHOH.
- Третичный (3 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к трем другим атомам углерода (синим цветом).Его общая формула — R 3 COH.
Свойства спиртов
Спирты можно рассматривать как производные воды (H 2 O; также обозначается как HOH).
Как и связь H – O – H в воде, связь R – O – H изогнута, а часть -OH в молекулах спирта полярна. Эта взаимосвязь особенно очевидна для небольших молекул и отражается в физических и химических свойствах спиртов с низкой молярной массой. Замена атома водорода алкана на группу ОН позволяет молекулам связываться посредством водородных связей (рис.9.2).
Рис. 9.2. Межмолекулярная водородная связь в метаноле. Группы ОН в молекулах спирта делают возможным образование водородных связей.
Напомним, что физические свойства в значительной степени определяются типом межмолекулярных сил. В таблице 9.1 перечислены молярные массы и точки кипения некоторых распространенных соединений. Из таблицы видно, что вещества с одинаковой молярной массой могут иметь совершенно разные точки кипения.
Таблица 9.1 Сравнение молярной массы и температуры кипения
Алканы неполярны и поэтому связаны только через относительно слабые лондонские дисперсионные силы (LDF). Температуры кипения алканов с одним-четырьмя атомами углерода настолько низки, что все эти молекулы являются газами при комнатной температуре. Напротив, если мы проанализируем соединения, которые содержат функциональную группу спирта, даже метанол (только с одним атомом углерода) будет жидкостью при комнатной температуре. Поскольку спирты обладают способностью образовывать водородные связи, их точки кипения значительно выше по сравнению с углеводородами сопоставимой молярной массы.Температура кипения — это грубая мера количества энергии, необходимой для отделения молекулы жидкости от ближайших соседей. Если молекулы взаимодействуют посредством водородных связей, для разрушения этого межмолекулярного притяжения необходимо подавать относительно большое количество энергии. Только тогда молекула может перейти из жидкости в газообразное состояние.
Другая интересная тенденция очевидна в таблице 9.1: поскольку молекулы спирта содержат больше атомов углерода, они также имеют более высокие температуры кипения.Это связано с тем, что молекулы могут иметь более одного типа межмолекулярных взаимодействий. Помимо водородных связей, молекулы спирта также имеют LDF, которые возникают между неполярными частями молекул. Как мы видели с алканами, чем больше углеродная цепь, тем больше LDF присутствует в молекуле. Как и в случае с алканами, повышенное количество ЛДФ в спиртосодержащих молекулах также вызывает повышение температуры кипения.
Помимо образования водородных связей между собой, спирты также могут вступать в водородные связи с молекулами воды (Рисунок 9.3). Таким образом, в то время как углеводороды нерастворимы в воде, небольшие спирты с одним-тремя атомами углерода полностью растворимы. Однако с увеличением длины цепи растворимость спиртов в воде снижается; молекулы становятся больше похожими на углеводороды и менее на воду. Спирт 1-деканол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH), содержащий 10 атомов углерода практически не растворяется в воде.Мы часто обнаруживаем, что граница растворимости в семействе органических соединений находится на четырех или пяти атомах углерода.
Рис. 9.3. Водородная связь между молекулами метанола и молекулами воды. Водородная связь между ОН метанола и молекулами воды определяет растворимость метанола в воде.
Вернуться к началу
Гликоли
Молекулы, содержащие две функциональные группы спирта, часто называют гликолями .Этиленгликоль, один из простейших гликолей, имеет два основных коммерческих применения. Он используется в качестве сырья при производстве полиэфирных волокон и составов антифризов. Добавление двух или более групп -ОН к углеводороду существенно увеличивает температуру кипения и растворимость спирта. Например, для этиленгликоля температура кипения составляет 197,3 o ° C, по сравнению с этанолом, который имеет точку кипения 78 o ° C. Таким образом, этиленгликоль является полезным охлаждающим веществом для автомобильных двигателей.
Рисунок 9.4 Свойства этиленгликоля. Этиленгликоль часто используется в качестве охлаждающего агента в смесях антифризов из-за его низкой температуры замерзания и высокой температуры кипения.
Этиленгликоль ядовит для людей и других животных, с ним следует обращаться осторожно и утилизировать надлежащим образом. Как прозрачная жидкость со сладким вкусом, она может привести к случайному проглатыванию, особенно домашними животными, или может быть преднамеренно использована в качестве орудия убийства. Этиленгликоль трудно обнаружить в организме, и он вызывает симптомы, включая интоксикацию, тяжелую диарею и рвоту, которые можно спутать с другими болезнями или заболеваниями.Его метаболизм производит оксалат кальция, который кристаллизуется в головном мозге, сердце, легких и почках, повреждая их; в зависимости от уровня воздействия, накопление яда в организме может длиться недели или месяцы, прежде чем вызвать смерть, но смерть от острой почечной недостаточности может наступить в течение 72 часов, если человек не получит надлежащего лечения от отравления. Некоторые смеси антифризов на основе этиленгликоля содержат горький агент, такой как денатоний, для предотвращения случайного или преднамеренного употребления.Типичные смеси антифризов также содержат флуоресцентный зеленый краситель, который упрощает обнаружение и удаление пролитого антифриза.
Фенолы
Соединения, в которых группа -ОН присоединена непосредственно к ароматическому кольцу, называются фенолами и в химических уравнениях могут называться АРОН. Фенолы отличаются от спиртов тем, что в воде они обладают слабой кислотностью. Подобно реакциям кислотно-щелочной нейтрализации двойного вытеснения, они реагируют с водным гидроксидом натрия (NaOH) с образованием соли и воды.
ArOH (водн.) + NaOH (водн.) → ArONa (водн.) + H 2 O
Простейшее фенолсодержащее соединение, C 6 H 5 OH, само называется фенолом. (Более старое название, подчеркивающее его легкую кислотность, было карболовая кислота ). Фенол — это белое кристаллическое соединение, имеющее характерный («больничный запах») запах.
Рисунок 9,5 (слева) Структура фенола. (справа) Примерно два грамма фенола в стеклянном флаконе.Фото В. Оэлена.
Для вашего здоровья: фенолы и мы
Фенолы широко используются в качестве антисептиков (вещества, убивающие микроорганизмы на живых тканях) и в качестве дезинфицирующих средств (вещества, предназначенные для уничтожения микроорганизмов на неодушевленных предметах, таких как мебель или полы). Первым широко применяемым антисептиком был фенол. Джозеф Листер использовал его для антисептической хирургии в 1867 году. Фенол, однако, токсичен для людей и может вызвать серьезные ожоги при нанесении на кожу.В кровотоке это системный яд , что означает, что он проникает во все части тела и поражает их. Его серьезные побочные эффекты привели к поискам более безопасных антисептиков, ряд из которых был найден.
Рис. 9.6 Операция в 1753 г. перед применением антисептиков. Картина написана Гаспаре Траверси.
В настоящее время фенол используется только в очень малых концентрациях в некоторых безрецептурных медицинских продуктах, таких как хлорасептик для горла.
Рис. 9.7 Фенол все еще используется в низких концентрациях в некоторых медицинских препаратах, таких как хлоразептик.
Более сложные соединения, содержащие фенольные функциональные группы, обычно встречаются в природе, особенно в виде растительных натуральных продуктов. Например, одними из основных метаболитов, обнаруженных в зеленом чае, являются полифенольные катехиновые соединения, представленные на рисунке 9.8А эпигаллокатехингаллатом (ЭКГК) и эпикатехином. Было показано, что употребление зеленого чая обладает химиопрофилактическими свойствами на лабораторных животных.Считается, что биологическая активность катехинов как антиоксидантных агентов способствует этой активности и другим преимуществам для здоровья, связанным с потреблением чая. Некоторые из биологически активных компонентов марихуаны, такие как тетрагидроканнабинол (THC) и каннабидиол (CBD), также являются фенольными соединениями (рис. 9B).
Рис. 9.8 Натуральные продукты растительного происхождения, содержащие фенольные функциональные группы. (A) Зеленый чай содержит соединения катехина, такие как галлат эпигаллокатехина (ECGC), и эпикатехины, которые, как считается, обеспечивают некоторые из противоопухолевых преимуществ для здоровья, присущих зеленому чаю.(B) Марихуана содержит множество биологически активных фенольных соединений, включая галлюциногенный компонент марихуаны, тетрагидроканнабинол (THC) и метаболит каннабидиол (CBD). Каннабидиол не обладает психоактивными свойствами и в настоящее время изучается в качестве потенциального средства лечения синдромов рефракционной эпилепсии.
Упражнения по обзору концепции
Почему этанол (CH 3 CH 2 OH) более растворим в воде, чем 1-гексанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 OH) ?
Почему 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH) имеет более низкую точку кипения, чем 1-гексанол (CH 3 CH 2 CH 2 CH 2 СН 2 СН 2 ОН)?
Ответы
Этанол имеет группу -ОН и только 2 атома углерода; 1-гексанол имеет одну группу -ОН для 6 атомов углерода и, таким образом, больше похож на (неполярный) углеводород, чем на этанол.
1-гексанол имеет более длинную углеродную цепь, чем у 1-бутанола, и, следовательно, больше LDF, которые способствуют более высокой температуре кипения.
Упражнения
Ответьте на следующие упражнения, не обращаясь к таблицам в тексте.
Расположите эти спирты в порядке увеличения температуры кипения: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), 1-гептанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) и 1-пропанол (CH 3 CH 2 CH 2 OH).
Что имеет более высокую точку кипения — бутан (CH 3 CH 2 CH 2 CH 3 ) или пропанол-1 (CH 3 CH 2 CH 2 OH)?
Расположите эти спирты в порядке увеличения растворимости в воде: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), метанол (CH 3 OH) и 1-октанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH).
Расположите эти соединения в порядке увеличения растворимости в воде: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), этанол (CH 3 CH 2 OH) и пентан. (CH 3 CH 2 CH 2 CH 2 CH 3 ).
Ответы на нечетные вопросы
1-пропанол <1-бутанол <1-гептанол
1-октанол <1-бутанол <метанол
Вернуться к началу
9.3 эфира
Простые эфиры — это класс органических соединений, которые содержат кислород между двумя алкильными группами. Они имеют формулу R-O-R ’, где R’s представляют собой алкильные группы. эти соединения используются в красителях, парфюмерии, маслах, восках и в промышленности.
Свойства эфиров
Связи C — O в простых эфирах полярны, и, следовательно, у простых эфиров есть общий дипольный момент. Слабая полярность эфиров не оказывает заметного влияния на их точки кипения, сравнимые с таковыми у алкенов сопоставимой молекулярной массы.Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это связано с тем, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира не могут образовывать водородные связи с другими молекулами эфира. Например, диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) имеет точку кипения 34,6 o C, тогда как н-бутанол, (CH 3 CH 2 CH 2 CH 2 OH), четырехуглеродный спирт, имеет пионт кипения 117.7 o C.
Эфиры могут образовывать водородные связи с водой, однако, поскольку вода содержит частично положительные атомы водорода, необходимые для образования водородных связей. Таким образом, простые эфиры, содержащие до 3 атомов углерода, растворимы в воде из-за образования Н-связей с молекулами воды.
Растворимость простых эфиров уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы снижает тенденцию образования водородной связи с водой.Эфиры в значительной степени растворимы в более неполярных органических растворителях и фактически могут использоваться в качестве растворителя для растворения неполярных и умеренно полярных молекул. Кроме того, эфиры очень неактивны. Фактически, за исключением алканов, циклоалканов и фторуглеродов, простые эфиры, вероятно, являются наименее химически активным обычным классом органических соединений. Таким образом, простые эфиры меньшего размера, такие как диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ), широко используются химиками-органиками в качестве растворителей для различных органических реакций.Инертность эфиров по отношению к спиртам, несомненно, связана с отсутствием реакционной связи О – Н.
Для вашего здоровья — Ethers and Us
В середине 1800-х — начале 1900-х годов диэтиловый эфир использовался в качестве анестетика во время хирургических операций, в значительной степени заменяя хлороформ из-за пониженной токсичности. Общий анестетик действует на мозг, вызывая бессознательное состояние и общую нечувствительность к ощущениям или боли.Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым широко используемым общим анестетиком.
Рис. 9.9 Уильям Мортон, стоматолог из Бостона, ввел диэтиловый эфир в хирургическую практику в 1846 году. На этой картине изображена операция в Бостоне в 1846 году, в которой диэтиловый эфир использовался в качестве анестетика. Вдыхание паров эфира вызывает потерю сознания, подавляя активность центральной нервной системы. Источник: Картина Уильяма Мортона Эрнеста Борд.
Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, обеспечивающей эффективный уровень анестезии, и смертельной дозой. Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, вызывающий тошноту, его заменили более новыми анестетиками для ингаляции, включая фторсодержащие соединения галотан и галогенированные эфиры, десфлуран, изофлуран и севофлуран. Галогенированные простые эфиры, изофлуран, десфлуран и севофлуран демонстрируют меньшие побочные эффекты по сравнению с диэтиловым эфиром.К сожалению, безопасность этих соединений для персонала операционной была поставлена под сомнение. Например, женщины, работающие в операционных, подвергшихся воздействию галотана, чаще страдают выкидышами, чем женщины в общей популяции.
Простые эфиры также являются общими функциональными группами, обнаруженными в натуральных продуктах, и могут обладать уникальной биологической активностью. Фактически, было обнаружено, что некоторые очень большие соединения, содержащие несколько простых эфиров, называемые полиэфирами , вызывают нейротоксическое отравление моллюсками.В этом примере динофлаггелат Karina brevis , который является возбудителем цветения водорослей красного прилива, производит класс высокотоксичных полиэфиров, называемых бреватоксинами. Бреватоксин А изображен на рисунке 9.10. Симптомы этого отравления включают рвоту и тошноту, а также различные неврологические симптомы, такие как невнятная речь.
Рисунок 9.10 Нейротоксическое отравление моллюсками. Динофлаггелат, Karina brevis , показанный в верхнем левом углу, является возбудителем вредоносного цветения водорослей красного прилива.Цветение морских водорослей может быть довольно обширным, как показано на фотографии красного прилива (вверху справа), происходящего недалеко от Сан-Диего, Калифорния. K. brevis производит класс полиэфиров, называемых бреватоксинами. Бреватоксин А показан в качестве примера. Моллюски и мышцы, питающиеся фильтром, заражаются динофлаггелатом и могут вызвать нейротоксическое отравление моллюсками при употреблении в пищу. Красные приливы могут иметь серьезные экономические издержки, поскольку промыслы и промысел моллюсков должны быть закрыты до тех пор, пока уровни токсинов в коммерческих продуктах не вернутся к приемлемым уровням.
Вернуться к началу
9,4 Альдегиды и кетоны
Альдегиды и кетоны характеризуются наличием карбонильной группы (C = O), и их реакционную способность обычно можно понять, признав, что карбонильный углерод содержит частичный положительный заряд (δ +), а карбонильный кислород содержит частичный отрицательный заряд. (δ−). Альдегиды обычно более реакционноспособны, чем кетоны.
Карбонильная группа
A карбонильная группа представляет собой химически органическую функциональную группу, состоящую из атома углерода, связанного двойной связью с атомом кислорода -> [ C = O ] Простейшими карбонильными группами являются альдегиды и кетоны, обычно присоединенные к другому углеродному соединению.Эти структуры можно найти во многих ароматических соединениях, влияющих на запах и вкус.
Прежде чем углубляться в подробности, обязательно поймите, что сама сущность C = O известна как « c арбонильная группа », в то время как члены этой группы называются « карбонильные соединения . «.
Как обсуждалось ранее, мы понимаем, что у кислорода есть две неподеленные пары электронов. Эти электроны делают кислород более электроотрицательным, чем углерод.Тогда углерод является частично положительным (или электрофильный, = «любящий электроны»), а кислород частично отрицательным ( нуклеофильный = «любящий ядро или протон»). Поляризуемость обозначается дельтой в нижнем регистре и положительным или отрицательным верхним индексом в зависимости от атома. Например, углерод будет иметь δ + , а кислород δ — .
Свойства альдегидов и кетонов
Альдегиды
В альдегидах к карбонильной группе присоединен атом водорода вместе с
- второй атом водорода
- или, чаще, углеводородная группа, которая может быть алкильной группой или группой, содержащей бензольное кольцо.
В этом разделе мы игнорируем те, которые содержат бензольные кольца. Ниже приведены некоторые примеры альдегидов
Обратите внимание, что все они имеют один и тот же конец молекулы. Отличается только сложность другой присоединенной углеродной группы. Когда вы пишете формулы для них, альдегидная группа (карбонильная группа с присоединенным атомом водорода) всегда записывается как -CHO — никогда как COH. Его легко спутать с алкоголем.Например, этанал записывается как CH 3 CHO; метанал как HCHO.
Кетоны
В кетонах к карбонильной группе присоединены две углеродные группы. Опять же, это могут быть либо алкильные группы, либо группы, содержащие бензольные кольца. Обратите внимание, что к карбонильной группе кетонов никогда не присоединен атом водорода.
Пропанон обычно обозначается как CH 3 COCH 3 .
Точки кипения и растворимость
Метаналь, также известный как формальдегид (HCHO), представляет собой газ при комнатной температуре (точка кипения -21 ° C), а этаналь, также известный как ацетальдегид, имеет температуру кипения + 21 ° C. Это означает, что этаналь кипит при температуре, близкой к комнатной. Более крупные альдегиды и кетоны являются жидкостями, температура кипения которых повышается по мере увеличения размера молекул. Величина точки кипения определяется силой межмолекулярных сил.В этих молекулах обнаружены две основные межмолекулярные силы:
- Лондонские силы дисперсии : Эти притяжения тем сильнее, чем больше длина молекул и больше электронов. Это увеличивает размеры устанавливаемых временных диполей. Вот почему точки кипения увеличиваются с увеличением числа атомов углерода в цепях — независимо от того, говорите ли вы об альдегидах или кетонах.
- Диполь-дипольные притяжения : Как альдегиды, так и кетоны являются полярными молекулами из-за наличия двойной связи углерод-кислород.Помимо дисперсионных сил, между постоянными диполями на соседних молекулах также будет существовать притяжение. Это означает, что точки кипения будут выше, чем у углеводородов аналогичного размера, которые обладают только дисперсионными силами. Интересно сравнить три молекулы одинакового размера. Они имеют одинаковую длину и одинаковое (хотя и не одинаковое) количество электронов.
Поляризация карбонильных групп также влияет на температуру кипения альдегидов и кетонов, которая выше, чем у углеводородов аналогичного размера.Однако, поскольку они не могут образовывать водородные связи, их температуры кипения обычно ниже, чем у спиртов аналогичного размера. В таблице 9.2 приведены некоторые примеры соединений одинаковой массы, но содержащих разные типы функциональных групп. Обратите внимание, что соединения с более сильными межмолекулярными силами имеют более высокие температуры кипения.
Алканы <Альдегиды <Кетоны <Спирты
Таблица 9.2 Сравнение точек кипения и межмолекулярных сил
Из-за полярности карбонильной группы атом кислорода альдегида или кетона вступает в водородную связь с молекулой воды.
Таким образом, растворимость альдегидов и кетонов примерно такая же, как у спиртов и простых эфиров. Формальдегид (HCHO), ацетальдегид (CH 3 CHO) и ацетон ((CH 3 ) 2 CO) растворимы в воде. По мере увеличения длины углеродной цепи растворимость в воде уменьшается. Граница растворимости находится примерно при четырех атомах углерода на атом кислорода. Все альдегиды и кетоны растворимы в органических растворителях и, как правило, менее плотны, чем вода.
Вернуться к началу
Альдегиды и кетоны в природе
Подобно другим кислородсодержащим функциональным группам, обсуждавшимся до сих пор, альдегиды и кетоны также широко распространены в природе и часто сочетаются с другими функциональными группами. Примеры встречающихся в природе молекул, которые содержат функциональную группу альдегида или кетона, показаны на следующих двух рисунках. Соединения на рисунке 9.11 обнаруживаются в основном в растениях или микроорганизмах, а также в соединениях на рисунке 9.12 имеют животное происхождение. Многие из этих молекулярных структур хиральны и имеют отчетливую стереохимию.
Когда хиральные соединения встречаются в природе, они обычно энантиомерно чисты, хотя разные источники могут давать разные энантиомеры. Например, карвон обнаружен как его левовращающий (R) -энантиомер в масле мяты курчавой, тогда как семена тмина содержат правовращающий (S) -энантиомер. В этом случае изменение стереохимии вызывает резкое изменение воспринимаемого запаха.Альдегиды и кетоны известны своим сладким, а иногда и резким запахом. Запах ванильного экстракта исходит от молекулы ванилина. Точно так же бензальдегид придает сильный запах миндаля. Благодаря приятным ароматам молекулы, содержащие альдегиды и кетоны, часто встречаются в парфюмерии. Однако не все ароматы приятны. В частности, 2-гептанон является частью резкого аромата голубого сыра, а (R) -Muscone является частью мускусного запаха гималайской кабарги.Наконец, кетоны присутствуют во многих важных гормонах, таких как прогестерон (женский половой гормон) и тестостерон (мужской половой гормон). Обратите внимание, как тонкие различия в структуре могут вызвать резкие изменения в биологической активности. Функциональность кетонов также проявляется в противовоспалительном стероиде кортизоне.
Рис. 9.11 Примеры молекул, содержащих альдегид и кетон, выделенных из растительных источников.
Рисунок 9.12 Примеры молекул, содержащих альдегид и кетон, выделенных из животных источников.
Для вашего здоровья: кетоны в крови, моче и дыхании
Кетоны образуются в организме человека как побочный продукт липидного обмена. Два общих метаболита, продуцируемых в организме человека, — это кетонсодержащая ацетоуксусная кислота и метаболит спирта, β-гидроксибутират. Ацетон также производится как продукт распада ацетоуксусной кислоты. Затем ацетон может выводиться из организма с мочой или в виде летучего продукта через легкие.
Обычно кетоны не попадают в кровоток в заметных количествах. Например, нормальная концентрация ацетона в организме человека составляет менее 1 мг / 100 мл крови. Вместо этого кетоны, которые вырабатываются во время метаболизма липидов внутри клеток, обычно полностью окисляются и расщепляются на углекислый газ и воду. Это потому, что глюкоза является основным источником энергии для тела, особенно для мозга. Глюкоза в контролируемых количествах попадает в кровоток печенью, где она перемещается по всему телу, обеспечивая энергию.Для мозга это основной источник энергии, поскольку гематоэнцефалический барьер блокирует транспорт больших липидных молекул. Однако во время голодания, когда глюкоза недоступна или при определенных болезненных состояниях, когда метаболизм глюкозы нарушен, например, при неконтролируемом сахарном диабете, концентрации кетонов в крови повышаются до более высоких уровней, чтобы обеспечить мозг альтернативным источником энергии. Однако, поскольку ацетоуксусная кислота и β-гидроксибутират содержат функциональные группы карбоновых кислот, добавление этих молекул в кровь вызывает закисление, которое, если его не контролировать, может вызвать опасное состояние, называемое кетоацидозом.Кетоацидоз может быть опасным для жизни событием. Кетоны легко обнаружить, так как ацетон выводится с мочой. В тяжелых случаях запах ацетона также может ощущаться в дыхании.
Вернуться к началу
9,5 Карбоновые кислоты и сложные эфиры
Карбоновые кислоты можно легко распознать, поскольку они имеют карбонильный углерод, который также непосредственно связан с функциональной группой спирта. Таким образом, карбонильный углерод также присоединен непосредственно к спирту.В сложноэфирной функциональной группе карбонильный углерод также непосредственно присоединен как часть простой эфирной функциональной группы.
Свойства карбоновых кислот и сложных эфиров
Карбоновые кислоты
Карбоновые кислоты — это органические соединения, которые включают карбоксильную функциональную группу, CO 2 H. Название карбоксил происходит от того факта, что карбонильная и гидроксильная группы присоединены к одному и тому же атому углерода.
Карбоновые кислоты названы так потому, что они могут отдавать водород для образования карбоксилатного иона.Факторы, влияющие на кислотность карбоновых кислот, будут обсуждены позже.
Сложные эфиры
Сложный эфир представляет собой органическое соединение, которое является производным карбоновой кислоты, в которой атом водорода гидроксильной группы заменен на алкильную группу. Структура является продуктом карбоновой кислоты (R-часть) и спирта (R’-часть). Общая формула сложного эфира показана ниже.
Группа R может быть водородной или углеродной цепью.Группа R ‘должна быть углеродной цепью, поскольку атом водорода сделает молекулу карбоновой кислотой. Шаги по названию сложных эфиров вместе с двумя примерами показаны ниже.
Точки кипения, точки плавления и растворимость
Карбоновые кислоты могут образовывать димеры с водородными связями, температура кипения которых выше, чем у спиртов аналогичного размера (таблица 9.3).
Таблица 9.3 Сравнение температур кипения соединений аналогичного размера
Мелкие сложные эфиры имеют температуры кипения ниже, чем у альдегидов и кетонов с аналогичной массой (Таблица 9.3). Сложные эфиры, как и альдегиды и кетоны, являются полярными молекулами. однако их диполь-дипольные взаимодействия слабее, чем у альдегидов и кетонов, и они не могут образовывать водородные связи. Таким образом, их температуры кипения выше, чем у простых эфиров, и ниже, чем у альдегидов и кетонов аналогичного размера.
Карбоновые кислоты с низким молекулярным весом обычно жидкие при комнатной температуре, тогда как более крупные молекулы образуют воскообразные твердые вещества. Карбоновые кислоты с длиной углеродной цепи от 12 до 20 атомов углерода обычно называют жирными кислотами, поскольку они обычно содержатся в жирах и маслах.По сравнению с другими кислородсодержащими молекулами, карбоновые кислоты с короткой цепью обычно растворимы в воде из-за их способности образовывать водородные связи. По мере увеличения длины углеродной цепи растворимость карбоновой кислоты в воде снижается. Сложные эфиры также могут связываться водородом с водой, хотя и не так эффективно, как карбоновые кислоты, и поэтому они немного менее растворимы в воде, чем карбоновые кислоты аналогичного размера.
Карбоновые кислоты обычно имеют неприятный, резкий и даже прогорклый запах.Например, запах уксуса возникает из-за этановой кислоты (также известной как уксусная кислота). Запах тренажерных залов и немытых носков в значительной степени вызван бутановой кислотой, а гексановая кислота отвечает за сильный запах лимбургского сыра. Из-за своей кислой природы карбоновые кислоты также имеют кислый вкус, как это отмечается для уксуса и лимонной кислоты, содержащихся во многих фруктах. С другой стороны, сложные эфиры обладают приятным ароматом и ответственны за аромат многих фруктов и цветов. Сложные эфиры также могут иметь фруктовый привкус.
Практические задачи:
Какое соединение имеет более высокую точку кипения — CH 3 CH 2 CH 2 OCH 2 CH 3 или CH 3 CH 2 CH 2 COOH? Объяснять.
Какое соединение имеет более высокую точку кипения — CH 3 CH 2 CH 2 CH 2 CH 2 OH или CH 3 CH 2 CH 2 COOH? Объяснять.
Какое соединение более растворимо в воде — CH 3 COOH или CH 3 CH 2 CH 2 CH 3 ? Объяснять.
Какое соединение более растворимо в воде — CH 3 CH 2 COOH или CH 3 CH 2 CH 2 CH 2 CH 2 COOH? Объяснять.
Ответы
CH 3 CH 2 CH 2 COOH из-за водородной связи (Нет межмолекулярной водородной связи с CH 3 CH 2 CH 2 OCH 2 CH 3 .)
CH 3 COOH, потому что он участвует в водородной связи с водой (Нет межмолекулярной водородной связи с CH 3 CH 2 CH 2 CH 3 .)
Обычно используемые карбоновые кислоты и сложные эфиры
Карбоновые кислоты и сложные эфиры широко распространены в природе и используются для множества целей. Например, муравьи из семейства Formicidae используют простейшую карбоновую кислоту, муравьиную кислоту, как в качестве химической защиты, так и в качестве атаки для подчинения добычи (рис.9.13А). Разбавленный раствор уксусной кислоты (5%) содержится в уксусе и отвечает за кислый и острый вкус. Уксусная кислота также придает хлебу на закваске острый вкус и отвечает за кислый привкус вина. Лимонная кислота содержится во многих фруктах и является причиной их кислого вкуса. Другие карбоновые кислоты, такие как ПАБК и гликолевая кислота, используются в косметической промышленности. ПАБК, продуцируемая растениями, грибами и бактериями, является обычным компонентом пищи и по структуре связана с витамином фолиевой кислоты.В 1943 году ПАБК был запатентован как одно из первых соединений, используемых при производстве солнцезащитного крема. Однако с середины 1980-х его использование перестало быть популярным из-за опасений, что он может увеличить клеточное УФ-повреждение, а также способствовать развитию аллергии. Гликолевая кислота является наименьшей из кислот класса α-гидроксикислот, и она нашла применение как в пищевой, так и в косметической промышленности. В пищевой промышленности он используется в качестве консерванта, а в индустрии ухода за кожей он чаще всего используется в качестве химического пилинга для уменьшения рубцов на лице от прыщей.
Рис. 9.13 Источники и использование обычных карбоновых кислот. (A) Муравьиная кислота — это защитный токсин, используемый муравьями семейства Formicidae. Фото Мухаммада Махди Карима (B) Уксус — это 5% раствор уксусной кислоты. На фотографии слева показаны различные сорта уксуса на рынке во Франции. Фото Жоржа Сегена (C) Лимонная кислота — обычный компонент фруктов, придающий им кислый вкус. Фотография лимонов, сделанная Андре Карватом (D). Парааминобензойная кислота (ПАБК) — это карбоновая кислота, обычно встречающаяся в растениях и пищевых культурах, включая цельное зерно.Он был запатентован в 1943 году для использования в солнцезащитных продуктах. Однако из-за проблем с безопасностью и аллергической реакции использование ПАБК для этой цели было прекращено. Фотография солнцезащитного крема предоставлена HYanWong (E) Гликолевая кислота обычно используется в косметике в качестве химического пилинга, используемого для уменьшения рубцов от прыщей. На фото слева — до лечения, а справа — после нескольких процедур с гликолевой кислотой. Исследование гликолей предоставлено Джайшри Шарад.
Сложные эфиры легко синтезируются и в большом количестве от природы способствуют вкусовым качествам и ароматам многих фруктов и цветов.Например, сложный эфир, метилсалицилат, также известен как масло грушанки (рис. 9.14). Фруктовый аромат ананасов, груш и клубники обусловлен сложными эфирами, а также сладким ароматом рома.
Рис. 9.14. Фруктовые и приятные ароматы сложных эфиров можно найти в (A) масле грушанки, (B) аромате ананасов и (C) сладости рома. Фотография (A) Gaultheria procumbens , производителя масла грушанки предоставлена: LGPL (B) фото ананаса предоставлено: David Monniaux, и (C) Фотография рома предоставлена: Summerbl4ck
Сложные эфиры также составляют основную часть животных жиров и растительных масел в виде триглицеридов.Образование липидов и жиров будет более подробно описано в главе 11.
Вернуться к началу
9.6 Реакции кислородсодержащих соединений
Спирты
Функциональные группы спирта могут участвовать в нескольких различных типах реакций. В этом разделе мы обсудим два основных типа реакций. Первые — это реакции дегидратации, а вторые — реакции окисления.Спирты также могут участвовать в реакциях присоединения и замещения с другими функциональными группами, такими как альдегиды, кетоны и карбоновые кислоты. Эти типы реакций будут обсуждаться более подробно в разделах, посвященных альдегидам, кетонам и карбоновым кислотам.
Реакции обезвоживания (устранения)
В главе 8 мы узнали, что спирты могут образовываться в результате гидратации алкенов во время реакций присоединения. Мы также узнали, что может иметь место и обратная реакция.Спирты могут быть удалены или удалены из молекул посредством процесса дегидратации (или удаления воды). Результатом реакции элиминирования является образование алкена и молекулы воды.
Реакции элиминирования, которые происходят с более сложными молекулами, могут привести к более чем одному возможному продукту. В этих случаях алкен образуется в более замещенном положении (у углерода, который имеет больше атомов углерода и меньше атомов водорода).Например, в реакции ниже спирт не является симметричным. Таким образом, есть два возможных продукта реакции элиминирования, вариант 1 и вариант 2. В варианте 1 алкен образуется с углеродом, который имеет наименьшее количество присоединенных атомов водорода, тогда как в варианте 2 алкен образуется с углеродом, имеющим большинство атомов водорода присоединены. Таким образом, вариант 1 будет основным продуктом реакции, а вариант 2 — второстепенным продуктом.
Реакции отщепления спирта с использованием небольших 1 o спиртов также могут быть использованы для получения простых эфиров.Для получения простого эфира, а не алкена, температура реакции должна быть снижена, и реакция должна проводиться с избытком спирта в реакционной смеси. Например:
| 2 CH 3 CH 2 -OH + H 2 SO 4 | 130 ºC | CH 3 CH 2 -O-CH 2 CH 3 + H 2 O |
| CH 3 CH 2 -OH + H 2 SO 4 | 150 ºC | CH 2 = CH 2 + H 2 O |
В этой реакции необходимо использовать избыток спирта и поддерживать температуру около 413 К.Если спирт не используется в избытке или температура выше, спирт предпочтительно подвергнется дегидратации с образованием алкена. Дегидратация вторичных и третичных спиртов для получения соответствующих простых эфиров неэффективна, поскольку в этих реакциях слишком легко образуются алкены.
Реакции окисления
Некоторые спирты также могут подвергаться реакциям окисления. Помните, что в окислительно-восстановительных реакциях окисляемый компонент реакции теряет электроны (LEO), в то время как молекула, получающая электроны, восстанавливается (GER).В органических реакциях поток электронов обычно следует за потоком атомов водорода. Таким образом, молекула, теряющая водород, обычно также теряет электроны и является окисленным компонентом. Молекула, набирающая электроны, сокращается. Для спиртов могут быть окислены как первичные, так и вторичные спирты. С другой стороны, третичные спирты не окисляются. Во многих реакциях окисления окислитель показан над стрелкой реакции как [O]. Окислитель может быть металлом или другой органической молекулой.В реакции окислителем является молекула, которая восстанавливается или принимает электроны.
В реакциях окисления спирта водород из спирта и водород, связанный с углеродом, к которому присоединен спирт, вместе со своими электронами удаляются из молекулы окислителем. Удаление атомов водорода и их электронов приводит к образованию карбонильной функциональной группы. В случае первичного спирта результатом является образование альдегида.В случае вторичного спирта результатом является образование кетона. Обратите внимание, что для третичного спирта углерод, присоединенный к спиртовой функциональной группе, не имеет присоединенного к нему атома водорода. Таким образом, он не может подвергаться окислению. Когда третичный спирт подвергается действию окислителя, реакции не происходит.
Обратите внимание, что для первичного спирта, который подвергается окислению, он все еще сохраняет атом водорода, который присоединен к карбонильному углероду во вновь образованном альдегиде.Эта молекула может подвергаться вторичной реакции окисления с окислителем и водой, чтобы добавить еще один атом кислорода и удалить карбонильный атом водорода. Это приводит к образованию карбоновой кислоты.
Для вашего здоровья: физиологические эффекты спиртов
Метанол довольно ядовит для человека. Проглатывание всего 15 мл метанола может вызвать слепоту, а 30 мл (1 унция) — смерть. Однако обычная смертельная доза составляет от 100 до 150 мл.Основная причина токсичности метанола заключается в том, что у нас есть ферменты печени, которые катализируют его окисление до формальдегида, простейшего члена семейства альдегидов:
Формальдегид быстро вступает в реакцию с компонентами клеток, коагулируя белки так же, как при варке яйца. Это свойство формальдегида объясняет большую часть токсичности метанола.
Органические и биохимические уравнения часто записываются, показывая только органические реагенты и продукты.Таким образом, мы сосредотачиваем внимание на органическом исходном материале и продукте, а не на балансировании сложных уравнений.
Этанол окисляется в печени до ацетальдегида:
Ацетальдегид, в свою очередь, окисляется до уксусной кислоты (HC 2 H 3 O 2 ), нормального компонента клеток, которая затем окисляется до диоксида углерода и воды. Даже в этом случае этанол потенциально токсичен для человека. Быстрое употребление 1 pt (около 500 мл) чистого этанола убило бы большинство людей, а от острого отравления этанолом ежегодно умирает несколько сотен человек — часто тех, кто участвует в каком-то соревновании по выпивке.Этанол свободно проникает в мозг, где угнетает центр контроля дыхания, что приводит к отказу дыхательных мышц в легких и, как следствие, к удушью. Считается, что этанол действует на мембраны нервных клеток, вызывая ухудшение речи, мышления, познания и суждения.
Медицинский спирт обычно представляет собой 70% -ный водный раствор изопропилового спирта. Он имеет высокое давление пара, а его быстрое испарение с кожи производит охлаждающий эффект. При проглатывании он токсичен, но, по сравнению с метанолом, хуже всасывается через кожу.
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
- CH 3 CH 2 CH 2 CH 2 CH 2 OH
Решение
Первый шаг — определить класс каждого алкоголя как первичный, вторичный или третичный.
Этот спирт имеет группу ОН на атоме углерода, который присоединен только к одному и другому атому углерода, так что это первичный спирт. При окислении сначала образуется альдегид, а при дальнейшем окислении образуется карбоновая кислота.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к трем другим атомам углерода, так что это третичный спирт. Никакой реакции не происходит.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к двум другим атомам углерода, так что это вторичный спирт; окисление дает кетон.
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
Вернуться к началу
Альдегиды и кетоны
В этом разделе мы обсудим первичные реакции альдегидов и кетонов. К ним относятся реакции окисления и восстановления, а также реакции сочетания со спиртами.
Реакции окисления
Как показано выше в разделе, посвященном спиртам, альдегиды могут подвергаться окислению с образованием коарбоновой кислоты. Это связано с тем, что карбонильный атом углерода все еще сохраняет атом водорода, который можно удалить и заменить атомом кислорода. Кетоны, с другой стороны, не содержат атом водорода, связанный с карбонильным атомом углерода. Таким образом, они не могут подвергаться дальнейшему окислению. Как отмечалось выше, кетоны, которые подвергаются воздействию окислителя, не вступают в реакцию.
Реакции восстановления
Реакции восстановления с альдегидами и кетонами превращают эти соединения в первичные спирты в случае альдегидов и вторичные спирты в случае кетонов. По сути, это реакции, обратные реакциям окисления спирта.
Например, с альдегидом этанал получается первичный спирт, этанол:
Обратите внимание, что это упрощенное уравнение, где [H] означает «водород из восстановителя».В общих чертах, восстановление альдегида приводит к первичному спирту.
Восстановление кетона, такого как пропанон, даст вам вторичный спирт, такой как 2-пропанол:
Восстановление кетона приводит к вторичному спирту.
Реакции присоединения со спиртами
Альдегиды и кетоны могут реагировать с функциональными группами спирта в реакциях присоединения (комбинации).Эти типы реакций обычны по своей природе и очень важны в процессе циклизации молекул сахара. Мы вернемся к этому вопросу в главе 11 во введении к основным макромолекулам тела.
Когда к альдегиду добавляется спирт, получается полуацеталь ; когда к кетону добавляют спирт, в результате получается гемикеталь .
В приведенной выше реакции B: относится к основанию, которое присутствует в растворе и может действовать как акцептор протонов.В этой реакции обычное основание активирует спирт в реакции (кислород спирта показан красным). Кислород спирта тогда заряжается отрицательно, потому что он переносит лишние электроны от водорода. Теперь он может действовать как нуклеофил и атаковать карбонильный углерод альдегида или кетона. Когда кислород спирта образует связь с карбонильным углеродом альдегида или кетона, это замещает одну из двойных связей карбонильной группы. Оксиен из карбонила затем вытягивает водород из обычной кислоты, присутствующей в растворе.На этой диаграмме обычная кислота обозначена как H-A. При этом образуется спирт на месте карбонильной группы альдегида или кетона. Исходная спиртовая группа теперь выглядит как эфирная функциональная группа. Таким образом, вы можете распознать полуацетали и гемикетали в природных продуктах как атом углерода, который одновременно связан как со спиртовой, так и с простой эфирной функциональной группой. Если этот углерод также имеет водородную связь с ним, он происходит из альдегида и называется полуацеталем .Если центральный углерод связан с двумя другими атомами углерода (обозначенными выше R 1 и R 3 ) в дополнение к атомам кислорода, молекула произошла от кетона и называется полукеталем .
Приставка « hemi» (половина) используется в каждом термине, потому что, как мы вскоре увидим, может произойти второе добавление нуклеофила спирта, что приведет к образованию видов, называемых ацеталей и кеталей .
Образование полуацеталей и полукеталей в биологических системах является обычным явлением и часто происходит спонтанно (без присутствия катализатора или фермента), особенно в случае простых молекул сахара.Из-за спонтанности реакций они также очень обратимы: полуацетали и гемикетали легко превращаются обратно в альдегиды и кетоны плюс спирт. Механизм обратного превращения полуацеталя в альдегид показан ниже:
Практические проблемы:
Реакции с образованием ацеталей или кеталей
Когда полуацеталь (или гемикеталь) подвергается нуклеофильной атаке со стороны второй молекулы спирта, результат называется ацеталь (или кеталь ).
В то время как образование полуацеталя из альдегида и спирта (этап 1 выше) является нуклеофильным присоединением, образование ацеталя из полуацеталя (этап 2 выше) представляет собой реакцию нуклеофильного замещения с исходным карбонилом кислород (показан синим) выходит в виде молекулы воды. Поскольку вода покидает молекулу во второй реакции (стадия 2), эта реакция также известна как реакция дегидратации . Реакция замещения, происходящая на второй стадии, не происходит спонтанно и не является легко обратимой.Внутри биологических систем для образования ацеталя или кеталя потребуется фермент. Обратите внимание, что и ацеталь, и кеталь выглядят как центральный углерод, связанный с двумя функциональными группами простого эфира. Если этот центральный углерод также связан с водородом, то это ацталь, а если он связан с двумя атомами углерода, это кеталь. Обратная реакция будет включать разложение ацеталя или кеталя с использованием гидролиза или проникновения воды в молекулу.
Практические проблемы:
Вернуться к началу
Карбоновые кислоты
Кислотность карбоновых кислот
Согласно определению кислоты как «вещества, которое отдает протоны (ионы водорода) другим вещам», карбоновые кислоты являются кислыми, потому что водород в группе -COOH может быть отдан другим молекулам.В растворе в воде ион водорода передается от группы -COOH к молекуле воды. Например, с этановой кислотой (как показано ниже) вы получаете этаноат-ион, образованный вместе с ионом гидроксония, H 3 O + .
CH 3 COOH + H 2 O ⇌ CH 3 COO — + H 3 O +
Эта реакция обратима, и в случае этановой кислоты (уксусной кислоты) не более 1% кислоты прореагировало с образованием ионов за один раз.
Таким образом, карбоновые кислоты являются слабыми кислотами.
Карбоновые кислоты и образование солей
Из-за своей кислой природы карбоновые кислоты могут реагировать с более химически активными металлами с образованием ионных связей и образования солей. Реакции такие же, как и с кислотами, такими как соляная кислота, за исключением того, что они, как правило, более медленные.
2CH 3 COOH (водн.) + Mg (s) → (CH 3 COO) 2 Mg + H 2
В указанной выше реакции разбавленная этановая кислота реагирует с магнием.Магний реагирует с образованием бесцветного раствора этаноата магния и выделяется газообразный водород. Если вы используете магниевую ленту, реакция будет менее интенсивной, чем такая же реакция с соляной кислотой, но с порошком магния обе протекают так быстро, что вы, вероятно, не заметите большой разницы.
Пример проблемы:
Напишите уравнение для каждой реакции.
- ионизация пропионовой кислоты (CH 2 CH 2 COOH) в воде (H 2 O)
- нейтрализация пропионовой кислоты водным гидроксидом натрия (NaOH)
Решение:
Пропионовая кислота ионизируется в воде с образованием пропионат-иона и иона гидроксония (H 3 O + ).
CH 3 CH 2 COOH (водн.) + H 2 O (ℓ) → CH 3 CH 2 COO — (водн.) + H 3 O + (водн.)
Пропионовая кислота реагирует с NaOH (водн.) С образованием пропионата натрия и воды.
CH 3 CH 2 COOH (вод.) + NaOH (вод.) → CH 3 CH 2 COO — Na + (вод.) + H 2 O ()
Образование сложных эфиров из карбоновых кислот и спиртов
Сложный эфир может быть образован путем объединения карбоновой кислоты со спиртом в присутствии сильной кислоты или в присутствии фермента в биологических системах.В реакции этерификации гидроксильная группа карбоновой кислоты действует как уходящая группа и образует молекулу воды в конечном продукте. Он заменен группой -OR из спирта.
Реакция обратимая. В качестве конкретного примера реакции этерификации бутилацетат может быть получен из уксусной кислоты и 1-бутанола.
Более подробно: конденсационные полимеры
Коммерчески важной реакцией этерификации является конденсационная полимеризация, при которой происходит реакция между дикарбоновой кислотой и двухатомным спиртом (диолом) с удалением воды.Такая реакция дает сложный эфир, который содержит свободную (непрореагировавшую) карбоксильную группу на одном конце и свободную спиртовую группу на другом конце. Затем происходят дальнейшие реакции конденсации с образованием полиэфирных полимеров.
Самый важный полиэфир, полиэтилентерефталат (ПЭТ), производится из мономеров терефталевой кислоты и этиленгликоля:
Из молекул полиэстера получаются отличные волокна, которые используются во многих тканях. Вязаная полиэфирная трубка, которая является биологически инертной, может использоваться в хирургии для восстановления или замены пораженных участков кровеносных сосудов.ПЭТ используется для изготовления бутылок для газировки и других напитков. Из него также образуются пленки, называемые майларом. В магнитном покрытии майларовая лента используется в аудио- и видеокассетах. Синтетические артерии могут быть изготовлены из ПЭТ, политетрафторэтилена и других полимеров.
Практические проблемы:
Завершите следующие реакции:
Гидролиз сложных эфиров
Обратную реакцию образования сложного эфира можно использовать для разложения сложных эфиров на карбоновую кислоту и спирт.Эта реакция требует включения воды в сложноэфирную связь, и поэтому называется реакцией гидролиза .
Сложный эфир нагревают с большим избытком воды, содержащей сильнокислый катализатор. Как и при этерификации, реакция обратима и не доходит до завершения.
В качестве конкретного примера бутилацетат и вода реагируют с образованием уксусной кислоты и 1-бутанола. Реакция обратима и не доходит до завершения.
Практические проблемы:
Вернуться к началу
9.7 Краткое содержание главы
Гидроксильная группа (ОН) является функциональной группой из спиртов . Спирты представлены общей формулой ROH. Спирты получают из алканов путем замены одного или нескольких атомов водорода на группу ОН. Первичный (1 °) спирт (RCH 2 OH) имеет группу ОН на атоме углерода, присоединенную к еще одному атому углерода; вторичный (2 °) спирт (R 2 CHOH) имеет группу ОН на атоме углерода, присоединенную к двум другим атомам углерода; и третичный (3 °) спирт (R 3 COH) имеет группу ОН на атоме углерода, присоединенную к трем другим атомам углерода.
Способность участвовать в водородных связях значительно увеличивает точки кипения спиртов по сравнению с углеводородами сопоставимой молярной массы. Спирты также могут вступать в водородную связь с молекулами воды, а спирты, содержащие до четырех атомов углерода, растворимы в воде.
Многие спирты можно синтезировать путем гидратации алкенов. Обычные спирты включают метанол, этанол и изопропиловый спирт. Метанол довольно ядовит. Это может вызвать слепоту или даже смерть. Этанол можно получить из этилена или получить путем ферментации.Это «алкоголь» в алкогольных напитках. Иногда люди по ошибке пьют метанол, думая, что это алкогольный напиток. Иногда недобросовестные бутлегеры продают метанол ничего не подозревающим покупателям. В любом случае результаты зачастую трагичны.
Когда вода удаляется из спирта на стадии дегидратации, результатом является либо алкен, либо простой эфир, в зависимости от условий реакции. Первичные спирты окисляются до альдегидов или карбоновых кислот, а вторичные спирты окисляются до кетонов.Третичные спирты не окисляются легко.
Спирты, содержащие две группы ОН на соседних атомах углерода, называются гликолями .
Фенолы (ArOH) представляют собой соединения, имеющие группу ОН, присоединенную к ароматическому кольцу.
Простые эфиры (ROR ‘, ROAr, ArOAr) представляют собой соединения, в которых атом кислорода присоединен к двум органическим группам. Молекулы эфира не имеют группы ОН и, следовательно, межмолекулярной водородной связи. Следовательно, простые эфиры имеют довольно низкие температуры кипения для данной молярной массы.Молекулы эфира имеют атом кислорода и могут вступать в водородную связь с молекулами воды. Молекула эфира имеет примерно такую же растворимость в воде, как и спирт, изомерный с ней.
Карбонильная группа , двойная связь углерод-кислород, встречается повсеместно в биологических соединениях. Он содержится в углеводах, жирах, белках, нуклеиновых кислотах, гормонах и витаминах — органических соединениях, важных для живых систем.
Карбонильная группа является определяющей особенностью альдегидов и кетонов .В альдегидах по крайней мере одна связь в карбонильной группе представляет собой связь углерод-водород; в кетонах обе доступные связи у карбонильного атома углерода являются связями углерод-углерод. Альдегиды синтезируются окислением первичных спиртов. Альдегид можно дополнительно окислить до карбоновой кислоты. Кетоны получают окислением вторичных спиртов. Мягкие окислители окисляют альдегиды до карбоновых кислот. Кетоны этими реагентами не окисляются.
Альдегиды и кетоны могут реагировать со спиртами с образованием полуацеталей и гемикеталей соответственно.Эти реакции происходят без добавления катализатора и могут двигаться как в прямом, так и в обратном направлении. Гемиацетали и гемикетали могут вступать в реакцию с дополнительной молекулой спирта с образованием ацеталей и кеталей. Образование ацеталя или кеталя требует удаления воды и называется реакцией дегидратации. Эти реакции требуют катализатора или фермента, чтобы они происходили. Обратная реакция, которая расщепляет ацеталь с образованием полуацеталя и спирта, требует добавления молекулы воды и называется гидролизом.
Карбоновая кислота (RCOOH) содержит функциональную группу COOH, называемую карбоксильной группой , которая имеет группу ОН, присоединенную к карбонильному атому углерода. Сложный эфир (RCOOR ‘) имеет группу OR’, присоединенную к карбонильному атому углерода.
Карбоновая кислота образуется при окислении альдегида с тем же числом атомов углерода. Поскольку альдегиды образуются из первичных спиртов, эти спирты также являются исходным материалом для карбоновых кислот.
Карбоновые кислоты имеют сильный, часто неприятный запах. Это высокополярные молекулы, которые легко образуют водородные связи, поэтому имеют относительно высокие температуры кипения.
Карбоновые кислоты — слабые кислоты. Они реагируют с основаниями с образованием солей и с карбонатами и бикарбонатами с образованием газообразного диоксида углерода и соли кислоты.
Сложные эфиры — это соединения с приятным запахом, которые отвечают за аромат цветов и фруктов. У них более низкие температуры кипения, чем у сопоставимых карбоновых кислот, потому что, хотя молекулы сложного эфира в некоторой степени полярны, они не могут участвовать в водородных связях.Однако с водой сложные эфиры могут образовывать водородные связи; следовательно, сложные эфиры с низкой молярной массой растворимы в воде. Сложные эфиры могут быть синтезированы путем этерификации , в которой карбоновая кислота и спирт объединяются в кислых условиях. Сложные эфиры представляют собой нейтральные соединения, которые подвергаются гидролизу , реакции с водой. В кислых условиях гидролиз по существу является обратным этерификации.
Рисунок 9.15 Сводка важных реакций с кислородом.
Фармер С., Ройш В., Александер Э. и Рахим А. (2016) Органическая химия. Либретексты. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry
Ball, et al. (2016) MAP: Основы химии ГОБ. Либретексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)/14%3A_Organic_Compounds_of_Oxygen/14.10%24des_of_Oxygen/14.10%24des_Android
McMurray (2017) MAP: Органическая химия.Либретексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry_Textbook_Maps/Map%3A_Organic_Chemistry_(McMurry)
Soderburg (2015) Карта: органическая химия с биологическим акцентом. Либретексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry_Textbook_Maps/Map%3A_Organic_Chemistry_With_a_Biological_Emphasis_(Soderberg)
Антифриз. (2017, 5 января). В Википедия, Бесплатная энциклопедия . Получено в 06:07, 21 апреля 2017 г., с https: // en.wikipedia.org/w/index.php?title=Antifreeze&oldid=758484047
Этиленгликоль. (2017, 4 апреля). В Википедия, Бесплатная энциклопедия . Получено в 06:09, 21 апреля 2017 г., с https://en.wikipedia.org/w/index.php?title=Ethylene_glycol&oldid=773769112
.
Органическое соединение — обзор
61.6.1 Предыстория
СОЗ, также известные как СОЗ (стойкие органические загрязнители), могут быть кандидатами на террористическое нападение на домашний скот. Большинство POC биомагнифицированы в пищевой сети.Медицинское, экономическое и политическое воздействие их использования в террористической атаке, вероятно, приведет к огромным финансовым потерям, включая здравоохранение, исходя из последствий непреднамеренного заражения кормов, о которых сообщается (Carter, 1976; Kay, 1977; Reich, 1983; Terrell et al., 2015; Malisch, 2017; Walker et al., 2019). Большинство ПОС биоконцентрированы в липидах организма. Большинству этих соединений требуются высокие дозы, чтобы вызвать острые заболевания у людей, домашнего скота, птицы и рыбы. При низких дозах вызываемое этим заболевание у сельскохозяйственных животных обычно менее очевидно, и эти животные и их продукты используются в качестве пищевых продуктов.Проблемы здоровья человека в результате длительного воздействия СОЗ получают все большее признание. Есть остатки в пищевых продуктах животного происхождения и топленых продуктах животного происхождения, используемых в кормах для животных. Наличие ЧОС, загрязняющих корма и кормовые ингредиенты, недооценивается (Kim et al., 2007). Отсутствие специфических клинических признаков и поражений увеличивает риск того, что зараженные животные не узнают и не пройдут инспекцию убоя, и впоследствии их продукты будут потреблены людьми, а их побочные продукты будут использованы в кормах.Для ЧОС безопасность пищевых продуктов и кормов зависит от результатов химического анализа (Kim et al., 2007). Известны случаи передачи POC из зараженных пищевых продуктов животного происхождения человеку и их побочных продуктов в корм (Kay, 1977; Reich, 1983; Fries, 1985; Huwe and Smith, 2005; Kim et al., 2007; Covaci et al. , 2008).
Обсуждаются исторические происшествия, чтобы продемонстрировать влияние на экономику и здоровье людей, которые могут быть вызваны загрязнением кормов СОЗ. Райх (1983) сообщил, что с 1969 по 1974 год, исключая инцидент с полибромированными дифенилами (ПБД) в Мичигане, потери животноводства и птицы в результате выявленного химического загрязнения составили 21 доллар США.5 миллионов. В качестве примера приводится инцидент с PBB в Мичигане, вероятно, крупнейший в истории США. Причиной этого инцидента был антипирен ПБД (примерно 200–400 кг), предназначенный для использования в пластике, который был отправлен на комбикормовый завод вместо оксида магния. Впоследствии ПБД были добавлены в корм для скота (Carter, 1976; Reich, 1983). Спустя более 40 лет последствия этого инцидента для здоровья выясняются, что демонстрирует долгосрочное воздействие на здоровье людей из разных поколений и долгосрочные затраты, связанные со здравоохранением, которые никогда не оценивались (Small et al., 2011; Террелл и др., 2015; Jacobson et al., 2017; Walker et al., 2019). Источники ЧОС из окружающей среды могут попадать в корма и требуют ответных мер регулирующих органов. В минеральные смеси вводился глинистый минерал, загрязненный полихлорированными дибензодиоксинами (ПХДД) и дибензофуранами (ПХДФ). Другие инциденты с зараженной глиной ясно показывают, что заражение кормов может происходить в течение значительного периода времени, прежде чем заражение будет обнаружено, а пищевые продукты и корма защищены нормативными актами (Hayward et al., 1999; Hoogenboom et al., 2010). Апельсиновая цедра, отходы хлебобулочных изделий, переработанный жир, хлорид холина и оксид цинка могут использоваться в качестве кормовых ингредиентов, и эти продукты были загрязнены СОЗ, что привело к загрязнению пищевых продуктов животного происхождения (Malisch and Kotz, 2014). Упреждающий аналитический надзор за СОЗ требует значительных ресурсов, состоящих из высококвалифицированного персонала, сложных лабораторных процедур и инфраструктуры для выполнения требований лабораторной безопасности. Аналитическая и кадровая поддержка расследований ЧОС, загрязняющих корма для скота, может бросить вызов бюджету, карантин может привести к тяжелым экономическим последствиям для производителей домашнего скота и птицы, и может возникнуть политическое давление на регулирующие органы с целью ограничить или отложить расследования (Reich, 1983; Deshingkar, 2002) ).Некоторые из самых высоких уровней СОЗ в потребляемых пищевых продуктах произошли из-за загрязнения кормов. Воздействие СОЗ в рационе человека на здоровье, вероятно, недооценивается, и есть данные, свидетельствующие о том, что эти эффекты могут распространяться на разные поколения (Blanck et al., 2000; Kim et al., 2007; Walker et al., 2019).
Технический обзор летучих органических соединений | Качество воздуха в помещении (IAQ)
На этой странице:
Обзор
Органические химические соединения1 присутствуют повсюду как в помещениях, так и на открытом воздухе, поскольку они стали важными ингредиентами многих продуктов и материалов.
- На открытом воздухе ЛОС улетучиваются или выбрасываются в воздух в основном при производстве или использовании повседневных товаров и материалов.
- Внутри помещений летучие органические соединения обычно выбрасываются в воздух в результате использования продуктов и материалов, содержащих летучие органические соединения.
ЛОС вызывают озабоченность как загрязнители воздуха внутри помещений, так и как загрязнители наружного воздуха. Однако акцент этой заботы на открытом воздухе отличается от акцента в помещении. Основная проблема в помещениях — это возможность ЛОС отрицательно повлиять на здоровье людей, подвергшихся их воздействию.Хотя летучие органические соединения также могут представлять опасность для здоровья на открытом воздухе, EPA регулирует выбросы летучих органических соединений на открытом воздухе в основном из-за их способности создавать фотохимический смог при определенных условиях.
Хотя один и тот же термин «летучие органические соединения» используется для обозначения качества воздуха внутри и снаружи помещений, этот термин определяется по-разному, чтобы отразить его преобладающую озабоченность в каждом контексте. Это вызвало недопонимание на рынке и в экологическом сообществе. Кроме того, измеряемое количество и состав ЛОС в воздухе могут значительно различаться в зависимости от используемых методов измерения, что вызывает дополнительную путаницу.
Начало страницы
Общее определение и классификации
Летучие органические соединения (ЛОС) означают любое соединение углерода, за исключением монооксида углерода, диоксида углерода, угольной кислоты, карбидов или карбонатов металлов и карбоната аммония, которое участвует в фотохимических реакциях в атмосфере, за исключением тех, которые определены EPA как имеющие незначительную фотохимическую реактивность 2 .
Летучие органические соединения или ЛОС — это органические химические соединения, состав которых позволяет им испаряться при нормальных атмосферных условиях температуры и давления в помещении 3 .Это общее определение ЛОС, которое используется в научной литературе и согласуется с определением, используемым для определения качества воздуха в помещениях. Поскольку летучесть 4 соединения обычно тем выше, чем ниже его температура кипения, летучесть органических соединений иногда определяют и классифицируют по их температурам кипения.
Например, Европейский Союз использует точку кипения, а не его волатильность в своем определении ЛОС.
ЛОС — это любое органическое соединение, начальная точка кипения которого меньше или равна 250 ° C, измеренная при стандартном атмосферном давлении 101.3 кПа. 5, 6, 7
ЛОС
иногда классифицируют по легкости их выделения. Например, Всемирная организация здравоохранения (ВОЗ) классифицирует органические загрязнители помещений как:
- Очень летучие органические соединения (ЛОС)
- Летучие органические соединения (ЛОС)
- Полулетучие органические соединения (SVOC)
Чем выше летучесть (ниже точка кипения), тем больше вероятность того, что соединение будет выброшено из продукта или поверхности в воздух.Очень летучие органические соединения настолько летучие, что их трудно измерить, и они почти полностью обнаруживаются в виде газов в воздухе, а не в материалах или на поверхностях. Наименее летучие соединения, обнаруженные в воздухе, составляют гораздо меньшую часть от общего количества, присутствующего в помещении, в то время как большинство из них находится в твердых или жидких веществах, которые их содержат, или на поверхностях, включая пыль, мебель и строительные материалы.
Классификация неорганических органических загрязнителей (адаптировано из ВОЗ 8 )
| Описание | Сокращение | Диапазон температур кипения (° C) | Соединения примера |
|---|---|---|---|
| Очень летучие (газообразные) органические соединения | VVOC | <0 до 50-100 | Пропан, бутан, метилхлорид |
| Летучие органические соединения | VOC | 50-100 до 240-260 | Формальдегид, d-лимонен, толуол, ацетон, этанол (этиловый спирт) 2-пропанол (изопропиловый спирт), гексаналь |
| Полулетучие органические соединения | SVOC | 240-260 до 380-400 | Пестициды (ДДТ, хлордан, пластификаторы (фталаты), антипирены (ПХД, ПБД)) |
Начало страницы
Нормативное определение EPA для ЛОС, влияющих на фотохимическое окисление в наружном воздухе
Фон
В Соединенных Штатах выбросы ЛОС в окружающую среду регулируются EPA в основном для предотвращения образования озона, составляющей фотохимического смога.Многие ЛОС образуют приземный озон, «реагируя» с такими источниками молекул кислорода, как оксиды азота (NOx) и монооксид углерода (CO) в атмосфере в присутствии солнечного света. Однако только некоторые ЛОС считаются достаточно «реактивными», чтобы вызывать беспокойство. ЛОС, которые не вступают в реакцию или обладают незначительной реакционной способностью с образованием озона в этих условиях, не подпадают под определение ЛОС, используемое Агентством по охране окружающей среды в своем регламенте. С момента первого создания списка исключенных соединений в 1977 году EPA добавило несколько соединений в этот список и часто имеет несколько петиций о дополнительных соединениях, находящихся на рассмотрении.Кроме того, в некоторых штатах есть свои определения и списки исключенных соединений. Таким образом, для целей регулирования конкретное определение ЛОС вне помещений может изменяться в зависимости от того, что исключено из этого определения.
Непонимание и заблуждение относительно ЛОС
EPA ранее определяло регулируемые органические соединения в наружном воздухе как «Реактивные органические газы» (ROG). Эта терминология пояснила, что ее значение ограничивается реактивными химическими веществами. Однако позже EPA изменило эту терминологию на «ЛОС».К сожалению, использование термина «ЛОС», а не «ROG», вызвало недоразумение применительно к качеству воздуха в помещении. Многие люди и организации, в том числе производители строительных материалов и продукции, а также сторонние сертификационные организации, стали думать о ЛОС как о «только тех, которые регулируются EPA для наружного воздуха», и применяют то же определение для воздуха внутри помещений.
В той степени, в которой некоторые исключенные соединения влияют на здоровье людей, подвергшихся воздействию в помещении, определение ЛОС, регулируемых для наружного воздуха, может создать серьезные неправильные представления о качестве воздуха в помещении, поэтому такие ЛОС не следует исключать из рассмотрения для воздуха в помещении.Например, метиленхлорид (средство для удаления краски) и перхлорэтилен (жидкость для химической чистки) являются соединениями, не подпадающими под действие правил на открытом воздухе, но они могут представлять серьезную опасность для здоровья людей, подвергшихся воздействию, если находятся в помещении. Первый указан Международным агентством по изучению рака (IARC) как потенциальный канцероген для человека, а второй — как вероятный канцероген для человека. ЛОС внутри помещений вступают в реакцию с озоном внутри помещений 9 даже при концентрациях ниже норм общественного здравоохранения.В результате химических реакций образуются частицы субмикронного размера и вредные побочные продукты, которые могут быть связаны с неблагоприятными последствиями для здоровья некоторых уязвимых групп населения.
Начало страницы
Классификация ЛОС
При обсуждении условий в помещении все органические химические соединения, которые могут улетучиваться при нормальных условиях температуры и давления в помещении, являются ЛОС. Хотя демаркационная линия между классификациями очень летучих органических соединений (VVOC), летучих органических соединений (VOC) и полулетучих органических соединений (SVOC) (см. Таблицу выше) несколько произвольна, она показывает широкий диапазон летучести среди органических соединений. Все три классификации важны для воздуха в помещениях и считаются подпадающими под широкое определение летучих органических соединений в помещениях. Никакие другие критерии, кроме летучести (или точки кипения), не используются для определения ЛОС в помещении.
Измерение ЛОС в воздухе помещений
Знание о ЛОС, которые присутствуют в низких концентрациях, обычно присутствующих в воздухе помещений. в любой конкретной ситуации сильно зависит от того, как они измеряются.Все доступные методы измерения избирательны в том, что они могут точно измерить и количественно определить, и ни один из них не способен измерить все присутствующие ЛОС. Например, бензол и толуол измеряются другим методом, чем формальдегид и другие подобные соединения. Диапазон методов измерения и аналитических инструментов велик и будет определять чувствительность измерений, а также их избирательность или систематические ошибки. Вот почему любое заявление о ЛОС, присутствующих в данной среде, должно сопровождаться описанием того, как были измерены ЛОС, чтобы профессионал мог правильно интерпретировать результаты.В отсутствие такого описания заявление имело бы ограниченное практическое значение.
Маркировка продукции
Для потребителей важно понимать, что информация на этикетках или другой документации о продукте с широкими заявлениями о воздействии на окружающую среду с использованием таких терминов, как «зеленый» или «экологически чистый», может включать или не включать некоторые ЛОС, выделяемые продуктом, и, следовательно, не могут иначе рассматривать их неблагоприятное воздействие на здоровье.
Однако существуют национальные и международные программы, которые сертифицируют и маркируют продукты и материалы на основе их воздействия на качество воздуха в помещениях, такого как различные эффекты для здоровья и комфорта человека, включая запах, раздражение, хроническую токсичность или канцерогенность.Такие программы, вероятно, будут включать рассмотрение, по крайней мере, некоторых ЛОС, вызывающих озабоченность в отношении воздуха внутри помещений. Однако нормы и требования, используемые в настоящее время в индустрии маркировки и сертификации продукции для помещений, не стандартизированы. Правительство или сторонняя организация еще не установили основные правила для разработки последовательных, защитных стандартных методов тестирования для оценки и сравнения продуктов и материалов. Отсутствие стандартизации в большинстве случаев затрудняет для потребителя полное понимание того, что означают этикетки и сертификаты.
Некоторые маркировки ЛОС или программы сертификации основаны на ЛОС, выделяемых продуктом во внутреннюю среду, и возможных связанных с этим воздействиях на здоровье. Однако некоторые из них основаны на содержании ЛОС, которые регулируются для контроля образования фотохимического смога на открытом воздухе. Поэтому маркировка ЛОС и программы сертификации могут не дать должной оценки всех ЛОС, выделяемых продуктом, включая некоторые химические соединения, которые могут иметь отношение к качеству воздуха в помещении. Это особенно верно в отношении большинства влажных продуктов, таких как краски или клеи, которые могут иметь маркировку «с низким содержанием летучих органических соединений» или «без летучих органических соединений».
Начало страницы
Заключение
Снижение концентрации ЛОС в помещении и на открытом воздухе является важной задачей для здоровья и окружающей среды. Однако важно понимать, что существуют опасные ЛОС внутри и снаружи помещений, которые не влияют на фотохимическое окисление и поэтому не регулируются EPA (42 U.S.C. §7401 et seq. (1970)). Важно понимать и понимать это различие, пропагандируя или используя стратегии улучшения качества воздуха в помещениях.Что касается качества воздуха в помещении, ВСЕ органические химические соединения, состав которых дает им возможность испаряться при нормальных атмосферных условиях, считаются ЛОС и должны учитываться при любой оценке воздействия на качество воздуха в помещении.
Начало страницы
Список литературы
- Органическое соединение — это любое из большого класса химических соединений, молекулы которых содержат углерод. По историческим причинам некоторые типы соединений, такие как карбонаты, простые оксиды углерода и цианиды, а также аллотропы углерода, считаются неорганическими.Разделение на «органические» и «неорганические» углеродные соединения полезно, но может считаться несколько произвольным.
- Свод федеральных нормативных актов, 40: Глава 1, подраздел C, часть 51, подраздел F, 51100. Exit по состоянию на 8 февраля 2009 г., а также Глоссарий, сокращения и сокращения терминов EPA по окружающей среде.
- Нормальные атмосферные условия температуры и давления в помещении, используемые здесь, относятся к диапазону условий, обычно встречающихся в зданиях, где живут люди. Таким образом, в зависимости от типа здания и его географического положения, температура может быть от середины 30 (в градусах Фаренгейта) до 90 ° F, а давление может быть от уровня моря до возвышенности гор, где могут находиться здания. расположена.Это не следует путать со «Стандартной температурой и давлением», которые часто используются при анализе и представлении научных исследований, но по-разному определяются разными авторитетными источниками. Наиболее часто используемые, хотя и не общепринятые, определения — это определения Международного союза теоретической и прикладной химии (IUPAC) и Национального института стандартов и технологий (NIST). Стандарт IUPAC — это температура 0 ° C (273, 15 K, 32 ° F) и абсолютное давление 100 кПа (14,504 psi), определение NIST — это температура 20 ° C (293, 15 K, 68 ° F). и абсолютное давление 101.325 кПа (14,696 фунтов на кв. Дюйм).
- Летучесть определяется давлением паров вещества. Это тенденция вещества к испарению или скорость, с которой оно испаряется. Вещества с более высоким давлением пара будут испаряться легче при данной температуре, чем вещества с более низким давлением пара.
- «Директива 2004/42 / CE Европейского парламента и Совета» EUR-Lex. Офис публикаций Европейского Союза. Проверено 27 сентября 2007.
- 101,3 кПа = 1 атмосфера, нормальное давление на уровне моря.
- 250 ° C = 482 ° F
- Всемирная организация здравоохранения, 1989 г. «Качество воздуха в помещениях: органические загрязнители». Отчет о совещании ВОЗ, Берлин, 23-27 августа 1987 г. Отчеты и исследования ЕВРО 111. Копенгаген, Европейское региональное бюро Всемирной организации здравоохранения.
- На концентрацию озона в помещении может влиять количество озона, выделяемого внутри помещения офисным оборудованием, таким как фотокопии и лазерные принтеры, а также озоном вне помещения, попадающим внутрь помещения либо через инфильтрацию, либо через воздух.
Начало страницы
летучих органических соединений (ЛОС) | Центр естественнонаучного образования UCAR
Большинство летучих органических соединений, производимых человеком, образуются в выхлопных газах автомобилей и в промышленных процессах. Летучие органические соединения, поступающие из потребительских растворителей, оказывают наибольшее влияние на качество воздуха в помещении.
Летучие органические соединения или ЛОС — это органические химические вещества, которые испаряются в атмосферу при комнатной температуре. Некоторые ЛОС также могут растворяться в грунтовых водах. Их называют органическими соединениями, потому что они содержат углерод.Есть много типов ЛОС. Например, углеводородные ЛОС содержат атомы водорода и углерода и включают бензол и толуол. Оксигенатные летучие органические соединения содержат углерод, водород и кислород и являются результатом выхлопных газов автомобилей и химических реакций в атмосфере. Растения выделяют безвредные ЛОС, чаще всего терпены или масла, которые придают некоторым растениям характерный запах, а лесные пожары также выделяют ЛОС. Некоторые летучие органические соединения токсичны и отрицательно влияют на атмосферу. Летучие органические соединения могут оказывать как краткосрочное, так и долгосрочное воздействие на здоровье и приводить к ухудшению качества воздуха в помещении и на улице.
ЛОС влияют на качество воздуха
ЛОС, которые влияют на качество воздуха в помещении, поступают из многих видов бытовых товаров, включая краски и лаки, средства для удаления краски, чистящие средства, пестициды, ковровые и виниловые полы, строительные материалы и мебель, офисное оборудование и ремесленные материалы, такие как клей и маркеры. Большая часть запаха, связанного с этими продуктами, исходит от летучих органических соединений, но выделение летучих органических соединений также может быть без запаха, что затрудняет их обнаружение. Все эти продукты могут выделять летучие органические соединения во время их использования и хранения.Концентрации ЛОС в помещении обычно намного выше, чем на открытом воздухе. Люди, страдающие астмой, респираторными заболеваниями и чувствительностью к химическим веществам, подвергаются наибольшему риску от выбросов летучих органических соединений в помещении.
Бензин и природный газ являются основными источниками ЛОС, влияющих на качество наружного воздуха. Выхлопные газы транспортных средств и сжигание ископаемого топлива, древесины и мусора выбрасывают ЛОС в атмосферу. ЛОС в воздухе реагируют с солнечным светом и оксидами азота с образованием тропосферного озона, еще одного вредного загрязнителя воздуха. Некоторые ЛОС действуют как парниковые газы, способствующие потеплению климата.
ЛОС могут нанести вред здоровью человека
Краски и бытовые чистящие средства являются источниками ЛОС. Использование и хранение таких продуктов, как краски и бытовая химия, без надлежащей вентиляции может привести к нездоровому уровню содержания ЛОС в воздухе.
Некоторые типы ЛОС более опасны, чем другие. Известно, что бензол вызывает рак и содержится в табачном дыме, нефти и газе, а также в выхлопных газах автомобилей. Полициклические ароматические углеводороды (ПАУ) также могут вызывать рак и выделяются при сжигании угля, нефти и газа.Бутадиен содержится в выхлопных газах бензиновых двигателей и сигаретном дыме, а также может вызывать рак. Длительное воздействие высоких уровней ЛОС также связано с повреждением печени, почек и нервной системы. Кратковременное воздействие ЛОС может включать такие симптомы, как головокружение, головная боль, раздражение глаз, носа и горла, тошнота и потеря памяти.
Снижение воздействия ЛОС
Чтобы снизить воздействие ЛОС, ограничьте использование и хранение продуктов, содержащих ЛОС, в вашем доме и не курите.Покупайте продукты с низким содержанием летучих органических соединений, например краску. Когда вам необходимо использовать летучие органические соединения, убедитесь, что у вас есть соответствующая вентиляция, или используйте их на открытом воздухе.
