Содержание
Урок 5. классификация химических реакций — Химия — 11 класс
Химия, 11 класс
Урок № 5. Классификация химических реакций
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению способов классификации химических реакций и системам классификации химических реакций.
Глоссарий
Гетерогенные реакции – реакции, в которых реагенты и продукты реакции находятся в разных фазах, при этом реакция протекает на границе раздела фаз.
Гомогенные реакции – реакции, в которых реагенты и продукты реакции находятся в одной фазе.
Катализатор – вещество, увеличивающее скорость химической реакции, но само при этом остающееся неизменным.
Необратимые реакции – реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции.
Обратимые реакции – реакции, протекающие одновременно в прямом и обратном направлениях в одних и тех же условиях.
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степеней окисления элементов.
Реакции замещения – реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Реакции обмена – реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Реакции разложения – реакции, при которых из одного сложного вещества образуется несколько новых веществ.
Реакции соединения – реакции, в результате которых из двух или нескольких исходных веществ образуется одно сложное вещество.
Химическая реакция (химическое превращение) – процесс, в котором одно или несколько веществ превращаются в другие вещества.
Экзотермическая реакция – реакция, сопровождающаяся выделением энергии (тепла).
Эндотермическая реакция – реакция, сопровождающаяся поглощением энергии (тепла).
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Химическая реакция – это процесс, в котором одно или несколько веществ превращаются в другие вещества. Выбирая определённые критерии, которые лягут в основу нашего описания, мы можем классифицировать и описать любую химическую реакцию с разных «точек зрения».
Рассмотрим, какие критерии могут лежать в основе разных классификаций химических реакций.
Первый критерий – число и состав реагирующих и образующихся веществ. Мы можем выделить реакции: соединения, разложения, замещения и обмена. Кроме этого, нам могут встретиться реакции, в ходе которых изменение состава веществ не происходит. Примерами таких реакций будут превращения одних аллотропных модификаций в другие, а также реакции изомеризации.
Если в основу классификации мы положим изменение степени окисления атомов элементов, то все реакции разделятся на две категории: окислительно-восстановительные и реакции, при которых изменение степени окисления не происходит.
В зависимости от использования катализатора, реакции могут являться каталитическими либо некаталитическими.
Если нас заинтересует смещение химического равновесия во время химического превращения, тогда мы увидим, что некоторые реакции окажутся обратимыми, а некоторые будут проходить до конца полностью и безвозвратно – необратимо.
По фазовому составу можно разделить реакции на гомогенные, при которых реагенты и продукты находятся в одной фазе, и гетерогенные, в которых реагенты и продукты находятся в разных фазах, а реакции происходят на границе раздела фаз.
Также реакции можно различить по виду энергии, которая их инициирует: таким образом реакции могут быть радиационные, фотохимические, термохимические и электрохимические.
В зависимости от теплового эффекта можно выделить реакции экзотермические, в ходе которых тепло выделяется, и эндотермические, при которых происходит поглощение тепла.
В заключение, можно посмотреть на реакции с точки зрения их механизма и тогда большинство реакций можно будет разделить на те, которые проходят по радикальному механизму, и те, что проходят по ионному.
Химические реакции следует отличать от ядерных. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются.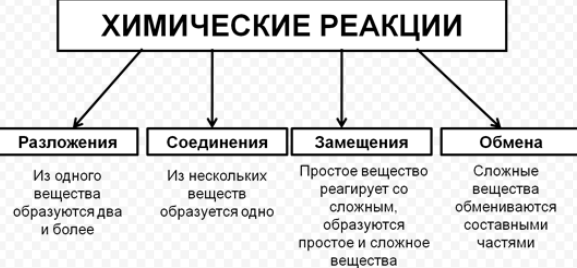 Ядерные же реакции – это процесс превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами.
Ядерные же реакции – это процесс превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами.
Как мы видим, классификация химических реакций многопланова, то есть в ее основу положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Для примера рассмотрим реакцию разложения осадка гидроксида меди (II) с образованием оксида меди (II) и воды.
Cu(OH)2 → CuO + H2O
По количеству и характеру реагентов и продуктов эта реакция относится к типу реакций разложения – из одного сложного вещества мы получаем два новых сложных. В ходе реакции степени окисления атомов элементов остаются прежними, значит, это превращение относится к реакциям без изменения степеней окисления. Для осуществления такой реакции нам не требуется катализатор, поэтому это будет превращением некаталитическим. При разложении нерастворимого гидроксида меди (II) мы получаем нерастворимый в воде оксид меди (II), поэтому, если мы попробуем провести реакцию между оксидом меди (II) и водой, у нас ничего не выйдет.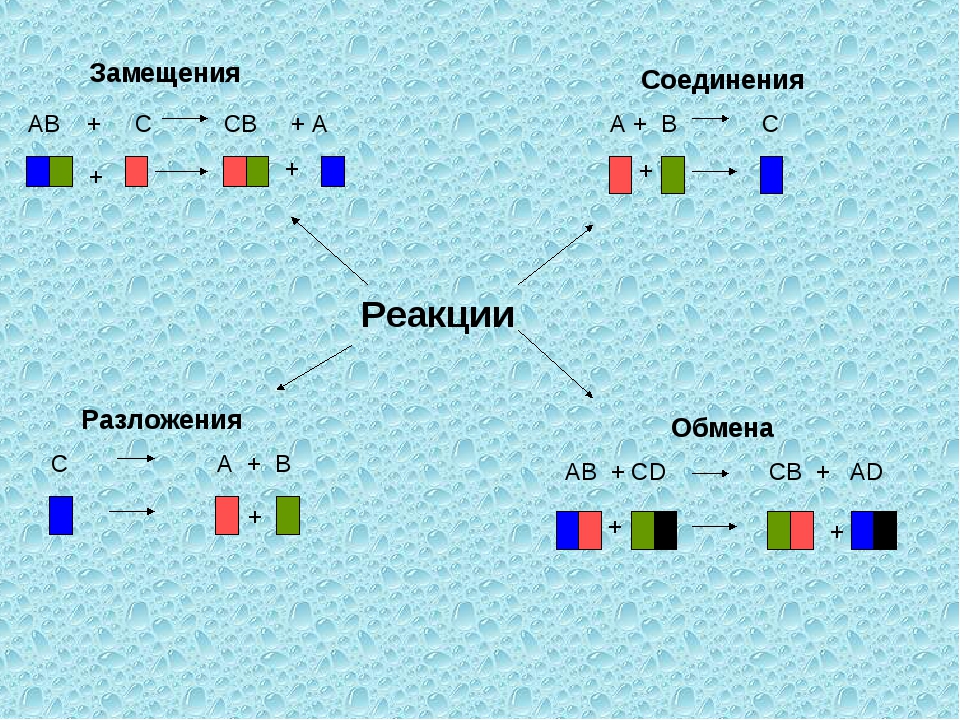 Значит, реакция разложения гидроксида меди (II) является необратимой. В качестве реагента выступает твердое вещество, а в качестве продуктов – твердый оксид меди (II) и водяной пар, поэтому по фазовому составу такая реакция является гетерогенной. Реакция разложения гидроксида меди (II) начинается при его нагревании, температура превращения составляет около 80 °С. Значит, по виду энергии, инициирующей реакцию, эта реакция является термохимической. Для «запуска» этой реакции требуется нагревание, следовательно, теплота, которую мы подводим извне, будет поглощаться и полученная энергия будет расходоваться на перестройку структуры. Такая реакция относится к эндотермическим.
Значит, реакция разложения гидроксида меди (II) является необратимой. В качестве реагента выступает твердое вещество, а в качестве продуктов – твердый оксид меди (II) и водяной пар, поэтому по фазовому составу такая реакция является гетерогенной. Реакция разложения гидроксида меди (II) начинается при его нагревании, температура превращения составляет около 80 °С. Значит, по виду энергии, инициирующей реакцию, эта реакция является термохимической. Для «запуска» этой реакции требуется нагревание, следовательно, теплота, которую мы подводим извне, будет поглощаться и полученная энергия будет расходоваться на перестройку структуры. Такая реакция относится к эндотермическим.
В итоге мы видим, что любая химическая реакция может быть одновременно и полно охарактеризована по различным критериям.
Классификация химических реакций разнообразна. Такой комплексный подход позволяет рассмотреть и изучить каждое превращение со всех возможных сторон и понять его максимально полно.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Пример 1.
Введите формулу недостающего продукта реакции.
CH3COOH + Ca(OH)2 → … + H2O.
Решение
Мы видим, что первое вещество в этой реакции – это уксусная кислота, а второе – гидроксид кальция. Вспоминаем, что реакция между кислотой и основанием – это реакция нейтрализации. Продуктами подобных реакций являются соль и вода. Вода уже записана в правой части уравнения, остается вписать туда формулу соль. Это должна быть кальциевая соль уксусной кислоты – ацетат кальция. Ацетат-ион одновалентен, а ион кальция – двухвалентен, следовательно, на каждый ион кальция приходится два ацетат-иона. Его формула (CH3COO)2Ca. Записываем формулу на место пропуска.
Пример 2.
К каким типам реакций относится промышленный синтез аммиака?
- Реакция соединения
- Реакция обмена
- Электрохимическая реакция
- Радиохимическая реакция
- Гомогенная реакция
- Каталитическая реакция
Решение.
Реакция синтеза аммиака: N2 + H2 → NH3
Два простых вещества реагируют друг с другом с образованием сложного вещества. Следовательно, по определению, такая реакция будет реакцией соединения. Значит, «обмен» можно смело вычеркивать. Реакция синтеза аммиака происходит при высокой температуре и очень высоком давлении в присутствии катализатора. Выходит, что по типу энергии, инициирующей реакцию, эта реакция будет термохимической. Такого варианта у нас нет, значит оба предложенных варианта не подходит (электрохимическая и радиохимическая). Мы сказали, что для реакции требуется катализатор, поэтому эта реакция является каталитической. Все три вещества – азот, водород и аммиак – являются газообразными веществами, значит, реакция относится к типу гомогенных.
Химические реакции, типы реакций, виды реакций, окислительно-восстановительные реакции
Виды реакций:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером химической реакции соединения может служить нагревание порошков железа и серы, — при этом образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода,…) на воздухе. Например, углерод горит на воздухе С+О2=СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции горения всегда сопровождаются выделением тепла — являются экзотермическими.
Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в раствор медного купороса получаем железный купорос (здесь железо вытеснило медь из её соли) Fe+CuSO4→ FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н2О.
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций и их механизмы приведены в таблице:
|
химические реакции соединения
A + B = AB
Пример:
Из нескольких простых или сложных веществ образуется одно сложное
|
химические реакции разложения
AB = A + B
Пример:
Из сложного вещества образуется несколько простых или сложных веществ
|
химические реакции замещения
A + BC =AC + B
Пример:
Атом простого вещества замещает один из атомов сложного
|
химические реакции ионного обмена
AB+CD = AD+CB
Пример:
Сложные вещества обмениваются своими составными частями
|
Однако очень многие реакции не укладываются в приведённую простую схему.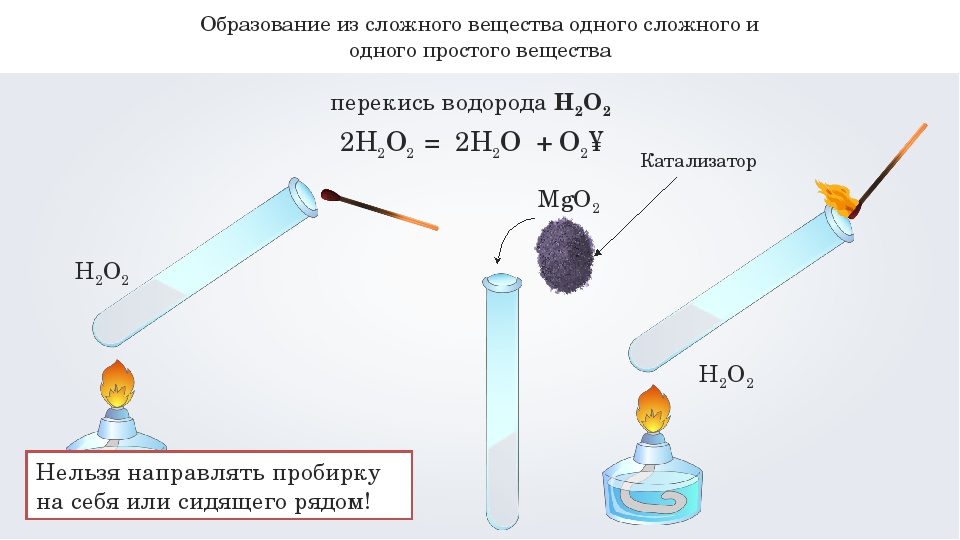 Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
2KMnO4+10NaI+8H2SO4→ 2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Признаки химических реакций. По ним можно судить, прошла ли химическая реакция между реагентами или нет. К таким признакам принято относить следующие:
— Изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа — химическая реакция взаимодействия железа с кислородом).
— Выпадение осадка (например, если через известковый раствор (раствор гидроксида кальция) пропустить углекислый газ, выпадет белый нерастворимый осадок карбоната кальция).
— Выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ).
— Образование слабодиссоциированных веществ (например, реакции, при которых одним из продуктов реакции является вода).
— Свечение раствора.
Примером свечения раствора может служить реакция с использованием такого реагента как раствор люминола (люминол- это сложное химическое вещество, которое может излучать свет при химических реакциях).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — составляют особый класс химических реакций. Их характерной особенностью является изменение степени окисления, по крайней мере, пары атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Сложные вещества, понижающие свою степень окисления — окислители, а повышающие степень окисления — восстановители. Например:
2Na + Cl2→ 2NaCl,
— здесь окислитель — хлор (он присоединяет к себе электроны), а восстановитель — натрий (он отдаёт электроны).
Реакция замещения NaBr-1+ Cl20→ 2NaCl-1 + Br20 (характерна для галогенов) тоже относится к окислительно -восстановительным реакциям. Здесь хлор — окислитель (принимает 1 электрон), а бромид натрия (NaBr) — восстановитель (атом брома отдаёт электрон).
Реакция разложения дихромата аммония ((NH4)2Cr2O7) тоже относится к окислительно-восстановительным реакциям:
(N-3H4)2Cr2+6O7→ N20 + Cr2+3O3 + 4H2O
Ещё одна из распространённых классификаций химических реакций — это их разделение по тепловому эффекту.
Разделяют эндотермические реакции и экзотермические реакции.
Эндотермические реакции — химические реакции, сопровождающиеся поглощением окружающего тепла (вспомните охлаждающие смеси). Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Опасные химические реакции :»БОМБА В РАКОВИНЕ»- забавно или не очень?!
Существуют некоторые химические реакции, которые протекают спонтанно при смешивании реагентов. При этом образуются достаточно опасные смеси, которые могут взрываться, воспламеняться или отравлять. Вот одна и них!
В некоторых американских и английских клиниках наблюдались странные явления. Время от времени из раковин раздавались звуки, напоминающие пистолетные выстрелы, а в одном случае неожиданно взорвалась сливная трубка. К счастью, никто не пострадал. Расследование показало, что виновником всего этого был очень слабый (0,01%) раствор азида натрия NaN3, который использовали в качестве консерванта физиологических растворов.
Азид свинца
Излишки раствора азида в течение многих месяцев, а то и лет сливали в раковины — иногда до 2 л в день.
Сам по себе азид натрия — соль азидоводородной кислоты HN3 — не взрывается. Однако азиды тяжёлых металлов (меди, серебра, ртути, свинца и др.) — весьма неустойчивые кристаллические соединения, которые взрываются при трении, ударе, нагревании, действии света. Взрыв может произойти даже под слоем воды! Азид свинца Pb(N3)2 используется как инициирующее взрывчатое вещество, с помощью которого подрывают основную массу взрывчатки. Для этого достаточно всего двух десятков миллиграммов Pb(N3)2. Это соединение более взрывчато, чем нитроглицерин, а скорость детонации (распространения взрывной волны) при взрыве достигает 45 км/с — в 10 раз больше, чем у тротила.
Но откуда в клиниках могли взяться азиды тяжёлых металлов? Оказалось, во всех случаях сливные трубки под раковинами были изготовлены из меди или латуни (такие трубки легко гнутся, особенно после нагревания, поэтому их удобно устанавливать в сливной системе). Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Медиков не очень интересовала сущность химических реакций, приводящих к образованию взрывчатки. В химической литературе также не удалось найти описания этого процесса. Но можно предположить, исходя из сильных окислительных свойств HN3, что имела место такая реакция: анион N-3, окисляя медь, образовал одну молекулу N2 и атом азота, который вошёл в состав аммиака. Это соответствует уравнению реакции: 3NaN3+Cu+3Н2О→ Cu(N3)2+3NaOH+N2+NH3.
С опасностью образования бомбы в раковине приходится считаться всем, кто имеет дело с растворимыми азидами металлов, в том числе и химикам, поскольку азиды используются для получения особо чистого азота, в органическом синтезе, в качестве порообразователя (вспенивающего агента для производства газонаполненных материалов: пенопластов, пористой резины и т. п.). Во всех подобных случаях надо проследить, чтобы сливные трубки были пластмассовыми.
Сравнительно недавно азиды нашли новое применение в автомобилестроении. В 1989 г. в некоторых моделях американских автомобилей появились надувные подушки безопасности. Такая подушка, содержащая азид натрия, в сложенном виде почти незаметна. При лобовом столкновении электрический запал приводит к очень быстрому разложению азида: 2NaN3=2Na+3N2. 100 г порошка выделяют около 60 л азота, который примерно за 0,04 с надувает подушку перед грудью водителя, спасая тем самым ему жизнь.
Классификация химических реакций в неорганической и органической химии | ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.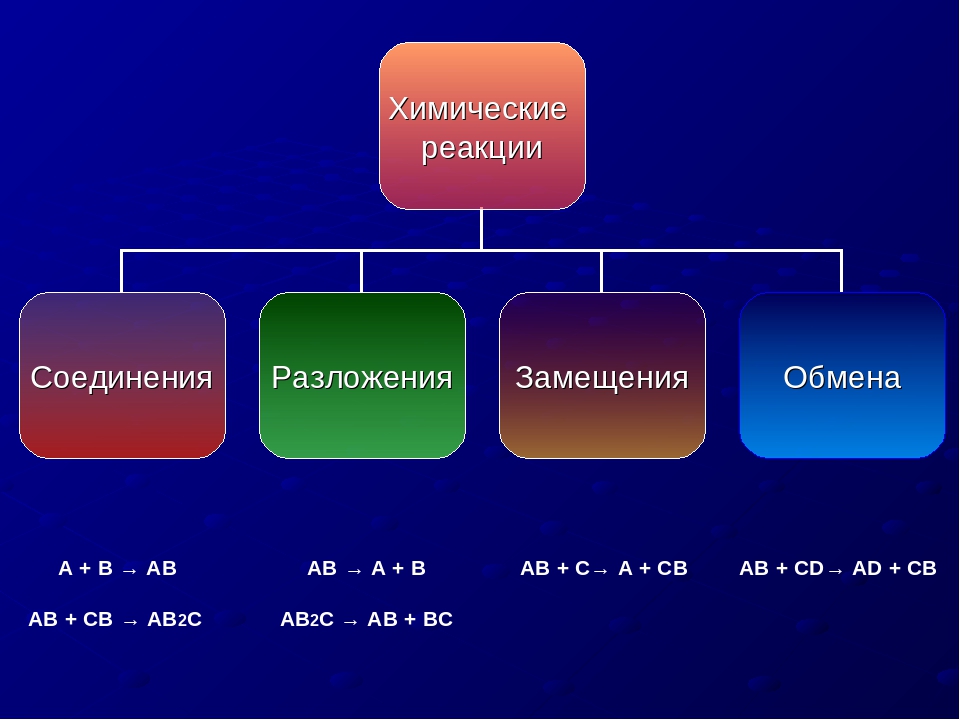
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат. ,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑. $
$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{\text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{\text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{\text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{\text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Классификация химических реакций в неорганической и органической химии » HimEge.ru
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
По изменению степени окисления элементов
Первый признак классификации — по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
б) без изменения степени окисления
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
По числу и составу реагентов и продуктов
Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из нескольких более простых, например:
4Li + O2 = 2Li2O
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
CaCO3 = CaO + CO2
Реакции разложения можно рассматривать как процессы, обратные соединению.
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Fe + 2HCl = FeCl2 + H2
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
— обмена (в том числе и нейтрализации).
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
AgNO3 + KBr = AgBr + KNO3
По возможности протекать в обратном направлении
По возможности протекать в обратном направлении – обратимые и необратимые.
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
По тепловому эффекту
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
По фазе
Гомогенными называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатора
Катализатор – вещество ускоряющее химическую реакцию.
Каталитические реакции протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции идут в отсутствие катализатора.
По типу разрыва связей
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
- гомолитические (равный разрыв, каждый атом по 1 электрону получает)
- гетеролитический (неравный разрыв – одному достается пара электронов)
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Классификация органических реакций
Классификация органических реакций приведена в таблице:
Таблицы по теме «Типы химических реакций»
Что такое реакция разложения в химии? Примеры реакции разложения. Химические реакции
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
По изменению степени окисления элементов
Первый признак классификации — по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
б) без изменения степени окисления
Окислительно-восстановительными
называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
По числу и составу реагентов и продуктов
Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
Реакциями соединения
называют химические реакции, в результате которых сложные молекулы получаются из нескольких более простых, например:
4Li + O 2 = 2Li 2 O
Реакциями разложения
называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
CaCO 3 = CaO + CO 2
Реакции разложения можно рассматривать как процессы, обратные соединению.
Реакциями замещения
называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Fe + 2HCl = FeCl 2 + H 2
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
— обмена (в том числе и нейтрализации).
Реакциями обмена
называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
AgNO 3 + KBr = AgBr + KNO 3
По возможности протекать в обратном направлении
По возможности протекать в обратном направлении – обратимые и необратимые.
Обратимыми
называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N 2 +3H 2 ↔2NH 3
Необратимыми
называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O 2 = 2CaO
BaBr 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaBr
По тепловому эффекту
Экзотермическими
называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH
Эндотермическими
называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q 0.
Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
По фазе
Гомогенными
называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными
называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатора
Катализатор – вещество ускоряющее химическую реакцию.
Каталитические реакции
протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции
идут в отсутствие катализатора.
По типу разрыва связей
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими
называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими
называют реакции, протекающие через образование ионных частиц — катионов и анионов.
- гомолитические (равный разрыв, каждый атом по 1 электрону получает)
- гетеролитический (неравный разрыв – одному достается пара электронов)
Радикальными
(цепными) называют химические реакции с участием радикалов, например:
CH 4 + Cl 2 hv →CH 3 Cl + HCl
Ионными
называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO 3 = KNO 3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C 6 H 6 + Cl 2 FeCl3 → C 6 H 5 Cl + HCl
H 2 C =CH 2 + Br 2 → BrCH 2 –CH 2 Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH 3 Br + NaOH → CH 3 OH + NaBr
CH 3 C(O)H + C 2 H 5 OH → CH 3 CH(OC 2 H 5) 2 + H 2 O
Классификация органических реакций
Классификация органических реакций приведена в таблице:
В современной науке различают химические и ядерные реакции, протекающие в результате взаимодействия исходных веществ, которые принято называть реагентами. В результате образуются другие химические вещества, которые называются продуктами. Все взаимодействия происходят при определенных условиях (температура, излучение, присутствие катализаторов и прочее). Ядра атомов реагентов химических реакций не меняются. В ядерных превращениях образуются новые ядра и частицы. Существует несколько различных признаков, по которым определяют типы химических реакций.
За основу классификации можно взять число исходных и образующихся веществ. В этом случае все типы химических реакций делятся на пять групп:
- Разложения (несколько новых получается из одного вещества), например, разложение при нагревании на хлористый калий и кислород: KCLO3 → 2KCL + 3O2.
- Соединения (два или несколько соединений образуют одно новое), взаимодействуя с водой, окись кальция превращается в гидроокись кальция: h3O + CaO → Ca(OH)2;
- Замещения (число продуктов равно числу исходных веществ, в которых замещена одна составляющая часть на другую), железо в сульфате меди, замещая медь, образует сульфат двухвалентного железа: Fe + CuSO4 → FeSO4 +Cu.
- Двойного обмена (молекулы двух веществ обмениваются оставляющими их частями), металлы в и обмениваются анионами, образуя выпадающий в осадок йодид серебра и азотнокислый кадий: KI + AgNO3 → AgI↓ + KNO3.
- Полиморфного превращения (происходит переход вещества из одной кристаллической формы в другую), йодид цвета при нагревании переходит в йодид ртути желтого цвета: HgI2 (красный) ↔ HgI2 (желтый).
Если химические превращения рассматривать по признаку изменения в реагирующих веществах степени окисления элементов, то тогда типы химических реакций могут делиться на группы:
- С изменением степени окисления — реакции окислительно-восстановительные (ОВР). В качестве примера можно рассмотреть взаимодействие железа с соляной кислотой: Fe + HCL → FeCl2 + h3, в результате степень окисления железа (восстановитель, отдающий электроны) изменилась с 0 до -2, а водорода (окислитель, принимающий электроны) с +1 до 0.
- Без изменения степени окисления (т. е. не ОВР). Например, реакции кислотно-щелочного взаимодействия бромистого водорода с гидроокисью натрия: HBr + NaOH → NaBr + h3O, в результате таких реакций образуются соль и вода, а степени окисления химических элементов, входящих в исходные вещества, не меняются.
Если рассматривать и скорость протекания в прямом и обратном направлении, то все типы химических реакций могут делиться также на две группы:
- Обратимые — те, что одновременно протекают в двух направлениях. Большинство реакций являются обратимыми. В качестве примера можно привести растворение в воде двуокиси углерода с образованием нестойкой угольной кислоты, которая разлагается на исходные вещества: h3O + CO2 ↔ h3CO3.
- Необратимые — протекают только в прямом направлении, после полного расходования одного из исходных веществ завершаются, после чего присутствуют только продукты и исходное вещество, взятое в избытке. Обычно один из продуктов является или выпавшим в осадок нерастворимым веществом или выделившимся газом. Например, при взаимодействии серной кислоты и хлористого бария: h3SO4 + BaCl2 + → BaSO4↓ + 2HCl в осадок выпадает нерастворимый
Типы химических реакций в органической химии можно разделить на четыре группы:
- Замещение (происходит замена одних атомов или групп атомов на другие), например, при взаимодействии хлорэтана с гидроокисью натрия образуется этанол и хлорид натрия: C2H5Cl + NaOH → C2H5OH + NaCl, то есть атом хлора замещается на атом водорода.
- Присоединение (две молекулы реагируют и образовывают одну), например, бром присоединяется в месте разрыва двойной связи в молекуле этилена: Br2 + Ch3=Ch3 → BrCh3—Ch3Br.
- Отщепление (молекула разлагается на две и более молекулы), например, при определенных условиях этанол разлагается на этилен и воду: C2H5OH → Ch3=Ch3 + h3O.
- Перегруппировка (изомеризация, когда одна молекула превращается в другую, но качественный и количественный состав атомов в ней не меняется), например, 3-хлорутен-1 (C4H7CL) превращается в 1 хлорбутен-2 (C4H7CL). Здесь атом хлора перешел от третьего углеродного атома в углеводородной цепочке к первому, а двойная связь соединяла первый и второй атомы углерода, а затем стала соединять второй и третьи атомы.
Известны и другие виды химических реакций:
- По протекающие с поглощением (эндотермические) или выделением тепла (экзотермические).
- По типу взаимодействующих реагентов или образующихся продуктов. Взаимодействие с водой — гидролиз, с водородом — гидрирование, с кислородом — окисление или горение. Отщепление воды — дегидратация, водорода — дегидрирование и так далее.
- По условиям взаимодействия: в присутствии под действием низкой или высокой температуры, при изменении давления, на свету и прочее.
- По механизму протекания реакции: ионные, радикально-цепные или цепные реакции.
Химические реакции следует отличать от ядерных реакций. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например превращение алюминия в магний:
27 13 Аl + 1 1 Н = 24 12 Мg + 4 2 Не
Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Реакции, идущие без изменения состава веществ.
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
С (графит) ↔ С (алмаз)
S (ромбическая) ↔ S (моноклинная)
Р (белый) ↔ Р (красный)
Sn (белое олово) ↔ Sn (серое олово)
3O 2 (кислород) ↔ 2O 3 (озон)
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, так как углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
CH 3 — CH 2 — С= — СН ↔ СН 3 — С= — С- СН 3
этилацетилен диметнлацетилен
4. Изомеризация галогеналканов (А. Е. Фаворский, 1907 г.).
5. Изомеризация цианита аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1828 г. изомеризацией цианата аммония при нагревании.
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения
— это такие реакции, при которых из двух и более веществ образуется одно сложное вещество
В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы:
1. Получение оксида серы (IV):
S + O 2 = SO — из двух простых веществ образуется одно сложное.
2. Получение оксида серы (VI):
SO 2 + 0 2 → 2SO 3 — из простого и сложного веществ образуется одно сложное.
3. Получение серной кислоты:
SO 3 + Н 2 O = Н 2 SO 4 — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
4NО 2 + O 2 + 2Н 2 O = 4НNO 3
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1. Реакция гидрирования — присоединения водорода:
CH 2 =CH 2 + Н 2 → Н 3 -СН 3
этен → этан
2. Реакция гидратации — присоединения воды.
3. Реакция полимеризации.
2. Реакции разложения
— это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами:
1. Разложение оксида ртути(II) — из одного сложного вещества образуются два простых.
2. Разложение нитрата калия — из одного сложного вещества образуются одно простое и одно сложное.
3. Разложение перманганата калия — из одного сложного вещества образуются два сложных и одно простое, то есть три новых вещества.
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности:
1. Реакция дегидратации (отщепления воды) этанола:
С 2 H 5 OH → CH 2 =CH 2 + H 2 O
2. Реакция дегидрирования (отщепление водорода) этана:
CH 3 -CH 3 → CH 2 =CH 2 + H 2
или СН 3 -СН 3 → 2С + ЗН 2
3. Реакция крекинга (расщепления) пропана:
CH 3 -СН 2 -СН 3 → СН 2 =СН 2 + СН 4
3. Реакции замещения
— это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1. Взаимодействие щелочных или щелочноземельных металлов с водой:
2Na + 2Н 2 O = 2NаОН + Н 2
2. Взаимодействие металлов с кислотами в растворе:
Zn + 2НСl = ZnСl 2 + Н 2
3. Взаимодействие металлов с солями в растворе:
Fе + СuSO 4 = FеSO 4 + Сu
4. Металлотермия:
2Аl + Сr 2 O 3 → Аl 2 O 3 + 2Сr
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена. Другой пример — бромирование ароматического соединения (бензола, толуола, анилина).
С 6 Н 6 + Вr 2 → С 6 Н 5 Вr + НВr
бензол → бромбензол
Обратим внимание на особенность реакции замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещество, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола. Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена
— это такие реакции, при которых два сложных вещества обмениваются своими составными частями
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н 2 O).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1. Реакция нейтрализации, идущая с образованием соли и воды.
2. Реакция между щелочью и солью, идущая с образованием газа.
3. Реакция между щелочью и солью, идущая с образованием осадка:
СuSO 4 + 2КОН = Сu(ОН) 2 + К 2 SO 4
или в ионном виде:
Сu 2+ + 2OН — = Сu(ОН) 2
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1. Реакция, идущая с образованием слабого электролита — Н 2 O:
СН 3 СООН + NаОН → Nа(СН3СОО) + Н 2 O
2. Реакция, идущая с образованием газа:
2СН 3 СООН + СаСO 3 → 2СН 3 СОО + Са 2+ + СO 2 + Н 2 O
3. Реакция, идущая с образованием осадка:
2СН 3 СООН + К 2 SO 3 → 2К(СН 3 СОО) + Н 2 SO 3
2СН 3 СООН +SiO → 2СН 3 СОО + Н 2 SiO 3
По этому признаку различают следующие реакции:
1. Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1. Mg 0 + H + 2 SO 4 = Mg +2 SO 4 + H 2
2. 2Mg 0 + O 0 2 = Mg +2 O -2
Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса.
2KMn +7 O 4 + 16HCl — = 2KCl — + 2Mn +2 Cl — 2 + 5Cl 0 2 + 8H 2 O
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов.
1. Они восстанавливаются в соответствующие спирты:
Альдекиды окисляются в соответствующие кислоты:
2. Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, многие реакции разложения, реакции этерификации:
НСООН + CHgOH = НСООСН 3 + H 2 O
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1. Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота(II) из азота и кислорода и реакция газообразного водорода с твердым иодом.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения. Гидрирование этилена — пример экзотермической реакции. Она идет при комнатной температуре.
2. Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
1. Обжиг известняка
2. Крекинг бутана
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением:
Н 2(г) + С 12(г) = 2НС 1(г) + 92,3 кДж
N 2(г) + O 2(г) = 2NO(г) — 90,4 кДж
По агрегатному состоянию реагирующих веществ различают:
1. Гетерогенные реакции
— реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах).
2. Гомогенные реакции
— реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе).
По участию катализатора различают:
1. Некаталитические реакции, идущие без участия катализатора.
2. Каталитические реакции, идущие с участием катализатора. Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным. Следует отметить, что более 70% химических производств используют катализаторы.
По направлению различают:
1. Необратимые реакции протекают в данных условиях только в одном направлении. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
2. Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия — антонимы процессов:
Гидрирование — дегидрирование,
Гидратация — дегидратация,
Полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма — обмена веществ.
1. Радикальные реакции идут между образующимися в ходе реакции радикалами и молекулами.
Как вы уже знаете, при всех реакциях происходит разрыв старых и образование новых химических связей. Способ разрыва связи в молекулах исходного вещества определяет механизм (путь) реакции. Если вещество образовано за счет ковалентной связи, то могут быть два способа разрыва этой связи: гемолитический и гетеролитический. Например, для молекул Сl 2 , СН 4 и т. д. реализуется гемолитический разрыв связей, он приведет к образованию частиц с неспаренными электронами, то есть свободных радикалов.
Радикалы чаще всего образуются, когда разрываются связи, при которых общие электронные пары распределены между атомами примерно одинаково (неполярная ковалентная связь), однако многие полярные связи также могут разрываться подобным же образом, в частности тогда, когда реакция проходит в газовой фазе и под действием света, как, например, в случае рассмотренных выше процессов — взаимодействия С 12 и СН 4 — . Радикалы очень реакционноспособны, так как стремятся завершить свой электронный слой, забрав электрон у другого атома или молекулы. Например, когда радикал хлора сталкивается с молекулой водорода, то он вызывает разрыв общей электронной пары, связывающей атомы водорода, и образует ковалентную связь с одним из атомов водорода. Второй атом водорода, став радикалом, образует общую электронную пару с неспаренным электроном атома хлора из разрушающейся молекулы Сl 2 , в результате чего возникает радикал хлора, который атакует новую молекулу водорода и т. д
Реакции, представляющие собой цепь последовательных превращений, называют цепными реакциями.
За разработку теории цепных реакций два выдающихся химика — наш соотечественник Н. Н. Семенов и англичанин С. А. Хиншелвуд были удостоены Нобелевской премии.
Аналогично протекает и реакция замещения между хлором и метаном:
По радикальному механизму протекают большинство реакций горения органических и неорганических веществ, синтез воды, аммиака, полимеризация этилена, винилхлорида и др.
Типичные ионные реакции — это взаимодействие между электролитами в растворе. Ионы образуются не только при диссоциации электролитов в растворах, но и под действием электрических разрядов, нагревания или излучений. γ-Лучи, например, превращают молекулы воды и метана в молекулярные ионы.
По другому ионному механизму происходят реакции присоединения к алкенам галогеноводородов, водорода, галогенов, окисление и дегидратация спиртов, замещение спиртового гидроксила на галоген; реакции, характеризующие свойства альдегидов и кислот. Ионы в этом случае образуются при гетеролитическом разрыве ковалентных полярных связей.
инициирующей реакцию, различают:
1. Фотохимические реакции. Их инициирует световая энергия. Кроме рассмотренных выше фотохимических процессов синтеза НСl или реакции метана с хлором, к ним можно отнести получение озона в тропосфере как вторичного загрязнителя атмосферы. В роли первичного в этом случае выступает оксид азота(IV), который под действием света образует радикалы кислорода. Эти радикалы взаимодействуют с молекулами кислорода, в результате чего получается озон.
Образование озона идет все время, пока достаточно света, так как NO может взаимодействовать с молекулами кислорода с образованием того же NO 2 . Накопление озона и других вторичных загрязнителей атмосферы может привести к появлению фотохимического смога.
К этому виду реакций принадлежит и важнейший процесс, протекающий в растительных клетках, — фотосинтез, название которого говорит само за себя.
2. Радиационные реакции.
Они инициируются излучениями большой энергии — рентгеновскими лучами, ядерными излучениями (γ-лучами, а-частицами — Не 2+ и др.). С помощью радиационных реакций проводят очень быструю радиополимеризацию, радиолиз (радиационное разложение) и т. д.
Например, вместо двухстадийного получения фенола из бензола его можно получать взаимодействием бензола с водой под действием радиационных излучений. При этом из молекул воды образуются радикалы [ OН] и [ H ], с которыми и реагирует бензол с образованием фенола:
С 6 Н 6 + 2[ОН] → С 6 Н 5 ОН + Н 2 O
Вулканизация каучука может быть проведена без серы с использованием радиовулканизации, и полученная резина будет ничуть не хуже традиционной.
3. Электрохимические реакции. Их инициирует электрический ток. Помимо хорошо известных вам реакций электролиза укажем также реакции электросинтеза, например, реакции промышленного получения неорганических окислителей
4. Термохимические реакции. Их инициирует тепловая энергия. К ним относятся все эндотермические реакции и множество экзотермических реакций, для начала которых необходима первоначальная подача теплоты, то есть инициирование процесса.
Рассмотренная выше классификация химических реакций отражена на схеме.
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам. Например, составим характеристику процесса синтеза аммиака.
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гетерогенная (точнее, гетерогенно-каталитическая), протекающая с уменьшением давления в системе. Для успешного управления процессом необходимо учитывать все приведенные сведения. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки.
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Химические реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы химических реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Химическая реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа — Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Химическая реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Химическая реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Fe+CuSO 4 → FeSO 4 +Cu
Химическая реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
NaOH+HCl→ NaCl+Н 2 О
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки химических реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и ).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак химической реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость химической реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие химической реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения химических реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Химические реакции, видео
И в завершение интересно видео про самые удивительные химические реакции.
Примеры химических реакций соединения и разложения. Вопросы и задания
Часть I
1. Реакции соединения – это
«химический антоним» реакции разложения.
2. Запишите признаки реакции соединения:
— в реакции участвуют 2 простых или сложных вещества;
— образуется одно сложное;
— выделяется тепло.
3. На основании выделенных признаков дайте определение реакций соединения.
Реакции соединения – это реакции, в результате которых образуется из одного или нескольких простых или сложных веществ одно сложное.
По направлению протекания реакции делят на:
Часть II
1. Запишите уравнения химических реакций:
2. Напишите уравнения химических реакций между хлором:
1) и натрием 2Na+Cl2=2NaCl
2) и кальцием Ca+Cl2=CaCl2
3) и железом с образованием хлорида железа (III) 2Fe+3Cl2=2FeCl3
3. Дайте характеристику реакции
4. Дайте характеристику реакции
5. Запишите уравнения реакций соединения, протекающих согласно схемам:
6. Расставьте коэффициенты в уравнениях реакций, схемы которых:
7. Верны ли следующие суждения?
А. Большинство реакций соединения являются экзотермическими.
Б. При повышении температуры скорость химической реакции увеличивается.
1) оба суждения верны
8. Рассчитайте объём водорода и массу серы, которые необходимы для образования 85 г сероводорода.
Виды реакций
:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения
, реакции разложения
, реакции замещения
и реакции обмена
.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером химической реакции соединения
может служить нагревание порошков железа и серы, — при этом образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода,…) на воздухе. Например, углерод горит на воздухе С+О 2 =СО 2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции горения всегда сопровождаются выделением тепла — являются экзотермическими.
Химические реакции разложения
, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО 3 → СаО+СО 2 . Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное -то эта химическая реакция называется химической реакцией замещения
: Например опустив стальной гвоздь в раствор медного купороса получаем железный купорос (здесь железо вытеснило медь из её соли) Fe+CuSO 4 → FeSO 4 +Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена
. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н 2 О.
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций
и их механизмы приведены в таблице:
химические реакции соединения Пример: Из нескольких простых или сложных веществ образуется одно сложное | химические реакции разложения Пример: Из сложного вещества образуется несколько простых или сложных веществ | химические реакции замещения Пример: Атом простого вещества замещает один из атомов сложного | химические реакции ионного обмена Пример: Сложные вещества обмениваются своими составными частями |
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции
, например:
2KMnO 4 +10NaI+8H 2 SO 4 → 2MnSO 4 +K 2 SO 4 +5Na 2 SO 4 +5I 2 +8H 2 O.
Признаки химических реакций
Признаки химических реакций
. По ним можно судить, прошла ли химическая реакция между реагентами или нет. К таким признакам принято относить следующие:
Изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа — химическая реакция взаимодействия железа с кислородом).
— Выпадение осадка (например, если через известковый раствор (раствор гидроксида кальция) пропустить углекислый газ, выпадет белый нерастворимый осадок карбоната кальция).
— Выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ).
— Образование слабодиссоциированных веществ (например, реакции, при которых одним из продуктов реакции является вода).
— Свечение раствора.
Примером свечения раствора может служить реакция с использованием такого реагента как раствор люминола (люминол- это сложное химическое вещество, которое может излучать свет при химических реакциях).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
— составляют особый класс химических реакций. Их характерной особенностью является изменение степени окисления, по крайней мере, пары атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Сложные вещества , понижающие свою степень окисления — окислители
, а повышающие степень окисления — восстановители
. Например:
2Na + Cl 2 → 2NaCl,
— здесь окислитель — хлор (он присоединяет к себе электроны), а восстановитель — натрий (он отдаёт электроны).
Реакция замещения NaBr -1 + Cl 2 0 → 2NaCl -1 + Br 2 0 (характерна для галогенов) тоже относится к окислительно -восстановительным реакциям. Здесь хлор — окислитель (принимает 1 электрон), а бромид натрия (NaBr) — восстановитель (атом брома отдаёт электрон).
Реакция разложения дихромата аммония ((NH 4) 2 Cr 2 O 7) тоже относится к окислительно-восстановительным реакциям:
(N -3 H 4) 2 Cr 2 +6 O 7 → N 2 0 + Cr 2 +3 O 3 + 4H 2 O
Ещё одна из распространённых классификаций химических реакций — это их разделение по тепловому эффекту.
Разделяют эндотермические реакции и экзотермические реакции .
Эндотермические реакции — химические реакции, сопровождающиеся поглощением окружающего тепла (вспомните охлаждающие смеси). Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Опасные химические реакции
:»БОМБА В РАКОВИНЕ»- забавно или не очень?!
Существуют некоторые химические реакции, которые протекают спонтанно при смешивании реагентов. При этом образуются достаточно опасные смеси, которые могут взрываться, воспламеняться или отравлять. Вот одна и них!
В некоторых американских и английских клиниках наблюдались странные явления. Время от времени из раковин раздавались звуки, напоминающие пистолетные выстрелы, а в одном случае неожиданно взорвалась сливная трубка. К счастью, никто не пострадал. Расследование показало, что виновником всего этого был очень слабый (0,01%) раствор азида натрия NaN 3 , который использовали в качестве консерванта физиологических растворов.
Излишки раствора азида в течение многих месяцев, а то и лет сливали в раковины — иногда до 2 л в день.
Сам по себе азид натрия — соль азидоводородной кислоты HN 3 — не взрывается. Однако азиды тяжёлых металлов (меди, серебра, ртути, свинца и др.) — весьма неустойчивые кристаллические соединения, которые взрываются при трении, ударе, нагревании, действии света. Взрыв может произойти даже под слоем воды! Азид свинца Pb(N 3) 2 используется как инициирующее взрывчатое вещество, с помощью которого подрывают основную массу взрывчатки. Для этого достаточно всего двух десятков миллиграммов Pb(N 3) 2 . Это соединение более взрывчато, чем нитроглицерин, а скорость детонации (распространения взрывной волны) при взрыве достигает 45 км/с — в 10 раз больше, чем у тротила.
Но откуда в клиниках могли взяться азиды тяжёлых металлов? Оказалось, во всех случаях сливные трубки под раковинами были изготовлены из меди или латуни (такие трубки легко гнутся, особенно после нагревания, поэтому их удобно устанавливать в сливной системе). Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Медиков не очень интересовала сущность химических реакций, приводящих к образованию взрывчатки. В химической литературе также не удалось найти описания этого процесса. Но можно предположить, исходя из сильных окислительных свойств HN 3 , что имела место такая реакция: анион N-3, окисляя медь, образовал одну молекулу N2 и атом азота, который вошёл в состав аммиака. Это соответствует уравнению реакции: 3NaN 3 +Cu+3Н 2 О→ Cu(N 3) 2 +3NaOH+N 2 +NH 3 .
С опасностью образования бомбы в раковине приходится считаться всем, кто имеет дело с растворимыми азидами металлов, в том числе и химикам, поскольку азиды используются для получения особо чистого азота, в органическом синтезе, в качестве порообразователя (вспенивающего агента для производства газонаполненных материалов: пенопластов, пористой резины и т. п.). Во всех подобных случаях надо проследить, чтобы сливные трубки были пластмассовыми.
Сравнительно недавно азиды нашли новое применение в автомобилестроении. В 1989 г. в некоторых моделях американских автомобилей появились надувные подушки безопасности. Такая подушка, содержащая азид натрия, в сложенном виде почти незаметна. При лобовом столкновении электрический запал приводит к очень быстрому разложению азида: 2NaN 3 =2Na+3N 2 . 100 г порошка выделяют около 60 л азота, который примерно за 0,04 с надувает подушку перед грудью водителя, спасая тем самым ему жизнь.
При
реакциях соединения из нескольких
реагирующих веществ относительно
простого состава получается одно
вещество более сложного состава:
Как
правило, эти реакции сопровождаются
выделением тепла, т.е. приводят к
образованию более устойчивых и менее
богатых энергией соединений.
Реакции
соединения простых веществ всегда
носят окислительно-восстановительный
характер. Реакции соединения, протекающие
между сложными веществами, могут
происходить как без изменения валентности:
СаСО 3 +
СО 2 +
Н 2 О
= Са(НСО 3) 2 ,
так
и относиться к числу
окислительно-восстановительных:
2FеСl 2 +
Сl 2 =
2FеСl 3 .
2. Реакции разложения
Реакции
разложения приводят к образованию
нескольких соединений из одного сложного
вещества:
А
= В + С + D.
Продуктами
разложения сложного вещества могут
быть как простые, так и сложные вещества.
Из
реакций разложения, протекающих без
изменения валентных состояний, следует
отметить разложение кристаллогидратов,
оснований, кислот и солей кислородсодержащих
кислот:
2H 2 O |
2AgNO 3 =
2Ag + 2NO 2 +
O 2 ,
(NH 4)2Cr 2 O 7 =
Cr 2 O 3 +
N 2 +
4H 2 O.
Особенно
характерны окислительно-восстановительные
реакции разложения для солей азотной
кислоты.
Реакции
разложения в органической химии носят
название крекинга:
С 18 H 38 =
С 9 H 18 +
С 9 H 20 ,
или дегидрирования
C 4 H 10 =
C 4 H 6 +
2H 2 .
3. Реакции замещения
При
реакциях замещения обычно простое
вещество взаимодействует со сложным,
образуя другое простое вещество и
другое сложное:
А
+ ВС = АВ + С.
Эти
реакции в подавляющем большинстве
принадлежат к окислительно-восстановительным:
2Аl
+ Fe 2 O 3 =
2Fе + Аl 2 О 3 ,
Zn
+ 2НСl = ZnСl 2 +
Н 2 ,
2КВr
+ Сl 2 =
2КСl + Вr 2 ,
2КСlO 3 +
l 2 =
2KlO 3 +
Сl 2 .
Примеры
реакций замещения, не сопровождающихся
изменением валентных состояний атомов,
крайне немногочисленны. Следует отметить
реакцию двуокиси кремния с солями
кислородсодержащих кислот, которым
отвечают газообразные или летучие
ангидриды:
СаСО 3 +
SiO 2 =
СаSiO 3 +
СО 2 ,
Са 3 (РО 4) 2 +
ЗSiO 2 =
ЗСаSiO 3 +
Р 2 О 5 ,
Иногда
эти реакции рассматривают как реакции
обмена:
СН 4 +
Сl 2 =
СН 3 Сl
+ НСl.
4. Реакции обмена
Реакциями
обмена называют реакции между двумя
соединениями, которые обмениваются
между собой своими составными частями:
АВ
+ СD = АD + СВ.
Если
при реакциях замещения протекают
окислительно-восстановительные
процессы, то реакции обмена всегда
происходят без изменения валентного
состояния атомов. Это наиболее
распространенная группа реакций между
сложными веществами — оксидами,
основаниями, кислотами и солями:
ZnO
+ Н 2 SО 4 =
ZnSО 4 +
Н 2 О,
AgNО 3 +
КВr = АgВr + КNО 3 ,
СrСl 3 +
ЗNаОН = Сr(ОН) 3 +
ЗNаСl.
Частный
случай этих реакций обмена — реакции
нейтрализации:
НСl
+ КОН = КСl + Н 2 О.
Обычно
эти реакции подчиняются законам
химического равновесия и протекают в
том направлении, где хотя бы одно из
веществ удаляется из сферы реакции в
виде газообразного, летучего вещества,
осадка или малодиссоциирующего (для
растворов) соединения:
NаНСО 3 +
НСl = NаСl + Н 2 О
+ СО 2 ,
Са(НСО 3) 2 +
Са(ОН) 2 =
2СаСО 3 ↓
+ 2Н 2 О,
СН 3 СООNа
+ Н 3 РО 4 =
СН 3 СООН
+ NаН 2 РО 4 .
Реакции соединения (образование одного сложного вещества из нескольких простых или сложных веществ) А + В = АВ
Реакции разложения (разложение одного сложного вещества на несколько простых или сложных веществ) АВ = А + В
Реакции замещения (между простыми и сложными веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе) : АВ + С = АС + В
Реакции обмена (между двумя сложными веществами, в которых вещества обмениваются своими составными частями) АВ + СД = АД + СВ
1. Укажите правильное определение реакции соединения:
А. Реакция образования нескольких веществ из одного простого вещества;
Б. Реакция, в которой из нескольких простых или сложных веществ, образуется одно сложное вещество.
В. Реакция, в которой вещества обмениваются своими составными частями.
2. Укажите правильное определение реакции замещения:
А. Реакция между основанием и кислотой;
Б. Реакция взаимодействия двух простых веществ;
В. Реакция между веществами, в которой атомы простого вещества замещают атомы одного из элементов в сложном веществе.
3. Укажите правильное определение реакции разложения:
А. Реакция, при которой из одного сложного вещества образуется несколько простых или сложных веществ;
Б. Реакция, в которой вещества обмениваются своими составными частями;
В. Реакция с образованием молекул кислорода и водорода.
4. Укажите признаки протекания реакции обмена:
А. Образование воды;
Б. Только образование газа;
В. Только выпадение осадка;
Г. Выпадение осадка, образование газа или образование слабого электролита.
5. К какому типу реакций относится взаимодействие кислотных оксидов с основными оксидами:
А. Реакция обмена;
Б. Реакция соединения;
В. Реакция разложения;
Г. Реакция замещения.
6. К какому типу реакций относится взаимодействие солей с кислотами или с основаниями:
А. Реакции замещения;
Б. Реакции разложения;
В. Реакции обмена;
Г. Реакции соединения.
7.
Вещества, формулы которых KNO3 FeCl2, Na2SO4, называют:А) солями; Б) основаниями; В) кислотами; Г) оксидами.
8
. Вещества, формулы которых HNO3, HCl, h3SO4, называют:9
. Вещества, формулы которых KOH, Fe(OH)2, NaOH, называют:А) солями; Б) кислотами; В) основаниями; Г) оксидами.
10
. Вещества, формулы которых NO2, Fe2O3, Na2O, называют:А) солями; Б) кислотами; В) основаниями; Г) оксидами.
11
. Укажите металлы, образующие щелочи:Cu, Fe, Na, K, Zn, Li.
Ответы:
Открытый урок химии в 8 классе на тему «Типы химических реакций» | Официальный сайт МОУ СОШ №7 г. Коряжмы
Автор: Нагишева Ольга Викторовна, учитель химии МОУ «СОШ №7».
Цели урока:
деятельностная: сформировать познавательные универсальные учебные действия при изучении типов химических реакций.
предметно-дидактическая: сформировать понятия: реакции соединения, реакции разложения, реакции замещения, реакции обмена; сформировать знание о признаках химических реакций, научить определять тип реакции по числу и составу продуктов и реагентов реакции.
Планируемые образовательные результаты урока
личностные: убеждаются в познаваемости мира.
метапредметные:
регулятивные: умение планировать и регулировать свою деятельность, владение основами самоконтроля и самооценки;
коммуникативные: готовность получать необходимую информацию, продуктивно взаимодействовать со своими партнерами и учителем;
познавательные: умение определять понятия, устанавливать аналогии, строить логические рассуждения и делать выводы, производить поиск информации, анализировать и оценивать её достоверность.
предметные: знать определения «типы химических реакций», «признаки классификации реакций», «реакции соединения, разложения, замещения, обмена», «закон сохранения массы веществ».
Тип урока:
1. По ведущей дидактической цели: урок изучения нового материала, последовательного изучения ключевых вопросов темы.
- По способу организации: синтетический урок
- По ведущему методу обучения: проблемный урок
Метод обучения: самостоятельная работа, работа с карточками, взаимоконтроль
Основные вопросы урока:
- Типы химических реакций по числу и составу продуктов и реагентов
- Реакции соединения.
- Реакции разложения.
- Реакции замещения.
- Реакции обмена.
Оборудование: учебник, карточки, презентация
Ход урока:
Организационный момент
— Добрый день! Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
— Сегодня мы продолжим знакомство с этим удивительным и волшебным миром.
-О чем же пойдет речь на сегодняшнем уроке?
-Чтобы ответить на этот вопрос, попробуйте отгадать загадку: » Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
Актуализация
На доске корзина “Химические реакции”
— Ребята, чтобы отправиться дальше в страну знаний, нам с вами необходимо взять с собой багаж. На доске перед вами корзина «Химические реакции». Она пуста. Давайте заполним ее.
-Что мы знаем о химических реакциях? (говорят мнения, учитель прикрепляет над корзиной таблички с вариантами ответов:
— Итак, что такое химические реакции — это превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
— Как мы можем отразить химическую реакцию на письме? (с помощью химического уравнения)
— А что такое химическое уравнение? В чем отличие от реакции? (запись химической реакции с помощью формул и математических знаков)
— Какой закон мы используем при составлении химического уравнения? (закон сохранения массы веществ)
— Сформулируйте этот закон (Масса веществ вступивших в химическую реакцию равна массе веществ, образовавшихся в результате ее)
— Кто открыл закон сохранения массы веществ? (М.В.Ломоносов в 1748г)
— Как закон сохранения массы отображается в уравнении? (уравниваем с помощью коэффициентов)
— Скажите, какими признаками сопровождаются химические реакции? (образование осадка или газа, изменение цвета, выделение или поглощение теплоты, появление запаха)
— Ребята, мы с вами разобрали понятие химические реакции.
— Сегодня, по мере выполнения заданий, баллы за правильные ответы вы заносите в оценочные листы . В конце урока, мы подсчитаем сумму баллов, и вы получите отметки за работу на уроке. Напишите фамилию и имя на листах.
Работа у доски
На доске написаны реакции. Учитель вызывает к доске 2 учащихся и предлагает выполнить задание.
— Вспомним, как реализуется закон сохранения массы веществ в химических реакциях.
Задание. Расставить коэффициенты и объяснить.
- Al + CuCl2 → AlCl3 + Cu
- N2 + O2 → NO
- P + O2 → P2O5
- NaOH + H3PO4 → Na3PO4 + H2O
- H2O → H2 + O2
- Al2O3 + HCl→ AlCl3 + H2O
- KOH +H2SO4 → K2SO4 + H2O
- Al + O2 → Al2O3
2 ученика работают у доски, уравнивая по 4 реакции
— Остальным учащимся предлагаю выполнить задание на карточке №1, ответив вопрос:
Карточка №1
Выполняется ли закон сохранения массы в следующих схемах химических реакций? (Нужно ответить ДА или НЕТ)
|
Схемы химических реакций
|
Да/Нет
|
|
1. Ca + Cl2→ CaCl2
| |
|
2. 2C + O2 → 2CO
| |
|
3. Fe(OH)2 → FeO + H2O
| |
|
4. CaCO3 → CaO + CO2
| |
|
5. 2Zn + HCl → ZnCl2 + H2
| |
|
6. Fe + CuCl2 → Cu + FeCl2
| |
|
7. АgNO3 + NaCl → AgCl + NaNO3
| |
|
8. Na2SO4 + BaCl2 → NaCl + BaSO4
|
Учитель проверяет выполненные задания. Ответы на карточку №1 написаны на слайде.
Учащиеся сверяют свои ответы с эталоном (ответы «да» или «нет»)
— У всех совпало с ответом?
— Почему в некоторых уравнениях закон не сохраняется? (учитель выводит на экран схемы с коэффициентами, учащиеся определяют ошибки)
— Посчитайте количество правильных ответов и занесите в лист. 1 уравнение – 1 балл (максимально – 4 баллов)
— Посмотрите, пожалуйста, на уравнения реакций на доске. Найдите ошибки, если есть.
Изучение нового материала
Учитель предлагает решить проблему: почему в срезанных вечером зеленных культурах (салат, петрушка, укроп и др.) содержится больше питательных веществ, чем в срезанных их в утреннее время? (Зная условия протекания реакций фотосинтеза. Можно утверждать, что к вечеру происходит максимальное накопление углеводов в листьях, а к утру они частично расходуются на процесс дыхания. Вечерняя зелень полезнее утренней.)
— В природе существует огромное число реакций. Как же удержать в памяти всё это многообразие и ориентироваться в нем?
Учитель напоминает учащимся о многообразии живых организмов, о разнообразии видов растений и животных
Вопрос классу: как поступали ученые — биологи в подобном случае? (Ученики вместе с учителем вспоминают основы классификации и систематики видов животных и растений. Приводят примеры.)
ΙΙ. – Итак, в любой науке применяется метод классификации, позволяющей по общим признакам разделить всё множество объектов на группы. (Учащиеся вспоминают, что им известно о классификации простых веществ по свойствам на металлы и неметаллы)
- 1. Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций)
- 2. Что такое классификация? (Деление на группы)
- 3. Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Учитель. Используя эти знания, мы сегодня продолжим изучать химические реакции и познакомимся с типами химических реакций и их классификацией.
Запишите тему урока в тетрадь (открывается тема урока)
(учащиеся записывают это в тетрадях.)
На экране появляется, на котором представлены несколько химических реакций:
2H2 + O2 -> 2H2O; CaO + H2O -> Ca(OH)2 Cu(OH)2 -> CuO + H2O; 2HgO -> 2Hg + O2
— можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
— различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
Введение понятия реакции соединения.
Обсуждаются вопросы:
— что объединяет все эти реакции? — в чём их отличие?
— как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом — сложные вещества. Во всех реакциях образуется одно сложное вещество.
Учитель предлагает учащимся попытаться вывести определение этого типа реакций (наиболее подготовленные учащиеся делают это легко) и, используя буквы А, В, С, вывести уравнение реакции соединения в общем виде:
A + B -> AB AB + CB -> AB2C
Введение понятий реакции разложения, замещения, обмена.
По такой же схеме, как и реакции соединения, изучаются реакции разложения, замещения, обмена.
После изучения всех типов реакций проводится обобщение материала. Итак, мы узнали, как классифицируют химические реакции.
соединения разложения замещения обмена
— А сейчас откройте учебник на стр.41. (Схема «Типы химических реакций»). Посмотрите, пожалуйста, на схему. В ней описаны типы химических реакций, написаны примеры уравнений каждого типа. На протяжении урока вы будете работать с этой таблицей.
Закрепление
1.1.. Работают с уравнениями реакции предложенными учителем( у всех групп одинаковые), каждая группа работает по принципу оформления своих уравнений на листах при помощи картинок или рисунков и записи уравнений, предложенных учителем.
Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы реакций
Карточка №2
|
Тип реакции
|
Уравнение реакции
|
|
а)
|
а) CuCl2 + Zn →
|
|
б)
|
б) Cu(OH)2 →
|
|
в)
|
в) KI + Pb(NO3)2 →
|
|
г)
|
г) Ca + O2 →
|
1.2. Презентация работ учащимися
1.3. Оценивание группами по очереди друг друга.
Раздает и поясняет задания, помогает, группам справиться с работой
Если определили правильно, то ставим себе 8 баллов (4 –за написание 4-х уравнений, 4 –за схемы).
2. Найдите ошибки в предложенных реакциях, укажите их количество и исправьте (работа индивидуальная)
а) H2 + O2 = H2O – реакция соединения
б) 2KCl + AgNO3 = KNO3 + AgCl↓ – реакция обмена
в) Mg(OH)2 + HNO3 = Mg(NO3)2 + 2H2O – реакция обмена
г) Cu + HCl = CuCl2 + H2 – реакция замещения
д) FeCl3 + 3NaOH = Fe(OH)3 +3NaCl – реакция замещения
е) Na2O + H2O = 2NaOH — реакция замещения
— Обменяйтесь карточками, проверьте ответы одноклассников по образцу. Посчитайте баллы 1 уравнение – 1 балл ( всего -6 баллов)
— Занесите баллы в оценочный лист и подсчитайте общую сумму баллов и определите отметки за урок.
Учитель выводит критерии отметок:
18-15 баллов – отметка «5»
14-11 баллов – отметка «4»
10-7 баллов – отметка «3»
— Поднимите руку, у кого «5». А «4» есть?
Подведение итога и рефлексия
Учитель подводит итог урока
— Ребята, как вы думаете, достигли ли мы цели урока?
— Сможете ли вы по числу и составу реагентов и продуктов определить тип химической реакции?
— Сейчас еще раз проверим. О каких реакциях идет речь?
Зачитываются загадки.
Ты было сложным, я простым, мы встретились однажды,
В тебе я атом заместил, мы подружились даже.
И сразу изменился мир: я сложным стал, а ты простым. (замещения)
Нас было много, мы соединились,
В одно большое вместе превратились.
Такое процесс объединения – реакция … (соединения)
Когда два сложных вещества в реакцию вступают,
Меняются фрагментами (себя не обижают),
И происходят с ними тут простые перемены
Такой процесс мы назовем реакцией … (обмена)
Домашнее задание: п.16 –всем,
На оценку «5» — из учебника выписать по 3 примера на каждый тип реакции,
на оценку «4» — из учебника выписать по 2примера на каждый тип реакции,
на оценку «3» — из учебника выписать 1 пример на каждый тип реакции
Перед уходом детей учитель предлагает учащимся проанализировать свое эмоциональное состояние:
— Сдайте, пожалуйста, оценочные листы.
— Спасибо за работу на уроке!
11.5: Реакции разложения — химия LibreTexts
Антуан Лавуазье широко известен как «отец современной химии». Он был одним из первых, кто подробно изучал химические реакции. В рамках своих исследований состава атмосферы Лавуазье вступил в реакцию ртути с кислородом с образованием оксида ртути; Затем он смог показать, что при разложении оксида ртути образуется ртуть и кислород.
Реакции разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества.Общая форма реакции разложения:
\ [\ ce {AB} \ rightarrow \ ce {A} + \ ce {B} \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода.
\ [2 \ ce {HgO} \ left (s \ right) \ rightarrow 2 \ ce {Hg} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \]
Рисунок \ (\ PageIndex {1} \): Оксид ртути (II) представляет собой твердое вещество красного цвета.При нагревании он разлагается на металлическую ртуть и газообразный кислород. (CC BY-NC; CK-12)
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединениями. Карбонат металла разлагается на оксид металла и газообразный диоксид углерода. Например, карбонат кальция разлагается на оксид кальция и диоксид углерода:
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды.Гидроксид натрия разлагается с образованием оксида натрия и воды:
\ [2 \ ce {NaOH} \ left (s \ right) \ rightarrow \ ce {Na_2O} \ left (s \ right) + \ ce {H_2O} \ left (g \ right) \]
Некоторые нестабильные кислоты разлагаются с образованием оксидов неметаллов и воды. Углекислота легко разлагается при комнатной температуре на диоксид углерода и воду:
\ [\ ce {H_2CO_3} \ left (aq \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \]
Пример \ (\ PageIndex {1} \)
Когда электрический ток проходит через чистую воду, она разлагается на элементы.Напишите сбалансированное уравнение разложения воды.
Решение
Шаг 1. Спланируйте проблему .
Вода — это бинарное соединение, состоящее из водорода и кислорода. Газообразные водород и кислород, образующиеся в реакции, представляют собой двухатомные молекулы.
Шаг 2: Решить.
Уравнение скелета (неуравновешенное):
\ [\ ce {H_2O} \ left (l \ right) \ overset {\ text {elec}} {\ rightarrow} \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (g \ справа) \]
Обратите внимание на аббревиатуру «\ (\ text {elec} \)» над стрелкой, чтобы указать прохождение электрического тока для инициирования реакции.Сбалансируйте уравнение.
\ [2 \ ce {H_2O} \ left (l \ right) \ overset {\ text {elec}} {\ rightarrow} 2 \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (г \ вправо) \]
Шаг 3. Подумайте о своем результате.
Продукты являются стихиями и уравнение сбалансировано.
Реакция разложения: определение, примеры и применение
Что такое реакция разложения?
Реакция разложения — это тип химической реакции, при которой соединение распадается на два или более вещества.Это противоположность комбинированной реакции. Иногда сложные химические соединения распадаются на простые части. Исходное вещество называется реагентом, а полученные вещества — продуктами [1-5] .
Общее уравнение
Следующее уравнение представляет собой общую реакцию разложения.
АВ → А + В
При написании реальной реакции реакция должна быть сбалансированной.
Реакция разложения
Что происходит при реакции разложения?
В ходе реакции разложения в исходном веществе разрываются связи между атомами.Затем атомы перестраиваются с образованием новых связей, в результате чего образуются новые вещества со свойствами, отличными от исходного материала.
Характеристики реакции разложения
- Один единственный реагент и два или более продуктов
- Требуется энергия
Примеры реакции разложения
Примером реакции разложения является разложение угольной кислоты (H 2 CO 3 ) до диоксида углерода (CO 2 ) и воды (H 2 O) [2] .
H 2 CO 3 (водн.) → CO 2 (г) + H 2 O (л)
Эта реакция значительна и ответственна за шипение соды. Ниже приведены еще несколько примеров:
Примеры реакций разложения
Как уравновесить реакцию разложения?
Рассмотрим пример разложения хлората калия (KClO 3 ) на хлорид калия (KCl) и кислород (O 2 ).
KClO 3 (т) → KCl (т) + O 2 (г)
Это уравнение несбалансированное.Чтобы сбалансировать уравнение, мы проверяем количество атомов кислорода (O) в правой части уравнения и сравниваем его с левой. Мы замечаем, что есть два атома кислорода справа и три слева. Итак, мы умножаем правый O на 3 и левый O на 2. Обратите внимание, что мы собираемся умножить все соединение KClO 3 на 2 и уравновесить кислород.
2 KClO 3 (т) → KCl (т) + 3 O 2 (г)
Теперь мы замечаем, что калий (K) и хлор (Cl) не сбалансированы.В левой части уравнения находятся два атома K и Cl, а в правой — только по одному атому каждого. Итак, мы умножаем состав KCl на 2 и получаем окончательное уравнение.
2 KClO 3 (т.) → 2 KCl (т.) + 3 O 2 (г)
Типы реакций разложения
Существует три типа реакций разложения [1-3] .
1. Термическое разложение
В этой реакции для разрыва связей соединения требуется энергия в виде тепла.Реакция обычно эндотермическая, т.е. к реакции добавляется тепло.
Правила термического разложения
- Карбонаты разлагаются на диоксид углерода и оксид.
- Хлораты разлагаются на газообразный кислород и хлорид.
- Гидроксиды разлагаются на воду и оксид.
- Кислоты, содержащие кислород, разлагаются на воду и молекулярный оксид.
- Оксиды разлагаются на кислород и другой элемент.
Примеры
- Карбонат кальция (CaCO 3 ) при нагревании разлагается на оксид кальция (CaO) и диоксид углерода (CO 2 ).
CaCO 3 (т) + тепло → CaO (т) + CO 2 (г)
- При высоких температурах карбонат магния (MgCO 3 ) разлагается на оксид магния (MgO) и диоксид углерода (CO 2 ).
CaCO 3 (т) + тепло → CaO (т) + CO 2 (г)
- Термическое разложение фосфорной кислоты (H 3 PO 4 ) дает дифосфорную кислоту (H 4 P 2 O 7 ) и воду (H 2 O).
2 H 3 PO 4 → H 4 P 2 O 7 + H 2 O
(NH 4 ) 2 Cr 2 O 7 (с) + тепло → Cr 2 O 3 (с) + N 2 (г) + 4 H 2 O (г)
2. Электролитическое разложение
В этой реакции разложение происходит при пропускании электрического тока через водный раствор соединения.
Примеры
- Электролиз воды (H 2 O) с образованием газов водорода (H 2 ) и кислорода (O 2 )
2 H 2 O (л) → 2 H 2 (г ) + O 2 (г)
- Электролиз раствора хлорида натрия (NaCl) дает расплавленный газ натрия (Na) и хлора (Cl 2 )
2 NaCl (l) → 2 Na (l) + Cl 2 (g)
3. Фото или фотохимическое разложение
В этой реакции свет (фотоны) используется для разложения соединения.
Примеры
- Хлорид серебра (AgCl) разлагается на серебро (Ag) и хлор (Cl 2 ) в присутствии солнечного света
2 AgCl (s) + солнечный свет → 2 Ag (s) + Cl 2 ( г)
- В присутствии света перекись водорода (H 2 O 2 ) разлагается на воду (H 2 O) и кислород (O 2 ).
2 H 2 O 2 (л) → 2 H 2 O (л) + O 2 (г)
Другой тип реакции разложения
Каталитическое разложение
При этом типе разложения реакция протекает с помощью катализатора.
Пример
- Разложение перекиси водорода (H 2 O 2 ) до воды (H 2 O) и кислорода (O 2 ) катализируется ферментом под названием каталаза [7] .
2 H 2 O 2 (л) + каталаза (фермент) → 2 H 2 O (л) + O 2 (г)
Примеры реакций разложения в реальной жизни
Реакция разложения имеет несколько применений в промышленности и повседневной жизни.
Промышленность
- Производство оксида кальция или негашеной извести
- Производство оксида лития
- Получение кислорода и диоксида углерода
- В металлургии для извлечения металлов из их оксидов и хлоридов путем электролитического разложения
Повседневная жизнь
- Когда бутылка содовой открыта, углекислота распадается с образованием воды и углекислого газа, что вызывает шипение.
- Во время переваривания пищи в нашем организме углеводы, жиры и белки разлагаются с образованием множества более простых веществ.
- Фотографические пленки имеют покрытие из бромида серебра, которое под воздействием света расщепляется на серебро и бром.
- Когда перекись водорода наносится на порез или рану, перекись разлагается и образует пузырьки кислорода и лопается.
- При выпекании торта с разрыхлителем (бикарбонатом натрия) разложение приводит к образованию диоксида углерода и гидроксида натрия.
- В продуктах питания наблюдается много органических разложений, таких как брожение и загрязнение. Гниение пищевых продуктов и кожуры овощей дает прекрасные питательные вещества и удобрение для почвы.
Лаборатория
- В нескольких аналитических методах, таких как масс-спектрометрия, гравиметрический анализ и термогравиметрический анализ
Часто задаваемые вопросы
Q.1. Почему реакции разложения носят преимущественно эндотермический характер?
Отв. Для большинства реакций разложения требуется энергия в виде тепла, света или электричества. Поглощение энергии вызывает разрыв связей, присутствующих в реагирующем веществе, которое разлагается с образованием продукта.
Q.2. Чем реакция сочетания отличается от реакции разложения?
Отв. В реакции сочетания два или более веществ объединяются с образованием единого продукта. Однако в реакции разложения одно вещество распадается с образованием двух или более веществ.Следовательно, эти двое противоположны друг другу. Обычно реакции сочетания в основном экзотермические, а реакции разложения — эндотермические.
Q.3. Разложение — это окислительно-восстановительная реакция?
Отв. Нет. Не все разложения являются окислительно-восстановительными реакциями.
Список литературы
- Amrita.olabs.edu.in
- Chem.libretexts.org
- Opentextbc.ca
- Cpanhd.sitehost.iu.edu
- Chem.wisc.edu
- Angelo.eduYork.ac.uk
Что такое реакция разложения? Определение и примеры
Реакция разложения или реакция анализа происходит, когда один реагент распадается на два или более продуктов.
Реакция разложения — один из четырех основных типов химических реакций. Этот тип реакции также называется реакцией анализа или реакцией разложения. Вот определение реакции разложения, примеры реакции и способы распознавания реакции разложения.
Определение реакции разложения
Реакция разложения — это химическая реакция с одним реагентом, в результате которой образуются два или более продуктов.
Общая форма реакции разложения:
AB → A + B
В результате реакции разложения образуются более мелкие молекулы, часто включающие чистые элементы.
Противоположность реакции разложения
Противоположностью реакции разложения является реакция синтеза, которую также называют реакцией комбинации.В реакции синтеза два или более реагента объединяются, образуя более сложный продукт.
Примеры реакций разложения
Реакции разложения обычны в повседневной жизни. Одним из примеров является электролиз воды с образованием газообразного кислорода и газообразного водорода:
2 H 2 O → 2 H 2 + O 2
Другой пример — разложение пероксида водорода с образованием воды и кислорода:
2 H 2 O 2 → 2 H 2 O + O 2
Газирование безалкогольных напитков происходит в результате разложения.Углекислота распадается на воду и диоксид углерода:
H 2 CO 3 → H 2 O + CO 2
Эндотермический или экзотермический?
Большинство реакций разложения эндотермические. Другими словами, для разрыва химических связей в реагенте требуется больше энергии, чем выделяется, когда образуются новые химические связи для образования продуктов. Эти реакции поглощают энергию из окружающей среды, чтобы продолжаться. Например, разложение оксида ртути (II) на ртуть и кислород (как и разложение большинства оксидов металлов) требует подвода тепла и является эндотермическим:
2HgO → 2Hg + O 2
Однако небольшое разложение реакции экзотермические.Они выделяют больше тепла, чем поглощают. Например, разложение закиси азота на азот и кислород является экзотермическим:
2NO → N 2 + O 2
Как распознать реакцию разложения
Самый простой способ определить реакцию разложения — это поискать реакция, которая начинается с одного реагента и дает несколько продуктов. Кроме того, это помогает распознавать знакомые примеры. Оксиды металлов образуют металлы и кислород, карбонаты обычно дают оксиды и диоксид углерода и так далее.
Типы реакций разложения
Три основных типа реакций разложения — это термическое разложение, электролитическое разложение и фотолитическое разложение.
- Термическое разложение : Тепло активирует реакцию термического разложения. Эти реакции имеют тенденцию быть эндотермическими. Примером является разложение карбоната кальция с образованием оксида кальция и диоксида углерода:
CaCO 3 → CaO + CO 2 - Электролитическое разложение : Электрическая энергия обеспечивает энергию активации для разложения реагента на продукты.Примером является электролиз воды на водород и кислород:
2H 2 O → 2H 2 + O 2 - Фотолитическое разложение : Реагент поглощает энергию света (фотоны) для разрыва химических связей и образования продуктов. Примером может служить разложение озона с образованием кислорода:
O 3 + hν → O 2 + O .
Катализаторы могут способствовать реакциям разложения. Эти реакции называют каталитическим разложением.
Использование реакций разложения
Иногда реакции разложения нежелательны, но они имеют несколько важных применений.
- Для производства негашеной извести (CaO) для цемента и других применений.
- Для сварки термитной реакцией.
- Для извлечения чистых металлов из их руд, оксидов, хлоридов и суфидов.
- Для лечения кислотного расстройства желудка.
- Для получения водорода, который обычно связан в соединениях.
- Для идентификации образца по продуктам его разложения.
Ссылки
- Brown, T.L .; LeMay, H.E .; Берстон, Б. (2017). Химия: Центральная наука (14-е изд.). Пирсон. ISBN 9780134414232.
- McNaught, A .; Уилкинсон, А. (1997). «Химическое разложение». Сборник химической терминологии (2-е изд.) («Золотая книга») ». Научные публикации Блэквелла. doi: 10.1351 / goldbook.C01020
Реакции синтеза и разложения | Протокол
4.13: Реакции синтеза и разложения
Синтез и разложение — это два типа окислительно-восстановительных реакций. Синтез означает что-то создать, а разложение означает что-то сломать. Реакции сопровождаются химическими и энергетическими изменениями.
Реакции синтеза
Реакции синтеза также называют реакциями сочетания. Это реакция, в которой два или более вещества объединяются, образуя сложное вещество. Реакции синтеза обычно представлены как: A + B → AB или A + B → C.Образование диоксида азота представляет собой реакцию синтеза: 2 NO ( г ) + O 2 ( г ) → 2 NO 2 ( г ).
В реакциях синтеза реагентами могут быть все элементы (1), или комбинация элемента и соединения (2), или все соединения (3).
1) C ( с ) + O 2 ( г ) → CO 2 ( г )
2) 2 CO ( г ) + O 2 ( г ) → 2 CO 2 ( г )
3) 2 CaO ( с ) + 2 H 2 O ( л ) → 2 Ca (OH) 2 ( с )
Комбинированная реакция между металлом и неметаллом всегда дает ионное твердое вещество.Например, образование хлорида натрия или поваренной соли из натрия и хлора представляет собой комбинационную реакцию: 2 Na (s) + Cl 2 ( г ) → 2 NaCl ( s ).
Реакция синтеза обычно сопровождается выделением энергии. В приведенном выше примере хлорида натрия выделяется 787 кДж тепловой энергии.
Реакция разложения
Кислород был впервые открыт ученым Джозефом Пристли в 1774 году при нагревании оксида ртути горящим стеклом.Реакция была результатом разложения. Пристли под действием тепла разложил оксид ртути (II) на элементы.
Реакция представлена как: 2 HgO ( с ) → 2 Hg ( л ) + O 2 ( г )
Реакции разложения включают расщепление более сложного вещества на два или более вещества меньшего размера. Эту реакцию часто представляют как: AB → A + B или C → A + B. Реакции разложения происходят повсюду. Например, переваривание белков, жиров и углеводов в нашей пище является важной реакцией разложения.Другой пример — разложение азида натрия до газообразного азота.
Реакция представлена как: 2 NaN 3 ( с ) → 2 Na ( с ) + 3 N 2 ( г )
В приведенной выше реакции, хотя коэффициент 2 указывает на разложение двух молекул азида натрия, присутствует только один реагент. Следовательно, это реакция разложения. Подобно реакции синтеза, в реакции разложения образующиеся продукты могут быть всеми элементами (1), или комбинацией элементов и соединений (2), или всеми соединениями (3).
1) 2 Al 2 O 3 ( с ) → 4 Al ( с ) + 3 O 2 ( г )
2) 2 KClO 3 ( с ) → 2 KCl ( с ) + 3 O 2 ( г )
3) NH 4 Cl ( с ) → NH 3 ( г ) + HCl ( г )
Какие есть примеры реакций разложения?
Реакции разложения — это химические реакции, в которых более сложная молекула распадается на более простые.Есть три типа реакций разложения:
термическое реакции разложения;
Электролитический реакции разложения;
Фото реакции разложения.
Термическое разложение — такие реакции обычно являются эндотермическими, поскольку для разрыва связей более сложной молекулы требуется энергия в виде тепла. Примеры включают
#CaCO_ (3 (s)) + «тепло» -> CaO _ ((s)) + CO_ (2 (g)) # — Карбонат кальция разлагается на оксид кальция и диоксид углерода при нагревании ;
# 2KClO_ (3 (s)) + «тепло» -> 2KCl _ ((s)) + 3O_ (2 (g)) # — Хлорат калия разлагается на хлорид калия и газообразный кислород при эатировании ;
# 2Fe (OH) _3 + «тепло» -> Fe_2O_3 + 3H_2O # — Двуокись железа разлагается на оксид железа и воду при нагревании ;
Электролитическое разложение — такие реакции происходят при пропускании электрического тока через водный раствор соединения.Два классических примера — электролиз воды
.
# 2H_2O _ ((l)) -> 2H_ (2 (g)) + O_ (2 (g)) # — вода разлагается на водород и кислород в присутствии электрического тока ;
и разложение хлорида натрия
# 2NaCl _ ((l)) -> 2Na _ ((l)) + Cl_ (2 (g)) # — расплавленный хлорид натрия разлагается на расплавленный натрий и газообразный хлор ;
Фото разложение — эти реакции происходят в присутствии света (фотонов).Примеры включают
# 2AgCl _ ((s)) + «солнечный свет» -> 2Ag _ ((s)) + Cl_ (2 (g)) # — Хлорид серебра разлагается на серебро и хлор в присутствии солнечного света ;
# 2AgBr _ ((s)) + «солнечный свет» -> 2Ag _ ((s)) + 2Cl_ (2 (g)) # — бромид серебра разлагается на серебро и хлор в присутствии солнечного света ;
Как показывает опыт, большинство реакций разложения являются эндотермическими, поскольку для разрыва связей более сложной молекулы необходимо подавать энергию в виде тепла, электрического тока или солнечного света.
Реакции состава, разложения и горения
Цели обучения
- Распознавать состав, реакции разложения и горения.
- Предсказать продукты реакции горения.
В этом разделе будут рассмотрены три классификации химических реакций. Предсказать продукты в некоторых из них может быть сложно, но реакции все же легко распознать.
Реакция композиции (иногда также называемая реакцией комбинации или реакцией синтеза ) дает одно вещество из нескольких реагентов.Единичное вещество как продукт является ключевой характеристикой реакции композиции. Для вещества может быть коэффициент, отличный от единицы, но если в реакции используется только одно вещество в качестве продукта, ее можно назвать реакцией композиции. В реакции
2 H 2 (г) + O 2 (г) → 2 H 2 O (ℓ)
вода производится из водорода и кислорода. Хотя образуются две молекулы воды, в качестве продукта используется только одно вещество — вода.Итак, это композиционная реакция.
Реакция разложения начинается с одного вещества и дает более одного вещества; то есть разлагается. Одно вещество в качестве реагента и более одного вещества в качестве продуктов являются ключевой характеристикой реакции разложения. Например, при разложении гидрокарбоната натрия (также известного как бикарбонат натрия)
2 NaHCO 3 (с) → Na 2 CO 3 (с) + CO 2 (г) + H 2 O (ℓ)
карбонат натрия, диоксид углерода и вода производятся из одного вещества гидрокарбоната натрия.
Состав и реакции разложения трудно предсказать; однако их должно быть легко распознать.
Пример 9
Обозначьте каждое уравнение как реакцию состава, реакцию разложения или ни то, ни другое.
- Fe 2 O 3 + 3 SO 3 → Fe 2 (SO 4 ) 3
- NaCl + AgNO 3 → AgCl + NaNO 3
- (NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + 4 H 2 O + N 2
Решение
- В этом уравнении два вещества объединяются в одно вещество.Это композиционная реакция.
- Два разных вещества вступают в реакцию с образованием двух новых веществ. Это не соответствует определению ни реакции композиции, ни реакции разложения, поэтому не является ни тем, ни другим. Фактически, вы можете распознать это как реакцию двойной замены.
- Одно вещество реагирует с образованием нескольких веществ. Это реакция разложения.
Проверьте себя
Определите уравнение как реакцию состава, реакцию разложения или ни то, ни другое.
C 3 H 8 → C 3 H 4 + 2 H 2
Ответ
разложение
Реакция горения происходит, когда реагент соединяется с кислородом, многократно из атмосферы, с образованием оксидов всех других элементов в качестве продуктов; любой азот в реагенте превращается в элементарный азот, N 2 . Многие реагенты, называемые топливами , содержат в основном атомы углерода и водорода, которые реагируют с кислородом с образованием CO 2 и H 2 O.Например, сбалансированное химическое уравнение горения метана CH 4 выглядит следующим образом:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
Керосин можно аппроксимировать формулой C 12 H 26 , а уравнение его горения —
2 C 12 H 26 + 37 O 2 → 24 CO 2 + 26 H 2 O
Иногда топливо содержит атомы кислорода, которые необходимо учитывать при балансировании химического уравнения.Одним из распространенных видов топлива является этанол, C 2 H 5 OH, уравнение горения которого составляет
.
C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O
Если в исходном топливе присутствует азот, он преобразуется в N 2 , а не в азотно-кислородное соединение. Таким образом, для сжигания топлива динитроэтилена, формула которого C 2 H 2 N 2 O 4 , имеем
2 C 2 H 2 N 2 O 4 + O 2 → 4 CO 2 + 2 H 2 O + 2 N 2
Пример 10
Заполните и сбалансируйте каждое уравнение горения.
- горение пропана, C 3 H 8
- сжигание аммиака, NH 3
Решение
Продуктами реакции являются CO 2 и H 2 O, поэтому наше несбалансированное уравнение составляет
C 3 H 8 + O 2 → CO 2 + H 2 O
Балансировка (и вам, возможно, придется пройти несколько раз, чтобы сбалансировать это), мы получаем
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
Атомы азота в аммиаке будут реагировать с образованием N 2 , а атомы водорода будут реагировать с O 2 с образованием H 2 O:
NH 3 + O 2 → N 2 + H 2 O
Чтобы сбалансировать это уравнение без дробей (что является условием), мы получаем
4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 O
Проверьте себя
Заполните и сбалансируйте уравнение горения для циклопропанола, C 3 H 6 O.
Ответ
C 3 H 6 O + 4 O 2 → 3 CO 2 + 3 H 2 O
Пропан — это топливо, используемое для обогрева некоторых домов. Пропан хранится в больших резервуарах, подобных показанному здесь.
Источник: «Цветы и пропан» от vistavision под лицензией Creative Commons Attribution-NonCommercial-NoDerivs 2.0 Generic
Основные выводы
- Композиционная реакция дает одно вещество из нескольких реагентов.
- В результате реакции разложения из одного реагента образуется несколько продуктов.
- Реакции горения — это комбинация одного соединения с кислородом с образованием оксидов других элементов в виде продуктов (хотя атомы азота реагируют с образованием N 2 ).
Упражнения
Какая реакция является композиционной, а какая нет?
а) NaCl + AgNO 3 → AgCl + NaNO 3
б) CaO + CO 2 → CaCO 3
2.Что представляет собой композиционная реакция, а какая нет?
а) H 2 + Cl 2 → 2 HCl
б) 2 HBr + Cl 2 → 2 HCl + Br 2
3. Какая реакция является композиционной, а какая нет?
а) 2 SO 2 + O 2 → 2 SO 3
б) 6 C + 3 H 2 → C 6 H 6
4. Какая реакция является композиционной, а какая нет?
а) 4 Na + 2 C + 3 O 2 → 2 Na 2 CO 3
б) Na 2 CO 3 → Na 2 O + CO 2
5.Что такое реакция разложения, а какая нет?
а) HCl + NaOH → NaCl + H 2 O
б) CaCO 3 → CaO + CO 2
6. Что такое реакция разложения, а какая нет?
а) 3 О 2 → 2 О 3
б) 2 KClO 3 → 2 KCl + 3 O 2
7. Что такое реакция разложения, а какая нет?
а) Na 2 O + CO 2 → Na 2 CO 3
б) H 2 SO 3 → H 2 O + SO 2
8.Что такое реакция разложения, а какая нет?
a) 2 C 7 H 5 N 3 O 6 → 3 N 2 + 5 H 2 O + 7 CO + 7 C
б) C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
9. Что такое реакция горения, а какая нет?
a) C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
б) 2 Fe 2 S 3 + 9 O 2 → 2 Fe 2 O 3 + 6 SO 2
10.Что такое реакция горения, а какая нет?
a) CH 4 + 2 F 2 → CF 4 + 2 H 2
б) 2 H 2 + O 2 → 2 H 2 O
11. Что такое реакция горения, а какая нет?
а) P 4 + 5 O 2 → 2-пол. 2 O 5
б) 2 Al 2 S 3 + 9 O 2 → 2 Al 2 O 3 + 6 SO 2
12.Что такое реакция горения, а какая нет?
a) C 2 H 4 + O 2 → C 2 H 4 O 2
б) C 2 H 4 + Класс 2 → C 2 H 4 Класс 2
13. Может ли реакция композиции быть реакцией горения? Приведите пример, подтверждающий вашу позицию.
14. Может ли реакция разложения быть реакцией горения? Приведите пример, подтверждающий вашу позицию.
15. Заполните и сбалансируйте каждое уравнение горения.
а) C 4 H 9 OH + O 2 →?
б) CH 3 NO 2 + O 2 →?
16. Заполните и сбалансируйте каждое уравнение горения.
а) B 2 H 6 + O 2 →? (Образовавшийся оксид бора имеет вид B 2 O 3 .)
б) Al 2 S 3 + O 2 →? (Образовавшийся оксид серы SO 2 .)
c) Al 2 S 3 + O 2 →? (Образовавшийся оксид серы SO 3 .)
ответы
1.
а) не состав
б) состав
3.
а) состав
б) состав
5.
а) без разложения
б) разложение
7.
а) без разложения
б) разложение
9.
а) горение
б) горение
11.
а) горение
б) горение
13.
Да; 2 H 2 + O 2 → 2 H 2 O (ответы могут быть разными)
15.
a) C 4 H 9 OH + 6 O 2 → 4 CO 2 + 5 H 2 O
б) 4 канала 3 NO 2 + 3 O 2 → 4 CO 2 + 6 H 2 O + 2 N 2
Справка по разложению | Учебное пособие по химическим реакциям
Разложение
Простите меня, пока я разлагаюсь
Мы все довольно хорошо понимаем, что такое разложение.Серьезно, сколько сейчас выставок типа CSI или Law and Order ? Они все время говорят о разложении. Реакции разложения происходят именно так, как и следовало ожидать: разложение или разделение химического соединения на элементы или более простые соединения.
Добро пожаловать в противоположный день
Реакции разложения противоположны реакциям синтеза. Наиболее простое представление реакции разложения:
AB → A + B
Во время процесса вещество AB разлагается или распадается с образованием веществ A и B.
В простейшем типе реакции разложения соединение распадается на составляющие его элементы. Простым примером повседневной жизни может служить разложение воды на водород и кислород следующим образом:
2 H 2 O → 2 H 2 + O 2
Когда вы в последний раз наливали себе стакан хороший стакан воды, и он самопроизвольно превратился в водород и кислород? Мы, , надеемся, что никогда не ответят. На самом деле реакции разложения обычно не происходят спонтанно.Обычно им нужна какая-то движущая сила, чтобы это произошло. В случае, когда вода превращается в водород и кислород, движущей силой является энергия в форме электричества. Процесс называется «расщепление воды». Если вы хотите попробовать разделить воду дома, ознакомьтесь с этими инструкциями здесь или вы можете посмотреть видео здесь.
Электролиз воды: форма разложения
Поскольку реакция разложения включает разрыв химических связей, она требует добавления энергии.Мы уже упоминали, что один из способов добавления энергии — это электролиз , который буквально представляет собой добавление электрического тока. Еще один способ добавить энергии — это добавить тепла, и мы не говорим о тепле, которое возникает при поедании призрачного перца.
Отличным примером реакции термического разложения (который представляет собой тип разложения, происходящего с добавлением тепла) является разложение карбоната меди, CuCO 3 . Если пробирку с CuCO 3 нагреть в горелке Бунзена, твердый порошок «прыгает», когда высвобождаются молекулы углекислого газа.Твердое вещество остается в трубке, но теперь оно представляет собой оксид меди CuO. Посмотрите это потрясающее видео.
CuCO 3 + тепло → CuO + CO 2
Для определенного числа химических соединений энергия, необходимая для разложения, довольно мала. В этих случаях для достижения цели достаточно легкого толчка или удара.
