Содержание
Чистые вещества — урок. Химия, 8–9 класс.
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Если же сахар смешать с водой, происходит диффузия — молекулы сахара проникают между молекулами воды. Образуется раствор, в состав которого входят как молекулы воды, так и молекулы сахара.
Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?
Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, образец практически чистой воды бесцветный, без вкуса и запаха, имеет температуру кристаллизации \(0\) °С, температуру кипения \(+100\) °С, плотность при температуре \(+4\) °С равную \(1000\) кг/м³ и не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.
В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
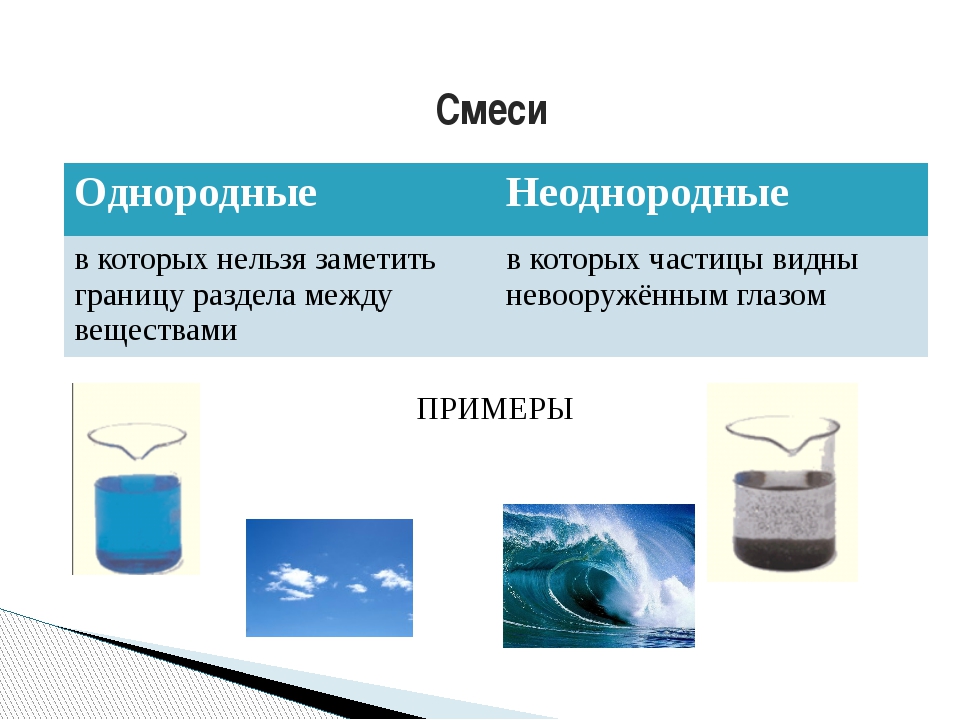
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
Чистые вещества и смеси
Смеси
Смесь — это совокупность из двух или большего числа различных веществ, химически не соединённых между собой. Вещества в смеси могут находиться в любых соотношениях.
Пример. Атмосферный воздух представляет собой смесь газов, состоящую из кислорода, азота и других газов.
Вещества, которые входят в состав смеси, называются компонентами смеси.
Смеси делятся на однородные (гомогенные) и неоднородные (гетерогенные).
Однородные (гомогенные) смеси — это смеси, в которых невооружённым глазом или даже с помощью микроскопа нельзя обнаружить компоненты, входящие в состав смеси.
Пример. Вода с растворённым в ней сахаром, воздух, большинство металлических сплавов — однородные смеси.
Однородные смеси иначе ещё называются растворами. Раствор — это однородная смесь, которая состоит из растворённого вещества и растворителя.
Раствор — это однородная смесь, которая состоит из растворённого вещества и растворителя.
Физические свойства однородных смесей могут отличаться от свойств их компонентов.
Пример. Вода закипает при температуре 100 °C, а водный раствор соли — при более высокой температуре. Сплав олова со свинцом, используемый для паяния, плавится при более низкой температуре, чем чистые металлы.
Неоднородные (гетерогенные) смеси — это смеси, в которых невооружённым глазом или при помощи микроскопа можно увидеть компоненты, входящие в состав смеси.
Пример. Вода с песком, живые ткани, мутная вода, молоко — неоднородные смеси.
В неоднородных смесях физические свойства компонентов сохраняются.
Пример. Вода с песком закипает при температуре 100 °C.
Неоднородные смеси иначе ещё называются механическими смесями.
По агрегатному состоянию смеси можно разделить на три группы:
- газообразные (атмосферный воздух, природный и бытовой газы)
- жидкие (природная вода, молоко, нефть)
- твёрдые (природные минералы, горные породы)
Чистые вещества
Чистое вещество — это вещество, состоящее из частиц только одного вещества. Абсолютно чистые вещества получить невозможно, поэтому чистыми веществами условились называть такие вещества, в которых почти нет примесей. Примесь — это вещество, содержащееся в основном веществе в очень малом количестве.
Чистые вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного химического элемента.
Пример. Кислород (O2), аргон (Ar), азот (N2) — простые вещества.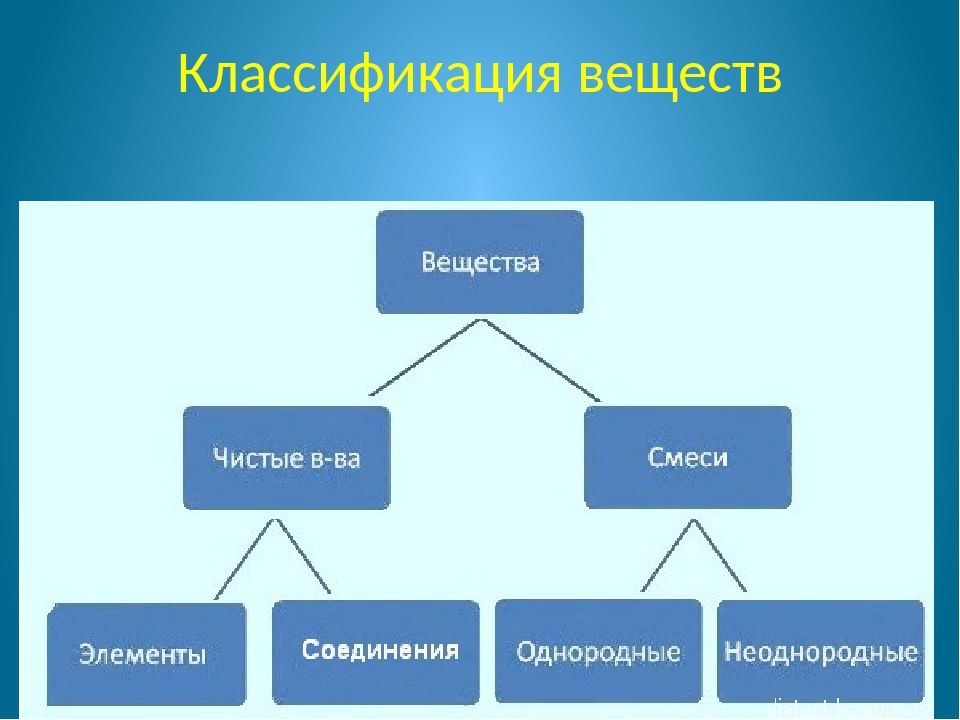
Сложные вещества — это вещества, которые состоят из атомов разных химических элементов.
Пример. Вода (H2O), углекислый газ (CO2), поваренная соль (NaCl) — сложные вещества.
Сложные вещества иначе ещё называются химическими соединениями.
Классификация веществ в виде схемы:
Урок №4. Чистые вещества и смеси. Способы разделения смесей
I. Новый материал
При подготовке урока использованы материалы автора: Н.К.Черемисиной,
учителя химии средней школы № 43
(г. Калининград), Источник
Мы живем среди химических веществ. Мы вдыхает воздух,
а это смесь газов (азота, кислорода и других), выдыхаем углекислый
газ. Умываемся водой — это еще одно вещество, самое распространенное
на Земле. Пьём молоко — смесь воды с мельчайшими капельками
молочного жира, и не только: здесь еще есть молочный белок казеин,
минеральные соли, витамины и даже сахар, но не тот, с которым
пьют чай, а особый, молочный — лактоза. Едим яблоки, которые состоят из
Едим яблоки, которые состоят из
целого набора химических веществ — здесь и сахар, и яблочная кислота,
и витамины… Когда прожеванные кусочки яблока попадают в желудок, на
них начинают действовать пищеварительные соки человека, которые помогают
усваивать все вкусные и полезные вещества не только яблока, но и любой другой
пищи. Мы не только живем среди химических веществ, но и сами из
них состоим. Каждый человек — его кожа, мышцы, кровь, зубы, кости, волосы
построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар,
витамины – вещества природного, естественного происхождения. Стекло, резина,
сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло,
и резина — искусственного происхождения, в природе их не было. Совершенно
чистые вещества в природе не встречаются или встречаются очень редко.
Чем же отличаются чистые вещества от смесей веществ?
Индивидуальное чистое вещество обладает определённым
набором характеристических свойств (постоянными физическими свойствами). Только
Только
чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса.
Морская вода замерзает при более низкой, а закипает при более высокой
температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более
низкой, а закипает при более высокой температуре, чем вода Балтийского моря.
Почему? Дело в том, что в морской воде содержатся другие вещества, например
растворенные соли, т.е. она представляет собой смесь различных веществ, состав
которой меняется в широких пределах, свойства же смеси не являются постоянными.
Определение понятия «смесь» было дано в XVII в. английским
ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Состав | Постоянный | Непостоянный |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:
Приведём
примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и
растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий +
медь или никель + медь).
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки
жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах
компоненты не различимы, они являются однородными (гомогенными) смесями.
Способы разделения смесей
В природе
вещества существуют в виде смесей. Для лабораторных исследований, промышленных
производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки
веществ применяются различные способы разделения смесей
Эти способы основаны на различиях в физических свойствах компонентов
смеси.
Рассмотрим способы разделения гетерогенных и гомогенных смесей.
Пример смеси | Способ |
Суспензия – смесь речного песка с водой | Отстаивание Разделение отстаиванием Разделение |
Смесь песка и поваренной соли в воде | Фильтрование На чем основано разделение гетерогенных смесей с Разделение смеси крахмала и воды фильтрованием |
Смесь порошка железа и серы | Действие Порошок железа притягивался магнитом, а порошок серы Несмачивающийся порошок серы всплывал на поверхность Разделение смеси серы и железа с помощью |
Раствор соли в воде – гомогенная смесь | Выпаривание или Вода испаряется, а в фарфоровой чашке остаются Если же разделять смесь спирта и воды, то первым Разделение однородных смесей |
Особым методом разделения компонентов, основанным на
различной поглощаемости их определенным веществом, является хроматография.
Дома вы можете проделать следующий опыт. Подвесьте
полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в
них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но
граница подъема краски отстает от границы подъема воды. Так происходит
разделение двух веществ: воды и красящего вещества в чернилах.
С помощью хроматографии русский ботаник М. С. Цвет
впервые выделил хлорофилл из зеленых частей растений. В промышленности и
лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал,
уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой
степенью очистки?
Для различных целей необходимы вещества с различной
степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления
примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно
предварительно прокипятить. А в химических лабораториях для приготовления
растворов и проведения опытов, в медицине необходима дистиллированная вода,
максимально очищенная от растворенных в ней веществ. Особо чистые вещества,
содержание примесей в которых не превышает одной миллионной процента,
применяются в электронике, в полупроводниковой, ядерной технике и других точных
отраслях промышленности.
Прочитайте стихотворение Л. Мартынова «Дистиллированная
вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Применение дистиллированной воды
II. Задания для закрепления
1) Поработайте с тренажёрами №1-4 (необходимо загрузить тренажёр)
Тренажёр №1. Чистые вещества и смеси
Тренажёр №2. Смеси
Тренажёр №3. Смеси в природе
Тренажёр №4. Смеси в сельском хозяйстве
2) Решите задачу:
Дана смесь сахара, речного песка и железных опилок. Предложите способ разделения этой смеси.
3) Творческое задание:
Подготовьте электронную презентацию на тему «Чистые вещества и смеси, которые нас окружают»
Чистые вещества и смеси
Тема. Чистые вещества и смеси.
Цели по содержанию:
Образовательная:
Развивающая:
сформировать умения распознавать чистые вещества и смеси;
сформировать умения составлять план действий разделения смесей веществ;
сформировать умения разделять смеси фильтрованием, действием магнита.

ознакомить с понятием адсорбция, отстаивание, декантация.
Воспитательная:
способствовать формированию интереса к знаниям, умениям, адекватной оценке своей деятельности.
Ожидаемый результат: Каждый ученик должен четко представлять понятия «чистое вещество», «смесь», знать способы разделения смесей, находить причинно-следственные связи, формулировать выводы на основании знаний, экспериментальных данных и жизненного опыта, доказывать их правильность, рефлексия деятельности.
Методы обучения: проблемный.
Тип урока: комбинированный.
Формы организации познавательной деятельности учащихся: фронтальная, парная и индивидуальная.
Средства обучения:
Химия «Вводный курс» – учебник для 7 класса общеобразовательных учреждений под редакцией О.
 С. Габриеляна – М., Дрофа, 2006.
С. Габриеляна – М., Дрофа, 2006.Презентация в MS Power Point.
Демонстрационный эксперимент:
Оборудование и вещества: Компьютер, проектор.
Разделение смеси нерастворимого в воде вещества и растворителя (растворимого вещества): Лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, колба или стакан химический.
Ход урока
А) Мотивационно-ориентировочный этап.
I. Организационный момент.
Приветствие, выявление эмоционального настроения у учащихся.
Что такое массовая доля растворенного вещества (это отношение растворенного вещества к массе раствора).
В чем измеряется массовая доля (в процентах)
Где можно и нужно использовать знания о приготовлении растворов?
В каких областях народного хозяйства можно использовать растворы и
Какие вам известны профессий в данных отраслях?
В домашних условиях (подкормка комнатных цветов, использование правильного количества чистящих веществ)
В пищевой промышленности (повара, технологи)
В сельском хозяйстве (агрономы рассчитывают удобрения для выращивания растений)
В аптеках (фармакологи)
В медицине (очень важны медсестры, потому что они занимаются разведением лекарств, и врачи, потому что они назначают лекарства)
В строительстве (маляр, штукатур, множество строительных смесей, разведение клея)
II. Подготовка к восприятию нового материала. Объявление темы.
Подготовка к восприятию нового материала. Объявление темы.
Беседой выясним вопросы:
? Как выдумаете растворы, полученные при смешивании соли и воды, сахара и воды это чистые вещества?
? А знаете ли Вы какую воду называют дистиллированной? (чистую), а что представляет собой морская вода? (смесь веществ).
А теперь давай те запишем тему сегодняшнего занятия: «Чистые вещества и смеси»
? А что Вы хотели бы узнать по данной теме? Какие бы цели Вы поставили перед собой на сегодняшнем занятии?
Цели урока обсуждаются с учащимися и как результат совместных действий.
Выяснить:
Какое вещество считают чистым.
Что такое смесь?
Какие бывают смеси?
Какими способами можно разделить смеси?
Б) Операционно-исполнительный этап.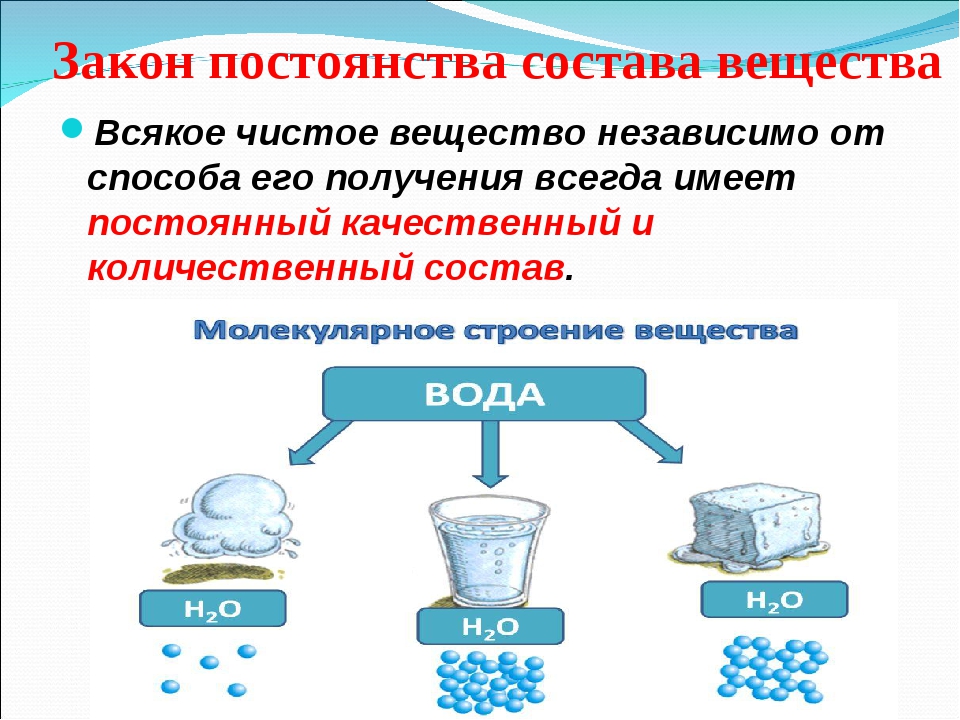
1. Объяснение нового материала.
а) Чистое вещество.
А теперь приступим к реализации поставленных целей.
Учитель демонстрирует слайд и поясняет условия эксперимента (в двух сосудах нагревали до кипения дистиллированную и морскую воду). Через определенное время измеряли температуры кипения в этих сосудах.
Ученики обсуждают результаты эксперимента. Сам собой напрашивается вопрос-проблема, которую озвучивает учитель, «Почему у морской воды tкип не постоянная в разные промежутки времени, по сравнению с tкип дистиллированной воды».
Учащиеся делают вывод, что соленость морской воды влияет на tкип. С помощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность).
Демонстрируется слайд
Ребята записывают в листе учёта знаний выводы.
Учитель дополняет, что в чистом веществе могут содержаться примеси, если в незначительных количествах, то они не влияют на физические и химические свойства. Пример чистого вещества – дистиллированная вода.
б) Смеси и их классификация.
Учитель предлагает ученикам рассмотреть смеси, находящиеся на демонстрационном столе (раствор поваренной соли, речной песок и вода, смесь опилок и кнопок, смесь порошка серы и железных опилок, морская вода), и примеры смесей, представленные на слайде.
Далее ребята дают определение смеси, как комбинации их нескольких веществ, находящихся в непосредственном контакте друг с другом. Эта формулировка появляется на слайде.
Учащиеся фиксируют содержание слайда в листе учёта знаний.
Учитель дополняет, что в природе нет абсолютно чистых веществ. Вещества встречаются преимущественно в виде смесей. Он рассказывает о воздухе, как смеси, которая состоит из газов – азота, кислорода, аргона и др.
? А можем ли мы различить эти газы в воздухе нашего класса? (нет).
(Демонстрируется слайд «Состав воздуха», на который можно перейти по гиперссылке Воздух предыдущего слайда. По окончании рассказа, щелчок на стрелочку слева внизу переместит на слайд «Классификация смесей»).
? А почему? (т.к. это бесцветные, газообразные вещества. Они одинаковы по агрегатному состоянию.)
Далее рассматривается классификация смесей, с помощью слайда.
Далее педагог обращает внимание учащихся на то что, неоднородными называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными называют смеси, в которых нельзя заметить частицы веществ, входящих в смесь (даже при помощи микроскопа).
Учащиеся выполняют задание: приводят примеры однородных и неоднородных смесей из общего списка смесей. (см. выше). Проверка выполненных заданий.
Дополнительный материал рассказывает учитель, если позволяет время на занятии. [Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В то же время необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит хотя ничтожное малое количество примесей. ]
]
в) Основные способы разделения смеси.
А теперь поговорим о способах разделения смесей в зависимости от вида смеси.
Демонстрация схемы способов очистки смесей в зависимости от вида смеси.
«Разделение смеси серы с железом»
Демонстрация способов разделения смесей: фильтрования, отстаивания, действия магнитом.
Работа с текстом 8-10 мин
Прочитать текст, выписать в тетрадь новые понятия.
Какая информация для вас знакома, вы слышали о ней, использовали ее в своей жизни (информация о активированном угле, использование в медицине, какие профессии вам известны; противогазы используют пожарные, военные, ученые)
В) Оценочно-рефлексивный этап.
Рефлексивный тест:
Я узнал(а) много нового.
Мне это пригодится в жизни.

На уроке было над чем подумать.
На все возникшие у меня вопросы я получил(а) ответы.
На уроке я поработал(а) добросовестно.
После выполнения теста учитель просит поднять руки тех учащихся, у которых поставлено в тесте 5 плюсов, затем тех, у которых 4 и 3 плюса.
Или в качестве рефлексии – беседа по вопросам:
А) Что нового вы узнали сегодня на уроке?
Б) Что запомнилось?
В) Что понравилось, а что не удалось, на ваш взгляд?
Дз: параграф 12,16, привести примеры различных неоднородных смесей и способы их разделения
1. Что такое чистые вещества?
Чистые вещества – вещества, которые имеют постоянный качественный и количественный состав.
Смеси – это многокомпонентные системы, в которых свойства веществ сохраняются.
Неоднородные смеси – это гетерогенные системы, в которых обнаруживается поверхность раздела фаз.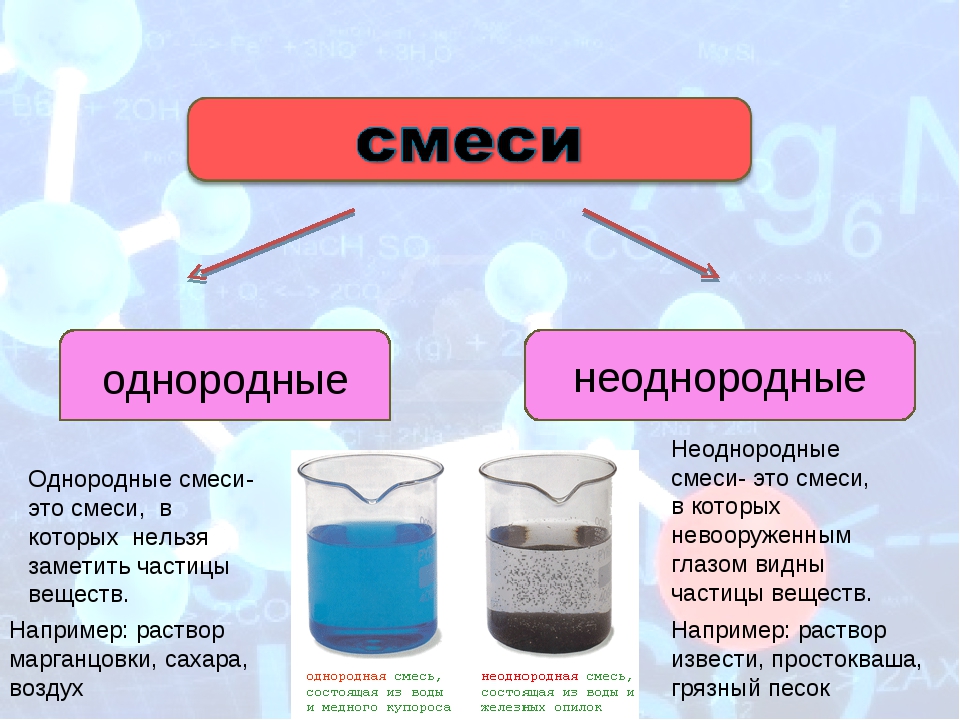
Однородные смеси – это гомогенные системы, в которых невооружённым глазом поверхность раздела фаз не обнаруживается.
2. Чем смеси отличаются от чистых веществ?
В смеси свойства компонентов сохраняются, состав смеси непостоянен.
3. Подчеркните названия чистых веществ: сталь, алюминий, кока-кола, кислород, спиртовой раствор иода, поваренная соль, морская вода, воздух, железо, почва, дистиллированная вода.
4. Чтобы выявить свойства вещества, нужно брать для исследования чистые вещества, потому что смеси, т.е. компоненты смесей, будут мешать исследованию.
5. Зачем нужно разделение смесей?
Для того, чтобы получить чистые вещества.
6. На чем основано разделение смесей?
На различных химических свойствах их компонентов.
7. Метод фильтрования основан на выделении веществ из неоднородной смеси, образованной растворимыми и нерастворимыми в воде веществами.
8. Метод отстаивания основан на различии в плотностях веществ, смешанных с водой.
9. Метод выпаривания основан на разных температурах кипения компонентов смеси, выделяют таким образом вещества из гомогенной смеси.
10. Метод дистилляции (перегонки) основан на разделении однородных смесей путём испарения летучих жидкостей с последующей конденсацией их паров.
11. Метод кристаллизации основан на частичном упаривании воды, при охлаждении растворённое вещество выделяется в виде кристаллов.
12. Метод хроматографии основан на различном поглощении разделяемых веществ поверхностью другого вещества.
13. В сахарный песок случайно попали древесные опилки. Опишите способ, которым можно очистить сахар от примесей.
1) растворить в воде;
2) отфильтровать – отделить опилки;
3)выпарить – на дне чашки останется сахар.
14. Опишите способ, которым можно разделить смесь, состоящую из речного песка, древесных опилок и поваренной соли.
1) растворить в воде – соль растворится, а песок, как более тяжёлый осядет на дне;
2) отфильтровать опилки;
3) выпарить воду – на дне чашки останется поваренная соль.
15. При исследовании образца воды было выявлено, что в воде содержатся нерастворимые частички твердого вещества (предположительно древесные стружки), несмешивающаяся с водой жидкость (возможно масло). Образец имеет неприятный запах и неестественный цвет, кроме того, содержит растворенную соль. Как очистить такую воду? Опишите последовательность операций.
1) отделить воду от масла делительной воронкой – отделится масло;
2) отфильтровать – отделятся древесные стружки;
3) выпарить – на дне чашки останется соль, которая была растворена в воде.
Тема: Разделение смесей
Цель:
1) построение знаний о чистых веществах и смесях;
2) формирование знаний о способах разделения смесей;
3) отработка практических умений и навыков разделения смесей
Ход урока:
1. Стадия вызова
2. Стадия содержания
Смеси: однородные и неоднородные
— Попробуйте дать определение этим смесям.
— Существуют разные способы очистки веществ. Сегодня я предлагаю вам, познакомится с некоторыми из них. (Сократовский диалог – все -1-2-3-4-все)
Способы очистки веществ:
Фильтрование 1 с. 86 — 87
Адсорбция 2 с. 87 — 88
Дистилляция 3 с. 89-90
Кристаллизация 4 с 90-91
Давайте все вместе зададим вопросы, на которые постараемся найти ответы, используя вопросительные слова:
— Что такое?
— Какие?
— Каким Образом?
— На каких?
— Где?
(работа в группе, совместное обсуждение точности вопросов)
В группе разделите номера с 1 по 4.
Каждый из вас отвечает за свой способ разделения смеси, после завершения работы с текстом вы должны ответить на вопросы своим партнерам по группе.
(хранитель времени, сигнальные карточки, колокольчик.)
— Наш лаборант случайно в баночку с медным купоросом высыпала песок. Сможем ли мы, помочь разделить эту смесь.
Каким образом обсудите в группе, и предложите план разделения смеси.
1. Растворить смесь в воде.
2. Профильтровать.
3. Выпарить.
(Инструктаж ТБ, уточнение деталей работы)
3. Стадия рефлексии
Оформление практической работы в тетради по плану:
1. Что делали?
2. Что наблюдали?
3. Рисунок.
4. Вывод.
Фильтрованием можно …
Чистые вещества: примеры. Получение чистых веществ
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Банальное яблоко – это целый комплекс сложных химических веществ, которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное – это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим способы разделения смесей. А также взглянем на типичные примеры чистых веществ.
Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное – это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим способы разделения смесей. А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества – это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом – m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом – m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо чистые вещества (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.
Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества – рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества – рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ – смесям. Смесь – это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.
Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Содержат одно вещество | Включают в себя различные вещества |
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |
Способы получения чистых веществ
В природе многие вещества существуют в виде смесей. Они применяются в фармакологии, промышленном производстве.
Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека).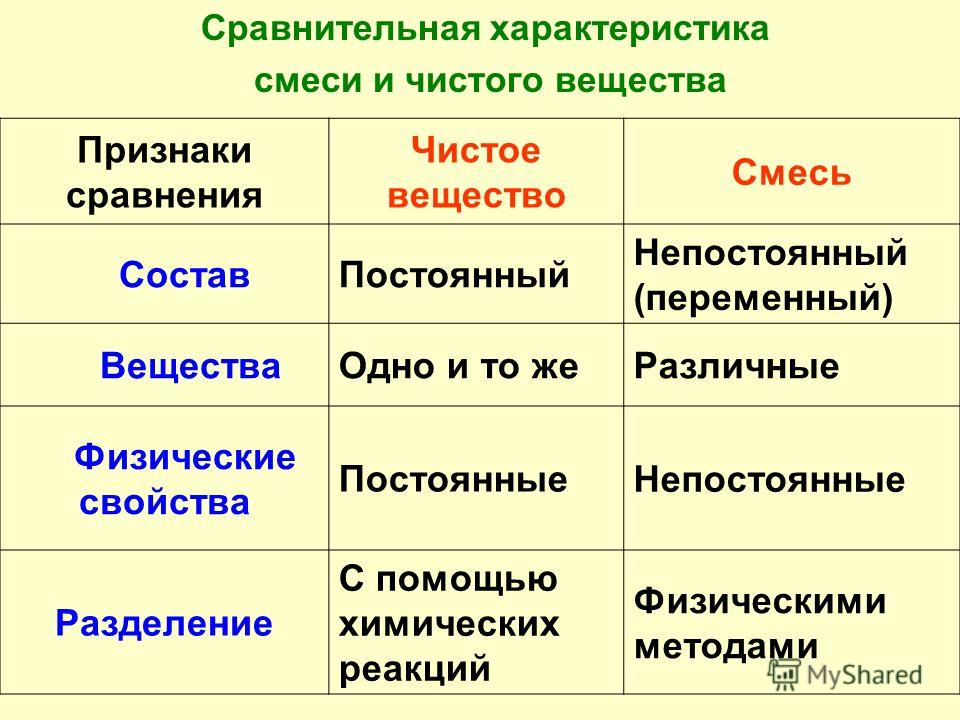 Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят респираторные маски, защищающие их от отравления.
Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят респираторные маски, защищающие их от отравления.
Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с гомогенными смесями, такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль.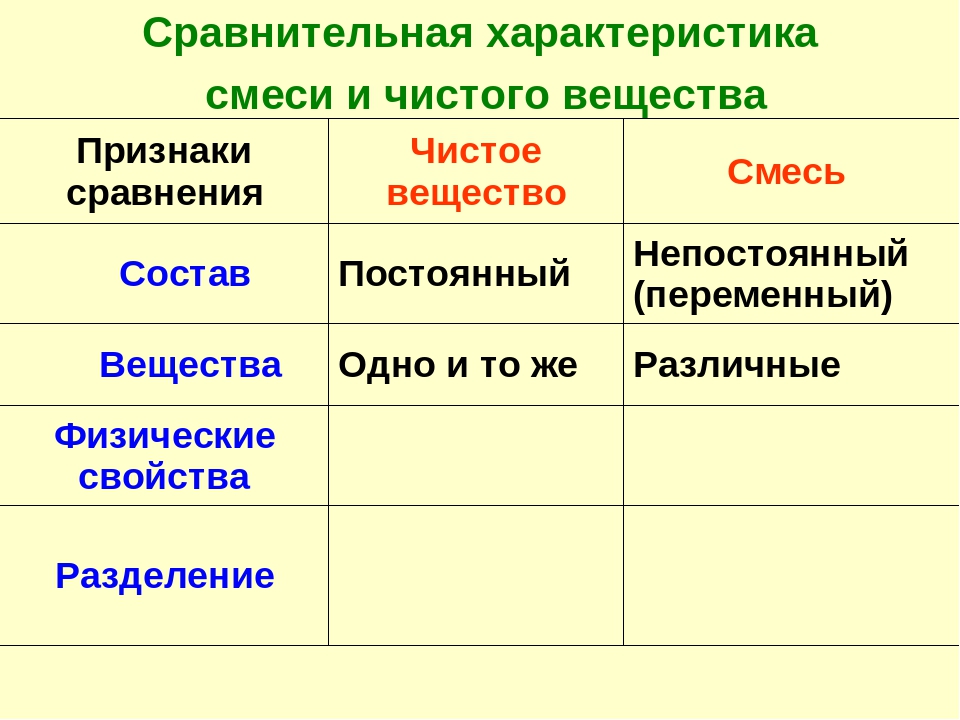 С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача — отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.
Хроматография
Последний метод отделения – хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Тема: «Чистые вещества и смеси»
Беседует с учащимися, подводит учащихся к формулировке темы и цели урока
Посмотрите, как разнообразен мир веществ. Вспомните, что называется веществом.
—Вещества – это то, из чего состоят тела
Какие вы знаете вещества? — Простые и сложные
У вас на столах находятся химические стаканы, посмотрите, что вы можете сказать о содержимом? — в стакане находится вода, песок, смешаны с чем-то, состоят из нескольких веществ (компонентов)
Подберите обобщающее слово, как можно назвать все эти вещества
-смеси
Нам хорошо знакомо, что такое чистота. Чистая комната, чистая тетрадь, а часто ли встречаются ли в природе чистые вещества?
Чистая комната, чистая тетрадь, а часто ли встречаются ли в природе чистые вещества?
И с чем в повседневной жизни мы встречаемся чаще с чистыми веществами или со смесями?- чтобы ответить на вопрос, нужно знать, чем отличаются чистые вещества и смеси
О чем же пойдет речь сегодня на уроке? Попробуйте теперь сформулировать тему урока:
Чистые вещества и смеси.
-Поставьте цель урока
— выяснить, чем чистые вещества отличаются от смесей.
Каких знаний нам не хватает, чтобы достичь цели?
—Не знаем, чем чистые вещества отличаются от смесей.
Для этого ребята давайте познакомимся с определениями понятий «чистое вещество» и «смесь» и характеристикой каждого понятия
Посмотрите, в одном стакане находится морская вода, в другом– дистиллированная. Какая из них является чистым веществом, а какая – смесью?
Какая из них является чистым веществом, а какая – смесью?
—морская вода – смесь воды и соли
Как вы думаете, морская вода и чистая дистиллированная вода будут обладать одинаковыми физическими свойствами? — нет
Какие вы знаете физические свойства веществ?
— агрегатное состояние, цвет, темп. кипения и др.
Объясняет условие эксперимента:
В 2-х сосудах нагревали до кипения дистиллированную и морскую воду. Через определенное время измеряли температуры кипения в этих сосудах. Посмотрите на график, сделайте вывод
— у морской воды непостоянная температура кипения в разные промежутки времени, а у дистиллированной воды температура кипения постоянная
Сформулируйте определение, что называется чистым веществом
Чистые вещества – вещества, которые обладают постоянными физическими свойствами
Выберите, из предложенных веществ чистые вещества.
Вывод:
Чистые вещества имеют постоянный состав.
Чистые вещества характеризуются постоянными физическими свойствами
Определения понятия «смесь».
Смесь – это система из двух и более веществ (компонентов).
1. Рассмотрите цвет серы и железа
2. Возьмите небольшие порции каждого вещества
а) испытайте магнитом б) опустите в пробирку с водой, проверьте растворимость
3. Смешайте серу с железом
4. Отметьте, изменился ли цвет компонентов в смеси, растворимость, магнитные свойства
5. Сделайте вывод (сохраняют ли компоненты свои свойства в смеси?)
Сделайте вывод
Смеси состоят из нескольких веществ
1. Смесь порошков железа и серы.
Смесь порошков железа и серы.
2. Морская вода.
3. Глина в воде
Состав воздуха.
Из перечисленных веществ выберите смеси, которые встречаются в природе
1. Дождевая вода
2. Воздух
3. Стиральный порошок
4. Почва
5. Пластмасса
6. Речная вода
7. Бетон
8. Туман
9. Железная руда
Работа в группах
Определи составные вещества предложенных смесей
Чистые вещества и смеси — Учебник по Химии. 7 класс. Григорович
Учебник по Химии. 7 класс. Григорович — Новая программа
Вспомните: вещества состоят из мельчайших частиц — атомов и молекул, каждому веществу соответствует определенный набор атомов или молекул.
Смеси и чистые вещества в природе
В природе вещества в индивидуальном состоянии — чистые вещества — почти не встречаются (рис. 37, с. 44). Чаще вещества в природе смешаны друг с другом и образуют смеси. Смесями является морская и газированная вода, молоко и сок, гранит и сталь.
37, с. 44). Чаще вещества в природе смешаны друг с другом и образуют смеси. Смесями является морская и газированная вода, молоко и сок, гранит и сталь.
Обозначение степени чистоты химических реактивов
Узнайте больше
Обычно химикам не требуются абсолютно чистые вещества, но иногда посторонние примеси могут влиять на результаты опытов. Поэтому на банках с химическими реактивами обязательно указывается степень чистоты вещества. Этикетка с надписью «Техн.» (техническое) указывает на высокое, до нескольких процентов, содержание примесей. Для химических опытов такие вещества не используют, но в строительстве и на заводах такой степени чистоты достаточно. Степень чистоты «Ч» (чистое) или «ХЧ» (химически чистое) обозначает, что в веществе примесей мало, менее одного процента. Чистые вещества уже можно использовать для производства лекарств, а химически чистые — для проведения научных опытов. В некоторых случаях нужны очень чистые вещества. Такие реактивы обозначаются «ОСЧ» (особо чистые), в них содержится меньше чем 10-6 процента примесей. Такие вещества нужны для проведения очень точных экспериментов, а также используются в производстве микросхем для компьютеров. Очистка веществ — это дорогой процесс, поэтому чем чище вещество, тем оно дороже. Например, особо чистые медь и железо стоят значительно дороже обычного золота.
Такие реактивы обозначаются «ОСЧ» (особо чистые), в них содержится меньше чем 10-6 процента примесей. Такие вещества нужны для проведения очень точных экспериментов, а также используются в производстве микросхем для компьютеров. Очистка веществ — это дорогой процесс, поэтому чем чище вещество, тем оно дороже. Например, особо чистые медь и железо стоят значительно дороже обычного золота.
Понятие о смесях и чистых веществах существовало еще у древнегреческих ученых. Согласно их представлениям, чистое вещество состоит из частиц одного вида, а смесь — из частиц разных видов.
Когда химики говорят о каком-либо веществе, имеется в виду, что оно чистое и состоит из частиц одного вида. Однако на практике идеально чистое вещество получить почти невозможно. Среди частиц одного вещества обязательно попадется несколько частиц другого.
Рис. 37. Редкие примеры чистых веществ в природе: а — самородное золото; б — самородная сера
Даже те вещества, которые называют чистыми, содержат посторонние частицы других веществ — примеси.
Однородные и неоднородные смеси
Во многих случаях мы не можем различить отдельные вещества в составе смеси. Так, мы не замечаем, что воздух — это смесь нескольких газообразных веществ. Внешне нельзя определить, что молоко — это смесь разных веществ, что большинство металлических предметов сделаны из сплавов, а не из чистых металлов. Такие смеси называют однородными. В них частицы, образующие смесь, настолько малы, что их невозможно рассмотреть невооруженным глазом (рис. 38).
Рис. 38. Однородные смеси: а — морская вода; б — пряжка ремня из латуни — смеси меди и цинка
Рис. 39. Неоднородные смеси: а — в граните можна увидеть вкрапления различных минералов; б — в газированной воде видны пузырьки углекислого газа
Когда мы пьем чай, кофе или другие напитки, мы имеем дело с водными растворами разных веществ. Отдельные частицы сахара или другие соединения в них увидеть невозможно, поэтому все растворы являются однородными смесями.
Рассматривая гранит (рис. 39а), можно заметить в нем розовые зерна и прозрачные кристаллы. Это пример неоднородной смеси. В таких смесях отдельные вещества заметны невооруженным глазом.
Свойства чистых веществ и смесей
На рисунке 40 частицы двух чистых веществ схематически изображены в виде шариков разного цвета. Перемешаем эти шарики. Изменились ли они после этого? Нет, они просто перемешались. Ни форма, ни размер, ни цвет шариков в результате перемешивания не изменились. Так же и в смеси все вещества — компоненты — сохраняют свои свойства. Поэтому, основываясь на индивидуальных свойствах, смеси можно разделить на отдельные компоненты.
Рис. 40. В смеси свойства веществ не меняются
Рис. 41. Железо из смеси с солью притягивается магнитом (а), а соль не теряет способности растворяться (б)
Например, если поднести магнит к смеси железного порошка и поваренной соли, то железо к нему притянется, а соль — нет (рис. 41). Если эту смесь поместить в воду, то соль растворится, а железо — нет.
41). Если эту смесь поместить в воду, то соль растворится, а железо — нет.
Сахар имеет сладкий вкус, а лимонная кислота — кислый. Попробуйте растворить в воде небольшое количество сахара и лимонной кислоты. Какой вкус будет иметь эта смесь? Кислый плюс сладкий равняется кисло-сладкому. Следовательно, каждое вещество в смеси не меняет своих свойств и придает некоторые свои свойства всей смеси.
Интересно, что…
На принципе сохранения свойств веществ в смеси основано изготовление материалов, ведь большинство материалов являются смесями. Например, чистое золото является очень мягким металлом и изготовленные из него предметы могут испортиться даже от слабого удара. Поэтому для изготовления ювелирных изделий в золото обязательно добавляют определенное количество меди или серебра. Конечно же, цвет такой смеси (сплава) немного отличается от цвета чистого золота, однако изделия из нее получаются более стойкими.
Как отличить чистое вещество от смеси?
Это легко сделать, если смесь неоднородная и ее отдельные компоненты хорошо видны, как, например, песчинки в воде. Чистое вещество всегда однородное, поэтому даже при сильном увеличении его изображения под микроскопом все частицы, из которых оно состоит, будут иметь одинаковый вид.
Чистое вещество всегда однородное, поэтому даже при сильном увеличении его изображения под микроскопом все частицы, из которых оно состоит, будут иметь одинаковый вид.
Иногда, чтобы отличить смесь от чистого вещества, можно воспользоваться микроскопом.
Рис. 42. Изображение капли молока под микроскопом
Рис. 43. Измерение температуры кипения: жидкость внутри колбы нагревается на горелке, а термометр покажет температуру, при которой жидкость закипит
Молоко имеет вид однородной жидкости, но под микроскопом в нем видны капельки жира, плавающие в жидкости (рис. 42). Но даже микроскоп не поможет нам увидеть отдельные частицы в водном растворе сахара. Раствор, конечно, приобретет сладкий вкус, но в химической лаборатории пробовать вещества нельзя!
В этом случае нам помогут знания о физических свойствах веществ. Хотя каждое вещество передает свои свойства смеси, но никогда смесь не имеет таких же свойств, как чистые вещества по отдельности. Например, температура, при которой плавится сплав олова и свинца, ниже, чем температура плавления чистого олова или чистого свинца. Морская вода или раствор соли в воде замерзает при более низкой, а кипит при более высокой температуре, чем чистая вода.
Например, температура, при которой плавится сплав олова и свинца, ниже, чем температура плавления чистого олова или чистого свинца. Морская вода или раствор соли в воде замерзает при более низкой, а кипит при более высокой температуре, чем чистая вода.
В этом случае достаточно измерить температуру плавления или кипения смеси (рис. 43) и сравнить результат с данными справочника для чистых веществ. Если есть отклонения от справочных данных, то исследуемое вещество не чистое, а является смесью.
Разделение смесей
Смесь можно разделить на отдельные компоненты, если знать их физические свойства. Смесь, компоненты которой существенно отличаются по свойствам, разделить легко. Но если свойства веществ подобны, этот процесс затрудняется. Современные химики научились разделять почти любые смеси, даже те, которые содержат большое количество компонентов.
В воде, зачерпнутой из реки, есть примеси ила, песка и растворенных солей. Песок от воды можно отделить отстаиванием — тяжелые песчинки быстро осядут на дне. Этот метод называют отстаиванием. Он основан на том, что более легкие вещества всплывают на поверхность, а более тяжелые — оседают на дно сосуда (рис. 44, с. 48).
Этот метод называют отстаиванием. Он основан на том, что более легкие вещества всплывают на поверхность, а более тяжелые — оседают на дно сосуда (рис. 44, с. 48).
Рис. 44. Если смесь серы с железом попадает в воду (а), то частицы серы всплывают, а железа — тонут (б)
Этим методом можно отделить, например, сливки от свежего молока, так как капельки жира легче воды и всплывают на поверхность, образуя сливки.
Если частицы в жидкости слишком мелкие и почти не оседают, то их можно отделить фильтрованием. Например, для очистки речной воды от речного ила ее можно пропустить через фильтр. В химических лабораториях используют специальную фильтровальную бумагу (рис. 45а). Это обычная бумага с очень маленькими порами (отверстиями). Для фильтрования смесь воды с илом наливают в воронку с бумажным фильтром (рис. 45б). Молекулы воды очень маленькие, намного мельче, чем любые частицы, которые видно невооруженным глазом. Они легко проходят сквозь поры в фильтре, а большие частицы, размер которых больше, чем размер пор, задерживаются фильтром (рис.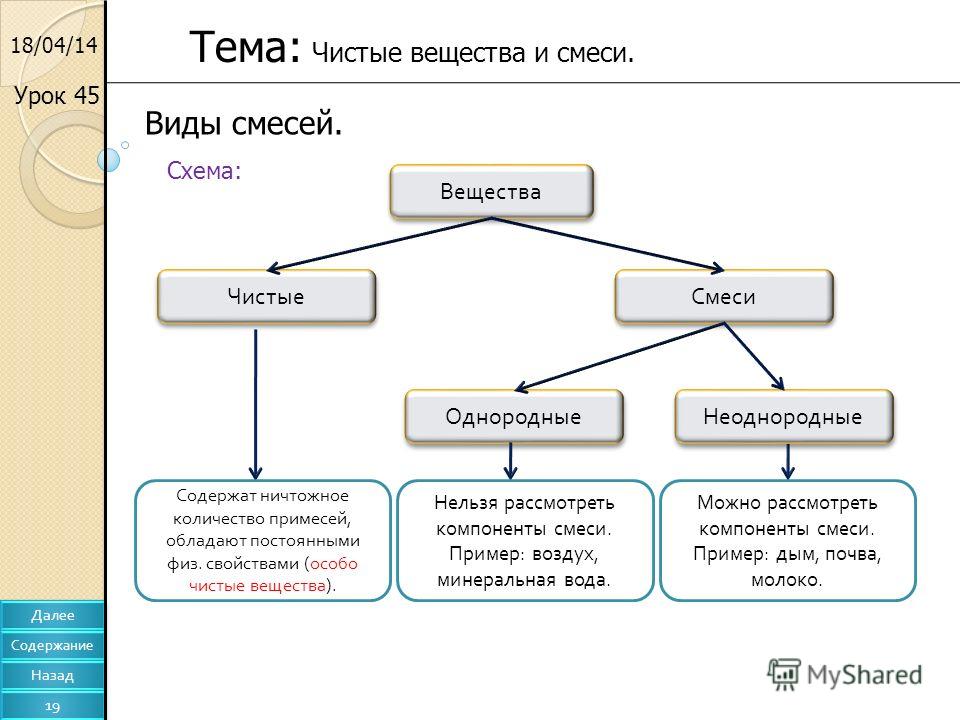 45в).
45в).
Фильтрованием можно разделить только неоднородные смеси. В однородных смесях с водой (растворах) растворенные частицы по размеру подобны молекулам воды и легко проходят через фильтр. Но такие смеси можно разделить выпариванием или перегонкой.
Рис. 45. Для разделения смесей фильтрованием используют фильтровальную бумагу (а), через которую пропускают неоднородную смесь с водой (б). При этом большие частицы, размер которых больше, чем поры фильтра, задерживаются, а вода и более мелкие частицы просачиваются (в)
Рис. 46. При выпаривании раствор нелетучего вещества в воде нагревают до полного испарения воды
Если необходимо разделить растворенные вещества, раствор наливают в фарфоровую чашку и выпаривают (рис. 46). Вода испарится, а растворенные вещества останутся на дне чашки. Выпариванием можно разделить смесь нелетучего вещества с летучим.
Для разделения смесей двух летучих веществ выпаривание применять нельзя. Смесь таких веществ можно разделить перегонкой (рис. 47). Для этого смесь помещают в колбу и нагревают. Жидкость, которая кипит при более низкой температуре, испаряется первой, и ее пары попадают в холодильник. В холодильнике они конденсируются (превращаются в жидкость), и в приемник по каплям стекает чистая жидкость. Этот метод разделения смесей называют также дистилляцией, поэтому воду, очищенную таким способом, называют дистиллированной.
Смесь таких веществ можно разделить перегонкой (рис. 47). Для этого смесь помещают в колбу и нагревают. Жидкость, которая кипит при более низкой температуре, испаряется первой, и ее пары попадают в холодильник. В холодильнике они конденсируются (превращаются в жидкость), и в приемник по каплям стекает чистая жидкость. Этот метод разделения смесей называют также дистилляцией, поэтому воду, очищенную таким способом, называют дистиллированной.
Рис. 47. Приспособление для перегонки состоит из колбы с термометром для контроля температуры паров, холодильника, в котором охлаждаются пары, и приемника, в котором собирается очищенная жидкость
Перегонкой можно разделить однородную смесь двух жидкостей, которые кипят при разных температурах, например смесь спирта с водой. При нагревании такой смеси сначала испаряется и собирается в приемнике жидкость с более низкой температурой кипения — спирт. Когда весь спирт выкипит, жидкость в колбе продолжит нагреваться, а при температуре 100 °С начнет испаряться вода.
Действием магнита можно выделить из неоднородной смеси вещество, имеющее магнитные свойства (рис. 41, с. 46).
Используя описанные методы, можно разделить большинство смесей на чистые вещества.
Лингвистическая задача
На греческом языке смеси называют словом «миксис». Какое значение, по вашему мнению, имеют слова «микстура», «миксер»?
В переводе с латинского distille означает «капля». Как вы считаете, почему перегонка жидкостей получила название «дистилляция»?
Выводы:
1. Чистые вещества образованы одинаковыми частицами, а смеси — разными. Чистые вещества, входящие в состав смесей, называют компонентами смеси. В неоднородных смесях частицы компонентов видны невооруженным глазом, а в однородных смесях отдельных компонентов не видно, и на вид они кажутся чистыми веществами.
2. В смесях вещества сохраняют свои свойства и передают их смеси. На этом основана возможность разделения смеси веществ на чистые вещества. Для разделения смесей чаще всего используют фильтрование, отстаивание, выпаривание, перегонку и действие магнитом.
Для разделения смесей чаще всего используют фильтрование, отстаивание, выпаривание, перегонку и действие магнитом.
Контрольные вопросы
1. Дайте определение смеси. Какие смеси называются однородными, а какие — неоднородными? Приведите примеры.
2. Существуют ли в природе абсолютно чистые вещества?
3. Меняются ли свойства веществ в смеси? Почему?
4. Как отличить чистое вещество от смеси веществ?
Задания для усвоения материала
1. Чем отличаются смеси от чистых веществ? Выберите правильные ответы: а) чистые вещества состоят из одинаковых молекул, а смеси — из разных; б) чистые вещества состоят из разных молекул, а смеси — из одинаковых; в) в смеси вещества изменяют свои свойства; г) при смешивании свойства компонентов смеси не меняются; д) в свойствах смеси проявляются свойства ее отдельных компонентов.
2. Выпишите отдельно названия смесей и чистых веществ; кислород, речная вода, водопроводная вода, минеральная вода, дистиллированная вода, поваренная соль, воздух, сахар, бензин, кровь, зубная паста, золото, зола.
3. Однородная или неоднородная смесь образуется при смешивании; а) одеколона и воды; б) муки и воды; в) меда и чая; г) песка и камней; д) бензина и воды?
4. Почему не удается выделить жир из свежего молока фильтрованием?
5. Приведите не менее пяти примеров однородных и неоднородных смесей, с которыми вы сталкиваетесь в повседневной жизни.
6. Какие методы разделения смесей вам известны? На каких свойствах веществ они основаны? Приведите примеры смесей, которые можно разделить этими методами. Свой ответ оформите в виде таблицы;
Тип смеси | Метод разделения | Краткое описание метода | На каких свойствах веществ основан метод | Пример смесей |
Однородная | 1. | |||
2. | ||||
Неоднородная | 1. | |||
2. | ||||
3. | ||||
4. |
7. Каким способом можно разделить смеси; а) воды и бензина; б) сахара и песка; в) песка и опилок; г) муки и железных опилок; д) крахмала и сахара?
Каким способом можно разделить смеси; а) воды и бензина; б) сахара и песка; в) песка и опилок; г) муки и железных опилок; д) крахмала и сахара?
8. Приведите пример использования метода отстаивания в быту.
9*. Что представляет собой питьевая вода? Узнайте, как вода попадает в ваш дом. Можно ли считать водопроводную воду чистой? Может ли в природе существовать чистая вода? Поговорите со взрослыми и узнайте, какие меры позволят улучшить качество питьевой воды.
Интересно, что…
• Особо чистые вещества необходимо правильно хранить. Так, особо чистую воду можно хранить только в емкостях из кварца и без доступа воздуха. Обычное стекло и воздух очень слабо, но все же растворяются в воде и «загрязняют» ее.
• В древние времена торговцы, для того чтобы отличить золотую монету от медной или другой желтого цвета, пробовали ее «на зуб». Если зубы оставляли след на поверхности монеты, это означало, что монета сделана из чистого золота. Именно поэтому большинство древних золотых монет, сохранившихся до наших дней, изогнуты или покусаны.
Именно поэтому большинство древних золотых монет, сохранившихся до наших дней, изогнуты или покусаны.
ГДЗ к учебнику можно найти тут.
Какие примеры чистых веществ?
Чистое вещество или химическое вещество — это материал, который имеет постоянный состав (однороден) и имеет одинаковые свойства по всему образцу. Чистое вещество участвует в химической реакции с образованием предсказуемых продуктов. В химии чистое вещество состоит только из одного типа атомов, молекул или соединений. В других дисциплинах определение распространяется на однородные смеси.
Примеры чистых веществ
- В химии вещество считается чистым, если оно имеет однородный химический состав.На наноуровне это применимо только к веществу, состоящему из одного типа атомов, молекул или соединений.
- В более общем смысле чистое вещество — это любая однородная смесь. То есть это вещество, которое кажется однородным по внешнему виду и составу, независимо от того, насколько мал размер выборки.
- Примеры чистых веществ: железо, сталь и вода. Воздух — это однородная смесь, которую часто считают чистым веществом.
Примеры чистых веществ
Примеры чистых веществ включают олово, серу, алмаз, воду, чистый сахар (сахарозу), поваренную соль (хлорид натрия) и пищевую соду (бикарбонат натрия).Кристаллы, как правило, представляют собой чистые вещества.
Олово, сера и алмаз являются примерами чистых веществ, которые являются химическими элементами. Все элементы — чистые вещества. Сахар, соль и пищевая сода — это чистые соединения. Примеры чистых веществ, которые представляют собой кристаллы, включают соль, алмаз, кристаллы белка и кристаллы сульфата меди.
В зависимости от того, с кем вы разговариваете, гомогенные смеси могут считаться примерами чистых веществ. Примеры гомогенных смесей включают растительное масло, мед и воздух.Хотя эти вещества содержат несколько типов молекул, их состав одинаков во всем образце. Если добавить в воздух сажу, она перестает быть чистым веществом. Загрязнения в воде делают ее нечистой.
Загрязнения в воде делают ее нечистой.
Гетерогенные смеси не являются чистыми веществами. Примеры материалов, которые являются чистыми веществами , а не , включают гравий, компьютер, смесь соли и сахара и дерево.
Совет по распознаванию чистых веществ
Если вы можете написать химическую формулу для вещества или если это чистый элемент, это чистое вещество!
Источники
- Хилл, Дж.W .; Petrucci, R.H .; McCreary, T. W .; Перри, С. С. (2005). Общая химия (4-е изд.). Пирсон Прентис Холл. Нью-Джерси.
- ИЮПАК (1997). «Химическая субстанция.» Сборник химической терминологии (2-е изд.) Doi: 10.1351 / goldbook.C01039
Примеры чистых веществ
Чистая субстанция
Чистое вещество — это любой отдельный тип материала, состоящий только из одного типа атомов или только из одного типа молекул. Кроме того, чистое вещество можно определить как любой отдельный тип материала, который не был загрязнен другим веществом. В химии чистое вещество имеет определенный состав. Это может быть составной элемент или отдельный элемент. Элемент — это чистое вещество, которое нельзя разделить на более простые химическими или физическими способами. Всего около 117 элементов, но углерод, водород, азот и кислород — лишь некоторые из них, которые составляют большую часть Земли. Материал больше не является чистым веществом, если он был смешан с другим чистым веществом. Два чистых вещества, смешанные вместе, называются смесью. Ученые часто используют фильтрацию для отделения чистых веществ от смеси с целью анализа материалов.
В химии чистое вещество имеет определенный состав. Это может быть составной элемент или отдельный элемент. Элемент — это чистое вещество, которое нельзя разделить на более простые химическими или физическими способами. Всего около 117 элементов, но углерод, водород, азот и кислород — лишь некоторые из них, которые составляют большую часть Земли. Материал больше не является чистым веществом, если он был смешан с другим чистым веществом. Два чистых вещества, смешанные вместе, называются смесью. Ученые часто используют фильтрацию для отделения чистых веществ от смеси с целью анализа материалов.
Химическое вещество может быть твердым, жидким, газообразным или плазменным. Чистые вещества часто называют чистыми, чтобы отличить их от смесей. Вещество может быть чем угодно. Он не обязательно должен состоять из одного элемента или типа молекулы. Чистый водород — чистое вещество. То же самое и с чистым медом, даже если он состоит из множества различных типов молекул. Что делает оба эти материала чистыми веществами, так это то, что они не содержат загрязнений. Если вы добавите немного кислорода к водороду, полученный газ не будет ни чистым водородом, ни чистым кислородом.Если вы добавите в мед кукурузный сироп, у вас больше не будет чистого меда. Чистый спирт может быть этанолом, метанолом или смесью разных спиртов, но как только вы добавите воду, которая не является спиртом, у вас больше не будет чистого вещества.
Если вы добавите немного кислорода к водороду, полученный газ не будет ни чистым водородом, ни чистым кислородом.Если вы добавите в мед кукурузный сироп, у вас больше не будет чистого меда. Чистый спирт может быть этанолом, метанолом или смесью разных спиртов, но как только вы добавите воду, которая не является спиртом, у вас больше не будет чистого вещества.
Большинство чистых веществ, с которыми вы сталкиваетесь в повседневной жизни, были очищены людьми путем очистки.
Примеры чистых веществ:
1. Золото
Он имеет одинаковый состав, независимо от того, откуда он родом.Золото состоит из атомов золота. К золоту не добавляются никакие другие элементы или соединения.
2. Бриллианты
Они образуются глубоко внутри Земли лишь в очень немногих областях. Все частицы в алмазе одинаковы.
3. Вода
Считается чистым веществом, если вода содержит только водород и кислород. Чистую воду сложно найти в природе. Даже самая чистая родниковая вода содержит растворенные минералы. В природе чистые вещества имеют тенденцию смешиваться с другими веществами
В природе чистые вещества имеют тенденцию смешиваться с другими веществами
4.Пищевая сода
Хотя пищевую соду можно использовать в самых разных целях, в ее простейшем виде она не загрязнена какими-либо другими химическими соединениями.
5. Соль поваренная
Одна из самых распространенных бытовых химикатов. Поваренная соль содержит от 97% до 99% хлорида натрия. Чистый хлорид натрия представляет собой твердое ионное кристаллическое вещество.
Атомы
Ионные и металлические связи
Факты о соединениях
Примеры углеводородов
Факты о смесях
Свойства воды Quiz
Молевые факты
Формула карбида кремния — Использование карбида кремния, свойства…
Факты о радии
Формула моляльности
Примеры чистых веществ
Вещества и смеси | Введение в химию
Цель обучения
- Отличить химические вещества от смесей
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси.
 Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты.
Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты. - Химическое вещество состоит из одного типа атома или молекулы.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию.Для этого разделения вещество может находиться в одной или двух разных фазах.
Условия
- веществоФорма вещества, имеющая постоянный химический состав и характерные свойства. Он состоит из одного типа атома или молекулы.
- элемент: Химическое вещество, состоящее из определенного вида атомов, которое не может быть расщеплено или преобразовано с помощью химической реакции.

- смесь: То, что состоит из различных, несвязанных элементов или молекул.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства. Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент.Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку.Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку.Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории.Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза). Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это система материалов, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически. Под смесью понимается физическая комбинация двух или более веществ, в которой сохраняются идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы Сера встречается в природе в виде элементарной серы, сульфидов и сульфатных минералов, а также в виде сероводорода.Это месторождение полезных ископаемых состоит из смеси веществ.
Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами. Примеры включают:
Примеры включают:
- смеси песка и воды
- смеси песка и опилок
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Interactive: Oil and Water Изучите взаимодействия, которые заставляют воду и масло отделяться от смеси.
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Состав однородных смесей постоянный. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб.В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу. На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Химия 1.2 Classification Matter (Part 1 of 3) — YouTube Введение в классификацию вещества как вещества или смеси веществ. Смеси описываются как гетерогенные или гомогенные. Описываются три распространенных метода разделения. Часть 2 из 3: http://www.youtube.com/watch?v=SoFywULNF3s (Вещества) Часть 3 из 3: http://www.youtube.com/watch?v= LXMyN9kco7E (Диаграммы частиц)
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Чистые вещества и смеси Учебное пособие по химии
Сноски
1.Область, в которой все физические и химические свойства одинаковы, называется фазой.
Чистое вещество состоит только из одной фазы.
Данная фаза может быть твердой, жидкой или газообразной.
2. Гомогенная смесь состоит из одной фазы.
Поскольку газы смешиваются полностью, любая смесь газов будет состоять из одной фазы и будет однородной.
Растворимая соль, растворенная в жидкой воде для получения водного раствора соли, также состоит из единственной фазы.
Растворимая жидкость, такая как этанол, растворенная в жидкой воде, также состоит только из одной фазы.
3. Гетерогенная смесь состоит более чем из одной фазы.
4. H 2 O — это молекулярная формула воды, она говорит нам, что в каждой молекуле воды присутствуют 2 атома водорода и 1 атом кислорода.
Вы можете узнать больше в учебнике по молекулярным формулам.
5. Сульфид железа — это название, данное соединению, содержащему 1 «атом» железа и 1 «атом» серы, в зависимости от его состава.
Вы можете назвать это бинарным неорганическим ионным соединением (солью), и в этом случае предпочтительным названием IUPAC является сульфид железа (2+).
Более раннее название того же соединения по ИЮПАК — сульфид железа (II) (или сульфид железа (II)).
Еще более древнее название того же соединения — сульфид железа (или сульфид железа).
6. Предпочтительное написание ИЮПАК для элемента с химическим символом S — это сера, а не сера.
Вы все еще можете найти старое написание слова «сера», используемое для обозначения элемента сера.
7. Атомы серы могут располагаться по-разному.
Вы можете узнать больше об этом в руководстве по аллотропам.
8. Термин жидкость в химии относится к состоянию (или фазе) вещества, в котором все «частицы» (например, молекулы) идентичны.
Следовательно, жидкость по определению является чистым веществом.
В обычном обиходе люди называют многие типы смесей «жидкостями», например, ликер в стакане нехимик может называть жидкостью, но химик думает об этом как о смеси, известной как водный раствор, потому что В воде растворено много веществ (аква), которые придают ей аромат и цвет.
Самый общий термин для текущего вещества — «жидкость». Жидкость — это жидкость, водный раствор — это жидкость, а газы — это жидкости.
9. Кислород также может существовать в другой форме, известной как озон, в которой 3 атома кислорода химически связаны друг с другом (O 3 ).
O 2 и O 3 известны как аллотропы кислорода.
10. Это НЕ исчерпывающий список методов разделения. Вы также можете прочитать о некоторых методах, которые химики используют для отделения веществ от смесей, в следующих руководствах AUS-e-TUTE:
Хроматография, электрофорез и масс-спектроскопия
И существует множество методов, используемых в коммерческих целях для отделения металлов от руд.Возможно, вы захотите прочитать следующие уроки AUS-e-TUTE по извлечению металлов:
Концепции извлечения металлов, восстановительный углеродный метод извлечения металлов, извлечение меди плавлением, электролитическое извлечение алюминия, электролитическое извлечение натрия, электрохимическое извлечение меди
11. Золотые самородки могут быть достаточно большими, чтобы их можно было разглядеть на окружающей земле. Найденный подобный золотой самородок привел к созданию огромных золотых приисков Калгурли в Западной Австралии.
Подробнее об этом можно прочитать в декабрьском выпуске AUS-e-NEWS за 2012 год.
12. Строго говоря, это свойство следует называть ферромагнетизмом.
Ферромагнетизм относится к сильному притяжению магнитного поля и проявляется элементами железа (Fe), кобальта (Co) и никеля (Ni) в твердом состоянии.
В общем смысле «магнетизм» относится к «ферромагнетизму».
Есть и другие виды магнестизма:
⚛ парамагнетизм, вещества с неспаренными электронами испытывают слабое притяжение к магнитному полю
⚛ диамагнетизм, очень слабое отталкивание от магнитного поля, которое испытывает вся материя.
13.Одно время считалось, что болезнь Гуам деменция вызывается мукой, приготовленной из токсичных семян цикад.
Подробнее об этом можно прочитать в сентябрьском номере AUS-e-NEWS за 2017 год.
14. Хорид натрия (NaCl) обычно называют солью или поваренной солью.
Для химика хлорид натрия — всего лишь один пример соли.
В химии соли — это соединения, состоящие из катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), которые удерживаются вместе в трехмерной решетке с помощью электростатических сил притяжения (ионные связи).Таким образом, соль представляет собой ионное соединение, состоящее из двух ионов, бинарное ионное соединение.
15. Солнечное производство испарительной соли подробно обсуждалось в сентябрьском выпуске AUS-e-NEWS за 2016 год.
16. Когда вещество растворяется в воде, полученная смесь называется водным раствором. Количество вещества, растворенного в данном объеме воды, называется концентрацией раствора.
Вы можете узнать больше о растворах и концентрации в Руководстве по концепциям решений.
Учебное пособие по химии бинарных сплавов
Ключевые понятия
- Атомы в чистом металлическом твердом теле расположены в правильной кристаллической решетке.
- Сплав — это смесь металла с одним или несколькими другими элементами.
- Бинарный сплав состоит из двух элементов. 1
- Однородный бинарный сплав 2 представляет собой твердый раствор:
Первичный элемент представляет собой металл и называется растворителем 3 .
Вторичный элемент называется растворенным веществом.
- Гомогенный бинарный сплав можно классифицировать как замещающий или внедренный:
Тип сплава Относительный размер атомов Описание Пример Замещающий растворенного вещества и прибл .; растворитель Растворенные атомы замещают атомы растворителя в решетке. углеродистая сталь Межстраничное растворенное вещество <растворитель Атомы растворенных веществ занимают «дыры» (пустоты) в решетке металла растворителя. бронза, латунь - Сплав проявляет металлические свойства.
- Межузельные и замещающие сплавы тверже, чем чистый металлический растворитель.
Теория
В образце твердого чистого металла атомы металла расположены в правильной трехмерной кристаллической решетке 4 .
Мы можем изобразить один слой этой металлической решетки, как показано ниже:
| Каждый черный кружок представляет собой двумерное представление сферы. Каждая сфера представляет собой атом одного и того же металлического элемента. |
Эти атомы способны «перекатываться» друг с другом, делая чистый металл пластичным, пластичным и довольно мягким.
Такие металлы, как чистое железо, медь, олово, цинк, золото и свинец, довольно мягкие.Легирование, смешивание этих металлов с другим элементом — это способ сделать их более твердыми и, следовательно, более полезными.
Обратите внимание, что между атомами металла в решетке есть промежутки или дыры:
| Эти промежутки или дыры в решетке называются пустотами. |
Один из способов образования твердого раствора, гомогенного сплава для этого металла, заключается в том, что атомы другого элемента занимают некоторые из этих отверстий (пустот):
| Черные кружки представляют собой исходные атомы металла, составляющие решетку. Красные кружки представляют атомы другого элемента, вставленные в промежутки. Обратите внимание, что атомы, занимающие междоузлия, должны быть намного меньше, чем атомы металла, составляющие исходную решетку. |
Этот тип сплава известен как «сплав внедрения», потому что более мелкие атомы входят в «дыры» (пустоты) в существующей металлической решетке.
Промежуточные элементы часто представляют собой неметаллы, такие как водород, бор, углерод, азот, кислород и кремний.
Эффект от того, что эти маленькие атомы занимают пустоты, заключается в том, что большие атомы металла больше не могут так легко катиться друг по другу при приложении напряжения, то есть сплав будет более жестким, менее податливым и менее пластичным, чем оригинальный чистый металл.
Есть еще один способ, которым металл может образовывать гомогенный твердый раствор с другим элементом, атомы металла в решетке могут быть заменены или замещены атомами другого элемента:
| Черные кружки представляют собой исходные атомы металла, составляющие решетку. Красные кружки представляют собой атомы другого элемента, которые заменили некоторые из исходных атомов металла. Обратите внимание, что эти замещенные атомы имеют такой же размер, что и атомы металла, составляющие исходную решетку. |
Этот тип сплава известен как «сплав замещения», то есть в металлической решетке атомы другого элемента были замещены атомами аналогичного размера.
Как правило, атомные радиусы двух типов атомов должны находиться в пределах примерно 15% друг от друга, чтобы они не влияли на общую кристаллическую структуру, что означает, что растворенные атомы, скорее всего, связаны с металлами.
Несколько иной размер этих растворенных атомов вызывает деформацию в решетке, которая усиливает решетку, делая полученный твердый сплав более жестким, менее податливым, менее пластичным, но с плотностью, аналогичной исходной решетке чистого металла.
Углеродистая сталь: Интерститальный сплав
Чистое железо слишком мягкое, чтобы быть полезным.Один из способов сделать железо более твердым — добавить небольшое количество углерода по массе. Полученный сплав известен как углеродистая сталь.
Атомы углерода меньше атомов железа, как показано в таблице ниже:
| атом | радиус 5 / Å | вылет / м | передаточное отношение радиуса | объем 6 / м 3 | объемное соотношение | |
|---|---|---|---|---|---|---|
| углерод | 0.75 | 7,5 × 10 -11 | 0,60 | 1,8 × 10 -30 | 0,2 | |
| утюг | 1,24 | 1,24 × 10 -10 | 1 | 8,0 × 10 -30 | 1 |
Радиус атома углерода составляет всего 60% от радиуса атома железа, то есть радиус атома углерода немногим больше половины радиуса атома железа.
Это означает, что объем пространства, занимаемого атомом углерода, составляет только 20% объема пространства, занимаемого атомом железа.
Поскольку атом углерода намного меньше атома железа, атомы углерода могут занимать «дыры», промежутки в решетке атомов железа.
Атомы углерода называются межузельными атомами, в данном случае межузельными атомами углерода, и показаны красными кружками на диаграмме справа, а атомы железа показаны большими черными кружками.
В твердом растворе углеродистой стали железо является растворителем, а углерод — растворенным веществом.
Углеродистая сталь производится путем добавления примерно 1% углерода к железу.
Другими словами, каждые 100 г углеродистой стали содержат 1 г углерода и 99 г железа.
| Состав 100 г углеродистой стали | ||
|---|---|---|
| элемент | % | масса (г) =% × масса стали (г) |
| угольный | 1% | 1% × 100 = 1 / 100 × 100 = 1 г |
| утюг | 99% | 99% × 100 = 99 / 100 × 100 = 99 г |
Поскольку мы знаем массу углерода и железа, составляющих образец углеродистой стали, мы можем вычислить соотношение атомов углерода и железа, присутствующих в решетке.
Предположим, у нас есть 100-граммовый образец углеродистой стали:
| м / г | M r / г моль -1 | н / моль n = м ÷ M r | N / атомы N = n × N A | отношение атомов | |
|---|---|---|---|---|---|
| угольный | 1,00 | 12,01 | 1.00 ÷ 12,08 = 0,0833 | 0,0833 × 6,02 × 10 23 = 5,01 × 10 22 | (5,01 × 10 22 ) ÷ (5,01 × 10 22 ) = 1 |
| утюг | 99,00 | 55,85 | 99,00 ÷ 55,85 = 1,773 | 1,773 × 6,02 × 10 23 = 1,067 × 10 24 | (1,067 × 10 24 ) ÷ (5.01 × 10 22 ) = 21,30 |
Отношение атомов углерода к атомам железа составляет примерно 1:21.
То есть на каждый 21 атом железа в решетке приходится 1 атом углерода.
Межузельные атомы углерода делают решетку металла более жесткой, уменьшая пластичность и пластичность.
Углеродистая сталь намного тверже железа.
Бронза: замещающий сплав
Медный век (3200-2300 гг. До н. Э.C.) назван так из-за того, что из-за того, что из меди все чаще появляются человеческие артефакты.
Но медь — мягкий металл, поэтому она легко подвергается вмятинам и коррозии. Один из способов сделать медь более твердой и устойчивой к коррозии — это добавить олово, и этот сплав известен как бронза.
Бронза была впервые произведена людьми около 5000 лет назад, что сделало ее первым искусственным сплавом и дало название бронзовому веку (3200-1000 до н.э.).
В таблице ниже сравниваются размеры атомов олова и меди:
| атом | радиус / Å | вылет / м | передаточное отношение радиуса | объем / м 3 | объемное соотношение | |
|---|---|---|---|---|---|---|
| банка | 1.4 | 1,40 × 10 -10 | 1,15 | 1,15 × 10 -29 | 1,5 | |
| медь | 1,22 | 1,22 × 10 -10 | 1 | 7,6 × 10 -30 | 1 |
Из таблицы видно, что радиус атома олова равен 1.В 15 раз больше радиуса атома меди, то есть радиус атома олова лишь немного больше радиуса атома меди.
Это означает, что объем пространства, занимаемого атомом олова, также немного больше (в 1,5 раза), чем объем пространства, занимаемого атомом меди.
Поскольку атомы олова и меди одинакового размера, атомы олова могут замещать некоторые атомы меди в металлической решетке.
На диаграмме справа атомы меди представлены черными кружками, а красные кружки представляют атомы олова, которые заменили некоторые из атомов меди.
В твердом растворе бронзы медь является растворителем, а олово — растворенным веществом.
Бронза — это сплав, состоящий из 70-90% меди и 30-10% олова.
Состав бронзы из оружейного металла представлен ниже:
| Элемент | % по массе | элемент массы =% & умноженная на массу бронзы Для 100-граммового образца бронзы: |
|---|---|---|
| банка | 10% | 10 / 100 × 100 = 10 г |
| медь | 90% | 90 / 100 × 100 = 90 г |
Мы можем использовать эти данные для расчета отношения атомов олова к меди в бронзе из пушечного металла:
| м / г | M r / г моль -1 | н / моль n = м ÷ M r | N / атомы N = n × N A | отношение атомов | |
|---|---|---|---|---|---|
| банка | 10.00 | 118,7 | 10,00 ÷ 118,7 = 0,08425 | 0,08425 × 6,02 × 10 23 = 5,072 × 10 22 | (5,072 × 10 22 ) ÷ (5,072 × 10 22 ) = 1 |
| медь | 90,00 | 63,55 | 90,00 ÷ 63,55 = 1,416 | 1,416 × 6,02 × 10 23 = 8.526 × 10 23 | (8,526 × 10 23 ) ÷ (5,072 × 10 22 ) = 16,81 |
Соотношение атомов олова и меди составляет примерно 1:17.
По сравнению с исходной решеткой из чистой меди только 1 из каждых 18 атомов меди был замещен атомом олова.
Мы можем оценить влияние этого на плотность сплава.
Рассмотрим 100 г бронзы оружейного металла.Из них 10 г олова, 90 г — меди. Плотность чистого олова и чистого известна:
| элемент | плотность / г см -3 |
|---|---|
| банка | 7,31 |
| медь | 8,96 |
Поскольку плотность = масса (г) ÷ объем (см 3 ), мы можем изменить это уравнение, чтобы найти объем (см 3 ):
| плотность | = | масса объем |
| умножьте обе части уравнения на объем | ||
| плотность × объем | = | масса × |
| , что дает | ||
| плотность × объем | = | масса |
| разделите обе части уравнения на плотность | ||
| | = | масса плотность |
| так | ||
| объем | = | масса плотность |
Теперь мы можем рассчитать объем пространства, занимаемого 10 г олова и 90 г меди в бронзовом сплаве 7 :
| элемент | плотность / г см -3 | масса / г | объем / см 3 (= масса / плотность) |
|---|---|---|---|
| банка | 7.31 | 10 | 10 ÷ 7,31 = 1,4 |
| медь | 8,96 | 90 | 90 ÷ 8,96 = 10 |
Затем можно рассчитать плотность сплава:
| плотность сплава = | масса сплава объем сплава |
| плотность сплава = | масса меди + масса олова объем меди + объем олова |
| плотность сплава = | 10 + 90 1.4 + 10 |
| плотность сплава = | 100 11,4 |
| плотность сплава = | 8,8 г см -3 |
Мы видим, что плотность бронзы из оружейного металла лишь немного меньше плотности чистой меди.
Мы обнаружили, что есть другие физические свойства сплава, такие как температура плавления, которые находятся где-то между одинаковыми свойствами для каждого из чистых металлов:
| Вещество | точка плавления / ° C |
|---|---|
| банка | 232 |
| медь | 1803 |
| бронза | 950 |
Заменяя некоторые атомы меди на олово в решетке, мы получаем сплав, бронзу, которая тверже меди и имеет более низкую плотность и температуру плавления, чем медь, что облегчает литье.
Поскольку олово и медь являются металлами, металлические связи удерживают решетку вместе, поэтому сплав продолжает проявлять типичные металлические свойства — пластичность и податливость.
Бронза обычно окисляется только поверхностно, то есть атомы меди окисляются до оксида меди, который образует защитный слой на поверхности, предотвращающий дальнейшее окисление.
По этой причине, а также из-за того, что бронзу легко лить, из нее изготавливали статуи, монеты, колокольчики и тарелки.Бронза также довольно устойчива к коррозии морской водой, поэтому ее до сих пор используют для изготовления гребных винтов.
Бронза также используется для подшипников, потому что у нее очень низкое трение металл о металл, например, размещение небольших бронзовых шариков между двумя движущимися стальными деталями уменьшит трение между поверхностями, что снижает износ стальных деталей.
Латунь: замещающий сплав
Еще один способ сделать мягкий медный металл более твердым — это добавить цинк.Сплав, состоящий из меди и небольшого количества цинка, известен как латунь.
Атомы меди и цинка имеют одинаковые размеры:
| атом | радиус / Å | вылет / м | передаточное отношение радиуса | объем / м 3 | объемное соотношение | |
|---|---|---|---|---|---|---|
| цинк | 1.20 | 1,20 × 10 -10 | 0,98 | 7,24 × 10 -30 | 0,95 | |
| медь | 1,22 | 1,22 × 10 -10 | 1 | 7,61 × 10 -30 | 1 |
Из таблицы видим, что радиус атома цинка равен 0.В 98 раз больше радиуса атома меди, то есть атом цинка имеет лишь немного меньший радиус, чем атом меди.
Объем пространства, занимаемого атомом цинка, в 0,95 раза больше объема пространства, занимаемого атомом меди, то есть два атома занимают одинаковый объем пространства.
Следовательно, атомы цинка могут замещать некоторые атомы меди в металлической решетке.
На схеме справа атомы меди показаны черными кружками, а красные кружки представляют атомы цинка.
В твердом растворе латуни растворителем является медь, а растворенным веществом — цинк.
Состав обычной желтой латуни представлен ниже:
| Элемент | % по массе | m (элемент) =% & times m (латунь) Для 100 г образца латуни: |
|---|---|---|
| медь | 67% | 67 / 100 × 100 = 67 г |
| цинк | 33% | 33 / 100 × 100 = 33 г |
Мы можем использовать эти данные для расчета отношения атомов цинка к меди в обычной желтой латуни:
| м / г | M r / г моль -1 | н / моль n = м ÷ M r | N / атомы N = n × N A | отношение атомов | |
|---|---|---|---|---|---|
| цинк | 33.00 | 65,38 | 33,00 ÷ 65,38 = 0,5047 | 0,5047 × 6,02 × 10 23 = 3,04 × 10 23 | (3,04 × 10 23 ) ÷ (3,04 × 10 23 ) = 1 |
| медь | 67,00 | 63,55 | 67,00 ÷ 63,55 = 1,0543 | 1,0543 × 6,02 × 10 23 = 6.35 × 10 23 | (6,35 × 10 23 ) ÷ (3,04 × 10 23 ) = 2,1 |
Соотношение атомов цинка и меди составляет примерно 1: 2.
То есть на 1 атом цинка приходится 2 атома меди, или, другими словами, одна треть всех атомов в решетке — это атомы цинка, а другие две трети — атомы меди.
Мы можем оценить влияние этого на плотность сплава, рассчитав объем пространства, занимаемого 33 г цинка и 67 г меди в латунном сплаве:
| элемент | плотность / г см -3 | масса / г | объем / см 3 (= масса / плотность) |
|---|---|---|---|
| цинк | 7.13 | 33 | 33 ÷ 7,13 = 4,63 |
| медь | 8,96 | 67 | 67 ÷ 8,96 = 7,48 |
Затем можно рассчитать плотность сплава:
| плотность сплава = | масса сплава объем сплава |
| плотность сплава = | масса меди + масса цинка объем меди + объем цинка |
| плотность сплава = | 33 + 67 4.63 + 7,48 |
| плотность сплава = | 100 12,11 |
| плотность сплава = | 8,3 г см -3 |
Плотность обычной желтой латуни находится между цинком и медью.
Мы обнаружили, что есть другие физические свойства сплава, такие как температура плавления, которые находятся где-то между одинаковыми свойствами для каждого из чистых металлов:
| Вещество | точка плавления / ° C |
|---|---|
| цинк | 420 |
| медь | 1803 |
| латунь | 900 |
Добавив цинк к решетке меди, мы создали сплав, который менее плотен, чем медь, и имеет более низкую температуру плавления, чем медь, что облегчает литье, чем медь.
Латунь более пластична, чем цинк или бронза (сплав меди и олова), что означает, что ее можно раскалывать в листы и сгибать в разные формы, что делает ее идеальной для использования в музыкальных инструментах.
Чистая медь мягкая, чистый цинк тоже мягкий, но латунный сплав тверже, чем медь или цинк.
Поскольку латунь — это привлекательный сплав с блестящим золотым внешним видом и низким трением металла о металл, она использовалась в замках, механизмах, клапанах и гильзах для боеприпасов.
1 Сплавы могут состоять более чем из 2 элементов. Тройной сплав состоит из трех элементов, четвертичный сплав состоит из 4 элементов, а пятеричный сплав состоит из 5 элементов.
2 Гомогенный раствор металла будет иметь ту же структуру кристаллической решетки, что и один из элементов, составляющих сплав.
Сплав не обязательно должен быть однородным.
Если сплав имеет кристаллическую решетку, отличную от кристаллической решетки элементов, составляющих сплав, то он называется интерметаллическим.Если сплав вообще не имеет регулярной кристаллической структуры, его называют гетерогенным, например, припой, состоящий примерно на 50% из свинца, а на 50% из олова, является гетерогенным сплавом.
3 Первичный металл также может упоминаться как основа или матрица.
4 Мы собираемся игнорировать природу этой решетки во время этого обсуждения.
Приведено представление для наиболее компактной упаковки атомов в 2-х измерениях.
5 Ковалентные радиусы используются в этом обсуждении.
Атомный радиус обычно измеряется в ангстремах (Å).
1 Å = 1 × 10 -10 м
6 Предполагая, что атомы сферические, V = 4 / 3 πr 3
7 Мы предполагаем аддитивность объемов для выполнения этого расчета.
чистых веществ, смесей и растворов, о боже! —
Этот урок поможет студентам различать чистые вещества и смеси.Студенты смогут идентифицировать элементы и соединения как примеры чистых веществ. Студенты также смогут различать гомогенные (растворы) и гетерогенные смеси.
Общая информация
Предмет (и): Наука
Уровень (и): 8
Предлагаемая технология:
Документ-камера, компьютер для докладчика, ЖК-проектор
Время обучения:
1 час 30 минут
Ключевые слова: чистое вещество , смесь, гомогенная смесь, гетерогенная смесь
Этот ресурс требует, чтобы вы вошли в iCPALMS.Пожалуйста, войдите в систему, используя раздел «Вход» вверху, затем повторите попытку
Простите! Для этого ресурса требуется специальное разрешение, и только определенные пользователи имеют к нему доступ в настоящее время.
Содержание урока
Шаблон плана урока:
Общий план урока
Цели обучения: Что студенты должны знать и уметь делать в результате этого урока?
Студенты смогут различать чистые вещества и смеси, в том числе растворы.
Предыдущие знания: Какие предварительные знания должны быть у учащихся для этого урока?
Изучите и определите материалы, которые будут растворяться в воде, и те, которые не будут растворяться, и определите условия, которые ускорят или замедлят процесс растворения.(SC.5.P.8.2)
Продемонстрируйте и объясните, что смеси твердых тел можно разделить на основе наблюдаемых свойств их частей, таких как размер, форма, цвет и магнитное притяжение частиц. (SC.5.P.8.3)
Наводящие вопросы: Какие наводящие вопросы для этого урока?
Направляющий вопрос этого урока будет: «В чем разница между чистым веществом и смесью?» Возможные ответы учащихся включают, но не ограничиваются:
- Смесь представляет собой комбинацию, а чистое вещество — нет.
- Чистое вещество (соединения) нельзя разделить физически, а смесь — можно.
- Смеси химически не объединяются, но чистые вещества могут объединяться.
- Раствор является примером смеси.
- Есть два типа смесей: гетерогенные смеси и гомогенные смеси.
- Элементы и соединения являются примерами чистых веществ.
Этап обучения: Как учитель представит ученикам концепцию или навык?
Концепция будет представлена студентам через презентацию PowerPoint и демонстрацию Lego.
Слайды 8 — Этот слайд будет служить сигналом к началу демонстрации Lego.
Шаг 1: Возьмите одноцветный конструктор Lego.
- Объясните ученикам, что это одноцветное Lego представляет собой элемент.
- Это пример элемента (чистого вещества).
Шаг 2: Возьмите еще четыре лего того же цвета.
- Объясните ученикам, что это пример чистой субстанции, потому что Лего однородны и не могут быть физически разделены.
- Это все еще пример элемента (чистого вещества).
Шаг 3: Возьмите три Lego разных цветов, чем на шаге 1, и смешайте их вместе.
- Спросите студентов, является ли это все еще примером чистого вещества.
- Объясните ученикам, что это стало смесью, потому что она больше не однородна (теперь присутствуют два разноцветных лего) и ее можно физически разделить (на две разные цветовые группы).
- Это пример смеси элементов.
Шаг 4: Создайте одно соединение, соединив два синих Лего и одно белое Лего.
- Объясните студентам, что это пример соединения и что соединения также являются примерами чистых веществ.
- Это пример соединения (чистого вещества).
Шаг 5: Создайте еще три таких же компаунда, как на шаге 4, и смешайте их вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните студентам, что, поскольку соединения однородны и не могут быть разделены на разные соединения, они по-прежнему считаются чистым веществом.
- Это все еще пример соединения (чистого вещества).
Шаг 6: Создайте два соединения, соединив два оранжевых Lego и два зеленых Lego вместе, и смешайте их вместе с соединениями из шага 5.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это стало смесью, потому что она больше не является однородной (теперь присутствуют два разных соединения с рисунком) и его можно физически разделить (на две разные группы с рисунком).
- Это пример смеси соединений.
Шаг 7: Объединение элементов и соединений, созданных на шагах 1-6, вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это смесь, потому что она неоднородна (в ней есть разные типы элементов и соединений) и ее можно физически разделить (на разные группы элементов и соединений).
Шаг 8: Продолжайте шаги 1-7, чтобы представить дополнительные примеры этой абстрактной концепции, пока учащиеся не начнут чувствовать себя комфортно с концепцией.Затем перейдите к нескольким следующим слайдам, чтобы проверить их понимание.
Практика под руководством: Какие действия или упражнения ученики будут выполнять под руководством учителя?
Студентам будет представлена информация через презентацию PowerPoint и демонстрацию Lego, а также они будут отвечать на практические вопросы.
Самостоятельная практика: какие задания или упражнения студенты будут выполнять, чтобы закрепить концепции и навыки, полученные на уроке?
Учащиеся будут делать свои собственные модели Lego, чтобы создавать образцы чистых веществ и смесей.Это произойдет после того, как учитель предоставит примеры каждой категории во время демонстрации Lego.
Ученики будут использовать конструкторы Lego, чтобы сделать следующие примеры:
- Элементы —
- Например: использование 1 одноцветного конструктора Lego.
- Соединения —
- Например: соединение двух лего одного цвета и одного лего другого цвета.
- Смеси элементов —
- Например: Смешивание нескольких цветных Lego (ни один из которых не соединен вместе)
- Смеси соединений —
- Например: соединение двух лего одного цвета и двух лего другого цвета.Затем смешайте это творение с ранее созданным составом.
- Смеси элементов и соединений —
- Например: объедините элементы и соединения, созданные на предыдущих шагах.
- Элементы —
Завершение: Как учитель будет помогать ученикам систематизировать знания, полученные на уроке?
По окончании урока учащиеся заполнят «Организатор сводной графики» на слайдах 40-42, чтобы систематизировать знания, полученные на уроке.
- Слайд 40-41 — Это дает учителю и ученику возможность увидеть, могут ли они различать чистые вещества и смеси.
- Слайд 42 — Этот слайд дает учащимся последний шанс провести самооценку, считают ли они, что они понимают концепцию.
Суммарная оценка
В следующем классе будет выпущена мини-викторина, в которой учащийся оценит способность успешно различать чистые вещества и смеси.Мини-викторина и ключ для ответа находятся во вложении.
Формирующее оценивание
Учитель будет использовать презентацию PowerPoint для проведения формирующего оценивания.Практические вопросы «Элементы, соединения и смеси» на слайдах 10–14 и практические вопросы «Примеры из реальной жизни» на слайде 16-27 будут служить в качестве формирующих оценок для проверки понимания учащимися и определения необходимости дальнейшей помощи.
Обратная связь с учениками
Обратная связь с учениками будет происходить на этапе обучения и во время наблюдения за выполнением учениками практических вопросов «Элементы, соединения и смеси» и «Примеры из реальной жизни».
Размещение и рекомендации
-
Размещение:
Пересмотрите IEP учащихся, чтобы получить соответствующие индивидуальные приспособления, соответствующие этому уроку.Тем не менее, общие условия проживания будут включать:
- Расширенное время; и
- Небольшие группы / совместные группы
-
Extensions:
Возможное расширение этого урока будет включать в себя то, что учащиеся предложат свое собственное объяснение различий между чистыми веществами и смесями и примеры каждого из них.
-
Предлагаемые технологии: документ-камера, компьютер для докладчика, ЖК-проектор -
Необходимые специальные материалы:
Фаза обучения:
- Презентация — Чистые вещества, смеси и растворы — Oh My!
Демонстрация Lego:
Суммативная оценка:
-
Дополнительные рекомендации:
Процедуры:
Управляемый вопрос: Учитель начнет с того, что попросит класс устно ответить на следующий управляемый вопрос: «В чем разница между чистым веществом и смесями?»
Презентация PowerPoint: Затем учитель начнет урок, используя подготовленную презентацию PowerPoint:
- Слайды 1-7 — Эти слайды следует использовать на этапе обучения.Они обеспечивают характеристики чистых веществ, гомогенных смесей, гетерогенных смесей и растворов. Это предоставит студентам справочную информацию, необходимую для успешного понимания теста.
Лего демонстрация
- Слайды 8 — Этот слайд послужит сигналом к началу демонстрации Lego.
- Шаг 1: Возьмите одноцветный Lego.
- Объясните ученикам, что это одноцветное Lego представляет собой элемент.
- Это пример элемента (чистого вещества).
- Шаг 2: Возьмите еще четыре Legos того же цвета.
- Объясните ученикам, что это пример чистой субстанции, потому что Лего однородны и не могут быть физически разделены.
- Это все еще пример элемента (чистого вещества).
- Шаг 3: Возьмите объекты разных цветов, чем на шаге 1, и смешайте их вместе.
- Спросите студентов, является ли это все еще примером чистого вещества.
- Объясните ученикам, что это стало смесью, потому что она больше не однородна (теперь присутствуют два разноцветных лего) и ее можно физически разделить (на две разные цветовые группы).
- Это пример смеси элементов.
- Шаг 4: Создайте одно соединение, соединив два синих Lego и одно белое Lego.
- Объясните студентам, что это пример соединения и что соединения также являются примерами чистых веществ.
- Это пример соединения (чистого вещества).
- Шаг 5: Создайте еще три таких же компаунда, как на шаге 4, и смешайте их вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните студентам, что, поскольку соединения однородны и не могут быть разделены на разные соединения, они по-прежнему считаются чистым веществом.
- Это все еще пример соединения (чистого вещества).
- Шаг 6: Создайте два соединения, соединив два оранжевого легиона и два зеленых легкого, и смешайте их вместе с соединениями из шага 5.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это стало смесью, потому что она больше не является однородной (теперь присутствуют два разных соединения с рисунком) и его можно физически разделить (на две разные группы с рисунком).
- Это пример смеси соединений.
- Шаг 7: Объединение элементов и соединений, созданных на шагах 1-6, вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это смесь, потому что она неоднородна (в ней есть разные типы элементов и соединений) и ее можно физически разделить (на разные группы элементов и соединений).
- Шаг 8: Продолжайте шаги 1-7, чтобы представить дополнительные примеры этой абстрактной концепции, пока учащиеся не начнут чувствовать себя комфортно с концепцией. Затем перейдите к нескольким следующим слайдам, чтобы проверить их понимание.
- Шаг 1: Возьмите одноцветный Lego.
Практические вопросы по элементам, соединениям и смесям
- Слайды 9-14 — Эти слайды будут служить «проверкой здоровья», чтобы увидеть, поняли ли ученики демонстрацию Lego.
- Слайд 15 — Этот слайд дает учащимся возможность провести самооценку, считают ли они, что они понимают абстрактную концепцию.
Примеры из реальной жизни Практические вопросы
- Слайды 16-27 — Эти слайды будут использоваться в качестве формирующих оценок. Предыдущее формирующее оценивание оценивало понимание студентами абстрактной концепции элементов, соединений и смесей. Эта формирующая оценка позволит оценить, способны ли студенты применить эти абстрактные знания на примерах из реальной жизни.
- Слайды 28-38 — Эти слайды будут использоваться для обзора ответов на формирующее оценивание. Это будет шанс для учителя высказать мнение ученика о том, почему ответ правильный или неправильный.
- Слайд 39 — Этот слайд дает учащимся еще одну возможность провести самооценку, считают ли они, что они понимают концепцию.
Графический органайзер сводной информации
- Slide 40-41 — Это дает учителю и ученику возможность увидеть, могут ли они различать чистые вещества и смеси.
- Слайд 42 — Этот слайд дает учащимся последний шанс провести самооценку, считают ли они, что они понимают концепцию.
Информация об источнике и доступе
Добавил:
Сэнди Люнг
Имя автора / источник: Sandy Leung
Район / организация авторов: Broward
Права доступа: Общедоступный
* Обратите внимание, что примеры ресурсов не являются полной учебной программой.
Согласованные стандарты
Этот проверенный ресурс соответствует концепциям или навыкам в этих тестах.
Связанные ресурсы
Другие проверенные ресурсы, связанные с этим ресурсом.
Поздравления
Вы успешно создали учетную запись.
Ссылка для подтверждения была отправлена на вашу электронную почту
.Пожалуйста, проверьте свою электронную почту
и щелкните ссылку, чтобы подтвердить свой адрес электронной почты и полностью активировать свою учетную запись iCPALMS.
Пожалуйста, проверьте папку со спамом.
Вы не ввели данные своего профиля. Пожалуйста, уделите несколько минут, чтобы заполнить раздел ниже, чтобы мы могли настроить ваш опыт CPALMS.
При создании учетной записи произошла ошибка. Обратитесь в службу поддержки [email protected] за помощью.
Чистая субстанция is_
Чистая субстанция, единственное, что удерживает ее в мире. Это четко определенное химически чистое вещество, состоящее из шести связанных единиц глюкозы. Это потому, что 1 часть в 1 является этим чистым веществом. Ответ — нет, не для макроскопических количеств почти чистого вещества.По определению, свойства смешивания связаны со свойствами чистого …
Чистые вещества включают элементы и соединения. Разбить чистые вещества на части гораздо сложнее, и для этого нужны сложные химические методы. Мы можем использовать точки плавления и кипения, а также хроматографию для проверки чистых веществ. Чистые вещества имеют четко определенную (одну температуру) точку плавления или кипения …
Чистые вещества встречаются редко. Например, растворенный сахар можно отделить от раствора с помощью какого-либо физического процесса (испарения или дистилляции).Однако сахар сам по себе является веществом и не может быть разделен на его составляющие с помощью физических процессов.
Чистое вещество классифицируется как • вещество с определенным и постоянным составом. • элемент, когда он состоит из одного типа атомов. • соединение, состоящее из двух или более элементов, объединенных в определенном соотношении. Чистые вещества
26 апреля 2017 г. · Попкорн, приготовленный из одного вида кукурузы, в который ничего не добавлено, будет чистым веществом, если вы считаете, что попкорн — это вещество.Однако сам попкорн состоит из множества разных веществ. Так что ответ будет либо да, либо нет, в зависимости от того, о чем вы говорите.
планы на будущее. Как и в углекислом газе, углекислый газ является обильным побочным продуктом … За исключением того, что, в отличие от коммунального предприятия, CO2 в New Belgium почти чистый, идеально подходит для …
Чистые вещества имеют однородный химический состав. Примеры включают воду (жидкость), алмаз (твердое тело) и кислород (газ). В химии чистое вещество — это материал с постоянным составом.Другими словами, он однороден независимо от того, когда вы его пробуете. Чистое вещество целиком состоит из .

 Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара. Через поры фильтра проходят лишь соизмеримые с
Через поры фильтра проходят лишь соизмеримые с
 В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения
В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения