Содержание
Классификация газов — окислители, инретные и нейтральные газы
КЛАССИФИКАЦИЯ ГАЗОВ
Простейшая классификация газов такова:
Окислители: сами по себе газы не горючие, но отлично поддерживают горение в качестве окислителя. Жир или смазка в комбинации с сильными окислителями представляют собой самовоспламеняющуюся (взрывоопасную) комбинацию.
Наиболее распространенные окислители:
- Воздух
- Двуокись азота NO2
- Кислород
- Окись азота NO
- Фтор
- Хлор
Нейтральные газы: не поддерживают горение и не горят. Кроме того, они не вступают в реакцию с обычными материалами. Если в помещение подать некоторый объем нейтрального газа, то таким образом, за счет вытеснения кислорода, можно серьезно ограничить процесс горения. Отличная замена воде в системах пожаротушения для применений, где использование воды недопустимо ( например, установки под напряжением и т. д.).
д.).
Наиболее распространенные нейтральные газы :
- Азот
- Аргон
- Гелий
- Ксенон
- Неон
- Углекислый газ (CO2) — (не путать с СО = угарный газ)
Горючие газы: в смеси с воздухом или кислородом возгораются или взрываются при соответствующей концентрации смеси. Если смесь слишком богатая или бедная, то воспламенения не произойдет.
Наиболее распространенные горючие газы:
- Аммиак
- Арсин
- Ацетилен
- Бутан
- Водород
- Угарный газ (Моноксид углерода)
- Метан
- Пропан
- Пропилен
- Силан
- Холодильный агент R160, хлористый этил
- Холодильный агент R600a, изобутан;
- Холодильный агент R40, хлористый метил;
- Циклопропан (наркоз)
- Этан
- Этилен
ЕГЭ.
 Правила составления окислительно-восстановительных реакций (железо)
Правила составления окислительно-восстановительных реакций (железо)
5. Химические свойства соединений железа с точки зрения изменения степеней окисления
Кратко:
| Окисление | Примеры окислителей |
| Fe+2 → Fe+3 | С солями-окислителями в кислой или щелочной среде. O2, Cl2, KMnO4, K2Cr2O7, HNO3, KNO2 |
| Fe0, Fe+2, Fe+3 → Fe+6 | В щелочной среде. KNO3, растворы Cl2, Br2, NaClO3 и др. |
| Восстановление | Примеры восстановителей |
| Fe+3 → Fe+2 | Соединения I–, S2–, SO32–, SO2, Cu, Fe и др. |
| Fe+6 → Fe+3 | Аммиак и др. |
Правила с примерами реакций:
Правило 5.1. Соединения Fe+3 восстанавливаются до Fe+2 в реакциях с такими восстановителями как I–, S–2, S+4 и некоторыми металлами:
Fe+3 и I– :
Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Fe2(SO4)3 + KI → 2FeSO4 + I2 + K2SO4
Fe+3 и S–2:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
(первоначально образующийся осадок FeS реагирует с HCl с образованием растворимого хлорида железа (II))
Fe+3 и S+4:
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + SO2 + 2H2O → 2FeCl2 + H2SO4 + 2HCl
Fe2(SO4)3 + Na2SO3 +H2O → 2FeSO4 + Na2SO4 + H2SO4
Fe+3 и металл:
2FeCl3 + Cu → CuCl2 + 2FeCl2
2Fe(NO3)3 + Fe → 3Fe(NO3)2
Правило 5. 2. Соединений Fe+6 восстанавливаются до Fe+3 в реакции с аммиаком:
2. Соединений Fe+6 восстанавливаются до Fe+3 в реакции с аммиаком:
2K2FeO4 + 2NH3 + 5H2SO4 → Fe2(SO4)3 + 2K2SO4 + N2 + 8H2O
Правило 5.3. Соединений Fe+2 окисляются до Fe+3 такими окислителями как оксид азота (IV), перманганат калия, нитриты металлов, азотная кислота и др.:
FeI2 + 6NO2 → Fe(NO3)3 + I2 + 3NO
2FeCl2 + Cl2 → 2FeCl3
В щелочной среде:
FeCl2 + KMnO4 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2FeSO4 + 2KMnO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
В кислой среде:
6FeCl2 + 2KNO2 + 4H2SO4 → 4FeCl3 + Fe2(SO4)3+ K2SO4 + N2 + 4H2O
6FeSO4 + 2HNO3(разб. ) + 3H2SO4 → 3Fe2(SO4)3 + 2NO + 4H2O
) + 3H2SO4 → 3Fe2(SO4)3 + 2NO + 4H2O
FeSO4 + HNO3(конц.) → Fe(NO3)3 + NO2 + H2SO4 + H2O
FeCl2 + 4HNO3(конц.) → Fe(NO3)3 + NO2 + 2HCl + H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
Fe3O4 + 10HNO3(конц.) → 3Fe(NO3)3 + NO2 + H2O
Правило 5. 4. Окисление соединений железа до степени окисления +6 (с образованием ферратов) возможно более сильными окислителями, такими как нитраты щелочных металлов в щелочной среде, хлораты в щелочной среде, раствор брома в щелочи и др:
4. Окисление соединений железа до степени окисления +6 (с образованием ферратов) возможно более сильными окислителями, такими как нитраты щелочных металлов в щелочной среде, хлораты в щелочной среде, раствор брома в щелочи и др:
Fe + 2KOH + 3KNO3 → K2FeO4+ 3KNO2 + H2O
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O (t)
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O (t)
2Fe(OH)3 + 3Br2 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O
2NaFeO2 + 3Na2O2 → 2Na2FeO4 + 2Na2O
2NaFeO2 + 3Br2 + 8NaOH(конц) → 2Na2FeO4 + 6NaBr + 4H2O.
Окислительно-восстановительные реакции — Химический элементарий
Многообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить ещё одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества. Например, в реакции
степени окисления атомов химических элементов после реакции не изменились. А вот в другой реакции — взаимодействие соляной кислоты с цинком
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк — с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону
а каждый атом цинка отдал два электрона
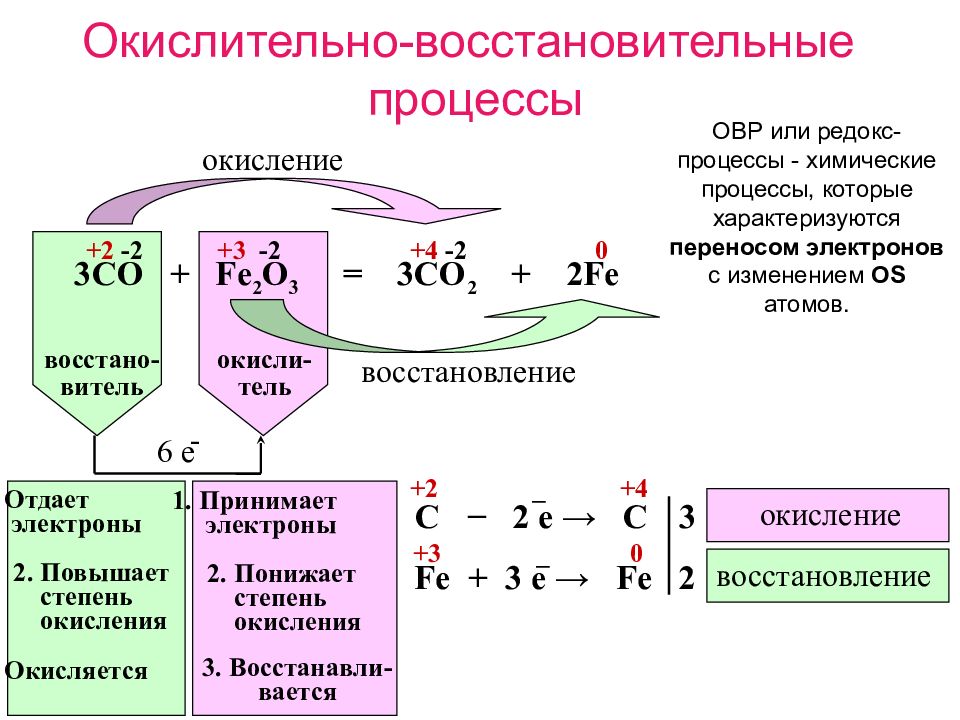
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями. |
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т. е. восстанавливаясь (Далее мы будем указывать степень окисления, а не заряды ионов, так как их численные значения совпадают.):
Электроны могут присоединяться и к положительным ионам, которые при этом превращаются в атомы:
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
| Атомы, ионы или молекулы, принимающие электроны, называют окислителями. |
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами. Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т. е. окисляются:
Отдавать электроны могут отрицательные ионы:
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
Можно отметить, что при этом степень окисления повышается.
| Атомы, ионы или молекулы, отдающие электроны, называют восстановителями. |
Окисление всегда сопровождается восстановлением и наоборот, т. е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме 2.
Схема 2
Процессы окисления и восстановления
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т. е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Рис. 146.
Схема окислительно-восстановительной реакции
Например, реакцию алюминия с хлоридом меди (II) описывают схемой (рис. 146):
а электронные уравнения будут иметь вид:
Молекулярное уравнение этой реакции написать уже несложно, так как коэффициенты для него будут взяты из электронных уравнений:
3CuCl2 + 2Аl = 2АlСl3 + ЗСu.
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Как вы помните, первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространялось на серную кислоту концентрированную и азотную кислоту любой концентрации.
В отличие от соляной кислоты, в которой окислителем атомов металла были катионы водорода, в концентрированной серной и азотной кислотах окислителями являются атомы серы и азота из сульфат-ионов и нитрат-ионов. Поэтому концентрированная H2SO4 и HNO3 любой концентрации взаимодействуют с металлами, стоящими в ряду напряжений как до водорода, так и после него, восстанавливаясь при этом до SO2, NO и т. д. Например, при взаимодействии разбавленной азотной кислоты с медью получается нитрат меди (II), оксид азота (II) и вода. Запишем формулы исходных веществ и продуктов реакции с указанием степеней окисления:
д. Например, при взаимодействии разбавленной азотной кислоты с медью получается нитрат меди (II), оксид азота (II) и вода. Запишем формулы исходных веществ и продуктов реакции с указанием степеней окисления:
Подчеркнём знаки химических элементов, изменивших свои степени окисления:
Составим электронные уравнения, т. е. отразим процессы отдачи и присоединения электронов:
Запишем коэффициент 3 перед и перед формулой нитрата меди (II), в котором , так как с такими значениями степеней окисления медь встречается по одному разу. Коэффициент 2 запишем только перед формулой вещества с , так как это значение степени окисления для азота в схеме реакции встречается только один раз, а вот перед HNO3 коэффициент 2 не запишем, ибо встречается ещё раз в формуле Cu(NO3)2. Наша запись примет вид:
Теперь уравняем число атомов азота. После реакции оно равно 3 × 2 = 6 из Cu(NO3)2 и ещё 2 атома из 2NO, всего 8.
Поэтому перед HNO3 запишем коэффициент 8:
8HNO3 + ЗСи → 3Cu(NO3)2 + 2NO + Н2O
и уравняем число атомов водорода:
8HNO3 + ЗСu → 3Cu(NO3)2 + 2NO + 4Н2O.
Проверим правильность расстановки коэффициентов, подсчитав число атомов кислорода до и после реакции: до реакции — 24 атома и после реакции — 24 атома. Коэффициенты расставлены правильно, поэтому заменим в уравнении стрелку на знак равенства:
8HNO3 + ЗСu = 3Cu(NO3)2 + 2NO + 4Н2O.
Зная формулу вещества и определив степени окисления атомов химических элементов в нём, нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом: окислительные или восстановительные. Например, азот в азотной кислоте имеет максимальное значение степени окисления +5, т. е. он «потерял» все электроны, поэтому в азотной кислоте будет проявлять только окислительные свойства. Азот в аммиаке имеет минимальное значение степени окисления -3, т. е. он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
Азот в аммиаке имеет минимальное значение степени окисления -3, т. е. он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
Другой пример — оксид азота (II) . Азот в этом соединении имеет промежуточное значение степени окисления и поэтому может проявлять как окислительные (например: ), так и восстановительные (например: ) свойства.
Приведём примеры важнейших восстановителей и окислителей.
Восстановители: активные металлы, водород, уголь, оксид углерода (II) СО, сероводород H2S, аммиак NH3 и т. д.
Окислители: кислород, галогены; азотная HN03 и серная H2SO4 кислоты, перманганат калия КМnO2 и др.
Проверьте, как вы поняли материал:
Если у вас остались вопросы, посмотрите видеоурок:
Ключевые слова и словосочетания
- Окислительно-восстановительные реакции.

- Окислитель и восстановитель; окисление и восстановление.
- Метод электронного баланса.
Вопросы и задания
- Какие из реакций, уравнения которых записаны ниже, относят к окислительно-восстановительным?
Для окислительно-восстановительных реакций укажите окислитель и восстановитель, процессы окисления и восстановления, составьте электронные уравнения.
- Дайте характеристику реакции синтеза аммиака по всем изученным вами признакам классификации химических реакций.
- Из следующих утверждений выберите истинные:
а) к окислительно-восстановительным будут относиться все реакции ионного обмена;
б) все реакции ионного обмена не будут являться окислительно-восстановительными;
в) все реакции замещения являются окислительно-восстановительными;
г) только некоторые реакции замещения являются окислительно-восстановительными реакциями;
д) к окислительно-восстановительным реакциям относят те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество;
е) все реакции разложения и соединения не являются окислительно-восстановительными.
 Обоснуйте свою точку зрения, докажите её примерами уравнений реакций.
Обоснуйте свою точку зрения, докажите её примерами уравнений реакций. - Согласны ли вы с утверждением, что HNO3 проявляет только окислительные свойства, a NH3 — только восстановительные? Ответ обоснуйте.
- Какое из веществ — сероводород H2S и серная кислота H2SO4 — проявляет только окислительные или только восстановительные свойства? Почему?
- Обоснуйте тезис, что SO2 может быть и окислителем, и восстановителем.
- Расставьте коэффициенты методом электронного баланса в следующих схемах реакций:
- Назовите окислитель в реакциях взаимодействия цинка с соляной и азотной кислотами. Для последней реакции используйте аналогию взаимодействия азотной кислоты с медью.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Кислоты — окислители | Дистанционные уроки
30-Авг-2018 | Нет комментариев | Лолита Окольнова
Давайте рассмотрим свойства
и продукты их реакций
Автор статьи — Саид Лутфуллин
Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
Pb + H2SO4 ≠
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:
Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до h3S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:
- Активные металлы восстанавливают серную кислоту до h3S:
8Li + 5H2SO4 конц → 4Li2SO4 + h3S ↑ + H2O
4Mg + 5H2SO4 конц → 4MgSO4 + h3S ↑ + H2O
- Металлы средней активности восстанавливают серную кислоту до S:
3Mn + 4H2SO4 конц → 3MnSO4 + S ↓ + 4H2O
3Zn + 4H2SO4 конц → t→ 3ZnSO4 + S ↓ + 4H2O
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Cu + 2H2SO4 конц → CuSO4 + SO2 ↑ + 2H2O
2Ag + 2H2SO4 конц → Ag2SO4 + SO2 ↑ + 2H2O
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:
2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
2P + 5H2SO4 конц → 2H3PO4 + 5SO2 ↑+ 2H2O
2B + 3H2SO4 конц → 2H3BO3 + 3SO2 ↑
Угольная кислота не образуется – получается углекислый газ:
C + 2H2SO4 конц → CO2 ↑ + 2SO2 ↑+ 2H2O
Концентрированная серная кислота окисляет серу:
3. Взаимодействие концентрированной серной кислоты с галогенидами.
Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
2KF тв + H2SO4 конц → K2SO4 + 2HF↑
2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:
А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
2HBr + H2SO4 конц → Br2 + SO2 ↑ + 2H2O
8HI + H2SO4 конц → 4I2 ↓+ H2S ↑ + 4H2O
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
4NH3+5O2 → кат., t°→ 4NO+6H2
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
2NO+O2→2NO2
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
NaNO3 тв + H2SO4 → t → NaHSO4 + HNO3 ↑
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
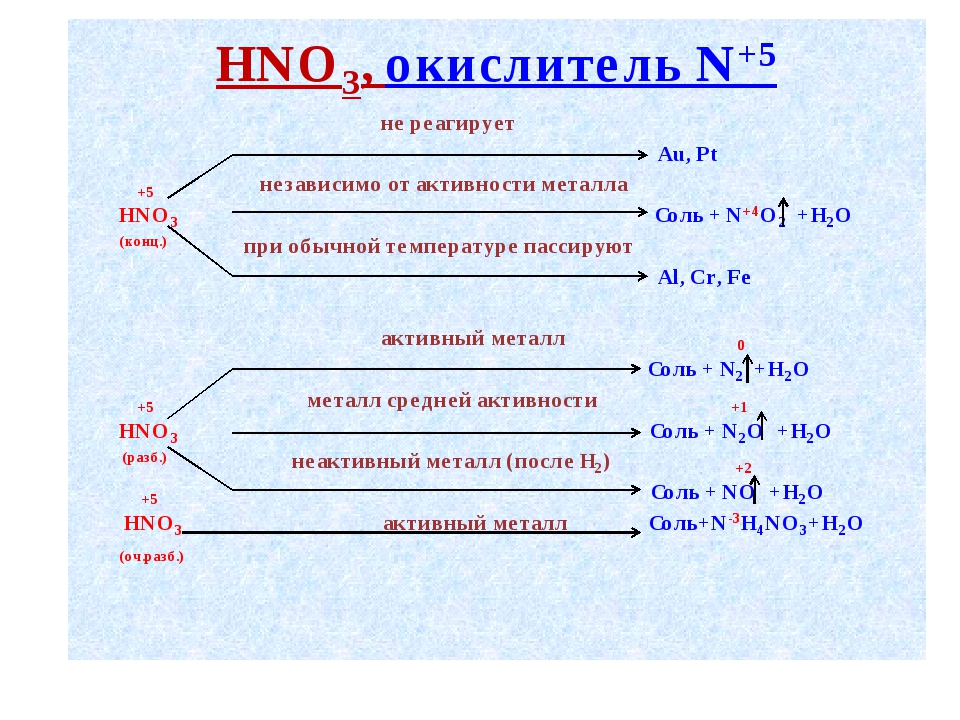
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:
Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.

Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – Nh5NO3.
4Ca + 10HNO3 разб → 4Ca(NO3)2 + NH4NO3 + 3H2O
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Cu + 4HNO3 конц → Cu(NO3)2 + 2NO2 ↑+ 2H2O
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N2O ↑ + 5H2O
3Cu + 8HNO3 разб → 3Cu(NO3)2 + 2NO ↑ + 4H2O
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.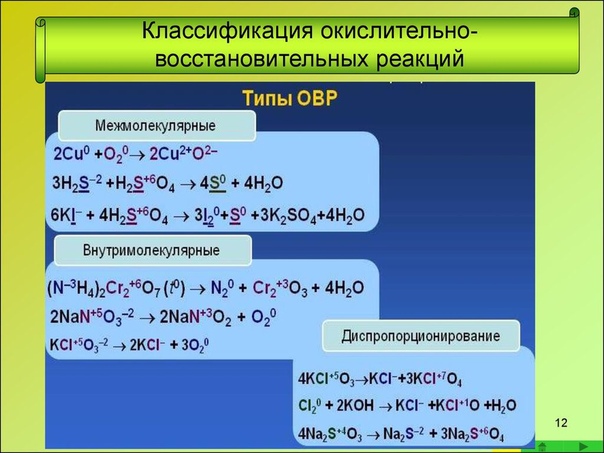
Чтобы провести реакцию нужно нагреть:
С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
I2 + 10HNO3 конц → t → 2HIO3 + 10NO2 ↑ + 4H2O
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
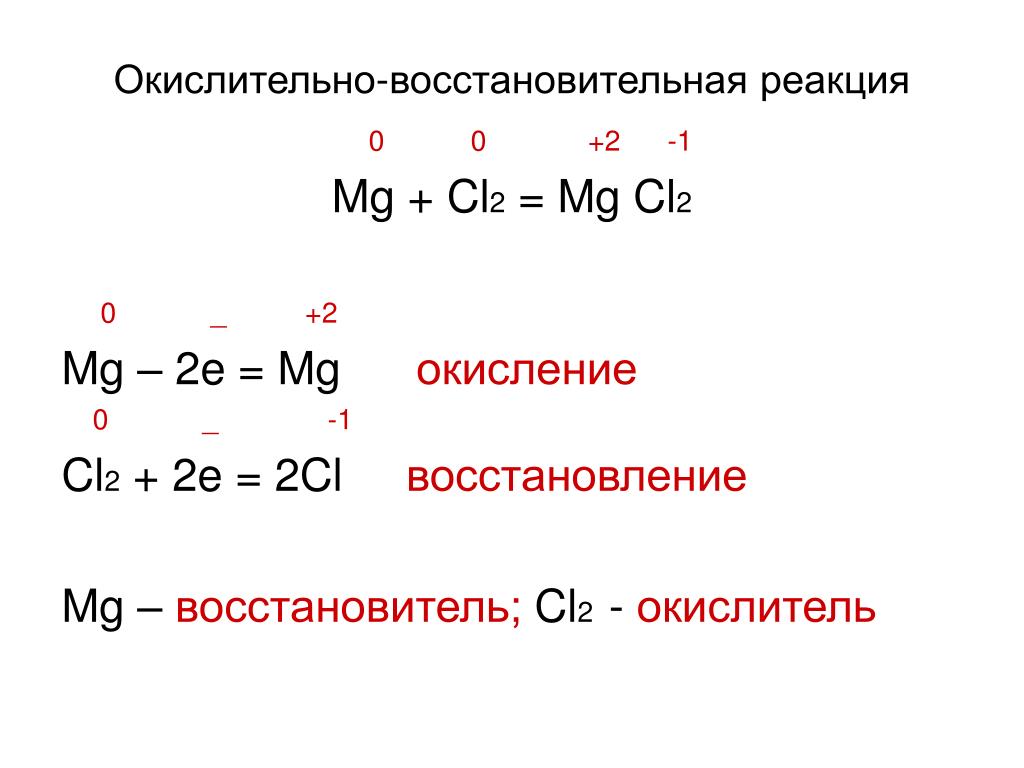
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
KF + HNO3 → HF + KNO3
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Еще на эту тему:
Обсуждение: «Кислоты — окислители»
(Правила комментирования)
Репетитор-онлайн — подготовка к ЦТ
Для расстановки коэффициентов в ОВР можно пользоваться способом, основанным на составлении схем процессов окисления и восстановления. Этот способ называется методом электронного баланса.
Суть метода электронного баланса состоит в следующем.
1. Составляют схему реакции и определяют элементы, которые изменили степень окисления.
2. Составляют электронные уравнения полуреакций восстановления и окисления.
3. Поскольку число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем, методом наименьшего общего кратного (НОК) находят дополнительные множители.
4. Дополнительные множители проставляют перед формулами соответствующих веществ (коэффициент 1 опускается).
5. Уравнивают числа атомов тех элементов, которые не изменили степень окисления (вначале — водород по воде, а затем — числа атомов кислорода).
Пример составления уравнения окислительно-восстановительной реакции
методом электронного баланса.
Находим, что атомы углерода и серы изменили степень окисления. Составляем уравнения полуреакций восстановления и окисления:
Для этого случая НОК равно 4, а дополнительными множителями будут 1 (для углерода) и 2 (для серной кислоты).
Найденные дополнительные множители проставляем в левой и правой частях схемы реакции перед формулами веществ, содержащих углерод и серу:
C + 2H2SO4 → CO2 + 2SO2 + H2O
Уравниваем число атомов водорода, поставив перед формулой воды коэффициент 2, и убеждаемся, что число атомов кислорода в обеих частях уравнения одинаковое. Следовательно, уравнение ОВР
Следовательно, уравнение ОВР
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
Возникает вопрос: в какую часть схемы ОВР следует поставить найденные дополнительные множители — в левую или правую?
Для простых реакций это не имеет значения. Однако следует иметь в виду: если определены дополнительные множители по левой части уравнения, то и коэффициенты проставляются перед формулами веществ в левой части; если же расчеты проводились для правой части, то коэффициенты ставятся в правой части уравнения. Например:
По числу атомов Al в левой части:
По числу атомов Al в правой части:
В общем случае, если в реакции участвуют вещества молекулярного строения (O2, Cl2, Br2, I2, N2), то при подборе коэффициентов исходят именно из числа атомов в молекуле:
Если в реакции с участием HNO3 образуется N2O, то схему электронного баланса для азота также лучше записывать исходя из двух атомов азота .
Наименование | Могут содержать |
Автомобили (мотор, мотоцикл) и автомобильные части | Двигатели, карбюраторы, топливные баки, в которых находится или находилось топливо, жидкостные батареи, сжатые газы в устройствах заполнения пневматиков газом, огнетушители, пневмоподушки. |
Аппаратура искусственного дыхания | Баллоны со сжатым воздухом или кислородом, генераторы кислорода, охлажденный сжиженный кислород. |
Аэростат, заполняемый горячим воздухом | Баллоны с легковоспламеняющимся газом, огнетушители, двигатели внутреннего сгорания, батареи |
Багаж пассажиров | Устройства для фейерверка, легковоспламеняющиеся хозяйственные жидкости, коррозионные вещества для чистки кухонных плит или канализации, легковоспламеняющийся газ или жидкостные заправочные элементы для зажигалок, баллоны для туристических плиток, боеприпасы, спички, отбеливающие материалы, аэрозоли. |
Баллоны | Сжатый или сжиженный газ. |
Буровое оборудование или оборудование для горных работ | Взрывчатые вещества. |
Вакцины | Сухой лед (твердая двуокись углерода). |
Водолазное снаряжение | Баллоны со сжатым газом (например, с воздухом или кислородом), высокоинтенсивные подводные лампы, которые могут выделять очень большое количество тепла при работе на открытом воздухе. Для безопасной перевозки такие лампы или батареи должны быть отключены. |
Выключатели электрического оборудования или приборов | Ртуть. |
Горелки | Микрогорелки и зажигалки общего назначения, которые могут содержать легковоспламеняющийся газ и быть оснащены . электронным зажигательным устройством, горелки более крупных размеров могут иметь наконечник (часто снабженный выключателем самовоспламенения), подсоединенный к контейнеру или баллону с легковоспламеняющимся газом. |
Детали машин | Легковоспламеняющиеся клеи, краски, герметические составы, растворители, жидкостные или литиевые батареи, ртуть, баллоны со сжатым или сжиженным газом. |
Диагностические пробы | Инфекционные вещества. |
Замороженные фрукты, овощи и т. д. | Сухой лед (твердая двуокись углерода). |
Замороженные эмбрионы | Сжиженный газ, сухой лед. |
Запасные части для воздушного судна, находящегося на земле (AOG) | Взрывчатые вещества (светящиеся или прочие пиротехнические), химические генераторы кислорода, неисправные пневматики в сборе, баллоны со сжатым газом (кислород, двуокись углерода или огнетушители), топливо в оборудовании, жидкостные или литиевые : батареи, спички. |
Командно-топливные агрегаты | Легковоспламеняющиеся жидкости |
Лабораторное/проверочное оборудование | Легковоспламеняющиеся жидкости, легковоспламеняющиеся твердые вещества, ; окислители, органические перекиси, токсические вещества, коррозионные вещества. |
Магнит и другие изделия из подобного материала | Намагниченный материал |
Медицинские препараты | Легковоспламеняющиеся жидкости, легковоспламеняющиеся твердые вещества, окислители, органические перекиси, токсические вещества, коррозионные вещества. |
Металлические ограждения | Ферромагнитный материал. |
Металлические трубы | Ферромагнитный материал. |
Металлический строительный материал | Ферромагнитный материал. |
Механизмы (машины) с электрическим приводом (кресла-каталки, газонокосилки, электрокары и т. д.) | Жидкостные батареи |
Несопровождаемый багаж пассажиров/личные вещи | Пиротехнические средства, легковоспламеняющиеся жидкости хозяйственного назначения, составы для очистки печей или водопроводных труб от ржавчины, легковоспламеняющийся газ, жидкие заправочные элементы, баллоны для туристских плиток, спички, аэрозоли. |
Оборудование киносъемочных групп и групп представителей и средств массовой информации | Взрывные пиротехнические устройства, генераторы, в состав которых входят двигатели внутреннего сгорания, жидкостные батареи, топливо, предметы, выделяющие тепло. |
Оборудование команд, участвующих в авто- или мотогонках | Двигатели, карбюраторы, топливные баки, в которых находится топливо или остатки топлива, жидкостные батареи, легковоспламеняющиеся аэрозоли, нитрометан или другие добавки к бензину, баллоны со сжатыми газами. |
Образцы для испытаний | Инфекционные вещества, легковоспламеняющиеся жидкости легковоспламеняющиеся твердые вещества, окислители, органические перекиси, токсические вещества, коррозионные вещества. |
Объединенные партии грузов (контейнеры) | Любые опасные грузы. |
Охлаждающая смесь (жидкая) | Аргон, гелий, неон, азот. |
Приборы | Барометры, манометры, ртутные выключатели, выпрямительные лампы, термометры, содержащие ртуть. |
Ремонтные комплекты | Перекиси, легковоспламеняющиеся клеи, краски, основанные на растворителях, смолы. |
Семенная жидкость | Сухой лед, сжиженный газ. |
Спец. изделия имущество | Любые опасные грузы. |
Стоматологическая аппаратура | Смолы, растворители, сжатый газ, сжиженный газ, ртуть, радиоактивный материал. |
Транспортный контейнер «сухого» типа | Свободный жидкий азот. |
Туристическое оборудование | Легковоспламеняющиеся газы (бутан, пропан и т.д.), легковоспламеняющиеся жидкости (керосин, бензин и т.д.), легковоспламеняющиеся твердые вещества (гексамин, спички и т.д.). |
Фармацевтические препараты | Радиоактивный материал, легковоспламеняющиеся жидкости, легковоспламеняющиеся твердые вещества, окислители, органические перекиси, токсические вещества, коррозионные вещества. |
Фотопринадлежности | Устройства, выделяющие тепло, легковоспламеняющиеся жидкости, легковоспламеняющиеся твердые вещества, окислители, органические перекиси, токсические вещества, коррозионные вещества. |
Химические вещества | Легковоспламеняющиеся жидкости, легковоспламеняющиеся твердые вещества, окислители, органические перекиси, токсические вещества, коррозионные вещества. |
Хозяйственные принадлежности | Краска, основанная на растворителях, клеи, полировальные материалы, аэрозоли, отбеливающие материалы, средства очистки печей или водосточных труб от ржавчины, боеприпасы, спички. |
Холодильники | Сжиженные газы, раствор аммиака. |
Экспедиционное оборудование | Взрывчатые вещества (сигнальные ракеты) легковоспламеняющиеся жидкости (газолин), легковоспламеняющийся газ. |
Электрическое оборудование | Намагниченные материалы ртуть в устройстве включения, электронные лампы, жидкостные батареи. |
Ящики для инструмента | Взрывчатые вещества (пистонные заклепки), сжатые газы, аэрозоли, легковоспламеняющиеся газы (баллоны с бутаном или горелки), легковоспламеняющиеся клеи, краски, коррозионные жидкости. |
Окислители II группы — Справочник химика 21
Ко второй группе топлив относятся топлива, жидкие компоненты которых (горючее и окислитель) при контакте не загораются, и для их воспламенения требуются специальные устройства. [c.116]
В элементах третьей группы работа ХИТ осуществляется благодаря подаче компонентов электрохимической реакции к электродам. Такие элементы могут работать без перерыва длительное время, лимитируемое потерей каталитических свойств элект )одов. Обычно на один из электродов (отрицательный) подается топливо, на другой (положительный)—окислитель, и в элементе происходит холодное электрохимическое сжигание топлива в виде двух расчлененных реакций иа одном электроде окисляе ся топливо, на другом — восстанавливается окислитель. Такие электрохимические системы называются топливными элементами. [c.208]
Такие электрохимические системы называются топливными элементами. [c.208]
Классификация катализатора по условиям их применения в ряде процессов конверсии углеводородов приведена на с. 31. По этой классификации можно выделить шесть групп показателей (фасетов) вид углеводородного сырья, природа окислителя, температурный уровень процесса, величина давления, способ аппаратурного оформления процесса, целевое назначение продукта. [c.32]
В эту группу окислителей входят соединения, содержащие положительно заряженный ион Н, точнее, ион гидроксония [Н3О] (вода, кислоты и щелочи), который при взаимодействии с восстановителем переходит в элементарный водород. Ионы металлов в их высщей степени окисления, например Fe , u , выполняя [c.150]
Катализаторы, содержащие бензильную группу, могут быть особенно чувствительны к действию окислителей [2]. Фосфониевые соли в отсутствие водного раствора гидроксида натрия, по-видимому, более стабильны, чем соответствующие соли аммония, примерно до 200 °С [4]. Однако при получении тиоэфиров было отмечено, что некоторые фосфониевые ионы распадаются быстрее аммониевых даже в мягких условиях [27]. [c.91]
Однако при получении тиоэфиров было отмечено, что некоторые фосфониевые ионы распадаются быстрее аммониевых даже в мягких условиях [27]. [c.91]
Хранение реактивов допускается лишь в специально оборудованных, хорошо вентилируемых помещениях в строгом порядке. Не разрешается совместное хранение реактивов, способных бурно взаимодействовать друг с другом, например окислителей и восстановителен, кислот и щелочей. Обособленно следует хранить следующие группы реактивов [c.12]
Все реакции можно разделить на две группы в одних степень окисления атомов остается постоянной — обменные реакции, в других — окислительно-восстановительные реакции — она меняется. Протекание окислительно-вос-становительных реакций в отличие от обменных связано со сдвигом или с полным переходом электронов от одних атомов (ионов) к другим — от восстановителя к окислителю. Пример обменной реакции [c.83]
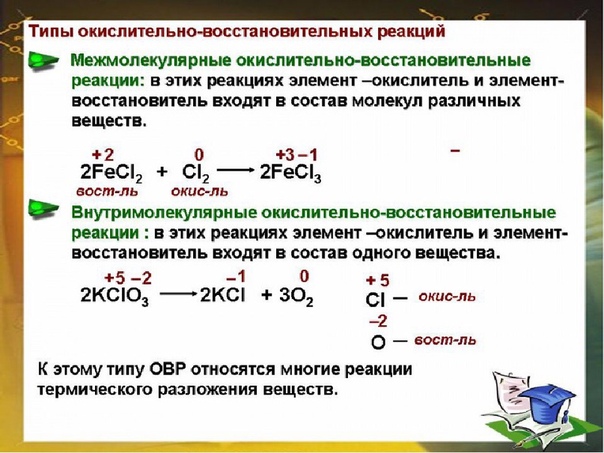
Межмолекулярные реакции. Они протекают с изменением степени окисления атомов в разных молекулах. Эти процессы составляют наиболее обширную группу окислитель-но-восстановительных реакций. Вот несколько примеров Синтез [c.90]
Эти процессы составляют наиболее обширную группу окислитель-но-восстановительных реакций. Вот несколько примеров Синтез [c.90]
Третья группа—окислители, вызывающие воспла.менение пр 1 смешении с ними органических веществ. К таким окислителям относятся водород, галогены, азотная кислота, пероксиды бария и натрия, хромовый ангидрид, диоксид свинца, селитры, хлориты, перхлораты, хлорная известь и др. [c.144]
Взрывоопасные смеси — категории и группы. Взрывоопасная смесь — смесь горючих газов, паров ЛВЖ с воздухом, кислородом или другим окислителем, которая при определенной концентрации (между НПВ и ВПВ) способна взрываться при возникновении источника инициирования взрыва. [c.621]
В процессах 1-й группы токсичные вещества могут участвовать в качестве исходных, конечных, промежуточных и побочных продуктов. Это значит, что токсичными веществами могут являться исходные и конечные продукты реакции, они могут получаться по ходу основной реакции, которая идет в несколько стадий, и, наконец, могут получаться в результате прохождения побочных реакций.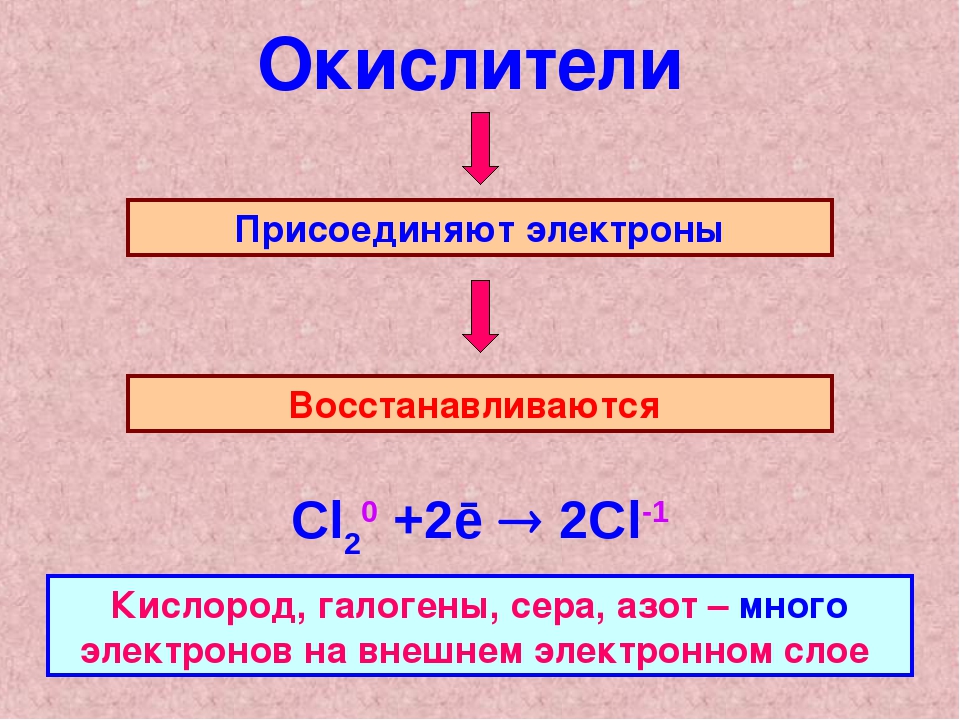 В последнем случае имеют место два варианта побочные реакции или всегда сопутствуют основной или же возникают только при отклонениях от нормального режима работы, т. е. при возникновении аварийной ситуации. Например, в процессах нитрования основным нитрующим агентом является азотная кислота, пары которой обладают токсическим действием. В то же время нитрующие агенты одновременно являются сильными окислителями. Эта двойственная природа нитрующих агентов делает возможным возникновение множества побочных реакций при нарушениях нормального режима. Одним из продуктов побочных реакций являются окислы азота, обладающие сильными токсическими свойствами. [c.13]
В последнем случае имеют место два варианта побочные реакции или всегда сопутствуют основной или же возникают только при отклонениях от нормального режима работы, т. е. при возникновении аварийной ситуации. Например, в процессах нитрования основным нитрующим агентом является азотная кислота, пары которой обладают токсическим действием. В то же время нитрующие агенты одновременно являются сильными окислителями. Эта двойственная природа нитрующих агентов делает возможным возникновение множества побочных реакций при нарушениях нормального режима. Одним из продуктов побочных реакций являются окислы азота, обладающие сильными токсическими свойствами. [c.13]
Определяемые элементы поступают в плазму в виде аэрозоля, получаемого при распылении раствора пробы сжатым окислителем (воздух, кислород). С момента распыления раствора до момента излучения возбужденными атомами происходят сложные процессы. Образуемый при распылении аэрозоль жидкость — газ после испарения растворителя превращается в аэрозоль твердое тело — газ.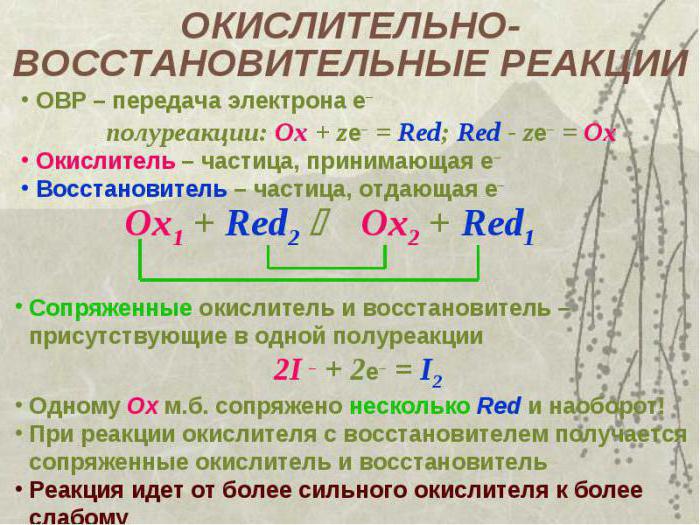 Затем происходит испарение твердых частиц соли и диссоциация ее молекул, причем второй процесс может происходить Б некоторых случаях одновременно с первым. Процессы этой группы являются необратимыми. Атомы определяемого [c.36]
Затем происходит испарение твердых частиц соли и диссоциация ее молекул, причем второй процесс может происходить Б некоторых случаях одновременно с первым. Процессы этой группы являются необратимыми. Атомы определяемого [c.36]
Характерной особенностью парафиновых углеводородов являет- ) ся их химическая стойкость по отношению к кислотам, щелочам ч и различным окислителям. Они неспособны присоединять к себе Г другие атомы или группы атомов и вступают лишь в реакции замещения. [c.9]
Межмолекулярные (межатомные) окислительно-восстановительные реакции характеризуются тем, что атомы, изменяющие свои степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах. Другими словами, одни вещества (простые или сложные), вступающие в химические реакции, являются окислителями, а другие — восстановителями. Межмолекулярные процессы составляют наиболее обширную группу окислительно-восстановительных реакций. Примерами могут служить реакции с участием простых и сложных веществ, а также различных атомных и молекулярных частиц (радикалов, ионов и ион-радикалов) [c.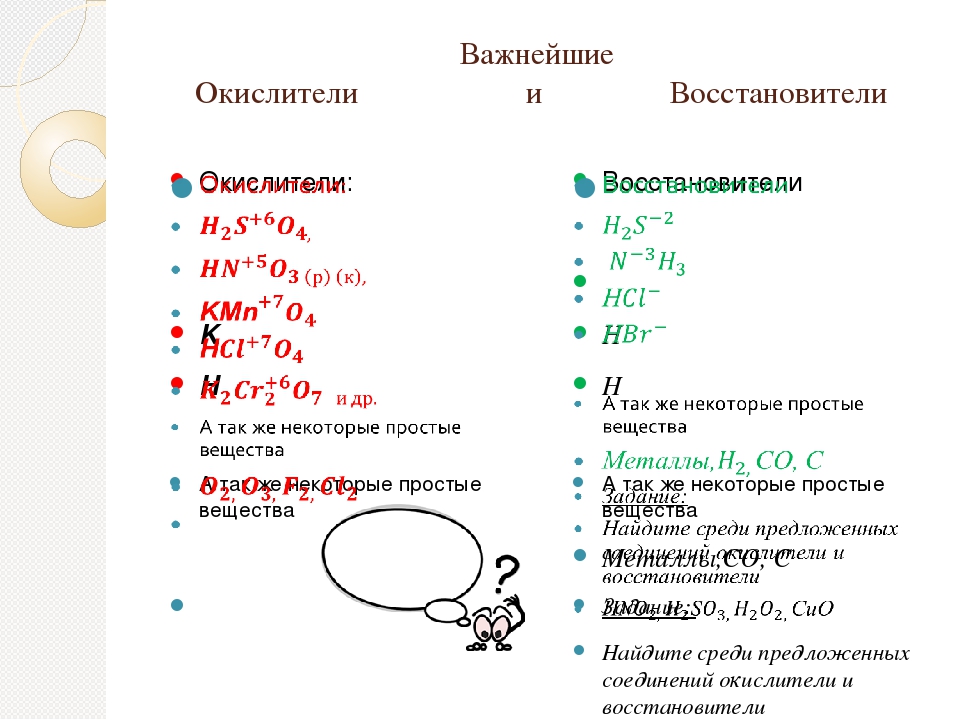 77]
77]
Иначе говоря, галогены являются окислителями. Они соединяются с очень многими химическими элементами, образуя галогениды. Галогены реагируют с подавляющим большинством металлов и неметаллов непосредственно, за исключением кислорода, углерода, азота и благородных газов. Фтор реагирует даже с ксеноном. Связи галогенов с металлами главных подгрупп I и II групп носят преимущественно ионный характер, с остальными — в основном ковалентный. [c.102]
При окислении гомологов бензола различными окислителями или воздухом боковые алкильные цепи превращаются в карбоксильные группы. Таким образом можно получать соответствующие ароматические кислоты. Эта реакция имеет большое практическое значение для синтеза двухосновных фталевых кислот. [c.30]
На примере глюкозы показано, что наибольший расход окислителя (НСЮ) наблюдается в первый момент окисления [91]. При этом расход активного хлора резко увеличивается с повышением температуры. Показано, что в первую очередь окисляется спиртовая группа, затем альдегидная. Предложен следующий механизм окисления глюкозы [c.25]
Показано, что в первую очередь окисляется спиртовая группа, затем альдегидная. Предложен следующий механизм окисления глюкозы [c.25]
Целый ряд энзимов, называемых флавопротеиновыми энзимами, содержит фосфорилированный рибофлавин, связанный в структуре белка. Все они могут вызывать биохимическое окисление, например, аминокислот или пуринов, абсорбирующих кислород. Аналогично могут действовать на молекулярный кислород другие автоокисляющиеся энзиматические системы. Но перекись водорода не содержится в заметных концентрациях в живых клетках, так как а) она может очень быстро быть использована как окислитель группой широко распространенных энзимов, называемых пероксидазами, и б) она быстро разлагается на кислород и воду [c.284]
Двухкомпонентные топлива по способу воспламенения в-двигателе можно разделить на две группы самовоспламеняющиеся и неса-мовоспламеняющиеся. При контакте некоторых горючих и окислителей при обычных температурах протекает химическая реакция с выделением такого количества тепла, которого достаточно для воспламенения топливной смеси.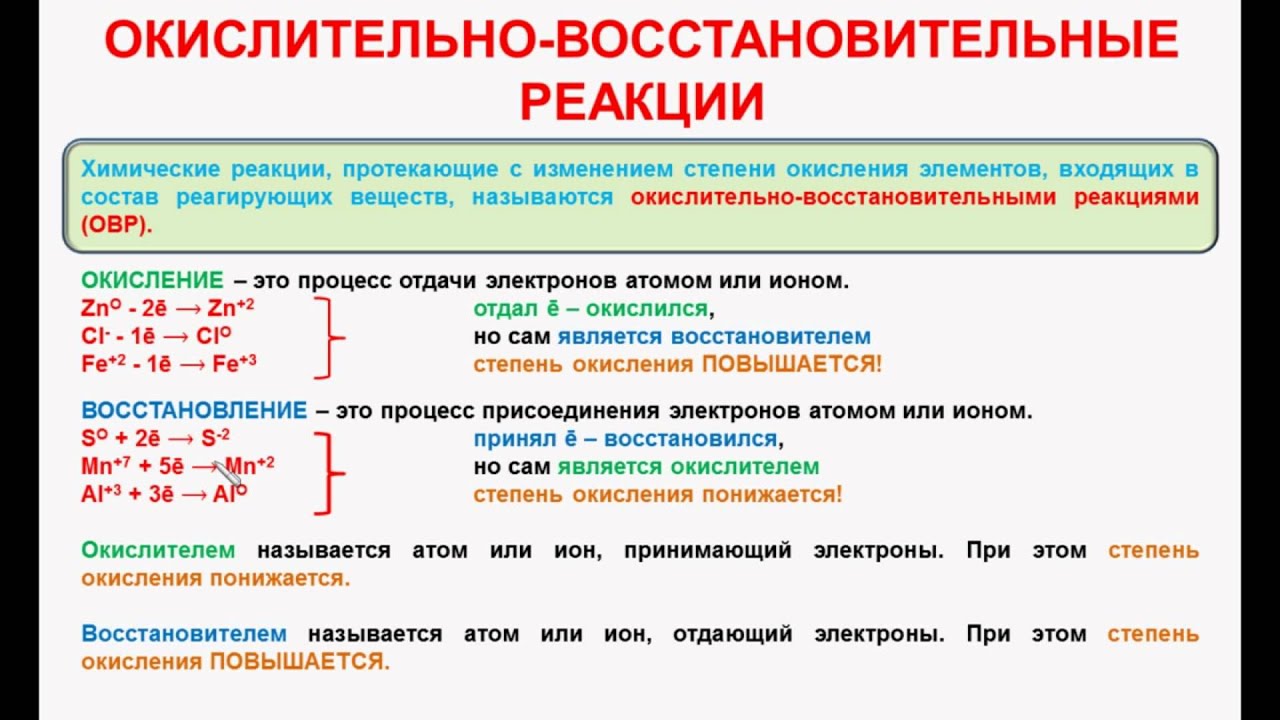 Такие топлива получили название самовоспламеняющихся. [c.116]
Такие топлива получили название самовоспламеняющихся. [c.116]
Другая группа окислителей (л-гидроксидифениламин) весьма эффективно влияет на ход окисления масла как в индукционном периоде, так и в автокаталитической стадии процесса (рис. 2.19). Механизм действия таких присадок связывают с их способностью не только тормозить образование активных радикалов в начальной стадии цепного процесса, но и разлагать уже образовавшиеся пероксиды, переводя их в стабильное состояние и не допуская таким образом распространения цепей. [c.81]
Разрушение сульфонового комплекса возможно как с образованием газообразных продуктов окисления (502), так и продуктов парциального окисления (сульфоксидов, сульфоновХ Однако низкая термическая стабильность суль-фонов обусловливает их разложение в условиях окислитель-но-каталитической конверсии также с образованием 302. Такой механизм образования и разрушения сульфонового комплекса позволяет предположить снижение содержания серы в химических группах сырья, в наибольшее степени подвергаемых окислительно-каталитической конверсии. [c.24]
[c.24]
Таким образом, катионит КУ-1 представляет собой трехмерный продукт, в котором отдельные цепочки связаны метиленовыми мостиками. Этот катионит содержит ионогенные группы двух видов (—ОН и —SO3H), т. е. он бифункционален. Катионит представляет собой черные зерна неправильной формы и размером 0,3—2 мм. Его выпускают также в виде гранул правильной сферической формы. Химическая стойкость катионита высока в кислых, нейтральных и слабощелочных средах. Наличие в нем фенольных групп обусловливает его недостаточную стойкость к концентрированным щелочам и окислителям. [c.143]
Ценные свойства этого каучука — огнестойкость, высокая стабильность по отношению к окислителям, кислотам, растворителям. Однако термическая стойкость нитрозокаучуков не превышает 175 °С, что объясняется низкой энергией диссоциации N—0-связи (223 кДж/моль) [38]. Для вулканизации нитрозокаучука в него вводят третий мономер с карбоксильной группой [39] [c.512]
Для металлов переходных групп характерна сильно пониженная способность к растворению в кислотах и к анодному растворению после обработки поверхности этих металлов окислителями.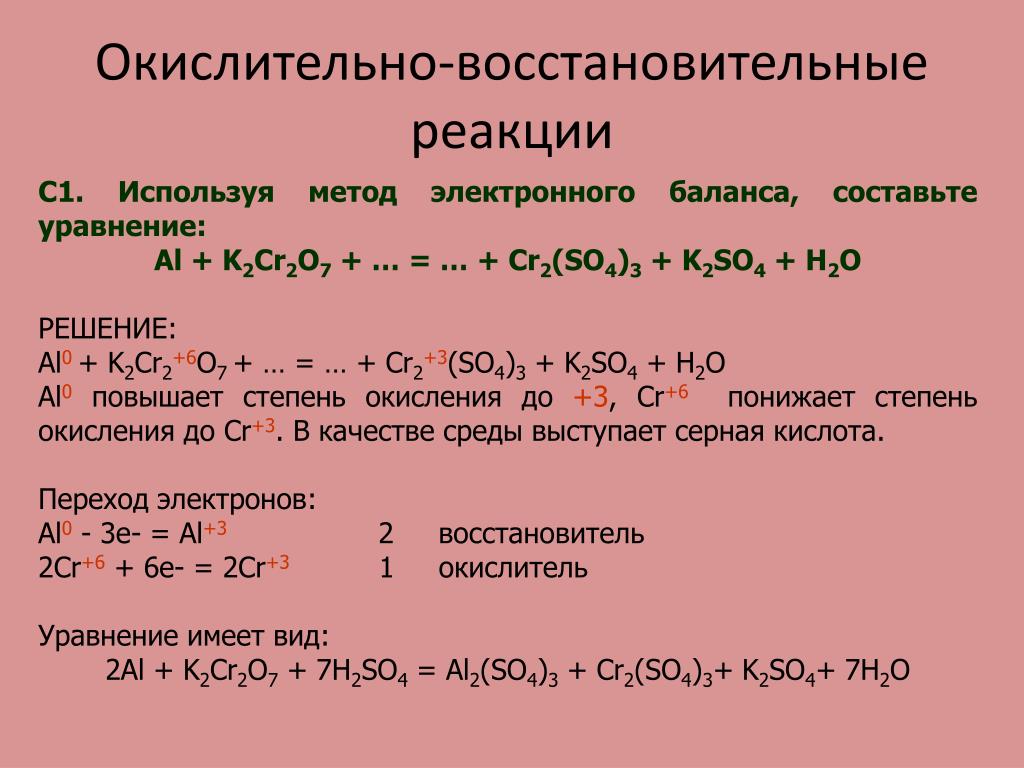 Такое состояние металлов называется пассивностью. Для хрома, золота и платины достаточно воздейстиия кислорода воздуха для того, чтобы эти металлы перешли в пассивное состояние. Если железо погрузить в концентрированную азотную кислоту, то оно становится пассивным и не растворяется в разбавленной азотной кислоте. Можно перевести в пассивное состояние железо, хром, никель и другие металлы, обработав их окислителями, например опустив в раствор бихроматов, нитратов и др. [c.635]
Такое состояние металлов называется пассивностью. Для хрома, золота и платины достаточно воздейстиия кислорода воздуха для того, чтобы эти металлы перешли в пассивное состояние. Если железо погрузить в концентрированную азотную кислоту, то оно становится пассивным и не растворяется в разбавленной азотной кислоте. Можно перевести в пассивное состояние железо, хром, никель и другие металлы, обработав их окислителями, например опустив в раствор бихроматов, нитратов и др. [c.635]
К сильным окислителям принадлежат неметаллы верхней части VI и Vn групп периодической системы. Сильные окислительные свойства этих веществ объясняются больщой электроот-рицательностью их атомов. Сильнее всего окислительные свойства выражены у фтора, но в практике чаще пользуются в качестве окислителей кислородом, хлором и бромом. [c.270]
Окисление. Ароматические углеводороды, кроме бензола, весьма чувствительны к окислителям. Разбавленная азотная кислота, хромовая смесь, перманганат калия, железосинеродистый калий окисляют боковые цепи ароматических углеводородов, превращая их в карбоксильные группы. Эта реакция часто применяется для определения расположенпя боковых цепей в ароматическом ядре. Осторожное окисление приводит к целому ряду промежуточных продуктов. [c.40]
Эта реакция часто применяется для определения расположенпя боковых цепей в ароматическом ядре. Осторожное окисление приводит к целому ряду промежуточных продуктов. [c.40]
При наличии в молекуле парафиновых углеводородов группы N0 атомы водорода у того углеродного атома, с которым соединена нитро-группа, весьма подвижны и склонны к реакциям замещения на различные атомы (например, галоиды) и группы (например, на алкилариламино- и диалкиламиногруппы). В связи с подвижностью этих атомов водорода возможны реакции конденсации нитропарафинов с альдегидами и-кетопами с образованием нитроспиртов, нитрогликолей и других соединений, которые используются в качестве растворителей, а также окислителей для производства эмульгирующих средств. Нитроспирты в свою очередь склонны ко многим реакциям превращения, в результате которых образуются эфиры и другие ценные соединения. [c.131]
Образование фенолкарбонатов проходит при взаимодействии фенолов, СО, гидроксида натрия в присутствии МФ-катализатора, окислителя и катализатора, содержащего элементы группы 8Б [1552]. В двух исследованиях описана изомеризация следующего типа, протекающая в присутствии родиевого катализатора [c.288]
В двух исследованиях описана изомеризация следующего типа, протекающая в присутствии родиевого катализатора [c.288]
Окислители и восстанов ители. Все реакции можно разделить на две группы в одних реакциях степень окисления атомов остается постоянной, в других она меняется. К первым относятся обменные реакции, некоторые процессы синтеза и распада веществ. В отличие от них протекание окислительно-восстановительных реакций. связано со сдвигом или полным переходом электронов от одних атомов (ионов) к другим — от восстановителя к окислителю, Примером такой реакции является процесс [c.202]
Типичными окислителями являются а) простые вещества, атомы которых обладают большой электроотрицательностью (элементы VIA и VIIA групп), из них наиболее активны фтор, а также кислород и хлор б) ионы с дефицитом электронов это простые катионы с высшей или большой степенью окисления, например РЬ+ , Fe+ , Т1+ , Се+ , и сложные анноны, в которых более электроположительный элемент имеет высшую пли значительную степень окисления, например (Сг+Ю4) — , ( ri 07) «, (М+Юз) , (Мп+Ю4) ,, (5+Ю4)2-, (С1-Юз)-, (С1+Ю4)-. (Bi+Юз)-. (РЬ+Юз)2-. ( i+ O)-. (Вг+Юз)-. [c.203]
(Bi+Юз)-. (РЬ+Юз)2-. ( i+ O)-. (Вг+Юз)-. [c.203]
Создание новых процессов, базирующихся на более доступном или дешевом сырье, обычно является результатом от-кр1ития новых реакций и нередко оказывает революционизирующее влияние на развитие технологии. В отношении ископаемого сырья — это уже отмеченное выше перебазирование органического синтеза с каменного угля на нефть и газ. Постепенное исчерпание месторождений нефти и газа рано или поздно должно привести к возвращению на твердое топливо, что серьезно скажется на всей структуре технологии, В отношении пяти главных групп исходных веществ для органического сннтеза выявилась тенденция замены дорогостоящего ацетилена па низшие олефины и даже парафины, а а чкже усилоииое развитие синтезов на основе СО и Нг, которые могут базироваться иа угле. В других случаях разрабатываются ноЕые процессы с заменой сырья сии )тов на олефины, фосгена на ди( ксид углерода, дорогостоящих окислителей (хромпик, пероксид водорода, азотная кислота) на кислород и воздух, различных восстановителей на водород и т. д. К этому же вопросу относится ра .работка прямых методов синтеза, исключающих расход кислот илн щелочей, например прямая гидратация олефинов вместо сернокислотной при синтезе спиртов и т. д. [c.18]
д. К этому же вопросу относится ра .работка прямых методов синтеза, исключающих расход кислот илн щелочей, например прямая гидратация олефинов вместо сернокислотной при синтезе спиртов и т. д. [c.18]
Металлы группы цинка взаимодействуют с элементарными окислителями, особенно активно с галогенами, далобычной температуре. В результате взаимодействия с кислородом при обычной темиературе на поверхности цинка и кадмия образуется тончайшая оксидная пленка, которая защищает эти металлы ог дальнейшего окисления. При нагревании цинк и кадмий образуют с кислородом оксиды ZnO и dO. Ртуть довольно легко окисляется кислородом при нагревании до невысокой температуры, однако образующийся оксид HgO, будучи термически непрочным, при высокой температуре легко разлагается, Цушк и к.ддмий при нагревании образуют с серой сульфиды ZnS и dS, а ртуть при растирании с серой образует сульфид HgS даже ири обычной температуре. С азотом, водородом и углеродом металлы группы цинка в обычных условиях ие взаимодействуют. [c.330]
[c.330]
По химическим свойствам элементарные олово и свинец также довольно сильно отличаются от типичных металлов. Особенно это проявляется в их низкой электрохимической активности. Различные элементарные вещесгва по отношению к олову и свинцу делят на трн группы. К первой отиосят элементарные окислители — га- [c.340]
Углеродная цепь полиолов разрывается под действием тетраацетата свинца, йодной кислоты и ее солей [25]. Эти окислители действуют лишь на диольные группировки, причем наиболее уязвимыми оказываются грео-гидрокснльные группы (для сорбита — положения 2,3 и 3,4, для маннита — 3,4, для дульцита — положения 2,3 и 4,5), как это показал в своих работах Хокетт [26]. Тетраацетат свинца и йодная кислота широко применяются для определения структуры сахаров, сахарных спиртов и родственных соединений. При использовании избытка этих окислителей фрагменты с вторичными спиртовыми группами превращаются в муравьиную кислоту, а метилольные группировки — в формальдегид применяя ограниченное количество периодг1та, углеродную цепь разрывают главным образом по грео-гидроксильным группировкам [26]. Так, из маннита с избытком этих окислителей получают 4 моль муравьиной кислоты и 2 моль формальдегида, а при недостатке перйодата — 2 моль глицеринового альдегида [c.14]
Так, из маннита с избытком этих окислителей получают 4 моль муравьиной кислоты и 2 моль формальдегида, а при недостатке перйодата — 2 моль глицеринового альдегида [c.14]
При окислении асфальтенов различными окислителями (азотная кислота, бихромат и перманганат калия, перекись натрия, перекись водорода, озон, кислородо-воздушная смесь и воздух в щелочной среде) происходит образование аренов, кетонов и кислот. Окисление сопровождается уменьлением числа ароматических и алициклических колец и длинньх алкильных цепей и увеличением метильных групп, хотя степень замещения ароматических систем значительно не изменяется. Конверсия исходного вещества при окислеггии составляет 20—40% (масс.). [c.215]
Горелочные устройства второй группы, также как м первой, пред аз ачены для сжигания газообразного, жидкого топлива или их совместного сжигания. При этом конструкция этого типа горелок предусматривает регулировку подачи окислителя в широком диапазоне (возможно использование как полного предварительного смешения окислителя с топливом, так и частичной подачи окислителя к фронту пламени из окружающего пространства диффузией). Конструкции горелочных устройств этого типа для сжигания газа используют инжекцию газа воздухом. [c.106]
Конструкции горелочных устройств этого типа для сжигания газа используют инжекцию газа воздухом. [c.106]
Нами замечено, что окисление азотной кислотой первичных биссульфидов начинается после прибавления в реакционную смесь не менее половины рассчитанного количества окислителя. После этого реакция протекает с полувзрывной скоростью. Выделяются бурые пары окислов азота и образуются дисульфоксиды, содержащие незначительную примесь сульфон-группы [30 (1020 см ), ЗО2 (1120 и 1310см )]. Реакция хорошо контролирует-сй ТХС. Окисление азотной кислотой вторичных, третичных бис- [c.63]
В наиболее значительных процессах этой группы в качестве окислителя используют кислород воздуха в присутствии таких катализаторов, как оксид железа (II) (процессы Феррокс , Глууд и Манчестер ), сульфат никеля (процесс Никель ), тиоарсенат натрия (процесс Тиолокс ), цианид железа (процессы Фишера и Стаатстинен — Отто ) или органический катализатор окисле-ения (процесс Перокс ). [c.147]
[c.147]
В группу пассиваторов входят неорганические окислители, имеющие свойство в контакте с железом реагировать медленно, хотя под действием катодного тока они восстанавливаются довольно быстро. Пассиваторы адсорбируются на поверхности металла, увеличивая эффективную катодную поверхность. Чем выше концентрация пассиватора, тем легче он адсорбируется, тем меньше становятся анодные участки, что способствует увеличению анодной поляризации и полной пассивации. Для образования пассивной пленки на железе, погруженном в 0,1 % К2СГО4, требуется около 0,5—2 ч, причем в аэрируемом растворе этот процесс идет быстрее . [c.76]
Соединения III и IV, называемые часто просто дисульфидами, играют значительную роль в процессе гидрофобизации поверхности минерала. Большинство исследователей считает, что дисульфиды способны к хемосорб-ционному закреплению на поверхности минерала [3]. Некоторое преимущество этих соединений по сравнению с ксантогенатами и аэрофлотами — их меньшая чувствительность к составу флотационной пульпы (наличию ионов солей жесткости и ионов тяжелых металлов), а также к присутствию окислителей и к pH среды. Бис-ксантогенаты и бис-(диалкилдитиофосфаты наряду с дисульфидной группой содержат серу в тионной форме, которая может оказывать существенное влияние на их поведение при флотации. [c.200]
Бис-ксантогенаты и бис-(диалкилдитиофосфаты наряду с дисульфидной группой содержат серу в тионной форме, которая может оказывать существенное влияние на их поведение при флотации. [c.200]
Что такое окислитель? Определение терминов химии
Окислитель — это реагент, который окисляет или удаляет электроны из других реагентов во время окислительно-восстановительной реакции. Окислитель также может называться окислителем или окислителем. Когда окислитель включает кислород, его можно назвать реагентом оксигенации или агентом переноса атома кислорода (ОТ).
Как работают окислители
Окислитель — это химическое вещество, которое удаляет один или несколько электронов из другого реагента в химической реакции.В этом контексте любой окислитель в окислительно-восстановительной реакции можно рассматривать как окислитель. Здесь окислитель является рецептором электронов, а восстановитель — донором электронов. Некоторые окислители переносят электроотрицательные атомы на подложку. Обычно электроотрицательным атомом является кислород, но это может быть другой электроотрицательный элемент или ион.
Обычно электроотрицательным атомом является кислород, но это может быть другой электроотрицательный элемент или ион.
Примеры окислителей
Хотя окислителю технически не требуется кислород для удаления электронов, наиболее распространенные окислители содержат этот элемент.Галогены являются примером окислителей, не содержащих кислород. Окислители участвуют в горении, органических окислительно-восстановительных реакциях и других взрывчатых веществах.
Примеры окислителей включают:
- перекись водорода
- озон
- азотная кислота
- серная кислота
- кислород
- перборат натрия
- закись азота
- нитрат калия
- висмутат натрия
- Гипохлорит и бытовой отбеливатель
- галогены, такие как Cl 2 и F 2
Окислители как опасные вещества
Окислитель, который может вызвать или способствовать возгоранию, считается опасным материалом. Не все окислители в этом отношении опасны. Например, дихромат калия является окислителем, но не считается опасным веществом с точки зрения транспорта.
Не все окислители в этом отношении опасны. Например, дихромат калия является окислителем, но не считается опасным веществом с точки зрения транспорта.
Окисляющие химические вещества, которые считаются опасными, помечены специальным символом опасности. На символе изображены шар и пламя.
Источники
- Connelly, N.G .; Гейгер, У. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Химические обзоры . 96 (2): 877–910.DOI: 10.1021 / cr940053x
- Smith, Michael B .; Март, Джерри (2007). Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.). Нью-Йорк: Wiley-Interscience. ISBN 978-0-471-72091-1.
Окислители и восстановители — Химия LibreTexts
Окислители и восстановители — ключевые термины, используемые при описании реагентов в окислительно-восстановительных реакциях, которые переносят электроны между реагентами с образованием продуктов. На этой странице обсуждается, что определяет окислитель или восстановитель, как определять окислитель и восстановитель в химической реакции, а также важность этой концепции в реальных приложениях.
На этой странице обсуждается, что определяет окислитель или восстановитель, как определять окислитель и восстановитель в химической реакции, а также важность этой концепции в реальных приложениях.
Окислители и восстановители
Окислитель или окислитель , получает электрона и восстанавливается в химической реакции. Также известный как акцептор электронов, окислитель обычно находится в одной из своих более высоких возможных степеней окисления, поскольку он приобретает электроны и восстанавливается. Примеры окислителей включают галогены, нитрат калия и азотную кислоту.
Восстановитель , восстановитель или , теряет электронов и окисляется в химической реакции.Восстановитель обычно находится в одной из своих более низких возможных степеней окисления и известен как донор электронов. Восстановитель окисляется, потому что он теряет электроны в окислительно-восстановительной реакции. Примеры восстановителей включают земельные металлы, муравьиную кислоту и сульфитные соединения.
Примеры восстановителей включают земельные металлы, муравьиную кислоту и сульфитные соединения.
Рисунок \ (\ PageIndex {1} \): восстановитель восстанавливает другие вещества и теряет электроны; следовательно, его степень окисления увеличивается. Окислитель окисляет другие вещества и приобретает электроны; следовательно, его степень окисления снижается.
Чтобы избежать путаницы, существует мнемоническое устройство, помогающее определять окислители и восстановители.
НЕФТЯНАЯ БУРОВКА :
O xidation I s L oss и R eduction I s G ain электронов
| Обычные окислители | Восстановители общие |
|---|---|
| \ (\ ce {O2} \) | \ (\ ce {h3} \) |
| \ (\ ce {O3} \) | \ (\ ce {CO} \) |
| \ (\ ce {F2} \) | \ (\ ce {Fe} \) |
| \ (\ ce {Br2} \) | \ (\ ce {Zn} \) |
| \ (\ ce {h3SO4} \) | \ (\ ce {Li} \) |
| Галогены (они способствуют получению электрона, чтобы получить конфигурацию благородного газа) | Щелочные металлы (они способствуют потере электрона для получения конфигурации с благородным газом) |
Пример \ (\ PageIndex {1} \): определение восстанавливающих и окисляющих агентов
Определите восстановители и окислители в сбалансированной окислительно-восстановительной реакции:
\ [\ ce {Cl2 (водн. {-} (водн.)} \ Nonumber \]
{-} (водн.)} \ Nonumber \]
Степени окисления: 0-1
Обзор
- B — теряет электрон; окисленный от Br — до Br 2 ; таким образом, Br — является восстановителем .{-}} \) — окислитель. Обратите внимание, что, хотя у конкретного атома обычно есть изменения состояния одизации, агентами являются фактические частицы, а не атомы.
Приложения
Окислители и восстановители важны для промышленного применения. Они используются в таких процессах, как очистка воды, отбеливание тканей и хранение энергии (например, в батареях и бензине). Окислители и восстановители особенно важны в биологических процессах, таких как метаболизм и фотосинтез.+ \ rightarrow 2CH_3COCO_2H + 2ATP + 2NADH \ nonumber \]
Все реакции горения также являются примерами окислительно-восстановительных реакций. Реакция горения происходит, когда вещество реагирует с кислородом с выделением тепла.
 Одним из примеров является сгорание октана, основного компонента бензина:
Одним из примеров является сгорание октана, основного компонента бензина:.
\ [2 C_8H_ {18} (l) + 25 O_2 (g) \ rightarrow 16 CO_2 (g) + 18 H_2O (g) \ nonumber \]
Реакции горения являются основным источником энергии для современной промышленности.
Сводка
Посмотрев на степень окисления каждого элемента на стороне реагента в химическом уравнении по сравнению со степенью окисления того же элемента на стороне продукта, можно определить, является ли элемент восстановленным или окисленным, и, следовательно, можно идентифицировать окислители и восстановители химическая реакция.
Окисляющие вещества Восстановители Состояние окисления Уменьшается Увеличивается Число электронов Получил Потерян Вещество .  {2+} (aq) + 2 H_2O (л) + Cl_2 (г) \]
{2+} (aq) + 2 H_2O (л) + Cl_2 (г) \]- Для реакции \ (2 NO_2 (г) + 7 H_2 (г) \ rightarrow 2 NH_3 (г) + 4 H_2O (г) \), является ли водород окислителем или восстановителем? Объяснять.{2+} (водн.) + Cu (s) \]
- Определите окислитель и восстановитель по следующему химическому уравнению для аэробного дыхания: \ [C_6H_ {12} O_6 (s) + 6 O_2 (g) \ rightarrow 6 CO_2 (g) + 6 H_2O (l) \]
- Для общей окислительно-восстановительной реакции с участием частиц \ (A \) и \ (B \), при которой \ (A \) теряет электроны, а \ (B \) получает электроны: Является ли A окислителем или восстановителем? B — окислитель или восстановитель? Какой из них восстановлен, а какой окислен?
- В окислительно-восстановительной реакции должно быть
- окислитель без восстановителя
- восстановитель без окислителя
- восстановитель и окислитель
- без восстановителя или окислителя
- Что из перечисленного является сильным восстановителем? Что из перечисленного является сильным окислителем?
\ (NO_3 ^ — \), \ (NO \), \ (N_2H_4 \), \ (NH_3 \)
Решения
- \ (Cl ^ — \) является восстановителем, потому что он окисляется и теряет один электрон (начиная со степени окисления -1 в ионах \ (Cl ^ — \) и увеличиваясь до 0 в \ (Cl_2 \) ).
 — \), скорее всего, будет сильным окислителем.- \) имеет наивысшую степень окисления +5, по сравнению с другими молекулами, он, скорее всего, будет окислителем. Поскольку азот в \ (NH_3 \) имеет степень окисления -3, он имеет самую низкую степень окисления и, скорее всего, будет восстановителем.
— \), скорее всего, будет сильным окислителем.- \) имеет наивысшую степень окисления +5, по сравнению с другими молекулами, он, скорее всего, будет окислителем. Поскольку азот в \ (NH_3 \) имеет степень окисления -3, он имеет самую низкую степень окисления и, скорее всего, будет восстановителем.
Список литературы
- Герхарт, Карен. Истоки и основы жизни . Dubuque: Kendall / Hunt Publishing Company, 2009.
- Петруччи, Ральф Х. Общая химия: принципы и современные приложения .9-е. Река Аппер Сэдл: Pearson Prentice Hall, 2007.
- Oxtoby, Дэвид В., Х.П. Гиллис и Алан Кэмпион. Принципы современной химии . 6-е. Бельмонт: Томсон Брукс / Коул, 2008.
.
Авторы и авторство
- Диана Пирсон, Конни Сюй, Лувлин Брар (UCD)
Что такое окислители? | Sciencing
Антиоксидант стал нарицательным словом, синонимом хорошего здоровья. В свою очередь, окислитель может логически относиться к веществу, ухудшающему здоровье.
 Но термин «окислитель» на самом деле имеет разные значения в зависимости от природы предмета; например: биологические системы против промышленных. Это потому, что на самом основном уровне окисляющие вещества принимают электроны. Таким образом, как вещества и процессы будут меняться, так и значение окислителя.
Но термин «окислитель» на самом деле имеет разные значения в зависимости от природы предмета; например: биологические системы против промышленных. Это потому, что на самом основном уровне окисляющие вещества принимают электроны. Таким образом, как вещества и процессы будут меняться, так и значение окислителя.TL; DR (слишком долго; не читал)
Окислители или окислители «отбирают» электроны у других веществ, находящихся поблизости. Это может быть как полезный, так и вредный процесс.
Окислитель
Окислитель, также называемый окислителем, может выражаться в форме отдельной молекулы, соединения (смеси веществ) или элемента. Окислитель обычно появляется в виде молекулы, когда его использование относится к биологическим функциям. Эти биологические оксиданты образуются во время различных типов внутриклеточных процессов, таких как метаболизм и воспалительные реакции. Окислители обычно появляются в виде соединений, когда это относится к химическим функциям.
 Химические окислители могут быть искусственно созданы с помощью промышленных или производственных процессов, например, с помощью перекиси водорода или соли трехвалентного железа.Окислители, выраженные в виде природных элементов, таких как кислород или йод, могут иметь как биологические, так и химические функции.
Химические окислители могут быть искусственно созданы с помощью промышленных или производственных процессов, например, с помощью перекиси водорода или соли трехвалентного железа.Окислители, выраженные в виде природных элементов, таких как кислород или йод, могут иметь как биологические, так и химические функции.Окислители или окислители принимают электроны, процесс, который вызывает «окисление» на биологическом или химическом уровне. Ранее термин «окисление» применялся к реакциям, в которых участвует исключительно кислород. Однако сегодня ученые признают, что окисление может происходить в присутствии кислорода или без него. Является ли окисление «хорошим» или «плохим», зависит от природы реакций и их последствий.
Химическое окисление
Химическое окисление происходит, когда элемент теряет один или несколько электронов в результате контакта с окислителем и реакции с ним, например: когда железо вступает в контакт с кислородом (окислителем) и влагой.
 В результате реакции железо разъедает и образуется красно-оранжевый осадок. Этот процесс называется ржавчиной.
В результате реакции железо разъедает и образуется красно-оранжевый осадок. Этот процесс называется ржавчиной.Окисление на химическом уровне также используется в коммерческих целях посредством «технологий окисления». Эти технологии используют различные вещества для окисления других.Например, с помощью этого процесса можно очистить загрязненную почву и сточные воды.
Биологическое окисление
Подобно химическому окислению, биологическое окисление происходит, когда электроны покидают вещество. Однако процессы расходятся с биологическим окислением, происходящим на другом атомном или молекулярном уровне. Например, глюкоза окисляется, когда атомы водорода покидают вещество и соединяются с окислителем, в процессе клеточного дыхания. Этот тип биологического окисления — полезный процесс, который создает энергию для организма.
Однако другие формы биологического окисления могут нанести вред организму. Эти взаимодействия включают окислители, которые повреждают биологический материал, такой как ДНК и белок, способствуя дегенеративным заболеваниям.
 Эти оксиданты появляются в результате естественных процессов, таких как метаболизм организма. Такие отрицательные формы окисления, как это, привели к появлению большого количества информации о здоровье, относящейся к веществам, которые могут помочь нейтрализовать взаимодействия. Эти противодействующие вещества называются антиоксидантами.
Эти оксиданты появляются в результате естественных процессов, таких как метаболизм организма. Такие отрицательные формы окисления, как это, привели к появлению большого количества информации о здоровье, относящейся к веществам, которые могут помочь нейтрализовать взаимодействия. Эти противодействующие вещества называются антиоксидантами.Хорошие антиоксиданты
Антиоксиданты, которые борются с последствиями вредного биологического окисления, представлены в виде соединений; и появляются в различных продуктах питания, травах и экстрактах. Некоторые из этих антиоксидантов включают витамины C, A и E; селен; бета-каротин и экстракт виноградных косточек. Эти и другие продукты можно получить, употребляя фрукты, овощи и пищевые добавки.
Окислитель (окислитель) — определение, примеры, контрольная работа
Определение окислителя
Окислитель — это химическое вещество, которое вызывает потерю электронов другим химическим веществом.
 Окисление означает потерю электронов, потерю атома водорода или добавление атома кислорода. Окислитель обладает способностью принимать или переносить эти электроны.
Окисление означает потерю электронов, потерю атома водорода или добавление атома кислорода. Окислитель обладает способностью принимать или переносить эти электроны.Обзор окислителя
Окислитель можно сравнить с восстановителем или химическим веществом, которое заставляет другую молекулу приобретать электроны. Агент, способный окислять другой вид, заставляет его терять электроны. В качестве альтернативы окислителем может быть добавка кислорода к химическому веществу.Кислород оттягивает электроны от других частей молекулы, эффективно окисляя всю молекулу. В других случаях, как мы увидим в примерах, окислитель отделен от восстановителя, но позволяет переносить электроны для завершения реакции восстановления-окисления , или для краткости окислительно-восстановительной реакции.
Редокс-реакции всегда состоят из двух полуреакций , независимо от того, протекают они вместе или нет. Реакция восстановления происходит, когда химическое вещество приобретает электроны.
 Эти электроны должны исходить откуда-то и теряться из-за другого химического вещества в предыдущем процессе. Этот процесс известен как окисление. Окислитель или окислитель отвечает за удаление этих электронов. Агент может быть непосредственно вовлечен в реакцию, или он может быть катализатором, который просто управляет удалением электронов из вещества.
Эти электроны должны исходить откуда-то и теряться из-за другого химического вещества в предыдущем процессе. Этот процесс известен как окисление. Окислитель или окислитель отвечает за удаление этих электронов. Агент может быть непосредственно вовлечен в реакцию, или он может быть катализатором, который просто управляет удалением электронов из вещества.Список окислителей
Окислитель может быть любым химическим веществом, которое склонно принимать электроны.Следовательно, такие вещества, как кислоты, обычно являются окислителями из-за их склонности брать больше электронов. Ниже приведены несколько распространенных окислителей:
- Кислород
- Фтор
- Хлор
- Азотная кислота
- Перекись водорода
- И МНОГОЕ ДРУГОЕ…
Примеры окислителей
Формовочная соль в лаборатории
Столовая соль представляет собой чрезвычайно простую комбинацию двух элементов: натрия и хлора.
 Хотя большая часть коммерческой соли производится путем извлечения готовой соли из природных источников, ее можно производить в лаборатории. При объединении твердого металлического натрия в атмосфере газообразного хлора натрий окисляется. Эта реакция окисления сочетается с реакцией восстановления хлора. Другими словами, натрий теряет электрон, превращаясь в катион натрия (положительный ион). Хлор получает электрон, становясь отрицательным анионом. Вместе эти два иона образуют ионное соединение хлорида натрия или поваренную соль.Интересно, что хотя поваренная соль в основном безвредна, газообразный хлор — чрезвычайно токсичное соединение.
Хотя большая часть коммерческой соли производится путем извлечения готовой соли из природных источников, ее можно производить в лаборатории. При объединении твердого металлического натрия в атмосфере газообразного хлора натрий окисляется. Эта реакция окисления сочетается с реакцией восстановления хлора. Другими словами, натрий теряет электрон, превращаясь в катион натрия (положительный ион). Хлор получает электрон, становясь отрицательным анионом. Вместе эти два иона образуют ионное соединение хлорида натрия или поваренную соль.Интересно, что хотя поваренная соль в основном безвредна, газообразный хлор — чрезвычайно токсичное соединение.Отчасти газообразный хлор настолько смертоносен, что он является чрезвычайно мощным окислителем. Хлор очень реактивен и обычно пытается увести электроны. Хотя окисление может превратить металл в соль, оно также может опасно реагировать с многочисленными химическими реакциями организма, отводя столь необходимые электроны и вызывая хаос.
 К счастью, окислители работают только в одном направлении.Вам не нужно беспокоиться о том, что вас отравят поваренной солью.
К счастью, окислители работают только в одном направлении.Вам не нужно беспокоиться о том, что вас отравят поваренной солью.The Fruit Battery
Еще один интересный окислитель представлен в виде классической демонстрации в классе. Фруктовая батарея, также известная как лимонная или картофельная батарея, представляет собой форму электрического тока, возникающую в результате окислительно-восстановительных реакций. Два зонда помещают по обе стороны от лимона или другого фрукта или овоща. Один зонд, сделанный из цинка, через светильник соединяется с другим зондом, сделанным из меди.
Цинковый зонд при наличии кислотности фруктов начинает растворяться в фрукте. Это происходит за счет окисления фруктовых кислот. Кислота действует как катализатор, который позволяет некоторым атомам цинка разорвать связи с другим цинком, оставляя электроны, удерживающие их в матрице. Электроны, которые теперь накапливаются в цинковом зонде, пытаются равномерно распределиться по зонду.
 Между тем, на медном зонде медь действует как катализатор при восстановлении ионов водорода до газообразного водорода.Медь откладывает лишние электроны на ионах водорода, которые затем могут образовывать ковалентные связи друг с другом. Это создает небольшие пузырьки вокруг медного зонда.
Между тем, на медном зонде медь действует как катализатор при восстановлении ионов водорода до газообразного водорода.Медь откладывает лишние электроны на ионах водорода, которые затем могут образовывать ковалентные связи друг с другом. Это создает небольшие пузырьки вокруг медного зонда.Таким образом, с одной стороны фруктовой батареи есть потребность в электронах, а с другой стороны, есть избыток электронов. Медный провод, соединяющий два зонда через светильник, действует как проводник, обеспечивая легкий путь для электронов. Когда электроны текут от цинка к меди, они могут выделять часть своей энергии в лампочке и создавать свет. Концепции, описанные выше, можно увидеть на изображении ниже, которое представляет собой схему любой простой батареи. Фруктовая батарея, хотя некоторые ошибочно утверждают, что она питается от живых фруктов, работает как все батареи.
Цинк-медный гальванический элемент
В этом случае окислитель не является прямым приемником электронов, а просто заставляет их удаляться из цинка и проходить через проволоку.
 Восстановитель , противоположный окислителю, представляет собой медную проволоку, потому что она катализирует перенос электронов в молекулы водорода.
Восстановитель , противоположный окислителю, представляет собой медную проволоку, потому что она катализирует перенос электронов в молекулы водорода.Окислительное фосфорилирование
Одним из наиболее важных биохимических процессов для всех живых животных является окислительное фосфорилирование , или перенос электронов от питательных веществ к молекулам, которые обеспечивают энергию для клеток. Обычно полный распад пищи представляет собой серию окислительно-восстановительных реакций, в которых задействовано множество различных окислителей и получателей электронов. Окислительное фосфорилирование — последняя стадия процесса, происходящая в митохондриях всех растений и животных.
Во время окислительного фосфорилирования, серия белков, встроенных в митохондриальную мембрану, катализирует реакции окисления и направляет электроны к другим белкам. Эти белки катализируют реакции восстановления АТФ и других молекул, обеспечивающих энергию.
 В этой сложной серии окислительно-восстановительных реакций используется много белков, но они работают примерно так же, как и батарея. Однако вместо того, чтобы высвобождать энергию в виде света, энергия в основном улавливается образованием новых связей.Часть энергии выделяется в виде тепла, поэтому митохондрии значительно горячее, чем остальная часть клетки.
В этой сложной серии окислительно-восстановительных реакций используется много белков, но они работают примерно так же, как и батарея. Однако вместо того, чтобы высвобождать энергию в виде света, энергия в основном улавливается образованием новых связей.Часть энергии выделяется в виде тепла, поэтому митохондрии значительно горячее, чем остальная часть клетки.Викторина
Окисляющие и восстанавливающие агенты
Окислители и восстановители
Обычные окислители и восстановители
Рассматривая окислительно-восстановительные реакции, мы можем сосредоточиться на роли, которую играет
конкретный реагент в химической реакции.Какова роль перманганат-иона в
следующая реакция, например?2 MnO 4 — ( водн. ) + 5 H 2 C 2 O 4 ( водн. )
+ 6 H + ( водн. ) 10 CO 2 ( г ) + 2 Mn 2+ ( водн. ) + 8 H 2 O ( l )
) 10 CO 2 ( г ) + 2 Mn 2+ ( водн. ) + 8 H 2 O ( l )В этой реакции щавелевая кислота окисляется до диоксида углерода, и перманганат-ион превращается в
восстановлен до иона Mn 2+ .Окисление: H 2 C 2 O 4 CO 2 +3 +4 Уменьшение: MnO 4 — Mn 2+ +7 +2 Перманганат-ион удаляет электроны из молекул щавелевой кислоты и тем самым окисляет
щавелевая кислота. Таким образом, ион MnO 4 — действует как окислитель.
Таким образом, ион MnO 4 — действует как окислитель.
агент в этой реакции. Щавелевая кислота, с другой стороны, восстанавливает
агент в этой реакции. Отказываясь от электронов, он уменьшает MnO 4 —
ион к Mn 2+ .Атомы, ионы и молекулы, обладающие необычно большим сродством к электронам, имеют тенденцию к
быть хорошими окислителями. Элементарный фтор, например, самый сильный из обычных
окислитель.F 2 — такой хороший окислитель, что металлы, кварц,
асбест, и даже вода воспламеняется в его присутствии. Другие хорошие окислители
включают O 2 , O 3 и Cl 2 , которые являются элементарными формами
второй и третий по величине электроотрицательный элемент соответственно.Еще одно место для поиска хороших окислителей — соединения с необычно большими
степени окисления, такие как перманганат (MnO 4 — ), хромат (CrO 4 2-),
и дихромат (Cr 2 O 7 2-) ионы, а также азотная кислота
(HNO 3 ), хлорную кислоту (HClO 4 ) и серную кислоту (H 2 SO 4 ).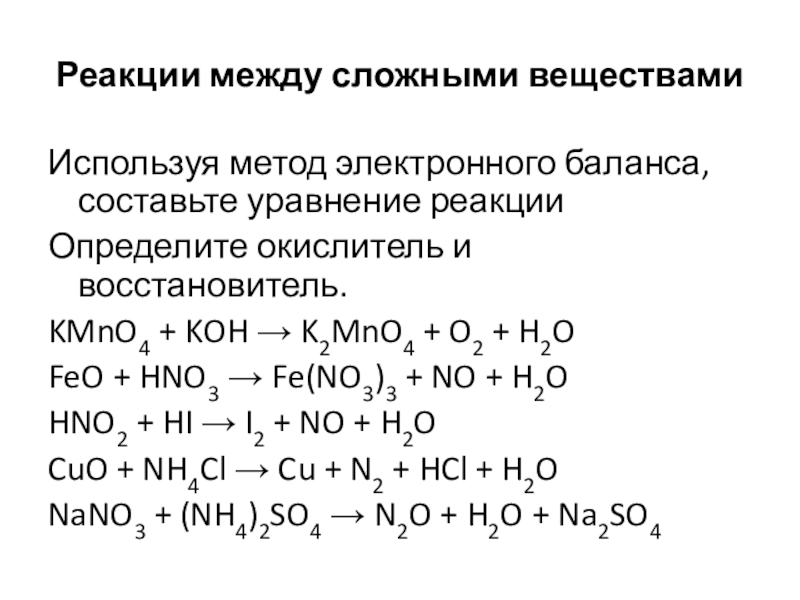 Эти соединения являются сильными окислителями, поскольку элементы становятся более электроотрицательными.
Эти соединения являются сильными окислителями, поскольку элементы становятся более электроотрицательными.
по мере увеличения степени окисления их атомов.Хорошие восстановители включают активные металлы, такие как натрий, магний, алюминий,
и цинк, которые имеют относительно небольшую энергию ионизации и низкую электроотрицательность.
Гидриды металлов, такие как NaH, CaH 2 и LiAlH 4 , которые формально
содержат ион H — , также являются хорошими восстановителями.Некоторые соединения могут действовать как окислители или восстановители. Одним из примеров является
газообразный водород, который действует как окислитель, когда он соединяется с металлами, и как
восстановитель при взаимодействии с неметаллами.2 Na ( с ) + H 2 ( г ) 2 NaH ( с ) H 2 ( г ) + Cl 2 ( г ) 2 HCl ( г ) Другой пример — перекись водорода, в которой атом кислорода находится в реакции окисления -1.

государственный.Поскольку эта степень окисления находится между крайними значениями более распространенных 0 и -2.
степени окисления кислорода, H 2 O 2 может действовать как окисляющий
агент или восстановитель.Относительная сила окисления и
ВосстановителиСамопроизвольные окислительно-восстановительные реакции превращают более сильную из пары окислительных
агентов и более сильного из пары восстановителей в более слабый окислитель и
более слабый восстановитель.Тот факт, что происходит, например, следующая реакция, предполагает
что металлическая медь является более сильным восстановителем, чем металлическое серебро, и что Ag +
ион является более сильным окислителем, чем ион Cu 2+ .Cu ( с ) + 2 Ag + ( водн.  )
)Cu 2+ ( водн. ) + 2 Ag ( с ) более прочный
уменьшение
агентсильнее
окислительный
агентслабее
окислительный
агентслабее
восстанавливающий
агентНа основе многих таких экспериментов общие окислительно-восстановительные полуреакции
были организованы в таблицу, в которой самые сильные восстановители находятся на одном конце и
самые сильные окислители находятся в другом, как показано в таблице ниже.От
условно, все полуреакции записываются в сторону уменьшения.
Кроме того, по традиции самые сильные восстановители обычно находятся в верхней части
стол.
Относительная сила обычных окислителей и восстановителей
АгентыК счастью, вам не нужно запоминать эти условные обозначения. Все, что тебе нужно сделать, это
помните, что активные металлы, такие как натрий и калий, отлично восстанавливают
агентов и найдите эти записи в таблице.Самые сильные восстановители находятся в углу стола, где находятся натрий и калий.
перечисленные.Практическая задача 9: Организуйте следующее
окислители и восстановители в порядке увеличения прочности:Восстановители: Cl — ,
Cu, H 2 , H — , HF, Pb и ZnОкислители: Cr 3+ ,
Cr 2 O 7 2-, Cu 2+ , H + , O 2 , O 3 ,
и Na +Нажмите здесь, чтобы проверить свой ответ на «Практика»
Проблема 9.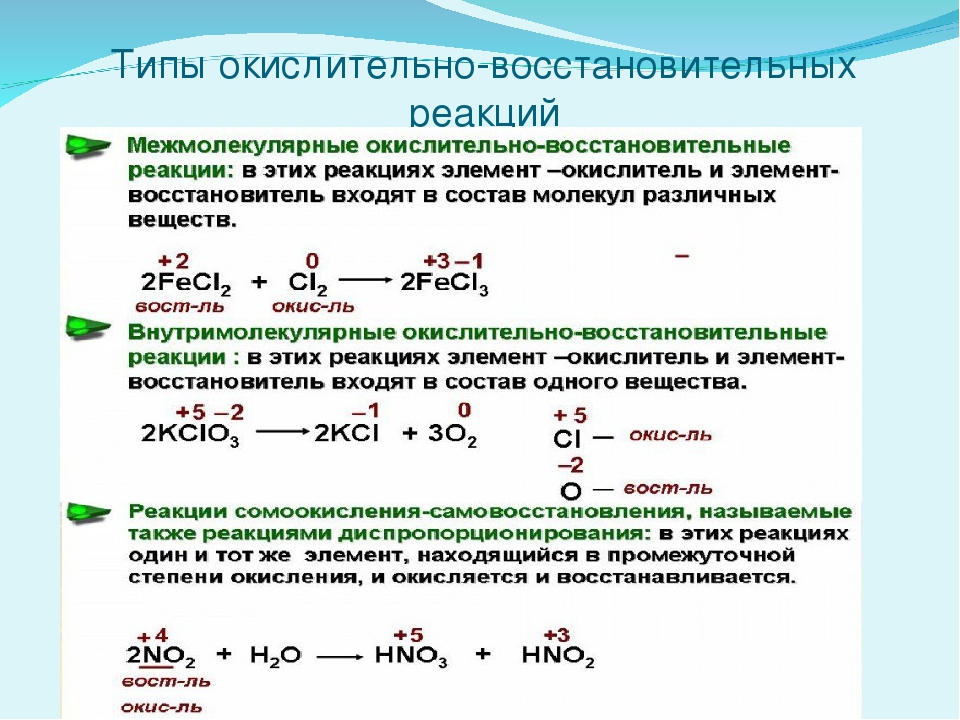
Практическая задача 10: Прогноз
должны ли происходить следующие окислительно-восстановительные реакции, как написано:(а) 2 Ag ( с ) + S ( с ) Ag 2 S ( с )
(б) 2 Ag ( с ) + Cu 2+ ( водн. ) 2 Ag + ( водн. ) + Cu ( с )
(c) MnO 4 — ( водн. ) + 3 Fe 2+ ( водн. ) + 2 H 2 O ( l ) MnO 2 ( s )
+ 3 Fe 3+ ( водн. ) + 4 OH — ( водн. )(d) MnO 4 — ( водн. ) + 5 Fe 2+ ( водн. ) + 8 H + ( водн. ) Mn 2+ ( водн. )
+ 5 Fe 3+ ( водн. ) + 4 H 2 O ( л )
) + 4 H 2 O ( л )Нажмите здесь, чтобы проверить свой ответ на
Задача 10.окислителей | Лабораторная безопасность | Здоровье и безопасность окружающей среды
Окисляющие химикаты
Какова область применения данного руководства?
Настоящие правила техники безопасности компании Brandeis применимы ко всем пользователям окисляющих химикатов. Примеры окислителей включают:
- перхлорат аммония
- Бром
- Хромовая кислота
- Пероксид дибензоила
- Перекись водорода
- Хлорная кислота
- Перхлорат натрия
Окисляющие химические вещества — это материалы, которые самопроизвольно выделяют кислород при комнатной температуре или при небольшом нагревании или способствуют горению.К этому классу химикатов относятся:
- Пероксиды
- Хлораты
- Перхлораты
- Нитраты
- Перманганаты
Сильные окислители способны образовывать взрывоопасные смеси при смешивании с горючими, органическими или легко окисляемыми материалами.

Как мне защитить себя?
Защита глаз
Персонал, работающий с окислителями, должен носить соответствующие средства защиты глаз. Соответствующие защитные очки должны соответствовать требованиям Правил профессиональной и образовательной защиты глаз и лица (ANSI Z.87. 1 1989) и должен быть оборудован боковыми щитками. Обычные очки по рецепту не обеспечивают адекватной защиты, если они не соответствуют этому стандарту и не имеют соответствующей маркировки. Защитные очки с боковыми щитками не обеспечивают адекватной защиты от брызг; поэтому, когда существует опасность разбрызгивания, необходимо использовать другие средства защиты глаз и / или лица (например, очки для защиты от брызг).Защита кожи
При работе с окисляющими химикатами необходимо носить перчатки. Одноразовые нитриловые перчатки обеспечивают адекватную защиту от случайного контакта рук с небольшими количествами большинства лабораторных химикатов.
Следует надеть соответствующую защитную одежду, если вероятность контакта с кожей высока. Обувь с открытым носком не подходит при работе с химическими веществами в лаборатории или в других местах, где есть вероятность воздействия.
Инженерный, вентиляционный и административный контроль
Административный
Сотрудники Brandeis, работающие с опасными химическими веществами, должны быть осведомлены об опасностях, связанных с химическими веществами, присутствующими на их рабочем месте. Это обучение должно проводиться до первоначального назначения в лабораторию и передачи ключей или должно проходить под наблюдением до того, как будет проведено обучение.Персонал лаборатории должен быть обучен тому, как окислители реагируют с другими материалами, идентификации и местонахождению окислителей в лаборатории, правильным мерам обращения и хранения окислителей и мерам, которые необходимо использовать для очистки разливов окислителей.Средства технического контроля
Использование хлорной кислоты определенных концентраций должно производиться в вытяжном шкафу, оборудованном устройствами для промывки.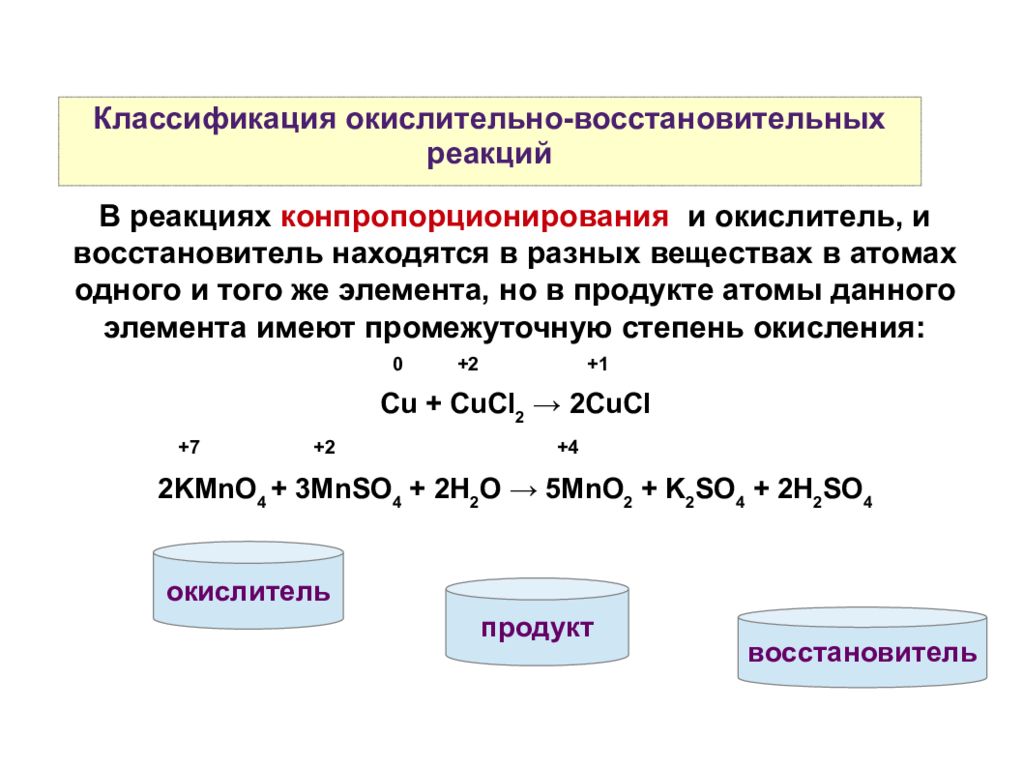 Необходимость в защитных экранах должна быть рассмотрена и использована всякий раз, когда существует риск взрыва, разбрызгивания или сильно экзотермической реакции.Все манипуляции с окислителями, которые представляют этот риск, должны производиться в вытяжном шкафу с створкой в самом нижнем возможном положении (18 дюймов или меньше).
Необходимость в защитных экранах должна быть рассмотрена и использована всякий раз, когда существует риск взрыва, разбрызгивания или сильно экзотермической реакции.Все манипуляции с окислителями, которые представляют этот риск, должны производиться в вытяжном шкафу с створкой в самом нижнем возможном положении (18 дюймов или меньше).Особые требования к обращению и / или хранению
Окислители следует хранить в прохладном и сухом месте. Отделите окислители от всех других химикатов в лаборатории. Сведите к минимуму количество сильных окислителей, хранящихся в лаборатории.
НЕ возвращайте излишки химикатов в исходный контейнер.В контейнер могут попасть примеси, которые могут вызвать пожар, взрыв или другое нежелательное событие или загрязнение.
Действия в чрезвычайных ситуациях, связанных с окислительными химикатами
Предвидеть чрезвычайные ситуации, иметь в лаборатории надлежащее оборудование для работы и быть готовым к разливу. Проверьте MSDS, чтобы определить, что подходит. Материалы для контроля разлива окислителей должны быть инертными и не вступать в реакцию с реагентом (например, Speedy Dry).
В случае разлива или неблагоприятной реакции немедленно сообщите персоналу лаборатории о происшествии.Не пытайтесь справиться с большим разливом / реакцией / возгоранием, а также с тем, для чего вы не обучены или не подготовлены. Выключите все источники возгорания, если это можно сделать безопасно; освободите место и обратитесь за помощью.
О чрезвычайных ситуациях в лаборатории следует сообщать в службу общественной безопасности по доб. 6-3333. Служба общественной безопасности также свяжется с Управлением по охране окружающей среды, здоровья и труда по доб. 6-4262. Сообщите следующее:
- Место разлива / инцидента
- Вид и количество задействованного материала
- Пострадавшие
- Пожар / взрыв
- Ваше местонахождение / контактная информация (или к кому обращаться для получения дополнительной информации)
Как можно скорее уведомите главного исследователя или назначенного специалиста по безопасности.
Требования к удалению отходов
Все материалы, загрязненные окислителями, представляют опасность пожара и должны утилизироваться как опасные отходы. Если у вас нет контейнера для отходов, позвоните на горячую линию по опасным отходам по доб. 6-2561 и оставьте сообщение, указав свое имя, местонахождение и вопрос.
Запросы на утилизацию следует направлять на горячую линию по обращению с отходами по доб. 6-2561.
Процедуры дезактивации
Мойте руки с мылом сразу после работы с любым химическим веществом.
По окончании работы тщательно очистите рабочие зоны. Утилизируйте загрязненный материал в контейнере для хранения опасных отходов. Не выбрасывайте отходы вместе с несовместимыми материалами. Бумажные полотенца или другой подобный материал могут представлять опасность пожара при загрязнении. Соблюдайте осторожность при работе с окислителями вокруг других органических материалов (бумаги, дерева, ткани).
Окислители сильные | CAMEO Chemicals
Материалы этой группы технически не горят, но для реакции горения необходим окислитель, а сильные окислители могут инициировать или ускорять горение других материалов.Это действие делает возгорание более опасным и может привести к взрывам. На самом деле члены этой группы часто входят во взрывоопасные смеси.
Сильные окислители часто активно реагируют с другими соединениями, выделяя тепло и, возможно, газообразные продукты, которые могут создавать давление в закрытом контейнере и которые могут участвовать в дальнейших реакциях. Примером широко известной окислительно-восстановительной (или окислительно-восстановительной) реакции является горение. Когда бензин сжигается в двигателе автомобиля, кислород воздуха действует как окислитель, а бензин действует как (очень слабый) восстановитель.Как только эта реакция инициируется искрой от воспламенения, она выделяет тепло, а также генерирует множество продуктов, включая горячие газы, вызывая повышение давления в камере внутреннего сгорания, которое толкает поршень. Органические соединения в целом обладают некоторой восстанавливающей способностью и в принципе могут реагировать с соединениями этого класса. Фактическая реакционная способность сильно зависит от типа органического соединения.
Реакции сильных окислителей с соединениями, которые являются известными восстановителями, часто взрывоопасны.Однако потенциально взрывоопасные смеси окислителей и восстановителей могут сохраняться без изменений в течение длительного времени, если не допустить нарушений (нагрев, искра, катализатор, механический удар). Порох — такая смесь. Другой, более опасный класс взрывчатых веществ — это взрывчатые вещества, в которых окислитель и восстановитель фактически являются разными частями одного и того же соединения. Эти соединения обычно намного более чувствительны, чем смеси отдельных окислителей и восстановителей, и могут использоваться в качестве детонаторов или первичных взрывчатых веществ.
Сильные окислители могут вступать в энергетическую реакцию с активными металлами, цианидами, сложными эфирами и тиоцианатами. Другие примеры включают смесь сахара (органического соединения) с хлоратом натрия или магния (неорганический восстановитель) с пероксидом бария.
Большинство из них токсичны при проглатывании; степень варьируется в широких пределах. Кроме того, газообразные или жидкие окислители могут вызвать химические ожоги при вдыхании или контакте с кожей.
Окислитель — это вещество, которое обычно реагирует, удаляя электроны из других веществ, процесс, известный как окисление.Противоположный процесс (присоединение электронов к соединению) известен как восстановление и всегда происходит одновременно с окислением. Общая реакция называется окислительно-восстановительной или «окислительно-восстановительной» реакцией.
Существует широкий диапазон возможных значений силы окисления, и эта группа реакционной способности предназначена для охвата тех окислителей, которые являются такими же сильными или более сильными, чем кислород, в условиях окружающей среды. Некоторые материалы становятся более сильными окислителями в присутствии кислоты и могут быть включены сюда, но окисляющие кислоты выделены в другую группу (кислоты, сильные окислители).







