Содержание
Закон авогадро и его следствия химия кратко. Закон авогадро примеры. Практическое использование числа Авогадро
В уроке 23 «Закон Авогадро
» из курса «Химия для чайников
» поговорим о роли изучения газов для всей науки, а также дадим определение закону Авогадро. Этим уроком мы открываем третий раздел курса, под названием «Законы газового состояния». Рекомендую просмотреть прошлые уроки, так как в них изложены основы химии, которые понадобятся вам в изучении данной главы.
Предисловие к главе
Слово «Газ
» происходит от хорошо известного греческого слова хаос. Химики гораздо позже подошли к изучению газов, чем других веществ. Твердые и жидкие вещества было значительно легче опознавать и отличать друг от друга, а представление о различных «воздухах» зарождалось очень медленно. Диоксид углерода был получен из известняка только в 1756 г. Водород открыли в 1766 г., азот — в 1772 г., а кислород — в 1781 г. Несмотря на столь позднее открытие газов, они являлись первыми веществами, физические свойства которых удавалось объяснить при помощи простых законов. Оказалось, что когда вещества, находящиеся в этом трудноуловимом состоянии, подвергаются изменениям температуры и давления, они ведут себя по гораздо более простым законам, чем твердые и жидкие вещества. Более того, одним из важнейших испытаний атомистической теории оказалась ее способность объяснить поведение газов. Эта история излагается в данной главе.
Оказалось, что когда вещества, находящиеся в этом трудноуловимом состоянии, подвергаются изменениям температуры и давления, они ведут себя по гораздо более простым законам, чем твердые и жидкие вещества. Более того, одним из важнейших испытаний атомистической теории оказалась ее способность объяснить поведение газов. Эта история излагается в данной главе.
Заключив в замкнутый сосуд образец какого-либо газа, мы можем измерить его массу, объем, давление на стенки сосуда, вязкость, температуру, теплопроводность и скорость распространения нем звука. Легко также измерить скорость эффузии (истечения) газа через отверстие в сосуде и скорость, с которой один газ диффундирует (проникает) в другой. В данном разделе будет показано, что все эти свойства не являются независимыми друг от друга, а связаны при помощи довольно простой теории, основанной на предположении, что газы состоят из непрерывно движущихся и сталкивающихся частиц.
В развитие атомистической теории чрезвычайно важную роль сыграла гипотеза, выдвинутая в 1811 г. Амедо Авогадро (1776-1856). Авогадро предположил, что в равных объемах всех газов, при одинаковых температуре и давлении, содержится равное число молекул.
Амедо Авогадро (1776-1856). Авогадро предположил, что в равных объемах всех газов, при одинаковых температуре и давлении, содержится равное число молекул.
Это означает, что плотность газа
должна быть пропорциональна молекулярной массе данного газа. Под плотностью газа понимается его масса, приходящаяся на единицу объема и измеряемая в граммах на миллилитр (г/мл).
На гипотезу Авогадро обратили внимание лишь спустя 50 лет, которая после многочисленных испытаний было подтверждена и из гипотезы превратилась в закон Авогадро
. В знак запоздалого признания незаслуженно обойденного вниманием ученого число молекул в моле вещества впоследствии получило название числа Авогадро
, равное 6,022·10 23 .
Если воспользоваться законом Авогадро, то число молекул газа, а следовательно и число n
его молей должно быть пропорционально объему V
газа:
- Число молей газа n = k·V (при постоянных P и Т)
В этом уравнении k
— коэффициент пропорциональности, зависящий от температуры T
и давления P
.
В уроке 23 «Закон Авогадро
» мы рассмотрели одну из многих закономерностей, присущих газам. В данной главе мы обсудим и другие закономерности, связывающие между собой давление газа P, его объем V, температуру T и число молей n в данном образце газа. Надеюсь урок был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Амедео Авогадро был одним из итальянских физиков и химиков в девятнадцатом веке. Надо сказать, что образование он получал юридическое, но тяга к математике и физике подтолкнула его самостоятельно заняться изучением этих наук. И в этом деле он преуспел.
В тридцать лет Авогадро становится преподавателем физики в одном из университетских лицеев того времени. Позже он станет профессором математике в университете. Однако, Авогадро известен вовсе не своей успешной карьерой преподавателя точных наук, коих он освоил самостоятельно, он известен, прежде всего, как учёный, и как человек, высказавший одну из основополагающих гипотез физической химии. Он предположил, что если взять равные объёмы двух разных идеальных газов при одном и том же давлении и температуре, то в этих объёмах будет содержаться одинаковое число молекул. Впоследствии гипотеза подтвердилась, и сегодня может быть доказана при помощи теоретических выкладок. Сегодня это правило носит название закона Авогадро. Кроме того, в честь него было названо некое постоянное число, так называемое число Авогадро, о чём пойдёт речь ниже.
Он предположил, что если взять равные объёмы двух разных идеальных газов при одном и том же давлении и температуре, то в этих объёмах будет содержаться одинаковое число молекул. Впоследствии гипотеза подтвердилась, и сегодня может быть доказана при помощи теоретических выкладок. Сегодня это правило носит название закона Авогадро. Кроме того, в честь него было названо некое постоянное число, так называемое число Авогадро, о чём пойдёт речь ниже.
Число Авогадро
Все вещества состоят из каких-то структурных элементов, как правило, это либо молекулы, либо атомы, но важно не это. Что должно происходить, когда мы смешиваем два вещества, и они реагируют? Логично, что один структурный элемент, кирпичик, одного вещества должен прореагировать с одним структурным элементом, кирпичиком, другого вещества. Поэтому при полной реакции число элементов для обоих веществ должно быть одинаковым, хотя при этом могут отличаться и вес, и объёмы препаратов. Таким образом, любая химическая реакция должна содержать одинаковое число структурных элементов каждого вещества, либо эти цифры должны быть пропорциональны какому-то числу. Совершенно неважно значение этого числа, но в дальнейшем за основу решили взять двенадцать грамм углерода-12 и подсчитать в нём количество атомов. Оно составляет порядка шести помноженной на десять в двадцать третьей степени. Если вещество содержит такое количество структурных элементов, то говорят об одном моле вещества. Соответственно все химические реакции в теоретических выкладках записываются в молях, то есть смешивают моли веществ.
Совершенно неважно значение этого числа, но в дальнейшем за основу решили взять двенадцать грамм углерода-12 и подсчитать в нём количество атомов. Оно составляет порядка шести помноженной на десять в двадцать третьей степени. Если вещество содержит такое количество структурных элементов, то говорят об одном моле вещества. Соответственно все химические реакции в теоретических выкладках записываются в молях, то есть смешивают моли веществ.
Как говорилось выше, значение числа Авогадро, в принципе неважно, однако при этом его определяют физическим способом. Поскольку опыты на данный момент имеют недостаточную точность, то данное число всё время уточняется. Можно, конечно, надеется, что когда-нибудь оно будет подсчитано абсолютно точно, но пока до этого далеко. На сегодняшний день последнее уточнение было сделано в 2011 году. Кроме того, в том же году была принята резолюция о том, как грамотно записывать данное число. Поскольку оно всё время уточняется, то его на сегодняшний день записывают как 6. 02214Х помноженное на десять в двадцать третьей степени. Такое количество структурных элементов содержится в одном моле вещества. Буква «Х» в данной записи говорит о том, что число уточняется, то есть значение Х в будущем будет уточняться.
02214Х помноженное на десять в двадцать третьей степени. Такое количество структурных элементов содержится в одном моле вещества. Буква «Х» в данной записи говорит о том, что число уточняется, то есть значение Х в будущем будет уточняться.
Закон Авогадро
В самом начале данной статьи мы упомянули Закон Авогадро. Это правило говорит об одинаковом количестве молекул. В таком случае имеет смысл связать этот закон с числом Авогадро или молем. Тогда закон Авогадро будет утверждать, что моль каждого идеального газа при одной и той же температуре и давление занимает одинаковый объём. Подсчитано, что при нормальных условиях этот объём составляет порядка двадцати четырёх с половиной литров. Есть точное значение этой цифры, 22.41383 литров. И поскольку процессы, происходящие при нормальных условиях, важны и встречаются очень часто, то есть и название для данного объёма, молярный объём газа.
В теоретических выкладках очень часто, рассматривается молярные объёмы газа. Если есть необходимость перейти к другим температурам или давление, то объём, конечно, изменится, однако есть соответствующие формулы из физики, которые позволяют его подсчитать. Просто надо всегда помнить, что моль газа всегда относится к нормальным условиям, то есть это какая-то конкретная температура и какое-то конкретное давление, и согласно постановлению 1982 года при нормальных условиях давление газа составляет десять в пятой степени Паскаль, а температура 273.15 Кельвина.
Просто надо всегда помнить, что моль газа всегда относится к нормальным условиям, то есть это какая-то конкретная температура и какое-то конкретное давление, и согласно постановлению 1982 года при нормальных условиях давление газа составляет десять в пятой степени Паскаль, а температура 273.15 Кельвина.
Помимо очевидного прикладного значения двух понятий, что были рассмотрены выше, есть и более интересные последствия, которые из них вытекают. Так, зная плотность воды и, взяв один моль её, мы можем оценить размеры молекулы. Здесь мы исходим из того, что нам известна атомарная масса молекул воды и углерода. Таким образом, если мы берём для углерода двенадцать грамм, то масса воды определяется согласно пропорциональной зависимости, она равна восемнадцати граммам. Поскольку плотность воды определить несложно, необходимых данных для оценки размера молекулы воды теперь достаточно. Вычисления показывают, что размер молекулы воды порядка десятых долей нанометра.
Интересно и дальнейшее развитие закона Авогадро. Так, Вант-Гоф распространил законы идеальных газов на растворы. Суть сводится к аналогии законов, но в итоге это дало возможность узнать молекулярные массы веществ, которые по-другому получить было бы очень трудно.
Так, Вант-Гоф распространил законы идеальных газов на растворы. Суть сводится к аналогии законов, но в итоге это дало возможность узнать молекулярные массы веществ, которые по-другому получить было бы очень трудно.
Конспект по химии на тему «Закон Авогадро. Молярный объем газов»
Тема: Закон Авогадро. Молярный объем газов.
Цель: изучить закон Авогадро, научиться определять молярный объем, решать задачи, применяя закон Авогадро.
Тип урока: комбинированный.
Ход работы:
Организационный момент
(2 мин.)
Приветствую учащихся, определяю готовность к уроку.
Приветствуют учителя, проверяют свою готовность к уроку
2.
Проверка домашнего задания (5 мин)
Прошу вспомнить, что такое Молярная масса и количество вещества и написать формулы для расчёта.
Прошу выполнить задание 1 в приложении. (Ответы: 1вариант 88г; 2вариант 51г)
Отвечают на вопросы. По одному выходят к доске и записывают формулы на доске. Самостоятельно работают в тетрадях, выполняют 1 задание.
3.
Целеполагание и планирование деятельности (3 мин.)
Прошу ответить на вопросы о газообразных веществах используя знания курса физики:
— В каких агрегатных состояниях может находиться вещество? (жидкое, твердое, газообразное)
— Охарактеризуйте газообразное состояние вещества. (расстояние между молекулами очень большое)
— Как влияет на физическое состояние газов изменение температуры? (Газообразные молекулы постоянно находятся в беспорядочном (хаотичном) движении. Если увеличить температуру, то движение молекул ускориться. Если понизить температуру, то замедлится.)
Как влияет на физическое состояние газов изменение давления? (При изменении давления газообразные вещества сжимаются. )
)
При решении задач мы часто находим количество вещества или массу газообразных веществ (кислорода, водорода, углекислого газа). Пересчитать количество молекул практически невозможно, но и взвесить газы на практике очень трудно. Для измерения газов принято использовать объемы. Итак, необходимо выяснить, как связаны между собой количество вещества и объем.
Сообщаю тему урока и прошу учеников сформулировать цель урока.
Отвечают на поставленные вопросы.
Слушают сообщение.
Формулируют цель урока.
Записывают тему урока в тетрадь.
4
Изучение новой темы
(25 мин.)
Закон Авогадро.
Итак, нас интересует, как связаны между собой объем газов и количество молекул, содержащихся в этом объеме? Этим вопросом заинтересовался в начале XIX столетия итальянской ученый Амедео Авогадро. Слайд1. После многочисленных экспериментов с газообразными веществами он в 1811 году сформулировал свой закон, который со временем получил название закона Авогадро.
Прошу найти в учебнике формулировку закона и записать к себе в тетрадь. (В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.) Слайд 2.
Прошу напомнить, сколько молекул содержит 1 моль любого вещества? (содержит одинаковое число молекул, это число равно 6,02 • 1023 молекул.)
Показываю Слайд 3 с примерами:
1 моль воды = 6,02 . 1023 молекул Н2О,
1 моль железа = 6,02 . 1023 атомов Fe,
1 моль хлора = 6,02 . 1023 молекул Cl,
1 моль ионов хлора Cl— = 6,02 . 1023 ионов Cl—,
1 моль кислорода О2 = 6,02 . 1023 молекул О2.
А как вы думаете, в честь кого названо это число? (В честь итальянского ученого Амедео Авогадро это число назвали постоянной Авогадро) Слайд 4
Прошу записать со слайда обозначение постоянной Авогадро NA = 6,02 ∙1023 молекул/моль
При вычислении постоянной Авогадро используют следующие формулы NA = N/n n = N/NA N=NA ∙ n Слайд 5
Прошу напомнить, что обозначают:
— N – количество молекул
— n – количество вещества
Сообщаю, что постоянная Авогадро настолько велика, что с трудом поддается воображению.
В пустыне Сахара содержится менее трех молей самых мелких песчинок.
Если взять 1 моль долларовых бумажек, то они покроют все материки Земли 2-х километровым плотным слоем.
Но вернемся к закону Авогадро. Из него следует, что какой бы мы с вами газ не взяли, в равных его объёмах при одинаковых условиях будет содержаться одинаковое число молекул. Прошу привести примеры.
У каждого закона есть свои следствия и дополнения. Так и у закона Авогадро оно имеется. Прошу найти его в учебнике. (Массы различных газов, в которых содержится одинаковое число молекул, должны занимать одинаковые объемы.) Слайд 6
И так, экспериментально доказано, что 1 моль любого вещества содержит 6,02 . 1023 молекул, это величина постоянна у любого газа при н.у. и не изменяется; так же экспериментально установлено, что масса любого газа при н.у. занимает одинаковый объем.
Задаю наводящие вопросы.
— Как можно назвать объем 1 моль газа по аналогии с молярной массой? (Молярный объем)
— Каким будет молярный объем любого газа при одинаковых условиях? (22,4 л/моль)
Правильно, прошу записать определение молярного объема в тетрадь. (Объём 1 моль данного газа называют молярным объёмом и обозначают VМ = 22,4л/моль)
Слайд 7, 8.
Записываю на доске формулу нахождения молярного объёма или вывожу на Слайд 9
Прошу расшифровать каждый показатель:
Vm молярный объём, величина постоянная = 22,4 л/моль
V объём выражается в л, м3, мл
n количество вещества выражается в молях
Прошу, используя исходную формулу получить объём и количество вещества:
V = Vm ∙ n
Зная молярный объем газа, можно определить количество вещества л, которое содержится в объеме V при нормальных условиях:
пVт = 22,4 л/моль.
Если мы знаем, что в одном моле вещества содержится такое количество молекул, которое равняется числу Авогадро, то можем вычислить число молекул газа в определенном объеме при нормальных условиях:
; N
Рассматривают слайд
Работают с учебником
Записывают определение закона в тетрадь.
Называют число.
Рассматривают первый пример и помогают с остальными.
Высказывают свои предположения, работают с учебником.
Записывают в тетрадь обозначение, формулу нахождения постоянной Авогадро и дополняют остальные.
Называют обозначения.
Слушают и анализируют примеры.
Приводят примеры.
Работают с текстом учебника, зачитывают следствие закона.
Помогают в обобщении.
Отвечают на вопросы. Работают с учебником.
Записывают определение в тетрадь.
Списывают с доски в себе в тетрадь.
Расшифровывают формулу, делают запись в тетрадь.
Составляют формулы, записывают их в тетрадь.
Физминутка.
Слушайте меня внимательно! Если я называю металл, то вы приседаете. Называю неметалл, поворачиваетесь влево. Называю газ, подпрыгиваете.
Выполняют физкультминутку
5
Первичное закрепление изученного (5 мин.)
Решение задачи
Вызываю по одному учеников к доске решать задачи из приложения (у доски 1, 3, 5;самостоятельно в тетради 2, 4, 6)
Один ученик выходит к доске, остальные работают на месте.
6
Подведение итогов. Рефлексия (3 мин.)
Ребята по кругу высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске:
1. сегодня я узнал…
2. было интересно…
3. было трудно…
4. я выполнял задания…
5. я понял, что…
6. теперь я могу…
7. я приобрел…
8. я научился…
9. у меня получилось …
у меня получилось …
10. я смог…
Рефлексируют свои знания
7
Домашнее задание (2 мин.)
— преобразовать текст § 38 ст.126, 127; упр.4 ст.128
Записывают задание в дневник
Приложение
1. Самостоятельная работа.
I вариант
Задание № 1 Расcчитайте молярную массу углекислого газа СО2
Задание № 2 Вычислите массу СО2, если n = 2 моль
II вариант
Задание № 1 Рассчитайте молярную массу аммиака NH Задание № 2 Вычислите массу NH3, если n = 3 моль
2. Закрепление изученного
Задача 1. Найдите число молекул при н.у. для 4 моль азота N2.
Задача 2. Найдите число молекул при н.у. для 5,6 моль кислорода О2.
Задача 3. Найдите объём, который при н.у. займут 5 моль углекислого газа СО2.
Найдите объём, который при н.у. займут 5 моль углекислого газа СО2.
Задача 4. Найдите объём, который при н.у. займут 0,25 моль хлора Сl2.
Задача 5. Вычислите, какой объём при н.у. займет азот массой 560г.
Задача 6. Вычислите, какой объём при н.у. займет оксид серы SO2 массой 8г.
Приложение
1. Самостоятельная работа.
I вариант
Задание № 1 Расcчитайте молярную массу углекислого газа СО2
Задание № 2 Вычислите массу СО2, если n = 2 моль
II вариант
Задание № 1 Рассчитайте молярную массу аммиака NH Задание № 2 Вычислите массу NH3, если n = 3 моль
2. Закрепление изученного
Задача 1. Найдите число молекул при н. у. для 4 моль азота N2.
у. для 4 моль азота N2.
Задача 2. Найдите число молекул при н.у. для 5,6 моль кислорода О2.
Задача 3. Найдите объём, который при н.у. займут 5 моль углекислого газа СО2.
Задача 4. Найдите объём, который при н.у. займут 0,25 моль хлора Сl2.
Задача 5. Вычислите, какой объём при н.у. займет азот массой 560г.
Задача 6. Вычислите, какой объём при н.у. займет оксид серы SO2 массой 8г.
Закон Авогадро применение — Справочник химика 21
Экспериментальное определение молекулярной массы газообразных веществ основано на применении закона Авогадро и следствий из него. При этом молекулярная масса газа может быть определена даже и в том случае, если состав исследуемого соединения неизвестен. [c.96]
Таким образом, применение закона Авогадро, а также следствий из него для определения атомных масс химических элементов и установления химических формул многих соединений не представляет больших трудностей. Для уточнения формул ряда веществ кроме знания их количественного (мае. доли, %) состава необходимо уметь находить независимым методом их молекулярные массы. [c.30]
Для уточнения формул ряда веществ кроме знания их количественного (мае. доли, %) состава необходимо уметь находить независимым методом их молекулярные массы. [c.30]
Применение закона Авогадро для решения задач [c.16]
Мариотта и Гей-Люссака с применением закона Авогадро, [c.11]
Домашняя подготовка. Атомный и молекулярный веса. Грамм-атом и грамм-молекула. Закон Авогадро и следствия, вытекающие из него. Относительная и абсолютная плотность газа. Вывод формулы М—МгО. Уравнение Клапейрона—Менделеева. Приведение объема газа к нормальным условиям (н. у.). Газовая постоянная и ее размерность. Расчеты с применением газовых законов. [c.57]
РАСЧЕТЫ, СВЯЗАННЫЕ С ПРИМЕНЕНИЕМ ЗАКОНА АВОГАДРО [c.211]
При расчетах газов и газовых смесей широко пользуются уравнением состояния Клапейрона — Менделеева, выведенным на основе объединенного уравнения (1. 8) с применением закона Авогадро [c.9]
8) с применением закона Авогадро [c.9]
Применение закона Авогадро к газам дает возможность определять молекулярные формулы газов. [c.208]
Методы определения молекулярных масс газов основаны на применении закона Авогадро и следствий из него. Так как молярный объем газа не зависит от его призе [c.38]
Проблема летных газов. Через посредство закона Авогадро связываются взаимно молекулярные веса, числа грамм-молекул, веса газовых масс, выраженные в граммах, н объемы этих масс, вследствие чего этот закон имеет обширное и разнообразное применение для всякого рода расчетов. Целесообразно продемонстрировать разнообразие их на примере решения комплекса задач, построенных так, что решение каждой предшествующей задачи обращается в исходное данное при решении следующей. за ней задачи. [c.34]
Так как простейшие формулы точно отображают относительное содержание отдельных элементов в частице рассматриваемого вещества, использование их вместо истинных никаких ошибок в массовые химические расчеты внести не может. Однако при гораздо реже встречающихся объемных расчетах правильное применение закона Авогадро и уравнения Клапейрона — Менделеева возможно лишь на основе истинных формул. Именно поэтому для газообразных веществ и применяют только истинные формулы (На, Оа и т. д.). [c.31]
Однако при гораздо реже встречающихся объемных расчетах правильное применение закона Авогадро и уравнения Клапейрона — Менделеева возможно лишь на основе истинных формул. Именно поэтому для газообразных веществ и применяют только истинные формулы (На, Оа и т. д.). [c.31]
Следует отметить, что подобное применение закона Авогадро позволяет строго определить лишь максимальное значение атомной массы элемента. Не исключена возможность того, что подлинная атомная масса в несколько раз меньше этого значения. [c.93]
Применение закона Авогадро для установления правильных атомных весов элементов [c.246]
Технологические расчеты многих производств органического синтеза требуют применения газовых законов, характеризующих любое состояние газа и устанавливающих взаимосвязь объема, давления и температуры. Приводимые в расчетах и задачах объемы газов отнесены к нормальным условиям (273 К, 0,1013 МПа), если не сообщаются параметры состояния газа. При нормальных условиях мольный объем любого газа равен 22,4 м /кмоль закон Авогадро). [c.10]
При нормальных условиях мольный объем любого газа равен 22,4 м /кмоль закон Авогадро). [c.10]
Вот совокупность тех понятий частичной механики, которые легли в основу всех современных физических и химических построений со времени утверждения закона Авогадро-Жерара. В совокупности частностей современного запаса химических сведений на каждом шагу видна плодотворность изложенных начал. Далее приводятся немногие примеры такого применения. [c.233]
Ампер, таким образом, ограничивался в этой статье единственной задачей — определением числа молекул в частицах и полностью обходил, например, такой вопрос, как применение своей гипотезы для определения частичных (молекулярных) весов. Поэтому едва ли справедливо считать Ампера автором или соавтором закона Авогадро, как это обычно делается авторами многих наших учебников но химии. Французский химик Е. Гримо писал по этому поводу (1884) Эта гипотеза была выдвинута в 1811 г. итальянским химиком Авогадро и совершенно несправедливо называется гипотезой Ампера. .. Ампер совершенно случайно выдвинул гипотезу, которой [c.116]
.. Ампер совершенно случайно выдвинул гипотезу, которой [c.116]
Гипотезу Авогадро часто называют законом Авогадро, так как она нашла очень широкое применение. Это одна из наиболее важных закономерностей в химии. Она важна не потому, что дает точные результаты, а вследствие применимости ко всем газам независимо от размера их молекул. Молекулы различных газов имеют различные размеры и несколько отличаются по силе притяжения друг к другу. В связи с этим в данном объеме различных газов содержится неодинаковое число молекул. Такие отклонения невелики (обычно меньше 1 %) и не снижают значения гипотезы Авогадро как метода определения молекулярного веса газа. [c.78]
Применению уравнения (ХП,99) для передачи данных о равновесии в газовой смеси должна предшествовать проверка является ли равновесная газовая смесь смесью идеальных газов. Такую проверку производят на химически заторможенной газовой смеси. Закон Бойля, закон Гей-Люссака справедливы только для химически заторможенной газовой смеси. Закон Авогадро можно применять только в том случае, если известно количество молей в газовой смеси. Снова необходимо затормозить химические превращения в системе. [c.325]
Закон Авогадро можно применять только в том случае, если известно количество молей в газовой смеси. Снова необходимо затормозить химические превращения в системе. [c.325]
При расчетах газов и газовых смесей широко используется уравнение Клапейрона—Менделеева, выведенное на основе объединенного уравнения (8) с применением закона Авогадро (уравнение состояния идеального газа) [c.13]
Канниццаро указал, что атомные веса многих химических элементов определены принципиально неверно из-за отсутствия последовательного применения закона Авогадро. Следовательно, чтобы определить атомный вес каждого элемента, прежде всего необходимо знать молекулярные веса и составы всех или большинства его соединений [1, стр. 12]. [c.142]
Упражнение I. Показать, что применение уравнения (19) к идеальным газам приводит к закону Авогадро, если молекулы двух видов имеют при одной и той же температуре одинаковые кинетические энергии. [c.303]
[c.303]
Применение законов Фарадея для количественных расчетов при электролизе. Количество выделившегося или разложившегося при электролизе вещества (М) пропорционально силе тока (/), времени прохождения тока через электролит (т), химическому эквиваленту вещества (5) и обратно пропорционально Р — произведению заряда электрона на число Авогадро [c.213]
Проблема летных газов. Через посредство закона Авогадро связываются взаимно молекулярные веса, числа грамм-молекул, веса газовых масс, выраженные в граммах, и объемы этих масс, вследствие чего этот закон имеет обширное и разнообразное применение для всякого рода расчетов. Цеяе-сообразно продемонстрировать разнообразие их на примере решения комплекса задач о летных газах (т. е. применяемых для наполнения воздушных шаров), построенном так, что решение каждой предшествующей задачи обращается в исходное данное при решении следующей за ней задачи, а весь комплекс иллюстрирует последовательное применение закона к решению определенной практической проблемы — изыскания газов легче воздуха для наполнения летательных аппаратов. [c.51]
[c.51]
На нем мы остановимся. Напомню, что основателем настоящей химической теория о построении тел из атомов бьш, как известно, Дальтон его теория считалась, однако, удачною гипотезою для объяснения закона кратных отношений, а также химических эквивалентов, которые некоторое время смешивались с атомными весами дальнейшее понятие об атомах faлo обособляться от понятия об эквивалентах (благодаря применению закона Авогадро, хотя и по настоящее время некоторые ученые смешивают эти понятия и даже числа), особенно когда окончательно выяснилась различная эквивалентность атомов. Недоставало, однако, общего закона, связывающего величины атомов с их свойствами веса атомов представлялись чем-то случайным и когда периодический закон был найден и выражен Менделеевым в естественной классификации — тогда только можно было считать научно установленным факт индивидуальности и независимого существования неделимых химических частиц, т. е. атомов, построенных, как и все сущее, на определенных и непреложных законах природы. Таким [18] обра.чом, периодический закон и основанная на нем Д. И. Менделеевым классификация элементов заканчивает и, так сказать, закрепляет вопрос об атомном строении материи и является, таким образом, всеобщим законом природы. [c.646]
Таким [18] обра.чом, периодический закон и основанная на нем Д. И. Менделеевым классификация элементов заканчивает и, так сказать, закрепляет вопрос об атомном строении материи и является, таким образом, всеобщим законом природы. [c.646]
Закон Авогадро-Жерара в случае применения его к осмотическому давлению имеет важное значение, так как использование его дает возможность разрешать ряд вопросов практического порядка. Формулировка этого закона по отношению к осмотическому дамению аналогична приведенной. Растворы, заключающие в равных объемах одинаковое количество молеку.л, при одной и той же температуре производят одинаковое осмотическое давление. Следовательно, растворы различных веществ, производящие при постоянной температуре одинаковое осмотическое давление, имеют в единице объема одинаковую молекулярную концентрацию. Конкретно, одна грамм-молекула любого вещества, растворенного в й литре при 0°, производит осмотическое давление в 22,4 атмосферы. [c. 114]
114]
При желании обобщить свойства элементов, подвергнуть их строгому изучению, допускающему практические выводы и химическое предсказание, необходимо принять во внима- ние как общие свойства, принадлежащие той группе элементов, к которой относится данный из них, так и индивидуальные его свойства, а в основу такого обобщения должно положить такое свойство, которое подлежит точному измерению. Таким свойством элементов не только ньше, но и еще и надолго будет их атомный вес. Наши представления об атомных весах получили, особенно в последнее время, благодаря применению закона Авогадро и Ампера и благодаря усилиям Лорана, Жерара, Реньо, Розе и Канницаро, такую незыблемую твердость, что можно с уверенностью л тверждать, что при всех дальнейших переменах в теоретических представлениях химиков — понятие об атомном весе (как о наименьшем количестве элемента, входящем в частицы его соединений) элементов останется неизменным. Самое название (атомный вес) заключает в себе, конечно, гипотезу об атомном строении тел, но здесь идет речь не о нaзвaнии, а о понятии, которое им условлено означать. Сравнение элементов по их атомному весу может притом перевести химические о них сведения на почву механиче-1СКИХ знаний, а потому мне кажется наиболее естественным [c.241]
Сравнение элементов по их атомному весу может притом перевести химические о них сведения на почву механиче-1СКИХ знаний, а потому мне кажется наиболее естественным [c.241]
Возьмем для ясности, например, кальций с атомным весом Са = 40. Вот что должно считать очевидным, а иначе в дальнейшем изложении вам встретятся затруднения. Вам должно быть ясно следуюшее что если мы сочтем кальций не за 40, а за 20, Са = 20, как и считали прежде, то тогда мы состав соединений кальция выразим совершенно правильно в эмпирическом отношении, но тогда хлористый кальций будет выражаться совершенно такой же формулой, как и хлористый натрий, СаС1 как и Na l точно так же водная окись кальция и водная окись натрия окажутся одинаковыми Са(НО) и Na (НО). Раньше все металлы считали однозквивалентными водороду. В 50-х годах, когда еще сомнение в применении законов Авогадро, Жерара и вообще законов, ныне уже доказанных и обыкновенных, еще существовало, тогда такого рода система обозначения атомных весов металлов даже очень щироко была распространена. Почему же эту, на первый взгляд кажущуюся выгодной систему, необходимо было уничтожить и заменить ее допущением металлов двух, трех и т. д. эквивалентных Я буду излагать материал не в историческом порядке, потому что исторический порядок очень сложен. Если бы я хотел рассказать историю этих споров, то мне пришлось бы употребить много лекций, чтобы изложить разного рода недоразумения, которые здесь существовали и которые в настоящее время, вообще говоря, вполне разрешены. [c.135]
Почему же эту, на первый взгляд кажущуюся выгодной систему, необходимо было уничтожить и заменить ее допущением металлов двух, трех и т. д. эквивалентных Я буду излагать материал не в историческом порядке, потому что исторический порядок очень сложен. Если бы я хотел рассказать историю этих споров, то мне пришлось бы употребить много лекций, чтобы изложить разного рода недоразумения, которые здесь существовали и которые в настоящее время, вообще говоря, вполне разрешены. [c.135]
Мы хотим подчеркнуть, что эти важные для развития науки мысли Д. И. Менделеева являются результатом последовательного применения закона Авогадро о двухобъемности молекул. В истории атомно-молекулярной теории Д. И. Менделеев является первым ученым, который стал последовательно применять закон Авогадро ко всем известным в то время химическим явлениям. Вслед за Менделеевым по этому пути пошел итальянский химик С. Канниццаро, на работах которого мы остановимся в следующей главе. [c. 136]
136]
Первые суждения о весе частиц химических соединений были сделаны почти независимо от изучения плотности паров, на основании чисто химических отношений тел. Сведения эти исправлялись, наблюдались и получили прочную опору в применении закона Авогадро, Ампера и Жерара. Но и ныне этот закон не может быть применен к огромному числу веш еств, непревращающихся в пар, а потому для этих тел неизбежно руководствоваться в определении частичного веса пока только одною совокупностью имеюплихся химических и физических сведений об этих телах. Это замечание имеет большое значение при рассмотрении так называемых, минеральных соединений, большинство которых относится к классу нелетучих веществ, а в особенности к рассмотрению солей, из которых только немногие летучи. Ныне же к этим веществам вовсе не применяется понятие о частице, а состав их выражается почти исключительно эквивалентными формулами, т. е. соли сравниваются с летучими соединениями тех же кислотных остатков, т. е. с самыми кислотами или с их эфирами. Подобная система эквивалентного сличения состава солей с эфирами была проведена Жераром с полнотою чрез целый ряд минеральных соединений, но уже с тех пор эти эквивалентные формулы претерпели изменение на основании термических паев, преимущественно вследствие настояний Каницаро. Но при этом все же таки состав минеральных соединений выражается обыкновенно простейшими или эмпирическими формулами и никаких суждений о частичном весе к этим последним не применяется, а между тем очевидно, что для суждений о природе окислов и солеобразных тел, равно как и множества подобных веществ, весьма важно было бы иметь хотя некоторые сведения о частичном их весе. Судя по тому, что многие [c.678]
Подобная система эквивалентного сличения состава солей с эфирами была проведена Жераром с полнотою чрез целый ряд минеральных соединений, но уже с тех пор эти эквивалентные формулы претерпели изменение на основании термических паев, преимущественно вследствие настояний Каницаро. Но при этом все же таки состав минеральных соединений выражается обыкновенно простейшими или эмпирическими формулами и никаких суждений о частичном весе к этим последним не применяется, а между тем очевидно, что для суждений о природе окислов и солеобразных тел, равно как и множества подобных веществ, весьма важно было бы иметь хотя некоторые сведения о частичном их весе. Судя по тому, что многие [c.678]
Применение точных методов химического анализа позволило определить состав многих природных веществ и продуктов технологической переработки, установить ряд основных законов химии. А. Л. Лавуазье (1743—1794) определил состав воздуха, воды и других веществ и разработал кислородную теорию горения. Опираясь на аналитические данные, Д. Дальтон (1766—1844) развил атомистическую теорию вещества и установил законы постоянства состава и кратных отношений. Ж- Г. Гей-Люссак (1778—1850) и А. Авогадро (1776—1856) сформулировали газовые законы. Аналитическая химия, обогащаясь новыми методами, продолжала развиваться и совершенствоваться. В конце XVII в. Т. Е. Ловиц (1757—1804), развивая идеи М. В. Ломоносова, создал микрокристаллоскопический анализ — метод качественного анализа солей по форме их кристаллов, М. В. Се-вергин (1765—1826) предложил колориметрический анализ, основанный на зависимости интенсивности окраски раствора от концентрации вещества, Ж. Л. Гей-Люссак разработал титриметрический метод анализа. Эти методы вместе с гравиметрическим составили основу классической аналитической химии и сохранили свое значение до настоящего времени. [c.9]
Опираясь на аналитические данные, Д. Дальтон (1766—1844) развил атомистическую теорию вещества и установил законы постоянства состава и кратных отношений. Ж- Г. Гей-Люссак (1778—1850) и А. Авогадро (1776—1856) сформулировали газовые законы. Аналитическая химия, обогащаясь новыми методами, продолжала развиваться и совершенствоваться. В конце XVII в. Т. Е. Ловиц (1757—1804), развивая идеи М. В. Ломоносова, создал микрокристаллоскопический анализ — метод качественного анализа солей по форме их кристаллов, М. В. Се-вергин (1765—1826) предложил колориметрический анализ, основанный на зависимости интенсивности окраски раствора от концентрации вещества, Ж. Л. Гей-Люссак разработал титриметрический метод анализа. Эти методы вместе с гравиметрическим составили основу классической аналитической химии и сохранили свое значение до настоящего времени. [c.9]
После такого историко-критического анализа Канниццаро переходит к построению рациональной системы атомных весов, применяя положения молекулярной теории. Он начинает с применения гипотезы Авогадро для определения весов молеку.т согласно Авогадро, молекулярные веса пропорциональны плотностям тел в газообразном состоянии. Так как плотности паров выражают веса молекул, все их можно относить к плотности простого газа, избранной в качестве единицы аналогично тому как поступил Авогадро, Канниццаро принимает вес молекулы водорода равным 2 и дает таблицу сопоставимых молекулярных весов 33 простых и сложных тел, поскольку значения молекулярных весов даны им в одних и тех же едан ах. Именно теперь сопоставление различных количеств одного и тог же элемента как в молекуле свободного тела, так и в молекулах всех его соединений приводит Канниццаро к выводу, что различные количества одного и того же элемента, содержащиеся в различных молекулах, являются целыми крат,ными одного и того же количества, которое, выступая всегда нераздельно, должно с полным основанием именоваться атомом Это закон атомов, который по своей важности превосходит атомную гипотезу, потому что в формулировке различные количества одного и того же элемента, содержащиеся в одинаковых объемах как свободного тела, так и его соединений, являются целыми кратными одного и того же количества, он дает строгое толкование фактам и не ссылается ни на какую гипотезу о конституции вещества.
Он начинает с применения гипотезы Авогадро для определения весов молеку.т согласно Авогадро, молекулярные веса пропорциональны плотностям тел в газообразном состоянии. Так как плотности паров выражают веса молекул, все их можно относить к плотности простого газа, избранной в качестве единицы аналогично тому как поступил Авогадро, Канниццаро принимает вес молекулы водорода равным 2 и дает таблицу сопоставимых молекулярных весов 33 простых и сложных тел, поскольку значения молекулярных весов даны им в одних и тех же едан ах. Именно теперь сопоставление различных количеств одного и тог же элемента как в молекуле свободного тела, так и в молекулах всех его соединений приводит Канниццаро к выводу, что различные количества одного и того же элемента, содержащиеся в различных молекулах, являются целыми крат,ными одного и того же количества, которое, выступая всегда нераздельно, должно с полным основанием именоваться атомом Это закон атомов, который по своей важности превосходит атомную гипотезу, потому что в формулировке различные количества одного и того же элемента, содержащиеся в одинаковых объемах как свободного тела, так и его соединений, являются целыми кратными одного и того же количества, он дает строгое толкование фактам и не ссылается ни на какую гипотезу о конституции вещества. В этом законе заключены закон кратных отношений и закон простых отношений между объемами газов. Но Канниццаро был убежден, что сформулированный закон ведет к экспериментальному подтверждению атомной теории, и поэтому считал, что атом любого простого тела представляет такое его количество, которое входит всегда целиком в равные объемы как свободного тела, так и его соединений. Это количество может быть или равно количеству, содержащемуся в одном объеме свободного тела, или в несколько целых раз меньше его [c.214]
В этом законе заключены закон кратных отношений и закон простых отношений между объемами газов. Но Канниццаро был убежден, что сформулированный закон ведет к экспериментальному подтверждению атомной теории, и поэтому считал, что атом любого простого тела представляет такое его количество, которое входит всегда целиком в равные объемы как свободного тела, так и его соединений. Это количество может быть или равно количеству, содержащемуся в одном объеме свободного тела, или в несколько целых раз меньше его [c.214]
Закон Авогадро.
В 1811 г. Авогадро выдвинул гипотезу, согласно которой равные объемы всех газов при одинаковых температуре и давлении содержат одинаковое число молекул. Эта гипотеза впоследствии получила название закона Авогадро.
Амедео Авогадро (1776-1856)-итальянский физик и химик. Его крупнейшие достижения заключаются в том, что он: установил, что вода имеет химическую формулу h3O, а не НО, как считалось ранее; стал проводить различие между атомами и молекулами (более того, ввел сам термин «молекула») и между атомным «весом» и молекулярным «весом»; сформулировал свою знаменитую гипотезу (закон).
Число молекул в одном моле любого газа равно 6,022 -10″. Это число называется постоянной Авогадро и обозначается символом А. (Строго говоря, оно является не безразмерной численной величиной, а физической постоянной, имеющей размерность моль»1.) Постоянная Авогадро-это просто название числа 6,022-1023 (любых частиц-атомов, молекул, ионов, электродов, даже химических связей или химических уравнений).
Поскольку один моль любого газа всегда содержит одинаковое число молекул, из закона Авогадро следует, что один моль любого газа всегда занимает один и тот же объем. Этот объем для нормальных условий можно вычислить при помощи уравнения состояния идеального газа (4), полагая п = 1 и подставляя в него значения газовой постоянной R и стандартных температуры и давления в единицах системы СИ. Такой расчет показывает, что моль любого газа при нормальных условиях имеет объем 22,4 дм3. Эта величина называется молярный объем.
Плотность газа. Поскольку один моль любого газа при нормальных условиях занимает объем 22,4 дм3, нетрудно вычислить плотность газа. Например, один моль газообразного CO2 (44 г) занимает объем 22,4 дм3. Отсюда следует, что плотность CO2 при нормальных условиях равна
Например, один моль газообразного CO2 (44 г) занимает объем 22,4 дм3. Отсюда следует, что плотность CO2 при нормальных условиях равна
44 г/моль
22,4 дм3/молъ
Следует обратить внимание на то, что этот расчет основан на двух предположениях, а именно: a) CO2 подчиняется закону Авогадро при нормальных условиях и б) CO2 представляет собой идеальный газ и, следовательно, подчиняется уравнению состояния идеального газа.
Позже мы убедимся, что свойство реальных газов, a CO2 является одним из них, при определенных условиях значительно отклоняется от свойств идеального газа.
Плотность водорода
На экспериментальном определении плотностей газов и их сопоставлении с плотностью водорода основывались первые в истории химии определения молекулярного «веса» многих газов и жидкостей. В таких определениях водороду всегда приписывали атомный «вес», равный единице.
Понятия атомный вес и молекулярный вес означают приблизительно то же самое, что и современные термины «относительная атомная Масса» и соответственно «относительная молекулярная масса».
Оглавление:
Закон Авогадро — Chemistry
Зако́н Авога́дро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро, став впоследствии (через 50 лет, после съезда химиков в Карлсруэ) количественной основой современной химии (стехиометрии)[1]. Закон Авогадро точно выполняется для идеального газа, а для реальных газов он является тем более точным, чем газ более разреженный.
История
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были теоретически объяснены в 1811 году итальянским физиком Амедео Авогадро[2].
Следствия закона
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых — изобаричных и изотермичных — условиях занимает одинаковый объём.
Согласно закону Авогадро, одно и то же количество молекул любого газа занимает при одинаковых условиях один и тот же объём. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое количество частиц (англ.)русск. (например, молекул). Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
В частности, при нормальных условиях, то есть при 0 °C (273,15 К) и 101,325 кПа, объём 1 моля газа равен 22,413 962(13) л. Эту физическую константу называют стандартным молярным объёмом идеального газа и обозначают Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Клапейрона:
- PVT=101,3 kPa⋅22,414 l273 K.
 {\displaystyle {\frac {PV}{T}}={\frac {101,3~\mathrm {kPa} \cdot 22,414~\mathrm {l} }{273~\mathrm {K} }}.}
{\displaystyle {\frac {PV}{T}}={\frac {101,3~\mathrm {kPa} \cdot 22,414~\mathrm {l} }{273~\mathrm {K} }}.}
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Это положение имело важное значение для развития химии, так как оно дает возможность определять молекулярную массу веществ, способных переходить в газообразное или парообразное состояние (см. Атомно-молекулярное учение). Если через μ обозначить молекулярную массу вещества и через ρ′ — его относительную плотность в газообразном состоянии, то отношение μ / ρ′ должно быть постоянным для всех веществ. Опыт показал, что для всех изученных веществ, переходящих в газообразное состояние без разложения, эта постоянная равна 28,9 а.е.м. (атомных единицы массы), если при определении относительную плотность исходить из плотности воздуха; но эта постоянная будет равняться 2 а.е.м., если принять за единицу плотность водорода. Обозначив эту постоянную, или, что то же, общее для всех газов отношение молекулярной массы к относительной плотности через С, мы из формулы имеем с другой стороны μ′ = ρ′C. Так как относительная плотность ρ′ газа определяется легко, то, подставив её значение в формулу, можно вывести и неизвестную молекулярную массу данного вещества.
Обозначив эту постоянную, или, что то же, общее для всех газов отношение молекулярной массы к относительной плотности через С, мы из формулы имеем с другой стороны μ′ = ρ′C. Так как относительная плотность ρ′ газа определяется легко, то, подставив её значение в формулу, можно вывести и неизвестную молекулярную массу данного вещества.
Пример использования закона Авогадро
Элементный анализ одного из углеводородов, выполненный А. М. Бутлеровым, указывал, что отношение атомного содержания углерода к водороду составляет в нём 1 к 2, а потому его относительный состав может быть выражен формулой СН2 или C2H4, C4H8 и вообще (СН2)n. Молекулярная масса этого углеводорода определяется, следуя закону Авогадро, из плотности его пара, которая оказалась в 5,85 раз больше плотности воздуха; отсюда молекулярная масса этого вещества равна ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м. Формуле C11H22 отвечает молекулярная масса 154 а. е.м., формуле C12H24 — 168 а.е.м., а C13H26 — 182 а.е.м. Формула C12H24 (циклододекан) близко отвечает наблюдаемой величине, а потому она и должна выражать собой состав молекулы исследуемого углеводорода (CH2)n.
е.м., формуле C12H24 — 168 а.е.м., а C13H26 — 182 а.е.м. Формула C12H24 (циклододекан) близко отвечает наблюдаемой величине, а потому она и должна выражать собой состав молекулы исследуемого углеводорода (CH2)n.
См. также
Закон Авогадро Википедия
Зако́н Авога́дро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро, профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро, став впоследствии (через 50 лет, после съезда химиков в Карлсруэ) количественной основой современной химии (стехиометрии)[1]. Закон Авогадро точно выполняется для идеального газа, а для реальных газов он является тем более точным, чем газ более разреженный.
История
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были теоретически объяснены в 1811 году итальянским физиком Амедео Авогадро[2].
Примечательным является тот факт, что при жизни открытие Авогадро осталось незамеченным из-за критики со стороны авторитетных химиков той эпохи — Йёнса Якоба Берцелиуса и Джона Дальтона, которые отрицали возможность существования двухатомных молекул простых веществ. И только в 1858 году работа Авогадро была случайно обнаружена итальянским химиком Станислао Канниццаро и обнародована в 1860 году на Первом международном химическом конгрессе химиков в Карлсруэ (Германия).
Следствия закона
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых — изобарных и изотермических — условиях занимает одинаковый объём.
Согласно закону Авогадро, одно и то же количество молекул любого газа занимает при одинаковых условиях один и тот же объём. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое количество частиц (англ.)русск. (например, молекул). Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
В частности, при нормальных условиях, то есть при 0 °C (273,15 К) и 101,325 кПа, объём 1 моля газа равен 22,413 962(13) л. Эту физическую константу называют стандартным молярным объёмом идеального газа и обозначают Vm. Найти молярный объём при других температуре и давлении можно с помощью уравнения Клапейрона:
- Vm=RTp{\displaystyle V_{\rm {m}}={\frac {RT}{p}}}, где R ≈ 8,314 Дж/(моль·К) — универсальная газовая постоянная.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Это положение имело важное значение для развития химии, так как оно дает возможность определять молекулярную массу веществ, способных переходить в газообразное или парообразное состояние (см. Атомно-молекулярное учение). Если через μ обозначить молекулярную массу вещества и через ρ′ — его относительную плотность в газообразном состоянии, то отношение μ / ρ′ должно быть постоянным для всех веществ. Опыт показал, что для всех изученных веществ, переходящих в газообразное состояние без разложения, эта постоянная равна 28,9 а.е.м. (атомных единицы массы), если при определении относительную плотность исходить из плотности воздуха; но эта постоянная будет равняться 2 а.е.м., если принять за единицу плотность водорода. Обозначив эту постоянную, или, что то же, общее для всех газов отношение молекулярной массы к относительной плотности через С, мы из формулы имеем с другой стороны μ′ = ρ′C. Так как относительная плотность ρ′ газа определяется легко, то, подставив её значение в формулу, можно вывести и неизвестную молекулярную массу данного вещества.
Пример использования закона Авогадро
Элементный анализ одного из углеводородов, выполненный А. М. Бутлеровым, указывал, что отношение атомного содержания углерода к водороду составляет в нём 1 к 2, а потому его относительный состав может быть выражен формулой СН2 или C2H4, C4H8 и вообще (СН2)n. Молекулярная масса этого углеводорода определяется, следуя закону Авогадро, из плотности его пара, которая оказалась в 5,85 раз больше плотности воздуха; отсюда молекулярная масса этого вещества равна ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м. Формуле C11H22 отвечает молекулярная масса 154 а.е.м., формуле C12H24 — 168 а.е.м., а C13H26 — 182 а.е.м. Формула C12H24 (циклододекан) близко отвечает наблюдаемой величине, а потому она и должна выражать собой состав молекулы исследуемого углеводорода (CH2)n.
Примечания
- ↑ Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2-х томах. Пер. с англ.. — М. : Мир, 1982. — Т. 1. — С. 62—65, 295. — 652 с. : ил.
- ↑ Глинка Н. Л. Общая химия. — 22 изд., испр. — Л. : Химия, 1977. — С. 18—19. — 719 с.
Литература
Ссылки
АВОГАДРО ЧИСЛО | Энциклопедия Кругосвет
Содержание статьи
АВОГАДРО ЧИСЛО, NA = (6,022045±0,000031)·1023, число молекул в моле любого вещества или число атомов в моле простого вещества. Одна из фундаментальных постоянных, с помощью которой можно определить такие величины, как, например, массу атома или молекулы (см. ниже), заряд электрона и т.д.
Моль – количество вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 12 г 12С, причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моль вещества, выраженная в граммах, численно равна его мол. массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит 6,02·1023 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2·18,998) = 78,076 г и содержит 6,02·1023 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4·35,453) = 153,823 г и т.п.
Масса 1 моль вещества, выраженная в граммах, численно равна его мол. массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит 6,02·1023 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2·18,998) = 78,076 г и содержит 6,02·1023 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4·35,453) = 153,823 г и т.п.
Закон Авогадро.
На заре развития атомной теории (1811) А.Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объемах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при стандартных температуре и давлении (0° С, 1,01Ч105 Па) равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й.Лошмидт; было установлено, что в 1 см3 идеального газа при нормальных (стандартных) условиях содержится 2,68675Ч1019 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Метод Лошмидта
представляет только исторический интерес. Он основан на предположении, что сжиженный газ состоит из плотноупакованных сферических молекул. Измеряя объем жидкости, которая образовалась из данного объема газа, и зная приблизительно объем молекул газа (этот объем можно было представить исходя из некоторых свойств газа, например вязкости), Лошмидт получил оценку числа Авогадро ~1022.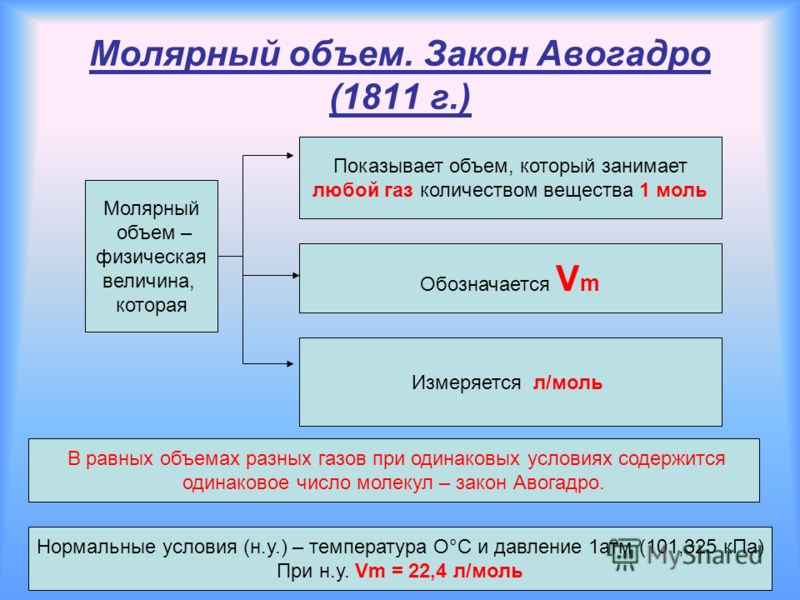
Определение, основанное на измерении заряда электрона.
Единица количества электричества, известная как число Фарадея F, – это заряд, переносимый одним молем электронов, т.е. F = Ne, где е – заряд электрона, N – число электронов в 1 моль электронов (т.е. число Авогадро). Число Фарадея можно определить, измеряя количество электричества, необходимое для растворения или осаждения 1 моль серебра. Тщательные измерения, выполненные Национальным бюро стандартов США, дали значение F = 96490,0 Кл, а заряд электрона, измеренный разными методами (в частности, в опытах Р.Милликена), равен 1,602Ч10–19 Кл. Отсюда можно найти N. Этот метод определения числа Авогадро, по-видимому, является одним из самых точных.
Эксперименты Перрена.
Исходя из кинетической теории, было получено включающее число Авогадро выражение, описывающее уменьшение плотности газа (например, воздуха) с высотой столба этого газа. Если бы удалось подсчитать число молекул в 1 см3 газа на двух разных высотах, то, воспользовавшись указанным выражением, мы могли бы найти N. К сожалению, сделать это невозможно, поскольку молекулы невидимы. Однако в 1910 Ж.Перрен показал, что упомянутое выражение справедливо и для суспензий коллоидных частиц, которые видны в микроскопе. Подсчет числа частиц, находящихся на разной высоте в столбе суспензии, дал число Авогадро 6,82Ч1023. Из другой серии экспериментов, в которых измерялось среднеквадратичное смещение коллоидных частиц в результате их броуновского движения, Перрен получил значение N = 6,86Ч1023. В дальнейшем другие исследователи повторили некоторые из экспериментов Перрена и получили значения, хорошо согласующиеся с ныне принятыми. Следует отметить, что эксперименты Перрена стали поворотным моментом в отношении ученых к атомной теории вещества – ранее некоторые ученые рассматривали ее как гипотезу. В.Оствальд, выдающийся химик того времени, так выразил это изменение во взглядах: «Соответствие броуновского движения требованиям кинетической гипотезы.
Если бы удалось подсчитать число молекул в 1 см3 газа на двух разных высотах, то, воспользовавшись указанным выражением, мы могли бы найти N. К сожалению, сделать это невозможно, поскольку молекулы невидимы. Однако в 1910 Ж.Перрен показал, что упомянутое выражение справедливо и для суспензий коллоидных частиц, которые видны в микроскопе. Подсчет числа частиц, находящихся на разной высоте в столбе суспензии, дал число Авогадро 6,82Ч1023. Из другой серии экспериментов, в которых измерялось среднеквадратичное смещение коллоидных частиц в результате их броуновского движения, Перрен получил значение N = 6,86Ч1023. В дальнейшем другие исследователи повторили некоторые из экспериментов Перрена и получили значения, хорошо согласующиеся с ныне принятыми. Следует отметить, что эксперименты Перрена стали поворотным моментом в отношении ученых к атомной теории вещества – ранее некоторые ученые рассматривали ее как гипотезу. В.Оствальд, выдающийся химик того времени, так выразил это изменение во взглядах: «Соответствие броуновского движения требованиям кинетической гипотезы. .. заставило даже наиболее пессимистично настроенных ученых говорить об экспериментальном доказательстве атомной теории».
.. заставило даже наиболее пессимистично настроенных ученых говорить об экспериментальном доказательстве атомной теории».
Расчеты с использованием числа Авогадро.
С помощью числа Авогадро были получены точные значения массы атомов и молекул многих веществ: натрия, 3,819Ч10–23 г (22,9898 г/6,02Ч1023), тетрахлорида углерода, 25,54Ч10–23 г и т.д. Можно также показать, что в 1 г натрия должно содержаться примерно 3Ч1022 атомов этого элемента.
См. также АТОМНАЯ МАССА.
Закон Авогадро — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Резюме
- Авторы и авторства
Обнаружение того, что объем газа прямо пропорционален количеству содержащихся в нем частиц, имело решающее значение для установления формул для простых молекул в то время (около 1811 г. ), когда различие между атомами и молекулы не были ясно поняты.В частности, существование двухатомных молекул таких элементов, как \ (H_2 \), \ (O_2 \) и \ (Cl_2 \) не было признано до тех пор, пока не были интерпретированы результаты экспериментов с объемами газа.
), когда различие между атомами и молекулы не были ясно поняты.В частности, существование двухатомных молекул таких элементов, как \ (H_2 \), \ (O_2 \) и \ (Cl_2 \) не было признано до тех пор, пока не были интерпретированы результаты экспериментов с объемами газа.
Ранние химики ошибочно предположили, что формула для воды была \ (HO \), что привело к неверному расчету молекулярной массы кислорода как 8 вместо 16. Однако, когда химики обнаружили, что предполагаемая реакция
\ [H + Cl → HCl \]
давал вдвое больший объем, чем \ (HCl \), они поняли, что водород и хлор являются двухатомными молекулами.Химики изменили уравнение реакции на
.
\ [H_2 + Cl_2 → 2HCl. \]
Когда химики пересмотрели свой эксперимент с водой и свою гипотезу о том, что
\ [HO \ rightarrow H + O \]
они обнаружили, что объем потребляемого газообразного водорода в два раза больше, чем кислорода. По закону Авогадро это означало, что водород и кислород объединяются в соотношении 2: 1. Это открытие привело к правильной молекулярной формуле воды (\ (H_2O \)) и правильной реакции
Это открытие привело к правильной молекулярной формуле воды (\ (H_2O \)) и правильной реакции
\ [2H_2O → 2H_2 + O_2.\]
Сводка
- Число молекул или атомов в определенном объеме идеального газа не зависит от размера или молярной массы газа.
- Закон Авогадро формулируется математически следующим образом: \ (\ frac {V} {n} = k \), где \ (V \) — объем газа, n — количество молей газа, а k — константа пропорциональности.
- Объемные отношения должны быть связаны с относительным числом реагирующих молекул; эта связь имела решающее значение для установления формул простых молекул в то время, когда различие между атомами и молекулами еще не было ясно понято.
Авторы и авторство
ChemTeam: Закон о газе — Закон Авогадро
ChemTeam: Закон о газе — Закон Авогадро
Закон Авогадро:
Десять примеров
Обнаружен Амедо Авогадро, известным по гипотезе Авогадро. Команда ChemTeam не знает, когда, но, вероятно, где-то в начале 1800-х годов.
Команда ChemTeam не знает, когда, но, вероятно, где-то в начале 1800-х годов.
Указывает соотношение между объемом и количеством, когда давление и температура поддерживаются постоянными. Помните, что количество измеряется в молях.Кроме того, поскольку объем является одной из переменных, это означает, что контейнер, содержащий газ, в некотором роде гибкий и может расширяться или сжиматься.
Если количество газа в баллоне увеличивается, объем увеличивается.
Если количество газа в баллоне уменьшается, объем уменьшается.
Почему?
Допустим, сумма увеличена. Это означает, что молекул газа больше, и это увеличит количество ударов по стенкам контейнера. Это означает, что давление газа внутри контейнера увеличится (на мгновение), становясь больше, чем давление снаружи стенок.Это заставляет стены двигаться наружу. Поскольку на стене больше места, удары уменьшатся, и давление вернется к исходному значению.
Математическая форма закона Авогадро:
Это означает, что объемная доля всегда будет постоянной, если давление и температура остаются постоянными.
Пусть V 1 и n 1 будут парой данных объем-количество в начале эксперимента. Если количество изменится на новое значение, называемое n 2 , то громкость изменится на V 2 .
Мы знаем это:
И мы это знаем:
Поскольку k = k, можно сделать вывод:
В 1 В 2 ––– = ––– n 1 n 2
Это уравнение будет очень полезно при решении проблем закона Авогадро. Вы также увидите, что это отображается следующим образом:
V 1 / n 1 = V 2 / n 2
Иногда вы увидите закон Авогадро в перемноженной форме:
V 1 n 2 = V 2 n 1
Закон Авогадро является прямым математическим соотношением. Если одна газовая переменная (V или n) изменится в значении (вверх или вниз), другая переменная также изменится в том же направлении. Константа K останется прежней.
Если одна газовая переменная (V или n) изменится в значении (вверх или вниз), другая переменная также изменится в том же направлении. Константа K останется прежней.
Пример № 1: Известно, что 5,00 л газа содержат 0,965 мол. Если количество газа увеличить до 1,80 моль, какой новый объем получится (при неизменной температуре и давлении)?
Раствор:
Я буду использовать V 1 n 2 = V 2 n 1
(5.00 л) (1,80 моль) = (x) (0,965 моль)
x = 9,33 л (для трех сигнатур)
Пример № 2: Цилиндр с подвижным поршнем содержит 2,00 г гелия, He, при комнатной температуре. В цилиндр добавляли еще гелий и регулировали объем так, чтобы давление газа оставалось неизменным. Сколько граммов гелия было добавлено в цилиндр, если объем был изменен с 2,00 л на 2,70 л? (Температура поддерживалась постоянной.)
Раствор:
1) Перевести граммы He в моль:
2.
00 г / 4,00 г / моль = 0,500 моль
2) Используйте закон Авогадро:
V 1 / n 1 = V 2 / n 2
2,00 л / 0,500 моль = 2,70 л / x
x = 0,675 моль
3) Вычислить граммы Он добавил:
0,675 моль — 0,500 моль = 0,175 моль
(0,175 моль) (4,00 г / моль) = 0,7 г He добавил
Пример № 3: Воздушный шар содержит определенную массу неонового газа. Температура поддерживается постоянной, и в баллон добавляют ту же массу газообразного аргона.Что происходит?
(a) Объем баллона увеличивается вдвое.
(b) Объем воздушного шара увеличивается более чем в два раза.
(c) Объем воздушного шара увеличивается менее чем в два раза.
(d) Баллон остается того же размера, но давление увеличивается.
(e) Ничего из вышеперечисленного.
Раствор:
Мы можем выполнить расчет по закону Авогадро:
V 1 / n 1 = V 2 / n 2
Давайте присвоим V 1 1 л, а V 2 будет нашим неизвестным.
Приведем 1 моль для количества неонового газа и присвоим его n 1 .
Масса добавленного аргона в точности равна массе неона, но аргон имеет более высокий грамм-атомный вес (молярную массу), чем неон. Следовательно, будет добавлено менее 1 моля Ar. Давайте возьмем 1,5 моль для общего количества молей в баллоне (это будет n 2 ) после добавления Ar. (Я выбрал 1,5, потому что неон весит около 20 г / моль, а аргон — около 40 г / моль.)
1/1 = х / 1.5
х = 1,5
вариант ответа (c).
Пример № 4: Гибкий контейнер при начальном объеме 5,120 л содержит 8,500 моль газа. Затем в контейнер добавляют еще газа, пока он не достигнет конечного объема 18,10 л. Предполагая, что давление и температура газа остаются постоянными, рассчитайте количество молей газа, добавленного в контейнер.
Раствор:
V 1 / n 1 = V 2 / n 2
5. 120 л
18,10 л –––––––– = –––––– 8,500 моль х x = 30,05 моль 30,05 — 8,500 = 21,55 моль (для четырех сигнатур)
Обратите внимание на спецификацию задачи для определения количества добавленного газа в молях. Расчет по закону Авогадро дает вам общее количество молей, необходимых для этого объема, а НЕ количество добавленных молей газа. Вот почему существует вычитание.
Пример № 5: Если 0,00810 моль газообразного неона при определенной температуре и давлении занимает объем 214 мл, какой объем будет занимать 0,00684 моль газообразного неона при тех же условиях?
Раствор:
1) Обратите внимание на одинаковые условия для температуры и давления. Сохранение этих двух постоянных значений означает, что объем и количество молей будут изменяться. Газовый закон, описывающий соотношение объема и моля, — это закон Авогадро:
Газовый закон, описывающий соотношение объема и моля, — это закон Авогадро:
В 1 В 2 ––– = –––– n 1 n 2
2) Подстановка значений дает:
214 мл V 2 –––––––––– = ––––––––––– 0.00810 моль 0,00684 моль
3) Перемножьте и разделите ответ:
V 2 = 181 мл (для трех сигнатур)
Когда я сделал фактический расчет для этого ответа, я использовал 684 и 810 при вводе значений в калькулятор.
4) Этот ответ может показаться вам интересным:
Разделив PV 1 = n 1 RT на PV 2 = n 2 RT, получим
V 1 / V 2 = n 1 / n 2
V 2 = V 1 n 2 / n 1
V 2 = [(214 мл) (0.00684 моль)] / 0,00810 моль
V 2 = 181 мл
Если вы не знаете, PV = nRT называется законом идеального газа. Вы увидите это чуть позже в своем блоке «Законы о газе», если еще не сделали этого.
Пример № 6: Гибкий контейнер при начальном объеме 6,13 л содержит 7,51 моль газа. Затем в контейнер добавляют еще газа, пока он не достигнет конечного объема 13,5 л. Предполагая, что давление и температура газа остаются постоянными, рассчитайте количество молей газа, добавленного в контейнер.
Раствор:
1) Давайте начнем с изменения закона идеального газа (который вы увидите чуть позже или можете просмотреть прямо сейчас):
PV = nRT
В / н = RT / P
R — это, конечно, постоянная величина.
2) Т и Р постоянны, как указано в задаче. Следовательно, мы можем написать это:
к = RT / P
где k — некоторая постоянная.
3) Следовательно, это правда:
В / п = к
4) Учитывая V и n при двух различных наборах условий, мы имеем:
V 1 / n 1 = k
В 2 / n 2 = k
5) Поскольку k = k, имеем следующее соотношение:
V 1 / n 1 = V 2 / n 2
6) Вставьте данные и решите:
6.13 / 7,51 = 13,5 / п
(6,13) (п) = (13,5) (7,51)
n = [(13,5) (7,51)] / 6,13
n = 16,54 моль (это не окончательный ответ)
7) Заключительный этап:
16,54 — 7,51 = 9,03 моль (это количество молей газа, которое было добавлено)
Пример № 7: Контейнер объемом 25,47 л вмещает 1,050 моль газообразного кислорода (O 2 ), молярная масса которого составляет 31,9988 г / моль. Каков объем, если из контейнера удалить 7,210 г газообразного кислорода при условии, что давление и температура остаются постоянными?
Каков объем, если из контейнера удалить 7,210 г газообразного кислорода при условии, что давление и температура остаются постоянными?
Решение № 1:
1) Начальная масса O 2 :
(1.050 моль) (31,9988 г / моль) = 33,59874 г
2) Конечная масса O 2 :
33,59874 — 7,210 = 26,38874 г
3) Конечные родинки O 2 :
26,38874 г / 31,9988 г / моль = 0,824679 моль
4) Используйте закон Авогадро:
V 1 / n 1 = V 2 / n 2
25,47 л / 1,050 моль = V 2 / 0,824679 моль
В 2 = 20,00 л
Решение № 2:
1) Переведем массу удаленного O 2 в моль:
7.210 г / 31,9988 г / моль = 0,225321 моль
2) Вычтите количество удаленных молей O 2 :
1,050 моль — 0,225321 моль = 0,824679 моль
3) Используйте закон Авогадро, как указано выше.
Решение № 3:
1) Это решение зависит от того, насколько массовое соотношение совпадает с мольным. Позвольте мне объяснить, используя закон Авогадро:
В 1 В 2 –––– = –––– n 1 n 2
2) Замените моль массой, разделенной на молярную массу:
В 1 V 2 ––––––––––– = ––––––––––– масса 1 / мм масса 2 / мм
3) Поскольку молярная масса состоит из одного и того же вещества (в данном случае кислорода), они уравновешиваются, оставляя нас с этим:
В 1 В 2 –––– = –––– масса 1 Масса 2
4) Решите, используя соответствующие значения
25. 47 л
V 2 –––––––– = –––––––– 33,59874 г 26,38874 г V 2 = 20,00 л
Пример № 8: Какой объем (в л) будет занимать 5,5 г газообразного кислорода, если 2,2 г газообразного кислорода занимает 3,0 л? (При постоянном давлении и температуре.)
Раствор:
1) Укажите закон идеального газа:
P 1 V 1 P 2 V 2 ––––– = ––––– n 1 T 1 n 2 T 2 Обратите внимание, что это полная версия, которая включает количество молей газа.
Обычно используется укороченный вариант без родинок. Поскольку речь идет о граммах (что приводит к появлению родинок), мы решили использовать полную версию.
2) Проблема утверждает, что P и T постоянны:
В 1 В 2 ––– = ––– n 1 n 2
3) Перемножьте и перегруппируйте, чтобы выделить V 2 :
V 2 n 1 = V 1 n 2
V 2 = (V 1 ) (n 2 / n 1 )
4) моль = масса / молекулярная масса:
n = масса / мВт
V 2 = (V 1 ) [(масса 2 / мВт) / (масса 1 / мВт)]
5) mw является константой (поскольку они оба являются молекулярной массой кислорода), что означает, что ее можно исключить:
V 2 = (V 1 ) (масса 2 / масса 1 )
6) Решить:
В 2 = (3.
0 л) (5,5 г / 2,2 г)
В 2 = 7,5 л
Пример № 9: При определенной температуре и давлении один моль двухатомного газа H 2 занимает объем 20 л. Каким будет объем одного моля атомов H в тех же условиях?
Раствор:
Один моль молекул H 2 содержит 6,022 x 10 23 H 2 молекул.
Один моль атомов H содержит 6,022 x 10 23 атомов H.
Количество независимых «частиц» в каждом образце одинаково.
Следовательно, объемы, занимаемые двумя образцами, одинаковы. Объем пробы атомов H составляет 20 л.
Кстати, я согласен с тем, что один моль H 2 имеет вдвое больше атомов, чем один моль атомов H. Однако атомы в H 2 связаны в один моль молекул, что означает, что одна молекула H 2 (с двумя атомами) считается одной независимой «частицей» при рассмотрении поведения газа.
Пример № 10: Гибкий контейнер при начальном объеме 6,13 л содержит 8,51 моль газа. Затем в контейнер добавляют еще газа, пока он не достигнет конечного объема 15,5 л. Предполагая, что давление и температура газа остаются постоянными, рассчитайте количество молей газа, добавленного в контейнер.
Затем в контейнер добавляют еще газа, пока он не достигнет конечного объема 15,5 л. Предполагая, что давление и температура газа остаются постоянными, рассчитайте количество молей газа, добавленного в контейнер.
Раствор:
1) Государственный закон Авогадро в разрешающей форме:
В 1 В 2 ––– = –––– n 1 n 2
2) Подставьте значения в уравнение и решите:
6.13 л 15,5 л ––––––– = –––––– 8,51 моль х x = 21,5 моль
3) Определите количество добавленного газа в молях:
21,5 моль — 8,51 моль = 13,0 моль (при правильном округлении)
Bonus Пример: Цилиндр с подвижным поршнем содержит 2,00 г гелия, He, при комнатной температуре. В цилиндр добавляли еще гелий и регулировали объем так, чтобы давление газа оставалось неизменным.Сколько граммов гелия было добавлено в цилиндр, если объем был изменен с 2,00 л на 2,50 л? (Температура поддерживалась постоянной.)
В цилиндр добавляли еще гелий и регулировали объем так, чтобы давление газа оставалось неизменным.Сколько граммов гелия было добавлено в цилиндр, если объем был изменен с 2,00 л на 2,50 л? (Температура поддерживалась постоянной.)
Раствор:
1) Двумя переменными являются объем и количество газа (температура и давление постоянны). Газовый закон, связывающий эти две переменные, — это закон Авогадро:
В 1 В 2 ––– = –––– n 1 n 2
2) Переводим граммы в моль:
2.00 г / 4,00 г / моль = 0,500 моль
3) Теперь воспользуемся законом Авогадро:
2,00 л 2,50 л –––––––– = –––––– 0,500 моль х x = [(0,500 моль) (2,50 л)] / 2,00 л
x = 0,625 моль
4) Это общее количество молей для создания 2,50 л.
Нам нужно преобразовать обратно в граммы:
(4.00 г / моль) (0,125 моль) = 0,500 г Обратите внимание, что я вычел 0,500 моль из 0,625 моль и использовал 0,125 моль в расчетах. Это потому, что я хочу добавить сумму, а не окончательную конечную сумму.
ChemTeam: Закон о газах — Закон Дальтона и другие проблемы с парциальным давлением
ChemTeam: закон газа — закон Дальтона и другие проблемы с парциальным давлением
Закон парциальных давлений Дальтона
и другие проблемы с парциальным давлением
Десять примеров
Этот закон был открыт Джоном Далтоном в 1801 году.
Для любого чистого газа (возьмем гелий) справедливо PV = nRT. Следовательно, P прямо пропорционально n, если V и T остаются постоянными. Чем больше n, тем выше будет и P. Или наоборот.
Предположим, вы должны удвоить количество молей присутствующего газообразного гелия. Что случилось бы?
Ответ: давление газа увеличивается вдвое.
Однако предположим, что новое количество добавленного газа было другим газом. Допустим, вы добавили неон вместо гелия.
Что будет с давлением?
Ответ: давление удваивается, как и раньше.
Закон Дальтона сразу следует из этого примера, поскольку каждый газ создает 50% давления. Суммирование их двух давлений дает общее давление.
В виде уравнения это выглядит так:
P He + P Ne = P всего
Закон парциальных давлений Дальтона: каждый газ в смеси создает давление, как если бы другие газы не присутствовали. Общее давление — это сумма давлений, создаваемых газами в смеси.
P всего = P 1 + P 2 + P 3 + …. + P n
Где n — общее количество газов в смеси.
Единственная необходимость состоит в том, чтобы два газа не взаимодействовали каким-либо химическим образом, например, взаимодействуя друг с другом.
Давление, которое каждый газ оказывает в смеси, называется его парциальным давлением.
Чаще всего закон Дальтона используется в средней школе с водяным паром.
Обычный метод сбора газа во время эксперимента — улавливание его «над водой». Перевернутая бутылка, наполненная водой, находится в водяной бане. Трубка из реакционного сосуда направляет газ в бутылку, где он пузырится вверх и вытесняет воду, которая выходит из горлышка бутылки в водяную баню.
Однако возникает неизбежная проблема. Газ насыщается водяным паром, и теперь общее давление внутри баллона является суммой двух давлений — самого газа и добавленного водяного пара.
НАМ НЕ НУЖНО ДАВЛЕНИЕ ВОДЯНОГО ПАРА.
Так что избавляемся от него вычитанием.
Это означает, что мы должны откуда-то получить давление водяного пара.
Мы получаем это из таблицы, потому что давление водяного пара зависит только от температуры, а НЕ от размера емкости или давления другого газа. Обычно в учебнике есть сокращенная таблица с более полными таблицами в справочных руководствах, таких как «Справочник по химии и физике».»
Обычно в учебнике есть сокращенная таблица с более полными таблицами в справочных руководствах, таких как «Справочник по химии и физике».»
Вот пример: 0,750 л газа собирается над водой при температуре 23,0 ° C с общим давлением 99,75 кПа. Какое давление сухого газа? Посмотрите здесь данные о давлении пара.
Для решения мы ищем давление пара и находим, что оно равно 2,8104.
Затем выполняем вычитание:
99,75 кПа — 2,8104 кПа = 96,9396 кПа
Затем мы округляем до четырех значащих цифр для окончательного ответа:
96,94 кПа
Другое распространенное понятие, которое возникает в контексте закона Дальтона, — это мольная доля.
Предположим, у вас есть равные моли двух разных газов в смеси. Тогда мольная доля для каждого будет 0,50.
Мольная доля каждого газа — это просто количество молей этого газа, деленное на общее количество молей в смеси.
Вроде достаточно просто. Как это связано с законом Далтона?
Как это связано с законом Далтона?
Ответ: мольная доля также дает долю от общего давления каждого газа. Таким образом, если мольная доля газа равна 0,50, то он будет составлять 50% от общего давления.Если бы мольная доля газа составляла 0,15, то его парциальное давление было бы в 0,15 раза больше общего давления.
Верно и обратное. Если вы разделите парциальное давление газа на общее давление, вы получите мольную долю этого газа. (Надеюсь, вы уже достаточно знаете, что два давления должны быть в одних и тех же единицах!)
Кстати, мольные доли — это безразмерные числа. Единицы измерения моль (или давление) сокращаются.
Пример № 1: Контейнер содержит три газа: кислород, диоксид углерода и гелий.Парциальные давления трех газов составляют 2,00 атм, 3,00 атм и 4,00 атм соответственно. Какое полное давление внутри контейнера?
Раствор:
1) Используя символы, я пишу закон парциальных давлений Дальтона:
P до = P O 2 + P CO 2 + P He
2) Сумма всех парциальных давлений в емкости дает нам общее давление:
P до = 2.
00 атм + 3,00 атм + 4,00 атм = 9,00 атм
Пример № 2: Парциальное давление F 2 в смеси газов, где полное давление составляет 1,00 атм, составляет 300. Торр. Какова мольная доля F 2 ?
Раствор:
Давайте возьмем 760 торр на 1,00 атм.
300. торр / 760. торр = 0,395
Пример № 3: 80,0 литров кислорода собирают над водой при 50,0 ° C. Атмосферное давление в помещении 96.00 кПа. Какое парциальное давление кислорода?
Раствор:
P до = P O 2 + P H 2 O
96,00 кПа = P O 2 + 12,344 кПа
P O 2 = 83,66 кПа
Пример № 4: Если 60,0 л азота собирается над водой при 40,0 ° C, когда атмосферное давление составляет 760,0 мм рт. Ст., Каково парциальное давление азота?
Раствор:
1) Во-первых, изложение закона Дальтона:
P до = P N 2 + P H 2 O
2) Далее небольшая работа над P H 2 O :
Мы должны найти давление водяного пара на 40.
0 ° С. Мы делаем это и находим его 7,3814 кПа. Для решения этой задачи нам понадобится значение в мм рт.
(7,3814 кПа) (760,0 мм рт. Ст. / 101,325 кПа) = 55,4 мм рт.
Между прочим, я сверился со списком, в котором указаны значения в кПа. В Интернете можно найти множество наборов данных о давлении водяных паров, и многие из них содержат значения в мм рт. Вот пример одного.
3) Определите парциальное давление азота:
760,0 атм = P N 2 + 55.4 мм рт.
P N 2 = 704,6 мм рт. Ст.
4) Обратите внимание, что в задаче написано «атмосферное давление». Однако действительно ли полное давление внутри контейнера равно давлению вне контейнера? Мы должны предположить, что да, потому что отрицание означает, что проблема не может быть решена. И намерение автора состоит в том, чтобы дать проблему, которую можно решить, а не проблему, которую нельзя решить.
Пример № 5: Смесь 2 моль H 2 , 3 моля NH 3 , 4 моля CO 2 и 5 моль N 2 создает общее давление 800 . торр. Какое парциальное давление каждого газа?
торр. Какое парциальное давление каждого газа?
Раствор:
1) Определите общее количество молей газа:
2 + 3 + 4 + 5 = 14 моль
2) Определите парциальное давление каждого газа:
H 2 —> (800. торр) (2/14) = 114 торр
NH 3 —> (800. торр) (3/14) = 171 торр
CO 2 —> (800 торр) (4/14) = 228 торр
N 2 —> (800. торр) (5/14) = 286 торр
3) Комментарий:
Обратите внимание, что 114 + 171 + 228 + 286 равно 799, поэтому у нас есть небольшая ошибка из-за округления.Обычное решение — определить последнее значение вычитанием, а не прямым вычислением.
Пример № 6: Если вы поместите 3,00 моль N 2 и 4,00 моль O 2 в контейнер объемом 35,0 л при 25,0 ° C, какое будет давление полученной смеси газов?
Раствор:
1) Общее давление в баллоне — это сумма парциальных давлений газов (закон Дальтона):
3,00 моль + 4.
00 моль = 7,00 моль
2) Закон идеального газа используется для расчета полного давления:
PV = nRT
(P) (35,0 л) = (7,00 моль) (0,08206 л атм / моль K) (273 K)
P = 4,48 атм
Пример № 7: Газовая смесь содержит водород, гелий, неон и аргон. Общее давление смеси 93,6 кПа. Парциальные давления гелия, неона и аргона составляют 15,4 кПа, 25,7 кПа и 35,6 кПа соответственно. Какое давление расширяет водород?
Раствор:
Используйте закон частичных давлений Дальтона:
93.6 — (15,4 + 25,7 + 35,6) = 16,9 кПа
Пример № 8: В колбу помещают смесь 14,0 г водорода, 84,0 г азота и 2,00 моль кислорода. Когда парциальное давление кислорода составляет 78,00 мм рт. Ст., Каково полное давление в колбе?
Раствор:
1) Определите количество молей каждого газа:
азот —> 84,0 г / 28,014 г / моль = 2,9985 моль
водород —> 14,0 г / 1,008 г / моль = 13.8889 моль
кислород —> 2,00 моль
2) Сложите родинки и получите общее количество родинок:
2,9985 моль + 13,8889 моль + 2,00 моль = 18,8874 моль
3) Разделите каждое мольное количество на общее количество молей, чтобы получить мольную долю для каждого газа:
азот —> 2,9985 моль / 18,8874 моль = 0,15876
водород —> 13,8889 моль / 18,8874 моль = 0,735353
кислород —> 2,00 моль / 18,8874 моль = 0,10589Обратите внимание на это:
0,15876 + 0.735353 + 0,10589 = 1,000003
Разумеется, он должен быть равен 1. То, что это не так, конечно же, связано с округлением. Во многих случаях значение немного ниже 1, например 0,999997.
Чтобы справиться с этим, для получения окончательного значения используйте вычитание, а не деление. В следующем примере я воспользуюсь вычитанием.
Примечание: я мог бы просто округлить водородное значение до 0,73535.
4) Мы будем использовать информацию о кислороде в двух соотношениях и пропорциях, чтобы определить парциальные давления азота и водорода.
Азот:
0,10589 0,15876 ––––––––––– = ––––––– 78,00 мм рт. х x = 116,94 мм рт. Ст.
Водород:
0,10589 0,735353 ––––––––––– = –––––––– 78.00 мм рт. Ст. х x = 541,67 мм рт. Ст.
5) Общее давление получается путем сложения парциальных давлений:
541,67 + 116,94 + 78,00 = 736,61 мм рт. Ст.
Пример № 9: Смесь газов содержит 2,14 г N 2 , 5,85 г H 2 и 4,18 г NH 3 . Если общее давление смеси составляет 4,58 атм, каково парциальное давление каждого компонента?
Если общее давление смеси составляет 4,58 атм, каково парциальное давление каждого компонента?
Раствор:
1) Определите количество молей каждого газа:
азот —> 2.14 г / 28,014 г / моль = 0,07639 моль
водород —> 5,85 г / 1,008 г / моль = 5,80357 моль
аммиак —> 4,18 г / 17,031 г / моль = 0,245435 моль
2) Сложите родинки и получите общее количество родинок:
0,07639 моль + 5,80357 моль + 0,245435 моль = 6,125435 моль
3) Разделите каждое количество молей на общее количество молей:
азот —> 0,07639 моль / 6,125435 моль = 0,01248
водород —> 5,80357 моль / 6,125435 моль = 0,94745
аммиак —> 0.245435 моль / 6,125435 моль = 0,04007Определяет мольную долю каждого газа. Кроме того, я фактически получил мольную долю азота путем вычитания. Как это:
1 — [0,94745 + 0,04007] = 0,01248
4) Умножьте мольную долю каждого газа на общее давление. Каждый ответ — парциальное давление газа.
Каждый ответ — парциальное давление газа.
азот —> 4,58 атм — [4,34 + 0,184] = 0,056 атм водород —> (4,58 атм) (0,94745) = 4,34 атм
аммиак —> (4.58 атм) (0,04007) = 0,184 атм
Пример № 10: Колба содержит 2,00 моля азота и 2,00 моль гелия. Сколько граммов аргона нужно накачать в колбу, чтобы парциальное давление аргона было вдвое выше, чем у гелия?
Раствор:
Рассмотрим только гелий. Аргон должен быть в два раза больше моля He, чтобы иметь удвоенную мольную долю. Это потому, что мольная доля каждого газа пропорциональна парциальному давлению газа.
Следовательно, требуется 4,00 моль аргона. 4,00 моль умножить на 40,0 г / моль дает 160 г для ответа.
Обратите внимание на мольные доли после добавления 4,00 моль:
N 2 —> 2/8 = 0,25
He —> 2/8 = 0,25
Ar —> 4/8 = 0,50
Бонус Пример: Контейнер с двумя газами, гелием и аргоном, содержит 30,0% гелия по объему. Вычислите парциальное давление гелия и аргона, если общее давление внутри контейнера равно 4.00 атм.
Вычислите парциальное давление гелия и аргона, если общее давление внутри контейнера равно 4.00 атм.
Раствор:
Температура и давление остаются постоянными, поэтому применима гипотеза Авогадро:
два образца газа равного объема, при одинаковой температуре и давлении, содержат одинаковое количество молекул.
Это означает, что гелий, составляющий 30,0% объема, также содержит 30% молекул. Это означает, что мольная доля гелия составляет 0,300. Вследствие этого:
(4,00 атм) (0,300) = 1,20 атм
— парциальное давление гелия.
Парциальное давление аргона получается вычитанием:
4,00 атм — 1,20 атм = 2,80 атм
ChemTeam: Закон о газе — Закон о комбинированном газе
ChemTeam: Закон о газе — Закон о комбинированном газе
Закон о комбинированном газе
Десять примеров
Вот один из способов «вывести» Закон о комбинированном газе:
Шаг 1: Напишите форму решения проблемы закона Бойля:
P 1 V 1 = P 2 V 2
Шаг 2: Умножьте на форму решения проблем Чарльза Лоу:
(P 1 V 1 ) (V 1 / T 1 ) = (P 2 V 2 ) (V 2 / T 2 )
P 1 V 1 2 / T 1 = P 2 V 2 2 / T 2
Шаг 3: Умножьте на форму решения проблемы закона Гей-Люссака:
(P 1 V 1 2 / T 1 ) (P 1 / T 1 ) = (P 2 V 2 2 / T 2 ) (P 2 / T 2 )
P 1 2 V 1 2 / T 1 2 = P 2 2 V 2 2 / T 2 2
Шаг 4: Извлеките квадратный корень, чтобы получить комбинированный газовый закон:
P 1 V 1 / T 1 = P 2 V 2 / T 2
В Интернете часто пишут о законе о комбинированном газе. Вы также можете увидеть его набранным так:
Вы также можете увидеть его набранным так:
P 1 V 1 P 2 V 2 ––––– = ––––– Т 1 т 2
При решении задач закона о комбинированном газе часто используется перекрестное умножение. Я обнаружил, что использование приведенной выше формулировки помогает визуализировать то, что нужно перемножать.
Если включить все шесть законов о газе (три выше, а также Avogadro, Diver и «no-name»), мы получим следующее:
P 1 V 1 / n 1 T 1 = P 2 V 2 / n 2 T 2
Или вот так:
P 1 V 1 P 2 V 2 ––––– = ––––– n 1 T 1 n 2 T 2
Однако этот более полный закон комбинированного газа обсуждается редко. Следовательно, мы (по большей части) проигнорируем это в будущих обсуждениях и будем использовать (в основном) закон, указанный в шаге 4 выше. Я поставил задачу с четырьмя переменными под номером 11 в файле Probs 1-10. (Это 11 не опечатка.)
Следовательно, мы (по большей части) проигнорируем это в будущих обсуждениях и будем использовать (в основном) закон, указанный в шаге 4 выше. Я поставил задачу с четырьмя переменными под номером 11 в файле Probs 1-10. (Это 11 не опечатка.)
Другой способ «вывести» наиболее распространенный трехуровневый закон комбинированного газа обсуждается в примере № 5 ниже. В нем я использую три закона: Бойля, Шарля и Гей-Люссака.
Пожалуйста, перейдите по этой ссылке, чтобы получить тот же самый закон комбинированного газа из трех уравнений, основанный только на законах Бойля и Чарльза.Комментарий: Я видел в Интернете материалы, в которых Закон о комбинированном газе называется Общим законом о газе. Я считаю неразумным пытаться переименовать Закон о комбинированном газе, но я не могу остановить попытку. Вы, как студент, должны будете знать об этом и, как следствие, выучить оба термина.
Пример # 0: Какой газовый закон вы использовали бы, если бы давление, объем и моль изменялись, а температура оставалась постоянной?
Решение: Вы бы использовали необычную форму закона комбинированного газа.
1) Напишите полный закон о комбинированных газах:
P 1 V 1 P 2 V 2 ––––– = ––––– n 1 T 1 n 2 T 2
2) Температура, будучи постоянной, падает:
P 1 V 1 P 2 V 2 ––––– = ––––– n 1 n 2 Это форма Закона о комбинированном газе, которая будет использоваться.
3) Можно легко сформулировать другие формы этого вопроса: какой газовый закон вы бы использовали, если бы объем, моль и температура изменялись, а давление оставалось постоянным? Ответ: другая форма закона о комбинированном газе, которая встречается нечасто.
В 1 В 2 ––––– = ––––– n 1 T 1 n 2 T 2
Пример №1: 2.00 л газа собирается при 25,0 ° C и 745,0 мм рт. Какой объем у STP?
Раствор:
1) Вы должны понимать, что в задаче даны пять (из шести возможных) значений, а шестое — это x. Также не забудьте изменить температуру по Цельсию на Кельвин.
2) Когда подобные проблемы были решены в классе ChemTeam (ChemTeam теперь исключен из класса), я бы написал матрицу решения, например:
P 1 = P 2 = В 1 = В 2 = T 1 = T 2 = и заполните его данными о проблеме.
3) Вот правая часть, заполненная значениями STP:
P 1 = P 2 = 760,0 мм рт. V 1 = V 2 = x T 1 = T 2 = 273 K
Комментарий: вы можете быть уверены, что термин «STP» (стандартная температура и давление) появится в формулировке хотя бы одного тестового вопроса в вашем классе.ChemTeam рекомендует вам запомнить различные стандартные условия. Если ваш учитель разрешает использовать «шпаргалку» в тесте, УБЕДИТЕСЬ, что эти значения там есть.
4) Вот полностью заполненная матрица решения:
P 1 = 745,0 мм рт. Ст. P 2 = 760,0 мм рт. Ст. V 1 = 2,00 л V 2 = x T 1 = 298 K T 2 = 273 K
5) Напишите уравнение комбинированного закона газа:
P 1 V 1 P 2 V 2 ––––– = ––––– Т 1 т 2
6) Решите относительно V 2 путем первого перемножения:
P 1 V 1 T 2 = P 2 V 2 T 1
7) Затем разделив обе стороны на P 2 T 1 :
P 1 V 1 T 2 V 2 = ––––– P 2 T 1 или:
V 2 = (P 1 V 1 T 2 ) / (P 2 T 1 )
8) Вставьте пять значений в их нужные места в правой части приведенного выше уравнения и выполните необходимые операции:
(745.0 мм рт. Ст.) (2,00 л) (273 К) х = –––––––––––––––––––––––––– (760,0 мм рт. Ст.) (298 К) или:
x = [(745,0 мм рт. Ст.) (2,00 л) (273 K)] / [(760,0 мм рт. Ст.) (298 K)]
x = 1,796 л
до трех значащих цифр ответ 1,80 L
Пример № 2: Давление 8,40 л газообразного азота в гибком контейнере снижается до половины от исходного давления, а его абсолютная температура повышается до удвоения исходной температуры.Какой новый том?
Раствор:
Это проблема комбинированного газа, поскольку у вас изменяются три переменные: давление, температура и объем. Всего будет шесть количеств.
1) Установите шесть величин:
P 1 = P 1 P 2 = P 1 /2 V 1 = 8,40 л V 2 = x T 1 = T 1 T 2 = 2T 1
Обратите внимание, что P 2 представляется как половина P 1 .Обратите внимание, что T 2 представляется как вдвое больше, чем T 1 .
2) Запишите, а затем переставьте Закон о комбинированном газе:
P 1 V 1 / T 1 = P 2 V 2 / T 2
V 2 = P 1 V 1 T 2 / T 1 п. 2
3) Заменить в измененном газовом законе:
V 2 = [(P 1 ) (8,40 л) (2T 1 )] / [(T 1 ) (P 1 /2)]
В 2 = 4 (8.40 л) = 33,6 л
4) Другой способ решить эту проблему — назначить значения заполнителей, которые соответствуют требованиям задачи, следующим образом:
P 1 = 2 P 2 = 1 V 1 = 8,40 л V 2 = x T 1 = 1 T 2 = 2
Обратите внимание, что заданные значения давления уменьшаются наполовину, а заданные значения температуры удваиваются в соответствии с инструкциями в задаче.
5) Заменить в измененном газовом законе:
В 2 = [(2) (8,40 л) (2)] / [(1) (1)]
В 2 = 4 (8,40 л) = 33,6 л
В следующем примере последовательно используются два закона газа. Сначала используется закон парциальных давлений Дальтона, а затем — комбинированный газовый закон. Объяснение предполагает, что вы понимаете закон Далтона. Эти два закона, встречающиеся вместе в проблеме, ОЧЕНЬ ОБЫЧНЫ.
Пример 3: 1.85 л газа собирают над водой при 98,0 кПа и 22,0 ° C. Какой объем сухого газа на СТП?
Ключевая фраза — «над водой». Еще одна распространенная фраза, используемая в задачах этого типа — «влажный газ». Это означает, что газ собирали путем барботажа в перевернутую бутылку, наполненную водой, которая находится на водяной бане. Газ пузырится и улавливается. Он вытесняет воду, стекающую в водяную баню. Термины «над водой» и «влажный газ» эквивалентны; они означают то же самое, что газ насыщен водяным паром.
Проблема в том, что в захваченный газ теперь примешан водяной пар. Это следствие техники, и этого нельзя избежать. Однако существует методика расчета (закон Дальтона), позволяющая убрать влияние водяного пара и рассматривать газ как «сухой». В этом примере мы запишем закон Дальтона следующим образом:
P газ + P H 2 O = P итого
Нам нужно знать давление водяного пара в 22.0 ° C, и для этого мы должны найти его в справочном источнике.
Важно понимать, что общая сумма P — это значение 98.0. P итого — это комбинированное давление сухого газа И водяного пара. Мы хотим, чтобы давление водяного пара ВЫКЛЮЧЕНО.
Подставляем значения в уравнение закона Дальтона:
P газ + 2,6447 кПа = 98,0 кПа
Решаем задачу для газа P и получаем 95,3553 кПа. Обратите внимание, что оно не округляется.Единственное округление производится при окончательном ответе, а это не так.
Размещение всех значений в матрице решения дает следующее:
P 1 = 95,3553 кПа P 2 = 101,325 кПа V 1 = 1,85 л V 2 = x T 1 = 295 K T 2 = 273 K
Решите относительно x обычным способом перекрестного умножения и деления:
V 2 = (P 1 V 1 T 2 ) / (P 2 T 1 )
х = [(95.3553 кПа) (1,85 л) (273 K)] / [(101,325 кПа) (295 K)
x = 1,61 л (для трех сигнатур)
Комментарий: очень распространенная ошибка студентов состоит в том, что они не понимают, что сначала нужно использовать закон Далтона, когда газ собирается над водой. Существует очень распространенный эксперимент, в котором некоторое количество газообразного водорода собирается над водой и определяется молярный объем. В расчетах, связанных с этой лабораторией, будет использоваться закон Далтона.
Пример № 4: Если объем идеального газа увеличится вдвое, а его температура — в четыре раза, останется ли давление (а) таким же, (б) уменьшится в 2 раза, (в) уменьшится в в 4 раза, (г) увеличиваться в 2 раза или (д) увеличиваться в 4 раза?
Раствор:
1) Напишите закон комбинированного газа:
P 1 V 1 / T 1 = P 2 V 2 / T 2
2) Я присвою V 1 значение 1 и позволю ему удвоиться.Я присвою T 1 значение 1 и позволю увеличить его значение в четыре раза.
[(P 1 ) (1)] / 1 = [(P 2 ) (2)] / 4
P 1 = P 2 /2
2P 1 = P 2
ответ: (d) увеличение в 2 раза
Между прочим, для V 1 подходит любая единица измерения объема, но следует понимать, что единицей измерения температуры является Кельвин. Другими словами, не выбирайте 1 ° C, дайте ему измениться на 4 ° C, а затем конвертируйте эти значения в K.
Пример № 5: Произведение давления и объема газа, разделенное на температуру, является постоянной величиной. Это представлено формулой:
PV / T = к
(x) Если давление и объем газа увеличиваются, будет ли температура увеличиваться или уменьшаться? Поясните свой ответ.
(y) Если давление увеличивается в два раза, а объем в три раза, во сколько раз должна увеличиваться или уменьшаться температура? Показать свою работу.
(z) Если давление газа снижается за счет удаления части газа, можно ли использовать приведенную выше формулу для прогнозирования изменения объема и температуры? Почему или почему нет?
Раствор:
1) Я хотел бы объяснить, как возникает PV / T = k:
(a) запишите закон Бойля (для константы используйте k 1 ):
PV = к 1
(b) умножьте на закон Чарльза (используйте k 2 в качестве константы):
PV 2 / T = k 1 k 2
(c) умножьте на закон Гей-Люссака (используйте k 3 для постоянной):
P 2 V 2 / T 2 = k 1 k 2 k 3
(d) извлекаем квадратный корень из обеих частей:
PV / T = к
где k — квадратный корень из k 1 k 2 k 3
2) Ответ (x):
(а) мы знаем, что PV / T = k
(b) поэтому для двух различных наборов условий мы можем написать
P 1 V 1 / T 1 = k
P 2 V 2 / T 2 = k(c), поскольку k = k, мы можем записать комбинированный газовый закон:
P 1 V 1 / T 1 = P 2 V 2 / T 2
(г) изолят Т 2 :
T 2 = T 1 x (P 2 / P 1 ) x (V 2 / V 1 )
(e) обоснование ответа о повышении температуры:
, если P 2 > P 1 и V 2 > V 1 , то T 2 должно быть> T 1
3) Ответ (у):
(а) начало здесь:
T 2 = T 1 x (P 2 / P 1 ) x (V 2 / V 1 )
(b) для P 2 = 2P 1 и V 2 = 3V 1
T 2 = T 1 x (2P 1 / P 1 ) x (3V 1 / V 1 )
T 2 = T 1 x 2 x 3
T 2 = 6T 1
4) Ответ (z):
Ответ — нет.Вот обоснование:
(а) начнем с закона идеального газа:
PV = nRT
(б) и переставить
PV / T = nR
(c) получаем исходное уравнение
PV / T = к
ТОЛЬКО если nR является константой
мы знаем, что R — постоянная
, поэтому, чтобы nR было константой, n также должно быть константой.
Удаление некоторого количества газа приводит к изменению n, так что PV / T = k не работает
Пример № 6: Если при постоянной температуре количество газа в пробе удвоится, а давление уменьшится вдвое, что произойдет с объемом пробы газа?
Раствор:
1) Вы можете определить это, присвоив значения для использования в задаче комбинированного газа.Я начну с менее распространенной формы, в которой есть все 4 переменные.
P 1 V 1 / n 1 T 1 = P 2 V 2 / n 2 T 2
2) Так как T постоянный, оставим его:
P 1 V 1 / n 1 = P 2 V 2 / n 2
3) Количество газа удваивается:
P 1 V 1 /1 = P 2 V 2 /2
4) Давление уменьшено вдвое:
2 В 1 /1 = 1 В 2 /2
5) Я назначу объем 1 V 1 и посмотрю, какой будет V 2 :
(2 * 1) / 1 = (1 * V 2 ) / 2
В 2 = 4
Объем пробы газа увеличивается в 4 раза.
5) Говоря о редко встречающихся формулировках закона комбинированного газа, пожалуйста, перейдите сюда для другого примера. Прокрутите вниз до бонусной задачи в конце файла. Я решил начать с закона идеального газа в своем решении этой проблемы и пришел к следующему:
P 1 / n 1 T 1 = P 2 / n 2 T 2
Пример № 7: Используя закон комбинированного газа, запишите каждое из шести символьных значений через другие пять символьных значений.
Раствор:
1) Вот закон комбинированного газа, который, скорее всего, предположил автор вопроса:
P 1 V 1 P 2 V 2 ––––– = ––––– Т 1 т 2 2) Перекрестное умножение:
P 1 V 1 T 2 = P 2 V 2 T 1
3) Чтобы получить P 1 отдельно, разделите обе стороны на V 1 T 2 :
P 2 V 2 T 1 P 1 = ––––– V 1 T 2 4) Чтобы получить V 2 отдельно, разделите обе части уравнения перекрестного умножения на шаге 2 на P 2 T 1 :
P 1 V 1 T 2 V 2 = ––––– P 2 T 1 5) Остальные четыре оставлены читателю.В самом деле, вы можете попробовать свои силы в форме закона комбинированного газа с четырьмя переменными. Вот немного начала:
P 1 V 1 P 2 V 2 ––––– = ––––– n 1 T 1 n 2 T 2 перекрестное умножение:
P 1 V 1 n 2 T 2 = P 2 V 2 n 1 T 1
Оттуда можно продолжить.
Пример № 8: 35,4 мл газообразного водорода собирают над водой при 24,0 ° C и общем давлении 745,0 мм рт. Какой объем газа на СТП?
Раствор:
Я решил не использовать слово «сухой» перед словом «газ» в последнем предложении. Часто учитель или составитель вопросов предполагает, что сухой газ — это то, что нужно для решения этого типа задач. Это потому, что водяной пар просто мешает проводить больше вычислений, связанных с водородом.Предполагается, что читатель (вы!) Просто это понимает и нет необходимости объяснять, что сухой газ является желаемым количеством.
Я решил использовать фразу «« общее давление ». Иногда не указывается явно, что данное давление является полным давлением и состоит из двух газов. И снова автор вопроса предполагает, что вы знаете это по контексту и по опыту.
1) Используйте закон Дальтона, чтобы снять давление водяного пара:
Из справочного источника определяем, что давление пара воды составляет 24.0 ° C составляет 2,985 кПа.
Переведем в мм рт. Ст .:
(2,985 кПа) (760,0 мм рт. Ст. / 101,325 кПа) = 22,39 мм рт. Ст.
Теперь воспользуйтесь законом Далтона:
P до = P H 2 + P H 2 O
745,0 = x + 22,39
x = 722,61 мм рт. Ст.
2) Настройте данные для задачи:
P 1 = 722,61 мм рт. Ст. P 2 = 760,0 мм рт. V 1 = 35.4 мл V 2 = x T 1 = 297,0 K T 2 = 273,0 K 3) Используйте закон комбинированного газа:
P 1 V 1 P 2 V 2 ––––– = ––––– Т 1 Т 2
(722.61 мм рт. Ст.) (35,4 мл) (760,0 мм рт. Ст.) (Х) –––––––––––––––––––––– = –––––––––––––––– 297,0 К 273,0 К x = 30,9 мл (для трех сигнатур)
Пример № 9: Шина имеет 25 частиц воздуха и объемом 205 мл с давлением 0,950 атм. Если в шину добавить 10 частиц воздуха, объем составит 215 мл. Какое новое давление в шинах?
Раствор:
Перед тем, как приступить к решению, вы должны понять, что слово «моль» можно заменить словом «частицы».Другими словами, соотношение частиц составляет 25 к 10. Если выражать в молях, соотношение все равно будет 25 к 10.
1) Начнем с четырехвариантной формы комбинированного газового закона:
P 1 V 1 P 2 V 2 ––––– = ––––– n 1 T 1 n 2 T 2 2) Поскольку температура никогда не упоминается, мы предполагаем, что она постоянная.Итак, T 1 = T 2 , что означает выпадение T. Это приводит к необычной формулировке закона комбинированного газа.
P 1 V 1 / n 1 = P 2 V 2 / n 2
5) Подставляем значения:
25 и 35 (из 25 + 10) наши родинки.
[(0,950 атм) (205 мл)] / 25 = [(x) (215 мл)] / 35
x = 1,27 атм
Пример № 10: Если при постоянной температуре количество газа в пробе удвоится, а давление уменьшится вдвое, что произойдет с объемом пробы газа?
Раствор:
1) Ответ может быть определен путем присвоения значений для использования в задаче комбинированного газового закона.Я начну с менее распространенной формы, в которой есть все 4 переменные:
P 1 V 1 / n 1 T 1 = P 2 V 2 / n 2 T 2
2) Так как T постоянный, оставим его:
P 1 V 1 / n 1 = P 2 V 2 / n 2
3) Количество газа увеличено вдвое:
P 1 V 1 /1 = P 2 V 2 /2
4) Давление уменьшено вдвое:
(2 * V 1 ) / 1 = (1 * V 2 ) / 2
5) Я назначу объем 1 V 1 и посмотрю, какой будет V 2 :
(2 * 1) / 1 = (1 * V 2 ) / 2
В 2 = 4
Объем пробы газа увеличивается в 4 раза.
Бонус Пример: Когда давление, оказываемое на 1,00 л идеального газа, увеличивается втрое, а абсолютная температура — вдвое, каким значением становится объем?
Решение № 1:
1) Используйте закон комбинированного газа:
P 1 V 1 / T 1 = P 2 V 2 / T 2
2) Назначьте значения следующим образом:
P 1 = 1.00 атм P 2 = 3,00 атм V 1 = 1,00 л V 2 = x T 1 = 1,00 K T 2 = 2,00 K 3) Вставьте значения в уравнение и решите относительно x:
[(1,00 атм) (1,00 л)] / 1,00 K = [(3,00 атм) (x)] / 2,00 K
x = 2/3 л = 0,667 л
Решение № 2:
При увеличении давления газа втрое его объем делится на 3 (закон Бойля).Следовательно, после повышения давления объем будет 1/3 л.
Однако удвоение абсолютной температуры газа также удвоит его объем (закон Чарльза). Умножьте предыдущий ответ на 2:
(1/3 л) (2) = 2/3 л
Решение № 3:
использовать PV = nRT
пусть V initial будет начальным объемом вашего газа
, поэтому, переставив уравнение, вы получите V начальное = nRT / P
вопрос говорит, что потом давление увеличивается втрое, а температура — вдвое, так что теперь у вас есть
V новый = (nR) (2T / 3P)
V новый = (2/3) (nRT / P)
, сравнивая V новый с исходным V , вы можете увидеть, что
V новый = 2/3 раза V начальный
вы знаете, что V начальный равен 1 л, поэтому ваш V новый должен быть 2/3 л
Закон Авогадро — определение, формула, примеры
Закон Авогадро гласит, что объем и количество газа прямо пропорциональны при постоянной температуре и давлении.
Закон Авогадро гласит, что объем идеального газа прямо пропорционален количеству молей газа в условиях постоянной температуры и давления. По мере увеличения количества молей газа пропорционально увеличивается объем. Это не зависит от размера частиц газа или их молярной массы, поэтому газы различных элементов и соединений сопоставимы друг с другом.
Конечно, как и в случае любого закона идеального газа, поведение реальных газов немного отличается от предсказанного.Закон предполагает, что каждая частица газа не имеет объема и что частицы отскакивают друг от друга и от своего контейнера в идеально упругих условиях. Молекулы реального газа имеют объем и могут притягиваться или отталкиваться друг от друга. Даже в этом случае закон Авогадро является полезным приближением, которое достаточно точно для реальных газов при нормальных условиях.
История
Закон назван в честь Амедео Авогадро. В 1812 году Авогадро предположил, что два образца идеального газа содержат одинаковое количество молекул, если они находятся при одинаковых температуре и давлении.Например, пузырек с газообразным водородом и пузырек с газообразным азотом содержат одинаковое количество молекул при одинаковом объеме, температуре и давлении, даже если газы имеют разную идентичность.
Закон Авогадро также известен как гипотеза Авогадро или принцип Авогадро. Он связан с другими законами идеального газа: законом Бойля (1662 г.), законом Шарля (1787 г.) и законом Гей-Люссака (1808 г.). Французский физик и математик Андре-Мари Ампер опубликовал тот же закон, что и Авогадро, но в 1814 году.Во Франции это соотношение было названо гипотезой Ампера , гипотезой Авогадро – Ампера или гипотезой Ампера – Авогадро .
Формула закона Авогадро
Существует четыре общие формулы, представляющие закон Авогадро, где V — объем, n — количество молей газа, а k — постоянная величина:
V ∝ n
V / n = k
V 1 / n 1 = V 2 / n 2
V 1 n 2 = V 2 n 1
Поскольку объем и количество молей прямо пропорциональны друг другу, a График зависимости объема от количества молей представляет собой прямую линию, идущую вверх от начала координат.
Пример закона Авогадро в повседневной жизни
Лучшим примером закона Авогадро является надувание воздушного шара. Объем воздушного шара увеличивается по мере добавления молей газа. Точно так же, когда вы спускаете воздушный шар, газ выходит из шара, и его объем сокращается.
Закон Авогадро Пример Задача
Объем газа 13,5 л содержит 0,000524 моль газообразного азота. Если предположить, что температура и давление газа остаются неизменными, какой объем заполняет 0,00144 моля газа?
Сначала запишите то, что вы знаете, и определите неизвестное значение:
V 1 = 13.5 л
В 2 =?
n 1 = 0,000524 моль
n 2 = 0,00144 моль
Затем подставьте значения в формулу закона Авогадро и измените уравнение, чтобы вычислить ответ:
V 1 / n 1 = V 2 / n 2
13,5 л / 0,000524 моль = V 2 / 0,00144 моль
V 2 / 0,00144 моль = 13,5 л / 0,000524 моль
V 2 = (13,5 л / 0,000524 моль) ( 0,00144 моль)
V 2 = 37.1 L
См. Еще один пример проблемы закона Авогадро.
Ссылки
- Авогадро, Амедео (1810). «Essai d’une manière de déterminer les masses родственников des molécules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons». Журнал физики . 73: 58–76. Английский перевод
- Castka, Joseph F .; Меткалф, Х. Кларк; Дэвис, Раймонд Э .; Уильямс, Джон Э. (2002). Современная химия . Холт, Райнхарт и Уинстон.ISBN 978-0-03-056537-3.
- Scheidecker-Chevallier, Myriam (1997). «Гипотеза д’Авогадро (1811 г.) и д’Ампер (1814 г.): различие между атомом / молекулой и теорией химического комбинирования». Revue d’Histoire des Sciences (на французском языке). 50 (1/2): 159–194. doi: 10.3406 / rhs.1997.1277
Закон Авогадро с графиками и приложениями ~ ChemistryGod
Закон Авогадро также известен как гипотеза Авогадро или принцип Авогадро. Закон диктует соотношение между объемом газа и количеством молекул в нем.Этот закон, как и закон Бойля, закон Шарля и закон Гей-Люссака, является частным случаем закона идеального газа. Этот закон назван в честь итальянского ученого Амедео Авогадро. Он сформулировал это соотношение в 1811 году. Проведя эксперименты, Авогадро предположил, что равные объемы газа содержат одинаковое количество частиц. Гипотеза также согласовала атомную теорию Дальтона. В 1814 году французский физик Андре-Мари Ампер опубликовал аналогичные результаты. Следовательно, закон также известен как гипотеза Авогадро-Ампера.
Содержание
Заявление
Для идеального газа равные объемы газа содержат одинаковое количество молекул (или молей) при постоянной температуре и давлении.
Другими словами, для идеального газа объем прямо пропорционален его количеству (молям) при постоянной температуре и давлении.
Объяснение
По закону: объем и количество газа (моль) прямо пропорциональны друг другу при постоянном объеме и давлении.Математически это утверждение можно выразить как:
Замена пропорциональности,
, где k — константа пропорциональности.
Вышеприведенное выражение можно переформатировать как:
Вышеприведенное выражение действительно для постоянного давления и температуры. Согласно закону Авогадро, с увеличением объема газа количество молей газа также увеличивается, а с уменьшением объема количество молей также уменьшается.
If V 1 , V 2 и n 1 , n 2 — объемы и моль газа при условии 1 и условии 2 при постоянной температуре и давлении, тогда, используя закон Авогадро, мы можем сформулировать уравнение ниже.
Пусть объем V 2 при условии 2 будет вдвое больше объема V 1 при условии 1.
Следовательно, с удвоением объема количество молей также удваивается.
Водород реагирует с кислородом с образованием воды.
Образование воды из водорода и кислорода происходит следующим образом:
В указанной выше реакции 1 моль ( n H 2 ) газообразного водорода реагирует с 1 ⁄ 2 моль ( n O 2 ) газообразного кислорода с образованием 1 моль ( n H 2 O ) водяного пара.Потребление водорода в два раза превышает потребление кислорода, что выражается ниже как:
Допустим, 1 моль водорода занимает объем V H 2 , a 1 ⁄ 2 моль кислорода занимает V O 2 и аналогично для 1 моля водяного пара, объем V H 2 O . Как мы знаем из закона Авогадро, равные объемы содержат равные моли. Следовательно, соотношение между объемами такое же, как и между кротами, а именно:
Закон Авогадро вместе с законом Бойля, законом Шарля и законом Гей-Люссака образует закон идеального газа.
Графическое представление
Графическое представление закона Авогадро показано ниже.
График представляет собой прямую линию, проходящую в начало координат с положительным наклоном.
Приведенный выше график построен при постоянных температуре и давлении. Как видно из графика, объем и моль линейно связаны с линией положительного наклона, проходящей через начало координат.
Линия параллельна оси x . Таким образом, соотношение V ⁄ n не зависит от молей газа.
Как показано на рисунке выше, линия
параллельна оси x . Это означает, что значение объема в молях постоянно и не зависит от каких-либо изменений в молях (или объеме).
Оба приведенных выше графика построены при постоянных температуре и давлении.
Константа Авогадро
Постоянная Авогадро — это константа, названная в честь Авогадро, но Авогадро не обнаружил ее. Константа Авогадро — очень полезное число; число определяет количество частиц, составляющих в любом материале.Обозначается он N A и имеет размер -1 моль. Его приблизительное значение приведено ниже.
Молярный объем
Поскольку закон Авогадро имеет дело с объемом и молями газа, необходимо обсудить концепцию молярного объема. Молярный объем, начиная с самого названия, определяется как объем на моль. Он обозначается как V м и имеет единицу объема, деленную на единицу моля (например, дм 3 моль -1 , м 3 кмоль -1 , см 3 моль −1 и т. Д.).Из закона идеального газа в STP ( T = 273,15 K, P = 101325 Па) молярный объем рассчитывается как:
Ограничение закона Авогадро
Ограничение выглядит следующим образом:
- Закон отлично работает только для идеальных газов.
- Закон является приблизительным для реальных газов при низком давлении и / или высокой температуре.
- При низкой температуре и / или высоком давлении отношение объема к молям для реальных газов немного больше, чем для идеальных газов.Это происходит из-за расширения реальных газов из-за сил межмолекулярного отталкивания при высоком давлении.
- Более легкие молекулы газа, такие как водород, гелий и т. Д., Лучше подчиняются закону Авогадро по сравнению с тяжелыми молекулами.
Применение закона Авогадро в реальном мире
Принцип Авогадро легко соблюдается в повседневной жизни. Ниже приведены некоторые из упомянутых.
Воздушные шары
Когда вы надуваете воздушный шар, вы буквально выталкиваете воздух изо рта внутрь воздушного шара.Другими словами, вы наполняете воздушный шар большим количеством молей, и он расширяется.
Шины
Заливали ли вы когда-нибудь спущенные шины? Если да, то вы просто следуете закону Авогадро. Когда вы накачиваете воздух внутрь спущенных шин на заправочной станции, количество (молей) газа внутри шин увеличивается, что увеличивает объем, и шины накачиваются.
Легкие человека
Когда мы вдыхаем, воздух течет внутри наших легких, и они расширяются, а когда мы выдыхаем, поток воздуха из легких в окружающую среду и легкие сжимаются.
Лабораторный эксперимент для доказательства закона Авогадро
Цель
Проверить закон Авогадро путем оценки количества (молей) различных газов при фиксированном объеме, температуре и давлении.
Экспериментальный прибор для проверки закона Авогадро
Аппарат
Аппарат, необходимый для этого эксперимента, показан на диаграмме выше. Он состоит из манометра с U-образной трубкой (на схеме используется манометр с закрытым концом, но также может использоваться манометр с открытым концом), как показано на рисунке, ртути, груши, вакуумного насоса, четырех-пяти цилиндров различных газы и градусник.Подключите все устройства, как показано на рисунке.
Номенклатура
- V 0 — объем колбы, который известен (или определен) до эксперимента.
- T — температура, при которой проводится эксперимент, которую можно определить по термометру (для простоты примите ее за комнатную температуру).
- P — давление, при котором проводится эксперимент, которое можно определить по разнице высот уровня ртути в манометре.
- W 0 — масса пустого баллона, известная (или определенная) до эксперимента.
- W — это полная масса лампы.
- W г — это вес газа внутри колбы.
- M — молярная масса газа.
Процедуры
- Возьмите газовый баллон, прикрепив его к баллону, а также прикрепите насос к баллону. При установке устройства необходимо соблюдать осторожность, чтобы не допустить утечки газа.
- Сначала закройте ручку газового баллона и откройте ручку вакуумного насоса на баллоне. Удалите воздух из системы и включите вакуумный насос.
- После опорожнения груши закройте ручку вакуумного насоса и выключите вакуумный насос.
- Начните заполнять баллон баллонным газом, медленно открывая ручку газового баллона до тех пор, пока не будет достигнута желаемая разница в высоте ртути. Обратите внимание на разницу в высоте манометра. (Значение перепада высот должно быть одинаковым для всех показаний.)
- Закройте все ручки, а также закройте соединение между колбой и манометром, чтобы изолировать газ внутри колбы. Снимите лампочку с манометра.
- Взвесьте грушу на весах и запишите показания.
- На этом процедура для первого газа завершается. Повторите ту же процедуру для разных газов.
Расчет
Рассчитайте вес газа ( W г ) в баллоне, вычтя вес пустой баллона ( W 0 ) из веса заполненного баллона ( W ).
Затем рассчитайте количество молей газа как:
Количество молей всех газов должно быть примерно одинаковым с точностью до небольшого процента погрешности. Если это правда, то все газы подчиняются закону Авогадро.
Если эксперимент проводится на STP ( T = 273,15 K, P = 101325 Па), то мы также можем рассчитать молярный объем V м как:
И его значение должно быть близким до 22,4 дм 3 моль −1 .
Примеры
Пример 1
Рассмотрим 20 моль газообразного водорода при температуре 0 ° C и давлении 1 атм, имеющем объем 44,8 дм 3 . Рассчитать объем 50 моль газообразного азота при той же температуре и давлении?
По закону Авогадро при постоянных температуре и давлении
Следовательно, объем равен 112 дм 3 .
Пример 2
Добавляют 2,5 л газообразного гелия в 5,0 л баллона с гелием; баллон расширяется, так что давление и температура остаются постоянными.Оцените конечное количество молей газа, если изначально газ содержит 8,0 молей.
Окончательный объем — это добавление начального объема и добавленного объема.
Из закона Авогадро,
Конечное количество молей в 7,5 л газа составляет 12 мол.
Пример 3
3,0 л водорода реагирует с кислородом с образованием водяного пара. Рассчитать объем кислорода, потребляемого во время реакции (предположим, что закон Авогадро выполняется)?
На каждый моль газообразного водорода расходуется половина моля кислорода.
Согласно закону Авогадро, объем прямо пропорционален молям, поэтому мы можем переписать приведенное выше уравнение как:
В ходе реакции потребляется 1,5 л кислорода.
Сопутствующие статьи
Закон Авогадро
Закон Авогадро
Закон Авогадро
- Некоторые типичные данные из лаборатории, которую вы сделали, исследуя взаимосвязь
между молями и объемом показано ниже:Моли газа
Объем (л)
0
0
0.0089
0.200
0,0179
0,400
0,0268
0,600
0,0357
0.800
0,0446
1.000
- Обратите внимание на простую взаимосвязь, изображенную на графике. Это прямо пропорционально
или обратно пропорционально? Если вы не знаете, посмотрите другие наши примеры. - Выведем закон Авогадро:
y = m * x или
y = константа * x или
V = константа * n или
V / n = постоянная, поэтому
V 1 / n 1 = V 2 / n 2 - Для этого необходимо сделать два предположения об условиях эксперимента.
отношения, чтобы быть правдой.Кто они такие? (Какие еще факторы могут повлиять на громкость?) - В отличие от других «констант», обнаруженных при открытии
закона Бойля и закона Чарльза, найденная выше константа верна для всех
газы при одинаковых условиях температуры и давления. - Авогадро провел множество экспериментов, в которых он химически объединил различные объемы.
разных газов. Они всегда сочетались в простых целочисленных соотношениях. Этот
приводят Авогадро к выводу, что равных объемов газов при одинаковой температуре
и условия давления содержат одинаковое количество молекул газа. Даже
хотя он не знал, как рассчитать родинки, его эксперименты подтвердили
отношения мы видим выше. Независимо от того, какой газ используется, одинаковое соотношение
объем в моль всегда находится: 22,4 л / моль при стандартной температуре (0 ° C)
и стандартное давление (1 атм). Это известно как стандартный молярный объем .
газа: 22,4л на СТП.
.



