Содержание
Урок «Сера – простое вещество». 9-й класс
Цели урока: дать общую характеристику серы; рассмотреть аллотропные модификации серы и её химические свойства; изучить природные соединения серы и роль в природе; рассмотреть вопросы практического характера.
Оборудование: сера, спирт, вода, стеклянная посуда, спиртовка, образцы минералов; ватные палочки, чугунок, камень; продукты питания – горох, яйца, овсяные хлопья; компьютер, проектор.
Ход урока.
I. Организационный момент. Проверка темы «Галогены».
Задания по теме ( пункты – а. — I вариант; пункты – б. — II вариант)
1. Какой элемент не является галогеном:
а. Br, At, S.
б. F, I, Si.
2. Какой элемент принадлежит большому периоду:
Какой элемент принадлежит большому периоду:
а. F, I.
б. Cl, Br.
3. Какой элемент активнее в данной паре:
а. I или Cl
б. Br или I
4. Газообразным веществом является:
а. Cl2, I2
б. Br2, F2
5. Летучее водородное соединение элемента:
а. ЛВС — Cl
б. ЛВС — Br
6. Дописать уравнения:
а.
1) Ca + Cl2 =
2) KCl + Br2 =
б.
1) Ba + F2 =
2) NaBr + I2 =
Ответы (Задания и ответы выдаются на экран.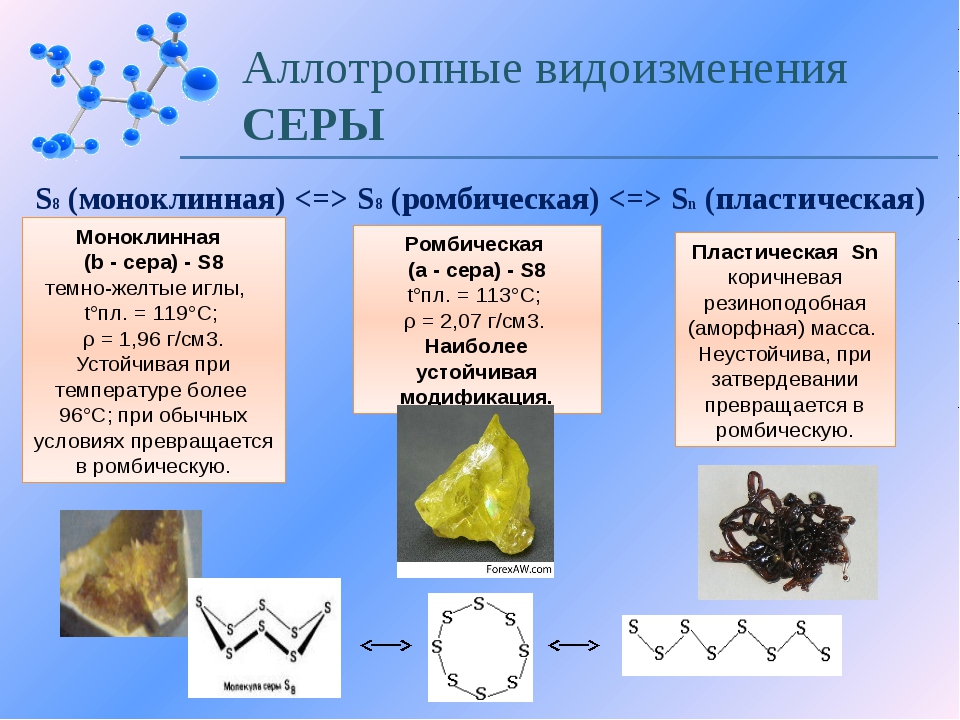 )
)
1. а. — S б.- Si
2. а. — I б.- Br
3. а. — Cl б.- Br
4. а .- Cl2б.- F2
5. а. — HCl б.- HBr
6.
а.
1) Ca0 + Cl20 = Ca+2CI-12 р-я соединения
2) KCl + Br2 = р-и нет, т. к. Cl> Br
б.
1) Ba0 + F20 = Ba+2F2-1 р-я соединения
2) NaBr + I2 = р-и нет т. к. Br>I
II. Работа по теме урока. Вопросы для изучения : выданы на экран.
- История элемента, название
- Положение атома серы в периодической системе химических элементов
- Физические свойства.
 Флотация
Флотация - Аллотропные модификации серы
- Химические свойства серы
- Сера в природе
- Значение серы, применение.
1. История элемента. Сейчас невозможно установить, когда человек впервые познакомился с серой и её соединениями. Произошло это очень давно. Она помогала нашим предкам получать огонь, вернее, снопы искр при ударе кресалом по обломку пирита. Использовали её для приготовления красок и косметических средств. Знали её и древние индийцы, именно они дали название — «сира» — означает «желтый». Химический символ произошел от латинского слова «сульфур». Древние римляне называли серу «желчью бога Вулкана» (покровителя огня). Картина Карла Брюллова «Гибель Помпеи».
2. Рассмотрим положение элемента серы в таблице химических элементов.
а. Запишем характеристику элемента в тетрадях – работа учащихся с периодической системой химических элементов, с дальнейшей проверкой выполнения.
б. Составим модель строения атома с электронных позиций – задание выполняется на магнитной доске.
в. Запишем электронную и графические формулы.
г. Сделаем вывод о степенях окисления элемента серы.
3. Изучим физические свойства серы – простого вещества.
У вас на партах пакетики, аккуратно разворачиваем и рассматриваем вещество. Проверяем его отношение к воде – осторожно высыпаем содержимое пакетика на всю поверхность воды, не перемешивая (в инструктивной карточке – задание 1). Делаем выводы из наблюдений: сера – твердое вещество, желтого цвета, в размолотом состоянии « плавает» на поверхности воды, имея при этом плотность больше, чем у воды.
«Флотация» — (франц.) – это свойство, основанное на различной смачиваемости поверхностей, в данном случае воды и порошка серы, является способом обогащения полезных ископаемых.
Посмотрите, как ведет себя сера по отношению к другому растворителю – спирту. В нем она немного растворима. Демонстрацию проводит учитель.
В нем она немного растворима. Демонстрацию проводит учитель.
4. На примере серы рассмотрим ещё раз природное явление – аллотропию.
Известно много модификаций серы с циклическим или линейным строением молекул различного состава. Рассмотрим это на рисунках: они спроецированы на экран
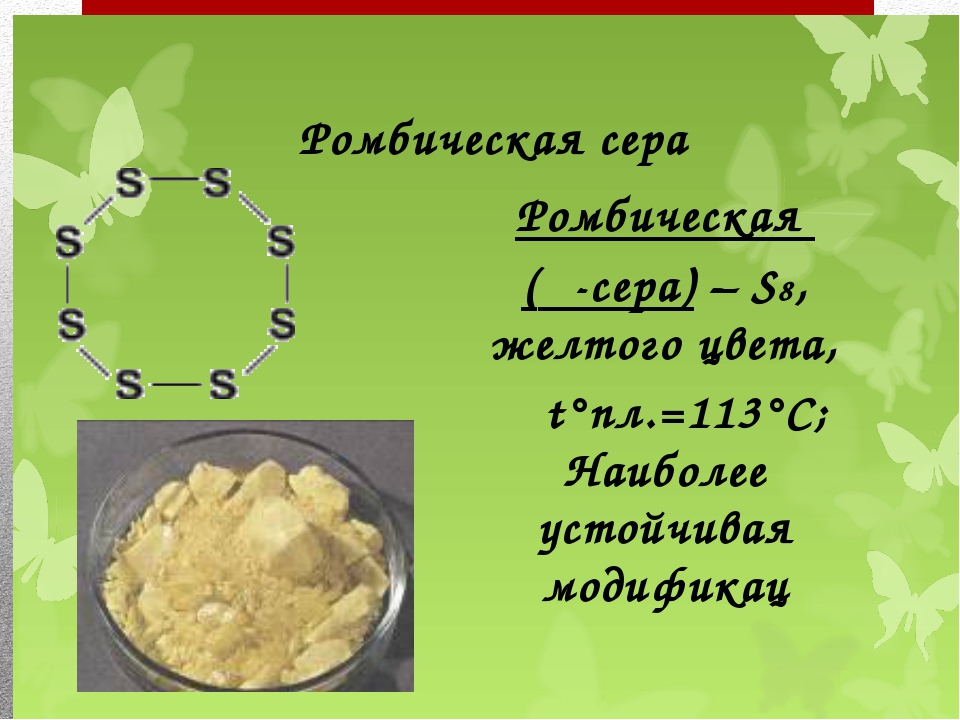
Структура молекулы S8 и модель структуры ромбической серы
Кристаллические модификации серы:
Слева – ромбическая. Справа – моноклинная
У серы 3 модификации: ромбическая, моноклинная и пластическая. Для серы причина аллотропии заключается в различном строении кристаллов её модификации. Наиболее устойчива — ромбическая сера, молекула которой состоит из 8 атомов, замкнутых в кольцо – S8 .
Пронаблюдаем за экспериментом. Нагреем порошкообразную серу в пламени спиртовки. Расплавленную жидкую серу, тонкой струйкой, осторожно выльем в стакан с холодной водой. Мы получим пластическую серу.
Мы получим пластическую серу.
5. Рассмотрим химические свойства серы – простого вещества.
1. Горение серы. У меня в руках знакомый всем предмет – это коробочка со спичками. Зажжем спичку. Ощущается запах – это запах газа, который образуется при горении серы и называется – сернистый газ. Запишем уравнение этой реакции:
S0 + O20 = S+4O2-2 Составить электронный баланс.
2. Взаимодействие с водородом:
H20 + S0 = H2+1S-2 – газ сероводород, является ядовитым веществом, образуется как результат гниения органических соединений. О нем говорят – тухлые яйца пахнут сероводородом.
3. Реакции серы с металлами – образование сульфидов:
а. Na0 + S0 = Na2+1S-2. Для данного уравнения составить электронный баланс.
Для данного уравнения составить электронный баланс.
б. Hg0 + S0 = Hg+2S-2. Эта реакция имеет практическое значение. Процесс называется – демеркуризация– удаление и обезвреживание разлитой ртути.
Подведем итог: сера в реакциях с кислородом и металлами проявляет разные степени окисления: +4, -2.Являясь и восстановителем и окислителем.
На закрепление: составить уравнения реакций серы с алюминием и цинком.
5. Сера в природе. Сейчас немного отдохнем, займемся « добычей серы». У вас в руках понятное и знакомое приспособление – ватные палочки. Откуда в нашем организме сера и зачем она нам нужна? Правильно, из продуктов питания. Вот некоторые из них: горох, яйца, овсяные хлопья. Обсудить с учащимися этот вопрос.
Переходим к работе с раздаточным материалом. Познакомьтесь с образцами природных минералов, содержащих серу.
Самостоятельная работа с раздаточным материалом и таблицей 8 учебника на странице 98 ( в инструктивной карточке – задание 2). Для учащихся даны образцы самородной серы и её сульфидные и сульфатные соединения: пирит, свинцовый блеск, медный колчедан, гипс.
6. Применение и роль серы. Одно изобретение человечества с использованием серы вы уже сегодня видели – это спички. А теперь посмотрите на эту конструкцию – чугунок, в котором находятся три компонента, а сверху камень. И это имеет отношение к нашей теме, история гласит, что это натолкнуло наблюдательного и конечно, грамотного человека на изобретение пушки.
Применения серы многообразны, об этом вы узнаете при подготовке домашнего задания. Обсудим это на следующем уроке.
Подведем итог нашего урока. Знакомство с элементом – серой – дало вам много новых, интересных фактов. Мы закрепили уже имеющиеся у вас навыки и умения. Желаю вам успешной работы дома по заданиям.
Домашнее задание: п.21, упр.3.4 стр.99. Найти ответ на вопрос: для чего в ушах сера?
Рефлексия.
Закончите любое из предложенных предложений:
- Самым интересным на уроке для меня было … .
- Самым неинтересным на занятии для меня было … .
- Я научился … .
- Теперь бы я хотел ещё узнать … .
- Мне понравилось … .
- Хотел бы вам сказать … .
- Самым скучным на занятии было … .
- Я буду вспоминать о … .
Инструктивная карточка.
1 задание. Аккуратно разверните пакетик с серой. Рассмотрите внешние признаки вещества: агрегатное состояние, цвет;
Затем осторожно насыпайте на поверхность воды в стаканчик. Не мешайте!
Сделайте выводы об отношении серы к воде (её плотность, растворимость).
2 задание. Рассмотрите образцы природных минералов, содержащих серу. Используя таблицу 8 на стр.98 учебника, запишите в тетрадь название и формулу минерала.
Используя таблицу 8 на стр.98 учебника, запишите в тетрадь название и формулу минерала.
Литература.
- Габриелян О.С.Химия 9 класс. «Дрофа» 2005г.
- Габриелян О.С. Книга для учителя. Москва, «Вако» 2004г.
- Гридчин А. Элементы мироздания. Воронеж, 1985г.
- Золотая книга русской культуры. Москва, 2007г.
- Полосин В.С. Школьный эксперимент по неорганической химии. «Просвещение», 1970г.
- Смолеговский А.М.Энциклопедия химических элементов. «Дрофа» 2000г.
Конспект урока «Сера как простое вещество. Аллотропия и свойства серы».
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА пос. МИС
КОНСПЕКТ УРОКА
«Сера как простое вещество.
Аллотропия и свойства серы».
Учитель химии Сокова Т. В.
В.
Цель урока:
Охарактеризовать положение серы в Периодической системе, строение атома, физические и химические свойства серы.
Охарактеризовать природные соединения серы, а также области ее применения.
Закрепить УУД учащихся по составлению уравнений окислительно-восстановительных реакций.
Оборудование:
Периодическая система химических элементов Д.И.Менделеева,
компьютер, проектор, экран, презентация.
Реактивы:
Сера кристаллическая, спиртовка, спички, пробирка с держателем, большая емкость с холодной водой.
Ход урока:
Подвести учащихся к осознанию темы, целей, задач урока.
-Самоопределение(Л)
-Смыслообразование(Л)
-Целеполагание (П)
-Планирование учебного сотрудничества с учителем и сверсниками (К)
Мы продолжаем изучать элементы подгруппы кислорода.
Вопросы учащимся:
— По каким признакам элементы объединяются в подгруппы?
— Вспомните, какие элементы входят в подгруппу кислорода?
-Какой еще представитель из этой подгруппы заслуживает внимания?
Следовательно, тема урока – сера.
— С чего мы должны начать изучение данного элемента?
План на сегодняшний урок – физические, химические свойства серы; нахождение в природе и еще аллотропные модификации.
2. Актуализация (повторение) знаний
Организовать подготовку учащихся к объяснению нового материала.
-анализ, синтез, сравнение, обобщение (П)
— осознанное и произвольное построение речевого высказывания (П)
— выражение своих мыслей с достаточной полнотой и точностью (К)
— аргументация своего мнения (К)
— использование критериевдля обоснования своего суждения (К)
Вопросы учащимся:
-Какая связь существует между элементом и простым веществом?
Давайте вместе дадим характеристику элементу сера по плану:
1. Каков химический знак?
2. В какой группе периодической системы находится?
3. В каком периоде находится?
4. Какой порядковый номер?
5. Какая относительная атомная масса?
6. Сколько электронов в атоме? Расположите электроны на энергетических уровнях.
7. Какая электронная формула серы?
8.Какие валентности проявляет сера?
Ответы этих вопросов записываются у доски и в тетрадях.
Проверка на слайде в презентации — самоконтроль
3. Объяснение нового материала
— анализ, синтез, сравнение, обобщение, аналогия (П)
-подведение под понятие(П)
— определение основной и второстепенной информации (П)
-постановка и формулирование проблемы (П)
-структурирование знаний(П)
-осознаное и произвольное построение речевого высказывания (П)
-выражение своих мыслей с достаточной полнотой и точностью (К)
— аргументация своего мнения и позиции в коммуникации (К)
-учет разных мнений, координирование в сотрудничестве разных позиций (К)
— разрешение конфликтов (К)
А теперь разберем нахождение серы в природе.
Сера самородная (слайд), минерал из класса самородных элементов. Самородная сера жёлтого цвета, при наличии примесей — бурая до чёрной; содержит включения карбонатов, сульфатов, глины. Блеск смолистый до жирного, хрупкая.
Самородная сера жёлтого цвета, при наличии примесей — бурая до чёрной; содержит включения карбонатов, сульфатов, глины. Блеск смолистый до жирного, хрупкая.
-Найдите в учебнике месторождения самородной серы, выпишите.
Мирабилит (слайд) (от лат. mirabilis — удивительный; назван немецким химиком И. Р. Глаубером), глауберова соль, минерал из класса сульфатов, химический состав Na2[SO4] ×10H2O. Легко растворим в воде, раствор обладает горько-солёным вкусом. В сухом виде быстро теряет воду и переходит в белый порошковидный безводный минерал — тенардит (Na2SO4). Встречается в соляных озёрах, мелководных заливах и горячих источниках; образует также выцветы на почве.
Мирабилит используется главным образом в химической промышленности для получения соды, едкого натра, в стекольной, красочной и других отраслях промышленности, а также в медицине.
Пирит (слайд) (греч. pyríteslíthos, буквально — камень, высекающий огонь, от pýr — огонь; название связано со свойством пирита давать искры при ударе), серный колчедан, железный колчедан, минерал химического состава FeS2 (46,6% Fe, 53,4% S). Нередки примеси Со, Ni, As, Cu, Au, Se и др.
pyríteslíthos, буквально — камень, высекающий огонь, от pýr — огонь; название связано со свойством пирита давать искры при ударе), серный колчедан, железный колчедан, минерал химического состава FeS2 (46,6% Fe, 53,4% S). Нередки примеси Со, Ni, As, Cu, Au, Se и др.
Цвет светлый, латунно-жёлтый; блеск металлический.
Пирит является сырьём для получения серной кислоты, серы и железного купороса.
Сера – жизненно важный химический элемент. (слайд) Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей и выпадение волос. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.
Теперь разберем физические свойства серы и ее аллотропные модификации.
-Рассмотрев образец серы,что вы можете сказать о физических свойствах?
-Какими еще физическими свойствами обладает сера?- найдите в учебнике. Выпишите.
Выпишите.
(Твёрдое, кристаллическое вещество желтого цвета, без запаха.
Как и все неметаллы плохо проводит теплоту и не проводит электрический ток.
Сера в воде не растворяется.
Температура плавления 1200С)
Сера образует две относительно устойчивые модификации: ромбическую и моноклинную.(слайд)
Демонстрация опыта.(получение моноклинной и пластической серы)
Химические свойства серы:
Окислительные свойства серы
1. взаимодействие с металлами(кроме благородных) — образование сульфидов
— напишите окислительно- восстановительный баланс взаимодействия натрия с серой
(ученик у доски)
2. взаимодействие с водородом
— напишите уравнение реакции взаимодействия водорода с серой
(ученик у доски)
Восстановительные свойства серы
1. взаимодействие с кислородом
-напишите окислительно – восстановительный баланс взаимодействия серы с кислородом (ст.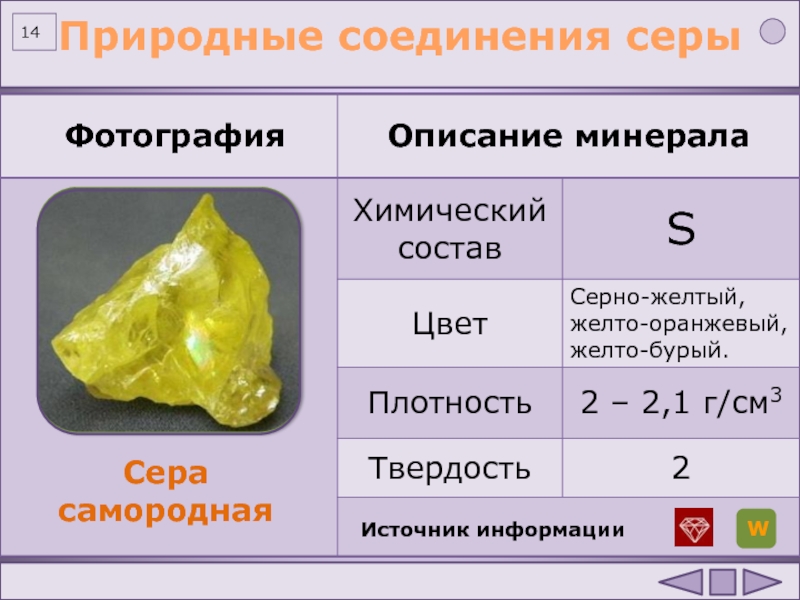 ок. +4)
ок. +4)
(ученик у доски)
2. взаимодействие с галогенами
— напишите уравнение реакции взаимодействия серы с фтором
( ст. ок. +6)
(ученик у доски)
3. взаимодействие с кислотами – окислителями (слайд)
Перепишите уравнение реакции в тетрадь.
Серу применяют для производства серной кислоты, вулканизации каучука,в пиротехнике, в производстве охотничьего порохаиспользуют как фунгицид в с/х.
Проверка на слайде в презентации —
самоконтроль
Проверка на слайде в презентации-
самоконтроль
Проверка на слайде в презентации — самоконтроль
самоконтроль
самоконтроль
самоконтроль
4. первичное закрепление с проговариванием вслух
Осуществить контроль полученных знаний, провести коррекцию полученной информации.
-анализ, сравнение, обобщение,
классификация (П)
— использование знаково – символических средств (П)
-подведение под понятие (П)
-становление причинно -следственных связей (П)
— выполнение действий по алгоритму (П)
— осознанное и произвольное построение речевого высказывания (П)
-построение логической цепи рассуждений, доказательство (П)
— выражение своих мыслей с достаточной полнотой и точностью (К)
— адекватное использование речевых средств для решения коммуникативных задач(К)
-формулирование и аргументация своего мнения (К)
— использование критериев для обоснования своего суждения (К)
— достижение договоренностей и согласование общего решения (К)
— осознание ответственности за общее дело (Л)
— Теперь выполним небольшое задание.
Из данного перечня веществ выберите те, с которыми взаимодействует сера:
Вода, хлор, сульфат натрия, золото, серная концентрированная кислота, железо.
Проверка на слайде в презентации
5. самостоятельная работа с самопроверкой по эталону
Выполнение задания нового вида с самопроверкой, корректирование ошибок, доработка заданий.
— анализ, синтез, сравнение, обобщение, аналогия,
классификация (П)
— использование знаково – символических средств (П)
-подведение под понятие (П)
— выполнение действий по алгоритму (П)
— осознанное и произвольное построение речевого высказывания (П)
— доказательство (П)
— контроль (Р)
-коррекция (Р)
— оценка (Р)
— волеваясаморегуляция в ситуации затруднения (Р)
Выполнение теста.
1. Наибольшую электроотрицательность имеет химический элемент:
А. кислород
Б. селен
В. теллур
Г. сера
2. Кислород проявляет положительную степень окисления в соединении:
А. SO2
SO2
Б. CuO
В. OF2
Г. H2O
3. Соединения серы с металлами называются:
А. сульфатами
Б. сульфитами
В. cульфидами
Г. сернистыми металлами
4. Сера не взаимодействует:
А. с водородом
Б. с кислородом
В. cметаллами
Г. с водой
5. Распределению электронов по слоям в атоме серы отвечает схема:
А. 2,8,6
Б. 2,8,8
В. 2,8,2
Г. 2,8
— Проверили правильные ответы и поставили оценку соседу по парте.
Проверка на слайде в презентации —
взаимоконтроль
6. Включение в систему знаний и повторение
связь полученных знанийс изученным ранее материалом
— нравственно- эстетическое оценивание усваиваемого содержания (Л)
— анализ, синтез, сравнение, обобщение, аналогия,
классификация (П)
— понимание тексстов, извлечение необходимой информации (П)
-подведение под понятие (П)
-моделирование , преобразование модели (П)
-использование знаково – символических средств (П)
-установление причинно — следственных связей(П)
— построение логической цепи рассуждений, выведение следствий (П)
-самостоятельное создание алгоритмов деятельности (П)
-выполнение действий по алгоритму (П)
— доказательство (П)
— осознанное и произвольное построение речевого высказывания (П)
— контроль, коррекция,оценка (Р)
Решение задачи.
Для уничтожения микробов и бактерий можно использовать диоксид серы, его также применяют в качестве консервирующего средства при сушке чернослива и других фруктов. Вычислите, сколько образуется оксида серы (IV) при горении 10 грамм серы в кислороде, объемом 1 литр?
7. рефлексия учебной деятельности на уроке
Самооценка учениками собственной учебной деятельности
— рефлексия способов и условий действий (П)
— контроль и оценка процесса и результатов деятельности (П)
-самооценка на основе критерия успешности (Л)
— адекватное понимание причин успеха и неуспеха в учебной деятельности (Л)
-выражение своих мыслей с достаточной полнотой и точностью (К)
— формирование и аргументация своего мнения , учет разных мнений (К)
— использование критериев для обоснования своего суждения (К)
— планирование учебного сотрудничества (К)
— следование в поведении моральным нормам и этическим требованиям (Л)
Рефлексия
Выбрать начало фразы (презентация) и продолжить его.
(1. сегодня я узнал ….
2. было интересно ……
3. было трудно …….
4. я выполнял задания…
5. я понял, что…
6. теперь я могу…
7. я почувствовал, что…
8. я приобрел…
9. я научился…
10. у меня получилось …
11. я смог…
12. я попробую…
13. меня удивило…
14. урок дал мне для жизни…
15. мне захотелось…)
Домашнее задание
-подготовить краткие иллюстрированные рефераты- сообщения – «История серы», «Применение серы»
— §17,задачник — № 3-10, 3-23.
Урок по химии на тему: «Сера
Урок химии в 9 классе
Тип:
Урок изучения и первичного закрепления знаний.
Тема урока: «Сера – простое вещество».
Стратегическая цель:
Научить учащихся составлять ш. с.о. элемента и прогнозировать химические свойства вещества.
с.о. элемента и прогнозировать химические свойства вещества.
Цели урока:
— дидактическая: охарактеризовать серу в свете трёх форм существования химического элемента: в форме атомов, простого вещества, а следовательно, и её аллотропию, а также формы некоторых соединений серы; химические свойства серы рассмотреть в свете окислительно-восстановительных реакций;
— развивающая: продолжить развитие умений устанавливать причинно- следственные связи, делать выводы, наблюдать и объяснять результаты демонстрационного эксперимента, прогнозировать свойства вещества;
— воспитательная: способствовать формированию информационной, коммуникативной, ценностно-смысловой компетенций учащихся.
Методы обучения: частично-поисковый, проблемно-дискуссионный, использование информационно-коммуникационных технологий.
Оборудование: компьютерная презентация, видео-опыты, инструктивные карты, компьютер, экран, проектор; химические стаканчики на 100 мл с водой, ступка с пестиком, стеклянные палочки, спиртовка, пробирки.
Реактивы: S, Na, H2 O.
Тема урока: «Сера – простое вещество»
Девиз: “Жить – значит узнавать”
Д.И.Менделеев
Мотивационно-ориентировочный этап.
«Черный ящик»
Люди начали меня использовать уже за 2 тысячи лет до н. э.
В Древнем Египте — для приготовления красок, для беления тканей и изготовления косметических средств, а в Древней Греции меня сжигали в целях дезинфекции вещей и воздуха в помещениях. Одна из причин этой известности – моя распространенность в самородном виде в странах древнейших цивилизаций. Меня сжигали при различных церемониях и ритуалах. С моей помощью боролись с насекомыми.
Меня сжигали при различных церемониях и ритуалах. С моей помощью боролись с насекомыми.
Я нужна везде. Бумага, резина, эбонит, спички, ткани, лекарства, косметика, пластмассы, взрывчатка, краска, удобрения и ядохимикаты – вот далеко не полный перечень вещей и веществ, для которых я необходима.
Название мое идет от санскритского слова «сира», что значит светло-желтый. Я содержусь в бобовых растениях, овсяных хлопьях, яйцах. А алхимики изображали меня в виде огнедышащего дракона.
Ребята, какое вещество находится в «черном ящике»?
Тема урока – «Сера – простое вещество».
Сера — это одно из первых веществ, о которых знало человечество; «начало начал» древнейших философов и алхимиков; элемент, окутанный мистикой и тайнами: в древности люди наделяли серу таинственными сверхъестественными свойствами. Встречаясь в виде серных жил в кратерах вулканов, сера издавна считалась продуктом деятельности подземного бога Вулкана.
Цель урока – изучить серу как простое вещество.
Операционально-исполнительский этап
Как мы будем изучать данное вещество? Спланируйте свои действия, составьте план работы на уроке.
План.
1. Положение в периодической системе.
2. Состав, строение, свойства атома серы.
3. Состав, строение, свойства простого вещества.
4.Физические и химические свойства серы.
5. Нахождение в природе, получение и применение серы.
Беседа с учащимися.
1. Какое положение занимает сера в ПСХЭ Д.И. Менделеева?
Модель ответа: сера находится в III периоде, в VIA группе и относится к семейству халькогенов.
2. Строение атома серы. Показать распределение электронов по энергетическим уровням и составить электронно- графическую формулу атома серы.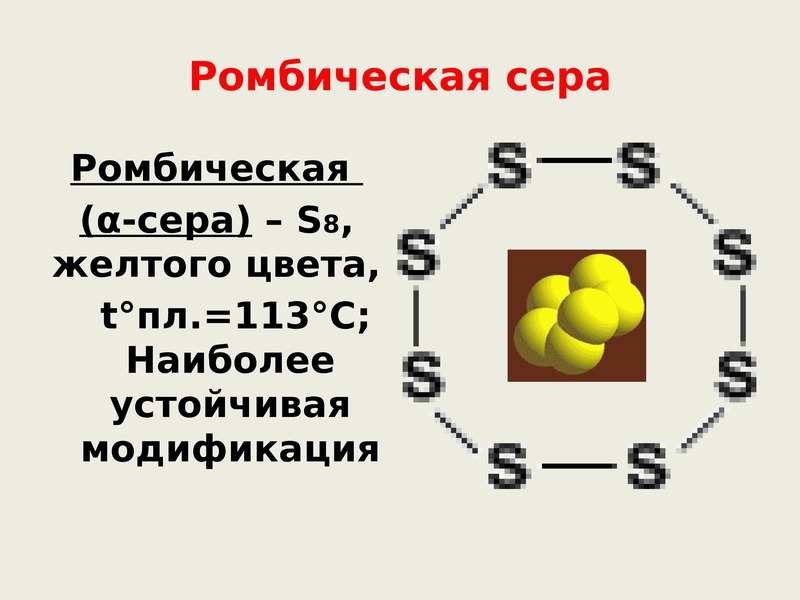
Это задание выполняет один из учащихся на доске, а остальные учащиеся в тетрадях.
Модель ответа:
На первом уровне один подуровень и одна s-орбиталь, заполненная полностью. На втором уровне два подуровня и четыре орбитали – 1s и 3p, заполненные полностью. На третьем уровне — три подуровня и девять орбиталей. Появляется d-подуровень, он в спокойном состоянии атома не заполнен. Внешний электронный слой заполнен так же, как и у кислорода.
3.Пользуясь периодической системой, определите ВСО и НСО атома серы в соединениях.
Сегодня на уроке мы будем учиться составлять шкалу степеней окисления элемента.
Шкала степеней окисления серы.
-2 0 +2 +4 +6
H2S S2 SCl2 SO2 SO3
K2S S8 H2SO3 H2SO4
K2SO3 K2SO4
Ребята, на прошлом уроке мы с вами говорили о том, что кислород проявляет только окислительные свойства, а сера — и окислительные, и восстановительные. С чем это связано?
С чем это связано?
У кислорода два электронных уровня, а у серы три. Радиус серы больше радиуса кислорода. Сера может предоставить более электроотрицательному элементу 2 электрона, проявляя при этом степень окисления +2.
Проблемный вопрос: «Может ли атом серы проявлять другие степени окисления?»
У атома серы есть две орбитали, имеющие пары электронов. В возбуждённом состоянии может происходить разъединение пары электронов. При разъединении одной пары электрон перескакивает на d-подуровень, образуется четыре не спаренных электрона, которые сера может предоставлять более электроотрицательным атомам, проявляя при этом степень окисления +4 . При разъединении ещё одной пары электронов образуется 6 неспаренных электронов, которые так же сера может предоставлять более электроотрицательным атомам, проявляя при этом степень окисления +6.
Вывод: Сера может быть и окислителем и восстановителем со степенями окисления: –2, 0, +2, +4, +6.
Пользуясь шкалой степеней окисления серы, вы будете далее самостоятельно прогнозировать химические свойства серы.
Предположите, с какими веществами будет реагировать сера, проявляя себя как окислитель.
Ученик: с водородом и металлами.
Действительно, сера активный неметалл и при обычных условиях реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром. При нагревании и с другими металлами. Взаимодействие с ртутью — демеркуризация.
Не реагирует с золотом.
Демонстрационный опыт.
Взаимодействие серы с натрием.
Окислительные свойства сера проявляет и с водородом, с которым реагирует при нагревании. В результате реакции получается ядовитый газ сероводород с запахом тухлых яиц.
Восстановительные свойства сера проявляет с более электроотрицательными неметаллами – кислородом, фтором. Фтор глубже, чем кислород окисляет серу(+6), она в потоке фтора начинает плавиться (без предварительного нагревания), а затем сгорает. Для реакции с кислородом серу предварительно следует расплавить. Сгорает она , образуя оксид серы (IV) S О2 , который каталитическим путем может быть окислен до оксида серы (VI) S О3. Из неметаллов с серой не реагируют азот, иод, благородные газы.
Фтор глубже, чем кислород окисляет серу(+6), она в потоке фтора начинает плавиться (без предварительного нагревания), а затем сгорает. Для реакции с кислородом серу предварительно следует расплавить. Сгорает она , образуя оксид серы (IV) S О2 , который каталитическим путем может быть окислен до оксида серы (VI) S О3. Из неметаллов с серой не реагируют азот, иод, благородные газы.
Демонстрационный видео-опыт – горение серы в кислороде.
Вторая группа свойств
S0 + 2е S-2
S0 — окислитель (восстанавливается)
S0 + 2Na Na 2 S-2
S0 + Н2 Н2 S-2
S0— 4е ® S+4 — 2е ® S+6
-6е
S0 — восстановитель (окисляется)
S0+О2 ®S+4 О2
2S О2 + О2 ® 2S+6 О3
S0 + 3F2 ® S+6 F6
Все реакции экзотермические
S +Al самостоятельно
Проблемный вопрос: какие свойства – окислительные или восстановительные будет проявлять сера, взаимодействуя с углеродом? Запишите уравнение реакции на доске, применив ряд ЭО неметаллов.
S +С ®СS2
Сера в данной реакции – окислитель.
Закрепление изученного материала.
Задание1.
Применяя шкалу степеней окисления серы осуществить цепочку превращений, записанную в непривычном для вас виде:
S0® S-2® S+4® S+6® S+6® S+6
С помощью учителя осуществляется работа учащихся у доски по цепочке.
Ответ:
S+ Н2 ® Н2S
Н2S + О2 ® Н2 О + S О2
2S О2 + О2® 2S О3
S О3 +Н2 О ® Н2SО4
Н2SО4 +2КОН ® К2SО4 + 2Н2 О
Задание2.
Применяя шкалу степеней окисления серы, приведите примеры соединений серы, в которых она образует ковалентную неполярную, ковалентную полярную и ионную связь.
Ответ: S8 , Н2S, К2S
Задание3.
Найти в ряду «лишнее» соединение серы и дать аргументированный ответ.
S О3 , K2 S, Al3S5, SCl2, CS2
Ответ: К2S – соединение с ионной связью, все остальные с ковалентной полярной.
Сера – простое вещество.
Сера – это типичный неметалл. Рассмотрите образцы серы, опишите физические свойства. Проверьте растворимость серы в воде. Кристаллы серы в воде тонут, а порошок плавает на поверхности воды, так как мелкие кристаллики серы не смачиваются и поддерживаются на плаву мелкими пузырьками воздуха. Это процесс флотации. Сера хорошо растворяется в ацетоне, толуоле, сероуглероде.
Это процесс флотации. Сера хорошо растворяется в ацетоне, толуоле, сероуглероде.
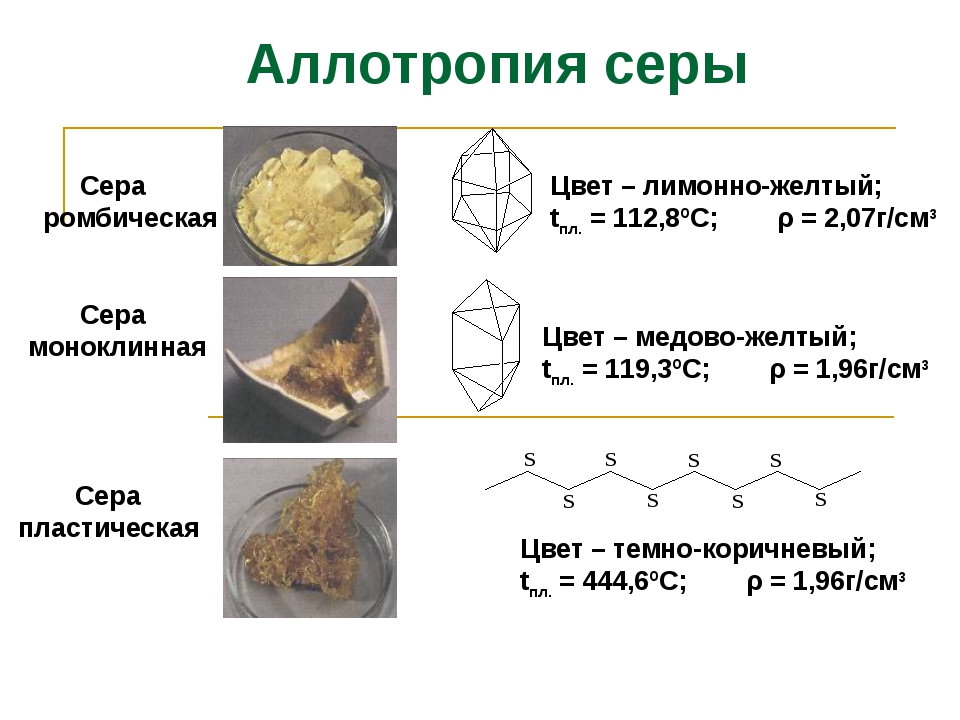
Для серы, как и для кислорода характерна аллотропия. Известно много аллотропных модификаций серы. Сегодня на уроке мы познакомимся с тремя– ромбической, моноклинной и пластической.
Ромбическая сера состоит из молекул S8, ее кристаллы имеют вид октаэдров со срезанными углами, они окрашены в лимонно-желтый цвет. Рассмотрим способ получения пластической серы из ромбической.
Ребята, ваша задача – внимательно провести наблюдения за явлениями, которые происходят при нагревании серы, зафиксировать внешние изменения вещества и выполнить задание на карточке.
Задание: изучить рисунки и на основании наблюдений выяснить причины аллотропных видоизменений серы.
Вспомним из прошлого материала, что такое аллотропия? (Аллотропия — это способность одного и того же химического элемента образовывать различные простые вещества).
На прошлом уроке мы познакомились с аллотропными модификациями химического элемента кислорода — кислородом и озоном. В чём причина различия их физических и химических свойств? (Причина в разном количестве атомов в молекуле: кислород — 2, озон – 3). Мы выяснили, что причина аллотропии кислорода — разное число атомов в молекуле; а в чём причина возникновения аллотропных модификаций у серы? (Причина кроется в различных способах соединения атомов между собой).
Сера образует молекулы с чётным числом атомов: S2, S4, S6, S8. При обычных условиях устойчива молекула S8. Из таких молекул построены две аллотропные кристаллические модификации серы: ромбическая и моноклинная. Ромбическая — лимонно-жёлтая кристаллическая сера . При температуре 95 0С ромбическая переходит в моноклинную. При температуре 119 0С она плавится, около 160 0С кольца молекул S8 разрываются, образуя бесконечные спирали. При кристаллизации из расплава получается моноклинная сера – игольчатые кристаллы, она устойчива между 95,6 °С и температурой плавления. Моноклинная переходит в тёмно-коричневую смолообразную пластическую серу. Все формы через определённое время переходят в ромбическую.
При кристаллизации из расплава получается моноклинная сера – игольчатые кристаллы, она устойчива между 95,6 °С и температурой плавления. Моноклинная переходит в тёмно-коричневую смолообразную пластическую серу. Все формы через определённое время переходят в ромбическую.
Какого типа кристаллическая решетка у серы?
Ученик: Молекулярная.
Как практически можно определить тип кристаллической решетки?
Сера в природе. Работа с учебником. По учебнику изучить нахождение серы в природе и сделать вывод.
Получение и применение серы – мини – проект , выполненный учащимися.
Рефлексивно-оценочный этап.
Тест с самопроверкой.
1. Электронная формула внешнего энергетического уровня атома серы:
А. ns2np6 Б. ns2np4 В. ns2np5 Г. ns2np3
ns2np5 Г. ns2np3
2. Ряд формул веществ, в которых степень окисления серы уменьшается:
А. SO3 FeS S О2 Б. MgS ¾ S ¾ S О2
В. S О2 ¾ S ¾ Н2 S Г. S ¾ Н2 S ¾ Al 2S3
3. Какой модификации серы не существует:
А. ромбической Б. тетраэдрической В. моноклинной Г. пластической?
4. Сера не растворяется в
А. ацетоне Б. воде В. сероуглероде Г. толуоле.
5. При комнатной температуре без первоначального нагревания сера реагирует с металлом:
А. железом Б. цинком В. алюминием Г. ртутью.
6. В каком виде сера практически не встречается в природе:
А. сульфитная Б. сульфидная В. сульфатная В. самородная?
сульфатная В. самородная?
Ответы:
1.Б
2.В
3.Б
4.В
5.Г
6.А
Домашнее задание – п.21, упр.3, задача 1. Для выполнения упр. 3 сделайте примечание – соли нестойких кислот при нагревании разлагаются.
Индивидуальное домашнее задание.
S-2 S-2 ®S0® S+4 ®S+6 ®S+6 ®S-2
В завершение поделитесь своими впечатлениями об уроке. Для этого выскажите свое мнение-
Сегодня я узнал ________________________________________________________
Я удивился ____________________________________________________________
Я хотел бы ____________________________________________________________
Конспект урока на тему «Сера – простое вещество»
Тема «Сера – простое вещество»
Цель урока: определить положение серы в периодической системе химических элементов Д. И. Менделеева, рассмотреть строение атома серы, физические и химические свойства, области применения серы.
И. Менделеева, рассмотреть строение атома серы, физические и химические свойства, области применения серы.
Оборудование: ПСХЭ, ноутбук, мультимедийный проектор, образцы серы, вода, химический стакан, стеклянная палочка.
Ход урока:
Организационный момент.
Проверка домашнего задания. (Презентация)
Игра по теме «Кислород». Стрелка барабана указывает на номер вопроса, ученики по очереди отвечают на вопросы, зарабатывая баллы (за правиль-ный ответ – 1 балл).
Назовите самый распространённый элемент на нашей планете. (Кислород)
Назовите аллотропные модификации кислорода. (Кислород и озон)
Какая химическая связь в молекуле кислорода? (Ковалентная неполярная)
Назовите основные физические характеристики кислорода. (Кислород – это газ без цвета, запаха, вкуса)
С какими веществами взаимодействует кислород? (Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов)
Назовите признаки реакций горения.
 (Выделение большого количества теплоты, воспламенение)
(Выделение большого количества теплоты, воспламенение)Где применяется кислород? (В металлургии, как окислитель ракетного топлива, в авиации и медицине для дыхания, при взрывных работах, для газовой резки и сварки металлов)
Напишите уравнение реакции для получения кислорода, осуществляемой в присутствии оксида марганца(IV) 2Н2О2 = 2Н2О + О2
Запишите уравнение реакции кислорода с щелочным металлом. 4Li + O2 = 2Li2O
Запишите уравнение реакции кислорода с алюминием. 4Аl + 3O2 = 2Al2O
Запишите уравнение реакции в которой кислород является восстановителем. 2F2 + 2Н2О = 4НF + О2
Запишите уравнение реакции кислорода с фосфором. Запишите уравнение реакции кислорода. 4Р + 5O2 = 2Р2O5
Сообщение темы и целей урока.

Сегодня на уроке, мы познакомимся со следующим элементом VI группы главной подгруппы ПСХЭ. Эпиграфом к нашему уроку послужат слова “В древней магии присутствую при рождении огня, называют серой издавна меня» (слайд 1). Итак, тема урока «Сера – простое вещество» (слайд 2), цель урока (слайд 3).
Изучение нового материала.
Положение серы в ПСХЭ. (слайд 4) Используя ПСХЭ, дайте характеристику химическому элементу сере (порядковый номер, номер группы, периода, строение атома). Сера на внешнем энергетическом уровне содержит 6 электронов, из которых 2 электрона неспаренные. Однако, по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2,+4,+6. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.
Физические свойства (слайд 5)
Лабораторный опыт: рассмотрите образец серы, определите агрегатное состояние, цвет, растворимость в воде.
Вывод: сера – это твёрдое вещество, жёлтого цвета, в воде не растворяется.
Кристаллы серы в воде тонут. А порошок плавает на поверхности воды, т.к. мелкие кристаллики серы водой не смачиваются и поддерживаются на плаву мелкими пузырьками воздуха. Это процесс флотации. (Продемонстрировать опыт)
Аллотропные модификации серы (слайд 6)
Для серы, как и для кислорода, характерна аллотропия.
— ромбическая сера (слайд 7)
Наиболее устойчивая модификация, состоящая из молекул S8. Её кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной температуре превращаются все другие модификации.
— моноклинная сера (слайд 8)
При кристаллизации расплава сначала получается моноклинная сера (игольчатые кристаллы), которая затем переходит в ромбическую.
— пластическая сера (слайд 9)
При нагревании кусочков серы в пробирке, она плавится, превращаясь в жидкость жёлтого цвета. При температуре 160 градусов жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость темно-коричневого цвета. Если её вылить в холодную воду, она застывает в виде резинообразной массы. Это пластическая сера. Однако через несколько дней она превращается в ромбическую серу.
Химические свойства серы (слайд 10)
При обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром, при нагревании сера реагирует и с другими металлами (цинк, алюминий, железо), образуя сульфиды. Только золото не реагирует с серой ни при каких условиях.
Запишите уравнение реакции серы с ртутью, составьте уравнение электронного баланса. Задание: используя учебник, стр. 131, ответьте на вопросы: какое практическое значение имеет эта реакция? Какая реакция называется демеркуризацией?
131, ответьте на вопросы: какое практическое значение имеет эта реакция? Какая реакция называется демеркуризацией?
Из неметаллов с серой не реагируют только азот, йод и благородные газы. Запишите уравнения реакции серы с водородом, кислородом, составьте уравнение электронного баланса. Сероводород и сернистый газ – это яды. При курении тоже образуются сероводород и сернистый газ, отравляя организм. Не губите своё здоровье сознательно! Не курите!
Нахождение в природе (слайд 11)
В природе сера встречается в трёх формах: самородная, сульфидная и сульфатная.
Биологическое значение серы.
Сера — жизненно важный химический элемент. Она входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. При недостатке серы в организме наблюдается ломкость костей, ногтей, выпадение волос. Серой богаты горох, фасоль, пшеница, яйца. Содержание серы в организме человека массой 70 кг – 140г. Сколько серы содержится в вашем организме.
Сколько серы содержится в вашем организме.
Применение серы (слайд 12)
5.Закрепление изученного материала (фронтальный опрос)
— охарактеризуйте положение серы в ПСХЭ;
— охарактеризуйте физические свойства серы;
— назовите аллотропные модификации серы;
— в каком соединении сера проявляет степень окисления +4
А) Н2S Б)Н2SО3 В) Н2SО4
— с каким веществом реагирует сера, образуя сульфиды
А) водой Б)водородом В) натрием
Запишите уравнение реакции.
Домашнее задание
Параграф 22, упр.2 стр.134
Подведение итогов урока.
Комментирование оценок.
Характерные химические свойства кислорода и серы.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т. е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию.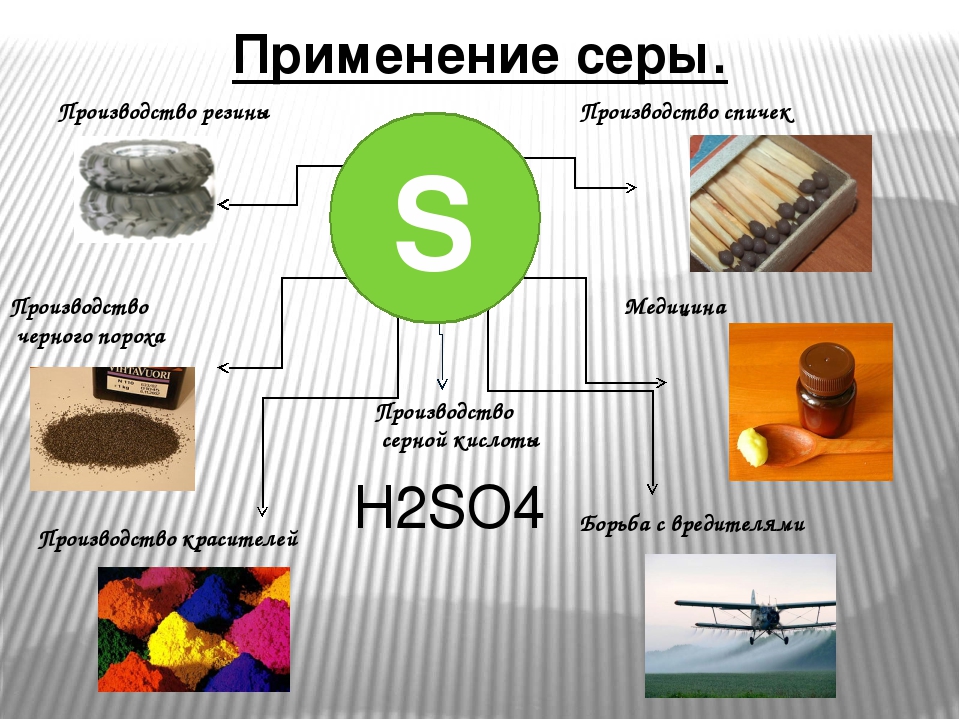 Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
PbS + 4O3 = PbSO4 + 4O2
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
2Ag + O3 = Ag2O + O2
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях.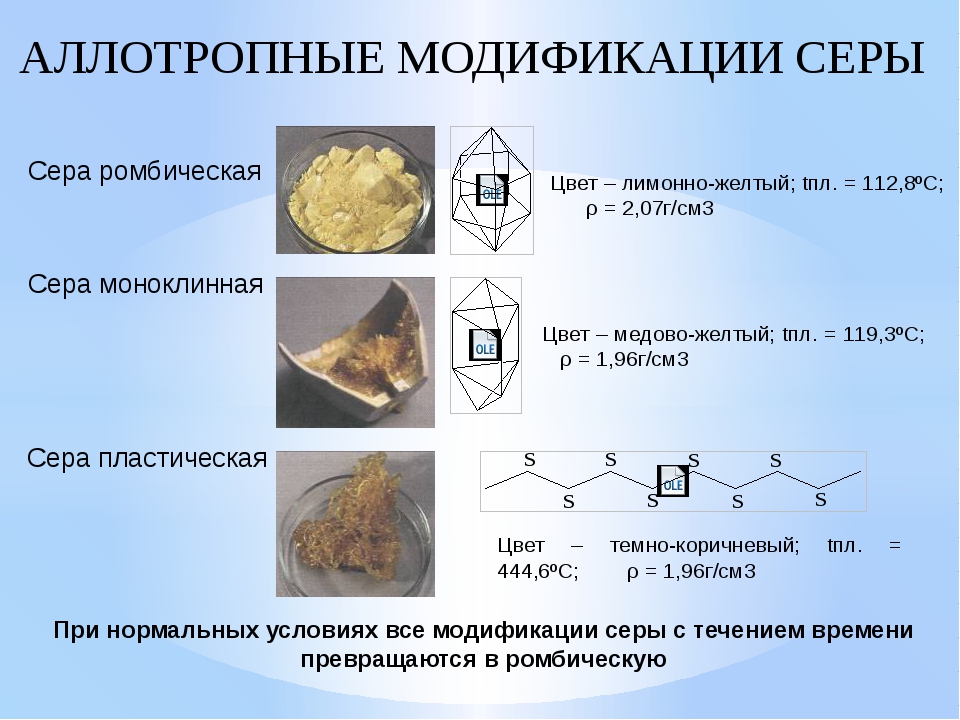 Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
Онлайн урок: Сера по предмету Химия 8 класс
Серная кислота H2SO4 – важный ресурс для химической промышленности и её продукт.
Серную кислоту активно использовали ещё алхимики как «купоросное масло».
Купоросное, потому что сульфаты тяжелых металлов издавна называют купоросами.
А масло, потому что чистая серная кислота:
- тяжелая (в 2 раза тяжелее воды) маслянистая жидкость
- без запаха
- не летучая
- гигроскопичная (быстро поглощает пары воды из воздуха)
Она смешивается с водой в любых отношениях, причем при смешении выделяется большое количество тепла.
Например, если в концентрированную серную кислоту влить немного воды, то выделяющегося тепла достаточно для её закипания, и вода может тут же разбрызгаться вместе с кислотой.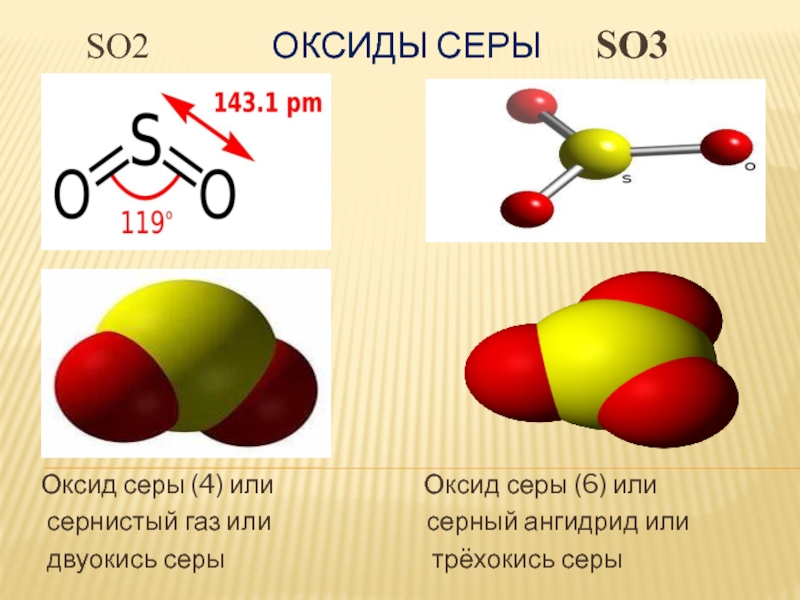
Поэтому при разбавлении серной кислоты никогда не льют воду в кислоту, а только кислоту в воду, небольшими порциями при постоянном перемешивании.
Вспомните об этом, если вам придется разбавить электролит для аккумулятора.
Серная кислота образуется при реакции оксида серы (VI) с водой.
Оксид серы (VI) SO3– бесцветная летучая жидкость, ниже 17 °С превращается в прозрачную хлопьевидную массу, кипит при 44 °С.
Это типичный кислотный оксид и проявляет все свойства кислотных оксидов, реагирует с основными и амфотерными оксидами, с основаниями, образуя сульфаты – соли серной кислоты.
Свойства разбавленной и концентрированной серной кислоты различаются.
За счет того, что сера находится в максимальной степени окисления +6, серная кислота – окислитель.
Однако её окислительные свойства проявляются только в концентрированном виде.
Разбавленная серная кислота является сильной кислотой, хорошо растворяет большинство металлов с выделением водорода, реагирует с основными и амфотерными оксидами, основаниями с образованием сульфатов.
Концентрированная серная кислота является окислителем и растворяет гораздо больше металлов, чем разбавленная, но уже с выделением оксида серы (IV) SO2, серы S или сероводорода H2S (чем активнее металл, тем меньше степень окисления серы в продукте реакции).
Но также концентрированная серная кислота реагирует и с неметаллами (серой, фосфором, углеродом), окисляя их до оксидов или кислот.
Концентрированная серная кислота гигроскопична, то есть поглощает пары воды, поэтому её используют как осушитель.
Газы, которые не вступают с ней в реакцию, сушат пропусканием через склянки с концентрированной серной кислотой.
Этот способ подходит для осушения углекислого газа CO2, хлороводорода HCl, хлора Cl2, водорода H2.
А, например, аммиак NH3 с серной кислотой немедленно образует сульфат аммония:
Гигроскопичность серной кислоты проявляется в том, что она обугливает органические вещества.
Например, если её добавить к истолчённому сахару, смесь сразу же чернеет – кислота отнимает от сахара воду, оставляя углерод.
Это свойство серной кислоты объясняет то, что при попадании на кожу она вызывает сильные ожоги.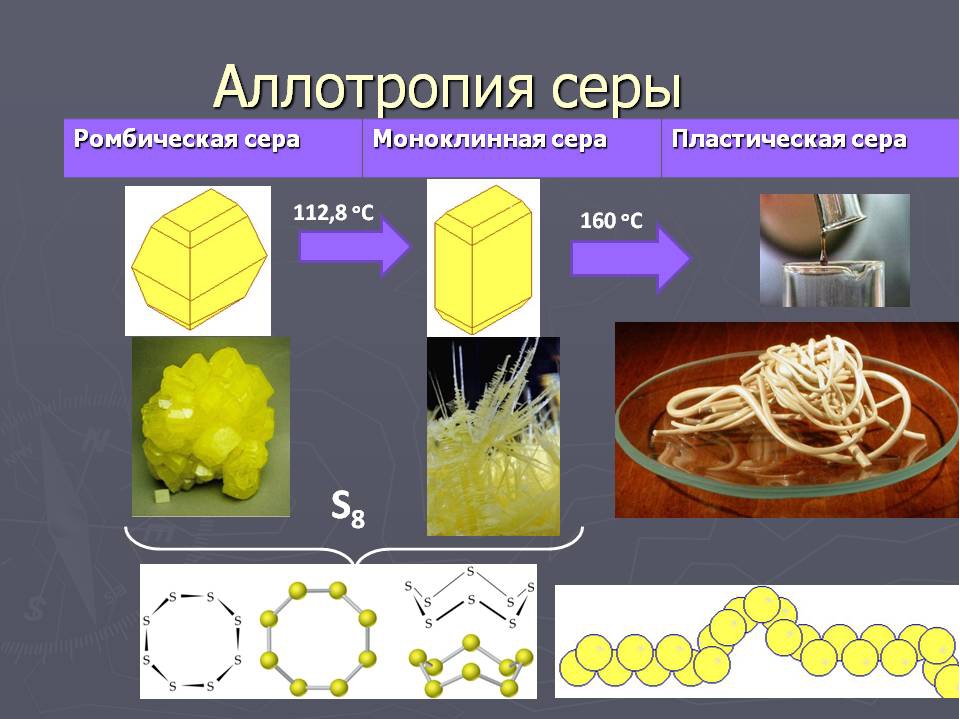
В лабораториях, где часто работают с концентрированной серной кислотой, под рукой всегда держат раствор питьевой соды. Именно этим раствором и большим количеством воды и смывают кислоту с кожи.
Серная кислота относится к продуктам основного химического производства.
С ней вы наверняка сталкиваетесь почти каждый день: электролит в свинцово-кислотных аккумуляторах представляет собой 30 % серную кислоту.
Но, кроме этого, она также используется при производстве удобрений, при обработке руд для получения редкоземельных металлов, в химическом производстве красителей, взрывчатых веществ, в легкой промышленности для обработки тканей, восстановления наполнителей фильтров для воды.
1.
 Химический элемент, простое вещество, сложное вещество и смесь
Химический элемент, простое вещество, сложное вещество и смесь
Под
химическим
элементом
понимают
совокупность атомов с одинаковым
положительным зарядом ядра и с определенным
набором свойств. Атомы одного и того же
химического элемента, соединяясь,
образуют простое
вещество.
При
сочетании атомов разных химических
элементов возникают сложные
вещества
(химические
соединения)
или
смеси.
Отличие
химических соединений от смесей состоит
в том, что:
— они
обладают новыми свойствами, которых не
было у простых веществ, из которых они
были получены;
— их
невозможно механически разделить на
составные части;
—
химические элементы в их составе могут
быть только в строго определенных
количественных соотношениях.
Некоторые
химические элементы (углерод,
кислород, фосфор, сера) способны
существовать в виде нескольких простых
веществ. Это явление носит название
Это явление носит название
аллотропии,
а
разновидности простых веществ одного
и того же химического элемента называются
его аллотропными
модификациями
(видоизменениями).
Задачи
1.1.
Чего больше существует в природе:
химических элементов или простых
веществ? Почему?
1.2.
Верно ли утверждение, что сера и железо
в состав сульфида железа входят как
вещества? Если нет, то каков правильный
ответ?
1.3.
Назовите аллотропные модификации
кислорода. Отличаются ли они по своим
свойствам? Если да, то как?
1.4.
Какая из аллотропных модификаций
кислорода химически более активна и
почему?
1.5.
Простыми веществами или химическими
элементами являются цинк, сера и кислород
в следующих реакциях:
1)
СuSО4
+ Zn = ZnSO4
+ Cu;
2)
S + O2
= SO2;
3)
Zn + 2HC1 = ZnCl2
+ H2;
4)
Zn + S = ZnS;
5) 2H20
= 2H2
+ O2.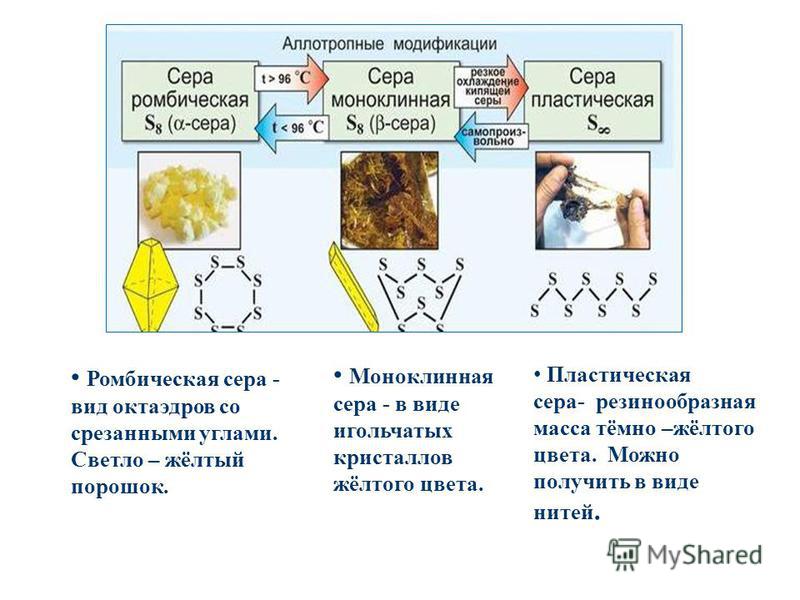
1.6.
Можно ли из одного простого вещества
получить другое простое вещество? Дать
мотивированный ответ.
1.7. При
сгорании некоторого вещества в кислороде
получаются оксид серы (IV),
азот и вода. Какие химические элементы
образуют исходное вещество?
1.8.
Указать, к простым или сложным веществам
относятся: Н2О,
С12,
NaOH,
O2,
HNO3,
Fe,
S,
ZnSO4,
N2,
AgCl,
I2,
A12O3,
O3?
1.9. Для
каких химических элементов известны
аллотропные модификации? Назовите эти
модификации.
1.10.
Возможен ли переход химического элемента
из одной аллотропной модификации в
другую? Привести примеры.
1.11.
Какие химические элементы имеют в виду,
когда говорят об алмазе, озоне?
1.12.
Какие из веществ являются химическими
соединениями, а какие — смесями:
1)
почва;
2)
воздух;
3) мел;
4)
серная кислота;
5) вода?
1. 13.
13.
Как доказать, что хлорид натрия относится
к сложным веществам?
1.14.
Назовите три аллотропные модификации
углерода.
1.15.
Как называются и чем отличаются друг
от друга аллотропные модификации
фосфора?
1.16.
Как называются и чем отличаются друг
от друга аллотропные модификации серы?
1.17.
Указать, какое из утверждений верно и
почему — в состав сульфата бария входят:
1)
простые вещества барий, сера, кислород;
2)
химические элементы барий, сера, кислород.
1.18.
Сколько литров аммиака может быть
получено из смеси 10 литров азота и 30
литров водорода?
1.19.
Сколько литров водяного пара образуется
из смеси 10 литров водорода и 4 литров
кислорода? Какой газ и в каком объёме
останется в избытке?
1.20.
Сколько граммов сульфида цинка (ZnS)
может образоваться из смеси 130 г цинка
и 48 г серы?
1. 21.
21.
Можно ли считать ковкий чугун химическим
соединением или это смесь веществ?
1.22.
Чем является раствор спирта в воде –
смесью или химическим соединением?
1.23.
Может ли сложное вещество состоять из
атомов одного вида?
1.24.
Какие из нижеперечисленных веществ
являются смесями и какие химическими
соединениями:
1)
бронза;
2)
нихром;
3)
керосин;
4)
калийная селитра:
5)
канифоль;
6)
суперфосфат.
1.25.
Дана смесь Cl2
+ HCl
+ CaCl2
+ H2O.
1)
Сколько в смеси различных веществ;
2)
Сколько в смеси молекул хлора;
3)
Сколько в смеси атомов хлора;
4)Сколько
молекул различных веществ содержится
в смеси.
Сера — это поливалентный неметалл, содержащийся в большом количестве, без вкуса и запаха. Приложения Основным производным серы является серная кислота (h3SO4), один из важнейших элементов, используемых в качестве промышленного сырья. Сера в окружающей среде Жизнь на Земле могла быть возможна из-за серы. Сера естественным образом встречается возле вулканов. Самородная сера встречается естественным образом в виде массивных отложений в Техасе и Луизиане в США. Известны многие сульфидные минералы: пирит и маркаист — сульфид железа; стибнит — сульфид сурьмы; галенит — сульфид свинца; киноварь — это сульфид ртути, а сфалерит — сульфид цинка.Другими, более важными сульфидными рудами являются халькопирит, борнит, пенландит, миллерит и молибденит.
Источники таблицы Менделеева. Вернуться к периодической таблице элементов . Для получения дополнительной информации о месте серы в окружающей среде перейдите к циклу серы . |
Элементы, соединения и смеси
Элементы,
Составы и смеси
Элементы
Известно любое вещество, содержащее только один вид атома.
как элемент . Потому что атомы не могут быть созданы или
разрушаются в химической реакции, такие элементы, как фосфор (P 4 )
или сера (S 8 ) не может быть разбита на более простые
веществами этими реакциями.
Пример: вода разлагается на смесь водорода и
кислород, когда через жидкость пропускают электрический ток.
С другой стороны, водород и кислород не могут быть разложены на
более простые вещества. Следовательно, они являются элементарными, или
простейшие, химические вещества — элементы.
Каждый элемент представлен уникальным символом. Обозначение
для каждого элемента можно найти в периодической таблице элементов.
Элементы можно разделить на три категории, которые имеют
характерные свойства: металлы, неметаллы и полуметаллы. Большинство элементов — это металлы, которые находятся слева и ближе к
Большинство элементов — это металлы, которые находятся слева и ближе к
нижняя часть таблицы Менделеева. Горстка неметаллов
сгруппированы в правом верхнем углу периодической таблицы. В
полуметаллы можно найти по разделительной линии между
металлы и неметаллы.
Атомы
Элементы состоят из атомов, самые маленькие
частица, обладающая любым из свойств элемента.
Дальтон в 1803 г. предложил современную теорию атома, основанную на
следующие предположения.
1. Дело составлено |
2. Все атомы элемента являются |
3. Атомы различных элементов имеют |
4. |
5. Атомы не могут быть созданы или |
Соединения
Элементы объединяются в химические соединения, которые часто
разделены на две категории.
Металлы часто реагируют с неметаллами с образованием ионных соединений .
Эти соединения состоят из положительных и отрицательных ионов, образованных
путем добавления или вычитания электронов из нейтральных атомов и
молекулы.
Неметаллы объединяются друг с другом, образуя ковалентный
соединения , которые существуют в виде нейтральных молекул.
Сокращенное обозначение соединения описывает количество
атомов каждого элемента, который обозначен нижним индексом, написанным
после символа элемента. По соглашению, нижний индекс не используется.
По соглашению, нижний индекс не используется.
записывается, когда молекула содержит только один атом элемента.
Таким образом, вода — это H 2 O, а диоксид углерода — это CO 2 .
Характеристики
Ионные и ковалентные соединения
Ионный | Ковалентные соединения | |
Содержит | Существуют как нейтральные | |
Твердые вещества | Твердые, жидкие или | |
Высокая | Нижняя плавка и | |
Сильный | Относительно слабое усилие | |
Отдельно | Остаться той же самой молекулы | |
Определение наличия
Соединение ионное или ковалентное
Рассчитайте разницу между электроотрицательностями
два элемента в соединении и среднее их
электроотрицательности, и найти пересечение этих значений на
рисунок, показанный ниже, чтобы помочь определить, является ли соединение ионным
или ковалентный, или металлический.
| Практическая задача 1: Для (а) оксид хрома (III), Cr 2 O 3 (б) четыреххлористый углерод, CCl 4 (в) метанол, CH 3 OH (г) фторид стронция, SrF 2 Нажмите здесь |
| Практическая задача 2: Использование
Нажмите |
Формулы
Молекула — самая маленькая частица, имеющая любой из
свойства соединения.Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться количеству отрицательных зарядов.
Примеры:
| CaCl 2 | Сбалансированная формула имеет 2 положительных заряда (1 кальций ион с +2 зарядом) и 2 отрицательных заряда (2 хлорида ионы с зарядом -1) |
| Al 2 (SO 4 ) 3 | Сбалансированная формула имеет 6 положительных зарядов (2 алюминиевых ионы с зарядом +3) и 6 отрицательных зарядов (3 сульфатных ионов с зарядом -2) |
Смеси Vs.Соединения
Закон постоянного состава гласит, что
соотношение по массе элементов в химическом соединении равно
всегда одинаково, независимо от источника соединения. В
закон постоянного состава может использоваться, чтобы различать
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу независимо от его источника. Латунь — это
пример смеси двух элементов: меди и цинка.Может
содержат всего от 10% до 45% цинка.
Еще одно различие между соединениями и смесями элементов
это легкость, с которой можно разделить элементы. Смеси,
такие как атмосфера, содержат два или более веществ, которые
относительно легко отделить. Отдельные компоненты
смеси могут быть физически отделены друг от друга.
Химические соединения сильно отличаются от смесей:
элементы в химическом соединении могут быть разделены только
уничтожение соединения.Некоторые различия между химическими
соединения и смеси элементов иллюстрируются
следующий пример с использованием изюмных отрубей и «Криспикс.».
Изюмовые отруби обладают следующими характеристиками смеси .
- Крупа не имеет постоянного состава; то
соотношение изюма и отрубей меняется от образца к
образец. - Легко физически разделить два
«элементы», чтобы выбрать изюм, для
пример, и съесть их отдельно.
Crispix обладает некоторыми из характерных свойств соединения .
- Соотношение рисовых хлопьев и кукурузных хлопьев постоянно; Это
составляет 1: 1 в каждой выборке. - Нет возможности разделить «элементы»
не разрывая узы, скрепляющие их вместе.
Глава 10 — Соединения с серой, фосфором и азотом — Химия
Глава 10 — Соединения с серой, фосфором и азотом
Эта глава скоро будет доступна в виде загружаемого файла PDF.
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Вступительное эссе — Органические химические вещества как агенты войны
Горчичный газ
Разработка первого химиопрепарата
Фосфаторганические нервные агенты
10,1 Соединения, содержащие серу
Тиолы и дисульфиды
Тиоэфиры
Тиоэфиры
10.2 Соединения, содержащие фосфор
10,3 Азотсодержащие соединения
Амины
Амиды
10.4 Краткое содержание главы
10,5 Ссылки
Вступительное эссе — Органические химические вещества как агенты войны
Напомним, что гетероатом — это любой атом, отличный от углерода или водорода, который находится в органической молекуле.В предыдущей главе мы познакомились с соединениями, содержащими кислород. В этой главе мы сосредоточимся на соединениях, содержащих азот, сульфур и фосфор. Соединения, содержащие эти уникальные гетероатомы, использовались множеством способов, включая смертоносные и разрушительные. Небольшие органические молекулы, содержащие гетероатомы, такие как азот, фосфор и сера, использовались для создания боевых отравляющих веществ. Сюда входят иприты серные, азотные и органофосфаты (например, газ зарин), представленные следующими соединениями:
Горчичный газ
Горчица серная — это прототипное вещество из семейства цитотоксических боевых агентов на основе серы, которые способны образовывать большие пузыри на незащищенных участках кожи и в легких.Чистые серные горчицы представляют собой бесцветные вязкие жидкости при комнатной температуре. При использовании в нечистой форме, например, в качестве боевых агентов, они обычно желто-коричневого цвета и имеют запах, напоминающий запах горчицы, чеснока или хрена, отсюда и название. Первоначально серная горчица получила название LOST в честь ученых Вильгельма Ломмеля и Вильгельма Стейнкопфа, которые разработали метод крупномасштабного производства для Императорской немецкой армии в 1916 году.
Горчичные отравляющие вещества регулируются Конвенцией о химическом оружии 1993 года.В соответствии с настоящей Конвенцией осуществляется мониторинг трех классов химикатов, включая серу и азотный иприт, сгруппированные в Списке 1, как вещества, которые не используются, кроме как в химической войне. Горчичные агенты можно было использовать на поле боя с помощью артиллерийских снарядов, авиабомб, ракет или распыления с боевых самолетов.
Рисунок 10.1 Использование иприта во время Первой и Второй мировых войн. A. Газовый идентификационный плакат армии США времен Второй мировой войны, ок. 1941–1945 гг. Б. Волдыри на руке человека, образовавшиеся в результате воздействия иприта.
Фотография опознавательного плаката предоставлена: Армией США. Фотография блистеров предоставлена: ClockworkSoul
(Вернуться к началу)
Разработка первого химиотерапевтического препарата
Еще в 1919 году было известно, что горчичные препараты подавляют кроветворение, или образование клеток крови. Кроме того, исследователи из Пенсильванского университета, которые сообщили о снижении количества лейкоцитов, провели вскрытие 75 солдат, умерших от горчичного агента во время Первой мировой войны.Это привело к тому, что Американское управление научных исследований и разработок (OSRD) профинансировало биологические и химические факультеты Йельского университета для проведения исследований по применению химического оружия во время Второй мировой войны. В рамках этих усилий группа исследовала азотистый иприт в качестве терапии лимфомы Ходжкина и других типов лимфомы и лейкемии, и это соединение было испытано на своем первом пациенте-человеке в декабре 1942 года. Результаты этого исследования не были опубликованы до тех пор, пока 1946 г., когда они были рассекречены. Параллельно с этим после авианалета на Бари в декабре 1943 года врачи армии США отметили снижение количества лейкоцитов у их пациентов. Через несколько лет после окончания Второй мировой войны инцидент в Бари и работа группы Йельского университета с азотным ипритом совпали, и это побудило к поиску других подобных химических соединений. Из-за использования в предыдущих исследованиях азотистый иприт, названный «HN2», позже известный как мустин, стал первым применяемым химиотерапевтическим препаратом против рака.Мустин (HN2) больше не используется из-за чрезмерной токсичности.
Фосфаторганические нервные агенты
Зарин является фосфорорганическим нервно-паралитическим агентом. Как и все другие нервно-паралитические агенты, зарин атакует нервную систему, препятствуя разложению нейромедиатора ацетилхолина в нервно-мышечных соединениях. Смерть обычно наступает в результате асфиксии из-за неспособности контролировать мышцы, участвующие в дыхательной функции.
Первыми симптомами после воздействия зарина являются насморк, стеснение в груди и сужение зрачков.Вскоре после этого у человека возникнет затрудненное дыхание, тошнота и слюнотечение. Поскольку они продолжают терять контроль над функциями организма, они могут рвать, испражняться и мочиться. За этой фазой следуют подергивания и подергивания. В конечном итоге человек впадает в кому и задыхается от серии судорожных спазмов. Более того, обычная мнемоника для симптоматики отравления фосфорорганическими соединениями, включая газ зарин, является «убийцей В» бронхореи и бронхоспазма, потому что они являются основной причиной смерти, а СЛОЙ — слюноотделение, слезотечение, мочеиспускание, дефекация, желудочно-кишечные расстройства и рвота. .Смерть может наступить через 1-10 минут после прямого вдыхания.
Зарин обладает высокой летучестью (легкостью, с которой жидкость может превращаться в газ) по сравнению с аналогичными нервно-паралитическими веществами, поэтому вдыхание может быть очень опасным, и даже концентрация паров может немедленно проникнуть через кожу. Одежда человека может выделять зарин в течение примерно 30 минут после контакта с газом зарина, что может привести к контакту с другими людьми. Производство и накопление зарина были объявлены вне закона с апреля 1997 года Конвенцией 1993 года о химическом оружии, и он классифицируется как вещество Списка 1.Предполагаемое использование зарина во время недавних терактов в Сирии остается спорной темой в мировой политике.
Кислород является наиболее распространенным и многочисленным гетероатомом, обнаруженным в органических молекулах, и является составной частью всех основных макромолекул, обнаруженных в организме человека (белков, углеводов, жиров / липидов и нуклеиновых кислот). В дополнение к кислороду, сера, фосфор и азот также являются обычными гетероатомами , которые играют особую роль в биологических системах. Азот является ключевым компонентом белков, а фосфор содержится в дезоксирибонуклеиновой кислоте (ДНК) и рибонуклеиновой кислоте (РНК).Сера содержится в более ограниченных количествах в белке, а также во многих других небольших молекулах человеческого тела, включая несколько витаминов. Серосодержащие органические соединения также необходимы для биосинтеза многих химических сигнальных молекул, таких как гормоны и нейротрансмиттеры. Таким образом, в этой главе основное внимание будет уделено органическим функциональным группам и связанным с ними химическим реакциям, связанным с молекулами, содержащими азот, серу и фосфор.
(Вернуться к началу)
10.1 Соединения, содержащие серу
Тиолы и дисульфиды
Поскольку сера находится в той же группе (6A) периодической таблицы, что и кислород, эти два элемента обладают некоторыми схожими свойствами. Можно ожидать, что сера будет образовывать органические соединения, родственные соединениям кислорода, и это действительно так. Тиолы (также называемые меркаптанами) являются серными аналогами спиртов и имеют общую формулу R-SH. Например, метантиол (также называемый метилмеркаптаном) имеет формулу CH 3 SH.Этантиол (этилмеркаптан или CH 3 CH 2 SH) является наиболее распространенным одорантом для жидкого пропана (LP). Его структура аналогична структуре этанола, но с серой вместо кислорода. Запах CH 3 CH 2 SH печально известен. Этантиол более летуч, чем этанол, из-за пониженной способности участвовать в водородных связях. Этантиол токсичен. Он встречается в природе как второстепенный компонент нефти и обычно добавляется к газообразным продуктам без запаха, таким как сжиженный нефтяной газ (LPG), в очень малых дозах, чтобы предупредить об утечках газа.В этих концентрациях этантиол не опасен.
Тиолы могут подвергаться мягкому окислению с образованием соединений, называемых дисульфидами. Этот тип реакции распространен в белковых структурах, где он образует внутримолекулярные дисульфидные мостиковые структуры. Аминокислоты цистеин [HSCH 2 CH (NH 2 ) COOH] и метионин [CH 3 SCH 2 CH 2 CH (NH 2 ) COOH] содержат атомы серы, как и все белки. которые содержат эти аминокислоты.Дисульфидные связи (–S – S–) между белковыми цепями чрезвычайно важны в структуре белка.
Рис. 10.2. Образование дисульфидов из тиоловых структур. A. изображает общее уравнение образования дисульфида из двух молекул тиола. Обратите внимание, что во время этой реакции требуется окисляющий реагент для удаления 2 атомов водорода и 2 электронов из тиоловых структур с целью образования окисленного дисульфидного продукта. Б. Показаны две цистеиновые аминокислоты, которые образовали дисульфидную связь. C. Когда цистеин присутствует в белковых последовательностях, он может реагировать с другими остатками цистеина в структуре и образовывать внутренние белковые структуры, называемые дисульфидными мостиками. Дисульфидные мостики важны для поддержания правильной трехмерной структуры и, таким образом, общей функции белков в биологических системах.
Изображение дисульфидных белковых мостиков в C, предоставлено: Jü
Дисульфидные связки в волосах и перьях — внимательный взгляд
Более 90% сухого веса волос составляют белки, называемые кератинами, которые имеют высокое содержание дисульфидов из аминокислоты цистеина.
Устойчивость, частично обеспечиваемая дисульфидными связями, иллюстрируется обнаружением практически неповрежденных волос из древних египетских гробниц. Перья имеют аналогичные кератины и чрезвычайно устойчивы к пищеварительным ферментам, связанным с белками. Различные части волос и пера имеют разный уровень цистеина, что приводит к получению более твердого или мягкого материала. Манипулирование дисульфидными связями в волосах — основа перманентной завивки в прическе. Реагенты, которые влияют на образование и разрыв связей S – S, являются ключевыми, например.г., тиогликолят аммония. Высокое содержание дисульфидов в перьях обусловливает высокое содержание серы в птичьих яйцах. Высокое содержание серы в волосах и перьях способствует возникновению неприятного запаха, возникающего при их сжигании.
Рис. 10.3 Значение дисульфидных мостиков. Дисульфидные связи очень распространены в волосах и перьях. A. Изображает человеческий волос с увеличением 200X. B. Показывает структуру пера без какой-либо окраски. C. Демонстрирует стойкую прическу.
Фотография увеличенного человеческого волоса предоставлена: Jan Homann. Фотография пера предоставлена: Rita Ballantyne. Фотография постоянной прически предоставлена: LJP Assistant
.
В белке волос, кератине, дисульфидные связи образуются в результате окисления сульфгидрильных групп цистеина. Различные белковые цепи или петли внутри одной цепи удерживаются вместе прочными ковалентными дисульфидными связями. В процессе перманентной волны сначала добавляется основное восстанавливающее вещество (обычно тиогликолят аммония) для уменьшения и разрушения дисульфидных поперечных связей.
Рисунок 10.4 Первый шаг в получении перманентного средства для ухода за волосами. Сначала волосы накручиваются на бигуди. Затем к волосам добавляется первый реагент, основной восстанавливающий агент. Восстанавливающий агент разрушает дисульфидные связи в кератиновых белках волос, позволяя смещать структуру складчатости кератина и приспосабливать к завитой структуре волос.
Для стабилизации волос в новом положении добавляется окислитель, обычно разбавленный раствор перекиси водорода (также называемый нейтрализатором), чтобы восстановить дисульфидные связи в их новых положениях.Перманент будет удерживать эти новые позиции дисульфидных связей до тех пор, пока волосы не отрастут. Новые волосы не обрабатывались и, таким образом, перенимают структуру естественной дисульфидной связи.
Рисунок 10.5 Второй этап перманентного ухода за волосами. После обработки завитых волос восстановителем. К волосам добавляется окислитель для восстановления дисульфидных мостиков, пока волосы находятся в свернутом положении. После раскручивания волосы теперь сохраняют вьющуюся форму из-за образования новых дисульфидных мостиков.
Тиоэфиры
Тиоэфиры, являющиеся серными аналогами простых эфиров, имеют общую формулу RSR ‘. Серный горчица во вступительном эссе является примером тиоэфира. Аналогичным, но нетоксичным тиоэфиром является диметилсульфид (CH 3 SCH 3 ), который вызывает иногда неприятный запах вареной капусты и связанных с ней овощей.
Тиоэфиры
Подобно спиртам, тиолы могут также реагировать с карбоновыми кислотами в реакции дегидратации с образованием сложноэфирной структуры.В этом случае группа -ОН карбоновой кислоты действует как уходящая группа после нуклеофильной атаки серы на карбонильный углерод. Полученный продукт называется тиоэфиром. Общая структура тиоэфира показана ниже:
Реакция дегидратации, необходимая для образования тиоэфира, показана ниже:
Образование тиоэфиров очень важно в биологических системах, особенно в отношении метаболизма жиров. Длинноцепочечные жирные кислоты не могут переноситься через клетку в виде свободных жирных кислот.Структура карбоновой кислоты может нарушить целостность клеточной мембраны. Таким образом, жирные кислоты безопасно перемещаются внутри клетки в виде тиоэфира с важной органической молекулой, известной как кофермент А. Структура кофермента А довольно большая и сложная. Однако важным активным компонентом является ключевая тиоловая группа, указанная стрелкой.
Фактически, кофермент A часто сокращенно называют HSCoA, чтобы подчеркнуть, что именно тиоловая сера обеспечивает критическую связь тиоэфира с группами жирных кислот.Когда жирная кислота присоединена к коферменту A, группа жирной кислоты называется жирной ацил- или более просто группой ацил-. Пример жирной кислоты C 16 , которая была активирована и связана с коферментом A, показан ниже:
Когда ваша пища (углеводы и жиры) расщепляется в вашем теле, она в конечном итоге превращается в простую двухуглеродную единицу, называемую ацетил-КоА, которая по сути является тиоэфирным производным уксусной кислоты:
Ацетил-КоА затем используется в сложном метаболическом цикле, называемом циклом Креба, для производства большого количества аденозинтрифосфата (АТФ).АТФ — основной источник энергии, который поддерживает жизнь и функционирование ваших клеток.
Ключевые вынос
Тиолы, дисульфиды, тиоэфиры и тиоэфиры часто встречаются в биологических соединениях.
Фактов о сере | Живая наука
Ик, что это за запах? Если запах тухлых яиц, это может быть вина серы. Этот ярко-желтый элемент, известный в Библии как «сера», встречается в изобилии в природе и в древние времена использовался для различных целей.
По данным Национальной лаборатории линейных ускорителей Джефферсона, сера, неметалл, занимает 10-е место по численности во Вселенной. Сегодня его чаще всего используют в производстве серной кислоты, которая, в свою очередь, используется в удобрениях, батареях и чистящих средствах. Он также используется для очистки нефти и обработки руд.
Чистая сера не имеет запаха. Согласно Chemicool, запах, связанный с этим элементом, исходит от многих его соединений. Например, соединения серы, называемые меркаптанами, придают скунсу защитный запах.Тухлые яйца и вонючие бомбы приобретают свой характерный аромат из-за сероводорода.
Только факты
По данным лаборатории Джефферсона, свойства серы следующие:
- Атомный номер (количество протонов в ядре): 16
- Атомный символ (в Периодической таблице элементов): S
- Атомный вес (средняя масса атома): 32,065
- Плотность: 2,067 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердое вещество
- Точка плавления: 239.38 градусов по Фаренгейту (115,21 градуса Цельсия)
- Точка кипения: 832,28 градусов по Фаренгейту (444,6 градусов по Цельсию)
- Количество изотопов (атомов одного элемента с разным количеством нейтронов): 23
- Наиболее распространенные изотопы: S-32 (94,99% естественного изобилия), S-33 (0,75% естественного изобилия), S-34 (4,25% естественного изобилия), S-36 (0,01% естественного изобилия)
(Изображение предоставлено Грегом Робсоном / Creative Commons, Андрей Маринкас Shutterstock)
Элемент библейских пропорций
«На нечестивых прольет дождем раскаленные угли и горящую серу; их удел будет палящим ветром.»- Псалом 11: 6
Немногие элементы имеют достаточно высокий статус, чтобы их можно было упомянуть в Библии, не говоря уже о 15 отдельных обозначениях. Но сера часто встречается в природных соединениях, обычно в виде вонючего желтого минерала, связанного с горячими источниками. и вулканы, что, возможно, объясняет, почему авторы Библии связали его с адским огнем и гневом.
Сам по себе элемент не был изолирован до 1809 года, согласно данным Королевского химического общества, когда французские химики Луи-Жозеф Гей-Люссак и Луи-Жак Тенар создал чистый образец.(Гей-Люссак был известен своими исследованиями газов, в ходе которых он летал на воздушных шарах, наполненных водородом, на высоте более 22 900 футов (7 000 метров) над уровнем моря, по данным Фонда химического наследия.)
При сгорании сера дает синий цвет. по данным Агентства по охране окружающей среды, пламя и газообразный диоксид серы — распространенные загрязнители. Диоксид серы в атмосфере поступает в основном из электростанций, работающих на ископаемом топливе, и является одной из основных причин кислотных дождей. Газ также раздражает легкие.EPA регулирует выбросы диоксида серы вместе с пятью другими так называемыми «критериями загрязняющих веществ», включая свинец и монооксид углерода.
Кто знал?
- По данным Chemicool, сера составляет почти 3 процента массы Земли. Этого достаточно серы, чтобы сделать еще две луны.
- Сера (в виде диоксида серы) использовалась для консервирования вина на протяжении тысячелетий и остается ингредиентом вина сегодня, согласно Practical Winery & Vineyard Journal.
- Непонятно, откуда произошло название «сера».Оно могло происходить от арабского слова «суфра» или «желтый». Или это могло быть от санскритского «шульбари», что означает «враг меди». Согласно Chemicool, вторая возможность интригует, поскольку сера действительно сильно реагирует с медью. Знали ли древние люди об этом свойстве серы и называли его соответствующим образом?
- Двуокись серы использовалась для дезинфекции домов с древних времен, практика, которая продолжалась и в 19 веке. В одной статье 1889 года главного инспектора здравоохранения Нью-Йорка описывается, как чиновники сжигали серу и алкоголь в домах, пораженных оспой, скарлатиной, дифтерией и корью.
- А, расслабься! Горячие источники, полные растворенных соединений серы, могут иметь сомнительный запах, но их давно ценили за их предполагаемые лечебные свойства. Город Хот-Сульфур-Спрингс, штат Колорадо, например, возник в 1860 году после того, как белые поселенцы обнаружили серные источники, в которых индейцы Юте впитывали воду на протяжении веков.
- Погодите, а что там с написанием? «Сера» — это обычное написание в Соединенном Королевстве, в то время как «сера» предпочтительнее в Америке.Но с научной точки зрения «сера» — это правильно, согласно Международному союзу чистой и прикладной химии, организации, чья работа заключается в определении этих вещей. Таким образом, даже британские журналы, такие как Nature Chemistry, используют написание «f».
- Сера может сделать много кораблекрушений. Исследование шведского военного корабля, затонувшего в 1628 году, в 2008 году показало, что более 2 тонн серы пропитывают древесину спасенного судна.
- Простите! Основная причина неприятного запаха кишечного газа заключается в том, что толстый кишечник полон бактерий, выделяющих соединения серы в виде отходов.
Текущие исследования
Сегодня сера является побочным продуктом переработки ископаемого топлива в полезные источники энергии, такие как бензин. Эта доработка хороша для предотвращения уноса соединений серы в небо при сгорании топлива, вызывая кислотные дожди. Но это приводит к скоплению холмов элементарной серы на нефтеперерабатывающих заводах.
Около 90 процентов этой элементарной серы идет на производство серной кислоты, сказал Джефф Пьюн, биохимик из Университета Аризоны. Но «поскольку мы проходим миллионы баррелей нефти в день, несколько процентов [серы] на баррель просто быстро накапливаются», — сказал Пьюн.При почти 100 млн. Тонн отработанной серы в год 10 процентов, не используемых в производстве серной кислоты, составляют немаловажные 10 млн. Тонн в год.
Что делать с этим желтым беспорядком? Пюн и его коллеги думают, что у них есть ответ. Они нашли способ превращать отработанную серу в пластик, который, в свою очередь, можно использовать в тепловизионных устройствах и литий-серных батареях.
«Это была огромная проблема, и мы были первыми сумасшедшими, которые серьезно отнеслись к ней», — сказал Пьюн Live Science.
С серой трудно работать, потому что она плохо растворяется в других химических веществах. Это было первое разочарование, с которым пришлось столкнуться Пьюну и его команде исследователей из Кореи, Германии и США.
«Он не хотел растворяться», — сказал Пюн. «Он просто повсюду, по всей моей лаборатории».
В конце концов исследователи решили просто расплавить вещество. Оказывается, сера автоматически превращается в полимер — длинную цепочку связанных молекул, которая является основой пластмасс, когда нагревается выше 320 F (160 C).По словам Пьюна, такая реакция известна уже более века. Но полимер распадается почти так же легко, как и образуется, что делает его бесполезным для практического применения.
Но эта полимерная фаза дала исследователям возможность «добавить что-то, потенциально, с чем она будет реагировать», чтобы стабилизировать пластик, сказал Пьюн. К счастью для команды, одно из первых опробованных ими химикатов оказалось победителем: 1,3-диизопропилбензол, более известный как «ДИБ».
«ДИБ так хорошо работает, потому что у него есть реактивные группы, которые могут реагировать с серой во время полимеризации», — сказал Пьюн.«Он был полностью растворим в жидкой сере».
В результате, как сообщили исследователи в апрельском журнале Nature Chemistry, получился красный пластик, который даже не пахнет тухлыми яйцами — полимеризующаяся сера не летучая, сказал Пьюн, и поэтому не пахнет летучими веществами. соединения серы, которые можно найти в горячих источниках.
Более того, процесс настолько прост, что Пьюн и его коллеги называют его «химией пещерного человека». По словам Пьюна, простота и низкая стоимость делают его привлекательным вариантом для промышленности.К команде обратились несколько компаний, заинтересованных в коммерческом использовании процесса полимеризации серы.
Что может быть хорошей новостью для окружающей среды. По словам Пьюна, обычные нефтяные и газовые месторождения содержат от 1 до 5 процентов серы. Однако все больше и больше при разведке нефти и газа используются нетрадиционные резервуары, заполненные более отвратительными веществами: нефть из битуминозных песков в Альберте, Канада, на 20 процентов состоит из серы. Некоторые новые месторождения на Ближнем Востоке производят нефть с содержанием серы до 40 процентов, добавил Пюн.
«Мы только собираемся производить больше серы», — сказал он, добавив, что они называют серу «транспортным мусором», потому что это побочный продукт переработки нефти. Если повезет, процесс его команды может превратить этот мусор во что-нибудь полезное.
Пестицид на основе серы
Элементарная сера — широко используемый пестицид на многих американских и европейских фермах. Он одобрен для использования как на обычных, так и на органических культурах, чтобы помочь контролировать грибок и других вредителей. В одной только Калифорнии более 21 миллиона килограммов (46.По данным Berkeley News, в 2013 году в сельском хозяйстве было использовано 2 миллиона фунтов элементарной серы.
Хотя Агентство по охране окружающей среды (EPA) назвало элементарную серу в целом безопасной, исследования показали, что этот тип пестицидов вызывает раздражение дыхательных путей у сельскохозяйственных рабочих.
Новое исследование, проведенное учеными из Калифорнийского университета в Беркли, сделало шаг вперед и изучило респираторное здоровье жителей, живущих рядом с обработанными полями, в частности, сотен детей, живущих в сельскохозяйственном сообществе долины Салинас, Калифорния .Их результаты были опубликованы в августе 2017 года в журнале Environmental Health Perspectives.
Исследователи обнаружили, что у детей, живущих в пределах полумили от недавних применений элементарной серы, снижена функция легких, повышен уровень симптомов, связанных с астмой, и больше употребления лекарств от астмы по сравнению с детьми, не подвергавшимися воздействию.
В частности, они обнаружили, что 10-кратное увеличение внесенной серы в пределах 1 километра (0,62 мили) от места жительства ребенка в течение года до респираторной оценки было связано с 3.По данным Berkeley News, в 5 раз повышен риск использования лекарств от астмы и вдвое выше риск респираторных симптомов, таких как хрипы и одышка.
Авторы исследования настоятельно призывают к дальнейшим исследованиям для подтверждения этих результатов в надежде, что это приведет к изменениям в правилах и методах применения, чтобы ограничить респираторный вред близлежащим жителям. По словам исследователей, одна из идей — перейти на «смачиваемые» порошки.
Дополнительный отчет от Трейси Педерсен, сотрудника Live Science.Подпишитесь на Live Science @livescience, Facebook и Google+.
Дополнительные ресурсы
Древние и алхимики | Chem13 News Magazine
[Эта серия является дополнением к нашему проекту Международного года Периодической таблицы Менделеева — Хронология элементов и мозаика Менделеева . Будут представлены периоды времени из нашего проекта временной шкалы, подчеркивающие исторические и научные достижения, приведшие к открытиям элементов того периода. Джеймс Маршалл исследует историю открытия элементов.Его исследования привели его в более чем 20 стран, где он сфотографировал и задокументировал определенные места, которые он описывает в своих публикациях по истории химии. Изучите иллюстрации к Хронике элементов для древних и алхимиков с индивидуальными историями открытия каждого элемента с признательностью художнику (-ам), учителю, школе и странам на нашем веб-сайте Хронология элементов. ]
Знакомство с древними и алхимиками
Древние
На протяжении более пяти тысячелетий таинственная трансмутация веществ в новые — загадочная метаморфоза песка и глины в стекло и керамику, превращение личинок в мух, основная загадка самой жизни — подсказывала человеческому разуму, что глубоко укоренившиеся принципы были ответственны.Начиная с записанной истории, древние египтяне были глубоко озабочены жизнью и смертью и искали ответы с помощью лекарств, фармацевтических препаратов и заклинаний.
Древние греки были первыми, кто задался вопросом о том, что это за принципы. Вода была очевидной основной сущностью, и Аристотель расширил греческую философию, включив в нее неясную смесь четырех элементов — огня, земли, воды и воздуха — как ответственных за состав всех материалов Земли.Человечеству потребовались бы тысячи лет, чтобы развить свое мышление от Принципов — которые были эфирными понятиями, описывающими восприятие этого материального мира — до Элементов — реальных, конкретных базовых вещей этой вселенной.
Алхимики, посвятившие неисчислимые изнурительные часы превращению металлов в золото, полагали, что в дополнение к четырем аристотелевским элементам два принципа дали начало всем природным веществам: ртути и сере. Родоначальником этой теории был арабский алхимик Гебер.Тысячу лет назад он объяснил, что ртуть может способствовать «текучести», а сера — «горючести»; позже алхимики добавили соль, которая придала бы «устойчивость».
Роберт Бойль, наиболее известный своим «Законом Бойля», в 1600-х годах обсуждал в «Скептическом химике» стандарты, по которым вещество может рассматриваться как элемент. Он понял, что четыре элемента Аристотеля и три принципа алхимиков не могут быть правильными, потому что никогда не было доказано, что они составляют и не могут быть извлечены из каких-либо других веществ.Другими словами, если что-то было элементом, то должно быть экспериментально доказано, что оно может быть отделено как основной материал, который не может быть сведен к более фундаментальным вещам.
Истина была гораздо более тонкой — и на удивление простой. Истинные элементы были ингредиентами мирских материалов и обычно скрывались в сложных комбинациях. Лишь изредка элемент проявлялся в природе в простой форме, например, в золоте. Это было похоже на попытку определить муку, сахар, соль, сало, яйца и специи, которые использовались при выпечке торта, по запахам, исходящим от последней смеси!
Гигантский шаг в этой эволюции мысли — от философского принципа к материалистическому элементу — был сделан Лавуазье, который в своем «Трактате 1789 года» осознал, что, поскольку вода была произведена комбинацией «горючего газа» (водорода) и «жизненно важного воздуха» (кислород), тогда вода должна быть составной.Из этой замечательной интуиции следовало все остальное. Лавуазье перечислил 31 материал, который он предложил — правильно — были истинными элементами, включая серу, железо, углерод, медь, молибден и т. Д. Признавая, что «легковоспламеняющийся воздух» и «жизненно важный воздух» являются элементами, он назвал их названиями, которыми мы знаем их сегодня. Лавуазье выглянул из столовой на кухню.
Роберт Бойль (1627-1691), разработчик «Закона Бойля», который связывает давление газа с его объемом.Он был первым ученым, определившим «элемент» как простейший химический ингредиент, который не мог быть преобразован в более простое вещество.
Проницательность Лавуазье открыла дверцы шкафа, из которых вывалилось несметное количество чудесных масел, сахаров и специй. Волнение в научном сообществе росло по мере того, как одна за другой в этой кладовой были обнаружены все новые приправы. К середине девятнадцатого века было признано, что шкаф даже организован в виде аккуратных полок и корзин, и вскоре Дмитрий Менделеев и Лотар Мейер — первооткрыватели Периодической таблицы — даже предсказывали новые ароматизаторы, о которых еще не пробовали и о которых даже не мечтали!
Для восьми выпусков в течение Международного года Периодической таблицы Менделеева мы расскажем о том, как исследовали эту кухню…
История Стихий начинается с каменного века, когда было обнаружено, как изготавливать инструменты из дерева, костей и камней.Люди обнаружили, что древесина хороша для изготовления гибких орудий, таких как древки и копья. Кость отлично подходит для тонких инструментов, таких как иглы. Камни можно использовать для изготовления кухонной утвари (например, чаш, обычно из грубых вулканических камней), а также для инструментов и оружия (например, скребков и наконечников копий, обычно кремня). Эти материалы были эффективны, но все страдали из-за их склонности к растрескиванию или разрушению — все они были хрупкими. В конце концов человечество наткнулось на металлы, которые обладали уникальными свойствами — они были одновременно пластичными и прочными — их можно было использовать для изготовления инструментов и оружия, их можно было приготовить под воздействием тепла и они не были хрупкими.
Древним было известно семь металлов: золото, медь, олово, свинец, ртуть, серебро и железо. Золото из-за его красоты и устойчивости к коррозии было принято для изготовления ювелирных изделий и украшений. Первым практичным металлом была медь, из которой можно было изготавливать инструменты и украшения. Было обнаружено, что при смешивании меди с оловом может образоваться более твердый и прочный металл — бронза. Свинец был более мягким и тяжелым металлом; его можно было использовать как утяжелители, водопроводные трубы, таблички для письма и монеты.Ртуть легко получить из руды простым нагреванием, так как на киновари появляется «пот»; он использовался в лекарствах. Серебро обычно было в комбинированном виде, и изначально его было труднее добыть, чем золото. Открытие железа было отложено из-за его коррозии и сложности плавки.
Древние греки, с их склонностью к гармонии, включили эти металлы в общий мир, состоящий всего из четырех элементов — воды, огня, земли и воздуха. Аристотель рассуждал, что эти четыре элемента могут смешиваться в различных пропорциях, чтобы дать начало любому свойству: вода с его влажностью и прохладой, земля с его сухостью и прохладой, огонь с его сухостью и жаркостью, воздух с его влажностью и жаркостью. , мог производить все камни, древесину, организмы и т. д., что мы наблюдаем в мире.
Аристотель (384-322 гг. До н.э.) был греческим философом, который объяснил четыре чувственных элемента (огонь, землю, воду и воздух) и связал их с физическими качествами тепла, холода, влажности и сухости.
Мнение о том, что Земля состоит из этих четырех элементов, сохранялось до 18 века. Действительно, в ведущей энциклопедии того времени — в разделе «Элемент» в A Dictionary of Chemistry П. Дж. Макера, опубликованном в 1777 году, сделана следующая запись:
Эти тела называются химиками элементами, которые настолько просты, что они не могут быть разложены или даже изменены никаким известным методом; и которые также входят в качестве принципов или составных частей в комбинацию других тел, которые поэтому называются составными телами.
Современная химия не могла развиваться, пока эти древние философии и суеверия принципов, сущностей и духов не были заменены более практическими схемами. Но от этих старых мыслей нельзя было отказаться, пока они не были тщательно опробованы в реальных ситуациях (т. Е. Экспериментально). Это исчерпывающее исследование было проведено алхимиками.
Алхимики (500-1700 гг. Н.э.)
В Средние века яркий свет химии поддерживали арабы.Классические греческие тексты по математике, астрономии и медицине были переведены на арабский язык примерно к 850 году нашей эры. Накапливалось огромное количество экспериментальных данных не только по металлам, но и по кислотам и основаниям, солям, органическим веществам и другим химическим веществам. Первым из арабских химиков был Гебер, который поднял экспериментальную науку на новый уровень с помощью обширной документации и новых учебников. Это арабское богатство информации медленно мигрировало в Европу. Известен своим арабским названием — «аль кимия», т.э., «химия» — практиков этого искусства стали называть «алхимиками».
Средневековые алхимики накапливали огромное количество информации о тайнах «трансмутационных» изменений и делали попытки интерпретировать свои наблюдения и свои надежды. Они заметили, что вещества непрерывно переходят из одной формы в другую. Они считали, что глубоко в земле металлы медленно эволюционировали в более высокую форму. Свинец постепенно превращался в железо, затем в медь, затем в серебро и, наконец, в золото.
Поскольку все вещества содержат принципы, если бы можно было только понять и направить эти принципы, то из них можно было бы производить более ценные материалы. Если бы только можно было найти катализатор для быстрого осуществления этого преобразования, это было бы поистине великолепно! Такой катализатор, называемый «философским камнем», позволит производить золото в больших количествах. Так родился «алхимик», который потратил тысячи часов тяжелого труда, пытаясь раскрыть эти секреты философского камня.
Алхимики считали, что все металлы образовались из двух начал — ртути и серы. Ртуть с ее существенным свойством текучести и плавкости породила пластичность металлов. Сера, обладающая важным свойством горючести, способствовала образованию твердости и кальцинированию (ржавлению). Если бы только алхимик мог соединить ртуть и серу в правильных пропорциях с философским камнем в качестве катализатора, он мог бы производить все металлы, включая золото! — в огромных количествах.
Когда алхимики бесчисленные часы трудились над печью, они наткнулись на несколько новых веществ, которые сегодня мы признаем элементами, но в то время характеризовались как странные смеси принципов огня, земли, воды и воздуха, а также ртути, сера и соль. Фосфор был выделен из мочи и назван так потому, что он буквально светился в темноте. Сурьма была признана новым веществом; на самом деле он упоминается в Библии как «стибический камень», используемый в качестве черной туши.Цинк использовался в медицинских препаратах, он известен прежде всего как каламин, а также входит в состав латуни. Висмут был открыт как тяжелый, ковкий металл, его использовали для изготовления металлических изделий из дерева. Мышьяк был известен в форме его соединений с древних времен; его использовали в косметике и лекарствах (хотя это яд!).
Алхимики ответственны за зарождение современной химии. Они развивались как субкультура в средневековом христианстве и невольно проложили путь этой науке, сделав три отдельных вклада:
- собственно эксперименты, включающие древние химические процессы дистилляции, осаждения, декрепитации, кальцинирования и т. Д.;
- основа греческой логики и гармонии, обеспечивающая веру в то, что логика и рассуждение могут прийти к окончательному ответу; и
- — вера в Бога, Который создал Совершенный мир с общим набором (научных) законов. Химия, как и все науки, зависела от этих трех факторов в своем развитии.
Когда мусульманская культура вторглась в Испанию, идеи Гебера (экспериментирование) и Аристотеля (логика) вторглись в умы средневековых европейцев. Карл Великий приказал соборам и монастырям основывать школы, предшественники современного университета, поскольку культура церкви была ответственна за университет, который стремился установить истины Совершенного Мира.
Из этой культуры произошел самый известный из средневековых ученых Роджер Бэкон, который ввел индуктивный метод в науку. Бэкон утверждал, что наука должна использовать эксперимент как свой метод. Другими словами, описание естественного права должно основываться на многих примерах — общее может вытекать из частного. Этот прорыв положил начало экспериментальному методу, основанию современной науки. В следующем выпуске мы рассмотрим, как наука и химия продвинулись в развитии технологий добычи полезных ископаемых.
Список литературы
Фотографии взяты из J. L. Marshall, Discovery of the Elements , Peterson Custom Publishing, 2002.
Алхимики в лаборатории в поисках золота. Они считали, что, изменив свойства металла, они могут изменить сам металл — следовательно, неблагородные металлы могут быть преобразованы в драгоценные металлы, надеюсь, с помощью «философского камня».
Лавуазье
Лавуазье
Антуан Лавуазье (1743-1794)
из
Элементы химии
Эдинбургское издание 1790 г., стр.175-8 [из изд. Дэвида М. Найта, Classical Scientific Papers — Chemistry, Second Series , 1970]
ТАБЛИЦА ПРОСТЫХ ВЕЩЕСТВ.
Простые вещества, принадлежащие всем царствам природы, которые можно рассматривать как элементы тел.
Окисляемые и поддающиеся подкислению простые вещества, неметаллические.
| Новые имена. | Корреспондент старых имен. |
|---|---|
| Сера | То же. |
| фосфор | |
| Древесный уголь | |
| Мюриатический радикал | Пока неизвестно. |
| Фтористый радикал | |
| Боракальный радикал |
Окисляемые и окисляемые простые металлические тела.
| Новые имена. | Корреспондент старых имен. | |
|---|---|---|
| Сурьма | Регулус из | Сурьма. |
| Мышьяк | «» | Мышьяк |
| Висмут | «» | Висмут |
| Кобальт | «» | Кобальт |
| Медь | «» | Медь |
| Золото | «» | Золото |
| Утюг | «» | Утюг |
| Свинец | «» | Свинец |
| Марганец | «» | Марганец |
| Меркурий | «» | Меркурий |
| Молибдена | «» | Молибдена |
| Никель | «» | Никель |
| Platina | «» | Platina |
| Серебро | «» | Серебро |
| Олово | «» | Олово |
| Tungstein | «» | Tungstein |
| Цинк | «» | Цинк |
Салифицируемые простые земные вещества
РАЗД.I. —
Наблюдения за таблицей простых веществ.
Основной целью химических экспериментов является разложение естественных тел,
чтобы по отдельности исследовать различные вещества, входящие в их состав.
состав. Посмотрев на химические системы, будет установлено, что это
наука химического анализа быстро продвинулась вперед в наше время.
Раньше нефть и соль считались элементами тел, а позже
наблюдения и эксперимент показали, что все соли, вместо того, чтобы быть простыми,
состоят из кислоты, соединенной с основанием.Пределы анализа были
значительно расширен современными открытиями *; кислоты
показано, что он состоит из кислорода, как общего для всех подкисляющего принципа,
объединены в каждом к определенной базе. Я доказал, что имел г-н Хассенфратц
до того, как утверждалось, что эти радикалы кислот не все простые элементы,
многие из них, подобно масляному принципу, состоят из водорода и
уголь. Даже основания нейтральных солей были доказаны г-ном Бертолле.
быть соединениями, поскольку он показал, что аммиак состоит из азота и
водород.
Таким образом, по мере того, как химия продвигается к совершенству, разделяя и разделяя, невозможно сказать, где она должна закончиться; и эти вещи, которые мы в настоящее время полагаем простыми, вскоре могут оказаться совершенно другими. Все, что мы осмеливаемся утверждать о каком-либо веществе, — это то, что оно должно рассматриваться как простое при нынешнем уровне наших знаний и насколько химический анализ до сих пор мог показать. Мы можем даже предположить, что земли вскоре перестанут считаться простыми телами; они — единственные тела класса выделяемых, которые не имеют тенденции соединяться с кислородом; и я очень склонен полагать, что это происходит из-за того, что они уже пропитаны этим элементом.Если это так, они будут рассматриваться как соединения, состоящие из простых веществ, возможно, металлических, до определенной степени окисленных. Это только предположение; и я надеюсь, что читатель позаботится не смешивать то, что я назвал истинами, закрепленными на твердой основе наблюдений и экспериментов, с простыми гипотетическими предположениями.
Фиксированные щелочи, поташ и сода не включены в вышеприведенную таблицу, потому что они, очевидно, являются составными веществами, хотя мы еще не знаем, из каких элементов они состоят.
* См. Воспоминания Академии за 176, с. 671, а за 1778 г., с. 535. — А.
Вернуться к списку избранных исторических документов.
Вернуться к началу классической химии.
Сделать смесь и соединение из железа и серы
Смесь возникает, когда вы объединяете вещества, чтобы компоненты можно было снова разделить. Соединение возникает в результате химической реакции между компонентами, образуя новое вещество. Например, вы можете соединить железные опилки с серой, чтобы образовать смесь.Все, что нужно, — это магнит, чтобы отделить железо от серы. С другой стороны, если вы нагреете железо и серу, вы получите сульфид железа, который представляет собой соединение; железо и сера больше не могут быть отделены друг от друга.
Что вам нужно
- Железные опилки
- Сера (порошок или цветки серы)
- Магнит
- Пробирка или стакан
- Горелка или плита или плита
Создание смеси, а затем соединения
- Сначала сформируйте смесь.Смешайте железные опилки и серу, чтобы получился порошок. Вы только что взяли два элемента и соединили их, чтобы получилась смесь. Разделить компоненты смеси можно, перемешивая порошок магнитом; железные опилки будут прилипать к магниту, а сера — нет. Другой (менее беспорядочный) вариант — перемешать порошок с помощью магнита под контейнером; утюг упадет на магнит внизу.
- Если вы нагреете смесь на конфорке Бунзена, горячей плите или плите, она начнет светиться.Элементы будут реагировать и образовывать сульфид железа, который представляет собой соединение. В отличие от смеси, образование соединения не так просто отменить. Используйте стеклянную посуду, которую не прочь испортить.
При формировании смеси вы можете добавлять компоненты в любом соотношении, которое захотите. Неважно, например, если железа больше, чем серы.
Когда вы формируете соединение, компоненты реагируют по заданной формуле. Если есть избыток одного или другого, он останется после реакции, в результате которой образуется соединение.

 В своей самородной форме сера представляет собой желтое кристаллическое твердое вещество. В природе он встречается как чистый элемент или как сульфидные и сульфатные минералы. Хотя сера печально известна своим запахом, который часто сравнивают с запахом тухлых яиц, этот запах на самом деле характерен для сероводорода (H 2 S).
В своей самородной форме сера представляет собой желтое кристаллическое твердое вещество. В природе он встречается как чистый элемент или как сульфидные и сульфатные минералы. Хотя сера печально известна своим запахом, который часто сравнивают с запахом тухлых яиц, этот запах на самом деле характерен для сероводорода (H 2 S).  Условия в ранних морях были такими, что простые химические реакции могли генерировать ряд аминокислот, которые являются строительными блоками жизни.
Условия в ранних морях были такими, что простые химические реакции могли генерировать ряд аминокислот, которые являются строительными блоками жизни. В среднем человек потребляет около 900 мг серы в день, в основном в виде белка.
В среднем человек потребляет около 900 мг серы в день, в основном в виде белка. Он может вызывать раздражение глаз и горла у животных, когда поглощение происходит путем вдыхания серы в газовой фазе. Сера широко применяется в промышленности и выбрасывается в воздух из-за ограниченных возможностей разрушения применяемых серных связей.
Он может вызывать раздражение глаз и горла у животных, когда поглощение происходит путем вдыхания серы в газовой фазе. Сера широко применяется в промышленности и выбрасывается в воздух из-за ограниченных возможностей разрушения применяемых серных связей.
 Атомы различных элементов.
Атомы различных элементов. е., часто существуют в виде жидкости или газа при
е., часто существуют в виде жидкости или газа при