Содержание
Урок химии «Основные классы неорганических веществ»
Цель урока. Обобщить сведения о
классификации веществ, составе основных классов
сложных неорганических веществ, закрепить
умения учащихся классифицировать
неорганические вещества, осуществлять
индуктивное и дедуктивное обобщения во процессе
классификации веществ, довести эти умения до
оптимального уровня.
Образовательные задачи:
- применение обобщения знаний, умений и навыков в
новых условиях – создание проблемной ситуации; - контроль и самоконтроль знаний, умений и
навыков с помощью домашней работы; - уметь устанавливать существенные признаки,
являющиеся основой различных классификаций; - уметь устанавливать причинно-следственные
связи между «составом», «химическими
свойствами», «класс вещества».
Развивающие задачи:
- развитие умений сравнивать, обобщать, правильно
формулировать задачи и излагать мысли; - развитие логического мышления, внимания и
умения работать в проблемной ситуации.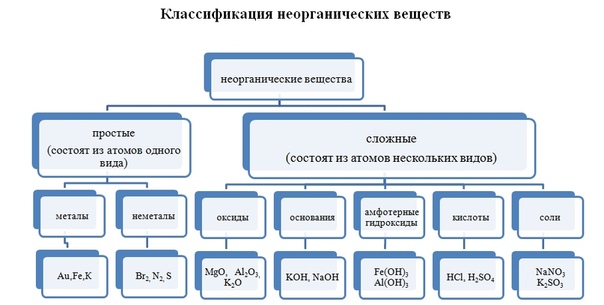
Воспитательные задачи:
- формирование у учащихся познавательного
интереса к химии; - воспитание таких качеств характера, как
настойчивость в достижении цели; - воспитание интереса и любви к предмету через
содержание учебного материала, умение работать в
коллективе, взаимопомощи, культуры общения.
Оборудование: презентация, цифровые
образовательные ресурсы: интерактив «Классификация
кислот», интерактив «Классификация
оснований», минилаборатория, оксиды фосфора,
кальция, цинка, гидроксид натрия, меди, цинка,
железа, азотная, серная, фосфорная, кремниевая
кислоты, соли
Тип урока: урок обобщения и
систематизации знаний
План урока
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Систематизация и обобщение знаний.
4. Закрепление.
5. Домашнее задание.
6. Рефлексия
ХОД УРОКА
I. Организационный момент
Проверяется готовность к уроку, раздаются план
урока (Приложение 1),
инструкции для выполнения лабораторной работы,
лист наблюдений (Приложение
2), минилаборатория, объявляются этапы
урока.
Организовывается работа учащихся на начальном
этапе урока, вспоминаются советы учителя о том,
как лучше организовать работу на уроке, чтобы
сохранить свое здоровье и здоровье своих
одноклассников.
1. Как удобней и полезней для здоровья сидеть на
уроке?
2. Почему на уроке учитель просит тишины?
Вступительное слово учителя. (Презентация. Слайды 1-3).
Постановка цели с опорой на знания учащихся. Мы с
вами в течение учебного года узнали, какие бывают
классы неорганических соединений.
Скажите, пожалуйста, какие классы веществ мы
изучили на прошлых уроках? (Мы изучили
классификацию неорганических веществ. И знаем,
что бывают оксиды, кислоты, основания, соли).
И прежде чем перейти к самому уроку. Давайте
вместе подумаем, что мы будем сегодня делать на
уроке.
Как вы думаете, какова цель нашего урока?
(Цель урока – обобщить и систематизировать
сведения о классификации неорганических
веществ)
Для этого нам нужно вспомнить материал, который
мы уже прошли в темах «Оксиды», «Кислоты»,
«Основания», «Соли». Сейчас мы выполним тест по
этим темам.
II. Промежуточный контроль знаний по
темам «Оксиды», «Кислоты», «Основания», «Соли» по
технологии «Взаимопередачи заданий»
Учащиеся выполняют тест, в группах по 2 или 4
человека – 5 минут (Приложение 2).
После того, как учащиеся выполнят тест,
необходимо поставить оценку себе и проверить
работу соседа и поставить оценку соседу по парте.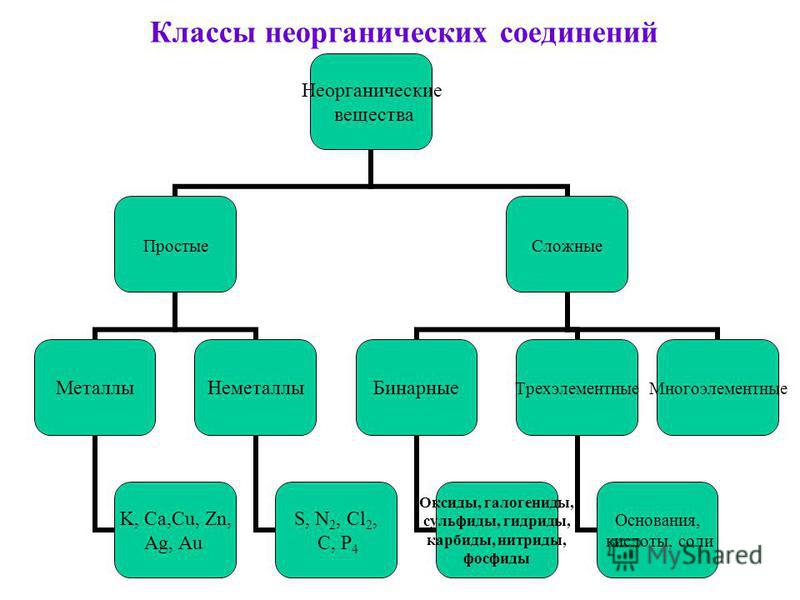
Учитель просит класс поднять руки, кто написал
тест на 5 или 4 балла. На закрытой доске или на
экране медиапроектора открывают заранее
подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты (Слайд 4)
Тест по теме «Классификация
неорганических веществ»
Время выполнения – 5 минут.
Расставьте коэффициенты в схемах реакций,
укажите тип химической реакции по
признаку «число и состав исходных веществ и
продуктов реакции», определите простое или
сложное вещество, если вещество сложное
определите класс вещества
III. Изучение нового учебного материала
Учебная цель: закрепить знания,
умения, навыки по классификации неорганических
веществ.
Вывод цели данного этапа урока с помощью
учеников
В результате этого урока мы с вами должны
непосредственно рассмотреть разделение оксидов,
кислот, оснований, солей на группы, признаки,
положенные в основу классификаций.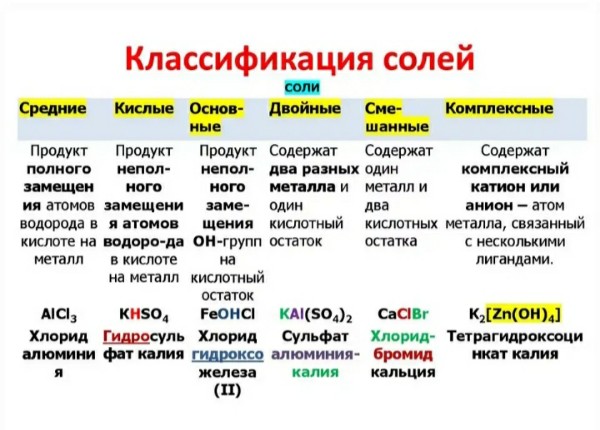 В ходе урока
В ходе урока
мы должны обобщить, систематизировать признаки
классификаций, закрепить эти умения и навыки.
Рассмотреть схему «Классификация веществ».
Моя цель на уроке рассказать вам об этом, помочь
вам запомнить эти классификации, и мы продолжим
учиться определять не только классы веществ, но и
разделение на группы внутри класса.
Сегодня эти части урока будут проходить в форме
игры. У вас будет 4 учителя. Они будут обобщать, и
систематизировать каждый по определенному
классу веществ. Они имеют право вас спрашивать, в
конце урока поставить вам оценки. После
объяснения ваших новых учителей. Мы проверим, как
вы вспомнили классификацию веществ и выясним,
кто у нас самый «классный» химик, и определим, кто
у нас самый «классный» учитель.
Основные положения учебного материала, который
вы сегодня должны освоить.
1. Классификация оксидов. Объяснение
материала заранее подготовленным учеником.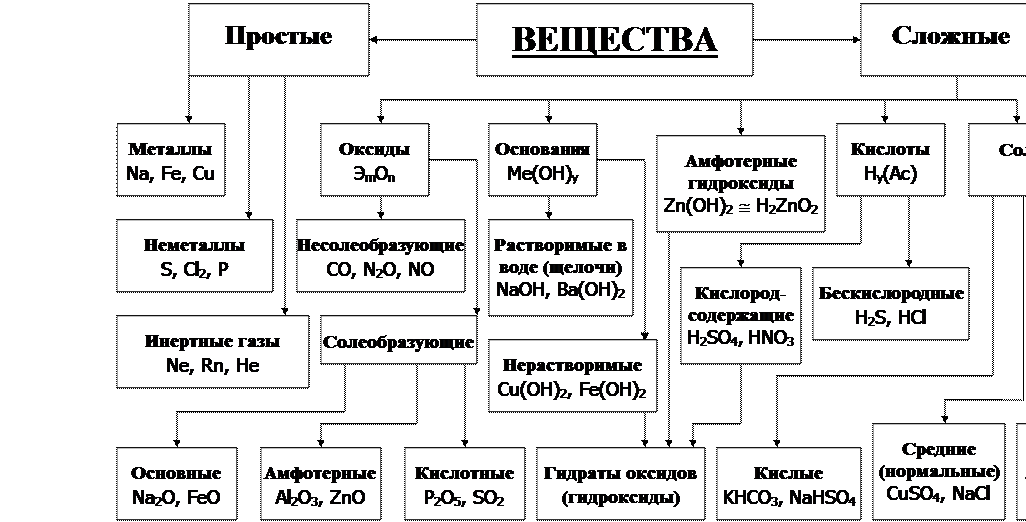
Актуализация знаний: Фронтальный
опрос. Что такое оксиды? (Оксиды – это сложные
вещества, состоящие из двух элементов, один из
которых кислород со степенью окисления – 2)
Слайды 5-7
Оксиды делят на несолеобразующие –
они не реагируют ни с кислотами, ни с щелочами, не
образуют солей. Это всего четыре оксида: CO, SiO, N2O,
NO
Остальные оксиды являются солеобразующими.
Среди них выделяют две группы. Кислотные
оксиды, этим оксидам соответствуют кислоты,
и, как правило – это оксиды неметаллов, или
металлов побочных подгрупп в высшей степени
окисления. Вторая группа основные оксиды –
это оксиды металлов в степени окисления +1, +2, +3
Заполнение таблицы с опорой на знания учеников
| Оксиды | Второй элемент металл или неметалл | Группа оксида | С чем реагирует: с кислотой, основанием
или ни с чем |
SO3 | неметалл | кислотный | с основанием |
SO2 | |||
SiO2 | |||
P2O5 | |||
CrO3 | |||
CO | неметалл | несолеобразующий | – |
N2O | |||
Na2O | металл | основный | с кислотой |
FeO | |||
Fe2O3 | |||
CaO |
Закрепление:
1. Почему несолеобразующие оксиды так
Почему несолеобразующие оксиды так
называются?
2. Классификация кислот
Актуализация знаний: Фронтальный
опрос. Какие кислоты вы знаете?
Слайд 8
Учитель демонстрирует образцы кислот, ученик у
доски с помощью таблиц на слайдах объясняет, что
такое кислоты и на какие группы они делятся,
класс работает вместе с доской или
самостоятельно. В учебнике страница 210, таблица 10.
Кислоты – это сложные вещества, состоящие из
положительно заряженных ионов водорода и
отрицательно заряженных кислотных остатков
| Признак классификации | Типы кислот | Формулы кислот |
| Наличие кислорода | Кислородсодержащие | H2SO4 HNO3 H2CO3 |
| Бескислородные | HCl H2S | |
| Основность | Одноосновные | HCl HNO3 |
| Двухосновные | H2SO4 H2CO3 H2S | |
| Трехосновные | H3PO4 | |
| Растворимость | Нерастворимые | H2SiO3 |
| Растворимые | все остальные |
Закрепление:
1. Что такое трехосновная кислота?
Что такое трехосновная кислота?
3. Классификация оснований
Актуализация знаний: Фронтальный
опрос. Что такое щелочи?
Слайд 10
Учитель демонстрирует образцы оснований,
ученик у доски с помощью таблиц на слайдах
объясняет, что такое основания и на какие группы
они делятся, класс работает вместе с доской или
самостоятельно. В учебнике страница 215, таблица 11.
Основания – это сложные вещества, состоящие из
положительно заряженных ионов металла и
отрицательно заряженных гидроксид-ионов
| Признак классификации | Типы оснований | Формулы оснований |
| Кислотность | Однокислотные | NaOH KOH |
| Двухкислотные | Ca(OH)2 Fe(OH)2 | |
| Трехкислотные | Al(OH)3 Fe(OH)3 | |
| Растворимость | Растворимые щелочи | NaOH KOH Ca(OH)2 |
| Нерастворимые | Al(OH)3 Fe(OH)2 Fe(OH)3 |
Закрепление:
1. Что такое щелочи?
Что такое щелочи?
4. Классификация солей
Актуализация знаний: Фронтальный
опрос. Приведите примеры солей?
Слайды 11, 12
Учитель демонстрирует образцы солей, ученик у
доски с помощью таблиц на слайдах объясняет, что
такое соли и на какие группы они делятся, класс
работает вместе с доской или самостоятельно.
Соли – это сложные вещества, состоящие из
положительно заряженных ионов металла и
отрицательно заряженных кислотных остатков
| Признак классификации | Типы солей | Формулы солей, названия |
| Состав, наличие ионов водорода или
гидроксид-ионов | Средние | Na2SO4 сульфат натрия |
| Кислые | NaHSO4 гидросульфат натрия | |
| Основные | MgOHNO3 гидроксонитрат магния. | |
| Растворимость | Растворимые | заполнить самостоятельно по |
| Нерастворимые | таблице растворимости |
Закрепление, фронтальный опрос:
1. Что такое кислые соли?
2. Как меняется название кислых солей по
сравнению со средними?
IV. Закрепление учебного материала
Выполнение Лабораторной работы «
Классификация неорганических веществ» (Приложение 2), работа в
группах
Организация работы класса.
Класс делится на малые группы по 4 человека,
например, по скорости работы или по желанию
учащихся.
Определение самого «классного» химика, самого
«классного» учителя.
Фронтальный опрос: если будет время.
Какой класс веществ для вас показался самым
сложным и почему?
Во всех группах учащимся раздаются инструкции
лабораторной работы.
Использование ЦОР ( дополнительный материал,
если будет время)
Слайд 13
Интерактив. Классификация Кислот Упражнение 1
Интерактив. Классификация Оснований Упражнение 2
[1]
V. Домашнее задание
Представлено в рабочих листах.
Цель: закрепить навыки классификации веществ
до оптимального уровня, уметь применять
полученные знания в новой ситуации( проблемный
вопрос)
Формулируется проблемный вопрос, для домашнего
задания, выставляются оценки за урок
Проблемный вопрос. Почему и кислоты и
основания объединяются в группу гидроксиды? Что
у них общего и чем они отличаются?
Параграфы 38-41[3], написать по 2 типичных уравнения
реакций для каждого класса веществ Закончить
таблицу оксиды
Вы можете также сделать свое домашнее задание, по
выбору. Придумать свои упражнения или взять их из
других источников.
VI. Рефлексия
Рефлексия
Фронтальное обсуждение результатов урока с
классом.
Понравился ли вам урок? Оцените, как изменились
за урок ваши знания.
Свои впечатления выразить рисунком.
Веселая рожица – понравился урок, знаний
прибавилось.
серьезная рожица – трудно сказать, но что-то
новое узнал и запомнил
и недовольная рожица – не понравился урок,
ничего не узнал
Список литературы
1. Химия 8, 9 класс. Мультимедийное приложение к
учебнику О.С.Габриеляна. Электронное учебное
издание. ООО «Дрофа» 2011.
2. Планирование
к учебнику «Химия», 8, 9 класс, Габриелян О.С.
Единая коллекция цифровых образовательных
ресурсов
3. Габриелян О.С. Химия 8 класс. Учебник , М.:
Дрофа, 2011.
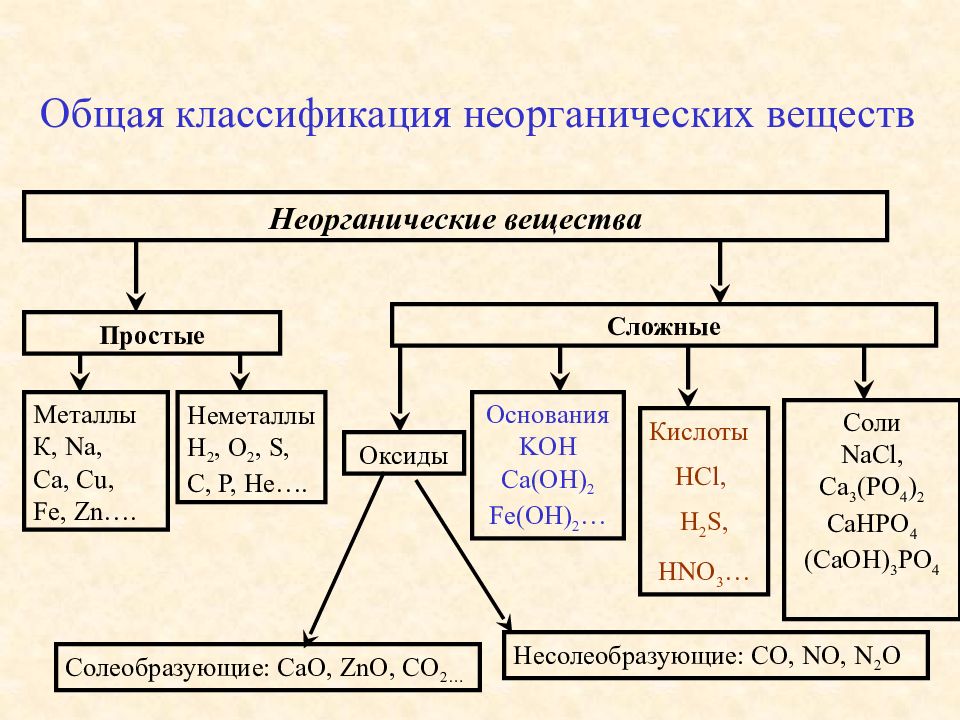
Классификация неорганических веществ
Каждый класс
веществ образован веществами со сходными свойствами.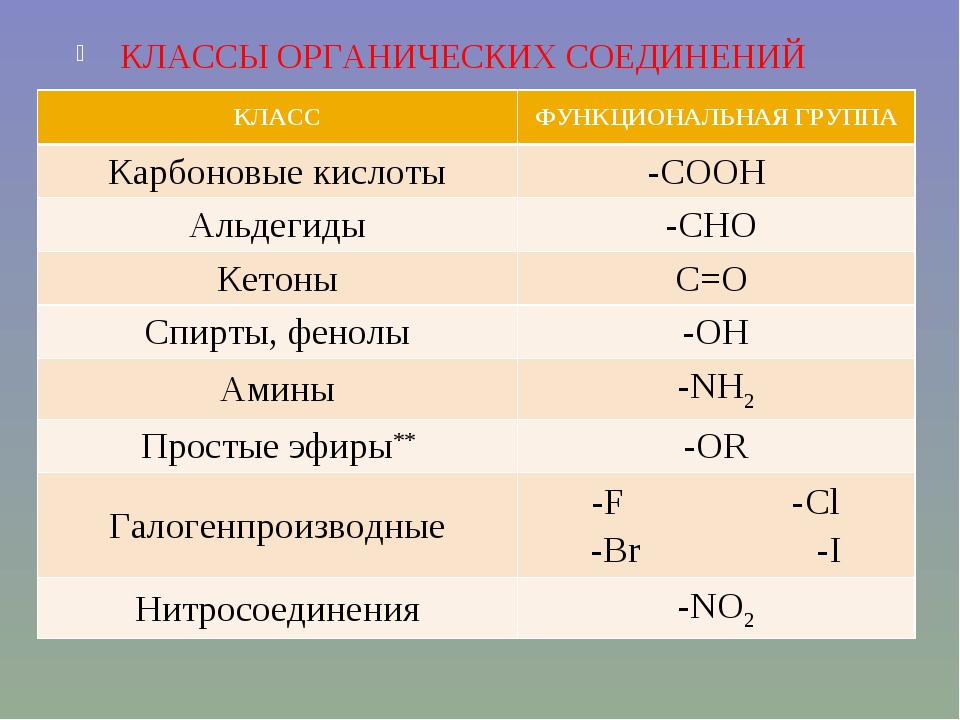 Эти вещества имеют схожее
Эти вещества имеют схожее
строение и состав.
Все неорганические
вещества делят
на простые и сложные. Простые вещества состоят из
атомов одного химического элемента. К простым веществам относятся металлы:
медь, железо, натрий и другие; неметаллы: сера, фосфор, кислород,
хлор; инэртные, или благородные газы: аргон,
криптон, гелий, неон.
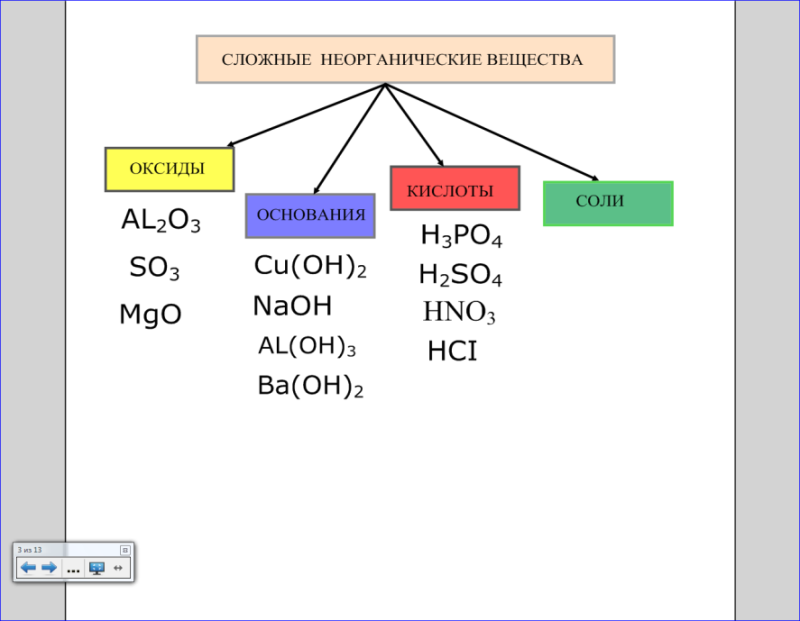
Сложные вещества
состоят из атомов нескольких химических элементов. К сложным
веществам относятся оксиды, основания, амфотэрные
гидроксиды, кислоты и соли.
Оксиды – это
сложные вещества, которые состоят из двух химических элементов, один из которых
кислород. Общая формула оксидов: э-эм-о-эн, где эм и эн – индэксы.
Степень окисления кислорода в оксидах равна минус двум.
Оксиды делят на две группы: солеобразующие
и несолеобразующие (индифферентные).
Солеобразующие
оксиды
образуют гидроксиды и соответствующие соли. Например, к солеобразующим оксидам
относятся оксид серы шесть, оксид кальция, оксид алюминия.
Несолеобразующие
оксиды
не образуют гидроксидов и солей. К таким оксидам относятся: оксид азота один,
оксид азота два, оксид углерода два, оксид кремния два.
Оксиды бывают кислотные,
амфотэрные и основные. Кислотным оксидам соответствуют
кислотные гидроксиды, основным оксидам соответствуют основные
гидроксиды.
Например: оксиду
натрия соответствует основный гидроксид – гидроксид натрия, в реакции этого
гидроксида с соляной кислотой образуется соль – хлорид натрия.
Оксиду алюминия
соответствует амфотэрный гидроксид – гидроксид алюминия, этот гидроксид с
азотной кислотой образует соль – нитрат алюминия.
Оксиду серы шесть
соответствует кислотный гидроксид – серная кислота, эта кислота с гидроксидом
меди два образует соль – сульфат меди два.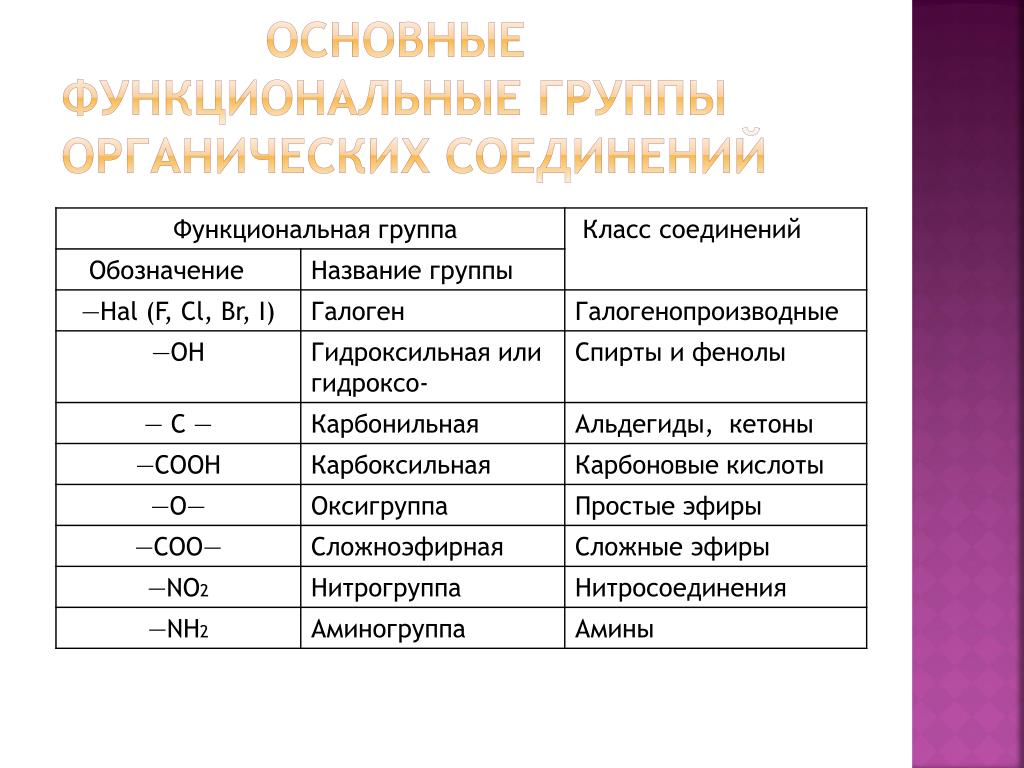
Оксиду марганца
семь соответствует кислотный гидроксид – марганцовая кислота, которая в реакции
с гидроксидом калия образует соль – перманганат калия.
Кислотные оксиды образованы
элементами металлами и неметаллами со степенью окисления
больше, чем плюс четыре.
Кислотным оксидам
соответствуют кислоты:
оксиду углерода четыре соответствует угольная кислота, оксиду серы шесть
соответствует серная кислота, оксиду фосфора пять соответствует фосфорная
кислота.
Для этих оксидов
характерен ковалентный характер связи между элементами. В основном у кислотных
оксидов молекулярная кристаллическая решётка. Они могут быть газообразными,
жидкими и твёрдыми. Например: оксид серы четыре, оксид углерода
четыре – газы, оксид хлора семь, оксид марганца семь – жидкости, оксид фосфора
пять, оксид кремния четыре, оксид хрома шесть – твёрдые.
Основные оксиды – это
оксиды, гидраты которых являются основаниями. Все основные оксиды являются
Все основные оксиды являются
оксидами металлов. Например: оксиду натрия соответствует гидроксид
натрия, оксиду кальция соответствует гидроксид кальция, оксиду железа два соответствует
гидроксид железа два.
Амфотэрные оксиды – это оксиды,
которым соответствуют амфотэрные гидроксиды. Все амфотэрные оксиды являются
оксидами металлов. Например: оксид алюминия, оксид хрома три, оксид железа три,
оксид свинца четыре, оксид олова четыре. Так оксиду цинка соответствует амфотэрный
гидроксид – гидроксид цинка, оксиду алюминия соответствует амфотэрный гидроксид
– гидроксид алюминия.
Оксиды широко
распространены в природе. Так, большая часть Земли покрыта Мировым океаном,
который образован оксидом водорода, в атмосфере содержится оксид углерода
четыре; оксид кремния четыре является основой многих минералов и горных пород,
таких как кварц, аметист, яшма; оксид алюминия – корунд, известные и его
разновидности – рубин и сапфир.
Основания – это сложные
вещества, состоящие из катионов металлов и гидроксогруппы.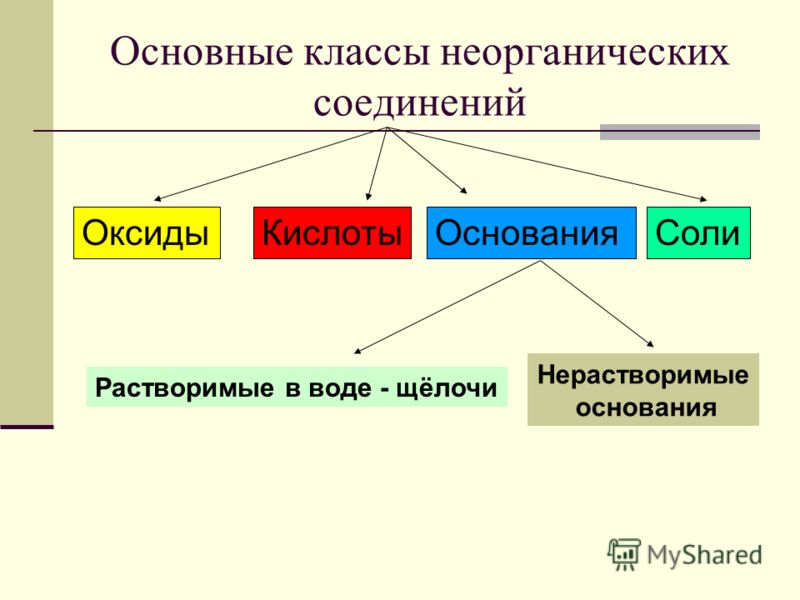 Общая формула оснований
Общая формула оснований
– металл –о-аш.
К основаниям
относятся: гидроксид натрия, гидроксид кальция, гидроксид железа три, гидроксид
калия и другие. Для оснований характерен ионный тип связи, а значит, и ионная
кристаллическая решётка, поэтому основания – это твёрдые вещества.
По числу
гидроксогрупп
различают однокислотные основания (как гидроксид натрия), двухкислотные
(как гидроксид железа два), трёхкислотные (как гидроксид никеля
три).
По растворимости в
воде
различают растворимые в воде основания – щёлочи, которые являются
сильными основаниями. К ним относятся: гидроксид натрия, гидроксид бария и
другие. Нерастворимые в воде основания – это слабые основания. К
ним относятся: гидроксид меди два, гидроксид железа два.
Щёлочи являются твёрдыми
веществами.
В реакции сульфата
меди два с гидроксидом натрия образуется нерастворимое основание – гидроксид
меди два и соль – сульфат натрия.
При добавлении гидроксида
натрия к сульфату железа два образуется также нерастворимое основание –
гидроксид железа два и соль – хлорид натрия.
Есть основания,
где в составе не ионы металла, а катион аммония. Раствор аммиака используют как
нашатырный спирт, основания используют для штукатурки стен.
Кислоты – это
сложные вещества, которые состоят из атомов металла и кислотных остатков.
Кислоты могут быть
образованы не только атомами неметаллов, как соляная кислота, сернистая,
азотная кислоты, но и атомами металлов в высшей степени окисления: как например
марганцовая кислота.
По количеству
атомов водорода
(основности) различают одноосновные кислоты (такие как соляная
кислота, азотная), двухосновные (такие как сероводородная, дихромовая
кислоты), трёхосновные (как фосфорная кислота).
По содержанию
атомов кислорода
различают кислородсодержащие кислоты (или оксокислоты), как азотная
кислота, хромовая кислота, так и бескислородные, как сероводородная,
соляная.
По летучести
кислоты
бывают летучие, которые легко испаряются или выветриваются из
раствора: это такие кислоты, как соляная, бромоводородная, азотная,
сероводородная; к нелетучим кислотам относятся серная, фосфорная
кислота и другие.
Кислоты бывают сильные
и слабые. Сильные кислоты практически полностью диссоциируют на
ионы. К таким кислотам относятся: азотная, серная, соляная, хлорная. Слабые
кислоты диссоциируют незначительно, к таким кислотам относятся: сернистая,
сероводородная, фосфорная кислоты.
К кислотам-окислителям
относятся: азотная кислота, серная, то есть в этих кислотах есть
элемент-окислитель. К кислотам-неокислителям относится
большинство кислот, в которых окислителем является ион водорода.
Для кислот
характерен ковалентный тип связи и молекулярная кристаллическая решётка.
При обычных
условиях
кислоты могут быть в газообразном состоянии: как соляная и
сероводородная, в жидком состоянии, как азотная, серная кислоты.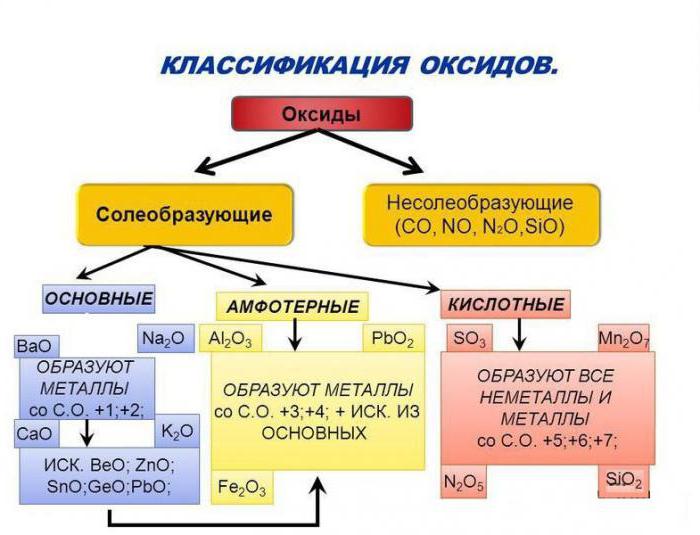
Кислоты могут быть и в твёрдом состоянии, как кремниевая кислота.
Амфотэрные
гидроксиды
– это сложные вещества, имеющие свойства кислот и оснований, поэтому
формулы амфотэрных гидроксидов можно записать в форме оснований и в форме
кислот.
Их образуют
элементы, проявляющие переходные свойства металлов и неметаллов. Эти соединения
образуют большинство дэ-элементов со степенью окисления плюс три, плюс четыре,
иногда плюс два; эти соединения могут образовывать и пэ-элементы: бериллий,
алюминий, олово, свинец.
К амфотэрным
гидроксидам относятся гидроксид цинка, гидроксид алюминия, гидроксид железа
три, гидроксид бериллия.
Амфотэрные
гидроксиды практически нерастворимы в воде. Например, при растворении хлорида
железа три с гидроксидом натрия образуется бурый осадок – гидроксид железа три.
При растворении
сульфата алюминия с гидроксидом натрия образуется белый осадок – гидроксид
алюминия. Полученные гидроксиды являются амфотэрными гидроксидами.
Таким образом, к
гидроксидам относятся основания, амфотэрные гидроксиды и
кислородсодержащие кислоты.
Соли – это
сложные вещества, которые состоят из катионов металла или аммония и кислотных
остатков.
Соли бывают средними,
кислыми, основными.
Средние соли – это продукты
полного замещения атомов водорода в кислоте атомами металлов: например,
хлорид калия, нитрат алюминия, сульфат меди два, сульфит натрия.
Кислые соли – это продукты
неполного замещения атомов водорода в молекулах многоосновных кислот атомами
металла. Например: гидрокарбонат натрия, дигидрофосфат калия, гидрофосфат
калия, гидросульфат натрия.
Основные соли – это продукты
неполного замещения гидроксидных групп в молекулах многокислотных оснований
кислотными остатками. Например: гидроксохлорид меди два, дигидроксонитрат
алюминия, гидроксохлорид железа два.
Для солей
характерен ионный характер связи и ионная кристаллическая решётка, поэтому это
твёрдые вещества.
Соли применяются в
быту: например, перманганат калия используют как дезинфицирующее средство,
широко используют алебастр и побелку, при приготовлении пищи используют поваренную
соль.
Таким образом,
вещества делят на простые и сложные. К простым веществам относятся металлы,
неметаллы, инэртные газы. К сложным веществам относятся оксиды, основания,
амфотэрные гидроксиды, кислоты и соли.
Какие бывают классы опасности вредных веществ? | Справка | Вопрос-Ответ
На выходных москвичи жаловались на неприятный запах в Сокольниках, Лефортове, Нагатинском затоне, а также в районе станции метро «Маяковская» в самом центре города.
Специалисты МЧС считают, что источник запаха является вредным веществом III класса опасности.
Какие бывают классы опасности вредных веществ*?
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности:
- 1-й — вещества чрезвычайно опасные;
- 2-й — вещества высокоопасные;
- 3-й — вещества умеренно опасные;
- 4-й — вещества малоопасные.
I класс опасности
- Предельно допустимая концентрация (ПДК) вредных веществ в воздухе рабочей зоны, мг/куб. м — менее 0,1.
- Средняя смертельная доза при введении в желудок, мг/кг — менее 15.
- Средняя смертельная доза при нанесении на кожу, мг/кг — менее 100.
- Средняя смертельная концентрация в воздухе, мг/куб. м — менее 500.
К таким веществам относятся: акролеин, бензапирен, бериллий, диэтилртуть, линдан озон, пентахлордифенил, ртуть, тетраэтилсвинец, трихлордифенил, этилмеркурхлорид, таллий, полоний, плутоний, протактиний, оксид свинца, растворимые соли свинца, теллур, фтороводород.
II класс опасности
- Предельно допустимая концентрация (ПДК) вредных веществ в воздухе рабочей зоны, мг/куб. м — 0,1–1,0.
- Средняя смертельная доза при введении в желудок, мг/кг — 15–150.
- Средняя смертельная доза при нанесении на кожу, мг/кг — 100–500.
- Средняя смертельная концентрация в воздухе, мг/куб. м — 500–5000.
К таким веществам относятся: атразин, бор, бромдихлорметан, бромоформ, гексахлорбензол, гептахлор, ДДТ, дибромхлорметан, кадмий, кобальт, литий, молибден, мышьяк, натрий, нитриты, свинец, селен, сероводород, силикаты, стронций, сурьма, формальдегид, фенол, фипронил, фосфаты, хлороформ, цианиды, четырёххлористый углерод, хлор, трихлорсилан.
III класс опасности
- Предельно допустимая концентрация (ПДК) вредных веществ в воздухе рабочей зоны, мг/куб. м — 1,1–10,0.
- Средняя смертельная доза при введении в желудок, мг/кг — 151–5000.
- Средняя смертельная доза при нанесении на кожу, мг/кг — 501–2500.
- Средняя смертельная концентрация в воздухе, мг/куб. м — 5001–50 000.
К таким веществам относятся: алюминий, барий, железо, марганец, медь, никель, нитраты, серебро, фосфаты, хром, цинк, этиловый спирт.
IV класс опасности
- Предельно допустимая концентрация (ПДК) вредных веществ в воздухе рабочей зоны, мг/куб. м — более 10,0.
- Средняя смертельная доза при введении в желудок, мг/кг — более 5000.
- Средняя смертельная доза при нанесении на кожу, мг/кг — более 2500.
- Средняя смертельная концентрация в воздухе, мг/куб. м — более 50 000.
К таким веществам относятся: симазин, сульфаты, хлориды.
* Вредное вещество — согласно ГОСТу — вещество, которое при контакте с организмом человека в случае нарушения требований безопасности может вызывать производственные травмы, профессиональные заболевания или отклонения в состоянии здоровья.
Нефтепродукты — Что такое Нефтепродукты?
Нефтепродукты — это смеси углеводородов, а также индивидуальные химические соединения, получаемые путем переработки нефти и попутных нефтяных газов (ПНГ).
ИА Neftegaz.RU. Нефтепродукты — это смеси углеводородов, а также индивидуальные химические соединения, получаемые путем переработки нефти и попутных нефтяных газов (ПНГ).
Нефтепродукты — это любые вещества, полученные в результате переработки нефтяного сырья.
На практике наиболее широко используются товарные нефтепродукты.
Они, как правило, представляют собой смесь определенного состава из нескольких индивидуальных веществ с характерными для данного товарного продукта свойствами.
Сегодня ассортимент выпускаемых нефтеперерабатывающими заводами (НПЗ) продуктов насчитывает порядка 500 различных наименований.
Это вещества различных агрегатных состояний, которые, могут представлять собой как индивидуальные соединения, так и смеси углеводородов определенного состава.
К индивидуальным веществам относятся такие соединения, как, например, бензол или толуол.
Ярким примером смесей углеводородов является товарный бензин, представляющие собой компаундированную смесь получаемых в процессе нефтепереработки соединений, которая соответствует требуемым нормативам.
Классификация нефтепродуктов
Продукты нефтепереработки классифицируются по целому ряду различных параметров.
Их можно разделить, например, по агрегатному состоянию на:
- газообразные
- жидкие
- твердые
Кроме этого, выделяют несколько классов по степени опасности веществ в зависимости от температуры вспышки:
- I класс (t вспышки менее 28 оC) – бензин
- II класс (t вспышки 28…61 оC) – керосин, дизельное топливо ДА
- III класс (t вспышки 61…120 оC) – дизельное топливо, мазут
- IV класс (t вспышки более 120 оC) – масло, битум, парафин
Самая распространенная классификация нефтепродуктов — их разделение в зависимости от области применения:
Топливо
Моторное топливо
Энергетическое топливо
- Газотурбинное топливо
- Котельное топливо
- Судовое топливо
Нефтяное масло
- Смазочное масло и пластичные смазки
- Не смазочное масло (трансформаторное, конденсаторное и пр.)
Углеродные и вяжущие материалы
Нефтехимическое сырье
- Ароматические углеводороды (бензол, толуол, ксилол и пр.)
- Сырье для пиролиза (смесь газов – предельных углеводородов)
- Твердые углеводороды (парафины, церезины)
Нефтепродукты специального назначения
-
Термогазойль - Осветительный керосин
- Растворители (ацетон, уайт-спирит)
- Топливные присадки
Основную долю получаемых из нефтяного сырья продуктов переработки составляют различные виды топлива.
Так, на моторное топливо приходится порядка 60% от всего объема производства нефтепродуктов.
Следующая по значимости группа нефтепродуктов – нефтяное масло.
Помимо прямого назначения горюче-смазочные нефтяные материалы, входящие в данную группу могут использоваться в качестве антикоррозионных и теплоотводящих составов, например, для заливки трансформаторов.
Довольно обширный класс нефтепродуктов представляют углеродные и вяжущие материалы.
Яркий представитель данной группы – битум, в огромном количестве используемый в составе асфальта для дорожных покрытий и в строительстве.
Какие бывают классы опасных грузов. Классы опастности грузов для перевозки
Содержание:
- Перевозка опасных грузов: какие классы
- Первый класс — взрывоопасные вещества
- Второй класс — газы
- Третий класс — легковозгараемые жидкости
- Четвертый класс
- Пятый класс
- Шестой класс
- Седьмой класс — радиоактивный груз
- Восьмой класс — коррозионные вещества
- Девятый класс — прочие опасные вещества и изделия
- Транспортирование грузов различных классификаций
Чрезвычайно важно знать ответ на вопрос, сколько классов опасности грузов и какие условия предъявляются к их доставке, так как при нарушении правил транспортировки опасных грузов может возникнуть много неприятных ситуаций. В частности, это затрагивает такую область, как перевозка сыпучих грузов. Перевозка опасных грузов осуществляется в соответствии с едиными стандартами, которые позволяют возить любые материалы. Изучив ДОПОГ и определив класс опасности перевозки грузов, можно обеспечить безопасность и соблюдение правил перевозки различных видов небезопасных грузов.
Различные вещества можно классифицировать и разделить на 9 основных классов, которые насчитывают классы опасности грузов. Помимо разделения на классы, отнести к тому или иному подклассу изделие можно, полагаясь на его свойства.
Первый класс — Взрывоопасные вещества
Систематизировать можно по следующим признакам:
-
способность к детонации; -
вероятность рассеивания; -
вероятность возгорания.
Второй класс — газы
-
Легковоспламеняющиеся газы — ORFG; -
Негорючие нетоксичные газы — ORNG, ORCL.
Третий класс – легковозгараемые жидкости
К третьему классу ORFL принято относить следующие жидкости:
-
легковозгараемые; -
обработанные водой или спиртом (для уменьшения взрывоопасных свойств) взрывоопасные смеси.
Четвертый класс
Легковозгараемые твердые компоненты (ORFS.) и компоненты, способные самопроизвольно возгораться — ORSC.
Пятый класс
-
Вещества, имеющие свойство окислять — OROX; -
Элементы органического типа — OROP.
Шестой класс
-
Токсичные вещества — ORPB; -
Вещества инфекционного типа — ORIS.
Седьмой класс – радиоактивный груз
Группа 1 — Белая — ORRW;
Группа 2 — Желтая — ORRY.
Восьмой класс — Коррозионные вещества
Восьмой класс перевозки опасных грузов несет в себе компоненты, обладающие такими способностями, вследствие коих может наблюдаться нанесение повреждений живым тканям с различной степенью тяжести, или, в результате утечки, физический вред транспорту или грузовым средствам, спецтехнике.
Девятый класс — Прочие опасные вещества
-
Опасные грузы, не относящиеся к другим категориям — ORMD; -
Диоксид углерода твердый — OICE; -
Намагниченный материал — OMAG; -
Вспенивающаяся полимерная смола — ORSB.
В зависимости от характеристики материала и делимости груза, хорошим решением может стать аренда автокрана. Помимо этого, несмотря на большое число видов транспорта на современном рынке, неизменно при перевозке сыпучих грузов наиболее выгодным решением станет аренда самосвала. Главные преимущества подобной техники – скорость и возможность корректировки маршрута, что непременно отразиться на качестве автомобильной транспортировки.
Возврат к списку
А В С D Е F
Класс пожара – это условно принятая характеристика объекта пожара в зависимости от вида горючих веществ и материалов для удобства обозначения огнетушащих веществ и (или) средств тушения (огнетушителей, установок пожаротушения) пожара.
Различают следующие классы и подклассы пожаров:
A
Класс пожара A
Класс пожара — А: характеристика класса — горение твердых веществ.
Подкласс пожара — А1: горение твердых материалов, сопровождаемое тлением (например, дерево, бумага, уголь, текстиль).
Рекомендуемые средства тушения пожаров подкласса А1:
- вода со смачивателями, распыленная вода;
- пены, огнетушащие порошки типа АВСЕ.
Подкласс пожара — А2: горение твердых материалов, не сопровождаемое тлением (например, резина, каучук, пластмасса).
Для тушения пожаров подкласса А2 можно применять все виды огнетушащих веществ: воду, пену, порошки, хладоны.
B
Класс пожара B
Класс пожара — В: характеристика класса — горение жидких веществ.
Подкласс пожара — В1: горение полярных горючих и легковоспламеняющихся жидкостей, на которых интенсивно разрушаются пены (например, спирты, эфиры и др.).
Рекомендуемые средства тушения пожаров подкласса В1: пены на основе специальных пенообразователей, устойчивые к действию полярных жидкостей, тонкораспыленная вода, хладоны, огнетушащие порошки общего назначения, аэрозольное пожаротушение, создаваемое сжиганием аэрозолеобразующих составов, и инертные разбавители: N2, СО2, и т.п.
Подкласс пожара В2: горение неполярных горючих и легковоспламеняющихся жидкостей и плавящихся при нагреве веществ (например, бензин, керосин, мазут, масла, стеарин, некоторые синтетические материалы).
Рекомендуемые средства тушения пожаров подкласса В2:
- пены;
- тонкораспыленная вода;
- хладоны;
- огнетушащие порошки общего назначения;
- аэрозольное пожаротушение и инертные разбавители: N2, СО2, и т.п.
C
Класс пожара C
Класс пожара — С: характеристика класса — горение газообразных горючих веществ (например, метан, водород, пропан).
Рекомендуемые средства тушения пожаров класса С:
- объёмное тушение и флегматизация газовыми составами;
- огнетушащие порошки общего назначения;
- пены, вода (для охлаждения оборудования).
Причем тушение и флегматизацию в помещении, где может образовываться взрывоопасная среда, следует осуществлять после прекращения поступления в помещение горючих газов (паров).
D
Класс пожара D
Класс пожара — D: характеристика класса — горение металлов и металлосодержащих веществ.
Подкласс пожара — D1: горение металлов, за исключением щелочных (например, алюминий, магний и их сплавы).
Рекомендуемые средства тушения пожаров подкласса D1:
- порошки типа ПХК;
- азот;
- аргон.
Подкласс пожара — D2: горение щелочных металлов (например, калий, натрий).
Для тушения пожаров подкласса D2 можно применять огнетушащие порошки специального назначения и инертные газы.
Подкласс пожара — D3: горение растворов с концентрацией металлосодержащих веществ до 60 % масс.
Для тушения пожаров подкласса D3 допускается применение пен, газовых составов, огнетушащих порошков всех видов.
E
Класс пожара E
Класс пожара — Е: использую для характеристики объекта пожара, который находится под напряжением электрического тока.
Для тушения пожаров класса Е рекомендуется применять:
- воду, в том числе тонкораспыленную;
- галогеносодержащие средства;
- диоксид углерода;
- аэрозольное пожаротушение;
- порошки (при использовании ручных огнетушителей и стволов применяются для тушения оборудования с напряжением до 1000 В).
F
Класс пожара F
Класс пожара — F: характеристика класса — горение ядерных материалов, радиоактивных отходов и радиоактивных веществ.
Источник: Федеральный закон РФ № 123-ФЗ от 22.07.2008 «Технический регламент о требованиях пожарной безопасности»; ГОСТ 27331-87 (СТ СЭВ 5637-86). Пожарная техника. Классификация пожаров; Баратов А.Н. Горение—Пожар—Взрыв— Безопасность. – М., 2003.
Состав нефти и ее классификация
Энциклопедия технологий
Нефть — это горючее жидкое полезное ископаемое, которое представляет собой сложную смесь различных веществ. Различная комбинация этих веществ обусловливает самые разнообразные свойства нефти, которые обнаруживаются даже невооруженным глазом — нефть бывает почти бесцветная, желтая, зеленоватая, коричневая или даже почти черная. При этом ее вязкость также будет варьироваться в весьма широких пределах.
Основную часть нефти составляют углеводороды, то есть соединения углерода и водорода, которые делятся на три класса: парафины, нафтены и ароматические углеводороды. Кроме этого в нефти присутствует сера и более редкие примеси, в том числе негорючие, формирующие так называемую зольную составляющую.
Разнообразие химического состава создает и широкую палитру физических свойств. В отличие от воды у нее нет строго определенной температуры кипения — можно говорить лишь о начале процесса кипения самой легкой фракции. Нет постоянной вязкости — она обычно уменьшается с нагреванием. И при нормальной температуре трудно найти нефть с одинаковой плотностью — она варьируется в достаточно широких пределах и даже может быть тяжелее воды.
Классификация нефтей
Уже в XIX веке возникла необходимость хотя бы какой-то базовой классификации нефти по комплексу ее свойств. Изначально были весьма экзотические классификации, например на «сладкую» или «кислую» нефть. С развитием нефтехимии и аналитических исследований, классификации стали развиваться и теперь их достаточно много.
Химическая классификация базируется на соотношении парафинно-нафтено-ароматических углеводородов. Для нужд нефтеперегонки имеет большое значение классификация по содержанию серы в нефти, а также ее плотность. Бывают нефти с малым (до 0,5–0,6%), средним (до 1,8%) и высоким (более 1,8–3,5%) содержанием серы. Нефти с содержанием серы более 3,5% относятся к особо высокосернистым. В свою очередь они могут быть легкими, средними или тяжелыми, с выделением также «особо легких» и битуминозных (то есть «особо тяжелых»).
Нефти также делят на три типа по объему легких фракций, кипящих при нагреве до 350 градусов Цельсия, из которых получают разнообразные бензины, керосин, дизельное топливо, легкий газойль. Есть классификация по содержанию парафина или так называемых базовых масел. Есть и другие специальные классификации.
Можно сказать, что нефть — это чрезвычайно разнообразный по своим свойствам продукт. Свойства конкретного образца нефти могут указать не только на регион, где она была добыта, но и на месторождение, а в ряде случаев даже на скважину. Однако для практических целей приходится огрублять ее оценку. Для этого существуют так называемые маркерные, или эталонные, сорта нефти, свойства которых приняты за определенную точку отсчета.
Оборудование нефтеперегонных заводов, трубопроводных коллекторов обычно настраивается под определенный сорт нефти, чтобы добиться наибольшей эффективности ее переработки. Наиболее известными сортами являются Brent, WTI (Light Sweet), Urals, Siberian Light, Dubai Crude. (Подробнее см. «Эталонные сорта нефти»).
1.2: Классификация веществ — Chemistry LibreTexts
Химики изучают структуру, физические свойства и химические свойства материальных веществ. Они состоят из материи , то есть всего, что занимает пространство и имеет массу. Золото и иридий важны, как арахис, люди и почтовые марки. Дым, смог и веселящий газ — это материя. Однако энергия, свет и звук не имеют значения; идеи и эмоции тоже не имеют значения.
Масса объекта — это количество вещества, которое он содержит.Не путайте массу объекта с массой , которая является силой, вызванной гравитационным притяжением, действующим на объект. Масса — это фундаментальное свойство объекта, которое не зависит от его местоположения. С физической точки зрения масса объекта прямо пропорциональна силе, необходимой для изменения его скорости или направления. Более подробное обсуждение различий между весом и массой и единиц, используемых для их измерения, включено в Основные навыки 1 (Раздел 1.9). С другой стороны, вес зависит от местоположения объекта. Астронавт, масса которого составляет 95 кг, весит около 210 фунтов на Земле, но только около 35 фунтов на Луне, потому что гравитационная сила, которую он или она испытывает на Луне, примерно в шесть раз меньше силы, испытываемой на Земле. Для практических целей в лабораториях вес и масса часто используются как взаимозаменяемые. Поскольку считается, что сила тяжести одинакова на всей поверхности Земли, 2,2 фунта (вес) равны 1,0 кг (масса), независимо от местоположения лаборатории на Земле.
В нормальных условиях существует три различных состояния вещества: твердые тела, жидкости и газы. Твердые тела относительно жесткие, имеют фиксированные формы и объемы. Скала, например, твердое тело. Напротив, жидкости имеют фиксированные объемы, но текут, принимая форму своих емкостей, таких как напиток в банке. Газы , такие как воздух в автомобильной шине, не имеют ни фиксированных форм, ни фиксированных объемов и расширяются, чтобы полностью заполнить свои контейнеры.В то время как объем газов сильно зависит от их температуры и давления (величина силы, приложенной к данной области), объемы жидкостей и твердых тел практически не зависят от температуры и давления. Материя может часто переходить из одного физического состояния в другое в процессе, называемом физическим изменением . Например, жидкая вода может быть нагрета с образованием газа, называемого паром, или пар может быть охлажден с образованием жидкой воды. Однако такие изменения состояния не влияют на химический состав вещества.
Рисунок \ (\ PageIndex {1} \): Три состояния материи. Твердые тела имеют определенную форму и объем. Жидкости имеют фиксированный объем, но текут, принимая форму своих емкостей. Газы полностью заполняют свои емкости, независимо от объема. Рисунок использован с разрешения Википедии
Чистые вещества и смеси
Чистое химическое вещество — это любое вещество, имеющее фиксированный химический состав и характерные свойства. Кислород, например, представляет собой чистое химическое вещество, бесцветный газ без запаха при 25 ° C.Очень немногие образцы материи состоят из чистых веществ; вместо этого большинство из них представляют собой смеси, которые представляют собой комбинации двух или более чистых веществ в различных пропорциях, в которых отдельные вещества сохраняют свою идентичность. Воздух, водопроводная вода, молоко, голубой сыр, хлеб и грязь — все это смеси. Если все части материала находятся в одинаковом состоянии, не имеют видимых границ и однородны на всем протяжении, тогда материал гомогенный . Примерами однородных смесей являются воздух, которым мы дышим, и вода из-под крана, которую мы пьем.Однородные смеси еще называют растворами. Таким образом, воздух представляет собой раствор азота, кислорода, водяного пара, углекислого газа и некоторых других газов; водопроводная вода — это раствор небольших количеств нескольких веществ в воде. Однако конкретные составы обоих этих растворов не фиксированы, а зависят как от источника, так и от местоположения; например, состав водопроводной воды в Бойсе, штат Айдахо, отличается от состава водопроводной воды в Буффало, штат Нью-Йорк. Хотя большинство растворов, с которыми мы сталкиваемся, являются жидкими, растворы также могут быть твердыми.Серое вещество, которое до сих пор используется некоторыми стоматологами для пломбирования зубных полостей, представляет собой сложный твердый раствор, который содержит 50% ртути и 50% порошка, который содержит в основном серебро, олово и медь, с небольшими количествами цинка и ртути. Твердые растворы двух или более металлов обычно называют сплавами.
Если состав материала не полностью однороден, то он будет неоднородным (например, тесто для печенья с шоколадной крошкой, сыр с плесенью и грязь). Смеси, которые кажутся однородными, после микроскопического исследования часто оказываются неоднородными.Молоко, например, кажется однородным, но при исследовании под микроскопом ясно, что оно состоит из крошечных шариков жира и белка, диспергированных в воде. Компоненты гетерогенных смесей обычно можно разделить простыми способами. Смеси твердого вещества и жидкости, такие как песок в воде или чайные листья в чае, легко отделяются фильтрацией, которая заключается в пропускании смеси через барьер, такой как ситечко, с отверстиями или порами, которые меньше твердых частиц. В принципе, смеси двух или более твердых веществ, таких как сахар и соль, можно разделить с помощью микроскопического исследования и сортировки.Однако обычно требуются более сложные операции, например, при отделении золотых самородков от речного гравия путем промывки. Сначала отфильтровывают твердый материал из речной воды; затем твердые частицы отделяются путем инспекции. Если золото внедрено в горную породу, его, возможно, придется изолировать химическими методами.
Рисунок \ (\ PageIndex {2} \): неоднородная смесь. Под микроскопом цельное молоко на самом деле представляет собой гетерогенную смесь, состоящую из глобул жира и белка, диспергированных в воде. Рисунок использован с разрешения Wikipedia
Гомогенные смеси (растворы) могут быть разделены на составляющие вещества с помощью физических процессов, которые зависят от различий в некоторых физических свойствах, таких как различия в их точках кипения.Двумя из этих методов разделения являются дистилляция и кристаллизация. Дистилляция использует разницу в летучести, меру того, насколько легко вещество превращается в газ при заданной температуре. Простой дистилляционный аппарат для разделения смеси веществ, хотя бы одно из которых является жидкостью. Наиболее летучий компонент закипает первым и снова конденсируется в жидкость в конденсаторе с водяным охлаждением, откуда он перетекает в приемную колбу. Если раствор соли и воды перегоняется, например, более летучий компонент, чистая вода, собирается в приемной колбе, а соль остается в перегонной колбе.
Рисунок \ (\ PageIndex {3} \): Дистилляция раствора поваренной соли в воде. Раствор соли в воде нагревают в перегонной колбе до кипения. Образующийся пар обогащается более летучим компонентом (водой), который конденсируется в жидкость в холодном конденсаторе и затем собирается в приемной колбе.
Смеси двух или более жидкостей с разными температурами кипения можно разделить с помощью более сложного дистилляционного аппарата. Одним из примеров является переработка сырой нефти в ряд полезных продуктов: авиационное топливо, бензин, керосин, дизельное топливо и смазочные масла (в приблизительном порядке уменьшения летучести).Другой пример — перегонка спиртных напитков, таких как бренди или виски. (Эта относительно простая процедура вызвала немало головной боли у федеральных властей в 1920-х годах, в эпоху сухого закона, когда нелегальные кадры распространились в отдаленных регионах США!)
Кристаллизация разделяет смеси на основе различий в растворимости, показателе того, сколько твердого вещества остается растворенным в данном количестве указанной жидкости. Большинство веществ более растворимы при более высоких температурах, поэтому смесь двух или более веществ можно растворить при повышенной температуре, а затем дать ей медленно остыть.В качестве альтернативы жидкости, называемой растворителем, можно дать испариться. В любом случае наименее растворимое из растворенных веществ, то, которое с наименьшей вероятностью останется в растворе, обычно сначала образует кристаллы, и эти кристаллы можно удалить из оставшегося раствора фильтрацией.
Рисунок \ (\ PageIndex {4} \): Кристаллизация ацетата натрия из концентрированного раствора ацетата натрия в воде. Добавление небольшого «затравочного» кристалла (а) заставляет соединение образовывать белые кристаллы, которые растут и в конечном итоге занимают большую часть колбы.Видео можно найти здесь: www.youtube.com/watch?v=BLq5NibwV5g
Большинство смесей можно разделить на чистые вещества, которые могут быть элементами или соединениями. Элемент , такой как серый металлический натрий, представляет собой вещество, которое не может быть разбито на более простые химическими изменениями; соединение , такое как белый кристаллический хлорид натрия, содержит два или более элемента и имеет химические и физические свойства, которые обычно отличаются от свойств элементов, из которых он состоит.За некоторыми исключениями, конкретное соединение имеет одинаковый элементный состав (одни и те же элементы в одинаковых пропорциях) независимо от его источника или истории. Химический состав вещества изменяется в процессе, называемом химическим изменением . Превращение двух или более элементов, таких как натрий и хлор, в химическое соединение, хлорид натрия, является примером химического изменения, часто называемого химической реакцией. В настоящее время известно около 118 элементов, но из этих 118 элементов получены миллионы химических соединений.Известные элементы перечислены в периодической таблице.
Рисунок \ (\ PageIndex {5} \): разложение воды на водород и кислород путем электролиза. Вода — это химическое соединение; водород и кислород — элементы.
В общем, обратный химический процесс расщепляет соединения на элементы. Например, вода (соединение) может быть разложена на водород и кислород (оба элемента) с помощью процесса, называемого электролизом. При электролизе электричество обеспечивает энергию, необходимую для разделения соединения на составляющие элементы (Рисунок \ (\ PageIndex {5} \)).Подобный метод широко используется для получения чистого алюминия, элемента, из его руд, которые представляют собой смеси соединений. Поскольку для электролиза требуется много энергии, затраты на электроэнергию, безусловно, являются самыми большими затратами при производстве чистого алюминия. Таким образом, переработка алюминия является экономичной и экологически безопасной.
Общая организация вещества и методы, используемые для разделения смесей, приведены на рисунке \ (\ PageIndex {6} \).
Рисунок \ (\ PageIndex {6} \): Взаимосвязь между типами материи и методами, используемыми для разделения смесей
Пример \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок с соотношением атомов алюминия и кислорода 2: 3
- селен
Дано : химическое вещество
Запрошено : его классификация
Стратегия:
- Определите, является ли вещество химически чистым. Если оно чистое, это либо элемент, либо соединение.Если вещество можно разделить на элементы, это соединение.
- Если вещество не является химически чистым, это либо гетерогенная смесь, либо гомогенная смесь. Если его состав однороден во всем, это однородная смесь.
Решение
- A Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрацией. B Поскольку состав раствора однороден, это однородная смесь.
- A Апельсиновый сок содержит твердые частицы (мякоть), а также жидкость; он не является химически чистым. Б. Апельсиновый сок является неоднородной смесью, поскольку его состав неоднороден.
- A Компакт-диск — это твердый материал, содержащий более одного элемента, с видимыми по краям участками разного состава. Следовательно, компакт-диск не является химически чистым. B Области разного состава указывают на то, что компакт-диск представляет собой неоднородную смесь.
- A Оксид алюминия представляет собой одно химически чистое соединение.
- A Селен — один из известных элементов.
Упражнение \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- Заправка для салата в стиле ранчо
- сахар столовый (сахароза)
- Ответ A
раствор
- Ответ Б
элемент
- Ответ C
гетерогенная смесь
- Ответ D
соединение
Сводка
Вещество можно классифицировать по физическим и химическим свойствам.Материя — это все, что занимает пространство и имеет массу. Три состояния вещества — твердое, жидкое и газообразное. Физическое изменение включает в себя преобразование вещества из одного состояния в другое без изменения его химического состава. Большая часть вещества состоит из смесей чистых веществ, которые могут быть однородными (однородными по составу) или неоднородными (разные области обладают разным составом и свойствами). Чистые вещества могут быть как химическими соединениями, так и элементами. Соединения можно разделить на элементы с помощью химических реакций, но элементы нельзя разделить на более простые вещества химическими методами.Свойства веществ можно разделить на физические или химические. Ученые могут наблюдать физические свойства без изменения состава вещества, тогда как химические свойства описывают тенденцию вещества подвергаться химическим изменениям (химическим реакциям), которые изменяют его химический состав. Физические свойства могут быть интенсивными или обширными. Интенсивные свойства одинаковы для всех образцов; не зависят от размера выборки; и включают, например, цвет, физическое состояние и точки плавления и кипения.Обширные свойства зависят от количества материала и включают массу и объем. Соотношение двух экстенсивных свойств, массы и объема, является важным интенсивным свойством, называемым плотностью.
Авторы и авторство
GHS 101: Классификация веществ и смесей
GHS 101: Классификация
[Для получения конкретных рекомендаций OSHA по классификации посетите веб-сайт об опасностях для здоровья и физических опасностях]
Как мы узнали из GHS 101: Обзор, первоначальный мандат Саммита Земли 1992 г. преследовал две основные цели, связанные с согласованной системой: 1) согласованные критерии для классификации веществ и смесей в соответствии с их экологической опасностью для здоровья и физической опасностью; и 2) согласованные элементы оповещения об опасности.
IOMC разделил работу над объемом этих двух элементов на три части , каждая из которых была разработана другим комитетом или организацией:
1. Критерии классификации опасностей для здоровья и окружающей среды — Разработаны Организацией экономического сотрудничества и развития (ОЭСР)
2. Критерии классификации физических опасностей — Разработаны Подкомитетом экспертов ООН по перевозке опасных грузов (UNSCETDG) и рабочей группой Международной организации труда (МОТ)
3.Элементы информирования об опасностях (включая паспорта безопасности и этикетки) — разработан МОТ
Три основные задачи для команд, работающих над согласованием критериев классификации:
1. Сравните основные системы классификации и определите похожие или идентичные элементы, а также выработайте консенсус по элементам, которые были несходными
2. Изучить научное обоснование критериев, определяющих класс опасности (например, острая токсичность, канцерогенность), и получить экспертный консенсус по методам испытаний, интерпретации данных и уровню озабоченности, а также консенсус по критериям
3.Достичь консенсуса в отношении процесса или схемы использования критериев при использовании подхода дерева решений или при наличии зависимых критериев в схеме классификации
Как видите, классификация является отправной точкой для оповещения об опасности.
Что именно покрывает СГС?
Для классификации СГС применяется к чистым веществам и их разбавленным растворам, а также к смесям. Это не относится к «статьям» согласно определению OSHA.
Вещества означают химические элементы и их соединения в естественном состоянии или полученные любым производственным процессом, включая любые добавки, необходимые для сохранения стабильности продукта, и любые примеси, полученные в результате используемого процесса, но исключая любой растворитель, который может быть отделен не влияя на стабильность вещества и не изменяя его состав.
Смеси означает смесь или раствор, состоящий из двух или более веществ, с которыми они не вступают в реакцию.
«Изделие» означает произведенный предмет, кроме жидкости или частицы: (i) которому при производстве придается определенная форма или конструкция; (ii) функции конечного использования которого полностью или частично зависят от его формы или конструкции во время конечного использования; и (iii) который при нормальных условиях использования не выделяет больше, чем очень небольшие количества, например, незначительные или следовые количества опасного химического вещества (как определено в соответствии с параграфом (d) данного раздела) и не представляют физической опасности или риска для здоровья сотрудников.
Сплав означает металлический материал, однородный в макроскопическом масштабе, состоящий из двух или более элементов, скомбинированных таким образом, что их нельзя легко разделить механическими средствами. Сплавы считаются смесями для целей классификации согласно СГС.
СГС должна быть простой и прозрачной с четким разграничением классов и категорий для обеспечения самоклассификации.
При классификации опасностей учитываются только внутренние опасные свойства веществ или смесей. Данные, используемые для классификации, могут быть получены из тестов, литературы и практического опыта.
Процесс начинается с определения соответствующей информации относительно опасностей вещества или смеси; эта информация анализируется, и принимается решение о том, следует ли классифицировать вещество или смесь как опасные, и о степени опасности.
Как классифицировать смеси по GHS:
- Используются данные испытаний для этой смеси, если таковые имеются
- Если тестовые данные отсутствуют, можно применить принципы моста.
- Связывающие принципы работают за счет использования имеющихся данных испытаний для веществ и / или ингредиентов, составляющих смесь, и их использования для классификации смеси
- Если данные испытаний отсутствуют и принципы согласования не работают, то для каждой опасности в официальной книге СГС есть информация об оценке опасности смеси.
Дополнительные рекомендации по тестированию
GHS не содержит требований к испытаниям веществ.Проводимые тесты должны быть научными и воспроизводимыми.
Критерии определения опасностей для здоровья и окружающей среды являются нейтральными для метода испытаний, что позволяет использовать разные подходы, если они являются научно обоснованными.
Методы испытаний для определения физических опасностей, как правило, более четкие и указаны в СГС.
Одной из целей GHS является сокращение дублирования испытаний и испытаний на животных, а также возможность использования данных испытаний, уже созданных для классификации химических веществ в рамках существующих систем, при классификации тех же химических веществ для GHS.
Когда это создает конфликт между существующей системой и GHS, необходима экспертная оценка.
Кроме того, тесты, не требующие использования живых животных, предпочтительнее тестов с использованием разумных живых экспериментальных животных.
Испытания на людях исключительно с целью выявления опасностей, как правило, неприемлемы; тем не менее, эпидемиологические данные и опыт воздействия химических веществ на человека должны приниматься во внимание при оценке опасности химических веществ для здоровья человека.
Важно качество и последовательность данных. Для некоторых классов опасности классификация получается напрямую, когда данные удовлетворяют критериям.
Для других классификация вещества или смеси производится на основе общего веса доказательств.
Есть особые соображения по классификации смесей.
Некоторые вещества медленно реагируют с атмосферными газами, например: кислород, диоксид углерода, водяной пар с образованием различных веществ или очень медленно реагируют с другими ингредиентами смеси или самополимеризуются; однако количество веществ, образующихся в таких реакциях, обычно достаточно мало, чтобы они не влияли на классификацию смеси.
Пороговые значения и пределы концентрации
Могут быть случаи, когда пороговые значения или пределы концентрации, используемые для непроверенных смесей, основанные на опасностях их ингредиентов, неадекватно отражают идентифицируемую опасность, которую представляет смесь. Если у классификатора есть информация о том, что опасность ингредиента будет очевидна ниже порогового значения или предела концентрации, тогда смесь следует классифицировать соответствующим образом.
И наоборот, если данные показывают, что опасность ингредиента не будет присутствовать на уровне выше порогового значения GHS, смесь может быть классифицирована в соответствии с этими данными.В таких случаях данные следует сохранить и сделать доступными для использования значений, отличных от порогового значения СГС и пределов концентрации.
классификаций наркотиков — Центр наркологии
Что такое классификации лекарств?
Классификации лекарств — это способ систематизировать лекарства по категориям. Для этого есть много причин.
Классификация лекарств по химическому сходству полезна, потому что химически похожие лекарства часто имеют схожие воздействия и риски.Человек, имеющий зависимость от какого-либо наркотика, также с большей вероятностью будет злоупотреблять другим наркотиком и стать зависимым от него, если он химически похож. Кроме того, одно и то же лечение часто оказывается эффективным для химически похожих лекарств. Несмотря на эти общие черты, химически похожие препараты могут иметь очень разные юридические и медицинские последствия.
Многие люди классифицируют наркотики по их влиянию на разум и тело. Например, некоторые наркотики имеют тенденцию делать пользователя активным и энергичным, в то время как другие заставляют человека чувствовать себя расслабленным и спокойным.Многие из этих классификаций лекарств имеют мало оснований для химического сходства или юридических результатов, хотя часто имеют место совпадения.
В большинстве стран существует правовая система классификации лекарств. Эти системы определяют обстоятельства, если таковые имеются, при которых это лекарство является законным, различные требования к этому лекарству и любые правовые санкции, связанные с его владением, распространением или производством. Правовая классификация обычно основана на предполагаемой медицинской ценности лекарственного средства и его предполагаемом риске и опасности.
Даже среди экспертов существуют значительные разногласия по поводу того, как следует классифицировать наркотики. Это означает, что одно и то же лекарство может быть по-разному классифицировано по двум схемам или две системы могут использовать категории с одним и тем же названием. Из-за этих разногласий невозможно создать «окончательный» набор классификаций лекарств. Однако некоторые из наиболее распространенных перечислены ниже.
Классификация лекарств на основе химического состава
Спирт
Алкоголь — это вещество, которым злоупотребляют чаще всего в большинстве стран мира, в том числе в Соединенных Штатах.В той или иной степени законно во всех 50 штатах, алкоголь воздействует на многие системы организма, что, в свою очередь, вызывает у потребителей многочисленные эффекты. Алкоголь вызывает чувство эйфории и снижает запреты, но также серьезно ухудшает суждение, восприятие и время реакции. Алкоголь является депрессантом центральной нервной системы, но он вызывает наиболее серьезные долговременные повреждения печени. Есть много форм алкоголя, в том числе:
Опиоиды
Опиоиды, также называемые опиатами, получают из наркотического опиума или химических веществ, имитирующих его.Опиоиды работают, взаимодействуя с нейротрансмиттерами в головном мозге и блокируя посылаемые ими сигналы. Это позволяет опиоидам действовать как сильные обезболивающие, но также может вызывать чувство сильного удовольствия, ведущее к зависимости. Опиоидная зависимость — одна из самых серьезных проблем, с которыми сегодня сталкивается Америка. Опиоиды являются одними из самых вызывающих привыкание из всех известных веществ, а также одними из самых смертоносных. Некоторые из наиболее известных опиоидов включают:
Бензодиазепины
Бензодиазепины, или бензо, представляют собой класс препаратов, которые действуют за счет взаимодействия с нейромедиатором гамма-аминомасляной кислоты-A (ГАМК-A).Каждый бензо взаимодействует с ГАМК-А по-разному, поэтому каждый бензо влияет на тело и разум по-разному. Бензо назначают для лечения широкого спектра психических расстройств и нарушений сна, но очень часто ими злоупотребляют. Бензо вызывает сильную зависимость и может вызвать множество медицинских и психиатрических проблем, если не используется по назначению. Примеры бензо:
Каннабиноиды
Каннабиноиды — это класс наркотиков, которые химически подобны тетрагидроканнабинолу (ТГК), активному веществу марихуаны.Каннабиноиды вызывают чувство восторга, известное как кайф, но они также негативно влияют на умственное и физическое функционирование. Каннабиноиды — это наркотики, которыми злоупотребляют больше всего после алкоголя, и они все чаще получают юридическое признание. Хотя каннабиноиды считаются менее вызывающими привыкание, чем другие классификации наркотиков, они могут серьезно повредить психическому и физическому здоровью человека. Примеры каннабиноидов:
Барбитураты
Барбитураты действуют на центральную нервную систему, замедляя ее работу.Барбитураты являются производными химической барбитуровой кислоты. Барбитураты исторически были популярны для лечения психических расстройств и нарушений сна, и они до сих пор используются для анестезии и лечения ряда состояний, таких как эпилепсия и головные боли. Барбитураты вызывают сильную зависимость, а также представляют очень высокий риск передозировки, поскольку вызывают отключение многих систем организма. Примеры барбитуратов включают:
Ищете с чего начать?
Обратитесь к поставщику медицинских услуг бесплатно сегодня.
Позвонить
(855) 826-4464
— ИЛИ —
Классификация лекарств, основанная на эффекте
Депрессанты
Депрессанты, которые чаще называют депрессантами, вызывают чувство расслабления и усталости. Хотя многие из них служат законным целям в борьбе с психическими заболеваниями и недосыпанием, ими очень часто злоупотребляют, поскольку они также могут вызывать чувство эйфории.Депрессанты — это не только одни из самых сильнодействующих наркотиков, но они также являются одними из самых опасных и могут вызвать передозировку. Примеры депрессантов включают:
Стимуляторы
Также известный как «верх», стимуляторы используются в первую очередь для повышения энергии, концентрации и бодрствования. Говорят, что стимуляторы вызывают «прилив». Считается, что в краткосрочной перспективе стимуляторы повышают продуктивность и работоспособность, вызывая при этом пик удовольствия. В долгосрочной перспективе стимуляторы вызывают невероятное привыкание и имеют очень высокий потенциал злоупотребления.Примеры стимуляторов включают:
Галлюциногены
Галлюциногены, иногда называемые диссоциативами, изменяют восприятие реальности пользователем, что часто приводит к слуховым и зрительным галлюцинациям — процессу, известному как «спотыкание». Хотя галлюциногены обычно вызывают меньше привыкания, чем другие классификации наркотиков, их непосредственное воздействие, как правило, более серьезное и опасное. Примеры галлюциногенов включают:
- LSD
- Псилоцибиновые грибы
- PCP
Ингалянты
Ингалянты — это широкий спектр химических веществ, которые попадают в организм в основном при вдыхании или выдыхании.Большинство ингалянтов — это широко используемые материалы, которые никоим образом не предназначены для приема внутрь людьми. Хотя существует невероятное разнообразие ингалянтов, большинство из них вызывают чувство кайфа. Ингалянты менее изучены, чем большинство других лекарств. Хотя они, как правило, вызывают меньше привыкания, чем многие другие вещества, использование ингалянтов невероятно опасно и вызывает множество серьезных последствий для здоровья. Примеры ингалянтов, которыми обычно злоупотребляют:
- Разбавитель для краски
- Жидкость для снятия лака
- Бензин
Классификация лекарств на основе юридических определений
Федеральное правительство приняло Закон о контролируемых веществах в 1970 году в ответ на эпидемию наркотиков.Этим законом установлено пять классификаций или списков лекарств. График, в который помещается препарат, определяется законностью и ценностью его потенциального медицинского применения, а также возможностью злоупотребления и уровнем риска зависимости. Исключение составляют международные договоры. Соединенные Штаты должны включить определенные наркотики в определенные списки в соответствии с определенными дипломатическими соглашениями, такими как Единая конвенция о наркотических средствах.
График V
Препараты Списка V имеют наименьшее количество правил и наказаний по сравнению с любой федеральной классификацией наркотиков.Препараты Списка V имеют законное медицинское назначение, имеют меньший потенциал злоупотребления, чем препараты Списка IV, и имеют меньший потенциал привыкания, чем препараты Списка IV. Примеры включают:
График IV
Лекарства, включенные в Список IV, имеют правила и штрафы между препаратами из Списка V и Списка III. Препараты из Списка IV имеют законное медицинское назначение, имеют низкий потенциал злоупотребления и низкий потенциал привыкания. Примеры включают:
Приложение III
Лекарства из Списка III имеют больше правил и более жесткие наказания, чем лекарства Списка IV, и имеют меньше правил и менее суровые наказания, чем лекарства Списка II.Препараты Списка III имеют законное приемлемое медицинское назначение, имеют меньший потенциал злоупотребления, чем препараты Списков I и II, и имеют умеренный или низкий потенциал привыкания. Примеры наркотиков Списка III включают:
Приложение II
Лекарства из Списка II имеют более строгие правила и более строгие наказания, чем лекарства из любой классификации, кроме лекарств из Списка I. Препараты из Списка II имеют разрешенное законное медицинское использование, имеют высокий потенциал злоупотребления и серьезный риск зависимости. Примеры наркотиков Списка II включают:
Приложение I
Лекарства, включенные в Список I, имеют самые строгие правила и самые суровые наказания среди любых наркотиков.Препараты, включенные в Список I, не имеют законного медицинского применения и имеют высокий потенциал злоупотребления. Примеры наркотиков Списка I включают:
Получите помощь во время COVID-19
Проведя всего 30 дней в реабилитационном центре, вы можете очиститься и протрезветь, начать терапию, присоединиться к группе поддержки и узнать, как справиться со своей тягой.
Узнать больше
Не позволяйте наркотикам разрушить вашу жизнь
Не имеет значения, есть ли у вас или у вашего близкого зависимость от бензодиазепина Списка V или опиоида Списка I.Зависимость — это ужасное состояние, и оно мешает вам вести жизнь, которой вы заслуживаете. Несмотря на то, что для всех категорий лекарств требуется специализированное лечение, есть реабилитационный центр, который может вам помочь. Свяжитесь с лечащим врачом сейчас, чтобы найти лучший вариант лечения для вашей ситуации.
home
Последствия обвинения в хранении наркотиков в штате Массачусетс могут существенно повлиять на чью-то жизнь. Обвинения могут означать тюремное заключение и серьезную пометку в чьем-либо личном деле.Вот почему важно иметь опытного адвоката для ведения дела. Адвокаты юридической фирмы Michael M. Monopoli готовы помочь. Майкл и Марк обладают более чем 30-летним опытом ведения уголовных дел в округах Вустер, Фрамингеме и Мальборо. Их знания и опыт могут помочь любому, кому предъявлено обвинение в хранении наркотиков, возможно, смягчить наказание или полностью снять с него обвинения. Чтобы понять законы штата в отношении обвинений в хранении наркотиков в Массачусетсе, мы собрали некоторую информацию, чтобы сделать ее более понятной.
Законы о хранении наркотиков
В штате Массачусетс владение наркотиками определяется как лицо, сознательно и намеренно владеющее контролируемым веществом. Последствия хранения наркотиков могут различаться в зависимости от типа вещества, количества вещества, будь то первое, второе, третье нарушение и т. Д.
Типы веществ и связанные с ними наказания
Существует четыре класса веществ в соответствии с определением штата Массачусетс: классы A, B, C, D и E.
Вещества класса A включают более сильные наркотики и наиболее заряженное вещество — героин. Героин считается одним из самых опасных веществ, и поэтому за него взимается соответствующая плата. Типичные последствия хранения героина могут включать от двух до трех лет тюремного заключения.
Вещества класса B включают наркотики, такие как кокаин, экстази, амфетамины и другие родственные вещества. Лица, уличенные в хранении вещества класса B, обычно наказываются лишением свободы на срок от одного до двух лет в случае предъявления им обвинения.
Вещества класса C расслабляют или стабилизируют настроение. Типичное наказание составляет минимум два года.
Вещества класса D — это марихуана, владение которой в штате Массачусетс не считается преступлением, если только ее содержание не превышает одной унции, что считается незаконным. Если вам предъявлено обвинение в незаконном хранении марихуаны, в обвинении может быть тюремное заключение или менее серьезные обвинения, такие как реабилитация от наркозависимости и штрафы, могут быть согласованы с соответствующим адвокатом.
Вещества класса E включают некоторые отпускаемые по рецепту лекарства для использования при тревоге, депрессии и т. Д. Лицо обвиняется в хранении класса E, если у него обнаружено хранение наркотика и у него нет действующего рецепта на него. Обычно нет времени в тюрьме за хранение вещества класса E, но человек может быть подвергнут испытательному сроку или лечению, и обвинение будет внесено в его постоянный учет.
Если вам или вашим знакомым предъявлены обвинения в хранении наркотиков и вам нужен адвокат, Марк и Майкл Монополи всегда готовы помочь.У них есть высокий процент успеха для уменьшения расходов или их полного снятия. Они изучат детали каждого дела, чтобы убедиться, что обыск проводился на законных основаниях, и увидят, о чем они могут договориться от имени каждого человека, с которым они работают. Свяжитесь с их офисом сегодня, чтобы узнать, чем они могут помочь.
Классификация элементов и соединений
3.4: Классификация элементов и соединений
Чистые вещества состоят только из одного типа материи.Чистое вещество может быть элементом или соединением. Элемент состоит только из одного типа атомов, в то время как соединение состоит из двух или более типов атомов, скрепленных химической связью. Элементы классифицируются как атомарные или молекулярные в зависимости от природы их основных единиц.
Соединения — это чистые вещества, состоящие из двух или более элементов в фиксированных, определенных пропорциях. Соединения классифицируются как ионные или молекулярные (ковалентные) в зависимости от присутствующих в них связей.
Молекулярные соединения
Молекулярные соединения (или ковалентные соединения) образуются, когда два или более разных неметаллических атома обмениваются электронами с образованием ковалентных связей.Основные единицы молекулярных соединений — это дискретные нейтральные молекулы, состоящие из различных составляющих атомов. Например, молекулярное соединение монооксида углерода состоит из молекул CO, содержащих ковалентно связанные атомы углерода и кислорода. Точно так же метанол содержит молекулы CH 3 OH в качестве основных единиц, составляющих один атом углерода, один атом кислорода и четыре атома водорода, все из которых ковалентно связаны.
Молекулярные соединения можно идентифицировать по их физическим свойствам.В нормальных условиях молекулярные соединения часто существуют в виде газов, низкокипящих жидкостей и легкоплавких твердых веществ, хотя существуют исключения.
Ионные соединения
Когда элемент, состоящий из атомов, которые легко теряют электроны (металл), реагирует с элементом, состоящим из атомов, которые легко приобретают электроны (неметалл), обычно происходит перенос электронов с образованием ионов. Соединение, образованное этим переносом, стабилизируется электростатическим притяжением (ионными связями) между ионами противоположного заряда, присутствующими в соединении.Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон для образования катиона натрия, Na + , и каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон на образуют хлорид-анион, Cl —, полученное соединение, NaCl, состоит из ионов натрия и хлорид-ионов в соотношении один ион Na + на каждый ион Cl —.
Соединение, содержащее ионы и удерживаемое ионными связями, называется ионным соединением.Ионные соединения — это твердые вещества, которые обычно плавятся при высоких температурах и кипят при еще более высоких температурах. В твердой форме ионное соединение не является электропроводным, потому что его ионы не могут течь. Однако в расплавленном состоянии он может проводить электричество, потому что его ионы могут свободно перемещаться через жидкость.
В каждом ионном соединении общее количество положительных зарядов катионов равно общему количеству отрицательных зарядов анионов. Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы.
Многие ионные соединения содержат многоатомные ионы в виде катиона, аниона или того и другого. Как и простые ионные соединения, эти соединения также должны быть электрически нейтральными, поэтому их формулы можно предсказать, рассматривая многоатомные ионы как дискретные единицы. Мы используем круглые скобки в формуле для обозначения группы атомов, которые ведут себя как единое целое. Например, формула фосфата кальция, одного из минералов в наших костях, — Ca 3 (PO 4 ) 2 . Эта формула показывает, что на каждые две фосфатные (PO 4 ) 3- группы приходится три иона кальция (Ca 2+ ).Группы (PO 4 ) 3- представляют собой дискретные единицы, каждая из которых состоит из одного атома фосфора и четырех атомов кислорода и имеет общий заряд 3−. Соединение электрически нейтрально, и его формула показывает общее количество трех атомов Ca, двух P и восьми атомов O.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 2.6: Молекулярные и ионные соединения.
Что такое контролируемое вещество?
Контролируемые вещества являются незаконными или отпускаемыми по рецепту лекарствами, которые регулируются Законом о контролируемых веществах (CSA) в США.Признавая потенциал некоторых лекарств для злоупотребления и зависимости, Конгресс принял CSA как часть Закона о комплексной профилактике и борьбе со злоупотреблением наркотиками 1970 года.
Этот закон классифицирует все вещества, которые регулируются федеральным законом, в «списки» в зависимости от того, насколько они потенциально опасны. График применения препарата зависит от его медицинского применения, потенциального злоупотребления и безопасности, а также от того, насколько легко люди становятся зависимыми от него.
Эта категоризация подверглась тщательному рассмотрению.Законодательный контроль над наркотиками существует для защиты людей от вреда, который эти наркотики могут нанести. Он основан на исследованиях из множества различных источников о потенциальном вреде препарата как для людей, так и для общества.
Список лекарств 1
Препараты из Списка I (в законе используются римские цифры от 1 до 5) потенциально опасны для злоупотребления. В настоящее время они не имеют федерально признанного медицинского применения для лечения в США, и отсутствует общепризнанная безопасность использования лекарственного средства или вещества под медицинским наблюдением.
Примеры веществ Списка I включают:
- Гамма-гидроксимасляная кислота (GHB)
- Героин
- Диэтиламид лизергиновой кислоты (LSD)
- Метаквалон
Марихуана — единственный наркотик из Списка I, разрешенный для использования в медицинских и рекреационных целях во многих штатах. Однако многие эксперты считают, что статус препарата следует изменить, чтобы можно было провести более всесторонние исследования для определения медицинских преимуществ марихуаны.
Список 2 наркотиков
Наркотики и вещества, включенные в Список II, также имеют высокий потенциал злоупотребления.Они отличаются от лекарств из Списка I тем, что в настоящее время они разрешены для медицинского использования в США или в настоящее время приняты в медицинских целях с серьезными ограничениями.
Примеры веществ Списка II включают:
Злоупотребление препаратами из списка II может привести к тяжелой психологической или физической зависимости.
Список лекарств 3
Наркотики и вещества из Списка III имеют меньший потенциал злоупотребления, чем наркотики или вещества из Списков I и II.В настоящее время они широко используются в медицинских целях в США.
Злоупотребление наркотиком или веществом может привести к умеренной или низкой физической зависимости или высокой психологической зависимости.
Примеры веществ, включенных в Список III, включают:
Список лекарств 4
Эти наркотики и вещества имеют низкий потенциал злоупотребления по сравнению с теми, которые включены в Список III. Лекарство или субстанция в настоящее время разрешено использовать для лечения в США.
Злоупотребление наркотиками или другими веществами может привести к ограниченной физической или психологической зависимости по сравнению с наркотиками или другими веществами, включенными в Список III.
Примеры веществ Списка IV включают:
Список лекарств 5
Лекарственное средство или вещество имеет низкий потенциал злоупотребления по сравнению с теми, которые включены в Список IV. Лекарство или другое вещество в настоящее время разрешено использовать для лечения в Соединенных Штатах.
Злоупотребление наркотиком или другими веществами может привести к ограниченной физической или психологической зависимости по сравнению с наркотиками или другими веществами, включенными в Список IV.Примеры препаратов Списка V включают лекарства от кашля с кодеином.
Если ваш врач прописывает контролируемое вещество
Хотя не все отпускаемые по рецепту лекарства находятся под контролем, есть несколько (например, опиоидные обезболивающие), которые подпадают под категорию контролируемых веществ. Если ваш врач прописывает одно из этих лекарств, важно, чтобы вы принимали его только в соответствии с указаниями. Помимо ограниченного количества пополнений, вам может потребоваться подписать соглашение о приеме обезболивающих или контракт между вами и врачом, чтобы гарантировать, что вы принимаете лекарства в точности в соответствии с предписаниями.
Хотя детали могут отличаться от врача к врачу, в соглашении также может содержаться просьба дать согласие на:
- Получите рецепт только в одной аптеке
- Не запрашивать и не принимать обезболивающие у другого поставщика
- Отправить на выборочную проверку на наркотики
Хранение контролируемых веществ (Класс A, B, C, D, E)
В Массачусетсе осуждение за любое обвинение в хранении наркотиков, даже за «простое» хранение, будет иметь далеко идущие побочные последствия.так как это автоматически запретит вам когда-либо получать определенные лицензии. Например, любой приговор, связанный с наркотиками, не позволит вам получить множество профессиональных лицензий, в том числе лицензию на продажу спиртных напитков в Массачусетсе на владение баром или рестораном. Также очень маловероятно, что вам когда-либо выдадут LTC (лицензию на ношение огнестрельного оружия), даже если кто-то может подумать, что простое обвинение в наркотиках не имеет ничего общего с пригодностью к владению огнестрельным оружием.
В Массачусетсе, в рамках MGL c.94C с. 34, для того чтобы быть признанным виновным в хранении контролируемого вещества, обвинение должно доказать, что вы:
- Вы сознательно или преднамеренно владели
- Контролируемым веществом
Во-первых, обвинение должно доказать вне разумных сомнений, что это вещество подпадает под один из классов контролируемых веществ в соответствии с MGL c. 94C с. 31. Если офицер, производящий арест, имеет достаточный опыт, образование и квалификацию в отношении обучения распознаванию наркотиков, его наблюдений и мнения может быть достаточно, чтобы доказать классификацию наркотика.Однако, если это единственное доказательство классификации наркотика, тщательный перекрестный допрос может дискредитировать показания офицера, оставив разумные сомнения в отношении этого элемента. Обвинение может пойти еще дальше, допустив сертификацию препарата после тестирования в лаборатории по наркотикам полиции штата. Однако эта лаборатория печально известна своими неоправданными задержками, и если обвинение не может получить свидетельство в разумные сроки, суд может запретить им использовать его в качестве доказательства.
Чтобы доказать владение, обвинение может доказать либо фактическое владение (вещество было у вас в руке, в кармане и т. Д.), Либо конструктивное владение. Конструктивное владение означает, что у вас были средства контроля и фактически было намерение продемонстрировать контроль над веществом. Например, вещество было в багажнике вашего автомобиля или под подушкой сиденья дивана, где вы сидели. Однако в отношении любого типа владения обвинение должно доказать, что вы знали, что вещество было.Например, обвинение должно доказать, что наркотики не клали в карман вашей куртки, пока куртку проверяли в баре. Конечно, разумное жюри может сделать вывод, что вы знали, что было в вашем собственном кармане пиджака, но если есть какие-то основания полагать, что иначе , мы обязательно сделаем это в суде.
В рамках MGL c. 94C с. 35, элемент «владение» героином гораздо шире. Умышленное присутствие там, где хранится героин, является отдельным преступлением.Это означает, что если вы находитесь в доме и знаете, что героин находится где-то в этом доме, или если вы идете со своим другом, у которого, как вы знаете, героин в кармане, даже если вы не контролируете По существу, в соответствии с этим законом вам грозит до 1 года тюремного заключения и штраф в размере 1000 долларов США.
Возможные штрафы зависят от конкретного класса наркотиков, хранением которых вы обвиняете.
Хранение вещества класса A в Массачусетсе (героин, морфин, GHB, Special K) влечет за собой следующие потенциальные наказания:
- 2 года тюремного заключения
- Штраф 2000 долларов
Второе нарушение за хранение класса A является тяжким преступлением в Массачусетсе, влекущим за собой следующие возможные наказания:
- 5 лет тюрьмы штата
- Штраф в размере 5000 долларов
Владение веществом класса B в Массачусетсе (кокаин, крэк, ЛСД, оксикодон, оксиконтин, экстаз, гидрохлорид, амфетамин, метамфетамин) влечет за собой следующие потенциальные наказания:
- 1 год тюремного заключения
- Штраф в размере 1000 долларов
Второе или последующее нарушение за хранение класса B в Массачусетсе влечет за собой следующие потенциальные наказания:
- 2 года лишения свободы. тюрьма
- Штраф 2000 долларов
Хранение вещества класса C в Массачусетсе несет следующие возможные наказания:
- 1 год тюремного заключения
- Штраф 1000 долларов
Второе или последующее преступление за владение классом C в Массачусетсе влечет за собой следующие потенциальные наказания:
- 2 года тюрьмы
- Штраф 2000 долларов
Хранение более одной унции марихуаны (класс D) или хранение вещества класса E в Массачусетсе влечет за собой следующие потенциальные наказания:
- 6 месяцев тюремного заключения **
- Штраф в размере 500 долларов США
- 1 год потери лицензии (обязательно)
** Если вы осуждены за первое правонарушение, не имеете никаких других судимостей или преступлений, связанных с наркотиками, за хранение более одной унции марихуаны или за хранение вещества класса E, вы имеют право на испытательный срок (без тюремного заключения).
