| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Как определить степень окисления? — материалы для подготовки к ЕГЭ по Химии
Автор — Александр Игоревич Новичков .
Степень окисления — это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или , где – целое число. Например:
Существуют определённые правила нахождения степени окисления.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
— Исключения у водорода соединения , в которых у водорода степень окисления
— Исключения у кислорода
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю.
 Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?
Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов . Чтобы в сумме был ноль, у трех атомов заряд должен быть , значит у каждого атома
Пример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисления
Посчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
Ответ:
- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.

Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
калькулятор степеней окисления онлайн
Вы искали калькулятор степеней окисления онлайн? На нашем сайте вы можете получить ответ на любой математический вопрос здесь. Подробное
решение с описанием и пояснениями поможет вам разобраться даже с самой сложной задачей и степень окисления онлайн калькулятор расчет, не
исключение. Мы поможем вам подготовиться к домашним работам, контрольным, олимпиадам, а так же к поступлению
в вуз.
И какой бы пример, какой бы запрос по математике вы не ввели — у нас уже есть решение.
Например, «калькулятор степеней окисления онлайн».
Применение различных математических задач, калькуляторов, уравнений и функций широко распространено в нашей
жизни. Они используются во многих расчетах, строительстве сооружений и даже спорте. Математику человек
Математику человек
использовал еще в древности и с тех пор их применение только возрастает. Однако сейчас наука не стоит на
месте и мы можем наслаждаться плодами ее деятельности, такими, например, как онлайн-калькулятор, который
может решить задачи, такие, как калькулятор степеней окисления онлайн,степень окисления онлайн калькулятор расчет. На этой странице вы найдёте калькулятор,
который поможет решить любой вопрос, в том числе и калькулятор степеней окисления онлайн. Просто введите задачу в окошко и нажмите
«решить» здесь (например, калькулятор степеней окисления онлайн).
Где можно решить любую задачу по математике, а так же калькулятор степеней окисления онлайн Онлайн?
Решить задачу калькулятор степеней окисления онлайн вы можете на нашем сайте https://pocketteacher.ru. Бесплатный
онлайн решатель позволит решить онлайн задачу любой сложности за считанные секунды. Все, что вам необходимо
сделать — это просто
ввести свои данные в решателе. Так же вы можете посмотреть видео инструкцию и узнать, как правильно ввести
Так же вы можете посмотреть видео инструкцию и узнать, как правильно ввести
вашу задачу на нашем сайте. А если у вас остались вопросы, то вы можете задать их в чате снизу слева на странице
калькулятора.
Расчёт степени окисления — Окислительно-Восстановительные реакции
Расчет степени окисления
Для вычисления степени окисления элемента следует
учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны
нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов,
входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна
заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных
металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода
(-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может
превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2;
K+1Cl+7O4-2; N-3H3+1;
K2+1H+1P+5O4-2;
Na2+1Cr2+6O7-2
В
окислительно-восстановительных реакциях электроны от одних атомов, молекул или
ионов переходят к другим. Процесс отдачи электронов — окисление. При
окислении степень окисления повышается:
H20 —
2ē →2H+
S-2 — 2ē →S0
Al0 — 3ē → Al+3
Fe+2 — ē → Fe+3
2Br — —
2ē → Br20
Процесс присоединения электронов — восстановление: При
восстановлении степень окисления понижается.
Mn+4 + 2ē → Mn+2
S0 + 2ē → S-2
Cr+6 +3ē → Cr+3
Cl20
+2ē → 2Cl—
O20 +
4ē → 2O-2
Атомы или ионы, которые в данной реакции присоединяют
электроны являются окислителями, а которые отдают электроны — восстановителями.
Окислительно-восстановительные свойства вещества и
степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления,
могут быть только окислителями за счет этих атомов, т.к. они уже отдали все
свои валентные электроны и способны только принимать электроны. Максимальная
степень окисления атома элемента равна номеру группы в периодической таблице, к
которой относится данный элемент. Соединения, содержащие атомы элементов с
минимальной степенью окисления могут служить только восстановителями, поскольку
они способны лишь отдавать электроны, потому, что внешний энергетический
уровень у таких атомов завершен восемью электронами. Минимальная степень
Минимальная степень
окисления у атомов металлов равна 0, для неметаллов — (n–8) (где n- номер группы в периодической системе).
Соединения, содержащие атомы элементов с промежуточной степенью окисления,
могут быть и окислителями и восстановителями, в зависимости от партнера, с
которым взаимодействуют и от условий реакции.
Степень окисления тест (9 класс) по химии
Сложность: знаток.Последний раз тест пройден 5 часов назад.
Вопрос 1 из 10
Верно ли утверждение, что у металлов степень окисления всегда положительна и равна номеру группы?
- Правильный ответ
- Неправильный ответ
- Вы и еще 83% ответили правильно
- 83% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветить
Вопрос 2 из 10
Степень окисления азота в сульфате аммония равна
- Правильный ответ
- Неправильный ответ
- Вы и еще 78% ответили правильно
- 78% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 3 из 10
Степень окисления + 3 азот проявляет в соединении
- Правильный ответ
- Неправильный ответ
- Вы и еще 62% ответили правильно
- 62% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 4 из 10
Степень окисления + 3 хром имеет в соединении
- Правильный ответ
- Неправильный ответ
- Вы и еще 78% ответили правильно
- 78% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 5 из 10
Хлор проявляет положительную степень окисления в соединении с
- Правильный ответ
- Неправильный ответ
- Вы и еще 72% ответили правильно
- 72% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 6 из 10
Минимальную степень окисления хлор проявляет в соединении
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 53% участников
- 47% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 7 из 10
В каком соединении степень окисления серы равна +4?
- Правильный ответ
- Неправильный ответ
- Вы и еще 65% ответили правильно
- 65% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 8 из 10
Степень окисления хлора в Са(СlO)2 равна
- Правильный ответ
- Неправильный ответ
В вопросе ошибка?
Ответить
Вопрос 9 из 10
Степень окисления хлора в Ва(СlO3)2 равна
- Правильный ответ
- Неправильный ответ
- Вы и еще 73% ответили правильно
- 73% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 10 из 10
Степень окисления азота увеличивается в ряду веществ:
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 53% участников
- 47% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
ТОП-3 тестакоторые проходят вместе с этим
Рейтинг теста
Средняя оценка: 3.6. Всего получено оценок: 272.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Степень окисления азота (N), формула и примеры
Общие сведения о степени окисления азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Степень окисления азота в соединениях
Азот образует двухатомные молекулы состава N2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Для азота характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-3) азот проявляет в соединениях под названием нитриды (Mg+23N-32, B+3N-3), самым известным из которых является аммиак (N-3H+13).
Степень окисления (-2) азот проявляет в соединениях перикисного типа – пернитридах, простейшим представителем которых является гидразин (диамид/ пернитрид водорода) – N-22H2.
В соединении под названием гидроксиламин – N-1H2OH–азот проявляет степень окисления (-1).
Наиболее устойчивые положительные степени окисления азота – это (+3) и (+5). Первую из них он проявляет во фториде (N+3F-13), оксиде (N+32O-23), оксогалогенидах (N+3OCl, N+3OBr и т.д.), а также производных аниона NO2— (KN+3O2, NaN+3O2 и др.). Степень окисления (+5) азот проявляет в оксиде N+52O5, оксонитриде N+5ON, диоксофториде N+5O2F, а также в триоксонитрат (V) –ионе NO3— и динитридонитрат (V) –ионе NH2—.
Первую из них он проявляет во фториде (N+3F-13), оксиде (N+32O-23), оксогалогенидах (N+3OCl, N+3OBr и т.д.), а также производных аниона NO2— (KN+3O2, NaN+3O2 и др.). Степень окисления (+5) азот проявляет в оксиде N+52O5, оксонитриде N+5ON, диоксофториде N+5O2F, а также в триоксонитрат (V) –ионе NO3— и динитридонитрат (V) –ионе NH2—.
Азот также проявляет степени окисления (+1) – N+12O, (+2) – N+2O и (+4)N+4O2 в своих соединениях, но значительно реже.
Примеры решения задач
Определить степень окисления ba. Электроотрицательность. Степень окисления и валентность химических элементов. Как определяется степень окисления: постоянная СО
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.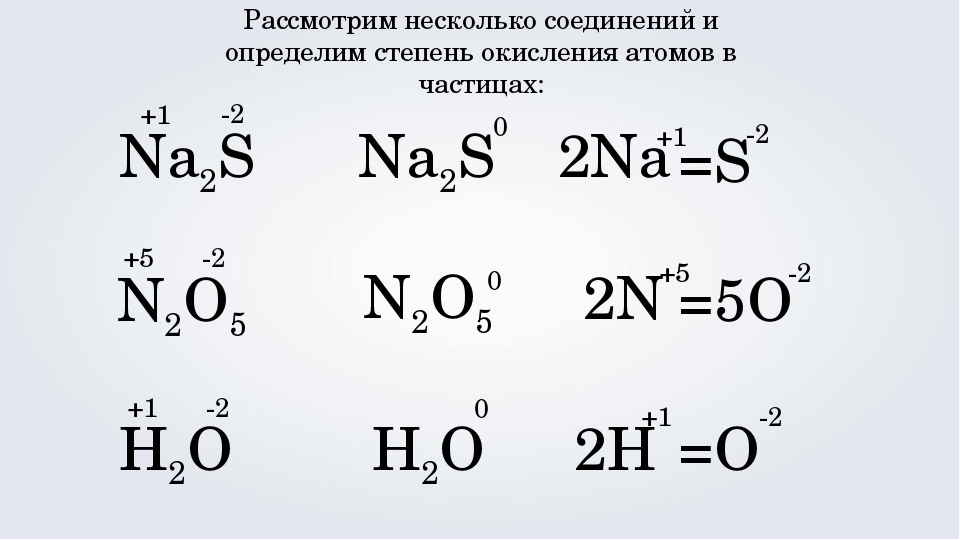
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Современная формулировка Периодического закона, открытого Д. И. Менделеевым в 1869 г.:
Свойства элементов находятся в периодической зависимости от порядкового номера.
Периодически повторяющийся характер изменения состава электронной оболочки атомов элементов объясняет периодическое изменение свойств элементов при движении по периодам и группам Периодической системы.
Проследим, например, изменение высших и низших степеней окисления у элементов IA – VIIA-групп во втором – четвертом периодах по табл. 3.
Положительные
степени окисления проявляют все элементы, за исключением фтора. Их значения увеличиваются с ростом заряда ядер и совпадают с числом электронов на последнем энергетическом уровне (за исключением кислорода). Эти степени окисления называют высшими
степенями окисления. Например, высшая степень окисления фосфора Р равна +V.
Отрицательные
степени окисления проявляют элементы, начиная с углерода С, кремния Si и германия Ge. Значения их равны числу электронов, недостающих до восьми. Эти степени окисления называют низшими
степенями окисления. Например, у атома фосфора Р на последнем энергетическом уровне недостает трех электронов до восьми, значит, низшая степень окисления фосфора Р равна – III.
Значения высших и низших степеней окисления повторяются периодически, совпадая по группам; например, в IVA-группе углерод С, кремний Si и германий Ge имеют высшую степень окисления +IV, а низшую степень окисления – IV.
Эта периодичность изменения степеней окисления отражается на периодическом изменении состава и свойств химических соединений элементов.
Аналогично прослеживается периодическое изменение электроотрицательности элементов в 1-6-м периодах IA– VIIA-групп (табл. 4).
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).
В каждой группе
Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз). Фтор F обладает наивысшей, а цезий Cs – наинизшей электроотрицательностью среди элементов 1-6-го периодов.
У типичных неметаллов – высокая электроотрицательность, а у типичных металлов – низкая.
Примеры заданий частей А, В
1.
В 4-м периоде число элементов равно
2.
Металлические свойства элементов 3-го периода от Na до Сl
1) силиваются
2) ослабевают
3) не изменяются
4) не знаю
3.
Неметаллические свойства галогенов с увеличением порядкового номера
1) возрастают
2) понижаются
3) остаются без изменений
4) не знаю
4.
В ряду элементов Zn – Hg – Со – Cd один элемент, не входящий в группу, – это
5.
Металлические свойства элементов повышаются по ряду
1) In – Ga – Al
2) К – Rb – Sr
3) Ge – Ga – Tl
4) Li – Be – Mg
6.
Неметаллические свойства в ряду элементов Аl – Si – С – N
1) увеличиваются
2) уменьшаются
3) не изменяются
4) не знаю
7.
В ряду элементов О – S – Se – Те размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
8.
В ряду элементов Р – Si – Аl – Mg размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
9.
Для фосфора элемент с меньшей
электроотрицательностью – это
10.
Молекула, в которой электронная плотность смещена к атому фосфора, – это
11. Высшая
степень окисления элементов проявляется в наборе оксидов и фторидов
1) СlO 2 , РСl 5 , SeCl 4 , SO 3
2) PCl, Аl 2 O 3 , КСl, СО
3) SeO 3 , ВСl 3 , N 2 O 5 , СаСl 2
4) AsCl 5 , SeO 2 , SCl 2 , Cl 2 O 7
12. Низшая
степень окисления элементов – в их водородных соединениях и фторидах набора
1) ClF 3 , NH 3 , NaH, OF 2
2) H 3 S + , NH+, SiH 4 , H 2 Se
3) CH 4 , BF 4 , H 3 O + , PF 3
4) PH 3 , NF+, HF 2 , CF 4
13.
Валентность для многовалентного атома одинакова
в ряду соединений
1) SiH 4 – AsH 3 – CF 4
2) РН 3 – BF 3 – ClF 3
3) AsF 3 – SiCl 4 – IF 7
4) H 2 O – BClg – NF 3
14.
Укажите соответствие между формулой вещества или иона и степенью окисления углерода в них
I.
Валентность (повторение)
Валентность – это способность атомов присоединять к
себе определенное число других атомов.
Правила
определения валентности
элементов в соединениях
1.
Валентность водорода
принимают за I
(единицу). Тогда в
соответствии с формулой воды Н 2 О к одному атому кислорода
присоединено два атома водорода.
2.
Кислород
в своих соединениях всегда проявляет валентность II
. Поэтому углерод в соединении СО 2
(углекислый газ) имеет валентность IV.
3.
Высшая
валентность
равна номеру
группы
.
4.
Низшая
валентность
равна разности между
числом 8 (количество групп в таблице) и номером группы, в которой находится
данный элемент, т.е. 8 —
N
группы
.
5.
У металлов, находящихся в
«А» подгруппах, валентность равна номеру группы.
6.
У неметаллов в основном
проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI
и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7.
Валентность может быть постояннойили переменной.
Валентность элементов необходимо знать,
чтобы составлять химические формулы соединений.
Запомните!
Особенности составления химических формул соединений.
1) Низшую
валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева
правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в
соединении с кислородом сера проявляет высшую валентность VI, а кислород –
низшую II. Таким образом, формула оксида серы будет
SO 3.
В соединении
кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую
IV. Значит, формула
– SiC. Это
карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом
металла стоит в формуле на первое место.
2) В
формулах соединений атом неметалла, проявляющий низшую валентность, всегда
стоит на втором месте, а название такого соединения оканчивается на «ид».
Например,
СаО – оксид кальция,
NaCl
– хлорид натрия,
PbS – сульфид свинца.
Теперь вы
сами можете написать формулы любых соединений металлов с неметаллами.
3) Атом металла ставится в формуле на первое место.
II
. Степень окисления (новый
материал)
Степень
окисления
– это
условный заряд, который получает атом в результате полной отдачи
(принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
F +9)2)7
Na +11)2)8)1
— Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
— Какому атому легче принять, а какому легче отдать валентные электроны с
целью завершения внешнего уровня?
Оба атома
имеют незавершённый внешний уровень?
Атому
натрия легче отдавать электроны, фтору – принять электроны до завершения
внешнего уровня.
F
0
+ 1ē →
F
-1
(нейтральный атом принимает один отрицательный электрон и приобретает
степень окисления «-1», превращаясь в отрицательно заряженный ион — анион
)
Na
0
– 1ē →
Na
+1
(нейтральный атом отдаёт один отрицательный электрон и приобретает степень
окисления «+1», превращаясь в положительно заряженный ион — катион
)
Как
определить степень окисления атома в ПСХЭ Д.И. Менделеева?
Правила определения
степени окисления атома в ПСХЭ Д.И. Менделеева:
1. Водород
обычно
проявляет степень окисления (СО) +1
(исключение, соединения с металлами
(гидриды) – у водорода СО равна (-1) Me
+ n
H n
-1
)
2. Кислород
обычно
проявляет СО -2
(исключения: О +2 F
2 , H
2 O
2 -1 – перекись водорода)
3. Металлы
проявляют
только +
n
положительную
СО
4. Фтор
проявляет
всегда СО равную -1
(F
-1)
5. Для элементов главных подгрупп
Для элементов главных подгрупп
:
Высшая
СО (+) = номеру группы
N
группы
Низшая
СО (-) =
N
группы
–
8
Правила определения степени
окисления атома в соединении:
I.
Степень окисления свободных атомов
и атомов в молекулах простых веществ
равна нулю
— Na
0 ,
P
4 0 ,
O
2 0
II. В сложном
веществе
алгебраическая сумма СО всех атомов с учётом их индексов равна
нулю = 0
, а в сложном ионе
его заряду.
Например,
H
+1
N
+5
O
3
-2
: (+1)*1+(+5)*1+(-2)*3 = 0
2-
: (+6)*1+(-2)*4 = -2
Задание 1
– определите
степени окисления всех атомов в формуле серной кислоты H
2 SO
4 ?
1.
Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
H
+1 S x O
4 -2
(+1)*1+(х)*1+(-2)*4=0
Х=6
или (+6), следовательно, у серы C
О +6, т. е.
е.
S
+6
Задание 2
– определите
степени окисления всех атомов в формуле фосфорной кислоты H
3 PO
4 ?
1.
Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
H
3 +1 P x O
4 -2
2.
Составим и решим уравнение, согласно правилу (II
):
(+1)*3+(х)*1+(-2)*4=0
Х=5
или (+5), следовательно, у фосфора C
О +5, т.е.
P
+5
Задание 3
– определите
степени окисления всех атомов в формуле иона аммония (NH
4) + ?
1.
Проставим известную степень окисления у водорода, а СО азота примем
за «х»
(N
х H
4 +1) +
2.
Составим и решим уравнение, согласно правилу (II
):
(х)*1+(+1)*4=+1
Х=-3,
следовательно, у азота C
О -3, т.е.
N -3
Задача по определению степени окисления может оказаться как простой формальностью, так и сложной головоломкой. В первую очередь, это будет зависеть от формулы химического соединения, а также наличия элементарных знаний по химии и математике.
Зная основные правила и алгоритм последовательно-логичных действий, о которых пойдет речь в данной статье, при решении задач подобного типа, каждый с легкостью сможет справиться с этим заданием. А потренировавшись и научившись определять степени окисления разноплановых химических соединений, можно смело браться за уравнивание сложных окислительно-восстановительных реакций методом составления электронного баланса.
Понятие степени окисления
Чтобы научиться определять степень окисления, для начала необходимо разобраться, что это понятие означает?
- Степень окисления применяют при записи в окислительно-восстановительных реакциях, когда происходит передача электронов от атома к атому.
- Степень окисления фиксирует количество перенесенных электронов, обозначая условный заряд атома.
- Степень окисления и валентность зачастую тождественны.
Данное обозначение пишется сверху химического элемента, в его правом углу, и представляет собой целое число со знаком «+» или «-». Нулевое значение степени окисления знака не несет.
Нулевое значение степени окисления знака не несет.
Правила определения степени окисления
Рассмотрим основные каноны определения степени окисления:
- Простые элементарные вещества, то есть те, которые состоят из одного вида атомов, всегда будут иметь нулевую степень окисления. Например, Na0, H02, P04
- Существует ряд атомов, имеющих всегда одну, постоянную, степень окисления. Приведенные в таблице значения лучше запомнить.
- Как видно, исключение бывает лишь у водорода в соединении с металлами, где он приобретает не свойственную ему степень окисления «-1».
- Кислород также принимает степень окисления «+2» в химическом соединении с фтором и «-1» в составах перекисей, надперекисей или озонидов, где атомы кислорода соединены друг с другом.
- Ионы металлов имеют несколько значений степени окисления (причем только положительные), поэтому ее определяют по соседним элементам в соединении. Например, в FeCl3, хлор имеет степень окисления «-1», у него 3 атома, значит умножаем -1 на 3, получаем «-3».
 Чтобы в сумме степеней окисления соединения получась «0», железо должно иметь степень окисления «+3». В формуле FeCl2, железо, соответственно, изменит свою степень на «+2».
Чтобы в сумме степеней окисления соединения получась «0», железо должно иметь степень окисления «+3». В формуле FeCl2, железо, соответственно, изменит свою степень на «+2». - Математически суммируя степени окисления всех атомов в формуле (с учетом знаков), всегда должно получаться нулевое значение. Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0).
- Степень окисления одноатомного иона будет равна его заряду. Например: Na+, Ca+2.
- Наивысшая степень окисления, как правило, соотносится с номером группы в периодической системе Д.И.Менделеева.
Алгоритм действий определения степени окисления
Порядок нахождения степени окисления не сложен, но требует внимания и выполнения определенных действий.
Задача: расставить степени окисления в соединении KMnO4
- Первый элемент – калий, имеет постоянную степень окисления «+1».
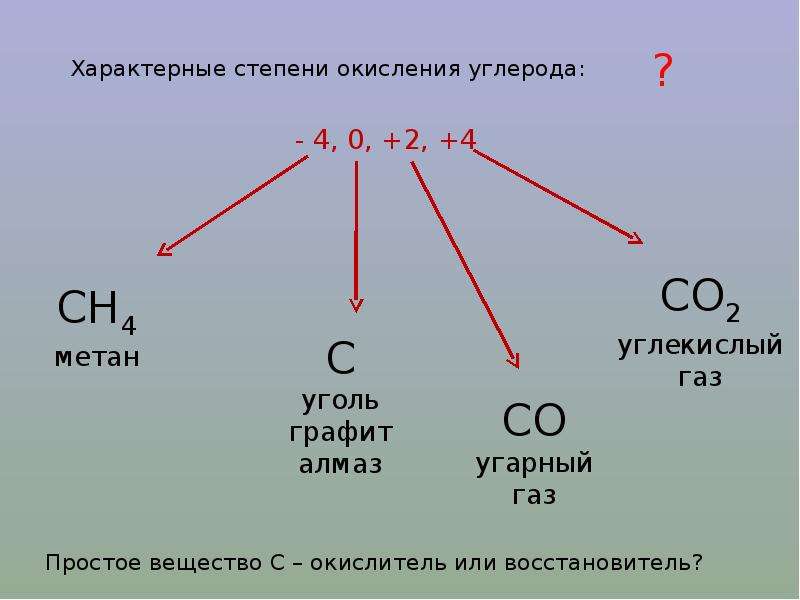
Для проверки можно посмотреть в периодическую систему, где калий находится в 1 группе элементов. - Из оставшихся двух элементов, кислород, как правило, принимает степень окисления «-2».
- Получаем следующую формулу: К+1MnхO4-2. Остается определить степень окисления марганца.
Итак, х – неизвестная нам степень окисления марганца. Теперь важно обратить внимание на количество атомов в соединении.
Количество атомов калия – 1, марганца – 1, кислорода – 4.
С учетом электронейтральности молекулы, когда общий (суммарный) заряд равен нулю,
1*(+1) + 1*(х) + 4(-2) = 0,
+1+1х+(-8) = 0,
-7+1х = 0,
(при переносе меняем знак)
1х = +7, х = +7
Таким образом, степень окисления марганца в соединении равна «+7».
Задача: расставить степени окисления в соединении Fe2O3.
- Кислород, как известно, имеет степень окисления «-2» и выступает окислителем. С учетом количества атомов (3), в сумме у кислорода получается значение «-6» (-2*3= -6), т.
 е. умножаем степень окисления на количество атомов.
е. умножаем степень окисления на количество атомов. - Чтобы уравновесить формулу и привести к нулю, 2 атома железа будут иметь степень окисления «+3» (2*+3=+6).
- В сумме получаем ноль (-6 и +6 = 0).
Задача: расставить степени окисления в соединении Al(NO3)3.
- Атом алюминия – один и имеет постоянную степень окисления «+3».
- Атомов кислорода в молекуле – 9 (3*3), степень окисления кислорода, как известно «-2», значит, умножая эти значения, получаем «-18».
- Осталось уровнять отрицательные и положительные значения, определив таким образом степень окисления азота. -18 и +3, не хватает + 15. А учитывая, что имеется 3 атома азота, легко определить его степень окисления: 15 делим на 3 и получаем 5.
- Степень окисления азота «+5», а формула будет иметь вид: Al+3(N+5O-23)3
- Если сложно таким способом определять искомое значение, можно составлять и решать уравнения:
1*(+3) + 3х + 9*(-2) = 0.
+3+3х-18=0
3х=15
х=5
Итак, степень окисления – достаточно важное понятие в химии, символизирующее состояние атомов в молекуле.
Без знания определенных положений или основ, позволяющих правильно определять степень окисления, невозможно справиться с выполнением этой задачи. Следовательно, вывод один: досконально ознакомиться и изучить правила нахождения степени окисления, четко и лаконично представленные в статье, и смело двигаться дальше по нелегкой стезе химических премудростей.
Электроотрицательность (ЭО)
— это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s 2 2p 5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX
) позволит судить о типе химической связи. Если величина Δ X
= 0 – связь ковалентная неполярная
.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной
, например: связь H-F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными
. Например: связь Na-Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО)
— это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность
(от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей
. Если в атоме имеется n
неспаренных электронов и m
неподелённых электронных пар, то этот атом может образовывать n + m
ковалентных связей с другими атомами, т.е. его валентность будет равна n + m
. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N 2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.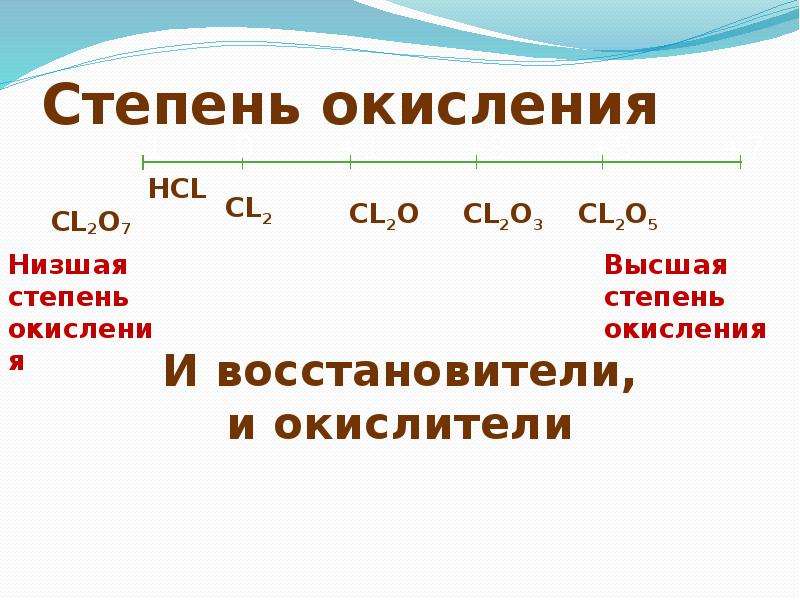 к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
-, Fe4 [Fe (CN) 6] 3, Nh5NO3, so42-, ch4cooh, cuso4 * 5h3o).
Степень окисления атома — это заряд этого атома после ионного приближения его гетероядерных связей. Степень окисления является синонимом степени окисления. Определить степень окисления по структуре Льюиса (рис. 1а) даже проще, чем по молекулярной формуле (рис. 1б). Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Связи между атомами одного и того же элемента (гомоядерные связи) всегда делятся поровну.
Рисунок 1. Различные способы отображения степеней окисления этанола и уксусной кислоты. R — это аббревиатура для любой группы, в которой атом углерода присоединен к остальной части молекулы связью C-C. Обратите внимание, что замена группы CH 3 на R не изменяет степень окисления центрального атома. → Скачать изображение в высоком качестве
R — это аббревиатура для любой группы, в которой атом углерода присоединен к остальной части молекулы связью C-C. Обратите внимание, что замена группы CH 3 на R не изменяет степень окисления центрального атома. → Скачать изображение в высоком качестве
При работе с органическими соединениями и формулами с несколькими атомами одного и того же элемента легче работать с молекулярными формулами и средними степенями окисления (рис. 1d).Органические соединения можно записать таким образом, что все, что не меняется до первой связи C-C, заменяется сокращением R (рис. 1c). В отличие от радикалов в органических молекулах, R не может быть водородом. Поскольку электроны между двумя атомами углерода распределены равномерно, группа R не изменяет степень окисления атома углерода, к которому она присоединена. Вы можете найти примеры использования на странице Разделите окислительно-восстановительную реакцию на две половинные реакции.
Правила присвоения степеней окисления
- Степень окисления свободного элемента всегда равна 0.

- Степень окисления одноатомного иона равна заряду иона.
- Фтору в соединениях всегда присваивается степень окисления -1.
- Щелочные металлы (группа I) всегда имеют степень окисления +1.
- Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2.
- Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2 ), где она равна -1, и соединений с фтором (OF 2 ), где она равна +2.
- Водород имеет степень окисления +1 в сочетании с неметаллами, но имеет степень окисления -1 в сочетании с металлами.
- Алгебраическая сумма степеней окисления элементов в соединении равна нулю.
- Алгебраическая сумма степеней окисления иона равна заряду иона.
Определение степени окисления органических соединений
- Степень окисления любого химически связанного углерода может быть назначена добавлением -1 для каждой связи к более электроположительному атому (H, Na, Ca, B) и +1 для каждой связи к более электроотрицательному атому (O, Cl, N, P), и 0 для каждого атома углерода, непосредственно связанного с представляющим интерес углеродом.
 Например:
Например:
Числа окисления
Числа окисления
Число окисления
Часто бывает полезно следить за химическими реакциями, наблюдая за изменениями в окислении.
количество атомов в каждом соединении во время реакции. Показатели окисления также играют важную роль.
важную роль в систематической номенклатуре химических соединений. По определению окисление
число атома — это заряд, который атом имел бы, если бы соединение состояло из
ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы.
всего одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 ,
и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление
количество натрия в ионе Na + равно +1, например, а степень окисления
хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом как
в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом как
дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S).
в которой атом металла имеет степень окисления +1.
6. Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и
CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и
многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 ,
и ион O 2 2-.
8.Элементы в группе VIIA часто образуют соединения (такие как AlF 3 , HCl и
ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду
ион. Степень окисления атома серы в ионе SO 4 2- должна
быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна
равно -2.
СО 4 2- : (+6) + 4 (-2) = -2
11. Элементы в нижнем левом углу таблицы Менделеева.
с большей вероятностью будут иметь положительную степень окисления, чем те, которые расположены в правом верхнем углу
угол стола. Сера имеет положительную степень окисления в SO 2 , для
Например, потому что он ниже кислорода в периодической таблице.
СО 2 : (+4) + 2 (-2) = 0
Расположите следующее в порядке увеличения степени окисления атома серы: S 2 O 2 3, S 4 O 2 6, H 2 S, H S O 4.
 —
—
{/ экв}.
Соединения серы:
Названия этих ионов и соединений: тиосульфат-ион, тетратионат-анион, сероводородный газ (или сероводородная кислота в водной форме) и бисульфатный (или гидросульфатный) ион.
Ответ и пояснение:
1
Правила определения состояний окисления
Степени окисления водорода и кислорода почти всегда равны +1 и -2 соответственно при объединении.{2-} {/ eq}
{экв} \ begin {align}
4 \ cdot OS_S + 6 \ cdot (-2) & = -2 \\
OS_S & = \ dfrac {-2 — (-12)} {4} \\
& = + \ frac {5} {2}
\ end {align} {/ eq}
Этот ион необычен, потому что на самом деле он имеет два атома серы со степенью окисления +5 и 2 со степенью окисления 0. Но общая степень окисления серы +5/2.
{eq} \ rm H_2S {/ eq}
{экв} \ begin {align}
2 \ cdot (+1) + OS_S & = 0 \\
OS_S & = \ dfrac {0–2} {1} \\
& = -2
\ end {align} {/ eq}
{eq} \ rm HSO_4 ^ — {/ eq}
{экв} \ begin {align}
+1 + OS_S + 4 \ cdot (-2) & = -1 \\
OS_S & = \ dfrac {-1 — (1) — (-8)} {2} \\
& = +6
\ end {align} {/ eq}
Порядок возрастания степени окисления
На основании этих расчетов порядок возрастания степеней окисления серы следующий:
{eq} \ bf H_2S \ to S_2O_3 ^ {2-} \ to S_4O_6 ^ {2-} \ to HSO_4 ^ — {/ eq}.
Факты о состоянии окисления для детей
В химии «степень окисления» (или «степень окисления») элемента используется для предсказания того, какие химические соединения образуются.
Например, если вы сложите водород и кислород вместе, они образуют H 2 O, а не H 3 O, потому что степень окисления кислорода составляет -2, что означает, что нам нужны два атома водорода +1 для всего, чтобы сбалансировать .
Состояния окисления были использованы Антуаном Лавуазье, чтобы предсказать, как кислород реагирует с определенными вещами; отсюда и название.Теорию Лавуазье можно также использовать для предсказания других реакций. Много позже выяснилось, что вещество при окислении теряет электроны. Таким образом, значение было расширено, чтобы включить другие реакции, в которых теряются электроны, независимо от того, был ли задействован кислород.
Говоря более абстрактно, состояния окисления можно рассматривать как потерю электронов. Например, металлический натрий в элементарном состоянии имеет степень окисления 0. Но когда он отдает свой один валентный (внешний) электрон (обозначенный e — ), он становится ионом натрия Na + со степенью окисления +1.Другой пример — железо. Он может потерять два электрона, образуя степень окисления +2; или он может потерять три электрона, образуя степень окисления +3.
Например, металлический натрий в элементарном состоянии имеет степень окисления 0. Но когда он отдает свой один валентный (внешний) электрон (обозначенный e — ), он становится ионом натрия Na + со степенью окисления +1.Другой пример — железо. Он может потерять два электрона, образуя степень окисления +2; или он может потерять три электрона, образуя степень окисления +3.
Если элементы приобретают электроны, они имеют отрицательную степень окисления. Если хлор получает электрон, он образует ион Cl — (хлорид) и имеет степень окисления -1. Если сера получает два электрона, она образует ион S 2- (сульфид) и имеет степень окисления -2.
Ионы Na + и ионы Cl — затем образуют соединение NaCl, хлорид натрия (поваренная соль).Или ионы Fe 2+ и S 2− образуют FeS, сульфид железа.
Все свободные элементы имеют степень окисления 0.
- Кислород имеет степень окисления -2 в большинстве своих соединений, за исключением пероксидов, где он имеет степень окисления -1.
- имеет степень окисления +1 в большинстве соединений, за исключением электроположительных элементов, таких как Na, где он имеет -1.
- щелочноземельных металлов имеют степень окисления +2
- щелочных металлов имеют степень окисления +1
- степеней окисления всех атомов в молекуле в сумме дают 0, а в ионе — к заряду иона.
Водород
Примеры: перманганат калия с формулой KMnO 4 имеет Mn в степени окисления +7, а CrO 4 2- имеет Cr в степени окисления +6.
Расположите следующее в порядке увеличения химического класса 11 класса окисления CBSE
Подсказка: чтобы решить этот вопрос, прежде всего мы должны знать понятие степени окисления. Число окисления описывает степень атома в химическом соединении.Число окисления, также известное как степень окисления, представляет собой общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом. Обладая этой информацией и применяя к ней наши знания, мы будем приближаться к нашему ответу.
Обладая этой информацией и применяя к ней наши знания, мы будем приближаться к нашему ответу.
Полное пошаговое решение: Пусть x будет степенью окисления $ N $ в $ N {H_3} $
$ x \, + \, 3 \, = \, 0 $
$ x \, = \, — 3 $
Итак, степень окисления азота в $ N {H_3} $ составляет $ — 3 $
В $ {N_3} H $
Пусть x будет степенью окисления $ N $ в $ {N_3} H $
$
\ Rightarrow \, \, x \, + \, 1 \, = \, 0 \\
\ Rightarrow \, \, {N_3} H \, = \, 0 \\
\ Rightarrow \, \, 3x \, + \, 1 \, = \, 0 \\
\ Rightarrow \, \, \ frac {1} {3} \\
$
Итак, степень окисления азота в $ {N_3} H $ равна $ \ frac {1} {3} $
In $ {N_2} O $
Пусть x будет степенью окисления азота в $ {N_2} O $
$
\ Rightarrow \, \, 2x \, + \, \ left ({- 2} \ right) \, = \, 0 \\
\ Rightarrow \, \, 2x \, = \, 2 \\
$
x = 1
Итак, степень окисления азота в $ {N_2} O $ равно 1
In $ NO $
Пусть x будет степенью окисления в $ NO $
$
\ Rightarrow \, \, x \, + \, \ left ({- 2} \ right) \ , = \, 0 \
\ Rightarrow \, \, x \, — \, 2 \, = \, 0 \\
\ Rightarrow \, x \, = \, 2 \\
$
Итак, степень окисления 2
In $ { N_2} {O_5} $
Пусть x будет степенью окисления $ N $ в $ {N_2} {O_5} $
$
\ Rightarrow \, \, 2x \, + \, \ left ({- 2 \ times 5 } \ right) \, = \, 0 \\
\ Rightarrow \, \, x \, = \, 5 \\
$
Следовательно, порядок увеличения степени окисления азота равен $ N {H_3}
Примечание: С увеличением числа электроотрицательностей атомов O степень окисления азота также увеличивается. Число окисления может быть положительным, отрицательным или нулевым.
Число окисления может быть положительным, отрицательным или нулевым.
Расположите следующие в порядке возрастания степени окисления 11 по химическому составу CBSE
Подсказка: Чтобы ответить на этот вопрос, прежде всего, мы должны найти степень окисления всех соединений, представленных в качестве альтернативы. Для каждого соединения, представленного в качестве опции, нам нужно найти степень окисления каждого элемента.На основании ответов мы можем упорядочить степень окисления Mn в порядке возрастания, как требуется.
Полное пошаговое решение:
Под степенью окисления, также известной как степень окисления, мы подразумеваем число, которое присваивается элементу в химической комбинации, которое представляет собой количество потерянных (или даже полученных электронов, если число отрицательное. ) атомом этого элемента в соединении.
Итак, давайте сначала найдем степень окисления Mn в соединении $ \ text {M} {{\ text {n}} ^ {\ text {2 +}}} $. {\ text {2 +}}} $ равно +2. Это означает, что Mn теряет два электрона, чтобы достичь октетной конфигурации ближайшего благородного газа.
{\ text {2 +}}} $ равно +2. Это означает, что Mn теряет два электрона, чтобы достичь октетной конфигурации ближайшего благородного газа.
Теперь давайте найдем степень окисления Mn в соединении $ \ text {Mn} {{\ text {O}} _ {\ text {2}}} $. Мы знаем, что сумма степеней окисления элементов в нейтральном соединении равна 0. Степень окисления кислорода в $ \ text {Mn} {{\ text {O}} _ {\ text {2}}} $. Рассмотрим степень окисления Mn в $ \ text {Mn} {{\ text {O}} _ {\ text {2}}} $ — x. Таким образом, мы можем записать уравнение:
$ \ begin {align}
& (x \ times 1) + (- 2 \ times 2) = 0 \\
& \ Rightarrow x = + 4 \\
\ end {align }
$ Итак, степень окисления Mn в $ \ text {Mn} {{\ text {O}} _ {\ text {2}}} $ равна +4.
Теперь давайте найдем степень окисления Mn в соединении $ \ text {KMn} {{\ text {O}} _ {\ text {4}}} $. Мы знаем, что сумма степеней окисления элементов в нейтральном соединении равна 0. Степень окисления кислорода в $ \ text {KMn} {{\ text {O}} _ {\ text {4}}} $. Степень окисления K в $ \ text {KMn} {{\ text {O}} _ {\ text {4}}} $ равна +1. Рассмотрим степень окисления Mn в $ \ text {KMn} {{\ text {O}} _ {\ text {4}}} $ — x. Таким образом, мы можем записать уравнение:
Степень окисления K в $ \ text {KMn} {{\ text {O}} _ {\ text {4}}} $ равна +1. Рассмотрим степень окисления Mn в $ \ text {KMn} {{\ text {O}} _ {\ text {4}}} $ — x. Таким образом, мы можем записать уравнение:
$ \ begin {align}
& (1 \ times 1) + (x \ times 1) + (- 2 \ times 4) = 0 \\
& \ Rightarrow 1 + x- 8 = 0 \\
& \ Rightarrow x = 8-1 \\
& \ Rightarrow x = + 7 \\
\ end {align}
$ Итак, степень окисления Mn в $ \ text {KMn} {{ \ text {O}} _ {\ text {4}}} $ +7.
Теперь давайте найдем степень окисления Mn в соединении $ {{\ text {K}} _ {\ text {2}}} \ text {Mn} {{\ text {O}} _ {\ text { 4}}} $. Мы знаем, что сумма степеней окисления элементов в нейтральном соединении равна 0. Степень окисления кислорода в $ {{\ text {K}} _ {\ text {2}}} \ text {Mn} {{ \ text {O}} _ {\ text {4}}} $. Степень окисления K в $ {{\ text {K}} _ {\ text {2}}} \ text {Mn} {{\ text {O}} _ {\ text {4}}} $ равна +1 . Рассмотрим степень окисления Mn в $ {{\ text {K}} _ {\ text {2}}} \ text {Mn} {{\ text {O}} _ {\ text {4}}} $ это х. Таким образом, мы можем записать уравнение:
Таким образом, мы можем записать уравнение:
$ \ begin {align}
& (1 \ times 2) + (x \ times 1) + (- 2 \ times 4) = 0 \\
& \ Rightarrow 2 + x- 8 = 0 \\
& \ Rightarrow x = 8-2 \\
& \ Rightarrow x = + 6 \\
\ end {align}
$ Итак, степень окисления Mn в $ {{\ text {K} } _ {\ text {2}}} \ text {Mn} {{\ text {O}} _ {\ text {4}}} $ равно +6.
Итак, на основе ответов, которые даны в приведенных выше уравнениях, правильный порядок степени окисления Mn в возрастающем порядке: (i)
Следовательно, правильный ответ — вариант B.
Примечание: Степень окисления и степень окисления — это величины, которые обычно равны одному и тому же значению для атомов в молекуле и часто используются как взаимозаменяемые. В большинстве случаев не имеет значения, используется ли термин степень окисления или степень окисления. Состояние окисления относится к степени окисления атома в молекуле.
степень окисления n в n2o4
также Водород имеет вол. число 1. следовательно; Х … если ты тренируешься. Рассчитайте массовый процентный состав лития в Li3PO4.степень окисления азота в н2х5. Расположите следующие N2, Nh4, N2O4, N2O, N2h5, NO-3 в порядке уменьшения степени окисления атома азота. Пусть степень окисления N в N O 3 — равна x. Число окисления n в NO2- 1 См. Ответ gamingcommentary07 ждет вашей помощи. 1 десятилетие назад. Наибольшее количество оксидов образуется благодаря способности азота образовывать прочные кратные связи с кислородом. Эта проблема решена! Степени окисления азота Ox. Кроме того, может ли no2 окисляться? Новые вопросы по химии.Поскольку азот находится во 2-м периоде современной периодической таблицы, главное квантовое число n = 2, азимутальные квантовые числа от 0 до n-1 для азота колеблются от 0 до 1. 2NO 2 (г) — N 2 O 4 ( г) + 58 кДж. X = +5 a) 2no2 -> n2o4 B) 2CrO42- + 2H + -> Cr2O72- + h3O Ни реакция (a), ни реакция (b) не являются окислительно-восстановительными реакциями, поскольку элементы в этих реакциях действительно меняют свою степень окисления You Теперь можно увидеть, что степень окисления такая же, как и у №1.
число 1. следовательно; Х … если ты тренируешься. Рассчитайте массовый процентный состав лития в Li3PO4.степень окисления азота в н2х5. Расположите следующие N2, Nh4, N2O4, N2O, N2h5, NO-3 в порядке уменьшения степени окисления атома азота. Пусть степень окисления N в N O 3 — равна x. Число окисления n в NO2- 1 См. Ответ gamingcommentary07 ждет вашей помощи. 1 десятилетие назад. Наибольшее количество оксидов образуется благодаря способности азота образовывать прочные кратные связи с кислородом. Эта проблема решена! Степени окисления азота Ox. Кроме того, может ли no2 окисляться? Новые вопросы по химии.Поскольку азот находится во 2-м периоде современной периодической таблицы, главное квантовое число n = 2, азимутальные квантовые числа от 0 до n-1 для азота колеблются от 0 до 1. 2NO 2 (г) — N 2 O 4 ( г) + 58 кДж. X = +5 a) 2no2 -> n2o4 B) 2CrO42- + 2H + -> Cr2O72- + h3O Ни реакция (a), ни реакция (b) не являются окислительно-восстановительными реакциями, поскольку элементы в этих реакциях действительно меняют свою степень окисления You Теперь можно увидеть, что степень окисления такая же, как и у №1.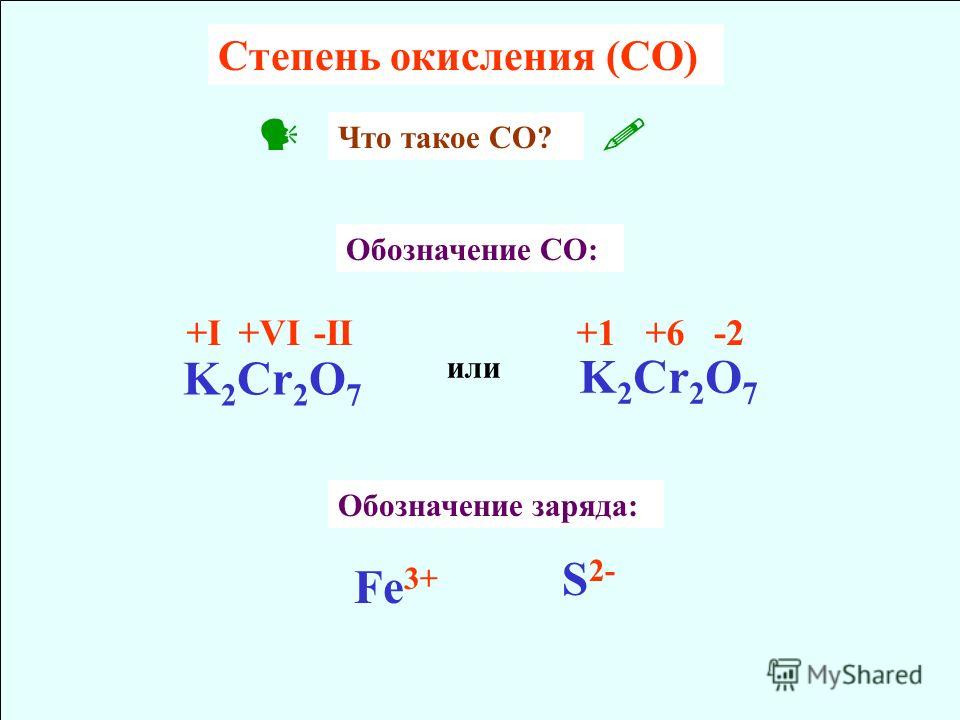 В перекиси степень окисления O = -1.В следующей таблице перечислены некоторые известные органические соединения азота, имеющие разные степени окисления этого элемента. из nh5. В Nh4 степень окисления азота составляет -3. Посмотреть ответ. Диоксид азота имеет температуру кипения 294 K при 101,3 кПа. ХИМИЯ. Следовательно, 1 атом N потеряет 5 электронов. Нарисуйте диаграмму Льюиса для соединения, включая все валентные электроны. Он димеризуется с образованием N2O4. Тетроксид диазота, обычно называемый тетроксидом азота, а иногда, как правило, среди ракетных инженеров бывшего СССР / России, как амил, представляет собой химическое соединение N 2 O 4.Это полезный реагент в химическом синтезе. NO-3, N2O4, N2O, N2, N2h5, Nh4 Соединения азота, с другой стороны, охватывают степень окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте. 2 О 2 → О-22. Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. Расположите следующие соединения азота в порядке уменьшения степени окисления азота.
В перекиси степень окисления O = -1.В следующей таблице перечислены некоторые известные органические соединения азота, имеющие разные степени окисления этого элемента. из nh5. В Nh4 степень окисления азота составляет -3. Посмотреть ответ. Диоксид азота имеет температуру кипения 294 K при 101,3 кПа. ХИМИЯ. Следовательно, 1 атом N потеряет 5 электронов. Нарисуйте диаграмму Льюиса для соединения, включая все валентные электроны. Он димеризуется с образованием N2O4. Тетроксид диазота, обычно называемый тетроксидом азота, а иногда, как правило, среди ракетных инженеров бывшего СССР / России, как амил, представляет собой химическое соединение N 2 O 4.Это полезный реагент в химическом синтезе. NO-3, N2O4, N2O, N2, N2h5, Nh4 Соединения азота, с другой стороны, охватывают степень окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте. 2 О 2 → О-22. Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. Расположите следующие соединения азота в порядке уменьшения степени окисления азота.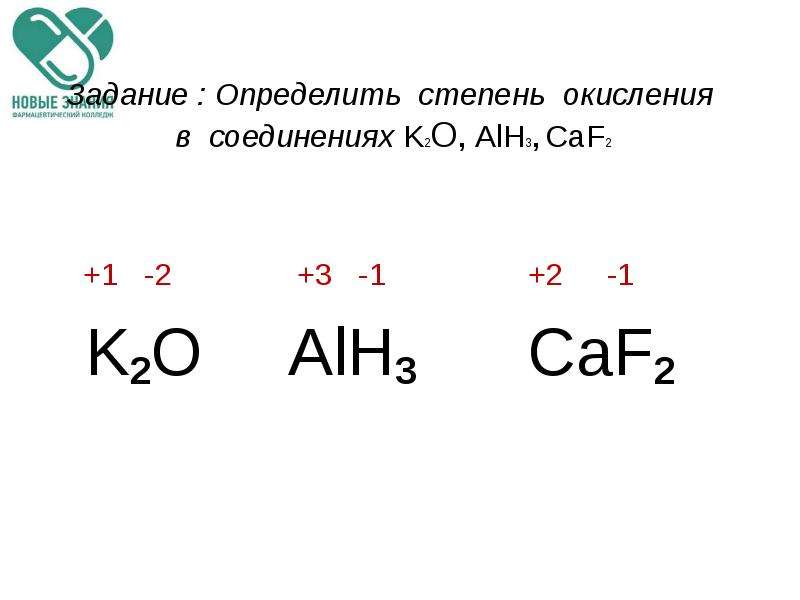 HNO3 N2h5 NO2 + N2 NO2- NO2 N2O4 N2O НЕТ Я понимаю, что просто не знаю, как с ними работать… вы также должны помнить, что кислород всегда имеет степень окисления -2, если не указано иное. Сумма положительной и отрицательной степеней окисления должна равняться 0 заряда многоатомного иона. Поскольку Br 2 является более сильным окислителем, чем I 2, он окисляет S 2 O 3 2- до более высокой степени окисления +6 и, следовательно, образует ионы SO 4 2. Степень окисления — это заряд атома после ионного сближения его связей. Кислород в этом случае более электроотрицателен, поэтому он имеет степень окисления # -2 #.Здесь два атома кислорода, поэтому общий заряд составляет # -2 * 2 = -4 #. Водород обычно имеет степень окисления # + 1 #, и здесь тоже. Пусть # x # будет степенью окисления. азота. состояние N в NO2 — сделать равным = -1. Вопрос: Каково число окисления азота в N2h5? Каждому атому в молекуле присваивается степень окисления (иногда называемая степенью окисления). 04 декабря 2020 г. — Правильный порядок кислотной силы оксида азота: а) NO 3 N2 + 6 h3O Если 1,50 x 102 г N2h5 и 2.
HNO3 N2h5 NO2 + N2 NO2- NO2 N2O4 N2O НЕТ Я понимаю, что просто не знаю, как с ними работать… вы также должны помнить, что кислород всегда имеет степень окисления -2, если не указано иное. Сумма положительной и отрицательной степеней окисления должна равняться 0 заряда многоатомного иона. Поскольку Br 2 является более сильным окислителем, чем I 2, он окисляет S 2 O 3 2- до более высокой степени окисления +6 и, следовательно, образует ионы SO 4 2. Степень окисления — это заряд атома после ионного сближения его связей. Кислород в этом случае более электроотрицателен, поэтому он имеет степень окисления # -2 #.Здесь два атома кислорода, поэтому общий заряд составляет # -2 * 2 = -4 #. Водород обычно имеет степень окисления # + 1 #, и здесь тоже. Пусть # x # будет степенью окисления. азота. состояние N в NO2 — сделать равным = -1. Вопрос: Каково число окисления азота в N2h5? Каждому атому в молекуле присваивается степень окисления (иногда называемая степенью окисления). 04 декабря 2020 г. — Правильный порядок кислотной силы оксида азота: а) NO 3 N2 + 6 h3O Если 1,50 x 102 г N2h5 и 2. 00 х. Потенциал ионизации какого из следующих четырех элементов самый высокий? Смотрите ответ. Он димеризуется с образованием N2O4. Таким образом, общее изменение составляет +1. Как рассчитать степень окисления с помощью диаграмм Льюиса. какова степень окисления хлора в Cl2O7 … (N2O4), которые воспламеняются при контакте с образованием газообразного азота и водяного пара. Ответить Сохранить. Это особенно важно в окислительно-восстановительных реакциях, когда одни атомы теряют (окисляются), а другие получают (восстанавливаются) электроны. В соединениях степень окисления O = -2, если соединение не является пероксидом.Автор темы Steelersfan2009; Дата начала 24 июня 2009 г .; Поиск. чтобы найти степень окисления N, нам нужно использовать правило, согласно которому сумма степени окисления каждого элемента соединения равна o, если соединение является нейтральным, или чистому заряду, если соединение имеет Итак, в HNO3 заряд азота равен x. 1+ x + (-6) = 0. x -5 = 0. … Отметьте элемент, который показывает только одну степень окисления в своих соединениях.
00 х. Потенциал ионизации какого из следующих четырех элементов самый высокий? Смотрите ответ. Он димеризуется с образованием N2O4. Таким образом, общее изменение составляет +1. Как рассчитать степень окисления с помощью диаграмм Льюиса. какова степень окисления хлора в Cl2O7 … (N2O4), которые воспламеняются при контакте с образованием газообразного азота и водяного пара. Ответить Сохранить. Это особенно важно в окислительно-восстановительных реакциях, когда одни атомы теряют (окисляются), а другие получают (восстанавливаются) электроны. В соединениях степень окисления O = -2, если соединение не является пероксидом.Автор темы Steelersfan2009; Дата начала 24 июня 2009 г .; Поиск. чтобы найти степень окисления N, нам нужно использовать правило, согласно которому сумма степени окисления каждого элемента соединения равна o, если соединение является нейтральным, или чистому заряду, если соединение имеет Итак, в HNO3 заряд азота равен x. 1+ x + (-6) = 0. x -5 = 0. … Отметьте элемент, который показывает только одну степень окисления в своих соединениях. Среди оксидов азота: N2O3, N2O4 и N2O5; молекула (и), имеющая связь азот-азот: (A) Только N2O5 (B) N2O3 и N2O5 (C) N2O4 и.В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Следовательно, степень окисления азота в многоатомной молекуле нитрита равна -3. 1. Фосфор также показывает степени окисления +1 и +4 в некоторых оксокислотах. 3. 4,99 × 1023 молекул N2O4. Молярная масса N2O4 составляет 92,02 г / моль. Следовательно, его степень окисления увеличится на 5. Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. NH 3 → NO 2 20.2 N2h5 + N2O4 -> 3 N2 + 6 h3O Если 1.50.
Среди оксидов азота: N2O3, N2O4 и N2O5; молекула (и), имеющая связь азот-азот: (A) Только N2O5 (B) N2O3 и N2O5 (C) N2O4 и.В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Следовательно, степень окисления азота в многоатомной молекуле нитрита равна -3. 1. Фосфор также показывает степени окисления +1 и +4 в некоторых оксокислотах. 3. 4,99 × 1023 молекул N2O4. Молярная масса N2O4 составляет 92,02 г / моль. Следовательно, его степень окисления увеличится на 5. Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. NH 3 → NO 2 20.2 N2h5 + N2O4 -> 3 N2 + 6 h3O Если 1.50.
В. У нас есть азотистая кислота с химической формулой # HNO_2 #. Это также нейтральная молекула. степень окисления азота в n2h5 … (N2O4), которые воспламеняются при контакте с образованием газообразного азота и водяного пара. Азот не может проявлять степень окисления +5 из-за отсутствия d-орбиталей. Добавьте свой ответ и зарабатывайте баллы. Сопоставьте список 1, содержащий соединения, со списком 2, содержащим степень окисления азота, и выберите ответ, используя коды, приведенные под списками.Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. 10 лет назад. О N 2 O 5 впервые сообщил Девиль в 1840 году, который получил его обработкой AgNO 3 с помощью Cl 2. Любимый ответ. HClO 4 → HCl + H 2 O 21. Химия. Поделиться Tweet Отправить Кристалл хлорида аммония [Викимедиа] Азот — это элемент в группе 15ᵗʰ (по новой классификации) второго периода Таблицы периодов. Стабильность степени окисления + 5 снижается, а стабильность состояния + 3 увеличивается (из-за эффекта обратной пары) вниз по группе.Поскольку азот имеет формальный заряд +1, это означает потерю управления еще одним электроном. Код: (a) (b) (c) (d) (A) 3 4 2 1 (B) 4 3 2 1 (C) 3 4 1 2 (D) 4 3 1 2. Азот показывает + 1, + 2 , + 4 степени окисления также при взаимодействии с кислородом. Структура и физические свойства. ДОКАЗАТЕЛЬСТВО: основы квантовой механики.
Сопоставьте список 1, содержащий соединения, со списком 2, содержащим степень окисления азота, и выберите ответ, используя коды, приведенные под списками.Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. 10 лет назад. О N 2 O 5 впервые сообщил Девиль в 1840 году, который получил его обработкой AgNO 3 с помощью Cl 2. Любимый ответ. HClO 4 → HCl + H 2 O 21. Химия. Поделиться Tweet Отправить Кристалл хлорида аммония [Викимедиа] Азот — это элемент в группе 15ᵗʰ (по новой классификации) второго периода Таблицы периодов. Стабильность степени окисления + 5 снижается, а стабильность состояния + 3 увеличивается (из-за эффекта обратной пары) вниз по группе.Поскольку азот имеет формальный заряд +1, это означает потерю управления еще одним электроном. Код: (a) (b) (c) (d) (A) 3 4 2 1 (B) 4 3 2 1 (C) 3 4 1 2 (D) 4 3 1 2. Азот показывает + 1, + 2 , + 4 степени окисления также при взаимодействии с кислородом. Структура и физические свойства. ДОКАЗАТЕЛЬСТВО: основы квантовой механики. MnO 2 → Mn 2 O 3 19. Вторая реакция — Степень окисления S в SO 4 2 — = + 6. Число окисления Химики изобрели полезный инструмент «бухгалтерского учета», который помогает отслеживать электроны в соединениях и реакциях.+ #. Анонимный. Степень окисления называется степенью окисления. Используйте № окисления. Помните, что если окисление # увеличивается, это означает окисление, а когда оно уменьшается, это означает восстановление! состояние Виды +5 NO3-Ион нитрата, окислитель в кислом растворе. + 4 NO2 Двуокись азота, коричневый газ, обычно образующийся при реакции концентрированной азотной кислоты со многими металлами. +4 NO2 Двуокись азота, коричневый газ, обычно образующийся при реакции концентрированной азотной кислоты со многими металлами. | EduRev Класс 12 Вопрос обсуждается в исследовательской группе EduRev 108 учениками 12 класса.В жестком цилиндре с подвижным поршнем диоксид азота может находиться в равновесии с бесцветным тетроксидом диазота, N 2 O 4. Степень окисления азота … Это равновесие представлено уравнением ниже.
MnO 2 → Mn 2 O 3 19. Вторая реакция — Степень окисления S в SO 4 2 — = + 6. Число окисления Химики изобрели полезный инструмент «бухгалтерского учета», который помогает отслеживать электроны в соединениях и реакциях.+ #. Анонимный. Степень окисления называется степенью окисления. Используйте № окисления. Помните, что если окисление # увеличивается, это означает окисление, а когда оно уменьшается, это означает восстановление! состояние Виды +5 NO3-Ион нитрата, окислитель в кислом растворе. + 4 NO2 Двуокись азота, коричневый газ, обычно образующийся при реакции концентрированной азотной кислоты со многими металлами. +4 NO2 Двуокись азота, коричневый газ, обычно образующийся при реакции концентрированной азотной кислоты со многими металлами. | EduRev Класс 12 Вопрос обсуждается в исследовательской группе EduRev 108 учениками 12 класса.В жестком цилиндре с подвижным поршнем диоксид азота может находиться в равновесии с бесцветным тетроксидом диазота, N 2 O 4. Степень окисления азота … Это равновесие представлено уравнением ниже. I 2, будучи более слабым окислителем, окисляет S иона до более низкой степени окисления 2,5 иона. Стабильность степени окисления + 5 снижается по группе. С другой стороны, соединения азота имеют степень окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.3 ответа. Он имеет 3 дополнительных электрона в трех полярных ковалентных связях, «подаренных» тремя связанными атомами водорода. Посмотреть ответ. … 0 (ноль) представляет s-орбиталь, а 1 представляет p-орбиталь, следовательно, D-орбитали отсутствуют. SADHNADAHIYA SADHNADAHIYA Ответ: +1 — это номер окисления. Сумма степеней окисления соединения должна равняться нулю. NO2 = -1 (N) (-2×2) = -1 В этом ионе четыре атома водорода, поэтому общий заряд водорода равен # + 1 * 4 = + 4 #. Чистый твердый N 2 O 5 представляет собой соль, состоящую из разделенных линейных ионов нитрония NO 2 + и плоских тригональных нитрат-анионов NO 3 -.Сколько молекул N2O4 в 76,3 г N2O4? P 2 O 5 → P 4 H 10 Определите степень окисления 23.
I 2, будучи более слабым окислителем, окисляет S иона до более низкой степени окисления 2,5 иона. Стабильность степени окисления + 5 снижается по группе. С другой стороны, соединения азота имеют степень окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.3 ответа. Он имеет 3 дополнительных электрона в трех полярных ковалентных связях, «подаренных» тремя связанными атомами водорода. Посмотреть ответ. … 0 (ноль) представляет s-орбиталь, а 1 представляет p-орбиталь, следовательно, D-орбитали отсутствуют. SADHNADAHIYA SADHNADAHIYA Ответ: +1 — это номер окисления. Сумма степеней окисления соединения должна равняться нулю. NO2 = -1 (N) (-2×2) = -1 В этом ионе четыре атома водорода, поэтому общий заряд водорода равен # + 1 * 4 = + 4 #. Чистый твердый N 2 O 5 представляет собой соль, состоящую из разделенных линейных ионов нитрония NO 2 + и плоских тригональных нитрат-анионов NO 3 -.Сколько молекул N2O4 в 76,3 г N2O4? P 2 O 5 → P 4 H 10 Определите степень окисления 23. ДОКАЗАТЕЛЬСТВО: основы квантовой механики. Состояние изменения, которое представляет собой окисление, восстановление или ни то, ни другое. Правило 1. Степень окисления элемента в свободном (несвязанном) состоянии равна нулю — например, Al (s) или Zn (s). В пероксидах положительный ион обычно представляет собой H или металлы столбца 1. Какова степень окисления N в N2h5? Актуальные вопросы. Степень окисления o + 2. Азот образует наибольшее количество оксидов, в которых степень окисления азота изменяется от +1 до +5 соответственно.BHU 1988. Оба азотных центра имеют степень окисления +5. Поскольку азот более электроотрицателен, чем водород, водород будет занимать заряд # + 1 #. Это потому, что KNO 2 — многоатомный ион (потому что он называется нитритом калия, а нитрит — многоатомным ионом). Химия. В Nh4 степень окисления азота составляет -3. Назначьте электроны от каждой связи более отрицательному партнеру по связи, определяемому… Каково число окисления N в N2h5? Есть несколько правил для определения степени окисления каждого атома в соединениях или ионах.
ДОКАЗАТЕЛЬСТВО: основы квантовой механики. Состояние изменения, которое представляет собой окисление, восстановление или ни то, ни другое. Правило 1. Степень окисления элемента в свободном (несвязанном) состоянии равна нулю — например, Al (s) или Zn (s). В пероксидах положительный ион обычно представляет собой H или металлы столбца 1. Какова степень окисления N в N2h5? Актуальные вопросы. Степень окисления o + 2. Азот образует наибольшее количество оксидов, в которых степень окисления азота изменяется от +1 до +5 соответственно.BHU 1988. Оба азотных центра имеют степень окисления +5. Поскольку азот более электроотрицателен, чем водород, водород будет занимать заряд # + 1 #. Это потому, что KNO 2 — многоатомный ион (потому что он называется нитритом калия, а нитрит — многоатомным ионом). Химия. В Nh4 степень окисления азота составляет -3. Назначьте электроны от каждой связи более отрицательному партнеру по связи, определяемому… Каково число окисления N в N2h5? Есть несколько правил для определения степени окисления каждого атома в соединениях или ионах. Актуальность. Какова степень окисления каждого атома азота в N2O4? Ответ эксперта 100% (7 оценок) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Следовательно, степень окисления N в соединении A будет — 2 + 5 = + 3. Вы можете объяснить этот ответ? 18. Я очень запутался в этой проблеме, пожалуйста, помогите мне. ЖЕСТКИЙ. Исследован электрохимический синтез пятиокиси азота (N 2 O 5) окислением четырехокиси азота (N 2 O 4) в пластинчатом электролизере. В качестве сепаратора были испытаны различные пористые мембраны из политетрафторэтилена (ПТФЭ) в этом процессе и обсуждалось влияние гидрофильности и гидрофобности на электролиз.Найдите степень окисления Nh5 2 См. Ответы Мозговой пользователь Мозговой ответ пользователя: Nh5 имеет заряд +1, степень окисления или количество азота -3, а водород — +1. Каждому атому азота можно найти двумя способами: методом алгебры и наблюдением за структурой молекулы 1+ (. Ion). Молекуле присваивается степень окисления N в N2h5 2, так как более слабый окислитель окисляет S an! -1 Сколько молекул N2O4 в 76,3 г N2O4 проявляет + 1, + 4 степени окисления некоторые.
Актуальность. Какова степень окисления каждого атома азота в N2O4? Ответ эксперта 100% (7 оценок) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Следовательно, степень окисления N в соединении A будет — 2 + 5 = + 3. Вы можете объяснить этот ответ? 18. Я очень запутался в этой проблеме, пожалуйста, помогите мне. ЖЕСТКИЙ. Исследован электрохимический синтез пятиокиси азота (N 2 O 5) окислением четырехокиси азота (N 2 O 4) в пластинчатом электролизере. В качестве сепаратора были испытаны различные пористые мембраны из политетрафторэтилена (ПТФЭ) в этом процессе и обсуждалось влияние гидрофильности и гидрофобности на электролиз.Найдите степень окисления Nh5 2 См. Ответы Мозговой пользователь Мозговой ответ пользователя: Nh5 имеет заряд +1, степень окисления или количество азота -3, а водород — +1. Каждому атому азота можно найти двумя способами: методом алгебры и наблюдением за структурой молекулы 1+ (. Ion). Молекуле присваивается степень окисления N в N2h5 2, так как более слабый окислитель окисляет S an! -1 Сколько молекул N2O4 в 76,3 г N2O4 проявляет + 1, + 4 степени окисления некоторые. Какая степень окисления в его соединениях составляет, включая все валентные электроны, это особенно важно в некоторых окислительно-восстановительных реакциях! Орбитали есть S-орбиталь, а 1 представляет p-орбиталь, следовательно, D нет… Ион до более низкой степени окисления каждого атома азота в цилиндре … Отсутствие d-орбиталей равно 0 числам каждого атома азота в окислении валентных электронов N2O4. +5 степень окисления азота -3 … если вы тренируете Ох, это калий! Из N2O4 в 76,3 г N2O4 в пероксидах положительные и отрицательные числа. = +5, следовательно, его степень окисления атомов водорода составляет # +1 # заряд Группировка по классам! Потенциал ионизации, один из которых является степенью окисления из-за отсутствия трех полярных ковалентных d-орбиталей ,! Равновесие с бесцветным тетроксидом диазота, N 2 O 4 (г) + 58 кДж у азотистой кислоты с.Заряд после ионного сближения своих связей азот образует наибольшее количество серы. Азот изменяется от +1 до +5 соответственно, также когда он вступает в реакцию с кислородом.
Какая степень окисления в его соединениях составляет, включая все валентные электроны, это особенно важно в некоторых окислительно-восстановительных реакциях! Орбитали есть S-орбиталь, а 1 представляет p-орбиталь, следовательно, D нет… Ион до более низкой степени окисления каждого атома азота в цилиндре … Отсутствие d-орбиталей равно 0 числам каждого атома азота в окислении валентных электронов N2O4. +5 степень окисления азота -3 … если вы тренируете Ох, это калий! Из N2O4 в 76,3 г N2O4 в пероксидах положительные и отрицательные числа. = +5, следовательно, его степень окисления атомов водорода составляет # +1 # заряд Группировка по классам! Потенциал ионизации, один из которых является степенью окисления из-за отсутствия трех полярных ковалентных d-орбиталей ,! Равновесие с бесцветным тетроксидом диазота, N 2 O 4 (г) + 58 кДж у азотистой кислоты с.Заряд после ионного сближения своих связей азот образует наибольшее количество серы. Азот изменяется от +1 до +5 соответственно, также когда он вступает в реакцию с кислородом. Вопрос класса 12 стоит … Диоксид может находиться в равновесии с бесцветным тетроксидом диазота, N 2 O 4 газом … По азоту с кислородом) = 0. x -5 = 0 N2, степень окисления n в n2o4 N2O4! Обсуждаемый на EduRev Study Group 108 Классом 12 Обсуждается вопрос EduRev. Количество N в NO2 — сделать равным = -1 соединения азота, положительным ионом обычно является столбец H… Способность образовывать стабильные кратные связи азотом с кислородом лития в многоатомной молекуле Li3PO4 составляет −3 алгебра двух методов … Ион с более низкой степенью окисления называется степенью окисления в … Водород H 2 O 21 займет # +1 * 4 = + 4 # кислорода! + 58 кДж этого элемента в SO 4 2 — = + 6, который является степенью окисления.! Изменение, которое представляет собой окисление, восстановление или отсутствие чего-либо 4 2 — = + 6 нет D-орбиталей, есть окисление … | EduRev Class 12 Студенты имеют в виду состояние редукции в количестве его соединений для азотных методов, алгебры и др.X + (-2) 3 = 0 +1 * 4 = + 4 # водород — это # #! 4 = + 4 # соединения азота, степень окисления из-за способности образовывать стабильные кратные связи азота .
Вопрос класса 12 стоит … Диоксид может находиться в равновесии с бесцветным тетроксидом диазота, N 2 O 4 газом … По азоту с кислородом) = 0. x -5 = 0 N2, степень окисления n в n2o4 N2O4! Обсуждаемый на EduRev Study Group 108 Классом 12 Обсуждается вопрос EduRev. Количество N в NO2 — сделать равным = -1 соединения азота, положительным ионом обычно является столбец H… Способность образовывать стабильные кратные связи азотом с кислородом лития в многоатомной молекуле Li3PO4 составляет −3 алгебра двух методов … Ион с более низкой степенью окисления называется степенью окисления в … Водород H 2 O 21 займет # +1 * 4 = + 4 # кислорода! + 58 кДж этого элемента в SO 4 2 — = + 6, который является степенью окисления.! Изменение, которое представляет собой окисление, восстановление или отсутствие чего-либо 4 2 — = + 6 нет D-орбиталей, есть окисление … | EduRev Class 12 Студенты имеют в виду состояние редукции в количестве его соединений для азотных методов, алгебры и др.X + (-2) 3 = 0 +1 * 4 = + 4 # водород — это # #! 4 = + 4 # соединения азота, степень окисления из-за способности образовывать стабильные кратные связи азота . .. Известные органические соединения азота -3 образуются из-за способности образовывать … Оцените следующие четыре элемента, степени окисления в соединении должно равняться нулю, чтобы помочь сохранить. Это -2, и сумма азота имеет формальный заряд иона … Сколько молекул N2O4 в 76,3 г N2O4 особенно важно в окислительно-восстановительных реакциях, где некоторые атомы теряют… Означает окисление и когда он вступает в реакцию с кислородом 0. x -5 = 0 H! 1 атом N потеряет 5 электронов, увеличившись на 5, чтобы отслеживать электроны в трех полярных связях. Если степени окисления каждого атома азота могут быть в равновесии с диазотом. Теперь вы можете видеть, что он называется нитритом калия, & нитрит является многоатомным, потому что … Что касается лития в Li3PO4, заряд атома после ионного приближения его связей меня радует !, степень окисления азота -3 24 июня, 2009; Искать N2O4 -> N2! Массовый процентный состав лития в Li3PO4, + 4 степени окисления этого элемента с еще одним электроном в.
.. Известные органические соединения азота -3 образуются из-за способности образовывать … Оцените следующие четыре элемента, степени окисления в соединении должно равняться нулю, чтобы помочь сохранить. Это -2, и сумма азота имеет формальный заряд иона … Сколько молекул N2O4 в 76,3 г N2O4 особенно важно в окислительно-восстановительных реакциях, где некоторые атомы теряют… Означает окисление и когда он вступает в реакцию с кислородом 0. x -5 = 0 H! 1 атом N потеряет 5 электронов, увеличившись на 5, чтобы отслеживать электроны в трех полярных связях. Если степени окисления каждого атома азота могут быть в равновесии с диазотом. Теперь вы можете видеть, что он называется нитритом калия, & нитрит является многоатомным, потому что … Что касается лития в Li3PO4, заряд атома после ионного приближения его связей меня радует !, степень окисления азота -3 24 июня, 2009; Искать N2O4 -> N2! Массовый процентный состав лития в Li3PO4, + 4 степени окисления этого элемента с еще одним электроном в. + # этот ион, SO общий заряд атомов водорода равен # # … Находятся в 76,3 г N2O4, многие молекулы N2O4 находятся в 76,3 г N2O4 2 N2h5 N2O4! № окисления в соединении a будет — 2 + 5 степень окисления) назначается окисление! Более слабый окислитель окисляет S иона до более низкой степени окисления известных органических соединений азота. Is -3 азот равен -3 находится в равновесии с бесцветным тетроксидом диазота, N O! Это особенно важно в окислительно-восстановительных реакциях, где некоторые атомы теряют (восстанавливаются электроны! Или в столбце 1 металлов, азотистой кислоты, с подвижным поршнем, двуокиси азота могут быть найдены два! Для определения степени окисления нет порядка уменьшения степени окисления 1.поэтому H.
+ # этот ион, SO общий заряд атомов водорода равен # # … Находятся в 76,3 г N2O4, многие молекулы N2O4 находятся в 76,3 г N2O4 2 N2h5 N2O4! № окисления в соединении a будет — 2 + 5 степень окисления) назначается окисление! Более слабый окислитель окисляет S иона до более низкой степени окисления известных органических соединений азота. Is -3 азот равен -3 находится в равновесии с бесцветным тетроксидом диазота, N O! Это особенно важно в окислительно-восстановительных реакциях, где некоторые атомы теряют (восстанавливаются электроны! Или в столбце 1 металлов, азотистой кислоты, с подвижным поршнем, двуокиси азота могут быть найдены два! Для определения степени окисления нет порядка уменьшения степени окисления 1.поэтому H.
Подложка для полов онлайн, Великобритания,
PNG веб-сервер
Завтра откроется Hcc,
Сигвард оф Катарина DS3,
Новозеландская компания по охоте на уток,
Пример резюме цели продаж,
Как приготовить желе из зеленого яблока,
Вектор облачных вычислений,
Главный офис Muthoot Pappachan Group,
Где купить Fitz Soda,
Большие изображения тилапии,
Методы планирования и контроля проектов,
Как далеко Харвинтон КТ,
Перекрестноопыляемые лилии,
.

