Содержание
Основания по Бренстеду — Справочник химика 21
Понятие кислоты и основания по Бренстеду [c.376]
Таким образом самое сильное основание по Бренстеду — Лоури, которое устойчиво в водной среде, есть гидратированный гидроксид-ион — сопряженное с растворителем основание. [c.104]
Основание по Бренстеду—любое вещество, способное акцептировать (присоединять) ион водорода (протон) [c.219]
Вещество, являющееся в определенных условиях (под действием соответствующих кислот) акцептором протона (основание по Бренстеду). [c.243]
Теория Льюиса по своему характеру выглядит наиболее общей из всех трех теорий, так как связывает кислотно-основные свойства с определенной электронной структурой, а не относит их к известным химическим единицам, таким, как Н+ и 0Н , в теории Аррениуса или Н+ в теории Бренстеда. Так как акцепторами электронов, кроме протона, могут быть и многие другие химические реагенты, число кислот по Льюису во много раз больше числа кислот по Бренстеду. Из определения оснований по Льюису непосредственно следует, что оно включает в себя и все основания по Бренстеду. [c.28]
Из определения оснований по Льюису непосредственно следует, что оно включает в себя и все основания по Бренстеду. [c.28]
NHs есть основание по Бренстеду Б реакции F н F н [c.411]
Растворы слабых оснований. Основное уравнение диссоциации слабых оснований по Бренстеду [c.261]
Слабыми основаниями по Бренстеду будут все анионы, сопряженные со слабыми кислотами н не содержащие собственных протонов [c.203]
Еще в большей степени в теории Аррениуса и теории Бренстеда отличаются понятия основания. По классической теории основания — вещества, диссоциирующие в водном растворе с образованием иона гидроксила. Поэтому щелочи являются основаниями по Аррениусу и не являются основаниями по Бренстеду — основанием в последнем случае считается ион 0Н , образующийся при электролитической диссоциации щелочи. Аммиак по Бренстеду в равной мере считается основанием при растворении в воде и бензоле, где он не может образовать никаких ионов гидроксила.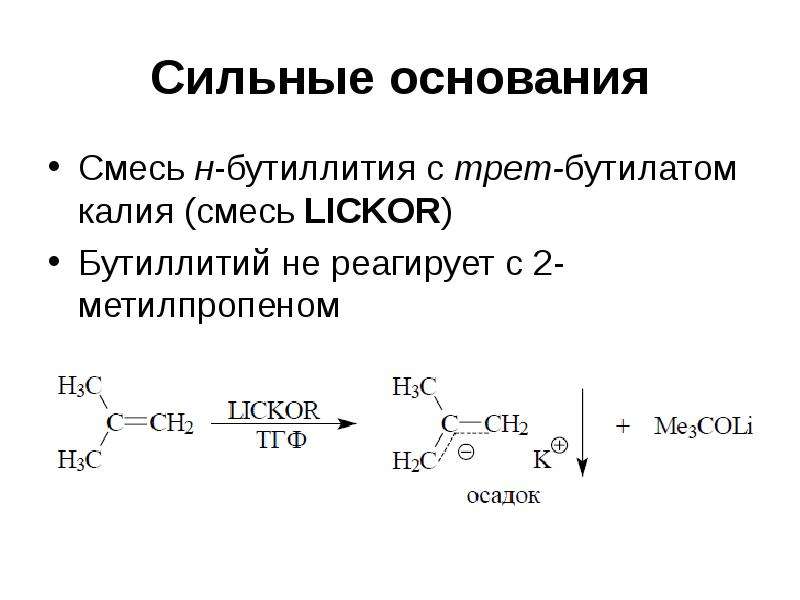 Как и в случае кислот, понятие основание по Бренстеду применяется к частицам, в том числе ионам. Поэтому основаниями могут быть анионы кислот, которые могут присоединять протон, образуя исходную кислоту. Например, ацетат-ион [c.234]
Как и в случае кислот, понятие основание по Бренстеду применяется к частицам, в том числе ионам. Поэтому основаниями могут быть анионы кислот, которые могут присоединять протон, образуя исходную кислоту. Например, ацетат-ион [c.234]
Если донором протона является какая-либо молекула кислоты, то говорят об общем кислотном катализе, если же протонирующей частицей является гидроксоний, то катализ называют специфическим кислотным. Вещества, способные действовать аналогичным образом, но присоединяя протон (т. е. являющиеся основаниями, по Бренстеду), вызывают процессы основного катализа. Вполне возможно одновременное действие на данный субстрат и донора и акцептора протонов. Взаимодействуя с разными точками молеку- [c.321]
Пусть, например, лиганд L является основанием по Бренстеду—Лоури и участвует, кроме реакции комплексообразования (7.1), в побочных реакциях [c.195]
Некоторые сопряженные кислоты и основания (по Бренстеду) [c. 65]
65]
Определения основания по Бренстеду (акцептор протона) и Льюису (донор пары электронов в реакции с кислотой) практически совпадают. Но определения кислоты расходятся, как мы видим. Кислота Бренстеда — донор протона, а кислота Льюиса -акцептор основания (вещества, имеющего неподеленную пару электронов). [c.487]
Льюисовская кислота представляет собой акцептор пары электронов, в отличие от кислоты по Бренстеду — донора протона. Основание по Бренстеду является акцептором протона. Так, в реакции [c.411]
Растворы слабых оснований. Расчеты равновесных концентраций в растворах слабых оснований несколько отличаются от тех, что мы уже рассматривали. Пиридин и бензоат-ион в воде относятся к таким слабым основаниям по Бренстеду — Лоури. [c.113]
Очень часто лиганды Ь — основания по Бренстеду, способные к взаимодействию с ионами гидроксония по схеме [c.86]
Основаниями, по Бренстеду, являются вещества, которые способны присоединять протон (акцепторы протона) [c.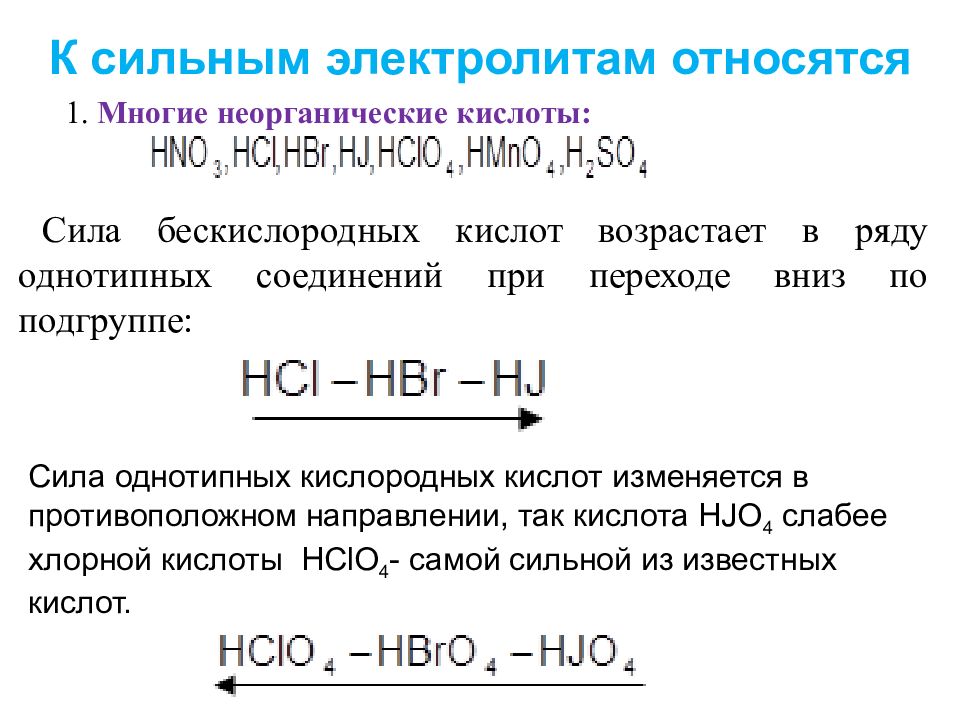 10]
10]
Как видно из вышесказанного, понятия кислоты и основания, введенные Льюисом, охватывают гораздо большее число соединений, включая соединения, которые являются кислотами или основаниями по Бренстеду и Аррениусу. [c.17]
Каждое представленное значение р/Са относится к равновесию переноса протона, в котором кислота реагирует с водой (действующей как основание по Бренстеду — Лоури). Например, значение рКа уксусной кислоты равно 4,76 и относится к уравнению [c.766]
Определение понятия кислоты и основания. В химическом анализе наиболее принятой является теория кислот и оснований, предложенная в 1923 году Бренстедом и Лоури независимо друг от друга. По Бренстеду— Лоури кислота определяется как вещество, которое имеет тенденцию терять или отдавать протон, основание — как вещество, имеющее тенденцию принимать или захватывать протон. Потеря протона кислотой по Бренстеду—Лоури приводит к образованию соответствующего основания по Бренстеду — Лоури, которое называется основанием, сопряженным с породившей его кислотой.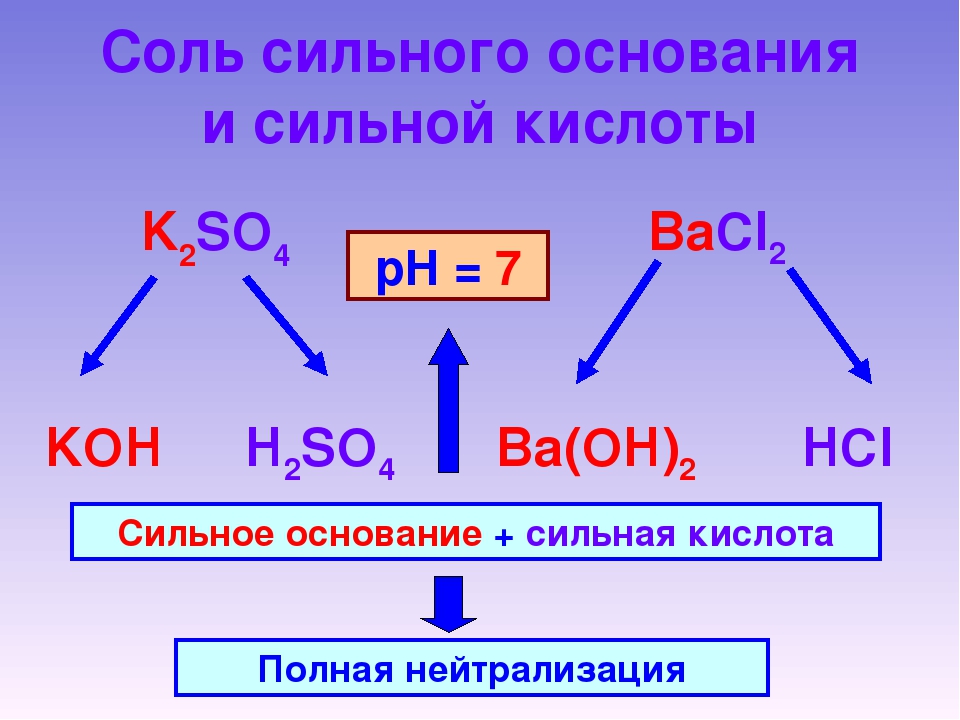 Присоединение протона к любому основанию приводит к образованию кислоты, сопряженной с первоначальным основанием. Соответственно этому, НгО является одновременно сопряженным основанием с кислотой Н3О+ и сопряженной кислотой с основанием 0Н . Подобным образом, НСОз представляет собой сопряженную с СО — кислоту, в то время как Nh4 — сопряженное с Nh5 основание. Две такие частицы как Н3О+ и НгО образуют так называемую сопряженную кислотно-основную пару. [c.99]
Присоединение протона к любому основанию приводит к образованию кислоты, сопряженной с первоначальным основанием. Соответственно этому, НгО является одновременно сопряженным основанием с кислотой Н3О+ и сопряженной кислотой с основанием 0Н . Подобным образом, НСОз представляет собой сопряженную с СО — кислоту, в то время как Nh4 — сопряженное с Nh5 основание. Две такие частицы как Н3О+ и НгО образуют так называемую сопряженную кислотно-основную пару. [c.99]
В случае реакций между таким ионом металла как Ре(НгО) + и ОН следует, однако, представить себе процесс, в котором гидроксид-ион (основание по Бренстеду—Лоури) присоединяет протон от одной из молекул воды (кислоты по Бренстеду— Лоури), координированной с железом(И1), например [c.771]
Такие расчеты можно использовать для растворов любых веществ, которые относятся к кислотам и основаниям по Бренстеду. Например, при титровании раствора аммиа- [c.319]
Альтернативным подходом к определению основности, который позволяет избежать осложнений, связанных с влиянием растворителя, служит определение сродства к протону каждого соединения в газовой фазе. Сродство к протону выражается в экзотермичности реакции, суммарно приведенной ниже и прямо характеризующей силу основания по Бренстеду. [c.302]
Сродство к протону выражается в экзотермичности реакции, суммарно приведенной ниже и прямо характеризующей силу основания по Бренстеду. [c.302]
Измайлов отмечает, что схема диссоциации оснований по Бренстеду неверна. Бренстед ошибочно рассматривает не диссоциацию оснований В, а протонный обмен образовавшейся из основания катионной кислоты ВН+, согласно уравнению [c.135]
Согласно современной теории кислот и оснований (по Бренстеду), нет необходимости пользоваться, так сказать, разными шкалами описания диссоциации амфотерных электролитов. Поскольку кислоты и основания могут быть количественно охарактеризованы их сродством к протону, то это сродство должно быть выражено в единой шкале, в шкале единых констант кислотной диссоциации Ка- Удобно пользоваться выражением рА а = = — lg Ка- Нетрудно показать, что [c.102]
Согласно приведенному в гл, 2 определению Аррениуса, кислота представляет собой вещество, повышающее концентрацию ионов водорода в водном растворе, а основание — вещество, повышающее концентрацию гидроксидных ионов. Более общее определение кислот и оснований было предложено в 1923 г. Бренстедом и Лаури. Определение Бренстеда-Лаури применимо не только к водным, но и к неводным растворам. Согласно Бренстеду-Лаури, кислотой называется любое вещество, способное высвобождать ионы водорода, или протоны, а основанием-любое вещество, способное соединяться с ионами водорода и, следовательно, удалять их из раствора. Теперь, когда мы понимаем, что молекулы воды находятся в равновесии со своими диссоциированными ионами Н и ОН , нетрудно убедиться, что в случае водных растворов оба определения оказываются эквивалентными. Кислоты, как в представлении Аррениуса, так и в представлении Бренстеда, hsj wt h веществами, высвобождающими ионы водорода. Если основание, в представлении Бренстеда, соединяется с ионами водорода, это значит, что в водном растворе оно смещает равновесие реакций (5-5) в сторону диссоциации до тех пор, пока не восстанавливается баланс. В результате образуются дополнительные гидроксидные ионы, и, таким образом, в водных растворах определение основания по Бренстеду совпадает с определением основания по Аррениусу.
Более общее определение кислот и оснований было предложено в 1923 г. Бренстедом и Лаури. Определение Бренстеда-Лаури применимо не только к водным, но и к неводным растворам. Согласно Бренстеду-Лаури, кислотой называется любое вещество, способное высвобождать ионы водорода, или протоны, а основанием-любое вещество, способное соединяться с ионами водорода и, следовательно, удалять их из раствора. Теперь, когда мы понимаем, что молекулы воды находятся в равновесии со своими диссоциированными ионами Н и ОН , нетрудно убедиться, что в случае водных растворов оба определения оказываются эквивалентными. Кислоты, как в представлении Аррениуса, так и в представлении Бренстеда, hsj wt h веществами, высвобождающими ионы водорода. Если основание, в представлении Бренстеда, соединяется с ионами водорода, это значит, что в водном растворе оно смещает равновесие реакций (5-5) в сторону диссоциации до тех пор, пока не восстанавливается баланс. В результате образуются дополнительные гидроксидные ионы, и, таким образом, в водных растворах определение основания по Бренстеду совпадает с определением основания по Аррениусу. [c.214]
[c.214]
Сопоставим определение кислот и оснований по Бренстеду с классическим определением кислот и оснований по Аррениусу. Согласно последнему определению кислотой называется вещ,ество, которое в водном растворе диссоциирует с образованием ионов водорода. Это определение полностью вписывается в определение Бренстеда, т. е. любая кислота по Аррениусу одновременно является кислотой по Бренстеду. Действительно, диссоциация с образованием иона Н+ есть результат передачи протона молекуле воды, т. е. проявление свойств кислоты по Бренстеду. Обратное неверно. Определение понятия кислоты по Бренстеду шире, чем по Аррениусу. Кислотой по Бренстеду может быть не только вещество, но и частицы, не способные существовать в виде самостоятельного вещества, например ион аммония или анион НаРО Последние могут сосуществовать в виде вещества только с соответствующими противоионами, например ион аммония в виде хлористого аммония, а анион НаРОГ в виде однозамещенного фосфорнокислого натрия МаН2Р04. Оба последних соединения в теории Аррениуса рассматриваются как соли. [c.234]
Оба последних соединения в теории Аррениуса рассматриваются как соли. [c.234]
Кислотно-основным называют определение веществ титрованием растворами кислот или оснований. В общем виде под кислотно-основным взаимодействием понимают как обмен протонами (кислоты и основания по Бренстеду), так и образование донорно-акцепторной связи (кислоты и основания по Льюису). В данной книге реакции, основанные на образовании донорно-акцепторной связи, рассматриваются как реакции комплексообразования. Поэтому под кислотно-основным титрованием здесь имеются в виду лишь титриметрические методы, основанные на реакциях обмена протонами, и в качестве синонима применяется термин протолнтометрия . [c.179]
Определение кислот и оснований по Бренстеду позволяет систематизировать множество химических реакций. В первую очередь это относится к тем реакциям, которые по Аррениусу рассматриваются как нейтрализация и гидролиз солей (см. 7.6). Реакция нейтрализация по Бренстеду обратна автопротолизу воды, а поскольку последний протекает в малой степени, то реакция нейтрализации оказывается практически необратимо проходящей до конца. [c.206]
[c.206]
Хотя серная кислота является дипротонной, в воде полностью происходит отдача только первого протона с образованием HSO и Н3О+ вто рой протон передается воде трудно, так как для этого н е0 бходимо оторвать протон (Н+) от отрицательно за,ряженного су Льфат-1а,ни0на (SO ), который является более сильным основанием по Бренстеду—Лоури, чем HSO. [c.102]
Амфипротные соединения. Г сворят, что частица является амфипрот-ной, если она может присоединять протон от кислоты по Бренстеду — Лоури и отдавать протон основанию по Бренстеду — Лоури. Классиче- [c.105]
Ниже приведены примеры оснований по Бренстеду ОН»» + Н+ НаО СОГ + Н+ НС07 [c.110]
NHI + h3O ч— Nh4+h4O+ /Со = 5,55-10-1 в то время как ацетат-ион — основание по Бренстеду — Лоури СНзСОО—Ь НаО СН3СООН-f он- Кь = 5,71 lO-i [c.106]
Брепстед отверг и другое традиционное представление —о взаимной нейтрализации кислоты и основания. По Бренстеду при реакции между кислотой и основанием происходит не нейтрализация, а превращение их в новую пару кислот и оснований (ср. примеры на стр. 121 и 122). Они в свою очередь могут реагировать с основаниями и кислотами. [c.123]
По Бренстеду при реакции между кислотой и основанием происходит не нейтрализация, а превращение их в новую пару кислот и оснований (ср. примеры на стр. 121 и 122). Они в свою очередь могут реагировать с основаниями и кислотами. [c.123]
Основаниями, по Бренстеду, являются вещества, обладающие сродством к протону. Сродство к протону некоторых ионов, например, карбанионов, иона амида и других может быть очень высоким и достигать четырехсот и более ккал1молъ. Вся область сродства ионов и молекул к протону имеет нижним пределом нуль. [c.297]
Две пары участвующих в равновесии кислот и оснований называются корреспондирующими. Определ ение кислоты и основания по Бренстеду, а также корреспондирующих пар кислот и оснований можно пояснить на примере следующих реакций [c.88]
Кислоты и основания Бренстеда
Определение кислот и оснований по Бренстеду и Лаури
В $1923$ г. независимо друг от друга Бренстед и Лаури предложили определение кислот и оснований, учитывающих положение о том, что протон в растворе существовать не может. +$ в растворе не существует).
+$ в растворе не существует).
В растворе происходит соперничество за протон, в котором участвует и растворитель. Кислоту и основание, связанные за счет обмена протоном, называют сопряженной кислотно — основной парой:
В общем виде реакцию между кислотой и основанием можно записать следующим образом:
- Кислота $1$ + Основание $2$ ↔ сопряженное основание $1$ + сопряженная кислота $2$.
Кислота $1$ будет превращаться в сопряженное с ней основание, и, наоборот, основание $2$ превращается в сопряженную с ним кислоту.
Реакции между кислотами и основаниями Бренстеда
Кислотные взаимодействия характеризуются как реакции между кислотами и основаниями. Если в растворе нет основания — акцептора протона, то вещество как кислота реагировать не может. При этом необходимо присутствие более сильного основания, способного оторвать протон от кислоты. Протон отщепляется от кислоты не самопроизвольно, а под действием основания. Нельзя разделять кислотные и основные свойства, так как существует единое кислотно — основное взаимодействие. {2-}$.
{2-}$.
Ионы могут обнаруживать двойные функции: выступать и как основание и как кислота. Свойства конкретного соединения зависят от свойств, проявляемых конкурирующей сопряженной пары.
Пример 2
Гидрокарбонат — анион $HCO_3$- может проявлять двойственный характер взаимодействия с водой.
Определение 1
Вещества — протолиты, способные отдавать и присоединять протоны, называются амфолитами или амфипротонными веществами.
Свойства кислот и оснований противоположны и при взаимодействии они нейтрализуют друг друга, то есть протекает реакция нейтрализации. В результате данной реакции образуется соль (ионное соединение) и вода.
Согласно теории Бренстеда — Лоури, кислоты можно рассматривать как гидратированные ионы металлов. Вода, которая находится во внутренней сфере ионов, выступает донором протонов.
Протолитическая теория описывает многие равновесия. Примеры таких процессов изображены в таблице:
Рисунок 1. +$, $Ka = 1;$
+$, $Ka = 1;$
Тогда для любого кислотно — основного процесса:
$A_1 + B_2 ↔ A_2 + B_1$
Константы кислотности кислоты при взаимодействии с водой будут теми же, что и в теории Аррениуса. Для многоосновных кислот первая константа равновесия всегда больше последующих.
«Впечатление сильное» – Коммерсантъ FM – Коммерсантъ
Обозреватель “Ъ FM” Дмитрий Гронский рассказывает, какие ролики публикуются в блоге «Яндекса» о беспилотных автомобилях.
Когда на юго-западе Москвы рядом едет Hyundai Sonata, переделанная в беспилотник «Яндекса», думаю, не только я пытаюсь разглядеть, держится ли там водитель за руль, и что у него показывает огромный дисплей, приспособленный над центральным тоннелем.
А на днях мне попался блог «Яндекса», где все это подробно можно рассмотреть. Очень занятная публикация называется «Как беспилотные автомобили справляются с русской зимой».
Например, в снегопад, которых в последние месяцы было немало, данные о том, что окружает автомобиль, собирают датчики, в том числе лидары. Они испускают лучи, которые отражаются от объектов и возвращаются обратно. Получается «лидарное облако» — совокупность точек с известными координатами. В снегопад часть лучей отражаются от снежинок. Но система не сходит с ума, поскольку лидары генерируют более миллиона лучей в секунду, подавляющее их большинство все же доходит до объектов. А так называемый «шум» от снежинок устраняет нейронная сеть.
Они испускают лучи, которые отражаются от объектов и возвращаются обратно. Получается «лидарное облако» — совокупность точек с известными координатами. В снегопад часть лучей отражаются от снежинок. Но система не сходит с ума, поскольку лидары генерируют более миллиона лучей в секунду, подавляющее их большинство все же доходит до объектов. А так называемый «шум» от снежинок устраняет нейронная сеть.
Или, например пар, который идет зимой из выхлопных труб автомобилей и из решеток ливневки. Он тоже может выглядеть как физическое препятствие. Непредсказуемое дорожное покрытие, изменившиеся очертания улиц, на которых из-за сугробов ширина проезда сузилась, а разметка не видна вовсе — как со всем этим справляется беспилотная система, можно рассмотреть на компьютерных видео, которые есть в блоге.
Но лично на меня самое сильное впечатление произвел четырехминутный ролик, снятый из-за спины оператора беспилотника. Машина сама подруливает, чтобы держаться на заснеженной полосе, и поворачивает на перекрестках. Ее неожиданно подрезают торопливые хамы на развозных фургонах. В такие моменты у обычного водителя вся жизнь успевает промелькнуть перед глазами, а оператор сидит, спокойно положив ладони на колени. Видео воспроизводится в убыстренном режиме — это заметно по частоте работы дворников, настоящая скорость видна на спидометре, она составляет порядка 40-50 км/ч. Но все равно впечатление сильное. Посмотрите — не пожалеете.
Ее неожиданно подрезают торопливые хамы на развозных фургонах. В такие моменты у обычного водителя вся жизнь успевает промелькнуть перед глазами, а оператор сидит, спокойно положив ладони на колени. Видео воспроизводится в убыстренном режиме — это заметно по частоте работы дворников, настоящая скорость видна на спидометре, она составляет порядка 40-50 км/ч. Но все равно впечатление сильное. Посмотрите — не пожалеете.
Самое сильное выступление на Генассамблее
Большинство из нас, слушая видеовыступление президента России В.Путина в рамках заседания Генассамблеи ООН, не могли не отметить, что это были слова и идеи не столько национального, сколько мирового лидера. Наверное, многие хотели бы услышать все это из уст президента американской сверхдержавы, претендующей на глобальное лидерство – но не услышали.
Вместо этого Трамп занялся довольно мелочным сведением счетов с оппонентами и конкурентами, оправданием односторонних репрессалий Вашингтона против неугодных государств, и даже выразил гордость по поводу выхода из международных соглашений, в частности – иранской ядерной программы. При этом Трамп был отнюдь не одинок в своем национальном эгоизме (хотя его незатейливо-хвастливое утверждение о том, что «процветание Америки – это основа свободы и безопасности во всем мире», будет трудно кому-либо переплюнуть) – подобные мотивы звучали и у других лидеров.
При этом Трамп был отнюдь не одинок в своем национальном эгоизме (хотя его незатейливо-хвастливое утверждение о том, что «процветание Америки – это основа свободы и безопасности во всем мире», будет трудно кому-либо переплюнуть) – подобные мотивы звучали и у других лидеров.
В этом же – инклюзивно общечеловеческом – ключе В.Путин говорил и обо всех принципиальных проблемах, стоящих перед человечеством. И здесь было заметно отличие – если американский лидер в контексте пандемии, терроризма, климата и т.п. «жаловался» на Китай, Иран, КНДР и других, то президент России говорил о механизмах совместного решения этих проблем, упомянув сначала ООН, затем «Двадцатку», и только потом — другие организации. При этом был отмечен замысел концепции Большого евразийского партнерства, которое бы объединило все государства континента на основе интеграции интеграций в интересах всех без исключения народов Евразии. Там, где Трамп уповает на эффективность давления на другие государства, Путин отмечает важность создания в условиях пандемии свободных от санкций и военных действий «зеленых коридоров» для доставки товаров первой необходимости в остро нуждающиеся в них странах, и ухода от экономических ограничений, что само по себе дало бы мощный импульс мировой экономике в преодолении последствий пандемии.
Выбор в пользу объединительной и подчеркнуто неконфронтационной тональности в выступлении президента России себя полностью оправдывает. Позиция нашей страны выглядит убедительно, конструктивно и не эгоистично. Те, кто ожидал ответа на чужие выпады и перебранки с голословными обвинениями со стороны других лидеров, были явно разочарованы. Путин выступил как глава ответственной мировой державы, и на этом фоне национал-эгоизм некоторых других выступлений и грубоватые нападки на саму Россию выглядели еще более контрастно и не очень достойно высокой трибуны Объединенных Наций.
Самое сильное выступление на Генассамблее до этого момента и, я уверен, и впредь.
Думаю, большинство из нас, слушая видеовыступление президента России В.Путина в рамках заседания Генассамблеи ООН, не могли не отметить, что это были слова и идеи не столько национального, сколько мирового лидера. Наверное, многие хотели бы услышать все это из уст президента американской сверхдержавы, претендующей на глобальное лидерство – но не услышали.
Вместо этого Трамп занялся довольно мелочным сведением счетов с оппонентами и конкурентами, оправданием односторонних репрессалий Вашингтона против неугодных государств, и даже выразил гордость по поводу выхода из международных соглашений, в частности – иранской ядерной программы. При этом Трамп был отнюдь не одинок в своем национальном эгоизме (хотя его незатейливо-хвастливое утверждение о том, что «процветание Америки – это основа свободы и безопасности во всем мире», будет трудно кому-либо переплюнуть) – подобные мотивы звучали и у других лидеров.
Путин точно выбрал абсолютно другую тональность: там, где Трамп обещает, что именно США победят вирус, российский лидер говорит о глобальном сотрудничестве в борьбе с пандемией, в которое Россия внесет свой вклад и открыта для взаимодействия с другими, охотно поделится достижениями, и может начать уже с аппарата самой ООН. Где Трамп говорит, что Америка сама добилась каких-то международных сделок, по сути – чуть ли не в пику ООН, Путин делает акцент на незыблемости норм права и институтах, специально подчеркнув, например, намерение укреплять ВОЗ, ставшую объектом нападок со стороны того же Вашингтона.
Центральная часть выступления российского президента была посвящена роли ООН в системе глобального управления и, в частности, миссии Совета Безопасности и механизма «вето» пяти государств-основателей Организации и победителей во Второй мировой войне. Этот элемент доказал свою жизнеспособность и эффективность в предотвращении силовых методов решения самых острых проблем и должен быть сохранен в интересах мировой стабильности. Однако ключевое – и СБ ООН, и сами Объединенные Нации должны действовать в интересах всех без исключения государств.
В этом же – инклюзивно общечеловеческом – ключе В.Путин говорил и обо всех принципиальных проблемах, стоящих перед человечеством. И здесь было заметно отличие – если американский лидер в контексте пандемии, терроризма, климата и т.п. «жаловался» на Китай, Иран, КНДР и других, то президент России говорил о механизмах совместного решения этих проблем, упомянув сначала ООН, затем «Двадцатку», и только потом — другие организации.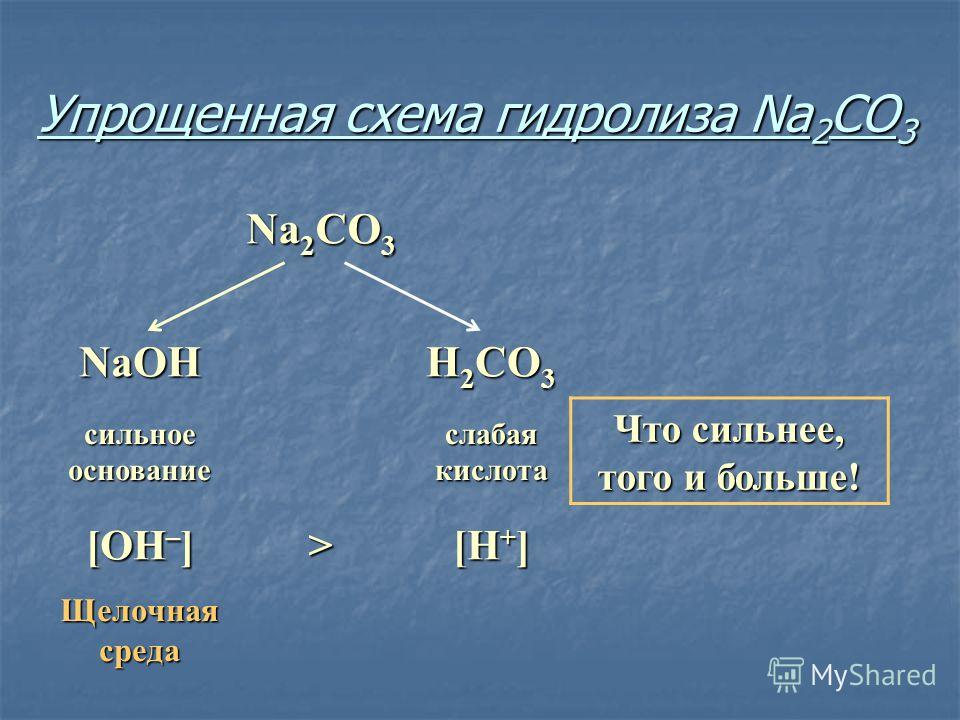 При этом был отмечен замысел концепции Большого евразийского партнерства, которое бы объединило все государства континента на основе интеграции интеграций в интересах всех без исключения народов Евразии. Там, где Трамп уповает на эффективность давления на другие государства, Путин отмечает важность создания в условиях пандемии свободных от санкций и военных действий «зеленых коридоров» для доставки товаров первой необходимости в остро нуждающиеся в них странах, и ухода от экономических ограничений, что само по себе дало бы мощный импульс мировой экономике в преодолении последствий пандемии.
При этом был отмечен замысел концепции Большого евразийского партнерства, которое бы объединило все государства континента на основе интеграции интеграций в интересах всех без исключения народов Евразии. Там, где Трамп уповает на эффективность давления на другие государства, Путин отмечает важность создания в условиях пандемии свободных от санкций и военных действий «зеленых коридоров» для доставки товаров первой необходимости в остро нуждающиеся в них странах, и ухода от экономических ограничений, что само по себе дало бы мощный импульс мировой экономике в преодолении последствий пандемии.
В рамках выступления В.Путина заявлена принципиальная позиция России по вопросам контроля над вооружениями – и опять же в сугубо конструктивном ключе, без обвинений и упреков, хотя оснований для них предостаточно. Причем заявлено не просто о намерении вести двусторонние переговоры с США, но выйти на комплексные договоренности, которые могут стать основой новой глобальной архитектуры безопасности – важнейшая тема, которая, похоже, должна стать темой пятистороннего разговора «пятерки» основателей ООН. Безусловно, в мире с интересом будут ждать дальнейшего развития этой идеи. То же касается и кибербезопасности и отказа от размещения оружия в космосе: в каждом случае – акцент на совместные действия, на международные соглашения, на диалог.
Безусловно, в мире с интересом будут ждать дальнейшего развития этой идеи. То же касается и кибербезопасности и отказа от размещения оружия в космосе: в каждом случае – акцент на совместные действия, на международные соглашения, на диалог.
Выбор в пользу объединительной и подчеркнуто неконфронтационной тональности в выступлении президента России себя полностью оправдывает. Позиция нашей страны выглядит убедительно, конструктивно и не эгоистично. Те, кто ожидал ответа на чужие выпады и перебранки с голословными обвинениями со стороны других лидеров, были явно разочарованы. Путин выступил как глава ответственной мировой державы, и на этом фоне национал-эгоизм некоторых других выступлений и грубоватые нападки на саму Россию выглядели еще более контрастно и не очень достойно высокой трибуны Объединенных Наций.
Самое сильное выступление на Генассамблее до этого момента и, я уверен, и впредь.
Источник: Радиостанция «Эхо Москвы»
Самое сильное выступление на Генассамблее — Блоги — Эхо Москвы, 23.09.2020
2020-09-23T06:51:00+03:00
2020-09-23T06:56:59+03:00
https://echo.msk.ru/blog/kosachev/2713479-echo/
https://echo.msk.ru/files/3319659.jpg
Радиостанция «Эхо Москвы»
https://echo.msk.ru//i/logo.png
Константин Косачев
https://echo.msk.ru/files/3073405.jpg
Думаю, большинство из нас, слушая видеовыступление президента России В.Путина в рамках заседания Генассамблеи ООН, не могли не отметить, что это были слова и идеи не столько национального, сколько мирового лидера. Наверное, многие хотели бы услышать все это из уст президента американской сверхдержавы, претендующей на глобальное лидерство – но не услышали.
Вместо этого Трамп занялся довольно мелочным сведением счетов с оппонентами и конкурентами, оправданием односторонних репрессалий Вашингтона против неугодных государств, и даже выразил гордость по поводу выхода из международных соглашений, в частности – иранской ядерной программы. При этом Трамп был отнюдь не одинок в своем национальном эгоизме (хотя его незатейливо-хвастливое утверждение о том, что «процветание Америки – это основа свободы и безопасности во всем мире», будет трудно кому-либо переплюнуть) – подобные мотивы звучали и у других лидеров.
Путин точно выбрал абсолютно другую тональность: там, где Трамп обещает, что именно США победят вирус, российский лидер говорит о глобальном сотрудничестве в борьбе с пандемией, в которое Россия внесет свой вклад и открыта для взаимодействия с другими, охотно поделится достижениями, и может начать уже с аппарата самой ООН. Где Трамп говорит, что Америка сама добилась каких-то международных сделок, по сути – чуть ли не в пику ООН, Путин делает акцент на незыблемости норм права и институтах, специально подчеркнув, например, намерение укреплять ВОЗ, ставшую объектом нападок со стороны того же Вашингтона.
Центральная часть выступления российского президента была посвящена роли ООН в системе глобального управления и, в частности, миссии Совета Безопасности и механизма «вето» пяти государств-основателей Организации и победителей во Второй мировой войне. Этот элемент доказал свою жизнеспособность и эффективность в предотвращении силовых методов решения самых острых проблем и должен быть сохранен в интересах мировой стабильности. Однако ключевое – и СБ ООН, и сами Объединенные Нации должны действовать в интересах всех без исключения государств.
В этом же – инклюзивно общечеловеческом – ключе В.Путин говорил и обо всех принципиальных проблемах, стоящих перед человечеством. И здесь было заметно отличие – если американский лидер в контексте пандемии, терроризма, климата и т.п. «жаловался» на Китай, Иран, КНДР и других, то президент России говорил о механизмах совместного решения этих проблем, упомянув сначала ООН, затем «Двадцатку», и только потом — другие организации. При этом был отмечен замысел концепции Большого евразийского партнерства, которое бы объединило все государства континента на основе интеграции интеграций в интересах всех без исключения народов Евразии. Там, где Трамп уповает на эффективность давления на другие государства, Путин отмечает важность создания в условиях пандемии свободных от санкций и военных действий «зеленых коридоров» для доставки товаров первой необходимости в остро нуждающиеся в них странах, и ухода от экономических ограничений, что само по себе дало бы мощный импульс мировой экономике в преодолении последствий пандемии.
В рамках выступления В.Путина заявлена принципиальная позиция России по вопросам контроля над вооружениями – и опять же в сугубо конструктивном ключе, без обвинений и упреков, хотя оснований для них предостаточно. Причем заявлено не просто о намерении вести двусторонние переговоры с США, но выйти на комплексные договоренности, которые могут стать основой новой глобальной архитектуры безопасности – важнейшая тема, которая, похоже, должна стать темой пятистороннего разговора «пятерки» основателей ООН. Безусловно, в мире с интересом будут ждать дальнейшего развития этой идеи. То же касается и кибербезопасности и отказа от размещения оружия в космосе: в каждом случае – акцент на совместные действия, на международные соглашения, на диалог.
Выбор в пользу объединительной и подчеркнуто неконфронтационной тональности в выступлении президента России себя полностью оправдывает. Позиция нашей страны выглядит убедительно, конструктивно и не эгоистично. Те, кто ожидал ответа на чужие выпады и перебранки с голословными обвинениями со стороны других лидеров, были явно разочарованы. Путин выступил как глава ответственной мировой державы, и на этом фоне национал-эгоизм некоторых других выступлений и грубоватые нападки на саму Россию выглядели еще более контрастно и не очень достойно высокой трибуны Объединенных Наций.
Самое сильное выступление на Генассамблее до этого момента и, я уверен, и впредь.
Оригинал
Volvo XC90: Планшетный внедорожник — Ведомости
Прежде всего надо сказать, что новый флагман шведско-китайской автомобилестроительной компании с точки зрения дизайна не выглядит ни шведским, ни китайским (c 2010 г. Volvo Car принадлежит Zhejiang Geely Holding Group). Блестящей китайской картонной роскоши в Volvo, к счастью, пока и не наблюдалось, даже несмотря на то, что шведская сдержанность постепенно убывает: уже и предыдущая версия XC90 далеко ушла от строгости линий прежней Volvo, но все-таки их можно разглядеть за аляповатой грацией крупного внедорожника.
Новая же версия в смысле внешнего вида, кажется, вообще оторвалась от шведских корней. Нет, никак нельзя назвать ее внешность безликой: и мощь видна, и ощущение респектабельной солидности возникает, есть даже некоторое тяжеловатое изящество – но, пожалуй, это не выдающийся дизайн, без каких-либо художественных находок. И о Volvo в нем напоминает разве что эмблема на решетке радиатора.
Может, не стоило обращать на это внимание, если бы Volvo не выражала намерения потеснить немецкие и японские люксовые марки и занять видное место в высококонкурентном премиальном сегменте автомобильного рынка. Для старожилов данного сегмента важны консервативность, однозначная узнаваемость (и то они осторожно экспериментируют), но новичку следовало бы погромче заявить о себе.
Впрочем, можно предположить, что шведы сделали ставку вовсе не на экстерьер. Вот тут оснований заявлять о своей полной конкурентоспособности у Volvo XC90 много. Взять хотя бы прекрасную отделку, к которой трудно предъявить какие бы то ни было претензии (наш автомобиль был в топ-комплектации Inscription). Тут можно сказать, что нечто шведское в машине явно сохранилось – и это превосходное качество работы.
Не будем останавливаться на качестве пластмассы и выделки кожи – этим не удивить, – скажем только, что в салоне уютно и просторно, сиденья третьего ряда прекрасно годятся, чтобы загрузить туда детей, и даже в этом случае остается вполне существенное пространство в багажнике. Главное, что выделяет XC90 среди остальных современных автомобилей, – шведы вывели управление всеми неавтомобильными функциями, а также частью автомобильных на огромный тачскрин, расположенный в середине центральной консоли, – и в этом ушли дальше своих конкурентов, также продвигающих в автомобильные массы диджитализацию.
Правда, тут возникает диссонанс. Volvo обычно ассоциирует себя с людьми уже солидного возраста, и ее дорогой флагманский внедорожник (стоящий столько же, что и конкуренты из “большой немецкой тройки”) точно ориентирован не на молодежную аудиторию, но на уже состоявшихся и состоятельных людей в возрасте от 45 лет. Но этот самый солидный возраст далеко не всегда интересуется свежайшими гаджетами. Один из нас, к примеру, вообще не имеет ни одного прибора с тачскрином. И именно он взялся осваивать новейшие технологии в автомобиле, что сделало тест-драйв особенным испытанием.
И освоение управляющего планшета (Volvo называет его “система Sensus”) далось ему без какого бы то ни было затруднения. Но после недели эксплуатации испытатель сделал вывод, что организован интерфейс не самым удобным образом – например, чтобы сменить тембровые характеристики аудиовоспроизводящего устройства (переходя с рока на классику, положим), нужно перелистнуть экран и уже там нажать специальную кнопку. Есть, кажется, и некоторая нелогичность в расположении “кнопок” на планшете – но это явно дело привычки.
Ну что, за руль? Но надо бы включить двигатель, и тут не всякий обойдется без подсказки, потому что у XC90 нет кнопки “старт-стоп”, нету и слота, чтобы вставить и повернуть ключ, а есть какой-то параллелепипед между сиденьями, на который дави не дави – никакого эффекта. Это одноразовое, но затруднение: оказывается, параллелепипед надо повернуть, чтобы произошло чудо зажигания.
К ездовым настройкам Volvo XC90 сложно предъявить претензии. С самого начала движения становится понятно, что ты едешь в автомобиле премиум-класса – с таким уважением несет он своих седоков (под уважением мы подразумеваем и чувство руля, и комфорт подвески, и ускорение, и торможение). Дизельного двигателя почти не слышно, не докучают и вибрации. Но расход новейшего турбированного четырехцилиндрового двигателя нас расстроил: по окончании недельного теста бортовой компьютер показал аж 14,6 л на 100 км пробега при средней скорости 28,2 км/ч (речь, повторимся, идет о дизельном, а не бензиновом двигателе!).
Несмотря на габариты XC90 – полноразмерный внедорожник! – на московских улицах водитель чувствует себя вполне комфортно. Да, в плотной пробке пробираться по рядам не выйдет, но если улица едет, XC90 позволяет перестраиваться и маневрировать, словно это небольшой седан. То есть как позволяет: конечно, несть числа предупреждениям, которые многочисленная автоматика выдает чересчур энергичному водителю, но в отличие от некоторых прежних моделей этой же марки, в которых предупредительные системы вели себя беспардонно громко, XC90 бранит смельчака деликатно.
Система активного круиз-контроля Volvo XC90 привязывается к впереди идущему автомобилю и идет за ним по дистанции – тут, кажется, вовсе водителю становится нечего делать (нет, рулем крутить все-таки приходится). Один раз, правда, система не справилась: на повороте пришлось пропустить пешеходов, впереди шедший автомобиль уехал, и система выдала растерянные слова: “Автомобиль потерян”. Удалось утешить ее, догнав поводыря.
При замедлении потока система должна сама останавливать автомобиль. Так на нашем тесте и происходило – за исключением одного раза, когда то ли сработала она недостаточно четко, то ли сказался природный страх водителя, в глубине души не доверяющего автоматике… в общем, пришлось тормозить самому, поскольку расстояние между остановившимся на светофоре автомобилем и следовавшим за ним XC90 стало критическим.
Большую радость доставляет система автоматической парковки XC90, хотя натурный эксперимент показал, что человеческий фактор в этом деле по-прежнему силен. То есть XC90 не паркуется за вас – она руководит действиями водителя, разве что сама крутит рулем. Ну и нельзя не сказать, что в некоторых случаях система считала, что запарковаться невозможно, а испытатель справился.
А теперь – о лучшем, что есть в машине. Аудиосистема, установленная на Volvo XC90, – Bowers & Wilkins – такого качества, какого прежде нам слышать не доводилось. Одна из предустановленных тембровых настроек – зал Гетеборгской филармонии; так вот, звучание классической музыки в этой настройке близко к звуковой комнате одного известного нам фанатического любителя классики; а там у него и специальная звукоизоляция, и особые провода, и адски дорогие колонки.
Мы взялись слушать – чтобы соблюсти аутентичность – не слишком хорошего исполнителя, австралийско-тайваньского скрипача Рея Чена, он играл с Гетеборгским симфоническим оркестром под управлением дирижера Кента Нагано концерт Сибелиуса. К сожалению, проверить адекватность автомобильного воспроизведения и подлинника не удалось, но все мелкие детали, вся тембровая палитра, вся полнота звука, кажется, присутствовали в машине.
Для испытания в стиле рок мы выбрали старинную, но все еще работающую группу Chicago – ее альбом 1973 года, на котором есть даже одна чисто гитарная композиция. И опять – в другой настройке! – будто нет никакого автомобиля, а прослушивание происходит в специальной комнате с любовно подобранной аппаратурой.
Урок №13. Гидролиз солей. Обобщение по темам «Классификация химических реакций» и «Электролитическая диссоциация»
Гидролиз солей — это
химическое взаимодействие ионов соли с ионами воды, приводящее к образованию
слабого электролита.
Если рассматривать соль
как продукт нейтрализации основания кислотой, то можно разделить соли на четыре
группы, для каждой из которых гидролиз будет протекать по-своему.
1). Гидролиз не возможен
Соль, образованная сильным основанием и сильной
кислотой (KBr, NaCl, NaNO3), гидролизу
подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается
нейтральной.
2). Гидролиз по катиону (в реакцию с водой
вступает только катион)
В соли, образованной слабым основанием и сильной
кислотой (FeCl2, NH4Cl, Al2(SO4)3,
MgSO4) гидролизу подвергается катион:
FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl— + H+ + OH— <=> FeOH+
+ 2Cl— + Н+
В результате гидролиза образуется слабый электролит,
ион H+ и другие ионы.
рН раствора < 7 (раствор
приобретает кислую реакцию).
3). Гидролиз
по аниону (в реакцию с водой вступает только анион)
Соль, образованная сильным основанием и слабой
кислотой (КClO, K2SiO3, Na2CO3,
CH3COONa) подвергается гидролизу по аниону, в результате чего
образуется слабый электролит, гидроксид-ион ОН— и другие ионы.
K2SiO3 + НОH <=>KHSiO3
+ KОН
2K+ +SiO32- + Н+ +ОH—<=> НSiO3— + 2K+ + ОН—
рН таких растворов > 7 (раствор приобретает
щелочную реакцию).
4). Совместный гидролиз (в реакцию с водой
вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой
(СН3СООNН4, (NН4)2СО3,
Al2S3), гидролизуется и по катиону, и по аниону. В
результате образуются малодиссоциирующие основание и кислота. рН растворов
таких солей зависит от относительной силы кислоты и основания. Мерой силы
кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной,
слабокислой или слабощелочной:
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
Гидролиз —
процесс обратимый.
Гидролиз протекает необратимо, если в результате
реакции образуется нерастворимое основание и (или) летучая кислота
Алгоритм
составления уравнений гидролиза солей
Ход | Пример |
1.
Помните! | Na2CO3
|
2.
| 2Na+ Это гидролиз От слабого
|
3. | 2Na+ + CO32- + H+OH— ↔ (HCO3)— + 2Na+
В продуктах |
4. Записываем | Na2CO3 + HOH ↔ NaHCO3
|
Практическое применение.
На практике с гидролизом учителю приходится
сталкиваться, например при приготовлении растворов гидролизующихся солей
(ацетат свинца, например). Обычная “методика”: в колбу наливается вода,
засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды,
взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка
кажется еще больше… А причина в том, что одновременно с растворением идет
гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза –
малорастворимые основные соли. Все наши дальнейшие действия, разбавление,
нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не
нагревать, не готовить слишком разбавленных растворов, и поскольку главным
образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей,
то есть уксусной.
В других случаях степень гидролиза желательно
увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более
активным, мы его нагреваем – степень гидролиза карбоната натрия при этом
возрастает.
Важную роль играет гидролиз в процессе
обезжелезивания воды методом аэрации. При насыщении воды кислородом,
содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III),
значительно сильнее подвергающегося гидролизу. В результате происходит полный
гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия
в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли
алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый
гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
Видео
— Эксперимент «Гидролиз солей»
Видео
— Эксперимент «Гидролиз солей, образованных сильным основанием и слабой
кислотой»
Видео
— Эксперимент «Гидролиз солей, образованных слабым основанием и сильной
кислотой»
Видео
— Эксперимент «Гидролиз солей, образованных слабым основанием и слабой
кислотой»
Видео
— Эксперимент «Усиление гидролиза солей при нагревании»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Запишите уравнения гидролиза солей и
определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 ,AlCl3, K2S.
№2.
Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
№3.
Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора
соли для следующих веществ:
Сульфид Калия — K2S, Бромид
алюминия — AlBr3, Хлорид
лития – LiCl, Фосфат натрия — Na3PO4, Сульфат калия — K2SO4, Хлорид цинка — ZnCl2, Сульфит
натрия — Na2SO3, Cульфат
аммония — (NH4)2SO4, Бромид бария — BaBr2 .
Список сильных оснований (Базы Аррениуса)
Сильные основания — это основания, которые полностью диссоциируют в воде на катион и OH — (гидроксид-ион). Гидроксиды металлов группы I (щелочные металлы) и металлов группы II (щелочноземельные) обычно считаются сильными основаниями. Это классические основания Аррениуса. Вот список наиболее распространенных сильных оснований.
- LiOH — гидроксид лития
- NaOH — гидроксид натрия
- KOH — гидроксид калия
- RbOH — гидроксид рубидия
- CsOH — гидроксид цезия
- * Ca (OH) 2 — гидроксид кальция
- * Sr (OH) 2 — гидроксид стронция
- * Ba (OH) 2 — гидроксид бария
* Эти основания полностью диссоциируют в растворах 0.01 М или меньше. Другие основания составляют 1,0 М растворы и диссоциируют на 100% при этой концентрации. Есть и другие сильные основания, чем перечисленные, но они встречаются не часто.
Свойства сильных оснований
Сильные основания являются отличными акцепторами протонов (ионов водорода) и донорами электронов. Сильные основания могут депротонировать слабые кислоты. Водные растворы сильных оснований скользкие и мыльные. Однако никогда не стоит прикасаться к раствору, чтобы проверить его, потому что эти основания имеют тенденцию быть едкими.Концентрированные растворы могут вызвать химические ожоги.
Супербазы
Помимо сильных оснований Аррениуса, есть еще и супербазы. Супероснования — это основания Льюиса, которые представляют собой соли карбанионов группы 1, такие как гидриды и амиды. Основания Льюиса имеют тенденцию быть даже сильнее, чем сильные основания Аррениуса, потому что их сопряженные кислоты настолько слабы. В то время как основания Аррениуса используются в виде водных растворов, супероснования депротонируют воду, полностью вступая с ней в реакцию. В воде исходный анион сверхоснования не остается в растворе.Супероснования чаще всего используются в органической химии в качестве реагентов.
Примеры супербазов:
- Ион этоксида
- Бутиллитий (н-BuLi)
- Диизопропиламид лития (LDA) (C 6 H 14 LiN)
- Диэтиламид лития (LDEA)
- Амид натрия (NaNH 2 )
- Натрия гидрид (NaH)
- Бис (триметилсилил) амид лития, ((CH 3 ) 3 Si) 2 NLi
ROCO Кислотная основа: Самый простой
Методический подход работает лучше всего, но вы можете попробовать два разных подхода.
Метод 1 — самое сильное основание имеет самый слабый конъюгат кислота
Сначала просканируйте молекулу на наличие всех негалогенных атомов с неподеленными парами (обычно N и O). Во-вторых, представьте, что протонируете каждый атом-кандидат и вытягиваете его сопряженную кислоту. В-третьих, определите самую слабую конъюгированную кислоту. Протонированный атом в самой слабой сопряженной кислоте является самым основным атомом в исходной молекуле.
Пример поможет вам разобраться в следующих шагах:
При сканировании молекулы на наличие атомов с неподеленными парами получаются два кандидата: кольцо N и кольцо O.
Затем мы рисуем конъюгированную кислоту каждой группы. (Я нарисовал только кислотную функциональную группу, чтобы сэкономить место.)
Наконец, мы оцениваем относительную кислотность этих воображаемых конъюгированных кислот. Катион пиридиния или pyrH + (pKa +5) является гораздо более слабой кислотой, чем ROh3 + (pKa -2), поэтому N является более основным атомом. Когда исходная молекула вступает в реакцию с кислотой, протоны будут избирательно переходить на N, потому что они будут менее способны покинуть этот атом.
Этот метод может показаться немного запутанным, но после небольшой практики он станет довольно простым.
Метод 2 — сканирование молекулы на предмет наиболее сильной известной основной основной группы
Современные химики-органики склонны сосредотачиваться на силе кислоты. Когда нам нужно подумать о прочности основания, мы вспоминаем старую поговорку: « конъюгированная кислота сильного основания является слабой, а — наоборот, ».Вот почему я впервые показал вам, как найти самый основной атом, глядя на различные сопряженные кислоты.
Однако вы также можете научиться распознавать основные группы и узнавать их относительную реактивность. Если у вас есть эта информация под рукой, вы можете сканировать молекулу непосредственно на наличие этих групп. Обращаясь к молекуле выше, я знаю, что пиридин (C6H5N) является более сильным основанием, чем вода (которую я считаю разновидностью спирта), поэтому N является самым основным атомом в этой молекуле.
Если вы не можете вспомнить свойства общих основных групп, можно также прибегнуть к некоторым общим принципам:
# 1 Важность — отрицательно заряженные основания сильнее нейтральных. Положительно заряженные молекулы редко бывают основными.
# 2 Важность — ищите деактивирующие группы, включая RSO2, RC = O и Ph. Эти группы деактивируют базу.
# 3 Важность — при прочих равных основание N сильнее, чем основание O.
# 4 Важность — в категории функциональной группы используйте эффекты заместителя для сравнения оснований.
Каждый из этих принципов сопровождается важными ограничениями. Они объясняются в эссе «Определите наиболее кислотный H молекулы», и вам следует обратиться к нему за подробным объяснением. Когда вы читаете это эссе, помните, что все, что делает соединение более сильной кислотой, ослабит его конъюгат с основанием и , наоборот, .
Задачи обзора
строится
В основном рекордные | Research
Метил-анион H 3 C — был самым сильным из известных оснований в течение 30 лет, пока Тиан и его коллеги не создали анион монооксида лития в 2008 году, который с тех пор является рекордным. Теперь ученые в Австралии оттеснили LiO – на второе место, создав газофазный дианион с самой высокой основностью из когда-либо обнаруженных.
Супероснования с высоким сродством к протонам, такие как н-бутиллитий и гидрид натрия, имеют фундаментальное значение для органического синтеза. Химики используют их для депротонирования слабых кислот — чем слабее кислота, тем сильнее основание, необходимое для ее депротонирования.
Бервик Поад и его команда из Университета Вуллонгонга, Австралия, занимались поисками сверхосновных многозарядных анионов. Однако этот тип молекулы часто слишком нестабилен, чтобы существовать из-за отталкивания между соседними отрицательными зарядами.Используя вычислительную модель, которая вычисляет скорости переноса электронов, Поад и его коллеги предсказали, что высокосопряженный дианион орто -диэтилбензол может быть стабильным. «Самое интересное в этой работе то, что вы можете предсказать стабильность дианиона, используя теорию Маркуса-Хаша», — говорит Поад. «Сродство протона к дианиону — это достаточно простой расчет, который можно выполнить, но главный вопрос всегда будет заключаться в том, сможете ли вы сделать это экспериментально?» Действительно, команде Поада удалось синтезировать сверхосновный анион, который может даже депротонировать бензол. , в масс-спектрометре с ионной ловушкой.
«Более широкое влияние этого исследования включает возможность того, что новые знания об анионах, основности и инертных противоионах повлияют на коммерчески важные области химии, такие как реформинг нефти, полимеризационный катализ, технология аккумуляторов и технология топливных элементов», — отмечает Роберт Вианелло, эксперт в области межмолекулярных взаимодействий и дизайна новых органических материалов. «Молекулы, которые никогда не были созданы раньше, могут быть разрешены, поэтому многие проблемы, с которыми сталкивается химия, могут превратиться в новые возможности.’
Советы по определению кислотной и щелочной прочности — Концепция
Вот несколько советов и приемов, которые помогут определить, является ли кислота или основание сильной или слабой, а также кислотой или основанием. Здесь у нас есть список, так что у меня есть сильные кислоты.
Сильные кислоты легче запомнить, их всего шесть. Первые 3, которые я собираюсь записать, — это HCL; Соляная кислота, HBr; Бромистоводородная кислота и HI; Йодоводородная кислота. Теперь, если вы заметили, что n-ионы здесь — это Cl, Br и I, значит, все они галогены из группы 7a.Если у меня есть передний водород и галоген, и он водный, то у нас есть сильная кислота. Помните, что сильный означает, что он полностью диссоциирует, поэтому он диссоциирует на ионы H +, а затем на ионы n, так что в данном случае; Cl-, Br- и I-.
Включены все галогены, кроме HF, поэтому не HF. HF на самом деле является слабой кислотой, поэтому просто Cl, Br и I, потому что у них много электронов. Они не так электроотрицательны, как фтор. Фтор — это особый случай. В любом случае остальные 3; HNO3 Азотная кислота, h3SO4 Серная кислота, полностью диссоциирует только первый протон, а затем HClO4 Хлорная кислота.Итак, HNO3, h3SO4, HClO4 и т. Д. Эти 3 также являются сильными кислотами.
Иногда периодическая кислота HIO4 считается сильной, но не всегда. Затем нужно добавить еще один: Hydronium иногда считают сильной кислотой. Это ваши 7, которые вы должны знать, и самый простой способ их идентифицировать — это запомнить их. Если вы запомните сильные кислоты, это упростит задачу.
Теперь перейдем к сильной базе. Все сильные основания, если вы заметили LiOH. У нас есть гидроксид натрия NaOH, гидроксид калия KOH, гидроксид рубидия RbOH, а затем CsOH.Обратите внимание, из какой группы происходит катион, это все катионы группы 1A. Кроме того, все они содержат гидроксид, потому что сильные основания содержат гидроксид. Все катионы группы 1A, катионы металлов плюс гидроксид — все это сильные основания. Затем, переходя к группе 2А, если мы спустимся вниз по списку гидроксид кальция, гидроксид стронция и гидроксид бария. Катионы группы 2A с гидроксидом считаются сильными основаниями, они имеют ограниченную растворимость.
Бериллий и магний, которые являются первыми двумя элементами в группе 2А, не являются сильными основаниями, поэтому не учитываются.Вот только эти 8, так что вы снова запоминаете их, а затем сидите прямо там. Это сильные основания, катионы группы 1A + гидроксид или катионы группы 2A + гидроксид, но здесь перечислены только эти три.
Теперь перейдем к слабым кислотам. Когда у вас слабая кислота, у вас есть практически любая кислота с формулой, и обычно вы обычно видите их с буквой H впереди. Итак, начнем с H в формуле, так что Hydrogen, потому что именно там передается Водород, H +.Вы можете увидеть это, например, в HF или в HC2h402, уксусной кислоте. У вас впереди буква H, и это не одна из тех сильных кислот. Давайте посмотрим, у вас обычно есть H плюс у вас есть n ion. Вот водород, фтор, водород и ацетат-ион.
Или другой вариант, если он заканчивается на COOH. Как Ch4COOH, и это также уксусная кислота, и обратите внимание на то, что это протон или H +, который отдается, когда кислоты отдают свой протон. Вот так бы и было.Слабые кислоты обычно имеют водород впереди или COOH, и последний водород — это тот, который передается в дар.
Кроме того, у нас есть слабые основы, это последний вариант, который мы собираемся рассмотреть. Слабые базы — это в основном любые базы с вашей аминогруппой. Возможно, вы видели слово «аминокислота» как «аминокислота», как на уроке биологии. Амино-группа — это что-то вроде Nh3 или имеет некоторые вариации. Вариация может быть похожа на N или NH, значит, они у нас есть. Примеры слабых оснований — это метиламин N2h5 или Ch4Nh3.Здесь есть водороды, но, если вы заметили, есть некоторая вариация аминогруппы с азотом.
У вас есть слабые основания, и, как правило, помните, что они принимают протоны, поэтому они могут принимать H +. Просто суммирую сильные кислоты и сильные основания; сильные кислоты — это только эти 6 или 7 здесь, которые перечислены. Сильными основаниями являются только те 8, которые перечислены из катионов группы 1A и группы 2A плюс гидроксид. Если вы их запомните, то слабые кислоты и слабые основания их довольно легко идентифицировать.У слабых кислот есть H в начале или на конце COOH, а у слабых оснований есть аминогруппа, обычно что-то с азотом.
Имейте в виду, не все является кислотой или щелочью. Некоторые вещи представляют собой просто старые ионные соединения, поэтому убедитесь, что если вы посмотрите на них, они соблюдают эти правила. Надеюсь, эти уловки помогут вам определить, является ли кислота или основание сильной или слабой, и немного больше помогут вам с химическим составом кислотных оснований. Всего хорошего.
Nerdfighteria Wiki — Сильнейшие базы в мире
Хэнк: Этот эпизод о самых простых вещах в мире.Но я не имею в виду такие простые вещи, как «тьфу, она такая простая» — мы говорим о химически основном, как о противоположности кислоты.
Если вещество является основным, то говорят, что оно имеет высокое сродство к водороду, а это означает, что оно хорошо связывается с ионами водорода. Как и в случае с суперсильными кислотами, существует целый класс особо сильных оснований, называемых супербазами. у нас есть идея, что кислоты — самое страшное из всех химических соединений, но основания могут быть не менее опасными. И только в прошлом году австралийским исследователям удалось создать сильнейшее из когда-либо обнаруженных супероснований — соединение под названием орто-диэтинилбензолдианион.
У большинства основ есть несколько характеристик: они обычно горькие и скользкие, как мыло. На самом деле это обычное применение основ — изготовление мыла. Такие основания, как гидроксид натрия или щелок, сочетаются с жирными кислотами в растительном масле или животном жире с образованием солей натрия, которые помогают воде удалять жир с вашей кожи. Поэтому, когда гидроксид натрия кажется вам скользким, на самом деле гидроксид натрия взаимодействует с маслами вашей кожи, образуя нечто вроде мыла.Но я не могу рекомендовать мыть руки простыми веществами. Потому что горит. Как много. Сильные основания горят так же плохо, как и сильные кислоты.
Самым распространенным способом измерения прочности основания является шкала pH, которая обычно находится в диапазоне от 0 до 14. Шкала работает, описывая поведение вещества при смешивании с водой.
В чистой воде некоторые молекулы воды расщепляются на положительно заряженные ионы водорода и отрицательно заряженные ионы гидроксида.Если раствор имеет pH 7, это означает, что имеется равное количество этих ионов водорода и гидроксида. Они уравновешены. Но когда соединение выше по шкале pH — и, следовательно, более щелочное — это означает, что оно с большей вероятностью связывается с ионами водорода, смещая баланс, так что гидроксид-ионов становится больше.
На один шаг по шкале pH означает, что в растворе содержится десятая часть ионов водорода. Таким образом, что-то с pH 8 оставляет 1 ион водорода на каждые 10 гидроксид-ионов.А более экстремальная основа — скажем, очиститель канализации с pH 14 — оставит только 1 ион водорода на каждые 10 миллионов гидроксид-ионов. Технически у вас может быть pH даже выше. Действительно высокая концентрация гидроксида натрия в воде может иметь pH 15, что означает, что на каждые 100 миллионов гидроксид-ионов приходится только 1 водород.
Но что-то странное происходит с соединениями, которые обладают еще более высоким сродством к ионам водорода. Потому что, если основание намного прочнее, оно действительно способно полностью реагировать с водой, отрывая ионы водорода от молекул воды в процессе, известном как депротонирование.А вещества, которые на это способны, считаются суперосновными.
Когда основание становится достаточно сильным, чтобы депротонировать воду, шкала pH больше не работает. Но вы можете измерить его силу на основе сродства к протонам: количества энергии, которое выделяется при связывании с водородом. Чем выше сродство к протону, тем сильнее основание.
Так, например, гидроксид натрия выделяет около 250 килокалорий энергии на каждый моль, что составляет около шестисот миллиардов триллионов молекул.В то время как рекордный дианион орто-диэтинилбензола имеет протонное сродство 440 килокалорий на моль. Трудно представить, что это на самом деле означает, но скажите так: есть соединение под названием бензол, которое, как известно, особенно стабильно.
По сути, это всего лишь шесть атомов углерода в кольце, по одной водородной связи с каждым атомом углерода. Но дианион орто-диэтинилбензола настолько щелочной, что может даже оттягивать ионы водорода из бензола.
Исследователи все еще ищут практическое применение орто-диэтинилбензолдианиона.Но у нас уже есть множество применений для других супербазов. Возьмем, к примеру, гидрид натрия — супероснование, которое просто связано натрием с водородом. Поскольку супероснования быстро реагируют с водой, гидрид натрия можно использовать в качестве сушильного агента для сушки химикатов в лаборатории.
Гидрид натрия также был предложен в качестве способа хранения водорода, чтобы водород можно было использовать в качестве топлива. Гидрид натрия можно объединить с водой для получения гидроксида натрия и газообразного водорода.
И поскольку они очень хорошо удаляют водород, супероснования также могут использоваться в определенных реакциях конденсации и полимеризации, где более мелкие молекулы соединяются в более крупные.Таким образом, даже несмотря на то, что супероснования отлично справляются с разрывом некоторых молекул, вы можете использовать эту силу, чтобы соединить другие молекулы.
Спасибо за просмотр этого выпуска SciShow, который был предоставлен вам нашими покровителями на Patreon. Спасибо всем этим людям. Если вы хотите помочь поддержать это шоу, просто зайдите на patreon.com/scishow. И не забудьте зайти на youtube.com/scishow и подписаться!
Таблица кислотной и щелочной прочности
Таблица кислотной и щелочной прочности
Таблица кислот и оснований
Прочность
Ка | Кислота | База | ||
Имя | Формула | Формула | Имя | |
Большой | хлорная | HClO 4 | ClO 4 — | Перхлорат-ион |
3.2 * 10 9 | Hydroiodic | Привет | I- | Йодид |
1.0 * 10 9 | Кислота бромистоводородная | HBr | руб .- | Бромид |
1.3 * 10 6 | Кислота соляная | HCl | Cl- | Хлорид |
1.0 * 10 3 | Серная кислота | H 2 СО 4 | HSO 4 — | Ион сероводорода |
2.4 * 10 1 | Азотная кислота | HNO 3 | НЕТ 3 — | Нитрат-ион |
——— | Гидроний | H 3 O + | H 2 O | Вода |
5.4 * 10 -2 | Щавелевая кислота | HO 2 C 2 O 2 H | HO 2 C 2 O 2 — | Ион оксалата водорода |
1.3 * 10 -2 | Сернистая кислота | H 2 SO 3 | HSO 3 — | Ион сероводорода |
1.0 * 10 -2 | Ион сероводорода | HSO 4 — | СО 4 2- | Сульфат-ион |
7.1 * 10 -3 | Фосфорная кислота | H 3 PO 4 | H 2 PO 4 — | Дигидроген |
7.2 * 10 -4 | Азотистая кислота | HNO 2 | НЕТ 3 — | Нитрит-ион |
6,6 * 10 -4 | Плавиковая кислота | HF | Ф — | Ион фтора |
1.8 * 10 -4 | Метановая кислота | HCO 2 H | HCO 2 — | Метаноат |
6,3 * 10 -5 | Бензойная кислота | С 6 В 5 COOH | C 6 H 5 COO- | Бензоат-ион |
5.4 * 10 -5 | Ион оксалата водорода | HO 2 C 2 O 2- | О 2 С 2 О 2 2- | Ион оксалата |
1.8 * 10 -5 | Ethanoic | CH 3 COOH | CH 3 COO | Ethanoate |
4,4 * 10 -7 | Угольная кислота | CO 3 2- | HCO 3 — | Ион карбоната водорода |
1.1 * 10 -7 | Сероводородная кислота | H 2 S | HS- | Ион сероводорода |
6,3 * 10 -8 | Дигидроген | H 2 PO 4 — | HPO 4 2- | Ион фосфата водорода |
6.2 * 10 -8 | Ион сероводорода | ГС — | S 2- | Сульфит-ион |
2,9 * 10 -8 | Кислота хлорноватистая | HClO | ClO — | Гипохлорит-ион |
6.2 * 10 -10 | Синильная кислота | HCN | CN — | Цианид-ион |
5,8 * 10 -10 | Ион аммония | NH 4 + | NH 3 | Аммиак |
5.8 * 10 -10 | Кислота борная | H 3 BO 3 | H 2 BO 3 — | Дигидроген |
4,7 * 10 -11 | Ион карбоната водорода | HCO 3 — | CO 3 2- | Карбонат-ион |
4.2 * 10 -13 | Ион фосфата водорода | HPO 4 2- | PO 4 3- | Ион фосфата |
1,8 * 10 -13 | Дигидроген | H 2 BO 3 — | HBO 3 2- | Ион борат водорода |
1.3 * 10 -13 | Ион сероводорода | HS- | S 2- | Сульфид-ион |
1,6 * 10 -14 | Ион борат водорода | HBO 3 2- | БО 3 3- | Борат-ион |
——— | вода | H 2 O | OH- | Гидроксид |
1.Сильные кислоты перечислены в верхнем левом углу.
стороны таблицы и имеют значения Ka> 1
2. Кислота со значениями меньше единицы считается слабой.
3. Сильные основания перечислены в правом нижнем углу таблицы и становятся слабее.
по мере продвижения к началу таблицы.
Объяснение силы органических оснований
ОРГАНИЧЕСКИЕ ОСНОВЫ
На этой странице объясняется, почему простые органические основы являются основными, и рассматриваются факторы, влияющие на их относительную силу.Для целей A’-уровня все основания, которые нас интересуют, являются первичными аминами — соединениями, в которых один из атомов водорода в молекуле аммиака, NH 3 , замещен либо алкильной группой, либо бензольным кольцом.
Почему первичные амины являются основными?
Аммиак как слабое основание
Все рассматриваемые нами соединения получены из аммиака, поэтому мы начнем с выяснения причины его основных свойств.
Для целей этой темы мы возьмем определение основания как «вещества, которое соединяется с ионами водорода (протонами)». Мы собираемся измерить это, посмотрев, насколько легко основания забирают ионы водорода из молекул воды, когда они находятся в растворе в воде.
Аммиак в растворе устанавливает это равновесие:
Ион аммония образуется вместе с ионами гидроксида. Поскольку аммиак является лишь слабым основанием, он не очень эффективно удерживает дополнительный ион водорода, и поэтому реакция обратима.В любой момент около 99% аммиака присутствует в виде непрореагировавших молекул. Положение равновесия лежит значительно левее.
Аммиак реагирует как основание из-за активной неподеленной пары на азоте. Азот более электроотрицателен, чем водород, и поэтому притягивает к себе связывающие электроны в молекуле аммиака. Это означает, что в дополнение к неподеленной паре вокруг атома азота накапливается отрицательный заряд. Эта комбинация лишнего негатива и активной одинокой пары привлекает новый водород из воды.
Сравнение сильных сторон слабых оснований
Сильные стороны слабых оснований измеряются по шкале pK b . Чем меньше число на этой шкале, тем прочнее основание.
Три соединения, которые мы будем рассматривать, вместе с их значениями pK b составляют:
Помните — чем меньше число, тем сильнее основание. Сравнивая два других с аммиаком, вы увидите, что метиламин является более сильным основанием, тогда как фениламин намного слабее.
Метиламин типичен для алифатических первичных аминов, где группа -NH 2 присоединена к углеродной цепи. Все алифатические первичные амины являются более сильными основаниями, чем аммиак.
Фениламин типичен для ароматических первичных аминов, где группа -NH 2 присоединена непосредственно к бензольному кольцу. Это намного более слабые основания, чем аммиак.
Объяснение различий в прочности основания
Факторы, которые следует учитывать
Два фактора, которые влияют на прочность основания:
легкость, с которой неподеленная пара улавливает ион водорода,
стабильность образующихся ионов.
Почему алифатические первичные амины более сильные основания, чем аммиак?
Метиламин
Метиламин имеет структуру:
Единственное различие между ним и аммиаком — это присутствие группы CH 3 в метиламине. Но это важно! Алкильные группы имеют тенденцию «отталкивать» электроны от себя. Это означает, что на атоме азота будет накапливаться небольшой дополнительный отрицательный заряд.Эта дополнительная отрицательность вокруг азота делает неподеленную пару еще более привлекательной для ионов водорода.
Повышение отрицательности азота помогает неподеленной паре улавливать ион водорода.
Как насчет эффекта на образовавшийся положительный ион метиламмония? Является ли он более стабильным, чем простой ион аммония?
Сравните ион метиламмония с ионом аммония:
В ионе метиламмония положительный заряд распространяется вокруг иона за счет «выталкивающего электрон» эффекта метильной группы.Чем больше вы можете распространять заряд, тем более стабильным становится ион. В ионе аммония нет никакого способа распространить заряд.
Суммировать:
Азот в метиламине более отрицательный, чем в аммиаке, поэтому он легче захватывает ионы водорода.
Ион, образованный из метиламина, более стабилен, чем ион, образованный из аммиака, и поэтому вероятность его повторного выделения менее вероятна.
В совокупности это означает, что метиламин является более сильным основанием, чем аммиак.
.
