Содержание
Кристаллическая решетка ромбическая — Справочник химика 21
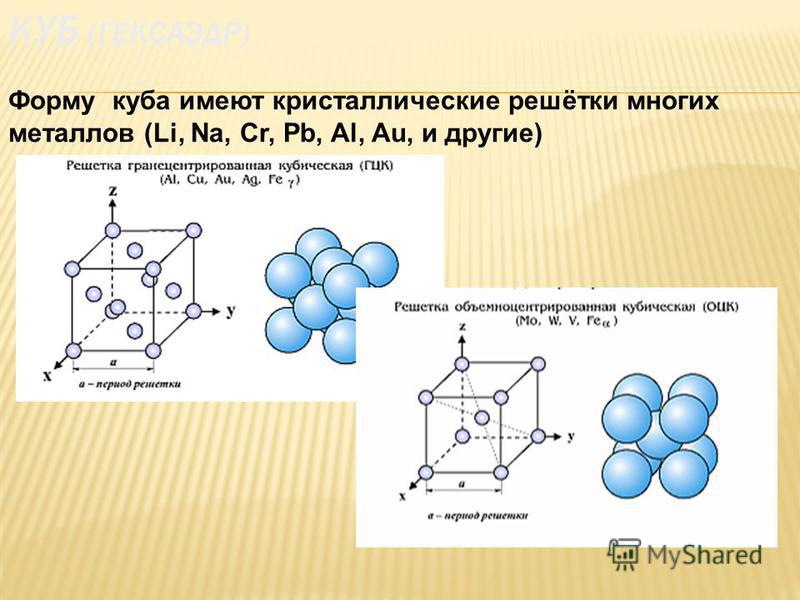
Кристаллическая решетка Ромбическая, а = 4,52 А Ь = 7,66 А с = 4,53 А Тетрагональ- ная, а = 4,60 А с = 4,95 А а-Т1 гексагональная, а = 3,46 А с = 5,53 А Р-Т10 230° С) кубическая гране-центрированная, а = 3,88 А [c.290]
Таким образом, при образовании простых веществ из элементов в общем случае выделяются две стадии химического превращения атом — молекула и молекула — координационный кристалл Уже на первой стадии из одного элемента может образоваться несколько простых веществ. Например, из элемента кислорода образуются два простых вещества Оа и Оз, различающихся составом, строением, а следовательно, и свойствами. Элемент сера в парообразном состоянии существует в виде молекул 5,, 5 , причем равновесие между различными молекулярными ( )ормами зависит от температуры. На второй стадии образования простых веществ возникающие координационные кристаллы в зависимости от внешних параметров равновесия — температуры и давления — существуют в различных структурах (полиморфизм) Одному элементу соответствует несколько простых веществ (полиморфные модификации), различающихся типом кристаллической решетки ромбическая и моноклинная сера, белый, красный и черный фосфор, ГЦК и ОЦК модификации железа и т.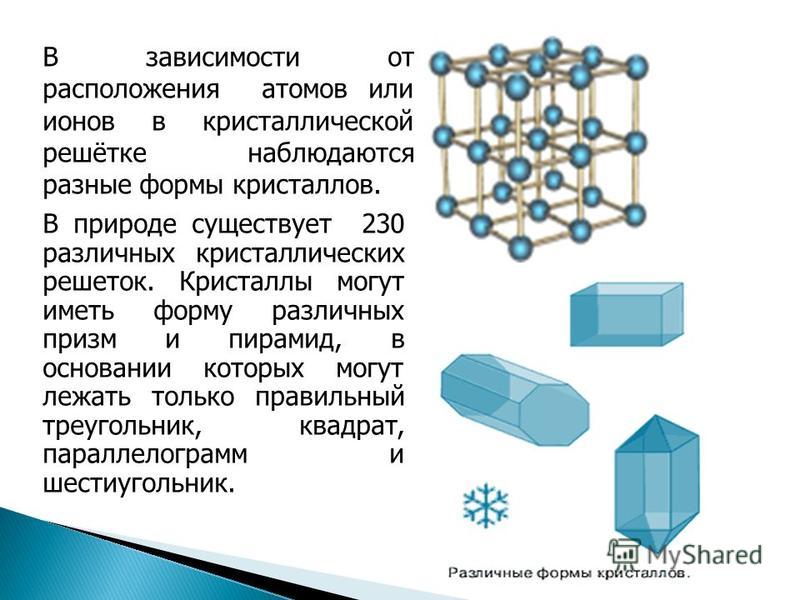 п. [c.28]
п. [c.28]
Свойства. Л1 197,1. Растворимость (20 °С) в 2 н. растворе гидроксида калия 224,7 г/л в 10 н. растворе гидроксида калия 3,15 г/л. Кристаллическая решетка ромбическая, пр. гр. Рпта (а=7,66 А Ь=5,89 А с= 10,33 А). [c.1687]
Свойства. Светло-желтые игольчатые устойчивые на воздухе кристаллы. d 4,21 (18°С). Кристаллическая решетка ромбическая (а=10,10 А 6=22,41 А и с=4,56 А). При сильном высушивании в эксикаторе теряет [c.840]
Переход ромбической серы в моноклинную происходит очень медленно, поэтому при быстром нагревании удается сохранить кристаллическую решетку ромбической серы при температурах выше 95,5° С, т. е. в области устойчивости моноклинной серы (это метастабильное состояние 8р на диаграмме состояния показано пунктирной линией АО). Метастабильная 5р устойчива только при отсутствии стабильной моноклинной серы. [c.185]
Свойства. Темная свинцово-серая кристаллическая масса с синеватым металлическим блеском мягкая, легко растирается в порошок и оставляет след на бумаге полупроводник (ширина зоны 1,25 эВ). Кристаллическая решетка ромбическая (а=4,33 А й= 11,18 А с=3,98 А). 880 °С при затвердевании расплава в интервале 600—400 °С наблюдается заметное увеличение объема (полиморфный переход при 584 °С), и поэтому тонкостенные сосуды разрываются кип 1210°С (в инертном газе) 5,1. Возгоняется без разложения в потоке водорода. При сильном нагревании на воздухе окисляется с образованием ЗпОг. В 100 г воды при 18 °С растворяется 1,36-10 г SnS. Растворяется в концентрированной соляной кислоте и в желтом сульфиде аммония, вступая с ними в химические реакции. [c.830]
Темная свинцово-серая кристаллическая масса с синеватым металлическим блеском мягкая, легко растирается в порошок и оставляет след на бумаге полупроводник (ширина зоны 1,25 эВ). Кристаллическая решетка ромбическая (а=4,33 А й= 11,18 А с=3,98 А). 880 °С при затвердевании расплава в интервале 600—400 °С наблюдается заметное увеличение объема (полиморфный переход при 584 °С), и поэтому тонкостенные сосуды разрываются кип 1210°С (в инертном газе) 5,1. Возгоняется без разложения в потоке водорода. При сильном нагревании на воздухе окисляется с образованием ЗпОг. В 100 г воды при 18 °С растворяется 1,36-10 г SnS. Растворяется в концентрированной соляной кислоте и в желтом сульфиде аммония, вступая с ними в химические реакции. [c.830]
МпР /пл 1147 С. Кристаллическая решетка ромбическая, пр. гр. Рпта (я=5,258 А =3,172 А с=5,918 А) собственный структурный тип. [c.1693]
Кристаллическая решетка ромбическая (а=8,22 А i=8,H А с= =9,31 А). Растворяется в воде гидролиз при 0°С происходит очень медленно. Разлагается выше 125 °С. [c.870]
Разлагается выше 125 °С. [c.870]
Свойства. Кристаллическая решетка ромбическая. В 100 г раствора при 0°С растворяются 2,1 г соли. [c.878]
Тип кристаллической решетки Ромбическая (а-5, комнатная температура) Моноклинная (Р-5, 7-3, комнатная температура) Ромбоэдрическая (а-Зе) Ромбоэдрическая [c.512]
Окись свинца РЬО известна в двух модификациях низкотемпературной а-РЬО (глет) и высокотемпературной Р-РЬО (массикот). Окись а-РЬО красного цвета, кристаллическая решетка тетрагональная Р-РЬО желтого цвета, кристаллическая решетка ромбическая. [c.154]
Кристаллическая решетка. . ромбическая тетрагональ- гексагональ- [c.77]
Свопства. Белый кристаллический порошок, d 4,71 (20 °С). Кристаллическая решетка ромбическая. При иагреванни до 350°С, ударе или толчках взрывается. Плохо растворяется в воде при кипячении разлагается. Не растворяется в концентрированном растворе аммиака хорошо растворим в уксусной кислоте, но при этом происходит медленное разложение препарата. [c.848]
[c.848]
Свойства. Темио-красные иглы. Кристаллическая решетка ромбическая пр. гр. РЬса (а= 11,65 А =14,06 А с=6,03 А), d 3,3. T U растворяется в воде с разложением, в растворах соляиой кислоты образуется [T le] . [c.1703]
Кристаллическая решетка ромбическая, пр. гр. P2i2i2i (а=26,58 А 6= =9,52 А с=6,70 А). ИК-спектры приведены в работе [2]. Очень гигроскопичное вещество. [c.1719]
Свойства. Черные кристаллы, d 4,4. Кристаллическая решетка ромбическая (а=11,07 А 6=13,48 А с=10,19 А). Парамагнетик, при 300 К Хафф = =3,32 (д,в. В воде, основаниях и разбавленных кислотах быстро гидролизуется. Растворы в метаноле и ацетоне окрашены в пурпурный цвет сравнительно устойчивы. Мало растворим в спирте и эфире. [c.1730]
Свойства. Черные кристаллы в форме пластииок. 5,10. Кристаллическая решетка ромбическая, пр. гр. РЬса (а= 12,625 А 6=12,953 А с= 10,141 А) кратность связи Re—Re — четыре заслоненная конфигурация фрагментов ReBr . ИК- и КР-спектры см. в работе [2]. [c.1733]
ИК- и КР-спектры см. в работе [2]. [c.1733]
Свобства. Темно-красные кристаллы, d 4,5. Кристаллическая решетка ромбическая, пр. гр. Ата2 (а= 10,69 А 6=14,00 А с= 14,06 А). Диамагнетик, пьезоэлектрик. [c.1734]
Кристаллическая решетка Ромбическая Кубиче- ская Ромбиче- ская Ромбиче- ская — Ромбиче- ская Моноклинная 1 [c.1214]
Значения потенциалов ноннзацни /(эВ) 11,84 21,6 35,9. Сродство к электрону Вг — Вг- 3,56 эВ. Электроотрицательиость 2,9. Молекула бро-ма состоит из двух атомов Вгг, связь между которыми ковалентная неполярная диссоциация на атомы становится заметной при температуре около 1073 К диссоциация наблюдается и при действии света. Кристаллическая решетка ромбическая с периодами решетки (нм) а = 0,449 й = 0,668 с=0,874 координационное число равно 1. [c.432]
У синдиотактического 1,2-полибутадиена кристаллическая решетка ромбического типа а = 10,98 А Ь = 6,60 А с = 5,14 А. В литературе наиболее полно представлены данные о кристаллизации 4-полибутадиена. Неоднократно отмечалось 122,123 полибутадиен имеет широкий интервал температур кристаллизации и две или более температуры плавления, ранличающиеся на 10— 15° С. Температуры кристаллизации и плавления в значительной степени зависят от скорости нагревания и охлаждения 123,124 причем существование двух точек плавления (накладывающихся друг на друга) иногда относили 2з неравновесных процессов, проте- [c.57]
В литературе наиболее полно представлены данные о кристаллизации 4-полибутадиена. Неоднократно отмечалось 122,123 полибутадиен имеет широкий интервал температур кристаллизации и две или более температуры плавления, ранличающиеся на 10— 15° С. Температуры кристаллизации и плавления в значительной степени зависят от скорости нагревания и охлаждения 123,124 причем существование двух точек плавления (накладывающихся друг на друга) иногда относили 2з неравновесных процессов, проте- [c.57]
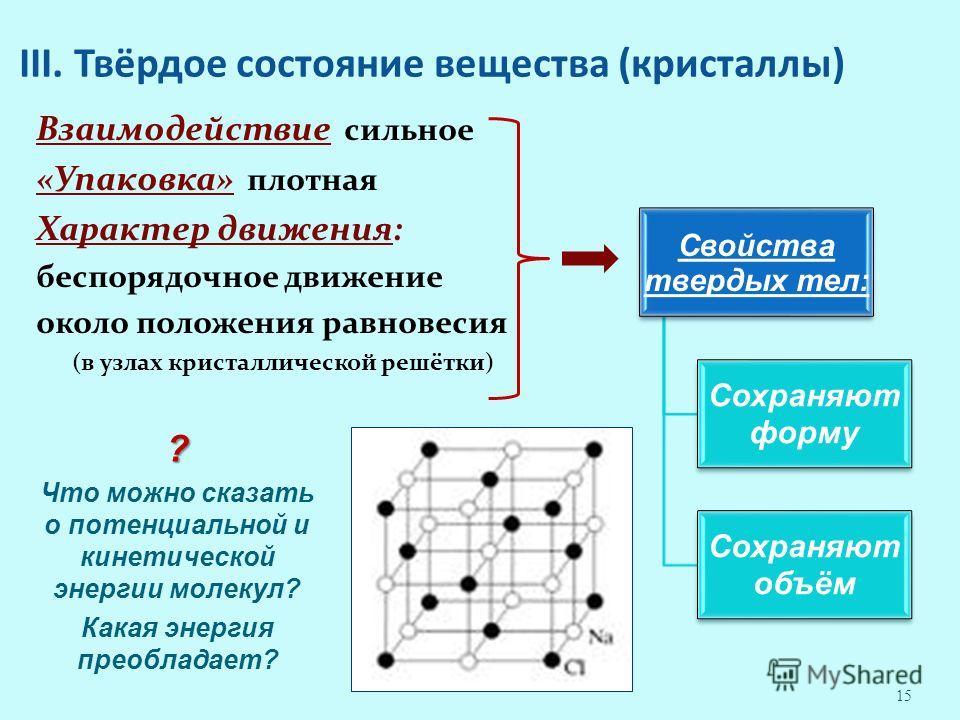
Какой тип кристаллической решетки? Сера, фосфор, углерод находятся в твердом состоянии. У них атомные кристаллические решетки.
Чтобы посмотреть этот PDF файл с форматированием и разметкой, скачайте его и откройте на своем компьютере.
1
Урок
—
лекция по теме «Сера. Положение в периодической системе. Строение атома.
Свойства».
(9
класс
)
Учитель химии высшей категории
СОШ №7 г. Уральска ЗКО Зубкова Н.Д.
Цели урока
: Продолжить формирование понятий «химический элемент», «простое
вещество»,
«химические реакции». Знать понятие флотации, аллотропные видоизменения
серы, причину их образования, физические свойства серы, области применения серы.
Образовательные задачи:
научить школьников
доказывать химические свойства
серы, составлять уравнения р
еакций в молекулярном виде и с точки зрения окислительно
—
восстановительных процессов.
Развивающая задача:
с
пособствовать дальнейшему развитию мировоззренческих
знаний о причинно
—
следственной связи между составом и применением вещества (на примере
серы).
Во
спитательная задача:
воспитать интерес к предмету при помощи новых и
увлекательных сведений
Ход урока
.
1.
Подготовка к восприятию нового материала
.
Фронтальная беседа по вопросам прошлого ур
ока.
—
Какое положение занимают неМе в Периодической системе?
Неметаллы занимают правый верхний угол П. С. 22 не
С. 22 не
Ме. Располагаются в главных п/г
.
—
Чем отличаются атомы неМе от атомов Ме по строению?
Атомные радиусы неМе меньше, атомные радиусы Ме. На внешней оболочке атомов неМе
содержится от 4
—
х до 8
—
и электронов
(исключение водород, бор, гелий).
—
Как строение атомов неМе влияет на их окислительно
—
восстановительные свойства?
У типичных неМе внешние
электронные слои близки к завершению, поэтому неМе способны
принимать электроны, т.е. проявляют окислительные свойства.
—
Как изменяются окислительные свойства неМе в периодах и группах?
В периодах окислительные свойства неМе усиливаются слева на право, а г
руппах
уменьшаются сверху вниз. Это связано с тем, что сверху вниз увеличиваются атомные
радиусы, а слева на право
возрастает число электронов на внешней оболочке.
—
В каком агрегатном состоянии неМе встречаются в природе? Какой тип кристаллической
решет
ки?
Сера, фосфор, углерод находятся в
твердом
состоянии. У них атомные кристаллические
У них атомные кристаллические
решетки. Кислород, водород, азот, фтор, хлор имеют молекулярную кристаллическую
решетку и в обычных условиях газообразны.
—
Что такое аллотропия? Для каких элементов
характерно это явление?
Аллотропия
это явление существования
химического
элемента в виде нескольких простых
веществ. Например, элемент кислород образует два пр
остых вещества кислород и
озон
О
2
и
О
3
, углерод образует простые вещества алмаз, графит,
уголь.
2.
Изучение нового материала
(Лекция)
План.
1.
История открытия серы.
2
2.
Положение в Периодической системе.
3.
Строение атома.
4.
Физические свойства.
5.
Нахождение в природе.
6.
Получение.
7.
Химические свойства. Применение.
1.
История открытия серы.
«…Вдруг раздались раска
ты грома и от горного пламени покатились вниз черные
серные пары. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти,
Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти,
но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и
задохнулся». Так погиб ве
личайший ученый древности Плиний старший. Это случилось в 79
году н.э. во время извержения вулкана Везувия
. Пепел засыпал два цветущих и богатых
города
Геркуланум и Помпею. Ядовитый сернистый газ задушил многие сотни людей.
(Слайд «Последний день Помпеи»
К. Брюллов)
Сернистый газ
первое соединение серы, с которым познакомились люди. Долгое
время знали только об удушающих качествах SO
2
—
сернистого газа и никто не подозревал, что
со временем он станет очень важным сырьем для химической промышленности. Газ
образуется при горении серы
элемента, сыгравшего в истории химии огромную роль,
подобно закону Архимеда в эволюции физики.
Сера
одно из важнейших простых веществ, о которых знало человечество, «начало
начал» древнейших философов и алхимиков, элемент,
окутанный мистикой и тайнами.
Жрецы использовали её в составе «священных курений» при некоторых религиозных
обрядах. Разные горючие смеси для военных целей также содержат серу. Ещё у Гомера
упоминаются «сернистые испарения» и смертельное действие продуктов
горения сер
ы. Она
входила в состав «греческого огня», наводившего ужас на противников.
В 941 году под стенами Царьграда был уничтожен флот киевского князя Игоря. В
летописном своде событий «Повесть временных лет», составленном в Киеве, так описан
поход Иг
оря: «Словно
молнию,
которая на небе, греки имеют у себя и пускали её, сжигая нас,
поэтому
мы и не одолели их». Дружинники князя защищались от «греческого огня» щитами,
воловьими шкурами, но потерпели поражение. Греки выбрасывали горящую смесь через
медные
трубы, установленные на бортах византийских кораблей. Состав э
той смеси был
неизвестен. Греки держали его в секрете. Предполагают, что в неё входили нефть, различные
горючие масла, смола, селитра, клей, сера и вещества, окрашивающие пламя.
Горючесть серы,
легкость с которой она соединяется с металлами, объясняют причину,
почему её считали «принципом горючести», и обязательной составной частью
металлических
руд. Наивное верование алхимиков о сере выражено в небольшом стихотворении
Н.А.Михайловым:
Семь металлов создал свет,
По числу семи планет:
Дал нам Космос на добро
Медь, железо, серебро,
Злато, олово, свинец…
Сын мой! Сера им отец!..
(Слайд)
Алхимики рассчитывали превратит
ь разные металлы в золото, для этого, по их мнению
достаточно было лишь отделить от них серу.
3
Элементарную природу серы установил француз Антуан Лоран Лавуазье (по
образованию юрист, а по призванию химик) в своих опытах по сжиганию. Слово «СЕРА», или
же «С
ИРА» по
—
с
анскритски означает «светло
—
желтый».
2.
Положение в Периодической системе.
Сера
элемент 3
—
го периода,
VI
группы главной подгруппы (
VI
А), относительная
атомная масса 32, порядковый номер 16.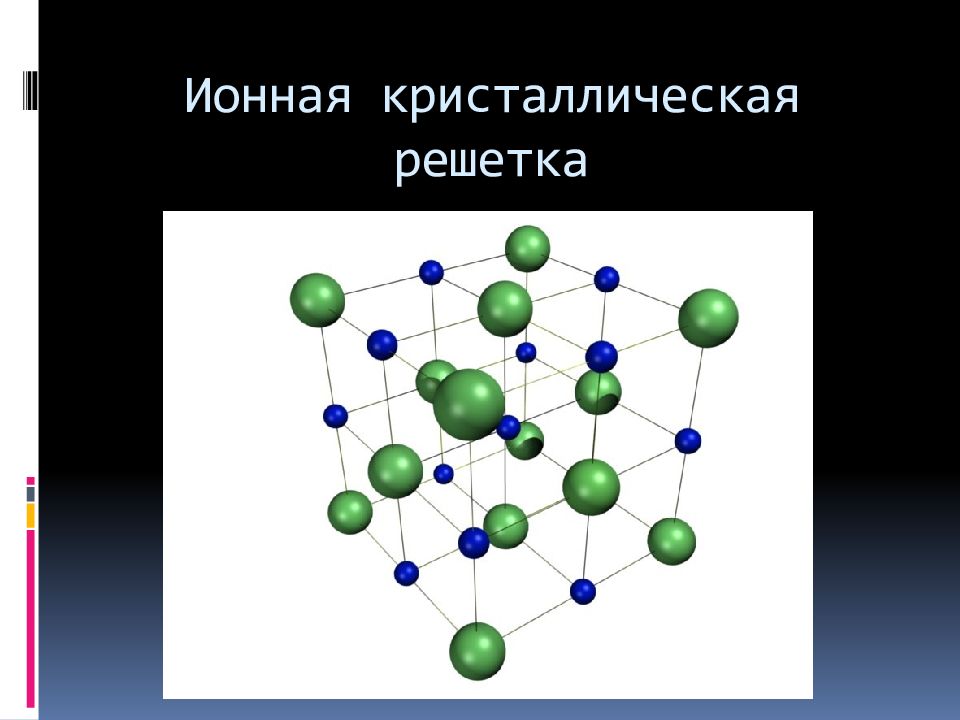 Поэтому в ядре атома серы находится 16 протонов и
Поэтому в ядре атома серы находится 16 протонов и
16 н
ейтронов общее число
электронов
16.
(Слайд)
3.
Строение атома.
В атоме серы 3
—
и
энергетических уровня, электроны распределены 2,8,6. Электронная
формула: 1
S
2
2
S
2
2
P
6
3
S
2
3
P
4
. В атоме серы 6 валентных электронов, расположенных на 3
—
м
энергетическом уровне. (На
слайде графические формулы нормального и возбужденных
состояний атома серы).
В нормальном состоянии сера проявляет валентность
II
, а в
возбужденном
IV
и
VI
. Степени окисления
—
2, 0, +4, +6. Соответствующие соединения H
2
S, S,
SO
2
, SO
3
.
4.
Физические свойства.
Сера
это порошок желтого цвета. Она плохо растворяется в воде и даже не
смачивается водой, поэтому порошок серы всплывает (флотация).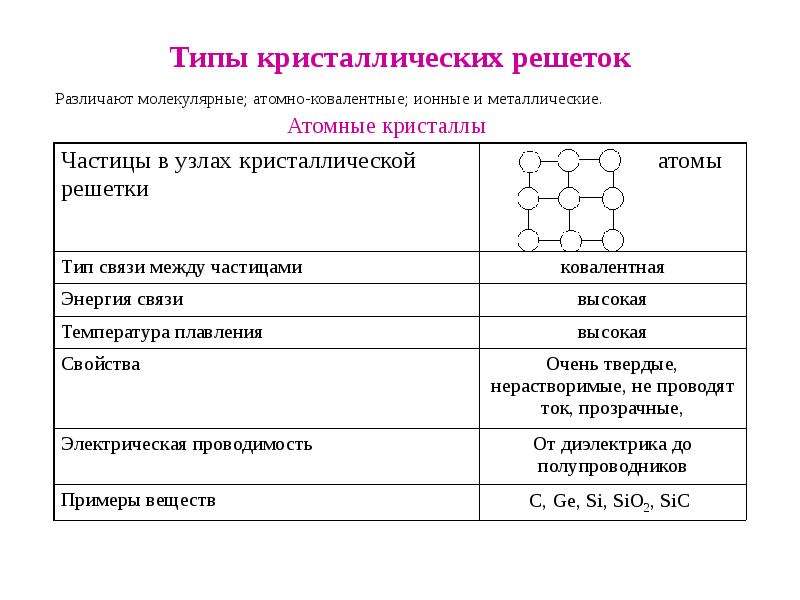 Сера не проводит
Сера не проводит
электрический
ток и теплоту,
температура плавления +119
О
С, температура кипения +444,6
О
С,
плотность
2,06 г/см
3
. Для серы характерно несколько аллотропных модификации,
отличающихся друг от друга строением молекул и некоторыми свойствами. (Слайд)
Ромбическая сера, моноклинная, пластическая. Наиболее устойчива при обычных условиях
при нормальном давлении и
температуре 95,6 С является ромбическая сера. Пластическая
сера состоит из нерегулярно расположенных зигзагообразных цепочек Sn, где
n
достигает
нескольких тысяч.
5.
Нахождение в природе.
В земной коре содержится 0,04% серы (Слайд). Как реально представить се
бе такое
количество? Попробуем решить простую задачу: сколько серной кислоты можно получить из
всей серы встречающейся на Земле? Расчет даёт огромн
ую цифру: 3,16х1016 тонн, или 2х
107
кубических километров серной кислоты.
Такой массой кислоты можно наполнит
ь примерно
1000 водоемов, равных озеру Байкал.
Свободная (самородная) сера
Цинковая обманка ZnS Горькая соль
MgSO
4
*
7
H
2
O
Киноварь
HgS
Тяжелый шпат BaSO
4
Свинцовый блеск
PbS
Гипс
CaSO
4
*2
H
2
O
Медный колчедан
CuS
Железный колчедан (пирит)
FeS
2
Глауберова соль
Na
2
SO
4
*10
H
2
O
ZnS
—
«
Цинковая обманка» это название дали минералу немецкие рудокопы, за то, что от
бывает прозрачным и не напоминает сернистую руду. Если сульфид цинка обработать особым
4
способом,
он начинает
светиться в темноте, эта его особенность применяется в
рентгеновской технике
.
HgS
киноварь, ярко
—
красного цвета, древние индийцы называли её «драконьей кровью». В
древней Руси киноварь была одной из самых распространенных минеральных красок,
переписчики к
ниг писали её заставки. Источник получения ртути.
FeS
2
пирит «огненный камень». Ярко
—
желтого цвета, был хорошо знаком древним грекам,
ударяя камнем по камню они высекали искры. «Пирит»
—
огонь. У эскимосов полярной
Америки до сих пор находит применение
«огненный камень».
Свинцовый блеск
—
PbS
, медный колчедан
—
CuS
, ZnS
—
сульфид цинка
используют для
получения металлов: свинца, меди, цинка.
Гипс
—
CaSO
4
*2
H
2
O
в зависимости от разных примесей, может быть от прозрачно
—
белого до
бурого, желтого и нежно
—
розового цвета. Применяется в строительстве, хирургии, скульптуре.
Na
2
SO
4
*10
H
2
O
мирабилит («чудесная соль») или Глауберова соль. В начале 17 века в
Германии жил химик Иоганн Рудольф Глаубер. Будучи тяжело больным, он по совету
знакомых стал пить воду
одного источника
и вылечился. Он заинтересовался составом воды,
выпарил её и в чашке остались белые кристаллы какой
—
то соли. Впоследствии он получил
подобные кристаллы из поваренной соли и серной кислоты. В память о своём излечении
назвал полученную им сол
ь мирабилитом, но чаще её называют глауберовой сол
ь
ю.
MgSO
4
придает морской воде горько
—
соленый вкус, за это её называют «горькой солью». В
медицине используется в качестве слабительного.
6.
Получение серы.
Добыча серы основана на её легкоплавкости. В
древности выплавка серы была
примитивной. Большой глиняный горшок с отверстиями в дне заполняли породой,
содержащей серу. Этот горшок ставили на другой, вкопанный в землю. Нехитрый «аппарат»
Этот горшок ставили на другой, вкопанный в землю. Нехитрый «аппарат»
нагревали. Сера плавилась и стекала из отверстий в нижний горшок.
Шли века, и способ
выплавки серы совершенствовался.
Американский инженер Фраш предложил оригинальное решение. Через систему
вложенных друг в друга труб, под землю нагнетается перегретый водяной пар, который
расплавляет серу и выталкивает её на поверхность
. Так в 19 веке на полуострове Флорида
забил фонтан чистой расплавленной серы.
Советский
инженер Волков предложил получать каракумскую серу, содержащую
примеси песка, иным способом
. Он соорудил простой аппарат, чем
—
то напоминающий
самовар. Этот сосуд запол
няли размельченной рудой, которую смешивали с водой, и
начинали кипятить. Расплавленная сера собиралась внизу и выливалась из «самовара» ровной
чистой струёй.
В настоящее время способ усовершенствован. «Самовар» заменили герметически
закрывающимся котлом
—
а
втоклавом.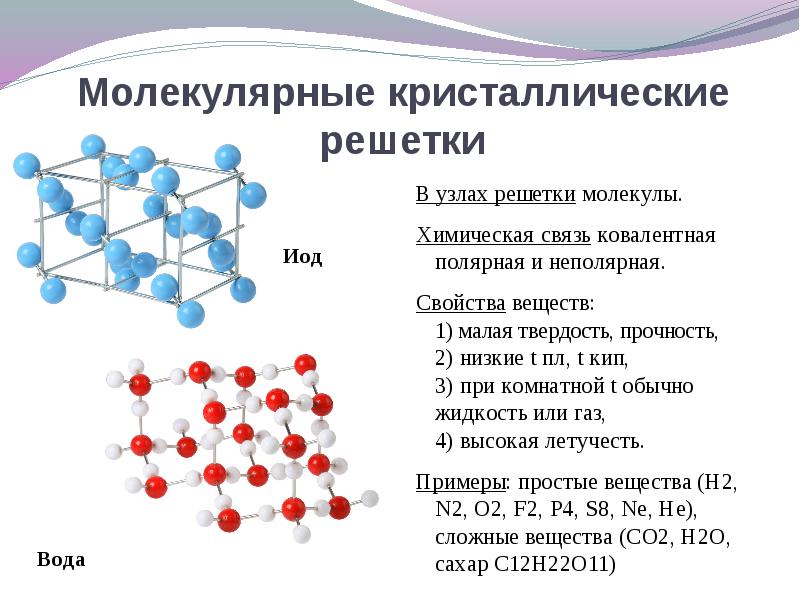 (Слайд)
(Слайд)
В лаборатории серу получают восстановлением оксида серы (
IV
):
SO
2
+ 2
C
= 2
CO
↑ +
S
2H
2
S + SO
2
= 3S↓ + 2H
2
O
7.
Химические свойства серы.
5
В химических реакциях сера проявляет как окислительные, так и восстановительные
свойства.
Реагирует и с простыми и со сложными веществами. (Слайды)
а
) взаимодействует с простыми веществами:
1. С металлами образует сульфиды:
S
0
+ F
e
0
=
Fe
+2
S
—
2
2.
C
водородом образует сероводород:
S
0
+
H
2
0
=
H
2
+
S
—
2
+2
e
S
0
→
S
—
2
│
S
0
окислитель,
восстанавливается
—
2
e
H
2
0
→2
H
+
│
H
2
0
восстановитель, окисляется
3.
В процессе горения образуется оксид серы (
IV
):
S
0
+
O
2
0
→
S
+4
O
2
—
2
—
4
e
S
0
→
S
+4
│
S
0
—
восстановитель, окисляется
+4
e
O
2
0
→2
O
—
2
│
O
2
0
—
окислитель,
восстанавливается
б) взаимодействие со сложными веществами:
1) При взаимодей
ствии с
H
2
SO
4
сера является восстановителем:
S
+ 2
H
2
SO
4
= 3
SO
2
+ 2
H
2
O
—
4
e
1│
S
0
→
S
+4
│
S
0
—
восстановитель, окисляется
+2
e
2│
S
+6
→
S
+4
│
S
+6
окислитель, восстанавливается
2) При взаимодействии со щелочью NaOH образуются соли двух кислот:
3S
0
+ 6NaOH = 2Na
2
S
—
2
+ Na
2
S
+4
O
3
+ 3H
2
O
+2
e
2│
S
0
→
S
—
2
│
S
0
окислитель, восстанавливается
—
4
e
1│
S
0
→
S
+4
│
S
0
восстановитель, окисляется
8.
Применение.
6
Сера широко используется в промышленности, медицине и в сельском хозяйстве.
Порошок серы применяют для вулканизации каучука в резиновой промышленности. В
медицине серу используют для приготовления мазей, для лечения кожных заболеваний. Её
прим
еняют в производстве спичек, черного пороха, а в сельском хозяйстве
для борьбы с
вредителями растений (Слайд).
Число
различных изделий из резины в настоящее время включает больше 35 тысяч
наименований. Натуральный каучук очень дорог, при низких температу
рах он делается
твердым и хрупким, а при высоки
х
—
липким и клейким.
При вулканизации серу нагревают с
каучуком при 140
О
С. Атомы серы, как бы сшивают длинные нитевидные молекулы каучука
по месту двойных связей. За счет этого возникают новые свойства:
прочность, большая
эластичность и термическая устойчивость. При изготовлении резины в каучук вводят 1
—
3%
серы. При повышении содержания серы до 45% образуется эбонит
При повышении содержания серы до 45% образуется эбонит
твердое вещество
черного цвета. Он является
диэлектриком
и применяется в электротехнике
.
Закрепление.
№1
.
Осуществить превращение по схеме:
______________
│ ↓
S→ SO
2←
ZnS→ H
2
S
│_________↑
№. Расставьте коэффициенты методом электронного баланса. Запишите уравнения реакций в
полном и сокращенном ионном виде.
Zn
+
H
2
SO
4
→
S
+
ZnSO
4
+
H
2
O
№3. Рассчитайте, сколько грамм серы можно получить при растворении 130 г цинка в 200 мл
раствора серной кислоты (р=1,38 г/мл) с массовой долей кислоты 49%.
(Ответ: 11г)
Домашнее задание: параграф 13, стр. 72 А №1
—
3, С №1.
Список используемой литературы
:
1.
Гаврусейко Н.П. Проверочные работы по неорганическ
ой химии.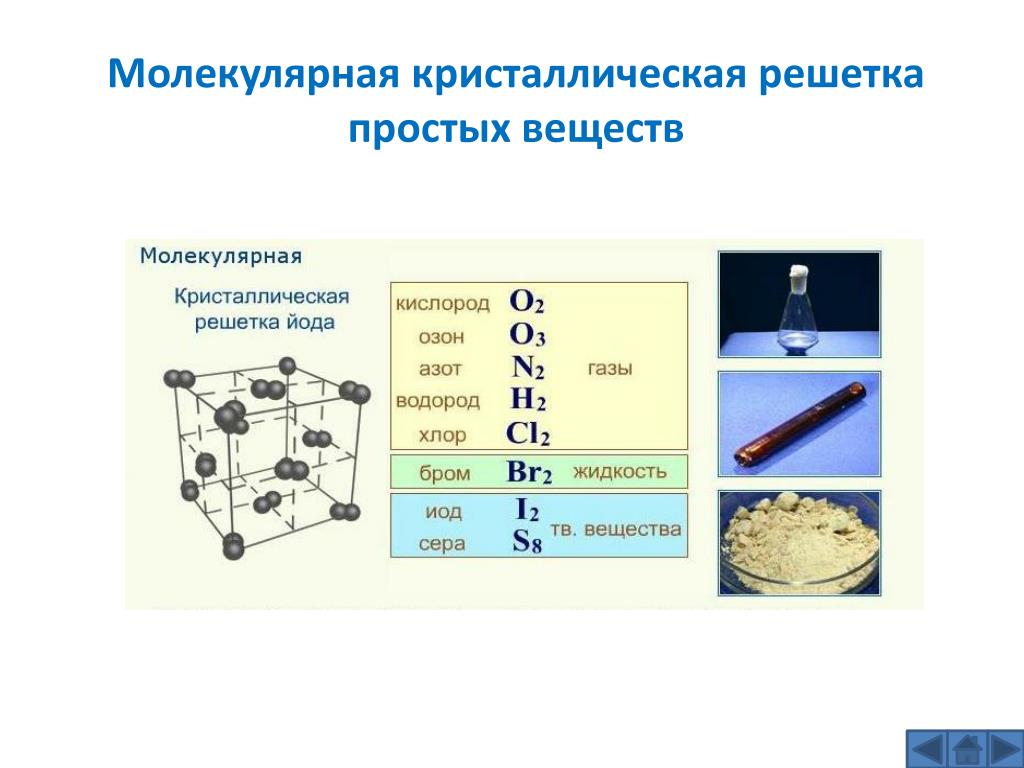 Дидактический
Дидактический
материал для 9 класса. М.: Просвещение, 1990.
2.
Немчинникова Г.Л. Путешествие по шестой группе. М.: Просвещение , 1976.
3.
Путешествие в страну элементов. Составители Власов Л., Трифонов Д. М.:
Просвещение 1963.
4.
Усманов М.Б., Сакарьянова
К.Н., Химия: Учебник для 9 кл. общеобразоват.
шк.Алматы: Атам
у
ра, 2013.
Кристаллические решетки — Химия — Презентации
Кристаллические решетки
Химия 8 класс
Распределите вещества
на 2 группы
Шоколад
Стекло
Горный хрусталь
Сера
Алмаз
Поваренная соль
Пластилин
Жевательная резинка
Классификация веществ
1.Нет строгого расположения частиц, нет кристаллической решетки.
2.Нет четкой
Т пл и Т кип
1. Правильное расположение частиц, образующих кристаллическую решетку
Правильное расположение частиц, образующих кристаллическую решетку
2.Строго определенные
Т пл и Т кип
Сера
Стекло
Алмаз
Шоколад
Горный хрусталь
Пластилин
Жевательная резинка
Поваренная соль
Кристаллические
Аморфные
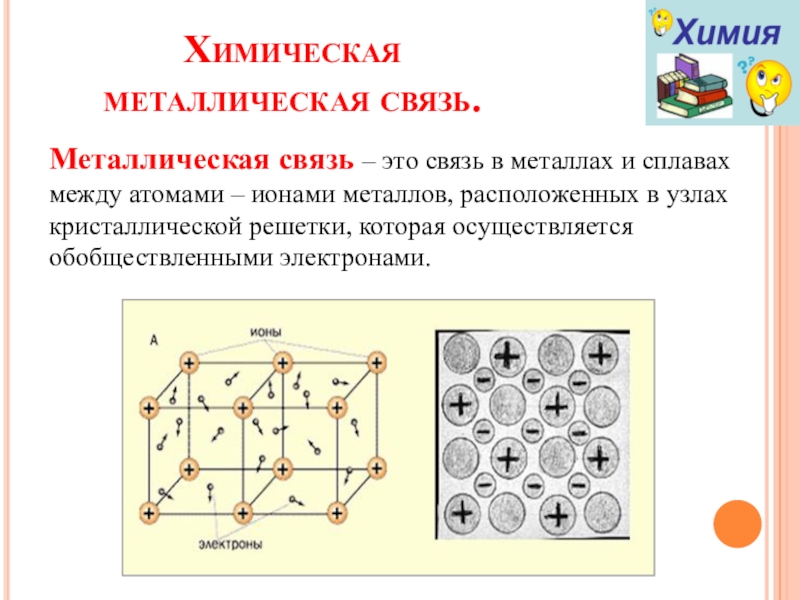
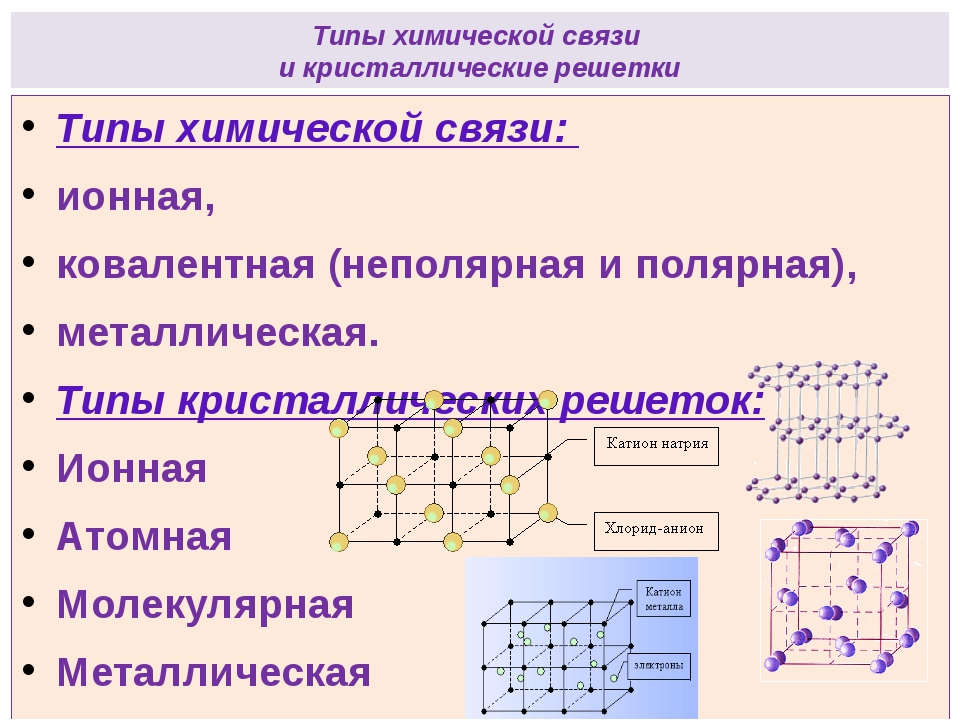
Кристаллическая решетка
Кристаллическая решётка вещества –
это структура с геометрически упорядоченным расположением частиц в определённых точках пространства.
Узлы решетки – точки,
в которых размещены
частицы кристалла.
Атомы
Молекулы
Ионы
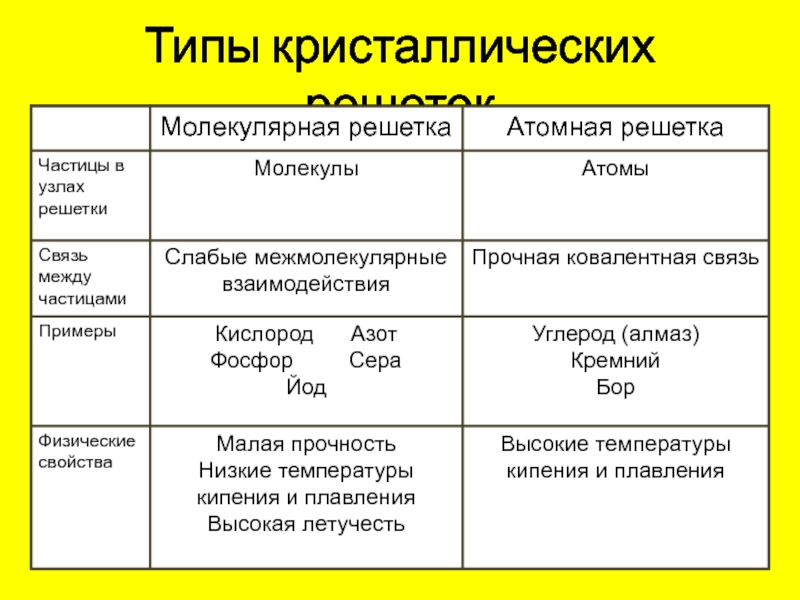
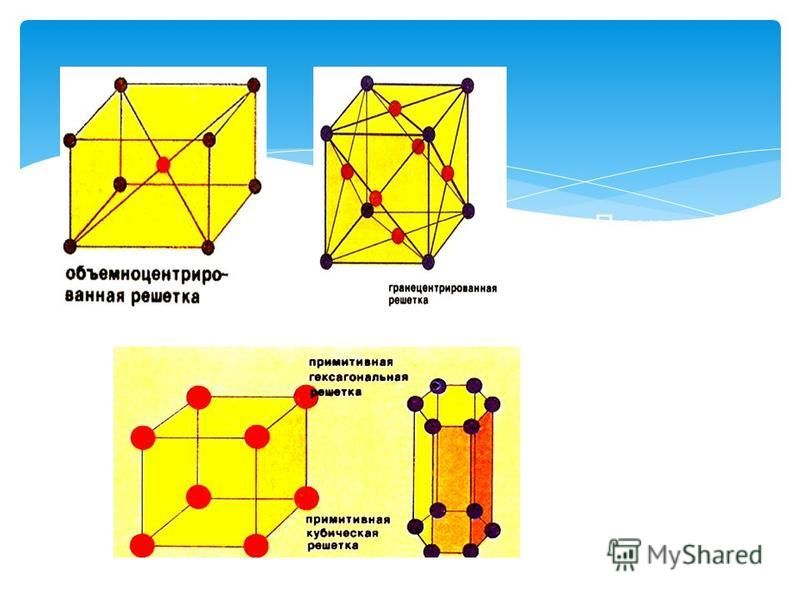
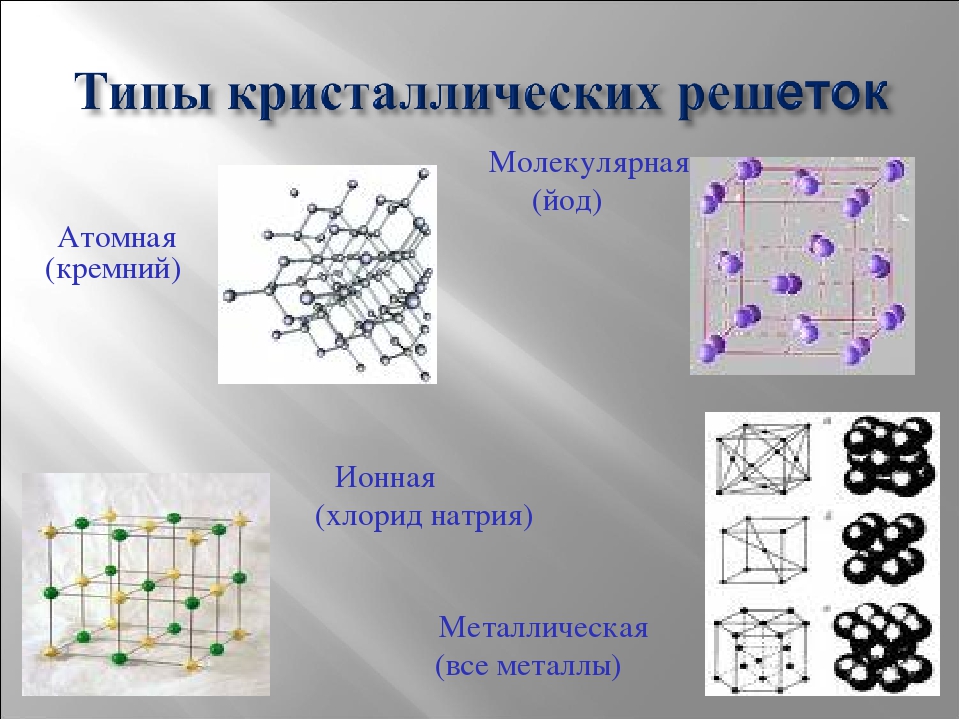
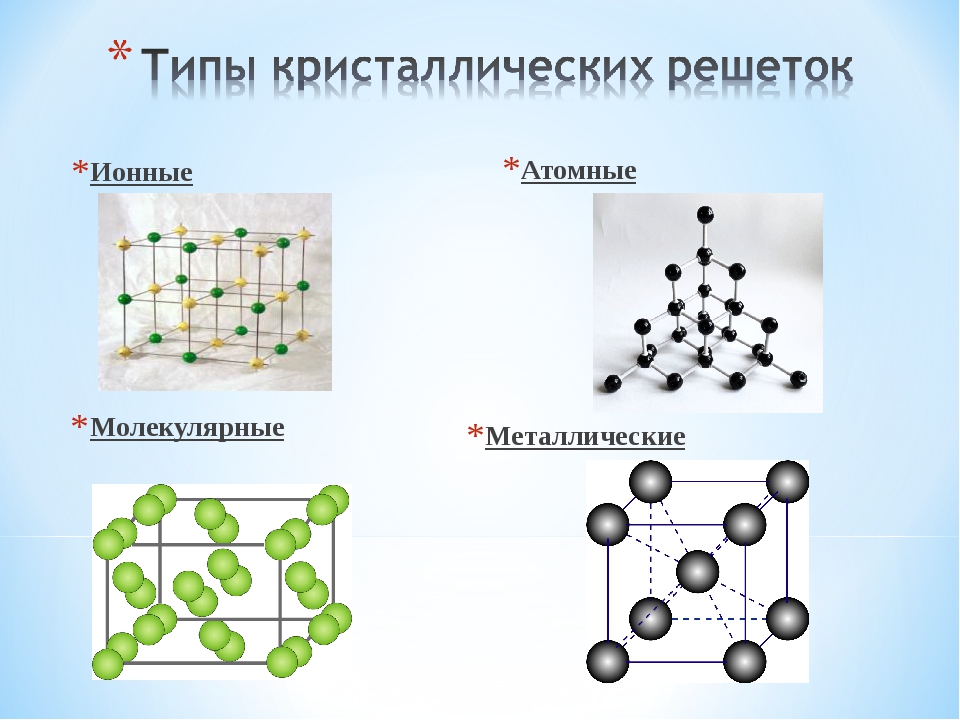
Типы кристаллических решеток
1
Ионная
Атомная
2
Молекулярная
3
Металлическая
4
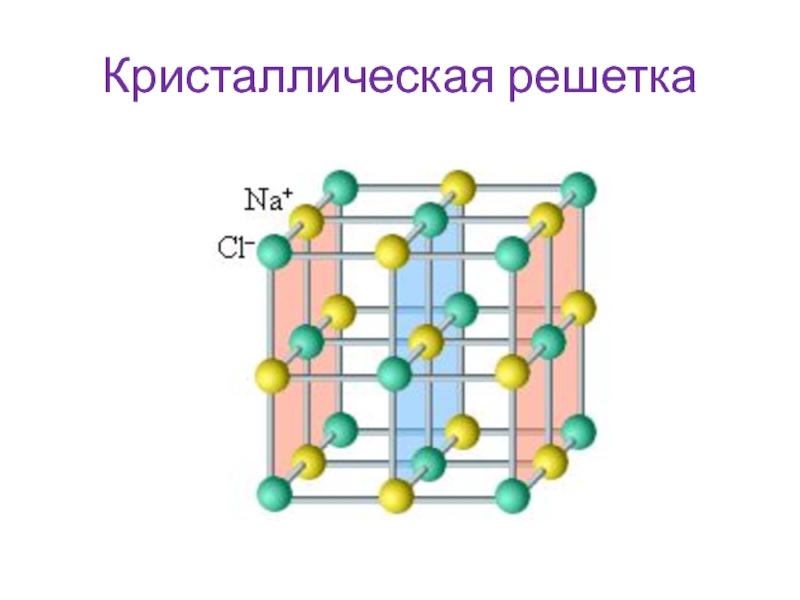
Ионная кристаллическая решетка
- В узлах решетки –
Химическая связь —
Свойства веществ:
ионы
(К + , Сa 2+ , SO4 2- ,OH — и др. )
)
ионная.
1) высокая твердость, прочность, 2) хрупкость, 3) тугоплавкость, 4) нелетучесть.
CaO
NaOH
CsCl
CaF2
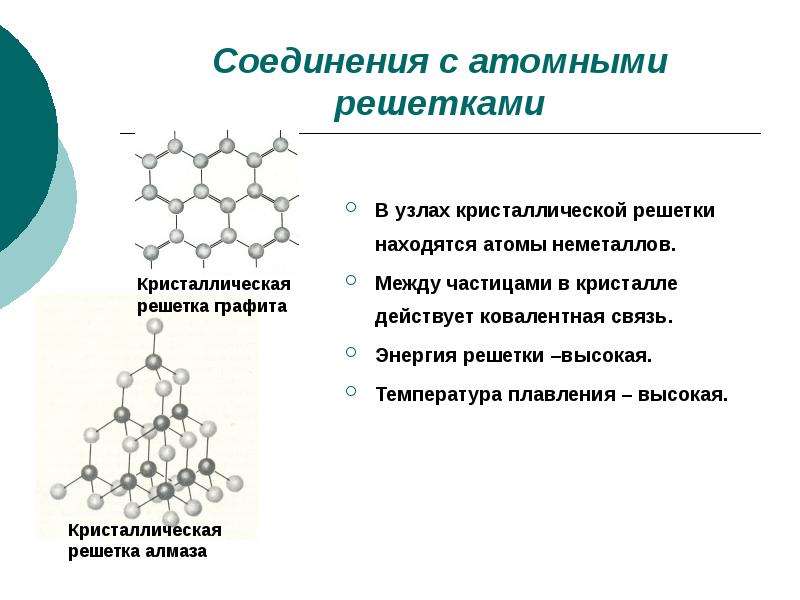
Атомная кристаллическая решетка
атомы.
- В узлах решетки —
- Химическая связь —
- Свойства веществ:
ковалентная неполярная, полярная.
Алмаз
1) очень высокая твердость, прочность, 2) очень высокая Тпл.,
3) тугоплавкость,
4) практически нерастворимы.
Графит
Оксид кремния SiO2
Карбид кремния SiC
Бор B
Кремний Si
Самый большой алмаз
Алмаз «Куллинан» — самый большой природный алмаз. (Южная Африка, 1905 г., вес-3106,75 каратов (621,35 г.).
При огранке его раскололи на 9 крупных частей и порядка 100 мелких осколков.
«Куллинан I» или «Великая Звезда Африки»
Самый большой бриллиант
Желто-коричневый бриллиант (Южная Африка), под названием «The Golden Jubilee» «Золотой Юбилей» .
Его вес составляет 545,67 карата (109,13 г).
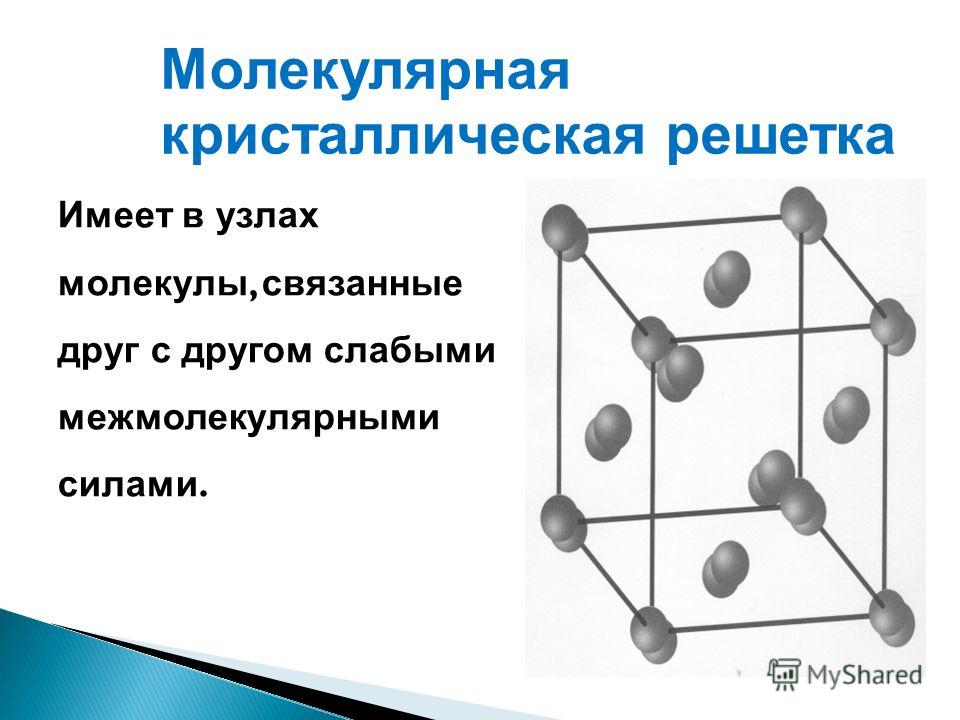
Молекулярная кристаллическая решетка
В узлах решетки —
Химическая связь —
Свойства веществ:
молекулы.
ковалентная полярная и неполярная.
1) малая твердость, 2) низкие Т пл., Т кип., 3) при комнатной Т обычно жидкости или газы, 4) высокая летучесть.
Иод I2
Сера S
Белый фосфор P4
Крахмал (C 6 H 10 O 5 )n
Металлическая кристаллическая решетка
В узлах решетки –
Химическая связь —
Свойства веществ:
атом-ионы.
металлическая.
Натрий Na
1) металлический блеск, 2) электро- и теплопроводность, 3) ковкость и пластичность.
Схема металлической связи
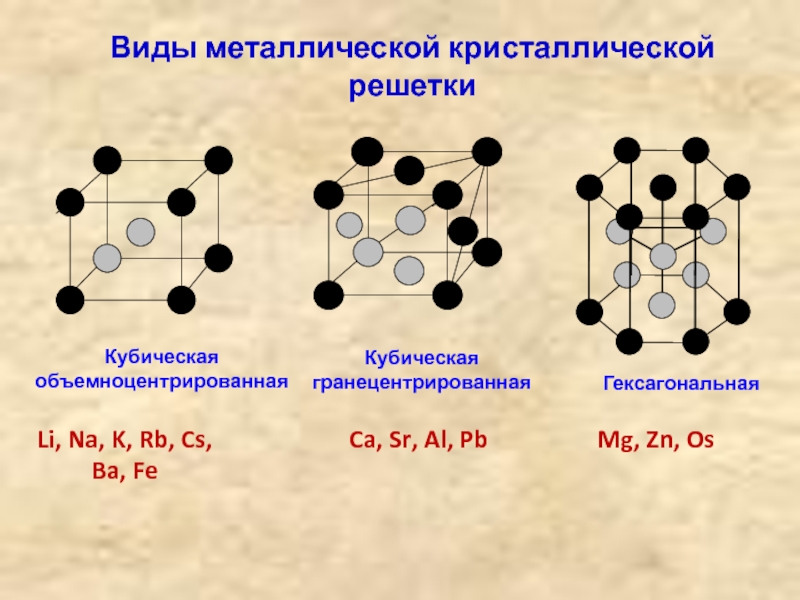
Типы металлических решеток
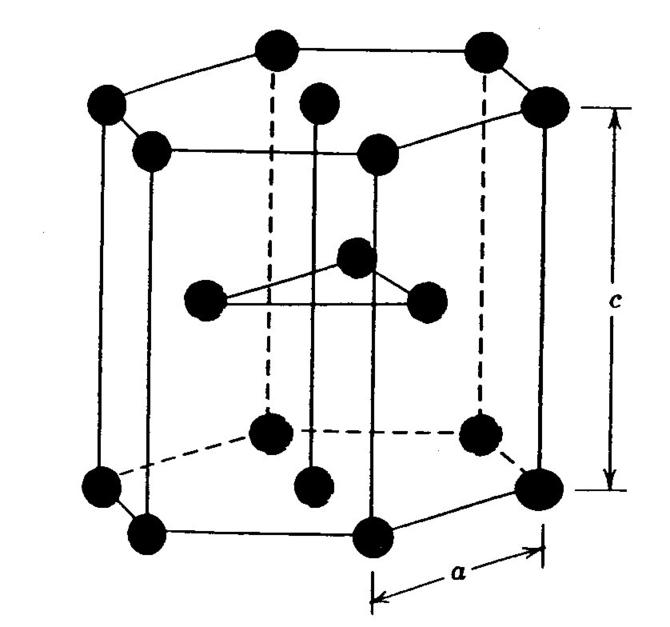
Гексагональная
Mg, Zn, Cd, Ti
Кубическая
Гранецентрированная
Fe, Al, Cu, Ni, Pb
Объемно-центрированная
Fе, Cr, V, W
Закон постоянства состава веществ
Молекулярные химические
соединения независимо
от способа их получения
имеют постоянный
состав и свойства.
Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула h3O.
Ж.Л. Пруст
1754-1826
Определить тип кристаллической решетки
Шоколад
Алмаз С
Кварц SiO2
Сахар С 12 Н 22 О 11
Аморфное вещество
Атомная
Атомная
Молекулярная
Металлическая
Ионная
Молекулярная
Поваренная соль
Медь Cu
NaCl
Лед Н2О
Углекислый газ
Химическая связь.
 Типы кристаллических решеток.
Типы кристаллических решеток.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 1
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещество с ковалентной полярной связью:
А) Al2O3 В) O3 С) PH3 Д) NaCl Е) Ag
4. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
5. Вид связи в веществах – электролитах:
А) Ковалентная неполярная, металлическая В) Ковалентная неполярная, ионная
С) Ионная, ковалентная сильнополярная Д) Металлическая, ионная
Е) Ковалентная неполярная, полярная
6. Вещества с металлической связью:
Вещества с металлической связью:
А) J2, H2 В) Fe, Cu С) NaCl, ВаСl2 Д) С2Н5ОН, СН3СООН Е) О2, Н2О
7. Группа веществ с водородной связью:
А) J2, H2 В) С2Н5ОН, СН3СООН С) NaCl, ВаСl2 Д) Fe, Cu Е) О2, Н2О
8. Ионную кристаллическую решетку имеет:
А) СO2 В) Br2 С) Fe Д) NaCl Е) SiO2
9. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Натрия С) Серебра Д) Цинка Е) Углерода
10. Выполни задание. Составьте схемы образования молекул веществ: H2, НBr, Nа2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 2
1. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ряд веществ с ковалентной неполярной связью:
А) СаF2, NaF, КBr В) О2, Н2, Cl2 С) NН3, Н2О, НBr
Д) Al, Na, Fе Е) Н2О, Fе2О3, НCl
4. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
5. Только σ — связи в веществах ряда:
А) С2Н6 и СO2 В) С2Н6 и H2S С) С2Н6 и SO3 Д) С2Н6 и SO2 Е) С2Н6 и СO
6. Водородную связь могут образовывать между собой:
А) СН4 В) С2Н5ОН С) С3Н8 Д) СаО Е) NaH
7. Металлическую и ионную связи может образовывать:
Металлическую и ионную связи может образовывать:
А) Селен В) Теллур С) Бор Д) Кремний Е) Натрий
8. Молекулярную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) SiO2
9. Металлическую кристаллическую решетку имеет:
А) Ag B) Br C) Se Д) Хе Е) Kr
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НCl, КBr.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 3
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
4. Пара химических элементов, между которыми образуется ковалентная полярная связь:
Пара химических элементов, между которыми образуется ковалентная полярная связь:
А) К и F В) Na и Cl C) Н и Р Д) О и О Е) Fe и Fe
5. Ионная связь есть в:
А) Mg В) NaF C) Br2 Д) HCl Е) F2
6. Водородная связь может образоваться между молекулами:
А) Фтора В) Хлора С) Фтороводорода Д) Серы Е) Водорода
7. Порядок связи равен двум в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
8. Атомную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) SiO2
9. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: N2, НCl, NаBr.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 4
1. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н2S В) H2O С) HF Д) NH3 Е) NH4Cl
4. Ковалентная неполярная связь присутствует у всех веществ группы:
А) Mg, КCl В) NaF, NО C) Br2, О2 Д) HCl, СО2 Е) Н2S, О2
5. Порядок связи равен трем в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
6. Вид химической связи в молекуле H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Молекулярная кристаллическая решетка будет в:
Молекулярная кристаллическая решетка будет в:
А) Mg В) NaF C) С Д) HCl Е) SiO2
8. Кристаллическая решетка поваренной соли:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
10. Выполни задание. Составьте схемы образования молекул веществ: Cl2, Н2О, NаJ.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 5
1. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещества с ковалентной связью в группе:
Вещества с ковалентной связью в группе:
А) Br2, NaH, MgO, KCl В) РН3, N2О5, СаО, ВаСl2 С) Н2О, СS2, НJ, РН3
Д) As2S3, AlCl3, O2, N2 Е) НCl, SiH4, К2О, ВаBr2
4. Вид химической связи в молекуле К2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
5. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
6. Вид химической связи между молекулами H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Металлическая кристаллическая решетка будет в:
А) Mg В) NaF C) Н2 Д) HCl Е) O2
8. Молекулярную кристаллическую решетку имеет:
А) CuSO4 В) NaОН С) Fe Д) NaCl Е) SO2
9. Кристаллическая решетка графита:
Кристаллическая решетка графита:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: H2, NН3, NaCl.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 6
1. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ионная связь есть в:
А) Са В) N2О5C) Br2 Д) NaCl Е) F2
4. Число электронов, участвующих в образовании химической связи в молекуле N2:
А) 2 В) 4 С) 5 Д) 8 Е) 6
5. Вид химической связи в кристаллической сере
Вид химической связи в кристаллической сере
А) ионная В) ковалентная полярная С) водородная
Д) ковалентная неполярная Е) металлическая
6. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
7. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А) К и F В) Na и Cl C) Н и Н Д) Н и N Е) Са и Са
8. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Углерода С) Серебра Д) Цинка Е) Натрия
9. Кристаллическая решетка брома:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: J2, НCl, К2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 7
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Соединения с ковалентной полярной связью в группе:
А) NaCl, СаО В) Cl2, Н2 С) Н2S, НCl Д) О2, Н2О Е) Fе, CuO
4. Тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов… 3 s1 и …3 s2 3 р5
А) атомная и ковалентная неполярная В) молекулярная и ковалентная неполярная
С) молекулярная и ковалентная полярная Д) металлическая и металлическая
Е) ионная и ионная
5. Вещества с металлической связью:
А) J2, H2 В) Fe, Cа С) NaCl, ВаСl2 Д) С2Н5ОН, СН3СООН Е) О2, Н2О
6. Группа веществ с водородной связью:
А) J2, H2 В) С2Н5ОН, СН3СООН С) NaCl, ВаСl2 Д) Fe, Cu Е) О2, Н2О
7. Порядок связи равен трем в молекуле:
Порядок связи равен трем в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
8. Ионную кристаллическую решетку имеет:
А) СO2 В) Br2 С) Fe Д) NaCl Е) SiO2
9. Кристаллическая решетка углекислого газа:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НCl, Na2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 8
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ковалентная неполярная связь присутствует у всех веществ группы:
Ковалентная неполярная связь присутствует у всех веществ группы:
А) MgS, КCl В) NaF, NО C) Br2, N2 Д) HCl, SiО2 Е) Н2S, СО2
4. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н2S В) H2O С) HF Д) NH3 Е) NH4Cl
5. Порядок связи равен двум в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
6. Атомную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) С
7. Вид химической связи в молекуле H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
8. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Только σ — связи в веществах ряда:
А) С2Н6 и СO2 В) С2Н6 и H2S С) С2Н6 и SO3 Д) С2Н6 и SO2 Е) С2Н6 и СO
10. Выполни задание. Составьте схемы образования молекул веществ: Н2, Н2О, NaF .
Выполни задание. Составьте схемы образования молекул веществ: Н2, Н2О, NaF .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 9
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещество с ковалентной полярной связью:
А) Al2O3 В) O3 С) H2О Д) NaCl Е) Ag
4. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
5. Вид связи в веществах – электролитах:
А) Ковалентная неполярная, металлическая В) Ковалентная неполярная, ионная
С) Ионная, ковалентная сильнополярная Д) Металлическая, ионная
Е) Ковалентная неполярная, полярная
6. Вещества с металлической связью:
Вещества с металлической связью:
А) J2, H2 В) Са, Cu С) NaCl, ВаСl2 Д) С2Н5ОН, СН3СООН Е) О2, Н2О
7. Группа веществ с водородной связью:
А) J2, H2 В) С2Н5ОН, СН3СООН С) NaCl, ВаСl2 Д) Fe, Cu Е) О2, Н2О
8. Ионную кристаллическую решетку имеет:
А) СO2 В) Br2 С) Fe Д) NaОН Е) SiO2
9. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Натрия С) Серебра Д) Цинка Е) Серы
10. Выполни задание. Составьте схемы образования молекул веществ: H2, НBr, К2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 10
1. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ряд веществ с ковалентной неполярной связью:
А) СаF2, NaF, КBr В) О2, Н2, Cl2 С) NН3, Н2О, НBr
Д) Al, Na, Fе Е) Н2О, Fе2О3, НCl
4. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
5. Только σ — связи в веществах ряда:
А) С2Н6 и СO2 В) С2Н6 и H2S С) С2Н6 и SO3 Д) С2Н6 и SO2 Е) С2Н6 и СO
6. Водородную связь могут образовывать между собой:
А) СН4 В) СН3СООН С) С3Н8 Д) СаО Е) NaH
7. Металлическую и ионную связи может образовывать:
Металлическую и ионную связи может образовывать:
А) Селен В) Теллур С) Калий Д) Кремний Е) Бор
8. Молекулярную кристаллическую решетку имеет:
А) СаO В) NaОН С) Fe Д) NaCl Е) SO2
9. Металлическую кристаллическую решетку имеет:
А) Ag B) Br C) Se Д) Хе Е) Kr
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НBr, КCl.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 11
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
4. Пара химических элементов, между которыми образуется ковалентная полярная связь:
Пара химических элементов, между которыми образуется ковалентная полярная связь:
А) К и F В) Na и Cl C) Н и Р Д) О и О Е) Fe и Fe
5. Ионная связь есть в:
А) Mg В) NaCl C) Br2 Д) HCl Е) F2
6. Водородная связь может образоваться между молекулами:
А) Фтора В) Хлора С) Серы Д) Воды Е) Водорода
7. Порядок связи равен двум в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
8. Атомную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) SiO2
9. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НCl, СаCl2.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 12
1. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н2S В) H2O С) HF Д) NH3 Е) NH4Cl
4. Ковалентная неполярная связь присутствует у всех веществ группы:
А) Mg, КCl В) NaF, NО C) Br2, О2 Д) HCl, СО2 Е) Н2S, О2
5. Порядок связи равен трем в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
6. Вид химической связи в молекуле H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Молекулярная кристаллическая решетка будет в:
Молекулярная кристаллическая решетка будет в:
А) Mg В) NaF C) С Д) H2О Е) SiO2
8. Кристаллическая решетка поваренной соли:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
10. Выполни задание. Составьте схемы образования молекул веществ: N2, Н2О, NаJ.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 13
1. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещества с ковалентной связью в группе:
Вещества с ковалентной связью в группе:
А) Br2, NaH, MgO, KCl В) РН3, N2О5, СаО, ВаСl2 С) Н2О, СS2, НJ, РН3
Д) As2S3, AlCl3, O2, N2 Е) НCl, SiH4, К2О, ВаBr2
4. Вид химической связи в молекуле К2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
5. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
6. Вид химической связи между молекулами HF:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Металлическая кристаллическая решетка будет в:
А) Mg В) NaF C) Н2 Д) HCl Е) O2
8. Молекулярную кристаллическую решетку имеет:
А) CuSO4 В) NaОН С) Fe Д) NaCl Е) СO2
9. Кристаллическая решетка графита:
Кристаллическая решетка графита:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: Cl2, NН3, NaBr.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 14
1. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ионная связь есть в:
А) Са В) N2О5C) Br2 Д) Na2О Е) F2
4. Число электронов, участвующих в образовании химической связи в молекуле N2:
А) 2 В) 4 С) 5 Д) 8 Е) 6
5. Вид химической связи в кристаллической сере
Вид химической связи в кристаллической сере
А) ионная В) ковалентная полярная С) водородная
Д) ковалентная неполярная Е) металлическая
6. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
7. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А) К и F В) Na и Cl C) Н и Н Д) Н и N Е) Са и Са
8. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Бора С) Серебра Д) Цинка Е) Натрия
9. Кристаллическая решетка брома:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: Н2, НCl, К2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 15
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Соединения с ковалентной полярной связью в группе:
А) NaCl, СаО В) Cl2, Н2 С) Н2S, КCl Д) СО2, Н2О Е) Fе, CuO
4. Тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов… 3 s1 и …3 s2 3 р5
А) атомная и ковалентная неполярная В) молекулярная и ковалентная неполярная
С) молекулярная и ковалентная полярная Д) металлическая и металлическая
Е) ионная и ионная
5. Вещества с металлической связью:
А) J2, H2 В) Fe, Mg С) NaCl, ВаСl2 Д) С2Н5ОН, СН3СООН Е) О2, Н2О
6. Группа веществ с водородной связью:
А) J2, H2 В) С2Н5ОН, СН3СООН С) NaCl, ВаСl2 Д) Fe, Cu Е) О2, Н2О
7. Порядок связи равен трем в молекуле:
Порядок связи равен трем в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
8. Ионную кристаллическую решетку имеет:
А) СO2 В) Br2 С) Fe Д) NaCl Е) SiO2
9. Кристаллическая решетка аммиака:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НCl, К2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 16
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ковалентная неполярная связь присутствует у всех веществ группы:
Ковалентная неполярная связь присутствует у всех веществ группы:
А) MgS, КCl В) NaF, NО C) Br2, Н2 Д) HCl, SiО2 Е) Н2S, СО2
4. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н2S В) H2O С) HF Д) NH3 Е) NH4Cl
5. Порядок связи равен двум в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
6. Атомную кристаллическую решетку имеет:
А) С В) NaОН С) Fe Д) NaCl Е) СО2
7. Вид химической связи в молекуле H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
8. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Только σ — связи в веществах ряда:
А) С2Н6 и СO2 В) С2Н6 и H2S С) С2Н6 и SO3 Д) С2Н6 и SO2 Е) С2Н6 и СO
10. Выполни задание. Составьте схемы образования молекул веществ: Н2, Н2О, КF.
Выполни задание. Составьте схемы образования молекул веществ: Н2, Н2О, КF.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 17
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещество с ковалентной полярной связью:
А) Al2O3 В) O3 С) PH3 Д) NaCl Е) Ag
4. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
5. Вид связи в веществах – электролитах:
А) Ковалентная неполярная, металлическая В) Ковалентная неполярная, ионная
С) Ионная, ковалентная сильнополярная Д) Металлическая, ионная
Е) Ковалентная неполярная, полярная
6. Вещества с металлической связью:
Вещества с металлической связью:
А) J2, H2 В) Fe, Cu С) NaCl, ВаСl2 Д) С2Н5ОН, СН3СООН Е) О2, Н2О
7. Группа веществ с водородной связью:
А) J2, H2 В) С2Н5ОН, СН3СООН С) NaCl, ВаСl2 Д) Fe, Cu Е) О2, Н2О
8. Ионную кристаллическую решетку имеет:
А) СO2 В) Br2 С) Fe Д) NaCl Е) SiO2
9. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Натрия С) Серебра Д) Цинка Е) Углерода
10. Выполни задание. Составьте схемы образования молекул веществ: H2, НBr, Nа2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 18
1. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ряд веществ с ковалентной неполярной связью:
А) СаF2, NaF, КBr В) О2, Н2, Cl2 С) NН3, Н2О, НBr
Д) Al, Na, Fе Е) Н2О, Fе2О3, НCl
4. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
5. Только σ — связи в веществах ряда:
А) С2Н6 и СO2 В) С2Н6 и H2S С) С2Н6 и SO3 Д) С2Н6 и SO2 Е) С2Н6 и СO
6. Водородную связь могут образовывать между собой:
А) СН4 В) С2Н5ОН С) С3Н8 Д) СаО Е) NaH
7. Металлическую и ионную связи может образовывать:
Металлическую и ионную связи может образовывать:
А) Селен В) Теллур С) Бор Д) Кремний Е) Натрий
8. Молекулярную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) SiO2
9. Металлическую кристаллическую решетку имеет:
А) Ag B) Br C) Se Д) Хе Е) Kr
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НCl, КBr.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 19
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
4. Пара химических элементов, между которыми образуется ковалентная полярная связь:
Пара химических элементов, между которыми образуется ковалентная полярная связь:
А) К и F В) Na и Cl C) Н и Р Д) О и О Е) Fe и Fe
5. Ионная связь есть в:
А) Mg В) NaF C) Br2 Д) HCl Е) F2
6. Водородная связь может образоваться между молекулами:
А) Фтора В) Хлора С) Фтороводорода Д) Серы Е) Водорода
7. Порядок связи равен двум в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
8. Атомную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) SiO2
9. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: N2, НCl, NаBr.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 20
1. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н2S В) H2O С) HF Д) NH3 Е) NH4Cl
4. Ковалентная неполярная связь присутствует у всех веществ группы:
А) Mg, КCl В) NaF, NО C) Br2, О2 Д) HCl, СО2 Е) Н2S, О2
5. Порядок связи равен трем в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
6. Вид химической связи в молекуле H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Молекулярная кристаллическая решетка будет в:
Молекулярная кристаллическая решетка будет в:
А) Mg В) NaF C) С Д) HCl Е) SiO2
8. Кристаллическая решетка поваренной соли:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
10. Выполни задание. Составьте схемы образования молекул веществ: Cl2, Н2О, NаJ.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 21
1. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещества с ковалентной связью в группе:
Вещества с ковалентной связью в группе:
А) Br2, NaH, MgO, KCl В) РН3, N2О5, СаО, ВаСl2 С) Н2О, СS2, НJ, РН3
Д) As2S3, AlCl3, O2, N2 Е) НCl, SiH4, К2О, ВаBr2
4. Вид химической связи в молекуле К2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
5. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
6. Вид химической связи между молекулами H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Металлическая кристаллическая решетка будет в:
А) Mg В) NaF C) Н2 Д) HCl Е) O2
8. Молекулярную кристаллическую решетку имеет:
А) CuSO4 В) NaОН С) Fe Д) NaCl Е) SO2
9. Кристаллическая решетка графита:
Кристаллическая решетка графита:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: H2, NН3, NaCl.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 22
1. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ионная связь есть в:
А) Са В) N2О5C) Br2 Д) NaCl Е) F2
4. Число электронов, участвующих в образовании химической связи в молекуле N2:
А) 2 В) 4 С) 5 Д) 8 Е) 6
5. Вид химической связи в кристаллической сере
Вид химической связи в кристаллической сере
А) ионная В) ковалентная полярная С) водородная
Д) ковалентная неполярная Е) металлическая
6. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
7. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А) К и F В) Na и Cl C) Н и Н Д) Н и N Е) Са и Са
8. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Углерода С) Серебра Д) Цинка Е) Натрия
9. Кристаллическая решетка брома:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: J2, НCl, К2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 23
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Соединения с ковалентной полярной связью в группе:
А) NaCl, СаО В) Cl2, Н2 С) Н2S, НCl Д) О2, Н2О Е) Fе, CuO
4. Тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов… 3 s1 и …3 s2 3 р5
А) атомная и ковалентная неполярная В) молекулярная и ковалентная неполярная
С) молекулярная и ковалентная полярная Д) металлическая и металлическая
Е) ионная и ионная
5. Вещества с металлической связью:
А) J2, H2 В) Fe, Cа С) NaCl, ВаСl2 Д) С2Н5ОН, СН3СООН Е) О2, Н2О
6. Группа веществ с водородной связью:
А) J2, H2 В) С2Н5ОН, СН3СООН С) NaCl, ВаСl2 Д) Fe, Cu Е) О2, Н2О
7. Порядок связи равен трем в молекуле:
Порядок связи равен трем в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
8. Ионную кристаллическую решетку имеет:
А) СO2 В) Br2 С) Fe Д) NaCl Е) SiO2
9. Кристаллическая решетка углекислого газа:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О2, НCl, Na2О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 24
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ковалентная неполярная связь присутствует у всех веществ группы:
Ковалентная неполярная связь присутствует у всех веществ группы:
А) MgS, КCl В) NaF, NО C) Br2, N2 Д) HCl, SiО2 Е) Н2S, СО2
4. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н2S В) H2O С) HF Д) NH3 Е) NH4Cl
5. Порядок связи равен двум в молекуле:
А) Н2 В) F2 С) Br2 Д) О2 Е) N2
6. Атомную кристаллическую решетку имеет:
А) СO2 В) NaОН С) Fe Д) NaCl Е) С
7. Вид химической связи в молекуле H2O:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
8. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Только σ — связи в веществах ряда:
А) С2Н6 и СO2 В) С2Н6 и H2S С) С2Н6 и SO3 Д) С2Н6 и SO2 Е) С2Н6 и СO
10. Выполни задание. Составьте схемы образования молекул веществ: Н2, Н2О, NaF.
Выполни задание. Составьте схемы образования молекул веществ: Н2, Н2О, NaF.
Свойства аллотропных модификаций серы. Физические и химические свойства серы. Сера: полезные свойства
Способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся лишь числом атомов в молекуле, либо строением. Углерод
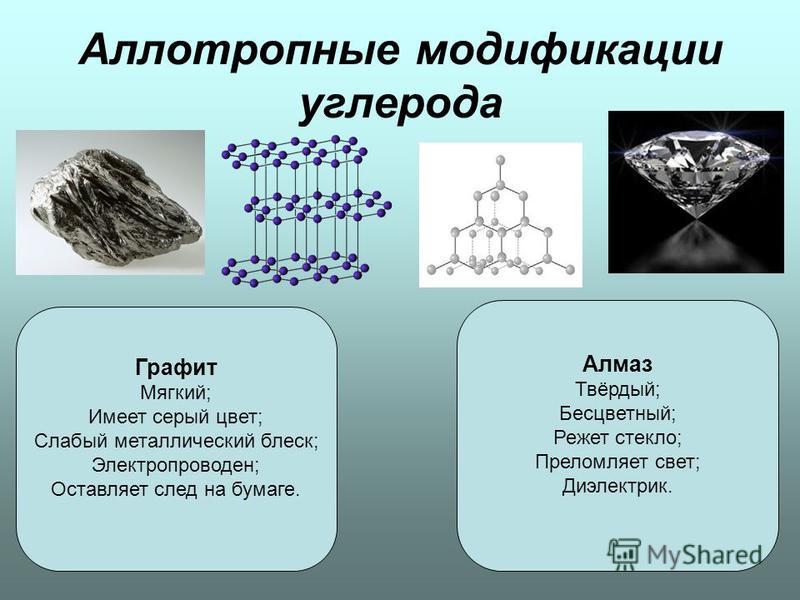
Признаки | Алмаз (С) | Графит (С) |
Состав молекулы | атомы углерода | атомы углерода |
Прозрачный | Серо-чёрное вещество, с металлическим блеском, жирное на ощупь | |
Агрегатное состояние | Очень твёрдый | |
Теплопроводность и электропроводность | Не проводит тепло и электричество | Проводит тепло и электричество |
Тип кристаллической решётки |
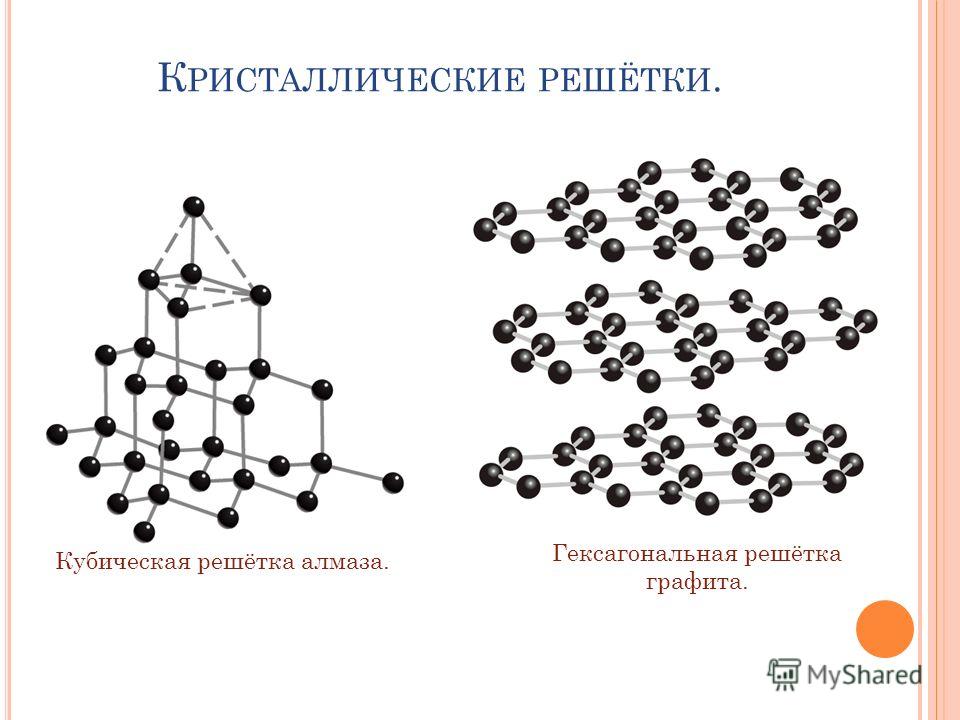
Аллотропия углерода обусловлена различным расположением атомов в кристаллической решётке
Алмаз и графит-атомная кристаллическая решётка, Фулерен-молекулярная (С 60)
Кислород существует в виде двух аллотропных модификаций –O 2 и О 3
Вещество, формула которого O2, встречается в атмосфере, гидросфере, земной коре и живых организмах. Около 20% атмосферы образовано двухатомными молекулами кислорода. В стратосфере на высоте примерно 12–50 км от земной поверхности находится слой, получивший название «озоновый экран». Его состав отражает формула O3. Озон защищает нашу планету, интенсивно поглощая опасные лучи красного и ультрафиолетового спектра Солнца.
Около 20% атмосферы образовано двухатомными молекулами кислорода. В стратосфере на высоте примерно 12–50 км от земной поверхности находится слой, получивший название «озоновый экран». Его состав отражает формула O3. Озон защищает нашу планету, интенсивно поглощая опасные лучи красного и ультрафиолетового спектра Солнца.
Сравнение кислорода и озона
Признаки | Кислород | Озон |
Состав молекулы | 2 атома кислорода | 3 атома кислорода |
Строение | ||
Агрегатное состояние и цвет | Бесцветный прозрачный газ либо бледно-голубая жидкость | Голубой газ, жидкость синего цвета, темно-фиолетовое твердое вещество |
Отсутствует | Острый, напоминающий о грозе, свежескошенном сене | |
Температура плавления (°С) | ||
Точка кипения (°С) | ||
Плотность (г/л) | ||
Растворимость в воде | Мало растворяется | Лучше, чем у кислорода |
Химическая активность | При обычных условиях стабилен | Легко разлагается с образованием кислорода |
Тип кристаллической решётки | Молекулярная | Молекулярная |
Аллотропия кислорода и озона обусловлена различным числом кислорода в молекулах веществ.
Аллотропия кислорода
Кислород О 2 | Озон О 3 |
Физические свойства | |
Кислород — один из самых часто встречающихся элементов в природе, в атмосфере на его долю приходится 21%. Он поддерживает жизнь на планете и делает возможным горение. Самый распространенный элемент на Земле, является компонентом большинства горных пород и минералов. Более 60% массы человеческого тела приходится на кислород. Бесцветный, не обладающий запахом газ — кислород, плохо растворим в воде и немного тяжелее воздуха. При охлаждении до -183С кислород становится прозрачной голубоватой жидкостью с плотностью, превышающей плотность воды. | Озон О 3 Озон образуется при разложении кислорода под воздействием ультрафиолетовых солнечных лучей, а также при атмосферных разрядах. Свое название он получил благодаря сильному запаху (от греческого слова ozon– душистый). Это бледно-голубой нестабильный газ. Легко растворяется в воде, обладает бактерицидными свойствами и используется для дезинфекции воды и воздуха. В больших количествах озон опасен. Благодаря своей способности поглощать ультрафиолетовые лучи, озон защищает живые организмы – людей, животных и растения – от опасного УФ-излучения Солнца. |
Аллатропия фосфора
Признаки | Красный фосфор(Р) | Белый фосфор(Р 4) |
Состав вещества | атомы фосфора | Молекулы фосфора |
Кирпично-красный | Желтовато-воскообразное вещество | |
Без запаха | Запах чеснока | |
Растворимость | Растворяется в воде и сероуглероде | Не растворяется в воде, хорошо растворяется в сероуглероде |
Влияние на организм | Не ядовит | Ядовитое вещество |
Свечение в темноте | Не светится | Светится |
Химическая активность | Менее химически активен, горит при поджигании | Более химически активен, самовоспламеняется на воздухе |
Тип кристаллической решётки | Молекулярная |
Аллотропия фосфора обусловлена различной кристаллической решёткой
Аллатропия серы
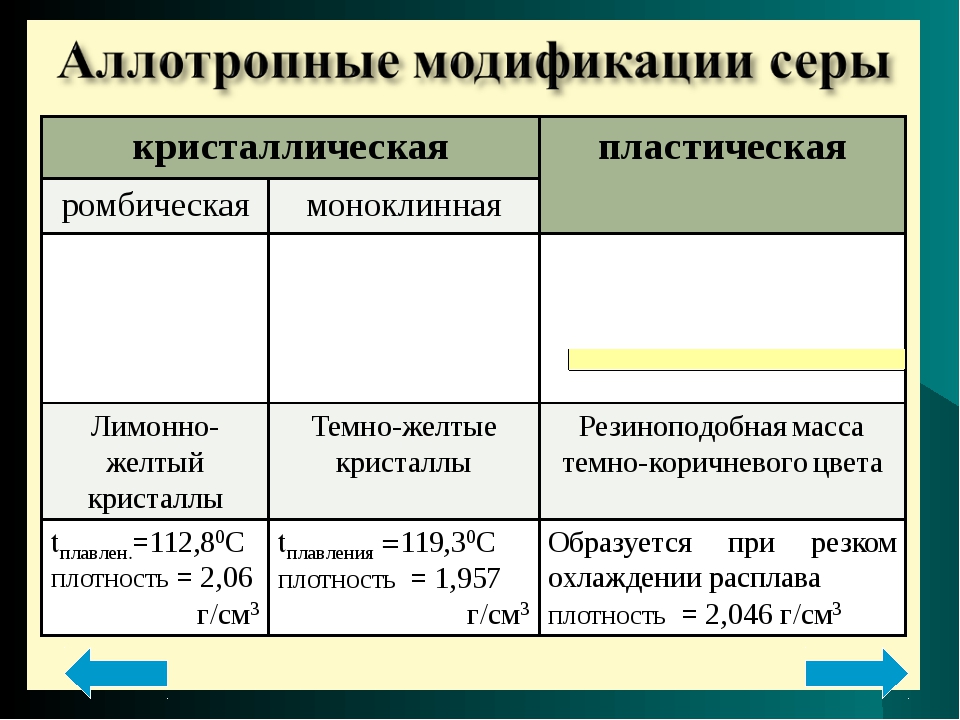
Признаки | Сера ромбическая(S8) | Сера пластическая |
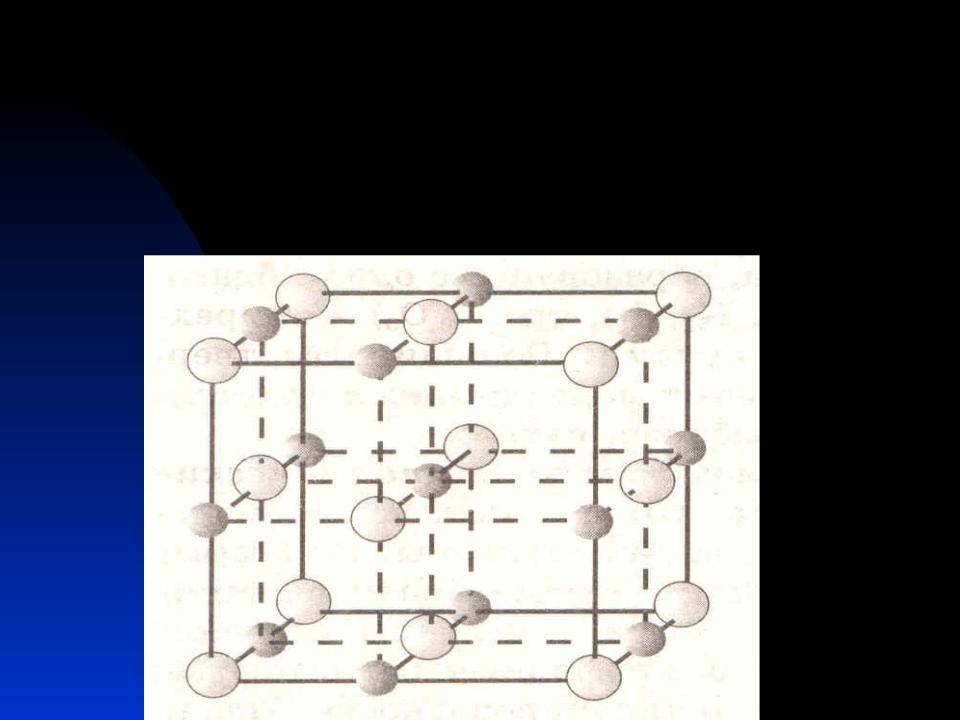
Состав вещества | Молекулы Серы | Атомы серы |
Тёмно-коричневый | ||
Без запаха | Без запаха | |
Агрегатное состояние | Тянется как резина | |
Температура плавления | Легкоплавкая, +112,8 0 С. | Плавится хуже, +444,6 0 С |
Тип кристаллической решётки | Молекулярная |
Аллотропия серы обусловлена различной кристаллической решёткой
ромбическая
, моноклинная
и пластическая
.
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне серы содержится 6 электронов, которые имеют 3s 2 3p 4 . В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS 2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
HgS — киноварь,
Sb 2 S 3 — антимонит.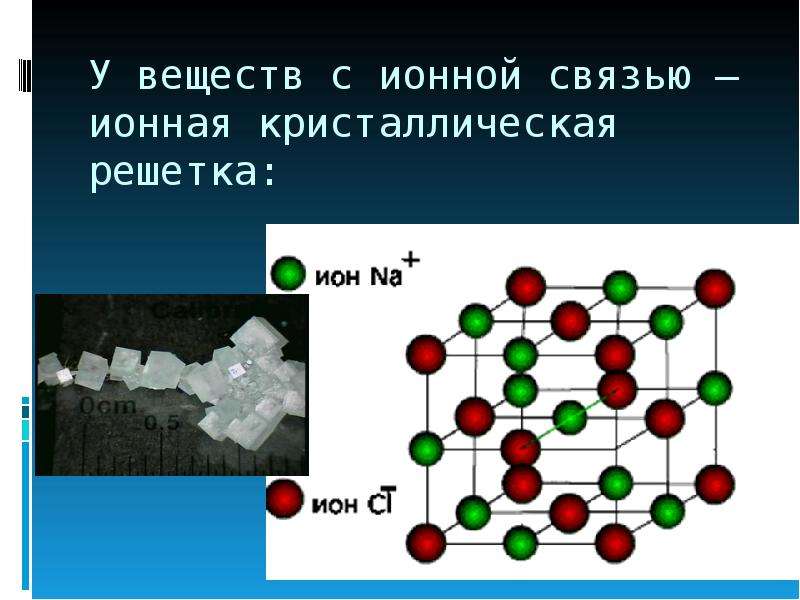
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропия
— это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S 8 , образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S 8
t°пл. = 113°C; r = 2,07 г/см 3
= 113°C; r = 2,07 г/см 3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см 3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H 2 S + O 2 → 2S + 2H 2 O
- Реакция Вакенродера:
2H 2 S + SO 2 → 3S + 2H 2 O
Окислительные свойства серы
(S
0
+ 2ē
→ S
-2
)
1) Сера реагирует со щелочными без нагревания:
S + O 2 – t° →
S +4 O 2
2S + 3O 2 – t °; pt → 2S +6 O 3
4) (кроме йода):
S + Cl 2 →
S +2 Cl 2
S + 3F 2 →
SF 6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H 2 SO 4 (конц) →
3S +4 O 2 + 2H 2 O
S + 6HNO 3 (конц) →
H 2 S +6 O 4 + 6NO 2 + 2H 2 O
Реакции диспропорционирования:
6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
7) сера растворяется в концентрированном растворе сульфита натрия:
S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 тиосульфат натрия
Аллотропией называют способность атомов одного элемента формировать разные типы простых веществ. Так образуются соединения, отличные друг от друга.
Аллотропные модификации являются стабильными. В условиях постоянного давления при определенной температуре эти вещества могут переходить одни в другие.
Аллотропные модификации могут образовываться из молекул, имеющих разное количество атомов. Например, элемент Кислород образует озон (О3) и собственно вещество кислород (О2).
Аллотропные модификации могут быть имеющими разное К таким соединениям можно отнести, например, алмаз и графит. Указанные вещества — аллотропные модификации углерода. Этот химический элемент может образовывать пять гексагональный и кубический алмаз, графит, карбин (в двух формах).
Гексагональный алмаз обнаружен в метеоритах и получен в лабораторных условиях при продолжительном нагревании под воздействием очень высокого давления.
Алмаз, как известно, является самым твердым из всех веществ, существующих в природе. Применяется он при бурении горных пород и резке стекла. Алмаз представляет собой бесцветное прозрачное которое обладает высокой светопреломляемостью. Кристаллы алмазов имеют кубическую гранецентрированную решетку. Половина атомов кристалла располагается в центрах граней и вершинах одного куба, а остальная половина атомов — в центрах граней и вершинах другого куба, который смещен относительно первого по направлению пространственной диагонали. Атомы формируют тетраэдрическую трехмерную сетку, в которой они имеют
Из всех простых веществ только в алмазе присутствует максимальное количество атомов, которые располагаются очень плотно. Поэтому соединение является очень прочным и твердым. Прочные связи в углеродных тетраэдрах обеспечивают высокую химическую стойкость. На алмаз может воздействовать только фтор или кислород при температуре восемьсот градусов.
Без доступа воздуха при сильном нагреве алмаз превращается в графит. Это вещество представлено кристаллами темно-серого имеет слабый металлический блеск. На ощупь вещество маслянистое. Графит устойчив к нагреванию, обладает сравнительно высокой тепло- и электропроводностью. Вещество применяют при изготовлении карандашей.
Карбин получают синтетическим путем. Это твердое вещество черного цвета со стеклянным блеском. Без доступа воздуха при нагревании карбин превращается в графит.
Существует еще одна форма углерода — аморфный неупорядоченную структуру получают при нагревании углеродосодержащих соединений. Большие залежи угля обнаруживаются в природных условиях. При этом вещество имеет несколько сортов. Уголь может быть представлен в виде сажи, костяного угля или кокса.
Как уже было указано, аллотропные модификации одного элемента характеризуются разной межатомной структурой. Кроме того, они наделены различными химическими и физическими свойствами.
Сера является еще одним элементом, способным к аллотропии. Это вещество применяется человеком с давних времен. Существуют разные аллотропные модификации серы. Наиболее популярной является ромбическая. Она представлена твердым веществом желтого цвета. Ромбическая сера не смачивается водой (плавает на поверхности). Это свойство применяется при добыче вещества. Ромбическая сера растворима в органических растворителях. Вещество обладает плохой электро- и теплопроводностью.
Кроме этого, существует пластическая и моноклинная сера. Первая представляет собой коричневую аморфную (похожую на резину) массу. Она образуется, если в холодную воду вылить расплавленную серу. Моноклинная представлена в виде темно-желтых игл. Под влиянием комнатной (или приближенной к ней) температуре обе эти модификации переходят в ромбическую серу.
Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон – аллотропная модификация кислорода
| ПОДГРУППА КИСЛОРОДА (ХАЛЬКОГЕНЫ) В подгруппу кислорода входят элементы: кислород, сера, селен, теллур, полоний. ХАЛЬКОГЕНЫ В ПРИРОДЕ Положение в таблице Свойства элементов VI-A подгруппы. Кислород и сера имеют одинаковое строение внешнего энергетического уровня –ns 2 np 4 , где n – номер периода. Кислород O 2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле |
АЛЛОТРОПИЯ КИСЛОРОДА
Строение атома
Химические свойства
Взаимодействие веществ с кислородом называется окислением
.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
С неметаллами
S + O 2 → SO 2
2H 2 + O 2 → 2H 2 O
С металлами
2Mg + O 2 → 2MgO
2Cu + O 2 →2CuO (при нагревании)
Со сложными веществами
4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
2H 2 S + 3O 2 → 2SO 2 + 2H 2 O
CH 4 + 2O 2 →CO 2 + 2H 2 O
Горение в кислороде
2. Действием серной кислоты на пероксид бария
3BaO 2 + 3H 2 SO 4 → 3BaSO 4 + 3H 2 O + O 3
Получение и обнаружение озона
Химические свойства
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами.
O 3 → O 2 + O (озон неустойчив)
Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании:
6Ag + O 3 → 3Ag 2 O
Т. е. озон — сильный окислитель:
2KI + O 3 + H 2 O → 2KOH + I 2 + O 2
Озон в природе
Обесцвечивает красящие вещества, отражает УФ — лучи, уничтожает микроорганизмы. Озон является постоянным компонентом атмосферы Земли и играет важную роль для поддержания на ней жизни. В приземных слоях земной атмосферы концентрация озона чрезвычайно мала и составляет величину порядка 10-7 — 10-6%. Однако с увеличением высоты концентрация озона резко возрастает, проходя через максимум на высоте 20-30 км. Общее содержание озона в атмосфере может быть охарактеризовано слоем озона, приведённого к нормальным условиям (0°С, 1 атм
), и составляет толщину около 0,4-0,6 см. Общее содержание озона в атмосфере переменное, и колеблется в зависимости от времени года и географической широты. Как правило, концентрация озона больше в высоких широтах и максимальна весной, а минимальна осенью. Известно, что атмосферный озон играет ключевую роль для поддержания жизни на земле, выступая в качестве защитной составляющей для живых организмов от жёсткого ультрафиолетового излучения Солнца. С другой стороны, озон является весьма эффективным парниковым газом, и, поглощая инфракрасное излучение поверхности Земли, препятствует её охлаждению. Установлено, что нахождение и перемещение масс озона в атмосфере Земли существенно влияет на метеорологическую обстановку на планете.
Применение озона обусловлено его свойствами
1. сильного окисляющего агента:
· для стерилизации изделий медицинского назначения
· при получении многих веществ в лабораторной и промышленной практике
· для отбеливания бумаги
· для очистки масел
2. сильного дезинфицирующего средства:
· для очистки воды и воздуха от микроорганизмов (озонирование)
· для дезинфекции помещений и одежды
Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие токсинов после обработки. Тогда как при хлорировании возможно образование существенного количества токсинов и ядов, например, диоксина.
Сера. Аллотропия серы. Физические и химические свойства серы. Применение
| СЕРА S Cера в природе Самородная сера Украина, Поволжье, Центральная Азия и др Сульфиды PbS — свинцовый блеск Cu 2 S – медный блеск ZnS – цинковая обманка FeS 2 – пирит, серный колчедан, кошачье золото H 2 S – сероводород (в минеральных источниках и природном газе) Белки Волосы, кожные покровы, ногти… Сульфаты CaSO 4 x 2H 2 O — гипс MgSO 4 x 7H 2 O – горькая соль (английская) Na 2 SO 4 x 10H 2 O – глауберова соль (мирабилит) Физические свойства Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t° кип = 445°С Аллотропия Для серы характерны несколько аллотропных модификаций: Взаимопревращение аллотропных модификаций серы |
Строение атома серы
Размещение электронов по уровням и подуровням
Получение серы
1. Промышленный метод — выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H 2 S + O 2 = 2S + 2H 2 O
3. Реакция Вакенродера
2H 2 S + SO 2 = 3S + 2H 2 O
Химические свойства серы
Неметаллы.Аллотропия.
Неметаллы, химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам относятся 22 элемента. Только два неметалла — углерод и сера — были известны в древности. В 13 в. был получен мышьяк, в 17 в. открыты водород и фосфор, в конце 18 в. — кислород, азот, хлор, теллур. В 1789 А. Л. Лавуазье включил эти неметаллы в список простых веществ (кроме хлора, который тогда считали окисленной соляной кислотой). В 1-й половине 19 в. были получены бром, иод, селен, кремний, бор. Изолировать фтор и открыть инертные газы удалось лишь в конце 19 в. Астат получен искусственно в 1940.
1. Положение неметаллов в ПС.
Неметаллы находятся в верхнем правом углу ПС над диагональю В – Аt.
Расположены в главных подгруппах 4 — 8 групп.
Физические свойства.
а) Агрегатное состояние.
- Твердые вещества: бор, углерод, кремний, фосфор, сера, мышьяк, селен, теллур, йод, астат;
- Жидкости: бром – красно – бурая жидкость с тяжелым неприятным запахом;
- Газы: водород, азот, кислород, фтор, хлор и инертные газы.
Особыми являются инертные или благородные газы. Инертные газы не имеют цвета и запаха. И являются одноатомными. Инертные газы считаются благородными. Обладают более высокой электропроводностью (по сравнению с другими) и, при прохождении через них тока, ярко светятся.
- Неон — огненно красным светом.
- Гелий — ярко-жёлтым светом.
- Аргон – синим светом.
- Криптон – светло- желтым светом.
- Ксенон – фиолетовым светом.
Несмотря на свою инертность, эти газы находят широкое применение:
Гелием заполняют воздушные шары и дирижабли.
Аргон в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов.
Все указанные неметаллы (водород, кислород, азот, фтор и хлор) имеют двухатомные молекулы. Водород, кислород и азот бесцветны, фтор имеет светло – зеленый цвет, хлор – желто – зеленый.
б) Не имеют металлического блеска (исключение – графит, йод)
в) Большинство не проводят электрический ток (кроме кремния и графита)
г) Хрупкие.
Аллотропия.
Явление, при котором один химический элемент образует несколько простых веществ.
Причины аллотропии:
Разный состав молекул (О2 и О3)
Разное строение (алмаз, графит)
Аллотропные видоизменения кислорода
О 3 = О 2 + О
Аллотропные видоизменения серы
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной решеток. Молекула S8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°.
Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Тест по теме: Химическая связь. Тип кристаллической решетки | Тест по химии (9 класс):
ТЕСТ
Химическая связь. Тип кристаллической решетки
- В соединении натрия с кислородом химическая связь :
А) ков. полярная б) ков. неполярная в) ионная г) металлическая.
2. Какой(-ие) вид(-ы) связи имеются в молекуле серной кислоты :
А) ков. полярная и ионная б) ков. полярная и ков. неполярная
в) только ков. полярная г) только ионная.
3. Ковалентная неполярная связь между атомами характерна для :
А) хлора б) сероводорода в) углекислого газа г) аммиака.
4. Пластичность и теплопроводность характерны для веществ с :
А) ионной связью б) ков. неполярной связью
В) ков. полярной связью г) металлической связью.
5 .В каком веществе ковалентная полярная связь :
а) H CI б) KCI в) K2O г) O2
6. Какое из веществ имеет ионную связь :
А) C h5 K) N2 O5 H) O 2 J) K2 S
7. Одинаковый вид химической связи имеют оксид калия и
А) сероводород б) фторид натрия в) натрий г) оксид серы ( IV )
8. Вещества с ков. полярной и ков. неполярной связью являются
соответственно:
А) фтор и хлорид калия б) водород и хлор
В) сера и водород г) вода и кислород.
9. Ионную кристаллическую решетку имеет:
А) фторид натрия б) вода в) серебро г) бром
10. Утверждение о том, что структурной частицей данного вещества является
молекула, справедливо только для :
А) алмаза б) азота в) кремния г) поваренной соли
11. Только молекулярную кристаллическую решетку имеют простые вещества,
образованные элементами главной подгруппы:
а) 7 группы б) 6 группы в) 5 группы г) 4 группы
12. Наибольшую температуру плавления имеет вещество,формула которого:
а) C H 4 б) Si O2 в) Sn г) K F
13. Атомную кристаллическую решетку имеет :
А) азот Б) кремний в) красный фосфор г) олово
14. Вещества только с ионной связью приведены в ряду:
а) F 2 , C CI4 , K CI б) Na Br , Na2 O , K I
в) SO2 , P , Ca F 2 г) h3 S , Br2 , K2 S
15. К числу веществ с молекулярным строением принадлежат:
А) алмаз б) известняк в) кварц г) сахароза
Как примеси влияют на качество стали?
Строительство – одна из ведущих отраслей и значимый сектор экономики. Огромное значение для развития строительных работ имеет качественный металлопрокат. Несмотря на то, что современный рынок располагает значительным многообразием строительных материалов, металл не только не теряет свою актуальность, но и приобретает новые воплощения и функции.
Давайте выясним, как те или иные примеси влияют на качество стали.
Какие примеси полезны?
В первую очередь, это кремний и марганец.
Марганец: Благодаря марганцу в стали повышается прокаливаемость, а вредное воздействие серы, наоборот, понижается.
Кремний: повышает прочность стали, раскисляя ее.
И фосфор, и кремний вводится в сталь специально при выплавке.
Какие примеси вредны?
К вредным примесям относятся сера и фосфор.
Сера: Влияние серы отрицательно сказывается на пластичности и вязкости стали. Сталь становится красноломкой при ковке и прокатке.
Но сера может влиять на сталь и положительно. Она придает стали свойства, более оптимальные для обработки. Поэтому, в некоторых случаях, содержание серы все же допустимо (но только в автоматических сталях неответственного назначения).
В стали сера появляется из чугуна.
Фосфор: Негативное влияние фосфора сказывается на пластичности стали. Это связано с тем, что тип кристаллической решетки заметно фосфора заметно отличается от стали.
Фосфор содержится в руде, из которой выплавляют сталь.
Отрицательно сказываются на качестве стали и такие газы, как кислород, азот и водород.
Кислород: уменьшает вязкость и пластичность стали.
Азот: Имеет аналогичное действие.
Водород: вызывает хрупкость стали.
Структура альфа-серы (A16)
Теперь вы можете
- Сера образует восьмиатомные молекулярные кольца. Если ты не видишь
их на картинках выше, вот два из них. - Обратите внимание, что координаты, используемые на изображениях выше, скорректированы.
так что происхождение находится на сайте инверсии. Пирсон выбирает
альтернативная установка для пространственной группы Fddd. - Если взять специальные параметры:
a = 8 ½ a 0 b = 4 a 0 c = 32 ½ a 0 x (1) = 0 г (1) = 1/16 z (1) = 1/16 x (2) = 1/4 г (2) = 1/16 z (2) = -1/16 x (3) = 1/2 г (3) = 1/16 z (3) = 1/16 x (4) = 1/4 г (4) = 3/16 z (4) = -3/16 Атомы находятся в узлах ОЦК (А2)
решетка с постоянной кубической решетки a 0 .
- Прототип: αS
- Символ Пирсона: oF128
- Strukturbericht Обозначение: A16
- Космическая группа: Fddd (списки декартовых координат и координат решетки
в наличии) - Номер: 70
- Ссылка: Виллар и
Калверт, Справочник Пирсона , т. IV, 5117. - Примитивные векторы:
А 1 = ½ b Y + ½ c
ZА 2 = ½ a X + ½ c
ZА 3 = ½ a X + ½ b
Y - Базовые векторы:
Все атомы серы находятся в (32h) узлах, каждый из которых имеет
восемь атомов в примитивной элементарной ячейке.Вместо того, чтобы повторять
все базисные векторы четыре раза, обозначим базис
векторов как
B i ( j ), что означает
атом i th ( i = [1-8]) в
j -я группа ( j = 1,2,3,4). Каждый
группа j задается тремя координатами,
( x (j), y (j), z (j) ), как указано ниже:B 1 (j) = + [y (j) + z (j) -x (j)]
A 1
+ [z (j) + x (j) -y (j)]
A 2
+ [x (j) + y (j) -z (j)]
А 3= + x (j) a X
+ y (j) b Y
+ z (j) c Z[S (j)] (32 часа) B 2 (к) = — [y (j) + z (j) -x (j)]
A 1
— [z (j) + x (j) -y (j)]
A 2
— [x (j) + y (j) -z (j)]
А 3= — x (j) a X
— y (j) b Y
— z (j) c Z[S (j)] (32 часа) B 3 (к) = + [½-x (j) -y (j) -z (j)]
A 1
+ [x (j) + y (j) -z (j)]
A 2
+ [z (j) + x (j) -y (j)]
А 3= + x (j) a X
+ [¼ — y (j)]
б Y
+ [¼-z (j)]
в Z[S (j)] (32 часа) B 4 (к) = + [½ + x (j) + y (j) + z (j)]
A 1
— [x (j) + y (j) -z (j)]
A 2
— [z (j) + x (j) -y (j)]
А 3= — x (j) a X
+ [¼ + y (j)]
б Y
+ [¼ + z (j)]
в Z[S (j)] (32 часа) B 5 (к) = + [x (j) + y (j) -z (j)]
A 1
+ [½-x (j) -y (j) -z (j)]
A 2
+ [y (j) + z (j) -x (j)]
А 3= + [¼-x (j)]
a X
+ y (j) b Y
+ [¼-z (j)]
в Z[S (j)] (32 часа) B 6 (к) = — [x (j) + y (j) -z (j)]
A 1
+ [½ + x (j) + y (j) + z (j)]
A 2
— [y (j) + z (j) -x (j)]
А 3= + [¼ + x (j)]
a X
— y (j) b Y
+ [¼ + z (j)]
в Z[S (j)] (32 часа) B 7 (к) = + [z (j) + x (j) -y (j)]
A 1
+ [y (j) + z (j) -x (j)]
A 2
+ [½-x (j) -y (j) -z (j)]
А 3= + [¼-x (j)]
a X
+ [¼-y (j)]
б Y
+ z (j) c Z[S (j)] (32 часа) B 8 (к) = — [z (j) + x (j) -y (j)]
A 1
— [y (j) + z (j) -x (j)]
A 2
+ [½ + x (j) + y (j) + z (j)]
А 3= + [¼ + x (j)]
a X
+ [¼ + y (j)]
б Y
— z (j) c Z[S (j)] (32 часа)
Вернуться к сере
и его составная страница.
Вернуться к кристаллу
Страница структуры решетки.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Орторомбическая — обзор | Темы ScienceDirect
3.1.1 Сера
Основными компонентами сульфидов меди и железа, конечно же, являются сера, медь и железо. Перед анализом фазового равновесия в системах металл-сера было бы полезно рассмотреть также однокомпонентную систему, содержащую серу.
Серу нельзя удалить из обработанного сырья цветных металлов путем обработки во избежание загрязнения окружающей среды (обжиг, плавка).По этой причине особое внимание следует уделять поведению серы в гидрометаллургических способах обработки цветных металлов. Фактически, элементарная сера представляет собой сложное вещество, которое еще не полностью изучено и не изучено. Это элемент с атомным номером 16, второй элемент VI группы периодической таблицы элементов, так что это неметалл со свойствами, аналогичными свойствам кислорода и селена. Как окислитель, сера имеет валентность -2 и образует сульфиды в сочетании со многими другими элементами.Соединения серы с отрицательной валентностью, конечно, не могут действовать в химических реакциях как окислители независимо от того, имеют ли они ионную или ковалентную связь, и, наоборот, они являются более или менее сильными восстановителями.
При нормальной температуре чистая сера представляет собой светло-желтое твердое вещество без запаха. При понижении температуры сера становится все ярче и при температуре жидкого воздуха становится почти белой. На рынке сера доступна во многих различных коммерческих формах с различными физическими и химическими свойствами, а также чистотой.
Удельная плотность серы примерно в два раза больше плотности воды, в которой сера не растворяется. Он слабо растворим в большинстве обычных растворителей и более растворим в сероуглероде. Реакционная способность серы очень высока. В подходящих условиях сера может напрямую реагировать с большинством других элементов, за исключением инертных газов, йода и молекулярного азота.
Сера реагирует не только с большинством элементов, но и с большим количеством неорганических и органических соединений.Конечно, когда сера образует большое количество аллотропных модификаций, она также должна иметь различное химическое поведение и свойства из-за разного энергетического содержания этих атомов. К сожалению, в отношении серы было опубликовано лишь небольшое количество исследований, позволяющих определить химические свойства различных аллотропных форм элементарной серы. При комнатной температуре термодинамически стабильна только одна модификация серы: сера с циклической цепью, S 8 , но количество атомов серы в молекуле S x может изменяться от 1 до приблизительно 10 6 , когда только изменение температуры.Это означает, что можно получить по крайней мере один миллион форм серы или даже больше, если они действительно существуют, но большинство этих форм могут быть получены только в очень сложных равновесных системах, которые зависят от температуры [8].
Твердая сера имеет две аллотропные модификации: первая, внутримолекулярная аллотропия, учитывается для различных молекулярных форм, образованных химической связью атомов серы, а другая, межмолекулярная, для различного структурного расположения молекул в кристаллах.По сравнению с другими элементами сера имеет очень большое количество полиморфов; в литературе упоминается более тридцати модификаций. Как элемент халькогена с замкнутым внешним слоем (основное состояние представлено формой 3 s 2 3 p x 2 3 p y 1 e p z 2 , что указывает на то, что два неспаренных электрона расположены на разных p -орбиталях; это объясняет, почему сера является двухвалентной: атомы серы образуют только две ковалентные связи с соседними атомами серы с нулевой валентностью) на самом деле сера может образовывать большое количество априори возможных молекулярных форм.Он может быть образован из линейных молекул любой длины, которые могут замыкаться, образуя циклические, кольцеобразные молекулы или иным образом бесконечно длинные цепи. Большое количество этих гипотетических молекулярных группировок организовано независимо от стереохимических отношений, а другие не могут быть отнесены к какому-либо другому кристаллическому устройству. В действительности все циклические молекулы, описанные из кристаллографических соображений, могут образовываться без взаимного проникновения. Однако только линейные цепи с прямыми координатами (которые являются линейными в кристаллографическом смысле этого слова) могут быть скомпонованы в кристаллографические связи.Следовательно, молекулярные структуры, за исключением непрямых цепей, могут формироваться в соответствии с любым молекулярным типом. Ориентация в пространстве ковалентной связи зависит от ориентации ближайшей последующей связи цепи, свободные молекулы делятся равномерно. Другими словами, ожидаемое молекулярное образование характеризуется низкой степенью симметрии. Конечно, это сильно влияет на возможность идентификации отдельных аллотропных форм элементарной серы.
Уже упоминалось, что сера присутствует во многих различных формах. Некоторые из них представляют собой вариации молекулярных конфигураций, другие — вариации кристаллографических структур. При этом упоминается только несколько форм элементарной серы. Они образуются или могут образовываться в процессах выщелачивания и, следовательно, влияют на ход гидрометаллургических реакций.
Вначале следует отметить, что терминология и описание различных форм элементарной серы не очень эффективны и в некоторой степени сбивают с толку.Поэтому термины и названия значительных аллотропных модификаций элементарной серы даны до описания отдельных аллотропных форм серы в таблице 3.1.
Таблица 3.1. Названия и синонимы аллотропных модификаций элементарной серы
| Название | Синоним | Молекулярный тип | Спецификация |
|---|---|---|---|
| α (альфа) | ромбическая, орторомбическая | IoOcta | , Muth орторомбический — α |
| β (бета) | моноклинный I, призматический, Muthmann II | cycloocta-S | моноклинный — β |
| γ (гамма) | моноклинический II, Gerne-Muthmann III, жемчужный- как, перламутр | циклоокта-S | моноклинный — γ |
| δ (дельта) | моноклинный III, −моноклинический, Мутманн IV | циклоокта-S | аллотроп S 8 |
| ε (эпсилон) | Энгель, ромбоэдрический, Атон, моноклинный Энгель | циклогекса-S | ромбоэдрический |
| ζ (дзета) | 5.моноклинический, Коринф | циклоокта-S | аллотроп S 8 |
| η (эта) | 4. моноклинный, Коринф | циклоокта-S | аллотроп S 8 |
| η | тетрагональный, Коринф | циклоокта-S | аллотроп S 8 |
| ɩ (йота) | Erämetsä | циклоокта-S | аллотроп S 8 |
| κ Erämetsä | cycloocta-S | аллотроп S 8 | |
| λ (лямбда) | cycloocta-S | cycloocta S 8 | |
| растворимый μ (mi) | (b) нерастворимый ) полимерный | polychain-S | твердый / жидкий полимер |
| ν (ny) | m | смесь | твердый полимер |
| ξ (xi) | triclinic , Коринф | cycloocta-S | аллотроп S 8 |
| ο (омикрон) | Erämetsä | cycloocta-S | аллотроп S 8 |
| π (pi) | кольцевая смесь | замороженная жидкость | |
| ρ (rho) | Aten, Engel | cyclohexa-S | cyclohexa-S 8 |
| τ (тау) | Erämetsä | cyclohexa-S | аллотроп S 8 |
| ϕ (phi) | Волокнистая | смесь | волокнистая |
| φ (ph) | волокнистая, пластичная | polychain-S | волокнистый |
| χ (chi) | Пластик | смесь | полимер |
| ψ (psi) | Волокнистый | смесь | волокнистый |
| ω (омега) | нерастворимый, белый, Das, суперсублимация | смесь | полимер |
| m | триклинический | циклоокта-S | аллотроп S 8 , твердый полимер |
| n | μ | ||
| Athen | см ϵ, ρ | cyclohexa-S | ромбоэдрический |
| Braun | см μ | смесь | твердый полимер |
| Engel | см. ϵ, ρ | циклогекса-S | ромбоэдрический |
| Коринт | см. ξ, η, θ, ζ | циклоокта-S | твердое тело, полимер |
| Мутманн | см. α, β, γ, δ | cycloocta-S | форма высокого давления |
| Schmidt | см. orthrombic-S 12 | cyclododeca-S | |
| ω, μ | смесь | волокнистый | |
| кубический | кубический пластик высокого давления ϕ, φ, фаза II | нерастворимый | |
| волокнистый | ‘Crystex’, суперсублимированный | смесь | ламинарный |
| нерастворимый | фаза I, белый, ω, μ, χ | polychain-S | форма высокого давления |
| ламинарный | металлический высокого давления | ? | фотосера |
| металлический | нерастворимый | ? | охлаждаемая жидкость |
| фотосера | (a) Skjerven (b) Rice, Schenk | ? | разделенные пары |
| черный | Мальцев | смесь | разделенные пары |
| коричневый | рис | смесь | разделенные пары |
| зеленый | Erämetsä | смесь | |
| оранжевый | Рис | смесь | разделенные пары |
| фиолетовый | (а) Рис (б) Erämetsä | смесь | разделенные пары |
| красный | рис | смесь | разделенный пары |
| фиолетовый | Erämetsä красный | смесь | аллотроп S 8 |
| E, F, GI, K, L, M | оранжевый | смесь |
3.1.1.1 Аллотропные модификации твердой серы
Циклооктасера , S 8
Орторомбическая сера , S α : наиболее значимой формой серы является α
Моноклинная сера , S β : Кристаллизация расплава серы приводит к образованию моноклинной кристаллической формы. Ниже температуры 95,4 ° C кристаллы переходят в ромбическую (α) форму, но быстро охлаждаемые кристаллы могут оставаться при комнатной температуре в моноклинной форме в течение приблизительно одного месяца.По структуре аналогична орторомбической сере S α .
Моноклинная сера , S γ : Вторая форма моноклинной серы упоминается как сера Мутмана III, жемчужная сера или γ-сера. Моноклинные призматические кристаллы образуются путем медленного охлаждения расплава серы, нагретого до температуры выше 150 ° C, или путем охлаждения горячего раствора серы в спирте, гидрокарбонатах или сероуглероде. Также встречается минеральный розикит.Его стабильность до сих пор является предметом дискуссий. Температура плавления S γ составляет 106,8 ° C, а S γ превращается в S β и / или S α .
Помимо этих форм описано большое количество других недостаточно идентифицированных аллотропов циклооктасеры. Их идентификация либо неполна, либо сомнительна [11].
Cyclohexasulphur , S 6 : Термодинамически нестабильный циклогексасера может состоять из чистых кристаллов или находиться в чистом растворе в течение длительного периода времени.Однако в присутствии небольшого количества примесей эта форма серы разрушается очень быстро. Он чувствителен к видимому свету, и его химическая активность также значительно выше, чем у S 8 . Молекулы циклогексасульфура организованы эффективно. Кристаллы имеют элементарную ячейку с 18 атомами и удельную плотность 2,21 г · м — 3 . Это самая высокая удельная плотность из всех известных модификаций, включая термодинамически стабильную орторомбическую форму S 8 [12].
Циклогептасера , γ -S 7 , и δ-S 7 : S 7 могут кристаллизоваться в виде очень длинных игл. Их ярко-желтый цвет, в отличие от S 8 , не исчезает при охлаждении до температуры жидкого воздуха. S 7 обратимо плавится при 39 ° C, претерпевает превращение в полимер при 45 ° C, снова показывает низкую вязкость примерно при 115 ° C и снова полимеризуется при 159 ° C. Видимый свет приводит к быстрому превращению в S 8 путем полимеризации.При низких температурах эта форма серы устойчива в течение нескольких недель. Экспериментальная удельная плотность составляет 2,09 г · м — 3 по сравнению с 2,144 г · м — 3 , рассчитанной для элементарной ячейки из 16 молекул S 7 [13,14].
Результаты большого количества исследований твердого и растворенного S 7 показывают, что S 7 кристаллизуется в четырех различных аллотропах (α, β, γ, δ-S 7 ), термодинамическая стабильность которых все еще неизвестна [ 14].Строение форм γ и δ известно.
Cyclododecasulphur , S 12 : Этот аллотроп является предметом особого внимания не только из-за его удивительно высокой стабильности. Ярко-желтые иглы показывают самую высокую температуру плавления (с разложением) из всех известных модификаций серы, 148 ° C. Его растворимость в обычных растворителях неожиданно низкая. Реакционная способность циклододека серы находится между S 8 и S 6 , но больше на стороне S 8 [14].
Аллотропы полимерной серы : Если вязкий расплав серы ( T > 160 ° C) быстро охлаждается, получается пластичный материал с двумя легко обнаруживаемыми фазами. Все аллотропы образованы серными цепями. Цепная молекула образует длинные спирали. Три члена спирали содержат 10 атомов. Два значения характеристик привязки очень похожи на значения для S 20 и S 12 и находятся между данными для S 8 и S 6 .
Твердая полимерная цепная сера существует во многих формах [15–19], например, каучуковая сера, пластичная сера (χ), ламинарная сера, волокнистая (Y, F), η, μ и так далее. Все эти формы представляют собой метастабильные смеси аллотропов, содержащие более или менее известное определенное количество спиралей, циклооктасеры и других форм, которые зависят от генезиса их образования. Их состав со временем меняется. Если примеси присутствуют, они медленно изменяются до α-S 8 в течение периода до одного месяца.
Жидкая сера : Температуры плавления различных кристаллических аллотропов, часто сопровождающиеся диссоциацией, приведены в таблице 3.2.
Таблица 3.2. Точки плавления аллотропов серы [10]
| Аллотроп | Точка плавления (° C) | Аллотроп | Точка плавления (° C) |
|---|---|---|---|
| S 6 | ~ S 10 | 80–105 | |
| S 7 | 39 | S 6 –S 10 | 92 |
| α-S 8 | 115.1 | S 11 | 74 |
| β-S 8 | 120,1 | S 12 | 148 |
| β-S 8 | 119,6 | S 13 | 114 |
| γ-S 8 | 108,6 | α-S 18 | 126–128 |
| S 9 | & gt; 50 | S 20 | 121 |
Физические свойства жидкой серы очень необычны.При температуре превращения 159 ° C жидкая сера неожиданно превращается в высоковязкий материал, который не течет [20]. Это исключительное 2000-кратное увеличение вязкости сопровождается изменением цвета от светло-серого до темно-красного. Почти все физические свойства (удельная теплоемкость, удельная плотность, электропроводность и т. Д.) Демонстрируют неоднородность при этой температуре превращения. Такое необычное поведение серы вызвано полимеризацией. Полимеризация представлена двумя стадиями реакции; начальная реакция
S8ring → S8chainandring / chain = K1
и продвигающаяся реакция
S8chainn + S8ring → S8n + 1 = K3
Если K 1 и K 3 известны для двух температур , их энтальпия и энтропия получаются из уравнения Ван-Хоффа.
Эта гипотеза точно описывает многие свойства жидкой серы ниже и выше максимума вязкости, предполагая, что при этой температуре плавления жидкость состоит из трех единиц S 8 , которые при 159 ° C полимеризуются до средней цепи примерно 10 5 единиц S 8 длинный. Ожидается, что непрерывная деполимеризация будет происходить при более высоких температурах. С другой стороны, многие свойства показывают, что жидкая сера на самом деле является гораздо более сложной системой.
Помимо полимеров и колец S 8 , также подтверждено присутствие S 3 , S 4 , S 5 и S 6 в жидкой сере [21].Согласно IUPAC, обычная температура кипения серы составляет 444,6 ° C.
3.1.1.2 Фазовая диаграмма
На рисунке 3.1 показана фазовая диаграмма, иллюстрирующая качественные отношения между орторомбическим (S R ), моноклинным (S M ), жидким (S l ) и газообразная сера (S г ) как функция давления и температуры [22,23].
Рис. 3.1. Фазовая диаграмма элементарной серы.
Область, обозначенная S R , является областью стабильности орторомбической серы, а S M является областью стабильности моноклинной серы. Жидкая сера находится в области S l , а пары серы — в области S г .
Линия АО — кривая давления паров ромбической серы. При достаточно быстром повышении температуры кривую давления паров ромбической серы можно продолжить в область моноклинной серы в соответствии с пунктирной линией Ob .Это возможно, потому что превращение ромбической серы в моноклинную происходит очень долго.
OC — кривая кристаллизации из орторомбической формы в моноклинную. Линия BC представляет собой кривую температуры плавления моноклинной серы. Однако, если ромбическая сера быстро нагревается, она может плавиться без образования моноклинной серы. В этих условиях пунктирная линия bC представляет собой кривую плавления орторомбической серы.Следует отметить, что орторомбическая сера плавится при более низкой температуре, чем моноклинная сера.
На диаграмме линия bC продолжается до точки D . Секция CD представляет собой кривую температуры плавления ромбической серы в диапазоне высоких давлений, в котором моноклинная сера нестабильна при любой температуре.
Кривая OB — это кривая давления паров моноклинной серы. При быстром охлаждении моноклинная сера может временно существовать в области орторомбической серы.Пунктирная линия aO , являющаяся продолжением линии OB , указывает метастабильное давление паров моноклинной серы.
Линия BE представляет собой кривую температуры плавления жидкой серы. Ее продолжение вниз до точки b , линия bB , представляет собой кривую точки кипения жидкой орторомбической серы, которая является строго метастабильной формой.
Точка O — точка тройного равновесия ромбической, моноклинной и газообразной серы.Точка C — тройная точка равновесия ромбической, моноклинной и жидкой серы. Точка b — это тройная точка «равновесия» орторомбической, жидкой и газообразной серы, хотя она не является точкой равновесия в обычном смысле этого слова, поскольку представляет собой метастабильные условия.
Из диаграммы видно, что моноклинная сера стабильна только при определенных условиях. При низкой температуре он становится ромбическим и плавится при очень высокой температуре.При слишком низком давлении моноклинная сера испаряется, а при слишком высоком давлении она превращается в ромбическую серу.
Структуры решеток в кристаллических твердых телах — Химия: сначала атомы 2e
Цели обучения
К концу этого раздела вы сможете:
- Опишите расположение атомов и ионов в кристаллических структурах
- Вычислить ионные радиусы, используя размеры элементарной ячейки
- Объяснить использование измерений дифракции рентгеновских лучей для определения кристаллических структур
Более 90% твердых веществ природного и антропогенного происхождения являются кристаллическими.Большинство твердых тел образуются с регулярным расположением своих частиц, потому что общее притягивающее взаимодействие между частицами максимизируется, а общая межмолекулярная энергия сводится к минимуму, когда частицы упаковываются наиболее эффективным образом. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы исследуем некоторые детали структур металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Структуры металлов
Мы начнем обсуждение кристаллических твердых тел с рассмотрения элементарных металлов, которые относительно просты, поскольку каждый содержит только один тип атомов. Чистый металл — это кристаллическое твердое тело, атомы которого плотно упакованы в повторяющийся узор. Некоторые свойства металлов в целом, такие как их пластичность и пластичность, во многом обусловлены наличием одинаковых атомов, расположенных в правильном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения.В следующих разделах мы исследуем сходства и различия четырех наиболее распространенных геометрических форм металлических кристаллов.
Элементарные ячейки металлов
Структуру кристаллического твердого вещества, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая упоминается как его элементарная ячейка. Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на (Рисунок).
Элементарная ячейка показывает расположение точек решетки, повторяющихся во всех направлениях.
Давайте начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Самый простой способ сделать это — создать слои, в которых сферы в одном слое находятся прямо над сферами в слое ниже, как показано на (Рисунок).Такое расположение называется простой кубической структурой, а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.
Когда атомы металла расположены сферами в одном слое непосредственно над или под сферами в другом слое, структура решетки называется простой кубической. Обратите внимание, что сферы соприкасаются.
В простой кубической структуре сферы не упакованы так плотно, как могли бы, и они «заполняют» только около 52% объема контейнера.Это относительно неэффективное устройство, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано на (Рисунок), твердое тело с таким расположением состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом прямо над ним в верхнем слое; и один атом прямо под ним в слое ниже. Число других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, известно как ее координационное число.Следовательно, для атома полония в простом кубическом массиве координационное число равно шести.
Атом в структуре простой кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.
В простой кубической решетке элементарная ячейка, повторяющаяся во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано на (Рисунок). Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам или одному атомному диаметру.Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся в ней. Поскольку атом в углу простой кубической элементарной ячейки состоит в общей сложности из восьми элементарных ячеек, только одна восьмая часть этого атома находится в конкретной элементарной ячейке. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из восьми «углов», в одной простой кубической элементарной ячейке находится атом.
Простая элементарная ячейка кубической решетки содержит одну восьмую атома в каждом из восьми углов, так что всего она содержит один атом.
Расчет атомного радиуса и плотности металлов, часть 1 Длина ребра элементарной ячейки альфа-полония составляет 336 мкм.
(а) Определите радиус атома полония.
(b) Определите плотность альфа-полония.
Раствор Альфа-полоний кристаллизуется в простой кубической элементарной ячейке:
(a) Два соседних атома По контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам По: l = 2 r .Следовательно, радиус Po равен
.
(b) Плотность определяется по формуле. Плотность полония может быть определена путем определения плотности его элементарной ячейки (масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки). Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Массу элементарной ячейки По можно найти по формуле:
Объем элементарной ячейки По можно найти по:
(Обратите внимание, что длина края была преобразована из pm в см, чтобы получить обычные единицы объема для плотности.)
Следовательно, плотность
Проверьте свои знания Длина края элементарной ячейки для никеля составляет 0,3524 нм. Плотность Ni 8,90 г / см 3 . Кристаллизуется ли никель в виде простой кубической структуры? Объяснять.
Ответ:
Нет. Если бы Ni был простым кубическим, его плотность была бы определена как:
Тогда плотность Ni была бы
. Поскольку фактическая плотность Ni не близка к этой, Ni не образует простую кубическую структуру.
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек.А пока мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которые мы уже видели), объемно-центрированной кубической элементарной ячейке и кубической элементарной ячейке с гранецентрированной структурой — все они проиллюстрированы на (Рисунок). (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решеток, всего 14 различных типов элементарных ячеек. Мы оставляем более сложные геометрии на будущее в этом модуле.)
Кубические элементарные ячейки металлов показывают (на верхних рисунках) расположение узлов решетки и (на нижних рисунках) атомов металлов, расположенных в элементарной ячейке.
Некоторые металлы кристаллизуются в виде кубической элементарной ячейки с атомами во всех углах и атомом в центре, как показано на (Рисунок). Это называется объемно-центрированным кубическим (ОЦК) твердым телом. Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре. Элементарная ячейка BCC содержит два атома: одна восьмая атома в каждом из восьми угловых атомов (атом от углов) плюс один атом из центра. Любой атом в этой структуре касается четырех атомов в слое над ним и четырех атомов в слое под ним.Таким образом, атом в структуре ОЦК имеет координационное число восемь.
В объемно-центрированной кубической структуре атомы в определенном слое не касаются друг друга. Каждый атом касается четырех атомов в слое выше и четырех атомов в слое ниже.
Атомы в структурах ОЦК упакованы гораздо эффективнее, чем в простой кубической структуре, занимая около 68% от общего объема. Изоморфные металлы со структурой BCC включают K, Ba, Cr, Mo, W и Fe при комнатной температуре.(Элементы или соединения, которые кристаллизуются с одинаковой структурой, считаются изоморфными.)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и в центре каждой грани, как показано на (Рисунок). Такое расположение называется гранецентрированным кубическим (ГЦК) твердым телом. Элементарная ячейка FCC содержит четыре атома: одну восьмую атома в каждом из восьми угловых атомов (атом от углов) и половину атома на каждой из шести граней атомов от граней).Атомы в углах касаются атомов в центрах смежных граней по диагоналям граней куба. Поскольку атомы находятся в идентичных узлах решетки, они имеют идентичное окружение.
Гранецентрированное кубическое твердое тело имеет атомы по углам и, как следует из названия, в центрах граней его элементарных ячеек.
Атомы в системе ГЦК упакованы как можно ближе друг к другу, причем атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковкой (CCP).В CCP есть три повторяющихся слоя гексагонально расположенных атомов. Каждый атом контактирует с шестью атомами в своем собственном слое, с тремя в слое выше и с тремя в слое ниже. В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12. Тот факт, что устройства FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле являются одной и той же структурой, показано на (Рисунок).
Компоновка CCP состоит из трех повторяющихся слоев (ABCABC…) гексагонально расположенных атомов.Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже. Поворачивая перспективу, мы видим, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине лица) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированное кубическое расположение.
Поскольку более тесная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом. Мы находим два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональная плотнейшая упаковка (HCP), показанная на (Рисунок). Оба состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (B) помещается на первый слой (A), так что каждый атом во втором слое контактирует с тремя атомами в первом слое.Третий слой размещается одним из двух способов. В HCP атомы в третьем слое находятся непосредственно над атомами в первом слое (т. Е. Третий слой также относится к типу A), а наложение состоит из чередующихся плотноупакованных слоев типа A и типа B (то есть ABABAB ⋯). В CCP атомы в третьем слое не находятся над атомами в любом из первых двух слоев (т. Е. Третий слой относится к типу C), а наложение состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т.е. ABCABCABC ⋯). Около двух третей всех металлов кристаллизуются в виде плотноупакованных массивов с координационным числом 12.Металлы, которые кристаллизуются в структуре HCP, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в структуре CCP, включают Ag, Al, Ca, Cu, Ni, Pb и Pt.
В обоих типах плотнейшей упаковки атомы упакованы максимально компактно. Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Расчет атомного радиуса и плотности металлов, часть 2 Кальций кристаллизуется в гранецентрированной кубической структуре.Длина ребра его элементарной ячейки составляет 558,8 мкм.
(а) Каков атомный радиус Са в этой структуре?
(b) Рассчитайте плотность Ca.
Решение
(a) В структуре ГЦК атомы Са контактируют друг с другом по диагонали грани, поэтому длина диагонали равна четырем атомным радиусам Са (d = 4 r ). Два смежных ребра и диагональ лица образуют прямоугольный треугольник, длина каждой стороны которого равна 558.8 пм и длина гипотенузы, равная четырем атомным радиусам Ca:
Решение дает
(b) Плотность дается формулой. Плотность кальция может быть найдена путем определения плотности его элементарной ячейки: например, масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки. Гранецентрированная элементарная ячейка Са имеет одну восьмую атома на каждом из восьми угловых атомов) и половину атома на каждом из шести граней атомов), всего четыре атома в элементарной ячейке.
Массу элементарной ячейки можно найти по:
Объем элементарной ячейки Са можно определить по:
(Обратите внимание, что длина края была преобразована из pm в см, чтобы получить обычные единицы объема для плотности.)
Тогда плотность
Проверьте свое обучение Серебро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки 409 мкм.
(а) Каков атомный радиус Ag в этой структуре?
(б) Рассчитайте плотность Ag.
Ответ:
(а) 144 пм; (б) 10,5 г / см 3
В общем случае элементарная ячейка определяется длиной трех осей ( a , b и c ) и углами ( α , β и γ ) между ними, как проиллюстрировано на (Рисунок). Оси определяются как длины между точками пространственной решетки. Следовательно, оси элементарной ячейки соединяют точки с идентичной средой.
Элементарная ячейка определяется длиной трех ее осей ( a , b и c ) и углами ( α , β и γ ) между осями.
Существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, которые имеют форму, показанную на (Рисунок).
Существует семь различных систем решеток и 14 различных элементарных ячеек.
Структура ионных кристаллов
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металла того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение к ионам противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1), когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда, и (2) когда катионы и анионы контактируют друг с другом. Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением количества положительных и отрицательных ионов в соединении.
В простых ионных структурах мы обычно находим анионы, которые обычно больше, чем катионы, расположенные в виде плотноупакованного массива. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы крупнее, а меньшее количество электронов, притягиваемых к тому же ядру, делает катионы меньше по сравнению с атомами, из которых они образованы.) Более мелкие катионы обычно занимают один из двух типов дырок ( или пустоты), оставшиеся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости.Четыре аниона, окружающие это отверстие, расположены по углам тетраэдра, поэтому отверстие называется тетраэдрическим отверстием. Дыра большего размера находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием. (Рисунок) иллюстрирует оба этих типа отверстий.
Катионы могут занимать два типа дырок между анионами: октаэдрические дырки и тетраэдрические дырки.
В зависимости от относительных размеров катионов и анионов, катионы ионного соединения могут занимать тетраэдрические или октаэдрические отверстия, как показано на (Рисунок).Относительно небольшие катионы занимают тетраэдрические отверстия, а более крупные — октаэдрические. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простой кубический массив. Тогда более крупные катионы могут занять большие кубические отверстия, что стало возможным благодаря более открытому пространству.
Размер катиона и форма отверстия, занимаемого соединением, напрямую связаны.
Есть две тетраэдрические дырки для каждого аниона в массиве анионов HCP или CCP.Соединение, которое кристаллизуется в виде плотноупакованного массива анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены при этом соотношении. Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2: 1 также могут кристаллизоваться в виде плотноупакованного массива анионов с катионами. в тетраэдрических отверстиях, если подходят размеры ионов. Однако в этих соединениях часть тетраэдрических дырок остается вакантной.
Заполнение четырехгранных отверстий Сульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках. Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотноупакованном массиве сульфид-ионов. Какая формула сульфида цинка?
Решение Поскольку на каждый анион (сульфид-ион) приходится две тетраэдрических дырки и половина этих дырок занята ионами цинка, на каждый сульфид-ион должно приходиться или 1 ион цинка.Таким образом, формула ZnS.
Проверьте свои знания Селенид лития можно описать как плотнейшую упаковку ионов селенида с ионами лития во всех тетраэдрических отверстиях. Какая у него формула селенида лития?
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1: 1. Таким образом, соединения с катионами в октаэдрических дырках в плотноупакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены.Отношения менее 1: 1 наблюдаются, когда некоторые из октаэдрических отверстий остаются пустыми.
Стехиометрия ионных соединений Сапфир — это оксид алюминия. Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических отверстий в плотноупакованном массиве оксидных ионов. Какая формула у оксида алюминия?
Решение Поскольку на каждый анион (оксидный ион) приходится одна октаэдрическая дырка и только две трети этих дырок заняты, отношение алюминия к кислороду должно быть: 1, что дало бы простейшее целочисленное отношение 2: 3, поэтому формула Al 2 O 3 .
Проверьте свои знания Белый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотноупакованном массиве оксидных ионов. Какая формула оксида титана?
В простом кубическом массиве анионов есть одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические дырки заняты. Половина кубических дырок занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одной и той же структуре, если относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) схожи.
Элементарные ячейки ионных соединений
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения, чтобы описать общие особенности ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1: 1, оно обычно образует простую кубическую структуру.Примером этого является хлорид цезия, CsCl (проиллюстрирован на (Рисунок)), причем Cs + и Cl — имеют радиусы 174 и 181 мкм соответственно. Мы можем представить это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или в виде ионов цезия, образующих элементарную ячейку с ионом хлорида в центре; или в виде простых кубических элементарных ячеек, образованных ионами Cs + , перекрывающими элементарные ячейки, образованные ионами Cl — . Ионы цезия и ионы хлора соприкасаются по диагоналям тела элементарных ячеек.Один ион цезия и один ион хлорида присутствуют в элементарной ячейке, что дает стехиометрию 1: 1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, и CsCl не является структурой BCC, потому что ион цезия не идентичен иону хлорида.
Ионные соединения с катионами и анионами аналогичного размера, такие как CsCl, обычно образуют простую кубическую структуру. Их можно описать элементарными ячейками с катионами по углам или анионами по углам.
Мы сказали, что расположение точек решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия. В этом описании ионы цезия расположены в точках решетки в углах ячейки, а ион хлорида расположен в центре ячейки. Две элементарные ячейки разные, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1: 1, которые значительно различаются по размеру, оно обычно кристаллизуется с помощью элементарной ячейки FCC, как показано на (Рисунок).Примером этого является хлорид натрия, NaCl, причем Na + и Cl — имеют радиусы 102 и 181 мкм соответственно. Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Ионные соединения с анионами, которые намного крупнее катионов, например NaCl, обычно образуют структуру ГЦК. Их можно описать элементарными ячейками ГЦК с катионами в октаэдрических дырках.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке FCC, как показано на (Рисунок). Эта структура содержит ионы сульфида в узлах решетки ГЦК-решетки. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия.) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти маленькие ионы Zn 2+ расположены в чередующихся тетраэдрических дырках, то есть в одной половине тетраэдрических дырок. В элементарной ячейке четыре иона цинка и четыре иона сульфида, что дает эмпирическую формулу ZnS.
ZnS, сульфид цинка (или цинковая обманка) образует элементарную ячейку ГЦК с ионами сульфида в узлах решетки и ионами цинка гораздо меньшего размера, занимающими половину тетраэдрических отверстий в структуре.
Элементарная ячейка с фторидом кальция, подобная той, что показана на (Рисунок), также является элементарной ячейкой FCC, но в этом случае катионы расположены в точках решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК-решетки. Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора. В элементарной ячейке четыре иона кальция и восемь ионов фтора, что дает соотношение кальций: фтор 1: 2 в соответствии с химической формулой CaF 2 .Внимательное изучение (Рисунок) покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структуру нельзя описать в терминах пространственной решетки точек на фторид-ионах, потому что не все фторид-ионы имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Фторид кальция, CaF 2 , образует элементарную ячейку ГЦК с ионами кальция (зеленый) в узлах решетки и ионами фтора (красный), занимающими все тетраэдрические узлы между ними.
Расчет ионных радиусов
Если мы знаем длину края элементарной ячейки ионного соединения и положение ионов в ячейке, мы можем вычислить ионные радиусы для ионов в соединении, если мы сделаем предположения об индивидуальных формах ионов и контактах.
Расчет ионных радиусов Длина края элементарной ячейки LiCl (NaCl-подобная структура, FCC) составляет 0,514 нм или 5,14 Å. Предполагая, что ион лития достаточно мал, чтобы ионы хлора контактировали, как показано на (Рисунок), рассчитайте ионный радиус для иона хлорида.
Примечание. Единица измерения длины, Å, часто используется для представления размеров в атомном масштабе и эквивалентна 10 −10 м.
Решение На лицевой стороне элементарной ячейки LiCl ионы хлора контактируют друг с другом по диагонали грани:
Нарисовав прямоугольный треугольник на поверхности элементарной ячейки, мы видим, что длина диагонали равна четырем радиусам хлорида (один радиус от каждого углового хлорида и один диаметр, равный двум радиусам, от иона хлорида в центре). грани), поэтому d = 4 r .Из теоремы Пифагора имеем:
, что дает:
Решение этого дает:
Проверьте свои знания Длина края элементарной ячейки KCl (NaCl-подобная структура, FCC) составляет 6,28 Å. Предполагая, что анион-катионный контакт проходит по краю ячейки, рассчитайте радиус иона калия. Радиус хлорид-иона составляет 1,82 Å.
Ответ:
Радиус иона калия 1,33 Å.
Важно понимать, что значения ионных радиусов, рассчитанные из длин краев элементарных ячеек, зависят от множества предположений, таких как идеальная сферическая форма для ионов, которые в лучшем случае являются приблизительными.Следовательно, такие расчетные значения сами по себе являются приблизительными, и сравнения нельзя зайти слишком далеко. Тем не менее, этот метод оказался полезным для расчета ионных радиусов на основе экспериментальных измерений, таких как рентгеновские кристаллографические определения.
Рентгеновская кристаллография
Размер элементарной ячейки и расположение атомов в кристалле могут быть определены из измерений дифракции рентгеновских лучей на кристалле, называемых рентгеновской кристаллографией. Дифракция — это изменение направления движения электромагнитной волны, когда она встречает физический барьер, размеры которого сопоставимы с размерами длины волны света.Рентгеновские лучи — это электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматических рентгеновских лучей попадает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла. Когда рассеянные волны, распространяющиеся в одном направлении, сталкиваются друг с другом, они претерпевают интерференцию , процесс, посредством которого волны объединяются, приводя к увеличению или уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн находятся разделены (см. (рисунок)).
Световые волны, занимающие одно и то же пространство, испытывают интерференцию, объединяясь, давая волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи определенной длины волны, λ , рассеиваются атомами в соседних кристаллических плоскостях, разделенных расстоянием, d , они могут претерпевать конструктивную интерференцию, когда разница между расстояниями, пройденными двумя волнами до их комбинация представляет собой целочисленный коэффициент длины волны n .Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
Это соотношение известно как уравнение Брэгга в честь У. Х. Брэгга, английского физика, который первым объяснил это явление. (Рисунок) иллюстрирует два примера дифрагированных волн от одних и тех же двух кристаллических плоскостей. На рисунке слева изображены волны, дифрагированные под углом Брэгга, приводящие к конструктивной интерференции, а на рисунке справа показаны дифракция и другой угол, который не удовлетворяет условию Брэгга, что приводит к деструктивной интерференции.
Дифракция рентгеновских лучей, рассеянных атомами внутри кристалла, позволяет определить расстояние между атомами. Верхнее изображение показывает конструктивную интерференцию между двумя рассеянными волнами и результирующей дифрагированной волной высокой интенсивности. На нижнем изображении показаны деструктивная интерференция и дифрагированная волна низкой интенсивности.
Посетите этот сайт для получения дополнительных сведений об уравнении Брэгга и симуляторе, который позволяет исследовать влияние каждой переменной на интенсивность дифрагированной волны.
Рентгеновский дифрактометр, такой как изображенный на (Рисунок), может использоваться для измерения углов, под которыми рентгеновские лучи дифрагируют при взаимодействии с кристаллом, как описано ранее. Из таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
(a) В дифрактометре луч рентгеновских лучей попадает на кристаллический материал, создавая (b) картину дифракции рентгеновских лучей, которая может быть проанализирована для определения кристаллической структуры.
Использование уравнения Брэгга В дифрактометре рентгеновские лучи с длиной волны 0,1315 нм использовались для создания дифракционной картины для меди. Дифракция первого порядка ( n = 1) произошла под углом θ = 25,25 °. Определите расстояние между дифрагирующими плоскостями в меди.
Решение Расстояние между плоскостями находится путем решения уравнения Брэгга, nλ = 2 d sin θ для d .
Это дает:
Проверьте свои знания Кристалл с расстоянием между плоскостями, равным 0,394 нм, дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Рентгеновский кристаллограф Розалинд Франклин
Открытие структуры ДНК в 1953 году Фрэнсисом Криком и Джеймсом Уотсоном — одно из величайших достижений в истории науки. Они были удостоены Нобелевской премии по физиологии и медицине 1962 года вместе с Морисом Уилкинсом, который предоставил экспериментальное доказательство структуры ДНК.Британский химик Розалинд Франклин внесла неоценимый вклад в это грандиозное достижение своей работой по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин структуры углей оказались полезными для британских военных действий. В начале 1950-х годов Франклин и докторант Реймонд Гослинг переключили свое внимание на биологические системы и обнаружили, что ДНК состоит из двух форм: длинного тонкого волокна, образующегося при намокании (тип «B»), и короткого широкого волокна, образующегося при сушке ( наберите «А»).Ее рентгеновские дифракционные изображения ДНК ((Рисунок)) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры. Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди множества посмертных признаний ее работы Чикагская медицинская школа Финчского университета медицинских наук изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году. и приняла изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
На этой иллюстрации показано изображение дифракции рентгеновских лучей, подобное тому, которое Франклин нашла в своем исследовании. (кредит: Национальный институт здоровья)
Основные понятия и резюме
Структуры кристаллических металлов и простых ионных соединений можно описать в терминах упаковки сфер. Атомы металла могут упаковываться в гексагональные структуры с плотнейшей упаковкой, кубические структуры с плотнейшей упаковкой, объемно-центрированные структуры и простые кубические структуры. Анионы в простых ионных структурах обычно принимают одну из этих структур, а катионы занимают пространства, оставшиеся между анионами.Маленькие катионы обычно занимают тетраэдрические дырки в плотноупакованном массиве анионов. Катионы большего размера обычно занимают октаэдрические отверстия. Катионы еще большего размера могут занимать кубические дырки в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и ее содержимое. Тип структуры и размеры элементарной ячейки могут быть определены путем измерения дифракции рентгеновских лучей.
Ключевые уравнения
Химия: упражнения в конце главы
Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в кубической элементарной ячейке.
Структура этой низкотемпературной формы железа (ниже 910 ° C) является объемноцентрированной кубической. В каждом из восьми углов куба находится по одной восьмой атома, а в центре куба — по одному атому.
Опишите кристаллическую структуру Pt, которая кристаллизуется с четырьмя эквивалентными атомами металла в кубической элементарной ячейке.
Какое координационное число атома хрома в объемноцентрированной кубической структуре хрома?
Каково координационное число атома алюминия в гранецентрированной кубической структуре алюминия?
Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре.Какое координационное число атома кобальта?
Металлический никель кристаллизуется в кубической плотноупакованной структуре. Какое координационное число атома никеля?
Вольфрам кристаллизуется в объемно-центрированной кубической элементарной ячейке с длиной ребра 3,165 Å.
(а) Каков атомный радиус вольфрама в этой структуре?
(б) Рассчитайте плотность вольфрама.
(а) 1,370 Å; (б) 19,26 г / см
Платина (атомный радиус = 1.38 Å) кристаллизуется в кубическую плотноупакованную структуру. Рассчитайте длину кромки гранецентрированной кубической элементарной ячейки и плотность платины.
Барий кристаллизуется в объемноцентрированной кубической элементарной ячейке с длиной ребра 5,025 Å
(а) Каков атомный радиус бария в этой структуре?
(б) Рассчитайте плотность бария.
(а) 2,176 Å; (б) 3,595 г / см 3
Алюминий (атомный радиус 1,43 Å) кристаллизуется в кубической плотноупакованной структуре.Рассчитайте длину ребра гранецентрированной кубической элементарной ячейки и плотность алюминия.
Плотность алюминия 2,7 г / см 3 ; кремния 2,3 г / см 3 . Объясните, почему Si имеет более низкую плотность, хотя в нем более тяжелые атомы.
Кристаллическая структура Si показывает, что он менее плотно упакован (координационное число 4) в твердом теле, чем Al (координационное число 12).
Свободное пространство в металле может быть найдено путем вычитания объема атомов в элементарной ячейке из объема ячейки.Вычислите процент свободного пространства в каждой из трех кубических решеток, если все атомы в каждой имеют одинаковый размер и касаются своих ближайших соседей. Какая из этих структур представляет собой наиболее эффективную упаковку? То есть в каких упаковках меньше всего неиспользуемого места?
Сульфид кадмия, иногда используемый художниками в качестве желтого пигмента, кристаллизуется с кадмием, занимая половину тетраэдрических отверстий в плотно упакованном массиве сульфид-ионов. Какая формула сульфида кадмия? Поясните свой ответ.
В массиве с наиболее плотной упаковкой для каждого аниона существуют две тетраэдрические дырки. Если занята только половина тетраэдрических дырок, количество анионов и катионов равно. Формула сульфида кадмия — CdS.
Соединение кадмия, олова и фосфора используется в производстве некоторых полупроводников. Он кристаллизуется с кадмием, занимающим одну четверть тетраэдрических дырок, и оловом, занимающим одну четверть тетраэдрических дырок в плотно упакованном массиве фосфид-ионов.Какая формула соединения? Поясните свой ответ.
Какова формула магнитного оксида кобальта, используемого в записывающих лентах, который кристаллизуется с атомами кобальта, занимающими одну восьмую тетраэдрических дырок и половину октаэдрических дырок в плотно упакованном массиве оксидных ионов?
Соединение, содержащее цинк, алюминий и серу, кристаллизуется с плотнейшей упаковкой сульфид-ионов. Ионы цинка находятся в одной восьмой тетраэдрических дырок, а ионы алюминия — в половине октаэдрических дырок.Какова эмпирическая формула соединения?
Соединение таллия и йода кристаллизуется в виде простого кубического массива иодид-ионов с ионами таллия во всех кубических дырках. Какая формула этого йодида? Поясните свой ответ.
В простом кубическом массиве только одно кубическое отверстие может быть занято катионом для каждого аниона в массиве. Соотношение таллия и йодида должно быть 1: 1; следовательно, формула таллия — TlI.
Какой из следующих элементов реагирует с серой с образованием твердого тела, в котором атомы серы образуют плотноупакованный массив со всеми занятыми октаэдрическими отверстиями: Li, Na, Be, Ca или Al?
Каков массовый процент титана в рутиле, минерале, содержащем титан и кислород, если структуру можно описать как плотно упакованный массив оксидных ионов с ионами титана в половине октаэдрических отверстий? Какова степень окисления титана?
59.95%; Степень окисления титана +4.
Объясните, почему химически похожие хлориды щелочных металлов NaCl и CsCl имеют разную структуру, тогда как химически разные NaCl и MnS имеют одинаковую структуру.
Поскольку минералы образовались из расплавленной магмы, разные ионы занимали одни и те же участки в кристаллах. Литий часто встречается вместе с магнием в минералах, несмотря на разницу в заряде их ионов. Предложите объяснение.
Оба иона близки по размеру: Mg, 0.65; Ли 0,60. Это сходство позволяет им довольно легко поменяться местами. Разница в заряде обычно компенсируется переключателем Si 4+ на Al 3+ .
Иодид рубидия кристаллизуется с кубической элементарной ячейкой, содержащей иодид-ионы по углам и ион рубидия в центре. Какая формула соединения?
Один из различных оксидов марганца кристаллизуется с кубической элементарной ячейкой, содержащей ионы марганца по углам и в центре.Ионы оксида расположены в центре каждого края элементарной ячейки. Какая формула соединения?
NaH кристаллизуется с той же кристаллической структурой, что и NaCl. Длина ребра кубической элементарной ячейки NaH составляет 4,880 Å.
(a) Рассчитайте ионный радиус H — . (Ионный радиус Li + составляет 0,0,95 Å.)
(b) Рассчитайте плотность NaH.
Иодид таллия (I) кристаллизуется с той же структурой, что и CsCl. Длина ребра элементарной ячейки TlI равна 4.20 Å. Рассчитайте ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)
Кубическая элементарная ячейка содержит ионы марганца по углам и ионы фтора в центре каждого края.
(а) Какова эмпирическая формула этого соединения? Поясните свой ответ.
(б) Каково координационное число иона Mn 3+ ?
(c) Рассчитайте длину края элементарной ячейки, если радиус иона Mn 3+ равен 0.65 А.
(d) Рассчитайте плотность соединения.
Каково расстояние между плоскостями кристалла, которые дифрагируют рентгеновские лучи с длиной волны 1,541 нм под углом θ 15,55 ° (отражение первого порядка)?
Дифрактометр, использующий рентгеновские лучи с длиной волны 0,2287 нм, дает пик дифракции первого порядка для угла кристалла θ = 16,21 °. Определите расстояние между дифрагирующими плоскостями в этом кристалле.
Металл с расстоянием между плоскостями 0.4164 нм дифрагирует рентгеновские лучи с длиной волны 0,2879 нм. Каков угол дифракции для дифракционного пика первого порядка?
Золото кристаллизуется в кубической гранецентрированной элементарной ячейке. Отражение второго порядка (n = 2) рентгеновских лучей для плоскостей, составляющих вершину и основание элементарных ячеек, находится при θ = 22,20 °. Длина волны рентгеновских лучей составляет 1,54 Å. Какова плотность металлического золота?
Когда электрон в возбужденном атоме молибдена падает с L на K-оболочку, испускается рентгеновское излучение.Эти рентгеновские лучи дифрагируют под углом 7,75 ° на плоскостях с разделением 2,64 Å. Какова разница в энергии между K-оболочкой и L-оболочкой в молибдене в предположении дифракции первого порядка?
1,74 10 4 эВ
Глоссарий
- объемно-центрированный кубический (ОЦК) твердый
- кристаллическая структура, которая имеет кубическую элементарную ячейку с точками решетки по углам и в центре ячейки
- объемно-центрированная кубическая элементарная ячейка
- простейший повторяющийся элемент объемно-центрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре куба
- Уравнение Брэгга
- уравнение, связывающее углы, под которыми рентгеновские лучи дифрагируют атомами внутри кристалла
- координационный номер
- Число атомов, ближайших к любому данному атому в кристалле или к центральному атому металла в комплексе
- кубическая плотная упаковка (ГКТ)
- кристаллическая структура, в которой плоскости плотно упакованных атомов или ионов уложены в виде серии из трех чередующихся слоев с различной относительной ориентацией (ABC)
- дифракция
- перенаправление электромагнитного излучения, возникающее при встрече с физическим барьером соответствующих размеров
- гранецентрированный кубический (FCC) твердый
- кристаллическая структура, состоящая из кубической элементарной ячейки с точками решетки по углам и в центре каждой грани
- гранецентрированная кубическая элементарная ячейка
- простейший повторяющийся элемент гранецентрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре каждой грани
- Гексагональная плотная упаковка (HCP)
- кристаллическая структура, в которой плотно упакованные слои атомов или ионов уложены в виде серии из двух чередующихся слоев с различной относительной ориентацией (AB)
- отверстие
- (также междоузлия) пространство между атомами внутри кристалла
- изоморфный
- с такой же кристаллической структурой
- октаэдрическое отверстие
- открытое пространство в кристалле в центре из шести частиц, расположенных по углам октаэдра
- простая кубическая элементарная ячейка
- (также примитивная кубическая элементарная ячейка) элементарная ячейка в простой кубической структуре
- простая кубическая структура
- кристаллическая структура с кубической элементарной ячейкой с узлами решетки только по углам
- пространственная решетка
- все точки в кристалле, которые имеют идентичную среду
- четырехгранное отверстие
- тетраэдрическое пространство, образованное четырьмя атомами или ионами в кристалле
- элементарная ячейка
- наименьшая часть пространственной решетки, которая повторяется в трех измерениях, образуя всю решетку
- Рентгеновская кристаллография
- экспериментальный метод определения расстояний между атомами в кристалле путем измерения углов, под которыми рентгеновские лучи дифрагируют при прохождении через кристалл
()
% PDF-1.4
%
1 0 объект
>
эндобдж
6 0 obj
/Заголовок
/Предмет
/ Автор
/Режиссер
/ Ключевые слова
/ CreationDate (D: 20210512181048-00’00 ‘)
/ ModDate (D: 2008061
06 + 02’00 ‘)
>>
эндобдж
2 0 obj
>
эндобдж
3 0 obj
>
эндобдж
4 0 объект
>
эндобдж
5 0 obj
>
поток
GPL Ghostscript 9.05 () 2008-06-19T12: 07: 06 + 02: 002008-06-19T12: 07: 06 + 02: 00PDFCreator Version 1.4.1
конечный поток
эндобдж
7 0 объект
>
эндобдж
8 0 объект
>
эндобдж
9 0 объект
>
эндобдж
10 0 obj
>
эндобдж
11 0 объект
>
эндобдж
12 0 объект
>
эндобдж
13 0 объект
>
эндобдж
14 0 объект
>
эндобдж
15 0 объект
>
эндобдж
16 0 объект
>
эндобдж
17 0 объект
>
эндобдж
18 0 объект
>
эндобдж
19 0 объект
>
эндобдж
20 0 объект
>
эндобдж
21 0 объект
>
эндобдж
22 0 объект
>
эндобдж
23 0 объект
>
эндобдж
24 0 объект
>
эндобдж
25 0 объект
>
эндобдж
26 0 объект
>
эндобдж
27 0 объект
>
эндобдж
28 0 объект
>
эндобдж
29 0 объект
>
эндобдж
30 0 объект
>
эндобдж
31 0 объект
>
эндобдж
32 0 объект
>
эндобдж
33 0 объект
>
эндобдж
34 0 объект
>
эндобдж
35 0 объект
>
эндобдж
36 0 объект
>
эндобдж
37 0 объект
>
эндобдж
38 0 объект
>
эндобдж
39 0 объект
>
эндобдж
40 0 объект
>
эндобдж
41 0 объект
>
эндобдж
42 0 объект
>
эндобдж
43 0 объект
>
эндобдж
44 0 объект
>
эндобдж
45 0 объект
>
эндобдж
46 0 объект
>
эндобдж
47 0 объект
>
эндобдж
48 0 объект
>
эндобдж
49 0 объект
>
эндобдж
50 0 объект
>
эндобдж
51 0 объект
>
эндобдж
52 0 объект
>
эндобдж
53 0 объект
>
эндобдж
54 0 объект
>
эндобдж
55 0 объект
>
эндобдж
56 0 объект
>
эндобдж
57 0 объект
>
эндобдж
58 0 объект
>
эндобдж
59 0 объект
>
эндобдж
60 0 объект
>
эндобдж
61 0 объект
>
эндобдж
62 0 объект
>
эндобдж
63 0 объект
>
эндобдж
64 0 объект
>
эндобдж
65 0 объект
>
эндобдж
66 0 объект
>
эндобдж
67 0 объект
>
эндобдж
68 0 объект
>
эндобдж
69 0 объект
>
эндобдж
70 0 объект
>
эндобдж
71 0 объект
>
эндобдж
72 0 объект
>
эндобдж
73 0 объект
>
эндобдж
74 0 объект
>
эндобдж
75 0 объект
>
эндобдж
76 0 объект
>
эндобдж
77 0 объект
>
эндобдж
78 0 объект
>
эндобдж
79 0 объект
>
эндобдж
80 0 объект
>
эндобдж
81 0 объект
>
эндобдж
82 0 объект
>
эндобдж
83 0 объект
>
эндобдж
84 0 объект
>
эндобдж
85 0 объект
>
эндобдж
86 0 объект
>
эндобдж
87 0 объект
>
эндобдж
88 0 объект
>
эндобдж
89 0 объект
>
эндобдж
90 0 объект
>
эндобдж
91 0 объект
>
эндобдж
92 0 объект
>
эндобдж
93 0 объект
>
эндобдж
94 0 объект
>
эндобдж
95 0 объект
>
эндобдж
96 0 объект
>
эндобдж
97 0 объект
>
эндобдж
98 0 объект
>
эндобдж
99 0 объект
>
эндобдж
100 0 объект
>
эндобдж
101 0 объект
>
эндобдж
102 0 объект
>
эндобдж
103 0 объект
>
эндобдж
104 0 объект
>
эндобдж
105 0 объект
>
эндобдж
106 0 объект
>
эндобдж
107 0 объект
>
эндобдж
108 0 объект
>
эндобдж
109 0 объект
>
эндобдж
110 0 объект
>
эндобдж
111 0 объект
>
эндобдж
112 0 объект
>
эндобдж
113 0 объект
>
эндобдж
114 0 объект
>
эндобдж
115 0 объект
>
эндобдж
116 0 объект
>
эндобдж
117 0 объект
>
эндобдж
118 0 объект
>
эндобдж
119 0 объект
>
эндобдж
120 0 объект
>
эндобдж
121 0 объект
>
эндобдж
122 0 объект
>
эндобдж
123 0 объект
>
эндобдж
124 0 объект
>
эндобдж
125 0 объект
>
эндобдж
126 0 объект
>
эндобдж
127 0 объект
>
эндобдж
128 0 объект
>
эндобдж
129 0 объект
>
эндобдж
130 0 объект
>
эндобдж
131 0 объект
>
эндобдж
132 0 объект
>
эндобдж
133 0 объект
>
эндобдж
134 0 объект
>
эндобдж
135 0 объект
>
эндобдж
136 0 объект
>
эндобдж
137 0 объект
>
эндобдж
138 0 объект
>
эндобдж
139 0 объект
>
эндобдж
140 0 объект
>
эндобдж
141 0 объект
>
эндобдж
142 0 объект
>
эндобдж
143 0 объект
>
эндобдж
144 0 объект
>
эндобдж
145 0 объект
>
эндобдж
146 0 объект
>
эндобдж
147 0 объект
>
эндобдж
148 0 объект
>
эндобдж
149 0 объект
>
эндобдж
150 0 объект
>
эндобдж
151 0 объект
>
эндобдж
152 0 объект
>
эндобдж
153 0 объект
>
эндобдж
154 0 объект
>
эндобдж
155 0 объект
>
эндобдж
156 0 объект
>
эндобдж
157 0 объект
>
эндобдж
158 0 объект
>
эндобдж
159 0 объект
>
эндобдж
160 0 объект
>
эндобдж
161 0 объект
>
эндобдж
162 0 объект
>
эндобдж
163 0 объект
>
эндобдж
164 0 объект
>
эндобдж
165 0 объект
>
эндобдж
166 0 объект
>
эндобдж
167 0 объект
>
эндобдж
168 0 объект
>
эндобдж
169 0 объект
>
эндобдж
170 0 объект
>
эндобдж
171 0 объект
>
эндобдж
172 0 объект
>
эндобдж
173 0 объект
>
эндобдж
174 0 объект
>
эндобдж
175 0 объект
>
эндобдж
176 0 объект
>
эндобдж
177 0 объект
>
эндобдж
178 0 объект
>
эндобдж
179 0 объект
>
эндобдж
180 0 объект
>
эндобдж
181 0 объект
>
эндобдж
182 0 объект
>
эндобдж
183 0 объект
>
эндобдж
184 0 объект
>
эндобдж
185 0 объект
>
эндобдж
186 0 объект
>
эндобдж
187 0 объект
>
эндобдж
188 0 объект
>
эндобдж
189 0 объект
>
эндобдж
190 0 объект
>
эндобдж
191 0 объект
>
эндобдж
192 0 объект
>
эндобдж
193 0 объект
>
эндобдж
194 0 объект
>
эндобдж
195 0 объект
>
эндобдж
196 0 объект
>
эндобдж
197 0 объект
>
эндобдж
198 0 объект
>
эндобдж
199 0 объект
>
эндобдж
200 0 объект
>
/ ProcSet [/ PDF / Text / ImageC / ImageB / ImageI]
>>
эндобдж
201 0 объект
>
поток
x ڝ Xn + 7 + HEhvE; AqW ($) X «, XsK% brYNo = 8oGX / 3a9MZ | mt
твердых веществ
чтения для этого раздела.
Петруччи: Секция 12-7, до 12-9
Классификация твердых тел
Существует несколько категорий классификации, используемых для группировки различных видов.
твердых тел. Некоторые сосредотачиваются на том, как твердые тела связаны друг с другом, другие сосредотачиваются на
от повторяемости твердой конструкции. Мы постараемся прояснить эти
различные классификации с примерами, чтобы учащийся мог идентифицировать
категория (-ы), к которой подходит любое данное твердое тело.
Классификация по диапазону повторяемости атомов
Повторяемость твердого тела относится к
к способности использовать расположение атомов в одном месте для прогнозирования расположения атомов
в других местах.В идеально повторяемой структуре существует небольшой
набор атомов (называемый элементарной ячейкой), положения которых можно использовать для предсказания атома
позиции во всей твердой структуре за счет повторения положений элементарной ячейки
согласно особой симметрии самого кристалла. В твердых телах, которые
имеют повторяемость на больших расстояниях, положения атомов должны быть точно описаны в
увеличенное расстояние, используя только структуру элементарной ячейки. В твердых телах, которые не
имеют повторяемость на больших расстояниях, структура элементарной ячейки может в лучшем случае дать нам представление
типа склеивания, задействованного в твердом теле, но неровности в расположении
атомов быстро сорвет любую попытку предсказать положение атомов на любом расстоянии
вдали от «элементарной ячейки».
Кристаллические твердые тела обладают большой повторяемостью. Они
содержат атомы или молекулы, связанные между собой регулярным образом. Хороший
Примером этого являются кристаллы кварца (эмперическая формула: SiO 2 ), где каждый
Силикон связан с четырьмя атомами кислорода, которые, в свою очередь, связаны с двумя силиконами в
непрерывная ковалентная сеть, простирающаяся в трех измерениях. Вы можете найти эти
кристаллы в кварцевых часах. Кристалл вибрирует с фиксированной частотой, когда
электрический заряд размещается в определенных направлениях.Ваши часы используют вибрацию
чтобы сохранить время.
Аморфные твердые вещества (или стекла) имеют в лучшем случае краткосрочную повторяемость.
Они состоят из атомов или молекул с незначительной регулярной структурой или без нее.
Кварц, который был расплавлен в жидкость и быстро (умеренно) охладился, образует
стекло. Кварцевое стекло используется для изготовления окон на лазерах и тонких
оптика как линзы цейсс. Много разных твердых веществ может существовать как в кристаллической
и аморфные формы.
Для конкретного твердого тела (например, кварца) стекло и кристалл будут иметь одинаковые
тип склеивания, та же эмперическая формула и некоторые очень похожие физические свойства.
Стеклянные и кристаллические разновидности также могут обладать некоторыми довольно привлекательными свойствами.
разные. Например, кристаллы кварца не пропускают свет одинаково.
во всех направлениях из-за кристалличности, тогда как кварцевое стекло пропускает
светят одинаково во всех направлениях. Кварцевое стекло не будет разрушаться таким же образом
в виде кристаллов кварца.
Полукристаллические твердые тела имеют среднюю воспроизводимость, не
истинная повторяемость на больших расстояниях, но некоторая повторяемость на коротких диапазонах (т. е.
не полностью аморфный). Такие полукристаллические материалы обладают разными свойствами.
как из стекол, так и из кристаллов. Например, жидкие кристаллы имеют среднюю
повторяемость диапазона.
Классификация по типу облигации.
Кристаллические, полукристаллические и аморфные твердые вещества могут быть изготовлены из
все разные типы атомов, которые связаны по-разному.Таким образом, еще один
Способ классификации твердых тел — это посмотреть на тип связей, удерживающих твердое тело вместе.
Эти различные типы облигаций перечислены здесь.
Молекулярные твердые вещества состоят из молекул, которые удерживаются вместе
по недельным межмолекулярным силам. Ярким примером этого является сера. Молекулы
серы (S 8 ) удерживаются вместе межмолекулярными силами гораздо слабее
чем ковалентные связи, удерживающие атомы внутри каждой молекулы.Этот тип
твердого вещества может не иметь высокой температуры плавления; ни одна из них не превышает 400 ° C. Молекулярный
твердые тела могут быть довольно мягкими, т.е. , они могут быть легко искажены или предупреждены
какой-либо физической силой из-за относительной слабости межмолекулярного
силы, которые удерживают твердое тело вместе.
Ковалентные (сетчатые) твердые тела состоят из атомов, которые ковалентно связаны
связаны вместе, образуя одну непрерывную сеть ковалентно связанных атомов.
Этот тип твердых тел можно было почти представить как макроскопические молекулы (достаточно большие
чтобы увидеть). Алмазы являются ярким примером таких твердых тел. Этот тип твердого
обычно имеют высокую температуру плавления и обычно довольно твердые. Например,
алмаз плавится при 3600С. Не все твердые тела сети являются кристаллическими. Кварц
Упомянутое выше, представляет собой сетчатое твердое вещество в кристаллической и аморфной формах.
Ионные твердые тела содержат ионы противоположного заряда, которые удерживаются вместе
с электростатическими (колумбическими) взаимодействиями.Хорошим примером этого является натрий.
хлорид (поваренная соль). Кристаллическая структура NaCl показана справа.
Атомы Na + чередуются с атомами Cl — .
так что каждый положительный ион имеет соседние отрицательные ионы, и наоборот.
Ионные твердые вещества имеют тенденцию к температуре плавления от довольно низкой до умеренной.
в зависимости от силы ионной связи.
Металлические твердые тела состоят из атомов металлов, которые слабо удерживаются
внешние электроны в некоторой степени свободны от своих положительных ядер и образуют непрерывный
диссоциированное море отрицательного заряда связывает положительные ядра вместе.
Металлические связи, как правило, ненаправленные, что означает, что твердое тело будет держаться вместе.
даже если материал сильно искажен. Металлы могут быть изменены
поражающий (податливый) или протягиваемый через небольшие отверстия (пластичный), как медь
сформированы в провода. Металлы могут иметь низкие температуры плавления, а также склонны к
быть мягким. Кристаллическая структура меди показана в модели на
право.
Классификация по размерности твердого тела
В твердых телах сети все атомы удерживаются вместе ковалентными связями, так что
в структуре нет мелких идентифицируемых единиц (молекул или кластеров).
Массив атомов непрерывно распространяется по всему твердому телу. Сеть
твердые тела могут иметь различную размерность.
Одномерные сети (пластик), они имеют тенденцию к образованию
очень мягкий пластик или даже воскообразные / смолистые твердые частицы. Одномерные твердые тела в целом
не образуют кристаллы из-за легкого запутывания длинных «молекул»,
что делает маловероятным дальнейшую повторяемость. Некоторые такие молекулы длинные
теоретически достаточно, чтобы его можно было измерить макроскопически индивидуально по массе или размеру.
Двумерные сети (графит). У них есть самолеты
атомов, которые могут легко скользить по каждому. Например, графит используется как
смазка.
Трехмерные сети (ромб). Это, как правило,
очень прочный и твердый, может иметь очень высокую температуру плавления. Керамика б / у
к линиям плавильных печей и в качестве теплозащитного экрана на космических кораблях используются трехмерные сети
твердые тела.
В начало
Для
В оставшейся части этого раздела мы ограничимся обсуждением кристаллических твердых тел.
У них есть атомы или группы атомов, организованные в регулярный массив или решетку в три
Габаритные размеры. Мы должны взглянуть на термин «решетка» и дать ему точное определение.
Решетка — это математическая абстракция, которая описывает способ, которым атомы или группы
атомов повторяются в пространстве. Мы не должны принимать следующие диаграммы за
расположения атомов. Следующие детали только математические моменты
которые составляют решетку. Давайте сначала посмотрим на простые решетки в двух измерениях.
Затем мы расширим обсуждение до трех измерений.
Элементарная ячейка — это любое подмножество решетки, которое содержит достаточно информации,
всю решетку можно перестроить, начав с элементарной ячейки и переведя
или вращаясь в соответствии с симметрией решетки. Простейшая элементарная ячейка
тот, который содержит наименьшее количество точек и нуждается только в переводах по
края ячейки, чтобы повторить узор. Единичные ячейки содержат то, что нам нужно.
повторить.Знаменитый голландский художник Эшер регулярно создавал картины, которые
были составлены из повторяющихся единиц.
Вы можете найти здесь элементарную ячейку? В красном квадрате показана элементарная ячейка, которая может
использоваться для копирования остальной части картины, используя ее в качестве виртуального штампа для
сделайте остальную часть картины, штампуя каждый раз несколько единиц, кратных
и высота от оригинала. В желтом квадрате показаны самые маленькие
элементарная ячейка, но не обязательно самая простая в использовании. Эта примитивная элементарная ячейка
потребует дополнительной операции симметрии, i.е. , что каждое движение
на одну ячейку по горизонтали или вертикали сопровождаться инверсией
светло-серый и темно-серый оттенок.
Двумерные решетки
Самая простая из 2-х решеток — квадратная решетка. Мы можем выбрать
элементарная ячейка (повторяющаяся единица), имеющая равные длины сторон (а) и угол
из 90. Мы можем разместить камеру где угодно. Один выбор ставит одного
точка нашей решетки в каждом углу ячейки. В качестве альтернативы мы могли бы
поместил элементарную ячейку так, чтобы одна точка находилась в центре.Менее удобно,
мы могли бы разместить ячейку с одной точкой где угодно в пределах ее границ.
Во всех случаях за каждую элементарную ячейку начисляется 1 балл (при первом выборе было только 1/4
каждой вершины фактически внутри границ элементарной ячейки.
Шестиугольная решетка содержит точки, расположенные так, что можно нарисовать элементарную ячейку.
с углами 60 и длиной со всех сторон a. Рисуется полный шестиугольник
для визуального эффекта.
Другой тип решетки — прямоугольная решетка.Элементарная ячейка в этом
решетка будет иметь углы 90, как квадратная решетка, но будет иметь другие
длина сторон a и b.
Ромбическая решетка имеет элементарную ячейку со сторонами равной длины, но с углом, равным
нет ни 60, ни 90.
Наконец, наименее симметричной из всех двумерных решеток является полностью ромбическая
(параллелограммная) решетка. Здесь углы ни 90, ни 60, а
стороны элементарной ячейки не имеют одинаковой длины.
Трехмерные решетки
В двух измерениях есть только эти 5 решеток . В трех измерениях,
решетки называются решетками точечных групп или решетками Браве. Есть
14 решеток Браве . Для наших целей мы рассмотрим только два основных
типы трехмерных решеток, кубических решеток и гексагональных решеток.
Кубические решетки
Есть несколько кубических решеток. Здесь мы остановимся на трех из них.
К ним относятся простая кубическая решетка, объемно-центрированная кубическая решетка и
гранецентрированная кубическая решетка.
Простая кубическая решетка имеет только одну решетку 1
точка в каждой элементарной ячейке. Обратите внимание, что, кажется, есть восемь сфер
(точки), связанные с этой элементарной ячейкой (прямоугольник). Важно напомнить
что только та часть точки, которая находится внутри коробки, действительно находится в элементарной ячейке.
Поскольку только 1/8 каждой угловой точки фактически находится внутри элементарной ячейки, там
действительно только 8 1/8 = 1 балл на каждую элементарную ячейку.Каждая точка решетки имеет
6 ближайших соседей (здесь показаны четыре). Мы определяем это как координацию
номер .
Объемно-центрированная кубическая элементарная ячейка (bcc) имеет
с ним связаны два момента. 81/8 = 1 угловая точка и одна точка
в центре клетки.
Одноатомные ОЦК-решетки, очевидно, имеют координационное число 8
.
Гранеццентрированная кубическая решетка (ГЦК) ,
имеет 4 точки, связанные с его элементарной ячейкой.Угловые точки 81/8 = 1 и
61/2 = 3 точки по центру лица. Эти точки находятся внутри коробки только наполовину и
так что мы можем претендовать только на половину балла за элементарную ячейку. Альтернативный
название гранецентрированной кубической решетки — кубическая плотнейшая упаковка (ccp).
Это один из двух массивов с наиболее плотной упаковкой, в которых точки упакованы наиболее плотно.
возможен эффективный (с наименьшим объемом) способ. 3d модель слева показывает
точки решетки. диаграммы слева показывают два разных взгляда на одноатомное
конструкции, использующие насадку с ГЦК.Крайний левый показывает наложение слоев abc.
и позволяет нам подсчитывать ближайших соседей к определенному атому (красный).
Слои в КПК на самом деле расположены не по сторонам куба, а перпендикулярны
к диагонали тела куба, как показано на крайнем правом изображении, где цвета
соответствуют цветам на крайнем левом изображении. Цветные атомы на изображении
все касаются красного атома в центре слоя B, поэтому мы
Видно, что координационное число для этого типа кристалла равно 12.Другой
диаграмма показывает долю каждого атома, которая фактически находится внутри элементарной ячейки.
Другой крупный класс трехмерной кристаллической решетки — это тот, который дает
гексагональная элементарная ячейка. Как и гексагональный 2d-массив, гексагональный 3d-массив
имеет несколько углов в 60 с 90 направлениями, перпендикулярными этому.
Элементарная ячейка гексагональной плотнейшей упаковки (hcp)
Массив имеет две стороны длиной a, разделенные углами 60, и одну сторону длиной
b под углом 90 к двум другим.Это другая ближайшая упаковка
массив, в котором точки упакованы наиболее эффективным (с наименьшим объемом) способом.
Вы можете видеть, что эта элементарная ячейка имеет одну точку полностью внутри, а 8 точек на вершине 4 имеют
8,33% внутри и 4 имеют 16,66% внутри элементарной ячейки, что в сумме между ними составляет
одна точка внутри.
ГПУ решетка с выделенной элементарной ячейкой.
ГПУ решетка с выделенными ближайшими соседними точками.
В начало
В металлах валентные электроны удерживаются довольно слабо. Эти внешние
электроны легко теряются или делятся с небольшими усилиями. Рассмотрим твердую
кусок (кристалл) металла (например, натрия), где внешняя орбиталь (и)
все соседние атомы металлов перекрывают друг друга.
Здесь мы видим, что свободно удерживаемые электроны могут свободно перемещаться от атома к атому.
без помех. Фактически, натриевые ядра (+1 заряд) плавают в
море электронов (отрицательных зарядов).Это позволяет использовать несколько свойств
характеристика металлов.
- податливый: если ударить по металлу, атомы могут скользить друг по другу
без разрыва каких-либо реальных связей. Золото можно вбить в сусальное золото
(Толщиной 10 атомов) без разрушения металла. - пластичный: металл протягивается через небольшое отверстие, как медь протягивается.
через отверстие в стальной пластине для формирования проволоки. - блестящий: из-за большого количества перекрывающихся орбиталей энергия
уровни расположены очень близко друг к другу, так что фотоны большого диапазона частот
поглощаются и мгновенно переизлучаются (псевдоним, отражаются). - электрически проводящий: поскольку электроны довольно подвижны, металлы легко
проводит электричество.
Из-за ненаправленной связи, которая возникает в металлах, атомы металла
кристаллы, как правило, упаковываются в очень эффективное поместье. Две самые эффективные упаковки
методы — это те, которые следуют за решетками ГПУ и ЦПУ, которые имеют одинаковую упаковку
эффективности (около 74% объема кристалла на самом деле атомы). Треть
распространенным методом упаковки металлов является ОЦК, который не так эффективен, как ГПУ или ОЦК.
Большинство металлов имеют одноатомных кристаллических структур . Они имеют
только один атом связан с каждой точкой кристаллической решетки. Это упрощает
для сравнения положения атомов с положениями кристаллической решетки. Мы можем выбрать
чтобы точно перекрыть атомные позиции с точками решетки. Это (очень
общий) выбор приводит в замешательство тех, кто думает, что атом — это решетка
точка. Это просто случайный выбор, сделанный в одноатомных кристаллах для
ради простоты.
Железо имеет тенденцию упаковываться в одноатомную кристаллическую структуру с ОЦК. «Одноатомный» означает
что есть только один атом, связанный с каждой точкой кристаллической решетки.
Для удобства мы стараемся размещать атомы точно в узлах решетки, но это
не требуется, если все точки решетки имеют одинаковое пространственное расположение
с одним и только одним атомом на точку.
Атомы железа имеют 8 ближайших соседей и, следовательно, имеют координационное число
8.
Медь имеет тенденцию упаковываться в одноатомную структуру ccp, где каждый атом связан
с собственной точкой решетки в решетке ccp. Напомним, что это лицо
центрированная кубическая решетка. Каждый атом имеет координационное число 12,
, то есть , на каждый атом меди приходится 12 ближайших соседей.
Атомы цинка имеют тенденцию организовываться в одноатомную кристаллическую структуру ГПУ
где один и только один атом Zn ассоциирован с каждой точкой решетки в ГПУ
кристаллическая решетка.Каждый атом Zn имеет 12 ближайших соседей, , т.е. ,
координационный номер 12.
В начало
Ионные твердые тела не образуют одноатомных кристаллических структур, но многие из них по-прежнему образуют самые близкие
устройства упаковки, поскольку ионные связи ненаправленные. Представить
кристаллическая структура многих ионных кристаллов, нам необходимо учитывать множество факторов, в том числе
относительный размер положительных и отрицательных ионов и их относительное количество.
Давайте посмотрим на упаковку атомов в структуре плотной упаковки.
Мы видим, что между атомами есть два типа промежутков.
- Существуют тетраэдрические пространства, в которых соединяются четыре атома (атом из слоя
б поверх треугольного отверстия из слоя а). - Октаэдрические пространства встречаются там, где встречаются шесть атомов (три атома из
слой b окружает отверстие из слоя a)
Поскольку октаэдрические отверстия больше тетраэдрических, они могут вместить
катионы большего размера по сравнению с размером анионов.
Возьмите хлорид натрия. Ионы хлорида
(зеленый в модели ниже) значительно больше, чем ионы натрия (синий)
и мы можем рассматривать хлорид натрия как ГЦК решетку плотнейшей упаковки хлоридов.
ионы натрия с ионами натрия, заполняющими октаэдрические дырки между ними. NaCl
имеет двухатомную кристаллическую структуру fcc, так как есть два «атома»
связанный с каждой точкой решетки.
.
Структура флюорита кальция (CaF 2 )
имеет катионы кальция в тетраэдрических пространствах между фторид-ионами. (Модель Ca 2+
синий, а F- зеленый)
Обратите внимание, что для тетраэдра (2 отверстия
: 1 атом) по сравнению с октаэдрическими (1: 1) дырками.
В начало
Как только мы поймем структуру кристаллов, мы сможем делать много разных типов кристаллов.
расчетов с использованием этой информации.Для простоты мы будем
ограничимся расчетами с одноатомным (металлическим) кубическим кристаллом
конструкции.
Давайте сначала посмотрим на геометрию куба.
Куб имеет все стороны длиной a. Каждое лицо имеет диагональ лица
длины b, а диагональ тела — c. Использование стандартной тригонометрии
отношения, мы можем легко вывести следующие отношения.
b 2 = 2 a 2 или
b = (2 а 2 ) 1/2
и
c 2 = 3 a 2 или
c = (3 a 2 ) 1/2 .
Таким образом, если мы имеем дело с Телоцентрированной кубической структурой,
Диагональ тела — единственное направление ячейки, кратное радиусу атома.
Здесь мы видим, что c равно четырем атомным радиусам. с = 4 г
или r = c / 4
От
та же логика, в гранецентрированной кубической структуре диагональ грани будет равна
в 4 раза больше атомного радиуса.
b = 4 r или
г = б / 4
Пример:
Длина элементарной ячейки железа (одноатомная ОЦК), измеренная с использованием
Дифракция рентгеновского излучения.2}} {4} = 124 \ mathrm {pm} \]
Пример:
Ванадий имеет структуру элементарной ячейки, как и железо. рентгеновская дифракция показывает
Размер элементарной ячейки должен составлять 305 мкм. Какова плотность ванадия?
Конечно, такой пример можно провести на любой элементарной ячейке; все вы
необходимо знать размер ячейки и количество атомов внутри ячейки.
Мы обсудили несколько простых кубических ячеек для плотноупакованных структур, но есть
другие конструкции, которые также вписываются в структуру кубических ячеек
Например,
Алмаз имеет 8 атомов внутри кубической элементарной ячейки.
NaCl имеет ГЦК-структуру (из 4 ионов Cl) с ионами Na + в октреэдрической
соотношение отверстий (1: 1), так как FCC также имеет 4 иона Na + в каждой элементарной ячейке.
Другие конструкции можно обрабатывать аналогичным образом.
В начало
Проф. Майкл Дж. Момбуркетт.
Авторское право 1997
Пересмотрено:
2 сентября-апрель-2012.
Молекулярные вещества третьего ряда (периода) таблицы Менделеева, P, S, Cl, Ar
Наука> Химия> Элементы третьего ряда> Молекулярные тела третьего ряда
в этой статье мы будем изучать кристаллическую структуру молекулярных твердых тел третьего перида таблицы Менделеева.
Молекулярное твердое вещество:
Вещество, в котором узлами решетки являются молекулы, которые удерживаются вместе с помощью слабых физических сил (сил Ван-дер-Вааль), называется молекулярным твердым телом. Фосфор, сера, хлор и аргон являются твердыми молекулярными телами, потому что точки решетки — это молекулы.
Они имеют больший потенциал ионизации, и вакантные валентные орбитали отсутствуют.
Характеристики твердых веществ:
- В кристаллической структуре этих элементов единицы, занимающие узлы решетки, представляют собой молекулы
- Они имеют больший потенциал ионизации
- Молекулы прикреплены друг к другу за счет слабых сил притяжения Ван-дер-Валла.
- В этих твердых телах атомы соединены в молекуле прочными ковалентными связями.
- В этих твердых телах вакантные валентные орбитали недоступны. Все валентные орбитали используются для внутримолекулярной прочной ковалентной связи.
Научные причины:
Фосфор, сера, хлор и аргон в твердом состоянии мягкие, легко сжимаются и деформируются. Они летучие, их точки кипения и плавления очень низкие.
В кристаллической структуре этих элементов звеньями, занимающими узлы решетки, являются молекулы.У них больший потенциал ионизации. Молекулы прикреплены друг к другу за счет слабых сил притяжения Ван-дер-Уолла. Внутри молекул атомы соединены прочными ковалентными связями. При этом они мягкие, легко сжимаются и деформируются.
Точно так же требуется меньше энергии, чтобы отделить молекулы друг от друга в молекулярном кристалле. Следовательно, они летучие и обладают низкими температурами кипения и плавления.
Фосфор и сера являются твердыми веществами при комнатной температуре, а хлор и аргон являются газами при комнатной температуре.
В кристаллической структуре этих элементов звеньями, занимающими узлы решетки, являются молекулы. У них больший потенциал ионизации. Молекулы прикреплены друг к другу за счет слабых сил притяжения Ван-дер-Уолла. Внутри молекул атомы соединены прочными ковалентными связями.
Сера октаатомная, фосфор четырехатомный, хлор двухатомный, аргон одноатомный. Размер молекулы уменьшается на порядок S 8 ; P 4 > Cl 2 > Ar.В том же порядке уменьшаются силы притяжения ван дер Валла. Они сильнее по фосфору и сере, но незначительны по хлору и аргону. Таким образом, хлор и аргон имеют очень низкие температуры кипения и плавления. Следовательно, фосфор и сера являются твердыми веществами при комнатной температуре, а хлор и аргон — газами при комнатной температуре.
Структура твердых веществ:
Структура фосфора:
Фосфор является твердым молекулярным веществом, поскольку узлами решетки являются молекулы P 4 , которые удерживаются вместе с помощью сил притяжения Ван-дер-Уолла.Внутри молекул атомы соединены прочными ковалентными связями.
Атомный номер фосфора равен 15. Электронная конфигурация фосфора: 1s2, 2s22p6, 3s2, 3px1 3py1 3pz1. Фосфор имеет больший потенциал ионизации. Из-за отсутствия вакантных валентных орбиталей это молекулярное твердое тело. Атомы фосфора гибридизированы sp 3 .
Один атом фосфора образует три ковалентные связи с тремя другими атомами фосфора, в то время как одна гибридная орбиталь sp 3 , содержащая спаренные электроны (неподеленная пара), остается несвязанной.Таким образом образуется тетраэдрическая молекула P 4 . Связующий угол П-П-П составляет 60 °. Молекула фосфора состоит из четырех атомов фосфора.
В белом фосфоре эти тетраэдрические молекулы соединены вместе посредством слабых сил притяжения Ван-дер-Вааль из-за меньшего размера молекул. Итак, белый фосфор имеет низкую температуру плавления.
Красный фосфор — это полимерная форма. В красном фосфоре одна связь P-P в звене P 4 разрывается, и освобождающиеся связи образуют цепь.Таким образом, в красном фосфоре тетраэдрические молекулы соединены друг с другом прочными ковалентными связями, образуя структуру, подобную цепочке. Следовательно, красный фосфор существует в полимерной форме.
В белом фосфоре молекулы соединены вместе слабыми силами Ван-дер-Валла, в то время как в красном фосфоре молекулы связаны прочными ковалентными связями. Следовательно, для разрыва связей между молекулами красного фосфора требуется больше энергии, чем для белого фосфора. Следовательно, красный фосфор имеет высокую температуру плавления и меньшую реакционную способность, чем белый фосфор.
Состав серы:
Сера является твердой молекулярной массой, потому что узлами решетки являются молекулы S 8 , которые удерживаются вместе с помощью сил притяжения Ван-дер-Вааль. Внутри молекул атомы соединены прочными ковалентными связями.
Атомный номер серы — 16. Электронная конфигурация фосфора — 1s2, 2s22p6, 3s2, 3px2 3py1 3pz1. Сера имеет больший потенциал ионизации. Его две наполовину заполненные орбитали используются для межмолекулярной связи.Из-за отсутствия вакантных валентных орбиталей это молекулярное твердое тело. Каждая молекула серы состоит из восьми атомов серы.
Молекула серы имеет гофрированную кольцевую структуру или структуру короны. Сера имеет две наполовину заполненные 3p-орбитали в валентной оболочке. В каждой молекуле S 8 каждый атом s связан с двумя соседними атомами S простой ковалентной связью. Таким образом, если смотреть сверху, он образует кольцевую структуру с четырьмя атомами серы в одной плоскости и чередующимися другими четырьмя в параллельной плоскости.Каждый атом серы имеет неподеленную пару электронов. Угол связи S-S-S составляет 107,8 0 , а длина связи S-S составляет 2,04 o
.
Состав хлора:
Хлор является молекулярным твердым телом, потому что узлами решетки являются молекулы Cl 2 , которые удерживаются вместе с помощью сил притяжения Ван-дер-Вааля. Внутри молекул атомы соединены прочными ковалентными связями.
Атомный номер хлора — 17. Электронная конфигурация фосфора — 1s 2 , 2s 2 2p 6 , 3s 2 , 3p x 2 3p y 2 3p z 1 .Хлор имеет больший потенциал ионизации. Следовательно, он образует ковалентную связь. Его одна наполовину заполненная орбиталь используется для межмолекулярной связи. Из-за отсутствия вакантных валентных орбиталей это молекулярное твердое тело. Каждая молекула хлора состоит из двух атомов хлора, связанных ковалентной связью.
Хлор в твердом состоянии состоит из слоев молекул хлора, удерживаемых слабыми силами Wander Wall. Следовательно, хлор является газом при комнатной температуре.
Структура аргона:
Вещество, в котором узлами решетки являются молекулы, которые удерживаются вместе с помощью слабых физических сил (силы Вандервааля), называют молекулярными твердыми телами.
Аргон — это молекулярное или атомарное твердое тело, поскольку узлы решетки представляют собой атомы (молекулы) аргона, которые удерживаются вместе с помощью сил притяжения Ван-дер-Вааль. Атомный номер аргона равен 18. Электронная конфигурация аргона: 1s2, 2s22p6, 3s2, 3px2 3py2 3pz1. Таким образом, его октет завершен. В нем нет неспаренных электронов. Аргон имеет больший потенциал ионизации. Из-за отсутствия вакантных валентных орбиталей это молекулярное твердое тело. Каждая молекула аргона состоит из одного атома аргона.
Кристалл аргона в твердом состоянии состоит из непрерывной структуры атомов, образующих гранецентрированную кубическую решетку с замкнутой упаковкой, подобную алюминию. Но разница в том, что в случае алюминия узлами решетки являются ионы алюминия, а в случае аргона узлами решетки являются атомы аргона. Точки плавления и кипения аргона очень низкие.
Наука> Химия> Элементы третьего ряда> Молекулярные твердые тела третьего ряда
.


