Содержание
формулировка Ж. Пруста и современная — урок. Химия, 8–9 класс.
Пример:
углекислый газ может быть получен в результате сгорания угля, метана или при разложении известняка. Но в любом случае в порции углекислого газа число атомов кислорода будет в два раза больше числа атомов углерода, а массовые доли углерода и кислорода всегда равны \(27,29\) % и \(72,71\) %.
Развитие химии внесло дополнения в закон постоянства состава. Оказалось, что этот закон строго выполняется только для веществ молекулярного строения. Так, в любой молекуле углекислого газа содержится один атом углерода и два атома кислорода, и состав этого вещества изменяться не может.
Молекула углекислого газа
Молекулярное строение имеют все газообразные и жидкие вещества, а также твёрдые вещества с низкими температурами плавления. Постоянный состав имеют: вода, сернистый газ, сероводород, метан, аммиак, кислоты, спирт, сахар, глюкоза и т. д.
д.
Количественный состав веществ немолекулярного строения может несколько изменяться в зависимости от способа получения.
Поваренная соль состоит из атомов натрия и хлора, расположенных в определённом порядке. Этот порядок может нарушаться, поэтому состав разных образцов соли несколько отличается. В поваренной соли, полученной разными способами, на \(1\) атом натрия может приходиться от \(0,99\) до \(1,01\) атомов хлора. Однако условно для простоты обычно указывают округлённые целые числа.
Кристалл поваренной соли
Немолекулярное строение имеют и другие соединения (питьевая сода, мел, оксиды металлов, их соли), песок и некоторые другие вещества. Для этих веществ закон постоянства состава выполняется только приблизительно.
Современная формулировка закона постоянства состава:
Всякое чистое вещество молекулярного строения независимо от места нахождения и способа получения имеет постоянный качественный и количественный состав.
Из закона постоянства состава следует, что при образовании сложного вещества химические элементы соединяются в определённых численных и массовых соотношениях.
Закон постоянства состава вещества — Справочник химика 21
Закон постоянства состава веществ (Ж.-Л. Пруст, 1799 г.) [c.13]
Закон постоянства состава вещества [c.21]
Вспомните формулировку закона постоянства состава веществ и поясните, почему эту формулировку потребовалось уточнить. [c.57]
Химические формулы. Закон постоянства состава вещества. Расчеты по химическим формулам с использованием относительных атомных и молекулярных масс. Определение химических формул из данных о массовых соотношениях веществ [c.274]
Написание химических формул возможно потому, что для большинства веществ соблюдается закон постоянства состава вещества. Этот закон может быть сформулирован следующим образом. [c.238]
Этот закон может быть сформулирован следующим образом. [c.238]
Тема Первоначальные химические понятия — теоретическая база вводного курса химии. В ней начинают формироваться системы понятий о веществе, химической реакции и химическом элементе на основе атомно-молекулярной теории. Учащиеся изучают два важнейших химических закона — постоянство состава веществ и закон сохранения массы вещества. Специальное внимание в теме уделяется химической терминологии и символике, а также выработке первоначальных практических умений по химии. На примере химических реакций учащиеся впервые знакомятся с химической формой движения материи. [c.251]
Зависимость I основана на законе постоянства состава вещества, зависимость II — на законе сохранения массы веществ и зависимость III — на газовых законах (Гей-Люссака и Авогадро). Все расчеты в химии сводятся к использованию этих трех зависимостей. [c.16]
Полное тождество всех атомов одного и того же вещества. Все атомы одного рода…,—подчеркивал Д. Дальтон,—должны обязательно рассматриваться как одинаковые между собой по форме, весу и всем другим особенностям Это положение подтверждалось законом постоянства состава вещества, открытым Ж. Прустом. [c.124]
Все атомы одного рода…,—подчеркивал Д. Дальтон,—должны обязательно рассматриваться как одинаковые между собой по форме, весу и всем другим особенностям Это положение подтверждалось законом постоянства состава вещества, открытым Ж. Прустом. [c.124]
Сформулируйте закон постоянства состава вещества. К каким соединениям он применим и почему Какие вещества относятся к веществам постоянного, а какие — к веществам переменного состава Приведите примеры. [c.23]
Закон сохранения массы веществ. Закон постоянства состава веществ. Закон Авогадро и следствия из него. Молярный объем газа. Относительная плотность газов и определение молярной массы веществ. [c.13]
Ответ. Закон постоянства состава веществ в первоначальной формулировке гласил, что всякое вещество имеет постоянный состав независимо от способа получения. Оказалось, однако, что существует довольно много веществ, для которых этот закон не выполняется. Это так называемые нестехиометрические соединения, состав которых колеблется в зависимости от способа синтеза. Поэтому потребовалось уточнить, для каких именно веществ справедлив этот закон, и ввести в формулировку слова вещество молекулярного строения . [c.143]
Поэтому потребовалось уточнить, для каких именно веществ справедлив этот закон, и ввести в формулировку слова вещество молекулярного строения . [c.143]
В начале XIX в. французский ученый Пруст установил закон постоянства состава вещества имеют постоянный качественный и количественный состав независимо от способа их получения. [c.22]
Атомно-молекулярное учение. Молекулы. Апю.иы. Закон постоянства состава вещества. Оп1носителы1ая атомная и относителы/ая молекулярная массы. Закон сохранения массы и его значение в хсшии. Моль. Молярная масса. Закон Авогадро и следствия из него. [c.88]
Проделав в течение 1799—1807 гг. массу анализов, Пруст доказал, что Бертолле сделал свои выводы о различном составе одних и тех же веществ, анализируя смеси, а не индивидуальные вещества, что он, например, не учитывал содержания воды в некоторых оксидах. Пруст убедительно доказал постоянство состава чистых химических соединений и завершил свою борьбу против взглядов Бертолле установлением закона постоянства состава веществ. [c.28]
[c.28]
Закон постоянства состава веществ был подтвержден Дальтоном, правда, на основе совершенно других исследований и рас-суждений. В то же время благодаря оригинальному подходу к изучению состава веществ Дальтон открыл и закон простых кратных отношений . Но главным образом Дальтон известен в [c.28]
Закон постоянства состава веществ (закон постоянных отношений) гласит состав одних и тех же веществ независимо от способа получения одинаков (постоянен). См. [178, с. 164—165].— Прим. ред. [c.28]
Значительно более интенсивно накопление экспериментального и теоретического материала, который лег в основу современной физической химии, происходило в начале XIX в., главным образом, на базе химической атомистики и закона постоянства состава веществ. Этот процесс накопления фактического материала проходил в тесной связи с развитием неорганической, аналитической и органической химии, а также физики и других естественных наук. [c.398]
[c.398]
Закон постоянства состава вещества может быть объяснен атомно-мо-лекулярным учением. [c.25]
Ч у Вспомните формулировку закона постоянства состава веществ и [c.143]
Все задачи на определение химического состава соединений решаются на основании закона постоянства состава веществ количественный и качественный состт химически чистого вещества всегда постоянный и не зависит от способа его получения. Другими словами, химические элементы при образовании данного соединения всегда взаимодействуют между собой в строго определенных количествах. Если в состав вещества входят элементы А и В, то, в соответствии с законом, постоянства состава, [c.15]
Закон постоянства состава веществ был открыт и сформулирован на основе представлений, что все вещества состоят из молекул. Дальнейшие исследования показали, что лишь около 5% из всех неорганических веществ имеет молекулярное строение. И только для них справедлив закон постоянства состава. Вещества немолекулярного строения этому закону в полной мере не подчиняются. Так, например, на основе точных современных исследований установлено, что состав сульфида железа (II) следует изображать не формулой Ре5, а формулой Ре1 х5, где х меняет значения от О до 0,05, а оксида титана (IV) —не формулой ТЮг, а формулой ТЮ( 9 2,о Но эти отклонения незначительны, и при составлении. химических формул мы их учитывать не будем. [c.57]
Вещества немолекулярного строения этому закону в полной мере не подчиняются. Так, например, на основе точных современных исследований установлено, что состав сульфида железа (II) следует изображать не формулой Ре5, а формулой Ре1 х5, где х меняет значения от О до 0,05, а оксида титана (IV) —не формулой ТЮг, а формулой ТЮ( 9 2,о Но эти отклонения незначительны, и при составлении. химических формул мы их учитывать не будем. [c.57]
N — Число формульных единиц. Число реальных или условных, химических частиц вещества В, определяющих состав этого вещества (изображаемый химической формулой) и сохраняющих его химические свойства. Каждое химически чистое венхество, каким бы способом оно ни было получено, всегда имеет один и тот же состав и свойства (закон постоянства состава вещества Ж. Пруст, 1799). Расчетные формулы [c.207]
Молекула каждого сложного вещества имеет постоянный атомный состав, т.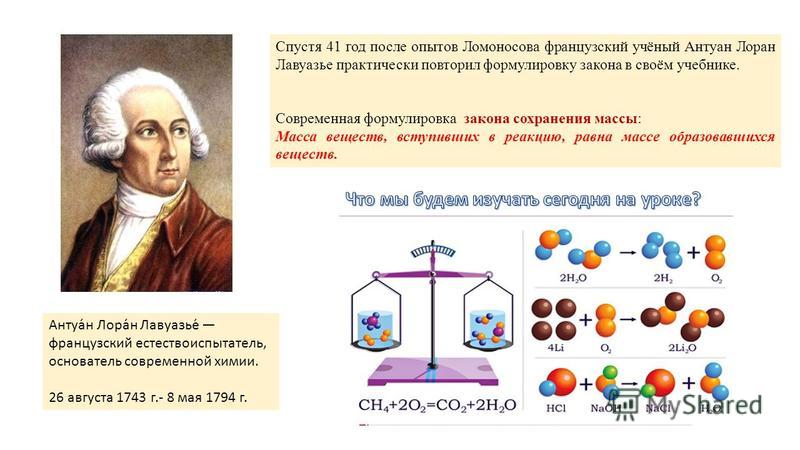 е. всегда состоит из одних и тех же атомов различных элементов. Вес каждого атома, образующего моле] улу, тоже постоянен. Поэтому остается постоянным и весовое отношение между элементами, образующими сложное вещество. Таким образом, закон постоянства состава вещества может быть иыведен с помощью основных положений атомно-молекулярного учения. [c.25]
е. всегда состоит из одних и тех же атомов различных элементов. Вес каждого атома, образующего моле] улу, тоже постоянен. Поэтому остается постоянным и весовое отношение между элементами, образующими сложное вещество. Таким образом, закон постоянства состава вещества может быть иыведен с помощью основных положений атомно-молекулярного учения. [c.25]
В настоящей главе будут рассмотрены также важнейшие понятия и законы, связанные со стехиометрией — разделом химии, в котором рассматриваются массовые или объемные отношения между реагируюш ими веществами. Исключительное значение для эффективного изучения химии имеют три стехиометрических закона 1) закон сохранения массы веществ 2) закон постоянства состава веществ-, 3) закон эквивалентов (формулировка закона и его практическое использование даны на примере типовой задачи 1-10). Открытие стехиометрических законов позволило приписать атомам (и молекулам) строго определенную массу. Значения масс атомов, выраженные в стандартных единицах массы (абсолютная атомная масса Шр), очень малы, поэтому для удобства введены понятия об относительных атомной и молекулярной массах (обозначают соответственно и Mj,, где г — начальная буква английского слова relative (относительный)). [c.5]
[c.5]
Занятие №1
Тема:
Введение в практикум. Основные законы
химии. Классификация и номенклатура
неорганических соединений. Способы
выражения концентрации растворов.
Основы количественного анализа.
Значение
темы:
Повторение и закрепление основных
законов химии, правил
классификации и номенклатуры неорганических
соединений.
Цель
занятия: Студент
должен
Знать:
Основные
законы химии и проводимые на их основе
расчеты. Основы классификации и
номенклатуры неорганических соединений.
Уметь:
Формулировать
основные законы химии и на их основе
проводить расчеты. Классифицировать
неорганические соединения и умело
пользоваться принципами номенклатуры.
Вопросы
для изучения темы
Применение
в химии законов сохранения массы и
энергии. Вещество. Количественная и
Вещество. Количественная и
качественная информация, содержащаяся
в химических формулах и уравнениях.
Закон постоянства состава и его
современная трактовка. Закон кратных
отношений. Закон Авогадро.Классификация
и номенклатура основных классов
неорганических соединений. Валентность.
Графические формулы веществ.Определение
понятий: эквивалент, фактор эквивалентности,
количество вещества эквивалента,
молярная масса эквивалента. Количественный
анализ.Требования
к реакциям, применяемым в титриметрическом
анализе. Основные понятия: титрант,
титрование, точка эквивалентности,
точка конца титрования. Способы
проведения анализа (прямое, заместительное,
обратное), приемы проведения анализа
(отдельных навесок, аликвотных
проб(пипетирования) Способы выражения
концентрации титрованных растворов,
способы их приготовления. Стандартные
(установочные, исходные) вещества.
Требования, предъявляемые к стандартным
веществам. Решение расчетных задач.
Решение расчетных задач.Осадительное
титрование. Окислительно-восстановительное
титрование. Комплексонометрическое
титрование. Вольтамперометрия
Ситуационные
задачи
Сформулируйте
закон сохранения массы веществ, напишите
его математическое выражение, приведите
примеры его проявления в химии.Сформулируйте
закон постоянства состава вещества.
Установите формулу соединения,
содержащего 43,4% натрия, 11,3% углерода,
45,3% кислорода.Сформулируйте
закон Авогадро. Что понимают под
нормальными условиями? Рассчитайте
какой объем при н.у. займут 5 л газа,
измеренных при 20о
и давлении 102 кПа.При
взаимодействии 3,59г некоторого
трехвалентного металла с раствором
кислоты выделилось 0,448 л водорода
(н.у.). Определите этот металл.Начертите
схему, отражающую классификацию
важнейших классов неорганических
веществ. Приведите примеры для каждого
Приведите примеры для каждого
класса.По
систематической и рациональной
номенклатуре дайте названия следующим
соединениям: AsH3,
HAlO2,
PbO,
Al(OH)2Cl,
HClO2,
KAl(SO4)2,
CaO,
Cu(OH)2,
K2Cr2O7,
H3O+,
Na2HPO4,
OH—,
HCO3—,
HNO2
,
(CuOH)2SO4,
HCl
.Дайте
определение валентности. Напишите
молекулярные и графические формулы
следующих веществ: оксид серы (IV),
серная кислота, оксид марганца (VII),
перманганат калия, дигидрофосфат
натрия, ортоборная кислота, гидроксокарбонат
кальция.
Литература:
Основная
литература: 1-7.
Дополнительная
литература: 1-24.
▶▷▶▷ гдз закон сохранения массы веществ
▶▷▶▷ гдз закон сохранения массы веществ
| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 08-09-2019 |
гдз закон сохранения массы веществ — Закон сохранения массы веществ суть в химии (8 класс) obrazovakaruhimiyazakon-sohraneniya-massy-ves Cached Закон сохранения массы веществ Ломоносов связывал с законом сохранения энергии (количества движения) Он рассматривал эти законы в единстве как всеобщий закон природы ГДЗ по химии для 8 класса ГЕ Рудзитис — 19 Закон reshebamegdzhimija8-klassrudzitise:18-a:0 Cached Закон сохранения массы веществ 1 по химии для учащихся 8 класса, авторов ГЕ Рудзитис, ФГ Фельдман 2015 показать содержание Гдз сборник задач по Химии за 8 класс можно найти тут Химические уравнения — ГДЗ Габриелян Сладков 8 класс рабочая gdz-himiyaru8-klassgdz-rabochaya-tetrad Cached Закон Ломоносова-Лавуазье закон сохранения массы веществ : 2 Уравнения химической реакции это условная запись химической реакции с помощью химических формул и математических знаков 24 Закон сохранения массы вещества — YouTube wwwyoutubecom watch?vSnxJdKZB2eY Cached В этом уроке ты узнаешь как формулируется закон сохранения массы вещества химияснуля, егэхимия, Закон сохранения массы веществ, калькулятор онлайн, конвертер wwwcalcruZakon-Sokhraneniya-Massy-Veshchestvhtml Cached Закон сохранения массы веществ формулируется так: Масса веществ , вступивших в реакцию, равна массе продуктов реакции Гдз Закон Сохранения Массы Веществ — Image Results More Гдз Закон Сохранения Массы Веществ images Урок Закон сохранения массы веществ (8 класс) infourokruurok-zakon-sohraneniya-massi-ves Cached Скачать: Урок Закон сохранения массы веществ 8 класс Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления 28 Закон сохранения массы веществ himiy88blogspotcomp28html Cached Закон сохранения массы веществ Химические уравнения В 1748 г МВ Ломоносов и в 1789 г А Лавуазье независимо друг от друга открыли закон сохранения массы веществ в химических реакциях Закон сохранения массы веществ Химические уравнения schooledrutextbookchemistry7klas_117html Cached Закон сохранения массы веществ один из фундаментальных законов химии, который читается так: масса веществ , вступивших в реакцию, равна массе веществ , образовавшихся после реакции Закон сохранения массы веществ Химия, 89 класс: уроки wwwyaklassruphimija89-klasspervonachalnye Cached Теоретические уроки, тесты и задания по предмету Закон сохранения массы веществ , Первоначальные химические понятия и теоретические представления, 89 класс, Химия 52 Закон сохранения массы — heminsuru wwwheminsuruucheb152htm 52 Закон сохранения массы Давайте вернемся к реакции между метаном и кислородом, рассмотренной в предыдущем параграфе Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of 1 2 3 4 5 Next 32,700
- гдз закон
- сохранения массы вещ
- массы веществ
- конвертер wwwcalcruZakon-Sokhraneniya-Massy-Veshchestvhtml Cached Закон сохранения массы веществ формулируется так: Масса веществ
- калькулятор онлайн
- равна массе продуктов реакции Гдз Закон Сохранения Массы Веществ — Image Results More Гдз Закон Сохранения Массы Веществ images Урок Закон сохранения массы веществ (8 класс) infourokruurok-zakon-sohraneniya-massi-ves Cached Скачать: Урок Закон сохранения массы веществ 8 класс Все материалы
гдз закон сохранения массы веществ Все результаты Закон сохранения массы веществ Химия класс temygabrielyanos zakonsohraneniyamassy Ответы на вопрос Закон сохранения массы веществ Химия класс Габриелян ГДЗ Введение Вопрос читайте на Рамблеркласс Урок Закон сохранения массы веществ Уравнение Рабочая тетрадь по химии Боровских класс ГДЗ к рабочей тетради по химии Боровских для класса Урок Закон сохранения массы веществ Уравнение химической реакции cтраницы Химические уравнения ГДЗ Габриелян Сладков класс klass himicheskieuravneniya ЧАСТЬ Закон ЛомоносоваЛавуазье закон сохранения массы веществ Уравнения химической реакции это условная запись химической Закон сохранения массы wwwheminsuru ucheb Похожие Этот простой опыт иллюстрирует один из важнейших законов природы ЗАКОН СОХРАНЕНИЯ МАССЫ Новые вещества не получаются из ничего и Закон сохранения массы веществ параграф ГДЗ химия himgdzru ГДЗ по химии й класс Рудзитис и Фельдман ГДЗ по химии для го класса по учебнику Рудзитис и Фельдман Параграф закон сохранения массы веществ Решение задач, ответы на вопросы и Номер , Параграф ГДЗ по Химии класс Габриелян himiya gabrielyanos nomerparagraf ГДЗ готовое домашние задание из решебника на Номер , по учебнику Противоречит ли это наблюдение закону сохранения массы веществ ? РешеноПараграф ГДЗ Кузнецова Титова класс по otvet reshebniki Изображение задания Параграф по химии ГДЗ Кузнецова Титова класс Сформулируйте закон сохранения массы веществ при химических Химия класс закон сохранения массы веществ Ответы Домашние задания Другие предметы Похожие ЧТО ЭТО? просто типа вопрос что такое закон сохранения массы веществ определиние или я незнаю чё нить Закон сохранения массы веществ Закон форма worldofschoolru himiya zakonyiuravneniya zakonsohraneniyam Похожие Во время химических реакций атомы сохраняются Происходит лишь их перегруппировка Поскольку атомы сохраняются, то должна сохраняться и их Видео Химия Законы сохранения массы и энергии Химическое Образование Обучение YouTube авг г Закон сохранения массы вещества Птичка Химичка Химия с Нуля YouTube авг г Закон сохранения массы веществ Урок Учебное видео YouTube июн г Все результаты Закон сохранения массы веществ Химические уравнения Химия апр г Познакомить учащихся с законом сохранения массы веществ и историей его открытия Опыт Ломоносова Познакомить учащихся с Вопрос Кем, когда и как был открыт закон сохранения node ГДЗ к Вопрос Кем, когда и как был открыт закон сохранения массы ? Приведите масса веществ , вступивших в химическую реакцию, равна массе Сформулируйте закон сохранения массы веществ node ГДЗ к Сформулируйте закон сохранения массы веществ Подумайте, почему при горении свечи ее масса постепенно уменьшается Противоречит ли Химические уравнения Химия класс ГДЗ Габриелян vippvippbegettech Химия_для__класса_Габриелян Химические уравнения Закон сохранения массы веществ , открытый М В Ломоносовым в г, гласит Материальными носителями массы веществ Закон сохранения массы веществ Химические уравнения himiya presentacii zakonsokhranieniiamassy июл г Закон сохранения массы вещества Все перемены в натуре случающиеся такого суть Ответы уровень Al HCl AlCl H Урок Закон сохранения массы вещества Химические site himulacom zvonoknaurok klass u Похожие Закон сохранения массы веществ Проблемный вопрос изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции? Сформулируйте закон сохранения массы веществ klass himiya gabrielyan voprosparagraf Подробный ответ из решебника ГДЗ на Вопрос , по учебнику О С Габриелян Учебник по химии класса е издание, Дрофа, г ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ ПРИ schooledru gdz chemistry Химия О Г Ярошенко класс год готовые домашние задания ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ В ХОДЕ ХИМИЧЕСКИХ РЕАКЦИЙ Картинки по запросу гдз закон сохранения массы веществ Показать все Другие картинки по запросу гдз закон сохранения массы веществ Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты Закон сохранения массы веществ Химические уравнения shkola khimiya library zakonsohr мая г Закон сохранения массы веществ Химические Сделать письменные ответы по формулам веществ план I вариант HCl презентация Закон сохранения массы веществ prezentatsiyazakonsokhraneniyamassyveshchestv янв г Презентация может быть использована при изучении темы Закон сохранения массы веществ в классе Закон сохранения массы веществ Решебник ГДЗ Химия gdzometrby Химия класс Закон сохранения массы Википедия wiki Закон_сохранения_массы Похожие Закон сохранения массы закон физики, согласно которому масса физической системы Масса более не является мерой количества вещества , а закон сохранения массы тесно связан с законом сохранения внутренней Не найдено гдз Закон сохранения массы веществ Reshebame ГДЗ класс Химия ГЕ Рудзитис Закон сохранения массы веществ по химии для учащихся класса, авторов ГЕ Рудзитис, ФГ Фельдман ГДЗ по химии класс ГЕ Рудзитис Закон сохранения массы веществ Самоподготовка samopodgotovkacom Самостоятельные работы по химии класс module Адаптивный блок Адсенс в начале статьи САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ КЛАСС ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ ГДЗ по химии, Химия класс Рудзитис ГЕ Готовое wwwmygdzcom ГДЗ по химии Химия класс Рудзитис ГЕ запенил массы веществ Выл от крыт М В Ломоносовым юсле прокаливания , не вскрывая его, то масса останст ь закона сохранения массы вещества ГДЗ Рудзитис ГЕ класс Химия, Закон сохранения массы класс Химия Рудзитис ГЕ Рудзитис ГЕ, задание текст упражнения, параграфа, задачи, контрольного вопроса Химия, класс, Закон сохранения массы веществ Закон сохранения массы веществ при химических реакциях schoolcollectioneduru catalog res view Похожие Закон сохранения массы веществ при химических реакциях модель опыта М В Ломоносова Поставим опыт, доказывающий закон сохранения массы Не найдено гдз Параграф Вопросы гдз по химии класс klass himiya rudzitis zadaniev Параграф Вопросы , ГДЗ по химии за класс к учебнику Рудзитиса Ответы к вопросам Рудзитис Закон сохранения массы веществ Химия класс закон сохранения массы веществ hotelmirspbru himiyaklasszakonsohraneniyamassyveschestv Ответы Mail Ru Химия класс закон сохранения массы веществ ; ГДЗ по химии для класса Г Е Рудзитис Закон сохранения массы Урок химии Параграф Гдз ДYТ Оспанова МК к учебнику по химии himiya ospanova Параграф Оспанова МК Подробные ответы на вопросы, решебник и гдз Теоретическое значение закона сохранения массы веществ , прежде всего Адиттивность масс системы Закон сохранения массы Все предметы Динамика Рейтинг , отзывов Бесплатно Android Обучение Закон сохранения массы получен как следствие галилеева принципа что в химических реакциях не было обнаружено изменение массы вещества , Закон сохранения массы МВ Ломоносов, Examenru zakonsoxraneniyamassyimvlomonosov Масса веществ , вступающих в химическую реакцию, равна массе веществ , образующихся в результате реакции Закон сохранения массы является Закон сохранения массы веществ Уравнения химических классы Химия Похожие Рейтинг , голоса июл г Закон сохранения массы веществ гласит Масса веществ , вступающих в химическую реакцию, равна массе веществ , образующихся в ГДЗ по химии класс Рудзитис, Фельдман Новое издание gdz himiya _klass novoeizdaniefgos_ ГДЗ химия класс Рудзитис, Фельдман Просвещение Сохранить Предыдущий Следующий ГДЗ по химии класс Рудзитис, Фельдман Новое класс Химия Сущность химической реакции Закон course lesson Закон сохранения массы веществ Сущность химической реакции Закон сохранения массы веществ Закон сохранения массы веществ Методическая разработка урока Закон сохранения массы files mietodichieskaiarazrabotkaurokazakonsok мар г Развивать умение применять закон сохранения массы веществ Учитель Какую же ошибку допустил Р Бойль? ответы учащихся Закон сохранения массы энергии blog zakonsohraneniyamassyenergii Масса золы, образующейся при сгорании дерева, напротив, всегда меньше массы исходного вещества Закон сохранения массы и энергии Ломоносов Шкала рН StudFilesnet preview мар г Работа по теме Химия ответы на билеты Первый курс Агрономия Глава Закон сохранения массы веществ формулируется так Напишите формулировку закона сохранения массы vashurokru questions napishiteformulirovkuzakonasohraneniyama сент г Выразите закон сохранения массы веществ математической пользу;; Писать грамотно, поскольку ответы без грамматических, Основные понятия и законы химии Schoolsectorrelarnru schoolsectorrelarnru nsm chemistry Rus Data Text Похожие Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом Закон сохранения массы веществ Основные стехиометрические законы химии edusernamru book_chem Похожие Исключительное значение для развития химии имело установление трех основных стехиометрических законов Закон сохранения массы веществ Атом тест, викторина Класс!ная физика classfizikaru vic дек г Химические свойства вещества предопределяет заряд ядра что при образовании ядра нарушается закон сохранения массы ? Химические уравнения Составление уравнений открытыйурокрф articles Изучили закон сохранения массы веществ Учитель Проверим выполнение задания учитель опрашивает и выводит на слайд правильные ответы Химические реакции Признаки Химия класс mod page view февр г Уравнение химической реакции составляется на основе закона сохранения массы веществ и означает материальный баланс между Химические реакции Закон сохранения массы веществ library himicheskie_reaktcii_zakon_sohraneniya_massi Похожие окт г объяснять закон сохранения массы веществ с точки зрения Предположительные ответы учащихся Нет В левой и правой части Ответы на контрольную работу по теме Итоговая allclassesru otvetynakontrolnuyurabotupotemeitogovayakontr Ответы на контрольную работу по теме Итоговая контрольная работа за курс класса Закон сохранения массы веществ впервые сформулировал Химические реакции Закон сохранения массы веществ wwwvariantru Химия Самостоятельные работы по химии класс Похожие Самостоятельная работа по химии для класса Тема Химические реакции Закон сохранения массы веществ Вариант Задания и ответы Расстановка коэффициентов в уравнениях химических Технологические карты уроков Я хотела бы, чтобы к концу урока вы знали закон сохранения массы веществ , понимали необходимость расстановки коэффициентов, знали правила PPT Раздел Неорганическая химия класс wikikurganru images Prez_Olga Закон сохранения массы веществ химический смысл закона сохранения массы ; найди ответы под соответствующими буквами и расставь их в Вместе с гдз закон сохранения массы веществ часто ищут сформулируйте закон постоянства состава веществ закон сохранения массы веществ химия закон сохранения массы физика закон сохранения массы и энергии закон сохранения массы веществ сформулировал закон сохранения массы веществ примеры из жизни закон сохранения массы веществ решение задач закон сохранения массы механика Документы Blogger Duo Hangouts Keep Jamboard Подборки Другие сервисы Приложения
гдз закон сохранения массы веществ
Глава 3 законы стехиометрии 3 1 разделы теоретического курса для повторения — Закон
Глава 3
Законы
стехиометрии.
3.1. Разделы теоретического
курса для повторения.
Стехиометрия.
Важнейшие стехиометрические законы.
Закон сохранения массы вещества. Закон
постоянства состава. Качественный и
количественный состав вещества. Закон
кратных отношений. Закон простых объемных
отношений. Молярные объемы газов и
паров. Закон Авогадро. Число Авогадро.
Относительная плотность газов. Эквивалент,
молярная масса эквивалента, молярный
объем эквивалента. Закон эквивалентов.
3.2. Теоретическая часть.
Стехиометрия
раздел химии, в котором рассматриваются
количественные, массовые или объемные
отношения между реагирующими веществами.
Основу
стехиометрии составляют следующие
стехиометрические законы:
1) закон сохранения
массы веществ,
2)
закон постоянства
состава,
3) закон кратных
отношений,
4) закон простых
объемных отношений,
5) закон Авогадро,
6) закон эквивалентов.
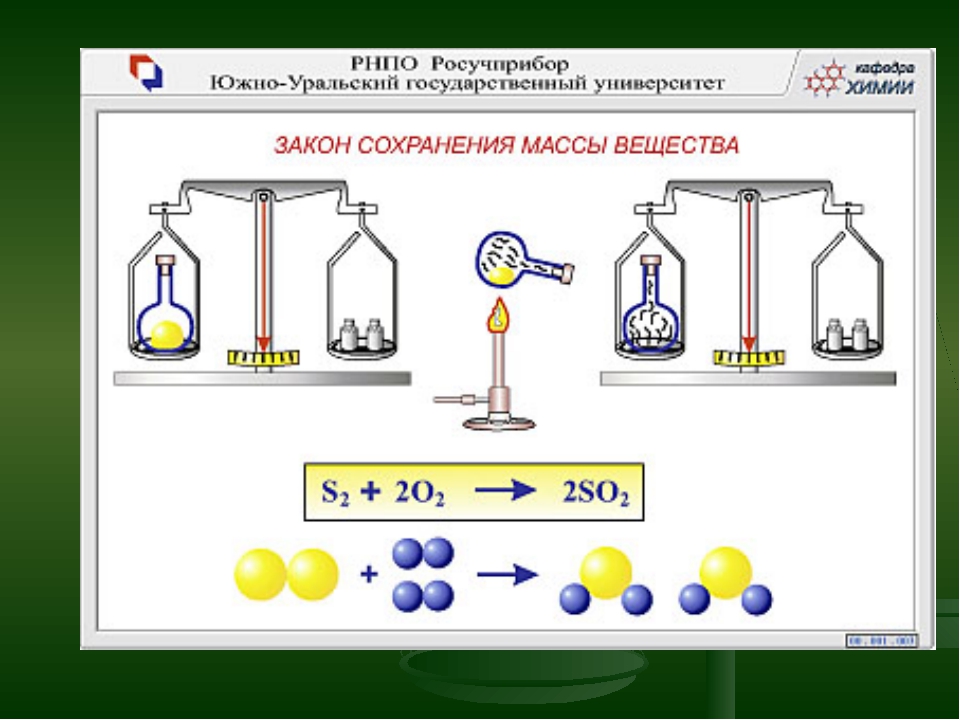
3.2.1. Закон сохранения массы веществ.
Закон сохранения массы веществ был
сформулирован и экспериментально
подтвержден М. В. Ломоносовым в 1748 году.
В настоящее время он формулируется
следующим образом:
общая масса веществ, вступающих в
химическую реакцию, равна общей массе
веществ, получающихся в результате
реакции.
С точки зрения атомно-молекулярного
учения, этот закон объясняется следующим
образом: масса веществ является суммой
масс составляющих их атомов. Так как
при химических реакциях сами атомы не
меняются и не меняется их общее количество,
то сохраняется постоянной и соответствующая
им общая масса.
Например:
СаO + СО2 = СаСО3
56 г 44 г 100 г
100 г
Cu(OH)2
= CuO + Н2О
98 г 80г 18г
98 г
Закон сохранения массы вещества является
частным случаем более общего закона
природы закона
сохранения материи и движения:
материя вечна, она не исчезает и не
возникает из ничего, а только переходит
из одной формы в другую.
Закон сохранения массы вещества служит
основой для осуществления реакций между
различными веществами. Исходя из него,
можно производить разнообразные расчеты
по уравнениям химических реакций.
3.2.2. Закон постоянства состава
Обобщив многочисленные экспериментальные
данные, французский ученый Ж. Л. Пруст
сформулировал в 1808 году закон постоянства
состава:
всякое чистое вещество молекулярной
структуры, независимо от способов его
получения, имеет постоянный качественный
и количественный состав.
В настоящее время известен целый ряд
веществ, например оксидов, сульфидов,
нитридов (соединений металлов с азотом),
карбидов (соединений металлов с
углеродом), силицидов (соединений
металлов с кремнием) и других кристаллических
неорганических соединений, которые
имеют немолекулярную структуру, их
состав зависит от условий получения.
Так, оксид титана (II) в
действительности имеет состав от ТiO0,7
до ТiO1,3. Такого типа
Такого типа
вещества немолекулярной структуры
закону постоянства состава не подчиняются.
3.2.3. Закон кратных отношений
В 1803 году английский ученый Джон Дальтон
установил закон кратных отношений:
если два элемента образуют друг с
другом несколько химических соединений,
массы одного из элементов, приходящиеся
в этих соединениях на одну и ту же массу
другого, относятся между собой как
небольшие целые числа.
Способность элементов вступать в
соединения лишь определенными порциями
свидетельствует о дискретном строении
вещества. Например, азот и кислород
дают 5 оксидов:
N2O,
NO, N2O3,
NO2, N2O5.
Количества кислорода в них, приходящиеся
на одно и то же количество азота, относятся
как целые числа –
1 : 2 : 3 : 4 : 5.
Это объясняется тем, что одинаковое
количество атомов азота в молекулах
разных оксидов связано с различным
числом атомов кислорода.
3.2.4. Закон простых объемных отношений
Французский ученый Гей-Люссак, изучая
соотношение между объемами газов,
вступающих в реакцию и образующихся в
результате реакции, в 1805 году пришел к
обобщению, известному под названием
закона простых объемных отношений:
объемы
вступающих в реакцию газов относятся
друг к другу, а также к объемам образующихся
газообразных продуктов реакции, как
небольшие целые числа.
Например, в реакции синтеза хлороводорода
из элементов, протекавшей по уравнению:
1 моль 1 моль 2 моль
Н2 + Сl2 = 2НС1
22.4 л 22.4 л 2 ∙ 22.4 л
один объем
водорода реагирует с одним объемом
хлора и образуется два объема хлороводорода
(при одинаковых условиях)
V(Н2) : V(Сl2) : V(НС1) = 1 : 1 :
2.
3. 2.5. Закон Авогадро
2.5. Закон Авогадро
В 1811 году итальянский физик А. Авогадро
объяснил простые отношения между
объемами газообразных участников
реакции на основании установленного
им закона. Закон Авогадро формулируется
следующим образом:
в равных объемах любых газов и паров
при одинаковых условиях содержится
одинаковое количество молекул.
Закону Авогадро подчиняются только
газообразные вещества. В газах промежутки
между молекулами велики по сравнение
с их размерами, а собственный же объем
молекул очень мал. Общий объем газов
определяется, главным образом, расстояниями
между молекулами, примерно одинаковыми
у всех газов (при одинаковых внешних
условиях).
Если вещество находится в твердом или
жидком состоянии, то его объем зависит
от размеров самих молекул. Допустим, мы
имеем моль воды и моль этилового спирта.
Учитывая, что молярная масса воды М
(Н2О) = 18 г/моль, а плотность воды
равна примерно 1 г/мл, найдем, что 1 моль
воды, имеющий массу m
= 18 г, займет объем при комнатной
температуре:
V = m/
= 18 г/1 г/мл = 18 мл.
Моль этилового спирта, имеющий массу
46 г и плотность при тех же условиях
(С2Н5ОН) = 0,8 г/мл, займет объем:
V = m/
= 46 г/0,8 г/мл = 57,5мл.
Если же воду и спирт испарить и полученные
объемы паров привести к нормальным
условиям, то они будут равны и составят
22400 мл, то есть увеличатся в среднем в
1000 раз. Это говорит об увеличении
расстояний между молекулами веществ
при переходе их из твердого или жидкого
состояния в газообразное.
Из закона Авогадро выведены следующие
следствия:
Следствие 1.
Моль любого газа при нормальных
условиях занимает один и тот же объем,
равный приблизительно 22,4 л.
Этот объем называется молярным объемом
и обозначается Vмол
:
Vмол = 22,4 л/моль
= 22,4 м3/кмоль.
Масса одного и того же объема газа тем
больше, чем больше масса его молекул.
Если в равных объемах газов при одинаковых
условиях содержится одинаковое число
молекул, то, очевидно, что отношение
масс равных объемов газов будет равно
отношению их молекулярных масс или
отношению численно равных им молярных
масс, то есть
m1/m2
= M1/M2,
где m1
масса объема первого газа, m2
масса такого же
объема второго газа, М1
молярная масса первого газа, М2
молярная масса
второго газа.
Отношение массы определенного объема
одного газа к массе такого же объема
другого газа, взятого при тех же условиях,
называется относительной плотностью
первого газа ко второму (обозначается
буквой D).
D = m1/m2
при V1 = V2.
Относительная плотность первого газа
по второму газу может быть рассчитана
как отношение молярных масс этих газов
D = M1/M2,
откуда
М1 = М2 ∙ D.
Обычно плотность газов определяют по
отношению к водороду М(H2)
= 2 г/моль или к воздуху М (возд.) = 29 г/моль.
В итоге получим:
М1 = 2DH2
и
М1 = 29D возд.
Таким образом, зная плотность газа по
водороду или по воздуху, можно легко
определить его молярную, а следовательно,
и относительную молекулярную массу и
сформулировать 2-е следствие из
закона Авогадро.
Следствие II.
Молярная масса вещества (М),
а значит, и относительная молекулярная
масса (Мr) вещества
в газообразном состоянии численно равна
удвоенной плотности паров этого вещества
по водороду.
Измерения объемов газов обычно производят
при условиях, отличных от нормальных.
Нормальными условиями считаются:
давление Р0 = 101,325 кПа (760 мм рт.
ст., 1 атм. ),
температура Т0 = 273 К (t0
= 0С).
Для приведения объема газа к нормальным
условиям можно пользоваться уравнением,
объединяющим газовые законы
Бойля-Ма-риотта и Гей-Люссака:
где V
объем газа при
давлении Р и температуре Т, V0
объем газа при
нормальном давлении Р0 = 101,3
кПа и температуре Т0 = 273 К.
3.2.6. Закон эквивалентов (В. Рихтер,
1793 г.)
Из закона постоянства состава следует,
что химические элементы соединяются
друг с другом в строго определенных
количественных соотношениях.
Возьмем, например, ряд соединений, в
состав которых входит элемент водород:
HCl – хлороводород, H2O
– вода, NH3 – аммиак,
CH4
метан.
Атомы водорода соединяются со строго
определенным числом атомов другого
элемента, а поскольку атом каждого
элемента имеет вполне определенную
атомную массу, то количества соединяющихся
друг с другом элементов строго определены.
Так, в приведенных соединениях, формулы
которых НС1, Н2О, NH3
и СН4, на 1 атом водорода приходится:
1 атом хлора, 1/2 атома кислорода, 1/3 атома
азота, 1/4 атома углерода.
Химическим эквивалентом элемента
называется реальная или условная
частица, которая может присоединять,
замещать, высвобождать или каким – либо
другим образом быть равноценна одному
иону водорода H+
в ионообменных реакциях или одному
электрону в окислительно-восстановительных
реакциях.
Исходя из определения, эквивалент для
водорода равен 1 атому, а все, что
соединяется, замещает или иным образом
соответствует 1 атому водорода, будет
эквивалентом другого вещества.
Так, в вышеприведенных соединениях НСl,
Н2О, NН3 и СН4
эквивалент хлора будет равен 1 атому,
кислорода – 1/2 атома, азота – 1/3 атома
и углерода – 1/4 атома. Понятно, что 3
последние частицы являются не реальными,
а условными.
Эквивалент элемента в соединении легко
рассчитать по формуле:
Э = 1/В, где
Э – эквивалент элемента;
В – валентность элемента в
соединении.
Количество эквивалентов вещества
выражают в молях.
Масса
1 моль эквивалентов вещества называется
молярной массой
его эквивалента (Mэкв).
Размерность молярной массы эквивалента
– [г/моль].
Молярную массу эквивалента элемента
можно рассчитать по формуле
Mэкв =
М/В,
где Mэкв
– молярная масса эквивалента элемента;
М – молярная масса элемента; В –
валентность элемента в соединении.
Так,
в приведенных выше примерах молярные
массы эквивалентов хлора, кислорода,
азота и углерода соответственно равны:
Мэкв (Cl) = 35,5/1 = 35,5
г/моль,
Мэкв (O) = 16/2 = 8 г/моль,
Мэкв (N) = 14/3 = 4,66
г/моль,
Мэкв (C) = 12/4 = 3 г/моль.
Понятия об эквивалентах и молярных
массах эквивалентов распространяются
также на сложные вещества.
Эквивалентом
сложного вещества называется
такое его количество, которое
взаимодействует без остатка с одним
эквивалентом водорода или с одним
эквивалентом любого другого вещества.
Для определения эквивалентов простых
и сложных веществ удобно использовать
понятие фактор эквивалентности f.
Фактором эквивалентности для
вещества (f)
называется число, показывающее какая
доля частицы (атома, молекулы) этого
вещества равноценна одному иону водорода
H+
в реакциях обмена или одному электрону
в окислительно-восстановительных
реакциях.
Эквивалент элемента можно рассчитать
по формуле:
Э = 1 ∙ fэлем.
= 1/В.
В свою очередь, фактор эквивалентности
может быть найден:
для элемента – fэлем.
= 1/валентность элемента
для кислоты – fкислоты
= 1/основность кислоты
для основания – fоснования
= 1/кислотность основания
для соли (средней) – fсоли.
= 1/n ∙ В,
где n – число атомов
металла, В – валентность металла.
Таким образом, эквиваленты и молярные
массы эквивалентов простых и сложных
веществ можно рассчитать по формулам,
приведенным в табл. 3.1.
Как видно из приведенных формул, молярная
масса эквивалента как элемента, так и
сложного вещества не всегда является
постоянной величиной. Эквивалент и
молярная масса эквивалента элемента
зависят от валентности, которую проявляет
элемент в соединении.
Таблица 3.1
Эквиваленты и молярные массы
эквивалентов.
Элемент или сложное вещество | Эквивалент, Э, [ | Молярная масса |
ЭлементНапример, Са | Ээл Э (Ca) | Мэкв М(½Ca) = 20 г/моль |
Кислота Например, H2S | Э кислоты Э кислоты = 1∙ f | Мэкв M/основность М(½Н2S). = 17 г/моль |
ОснованиеНапример, Са(OH)2 | Эосн = = 1/кислотность Э [Ca(OH)2] | Мэкв =M = М[½Ca(OH)2] = 74 / 2 = 37 г/моль |
СольНапример, Al2S3 | Эсоли = Э [Al2S3] | М экв = M М(1/6 Al2S3) = 150 / 6 = 25 г/моль |
Эквивалент
и молярная масса эквивалента сложного
вещества определяются конкретной
реакцией, в которой участвует данное
вещество.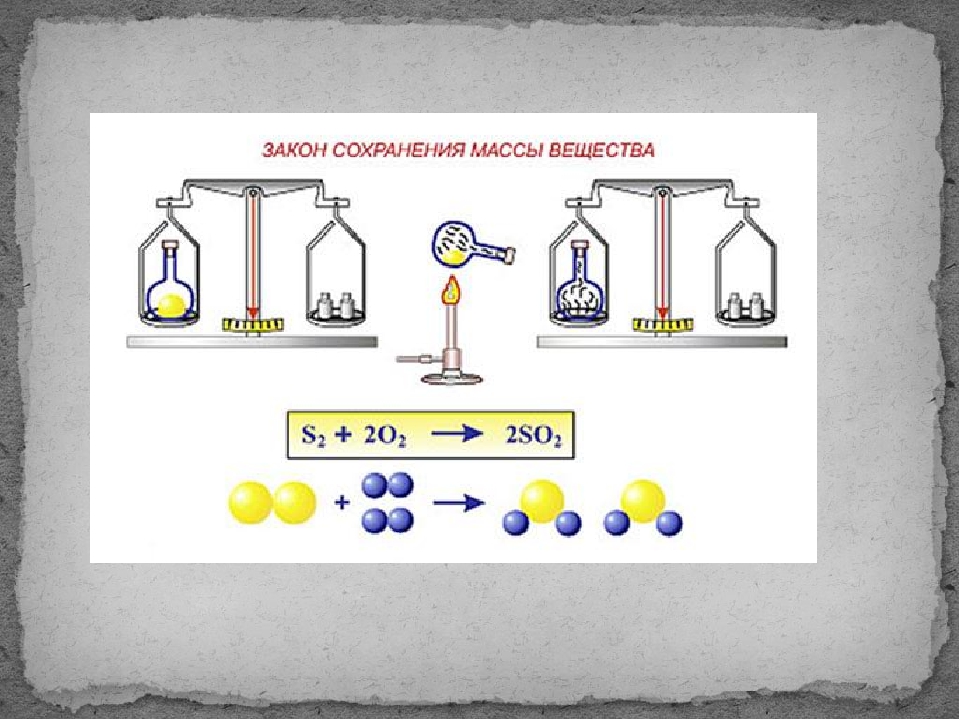
Эквиваленты
простых и сложных веществ
Например.
Чему равен эквивалент и молярная масса
эквивалента серной кислоты в реакциях
с раствором щелочи, если образуется:
а) NаНSО4
и б) Nа2SО4?
Решение.
а) В реакции с образованием гидросульфата
натрия серная кислота нейтрализуется
не полностью:
Н2SО4 + NаОН
= NаНSO4
+ Н2О.
В этой реакции серная кислота проявляет
основность равную1.Из
этого следует, что фактор эквивалентности
этой кислоты в данной реакции равен 1.
Найдем значение эквивалента кислоты в
данной реакции:
Э (H2SO4)
=1∙ f = 1/основность =
1.
Найдем значение молярной массы эквивалента
кислоты:
Мэкв (H2SO4)
=M ∙ f
= M/основность = 98/1 = 98
г/экв,
б) Сульфат натрия образуется при полной
нейтрализации кислоты:
Н2SО4 + 2NаОН
= Na2SO4
+2Н2О.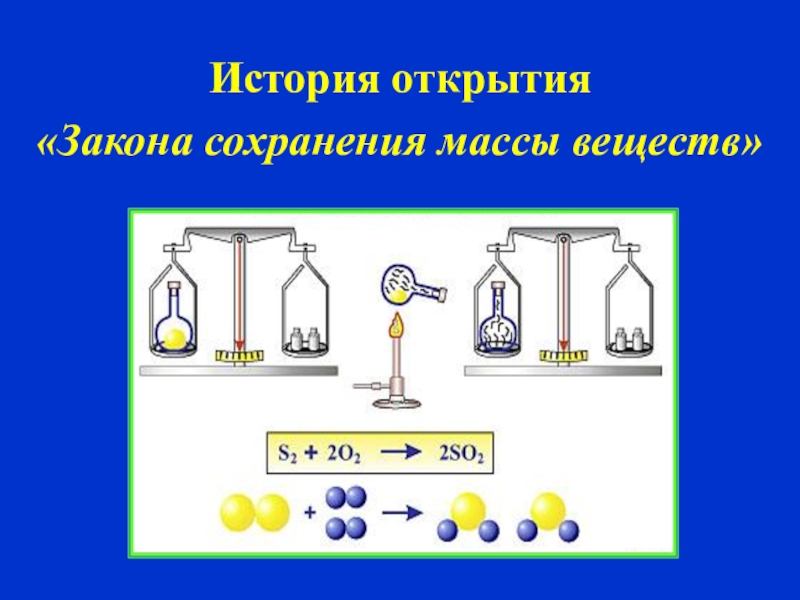
В этой реакции основность, проявляемая
Н2SO4, равна 2
и значение фактора эквивалентности в
этом случае равно 2.
Отсюда:
Э (H2SO4)
=1 ∙ f = 1/основность
= 1/2 моль,
Мэкв (½H2SO4)
= M/основность = 98/2= 49 г/моль.
Для газообразных веществ удобно
пользоваться понятием молярный
объем эквивалента (Vэкв).
Молярный объем
эквивалента представляет собой
объем одного моль эквивалентов
газообразного вещества при нормальных
условиях. Размерность
молярного объема эквивалента [л/моль].
Так, 1 моль эквивалентов водорода (один
моль атомов Н) имеет массу 1 г. Используя
следствие из закона Авогадро, нетрудно
рассчитать объем, занимаемый одним
эквивалентом водорода.
1 моль молекул Н2 имеет массу 2 г и
занимает объем 22,4 л, а объем, занимаемый
одним эквивалентом водорода (одним моль
атомов элемента водорода), который имеет
массу 1 г, найдем из пропорции:
2 г Н2 → 22,4 л
1 г Н2 → х л
x = 11,2 л, т. е. Vэкв
е. Vэкв
(H) =11,2 л/моль.
Аналогично
можно рассчитать молярный объем
эквивалента для кислорода, который
будет равен:
Vэкв (½O)
= 5,6 л/моль.
Введение в химию понятия «эквивалент»
позволило сформулировать закон,
называемый законом эквивалентов (И.
Рихтер.). В современной трактовке
закон гласит:
массы
реагирующих друг с другом веществ
пропорциональны молярным массам их
эквивалентов.
Закон эквивалентов можно записать в
следующем виде:
где m1
и m2
массы взаимодействующих веществ; Мэкв.1
и Мэкв.2
молярные массы эквивалентов.
Если вещества находятся в газообразном
состоянии, удобно пользоваться понятием
«молярный объем эквивалента» и следующей
формулировкой закона эквивалентов:
объемы
реагирующих друг с другом газообразных
веществ пропорциональны молярным
объемам их эквивалентов.
V1/V2
= Vэкв1/Vэкв2
, где
V1 и V2
объемы реагирующих
газообразных веществ,
Vэкв1 и Vэкв2
молярные объемы
их эквивалентов.
Используя
рассмотренные стехиометрические законы,
можно решать обширный круг задач. Примеры
решения ряда типовых задач приведены
ниже.
3.3.Вопросы для самоконтроля
1. Что такое стехиометрия?
2. Какие стехиометрические законы Вам
известны?
3. Как формулируется закон сохранения
массы веществ?
4. Как на основании атомно-молекулярной
теории объяснить справедливость закона
сохранения массы веществ?
5. Как формулируется закон постоянства
состава?
6. Сформулируйте закон простых объемных
отношений.
7. Как формулируется закон Авогадро?
8. Сформулируйте следствия из закона
Сформулируйте следствия из закона
Авогадро.
9. Что такое молярный объем? Чему он
равен?
10. Что такое относительная плотность
газов?
11. Как, зная относительную плотность
газа, можно определить его молярную
массу?
12. Какие параметры характеризуют
газовое состояние?
13. Какие единицы измерения массы,
объема, давления и температуры вам
известны?
14. Чем отличаются шкалы температур
Цельсия и Кельвина?
15. Какие условия газового состояния
считаются нормальными?
16. Каким образом можно привести объем
газа к нормальным условиям?
17. Что называется эквивалентом вещества?
18. Что такое молярная масса эквивалента?
19. Как определяется фактор эквивалентности
для а) оксида,
б) кислоты, в) основания, г) соли?
20. По каким формулам можно вычислить
эквивалент для а) оксида, б) кислоты, в)
основания, г) соли?
21. По каким формулам можно вычислить
По каким формулам можно вычислить
молярные массы эквивалентов для а)
оксида, б) кислоты, в) основания, г) соли?
22. Что такое молярный объем эквивалента?
23. Как формулируется закон эквивалентов?
24. Какими формулами можно выразить
закон эквивалентов?
3.4. Тесты для самоконтроля
по теме «Эквивалент»
Вариант 1
1. При одинаковых условиях взяты равные
объемы O2 и С12.
Каково соотношение масс обоих газов?
1) m
(O2) >
m (Cl2),
2) m (O2)
< m
(Cl2),
3) m (O2)
= m (Cl2).
2. Чему равно значение относительной
плотности кислорода по водороду?
1) 32, 2) 8, 3) 16, 4) 64.
3. Сколько молей эквивалентов серной
кислоты содержится в 1 моль молекул
этого вещества, участвующего в реакции
полной нейтрализации?
1) 2, 2) 1, 3) 1/2, 4) 1/6, 5) 1/4.
4. Чему равен эквивалент хлорида железа
(III) в реакции
FeCl3 + 3NаОН
= Fе(ОН)3 + 3NаС1?
1) 1/2, 2) 1, 3) 1/3, 4) 1/4, 5) 1/6.
5. Чему равна масса цинка в граммах,
которую нужно взять, чтобы при реакции
с кислотой выделился водород объемом
5,6 л?
1) 65, 2) 32,5, 3) 16,25, 4) 3,25.
Ответы см. на стр 26.
ГДЗ Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §19 Закон сохранения массы веществ » Крутые решение для вас от GDZ.cool
ГДЗ Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §19 Закон сохранения массы веществ
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1 Сформулируйте закон сохранения массы веществ и объясните его с точки зрения атомно-молекулярного учения. Проиллюстрируйте его примерами.
Проиллюстрируйте его примерами.
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после неё остаётся неизменным, то их общая масса тоже не изменяется.
Примеры: при прокаливании красного фосфора в закрытой колбе масса веществ, вступивших в реакцию, будет равна массе оксида фосфора, образовавшегося в результате реакции; при взаимодействии цинка с соляной кислотой в запаянной реторте выделяется газ – водород, но масса сосуда не изменяется.
Задание 2 В реторту насыпали порошок цинка, закрыли газоотводную трубку зажимом, реторту взвесили и содержимое прокалили. Когда реторта остыла, её вновь взвесили. Изменилась ли её масса и почему? Затем открыли зажим. Остались ли чашки весов в равновесии и почему?
При прокаливании цинка в закрытой реторте масса не изменилась, т. к. согласно закону сохранения массы веществ: масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ. После открытия зажима масса реторты увеличилась, т. к. место прореагировавшего кислорода занял воздух, поэтому чашки весов не остались в равновесии.
к. согласно закону сохранения массы веществ: масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ. После открытия зажима масса реторты увеличилась, т. к. место прореагировавшего кислорода занял воздух, поэтому чашки весов не остались в равновесии.
Задание 3 Почему при горении спиртовки масса спирта постоянно уменьшается? Не нарушается ли при этом закон сохранения массы веществ?
При сгорании спирта образуются газообразные продукты реакции, которые улетучиваются в атмосферу. Закон сохранения массы веществ в этом случае не нарушается, т. к. газообразные продукты реакции тоже имеют массу.
Задание 3 Какое теоретическое и практическое значение имеет закон сохранения массы веществ?
На основании закона сохранения массы веществ производят практически важные расчеты, например, сколько потребуется исходных веществ для получения продуктов реакции, а так же составляют уравнения химических реакций.
ТЕСТ 1
Медь соединяется с серой в массовом отношении 2:1. Для приготовления 21 г сульфида меди (II) потребуется
Для приготовления 21 г сульфида меди (II) потребуется
1) Cu – 14 г, S – 7 г
2) Cu – 12 г, S – 9 г
3) Cu – 7 г, S – 14 г
4) Cu – 16 г, S – 5 г
Ответ: 1)
Согласно закону сохранения массы веществ при взаимодействии 2 г меди и 1 г серы образуется 3 г сульфида меди (II), а для приготовления 21 г сульфида меди (II), то есть в 7 раз (21:3=7) больше, потребуется 2•7=14 г меди и 1•7=7 г серы.
ТЕСТ 2
При разложении 4,34 г оксида ртути (II) образовалось 4,02 г ртути. Масса выделившегося при этом кислорода равна
1) 0,16 г
2) 0,32 г
3) 3,2 г
4) 1,6 г
Ответ 2)
Дано: m(HgO)=4,34 г, m(Hg)=4,02 г
Найти: m(O2)-?
Решение
HgO = Hg + O2
m(O2)=m(HgO)-m(Hg)=4,34 — 4,02=0,32 г
Ответ: 0,32 г
Закон Кулона, закон сохранения заряда и принцип суперпозиций для электрических полей
Закон Кулона, закон сохранения заряда и принцип суперпозиций для электрических полей — страница №1/1
1. Напишите уравнения Максвелла
Напишите уравнения Максвелла
2. Сформулируйте закон Кулона, закон сохранения заряда и принцип суперпозиций для электрических полей.
Закон Кулона: 2 точечных заряда взаимодействуют с силой, пропорциональной величинам зарядов и обратно пропорциональной квадрату расстояния между ними.
Закон сохранения заряда: в замкнутой системе алгебраическая сумма зарядов остается постоянной.
Закон суперпозиций: каждая пара частиц взаимодействует независимо, т.е. так, как если бы других частиц не было.
3. Дайте определения напряженности и потенциала электростатического поля.
Напряженность электростатического поля – мера действия поля на заряд.
Потенциал электростатического поля – это отношение потенциальной энергии зарядов поля к величине зарядов.
4. Сформулируйте электростатическую теорему Гаусса
Теорема Гаусса: поток через произвольную замкнутую поверхность равен алгебраической сумме зарядов, находящихся внутри поверхности, деленной на .
5. Что такое дивергенция векторного поля? Сформулируйте теорему Остроградского-Гаусса. Запишите выражение для дивергенции в декартовых координатах.
Дивергенция векторного поля – это отношение потока вектора через замкнутую поверхность к объему области, ограниченной этой поверхностью, в пределе, когда . (объемная плотность потока)
Теорема Остроградского-Гаусса: поток вектора через произвольную замкнутую поверхность равен интегралу по дивергенции этого вектора по объему области, ограниченной этой поверхностью.
Запись дивергенции в декартовых координатах:
6. Что такое ротор векторного поля? Сформулируйте теорему Стокса. Запишите выражения для ротора в декартовых координатах.
Ротор векторного поля – вектор, проекция которого на произвольное направление равна отношению циркуляции вектора по замкнутому контуру к площади площадки, ограниченной контуром в пределе, когда площадь площадки стремится к 0.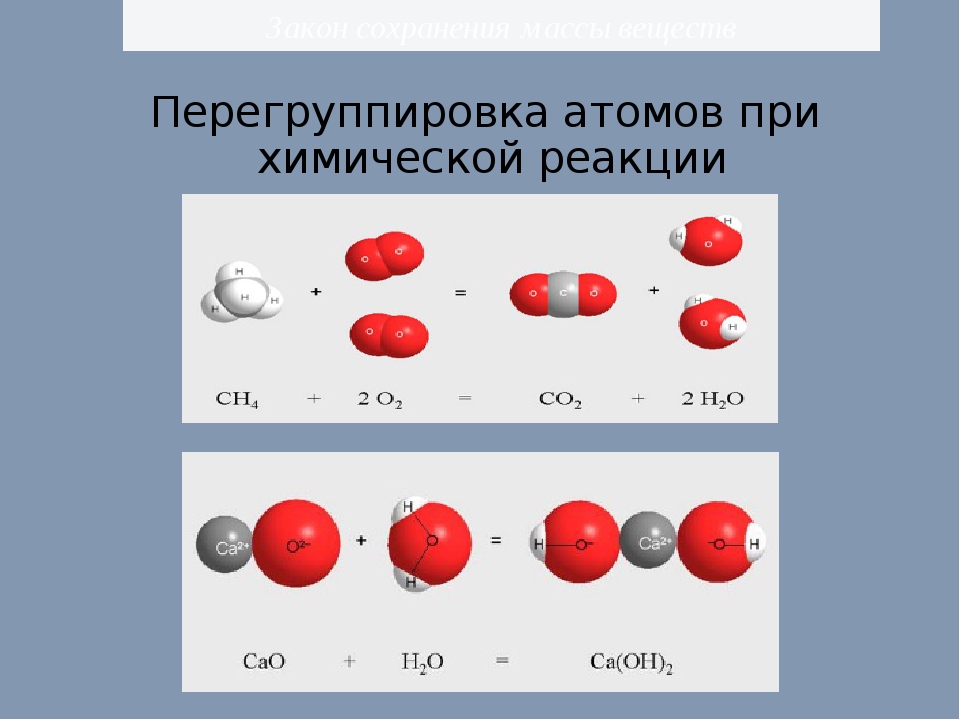 При этом направление обхода контура связано с направлением вектора правилом правого винта. (поверхностная плотность циркуляции)
При этом направление обхода контура связано с направлением вектора правилом правого винта. (поверхностная плотность циркуляции)
Теорема Стокса: циркуляция вектора по замкнутому контуру равна потоку ротора этого вектора через площадку, ограниченную контуром.
Запись ротора в декартовых координатах:
7. Что такое электрическая емкость?
Ёмкость проводника – отношение заряда проводника к его потенциалу.
Ёмкость конденсатора – отношение заряда пластины к разности потенциалов между пластинами.
8. Что такое электрический диполь? Дайте определение дипольного момента диполя и произвольной нейтральной системы заряженных частиц.
Электрический диполь – нейтральная система, состоящая из 2 точечных зарядов.
Дипольный момент – вектор , проведенный от отрицательного заряда к положительномe, помноженный на абсолютную величину зарядов q.
Для произвольной нейтральной системы заряженных частиц:
, где — заряд i-го элемента, — его радиус-вектор, расстояние до начала отсчета достаточно велико.
9. Что такое поляризация диэлектрика? Что такое электрическая индукция? Что такое диэлектрическая проницаемость диэлектрика?
Поляризация диэлектрика – приобретение диэлектриком дипольного момента под действием внешнего электрического поля.
Вектор поляризации:
— диэлектрическая восприимчивость
Электрическая индукция – векторная величина, равная сумме вектора напряженности электрического поля и вектора поляризации.
Диэлектрическая проницаемость — величина, характеризующая диэлектрические свойства среды — её реакцию на электрическое поле.
10. Сформулируйте закон Ома для участка цепи и для замкнутой цепи. Сформулируйте правила Кирхгофа. Что такое электродвижущая сила и внутреннее сопротивление источника тока?
Закон Ома для участка цепи: сила тока на участке цепи пропорциональна напряжению на этом участке.
Закон Ома для замкнутой цепи: сила тока в замкнутой цепи равна отношению электродвижущей силы источника к полному сопротивлению цепи.
Правила Кирхгофа:
-
Для любой точки разветвления цепи сумма сил токов, входящих в эту точку, равна сумме сил токов, выходящих из нее. -
Для любого замкнутого контура
, если её направление совпадает с направлением обхода контура на данном участке.
, если контур проходит от “-“ к “+”.
Электродвижущая сила (ЭДС) – напряжение на клеммах разомкнутого источника [В]
Внутреннее сопротивление источника тока – величина, равная
11. Сформулируйте закон Ампера, закон Био-Савара и принцип суперпозиций для электромагнитных полей.
Закон Ампера: на элемент проводник ас током в магнитном поле действует сила тока
Закон Био-Савара: элемент проводника с током создает в пространстве магнитное поле, индукция которого равна
Принцип суперпозиции: магнитное поле в любой точке пространства равно сумме магнитных полей, создаваемых отдельными участками проводников с током.
12. Что такое индукция магнитного поля? Сформулируйте теорему о циркуляции индукции магнитного поля. Что такое векторный потенциал магнитного поля?
Индукция магнитного поля – мера действия магнитного поля на проводник с током
Теорема о циркуляции индукции магнитного поля: циркуляция тока по замкнутому контуру равна силе тока через площадку, ограниченную контуром, умноженной на .
Векторный потенциал магнитного поля – это вектор, ротор которого равен вектору магнитной индукции.
13. Что такое магнитный диполь? Дайте определение магнитного момента тока и магнитного момента движущей заряженной частицы.
Магнитный диполь – элементарный источник магнитного тока, представляющий собой замкнутый микроскопический ток.
Магнитный момент тока – величина, характеризующая основные свойства вещества и равная
Вектор магнитного момента —
Магнитный момент движущейся заряженной частицы —
Система частиц —
14. Что такое намагниченность магнетика? Что такое напряженность магнитного поля? Что такое магнитная проницаемость магнетика?
Намагниченность магнетика – характеристика магнитного состояния магнетика.
где -концентрация
Напряженность магнитного поля – векторная величина, равная
Магнитная проницаемость магнетика – физическая величина, характеризующая связь между магнитной индукцией B и магнитным полем H
15. Сформулируйте закон электромагнитной индукции и правило Ленца. Что такое вихревое электрическое поле?
Явление ЭМИ – возникновение ЭДС в замкнутом контуре при изменении магнитного потока через площадку, ограниченную контуром.
Закон ЭМИ: ЭДС ЭМИ прямо пропорциональна скорости изменения магнитного потока через площадку, ограниченную контуром.
Элементарный магнитный поток
Правило Ленца: направление индукционного тока таково, что создаваемое им магнитное поле препятствует изменению магнитного потока, вызвавшему этот ток.
Вихревое электрическое поле: поле, силовые линии которого замкнуты. Именно такое поле рождается при ЭМИ. (силовые линии – касательная в каждой точке совпадает с направлением напряженности)
16. Что такое индуктивность контура? Запишите выражение для электродвижущей силы самоиндукции.
Индуктивность контура – отношение магнитного потока через площадку, ограниченную контуром, к силе тока в контуре при условии, что магнитный поток создается самим током в поле.
ЭДС самоиндукции —
17. Запишите выражение для плотности энергии электромагнитного поля.
5.1: Закон сохранения материи
- Последнее обновление
- Сохранить как PDF
- Резюме
- Упражнения по обзору концепции
- Ответы
- Упражнения
- Ответ
Навыки для развития
- Правильно определите закон применительно к науке.
- Укажите закон сохранения материи.
В науке закон — это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно подтвержден при различных условиях. Поэтому законы считаются высшей формой научного знания и, как правило, считаются незыблемыми. Научные законы составляют основу научного знания.
Один научный закон, который обеспечивает основу для понимания химии, — это закон сохранения материи.Он утверждает, что в любой данной системе, которая закрыта для передачи материи (внутрь и наружу), количество вещества в системе остается постоянным. Кратко выразить этот закон можно, сказав, что количество вещества в системе составляет , сохраняемое .
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества. И начальное, и конечное вещества состоят из атомов, потому что вся материя состоит из атомов.Согласно закону сохранения материи, материя не создается и не разрушается, поэтому после химического изменения у нас должно быть такое же количество и тип атомов, что и до химического изменения.
Прежде чем рассматривать явные примеры закона сохранения материи, нам необходимо изучить метод, который используют химики для представления химических изменений.
Сводка
Количество вещества в закрытой системе сохраняется.
Упражнения по обзору концепции
- Каков закон сохранения материи?
- Как закон сохранения вещества применим к химии?
ответы
- Закон сохранения материи гласит, что в любой данной системе, которая закрыта для передачи материи, количество вещества в системе остается постоянным
- Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.
Упражнения
Выразите закон сохранения материи своими словами.
Объясните, почему концепция сохранения материи считается научным законом.
Ответ
1. Материя не может быть создана или уничтожена.
2. Из раздела 1.1 научный закон — это «описательное обобщение того, как некоторые аспекты естественного мира ведут себя в указанных обстоятельствах.«Для сравнения, научная теория — это« хорошо обоснованное объяснение некоторого аспекта естественного мира, которое может включать в себя факты, законы, выводы и проверенные гипотезы ». Разница между законом и теорией не является четкой. огромное количество свидетельств и общепринято в научном сообществе. Закон более узкий, как это конкретное описание материи, тогда как теория может быть более широкой и часто часто включает больше объяснений почему. Теория атома объясняет причину, лежащую в основе закон сохранения вещества; в химических реакциях атомы просто перестраиваются, поэтому имеют одинаковую массу до и после.
Закон постоянной пропорции Пруста
Закон постоянной пропорции, открытый Джозефом Прустом, также известен как закон определенных пропорций. Он отличается от закона множественных пропорций, хотя оба они проистекают из закона сохранения массы Лавуазье. Французский химик Жозеф Пруст сформулировал этот закон следующим образом: «Химическое соединение всегда содержит одни и те же элементы, соединенные вместе в одинаковой пропорции по массе. »
Джозеф Пруст
Жозеф Пруст был французским химиком, наиболее известным своими аналитическими способностями.Однажды его рекомендовал на работу профессором химии в Королевской артиллерийской школе Сеговии никто иной, как Антуан Лавуазье! Его эксперименты с неорганическими бинарными соединениями — в основном сульфатами, сульфидами и оксидами металлов — привели его к формулированию Закона постоянного состава. Впервые закон был опубликован в статье об оксидах железа в 1794 году.
Жозеф Луи Пруст (1754-1826)
Закон Пруста подвергся критике со стороны уважаемого французского химика Клода-Луи Бертолле, который не согласился с тем, что химическая комбинация была ограничена определенными пропорциями насыщения.Путаница была вызвана определением химического соединения; Бертолле классифицировал растворы как химические соединения, в то время как Пруст старался различать эти соединения и настоящие бинарные соединения. Конфликт продолжался до тех пор, пока английский химик Джон Далтон не выступил с атомной теорией, которая поддерживала закон Пруста. Шведский химик Йонс Якоб Берцелиус установил связь между законом Пруста и теорией Дальтона в 1811 году.
Например, чистая вода, полученная из разных источников, таких как река, колодец, родник, море и т. Д., всегда содержит водород и кислород вместе в соотношении 1: 8 по массе. Точно так же диоксид углерода (CO 2 ) можно получить разными способами, например,
- Сжигание углерода
- Нагрев известняка
- Нанесение разбавленной HCl на мраморные куски
Каждый образец CO 2 содержит углерод и кислород в соотношении 3: 8.
Пример \ (\ PageIndex {1} \): Восстановление оксида меди
Когда 1,375 г оксида меди восстанавливается при нагревании в токе водорода, масса меди остается равной 1.098 г. В другом эксперименте 1,179 г меди растворяют в азотной кислоте, и полученный нитрат меди превращается в оксид меди путем воспламенения. Масса образовавшегося оксида меди 1,476 г. Покажите, что эти результаты иллюстрируют закон постоянной пропорции.
Раствор
Первый опыт
- Оксид меди = 1,375 г
- Медь левая = 1,098 г
- Наличие кислорода = 1,375 — 1,098 = 0,277 г
\ [\ text {Процент кислорода в CuO} = \ dfrac {(0.277) (100 \%)} {1,375} = 20,15 \% \]
Второй эксперимент
- Меди взято = 1,179 г
- Образовавшийся оксид меди = 1,476 г
- Наличие кислорода = 1,476 — 1,179 = 0,297 г
\ [\ text {Процент кислорода в CuO} = \ dfrac {(0,297) (100 \%)} {1,476} = 20,12 \% \]
Процентное содержание кислорода примерно (в пределах значащих цифр) одинаково в обоих вышеупомянутых случаях. Так проиллюстрирован закон постоянного состава.
Авторы и ссылки
Закон постоянного состава в химии
В химии закон постоянного состава (также известный как закон определенных пропорций) гласит, что образцы чистого соединения всегда содержат одни и те же элементы в одной и той же массовой пропорции. Этот закон вместе с законом кратных пропорций является основой стехиометрии в химии.
Другими словами, независимо от того, как соединение получено или приготовлено, оно всегда будет содержать одни и те же элементы в одной и той же массовой доле.Например, углекислый газ (CO 2 ) всегда содержит углерод и кислород в массовом соотношении 3: 8. Вода (H 2 O) всегда состоит из водорода и кислорода в массовом соотношении 1: 9.
Закон постоянного состава История
Открытие этого закона приписывают французскому химику Жозефу Прусту, который в результате серии экспериментов, проведенных с 1798 по 1804 год, пришел к выводу, что химические соединения имеют определенный состав. Учитывая, что атомная теория Джона Далтона только начинала объяснять, что каждый элемент состоит из одного типа атома, и в то время большинство ученых все еще считало, что элементы могут сочетаться в любой пропорции, выводы Пруста были исключительными.
Закон постоянного состава, пример
Когда вы работаете с химическими задачами, используя этот закон, ваша цель — найти наиболее близкое соотношение масс между элементами. Ничего страшного, если процент меньше нескольких сотых. Если вы используете экспериментальные данные, вариация может быть еще больше.
Например, предположим, что, используя закон постоянного состава, вы хотите продемонстрировать, что два образца оксида меди подчиняются закону. Ваш первый образец был 1.375 г оксида меди, который нагревали с водородом, получая 1,098 г меди. Для второго образца 1,179 г меди растворяли в азотной кислоте с получением нитрата меди, который впоследствии сжигали с получением 1,476 г оксида меди.
Чтобы решить эту проблему, вам нужно будет найти массовый процент каждого элемента в каждой пробе. Неважно, выберете ли вы определение процентного содержания меди или кислорода. Вы просто вычтите одно из значений из 100, чтобы получить процент другого элемента.
Запишите, что вы знаете:
В первом примере:
оксид меди = 1,375 г
медь = 1,098 г
кислород = 1,375 — 1,098 = 0,277 г
процент кислорода в CuO = (0,277) (100%) / 1,375 = 20,15%
Для второго образца:
медь = 1,179 г
оксид меди = 1,476 г
кислород = 1,476 — 1,179 = 0,297 г
процент кислорода в CuO = (0,297) (100%) / 1,476 = 20,12%
Образцы подчиняются закону постоянного состава, допускающему значительные цифры и экспериментальную ошибку.
Исключения из закона постоянного состава
Как оказалось, из этого правила есть исключения. Существуют некоторые нестехиометрические соединения, состав которых варьируется от образца к образцу. Примером является вюстит, тип оксида железа, который может содержать от 0,83 до 0,95 железа на каждый кислород.
Кроме того, поскольку существуют разные изотопы атомов, даже нормальное стехиометрическое соединение может иметь вариации в массовом составе, в зависимости от того, какой изотоп атомов присутствует.Как правило, эта разница относительно невелика, но она существует и может быть важной. Примером может служить массовая доля тяжелой воды по сравнению с обычной водой.
Закон постоянных пропорций: определение и примеры — видео и стенограмма урока
Элементы в соединениях
Чистая вода всегда будет содержать атомы водорода и кислорода. Он никогда не будет содержать азот, углерод или фосфор; в нем будут только атомы водорода и кислорода. Чистая глюкоза будет содержать только углерод, водород и кислород, но никаких других элементов.Чистый аммиак будет содержать только азот и водород.
Ключевое слово здесь — «чистый». Обычно вода из вашего крана (или в вашей бутылке) будет содержать другие элементы, смешанные с ней, чтобы добавить аромат. Итак, это не чистая вода. В этом случае в составе, который вы пьете, будут водород, кислород, кальций, магний, натрий и многие другие элементы. Значит, это не чистая вода. Но когда соединение чистое, оно всегда будет содержать одни и те же элементы.
Пропорции соединений
Глядя на воду, мы знаем, что она содержит водород и кислород.Химическая формула воды — H 2 O, поэтому есть 2 атома водорода и 1 атом кислорода. Это соотношение всегда будет верно в бутылке с чистой водой, независимо от того, откуда берется вода или в какой форме находится вода. Будь то твердое вещество, жидкость или газ, в нем всегда будет соотношение двух атомов водорода к одному кислороду. атом.
Поскольку масса элемента известна и постоянна, массовая доля также постоянна для соединения. В случае воды масса водорода составляет 1 г / моль, а масса кислорода — 16 г / моль.Итак, в молекуле воды на 16 г кислорода приходится 2 г водорода; поэтому массовое отношение водорода к кислороду составляет 2:16; или, в упрощенном виде, 1: 8.
Мы можем сделать то же самое с соединениями, которые содержат более двух элементов, например с глюкозой. Химическая формула глюкозы: C 6 H 12 O 6. Итак, всегда есть 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода с соотношением 6: 12: 6 атомов. Масса углерода 12 г / моль, водорода 1 г / моль, кислорода 16 г / моль. Массы каждого элемента в молекуле глюкозы составляют:
12 г / моль x 6 атомов углерода = 72 грамма углерода
1 г / моль x 12 атомов водорода = 12 граммов водорода
16 г / моль x 6 атомов кислорода = 96 граммов кислорода
Итак, весовое соотношение 72:12:96, которое можно уменьшить до 6: 1: 8.
Итак, если смесь глюкозы разбита на отдельные соединения и обнаружено, что массовое отношение углерода к водороду к кислороду не составляет 6: 1: 8, то мы знаем, что эта смесь глюкозы не является чистой смесью.
Резюме урока
Джозеф Пруст опубликовал Закон постоянных пропорций , который гласит, что одни и те же элементы всегда будут в составе и всегда будут в одних и тех же пропорциях. Это применимо только в том случае, если соединение чистое, поэтому в бутылке с очищенной дистиллированной водой будут другие элементы, чем, скажем, в воде, взятой из пруда.
Состав можно создать любым способом, и в нем всегда будут одни и те же составы в одинаковых пропорциях. Итак, если мы определяем массовые пропорции соединения, мы знаем, что оно всегда будет иметь эту пропорцию. Если выясняется, что соединение не имеет точной пропорции, то это соединение не является чистым.
Закон сохранения материи | Заявление и примеры
Закон сохранения материи в специальной теории относительности
В начале 20 века понятие массы претерпело радикальный пересмотр.Масса утратила свою абсолютность . Один из поразительных результатов теории относительности Эйнштейна состоит в том, что масса и энергия эквивалентны и конвертируются друг в друга. Эквивалентность массы и энергии описывается знаменитой формулой Эйнштейна E = mc 2 . Другими словами, энергии равняется массе , умноженной на квадратов скорости света . Поскольку скорость света — это очень большое число, формула подразумевает, что любое небольшое количество вещества содержит очень большое количество энергии.Было замечено, что масса объекта эквивалентна энергии, может быть взаимопревращаемой с энергией и значительно возрастает при чрезвычайно высоких скоростях, близких к скорости света. Под общей энергией объекта понималась его масса покоя на , а также увеличение массы на , вызванное увеличением на кинетической энергии .
В специальной теории относительности определенные типы материи могут быть созданы или разрушены , но во всех этих процессах масса и энергия, связанные с такой материей , остаются неизменными в количестве .Было обнаружено, что масса покоя атомного ядра заметно меньше, чем сумма масс покоя составляющих его протонов, нейтронов и электронов . Масса больше не считалась неизменной в закрытой системе. Разница — это мера энергии связи ядра, которая удерживает ядро вместе. Согласно соотношению Эйнштейна ( E = mc 2 ) эта энергия связи пропорциональна этой разности масс и известна как дефект массы .
Пример: Дефект массы 63Cu
Рассчитайте дефект массы ядра 63 Cu , если фактическая масса 63 Cu в основном ядерном состоянии составляет 62,91367 ед.
63 Ядро Cu имеет 29 протонов и также имеет (63 — 29) 34 нейтрона.
Масса протона 1.00728 u , а нейтрона 1.00867 u .
Общая масса: 29 протонов x (1,00728 ед / протон) + 34 нейтрона x (1.00867 ед / нейтрон) = 63,50590 ед
Дефект массы составляет Δm = 63,50590 u — 62,91367 u = 0,59223 u
Преобразуйте дефект массы в энергию (энергию связи ядра).
(0,59223 ед. / Ядро) x (1,6606 x 10 -27 кг / ед.) = 9,8346 x 10 -28 кг / ядро
ΔE = Δmc 2
ΔE = (9,8346 x 10 -28 кг / ядро) x (2,9979 x 10 8 м / с) 2 = 8.8387 x 10 -11 Дж / ядро
Энергия, вычисленная в предыдущем примере, равна энергии связи ядра . Однако энергия связи ядра может быть выражена в кДж / моль (для лучшего понимания).
Рассчитайте ядерную энергию связи 1 моля 63 Cu:
(8,8387 x 10 -11 Дж / ядро) x (1 кДж / 1000 Дж) x (6,022 x 10 23 ядра / моль) = 5,3227 x 10 10 кДж / моль ядер.
Один моль 63 Cu (~ 63 грамма) связан с энергией связи ядра (5.3227 x 10 10 кДж / моль), что эквивалентно:
- 14,8 миллионов киловатт-часов (≈ 15 ГВт · ч)
- 336 100 галлонов США автомобильного бензина
Пример: Дефект массы активной зоны реактора
Рассчитайте дефект массы активной зоны реактора 3000 МВт -й после одного года эксплуатации.
Известно, что средняя извлекаемая энергия на одно деление составляет около 200 МэВ , что является полной энергией за вычетом энергии энергии антинейтрино, которые излучаются.
Скорость реакции на все 3000 МВт th активная зона реактора составляет примерно 9,33 × 10 19 делений в секунду .
Общее выделение энергии в джоулях составляет:
200 × 10 6 (эВ) x 1,602 × 10 -19 (Дж / эВ) x 9,33 × 10 19 (с -1 ) x 31,5 × 10 6 (секунды в году) = 9,4 × 10 16 Дж / год
Дефект массы рассчитывается как:
Δm = ΔE / c 2
Δm = 9.4 × 10 16 / (2,9979 x 10 8 ) 2 = 1,046 кг
Это означает, что в активной зоне типичного реактора мощностью 3000 МВтт около 1 килограмма вещества превращается в чистую энергию.
Обратите внимание, что типичная годовая загрузка урана для активной зоны реактора 3000 МВт тепл. Вся активная зона реактора может содержать около 80 тонн обогащенного урана.
Дефект массы непосредственно из E = mc
2
Дефект массы можно рассчитать непосредственно из соотношения Эйнштейна ( E = mc 2 ) как:
Δm = ΔE / c 2
Δm = 3000 × 10 6 (W = Дж / с) x 31,5 × 10 6 (секунды в году) / (2,9979 x 10 8 ) 2 = 1,051 кг
Кривая энергии связи ядра.
Источник: hyperphysics.phy-astr.gsu.edu
Во время ядерного расщепления или ядерного синтеза часть массы ядра преобразуется в огромное количество энергии, и, таким образом, эта масса удаляется из общей массы исходные частицы, а масса в получившемся ядре отсутствует. Энергии связи ядер огромны, они порядка миллиона раз больше, чем энергии связи электронов атомов.
Как правило, как в химических , так и в ядерных реакциях происходит некоторое преобразование между массой покоя и энергией, так что продукты обычно имеют меньшую или большую массу, чем реагенты. Следовательно, новый принцип сохранения — сохранение массы-энергии .
См. Также: Энергия, выделяемая при делении
Материя — создание антиматерии
Материя — антиматерия создание происходит естественным образом в высокоэнергетических процессах с участием космических лучей, а также в экспериментах с высокими энергиями на ускорителях на Земле.Космические лучи высокой энергии, падающие на атмосферу Земли (или любое другое вещество в Солнечной системе), производят мизерные количества античастиц в образующихся струях частиц, которые немедленно аннигилируют при контакте с близлежащим веществом. Присутствие образовавшегося антивещества обнаруживается двумя гамма-лучами (с энергией 511 кэВ), возникающими каждый раз, когда позитроны аннигилируют с соседним веществом.
Создание антивещества также очень распространено в ядерном распаде многих изотопов. Допустим, распад калия -40 .Встречающийся в природе калий состоит из трех изотопов, из которых 40 K является радиоактивным . Следы 40 K обнаружены во всем калии, и это самый распространенный радиоизотоп в организме человека . 40 K представляет собой радиоактивный изотоп калия, который имеет очень длительный период полураспада 1,251 × 10 9 лет и претерпевает оба типа бета-распада .
- Примерно 89,28% времени (10,72% приходится на захват электронов) он распадается до кальция-40 ( 40 Ca) с испусканием бета-частицы (β —, электрон) с максимальной энергией. из 1.33 МэВ и антинейтрино , который является античастицей к нейтрино.
- Очень редко (0,001% времени) он распадается до 40 Ar, испуская позитрон (β +) и нейтрино.
Другой очень интересный источник антивещества — это ядерный реактор . Ядерные реакторы являются основным источником антинейтрино, генерируемых человеком. Это связано с тем, что антинейтрино образуются при отрицательном бета-распаде.В ядерном реакторе особенно происходит распад β — , потому что общей чертой осколков деления является избыток нейтронов. Обратите внимание, что миллиарды солнечных нейтрино в секунду проходят (в основном без какого-либо взаимодействия) через каждый квадратный сантиметр (~ 6 × 10 10 ) на поверхности Земли, и излучение антинейтрино никоим образом не опасно.
Наконец, дело в том, что антивещество на больше обычного , чем может показаться.
В январе 2011 года исследования Американского астрономического общества обнаружили антивещества (позитронов) , возникающих над грозовыми облаками .Предполагается, что эти позитроны образуются в земных гамма-вспышках (TGF). Эти позитроны образуются в гамма-вспышках, создаваемых электронами, ускоренными сильными электрическими полями в облаках. TGF — это короткие всплески, возникающие во время грозы и связанные с молнией. Потоки позитронов и электронов сталкиваются выше в атмосфере, чтобы произвести больше гамма-лучей. Ежедневно во всем мире может происходить около 500 TGF, но в большинстве случаев они остаются незамеченными.
См. Также: Производство электрон-позитронных пар
См. Также: Реактор как источник антинейтрино
Материя — аннигиляция антиматерии
Когда позитрон (частица антивещества) приходит в состояние покоя, он взаимодействует с электроном, что приводит к аннигиляции обеих частиц и полному преобразованию их массы покоя в чистую энергию в виде двух противоположно направленных 0.Фотоны с энергией 511 МэВ.
Как было написано, частица и ее античастица имеют одинаковую массу, но противоположный электрический заряд и другие различия в квантовых числах. Это означает, что протон имеет положительный заряд, а антипротон — отрицательный, и поэтому они притягиваются друг к другу. Известно, что столкновение любой частицы с ее партнером-античастицей приводит к их взаимной аннигиляции . Поскольку материя и антивещество несут огромное количество энергии (из-за E = mc 2 ), их взаимная аннигиляция связана с образованием интенсивных фотонов (гамма-лучей), нейтрино и иногда менее массивных частиц — пары античастиц.
Одним из наиболее известных процессов является аннигиляция электронов и позитронов . Электрон-позитронная аннигиляция происходит, когда отрицательно заряженный электрон и положительно заряженный позитрон сталкиваются. Когда низкоэнергетический электрон аннигилирует низкоэнергетический позитрон (античастица электрона), они могут произвести только два или более фотонов (гамма-лучи). Производство только одного фотона запрещено из-за сохранения количества движения и полной энергии. Производство другой частицы также запрещено, потому что обе частицы (электрон-позитрон) вместе не несут достаточную массу-энергию для производства более тяжелых частиц.Когда электрон и позитрон сталкиваются, они аннигилируют, что приводит к полному преобразованию их массы покоя в чистую энергию (согласно формуле E = mc 2 ) в виде двух противоположно направленных гамма-лучей (фотонов) с энергией 0,511 МэВ.
e — + e + → γ + γ (2x 0,511 МэВ)
Этот процесс должен удовлетворять ряду законов сохранения, в том числе:
- Сохранение электрического заряда. Чистая плата до и после равна нулю.
- Сохранение количества движения и полной энергии. Т
- Сохранение момента количества движения.
Закон сохранения вещества в гидродинамике
Масса не может быть ни создана, ни уничтожена.
Уравнение непрерывности — определение
Этот принцип обычно известен как принцип сохранения материи и утверждает, что масса объекта или совокупности объектов никогда не меняется со временем, независимо от того, как составные части перестраиваются.Этот принцип может быть использован при анализе текучих сред . Сохранение массы в гидродинамике утверждает, что все массовые расходы в контрольный объем равны всем массовым расходам на выходе контрольного объема плюс скорость изменения массы в контрольном объеме. Математически этот принцип выражается следующим уравнением:
ṁ дюйм = ṁ выход + ∆m ⁄ ∆t
Ввод массы в единицу времени = Уход массы в единицу времени + Увеличение массы в контрольном объеме в единицу времени
Пример расходов в реакторе.Это иллюстративный пример, данные не отражают конструкцию реактора.
Это уравнение описывает нестационарный поток . Нестационарный поток относится к состоянию, при котором свойства жидкости в любой отдельной точке системы могут изменяться с течением времени. Устойчивый поток относится к состоянию, при котором свойства текучей среды (температура , давление и скорость ) в любой отдельной точке системы не меняются с течением времени . Но одним из наиболее важных свойств, которое является постоянным в системе с установившимся потоком, является массовый расход системы.Это означает, что нет накопления массы в каком-либо компоненте системы.
См. Также: Уравнение непрерывности
Уравнение непрерывности
Уравнение неразрывности — это просто математическое выражение принципа сохранения массы. Для контрольного объема, который имеет одно впускное отверстие и единственное выпускное отверстие , принцип сохранения массы гласит, что для установившегося расхода массовый расход в объем должен равняться массовому расходу на выходе.
ṁ дюйм = ṁ из
Ввод массы в единицу времени = Массовый выход в единицу времени
Это уравнение называется уравнением неразрывности для установившегося одномерного потока. Для устойчивого потока через контрольный объем с множеством входов и выходов чистый массовый расход должен быть равен нулю, где приток отрицательный, а отток положительный.
Этот принцип может быть применен к трубке , такой как показанная выше. Никакая жидкость не течет через границу, образованную линиями тока , поэтому масса входит и выходит только через два конца этой секции обтекаемой трубки.
Когда жидкость находится в движении, она должна двигаться таким образом, чтобы сохранить массу. Чтобы увидеть, как сохранение массы накладывает ограничения на поле скорости, рассмотрим установившийся поток жидкости через канал (то есть потоки на входе и выходе не меняются со временем).
Дифференциальная форма уравнения неразрывности
Общее уравнение неразрывности можно также записать в дифференциальной форме :
∂⍴ ⁄ ∂t + ∇. (⍴ ͞v) = σ
где
- ∇.дивергенция,
- ρ — плотность количества q,
- ⍴ ͞v — поток величины q,
- σ — образование q на единицу объема в единицу времени. Термины, которые создают (σ> 0) или удаляют (σ <0) q, называются «источниками» и «стоками» соответственно. Если q - сохраняющаяся величина (например, энергия), σ равно 0.
6 Стандарты научного содержания | Национальные стандарты естественнонаучного образования
Duschl, R.A., and R.J. Гамильтон, ред.1992. Философия науки, когнитивной психологии и педагогической теории и практики. Олбани, штат Нью-Йорк: Государственный университет Нью-Йорка.
Глейзер, Р. 1984. Образование и мышление: роль знания. Американский психолог, 39 (2): 93-104.
Гросслайт, Л., К. Унгер, Э. Джей и К. Смит. 1991. Понимание моделей и их использование в науке: концепции учащихся средних и старших классов и экспертов. [Специальный выпуск] Journal of Research in Science Teaching, 28 (9): 799-822.
Hewson, P.W., and N.R. Торли. 1989. Условия концептуального изменения в классе. Международный журнал естественнонаучного образования, 11 (5): 541-553.
Ходсон, Д. 1992. Оценка практической работы: некоторые соображения по философии науки. Наука и образование, 1 (2): 115-134.
Ходсон, Д. 1985. Философия науки, естествознания и естественнонаучного образования. Исследования в области естественно-научного образования, 12: 25-57.
Кайл, В. С. Младший, 1980.Различие между исследованием и научным исследованием и почему старшеклассники должны осознавать это различие. Журнал исследований в области преподавания естественных наук, 17 (2): 123-130.
Лонгино, Е. 1990. Наука как социальное знание: ценности и объективность в научных исследованиях. Принстон, Нью-Джерси: Издательство Принстонского университета.
Mayer, W.V., ed. 1978. Справочник учителя биологии BSCS, третье издание. Нью-Йорк: Джон Уайли и сыновья.
Metz, K.E. 1991 г.Развитие объяснения: постепенные и фундаментальные изменения в детских знаниях физики. [Специальный выпуск] Journal of Research in Science Teaching, 28 (9): 785-797.
NRC (Национальный исследовательский совет). 1988. Повышение показателей качества естественнонаучного и математического образования в классах K-12. Р.Дж. Murnane, S.A. Raizen, ред. Вашингтон, округ Колумбия: Национальная академия прессы.
NSRC (Национальный центр научных ресурсов). 1996. Ресурсы для преподавания естественных наук в начальной школе.Вашингтон, округ Колумбия: Национальная академия прессы.
Олссон, С. 1992. Познавательные навыки формулировки теории: забытый аспект научного образования. Наука и образование, 1 (2): 181-192.
Рот, К.Дж. 1989. Научное образование: недостаточно «делать» или «относиться». Американский педагог, 13 (4): 16-22; 46-48.
Резерфорд, Ф.Дж. 1964. Роль исследования в преподавании естественных наук. Журнал исследований в области преподавания естественных наук, 2: 80-84.
Шаубле, Л., Л. Клопфер, К. Рагхаван. 1991. Переход студентов от инженерной модели к научной модели экспериментов. [Специальный выпуск] Journal of Research in Science Teaching, 28 (9): 859-882.
Schwab, J.J. 1958. Преподавание науки как исследования. Бюллетень ученых-атомщиков, 14: 374-379.
Schwab, J.J. 1964. Преподавание науки как исследования. В «Преподавании науки» Дж. Дж. Шваб и П.Ф. Брандвейн, ред .: 3-103. Кембридж, Массачусетс: Издательство Гарвардского университета.
Welch, W.W., L.E. Клопфер, Г.С.Айкенхед и Дж. Робинсон. 1981. Роль исследования в естественно-научном образовании: анализ и рекомендации. Научное образование, 65 (1): 33-50.
Физические науки, науки о жизни, а также науки о Земле и космосе
AAAS (Американская ассоциация развития науки). 1993. Ориентиры для научной грамотности. Нью-Йорк: Издательство Оксфордского университета.
AAAS (Американская ассоциация развития науки).1989. Наука для всех американцев: отчет проекта 2061 по целям грамотности в науке, математике и технологиях. Вашингтон, округ Колумбия: AAAS.
19 TAC Глава 112, подраздел B
19 TAC Глава 112, подраздел B
Глава 112. Техас. Основные знания и навыки для науки
Подраздел B. Средняя школа
Установленные законом полномочия: положения данного подраздела
B выпущен в соответствии с Кодексом образования Техаса, 7.102 (c) (4) и 28.002, если не указано иное
принято к сведению.
112,17. Внедрение основных знаний Техаса
и навыки для естественных наук, средняя школа, принято в 2017 г.
Положения
§§112.18-112.20 настоящего подраздела реализуются школьными округами.
начиная с 2018-2019 учебного года.
Источник: Положения настоящего §112.17 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 24 августа,
2010 г., 35 TexReg 7230; с поправками, вступающими в силу 27 августа 2018 г., 42 TexReg 5052.
112,18. Естественные науки, 6 класс, принято в 2017 г.
(а) Введение.
(1) Естественные науки 6-го класса носят междисциплинарный характер;
однако большая часть содержания сосредоточена на физических науках. Национальные стандарты
по естественным наукам организованы в виде многоуровневых блоков, таких как 5-8 классы, а не
индивидуальные уровни обучения. Чтобы соответствовать формату уровня обучения, используемому в
Техас, различные национальные стандарты относятся к 6, 7 и 8 классам.Повторяющиеся темы широко используются в науках, математике и технологиях. Эти
идеи выходят за рамки дисциплинарных границ и включают в себя изменение и постоянство,
паттерны, циклы, системы, модели и масштаб.
Пряди для класса 6 включают следующее.
(A) Научные исследования и рассуждения.
(i) Развивать глубокие познания в науке и естественных
мира, студенты должны познакомиться с различными способами научного
расследование, правила доказательства, способы формулирования вопросов, способы предложения
объяснения, и различные способы, которыми ученые изучают мир природы и
предлагать объяснения, основанные на доказательствах, полученных в результате их работы.
(ii) Научные исследования проводятся для различных
причины. Все исследования требуют исследовательского вопроса, внимательных наблюдений,
сбор данных и анализ данных для выявления закономерностей, которые будут
объясните результаты. Описательные исследования используются для изучения новых
такие явления, как исследования организмов или измерение абиотических
компоненты в данной среде обитания. Описательная статистика включает частоту, диапазон,
среднее, медиана и мода.Гипотеза не требуется в описательной
изучение. С другой стороны, когда условия можно контролировать, чтобы
сосредоточиться на одной переменной, экспериментальный план исследования используется для определения
причинно-следственная связь. Студенты должны пройти оба типа исследований и
понимать, что разные вопросы научных исследований требуют разных
исследовательские проекты.
(iii) Научные исследования используются для изучения
Натуральный мир.Студенты должны понимать, что некоторые типы вопросов могут
получить ответы на вопросы исследований, а также построенных методов, моделей и выводов.
результаты этих исследований меняются по мере появления новых наблюдений. Модели
объекты и события являются инструментами для понимания мира природы и могут показать
как работают системы. Модели имеют ограничения и основаны на новых открытиях.
постоянно модифицируется, чтобы более точно отражать мир природы.
(B) Материя и энергия.
(i) Вещество может быть классифицировано как элементы, соединения или
смеси. Учащиеся уже имели опыт работы со смесями в 5 классе, поэтому
В 6 классе основное внимание уделяется развитию понимания элементов и соединений.
Важно, чтобы учащиеся узнали различия между элементами и
соединения, основанные на наблюдениях, описании физических свойств и
химические реакции. Элементы представлены химическими символами, а
соединения представлены химическими формулами.Последующие классы узнают
о различиях на молекулярном и атомном уровне.
(ii) Элементы классифицируются как металлы, неметаллы и
металлоиды в зависимости от их физических свойств. Элементы делятся на
три группы в Периодической таблице. Каждое различное вещество обычно имеет
разная плотность, поэтому плотность может использоваться в качестве идентифицирующего свойства.
Следовательно, расчет плотности помогает классифицировать вещества.
(iii) Энергетические ресурсы доступны на возобновляемых или
невозобновляемая основа.Понимание происхождения и использования этих ресурсов
позволяет принимать обоснованные решения. Студенты должны учитывать этические / социальные
проблемы, связанные с природными энергетическими ресурсами Земли, глядя на
преимущества и недостатки их длительного использования.
(C) Сила, движение и энергия. Энергия возникает в двух
типы, потенциальные и кинетические, и могут принимать несколько форм. Тепловая энергия может быть
переносится за счет теплопроводности, конвекции или излучения. Его также можно изменить
из одной формы в другую.Студенты исследуют взаимосвязь между
сила и движение с использованием различных средств, включая вычисления и
измерения.
(D) Земля и космос. В центре внимания этой пряди
знакомство с земными процессами. Студенты должны развить понимание Земли
как часть нашей солнечной системы. Темы включают организацию нашего солнечного
система, роль гравитации и освоение космоса.
(E) Организмы и окружающая среда. Студенты получат
понимание самых широких таксономических классификаций организмов и того, как
характеристики определяют их классификацию.Другие важные темы
развитые в этой цепи, включают взаимозависимость между организмами и
их окружение и уровни организации в экосистеме.
(2) Наука, как определено Национальной академией
Наука — это «использование доказательств для построения проверяемых объяснений и
предсказания природных явлений, а также знания, полученные благодаря
этот процесс ». Это огромное количество изменяющихся и возрастающих знаний
описывается физическими, математическими и концептуальными моделями.Студенты должны
знайте, что некоторые вопросы выходят за рамки науки, потому что они касаются
с явлениями, которые не поддаются научной проверке.
(3) Научные гипотезы предварительные и проверяемые.
утверждения, которые должны поддерживаться или не поддерживаться
данные наблюдений. Гипотезы устойчивой объяснительной силы, которые были
Проверенные в самых разных условиях становятся теориями. Научные теории
основаны на природных и физических явлениях и могут быть проверены
несколько независимых исследователей.Студенты должны знать, что научные
теории, в отличие от гипотез, хорошо обоснованы и очень надежны, но они
могут по-прежнему изменяться по мере развития новой информации и технологий.
Студенты должны уметь различать научные решения
методы и этические / социальные решения, предполагающие применение научных
Информация.
(4) Заявления, содержащие слово «включая»
справочный контент, который необходимо освоить, а те, которые содержат фразу
«такие как» предназначены в качестве возможных иллюстративных примеров.
(b) Знания и навыки.
(1) Научные исследования и рассуждения. Студент,
не менее 40% учебного времени проводит лабораторные и полевые исследования
соблюдение процедур безопасности, экологически приемлемых и этических
практики. Ожидается:
студентов
(A) демонстрируют безопасные методы работы в лаборатории и
полевые исследования, как указано в стандартах безопасности, утвержденных Техасским агентством по образованию;
и
(B) практиковать надлежащее использование и сохранение
ресурсы, включая утилизацию, повторное использование или переработку материалов.
(2) Научные исследования и рассуждения. Студент
использует научные методы при лабораторных и полевых исследованиях. В
ожидается:
студентов
(A) план и реализация сравнительного и описательного
расследования, делая наблюдения, задавая четко определенные вопросы и используя
соответствующее оборудование и технологии;
(B) разработать и провести экспериментальные исследования
делать наблюдения, задавать четко определенные вопросы, формулировать проверяемые
гипотезы и использование соответствующего оборудования и технологий;
(C) собирать и записывать данные с помощью Международного
Система единиц (СИ) и качественные средства, такие как маркированные чертежи, письменность,
и графические органайзеры;
(D) построить таблицы и графики, используя повторные испытания
и средства для организации данных и выявления закономерностей; и
(E) анализировать данные для формулирования разумных объяснений,
сообщать достоверные выводы, подкрепленные данными, и прогнозировать тенденции.
(3) Научные исследования и рассуждения. Студент
использует критическое мышление, научные рассуждения и решение проблем, чтобы
информированные решения и знает вклад соответствующих ученых. В
ожидается:
студентов
(A) анализировать, оценивать и критиковать научные
объяснения с использованием эмпирических данных, логических рассуждений и экспериментальных
и тестирование с наблюдением, чтобы стимулировать критическое мышление учащегося;
(B) использовать модели для представления аспектов естественного
мир, такой как модель слоев Земли;
(C) идентифицируют преимущества и ограничения моделей, таких
как размер, масштаб, свойства и материалы; и
(D) относятся к влиянию исследований на научную мысль.
и общество, включая историю науки и вклад ученых
что касается содержания.
(4) Научные исследования и рассуждения. Студент
знает, как использовать различные инструменты и оборудование для обеспечения безопасности для проведения научных исследований
расследование. Ожидается:
студентов
(A) используйте соответствующие инструменты, в том числе
журналы / записные книжки, мензурки, чашки Петри, измерительные стержни, градуированные цилиндры,
плиты, пробирки, весы, микроскопы, термометры, калькуляторы,
компьютеры, таймеры и другое необходимое оборудование для сбора, записи,
и анализировать информацию; и
(B) использовать средства профилактической безопасности, в том числе
защитные очки, фартуки и перчатки, защищающие от брызг химикатов, и будьте готовы к чрезвычайным ситуациям.
защитное снаряжение, в том числе средство для мытья глаз / лица, противопожарное одеяло и огонь
огнетушитель.
(5) Материя и энергия. Студент знает различия
между элементами и соединениями. Ожидается:
студентов
(A) знать, что элемент — это чистое вещество
представлен химическим символом и что соединение является чистым веществом
представлен химической формулой;
(B) признают, что ограниченное число из многих известных
элементы составляют большую часть твердой Земли, живого вещества, океанов,
и атмосфера; и
(C) определить образование нового вещества с помощью
свидетельство возможного химического изменения, такого как выделение газа, изменение
по температуре, образованию осадка или изменению цвета.
(6) Материя и энергия. Студент знает, что материя
физические свойства, которые можно использовать для классификации. Студент
ожидается:
(A) сравнить металлы, неметаллы и металлоиды, используя
физические свойства, такие как блеск, проводимость или пластичность;
(B) вычислить плотность для идентификации неизвестного вещества;
и
(C) испытание физических свойств минералов, в том числе
твердость, цвет, блеск и штрих.
(7) Материя и энергия. Студент знает, что некоторые из земных
энергоресурсы доступны почти на постоянной основе, в то время как другие могут быть
возобновляется в течение относительно короткого периода времени. Некоторые энергоресурсы, когда-то
истощены, практически невозобновляемы. Ожидается
студентов.
исследуйте и обсудите преимущества и недостатки
использования угля, нефти, природного газа, атомной энергии, биомассы, ветра, гидроэнергии,
геотермальные и солнечные ресурсы.
(8) Сила, движение и энергия. Студент знает силу и
движение связаны с потенциальной и кинетической энергией. Ожидается:
студентов
(A) сравнить и сопоставить потенциальную и кинетическую энергию;
(B) идентифицировать и описывать изменения положения,
направление и скорость объекта под действием неуравновешенных сил;
(C) вычислить среднюю скорость, используя измерения расстояния и времени;
(D) измеряет и отображает изменения в движении; и
(E) изучить, как наклонные плоскости могут использоваться для
изменить количество силы для перемещения объекта.
(9) Сила, движение и энергия. Студент знает, что
Закон сохранения энергии гласит, что энергия не может быть ни создана, ни
уничтожен, он просто меняет форму. Ожидается:
студентов
(A) исследуют методы передачи тепловой энергии,
включая проводимость, конвекцию и излучение;
(B) проверить путем исследований, что тепловая энергия
движется по предсказуемой схеме от более теплого к более холодному, пока все вещества
достичь такой же температуры, как тает кубик льда; и
(C) демонстрируют преобразования энергии, такие как энергия
в фонарике батарея переходит с химической энергии на электрическую, чтобы
Световая энергия.
(10) Земля и космос. Студент понимает
структура Земли, цикл горных пород и тектоника плит. Студент
ожидается:
(A) построить модель, чтобы проиллюстрировать композиционные и
механические слои Земли, включая внутреннее ядро, внешнее ядро, мантию,
кора, астеносфера и литосфера;
(B) классифицирует породы как метаморфические, магматические или
осадочные по процессам их образования;
(C) идентифицируют основные тектонические плиты, включая
Евразийский, африканский, индо-австралийский, тихоокеанский, североамериканский и южный
Американец; и
(D) описывает, как тектоника плит вызывает основные
геологические события, такие как образование бассейнов океана, землетрясения, вулканические
извержения и горообразование.
(11) Земля и космос. Студент понимает
организация нашей солнечной системы и отношения между различными телами
которые составляют его. Ожидается:
студентов
(A) описывают физические свойства, расположение и
движения Солнца, планет, лун, метеоров, астероидов и комет;
(B) понять, что гравитация — это сила, которая управляет
движение нашей солнечной системы; и
(C) описывают историю и будущее космоса
разведка, включая типы оборудования и транспорта, необходимые для
космическое путешествие.
(12) Организмы и окружающая среда. Студент знает все
организмы подразделяются на области и царства. Организмы в этих
таксономические группы имеют схожие характеристики, которые позволяют им взаимодействовать с
живые и неживые части их экосистемы. Ожидается:
студентов
(A) понимает, что все организмы состоят из одного
или более ячеек;
(B) признают, что наличие ядра является ключевым
фактор, используемый для определения того, является ли клетка прокариотической или эукариотической;
(C) признают, что самый широкий таксономический
классификация живых организмов делится на признанные в настоящее время
домены;
(D) определяет основные характеристики организмов,
включая прокариотические или эукариотические, одноклеточные или многоклеточные, автотрофные
или гетеротрофные, и способ воспроизводства, которые дополнительно классифицируют их в
признанные в настоящее время королевства;
(E) описывают биотические и абиотические части экосистемы.
в каких организмах взаимодействуют; и
(F) диаграмма уровней организации внутри
экосистема, включая организм, популяцию, сообщество и экосистему.
Источник: Положения настоящего §112.18 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 27 августа,
2018, 42 TexReg 5052.
112,19. Естественные науки, 7 класс, принято в 2017 г.
(а) Введение.
(1) Естественные науки в 7 классе имеют междисциплинарный характер;
тем не менее, большая часть контента сосредоточена на организмах и окружающей среде.
Национальные стандарты в науке организованы в виде многоуровневых блоков, таких как
5-8 классы, а не отдельные классы.Чтобы следить за оценкой
формат уровня, используемый в Техасе, различные национальные стандарты можно найти среди
6, 7 и 8 классы. Повторяющиеся темы широко распространены в науках, математике,
и технологии. Эти идеи выходят за рамки дисциплинарных ограничений и включают:
изменение и постоянство, закономерности, циклы, системы, модели и масштаб.
Пряди для класса 7 включают следующее.
(A) Научное исследование и рассуждения.
(i) Развивать глубокие познания в науке и естественных
мира, студенты должны познакомиться с различными способами научного
расследование, правила доказательства, способы формулирования вопросов, способы предложения
объяснения, и различные способы, которыми ученые изучают мир природы и
предлагать объяснения, основанные на доказательствах, полученных в результате их работы.
(ii) Научные исследования проводятся для различных
причины. Все исследования требуют исследовательского вопроса, внимательных наблюдений,
сбор данных и анализ данных для выявления закономерностей, которые будут
объясните результаты. Описательные исследования используются для изучения новых
такие явления, как исследования организмов или измерение абиотических
компоненты в данной среде обитания. Описательная статистика включает частоту, диапазон,
среднее, медиана и мода.Гипотеза не требуется в описательной
изучение. С другой стороны, когда условия можно контролировать, чтобы
сосредоточиться на одной переменной, экспериментальный план исследования используется для определения
причинно-следственная связь. Студенты должны пройти оба типа исследований и
понимать, что разные вопросы научных исследований требуют разных
исследовательские проекты.
(iii) Научные исследования используются для изучения
Натуральный мир.Студенты должны понимать, что некоторые типы вопросов могут
получить ответы на вопросы исследований, а также построенных методов, моделей и выводов.
результаты этих исследований меняются по мере появления новых наблюдений. Модели
объекты и события являются инструментами для понимания мира природы и могут показать
как работают системы. Модели имеют ограничения и основаны на новых открытиях.
постоянно модифицируется, чтобы более точно отражать мир природы.
(B) Материя и энергия.Материя и энергия сохраняются
во всех живых системах. Лучистая энергия Солнца движет большую часть потока
энергии во всех живых системах за счет процесса фотосинтеза в
организмы, описанные как продуценты. Таким образом, большинство потребителей зависят от производителей.
удовлетворить их потребности в энергии. Последующие классы узнают о
различия на молекулярном и атомном уровне.
(C) Сила, движение и энергия. Сила, движение и
энергия наблюдается в живых системах и окружающей среде по-разному.Взаимодействие между мышечной и скелетной системами позволяет организму применять
силы и трансформируют энергию как внутренне, так и внешне. Сила и движение
может также описать направление и рост проростков, тургорное давление и
геотропизм. Катастрофические явления погодных систем, такие как ураганы, наводнения,
и торнадо могут формировать и реструктурировать окружающую среду за счет силы и
движение очевидно в них. Выветривание, эрозия и осаждение происходят в
окружающей среде из-за сил тяжести, ветра, льда и воды.
(D) Земля и космос. Земные и космические явления могут быть
наблюдается в различных условиях. Как природные явления, так и деятельность человека могут
воздействие на земные системы. Есть характеристики Земли и отношения к
объекты в нашей солнечной системе, которые позволяют жизни существовать.
(E) Организмы и окружающая среда.
(i) Студенты поймут взаимосвязь между живыми
организмы и их среда. Разные среды поддерживают разные
живые организмы, адаптированные к этому региону Земли.Организмы живые
системы, которые поддерживают устойчивое состояние с этой средой и баланс которых
может нарушаться внутренними и внешними раздражителями. К внешним раздражителям относятся:
деятельность человека или окружающая среда. Успешные организмы могут восстановить
балансировать с помощью различных процессов, таких как механизм обратной связи. Экологический
преемственность можно увидеть в широком или малом масштабе.
(ii) Студенты узнают, что все организмы получают энергию, избавляются от нее.
отходов, расти и воспроизводиться.Как при половом, так и при бесполом размножении,
черты характера передаются следующему поколению. Эти черты содержатся в
генетический материал, который находится в генах в хромосоме от родителя.
Изменения в чертах иногда происходят в популяции на протяжении многих поколений. Один из
изменения могут происходить в процессе естественного отбора.
Студенты расширяют свое понимание структур живых систем с
предыдущий акцент на внешних структурах для понимания внутренних
структуры и функции в живых существах.
(iii) Все живые организмы состоят из более мелких единиц
называется ячейками. Все клетки используют энергию, избавляются от отходов и содержат генетические
материал. Студенты сравнят клетки растений и животных и поймут
внутренние структуры внутри них, которые позволяют им получать энергию, избавляться от отходов,
растут и размножаются по-разному. Клетки могут организовываться в ткани, ткани
в органы и органы в системы органов. Студенты изучат основные
функции систем человеческого тела, такие как способность покровной системы
для защиты от инфекций, травм и ультрафиолетового (УФ) излучения; регулировать
температура тела; и удалить отходы.
(2) Наука, как определено Национальной академией
Наук, это «использование свидетельств для построения проверяемых объяснений и
предсказания природных явлений, а также знания, полученные благодаря
этот процесс ». Это огромное количество изменяющихся и возрастающих знаний
описывается физическими, математическими и концептуальными моделями. Студенты должны
знайте, что некоторые вопросы выходят за рамки науки, потому что они касаются
с явлениями, которые не поддаются научной проверке.
(3) Научные гипотезы предварительные и проверяемые.
утверждения, которые должны поддерживаться или не поддерживаться
данные наблюдений. Гипотезы устойчивой объяснительной силы, которые были
Проверенные в самых разных условиях становятся теориями. Научные теории
основаны на природных и физических явлениях и могут быть проверены
несколько независимых исследователей. Студенты должны знать, что научные
теории, в отличие от гипотез, хорошо обоснованы и очень надежны, но они
все еще могут быть изменены, поскольку новая информация и технологии
развитый.Студенты должны уметь различать научные
методы принятия решений и этические / социальные решения, которые включают
применение научной информации.
(4) Заявления, содержащие слово «включая»
справочный контент, который необходимо освоить, а те, которые содержат фразу
«такие как» предназначены в качестве возможных иллюстративных примеров.
(b) Знания и навыки.
(1) Научные исследования и рассуждения.Студент,
не менее 40% учебного времени проводит лабораторные и полевые
расследования в соответствии с процедурами безопасности и экологически приемлемыми и
этические практики. Ожидается:
студентов
(A) демонстрируют безопасные методы работы в лаборатории и
полевые исследования, как указано в утвержденной Техасским образовательным агентством безопасности
стандарты; и
(B) практиковать надлежащее использование и сохранение
ресурсы, включая утилизацию, повторное использование или переработку материалов.
(2) Научные исследования и рассуждения. Студент
использует научные методы при лабораторных и полевых исследованиях. В
ожидается:
студентов
(A) план и реализация сравнительного и описательного
расследования, делая наблюдения, задавая четко определенные вопросы и используя
соответствующее оборудование и технологии;
(B) разработать и провести экспериментальные исследования
делать наблюдения, задавать четко определенные вопросы, формулировать проверяемые
гипотезы и использование соответствующего оборудования и технологий;
(C) собирать и записывать данные с помощью Международного
Система единиц (СИ) и качественные средства, такие как маркированные чертежи, письменность,
и графические органайзеры;
(D) построить таблицы и графики, используя повторные испытания
и средства для организации данных и выявления закономерностей; и
(E) анализировать данные для формулирования разумных объяснений,
сообщать достоверные выводы, подкрепленные данными, и прогнозировать тенденции.
(3) Научные исследования и рассуждения. Студент
использует критическое мышление, научные рассуждения и решение проблем, чтобы
информированные решения и знает вклад соответствующих ученых. В
ожидается:
студентов
(A) анализировать, оценивать и критиковать научные
объяснения с использованием эмпирических данных, логических рассуждений и экспериментальных
и тестирование с наблюдением, чтобы стимулировать критическое мышление учащегося;
(B) использовать модели для представления аспектов естественного
мир, такой как системы человеческого тела и клетки растений и животных;
(C) идентифицируют преимущества и ограничения моделей, таких
как размер, масштаб, свойства и материалы; и
(D) относятся к влиянию исследований на научную мысль.
и общество, включая историю науки и вклад ученых
что касается содержания.
(4) Научные исследования и рассуждения. Студент знает
как использовать различные инструменты и оборудование для обеспечения безопасности для проведения научных исследований.
Ожидается:
студентов
(A) использовать соответствующие инструменты, в том числе науки о жизни
модели, ручные линзы, стереоскопы, микроскопы, мензурки, чашки Петри,
предметные стекла для микроскопов, градуированные цилиндры, пробирки, измерительные стержни, метрические
линейки, метрические рулетки, таймеры, плиты, весы,
термометры, калькуляторы, наборы для проверки воды, компьютеры, температура и pH
зонды, сети для сбора насекомых, ловушки для насекомых, глобусы, цифровые фотоаппараты,
журналы / записные книжки и другое необходимое оборудование для сбора, записи и
анализировать информацию; и
(B) использовать средства профилактической безопасности, в том числе
защитные очки, фартуки и перчатки, защищающие от брызг химикатов, и будьте готовы к чрезвычайным ситуациям.
защитное снаряжение, в том числе средство для мытья глаз / лица, противопожарное одеяло и огонь
огнетушитель.
(5) Материя и энергия. Студент знает, что взаимодействия
происходят между материей и энергией. Ожидается:
студентов
(A) признают, что лучистая энергия Солнца
превращается в химическую энергию в процессе фотосинтеза; и
(B) диаграмма потока энергии через живые системы,
включая пищевые цепи, пищевые сети и энергетические пирамиды.
(6) Материя и энергия. Студент знает, что дело
физические и химические свойства и могут претерпевать физические и химические изменения.Ожидается
студентов.
различают физические и химические изменения в
иметь значение.
(7) Сила, движение и энергия. Студент знает, что
существует связь между силой, движением и энергией. Студент
ожидается:
(A) иллюстрируют преобразование энергии в
организм, например, переход от химической энергии к тепловой энергии; и
(B) демонстрируют и иллюстрируют силы, влияющие на
движение в организмах, например, всходы всходов, тургорное давление,
геотропизм и кровообращение.
(8) Земля и космос. Студент знает, что природные явления
и деятельность человека может повлиять на системы Земли. Ожидается:
студентов
(A) предсказывать и описывать, как катастрофические события
как наводнения, ураганы или торнадо воздействуют на экосистемы;
(B) анализирует эффекты выветривания, эрозии и
осаждение на окружающую среду в экорегионах Техаса; и
(C) модель воздействия человеческой деятельности на подземные воды
и поверхностные воды в водоразделе.
(9) Земля и космос. Студент знает компоненты нашего
Солнечная система. Ожидается:
студентов
(A) анализирует характеристики объектов в нашей солнечной
система, которая позволяет жизни существовать, например, близость Солнца, присутствие
вода и состав атмосферы; и
(B) идентифицируют помещения, учитывая
характеристики нашей Солнечной системы, позволившие осуществить пилотируемые исследования космоса.
(10) Организмы и окружающая среда.Студент знает, что
существует связь между организмами и окружающей средой. Студент
ожидается:
(A) наблюдать и описывать, как разные среды,
включая микробытовые среды на школьных дворах и в биомах, поддерживают различные сорта
организмов;
(B) описывают, как биоразнообразие способствует
устойчивость экосистемы; и
(C) наблюдать, записывать и описывать роль
экологическая сукцессия, например, в микрогороде сада с сорняками.
(11) Организмы и окружающая среда. Студент знает, что
популяции и виды демонстрируют изменчивость и наследуют многие из своих уникальных
черты характера через постепенные процессы на протяжении многих поколений. Ожидается студент
к:
(A) исследует организмы или их структуры, такие как
насекомые или листья и использовать дихотомические ключи для идентификации;
(B) объясняют вариации внутри популяции или вида
сравнение внешних характеристик, поведения или физиологии организмов, которые улучшают
их выживание, такое как миграция, спячка или хранение пищи в луковице;
и
(C) идентифицируют некоторые изменения генетических признаков, которые
происходили на протяжении нескольких поколений в результате естественного отбора и селективного отбора.
разведение, например, галапагосский средний наземный вьюрок ( Geospiza fortis ) или
домашние животные и гибридные растения.
(12) Организмы и окружающая среда. Студент знает, что
живые системы на всех уровнях организации демонстрируют дополнительные
характер структуры и функции. Ожидается:
студентов
(A) исследует и объясняет, как внутренние структуры
У организмов есть адаптации, которые позволяют выполнять определенные функции, такие как жабры у рыб,
полые кости у птиц или ксилема у растений;
(B) определяют основные функции систем
человеческий организм, в том числе кровеносный, респираторный, скелетный, мышечный,
пищеварительный, выделительный, репродуктивный, покровный, нервный и эндокринный
системы;
(C) распознает уровни организации на заводах и
животные, включая клетки, ткани, органы, системы органов и организмы;
(D) различают структуру и функцию в
Органеллы клеток растений и животных, включая клеточную мембрану, клеточную стенку, ядро,
цитоплазма, митохондрия, хлоропласт и вакуоль;
(E) сравнивают функции клеточных органелл с
функции системы органов; и
(F) распознают компоненты клеточной теории.
(13) Организмы и окружающая среда. Студент знает, что
живой организм должен уметь поддерживать равновесие в стабильных внутренних условиях
в ответ на внешние и внутренние раздражители. Ожидается:
студентов
(A) исследует, как организмы реагируют на внешние
раздражители, обнаруживаемые в окружающей среде, такие как фототропизм и борьба или бегство; и
(B) описывает и связывает реакции организмов, которые могут
результат внутренних раздражителей, таких как увядание растений и лихорадка или рвота
животные, которые позволяют им сохранять равновесие.
(14) Организмы и окружающая среда. Студент знает, что
размножение — это характеристика живых организмов, и инструкции
поскольку черты регулируются генетическим материалом. Ожидается:
студентов
(A) определяет наследственность как передачу генетических
инструкции от одного поколения к следующему поколению;
(B) сравнить результаты однообразного или разнообразного потомства
от бесполого или полового размножения; и
(C) признают, что унаследованные черты индивидуума
регулируется генетическим материалом, обнаруженным в генах в хромосомах в
ядро.
Источник: Положения настоящего §112.19 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 27 августа,
2018, 42 TexReg 5052.
112,20. Естественные науки, 8 класс, принято в 2017 г.
(а) Введение.
(1) Естественные науки в 8 классе имеют междисциплинарный характер;
тем не менее, большая часть контента посвящена науке о Земле и космосе. Национальный
стандарты по естествознанию организованы в виде многоуровневых блоков, например 5-8 классы.
а не отдельные классы.Чтобы следовать формату уровня обучения
используются в Техасе, различные национальные стандарты находятся среди классов 6, 7 и
8. Повторяющиеся темы широко используются в науках, математике и технологиях.
Эти идеи выходят за рамки дисциплинарных ограничений и включают изменение и постоянство,
паттерны, циклы, системы, модели и масштаб.
Пряди для 8-го класса включают следующее.
(A) Научное исследование и рассуждения.
(i) Развивать глубокие познания в науке и естественных
мира, студенты должны познакомиться с различными способами научного
расследование, правила доказательства, способы формулирования вопросов, способы предложения
объяснения, и различные способы, которыми ученые изучают мир природы и
предлагать объяснения, основанные на доказательствах, полученных в результате их работы.
(ii) Научные исследования проводятся для различных
причины. Все исследования требуют исследовательского вопроса, внимательных наблюдений,
сбор данных и анализ данных для выявления закономерностей, которые будут
объясните результаты. Описательные исследования используются для изучения новых
такие явления, как исследования организмов или измерение абиотических
компоненты в данной среде обитания. Описательная статистика включает частоту, диапазон,
среднее, медиана и мода.Гипотеза не требуется в описательной
изучение. С другой стороны, когда условия можно контролировать, чтобы
сосредоточиться на одной переменной, экспериментальный план исследования используется для определения
причинно-следственная связь. Студенты должны пройти оба типа исследований и
понимать, что разные вопросы научных исследований требуют разных
исследовательские проекты.
(iii) Научные исследования используются для изучения
Натуральный мир.Студенты должны понимать, что некоторые типы вопросов могут
получить ответы на вопросы исследований, а также построенных методов, моделей и выводов.
результаты этих исследований меняются по мере появления новых наблюдений. Модели
объекты и события являются инструментами для понимания мира природы и могут показать, как
системы работают. Модели имеют ограничения и основаны на новых открытиях.
постоянно модифицируется, чтобы более точно отражать мир природы.
(B) Материя и энергия.Студенты осознают это
состоит из атомов. Студенты изучают информацию о Периодической таблице, чтобы
признать, что элементы сгруппированы в семейства. Кроме того, студенты
понять основную концепцию сохранения массы. Лабораторная деятельность позволит
студенты, чтобы продемонстрировать доказательства химических реакций. Они будут использовать химические
формулы для определения веществ.
(C) Сила, движение и энергия. Студенты экспериментируют с
отношения между силами и движением посредством изучения трех Ньютоновских
законы.Студенты узнают, как эти силы связаны с геологическими процессами и
астрономические явления. Кроме того, студенты признают, что эти законы
проявляется в повседневных предметах и деятельности. Математика используется для расчета
скорость с использованием измерений расстояния и времени.
(D) Земля и космос. Студенты определяют роль
природные явления в изменении систем Земли. Циклы внутри Солнца, Земли и Луны
системы изучаются по мере того, как студенты узнают о сезонах, приливах и лунных фазах.Студенты узнают, что звезды и галактики являются частью Вселенной. Кроме того,
студенты используют данные для исследования научных теорий происхождения
Вселенная. Студенты продемонстрируют, как объекты Земли меняются со временем, на пластинах.
тектоника. Они будут интерпретировать особенности земли и эрозии на топографических картах.
и спутниковые снимки. Студенты узнают, как взаимодействуют солнечные, погодные и
океанские системы вызывают изменения в погодных условиях и климате.
(E) Организмы и окружающая среда.В исследованиях жизни
системы, студенты исследуют взаимозависимость между этими системами. Студенты
описать, как биотические и абиотические факторы влияют на количество организмов и
популяции, присутствующие в экосистеме. Кроме того, студенты узнают, как
организмы и их популяции реагируют на краткосрочные и долгосрочные экологические
изменения, в том числе вызванные деятельностью человека.
(2) Наука, как определено Национальной академией
Наук, это «использование свидетельств для построения проверяемых объяснений и
предсказания природных явлений, а также знания, полученные благодаря
этот процесс.»Это огромное количество изменяющихся и растущих знаний
описывается физическими, математическими и концептуальными моделями. Студенты должны
знайте, что некоторые вопросы выходят за рамки науки, потому что они касаются
с явлениями, которые не поддаются научной проверке.
(3) Научные гипотезы предварительные и проверяемые.
утверждения, которые должны поддерживаться или не поддерживаться
данные наблюдений. Гипотезы устойчивой объяснительной силы, которые были
Проверенные в самых разных условиях становятся теориями.Научные теории
основаны на природных и физических явлениях и могут быть проверены
несколько независимых исследователей. Студенты должны знать, что научные
теории, в отличие от гипотез, хорошо обоснованы и очень надежны, но они
все еще могут быть изменены, поскольку новая информация и технологии
развитый. Студенты должны уметь различать научные
методы принятия решений и этические / социальные решения, которые включают
применение научной информации.
(4) Заявления, содержащие слово «включая»
справочный контент, который необходимо освоить, а те, которые содержат фразу
«такие как» предназначены в качестве возможных иллюстративных примеров.
(b) Знания и навыки.
(1) Научные исследования и рассуждения. Студент,
не менее 40% учебного времени проводит лабораторные и полевые
расследования в соответствии с процедурами безопасности и экологически приемлемыми и
этические практики.Ожидается:
студентов
(A) демонстрируют безопасные методы работы в лаборатории и
полевые исследования, как указано в утвержденной Техасским образовательным агентством безопасности
стандарты; и
(B) практиковать надлежащее использование и сохранение
ресурсы, включая утилизацию, повторное использование или переработку материалов.
(2) Научные исследования и рассуждения. Студент
использует научные методы при лабораторных и полевых исследованиях. В
ожидается:
студентов
(A) план и реализация сравнительного и описательного
расследования, делая наблюдения, задавая четко определенные вопросы и используя
соответствующее оборудование и технологии;
(B) разработать и провести экспериментальные исследования
делать наблюдения, задавать четко определенные вопросы, формулировать проверяемые
гипотезы и использование соответствующего оборудования и технологий;
(C) собирать и записывать данные с помощью Международного
Система единиц (СИ) и качественные средства, такие как маркированные чертежи, письменность,
и графические органайзеры;
(D) построить таблицы и графики, используя повторные испытания
и средства для организации данных и выявления закономерностей; и
(E) анализировать данные для формулирования разумных объяснений,
сообщать достоверные выводы, подкрепленные данными, и прогнозировать тенденции.
(3) Научные исследования и рассуждения. Студент
использует критическое мышление, научные рассуждения и решение проблем, чтобы
информированные решения и знает вклад соответствующих ученых. В
ожидается:
студентов
(A) анализировать, оценивать и критиковать научные
объяснения с использованием эмпирических данных, логических рассуждений и экспериментальных
и тестирование с наблюдением, чтобы стимулировать критическое мышление учащегося;
(B) использовать модели для представления аспектов естественного
мир, такой как атом, молекула, пространство или геологический объект;
(C) идентифицируют преимущества и ограничения моделей, таких
как размер, масштаб, свойства и материалы; и
(D) относятся к влиянию исследований на научную мысль.
и общество, включая историю науки и вклад ученых
что касается содержания.
(4) Научные исследования и рассуждения. Студент
знает, как использовать различные инструменты и оборудование для обеспечения безопасности для проведения научных исследований
расследование. Ожидается:
студентов
(A) используйте соответствующие инструменты, включая лабораторные журналы / записные книжки,
мензурки, измерительные стержни, градуированные цилиндры, анемометры, психрометры, горячие
тарелки, пробирки, пружинные весы, весы, микроскопы, термометры,
калькуляторы, компьютеры, спектроскопы, приборы для измерения времени и другое необходимое
оборудование для сбора, записи и анализа информации; и
(B) использовать средства профилактической безопасности, в том числе
защитные очки, фартуки и перчатки, защищающие от брызг химикатов, и будьте готовы к чрезвычайным ситуациям.
защитное снаряжение, в том числе средство для мытья глаз / лица, противопожарное одеяло и огонь
огнетушитель.
(5) Материя и энергия. Студент знает, что дело в том,
состоит из атомов и обладает химическими и физическими свойствами. Студент
ожидается:
(A) описывают структуру атомов, включая
массы, электрические заряды и расположение протонов и нейтронов в
ядро и электроны в электронном облаке;
(B) идентифицируют, что протоны определяют
тождественные и валентные электроны определяют его химические свойства, в том числе
реактивность;
(C) интерпретировать расположение Периодической таблицы,
включая группы и точки, чтобы объяснить, как свойства используются для классификации
элементы;
(D) признают, что химические формулы используются для
идентифицировать вещества и определять количество атомов каждого элемента в
химические формулы, содержащие индексы; и
(E) исследовать, как доказательства химических реакций
указывает на то, что образуются новые вещества с другими свойствами и как это
относится к закону сохранения массы.
(6) Сила, движение и энергия. Студент знает, что
существует связь между силой, движением и энергией. Студент
ожидается:
(A) продемонстрируйте и рассчитайте, как неуравновешенные силы
изменить скорость или направление движения объекта;
(B) различают скорость, скорость и
ускорение; и
(C) исследовать и описывать приложения Ньютона
три закона движения, такие как автомобильные удерживающие устройства, спортивные мероприятия,
аттракционы, тектоническая активность Земли и запуски ракет.
(7) Земля и космос. Студент знает эффекты
в результате циклических движений Солнца, Земли и Луны. Студент
ожидается:
(A) и проиллюстрируйте, как наклоненная Земля вращается.
на своей оси, вызывая день и ночь, и вращается вокруг Солнца, вызывая
смены сезонов;
(B) демонстрирует и предсказывает последовательность событий в
лунный цикл; и
(C) соотносят положения Луны и Солнца с их
влияние на океанские приливы.
(8) Земля и космос. Студент знает характеристики
Вселенная. Ожидается:
студентов
(A) описывает компоненты вселенной, в том числе
звезды, туманности и галактики, и используйте такие модели, как модель Герцшпрунга-Рассела.
схема для классификации;
(B) признать, что Солнце — звезда среднего размера.
расположен в спиральном рукаве галактики Млечный Путь и что Солнце много
в тысячи раз ближе к Земле, чем любая другая звезда;
(C) определить, как разные длины волн
электромагнитный спектр, такой как видимый свет и радиоволны, используются для получения
информация о компонентах вселенной; и
(D) исследование того, как научные данные используются в качестве доказательства
разработать научные теории для описания происхождения Вселенной.
(9) Земля и космос. Студент знает, что природные явления
может повлиять на земные системы. Ожидается:
студентов
(A) описать историческое развитие свидетельств
что поддерживает теорию тектоники плит;
(B) связывает тектонику плит с формированием земной коры.
Особенности; и
(C) интерпретировать топографические карты и спутниковые снимки для
определить особенности земли и эрозии и спрогнозировать, как эти особенности могут быть
видоизменился под воздействием погодных условий.
(10) Земля и космос. Студент знает, что климатическая
существует взаимодействие между Землей, океаном и погодными системами. Студент
ожидается:
(A) признают, что Солнце обеспечивает энергию, которая
вызывает конвекцию в атмосфере и океанах, вызывая ветры;
(B) определить, как глобальные модели атмосферного
движение влияет на местную погоду, используя погодные карты, которые показывают высокие и низкие
давления и фронты; и
(C) определить роль океанов в формировании
погодные системы, такие как ураганы.
(11) Организмы и окружающая среда. Студент знает, что
взаимозависимость между живыми системами и окружающей средой, и человечество
деятельность может повлиять на эти системы. Ожидается:
студентов
(A) исследует, как организмы и популяции в
экосистема зависит от биотических факторов, таких как пищевые и абиотические, и может конкурировать за них.
такие факторы, как количество света, воды, диапазон температур или почва
состав;
(B) изучить, как краткосрочные и долгосрочные экологические
изменения влияют на организмы и признаки в последующих популяциях; и
(C) признают зависимость человека от океанических систем и
объясните, как деятельность человека, такая как сток, искусственные рифы или использование
ресурсы изменили эти системы.
Источник: Положения настоящего §112.20 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 27 августа,
2018, 42 TexReg 5052.
Для
дополнительная информация, электронная почта [email protected].
.

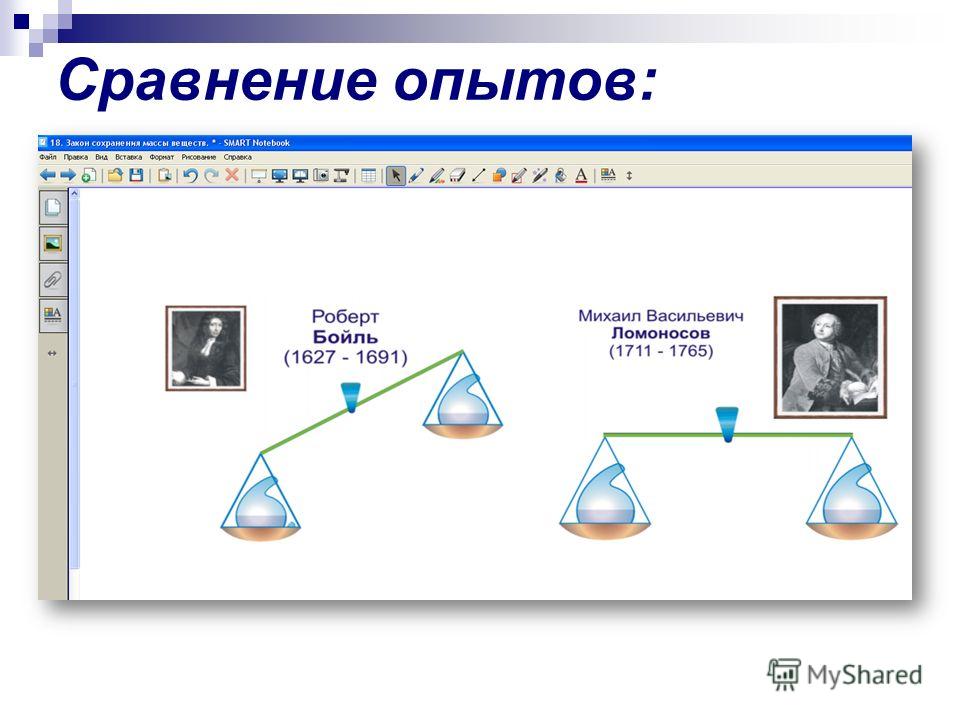 ) эквивалента,
) эквивалента, =34
=34