Содержание
ICSC 1429 — ПОЛИАКРИЛОВАЯ КИСЛОТА, НАТРИЕВАЯ СОЛЬ
ICSC 1429 — ПОЛИАКРИЛОВАЯ КИСЛОТА, НАТРИЕВАЯ СОЛЬ
| ПОЛИАКРИЛОВАЯ КИСЛОТА, НАТРИЕВАЯ СОЛЬ | ICSC: 1429 |
| Апрель 2008 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. | НЕ использовать открытый огонь. Не допускать оседания пыли. | Использовать порошок, спиртоустойчивую пену, большое количество воды, двуокись углерода. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. |
| Кожа | Защитные перчатки. | Снять загрязненную одежду. | |
| Глаза | Покраснение. | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН
ОСТОРОЖНО
Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от окислителей.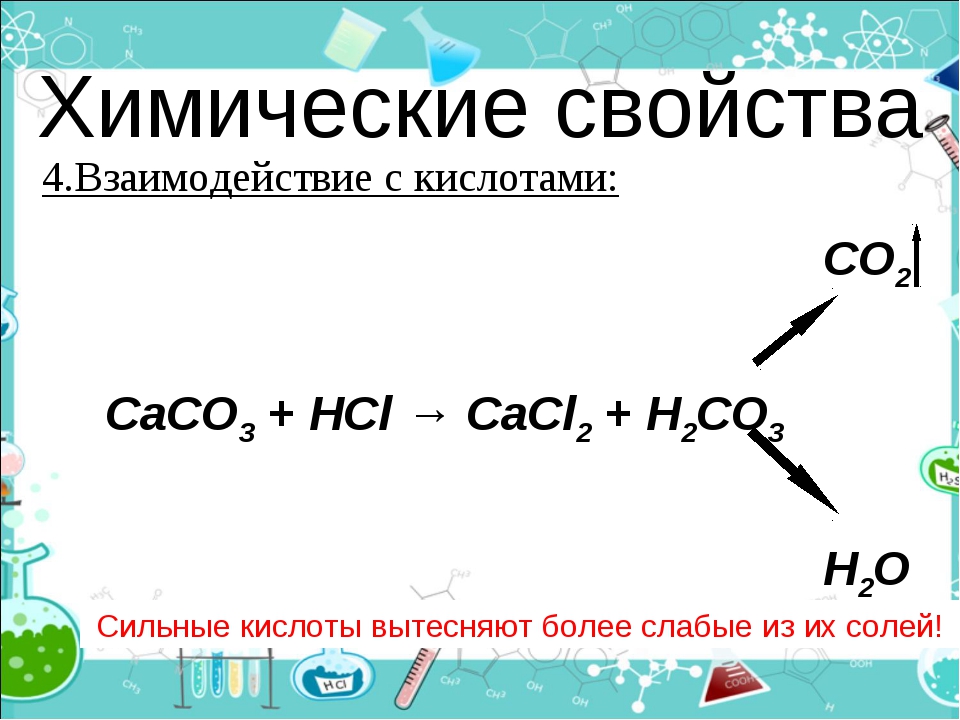 | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ПОЛИАКРИЛОВАЯ КИСЛОТА, НАТРИЕВАЯ СОЛЬ | ICSC: 1429 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: (C3H3O2)n·Na |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| The substance is combustible but no flash point is available in literature. Properties may vary with the molecular weight. Physical properties are for the acid form of the polymer. The recommendations on this Card also apply to (polyacrylic acid, CAS# 9003-01-4). |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена…
Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена между солями. Практическое значение солей
(хлорида натрия, карбонатов натрия, калия и кальция).
ПЛАН ОТВЕТА:
- Определение
- Химические свойства:
a) Взаимодействие с кислотами,
b) Взаимодействие со щелочами,
c) Взаимодействие с металлами,
d) Взаимодействие с солями.
- Практическое значение:
a) Хлорида натрия,
b) Карбоната натрия,
c) Карбоната калия,
d) Карбоната кальция.
Соли – это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl ® Na+ + Cl— K2SO4 ® 2K+ + SO42- Mg(NO3)2 ® Mg2+ + 2NO3—
Общие химические свойства солей характеризуются их взаимодействием с кислотами, щелочами, металлами и солями.
- Соли взаимодействуют с кислотами, если образуется:
a) летучая кислота: CaCO3 + 2HCl = CaCl2 + H2O + CO2, CaCO3 + 2H+ = Ca2+ + H2O + CO2;
b) нерастворимая кислота: Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3?, SiO32- + 2H+ = H2SiO3;
c) соль, нерастворимая в воде и образующейся кислоте:
AgNO3 + HCl = AgCl? + HNO3, Ag+ + Cl— = AgCl.
- Растворимые соли взаимодействуют со щелочами, если одно из образующихся веществ выпадает в осадок: CuSO4 + 2NaOH = Cu(OH)2? + Na2SO4 Cu2+ + 2OH— = Cu(OH)2,
Na2SO4 + Ba(OH)2 = BaSO4? + 2NaOH SO42- + Ba2+ = BaSO4
- Более активные металлы вытесняют менее активные металлы из растворов их солей, за исключением металлов, реагирующих с водой: CuSO4 + Zn = ZnSO4 + Cu
Cu + ZnSO4 = —————
!!! При взаимодействии растворов солей со щелочными металлами образуется новая соль, нерастворимое основание и водород, т.к. в реакции участвует вода из раствора:
Na + CuSO4 + H2О = …………………..
2Na + 2H2O = 2NaOH + H2
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
————————————————-
2Na + CuSO4 + 2H2O = H2 + Cu(OH)2? + Na2SO4
- Растворы солей реагируют между собой, если происходит связывание ионов.

Если связывания ионов не происходит, то говорят, что реакция идёт не до конца:
CuSO4 + BaCl2 = CuCl2 + BaSO4 SO42- + Ba2+ = BaSO4?
есть связывание ионов, реакция идёт до конца.
K2SO4 + 2NaCl = Na2SO4 + 2KCl
2K+ + SO42- + 2Na+ + 2Cl— = 2Na+ + SO42- + 2K+ + 2Cl—
нет связывания ионов, реакция идёт не до конца.
Многие соли имеют большое практическое значение. Например, хлорид натрия NaCl или поваренная соль, каменная соль, пищевая соль – ценнейшее химическое сырьё. Его используют при получении соды, хлороводорода. При электролизе водного раствора хлорида натрия получают гидроксид натрия, хлор и, попутно, водород, а при электролизе расплава хлорида натрия получают металлический натрий и хлор. Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу. В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу. В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Карбонат натрия Na2CO3 или кальцинированная сода, сода, стиральная сода. Его применяют при производстве стекла, мыла и моющих средств, при варке целлюлозы, как нейтрализующее вещество при обработке кислых растворов.
Карбонат калия, K2CO3 поташ применяют при варке оптического стекла, жидкого мыла, минеральных красок, получении многих соединений калия.
Карбонат кальция CaCO3 – распространённое в природе вещество: минерал кальцит, горная порода известняк и его разновидности – мел, мрамор, туф. Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.
Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.
12. Химические свойства солей (средних).
Тема № 12.
Рекомендуемые видеоуроки
Теоретические сведения
1. Взаимодействие соли с металлами
2AgNO3 + Ca = Ca(NO3)2 + 2Ag
2. Взаимодействие солей с основаниями
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
3. Взаимодействие солей с кислотами
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
4. Взаимодействие двух солей
AgNO3 + NaCl = AgCl + NaNO3
5. Термическое разложение солей
Многие соли устойчивы при нагревании, однако, соли аммония, некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
6. Реакции разложения
При разложении карбонатов образуются оксид металла и углекислый газ:
CaCO3 = CaO + CO2
Если оксид металла неустойчив, то карбонат разлагается на металл, углекислый газ и кислород:
2Ag2CO3 = 4Ag + 2CO2 + O2
Соли аммония разлагаются с выделением аммиака:
NH4Cl = NH3 + HCl
Исключение составляют нитрат и нитрит аммония:
NH4NO3 = N2O + 2H2O
NH4NO2 = N2 + 2H2O
Разложение нитратов металлов
Нитраты щелочных металлов разлагаются с образованием нитрита металла и кислорода:
2NaNO3 = 2NaNO2 + O2
Нитраты металлов, стоящих в ряду напряжений металлов между водородом и алюминием, разлагаются с образованием оксида металла, оксида азота (IV) и кислорода:
2Fe(NO3)2 = 2FeO + 4NO2 + O2
Нитраты малоактивных металлов, стоящих в ряду напряжений после водорода (за исключением нитрата меди (II)), разлагаются с образованием металла, оксида азота (IV) и кислорода:
2AgNO3 = 2Ag + 2NO2 + O2
Интернет-источники
Трилон Б — тетранатриевая соль
Трилон Б представляет собой белый кристаллический порошок или кристаллы белого цвета, хорошо растворимые в воде, очень малорастворимые в спирте.
Растворимость в воде при температуре 20°С составляет 100 г/л, при температуре 80°С – 230 г/л.
| Синонимы | тетранатриевая соль этилендиамин-N, N, N,N –тетрауксусной кислоты 4-водная, соль тетранатриевая этилендиамин-N,N,N’,N’-тетрауксусной кислоты, эдта-натрий, этилендинитрилотетрауксусной кислоты, тетранатриевая соль, 4Na-ЭДТУК |
| Международное название | EDTA- 4Na |
| CAS № | 13236-36-4 |
| Производство | Китай |
| Упаковка | Мешок 25 кг |
| Химическая формула | C10H12N2O8Na4 * 4H2O |
| Класс опасности груза по ДОПОГ (ООН) | Нет |
Применение Трилон Б
Трилон Б тетранатриевая соль (4Na-ЭДТУК, EDTA- 4Na, эдта-натрий, HEDTA) используется:
- для промывки теплоэнергетического оборудования, труб, котлов;
- водоподготовки в котельных и теплосетях;
- в производстве бытовой химии и синтетических моющих средств;
- в виде стабилизатора в процессах полимеризации;
- в целлюлозно-бумажной промышленности;
- при производстве каучука;
- в реставрации для удаления следов коррозии с изделий из бронзы и других цветных металлов;
- в производстве медицинских препаратов и при отравлениях тяжелыми металлами;
- в аналитической химии;
Интересный факт.

Трилон Б (Trilon B) является торговым названием тетранатриевой соли этилендиаминтетрауксусной кислоты. Данное название введено фирмой BASF и использовалась как торговая марка для данного химреактива, но очень быстро вошло в обиход и используется другими фирмами для обозначения продукта.
Физико-химические свойства Трилон Б
| Наименование показателя | Норма | Результат анализа |
| Массовая доля 4-водной тетранатриевой соли этилендиамин-N,N,N’,N’-тетрауксусной кислоты, % | 99.0% мин | 99.50% |
| Массовая доля хлоридов (Cl–), %, не более | 0.01% макс | 0.003% |
| Массовая доля железа (Fe), %, не более | 0.001% макс | 0.0001% |
| Тяжелые металлы % | 0.001% макс | 0.0001% |
| Кислотность (1% раствор) | 10.5-11.5 | 10.96 |
| Хелатное значение(mgCaCo3/g) | 215 мин | 221 |
| Внешний Вид | Белый кристаллический порошок | |
Соли.
 Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена… на Сёзнайке.ру
Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена… на Сёзнайке.ру
Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена между солями. Практическое значение солей
(хлорида натрия, карбонатов натрия, калия и кальция).
ПЛАН ОТВЕТА:
- Определение
- Химические свойства:
a) Взаимодействие с кислотами,
b) Взаимодействие со щелочами,
c) Взаимодействие с металлами,
d) Взаимодействие с солями.
- Практическое значение:
a) Хлорида натрия,
b) Карбоната натрия,
c) Карбоната калия,
d) Карбоната кальция.
Соли – это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl ® Na+ + Cl— K2SO4 ® 2K+ + SO42- Mg(NO3)2 ® Mg2+ + 2NO3—
Общие химические свойства солей характеризуются их взаимодействием с кислотами, щелочами, металлами и солями.
- Соли взаимодействуют с кислотами, если образуется:
a) летучая кислота: CaCO3 + 2HCl = CaCl2 + H2O + CO2, CaCO3 + 2H+ = Ca2+ + H2O + CO2;
b) нерастворимая кислота: Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3?, SiO32- + 2H+ = H2SiO3;
c) соль, нерастворимая в воде и образующейся кислоте:
AgNO3 + HCl = AgCl? + HNO3, Ag+ + Cl— = AgCl.
- Растворимые соли взаимодействуют со щелочами, если одно из образующихся веществ выпадает в осадок: CuSO4 + 2NaOH = Cu(OH)2? + Na2SO4 Cu2+ + 2OH— = Cu(OH)2,
Na2SO4 + Ba(OH)2 = BaSO4? + 2NaOH SO42- + Ba2+ = BaSO4
- Более активные металлы вытесняют менее активные металлы из растворов их солей, за исключением металлов, реагирующих с водой: CuSO4 + Zn = ZnSO4 + Cu
Cu + ZnSO4 = —————
!!! При взаимодействии растворов солей со щелочными металлами образуется новая соль, нерастворимое основание и водород, т. к. в реакции участвует вода из раствора:
к. в реакции участвует вода из раствора:
Na + CuSO4 + H2О = …………………..
2Na + 2H2O = 2NaOH + H2
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
————————————————-
2Na + CuSO4 + 2H2O = H2 + Cu(OH)2? + Na2SO4
- Растворы солей реагируют между собой, если происходит связывание ионов.
Если связывания ионов не происходит, то говорят, что реакция идёт не до конца:
CuSO4 + BaCl2 = CuCl2 + BaSO4 SO42- + Ba2+ = BaSO4?
есть связывание ионов, реакция идёт до конца.
K2SO4 + 2NaCl = Na2SO4 + 2KCl
2K+ + SO42- + 2Na+ + 2Cl— = 2Na+ + SO42- + 2K+ + 2Cl—
нет связывания ионов, реакция идёт не до конца.
Многие соли имеют большое практическое значение. Например, хлорид натрия NaCl или поваренная соль, каменная соль, пищевая соль – ценнейшее химическое сырьё. Его используют при получении соды, хлороводорода. При электролизе водного раствора хлорида натрия получают гидроксид натрия, хлор и, попутно, водород, а при электролизе расплава хлорида натрия получают металлический натрий и хлор. Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу. В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Карбонат натрия Na2CO3 или кальцинированная сода, сода, стиральная сода. Его применяют при производстве стекла, мыла и моющих средств, при варке целлюлозы, как нейтрализующее вещество при обработке кислых растворов.
Карбонат калия, K2CO3 поташ применяют при варке оптического стекла, жидкого мыла, минеральных красок, получении многих соединений калия.
Карбонат кальция CaCO3 – распространённое в природе вещество: минерал кальцит, горная порода известняк и его разновидности – мел, мрамор, туф. Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.
Хлорид натрия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
свойства, описание и сфера применения, статья на сайте ООО «Руссоль-Юг»
Говоря о соли, можно часто услышать про некий минерал галит. Что это такое и как он связан с каменной солью, мы и расскажем в этой статье.
Особенности и свойства галита
Галит – это не что иное, как природный минерал, который все мы хорошо знаем. Он присутствует на каждой кухне и это обычная пищевая соль. Но если купить каменную соль и хорошо рассмотреть, перед нами окажется порошок из крупинок, чистый и белый.
В природе она встречается немного в другом виде. Это куски породы, часто с примесями, разных цветов и форм. Под ними чаще всего и понимают галит, то есть соль в необработанном виде, она же хлорид натрия.
У галита есть целый ряд особенностей:
- прозрачная или полупрозрачная поверхность;
- в зависимости от места и способа добычи имеет белесый, белый или серый цвет, но встречаются и синие, розовые, черные и даже красные минералы;
- стеклянный блеск;
- от природы галит твердый и плотный, но имеет хрупкую структуру, что облегчает его добычу и обработку;
- хорошо растворяется в воде;
- характерный ярко-выраженный соленый вкус;
- стойкость к отрицательным температурам.

В процессе обработки галит очищается от примесей, приобретает конечный потребительский вид, в котором и поступает в магазины. В зависимости от места добычи и способа обработки, различается и цена на каменную соль. Самая дорогая – соль экстра – самая мелкая, чистого белого цвета и на 99% состоящая из хлорида натрия.
Применение каменной соли
Галит – это полностью природный минерал, он обладает множеством полезных качеств и свойств. Поэтому каменная соль нашла применение во всех сферах промышленности и производства.
Больше всего ее используют в пищевой отрасли. Нет такого блюда, в которое не полагалось бы добавить хотя бы щепотку этой приправы. Используется соль для консервации – засолки и засушки рыбы и мяса, для копчения и вяления, маринования, запекания и тушения.
Благотворные свойства соли нашли применение в медицине, как в обычной, так и в народной. С ее добавлением готовят лекарственные средства и растворы для инъекций.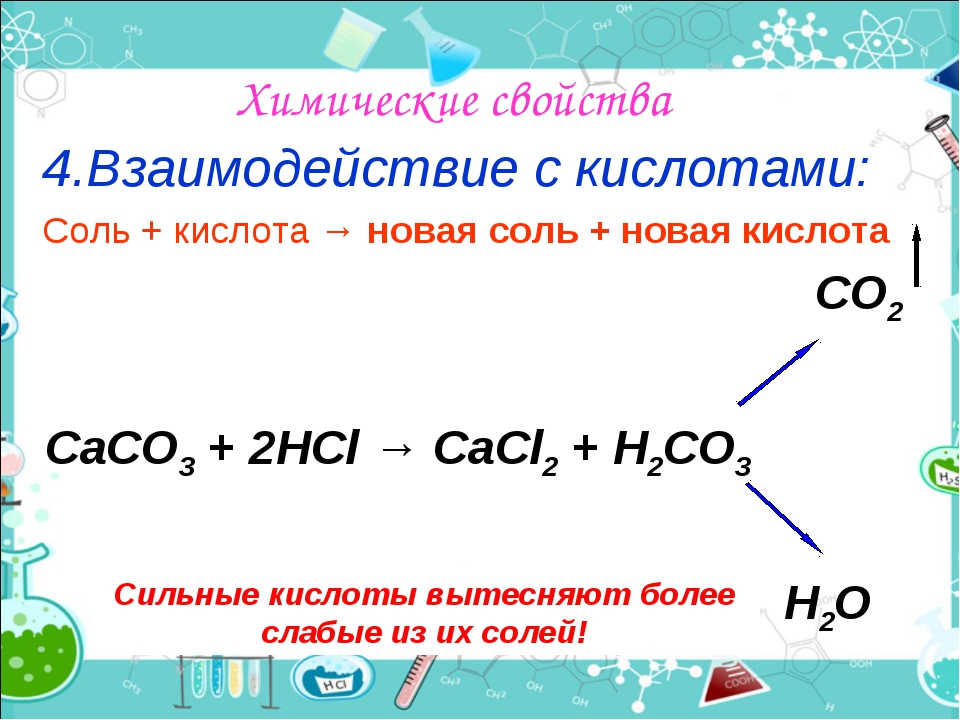 Активно применяются для лечения соляные пещеры и галокамеры. Пребывание в них укрепляет иммунитет, улучшает самочувствие, избавляет от дыхательных заболеваний, гайморитов и отитов.
Активно применяются для лечения соляные пещеры и галокамеры. Пребывание в них укрепляет иммунитет, улучшает самочувствие, избавляет от дыхательных заболеваний, гайморитов и отитов.
Разогретая соль положительно воздействует на организм. Прогревания с ней применяют для лечения суставов, артритов и артрозов. Для этого берут крупную каменную соль, прошедшую минимальную обработку, только тогда галит сохраняет природные качества и состав.
В химической промышленности из соли вырабатывают соляную кислоту, а в кожевенной отрасли задействуют в роли дубильного вещества для изготовления кожи.
Галит обладает антибактериальными свойствами, поэтому его используют для очистки воды и даже для удаления накипи.
И даже в металлургии не обойтись без соли, где она применяется в роли охладителя. А зимой на дорогах, чтобы не поскользнуться на льду, тоже насыпают соль. И это не считая декоративно-прикладного искусства, строительства, нефтедобычи, очистительных объектов.
Исходя из этого, получается, что галит – самое важное и незаменимое в современной жизни вещество.
Формула хлорида натрия — применение, свойства, структура и формула хлорида натрия
Формула и структура: Химическая формула хлорида натрия — NaCl, а его молярная масса составляет 58,44 г / моль. Это ионное соединение, состоящее из катиона натрия (Na + ) и аниона хлорида (Cl — ). Твердый NaCl имеет кристаллическую структуру, в которой каждый ион Na + окружен шестью ионами хлора в октаэдрической геометрии.
Прохождение: Хлорид натрия присутствует в морских и океанских водах, что придает им соленость.Около 1-5% морской воды состоит из хлорида натрия. Он также встречается в виде минерала галита или каменной соли.
Приготовление: Соль получают в больших количествах путем испарения морской воды или соленой воды (рассола) из соленых озер и солевых колодцев. Поскольку морская вода содержит несколько других солей (кальция, магния и других элементов), процесс испарения проводится осторожно, чтобы различные соли выпадали в осадок в разное время в зависимости от их растворимости.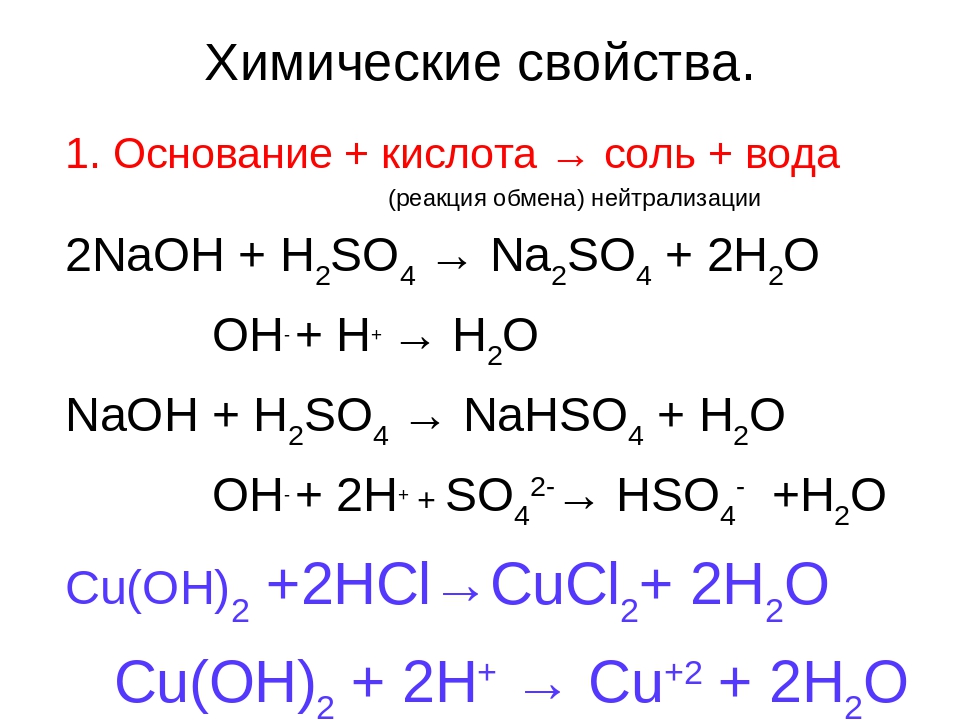 Другой важный метод производства — добыча запасов каменной соли.
Другой важный метод производства — добыча запасов каменной соли.
Физические свойства: хлорид натрия представляет собой белое кристаллическое твердое вещество с плотностью 2,16 г / мл и температурой плавления 801 ° C. Он также доступен в виде водных растворов различной концентрации, называемых солевыми растворами.
Химические свойства: Хлорид натрия легко растворяется в воде и других полярных растворителях. Это стабильное твердое тело. Он разлагается только при высоких температурах с образованием токсичных паров соляной кислоты (HCl) и оксида динатрия (Na 2 O).
Применение: Хлорид натрия, наиболее известный как поваренная соль, широко используется в пищевой промышленности для ароматизации и консервирования.Он также используется в производстве многих важных химикатов, включая гидроксид натрия, карбонат натрия, пищевую соду, соляную кислоту и т. Д. Он также применяется на нефтеперерабатывающих заводах, в текстильной, бумажной и целлюлозной промышленности, огнезащитных составах, в резиновой промышленности и т. Д. в дорожном строительстве. Еще одно важное применение — это защита от обледенения дорог и тротуаров в холодных и заснеженных регионах. Солевые растворы также используются во многих медицинских целях.
Д. в дорожном строительстве. Еще одно важное применение — это защита от обледенения дорог и тротуаров в холодных и заснеженных регионах. Солевые растворы также используются во многих медицинских целях.
Воздействие на здоровье / опасность для здоровья: В низких концентрациях хлорид натрия нетоксичен и неопасен, а также является важным источником электролитов для организма.Высокое потребление соли в течение длительного времени может вызвать дисбаланс электролитов в организме. Проглатывание в больших количествах может вызвать рвоту, тошноту, диарею и обезвоживание. Он также может раздражать глаза и вызывать повреждение глаз при высоких концентрациях.
Примечания по физическим и химическим свойствам солей
Соли — очень важные химические вещества в лаборатории, поскольку они используются в нескольких реакциях и процессах. Они также широко используются в различных отраслях.
Соли — это ионные соединения, образующиеся в результате нейтрализации кислоты и основания.
Ex: карбонат натрия, бикарбонат натрия, сульфат алюминия и калия, хлоргипохлорит кальция и хлорид аммония.
Они являются хорошими проводниками электричества в расплавленном состоянии или в водной форме.
Большинство солей растворимы в воде. Степень растворимости зависит от температуры.
Соли состоят как из катионов, так и из анионов.
Общая недвижимость
Кристаллизационная вода
Количество молекул воды, химически объединенных в определенной молекулярной пропорции с солью в кристаллическом состоянии.Соли, которые содержат определенное количество молекул воды в виде кристаллизационной воды, называются гидратированными солями.
Пример: Гипс и стиральная сода.
И наоборот, соли, не содержащие кристаллизационной воды, называются безводными солями.
Пример: безводный сульфат меди.
Deliquescence
Способность некоторых солей поглощать влагу из атмосферы, растворяться и превращаться в жидкость.
Размножение соединений происходит из-за того, что давление пара конкретной соли ниже атмосферного давления пара.И его можно уменьшить, если хранить соль в сухих условиях.
Примеры:
Хлорид кальция, хлорид магния, хлорид цинка и карбонат калия.
Гигроскопичные вещества
Некоторые соли гигроскопичны, т. Е. Обладают способностью поглощать влагу из атмосферы, не растворяясь. Пример:
Оксид кальция, силикагель и т. Д.
.
Выцветание
Частичная или полная потеря кристаллизационной воды из гидратированной соли при воздействии атмосферы.
Светящиеся вещества при потере кристаллизационной воды становятся порошкообразными.
Пример:
Пентагидрат сульфата меди или голубой камень и гептагидрат сульфата магния или соль Эпсома.
CuSO 4 .5H 2 O → CuSO 4 + 5H 2 O
MgSO 4 .7H 2 O → MgSO 4 + 7H 2 O
Соли в повседневной жизни
Хлорид натрия (NaCl)
Он образуется при реакции гидроксида натрия с хлористым водородом.
Это белое кристаллическое твердое вещество с высокими температурами плавления и кипения.
Трудно растворим в воде /
Используется для консервирования солений, рыбы и мяса.
Используется для таяния льда, образующегося на дорогах в холодных странах, а
Используется как сырье для производства других соединений.
Также используется для производства мыла.
Карбонат натрия (Na 2 CO 3 )
Карбонат натрия или стиральная сода или кальцинированная сода представляет собой натриевую соль угольной кислоты.
Добавление воды к карбонату натрия и охлаждение смеси с образованием декагидратированного карбоната натрия.
Na 2 CO 3 + 10 H 2 O → Na 2 CO 3 . 10H 2 O
В кристаллическом состоянии он содержит десять молекул кристаллизационной воды.
Его получают путем пропускания газообразного диоксида углерода в концентрированный раствор гидроксида натрия.
Это белое кристаллическое твердое вещество, обычная форма которого — декагидрат.При контакте с воздухом его кристаллы теряют воду, переходят в моногидратную форму и выглядят как белый непрозрачный порошок.
При нагревании на горелке Бунзена излучает золотисто-желтое пламя.
При нагревании декагидрат карбоната натрия приобретает безводную форму.
Растворяется в воде, выделяя тепло. Раствор карбоната натрия имеет щелочную природу.
Карбонат натрия используется для производства стекла, чистящих средств, мыла, стекла и бумаги, соединений натрия, таких как бура.
Гидрокарбонат натрия (NaHCO 3 ):
Это белое кристаллическое твердое вещество без запаха.
Полностью растворим в воде и мало растворим в этаноле.
Его получают путем пропускания диоксида углерода через концентрированный раствор гидроксида натрия или карбоната натрия.
При нагревании теряет углекислый газ и воду с образованием карбоната натрия.
При реакции с кислотами образует соль и воду и выделяет диоксид углерода.
Гидрокарбонат натрия обычно называют пищевой содой.
Гидрокарбонат натрия используется в хлебопекарной промышленности.
Используется для приготовления содовой кислоты.
Также используется в огнетушителях пенного типа.
Квасцы калийные (K 2 SO 4 Al 2 (SO 4 ) 3 .24H 2 O):
Это бесцветное кристаллическое вещество без запаха. Его кристаллы получают путем смешивания концентрированных растворов сульфата калия и сульфата алюминия.
Растворим в воде.
Плавится при 92 ° C и разбухает по мере удаления кристаллизационной воды при 200 ° C.
Его получают смешиванием концентрированных растворов K 2 SO 4 и Al 2 (SO 4 ) 3 в эквимолярной пропорции по весу.
K 2 SO 4 + Al 2 (SO 4 ) 3 + 24H 2 O → K 2 SO 4 . Al 2 (SO 4 ) 3 24 ч 2 O
Он разложится на компоненты при температуре 200 0 C.
K 2 SO 4 . Al 2 (SO 4 ) 3 24H 2 O → K 2 SO 4 + Al 2 (SO 4 ) 3 + 24H 2 O
Обесцвечивающий порошок (CaOCl 2 )
Обесцвечивающий порошок, химически известный как оксихлорид кальция.
Его получают, когда хлор реагирует с сухой гашеной известью при 40 ° C.
Это бледно-желтый порошок с сильным запахом хлора.
Реагирует с разбавленными кислотами или диоксидом углерода с выделением хлора.
Используется для отбеливания хлопка, льняных тканей и древесной массы.
Растворим в воде. Где используется для обеззараживания питьевой воды.
Хлорид аммония или соль Naushadar (NH 4 Cl)
Его получают путем пропускания аммиака в соляной кислоте.
Это белое кристаллическое твердое вещество, растворимое в воде.
Он без запаха, ломкий, соленый на вкус, оказывает охлаждающее действие на язык.
При высокой температуре разлагается на аммиак и соляную кислоту. При охлаждении эти газы объединяются с образованием хлорида аммония.
Гипс Парижский (CaSO 4 . ½ H 2 O)
Штукатурка Парижа, химически называемая полугидратом сульфата кальция. Так как он введен в обиход из Парижа, его называют «парижской штукатуркой».
Получается нагреванием гипса до 373К.
CaSO 4 .2H 2 O 373 K → CaSO 4 ½H 2 O + 1½H 2 O
Гипсовая штукатурка Парижской воды
Реакция хлорида натрия
[Депонировать фотографии]
Хлорид натрия или натриевая соль соляной кислоты представляет собой порошок или кристаллы бесцветного вещества без запаха с соленым вкусом.В повседневной жизни хлорид натрия известен как поваренная соль. Химическая формула — NaCl. В природе встречается в виде галита — каменной соли. Чистый хлорид натрия бесцветен, но если он содержит примеси, он может принимать другие цвета. Например, он может быть фиолетовым или синим, желтым или розовым.
Физические свойства хлорида натрия
Он умеренно растворим в воде, и температура, при которой протекает реакция, практически не играет роли.При температуре 21 ° C коэффициент растворимости в 100 г воды составляет 35,9, при 100 ° C — 38,1. Ионы хлорида образуют кубическую решетку, причем ионы натрия находятся вверху. Температура плавления 800,8 ° C. Поваренная соль закипает при температуре 1465 ° C.
Химические свойства натриевой соли соляной кислоты
NaCl — это соль, образовавшаяся в результате взаимодействия щелочи и кислоты. Хлорид натрия — сильный электролит.Ионы очень сильно притягиваются друг к другу, и притяжение между ними может быть нарушено только полярными растворителями. В H₂O кристаллическая решетка легко распадается. Освобождаются анионы и катионы связи (Na⁺, Cl⁻). Этим объясняется хорошая электропроводность хлорида натрия.
[Депонировать фотографии]
Качественные реакции на катионы натрия
Качественная реакция для определения катиона натрия Na⁺
Возьмите проволоку и сделайте на конце петлю.Насыпьте немного соли на петлю и поднесите к огню. Пламя загорится желтым цветом — это указывает на присутствие натрия.
Другая реакция на катион натрия
Ацетат цинка диоксурана (VI) образует желтый кристаллический осадок. Химическая реакция:
NaCl + Zn (UO₂) ₃ (CH₃COO) ₈ + CH₃COOH + 9H₂O ↔ NaZn (UO₂) ₃ (CH₃COO) ₉ · 9H₂O ↓ + HCl
Реакция гексагидроксоантимоната калия (V)
Образуется белый осадок, растворимый в щелочах:
NaCl + K [Sb (OH) ₆] ↔ Na [Sb (OH) ₆] ↓ + KCl
В кислой среде реагент разрушается с образованием белого аморфного осадка мета-сурьмы HSbO₃:
K [Sb (OH) ₆] + HCl ↔ KCl + H₃SbO₄ + 2H₂O
H₃SbO₄ ↔ HSbO₃ ↓ + H₂O
Качественная реакция на присутствие аниона, т.е.е. Класс
Это можно наблюдать по качественной реакции на хлорид-ионы. При взаимодействии с нитратом серебра образуется осадок хлорида серебра белого цвета. Химическая формула:
AgNO₃ + NaCl = AgCl + NaNO₃
Молекула хлорида серебра
[Викимедиа]
Хлороводород из соли вытесняется более сильными кислотами, чем соляная кислота.Химическая реакция:
2NaCl + H₂SO₄ = Na₂SO₄ + 2HCl
Количественное определение хлорида натрия
Берем стандартный раствор хлорида натрия и переливаем в колбу, разводим двумя частями дистиллированной воды, добавляем две капли раствора хромата калия и титруем раствором нитрата серебра до появления оранжево-желтой окраски:
NaCl + AgNO₃ → AgCl ↓ + NaNO₃
Натрия хлорид
[Викимедиа]
Другой метод реакции хлорида натрия и определения количества соли.Раствор натрия хлорида смешать в колбе для титрования, добавить 4 капли разбавленной азотной кислоты (1: 4), 4 капли насыщенного спиртового раствора дифенилкарбазона. Начинайте титровать 0,01 М раствором перхлората ртути до появления розовато-пурпурного цвета.
Щелкните здесь, чтобы увидеть больше экспериментов с хлоридом натрия.
Расположение поваренной соли
На Земле имеется достаточное количество хлорида натрия. Его можно найти:
- В воде морей, океанов и озер.Мировой океан содержит 120 миллиардов тонн хлорида натрия. На 1000 тонн морской воды можно получить 1,3 тонны хлорида натрия.
- Есть много месторождений этого минерала в разных странах, самое крупное из которых находится в Великобритании.
- На берегу соленых озер.
- В солончаках
- На стенах кратеров вулкана.
Использование соли и польза от нее для человека
Соль кухонная предназначена для засолки овощей, рыбы и мяса.Используется как антисептик.
[Депонировать фотографии]
Роль хлорида натрия также важна в медицине; он используется для изотонического раствора. 9 г соли разводят в 1 литре воды. Это концентрация хлоридного раствора в организме человека: в жидкости и тканях. Растворы с более высокими концентрациями используются как противомикробные средства, а также для предотвращения гниения и брожения.
Несмотря на множество положительных характеристик, соль в больших количествах очень вредна и ядовита для кур, собак и кошек. Людям также не рекомендуется употреблять много соли, так как это может вызвать отек тканей.
хлорид натрия | Encyclopedia.com
Свойства
Облигации
Расположение и обработка
Горнодобывающая промышленность
Испарение
Использует
Ресурсы
Хлорид натрия (химическая формула NaCl), известный как поваренная соль, каменная соль, морская соль и минерал галит, представляет собой ионное соединение, состоящее из кристаллов кубической формы, состоящих из элементов натрия и хлора.Он несет ответственность за соленость Мирового океана. Эта соль имеет большое значение с древних времен и имеет широкий спектр применения. Одно из самых больших его применений — это соль, которую люди используют при употреблении в пищу и приготовлении пищи. Его можно приготовить химическим способом и получить путем добычи и испарения воды из морской воды и рассолов.
Натрия хлорид в чистом виде бесцветен. Он несколько гигроскопичен или поглощает воду из атмосферы. Соль легко растворяется в воде.Его растворение в воде является эндотермическим, что означает, что он забирает у воды некоторую тепловую энергию. Хлорид натрия плавится при 1474 ° F (801 ° C), кипит при 2670 ° F (1465 ° C), имеет плотность 2,16 г / см 3 (при 25 ° C) и проводит электричество при растворении или в расплавленное состояние.
Ионное соединение, такое как хлорид натрия, удерживается ионной связью. Этот тип связи образуется при притяжении противоположно заряженных ионов. Это притяжение похоже на притяжение двух противоположных полюсов магнита.Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Натрий (химический символ Na) — это щелочной металл, который имеет тенденцию терять электрон с образованием положительного иона натрия (Na + ). Хлор (химический символ Cl) является неметаллом и стремится получить электрон, чтобы сформировать отрицательный ион хлорида (Cl — ).
Противоположно заряженные ионы Na + и Cl — притягиваются, образуя ионную связь.Таким образом удерживаются вместе многие ионы натрия и хлора, в результате чего получается соль с характерной кристаллической формой. Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na + окружен шестью анионами (Cl — ), а каждый Clis окружен шестью катионами (Na + ). Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а общие положительные и отрицательные заряды равны.
Хлорид натрия, широко встречающийся в природе, встречается в морской воде, других соленых водах или рассолах, а также в сухих отложениях каменной соли.Его можно получить путем добычи и выпаривания воды из рассолов и морской воды. Эту соль также можно получить химическим путем путем реакции соляной кислоты (химическая формула HCl) с гидроксидом натрия (химическая формула NaOH) с образованием хлорида натрия и воды. Страны-лидеры по производству соли включают США, Китай, Мексику и Канаду.
Два способа удаления соли из земли — это каменная и колонковая добыча и добыча раствора. В методе помещения и колонны шахты врываются в землю, и горняки используют такие методы, как бурение и взрывные работы, для разрушения каменной соли.Соль удаляется таким образом, что остаются пустые комнаты, поддерживаемые соляными столбами.
При добыче растворами вода добавляется к залежи соли для образования рассола. Рассол — это раствор хлорида натрия и воды, который может содержать или не содержать другие соли. В одном методе в земле пробуривается скважина и в нее помещаются две трубы (меньшая труба помещается внутри большей). Пресная вода закачивается по внутренней трубе в соль. Растворенная соль образует рассол, который перекачивается через внешнюю трубу на поверхность, а затем удаляется.
Обычный способ получения соли из рассола — испарение воды с помощью вакуумных поддонов. В этом методе рассол кипятится и перемешивается в огромных резервуарах, называемых вакуумными поддонами. Качественные кубики соли образуются и оседают на дно кастрюль. Затем кубики собирают, сушат и обрабатывают.
Солнечное испарение морской воды для получения соли — старый метод, широко используемый сегодня. Он использует солнце как источник энергии. Этот метод эффективен в местах с обильными источниками соленой воды, сушей для прудов-испарителей и жарким сухим климатом для усиления испарения.Морская вода проходит через несколько прудов-испарителей. Минералы, содержащиеся в морской воде, выпадают в осадок или выпадают из раствора с разной скоростью. Большинство из них выпадают в осадок раньше, чем хлорид натрия, и поэтому остаются, когда морская вода перемещается из одного пруда-испарителя в другой.
С давних времен большое значение имела соль хлористого натрия. Он использовался множеством способов, включая ароматизацию и консервирование еды, и даже в качестве денежной формы. Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыры, и является важным консервантом в мясе, молочных продуктах, маргарине и других продуктах, поскольку замедляет рост микроорганизмов.Соль способствует естественному развитию цвета ветчины и хот-догов и усиливает нежность вяленого мяса, например ветчины, заставляя их впитывать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза гормонов щитовидной железы, которые влияют на рост, развитие и скорость метаболизма).
В химической промышленности для производства других химикатов используются большие количества соли хлорида натрия. Хлор и гидроксид натрия производятся электролитическим способом из рассола.
ОСНОВНЫЕ УСЛОВИЯ
Рассол — Раствор хлорида натрия и воды, который может содержать или не содержать другие соли.
Ион — Атом или молекула, которые приобрели электрический заряд, потеряв электроны (положительно заряженный ион) или получив электроны (отрицательно заряженный ион).
Ионная связь — Силы притяжения между положительными и отрицательными ионами, которые существуют, когда электроны переносятся от одного атома к другому.
Ионное соединение — соединение, состоящее из положительных ионов (обычно ионов металлов) и отрицательных ионов (ионы неметаллов), удерживаемых вместе за счет электростатического притяжения.
Солнечное испарение — метод испарения воды, использующий солнце в качестве источника энергии.
Хлорные продукты используются в очистителях металлов, в отбеливателе бумаги, пластмассах и при очистке воды. Кальцинированная сода, содержащая натрий, используется для производства стекла, мыла, бумаги и смягчителей воды. Химические вещества, образующиеся в результате реакции хлорида натрия, используются в керамической глазури, металлургии, обработке кож и фотографии.
Хлорид натрия находит широкое и разнообразное применение.Его разбрасывают по дорогам, чтобы растопить лед за счет снижения температуры плавления льда. Соль играет важную роль в регулировании жидкостей организма. Он используется в лекарствах и кормах для домашнего скота. Кроме того, соляные пещеры используются для хранения химикатов, таких как нефть и природный газ.
См. Также Консервация пищевых продуктов; Соленая вода.
КНИГИ
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я . Оксфорд, Великобритания: Издательство Оксфордского университета, 2003.
Курланский, Марк. Соль: всемирная история . Нью-Йорк: Penguin Books, 2003.
Lide, David R., ed. Справочник по химии и физике CRC Бока-Ратон, Флорида: CRC Press, 2005.
Майерс, Р. Томас, Кейт Б. Олдхэм и Сальваторе Токчи. Holt Chemistry Visualizing Matter . Остин, Техас: Холт, Райнхарт и Уинстон, 2000.
Сикерски, Славомир. Краткая химия элементов . Чичестер, Великобритания: Издательство Хорвуд, 2002.
Снайдер, C.H. Необычная химия обычных вещей . 4-е изд. Нью-Йорк: John Wiley and Sons, 2002.
Дана М. Барри
Соль — Энциклопедия Нового Света
- О химических свойствах соли см. Хлорид натрия; для химического термина см соль (химия).
- Для использования в других целях, см Соль (значения).
Соль в основном представляет собой хлорид натрия (NaCl). Эта солонка также содержит зерна риса, которые обеспечивают физическое возбуждение и предотвращают слеживание соли.
Соль — это минерал, состоящий в основном из хлорида натрия, который обычно едят люди.Существуют разные формы соли: неочищенная соль (например, морская соль), очищенная соль (поваренная соль) и йодированная соль. Это твердое кристаллическое вещество белого, бледно-розового или светло-серого цвета, обычно получаемое из морской воды или каменных отложений. Натуральная морская соль, помимо хлорида натрия, содержит жизненно важные микроэлементы. Пищевая каменная соль может быть слегка сероватой из-за содержания минералов.
Натрий и хлор, два компонента соли, необходимы для выживания всех живых существ, включая человека, но их не нужно употреблять в виде соли, поскольку они находятся вместе в очень концентрированной форме.Было обнаружено, что некоторые изолированные культуры, такие как яномами в Южной Америке, потребляют мало соли. [1] Соль участвует в регулировании содержания воды (баланса жидкости) в организме. Солевой аромат — один из основных вкусов. Тяга к соли может быть вызвана недостатком микроэлементов, а также недостатком самого хлорида натрия.
Чрезмерное потребление соли может увеличить риск проблем со здоровьем, включая высокое кровяное давление. При приготовлении пищи соль используется в качестве консерванта и приправы.
Рассол из соленой скважины доводится до чистой соли в Цзигуне, Китай
Определение
Соль в химии определяется как продукт, образующийся в результате реакции нейтрализации кислот и оснований. Соли — это ионные соединения, состоящие из катионов (положительно заряженных ионов) и анионов (отрицательных ионов), поэтому продукт является электрически нейтральным (без чистого заряда). Эти составляющие ионы могут быть неорганическими, такими как хлорид (Cl — ), а также органическими, такими как ацетат (CH 3 COO — ) и одноатомными ионами, такими как фторид (F — ), а также многоатомными. ионы, такие как сульфат (SO 4 2-).
Есть несколько разновидностей солей. Соли, которые производят ионы гидроксида при растворении в воде, — это основных солей и соли, которые производят ионы гидроксония в воде кислотных солей. Нейтральные соли — это соли, которые не являются ни кислотными, ни основными солями. Цвиттерионы содержат анионный центр и катионный центр в одной и той же молекуле, но не считаются солями. Примеры включают аминокислоты, многие метаболиты, пептиды и белки.
Когда соли растворяются в воде, они называются электролитами и способны проводить электричество, что присуще расплавленным солям.Смеси многих различных ионов в растворах — например, в цитоплазме клеток, в крови, моче, растительных соках и минеральных водах — обычно не образуют определенных солей после испарения воды. Поэтому их солесодержание дано для соответствующих ионов.
Внешний вид
Соль поваренная и перец горошком.
Цвет
Соли могут быть прозрачными (хлорид натрия), непрозрачными и даже металлическими и блестящими (дисульфид железа). Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов.Поскольку свет отражается от фазовых границ, более крупные кристаллы имеют тенденцию быть прозрачными, в то время как поликристаллические агрегаты выглядят как белые порошки. Конечно, некоторые соли по своей природе непрозрачны.
Соли существуют в полном ассортименте различных цветов. Примеры:
желтый (хромат натрия),
апельсин (дихромат калия),
красный (сульфид ртути),
лиловый (гексагидрат хлорида кобальта),
синий (пентагидрат сульфата меди, гексацианоферрат железа),
зеленый (оксид никеля),
бесцветный (сульфат магния),
белый и
черный (диоксид марганца).Большинство минералов и неорганических пигментов, а также многие синтетические органические красители являются солями.
Вкус
Различные соли могут вызывать все пять основных вкусов, например, соленый (хлорид натрия), сладкий (диацетат свинца; но при проглатывании вызывает отравление свинцом), кислый (битартрат калия), горький (сульфат магния) и умами или чабер (глутамат натрия).
Запах
Соли сильных кислот и сильных оснований («сильные соли») нелетучие и не имеют запаха, в то время как соли слабых кислот или слабых оснований («слабые соли») могут пахнуть конъюгированной кислотой (напр.грамм. ацетаты, такие как уксусная кислота (уксус), и цианиды, такие как цианистый водород (миндаль), или сопряженное основание (например, соли аммония, такие как аммиак) составляющих ионов. Это медленное частичное разложение обычно ускоряется присутствием воды, поскольку гидролиз составляет другую половину уравнения обратимой реакции образования слабых солей.
Номенклатура
Химический состав морской соли
Название соли начинается с названия катиона (например, натрия или аммония ), за которым следует название аниона (например.г., хлорид или ацетат ). Соли часто упоминаются только по названию катиона (например, натриевая соль или аммониевая соль ) или по имени аниона (например, хлорид или ацетат ).
Формирование
Соли образуются в результате химической реакции между:
Соли также могут образовываться, если растворы различных солей смешиваются, их ионы рекомбинируют, а новая соль нерастворима и выпадает в осадок (см .: равновесие растворимости).
Солеобразующие ионы
Обычные солеобразующие катионы включают:
Обычные солеобразующие анионы (и названия исходных кислот в скобках) включают:
История использования поваренной соли
Консервирующая способность соли была фундамент цивилизации. Он устранял зависимость от сезонной доступности пищи, позволял путешествовать на большие расстояния и был жизненно важной пищевой добавкой. Однако, поскольку соль (NaCl) было трудно достать, на протяжении всей истории она стала очень ценным предметом торговли.До 1900-х годов соль была одним из основных двигателей национальной экономики и войн. Соль часто облагалась налогом; исследования показали, что такая практика существовала еще в ХХ веке, в г. до н. э. в Китае.
Первые регистры использования соли были составлены около 4000 г. до н. Э. в Египте, а затем в Греции и Риме. Соль была очень ценной и использовалась для консервирования и ароматизации продуктов. В Древнем Риме соль использовалась в качестве валюты. Латинское слово salarium , означающее оплату солью, является корнем слова «зарплата».»К несчастью для тех, кому платили солью, он был легко разрушен дождем и другими погодными условиями. Платежи римским рабочим и солдатам производились солью. [2]
Финикийцы датируют свидетельства сбора твердой соли из моря. Они также экспортировали его другим цивилизациям. В результате увеличения поставок соли из моря стоимость соли обесценилась. Используемый метод сбора урожая заключался в затоплении равнины морской водой с последующим высыханием равнин. После того, как вода высохла , оставшаяся соль была собрана и продана.
В Малийской империи торговцы в Тимбукту XII века — воротах в пустыню Сахара и резиденции ученых — ценили соль (NaCl) настолько, чтобы покупать ее на вес золота; Эта торговля привела к легендам о невероятно богатом городе Тимбукту и подпитывала инфляцию в Европе, которая импортировала соль. [3]
Во время протестов в Индии Мохандас Ганди совершил знаменитый соляной марш, чтобы бросить вызов британской монополии на соль.
В религии
У древних, как и у нас, «соль» (солнце) и «сал» (соль) считались необходимыми для поддержания жизни.
В Библии 35 упоминаний (стихов) о соли (версия короля Якова), наиболее известной из которых, вероятно, является история жены Лота, которая превратилась в соляной столб, когда она ослушалась ангелов и оглянулась на нечестивых. город Содом (Бытие 19:26). В Нагорной проповеди Иисус также назвал своих последователей «солью земли». Апостол Павел также призывал христиан «пусть ваш разговор всегда будет благодатным, приправленным солью» (Колоссянам 4: 6), чтобы, когда другие спрашивают об их верованиях, ответ христианина вызывает «жажду» узнать больше о Христе.Соль является обязательной в обряде Тридентской мессы. Соль используется в третьем пункте (который включает в себя экзорцизм) кельтского освящения (см. Галликанский обряд), который используется при освящении церкви. Соль можно добавлять в воду «там, где это принято» в римско-католическом обряде святой воды. Самое раннее библейское упоминание о соли, по-видимому, относится к разрушению Содома и Гоморры (Бытие, XIX, 24-26), когда царь Авимелех разрушил город Сихем, что, как считается, произошло в тринадцатом веке в году до нашей эры.В году н. Э. Он, как говорят, «посыпал его солью», и эта фраза выражает полноту его разорения. (Судьи ix. 45.)
В исконной японской религии синто соль используется для ритуального очищения мест и людей, например, в борьбе сумо.
В ацтекской мифологии Хуикстоциуатль была богиней плодородия, правившей соленой и соленой водой.
Формы соли
Неочищенная соль
Различные природные соли имеют разную минеральность, что придает каждой из них уникальный вкус.Fleur de sel, натуральная морская соль, собранная вручную, обладает уникальным вкусом, который варьируется от региона к региону.
Некоторые утверждают, что нерафинированная морская соль полезнее, чем рафинированная. [4] Однако полностью сырая морская соль горькая из-за соединений магния и кальция, поэтому ее редко едят. Другие люди думают, что сырая морская и каменная соль не содержат достаточного количества солей йода для предотвращения йододефицитных заболеваний, таких как гипотиреоз. [5]
Рафинированная соль
Рафинированная соль, которая наиболее широко используется в настоящее время, в основном представляет собой хлорид натрия.Пищевая соль составляет лишь небольшую часть производства соли в промышленно развитых странах (3% в Европе [6] ), хотя во всем мире на пищевые продукты приходится 17,5% производства соли [7] . Большинство из них продается для промышленного использования, от производства целлюлозы и бумаги до окрашивания тканей и тканей, производства мыла и моющих средств, и имеет большую коммерческую ценность.
Соляные курганы в Боливии. Соль собирают традиционным способом.
Производство и использование соли — одно из старейших предприятий химической промышленности. [8] Соль также получают путем испарения морской воды, обычно в неглубоких бассейнах, нагретых солнечным светом; [9] соль, полученная таким образом, раньше называлась заливной солью, а теперь ее часто называют морской солью или солнечной солью. Рафинированную соль также получают из каменной соли: минеральные отложения с высоким содержанием соли. Эти отложения каменной соли образовались в результате испарения древних соленых озер. [10] Эти месторождения можно добывать традиционным способом или путем закачки воды. Закачиваемая вода растворяет соль, и рассол можно перекачивать на поверхность, где собирается соль.
После получения сырой соли ее очищают и улучшают характеристики хранения и обращения с ней. Очистка обычно включает перекристаллизацию. При перекристаллизации рассол обрабатывают химическими веществами, которые осаждают большинство примесей (в основном соли магния и кальция). [11] Затем используются несколько стадий испарения для сбора чистых кристаллов хлорида натрия, которые сушатся в печи.
С 1950-х годов в рассол обычно добавляли следы гексацианоферрата натрия II, который действует как антислеживающий агент, способствуя образованию кристаллов неправильной формы. [12] Другие агенты против слеживания (и йодид калия для йодированной соли) могут быть добавлены после кристаллизации. Эти вещества представляют собой гигроскопичные химические вещества, которые поглощают влагу, предотвращая слипание кристаллов соли. Некоторые используемые противослеживающие агенты представляют собой трикальцийфосфат, карбонаты кальция или магния, соли жирных кислот (кислотные соли), оксид магния, диоксид кремния, силикат кальция, алюмосиликат натрия и алюмосиликат алюминия. Высказывались опасения относительно возможных токсических эффектов алюминия в последних двух соединениях, однако и Европейский Союз, и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) разрешают их использование. [13] Очищенная соль готова для упаковки и распределения.
Поваренная соль
Соль в пакетиках на одну порцию
Поваренная соль — это очищенная соль с содержанием хлорида натрия 99%. [14] [15] Обычно он содержит вещества, придающие ему сыпучесть (антислеживатели), такие как силикоалюминат натрия или карбонат магния. Обычно в солонки кладут несколько зерен сырого риса, чтобы впитать лишнюю влагу, когда средств против слеживания недостаточно.
Йодированная соль
Йодированная соль (BrE: йодированная соль ), поваренная соль, смешанная с небольшим количеством йодида натрия, йодата или иногда йодида калия, используется для снижения вероятности йодной недостаточности у людей. Дефицит йода обычно приводит к проблемам со щитовидной железой, особенно к эндемическому зобу. Эндемический зоб — это заболевание, характеризующееся опухолью щитовидной железы, которая обычно приводит к выпячиванию на шее. Хотя для предотвращения зоба в диете требуется лишь небольшое количество йода, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США рекомендует (21 CFR 101.9 (c) (8) (iv)) 150 микрограммов йода в день как для мужчин, так и для женщин, и есть много мест по всему миру, где естественный уровень йода в почве низкий, а йод не усваивается овощами. .
Сегодня йодированная соль более распространена в США, Австралии и Новой Зеландии, чем в Великобритании.
Поваренная соль также часто йодируется — небольшое количество йодида калия (в США) или йодата калия (в ЕС) добавляется в качестве важной пищевой добавки. Поваренная соль в основном используется в кулинарии и в качестве столовой приправы.Йодированная поваренная соль значительно снизила уровень йодной недостаточности в странах, где она используется. [16] Йод важен для предотвращения недостаточной выработки гормонов щитовидной железы (гипотиреоз), которые могут вызывать зоб, кретинизм у детей и микседему у взрослых.
Фторированная соль
В некоторых европейских странах, где фторирование питьевой воды не практикуется, доступна фторированная поваренная соль. Во Франции 35 процентов продаваемой поваренной соли содержат фторид натрия или калия. [17] Еще одна добавка, особенно важная для беременных, — фолиевая кислота (витамин B), придающая поваренной соли желтый цвет.
Соленые приправы
Во многих азиатских культурах поваренная соль традиционно не используется в качестве приправы. [18] Однако такие приправы, как соевый соус, рыбный соус и устричный соус, как правило, имеют высокое содержание соли и выполняют почти ту же роль, что и столовая приправа, обеспечивающая соль, которую поваренная соль служит в западных культурах.
Влияние потребления соли на здоровье
Натрий — один из основных электролитов в организме.Все три электролита (натрий, калий и кальций) доступны в виде нерафинированной соли, как и другие жизненно важные минералы, необходимые для оптимального функционирования организма. Слишком много или слишком мало соли в рационе может привести к мышечным спазмам, головокружению или даже нарушению электролитного баланса, что может вызвать серьезные, даже фатальные, неврологические проблемы. [19] Употребление слишком большого количества воды с недостаточным потреблением соли подвергает человека риску отравления водой. Соль даже иногда используется как лечебное средство, например, при лечении дизавтономии. [20]
Риск людей заболеть из-за слишком низкого или слишком высокого потребления соли варьируется в зависимости от биохимической индивидуальности. Некоторые утверждали, что, хотя риски употребления слишком большого количества соли реальны, риски для большинства людей преувеличены или что исследования, проведенные по потреблению соли, можно интерпретировать по-разному. [21] [22]
Избыточное потребление соли было связано с:
- астмой, вызванной физической нагрузкой. [23] С другой стороны, другой источник возражает: «… мы до сих пор не знаем, способствует ли соль развитию астмы. Если есть связь, значит, она очень слабая…». [24]
- изжога [25] .
- остеопороз: один отчет показывает, что диета с высоким содержанием соли действительно снижает плотность костей у девочек. [26] . Тем не менее, «несмотря на то, что высокое потребление соли было связано с пагубным воздействием на здоровье костей, данных для окончательных выводов недостаточно». ( [27] , p3)
- Рак желудка (рак желудка) связан с высоким уровнем натрия, «но данные, как правило, не относятся к продуктам, обычно потребляемым в Великобритании.»( [28] ) Однако в Японии потребление соли выше. [29]
- гипертония (высокое кровяное давление):« С 1994 года данные о связи между потреблением соли с пищей и артериальным давлением увеличились. . Данные были согласованы в различных исследуемых популяциях и в возрастном диапазоне взрослых «. ( [30] ).» Директор по маркетингу (главный медицинский директор) Англии в своем Годовом отчете (DH, 2001) подчеркнул, что люди с повышенным артериальным давлением в три раза чаще развиваются сердечные заболевания и инсульт и в два раза чаще умирают от этих болезней, чем у людей с нормальным уровнем.»( [31] ). Одно исследование показало, что низкий уровень натрия в моче связан с более высоким риском инфаркта миокарда у леченных гипертоников. [32] .
- гипертрофия левого желудочка (увеличение сердца): потребление вызывает гипертрофию левого желудочка, сильный фактор риска сердечно-сосудистых заболеваний, независимо от влияния артериального давления. »( [33] )«… накапливаются данные о том, что высокое потребление соли предсказывает гипертрофию левого желудочка.»( [34] ) Чрезмерное потребление соли (натрия) в сочетании с недостаточным потреблением воды может вызвать гипернатриемию. Это может усугубить заболевание почек. [35]
- отек (BE: отек): уменьшение Было предложено употребление соли для лечения отеков (BE: отек) (задержка жидкости). [36]
- язвы двенадцатиперстной кишки и желудка [37]
Крупномасштабное исследование, проведенное Нэнси Кук и др., показывает. что у людей с высоким-нормальным [38] артериальным давлением, которые значительно снизили количество соли в своем рационе, уменьшились их шансы на развитие сердечно-сосудистых заболеваний на 25 процентов в течение следующих 10-15 лет.Их риск умереть от сердечно-сосудистых заболеваний снизился на 20 процентов. [39] [40]
Рекомендуемая доза
Морская соль и перец горошком. Соляная мельница для морской соли.
В этом разделе кратко изложено потребление соли, рекомендованное учреждениями здравоохранения различных стран. Рекомендации обычно похожи. Обратите внимание, что цели для населения в целом имеют тенденцию быть прагматичными (что достижимо), в то время как рекомендации для отдельного человека идеальны (что лучше для здоровья).Например, в Великобритании цель для населения — «съедать не более 6 г в день», а для человека — 4 г.
Потребление может быть выражено по-разному в виде соли или натрия и в различных единицах.
- 1 г натрия = 1000 мг натрия = 42 ммоль натрия = 2,5 г соли
Соединенное Королевство : В 2003 году Научный консультативный комитет Великобритании по питанию (SACN) рекомендовал для типичного взрослого человека эталонное питательное вещество. Доза составляет 4 г соли в сутки (1,6 г или 70 ммоль натрия).Однако среднее потребление натрия взрослым в два с половиной раза превышает референсное потребление натрия. «Хотя точных данных о детях нет, консервативные оценки показывают, что в пересчете на массу тела среднее потребление соли детьми выше, чем у взрослых». SACN нацелен на достижимое целевое снижение среднего потребления соли до 6 г в день (2,4 г или 100 ммоль натрия) — это примерно эквивалентно чайной ложке соли. Рекомендации SACN для детей:
- 0–6 месяцев: менее 1 г / день
- 7–12 месяцев: 1 г / день
- 1–3 года: 2 г / день
- 4–6 лет : 3 г / день
- 7–10 лет: 5 г / день
- 11–14 лет: 6 г / день
В SACN говорится: «Целевое потребление соли, установленное для взрослых и детей, не является идеальным или оптимальным. уровни, но достижимые цели в области народонаселения.« [41]
Республика Ирландия : Управление по безопасности пищевых продуктов Ирландии поддерживает цели Соединенного Королевства», подчеркивая, что рекомендуемая суточная норма 1,6 г натрия (4 г соли) должна лечь в основу рекомендаций, ориентированных на отдельных лиц. отличается от целевого показателя здоровья населения, который составляет 6 г соли в день ». ( [42] )
Канада : Министерство здравоохранения Канады рекомендует адекватное потребление (AI) и верхний предел (UL) с точки зрения натрия .
- 0–6 месяцев: 0.12 г / день (AI)
- 7-12 месяцев: 0,37 г / день (AI)
- 1-3 года: 1 г / день (AI) 1,5 г / день (UL)
- 4-8 лет: 1,2 / день (AI) 1,9 г / день (UL)
- 9-13 лет: 1,5 г / день (AI) 2,2 г / день (UL)
- 14-50 лет: 1,5 г / день (AI) 2,3 г / день (UL)
- 51–70 лет: 1,3 г / день (AI) 2,3 г / день (UL)
- 70 лет и старше: 1,2 г / день (AI) 2,3 г / день (UL) [43]
Новая Зеландия
- Достаточное потребление (AI) 0,46 — 0.92 г натрия = 1,2–2,3 г соли
- Верхний предел (UL)) 2,3 г натрия = 5,8 г соли
Австралия : Рекомендуемая доза с пищей (RDI) составляет 0,92–2,3 г натрия в день (= 2,3 г – 5,8 г соли) [44]
США : Само Управление по санитарному надзору за качеством пищевых продуктов и медикаментов не дает рекомендации [45] , но отсылает читателей к Диетическим рекомендациям для американцев 2005 . Они предполагают, что граждане США должны потреблять менее 2300 мг натрия (= 2.3 г натрия = 5,8 г соли) в сутки.
[46]
Маркировка
Великобритания: Агентство по пищевым стандартам определяет уровень соли в пищевых продуктах следующим образом: «Высокий — более 1,5 г соли на 100 г (или 0,6 г натрия). Низкий — 0,3 г соли или меньше. на 100 г (или 0,1 г натрия). Если количество соли на 100 г находится между этими цифрами, то это средний уровень соли ». В Великобритании продукты питания, производимые некоторыми супермаркетами и производителями, имеют на передней части упаковки цвета «светофора»: красный (высокий), янтарный (средний) или зеленый (низкий). [47]
США: Руководство FDA по маркировке пищевых продуктов определяет, может ли продукт быть помечен как «свободный», «низкий» или «с пониженным / меньшим содержанием натрия». Когда о продукте питания делаются другие заявления о пользе для здоровья (например, с низким содержанием жира, калорий и т. Д.), Требуется заявление о раскрытии информации, если продукт превышает 480 мг натрия на «порцию». [48]
Кампании
В 2004 году Британское агентство по стандартам на пищевые продукты начало кампанию общественного здравоохранения под названием «Соль — смотри», которая рекомендует употреблять не более 6 г соли в день; в нем присутствует персонаж по имени Сид Слизень, который подвергся критике со стороны Ассоциации производителей соли (SMA). [49] Управление по стандартам рекламы не поддержало жалобу SMA в своем решении. [50] .
Исследовательский институт Мензиса в Тасмании, Австралия, поддерживает веб-сайт [51] , посвященный информированию людей о потенциальных проблемах соленой диеты.
Заменители соли
Потребление соли можно уменьшить, просто уменьшив количество соленых продуктов в рационе без использования заменителей соли. Заменители соли имеют вкус поваренной соли и содержат в основном хлорид калия, который увеличивает потребление калия.Избыточное потребление калия может вызвать гиперкалиемию. Различные заболевания и лекарства могут снизить выведение калия организмом, тем самым увеличивая риск гиперкалиемии. Если у вас почечная недостаточность, сердечная недостаточность или диабет, обратитесь за медицинской помощью, прежде чем использовать заменитель соли. Производитель LoSalt выпустил консультативное заявление [52] о том, что люди, принимающие следующие рецептурные препараты, не должны использовать заменители соли: амилорид, триамтерен, Dytac, спиронолактон, альдактон, эплеренон и Inspra.
Тенденции производства
Соль получают путем испарения морской воды или рассола из других источников, таких как рассольные скважины и соленые озера, а также путем добычи каменной соли , называемой галитом. В 2002 году общее мировое производство оценивалось в 210 миллионов метрических тонн, в первую пятерку производителей входили США (40,3 миллиона метрических тонн), Китай (32,9), Германия (17,7), Индия (14,5) и Канада (12,3). . [53] Обратите внимание, что эти цифры относятся не только к поваренной соли, но и к хлориду натрия в целом.
См. Также
Судно загружает соль с терминала.
- Электролит
- Галогенид
- Хлорид натрия
- Морская соль
- История соли
- Fleur de sel
- Отверждение (консервация пищевых продуктов)
- Кислотная соль
- Щелочные соли
- Пищевая соль I 9036 соль
- Natron
- Old Salt Route
- Дорожная соль
- Засоление земли — это преднамеренное массовое использование соли для того, чтобы сделать почву непригодной для возделывания и, таким образом, препятствовать заселению.
- Натрий
- Поваренная соль
- Цвиттерион
- Соленость
- гипертония
Примечания
- ↑ Индейцы яномами в исследовании INTERSALT. Проверено 28 июля 2007 г.
- ↑ Дэвид Блох, Экономика NaCl: Соль заставила мир вращаться. www.salt.org . Проверено 28 июля 2007 года.
- ↑ Дженис Макдональд. Совершите путешествие в Тимбукту. Новости CNN. Проверено 28 июля 2007 г.
- ↑ Susan Dearing. Морская соль полезна и производится в Колиме! Проверено 28 июля 2007 года.
- ↑ Йод в не йодированной морской соли. Институт соли . Проверено 28 июля 2007 г.
- ↑ Salt and its Applications. Европейская ассоциация производителей соли . Проверено 28 июля 2007 г.
- ↑ Производство соли в Азии стремительно росло с 2003 года. Информационные службы Роскилла . Проверено 28 июля 2007 г.
- ↑ Archeology Salt.org . Проверено 28 июля 2007 г.
- ↑ АКТИВНОСТЬ ТРЕТЬЯ — ВОДНЫЙ ЦИКЛ Nauticus — Weather Curriculum .Проверено 28 июля 2007 г.
- ↑ What is Salt ?. Ассоциация производителей соли Великобритании . Проверено 28 июля 2007 г.
- ↑ О соли: Производство. Ассоциация производителей соли . Проверено 30 июля 2007 г.
- ↑ Соль и химическая революция: 8 Производство соли в 20 веке. Ассоциация производителей соли . Проверено 30 июля 2007 г.
- ↑ Дэниэлс Берджесс, Вилелла Дэниэлс и Мейсон, Эйприл С. Какие химические вещества содержатся в моей пище? Университет Пердью, Кооперативная служба распространения знаний .Проверено 30 июля 2007 года.
- ↑ Анализ питания, предоставленный с помощью столовой соли Tesco, от Tesco Stores Ltd (Великобритания), показывает 38,9 процента натрия по весу, что соответствует 98,9 процентам хлорида натрия.
- ↑ Солевые продукты — столовая соль. WA Запасы соли . Проверено 30 июля 2007 г.
- ↑ Йодированная соль Salt Institute . Проверено 30 июля 2007 г.
- ↑ [1] Оценка рисков для здоровья от несоблюдения параметров питьевой воды.
значения. AFSSA .Проверено 30 июля 2007 г. - ↑ Мэтью Амстер-Бертон. 2001. Соль Юго-Восточной Азии. Сиэтл Таймс . Проверено 30 июля 2007 г.
- ↑ Salt. Австралия: канал «Лучшее здоровье» (Австралия, Виктория) . Проверено 30 июля 2007 г.
- ↑ Dysautonomia. Медицинский информационный центр клиники Кливленда . Проверено 30 июля 2007 года.
- ↑ Соль и другие раны. Почему файлы статья . Проверено 30 июля 2007 г.
- ↑ Гэри Таубс.1998. (Политическая) наука о соли, Science 281 (14 августа 1998 г.) (5379): 898 — 907. Проверено 30 июля 2007 г.
- ↑ Трейси Джеймс. 2003. Астма, вызванная физическими упражнениями, более четко связана с диетой с высоким содержанием соли. Домашние страницы IU . Проверено 30 июля 2007 г.
- ↑ Доктор Триша Макнейр, «Ухудшает ли употребление соли астму?» BBC Health . Проверено 30 июля 2007 года.
- ↑ Исследование добавляет соли к подозреваемым триггерам изжоги Все . Проверено 30 июля 2007 года.
- ↑ Высокосолевая диета снижает плотность костей у девочек. Food Navigator . Проверено 30 июля 2007 г.
- ↑ Соль и здоровье. Научно-консультативный комитет по питанию (SACN) . Проверено 30 июля 2007 г.
- ↑ Там же, 18
- ↑ Соль повышает «риск рака желудка». BBC News . Проверено 30 июля 2007 г.Laragh, 1992. Низкий уровень натрия в моче связан с повышенным риском инфаркта миокарда у леченных мужчин с гипертонией. Hypertension 25 (1995): 1144-1152. Проверено 30 июля 2007 г.
- ↑ SACN 3
- ↑ Соль и здоровье: обзор научных данных и рекомендаций для государственной политики в Ирландии Управление по безопасности пищевых продуктов Ирландии . Проверено 30 июля 2007 г.
- ↑ oz
- ↑ Удержание жидкости Австралия: канал Better Health Channel (Австралия, Виктория) .Проверено 30 июля 2007 г.
- ↑ Связь высокосолевой диеты с риском развития язвы. BBC . Проверено 30 июля 2007 г.
- ↑ [http://www.vaughns-1-pagers.com/medicine/blood-pressure.htm Таблица артериального давления
]. Вонз . Проверено 30 июля 2007 г. - ↑ Сокращение соли «снижает риск сердечного приступа». BBC News . Проверено 30 июля 2007 г.
- ↑ Употребление меньшего количества соли может предотвратить сердечно-сосудистые заболевания Eurikalert . Проверено 30 июля 2007 года.
- ↑ SACN
- ↑ fsai, 16
- ↑ Диетические справочные дозы (ищите натрий) Health Canada .Проверено 2 августа 2007 г.
- ↑ Salt Better Health Channel (Австралия, Виктория) . Проверено 2 августа 2007 года.
- ↑ Немного противоречий: встряска диетическая соль Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Проверено 2 августа 2007 г.
- ↑ «Натрий и калий» Министерство здравоохранения и социальных служб (HHS) и Министерство сельского хозяйства (USDA) . Проверено 2 августа 2007 г.
- ↑ Понимание этикеток Агентство пищевых стандартов .Проверено 2 августа 2007 г.
- ↑ Руководство по маркировке пищевых продуктов — Приложение A Управление по санитарному надзору за качеством пищевых продуктов и медикаментов . Проверено 2 августа 2007 г.
- ↑ Новая соляная кампания подверглась атаке Пресс-релиз ассоциации производителей соли . Проверено 2 августа 2007 г.
- ↑ Постановления о трансляции рекламы: 20 апреля 2005 г. Управление по стандартам в области рекламы . Проверено 2 августа 2007 г.
- ↑ Salt Matters Исследовательский институт Мензиса . Проверено 2 августа 2007 года.
- ↑ Информационное сообщение LoSalt . Проверено 2 августа 2007 г.
- ↑ Susan R. Feldman. Натрия хлорид. John Wiley & Sons, Inc., опубликовано в Интернете 2005 . Хлорид натрия Энциклопедия химической технологии Кирка-Отмера . Проверено 2 августа 2007 г.
Список литературы
- Курланский, Марк. 2002. Соль: Всемирная история. Нью-Йорк, Нью-Йорк: Издательская компания Уолкер. ISBN 0142001619.
- __________. и С.Д. Шиндлер. 2006. История соли. Нью-Йорк, Нью-Йорк: G.P. Сыновья Патнэма. ISBN 0399239987 — детская книга о соли.
- Ласло, Пьер. 2002. Соль: Зерно жизни. Искусство и традиции стола. Нью-Йорк, Нью-Йорк: Columbia University Press, 2001. ISBN 0060084685.
- Великобритания: Министерство здравоохранения, Диетические справочные значения для пищевой энергии и питательных веществ для Великобритании: Отчет Группы по DRV Комитета по медицинским аспектам Продовольственная политика. Канцелярия.
Внешние ссылки
Все ссылки получены 31 августа 2019 г.
Кредиты
New World Encyclopedia Авторы и редакторы переписали и завершили статью Wikipedia
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедию Нового Света :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Хлорид натрия | 7647-14-5
Хлорид натрия Химические свойства, применение, производство
Описание
Хлорид натрия широко распространен в природе.Океаны являются огромным источником хлорида натрия. Он встречается в морской воде в средней концентрации 2,68 мас.%. Он также встречается во многих внутренних соленых водах и в солевых отложениях в осадочных породах в виде минерала галита.
Хлорид натрия, вероятно, самая важная соль как натрия, так и хлора. Хлорид натрия, поваренная соль, является важным компонентом большинства пищевых продуктов, придает пище вкус и обеспечивает потребность в питательных веществах натрия. Также его используют для консервирования продуктов.С терапевтической точки зрения раствор NaCl используется для борьбы с обезвоживанием в качестве пополнения электролитов и является рвотным средством.
Наиболее важные применения хлорида натрия в химической промышленности — это производство ряда важных промышленных химикатов, таких как соляная кислота, гидроксид натрия, карбонат натрия и металлический натрий. Это исходный материал для производства этих веществ. Другие применения — крашение и печать тканей, глазирование керамики, изготовление мыла и обработка шкур.Хлорид натрия входит в состав многих замораживающих смесей.
Химические свойства
Хлорид натрия, NaCl, также известный как поваренная соль и галит, представляет собой белое кристаллическое твердое вещество. Он растворим в воде, слабо растворим в спирте и плавится при 804 ° C (1480 ° F). Хлорид натрия является наиболее важным минералом натрия и встречается в морской воде, подземных отложениях и скважинах с рассолом. Хлорид натрия является основным сырьем для производства хлора, гипохлорита натрия, бисульфата натрия, кальцинированной соды и хлористого водорода.Хлорид натрия также используется в приготовлении пищи, удобрениях и дорожными службами для борьбы с обледенением дороги.
Химические свойства
Хлорид натрия представляет собой белый кристаллический порошок или бесцветный
кристаллы; имеет соленый вкус. Кристаллическая решетка — гранецентрированная.
кубическая структура. Твердый хлорид натрия не содержит кристаллизационной воды, хотя при температуре ниже 0 ℃ соль может кристаллизоваться в виде
дигидрат.
Физические свойства
Хлорид натрия — это знакомое соединение, обычно называемое солью или поваренной солью.Е
Минеральная форма хлорида натрия — галит, встречается в природных отложениях на всей территории
Мир. На его долю приходится примерно 2,7% от веса растворенных минералов в морской воде.
Хлорид натрия — это ионное соединение, существующее в виде белой кристаллической кубической структуры чередующихся
ионы натрия и хлора. Хлорид натрия необходим для жизни среднего взрослого человека.
требуется от 1 до 2 граммов в день. Соль обеспечивает натрий и многие важные
такие функции, как поддержание водного баланса в клетках, участие в передаче нервных сигналов
и сокращение мышц.
происхождение
Хлорид натрия широко распространен в природе. Океаны являются огромным источником хлорида натрия. Он встречается в морской воде в средней концентрации 2,68 мас.%. Он также встречается во многих внутренних соленых водах и в солевых отложениях в осадочных породах в виде минерала галита.
Хлорид натрия, вероятно, самая важная соль как натрия, так и хлора. Хлорид натрия, поваренная соль, является важным компонентом большинства пищевых продуктов, придает пище вкус и обеспечивает потребность в питательных веществах натрия.Также его используют для консервирования продуктов. С терапевтической точки зрения раствор NaCl используется для борьбы с обезвоживанием в качестве пополнения электролитов и является рвотным средством.
Наиболее важные области применения хлорида натрия в химической промышленности — это производство ряда важных промышленных химикатов, таких как соляная кислота, гидроксид натрия, карбонат натрия и металлический натрий. Это исходный материал для производства этих веществ. Другие применения — крашение и печать тканей, глазирование керамики, изготовление мыла и обработка шкур.Хлорид натрия входит в состав многих замораживающих смесей.
использует
Облегчает перекрестное связывание органостаннанов с иодидами без использования палладия.
использует
Используется в приложениях биохимии и молекулярной биологии; компонент буферов PBS и SSC
использует
Природная соль является источником хлора и натрия, а также всех или практически всех их соединений, например соляной кислоты, хлоратов, карбоната натрия, гидроксида и т. Д.; для консервирования продуктов; производство мыла для высаливания красителей; в морозильных смесях; для крашения и печати тканей, глазурования керамики, обработки кож; металлургия олова и других металлов.
использует
Используется как электролит; буферы; модификация матрицы.
использует
хлорид натрия (поваренная соль) используется как консервант, вяжущее и антисептическое средство для лечения воспаленных поражений. Его также можно использовать для маскировки запаха, уменьшения плотности продукта и контроля вязкости.Разбавленные растворы не вызывают раздражения.
использует
Хлорид натрия Обычно известный как поваренная соль, хлорид натрия встречается как
минерал галит и в рассолах и морской воде. Натрия хлорид
растворим в воде, но в меньшей степени в спирте. Это был первый
галогенид для соединения с нитратом серебра и также использовался
Л. Дж. М. Дагер и В. Х. Ф. Тальбот в качестве стабилизатора до
фиксация с гипогликемией была принята.
Определение
ChEBI: неорганическая хлоридная соль, имеющая натрий (1+) в качестве противоиона.
Препарат
Хлорид натрия производится солнечным испарением морской воды или рассола из подземных солевых отложений. Его также получают при добыче каменной соли. Коммерческий продукт содержит небольшое количество хлоридов кальция и магния.
Определение
Соединение с кислотой и
основной радикал или соединение, образованное полным или частичным замещением водорода
в кислоте металлом. В общих чертах
соль — это материал, который идентифицируется
катионные и анионные компоненты.
Определение
физиологический раствор: описание химического соединения, которое представляет собой соль или раствор, содержащий соль.
Определение
соль: соединение, образованное реакцией кислоты с основанием, в которой водород кислоты заменен на металл или другие положительные соединения. Обычно соли представляют собой кристаллинеионные соединения, такие как Na + Cl– и NH 4 + NO 3 — . Соединения ковалентных металлов, такие как TiCl 4 , также часто считаются солями.
Методы производства
Хлорид натрия встречается в природе как минерал галит. Коммерчески,
его получают путем испарения морской воды на солнце, при добыче полезных ископаемых,
или испарением рассола из подземных солевых отложений.
фирменное наименование
Бронхо-физиологический раствор (Blairex).
Общее описание
Белое кристаллическое твердое вещество. Товарный сорт обычно содержит хлориды кальция и магния, которые поглощают влагу и вызывают спекание.
Реакции воздуха и воды
Вода.
Профиль реактивности
Хлорид натрия обычно не реагирует. При смешивании с концентрированной нелетучей кислотой, например серной кислотой, выделяет газообразный хлористый водород.
Пожарная опасность
Литературные источники указывают, что хлорид натрия негорючий.
Использование в сельском хозяйстве
Галит — это месторождение хлорида натрия (NaCl) природного происхождения.Самым распространенным месторождением калийных минералов является сильвит (KCl). Сильвит с галитом образует обычную калийную руду, называемую сильвинитом.
Применение в фармацевтике
Хлорид натрия широко используется при парентеральном и парентеральном введении.
непарентеральные фармацевтические препараты, в которых основное применение
заключается в производстве изотонических растворов.
Хлорид натрия использовался в качестве смазки и разбавителя в
капсулы и таблетки прямого прессования в прошлом,
хотя эта практика больше не распространена.Хлорид натрия имеет
также использовался как канальный агент и как осмотический агент
в ядрах таблеток с контролируемым высвобождением. Он использовался как
модификатор пористости в покрытиях таблеток и для контроля высвобождения лекарственного средства
из микрокапсул.
Добавление хлорида натрия к водному покрытию распылением
растворы, содержащие гидроксипропилцеллюлозу или гипромеллозу
подавляет агломерацию частиц кристаллической целлюлозы. (13)
Хлорид натрия также можно использовать для изменения высвобождения лекарства из
гели и из эмульсий.Его можно использовать для контроля мицелл
размер, и регулировать вязкость полимерных дисперсий путем
изменение ионного характера состава.
Профиль безопасности
Отравление внутрибрюшинным и внутрицервикальным путями. Умеренно токсичен при приеме внутрь, внутривенно и подкожно. Экспериментальный тератоген. Системное воздействие на человека при приеме внутрь: повышение артериального давления. Влияние на репродуктивную функцию человека при внутриплацентарном введении: прерывание беременности. Экспериментальные репродуктивные эффекты.Приведены данные о мутации человека. Раздражает кожу и глаза. Когда основной объем хлорида натрия нагревается до высокой температуры, выделяется пар, который раздражает, особенно глаза. Проглатывание большого количества хлорида натрия может вызвать раздражение желудка. Этот эффект может вызвать неправильное употребление солевых таблеток. Потенциально взрывоопасная реакция с дихлормалеиновый ангидрид + мочевина. Электролиз смесей с соединениями азота может привести к образованию взрывоопасного трихлорида азота. Реакция с горящим литом образует опасно реактивный содмм.Расплав соли при 11 00 ‘вступает в реакцию с водой со взрывом. Бурная реакция с BrF3. При нагревании до разложения выделяет токсичные пары Cland Na2O.
Безопасность
Хлорид натрия — самая важная соль в организме для
поддержание осмотического напряжения крови и тканей. О
5–12 г хлорида натрия потребляется ежедневно у нормального взрослого человека.
диеты, и соответствующее количество выводится с мочой. Как
наполнитель, хлорид натрия можно рассматривать как существенно
нетоксичный и не вызывающий раздражения материал.Однако следующие токсические эффекты:
возможен пероральный прием 0,5–1,0 г / кг массы тела у взрослых.
Пероральный прием больших количеств хлорида натрия, например
1000 г в 600 мл воды вредно и может вызвать раздражение.
желудочно-кишечного тракта, рвота, гипернатриемия, респираторные
дистресс, судороги или смерть.
У крыс минимальная смертельная доза для внутривенного введения составляет 2,5 г / кг массы тела.
LD50 (мышь, IP): 6,61 г / кг
ЛД50 (мышь, в / в): 0,65 г / кг
LD50 (мышь, перорально): 4.0 г / кг
LD50 (мышь, SC): 3,0 г / кг
LD50 (крыса, перорально): 3,0 г / кг
склад
Водные растворы хлорида натрия стабильны, но могут вызывать
отделение частиц стекла от некоторых видов стеклянной тары.
Водные растворы можно стерилизовать автоклавированием или фильтрацией.
Твердый материал стабилен и должен храниться в хорошо закрытой
емкость в прохладном сухом месте.
Было показано, что характеристики уплотнения и
на механические свойства таблеток влияют относительные
влажность условий хранения, при которых хлорид натрия
хранился.
Методы очистки
Его перекристаллизовывают из насыщенного водного раствора (2,7 мл / г), пропуская газообразный HCl или добавляя EtOH или ацетон. Его можно освободить от примесей бромида и йода, добавив хлорную воду к водному раствору и прокипятив ее в течение некоторого времени, чтобы удалить свободный бром и йод. Следы железа можно удалить длительным кипячением твердого NaCl в 6M HCl; затем кристаллы промывают EtOH и сушат примерно при 100 ° С. Хлорид натрия очищали сублимацией в потоке предварительно очищенного N2 и собирали электростатическим разрядом [Ross & Winkler J Am Chem Soc 76 2637 1954].Для использования в качестве первичного аналитического стандарта, NaCl, предназначенный для аналитических целей, необходимо тонко измельчить, высушить в электрической печи при температуре 500-600 ° С в платиновом тигле и дать ему остыть в эксикаторе. Однако для большинства целей сушка при температуре 110–120 ° является удовлетворительной.
Несовместимость
Водные растворы хлорида натрия вызывают коррозию железа. Они также
реагируют с образованием осадков с солями серебра, свинца и ртути. Сильный
окислители высвобождают хлор из подкисленных растворов натрия
хлористый.Растворимость противомикробного консерванта метилпарабена
снижается в водных растворах хлорида натрия и
вязкость карбомерных гелей и растворов гидроксиэтила
целлюлозы или гидроксипропилцеллюлозы восстанавливается добавлением
натрия хлорид.
Нормативный статус
ГРАС внесен в список. Включен в базу данных неактивных ингредиентов FDA
(инъекции; ингаляции; назальные, офтальмологические, пероральные, ушные, ректальные и
препараты местного действия). Входит в состав непарентерального и парентерального
лекарства лицензированы в Великобритании.Включен в Канадский список
Допустимые немедикаментозные ингредиенты.
Продукты и сырье для получения хлорида натрия
Сырье
Препараты
Урокиназа
Gongzhulingmeisu
Цефепим
Пирофосфат олова
ГИДРОГЕНИРОВАННОЕ КАСТОРНОЕ МАСЛО
Триэтилентетрамин дигидрохлорид
Черный цианид
Кислотно-зеленый 28
3-гидроксинафталин-2,7-дисульфоновая кислота
КИСЛОТНЫЙ ЖЕЛТЫЙ 11
2-амино-1,4-бензолдисульфоновая кислота
Растворитель Фиолетовый 8
РТУТНЫЙ ХЛОРИД
Дисперсный красный 74
ископаемая соль
ХЛОРОФОРМАМИДИН ГИДРОХЛОРИД
Фицин из латекса фигового дерева
2,3,4,5-ТЕТРАФТОРО-6-НИТРОБЕНЗОЙНАЯ КИСЛОТА
2-амино-5-хлорбензотрифторид
(S) — (+) — Метилманделат
3-АМИНО-5-БРОМО-ПИРИДИН-2-OL
N-фенилгидроксиламин
Прямой синий 199
Монтелукаст
Желтая протрава 10
Средство для удаления мусора
ТРИЭТИЛЕНЕТРАМИН ТЕТРАГИДРОХЛОРИД
Моногидрат мононатриевой соли 8-амино-1-нафтол-3,6-дисульфоновой кислоты
4-хлор-3-метилпиридин
Хлорат аммония
5-фтор-2-метилбензальдегид
1-МЕТИЛ-4- (3-НИТРОФЕНИЛ) ПИПЕРАЗИН
Кислотно-черный 107
Комплекс меди, 2,2 ‘- [карбонилбис [имино (1-гидрокси-3-сульфо-6,2-нафталиндиил) азо]] бис [бензойная кислота]
Диоксид хлора стабильный
Пропилацетат
2 — [[(2-этилфенил) (2-гидроксиэтил) амино] метил] -3,3-дифторпропаннитрил
2-амино-5-хлор-4-метилбензолсульфоновая кислота
1-МЕТИЛ-4- (4-НИТРОБЕНЗИЛ) ПИПЕРАЗИН
СОДА ЯСЕНЬ СВЕТЛЫЙ 99.2% МИН.
Теплопоглощающие свойства соли
Хлорид натрия, то же самое вещество, которым вы посыпаете свой картофель фри на обед, является полезным химическим веществом. Одно из самых полезных его качеств — поглощение тепла. Соль — более распространенное название хлорида натрия — представляет собой кристалл, который может очень эффективно поглощать тепло из-за своих особых физических и химических свойств.
Общие физические свойства соли
Соль — это кристаллический минерал.Как и многие минералы, он имеет очень высокую температуру плавления. Температура плавления соли составляет 800,8 градуса по Цельсию или 1473,4 градуса по Фаренгейту. При этой температуре соль превращается в жидкость. Соль имеет еще более высокую температуру кипения — 1465 градусов по Цельсию или 2669 градусов по Фаренгейту. При этой температуре жидкая соль превращается в пар. Как видите, соль может поглощать огромное количество тепла, прежде чем она претерпит фазовый переход, превращаясь из твердого тела в жидкость и из жидкости в пар.
Поглощение тепла и замораживание
Свойства поглощения тепла соли влияют на температуру замерзания жидкости, особенно воды.Соль снижает температуру замерзания пресной воды до 36 градусов по Фаренгейту; это называется эвтектической реакцией. Например, лед тает при контакте с солью, потому что соль снижает температуру замерзания льда, возвращая лед в жидкое состояние.
Теплопоглощающие свойства соленой воды
Соленая вода в океанах состоит на 3,5% из солей, в основном из хлорида натрия. Эта вода имеет другие свойства поглощения тепла, чем обычная вода. Морская вода поглощает немного больше тепла, чем пресная.Этот факт очень важен, потому что он касается глобального потепления: когда температура поверхности Земли повышается, океаны удерживают тепло, что может повлиять на погодные условия и океанские течения.
Использование для приготовления пищи
Повара пользуются невероятными свойствами соли поглощать тепло, используя ее в качестве среды для приготовления пищи.

 Если вещество сухое, то оно может получать электростатический заряд от счет завихрения, пневматической транспортировки, разливки и т.д.
Если вещество сухое, то оно может получать электростатический заряд от счет завихрения, пневматической транспортировки, разливки и т.д.
