Содержание
Соляная кислота — ООО «Баум-люкс»
Соляная кислота ХЧ 1л
Соляная кислота (хлористоводородная кислота, химическая формула HCl) — сильная одноосновная кислота, раствор хлористого водорода в воде. Соляная кислота представляет собой бесцветную жидкость с острым запахом хлористого водорода. Техническая соляная кислота имеет желтовато-зелёный цвет из-за примесей хлора и солей железа. Максимальная концентрация Соляная кислота около 36%; такой раствор имеет плотность 1,18 г/см3, на воздухе он «дымит», т.к. выделяющийся HCl образует с водяным паром мельчайшие капельки.
Соляная кислота была известна алхимикам в конце 16 в., которые получали её нагреванием поваренной соли с глиной или с железным купоросом. Под названием «соляный спирт» её в середине 17 в. описал И. Р. Глаубер, соляную кислоту взаимодействием поваренной соли (хлорид натрия, NaCl) и серной кислоты h3SO4. Метод Глаубера применяют и в настоящее время.
Соляная кислота — одна из самых сильных кислот. Она растворяет (с выделением газообразного водорода и образованием солей — хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями соляная кислота ведёт себя как восстановитель, например: MnO2 + 4HCl = MnCl2 + Cl2 + 2h3O.
Она растворяет (с выделением газообразного водорода и образованием солей — хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями соляная кислота ведёт себя как восстановитель, например: MnO2 + 4HCl = MnCl2 + Cl2 + 2h3O.
Производство соляной кислоты в промышленности включает две стадии: получение газообразного хлороводорода и его абсорбцию водой. Основным способом получения газообразного хлороводорода является синтез из Cl2 и h3. Большие количества хлороводорода образуются в качестве побочного продукта при хлорировании органических соединений: RH + Cl2 = RCI + HCl, где R — органический радикал.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют разбавленной, если она содержит, например, 12,2% HCl; при содержании 24% и больше HCl её называют концентрированной. В лабораторной практике 2н. HCl (7%-ную, плотность 1,035) обычно называют разбавленной соляной кислотой.
HCl (7%-ную, плотность 1,035) обычно называют разбавленной соляной кислотой.
Соляная кислота — важнейший продукт химической промышленности. Она идёт на получение хлоридов различных металлов и синтез хлорсодержащих органических продуктов. Соляную кислоту применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и других осадков и загрязнений. В металлургии соляной кислотой обрабатывают руды, в кожевенной промышленности — кожу перед дублением. Соляная кислота — важный реактив в лабораторной практике. Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах.
Газообразная соляная кислота (хлороводород) токсична. Длительная работа в атмосфере паров соляной кислоты вызывает катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание соляной кислоты в воздухе рабочих помещений не более 0,005 мг/л.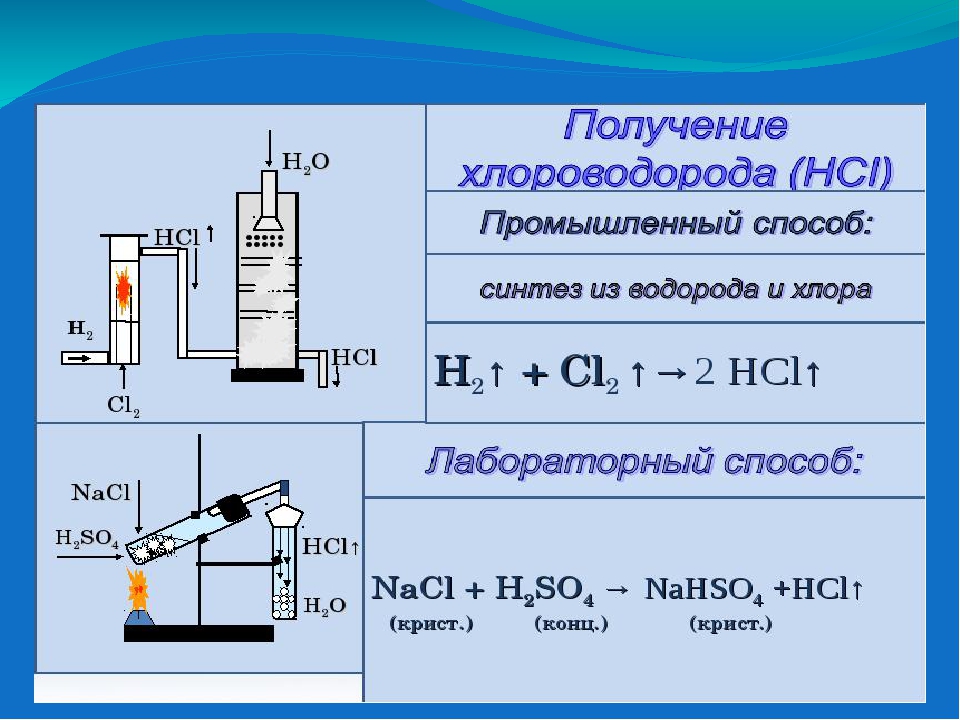 Защита: противогаз, очки, резиновые перчатки, обувь, фартук.
Защита: противогаз, очки, резиновые перчатки, обувь, фартук.
В медицинской практике разведённую соляную кислоту применяют в каплях и микстурах в комбинации с пепсином при заболеваниях, сопровождающихся недостаточной кислотностью желудочного сока (например, гастрите), а также гипохромной анемии (совместно с препаратами железа для улучшения их всасывания).
ООО «Баум-люкс» предлагает Вам соляная кислота купить в москве различной степени очистки (от технической до чда) и фасовки. Расценки указаны в прайс-листе.
Если Вы хотите купить соляную кислоту в Москве, Вы можете связаться с отделом продаж по указанным на сайте телефонам, либо оставить комментарий к этой записи.
Опыты по химии. Соляная кислота
Получение соляной кислоты (практическая работа)
Соляная кислота HCl получается при растворении газа хлороводорода воде.
Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H2SO4 = HCl ↑ + Na2HSO4
Направим поток хлороводорода в пробирку с водой. Этот газ легко растворяется в воде: до 450 объемов хлороводорода — в одном объеме воды. В пробирке образуется соляная кислота – раствор хлороводорода в воде.
Оборудование: пробирка, штатив для пробирок, пробирка с газоотводной трубкой, штатив, химические стаканы, воронка.
Техника безопасности. Соблюдать правила работы с нагревательными приборами. Необходима особая осторожность при работе с концентрированной серной кислотой. Недопустимо попадание выделяющегося хлороводорода в дыхательные пути. Опыт следует проводить под тягой.
Постановка опыта – Елена Махиненко, текст – к. п.н. Павел Беспалов.
п.н. Павел Беспалов.
Химические свойства соляной кислоты (практическая работа)
Соляная кислота это раствор хлороводорода в воде. Чтобы получить кислоту, получим хлороводород взаимодействием растворов поваренной соли и серной кислоты.
NaCl + H2SO4 = HCl + Na2HSO4.
Растворим хлороводород в воде, получится кислота. Соляная кислота – сильная кислота с типичными для кислот свойствами. Соляная кислота взаимодействует с основаниями с образованием солей и воды. В стакане со щелочью при добавлении соляной кислоты происходит реакция нейтрализации ‑ цвет индикатора изменяется, указывая на появление нейтральной среды.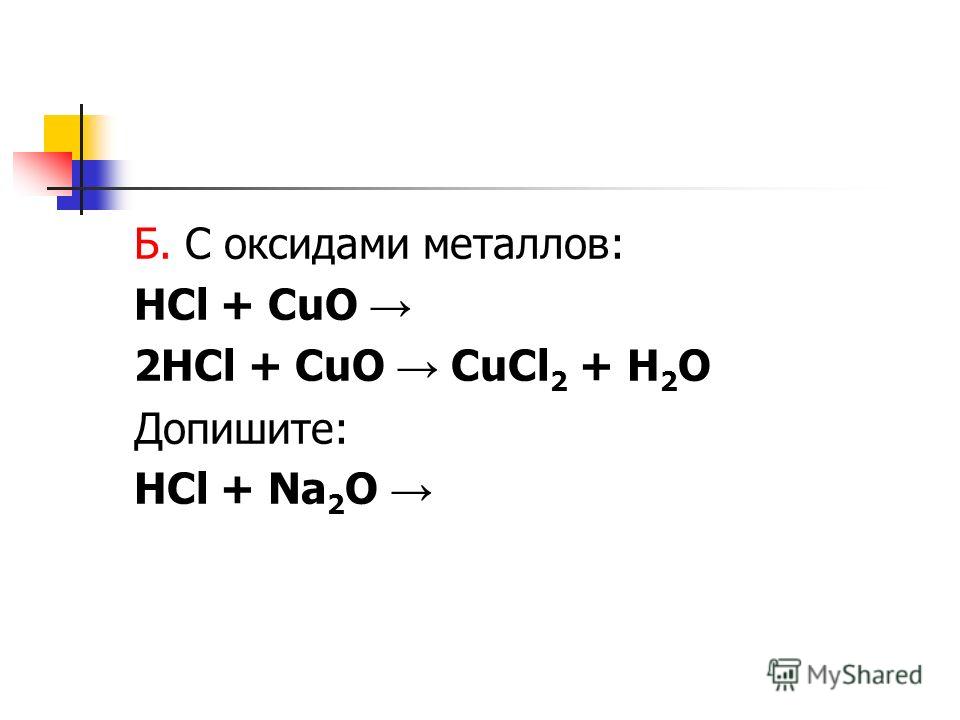
HCl + NaOH = NaCl+ H2O
Проведем качественную реакцию на хлорид-ион – реакцию с нитратом серебра.
Образуется нерастворимая соль – хлорид серебра.
HCl + AgNO3 = AgCl ↓ + HNO3
Соляная кислота взаимодействует с активными металлами: Когда цинк попадает в раствор соляной кислоты – начинается бурное выделение водорода.
2HCl + Zn = ZnCl2 + H2 ↑
Мы убедились в том, что соляная кислота реагирует с металлами, основаниями, солями.
Оборудование: спиртовка, шпатель, пробирка, штатив для пробирок, пробирка с газоотводной трубкой, штатив, химические стаканы, воронка.
Техника безопасности. Следует соблюдать правила работы с растворами кислот и щелочей. Избегать попадания кислот, щелочей, нитрата серебра на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Растворение хлороводорода в воде
Газоанализатор хлористого водорода
Хлористый водород
Из всего ряда галогеноводородов наиболее известен хлористый водород (хлороводород), причина его популярности в широком использовании водного раствора этого соединения – соляной кислоты. В чистом виде хлороводород, при нормальных условиях, находится в газообразном состоянии, он отличается токсичностью, высокой гигроскопичностью, резким запахом и не имеет цвета.
В чистом виде хлороводород, при нормальных условиях, находится в газообразном состоянии, он отличается токсичностью, высокой гигроскопичностью, резким запахом и не имеет цвета.
Свойства хлороводорода и его водного раствора
Газообразный хлористый водород — пары соляной кислоты тяжелее воздуха, его плотность составляет 1,639 г/л, из-за гигроскопичности притягивает атмосферную влагу, которая формирует своеобразное облако в местах скопления этого газа. При охлаждении до -85°C, газообразный HCl переходит в жидкое состояние, твердеет при 114°C, нагревание до 1500°C приводит к распаду соединения на элементарные составляющие. Растворимость в воде очень высокая – до 450 объемных частей на одну часть воды.
Без воды хлороводород малоактивен, но при нагревании до 650°C, газ реагирует с оксидами металлов переходной группы, с солями – карбидами, боридами, сульфидами и нитридами. В присутствии соединений-акцепторов, способен взаимодействовать с некоторыми гидридами.
Водный хлороводородный раствор намного активнее, представляя собой довольно сильный окислитель, он вступает в характерные реакции: с металлами с образованием хлоридов и водорода, а также со щелочами – реакции нейтрализации, в результате которых образуются те же хлориды и вода. При реакции замещения с солями слабых кислот, хлор соединяется с металлом, вытесняя остаток слабой кислоты. При взаимодействии с органикой соляная кислота образует хлоргидраты (органические соли).
Получение и использование
Традиционно, раствор хлористого водорода получали посредством взаимодействия поваренной соли (NaCl) и серной кислоты, но из-за невысокой чистоты готового продукта и малой эффективности, этот метод не применяется в современной промышленности. Хлорид водорода получают прямой реакцией химических элементов в условиях высокой температуры.
Полученный таким способом газообразный хлороводород, почти весь используется для получения раствора. Соляная кислота нужна в металлургии для удаления загрязнений с металлической поверхности, с ее помощью из руд получают металлы с высокой степенью очистки. Раствор HCl активно используется в синтезе материалов органической группы (гидрогалогенирование), служит сырьем при получении хлора. В медицине, это вещество в смеси с пепсином – эффективное средство лечения некоторых желудочных патологий, а в пищевом производстве, как добавка E507, выполняет функцию регулятора кислотности.
Соляная кислота нужна в металлургии для удаления загрязнений с металлической поверхности, с ее помощью из руд получают металлы с высокой степенью очистки. Раствор HCl активно используется в синтезе материалов органической группы (гидрогалогенирование), служит сырьем при получении хлора. В медицине, это вещество в смеси с пепсином – эффективное средство лечения некоторых желудочных патологий, а в пищевом производстве, как добавка E507, выполняет функцию регулятора кислотности.
Хлористый водород относится к веществам 3-го класса опасности, при небольшом превышении ПДК хлористого водорода для производственных зон – свыше 5 мг/м3, возникают признаки легкого отравления в виде раздражения органов дыхания, при увеличении количества до 50 мг/м3, наступает острая фаза с охриплостью голоса, кашлем и приступами удушья. Концентрация свыше 75 мг/м3 непереносима, она приводит к серьезным последствиям, вплоть до потери сознания. На тех предприятиях, где используется соляная кислота контроль за содержанием хлороводорода жизненно необходим, применение эффективных газоанализаторов соляной кислоты ХЛВ1. 0 от производителя ИНКРАМ позволит обезопасить производство и сохранить здоровье людей.
0 от производителя ИНКРАМ позволит обезопасить производство и сохранить здоровье людей.
Газоанализатор серии А200, А300
Газоанализатор серии В300, С300
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
Соляная кислота — неорганическое вещество, одноосновная кислота, одна из самых сильных кислот. Используются также другие названия: хлористый водород, кислота хлороводородная, кислота хлористоводородная.
Свойства
Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман.
Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
Кислота концентрации большей 24% считается концентрированной.
Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.
Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.
При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:
— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;
— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.
— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, глутамината натрия, хлоридов металлов, например, хлорида цинка, хлорида марганца, хлорида железа; синтеза хлорорганических веществ; катализатор в органических синтезах.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл.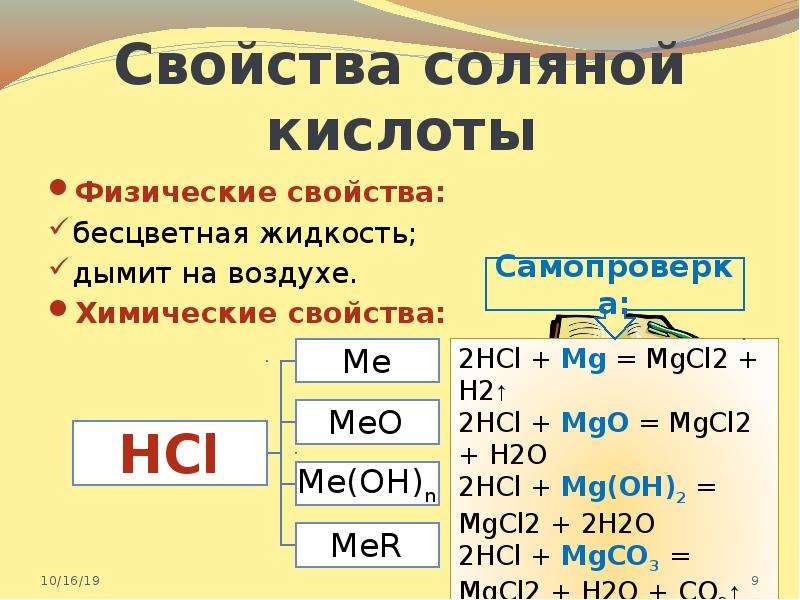 Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
— Обрабатывают кожу перед дублением.
— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.
— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Соляная кислота, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Хлороводородная кислота Соляная кислота — Справочник химика 21
Хлороводородная кислота (Соляная кислота) см. также Хлороводород селективный гидролиз [c.634]
Хлороводород НС1 — бесцветный газ с резким апа-хом, в воде хорошо растворяется, при О °С в 1 л воды растворяется более 500 л НС1. Раствор хлороводорода в воде имеет кислую реакцию и называется хлороводородной, или соляной кислотой. Соляная кислота явл [ется сильной кислотой, обладает всеми общими свойствами кислот. Диссоциация H l выражается уравнением [c.346]
Неправильно. Хлорсодержащая кислота, которую мы обсуждали до сих пор, это хлороводород. Его водный раствор называется хлороводородная, или соляная, кислота. Хлороводород имеет формулу НС1. Какова основность этой кислоты [c.361]
При растворении следует стремиться к тому, чтобы вещество растворилось полностью, независимо от того, полный или неполный анализ требуется провести. Многие неорганические соли и некоторые органические соединения хорошо растворяются в воде, подкисленной минеральными кислотами, чтобы предотвратить гидролиз (соли железа, висмута и др.). Органические соединения хорошо растворяются в органических растворителях — спирте, ацетоне, хлороформе и др. Большинство металлов и сплавов, а также оксидов, карбонатов, сульфидов и др. растворяется в разбавленных или концентрированных кислотах. Выбор кислот осуществляется на основании химических свойств растворяемых веществ. Так, сплавы и оксиды железа лучше растворять в хлороводородной (соляной) кислоте вследствие склонности Ре » к образованию хлоридных комплексов хром и алюминий не растворяются в азотной кислоте из-за образования на поверхности пассивирующей оксидной пленки и т.д. [c.49]
Многие неорганические соли и некоторые органические соединения хорошо растворяются в воде, подкисленной минеральными кислотами, чтобы предотвратить гидролиз (соли железа, висмута и др.). Органические соединения хорошо растворяются в органических растворителях — спирте, ацетоне, хлороформе и др. Большинство металлов и сплавов, а также оксидов, карбонатов, сульфидов и др. растворяется в разбавленных или концентрированных кислотах. Выбор кислот осуществляется на основании химических свойств растворяемых веществ. Так, сплавы и оксиды железа лучше растворять в хлороводородной (соляной) кислоте вследствие склонности Ре » к образованию хлоридных комплексов хром и алюминий не растворяются в азотной кислоте из-за образования на поверхности пассивирующей оксидной пленки и т.д. [c.49]
Хлороводород, строение молекулы. Растворение в воде. Хлороводородная (соляная) кислота, ее соли. Окислительно-восстановительные свойства. Качественная реакция на хлорид-ион. Получение и применение хлороводорода [c. 114]
114]
Процессы химической и электрохимической коррозии металлов показаны на рис. 8. Роль образования гальванических пар в процессе взаимодействия с электролитом может быть выяснена на таком примере. Известно, что ни медь, ни серебро не вытесняют водород из кислот, но если в раствор соляной (хлороводородной) кислоты опустить соединенные проводником пластины из меди и серебра (короткозамкнутый гальванический элемент), то происходит выделение водорода. Медь растворяется, а на серебряной пластинке идет восстановление водорода [c.91]
Названия бескислородных кислот производят от названия соответствующего неметалла с окончанием -о и дополнении слова водородная. Например HF — фтороводородная (фтороводород, плавиковая) кислота, H I — хлороводородная (хлороводород, соляная) кислота, [c.305]
Хлороводород газ с едким запахом, легкорастворимый в воде его раствор в воде имеет кислую реакцию и называется хлороводородная, или соляная, кислота. [c.59]
[c.59]
Водный раствор хлороводорода называется хлороводородной, или соляной кислотой. [c.203]
Кислотный остаток серной кислоты имеет два отрицательных заряда. Кислотный остаток фосфорной кислоты имеет три отрицательных заряда. Кислотный остаток азотной кислоты имеет один отрицательный заряд. Кислотный остаток хлороводородной, или соляной, кислоты имеет один [c.187]
Хлороводородная 1 соляная)кислота [c.858]
Ваш ответ почти правилен. Соединение (НС1), образующееся при реакции хлора с водородом, называется, однако, хлороводород. Водный раствор хлороводорода называется хлороводородная, или соляная, кислота. [c.358]
Взаимодействие металлов с хлороводородной (соляной) кислотой. Окислителем в соляной кислоте, так же как и в воде, является ион водорода. Стандартный электродный потенциал водородного электрода приравнен к нулю. Поэтому принципиально все активные металлы и металлы средней активности должны реагировать с кислотой. Так оно и есть, однако проявляется пассивация свинца [c.331]
Так оно и есть, однако проявляется пассивация свинца [c.331]
Такой раствор обладает кислыми свойствами и называется хлороводородной или соляной кислотой. Хлорид-ион в растворе обладает лишь слабыми восстановительными свойствами. [c.260]
Хлориды и другие соединения хлора обычно получают с помощью хлороводорода НС1. Это газ с едким запахом, хорошо растворимый в воде водный раствор его называют хлороводородной или соляной кислотой. НС1 легко вступает в реакцию со многими металлами. При этом высвобождается водород и образуется хлорид металла [c.53]
Хлороводород — одно из важнейших соединений хлора. Это бесцветный газ с резким запахом. При вдыхании раздражает дыхательные пути и вызывает удушье. В 1,3 раза тяжелее воздуха. Во влажном воздухе дымит , т. е. с водяными парами воздуха образует мельчайшие капельки тумана. При 0°С в одном объеме воды растворяется около 500 объемов хлороводорода. Водный раствор хлороводорода называется соляной или хлороводородной кислотой. [c.170]
[c.170]
Смесь хлора и водорода называют хлорный гремучий газ. Хлор соединяется с водородом, образуя хлороводород. Водный раствор хлороводорода называется хлороводородная, или соляная, кислота. Важнейшим соединением хлора, которое встречается в природе, является хлорид натрия (поваренная соль). [c.62]
Табл [c.130]
В круглодонную колбу емкостью 500 мл, снабженную обратным воздушным холодильником или стеклянной трубкой длиной 25—30 см, вставленной в резиновую пробку, вносят 20 г железных опилок. Для повышения активности железные опилки предварительно кипятят с кислотой Затем в колбу наливают 10,3 мл нитробензола. Приливают концентрированную хлороводородную кислоту порциями по 1—2 мл при встряхивании реакционной смеси (кислоту приливают через отверстие, куда вставлен холодильник). Если реакция восстановления идет слишком бурно, колбу охлаждают холодной водой. После прибавления 20 мл соляной кислоты остальное ее количество (70 мл) приливают порциями по 8—10 мл> Затем колбу нагревают на кипящей водяной бане 30 мик при периодическом встряхивании. Реакция восстановления заканчивается, когда из колбы исчезнет запах нитробензола (горького миндаля) и часть железа окислится в оксид железа (II, III) красно-коричневого цвета. В горячую смесь приливают 20 мл воды и осторожно порциями раствор 30 г гидроксида натрия в 40 мл воды до сильнощелочной реакции на лакмус. Причем раствор щелочи наливают в последний момент, когда собран прибор для перегонки анилина с водяным паром (рис 15), иначе значительная часть анилина может испариться Из горячей-реакционной массы отгоняют анилин с водяным паром. [c.201]
Реакция восстановления заканчивается, когда из колбы исчезнет запах нитробензола (горького миндаля) и часть железа окислится в оксид железа (II, III) красно-коричневого цвета. В горячую смесь приливают 20 мл воды и осторожно порциями раствор 30 г гидроксида натрия в 40 мл воды до сильнощелочной реакции на лакмус. Причем раствор щелочи наливают в последний момент, когда собран прибор для перегонки анилина с водяным паром (рис 15), иначе значительная часть анилина может испариться Из горячей-реакционной массы отгоняют анилин с водяным паром. [c.201]
Химически чистая соляная кислота — бесцветная жидкость с резким запахом, содержит 42% (мае.) H I (при 18 °С). Концентрированную соляную кислоту, получаемую сульфатным способом, содержащую 37% (мае.) НС1 (пл. 1,19 г/см=) и выделяющую на воздухе хлороводород, называют дымящей. Синтетическая соляная кислота содержит НС1 31% (мае.). Желтый цвет технической хлороводородной кислоты вызывается примесями хлорида железа (III). [c.396]
[c.396]
НР —фтороводородная, или плавиковая, кислота НС1 — хлороводородная, или соляная, кислота НВг — бромоводородная кислота Н1 —иодоводородная кислота НгЗ —сероводородная кислота [c.141]
Построены из ионов натрия и хлорид-ионов С1 , кислотного остатка хлороводородной (соляной) кислоты НС1. [c.127]
Водный раствор хлороводорода НС1-это хлороводородная кислота (если раствор концентрированный-соляная кислота), раствор сероводорода h3S-сероводородная кислота и т. п. [c.101]
Хлороводород НС1 — бесцветный газ с сильным запахом. Хорошо растворяется в воде, водные растворы называются хлороводородной кислотой, а дымящий концентрированный раствор (35-38% НС )-соляной кислотой (название дано еще алхимиками). В разбавленном растворе хлороводород является окислителем за счет катиона водорода [c.117]
HF —фтороводородная, или плавиковая, кислота H I —хлороводородная, или соляная, кислота НВг — бромоводородная кислота HI —иодоводородиая кислота H. jS —сероводородная кислота [c.127]
jS —сероводородная кислота [c.127]
Пример 4. Если обменные эквиваленты хлороводородной (соляной) кислоты и гидроксида натрия всегда равны их молярным массам, так как /3 3 = 1, то у серной кислоты и гидроксида кальция факторы эквивалентности равны 1 и а у фосфорной кислоты и гидроксида алюминия -1, 1/г и /з- [c.16]
Теперь рассмотрим, почему водородное соединение фтора — фтороводород НР — в водном растворе является кислотой, но более слабой, чем хлороводородная. Это объясняется тем, что радиусы ионов фтора значительно меньш,е, чем ионов хлора. Поэтому ионы фтора гораздо сильнее притягивают к себе ионы водорода, чем ионы хлора. В связи с этим степень диссоциации фтороводородной кислоты значительно меньше, чем соляной кислоты, т. е. фтороводородная кислота слабее соляной кислоты. [c.139]
Г. Дэви был первым, кто в 1810 г. высказал возражение против этой точки зрения. На опытах он доказал, что хлор представляет простое тело, подобное кислороду. Поэтому соляную кислоту надо рассматривать как соединение хлора и водорода. В 1812 г. К. Бертолле, Гей-Люссак и Л. Тенар присоединились к утверждению английского химика. В 1815 г. Гей-Люссак в своем большом исследовании, посвященном иоду, открытому Б. Куртуа в 1814 г., показал аналогию между свойствами иода и хлора, между иодоводородной и хлороводородной кислотами. В 1814 г. Г. Дэви пришел к важному общему выводу, что именно влияние элемента водорода определяет кислотные свойства вещества. [c.97]
Поэтому соляную кислоту надо рассматривать как соединение хлора и водорода. В 1812 г. К. Бертолле, Гей-Люссак и Л. Тенар присоединились к утверждению английского химика. В 1815 г. Гей-Люссак в своем большом исследовании, посвященном иоду, открытому Б. Куртуа в 1814 г., показал аналогию между свойствами иода и хлора, между иодоводородной и хлороводородной кислотами. В 1814 г. Г. Дэви пришел к важному общему выводу, что именно влияние элемента водорода определяет кислотные свойства вещества. [c.97]
Прибавим к этому раствору небольшое количество раствора хлороводородной (соляной) кислоты, т. е. введем дополнительно ионы Н+ [c.218]
При пропускании H l через воду образуется хлороводородная (соляная) кислота. Рассчитаем количество НС1 в образовавшейся соляной кислоте [c.182]
Имея в виду все сказанное выше, приступим теперь к изучению этикетки, изображенной на рис. 15.1. На ней указано, что концентрированный водный раствор соляной кислоты содер>1хлороводорода следовательно, НС1 обладает очень высокой растворимостью в воде. При 15°С в одном литре воды может раствориться до 4.50 л сухого газообразного НС1, находящегося под давлением 1 атм На лекциях часто демонстри]эуют опыт с хлороводородным фонтанчиком, который является прекрасной иллюстрацией высокой растворимости НС1. Устройство хлороводородного фонтанчика показано на рис. 15.2. Концентрированный водный раствор соляной кислоты имеет молярную коцентрацию около 12 М (этот результат получается в упражнении 15.1). Чтобы представить себе, насколько велика растворимость НС1 в воде, укажем, что аргон, который обладает приблизительно такой же молекулярной массой, как и H I, при 15°С и давлении 1 атм создает раствор с концентрацией только 0,002 М. [c.69]
При 15°С в одном литре воды может раствориться до 4.50 л сухого газообразного НС1, находящегося под давлением 1 атм На лекциях часто демонстри]эуют опыт с хлороводородным фонтанчиком, который является прекрасной иллюстрацией высокой растворимости НС1. Устройство хлороводородного фонтанчика показано на рис. 15.2. Концентрированный водный раствор соляной кислоты имеет молярную коцентрацию около 12 М (этот результат получается в упражнении 15.1). Чтобы представить себе, насколько велика растворимость НС1 в воде, укажем, что аргон, который обладает приблизительно такой же молекулярной массой, как и H I, при 15°С и давлении 1 атм создает раствор с концентрацией только 0,002 М. [c.69]
Мы уже знаем, что к важнейщим кислотам относятся НС1 -хлороводород (его водный раствор называется хлороводородная, или соляная, кислота) [c.167]
К бескислородным кислотам относят те кислоты, кислотные остатки которых не содержат атомов кислорода (забегая вперед, скажем, что кислотами называются и являются водные растворы этих веществ). Как правило, эти остатки состоят из одного атома неметалла, непосредственно связанного с одним или несколькими атомами водорода. Названия бескислородных кислот строятся путем добавления к корню названия неметалла окончания -оводородная и слова кислота . Например, хлороводородная кислота (тривиальное название — соляная кислота) НС1 (читается аш [c.11]
Как правило, эти остатки состоят из одного атома неметалла, непосредственно связанного с одним или несколькими атомами водорода. Названия бескислородных кислот строятся путем добавления к корню названия неметалла окончания -оводородная и слова кислота . Например, хлороводородная кислота (тривиальное название — соляная кислота) НС1 (читается аш [c.11]
Раствор его в воде называют хлористр водородной (хлороводородной) или соляной кислотой. В промыш- [c.157]
HF — фтороводоролная. или плавиковая, кпслота НС1 — хлороводородная, или соляная, кислота НВг — бромоводородная кислота HI—иодоводородная кислота h3S — сероводородная кислота [c.120]
Весьма существенно то обстоятельство,— п на него я в особенности должен обратить ваше внимание,— что род этой зависимости и натура веществ, с которыми элемент вошел в соединение,— т, е. от которых он встал в зависимость,— определяют свойства, присущие этому элементу в данном соединении,— условливают те отношения, которые элемент обнаруживает к разным реагентам. Эти свойства и отношения обыкновенно совершенно отличны от тех, которые принадлежат тому же элементу, когда он находится в отдельном состоянии или в других соединениях. Сопоставим, напр., воду, хлороводородную кислоту и болотный газ. Их общая составная часть, водород, относится к разным реагентам далеко не одинаково. Химик знает, что водород воды и водород соляной кислоты сходнее между собой, чем с водородом углеводорода, болотного газа, но все-таки и тут различие несомненно и резко. Чтобы вытеснить водород из воды, надо употребить какой-нибудь энергичный, нанр. щелочный, металл а для того, чтобы выделить его из хлороводородной кислоты, достаточно цинка или железа, которые на чистую воду почти вовсе не действуют. Тот же самый элемент, водород, когда он находится в болотном газе и в большинстве других углеводородов, не поддается вовсе действию металлов, даже самых энергичных. Если мы возьмем, наоборот, другое вещество, по химическому характеру, так сказать, противоположное металлу, напр, хлор, то, действуя им на воду, при обыкновенных условиях, вовсе не получим реакции, а нри содействии солнечного луча вытесним кислород, который является свободным, так что хлор соединится с водородом, т. е. становится на место кислорода. Если же реагировать хлором на болотный газ, то здесь хлор оказывается действующим на водород сравнительно легче он отнимает его мало-помалу, соединяется с ним и при этом сам становится на его место, так что получаются вещества, представляюпще болотный газ, в котором большая или меньшая часть водорода замешена хлором. Спрашивается чем определяется такое различие содержания одного и того же элементарного вещества в различных соединениях — Очевидно — натурой элемента, с которым это вещество является связанным,— натурою той зависимости, которая существует между составными частями данного соединения . Так как мы можем удостовериться опытом, что оба атома водорода в воде содержатся одинаково и четыре атома водорода в болотном газо также одинаковы, то остается сделать один шаг, чтобы сказать, что оба атома водорода в воде находятся в одинаковой зависимости от кислорода и четыре атома водорода в болотном газе то ке в одинаковой зависимости от угля. [c.373]
Эти свойства и отношения обыкновенно совершенно отличны от тех, которые принадлежат тому же элементу, когда он находится в отдельном состоянии или в других соединениях. Сопоставим, напр., воду, хлороводородную кислоту и болотный газ. Их общая составная часть, водород, относится к разным реагентам далеко не одинаково. Химик знает, что водород воды и водород соляной кислоты сходнее между собой, чем с водородом углеводорода, болотного газа, но все-таки и тут различие несомненно и резко. Чтобы вытеснить водород из воды, надо употребить какой-нибудь энергичный, нанр. щелочный, металл а для того, чтобы выделить его из хлороводородной кислоты, достаточно цинка или железа, которые на чистую воду почти вовсе не действуют. Тот же самый элемент, водород, когда он находится в болотном газе и в большинстве других углеводородов, не поддается вовсе действию металлов, даже самых энергичных. Если мы возьмем, наоборот, другое вещество, по химическому характеру, так сказать, противоположное металлу, напр, хлор, то, действуя им на воду, при обыкновенных условиях, вовсе не получим реакции, а нри содействии солнечного луча вытесним кислород, который является свободным, так что хлор соединится с водородом, т. е. становится на место кислорода. Если же реагировать хлором на болотный газ, то здесь хлор оказывается действующим на водород сравнительно легче он отнимает его мало-помалу, соединяется с ним и при этом сам становится на его место, так что получаются вещества, представляюпще болотный газ, в котором большая или меньшая часть водорода замешена хлором. Спрашивается чем определяется такое различие содержания одного и того же элементарного вещества в различных соединениях — Очевидно — натурой элемента, с которым это вещество является связанным,— натурою той зависимости, которая существует между составными частями данного соединения . Так как мы можем удостовериться опытом, что оба атома водорода в воде содержатся одинаково и четыре атома водорода в болотном газо также одинаковы, то остается сделать один шаг, чтобы сказать, что оба атома водорода в воде находятся в одинаковой зависимости от кислорода и четыре атома водорода в болотном газе то ке в одинаковой зависимости от угля. [c.373]
Чтобы продемонстрировать различия в химических свойствах, вы используете две химические реакции. Для каждого образца вы определите, реагирует ли он с хлороводородной (соляной) кислотой H I и с раствором хлорида меди u lj. [c.122]
Водные растворы рассматриваемых галогеноводородов представляют собой сильные кислоты это хлороводородная кислота H I (техническое название-соляная кислота), бромоаодородиая кислота НВг и иодоводородная кислота HI. Их соли — хлориды, бромиды, иодиды — обычно хорошо растворимы в воде мало растворимы все А Г (кроме A F), все РЬГ], Hgi lj, ВИэ. [c.463]
В отличие от AS2S3 в концентрированной соляной кислоте растворяются SbaSg и Bi Sg с образованием хлороводородных кислот НЭСи. Напишите уравнения этих реакций. [c.303]
Соляная кислота: свойства и применение
Соляная кислота (HCl) или хлористый водород применяется как сильнейший и популярный реактив, а также активно используется в медицине, пищепроме, химической отрасли, металлургии и пр.
В целом соляная кислота представляет собой прозрачную жидкость без запаха, но ее техническая версия может иметь слабый желтоватый оттенок за счет высокого содержания железа.
Растворитель пищи
HCl – очень агрессивное вещество, поэтому кажется невероятным, что именно оно обеспечивает расщепление еды в желудке человека. От такого сильного воздействия стенки желудка защищены тонкой слизистой оболочкой.
Несмотря на низкую концентрацию – всего 0,4% – хлороводород способен помочь нам переварить такие «несъедобные» вещи, как лезвие бритвы или жевательная резинка.
Свойства
- Нередко называется «дымящей кислотой», потому что совместно с влагой из воздуха ее пары образуют над поверхностью кислотный туман.
- Хорошо смешивается с водой и образует яркие реакции с металлами, оксидами и гидроксидами, превращаясь в соли.
- При соединении с ионами серебра образует белый осадок творожистой консистенции.
- HCl – едкий реагент, который разъедает кожу, костную ткань, даже металлы. Эта кислота по силе расщепления стоит в одном ряду с серной и нейтрализуется только щелочным раствором или содой.
- Смешиваясь с воздухом, вызывает удушье и повреждения органов дыхания, слизистых тканей носа и глаз. В связи с этим им гордо носит 2-й класс опасности.
Применение
Хлористый водород нашел широкое применение в промышленности и разных отраслях хозяйства.
В металлургии: для очищения металлических деталей от окисления используется техническая соляная кислота с ингибиторами, которые замедляют процесс расщепления, не позволяя растворять металл.
В медицине и фармацевтике: HCl повышает кислотность желудочного сока (при ее недостатке), а при анемии улучшает усвоение железа.
В пищевой промышленности: используется как пищевая добавка Е507, а еще входит в состав сельтерской воды.
В химической промышленности: является основой множества химических соединений (хлор, сода, хлориды металлов) и участвует в процессах органического синтеза.
Хлороводород требует осторожного обращения из-за своей едкости и опасных паров. При работе с ним желательно использовать специальную одежду (противогаз, фартук, перчатки, специальную обувь).
Неорганическая химия — Соляная кислота против хлористого водорода?
неорганическая химия — Соляная кислота против хлористого водорода? — Обмен химического стека
Сеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange
0
+0
- Авторизоваться
Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов в области химии.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществу
Кто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено
497 раз
$ \ begingroup $
На этот вопрос уже есть ответы здесь :
Закрыт 3 года назад.
Если один из них — водный раствор, в данном случае соляная кислота, почему у него нет другой химической формулы? Как бы я объяснил реакцию между водородом и хлором без использования воды, чтобы сделать ее кислой?
Лучник
4,71033 золотых знака3131 серебряный знак7272 бронзовых знака
Создан 13 апр.
$ \ endgroup $
0
$ \ begingroup $
Соляная кислота — водный раствор хлороводорода.
Создан 13 апр.
$ \ endgroup $
$ \ begingroup $
Вам лучше знать, что основное различие заключается в том, в каком состоянии они находятся. Hcl (g) получается без воды, и он очень агрессивен — он даже вступает в реакцию с водяным паром в воздухе.Не знаю, почему у них такое же название. 🙂
Создан 13 апр.
nin7nin7
122 бронзовых знака
$ \ endgroup $
Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Ваша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie
Настроить параметры
Соляная кислота Хлороводород | |
Х.ч. конц. HCl содержит HCl | |
Концентрированная кислота выделяет HCl при т.кип.110 ° C, т.пл. -24 ° C, т.кип. -85 ° C, т.пл. -114 ° C Смешивается с водой | |
Резкий раздражающий запах Резкий раздражающий запах | |
1,27 (воздух = 1,0) | LD 50 перорально (кролик) 900 мг / кг LC 50 вдох (крыса) 3124 ppm (1 ч) PEL (OSHA) 5 ppm (7 мг / м 3 ; потолок) ПДК (ACGIH) 5 частей на миллион (7,5 мг / м 3 ; потолок) | Сильно агрессивный; вызывает сильные ожоги при попадании в глаза и на кожу, а также при вдыхании газа. | Соляная кислота и газообразный хлористый водород являются очень едкими веществами, которые могут вызвать серьезные ожоги при контакте с тканями тела. Водная кислота и газ — сильные раздражители глаз и слезоточивые средства. Попадание концентрированной соляной кислоты или концентрированных паров HCl в глаза может привести к серьезным травмам, что приведет к необратимому ухудшению зрения и возможной слепоте, а контакт с кожей приведет к тяжелым ожогам. Проглатывание может вызвать серьезные ожоги рта, горла и желудочно-кишечного тракта и привести к летальному исходу.Вдыхание газообразного хлористого водорода может вызвать сильное раздражение и травму верхних дыхательных путей и легких, а воздействие высоких концентраций может привести к смерти. Считается, что газ HCl обладает адекватными предупреждающими свойствами. Не было обнаружено, что хлористый водород является канцерогенным или проявляет токсичность для репродуктивной системы или развития человека. |
Негорючие, но при контакте с металлами может образовываться легковоспламеняющийся водород. | |
Соляная кислота и хлористый водород бурно реагируют со многими металлами с образованием легковоспламеняющегося газообразного водорода, который может взорваться.Реакция с окислителями, такими как перманганаты, хлораты, хлориты и гипохлориты, может привести к образованию хлора или брома. | |
С соляной кислотой следует обращаться в лаборатории в соответствии с «основными принципами осмотрительности», описанными в главе 5.C. При работе с этой кислотой следует использовать защитные очки и резиновые перчатки, а контейнеры с HCl следует хранить в хорошо вентилируемом месте, изолированном от несовместимых металлов. Ни в коем случае нельзя добавлять воду в HCl, поскольку это может привести к разбрызгиванию; всегда добавляйте кислоту в воду.Емкости с соляной кислотой следует хранить во вторичных пластиковых лотках, чтобы избежать коррозии металлических полок для хранения из-за капель или разливов. С газообразным хлористым водородом следует обращаться в лаборатории, используя «основные разумные методы», описанные в главе 5.C, дополненные процедурами, описанными в главе 5.H для работы со сжатыми газами. Баллоны с хлороводородом следует хранить в прохладном, сухом месте, отдельно от щелочных металлов и других несовместимых веществ. | |
При попадании на кожу снять загрязненную одежду и немедленно промыть проточной водой не менее 15 мин. В случае попадания в глаза немедленно промыть большим количеством воды не менее 15 минут, удерживая веки открытыми. Обратитесь за медицинской помощью. В случае проглатывания не вызывать рвоту. Дайте большое количество воды или молока и доставьте в медицинское учреждение. В случае вдыхания вынести на свежий воздух и обратиться за медицинской помощью. Тщательно нейтрализуйте пролитую соляную кислоту подходящим средством, таким как порошкообразный бикарбонат натрия, затем разбавьте абсорбирующим материалом, поместите в соответствующий контейнер и утилизируйте должным образом. Разбавление водой перед нанесением твердого адсорбента может быть эффективным средством уменьшения воздействия паров хлористого водорода. В случае большого разлива или выброса в замкнутом пространстве может потребоваться защита органов дыхания. Утечки газообразного HCl проявляются в образовании плотных белых паров при контакте с атмосферой.Небольшие утечки можно обнаружить, подержав открытый контейнер с концентрированным гидроксидом аммония рядом с местом предполагаемой утечки; густые белые пары подтверждают наличие утечки. В случае случайного выброса газообразного хлористого водорода, например, из протекающего баллона или связанного с ним устройства, эвакуируйте зону и устраните источник утечки, если это можно сделать безопасно. Переместите баллон в вытяжной шкаф или в удаленное место, если его нельзя отключить. Может потребоваться полная защита органов дыхания и защитная одежда для борьбы с выбросом хлористого водорода. | |
Во многих местах соляная кислота или остатки разлива могут быть сброшены в канализацию после соответствующего разбавления и нейтрализации. В противном случае соляную кислоту и отходы, содержащие это вещество, следует поместить в соответствующий контейнер, четко обозначенный, и обращаться с ними в соответствии с инструкциями по утилизации отходов вашего учреждения. Избыток хлористого водорода в баллонах следует вернуть производителю. | |
Информация в этом LCSS была собрана комитетом Copyright 1995 Национальная академия наук.Все права защищены. | |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Хлористый водород — Институт хлора
- Home
- Stewardship
- Хлористый водород
Общие сведения о газообразном хлористом водороде
Безводный хлористый водород, AHCl, представляет собой бесцветный газ с резким раздражающим запахом. Легко абсорбируется водой с образованием соляной кислоты. Он очень гигроскопичен (притягивает влагу) и во влажном воздухе образует белые пары, представляющие собой туман соляной кислоты.
Точка кипения AHCl при давлении в одну атмосферу (760 мм рт. Ст.) Составляет -85 ° C (-121 ° F), а давление паров AHCl при температуре окружающей среды (20 ° C, 68 ° F) составляет 603 фунта / кв. . Из-за этих экстремальных значений давление в оборудовании, содержащем сжиженный AHCl, необходимо тщательно контролировать и контролировать.
Liquid AHCl имеет высокий коэффициент теплового расширения. При проектировании систем следует позаботиться о том, чтобы, насколько это возможно, исключить места, где жидкая AHCl и смеси жидкость / газ AHCl могут стать полностью герметичными между двумя закрытыми клапанами, потому что давление может возрасти, что приведет к повреждению прокладки или линии.НЕ ДОПУСКАЙТЕ попадания жидкого AHCl между закрытыми клапанами — это может привести к очень высокому давлению.
Более подробную информацию об AHCl можно найти в брошюре 99 и брошюре 160.
Информационный бюллетень о выбросах безводного хлористого водорода
Опасные химические реакции
AHCl реагирует с окислителями с образованием газообразного хлора. AHCl негорючий. Однако в присутствии воды AHCl разрушает большинство металлов с выделением легковоспламеняющегося газообразного водорода.Потенциально взрывоопасные смеси воздуха и водорода могут образовываться в замкнутых пространствах или закрытом оборудовании и линиях, а также в оборудовании и линиях после открытия. Замкнутые пространства должны хорошо вентилироваться, а трубопроводы оборудования следует продувать инертным газом или сухим воздухом до тех пор, пока испытания взрывом не покажут, что они свободны от водорода.
Токсикологические свойства
AHCl — это газ при атмосферном давлении. Он очень раздражает кожу, глаза и поверхности слизистых оболочек из-за быстрого поглощения влаги организмом с образованием соляной кислоты.Это может вызвать серьезные ожоги. Интенсивное или продолжительное вдыхание может вызвать замедленный отек легких с кашлем, дискомфортом в груди и затруднением дыхания. Контакт с паром может повредить глаза. Длительное передержание может вызвать эрозию зубов. Проглатывание может вызвать сильные кислотные ожоги рта, горла, пищевода и желудка с жгучей болью во рту, горле, груди и животе. Широкое воздействие может привести к смерти.
Рекомендации по экспозиции
Пределы воздействия AHCl OSHA и ACGIH составляют 5 частей на миллион или 7 мг / м3 и 7.ПДК 5 мг / м3. Это потолочные клапаны, превышение которых нельзя превышать во время любой части рабочего воздействия.
Порог запаха составляет 1-5 частей на миллион. 5-10 промилле вызовут дискомфорт.
Нормы воздействия HCL:
- ERPG 1, 3 ppm (Руководство по планированию действий в чрезвычайных ситуациях для 1-часового побега с легкими последствиями для здоровья)
- ERPG 2, 20 частей на миллион (Руководство по планированию действий в чрезвычайных ситуациях для 1 часа побега с серьезными последствиями для здоровья)
- ERPG 3, 150 частей на миллион (Руководство по планированию действий в чрезвычайных ситуациях для 1 часа побега с опасными для жизни последствиями для здоровья)
ERG 2016 (загрузка на английском языке) http: // www.phmsa.dot.gov/staticfiles/PHMSA/DownloadableFiles/Files/Hazmat/ERG2016.pdf
ERG 2016 (загрузка на испанском языке) http://www.phmsa.dot.gov/staticfiles/PHMSA/DownloadableFiles/Files/2016GRE.pdf
Хлористый водород | Технологическое оборудование Heil
Хлористый водород (HCl) — бесцветный газ с раздражающим резким запахом. Газообразный хлористый водород выделяется из растворов соляной кислоты. HCL растворим в воде и имеет относительно высокое давление пара. Соляная кислота — одна из наиболее часто используемых кислот в различных промышленных процессах.
Приложения
Выбросы газа соляной кислоты присутствуют в различных отраслях промышленности, включая металлообработку и отделку, сельское хозяйство, производство удобрений, полупроводников, химическое производство, горнодобывающую промышленность, а также производство продуктов питания и напитков. HCl широко используется в сталелитейной и легированной промышленности для травления и удаления окалины различных металлов. HCL обычно является этапом очистки перед гальваникой и финишной обработкой металла.
Воздействие на здоровье и окружающую среду
Воздействие хлористого водорода вызывает раздражение кожи, глаз, носа, горла и легких.В больших концентрациях он очень опасен. Соляная кислота вызывает коррозию мягких сталей и нержавеющих сталей.
Соответствие нормативным требованиям
Соляная кислота считается опасным загрязнителем воздуха (HAP) Агентством по охране окружающей среды США. Агентство по охране окружающей среды США регулирует выбросы соляной кислоты от предприятий по производству HCL в рамках своих национальных стандартов выбросов опасных веществ, загрязняющих воздух. Многие государственные и местные органы власти требуют, чтобы выбросы резервуаров для хранения HCL контролировались вентиляционным скруббером во время операций по загрузке и наполнению резервуаров HCL
Control Technologies
Противоточные башенные скрубберы HEIL серии 730 с насадкой — это наиболее распространенная технология высокоэффективной очистки хлористого водорода.Тарельчатые скрубберы Heil серии 740 также используются в определенных областях применения, где заказчик желает улавливать выбросы HCL, уловленные в скруббере, для повторного использования. Гидроксид натрия часто используется для нейтрализации pH моющего раствора.
Скрубберы
Heil HCL могут достигать эффективности удаления более 99,9%. В некоторых случаях в воздушном потоке создается туман соляной кислоты. Улавливающие сепараторы из композитной сетки Heil могут эффективно удалять выбросы HCl тумана размером до 1 микрона.
Соляная кислота — это то же самое, что соляная кислота?
Обновлено 26 марта 2020 г.
Кевин Бек
Проверено: Lana Bandoim, B.S.
«Мюриатик» — это не то слово, которое вы, вероятно, читали или слышали, если вы не изучаете историю науки или не являетесь серьезным поклонником химии. Следовательно, соляная кислота вряд ли вам знакома — по крайней мере, не под этим названием. Но, как вы увидите, соляная кислота используется очень часто.
Современное и гораздо более распространенное название того же вещества — соляная кислота, и если вы когда-либо работали с ней целенаправленно, вы знаете о ее эффектах.
Соляная или соляная кислота имеет химическую формулу HCl и считается сильной кислотой. Поскольку это вещество недорогое и его легко получить в значительных количествах, это вещество широко используется в промышленности, академических лабораториях и в различных других учреждениях. Соляная кислота для бассейнов по-прежнему широко маркируется и продается как таковая, но по большей части преобладает менее креативное, но более легкое для запоминания название.Использование соляной кислоты включает очистку бетона, например, настилов бассейнов или тротуаров, поэтому ее можно найти в магазинах товаров для дома.
Соляная кислота, помимо того, что, скорее всего, помогает в аспектах вашего собственного пищеварения, даже когда вы читаете это, используется в производстве металлов, нефтепродуктов, фармацевтических препаратов и многого другого.
Его химическая универсальность делает его чрезвычайно распространенным реагентом в химических реакциях, и его легко производить в массовых количествах с надежно точной концентрацией.Читайте дальше, чтобы вы могли полностью «переварить» все, что нужно знать об этом универсальном водном растворе.
Что такое кислоты и основания?
Кислота представляет собой молекулу, которая отдает протон (H + или ион водорода) в водном растворе, то есть при смешивании с водой. Молекулы H 2 O могут принять эти протоны, чтобы стать ионами гидроксония (H 3 O +), поскольку протоны не существуют в одиночку долго, если им есть с чем объединиться. Основание представляет собой молекулу, которая принимает протон или, что эквивалентно с точки зрения химии, отдает ионы гидроксида (ОН-) в растворе.
Молекула или элемент, остающийся, когда кислота отдает протон, называется сопряженным основанием кислоты. В случае HCl это, следовательно, хлорид-ион (Cl —). Один только Cl представляет собой элемент , хлор, , галоген.
Реакция газообразной соляной кислоты с водой в водном растворе выражается формулой
HCl (г) + H 2 O (л) ⟶ H 3 O + (водн.) + Cl — (водн. )
Эта реакция почти полностью завершается в большинстве условий (то есть почти вся HCl растворена), поскольку соляная кислота является сильной кислотой.
История и открытие соляной кислоты
Соляная кислота была открыта алхимиком Джабир ибн Хайян примерно в 800 году н. Э. Или более 1200 лет назад. Сегодня алхимию называют «лженаукой», но ее практикующие, тем не менее, работали с реальными веществами и иногда получали полезные результаты.
- Название соляная кислота происходит от латинского слова «соленый»; концентрированная соленая вода является реагентом в одном из процессов производства соляной кислоты.
Во время своего открытия мир находился за много веков от понимания того, что вообще такое кислоты. Но любое вещество со свойствами соляной кислоты, быстро и убедительно продемонстрированное, несомненно, приобретет большое значение для цивилизации, и именно это произошло с HCl.
Свойства соляной кислоты
Хлористый водород сам по себе существует как бесцветный газ без запаха при комнатной температуре, но в вакууме. На воздухе HCl образует густые белые пары, поскольку легко вступает в реакцию с молекулами воды.
Соляная кислота очень коррозионная и чрезвычайно токсичная . Если вы работаете с этим веществом, независимо от молярности (меры концентрации), вам следует использовать средства защиты глаз и кожи.
HCl имеет молекулярную массу (MW) 36,46 грамма на моль (г / моль). Более 95 процентов этой массы потребляется атомом хлора, но равное количество атомов H и Cl существует в конъюгированной (неповрежденной) форме кислоты. Он не является легко воспламеняемым, поэтому, несмотря на другие опасности для биологических систем, вероятность его возгорания маловероятна.
Производство соляной кислоты
HCl можно синтезировать несколькими способами. Один распространенный промышленный синтез включает сжигание газообразного водорода и газообразного хлора внутри камеры, в которую газы вводятся под давлением через сопло.
Полученный таким образом солянокислый газ затем постепенно и осторожно охлаждается до жидкого состояния и разбавляется до любой концентрации, требуемой спецификациями. Эта реакция представлена формулой:
HCl может быть также получен промышленным способом реакцией хлорида натрия и серной кислоты:
2NaCl + H 2 SO 4 ⟶ 2HCl + Na 2 SO 4
HCl можно также синтезировать из хлорида натрия, диоксида серы, воздуха и водяного пара:
4NaCl + 2SO 2 + 2H 2 O + O 2 ⟶ 2Na 2 SO 4 + 4HCl
Использование соляной кислоты
Те же свойства, которые делают HCl опасным при работе, если не будут приняты меры предосторожности, имеют преимущество в определенных условиях.Точно так же, как ножи потенциально очень опасны, но также чрезвычайно полезны и универсальны, коррозионные свойства соляной кислоты можно использовать в тщательно контролируемых условиях.
Следующий список представляет собой обзор некоторых из основных применений соляной кислоты в современном обществе. Обратите внимание, что при продаже для бассейнов (см. Ниже) она по-прежнему обозначается как «соляная кислота».
Производство стали и металлов: Сталелитейная и металлургическая промышленность используют соляную кислоту для «протравливания» стали с целью удаления поверхностных оксидов.Большая часть стали также очищается кислотой перед цинкованием, лужением и другими покрытиями.
Фармацевтическое производство: Фармацевтическая промышленность использует HCl для различных целей. Он может служить катализатором или реагентом в химических реакциях. Он отлично подходит для точного контроля pH; это важно для некоторых лекарств, чтобы иметь возможность адекватного доступа к определенным физиологическим пространствам (например, крови, лимфатической жидкости), поскольку некоторые из них более кислые, чем другие.
Пищевые добавки и пищевая промышленность: Пищевая промышленность использует соляную кислоту в различных продуктах, хотя подавляющее большинство ее составляет производство обычного «сладкого» пищевого ингредиента кукурузного сиропа с высоким содержанием фруктозы (HFCS). HCl также используется для производства витаминных добавок.
Обработка воды: Одно из применений соляной кислоты — регулирование pH воды в бассейне и аналогичных параметров (например, «горячие ванны»), а также кислотности промышленных сточных вод, чтобы она наносила минимальный ущерб водные организмы в водных путях, в которые они выбрасываются.
Добыча нефти и природного газа: В нефтяной (нефтегазовой) промышленности соляная кислота используется для подкисления нефтяных и газовых скважин. Более низкий pH увеличивает добычу нефти и газа за счет растворения минералов в коренных породах, отделяющих бурильщиков от их карьеров.
Эти минералы, карбонат кальция и карбонат магния, уступают место образованию пор в нефтесодержащих породах.
