Упражнение: 1 Почему гидроксиды натрия и калия называют едкими щелочами? Едкий — значит, разъедает кожу, ткани, бумагу и др. материалы. Это свойство щелочей, т.е. растворов гидроксидов натрия и калия. Упражнение: 3 Составьте формулы оксидов, соответствующих веществам, формулы которых: Fe(OH) 2, Fe(OH) 3, Cu(OH) 2, и дайте их названия. Fe(OH)2 — FeO оксид железа (II) Упражнение: 5 Рассчитайте количество вещества, которое соответствует: а) 120 г NaOH; б) 49 г Cu(OH)2.
| Упражнение: 2 Составьте химические формулы оснований для Cr(II) и Cu(I), назовите их. Гидроксид хрома (II) — Cr(OH)2, Упражнение: 4 Каким из оксидов, формулы которых: CO2, CuO, Cl2O7, P2O5, FeO, MgO, соответствуют основания? Запишите формулы этих оснований и дайте их названия. Основания соответствуют оксидам металлов: CuO, FeO, MgO Упражнение: 6 Найдите массу 5 моль Fe(OH) 2 и 0,5 моль Fe(OH) 3.
|
Оксиды.
 Химия. 8 класс. Викторина
Химия. 8 класс. Викторина
УМК «Химия. 8 класс» О. С. Габриеляна.
Цели:
Обучающие:
- Дать понятие об оксидах и летучих водородных соединениях;
- Продолжить формирование умения записывать формулы оксидов по с. о. и, наоборот, определять с. о. по формуле;
- Закрепить на оксидах знание химической номенклатуры для бинарных соединений;
- Раскрыть связь между химическими знаниями и повседневной жизнью человека.
Развивающие:
- Развивать познавательную активность, умение наблюдать окружающий мир, задумываться над причинами его изменения;
- Совершенствовать навыки само – и взаимопроверки.
Воспитательные:
- Воспитывать культуру речи, поведения.
- Прививать интерес к химии.
Планируемые результаты (учащиеся должны):
- знать определение оксидов, способы их получения, иметь представление о процессе окисления;
- уметь составлять формулы оксидов, летучих водородных соединений, называть их;
- уметь выделять признаки, на основании которых производится классификация оксидов и водородных соединений;
- повторить и обобщить материал о составе веществ, относящихся к оксидам;
- закрепить знания обучающихся составлять формулы и давать названия веществам;
- выяснить практическое значение оксидов в природе и жизни человека.

Тип урока: обобщающее повторение.
Оборудование: таблица химических элементов Д.И. Менделеева; компьютер, мультимедийный проектор, интерактивная доска.
Ход занятия
Здравствуйте! Сегодня мы с вами окунемся в мир неорганических веществ под названием «оксиды», проведем небольшое обобщающее повторение по данной теме. А для этого я приглашаю вас принять активное участие в викторине.
Слайд №1
Викторина « Оксиды»
Каждый может продемонстрировать свои знания, за каждый правильный ответ вы получаете жетон. По окончании викторины будут подведены итоги и количество набранных жетонов определят ваши оценки. Итак, мы начинаем!
Слайд №2
Вопрос: Что называют оксидами?
Ответ: Оксиды – бинарные соединения элементов с кислородом (кроме соединений фтора). Степень окисления кислорода в оксидах равна – II.
Слайд №3
Вопрос: Какова классификация оксидов?
Ответ: Оксиды делятся на три группы: основные, кислотные и амфотерные.
Слайд №4
Вопрос: Чтобы назвать оксид необходимо…
Ответ:
- произнести слово «оксид»,
- дать русское название элементу, который образовал оксид,
- если оксид образован неметаллом или элементом побочной подгруппы, то в скобках римской цифрой указать его валентность (она = степени окисления элемента.)
Пример: SiO2 – оксид кремния (IV)
Слайд №5
Вопрос: Как составить структурную формулу оксида?
Ответ:
- Составление формулы начинать с элемента, атомов которого больше в соединении;
- Атомы кислорода в оксидах между собой связей не образуют;
- Число химических связей, которые может образовать элемент равно его степени окисления по значению.
 Химическая связь обозначается «–»;
Химическая связь обозначается «–»; - Так как кислород в оксидах всегда имеет степень окисления «–2», то от его атома должно отходить две черточки «= »
Слайд №6
Вопрос: Составьте формулы названных в тексте оксидов.
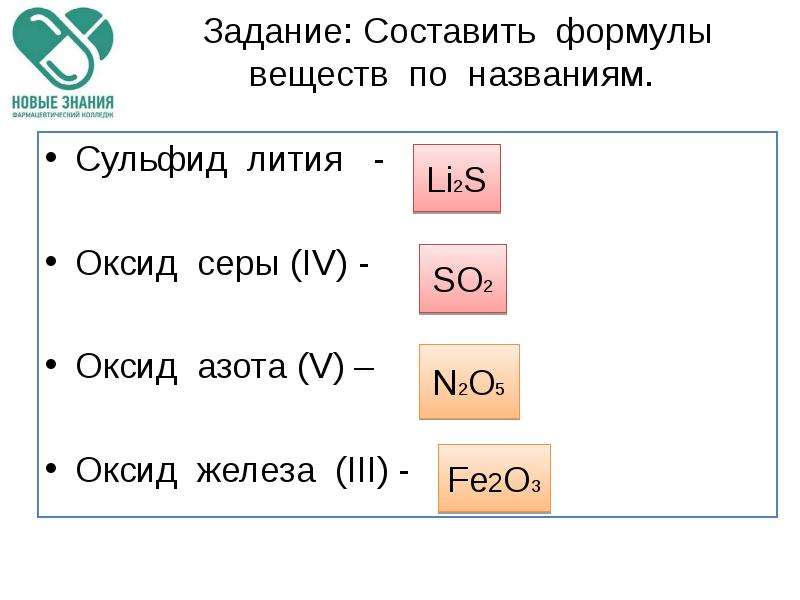
В земной коре-литосфере находятся оксид алюминия (глина), оксид кремния (IV) (песок), оксид железа (III) (содержится в красном железняке)
Ответ:
Al2O3 – оксид алюминия (глина),
SiO2 – оксид кремния (IV) (песок),
Fe2O3 – оксид железа (III) (содержится в красном железняке).
Слайд №7
Вопрос: Составьте формулы названных в тексте оксидов.
Водная оболочка Земли – гидросфера – это оксид водорода (вода)
В воздухе есть оксид углерода (IV) (углекислый газ).
Ответ: Н2О – оксид водорода (вода), СО2 – оксид углерода (IV) (углекислый газ).
Слайд №8
Вопрос: Составьте формулы названных в тексте оксидов.
В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) (угарный газ), оксид серы (IV) (сернистый газ), оксид азота (I) и оксид азота (IV) .
Ответ:
CO – оксид углерода (II) (угарный газ)
SO2 – оксид серы (IV) (сернистый газ)
N2O – оксид азота (I)
NO2 – оксид азота (IV)
Слайд №9
Вопрос: Вычислите массу оксида кальция количеством 0,5 моль.
Ответ: m (CaO) = 28 г.
Слайд №10
Вопрос: Вычислить количество атомов натрия в 0,2 моль оксида натрия
Ответ: n(Na) = 2,408 атомов
Слайд №11
Вопрос: Из перечня веществ выберите оксиды
CuO, Cu(OH)2, HNO3, NO, OF2, H2O, NaOH
Ответ: CuO, NO, H2O
Слайд №12
Вопрос: Как называется оксид (газ), необходимый для фотосинтеза?
Ответ: СО2 – оксид углерода (II) (углекислый газ). Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
Слайд №13
Вопрос: Каждому кислотному оксиду соответствует определенная кислота?
СО2 →
SО2 →
SО3 →
N2О5 →
P2О5 →
Ответ:
СО2 → Н2СО3
SО2 → H2SО3
SО3 → Н2SО4
N2О5 → HNO3
P2О5 → H3PO4
Слайд №14
Вопрос: Каждому основному оксиду соответствует определённое основание?
Na2O →
CaO →
Al2O3 →
FeO →
Fe2O3 →
Ответ:
Na2O → NaOH
CaO → Ca(OH)2
Al2O3 → Al(OH)3
FeO → Fe(OH)2
Fe2O3 → Fe(OH)3
Слайд №15
Вопрос: Самый распространенный оксид на планете?
Ответ: Н2O – вода
Слайд №16
Вопрос: Каковы запасы воды в природе? Сколько из этого запаса приходится на долю пресной воды, в том числе доступной?
Ответ: Запасы воды на Земле составляют 1 млн 359 тыс. м3. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступны людям. Это – ледяной щит Северного Ледовитого океана, Гренландии, Антарктиды.
м3. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступны людям. Это – ледяной щит Северного Ледовитого океана, Гренландии, Антарктиды.
Слайд №17
Меня дает огонь в печи
И пламя маленькой свечи.
И стоит только сделать вдох,
Чтоб я на свет явиться мог.
Я в газированной воде,
Я в хлебе, дыме, я везде!
Вопрос: О каком оксиде идёт речь?
Ответ: CO2 – оксид углерода (IV), углекислый газ
Слайд №18
Вопрос: Какой оксид входит в состав горного хрусталя?
Ответ: SiO2 – оксид кремния (IV)
Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния (IV).
Слайд №19
Вопрос: Это вещество белого цвета, идет для изготовления белой масляной краски (белил). О каком оксиде идет речь?
Ответ: ZnO – оксид цинка.
Слайд №20
Вопрос: Этот оксид используют как пигмент при изготовлении декоративного зеленого стекла и керамики. О каком оксиде идёт речь?
Ответ: Cr2O3 – оксид хрома (III).
Слайд №21
Молодцы!
Подведение итогов. Оценивание ответов обучающихся производится от количества набранных жетонов.
Домашнее задание
Подготовить презентацию по теме «Роль оксидов в жизни человека».
Источники информации:
ПРОВЕРЬ РЕШЕНИЕ — ХиМуЛя
1. Выпишите
отдельно химические формулы кислотных и
основных, амфотерных и безразличных оксидов.
Внимание в
списке есть лишние формулы.
NaOH, Al2O3, K2O, H2SO4, SO3, P2O5, HNO3, CaO, CO, BaO, FeCl3, SiO2, N2O5, Ca(OH)2, Na2O, HCl, NO, H2SO3.
Кислотные | SO3 – оксид серы (VI) P2O5– оксид фосфора (V) SiO2 – оксид кремния N2O5– оксид азота (V) |
Основные | K2O – оксид калия CaO – оксид кальция BaO – оксид бария Na2O – оксид натрия
|
Амфотерные | Al2O3 – оксид алюминия |
Безразличные | CO – оксид углерода NO – оксид углерода |
2. Составьте
формулы оксидов по их названиям и классифицируйте их:
оксид
железа (III) Fe2O3 — амфотерный
оксид
алюминия Al2O3 — амфотерный
оксид
серы (IV) SO2
— кислотный
оксид
азота (III) N2O3— кислотный
оксид
хрома (VI) CrO3— кислотный
оксид
бария BaO — основный
оксид
азота (I) N2O — безразличный
3. Закончите
Закончите
УХР, которые осуществимы:
Na2O + CO2=Na2CO3 3Na2O + P2O5=2Na3PO4 Na2O + SO3=Na2SO4 Na2O + SO2= | CaO + CO2=CaCO3 3CaO + P2O5=Ca3(PO4)2 CaO + SO3=CaSO4 CaO + SO2=CaSO3 | H2O+SO3=H2SO4 H2O+SiO2≠ 3H2O+P2O5t=2H3PO4 Р2O5+H2Oхолод=2HPO3 |
H2O+ZnO≠ H2O+Na2O=2NaOH H2O+CaO=Ca(OH)2 Р2O5+3BeO=Be3(PO4)2 | Na2O + H2SO4=Na2SO4+H2O Na2O +2HNO3=2NaNO3+H2O 3Na2O+2H3PO4=2Na3PO4+3H2O Na2O + H2S=Na2S+H2O | CaO +2HCl=CaCl2+H2O 3CaO +2H3PO4=3H2O+ CaO + H2S=CaS+H2O CaO +2HNO3=Ca(NO3)2+H2O |
2NaOH+SO3=Na2SO4+H2O 2NaOH+SiO2=Na2SiO3+H2O 6NaOH+P2O5=2Na3PO4+3H2O CO2+2NaOH=Na2CO3+H2O |
Ca(OH)2+SO3=CaSO4+H2O Ca(OH)2+SiO2=CaSiO3+H2O 3Ca(OH)2+P2O5=Ca3(PO4)2+3H2O Ca(OH)2+NaOH≠ |
|
4. Закончите УХР
Закончите УХР
получения оксидов:
2Mg+O2=2MgO H2CO3=CO2+H2O 2ZnS+3O2=2ZnO+2SO2 2Fe(OH)3t=Fe2O3+3H2O | CH4+2O2=CO2+2H2O MgCO3t=MgO+CO3 4Al+3O2=2Al2O3 SiH4+2O2= |
|
ICSC 0793 — ОКСИД ЖЕЛЕЗА (II)
ICSC 0793 — ОКСИД ЖЕЛЕЗА (II)
| ОКСИД ЖЕЛЕЗА (II) | ICSC: 0793 |
| ЗАКИСЬ ЖЕЛЕЗА | Апрель 2005 |
| CAS #: 1345-25-1 | |
| EINECS #: 215-721-8 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее при определенных условиях. | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. |
| Кожа | Защитные перчатки. | Ополоснуть и затем промыть кожу водой с мылом. | |
| Глаза | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. | |
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ОКСИД ЖЕЛЕЗА (II) | ICSC: 0793 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: FeO |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Ответы | § 19. Оксиды — Химия, 7 класс
1. Приведите химические формулы трех оксидов, в состав молекул которых входит 1, 2 и 3 атома кислорода.
2. Составьте формулы оксидов, в состав которых входят атомы следующих химических элементов: железо(II), углерод(IV), азот(V), медь(I),сера(VI), хлор(VII).

3. Назовите оксиды: Fe2O3, NO, P2O5, SO2.
Fe2O3 – оксид железа (III),
NO – оксид азота (II),
P2O5– оксид фосфора (V),
SO2 – оксид серы (IV).
4. Кроме принятых международных названий, у некоторых оксидов имеются тривиальные (исторически сложившиеся) названия. Каковы тривиальные названия оксида серы(IV) и оксида углерода(IV)?
Оксид серы (IV) — сернистый газ, оксид углерода (IV) — углекислый газ.
5.
 Какие газообразные оксиды, загрязняющие атмосферу Земли, вы знаете?
Какие газообразные оксиды, загрязняющие атмосферу Земли, вы знаете?
Газообразные оксиды, загрязняющие атмосферу – это сернистый газ, угарный газ, оксиды азота.
6. Почему оксиды являются широко распространенными химическими соединениями на Земле? Какой оксид самый часто встречающийся на нашей планете?
Оксиды являются широко распространёнными химическими соединениями, так как кислород является химически активным веществом и вступает в реакции со множеством простых и сложных веществ. Продуктами этих реакций являются оксиды. Самый часто встречающийся на нашей планете — вода (оксид водорода).
Продуктами этих реакций являются оксиды. Самый часто встречающийся на нашей планете — вода (оксид водорода).
7. Составьте уравнения реакций получения оксидов алюминия, кальция и водорода из простых веществ.
4Al + 3O2 = 2Al2O3 – оксид алюминия;
2Ca + O2 = 2CaO – оксид кальция;
2H2 + O2 = 2H2O – оксид водорода.
8.
 Рассчитайте массовую долю кислорода в оксидах натрия, алюминия, фосфора(III), азота(IV). В каком из них массовая доля кислорода наибольшая?
Рассчитайте массовую долю кислорода в оксидах натрия, алюминия, фосфора(III), азота(IV). В каком из них массовая доля кислорода наибольшая?
9. Молекулы веществ, входящих в состав бензина, состоят из атомов углерода и водорода. Какие вещества образуются при сгорании бензина в автомобильном двигателе? Почему увеличение количества автомобилей, использующих в качестве топлива бензин, приводит к усилению парникового эффекта?
При сгорании бензина в автомобилях будут образовываться оксиды углерода (углекислый газ СО2 и угарный газ СО) и оксид водорода Н2О. так ка при горении бензина образуется углекислый газ, который является парниковым газом, следовательно, увеличение количества автомобилей приводит к усилению парникового эффекта.
так ка при горении бензина образуется углекислый газ, который является парниковым газом, следовательно, увеличение количества автомобилей приводит к усилению парникового эффекта.
Присоединяйтесь к Telegram-группе @superresheba_7,
делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!
Железо. Химия железа и его соединений
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1. 1. Взаимодействие с галогенами
1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д. И. Менделеева.
И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.
(изображение с портала vchemraznica.ru)
Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).
(изображение с портала karatto.ru)
Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.
(изображение с портала livemaster.ru)
Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO
(изображение с портала 900igr. net)
net)
2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).
Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях с образованием нитрида дижелеза:
4Fe + N2 → 2Fe2N
1. 5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида:
5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида:
3Fe + C → Fe3C
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2. 2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц. ) → NO2 + Fe(NO3)3 + 2H2O
) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.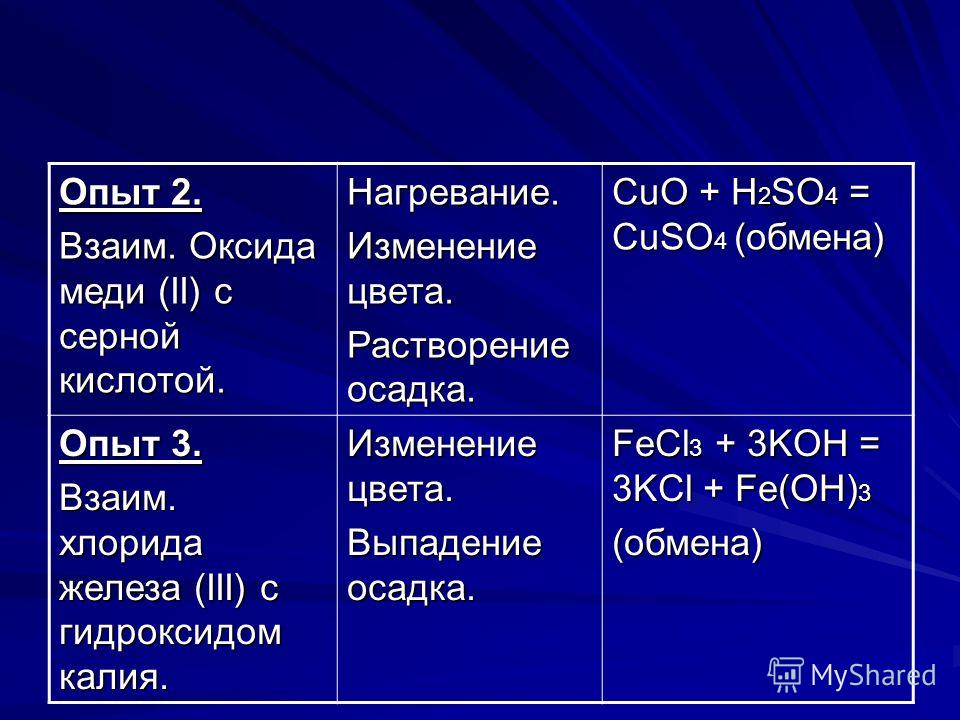
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц. ) → NO2↑ + 3Fe(NO3)3 + 5H2O
) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Железо оксиды — Справочник химика 21
Образующийся сероводород адсорбируют твердыми поглотителями или жидкими абсорбентами. В качестве твердых поглотителей для очистки от сероводорода применяют активированный уголь, гидроксид железа, оксид цинка. При жидкостной абсорбции используют аммиачную воду, этаноламины, мышьяково-содовый раствор, растворы карбонатов и т. п. В азотной промышленности наиболее часто применяют очистку при помощи оксида цинка (поглотитель ГИАП-10) при 350—400°С и объемной скорости до 2000 ч по уравнению реакции [c.86]
Задача Н-3. 1 г смеси железа, оксида железа (II) и оксида железа (III) обработали избытком раствора соляной кислоты при этом выделилось 112 мл водорода (н.у,). При полном восстановлении водородом другой порции исходной смеси массой [c.110]
Углерод. Изотопы углерода. Простейшие углеводороды метан, этилен, ацетилен. Карбиды кальция, алюминия и железа. Оксиды углерода (II) и (IV). Карбонилы переходных металлов. Угольная клслота и ее соли [c.305]
Железа оксиды с примесью оксидов марганца (до 3%) [c.77]
Железа оксиды с примесью свободного диоксида кремния (менее 10 %) и оксидов марганца (менее 6 %) [c.77]
Железа оксиды с примесью общего диоксида кремния (менее 10 %), оксидов марганца (1,5—3 %) и других оксидов металлов (до 10%) [c.77]
Железа оксиды с примесью фтор- или марганецсодержащих соединений (от 3 до 6 %) Железорудные окатыши Железный агломерат Зола горючих сланцев Кальция арсенат [c.77]
Соединения железа. Оксид железа (II) FeO — вещество черного цвета, не растворяется в воде и щелочах, но легко растворяется в кислотах с образованием солей железа (II) [c.279]
ЖЕЛЕЗА ОКСИДЫ. Оксид РеО (в технике-вюстит). В кристаллич. решетке вюстита имеются вакантные узлы, и его состав отвечает ф-ле Ре О, где х = 0,89-0,95 ур-ние температурной зависимости давления разложения IgpiO , в мм рт. ст.) = — 26730/T-f- 6,43 (Г > 1813 К) см. также табл. В воде практически не раств., хорошо раств. в к-тах, р-рах щелочей. Легко окисляется пирофорен. После прокаливания хим. активность и пирофорность FeO снижаются. [c.131]
Скорость косвенного восстановления оксидов железа оксидом углерода (П) пропорциональна концентрации СО в газовой фазе [c.64]
При этом образуется окрашенное в черный цвет пирофорное вещество, по составу близкое к РеО. В то же время полученная таким путем закись железа не является стехиометрическим соединением состава 1 1. Как показали физико-химические исследования [4, с. 89 5], область существования закиси железа стехиометрического состава (1 1) лежит вне области гомогенности, отвечающей веществу, которое принято считать закисью железа. Оксид РеО стехиометрического состава можно получить в системе Ре—О лишь при высокой температуре с последующей закалкой (быстрое охлаждение) для замораживания равновесия. Если охлаждение оказывается недостаточно быстрым, происходит диспропорционирование [c.122]
Железа оксид и руды [c.158]
Как, используя железо, оксид кальция, воду и азотную кислоту, получить оксид железа (III) Составьте уравнения реакций. [c.85]
Исходные вещества гидроксид никеля (II) с содержанием общего никеля ры,- 60,5 % оксидное железо, содержащее 70 % общего железа оксид кадмия с содержанием общего кадмия 87 %. [c.31]
Восстановление примесей. В состав металлизированных материалов шихты (агломерат, окатыши) входят помимо оксидов железа оксиды различных элементов.. По возрастанию срол-ства к кислороду и л ермодинамической прочности их оксидов, они располагаются в ряд Си, Аз, N1, Р, 2п, Мп, V, Сг, 81, Т1, А1, М , Са. Степень восстановления этих элементов в доменной печи соответствует их положению в этом ряду. Медь, мышьяк, фосфор подобно железу почти полностью восстанавливаются и переходят в чугун ЦИНК, хотя и восстанавливается, но возгоняется ванадий и хром восстанавливаются на 70—90%. Алюминий, кальций и магний при доменной плавке не восстанавливаются. [c.65]
Сульфид железа, оксид фосфора, вода -> 15 [c.40]
Процесс Сименса-Мартена проводится в больших печах с открытым подом (мартеновские печи). Для окисления примесей, содержащихся в чугуне, используется кислород, связанный в оксидах железа. Оксиды железа вводятся в процесс в форме ржавого металлолома. [c.405]
Метод часто применяют для определения марганца в сплавах, рудах и шлаках, где обычно содержится довольно много железа. Оксид цинка осаждает ионы железа(III), причем в растворе появляются ионы цинка, необходимые для вытеснения адсорбированных осадком ионов марганца [c.409]
Соединения двухвалентного железа. Оксид железа (И) FeO в природе встречается в виде составной части магнитного железняка FeO FejOg. Кроме того, двухвалентное железо в природе находится в виде кремниевых (оливин, роговая обманка), углекислых, фосфорнокислых и других солей. Лабораторным путем FeO получают при восстановлении накаленного оксида железа (III) водородом или окисью углерода. [c.353]
Общее количество отложений, мг/см Оксиды железа Оксиды хрома Оксиды никеля [c.150]
Стероиды — сложные органические вещества растительного и животного происхождения. КС. относятся стерины, желчные кислоты, половые гормоны, гормоны коркового слоя надпочечников (кортикостероиды) и др. С. имеют важное значение для жизнедеятельности организмов, многие применяются как лекарства. Стехиометрическая формула — химическая формула, отвечающая идеальному целочисленному составу химического соединения из атомов, удовлетворяющая требованию валентности. В твердых телах наблюдаются небольшие отклонения от стехнометрического состава, напр, в сернистом железе, оксидах титана и других соединениях. [c.129]
Известны три оксида железа РегОз, Рез04, РеО. При восстановлении оксидов железа оксидом углерода(11) возможны реакции [c.90]
В водных растворах существуют катионные аквокомплексы [Fe(0h3)e] имеющие бледно-зеленую окраску. Гексааквокомплек-сы образуются при растворении в воде солей Fe(ll) или при взаимодействии с разбавленными кислотами железа, оксида FeO (черный), гидрооксида Fe(0H)2 (белый), сульфида FeS (черный), карбоната Fe Og (белый), например [c.586]
Восстановление оксида железа оксидом углерода в дохменной печи проходит по уравнению реакции [c.50]
Процесс восстановления оксида железа оксидом углерода в доменной печи протекает по уравнению Fe Os (к) + ЗСО (г) = 2Fe (ж) -f S Oj (г) [c.105]
Учащимся предлагают, пользуясь материалом учебника ( 71), характеризовать состав и физические свойства всех этих ве-цеств, записав данные в таблицу со следующими графами сте-16НИ окисления железа, оксиды, гидроксиды, соли (хлориды, ульфаты, нитраты). [c.151]
В конверторном способе расплавленный чугун наливают в грушевидный сосуд — конвертор и продувают через металл воздух. При этом чг.сть углерода окисляется, образуя СОг окислятся также некоторые примеси (Р, S, Si и др.) и частично железо. Оксид фосфора реагирует с добавляемым оксидом СаО и с фуцикла работы конвертора (заканчивающегося выпуском — -300 т стали) составляет около 3 5 мин. Цех, имеющий три конвертора (в то время как два работают, в третьем заменяется футеровка) выплавляет в год около 8 млн. т стали. [c.555]
При взаимодействии сульфата двухвалентного железа о азотной и серной кислотами образуются сульфат трехвалентного железа, оксид азота (II) и вода. Составьте уравнение этой реакции. Вычислите количество сульфата двухвалентного железа, соотвегст-вующее 224 мл (н. у.) оксида азота (II). [c.127]
Соединения трехвалентнога железа. Оксид железа (III) PegOg весьма распространен в природе. Известны три модификации оксида железа, из которых а-РеаОз парамагнитна, а у аОз и б-РсаОз ферромагнитны. [c.354]
СОСТАВ, г/л, ЭЛЕКТРОЛИТОВ И PEXHiMbi ОСАЖДЕНИЯ КОМПОЗИЦИИ ЖЕЛЕЗО —ОКСИД ЦИРКОНИЯ [c.191]
Химический состав сухого вещества осадков колеблется в широких пределах. Сухое вещество сырьк осадков имеегг следующий состав (% массы сухого вещества осадка) 35,4—87,8 С, 4,5—8,7 Н, 0,2—2,7 8,1,8—8 К, 7,6—35,4 О сухое вещество активного ила содержит, % 44,0—75,8 С. 5—8,2 Н, 0,9—2,7 8,3,3—9,8 N. 12,5-43,2 О. В осадках содержатся соединения кремния, алюминия, железа, оксидов кальция, магния, калия, натрия, цинка, никеля, хрома и др. (см. табл. 8.1), а также ряд других соединений и микроэлементов. [c.259]
Неорганическая химия (1987) — [
c.427
]
Учебник общей химии (1981) — [
c.439
,
c.440
,
c.449
]
Химия (2001) — [
c.358
]
Химия справочное руководство (1975) — [
c.180
]
Неорганическая химия (1974) — [
c.390
,
c.391
]
Неорганическая химия Издание 2 (1976) — [
c.444
]
Общая и неорганическая химия (1981) — [
c.169
,
c.565
,
c.567
,
c.570
]
Неорганическая химия (1978) — [
c.410
]
Машинный расчет физико химических параметров неорганических веществ (1983) — [
c.78
,
c.79
,
c.233
]
Общая и неорганическая химия (1994) — [
c.181
,
c.538
,
c.540
,
c.541
]
Неорганическая химия (1994) — [
c.477
,
c.480
,
c.482
,
c.510
]
Биогенный магнетит и магниторецепция Новое о биомагнетизме Т.2 (1989) — [
c.14
,
c.25
,
c.145
,
c.218
,
c.247
,
c.248
]
В чем разница между железом и оксидом железа
Самые маленькие идиосинкразии могут иметь огромное значение. Особенно в мире химии. На Земле 118 известных элементов, которые составляют более девяти миллионов уникальных органических соединений. Все, что требуется, — это небольшое изменение на атомном уровне, чтобы перейти от одного соединения к другому.
Возьмем, к примеру, два часто путаемых кислородных соединения железа, закиси железа (FeO) и окиси железа (Fe 2 O 3 ).Они очень похожи, но большая разница между ними сводится к степени окисления железа. Здесь мы спустимся на атомный уровень, чтобы изучить разницу между закисью железа и оксидом железа. Но чтобы полностью понять разницу, нам нужно понять окисление.
Окисление происходит, когда химическая реакция заставляет электроны двигаться. Когда вещество теряет электроны, мы говорим, что вещество окислилось. Но окисление — это не включение или выключение переключателя.Это происходит по спектру. Чтобы говорить о спектре окисления, которое может испытывать вещество, у нас есть термин «степень окисления». Степень окисления — это уровень окисления, которому подверглось вещество, и выражается через степень окисления.
Итак, степень окисления вещества относится к общему количеству электронов, которые его атомы теряют при связывании. Вещества, которые проходят реакцию окисления, получают номер, добавленный к их названию, чтобы отметить потерю и указать их способность связываться с другими атомами с лишними электронами.
Железо в оксиде двухвалентного железа и оксиде трехвалентного железа проходит реакцию окисления. Чтобы узнать, сколько электронов теряет железо в оксиде железа и оксиде железа при связывании, вам достаточно взглянуть на их общие названия.
Закись железа, широко известная как оксид железа (II), содержит железо, которое потеряло 2 выделения в процессе окисления. Таким образом, он может связываться с другими атомами, у которых есть дополнительные 2 электрона. Оксид железа обычно известен как оксид железа (III).Он содержит железо, которое проиграло 3 выбора и может принимать лишние 3 электрона со связью с другими атомами.
Существует множество соединений железа, каждое из которых играет свою роль в природе. Нам даже нужно железо в составе нашего рациона. Несмотря на то, что может показаться почти тривиальным различием на атомном уровне, разница в степени окисления между оксидом железа и оксидом железа означает, что каждый из них играет уникальную роль в мире.
Закись железа представляет собой черный порошок и, что удивительно, содержит оксид железа.Он используется для производства множества материалов, таких как пластмассы, теплопоглощающее стекло, бумага, керамика и даже резина. Особые оксиды железа высокой чистоты используются для производства керамического магнита, называемого ферритом, который используется в электронике, такой как динамики, телевизоры и ядра памяти компьютеров.
Оксид железа, также известный как гематит, представляет собой красновато-коричневый порошок. Он одобрен FDA для косметического использования, даже вокруг глаз. Но оксид железа наиболее полезен в черной металлургии. Это основной источник железа, использованного для создания всего индустриального мира.
Несмотря на то, что оксид железа и оксид железа имеет бесчисленное множество применений, Noah Technologies может помочь вам получить правильное соединение железа с такой степенью чистоты и грануляции, которая необходима для успеха вашего проекта. Откройте для себя множество соединений железа в нашем огромном онлайн-каталоге. Чтобы поговорить с квалифицированным химиком о нестандартных химикатах и оптовых заказах, свяжитесь с нами сегодня!
КУПИТЬ ОКСИД ЖЕЛЕЗА И ЖЕЛЕЗА У NOAH Chemicals
Noah Chemicals предоставляет клиентам самые чистые химические вещества.Приобретайте эти химические вещества прямо в нашем огромном онлайн-каталоге. Чтобы поговорить с квалифицированным химиком о нестандартных химикатах и оптовых заказах, свяжитесь с нами сегодня!
Оксид железа
ОКИСЬ ЖЕЛЕЗА (II), чистота 99,9%, -10 меш (оксид железа), FeO
Оксид железа
ОКСИД ЖЕЛЕЗА (III), БЕЗВОДНЫЙ, чистота 99,9%, -325 меш, в среднем <3 мкм (оксид железа, безводный), Fe2O3
ОКСИД ЖЕЛЕЗА (III) БЕЗВОДНЫЙ, 99.95% чистота, -325 меш, тип. 0,3 мкм (оксид железа, безводный), Fe2O3
ОКСИД ЖЕЛЕЗА (III), ГИДРАТ, чистота 99%, -325 меш (оксид железа, гидрат), Fe2O3.xh3O
Оксид железа — объяснение, структура, свойства, приготовление, реакции, использование и ответы на часто задаваемые вопросы
Что такое оксид железа?
Оксид железа, который также называют оксидом железа, представляет собой неорганическое соединение, имеющее химическую формулу Fe2O3. Это один из трех основных оксидов железа, а два оставшихся — оксид железа (II) (FeO), который является редким оксидом железа (II и III) (Fe3O4), а также естественным образом встречается в качестве минерального магнетита. .Поскольку минерал называется гематитом, Fe2O3 является основным источником железа для сталелитейной промышленности и легко подвергается воздействию кислот. Часто оксид железа называют ржавчиной. Этот ярлык в некоторой степени полезен, потому что ржавчина обладает многими свойствами и имеет тот же состав. Но в химии ржавчина считается плохо определенным материалом, который можно описать как оксид железа.
Структура оксида железа Fe2O3
Fe2O3 получают в различных полиморфных формах. В качестве первичного, α, железо принимает октаэдрическую координационную геометрию.Это означает, что каждый центр Fe связан с 6 кислородными лигандами. В γ-полиморфе некоторые из Fe находятся в тетраэдрических сайтах с 4 кислородными лигандами.
Рассмотрим структуру оксида железа Fe2O3.
[Изображение будет загружено в ближайшее время]
Свойства оксида железа
IUPAC, название Fe2O3 | Оксид железа |
Молекулярная масса или молярная масса 4 4 159.69 г / моль | |
Плотность | 5,24 г / см³ |
Точка кипения | 3,414 ° C |
° C | |
Химическая формула | Fe2O3 |
Физические свойства оксида железа Fe2O3
Запах | 5 | |
Донор водородной связи | 3 | |
Состояние окисления | +3 | |
| красный | ||
Растворимость | Растворим в сильной кислоте и нерастворим в воде |
Химические свойства оксида железа Fe2O3
Fe2O3 + h3O → Fe (OH) 3
Fe2O3 + h3SO4 → Fe2 (SO4) 3 + h3O
Получение железа Оксид
Оксид железа (III) представляет собой окисление продуктов железа, где он может быть получен в лаборатории путем электролиза раствора бикарбоната натрия, который является инертным электролитом, включая железный анод:
4Fe + 3O2 + 2h3O → 4 FeO (OH)
2 FeO (OH) → Fe2O3 + h3O
Реакции
Одной из наиболее важных реакций оксидов железа является его карботермическое восстановление, которое дает железо, используемое в производстве стали:
Fe2O3 + 3CO → 2Fe + 3CO2
Другая окислительно-восстановительная реакция протекает с алюминием, что является чрезвычайно экзотермической термитной реакцией.
2 Al + Fe2O3 → 2 Fe + AI2O3
Мы можем использовать этот процесс для сварки толстых металлов, включая рельсы железнодорожных путей, с помощью керамического контейнера для воронки расплавленного железа между двумя секциями рельса. Термит также может быть использован для изготовления небольших чугунных скульптур, оружия и инструментов.
При частичном восстановлении вместе с водородным соединением при температуре около 400 ° C образуется магнетит, который называют черным магнитным материалом. Он содержит как Fe (III), так и Fe (II):
3 Fe2O3 + h3 → 2 Fe3O₄ + h3O
Оксид железа (III) нерастворим в воде, но легко растворяется в сильной кислоте.Например, серная и соляная кислоты. Он также хорошо растворяется в растворах хелатирующих агентов, таких как щавелевая кислота и ЭДТА.
Нагревание оксида железа (III) с другими карбонатами или оксидами металлов дает материалы, называемые ферратами (феррат (III)):
ZnO + Fe2O3 → Zn (FeO2) 2
Использование оксида железа Fe2O3
Давайте посмотрим на использование оксида железа в различных отраслях промышленности, перечисленных ниже.
Черная металлургия
В подавляющем большинстве случаев оксид железа (III) используется в качестве сырья для черной металлургии.Например, производство стали, чугуна и нескольких сплавов.
Полировка
Очень тонкий порошок оксида железа называется «красные румяна», «румяна ювелира» или просто как румяна. Его можно использовать для окончательной полировки линз и металлических украшений, а исторически — как косметическое средство. Эти румяна режут медленнее, чем некоторые современные полироли, такие как оксид церия (IV), но, тем не менее, они используются ювелирами для превосходной отделки, которую они могут производить, и при производстве оптики.Румяна слегка окрашивают золото при полировке золота, что придает изделию внешний вид.
Пигмент
Оксид железа также может использоваться в качестве пигмента под названиями «Коричневый пигмент 6», «Коричневый пигмент 7», «Красный пигмент 101». Некоторые из них, например, Pigment Brown 6, Pigment Red 101, одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для использования в косметике. Кроме того, оксиды железа могут использоваться в качестве пигментов в стоматологических композитах наряду с оксидами титана.
Гематит — один из характерных компонентов шведской краски цвета Falu red.
Лекарство
Лосьон Calamine, который используется для лечения легкого зуда, в основном состоит из комбинации оксида цинка, действующего как вяжущее средство, и около 0,5% оксида железа (III), активного ингредиента продукта, действующего как противозудное. Оксид железа (III) красного цвета также в первую очередь и широко ответственен за знакомый нам лосьон розового цвета.
Оксид железа (III) | Энциклопедия.com
ОБЗОР
Оксид железа (III) (EYE-urn three OK-side) представляет собой плотное, красновато-коричневое кристаллическое соединение, которое обычно встречается в виде комков или порошка. Он встречается в природе в виде минерального гематита и является компонентом ржавчины, которая образуется на железных предметах, находящихся на воздухе. Сама по себе ржавчина представляет собой сложную смесь оксидов и гидроксидов железа, включая Fe 2 O 3 , FeO, Fe 3 O 4 и FeO (OH). Гематит может иметь цвет от черного и серебристо-серого до красновато-коричневого и красного в зависимости от типа и количества примесей, присутствующих в оксиде железа (III).Железо (III) также является ферромагнитным. Ферромагнетизм относится к способности вещества становиться очень магнитным, а затем сохранять свой магнетизм.
ОСНОВНЫЕ ФАКТЫ
ДРУГИЕ НАИМЕНОВАНИЯ:
Оксид железа; красный оксид железа; красный триоксид железа
ФОРМУЛА:
Fe 2 O 3
ЭЛЕМЕНТЫ:
Железо; кислород
СОЕДИНЕНИЕ ТИП:
Оксид металла
СОСТОЯНИЕ:
Твердый
МОЛЕКУЛЯРНЫЙ ВЕС:
159.69 г / моль
ТОЧКА ПЛАВЛЕНИЯ:
1565 ° C (2849 ° F)
ТОЧКА КИПЕНИЯ:
Неприменимо
РАСТВОРИМОСТЬ:
Нерастворим в воде и всех обычных органических растворителях; растворим в кислотах
КАК ЭТО ПРОИЗВОДИТСЯ
Гематитит образуется естественным образом, когда железосодержащие породы и минералы вступают в реакцию с кислородом воздуха с образованием оксида железа (III). Оксид можно получить синтетическим путем с помощью множества процедур. В наиболее популярном методе сульфат железа (II) реагирует с гидроксидом натрия (NaOH) с образованием гидроксида железа (II) [Fe (OH) 2 ].Затем гидроксиду железа (II) дают возможность вступить в реакцию с кислородом воздуха с образованием оксида железа (III). Соединение также можно получить путем нагревания сульфата железа (II), гидратированного оксида железа (II) (FeO (OH)) или оксалата железа (III) [Fe 2 (C 2 O 3 ) 3 ].
ОБЩЕЕ ИСПОЛЬЗОВАНИЕ И ПОТЕНЦИАЛЬНЫЕ ОПАСНОСТИ
Оксиды железа (III) на протяжении большей части истории человечества были связаны с производством железа и стали. Железный век, начавшийся в Египте около 4000 г. до н. Э., Был периодом в истории человечества, когда железо использовалось для изготовления инструментов и оружия.Общий подход к очистке металлического железа от железной руды, такой как гематит, заключался в нагревании руды в присутствии углерода. Углерод удаляет кислород из руды, оставляя после себя свободный металл. К первому веку до нашей эры в Китае уже использовались первые известные доменные печи. В доменной печи оксид железа (III) восстанавливается углеродом с помощью дуновения воздуха и тепла. Кислород из воздуха реагирует с углеродом с образованием монооксида углерода, который затем реагирует с оксидом железа (III) с образованием жидкого металлического железа и диоксида углерода.
В восемнадцатом веке доменный процесс получил дальнейшее развитие, так что железо можно было производить в промышленных масштабах. Этот процесс можно проследить до региона вокруг Коулбрукдейла в Шропшире, Англия, примерно в 1773 году, и, как говорят, он стал одним из факторов, инициировавших промышленную революцию. Доменный метод по-прежнему остается одним из основных методов очистки металлического железа от железной руды.
Оксид железа (III) также является одним из старейших известных пигментов и использовался для этой цели во всех крупных цивилизациях.Одними из наиболее известных пигментов, изготовленных из оксида железа (III), были индийский красный, терра-Поццуоли и венецианский красный, они использовались для окрашивания керамической глазури и красок. В зависимости от используемого точного состава оксид железа (III) дает цвет от желтого до оранжевого и красного. Например, гидратированный оксид дает пигмент от желтого до коричневого. Пигменты на основе оксида железа (III) использовались в качестве пигмента для резины, бумаги, линолеума, стекла и многих типов красок, включая специальные краски, используемые для металлических конструкций и корпусов судов.
Интересные факты
- Название гематит происходит от греческого слова «кровь».
- Когда гематит превращается в украшение, его иногда называют черным алмазом.
- Марсоход НАСА Opportunity обнаружил на поверхности планеты мелкие частицы, которые, как считается, в основном представляют собой гематит. Ученые считают, что они образовались миллиарды лет назад, когда на поверхности Марса была вода.
- Люди палеолита в Свазиленде, жившие более 40 000 лет назад, добывали гематит в старейшей из известных шахт, упоминаемых в археологических памятниках, под названием «Львиная пещера».Считается, что они добыли гематит для производства красного пигмента, известного как охра.
Некоторые из других коммерческих и промышленных применений оксида железа (III) включают:
- В качестве катализатора для многих промышленных и химических операций;
- В качестве компонента термита представляет собой смесь оксида железа (III) и порошка алюминия, которая при воспламенении вызывает очень высокие температуры. При сварке используются термитные бомбы;
- В компьютерных жестких дисках, аудиокассетах, видеокассетах и компьютерных гибких дисках для магнитного хранения данных;
- В качестве абразива и полироли для латуни, стали, драгоценных камней и других твердых предметов;
- В качестве протравы при крашении тканей;
- В качестве кормовой добавки для домашних животных для обеспечения необходимого уровня железа в их организме; и
- При производстве магнитов и магнитных материалов.
Воздействие пыли оксида железа (III) может вызвать раздражение глаз и горла. Длительное воздействие частиц пыли может вызвать хроническое воспаление легких.
Слова, которые нужно знать
- КАТАЛИЗАТОР
- Материал, который увеличивает скорость химической реакции без каких-либо изменений в своей химической структуре.
- MORDANT
- Вещество, используемое при крашении и печати, которое химически вступает в реакцию как с красителем, так и с окрашиваемым материалом, помогая удерживать краситель на материале надолго.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Кратчфилд, Чарли. «Re: Что означают разные цвета ржавчины в химическом отношении». Сеть MadSci. http://www.madsci.org/posts/archives/2002–03/1015309769.Ch.r.html (по состоянию на 12 октября 2005 г.).
«Оксид железа». Международная организация труда. http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc15/icsc1577.htm (по состоянию на 12 октября 2005 г.).
Рикеттс, Джон А. «Как работает доменная печь.»Американский институт черной металлургии. Http://www.steel.org/AM/Template.cfm?Section=Home&template=/CM/HTMLDisplay.cfm&ContentID=5433 (по состоянию на 12 октября 2005 г.).
См. Также Окись углерода; Оксид железа (II)
Разница между оксидом железа и оксидом железа — Видео и стенограмма урока
Два разных оксида железа
Обе версии оксида железа являются ионными соединениями, что означает, что они сочетаются с отрицательными ионами в правильном соотношении, так что соединение является электрически нейтральным.Давайте посмотрим на уравнение образования оксида железа.
2Fe + 3 + 3O-2 → Fe2 O3
Образование закиси железа представлено уравнением:
Fe + 2 + O-2 → FeO
Разница в соотношении железа к кислороду в этих двух соединения влияют на различия в свойствах соединения. Посмотрим, в чем эти отличия.
Сравнение оксидов железа
Оксид железа — это соединение, образующееся при взаимодействии железа с кислородом воздуха.Он имеет красновато-коричневый цвет и также известен как минерал гематит и ржавчина. Он используется для изготовления цветных красителей, а железо извлекается в химических процессах для различных целей. Закись железа имеет черный цвет и известна как минеральный вюстит.
Поскольку оксид железа имеет два атома железа и три атома кислорода, он имеет большую молярную массу (159,69 г / моль) по сравнению с оксидом железа (71,84 г / моль). Оксид железа имеет немного более высокую температуру плавления, чем оксид железа, при чуть более 1500 ° C, по сравнению с чуть более 1300 ° C для закиси железа.
На ранней Земле не было атмосферы, богатой кислородом, как сейчас. Железо (II) растворимо в воде и было легко доступно микроорганизмам для выработки кислорода. По мере увеличения уровня кислорода железо реагирует с кислородом с образованием твердого оксида железа. Это привело к тому, что микроорганизмы эволюционировали, чтобы получить необходимое им железо. Оксид железа не растворяется в воде.
Краткое содержание урока
Оксиды железа и двухвалентного железа — это оксиды железа. Железо означает ион железа (III) Fe + 3, а двухвалентное железо означает железо (II), которое представляет собой Fe + 2.Оба эти иона реагируют с кислородом, но оксид железа встречается чаще. Оксид железа — это Fe2O3, а закись железа — это FeO. Закись железа имеет красноватый цвет и известна как минеральный гематит. Оксид железа имеет черный цвет и представляет собой минерал вюстит.
На ранней Земле не было кислорода в атмосфере, а железо (II) растворялось в океанской воде. Это позволило микроорганизмам производить газообразный кислород. Когда уровень кислорода достиг значительного уровня, железо вступило в реакцию с кислородом, образуя оксид железа.
еженедельной работы в сети
Еженедельная работа в Интернете
# 9:
a Расчеты
Использование химических уравнений
, и
Осмотр для подготовки к экзамену
Это задание
должен был быть сдан к полудню вторника, 11 марта 2003 г.
Представленных материалов
больше не принимается.
Пожалуйста, введите свою фамилию, имя
название:
Пожалуйста, введите последний
пять цифр вашего идентификационного номера:
Пожалуйста, введите ник:
(на случай, если ваш ответ будет использоваться в классе).
Вы можете менять свое мнение сколь угодно часто.
Когда вы будете удовлетворены своими ответами, нажмите кнопку ОТПРАВИТЬ.
внизу этой страницы.
Задание на этой неделе преследует две цели. В
Первая цель — решить проблемы с использованием сбалансированных химических уравнений.
Вторая цель — узнать, как проходит ваша подготовка к экзамену 2.
идущий.
Расчеты по химическим уравнениям
Сбалансированное химическое уравнение указывает
относительное количество молекул, участвующих в химической реакции.Ржавчина, оксид железа (III), образуется при взаимодействии железа и кислорода. В
сбалансированное химическое уравнение для этого процесса:
Из вычисленного химического уравнения
4 атома железа реагируют с 3 молекулы кислорода до
выход 2 оксида железа (III) формульных единиц. Или 4 моль
железа атомов реагируют с 3 молями молекул кислорода
с получением 2 моля оксида железа (III) .
Эти мольные отношения можно использовать как
коэффициенты пересчета.
Эти коэффициенты пересчета мольных соотношений
можно использовать во многих расчетах. Если вы хотите узнать номер
молей кислорода, необходимых для полной реакции с 6 молями
железа, вы бы увидели из сбалансированного химического уравнения, что 3
На каждые 4 моля железа требуется моль кислорода.Как бы
вы настраиваете расчет? Какое мольное соотношение вы бы использовали?
Как моль оксида железа (III) может
из 6 молей железа?
Если вы хотите произвести 6 моль
оксид железа (III), сколько молей железа нужно для начала
с участием? (Предположим, у вас есть весь кислород, который вам нужен.)
Способность превращаться из молей одного вещества
к молям другого вещества с использованием мольных соотношений из сбалансированных
химические уравнения — полезный навык. Однако нельзя просто
подойдите к полке и отсчитайте количество атомов или количество молей
вещества. Вместо этого мы взвешиваем вещество и вычисляем
соответствующее количество молей с использованием молярной массы.
Молярная масса Fe составляет 55,845 г (1 моль Fe
= 55,845 г Fe).
Молярная масса O 2 составляет 2 x 16,00 или 32,00 грамма (1
моль O 2 = 32,00 грамма O 2 ).
Масса моля Fe 2 O 3 составляет (2 x Fe)
+ (3 x Кислород) = (2 x 55,845) + (3 x 16,00) = 159,69 грамма (1
моль Fe 2 O 3 = 159.69 грамм Fe 2 O 3 ).
Какова масса в граммах 4,5 моль O 2 ?
Сколько молей Fe 2 O 3
в 75 граммах Fe 2 O 3 ?
Собираем все вместе.
Сколько граммов лития может быть
образованный из 27 граммов нитрида лития согласно следующему
химическое уравнение?
Во-первых, вам нужно преобразовать
27 г нитрида лития на моль нитрида лития (используя
молярная масса нитрида лития в качестве коэффициента пересчета).
Далее вам нужно будет преобразовать родинки
нитрида лития к молям лития (используя мольное соотношение из
вычисленное химическое уравнение.)
Наконец, вы бы преобразовали родинки
лития в граммы лития (используя молярную массу лития как
фактор общения).
Мы сообщаем ответ как 16
г лития.На каждом этапе сохранялась дополнительная значимая цифра.
Избегайте ошибок округления. В конце было выполнено округление, чтобы получить
соответствующее количество значащих цифр в нашем ответе.
Теперь ваша очередь.
Хлорат натрия разлагается на натрий
хлорид и кислород согласно следующему химическому уравнению:
Осмотр для подготовки к экзамену — как
это происходит?
Объясните, как вы готовитесь к
Экзамен 2 идет.Вот некоторые вопросы, на которые вы можете ответить: Как
вы используете конспекты лекций? Это отличается от того, как вы использовали
их при подготовке к экзамену 1? Сколько домашней работы вы сделали?
Это процент больше или меньше, чем то, что вы сделали из глав?
1-3? А как насчет практических экзаменов? Использование учебника? Наставничество?
Какие еще стратегии вы используете для изучения химии?
Для получения удовлетворительного
оценка, необходимо ответить на все вопросы и дать пояснения
за ваши ответы по запросу.
Помните, поскольку
этот файл находится в архиве, вы больше не можете его отправить.
связь — Альтернативные способы записи химической формулы и номенклатуры: оксид свинца (IV), Pb (NO3) 2, оксид железа (II), связь оксида водорода
— Альтернативные способы записи химической формулы и номенклатуры: свинец ( IV) оксид, Pb (NO3) 2, оксид железа (II), оксид водорода — Chemistry Stack Exchange
Сеть обмена стеков
Сеть Stack Exchange состоит из 177 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange
0
+0
- Авторизоваться
Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов, изучающих химию.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществу
Кто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено
744 раза
$ \ begingroup $
Каждая из следующих формул или химических названий содержит ошибку.Поправьте каждый пример.
Это решение в листе ответов (левая часть знака равенства — это вопрос, а правая часть — ответ)
оксид свинца (III) = оксид свинца (IV)
Pb (NO $ _3 $) $ _ 3 $ = Pb (NO $ _3 $) $ _ 2 $
оксид железа = оксид железа (II)
оксид дигидрогена = оксид водорода
Если взять один из этих примеров, я знаю, что свинец существует как в виде свинца (II), так и свинца (IV).Было бы неправильно исправить первое название на оксид свинца (II), а не оксид свинца (IV)?
Могу ли я сделать аналогичные футляры для $ \ ce {Pb (NO3) 4} $, оксида железа (III) и монооксида дигидрогена
Создан 10 дек.
дидгоки
31711 золотой знак44 серебряных знака1010 бронзовых знаков
$ \ endgroup $
$ \ begingroup $
Да, ваш вопрос непонятен по своей сути.За исключением одного, все ваши соединения могут быть неправильными во многих отношениях. Вот как:
Очевидно, свинец (III) не имеет стабильной степени окисления свинца; это свинец (II) и свинец (IV). Однако существует три различных, очень распространенных оксида свинца (а потенциально и больше):
- оксид свинца (IV) $ \ ce {PbO2} $ (черный)
- Оксид свинца (II, IV), также называемый шпинелью свинца, $ \ ce {Pb3O4} $ (оранжевый)
- оксид свинца (II) $ \ ce {PbO} $
Из-за своего цвета они обычно обозначались как German flag при качественном неорганическом анализе в Мюнхене.Без дополнительной информации невозможно определить, какой оксид свинца имеется в виду.
Насколько мне известно, известен только один нитрат свинца; таким образом, $ \ ce {Pb (NO3) 4} $ будет недействительным. Однако я не знаю почему, поскольку и нитрат, и свинец (IV) должны быть окислителями и, таким образом, в принципе могут сочетаться.
Та же проблема со свинцом, только хуже:
- оксид железа (II) $ \ ce {FeO} $ (черный)
- оксид железа (III) $ \ ce {Fe2O3} $ (красный)
- Википедия перечисляет шесть различных оксидов железа (II, III), от $ \ ce {Fe3O4} $ (железная шпинель) до $ \ ce {Fe25O32} $.
Оксид водорода, раствор в листе ответов, на самом деле должен быть помечен как неясно. Оксид дигидрогена явно относится к воде $ \ ce {h3O} $, но вода — не единственный оксид водорода. Разница здесь по сравнению с предыдущими ответами заключается в том, что теперь изменяется степень окисления кислорода: $ \ ce {h3O2} $ можно назвать диоксидом водорода. И в том же ключе, в котором другие соединения $ \ ce {A2B2} $ теряют свои числовые обозначения, оксид водорода может также относиться к соединению $ 1: 1 $ $ \ ce {h3O2} $.Однако я сомневаюсь, что это было намерением листа для ответов; поскольку оксид дигидрогена является однозначным.
Создан 11 дек.
JanJan
6.9k1010 золотых знаков156156 серебряных знаков335335 бронзовых знаков
$ \ endgroup $
3
Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Ваша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie
Настроить параметры
Реакция железа с кислородом | Реакции металлов с кислородом
Обзор главы
1.5 недель
В этой главе учащиеся снова столкнутся с реакциями выбранных металлов с кислородом, которые использовались в качестве примеров в предыдущей главе. В этой главе, однако, больше внимания будет уделено действительным реакциям — они должны быть продемонстрированы классу — и общности между ними. И снова написание химических уравнений будет поддерживаться процессом, начиная со словарного уравнения (макроскопическое представление) и переходя через графическое уравнение (субмикроскопическое представление) к химическому уравнению (символьное представление).
Содержание также было представлено в несколько ином порядке, чем CAPS, в том смысле, что сначала исследуются примеры реакций, а затем объясняется общая реакция металлов с кислородом, как только учащиеся уже видели примеры химических уравнений.
3.1 Реакция железа с кислородом (1 час)
Задачи | Навыки | Рекомендация |
Деятельность: Три разных уровня интерпретации в науке | Сортировка и классификация, интерпретация, идентификация | Дополнительно (версия) |
Активность: Реакция железа с кислородом | Демонстрация сжигания стальной ваты, наблюдение, запись, общение, описание | CAPS рекомендуется |
3.2 Реакция с магнием и кислородом (1 час)
Задачи | Навыки | Рекомендация |
Активность: Реакция магния с кислородом | Демонстрация горения магния, наблюдение, запись, сообщение, описание | CAPS рекомендуется |
3.3 Общая реакция металлов с кислородом (0,5 часа)
(Вопросы по тексту)
3,4 Образование ржавчины (1,5 часа)
Задачи | Навыки | Рекомендация |
Активность: Реакция между железом и кислородом в воздухе | Демонстрация, наблюдение, запись, описание, | Дополнительно (рекомендуется) |
Упражнение: Почему ржавчина — проблема? | Выявление проблем и проблем | Дополнительно (рекомендуется) |
3.5 способов предотвращения ржавчины (0,5 часа)
(Вопросы по тексту)
- Что происходит, когда металл вступает в реакцию с кислородом?
- Как называется товар?
- Как мы можем представить общую реакцию между металлом и кислородом?
- Что такое реакция горения?
- Что такое ржавчина и как она образуется?
- Как сделать железо более устойчивым к ржавчине?
В предыдущей главе мы научились писать и балансировать уравнения.Мы узнали о трех примерах:
магний + кислород → оксид магния
железо + кислород → оксид железа
медь + кислород → оксид меди
Из каких групп происходят магний, железо и медь?
Магний — группа 2, железо — группа 8, медь — группа 11.Это важно, поскольку элементы в одной группе будут реагировать одинаково.
В этих реакциях все элементы, которые вступают в реакцию с кислородом, представляют собой металл . Если вы не уверены в этом, найдите их в Периодической таблице, приведенной ниже, в начале вашей книги. Вы видите, что все они находятся в области, занятой металлами? Где металлы расположены в Периодической таблице?
Названия продуктов трех вышеуказанных реакций имеют нечто общее.Запишите имена. Вы видите, что у них общего?
Продукция: оксид магния, оксид железа, оксид меди. Все они имеют в своем названии слово «оксид».
Продукция состоит из оксидов металлов . Что такое оксиды металлов? Как мы увидим позже, когда будем рисовать диаграммы и писать формулы для представления этих реакций, это соединения, в которых металл соединяется с кислородом в некотором фиксированном соотношении.
Металлы будут реагировать аналогичным образом с другими элементами той же группы, что и кислород (группа 16).
В этой главе мы собираемся более подробно рассмотреть две реакции, показанные ранее. Помните, что это не единственные реакции металлов с кислородом; это как раз те, которые были выбраны в качестве примеров.
Сначала мы понаблюдаем за собственными реакциями. Ваш учитель продемонстрирует, а вы сделаете наблюдения.Впоследствии мы напишем об этих реакциях, используя «научный язык», поскольку мы будем писать уравнения реакций для каждой из них. Прежде чем мы начнем, напомним кое-что, что мы обсуждали в главе 1.
В первой главе Гр. 9 Материя и материалы, мы узнали, что ученые интерпретируют химические реакции на трех разных уровнях. Эти три уровня:
- макроскопический уровень;
- субмикроскопический уровень; и
- символический уровень.
Проверьте, помните ли вы, к чему относится каждый уровень, заполнив следующую таблицу.
Когда мы делаем следующее: | Мы работаем на этом уровне: (Макроскопический / субмикроскопический / символический) |
Наблюдайте за реальными реакциями (видеть, слышать, обонять, осязать, ощущать вкус). Опишите словами то, что мы видим. | |
Представьте себе поведение частиц во время реакций. Нарисуйте изображения частиц в веществах. | |
Напишите химические формулы. Напишите уравнения реакций. |
Когда мы делаем следующее: | Мы работаем на этом уровне: (Макроскопический / субмикроскопический / символический) |
Наблюдайте за реальными реакциями (видеть, слышать, обонять, осязать, ощущать вкус). Опишите словами то, что мы видим. | Макроскопический |
Представьте себе поведение частиц во время реакций. Нарисуйте изображения частиц в веществах. | Субмикроскопический |
Напишите химические формулы. Напишите уравнения реакций. | символическое |
Вскоре ваш учитель продемонстрирует две реакции, а вы будете проводить наблюдения. На каком из трех уровней вы будете работать?
Цель этих демонстраций — дать вам возможность сделать макроскопические наблюдения за химическими изменениями, происходящими во время реакций.Эта глава также поможет вам связать макроскопические наблюдения с изображениями и уравнениями, которые вы научились писать в предыдущей главе.
Реакция железа с кислородом
Мы рассмотрим, как железо реагирует с кислородом. В некоторых случаях для этих экспериментов можно использовать стальную вату. Вы знаете, что такое стальная вата? Это проволочная вата из очень тонких стальных нитей. Сталь — это сплав, состоящий в основном из железа.Итак, когда мы смотрим на то, как стальная вата горит в кислороде, мы фактически смотрим на то, как железо реагирует с кислородом.
Металлический сплав представляет собой твердую смесь двух или более различных металлических элементов. Примеры — сталь и латунь.
Прядение стальной ваты создает интересные фотографии, поскольку утюг горит в кислороде и образует оранжевые искры. http://www.flickr.com/photos/rockandrollfreak/7697586652/ Железные стружки выглядят как искры, когда они горят в синем пламени горелки Бунзена.
Вы можете посмотреть видео сжигания стальной ваты здесь:
Ваш учитель проведет демонстрацию, в которой железо сжигается на воздухе. Когда вещество горит на воздухе, реакция называется реакцией горения . Когда вещество горит на воздухе, оно действительно вступает в реакцию с кислородом.
Рекомендуется продемонстрировать эту реакцию учащимся из-за опасностей, связанных с сжиганием металлов.
Меры предосторожности, которые необходимо соблюдать во время демонстраций:
- Надевайте защитные очки и защитное пальто.
- Соблюдайте осторожность при сжигании стальной мочалки, так как при этом могут образоваться искры. Следует предостеречь учащихся от того, чтобы они не подходили слишком близко во время демонстрации.
- Поместите под ним чистый стакан или часовое стекло, чтобы уловить любой оксид металла, образующийся во время реакции. Впоследствии студенты могут изучить продукт реакции, чтобы сформулировать свои наблюдения.
МАТЕРИАЛЫ:
- Горелка Бунзена или спиртовка
- совпадений
- защитные очки
- стальная вата
- щипцы
ИНСТРУКЦИЯ:
- Ваш учитель продемонстрирует горение железа в кислороде (который присутствует в воздухе).
- Вы должны внимательно наблюдать во время демонстрации и записывать их в отведенных ниже полях.Чтобы помочь вам, были предоставлены некоторые вопросы.
ВОПРОСЫ:
В этой демонстрации мы использовали стальную вату, но из чего она в основном состоит?
Стальная вата — это сплав, в основном состоящий из железа. ПРИМЕЧАНИЕ: Другие элементы стали включают углерод, марганец, фосфор, серу, кремний и следы кислорода, азота и алюминия.Учащимся не нужно знать названия других элементов стальной ваты.
Посмотрите на металл, прежде чем он сгорит. Опишите, как это выглядит.
Наблюдения учащихся могут включать любое из следующего: Стальная вата состоит из тонких железных нитей. Похоже на волосы из металла.В зависимости от состояния стальной ваты учащиеся могут описать ее как блестящую, тускло-серую, металлическую или даже ржавую. Поощряйте творческие описания.
Вы видите кислород, с которым будет реагировать металл? Вы можете это описать?
Газообразный кислород нельзя увидеть или непосредственно наблюдать, поэтому его нельзя описать.
Что вы наблюдаете во время реакции? Опишите все, что вы видите, слышите или чувствуете запах.
- Учащиеся могут видеть горящую стальную вату и падающие ярко-оранжевые искры. Они могут даже заметить дым.
- Учащиеся могут слышать треск горящей стальной ваты.
- Учащиеся могут заметить металлический запах в воздухе.
- Учащиеся могут ощущать тепло от реакции горения.
Как выглядит продукт реакции? Опишите его как можно подробнее.
Продукт красновато-коричневого цвета, рассыпчатый.
Оксид железа используется в качестве пигмента в красках, поскольку он бывает коричневого и красного цвета.
Если вы думаете, что реакция при горении железа в кислороде впечатляющая, следующая демонстрация вас поразит!
Реакция магния с кислородом
Ваш учитель проведет демонстрацию, в которой магний сжигается на воздухе.
Магний горит ярким белым пламенем.
Видео, показывающее горение магния в кислороде
Рекомендуется продемонстрировать учащимся реакцию из-за опасности, связанной с горением металлов.
Инструкции :
- Надевайте защитные очки и защитное пальто.
- Предупредите учащихся, чтобы они не смотрели прямо на сильное белое пламя, возникающее при горении магния.
- Поместите под ним чистый стакан или часовое стекло, чтобы улавливать оксиды металлов, образующиеся во время каждой реакции. Впоследствии студенты могут изучить продукт реакции, чтобы сформулировать свои наблюдения.
Вы можете оставить продукт реакции горения магния для последующего эксперимента в главе Реакции кислот с оксидами металлов.
- На этом этапе также можно смешать продукт с водой и проверить, является ли он кислотой или основанием.
МАТЕРИАЛЫ:
- Горелка Бунзена или спиртовка
- совпадений
- защитные очки
- магниевая лента
- щипцы
- стекло для часов или стакан
ИНСТРУКЦИЯ:
- Ваш учитель продемонстрирует горение магния в кислороде.
- Вы должны внимательно наблюдать во время демонстрации и записывать их в отведенных ниже полях.
ВОПРОСЫ:
Опишите физическую форму (форму) металла в этом эксперименте.
Магний находится в форме магниевой ленты.
Что мы называем реакциями, при которых вещество горит на воздухе?
Как бы вы описали внешний вид или цвет металла до того, как он сгорел?
Наблюдения учащихся могут включать любое из следующего: Магниевая лента выглядит как тонкая полоска металла.Похоже на металлическую ленту. В зависимости от состояния ленты учащиеся могут описать ее как блестящую, темно-серую, черную, металлическую или даже потускневшую. Поощряйте творческие описания.
Вы видите кислород, с которым будет реагировать металл? Вы можете это описать?
Газообразный кислород нельзя увидеть или непосредственно наблюдать, поэтому его нельзя описать.
Что вы наблюдаете во время реакции? Опишите все, что вы видите, слышите или чувствуете запах.
- Учащиеся могут увидеть горящий магний в ослепляющем белом свете. Они могут заметить дым.
- Учащиеся могут слышать потрескивание или шипение во время горения магния.
- Учащиеся могут заметить в воздухе горячий металлический запах.
- Учащиеся могут ощущать тепло от реакции горения.
Как выглядит продукт реакции? Опишите его как можно подробнее.
Продукт представляет собой мягкое белое порошкообразное твердое вещество.
Магний находится во 2-й группе Периодической таблицы. Вы помните, как мы говорили, что элементы в одной группе будут вести себя одинаково. Это означает, что они будут реагировать аналогичным образом. Мы изучили, как магний реагирует с кислородом, но кальций, например, ведет себя аналогичным образом. Вы можете посмотреть видео по ссылке для посещения, чтобы подтвердить это.
Видео, показывающее реакцию кальция с кислородом
Следующая диаграмма объединяет макроскопические, субмикроскопические и символические представления реакции, которую вы только что наблюдали.
Чтобы сделать фото в темноте, нам понадобится вспышка фотоаппарата. В наши дни большинство камер имеют встроенные вспышки. Но самые ранние вспышки работали с порошком для вспышек, который содержал зерна магния. Их нужно было зажечь вручную и гореть очень ярко в течение очень короткого периода времени.
Фотограф использует старинную камеру и вспышку, работающую с магниевым порошком. http://en.wikipedia.org/wiki/File:1909_Victor_Flash_Lamp.jpg
Теперь, когда мы провели макроскопические наблюдения этих двух реакций, мы готовы написать об этих реакциях научным языком.
Общая реакция металлов с кислородом
- словесное уравнение
- уравнение изображения
- химическое уравнение
- реактивы
- товар
- оксид металла
Давайте начнем с написания словесных уравнений для двух только что выполненных нами реакций.Словесные уравнения часто легче писать, чем графические уравнения или химические уравнения, поэтому они являются хорошей отправной точкой, когда мы хотим писать реакции.
Напишите словесное уравнение для реакции между железом и кислородом и для реакции между магнием и кислородом.
Уравнения слов:
Вы можете написать это на доске.
Слово уравнение
Мы можем написать общее словесное уравнение для реакций, в которых металл реагирует с кислородом:
металл + кислород → оксид металла
Когда мы используем слова для описания реакции, мы все еще работаем на макроскопическом уровне.Затем мы собираемся перевести наше словесное уравнение в уравнение изображения.
Уравнение изображения
Когда мы представляем химическую реакцию в виде диаграммы частиц, как, например, в приведенном ниже уравнении, мы работаем на субмикроскопическом уровне.
Можете ли вы определить реагенты в приведенном выше уравнении? Пурпурные атомы — это магний, а атомы кислорода — красные.Запишите название и химическую формулу продукта реакции.
Продукт оксид магния (MgO)
Картина не одинакова для всех реакций металлов с кислородом.
Химическое уравнение
Мы можем пойти дальше и перевести уравнение реакции между магнием и кислородом в химическое уравнение:
2 Mg + O 2 → 2 MgO
Поскольку химическое уравнение состоит из символов, мы можем рассматривать его как символическое представление.
Можете ли вы вспомнить, как называются числа перед формулами в химическом уравнении? Вы можете вспомнить, как называются числа в химической формуле?
Коэффициенты и индексы соответственно.
Как мы уже сказали, металлы одной группы будут реагировать с кислородом таким же образом, как и друг друга. Итак, кальций реагирует с кислородом так же, как магний реагирует с кислородом.Химические уравнения также показывают сходство. Химическое уравнение реакции между кальцием и кислородом:
2Ca + O 2 → 2CaO
Как называется продукт в этой реакции?
Из какой группы входят кальций и магний?
Оксид металла имеет общую формулу MO или M 2 O. В формуле M представляет собой атом металла, а O представляет собой кислород.Таким образом, мы можем сказать, что металлы из группы 2 будут реагировать с кислородом и будут иметь следующее общее уравнение, где M представляет металл группы 2:
2M + O 2 → 2MO
Встречаются также оксиды металлов типа M 2 O 3 и MO 2 , но мы ограничимся рассмотрением первых двух типов.
Чтобы узнать, будет ли MO или M 2 O правильной формулой, вам следует запомнить два простых правила:
Это предлагаемый способ помочь учащимся писать формулы.Как только учащиеся узнают о валентностях в гр. 10-12, они смогут использовать эту информацию для написания формул соединений. на данный момент этого достаточно.
Оксиды металлов из группы 1 Периодической таблицы будут иметь формулу M 2 O.
Можете написать два примера? Посмотрите на Периодическую таблицу в начале книги, выберите два любых металла из группы 1 и напишите их формулы, используя это правило.
Любые два из следующих: Li 2 O, Na 2 O, K 2 O, Rb 2 O, Cs 2 O
Оксиды металлов группы 2 будут иметь формулу MO.
Можете написать 2 примера?
Любые два из следующих: BeO, MgO, CaO, SeO, BaO
Металлы группы 1 обозначаются как щелочные металлы , а металлы группы 2 обозначаются как щелочноземельные металлы .
Железо из группы 8. Вот графическое уравнение реакции между железом и кислородом (железо — зеленое, а кислород — красное).
Напишите химическое уравнение и словесное уравнение этой реакции под уравнением-изображением.
Учащиеся должны написать следующее в соответствии с соответствующими картинками на приведенной выше диаграмме:
В следующем разделе мы вернемся в макроскопический мир, чтобы увидеть еще один пример реакции между железом и кислородом, с которым вы должны быть хорошо знакомы — образование ржавчины.
Образование ржавчины
- ржавчина
- коррозия
- коррозионный
- нержавеющая
- сталь
Вы знаете, что такое ржавчина? Рисунки ниже дадут некоторые подсказки.
Различные предметы, которые ржавеют. http: // www.flickr.com/photos/flattop341/347445202/
Предлагаем вам упражнение, чтобы показать, как образуется ржавчина. CAPS этого не требует. Его можно настроить как демонстрацию. Затем вы можете сравнить эту реакцию с той, которую вы проводили ранее, когда железо сжигалось в кислороде в реакции горения.
Для этого эксперимента потребуется место, где он может оставаться нетронутым в течение двух или трех дней.Возможно, стоит настроить этот эксперимент в начале этого раздела. Обратите внимание: пробирку может быть трудно очистить в конце этого эксперимента.
МАТЕРИАЛЫ:
- пробирка
- зажим
- стойка для реторты
- блюдо
- опилки железные
- вода
ИНСТРУКЦИЯ:
- Промойте пробирку водой, чтобы смочить внутреннюю часть.
- Осторожно посыпьте шпателем железные опилки по бокам пробирки.
- Переверните пробирку в посуду с водой. Используйте зажим, прикрепленный к стойке для реторты, чтобы удерживать пробирку на месте.
- В течение трех дней вода должна оставаться над краем пробирки.
Вот простая схема, показывающая экспериментальную установку с зажимом, удерживающим пробирку в вертикальном положении.
ВОПРОСЫ:
Как выглядят железные опилки в начале эксперимента?
Они серебристого цвета.
Какие реагенты в этом эксперименте?
Железо и кислород (и вода).
Есть ли что-то, что помогает или ускоряет реакцию?
Как выглядит продукт по окончании реакции?
Коричнево-красный цвет.
Ржавчина — это слово, обозначающее хлопьевидный, твердый красновато-коричневый продукт, который образуется на железе при реакции с кислородом воздуха.
Когда учитель сжигал железо раньше, он быстро реагировал с кислородом с образованием оксида железа. Вот изображение оксида железа, чтобы напомнить вам, как он выглядел.
Образец оксида железа.
Ржавчина — форма оксида железа
Когда железо подвергается воздействию кислорода воздуха, происходит аналогичная реакция, но гораздо медленнее.Железо постепенно «съедается», поскольку оно медленно вступает в реакцию с кислородом. Во влажных условиях железо быстрее ржавеет.
Ржавчина на самом деле представляет собой смесь различных оксидов железа, но Fe 2 O 3 из нашего предыдущего примера является важной частью этого. Ржавчина железа на самом деле является хорошим примером процесса коррозии.
Напомните учащимся, где еще они слышали термин «коррозионный», использованный ранее в «Материи и материалах».Он используется для описания сильных кислот и оснований, с которыми учащиеся впервые познакомились на гр. 7 Материя и материалы, и мы еще раз рассмотрим их позже в этом семестре.
Ржавчина, как правило, происходит намного быстрее у океана. Мало того, что есть капли воды, в этих каплях есть соль, что делает их еще более агрессивными. Ржавчина также происходит быстрее в присутствии кислот. В лабораториях или на заводах, где используются или хранятся кислоты, воздух также очень агрессивен.Когда воздух в определенной области содержит влагу, смешанную с кислотой или солью, мы называем эту область агрессивным климатом .
Брошенная машина у моря быстро ржавеет и разъедает. http://www.flickr.com/photos/mikebaird/4585328947/
Если вы живете в агрессивном климате, например, у океана, часто лучше делать оконные рамы и двери вашего дома из дерева, а не из железа и стали, потому что дерево не ржавеет.Многие люди также используют алюминий, поскольку этот металл не ржавеет.
Проблема с ржавчиной
Ржавчина — это естественный процесс, и его эффекты могут быть очень красивыми.
Садовая скульптура, которая должна была ржаветь, чтобы придать ей больше текстуры. http://www.flickr.com/photos/lizjones/449708229/
Однако железо и ржавчина (оксид железа) — совершенно разные материалы и поэтому обладают разными свойствами.
Это ссылка на то, что учащиеся сделали в предыдущих классах в отношении свойств материалов.
Представим, что мы изготовили что-то из железа. Какими свойствами железа мы хотим воспользоваться?
Железо — это металл, поэтому он твердый, прочный и гибкий.
Как вы думаете, какие предметы мы делаем из железа, если эти свойства желательны?
Инструменты, замки, петли, шурупы и гвозди, гаражные ворота … перечень предметов практически бесконечен!
Когда предмет сделан из железа, мы можем защитить его от ржавчины, чтобы он не потерял желаемые свойства.Как вы думаете, ржавая цепь и дверная ручка на следующих фотографиях будут такими же прочными и гибкими, как когда они были новыми? Почему нет?
Ржавая цепь. http://www.flickr.com/photos/a2gemma/2373078360/ Ржавая дверная петля. http://www.flickr.com/photos/49889874@N05/4883527730/
Нет, они не будут такими сильными. Ржавчина — это соединение, отличное от элемента железа, и поэтому она имеет другие свойства.Это начинает ослаблять предметы.
Из предыдущих марок вы, возможно, уже узнали, что железо можно укрепить и сделать более устойчивым к ржавчине, смешав его с другими элементами, чтобы превратить его в сталь .
Сталь используется при строительстве зданий, потому что она очень прочная. Однако сталь не является полностью устойчивой к ржавчине, и ее необходимо защищать от ржавчины, особенно во влажном и агрессивном климате.
Строящееся здание. Вы можете увидеть каркас из стали. http://www.flickr.com/photos/ell-r-brown/5375682861/ Стальная арматура для поддержки здания. Как видите, сталь тоже может ржаветь. http://www.flickr.com/photos/sbeebe/5225048839/
В следующем разделе мы узнаем о различных способах защиты железа и стали от ржавчины.
Способы предотвращения ржавчины
- столкновение
- шлагбаум
- открытые
- пористый
- пробить
- хромированный металл
- металл оцинкованный
- оцинковка
- окислить
Ржавчина образуется на поверхности железного или стального предмета, когда эта поверхность вступает в контакт с кислородом.Молекулы кислорода сталкиваются с атомами железа на поверхности объекта и реагируют с образованием оксида железа. Если бы мы хотели предотвратить это, что бы мы должны были делать?
Нам нужно поместить что-нибудь между кислородом и железом, чтобы они не могли контактировать.
Краска защищает от ржавчины
Если бы мы хотели предотвратить контакт атомов железа и молекул кислорода, нам нужно было бы установить между ними барьер.Это то, что мы делаем, когда красим железную поверхность, чтобы защитить ее от ржавчины.
Однако краска
не является главным препятствием. Если поверхность краски поцарапана или начнет отслаиваться, металл обнажится, и ржавчина все еще может образоваться.
Другие металлы как барьеры против ржавчины
Ржавчина — пористый материал. Это означает, что воздух и вода могут проникать сквозь ржавчину на поверхности предмета и достигать утюга, находящегося под ним.Утюг будет продолжать разъедать, даже если он покрыт толстым слоем ржавчины. Таким образом, даже если поверхность железа покрыта, она не защищена, потому что молекулы кислорода все еще могут достигать железа, чтобы вступить с ним в реакцию.
Есть несколько других способов остановить или замедлить рост ржавчины. Один из способов защитить поверхность железа — это покрыть ее металлом, который не подвержен коррозии, например, хромом. Смесители и сантехника часто изготавливаются из «хромированного» железа.Они были покрыты слоем хрома, чтобы защитить поверхность железа от контакта с воздухом.
Хромированные краны в умывальник. http://www.flickr.com/photos/a_mason/3212274/
Спросите учащихся, почему, по их мнению, особенно важно защищать смесители в ванных комнатах и умывальниках от ржавчины. Это потому, что они находятся во влажной, влажной среде, и вода делает железо более подверженным ржавчине.
Цинк также реагирует с кислородом с образованием оксида цинка:
2 Zn + O 2 → 2 ZnO
В какую группу входит цинк?
Цинк принадлежит к группе, отличной от железа в Периодической таблице.Это говорит нам о том, что оно не реагирует так же, как железо с кислородом.
Оксид цинка (ZnO) не является пористым оксидом, а образует плотный защитный слой, через который не может проникнуть кислород или вода. Железо может быть покрыто тонким слоем цинка в процессе, называемом гальванизация . Слой цинка быстро реагирует с кислородом, образуя оксид цинка. Этот слой защищает находящийся под ним цинк от дальнейшего окисления. Он также защищает железо под цинком от контакта с кислородом.
Коррозия и ржавчина (видео)
На следующем рисунке показан сегмент из оцинкованной стали с царапиной на защитном покрытии. Как вы думаете, что произойдет со сталью, которая подвергнется воздействию воздуха из-за царапины на покрытии?
Открытая сталь со временем заржавеет.
Сегмент из оцинкованной стали с повреждением цинкового покрытия.
Оцинкованное железо используется для различных целей. Скорее всего, вы видели, как его используют в качестве оцинкованных кровельных панелей или других оцинкованных строительных материалов, таких как шурупы, гвозди, трубы или полы.
Образование ржавчины и как его предотвратить (видео)
Оцинкованные панели для стен или крыши. Оцинкованная лейка. http://www.flickr.com/photos/cwisnieski/5947754467/ Оцинкованные гайки и болты.http://www.flickr.com/photos/johnloo/528
90/ Оцинкованный пол. http://www.flickr.com/photos/ants88/6846263748/
В этой главе мы узнали, как образуются оксиды металлов. Мы видели две демонстрации реакций, в которых оксиды металлов образовывались как продукты. Наконец, мы узнали об оксиде металла (оксид железа или ржавчину) из нашего повседневного опыта, а также о способах предотвращения ржавчины предметов, особенно тех, которые используются в зданиях и промышленности.
Нарезанные дольки яблока становятся коричневыми, поскольку соединения железа в мякоти яблока вступают в реакцию с кислородом воздуха! Реакции способствует фермент в яблоке, поэтому капание лимонного сока на ломтики разрушит фермент и предотвратит их потемнение.
Почему яблоки становятся коричневыми? (видео)
Сводка
- Когда металл реагирует с кислородом, образуется оксид металла.
Общее уравнение этой реакции: металл + кислород → оксид металла.
Некоторые металлы при горении вступают в реакцию с кислородом.Эти реакции называются реакциями горения. Два примера реакций горения:
- Ржавчина — это форма оксида железа, которая медленно образуется при контакте железа с воздухом.
- Железо можно преобразовать в сталь (сплав), которая более устойчива к ржавчине.
- Ржавчину можно предотвратить, покрывая железные поверхности краской или нержавеющими металлами, такими как хром или цинк.
Концептуальная карта
Какое собственное название означает «сжигание»? Заполните это на концептуальной карте.Заполните примеры металлов, которые вы изучали в этой главе. Вам нужно будет посмотреть на сформированные продукты, чтобы знать, куда поставить. Наконец, приведите два примера металлов, о которых вы узнали в этой главе, которые не ржавеют.
Это законченная концептуальная карта.
Прочтите предложения и заполните пропущенные слова.Напишите пропущенное слово в строке ниже. [9 баллов]
Химическая реакция, при которой соединение и кислород реагируют во время горения с образованием нового продукта, называется реакцией ____________.
Магний + ____________ → оксид магния
____________ + кислород → оксид железа
медь + кислород → ____________
Другое название оксида железа — ____________.
Металл, покрытый тонкими слоями цинка и оксида цинка, называется ____________ металл.
Постепенное разрушение материалов (обычно металлов) в результате химической реакции с окружающей средой называется ____________.
Когда воздух в определенной области содержит влагу, смешанную с кислотой или солью, мы называем эту область климатом ____________.
Продукт реакции между металлом и кислородом называется ____________.
- горение
- кислород
- Утюг
- оксид меди
- ржавчина
- оцинковка
- коррозия
- коррозионный
- оксид металла
Перечислите три материала, которые можно использовать для защиты железа или стали от коррозии.[3 балла]
Заполните таблицу, указав недостающие уравнения реакции между железом и кислородом [4 балла]
Заполните таблицу, указав недостающие уравнения реакции между магнием и кислородом [4 балла]
Словесное уравнение | магний + кислород → оксид магния |
Химическое уравнение | 2 Mg + O 2 → 2 MgO |
Уравнение изображения |
Заполните таблицу, указав недостающие уравнения реакции между медью и кислородом [4 балла]
Словесное уравнение | медь + кислород → оксид меди |
Химическое уравнение | 2 Cu + O 2 → 2 CuO |
Уравнение изображения |
Заполните таблицу, указав недостающие уравнения реакции между цинком и кислородом [6 баллов]
Словесное уравнение | цинк + кислород → оксид цинка |
Химическое уравнение | 2 Zn + O 2 → 2 ZnO |
Уравнение изображения |
Итого [30 баллов]
.

 Изменяют ли окраску индикаторов эти вещества? Почему?
Изменяют ли окраску индикаторов эти вещества? Почему?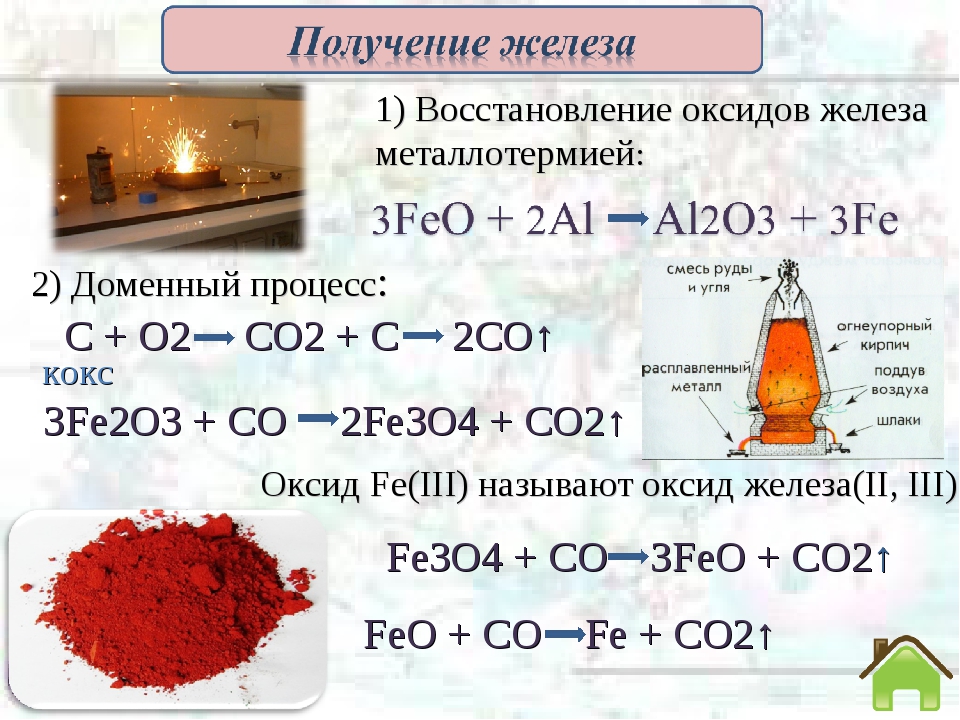
 9
9