Содержание
ХиМиК.ru — СТАНДАРТНЫЙ ПОТЕНЦИАЛ — Химическая энциклопедия
СТАНДАРТНЫЙ ПОТЕНЦИАЛ
(нормальный потенциал), значение электродного потенциала, измеренное
в стандартных условиях относительно выбранного электрода сравнения (стандартного
электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности
а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом
электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 105
Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный
электрод (Pt; H2 [1,01·105Па], Н+ [a=1]),
потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения):
стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого
и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич.
Согласно рекомендациям ИЮПАК (1953), при схематич.
изображении цепи (гальванич. ячейки) водородный электрод всегда записывается
слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным,
если в режиме «источник тока» слева направо во внеш. цепи движутся
электроны, а в р-ре — положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного
электрода равен эдс гальванич. ячейки
-Pt, Н2[1,01·105Па]|НС1(аb=l)|AgCl,
Ag|Pt +
Для любой электродной р-ции,
включающей перенос n электронов, электродный потенциал определяется ур-нием:
где Е°-стандартный потенциал
электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная
Фарадея, аi-термодинамич. активность частиц (как заряженных,
так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич.
коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных
числа для продуктов р-ций и отрицат. числа для исходных
в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят
в левую часть ур-ния, напр. AgCl + е : Ag + С1—). Значения
стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке
убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода,
расположенные в порядке их возрастания, составляют электрохимический ряд
напряжений.
Стандартный потенциал определяется либо
непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией
на бесконечно разб. р-ры, либо расчетом — по данным о стандартных значениях
изменения энергии Гиббса хим. р-ции DG0. В последнем
случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна
из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом ,
а другая-с известным стандартным потенциалом . .
.
Если в условной схеме ячейки 1-й электрод записан слева, то
Из ур-ния следует, что
стандартные потенциалы, в свою очередь, м.б. использованы для расчета DG0
и константы равновесия К р-ции (ln К = — DG°/RT).
Значения E0, рассчитанные на основе значений DG0,
представлены в таблице; они далеко не всегда м. б. реализованы в электрохим.
цепях из-за того, что предполагаемое равновесие электродной р-ции в действительности
может не устанавливаться (это характерно для щелочных, щел.-зем. металлов и
большинства орг. в-в в водных р-рах).
В неводных р-рителях стандартные потенциалы
также определяют по отношению к потенциалу водородного электрода для каждого
отдельного р-рителя. Ведется поиск стандартного электрода, потенциал к-рого
можно было бы считать практически не зависящим от природы р-рителя, что позволило
бы создать единую шкалу электродных потенциалов. В качестве таких электродов
В качестве таких электродов
предложены системы: рубидий/ион рубидия, ферроцен/ферроциний-катион и бис(дифенил)хром(I)/
/бис(дифенил)хром(0), потенциалы к-рых из-за большого размера ионов и соотв.
малой их сольватации незначительно (по сравнению с потенциалом водородного электрода)
зависят от природы р-рителя. Последние два электрода рекомендованы в 1984 ИЮПАК
в качестве электродов сравнения в неводных орг. средах.
Выбор электрода сравнения
и стандартного состояния исследуемого электрода в системах с расплавами и твердым
электролитом в большой мере определяется природой как исследуемого электродного
процесса, так и ионного проводника. В широко используемых в качестве электролитов
расплавах хлоридов металлов стандартный потенциал берется в хлорной шкале, т. е. в качестве
стандартного пользуются хлорным электродом в расплавленном хлориде (графит,
Сl2 [1,01 · 105 Па], MC1z [расплав]),
где М-металл (на практике обычно берут смесь хлоридов металла).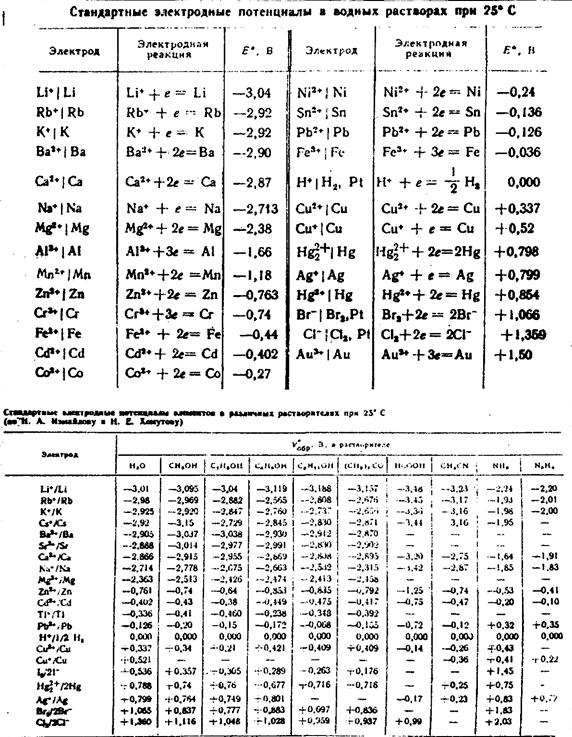 Активность
Активность
катионов Мz+ в индивидуальном расплаве принимается
равной 1. В ряде высокотемпературных гальванич. элементов с твердым электролитом
в качестве электрода сравнения применяют оксидные электроды, в частности вюститовый
(Pt; Fe, FeO).
Лит.: Электрохимия
металлов в неводных растворах, пер. с англ., М., 1974; Методы измерения в электрохимии,
т. 1, пер. с англ., М., 1977; Шаталов А. Я., Введение в электрохимическую термодинамику,
М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Standard Potentials
in aqueous solution, ed. by A.J. Bard, N.Y.-Basel, 1985. Б.И. Подловченко.
Стандартный электродный потенциал
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал принят равным 0,00 В, и любой электрод, для которого электродный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0,036 В
Fe2+ + 2e− → Fe(тв) −0,44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0,77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются.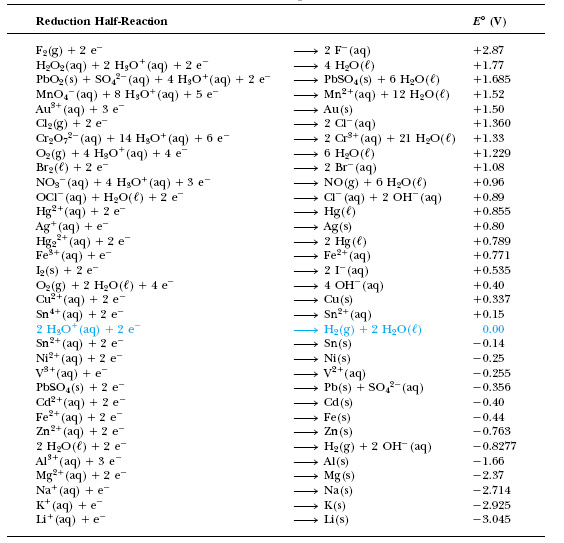 И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной в соответствии со следующим уравнением:
ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка) если Eoяч
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях.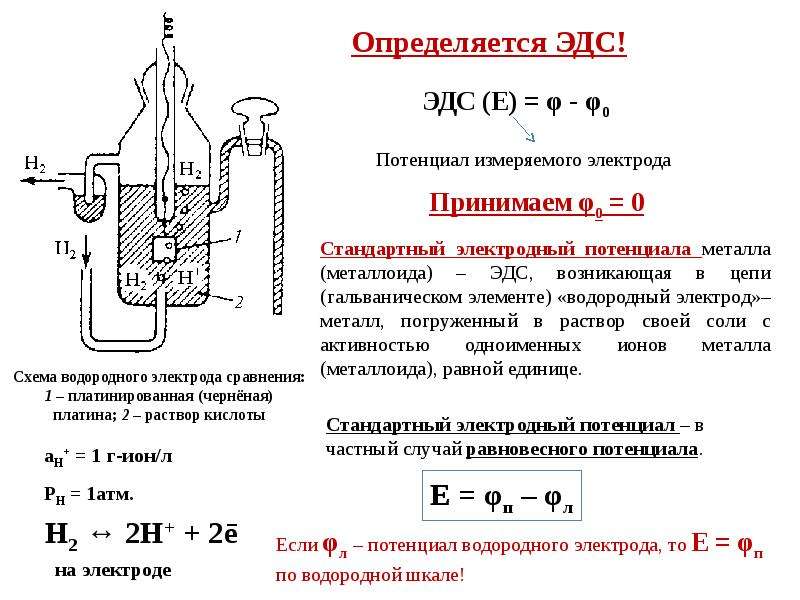 {0}+{frac {RT}{nF}}ln {frac {a_{
m {Ox}}}{a_{
m {Red}}}}}
{0}+{frac {RT}{nF}}ln {frac {a_{
m {Ox}}}{a_{
m {Red}}}}}
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
Стандартный потенциал электрода. Водородная шкала стандартных потенциалов
Водородная шкала потенциалов. Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым — стандартный водородный электрод. Схему такого элемента записывают следующим образом слева — водородный электрод, справа — измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид [c.190]
Условный электродный потенциал или электродный потенциал по водородной шкале равен э. д. с. элемента, составленного из данного электрода и стандартного водородного электрода, т. е. Е = э. д. с. элемента [c.293]
д. с. элемента, составленного из данного электрода и стандартного водородного электрода, т. е. Е = э. д. с. элемента [c.293]
Стандартный потенциал представляет собой величину, характерную для данного электродного процесса, и зависит от температуры и природы растворителя. Значения стандартных потенциалов некоторых электродов по водородной шкале приведены в табл. 27. [c.478]
Из выражений (7.44) и (7.45) видно, что потенциал водородного электрода определяется не только активностью водородных ионов, но и парциальным давлением газообразного водорода. Следовательно, водородный электрод (так же как и другие газовые электроды) более сложный, чем электроды первого или второго рода, потенциалы которых зависят непосредственно от активности одного сорта частиц. Согласно определ гнию условной шкалы электродных потенциалов стандартный потенциал водородного электрода н+ 112 температурах принято равным нулю, поэтому [c.166]
Из общего уравнения для электродного потенциала (7. 14) следует, что при заданной температуре потенциал любого электрода определяется составом системы и его стандартным потенциалом, значение которого не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного. электрода. В табл. 8.1 приведены значения стандартных потенциалов некоторых электродов по водородной шкале, а также соответствующие электродные реакции. [c.178]
14) следует, что при заданной температуре потенциал любого электрода определяется составом системы и его стандартным потенциалом, значение которого не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного. электрода. В табл. 8.1 приведены значения стандартных потенциалов некоторых электродов по водородной шкале, а также соответствующие электродные реакции. [c.178]
На рис. 4.3 изображен элемент с электродными пространствами, разделенными пористым стеклянным диском О. Предположим, что электрод В поляризован током, идущим от электрода О. Капилляр Ь (иногда называемый капилляром Луггина) электрода сравнения Я (или солевого мостика между электродами Я и В) расположен вблизи от поверхности В, что позволяет уменьшить ошибку измерения потенциала, вызванную омическим падением напряжения в электролите. Э. д. с. элемента В—определяют для каждого значения тока, измеряемого амперметром А с периодичностью достаточной для установления стабильного состояния. Поляризацию электрода В (катода или анода) измеряют в вольтах по отношению к электроду сравнения 7 при различных значениях плотности тока. Как правило, значения потенциалов приводят по стандартной водородной шкале. Этот метод назы- [c.49]
Поляризацию электрода В (катода или анода) измеряют в вольтах по отношению к электроду сравнения 7 при различных значениях плотности тока. Как правило, значения потенциалов приводят по стандартной водородной шкале. Этот метод назы- [c.49]
Поскольку потенциал стандартного электрода неизвестен, было принято, что нулевой потенциал имеет водородный электрод. «Стандартные электродные потенциалы металлов определяют исходя из нулевого потенциала водородного электрода. Таким образом, более активные металлы имеют более отрицательные электродные потенциалы. При температуре 25° С железо в растворе железистых ионов имеет стандартный электродный потенциал 0 = —0,440 В. Несмотря на то, что шкала потенциалов имеет важное теоретическое значение (см. вступление к гл. 2), она может давать неверную информацию не только из-за различия в температуре и концентрации раствора, но и потому, что эти растворы могут существенно отличаться от растворов или иной среды в реальных условиях. Поэтому в каждом конкретном случае потенциалы необходимо устанавливать опытным путем. [c.18]
Поэтому в каждом конкретном случае потенциалы необходимо устанавливать опытным путем. [c.18]
Для пересчета потенциалов в неводных растворах по водородной шкале на водную водородную шкалу следует к их значениям V прибавить значение стандартного обратимого потенциала водородного электрода в данном растворителе относительно стандартного обратимого потенциала водородного электрода в воде (Ун обр. р (табл. 26) [c.175]
При ЭТОМ во внешней цепи электроны двигаются от цинка к водородному электроду. Для определения стандартного потенциала цинка измеряют э.д.с. этой цепи при условии, что активности ионов цинка и водорода равны единице. Опыт показывает, что она равна + 0,763 В. Как было указано выше, знаки стандартных потенциалов соответствуют реакциям восстановления. В данном случае на цинковом электроде протекает обратная реакция, т. е. окисление. Поэтому потенциалу цинка приписывается знак минус. Таким образом, стандартный потенциал цинка 1п=—0,763 В. Повторим, что указанные правила определения знаков электродных потенциалов являются условными и приняты для единообразия оценок свойств веществ и установления единой шкалы. [c.109]
Повторим, что указанные правила определения знаков электродных потенциалов являются условными и приняты для единообразия оценок свойств веществ и установления единой шкалы. [c.109]
Водородный электрод для измерения потенциала можно получить, погружая пластинку платинированной платины в раствор, насыщенный водородом при давлении 1 ат (рис. 3.2), или, что более удобно, измеряют потенциал с помощью стеклянного электрода, который также обратим по отношению к водородным ионам. Заметим, что потенциал электрода равен нулю, если и активность водородных ионов, и давление газообразного водорода (в атмосферах) равны единице. Это и есть стандартный водородный потенциал. Таким образом, потенциал полуэлемента для любого электрода равен э. д. с. элемента, где в качестве второго электрода использован стандартный водородный электрод. Потенциал полуэлемента для любого электрода, определенный таким образом, называется потенциалом по нормальному стандартному) водородному электроду или по водородной шкале и обозначается или н. в. а- [c.34]
в. а- [c.34]
В настояш,ее время для вычисления условных электродных потенциалов пользуются водородной шкалой, в которой при всех температурах за нуль выбран потенциал стандартного водородного электрода с активностью водородных ионов в растворе, равной единице, и давлением водорода, равном 1 атм. [c.276]
Потенциал исследуемого электрода Ех относительно стандартного водородного электрода (СВЭ) рассчитывают по формуле Е — Е + Е , где 3 —потенциал электрода сравнения (в шкале СВЭ). Еслн необходимо [c.265]
Значок О поставлен внизу, чтобы подчеркнуть, что в уравнении в общем случае используется стандартный потенциал данной окислительно-восстановительной электродной реакции относительно некоторого выбранного электрода сравнения (лишь по водородной шкале о= = ). [c.126]
А так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу правого электрода. Таким образом, электродный потенциал по водородной шкале Е — это ЭДС электрохимической системы, в которой справа расположен данный электрод, а слева — стандартный водородный электрод. [c.197]
Таким образом, электродный потенциал по водородной шкале Е — это ЭДС электрохимической системы, в которой справа расположен данный электрод, а слева — стандартный водородный электрод. [c.197]
Чтобы установить шкалу этих потенциалов и иметь, таким образом, возможность сравнивать относительную тенденцию восстановителей или окислителей к отдаче или захвату электронов, выбирают электрод, который моншо соединить с любым другим, и произвольно принимают стандартный потенциал этого электрода равным нулю. В качестве такого электрода сравнения обычно используют водородный электрод. [c.291]
Потенциал электродов принято выражать в некоторой условной шкале, принимая потенциал одного из электродов равным нулю . В настоящее время общепринятой является шкала, в которой за нуль выбран потенциал стандартного водородного электрода. В этом электроде активность ионов водорода в растворе и фугитивность газообразного водорода над раствором равны единице. [c. 168]
168]
Потенциал отдельного электрода измерить нельзя, можно измерить лишь э. д. с, ячейки. Приводимые значения потенциалов — это э. д. с. ячеек, составленных из упомянутых электродов в стандартных условиях, и стандартного водородного электрода, потенциал которого условно принят за нуль при любой температуре и давлении Нг 1 атм. ( водородная шкала ) — Прим. ред. [c.307]
За потенциал электрода но водородной шкале электродных потенциалов принимают ЭДС электрохимической системы, составленной из данного электрода и стандартного водородного электрода (рис. 11) в соответствующих растворах. Установка для измерения нотенциала электрода но водородной шкале представлена па рис. 12. [c.42]
В случае если в качестве электрода с известным значением потенциала использован стандартный водородный электрод, то измеренная ЭДС численно равна потенциалу исследуемого электрода по водородной шкале потенциалов. Зная потенциал электродов, у которых равновесный потенциал зависит от концентрации ионов водорода в растворе, можно рассчитать значение рП раствора. [c.67]
[c.67]
Отсюда следует и возможность вычисления константы равновесия в гальваническом элементе (см. расчет в XII. 2). Измерив э. д. с. любого гальванического элемента, состоящего из с. в. э., потенциал которого, конечно, один и тот же во всех системах, и стандартного исследуемого полуэлемента, получаем величины стандартных потенциалов электродов в водородной шкале. Зная их, можно вычислить потенциалы полуэлементов при любых активностях потен-циалопределяющих ионов. Знак потенциала положителен относительно с. в. э., когда в данном полуэлементе происходит восстановление, и отрицателен — в случае окисления. [c.138]
Индикаторным может служить водородный электрод, к-рый представляет собой покрытую платиновой чернью платиновую пластинку, погруженную в р-р к-ты, насыщенный газообразным водородом. При парциальном давлении водорода р = 1 атм (101,3 кПа) и активности ионов НзО Hj o+ = 1 потенциал этого электрода принят за нуль при любой т-ре (стандартный водородный электрод). В соответствии с ур-нием Н 4-е VjHj потенциал водородного электрода Е= —0,0591 pH (В) при 25 °С. Водородный электрод пригоден для определения pH в интервале от О до 14. Для практич. работы он не удобен из-за относительно сложной конструкции, довольно быстрого отравления платины, необходимости получения электролитически чистого Hj и невозможности измерения pH в присут. окислителей, восстановителей и ионов тяжелых металлов. Поэтому обычно применяют др. электроды, обратимые относительно ионов Н ,-сурьмяный, хингидрон-ный и стеклянный, потенциалы к-рых отсчитывают от потенциала стандартного водородного электрода (водородная шкала потенциалов). [c.71]
В соответствии с ур-нием Н 4-е VjHj потенциал водородного электрода Е= —0,0591 pH (В) при 25 °С. Водородный электрод пригоден для определения pH в интервале от О до 14. Для практич. работы он не удобен из-за относительно сложной конструкции, довольно быстрого отравления платины, необходимости получения электролитически чистого Hj и невозможности измерения pH в присут. окислителей, восстановителей и ионов тяжелых металлов. Поэтому обычно применяют др. электроды, обратимые относительно ионов Н ,-сурьмяный, хингидрон-ный и стеклянный, потенциалы к-рых отсчитывают от потенциала стандартного водородного электрода (водородная шкала потенциалов). [c.71]
Опыт показывает, что это изменение условий перехода в элементарный водород или воды в элементарный кислород и приводит к изменению потенциалов соответствующих пар. Например, в то время как стандартный потенциал пары 2Н+/Нг на платинированной платине равен (по водородной шкале) нулю, при той же концентрации Н- -ионов и давлении газообразного водорода I а гладком платиновом электроде он равен —0,07 в. Точно так же I отенциал этой пары изменяется и при употреблении электродов 1 3 других металлов, например из меди, свинца, ртути и т. д. [c.430]
Для цепи (II), определяюптей стандартный потенциал электрода М в условной водородной шкале, величину 1, + равную в этом случае н+> можно найти из следующего цикла [c.225]
Скачки потенциала между фазами не поддаются экспериментальному определению. Поскольку э. д. с. электрохимической системы может быть легко измерена, то принято электродный потенциал считать равным э. д. с. цепи, составленной из водородного (слева) и данного электрода (справа). Водородный электрод при этом взят в стандартном состоянии (ан+ = 1) парциальное давление газа равно нормальному атмосферному давлению (1,013 10 Па) и его потенциал при любой температуре условно принят нулю. Электродные потенциалы при этом выражают в условной водородной шкале. Э. д. с. правильно разомкнутой цепи M Pt, HalLjM соответствует электродному потенциалу системы L M, для которого примем обозначение фьм [c.469]
Измерить ыепосредствеЕно потенциал отдельного электрода нельзя. Приводимые в справочниках значения электродных потенциалов являются относительными. Они измерены относительно стандартного водородного электрода, потенциал которого условно принят равным нулю (Ф2ы+/Н2=0). В практической работе удобнее пользоваться другими стандартными электродами сравнения, имеющими постоянное значение электродного потенциала по отношению к стандартному водородному электроду. Чаще других применяются хлорсере бряный и каломельный электроды, электродные потенциалы которых в водородной шкале равны Фа с1/А0== = +0,222 В, Hgj i,/Hg = +0,268 В при заполне 1ии электрода [c.111]
Методы определения различных физико-химических величин и количественного анализа растворов на основе измерения ЭДС получили общее название потенциометрни. В потенциометрии широко используется измерение потенциала исследуемого электрода относительно какого-либо электрода сравнения (см. с. 20). Потенциалы выражаются в шкалах либо выбранного электрода сравнения (последний обязательно должен указываться), либо пересчитываются в водородную шкалу, которая отвечает стандартному (нормальному) водородному электроду сравнения [Р1, На ( = 1 атм = 101,325 кПа), Н+ (а = 1)1. Для стандартного (нормального) водородного электрода будет использоваться принятое в нашей стране сокращенное обозначение н. в. э. [c.108]
Пользуясь табличными значениями стандартных электродных потенциале по водородной шкале для одного из следующих гальванических элементов, составленных из электродов 1) 2п и Ag , 2) Аи и Ад 3) каломельного и хлор-сереб-ряного 4) каломельного и (—) Ре +, Ре + (-Ь) 5) 2п и Аи 6) С1г и 2п 7) хлор-серебряного и ТР+, Т1+ 8) Со и Сё 9) А1 и Хп 10) Сс1 и Ag И) Со и Аи 12) Ае и N1 13) Т1 и 2п 14) 5п н 2п 15) Аи и А1 16) Ag и Си 17) Схлор-серебряного 23) хингидронного и водородного 24) водородного и хлор-серебряного 25) каломельного и серебряного, вычислить %. . Написать уравнения электродных реакций. Установить, знаки электродов. Написать уравнение реакции, протекающей п гальг.аническом элементе при его работе. Вычислить константу равновесия реакции при 25° С. Вычислить стандартную максимально полезную работу и изменение изобарно-изотермического потенциала в процессе реакции, протекающей в гальваническом элементе. [c.156]
Электродный скачок потенциала в условной шкале водородного электрода называется электродным потенциалом и обозначается ф. Он равен ЭДС электрохимического элемента, состоящего из стандартного водородцого и данного электродов. Запись такого элемента всегда начинается с водородного электрода, т. е. он считается л е-в ы м. Форма записи и знак отдельного электрода определяются правилом, утвержденным конвекцией Международного союза по чистой и прикладной химии (Стокгольм, 1953). По этому правилу слева записывается ионная форма реагирующего вещества далее прочие фазы в той последовательности, в которой они соприкасаются друг с другом. Справа должен стоять символ молекулярной формы вещества, участвующего в электродной реакции, или химический символ металла. Фазы, нанесенные на поверхность металла, отделяются запятой границы раздела жидких и твердых фаз отмечаются вертикальными черточками, а границы между жидкими фазами (растворами) — двумя вертикальными черточками (если между ними нет диффузионного скачка потенциала). Активности веществ указываются в скобках. [c.287]
Характерно, что при всех подобных изменениях определяются ие абсолютные (Величины электродных потенциалов, а лишь их огносительные значения. Поэтому необходимо было условиться о том, относительно какого электрода измерять все потенциалы. Как уже отмечалось, в качестве стандартной шкалы потенциалов была принята водородная шкала, за нуль которой условно принимается потенциал нормального водородного электрода, т. е. [c.147]
Если активность реагентов и продуктов равна единице, то второй член в правой части уравнения (1.14) равен нулю и = . Таким образом, стандартный электродный потенциал определяется как потенциал границы раздела при активности всех участников реакций, вовлекаемых в равновесие, равной единице. В случае водородного электрода равновесие соответствует уравнению (1.12), и при аи+ = рн = = и приобретает значение потенциала сравнения 0,00 В. Это дает возмолч-ность сравнивать все другие потенциалы по так называемой водородной шкале относительно нормального водородного электрода ( НВЭ). [c.18]
Па), термодинамич. активности ионов водорода в р-ре af , равной 1, наз. стандартным водородным электродом, а епэ потенциал условно принимают равным нулю. Потенциалы другах электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Для водороднопэ Э. с. Нернста уравнение записывается в ввде [c.426]
Error
Jump to…
Jump to…Новостной форумПрограмма производственной практикиМетодические указания по преддипломной практике для студентов специальности 280202 «Инженерная защита окружающей среды» В помощь дипломнику Рекомендуемая литература по химииКритерии оценки студентов по результатам контрольных точек по химииЛабораторный практикум по общей и неорганической химииЛидин. Справочник по неорганическим веществамКонтрольные вопросы и задания по химии, Часть 2Лекция №1 Термохимия и хим.термодинамикаЛекция №2 Химическая кинетика и равновесиеЛекция №4 Общие свойства растворовОкислительно-восстановительные реакцииГальванический элементЛекция. ЭлектролизКоррозия металловХимические источники токаВопросы для защиты лабораторных работ по химии для НТКбВопросы к экзамену по химии УКб Практикум по общей химии для заочников строительных специальностейХимич, Т. С. Практикум по общей химии. Ч.2Контрольные вопросы и задания по химии. Ч.1 Готовимся к интернет-тестированию по химии Хомич, В. А. Сборник задач по химииВопросы для защиты ЛР по АХВопросы к экзамену по аналитической химииСписок литературы по аналитической химииСправочные таблицы для статистической обработки экспериментальных результатов1. Основные понятия аналитической химии2. Методы маскирования, разделения и концентрирования3. Количественный анализ4. Гравиметрический анализ5.Объёмный анализ6. Кислотно-основное титрование7. Кривые кислотно-основного тирования8. Комплексонометрическое титрование9. Построение кривой комплексонометричексого титрования11. Осадительное титрование12. Физико-химические методы анализа13. Оптические методы анализа14. Электрохимические методы анализа15. Хроматографические методы анализаВопросы к зачету по экологииВопросы ко второму коллоквиуму по экологииВопросы к первому коллоквиуму по экологииРекомендуемая литература по экологииЛекция №1 Экология как наука. ЭкосистемыЛекция №2(1) Энергетика экосистемЛекция № 2(2) Устойчивость и динамика экосистемЛекция №3(1).БиосфераЛекция № 3(2). ПопуляцииЛекция № 4(1) Среды жизниЛекция № 4(2) Экологические факторыЛекция № 4(3) Лимитирующий факторЛекция № 4(4) АдаптацияЛекция №5 Глобальные экологические проблемыЛекция №6(1) Экологический мониторинг и нормированиеЛекция №6(2) Рациональное природопользованиеЛекция Рациональное природопользованиеОсобо охраняяемые природные территорииЛекция №7(1) Экологическое правоЛекция № 7(2) Экологический контроль и экспертизаЛекция №8 Экономика природопользованияЛекция №9 Международное экологическое сотрудничествоФрагменты из лекций по экологииЭкономический механизм природопользования. Международное сотрудничество1. История экологии2. Уровни организации материи3.Наземные экосистемы4.Водные экосистемы5.Антропогенные системы6.Структура экосистем7.Устойчивость и динамика экосистем8-9. Биосфера10. Эволюция биосферы11.Популяции12-13.Среда обитанияЛабораторные работы по практической экологии Еремеева, В. Г. Готовимся к тестированию по экологииВ.А. Хомич Основные термины и понятия экологииТуренко, Ф. П. Экология: основные термины и понятияВопросы к экзамену ДВСб ЭАТбВопросы для защиты лабораторных работ по ОХиЭ для ДВСб и ЭАТб
Стандартный электродный потенциал — это… Что такое Стандартный электродный потенциал?
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0.036 В
Fe2+ + 2e− → Fe(тв) −0.44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной, в соответствии со следующим уравнением:
- ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
- если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
- если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
- Таблица стандартных электродных потенциалов
- Восстановительный потенциал
- Абсолютный электродный потенциал
- Электрохимический потенциал
- Равновесный электродный потенциал
- Уравнение Нернста
- Электрохимическая ячейка
- Гальваническая ячейка
Литература
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Ссылки
Стандартные окислительные восстановительные потенциалы (Таблица)
Справочная таблица стандартные окислительно -восстановительные потенциалы по общей и неорганической химии содержит: элемент, уравнение реакции и стандартный потенциал. Таблица содержит справочный материал, необходимый для решения задач по общей и неорганической химии. Предназначено для школьников и студентов.
Смотрите также таблицу «Стандартные электродные потенциалы металлов».
|
Элемент
|
Уравнение реакции
|
Стандартный потенциал Ео, В
|
|
Азот
|
HNO2+ H+ + e = NO + H2O
|
+1,00
|
|
NO3—+ 2H+ + 2e = NO2—+ H2O
|
+0,835
| |
|
NO3—+ 4H+ + 3e = NO + 2H2O
|
+0,96
| |
|
3N2+ 2H+ + 2e = 2HN3
|
-3,1
| |
|
| ||
|
Алюминий
|
AlO2—+ 2H2O + 3e = Al + 4OH—
|
-2,35
|
|
Al(OH)3+ 3H+ + 3e = Al + 3H2O
|
-1,471
| |
|
| ||
|
Бериллий
|
Be(OH)2+ 2H+ + 2e = Be + 2H2O
|
-1,820
|
|
BeO22-+ 4H+ + 2e = Be + 2H2O
|
-0,909
| |
|
Be2+ + 2e = Be
|
-1,847
| |
|
| ||
|
Бром
|
Br2+ 2e = 2Br—
|
+1,065
|
|
HBrO + H+ + 2e = Br— + h3O
|
+1,33
| |
|
HBrO + 2H+ + 2e = Br2 + h3O
|
+1,59
| |
|
BrO— + h3O + 2e = Br— + 2OH—
|
+0,76
| |
|
BrO3—+ 2h3O + 4e = BrO— + 4OH—
|
+0,54
| |
|
BrO3—+ 6H+ + 6e = Br— + 3h3O
|
+1,44
| |
|
2BrO3—+ 12H+ + 10e = Br2+ 6H2O
|
+1,52
| |
|
| ||
|
Водород
|
H2+ 2e = 2H—
|
-2,251
|
|
2H2O + 2e—= H2+ 2OH—
|
-0,828
| |
|
| ||
|
Железо
|
Fe3+ + e = Fe2+
|
+0,771
|
|
Fe3+ + 3e = Fe
|
-0,037
| |
|
Fe(OH)3 + e = Fe(OH)2 + OH—
|
-0,56
| |
|
Fe(OH)3+ H+ + e = Fe(OH)2+ H2O
|
+0,271
| |
|
| ||
|
Иод
|
I2+ 2e = 2I—
|
+0,536
|
|
HIO + H+ + 2e = I—+ H2O
|
+0,99
| |
|
2HIO + 2H+ + 2e = I2 + 2h3O
|
+1,45
| |
|
IO— + h3O + 2e = I— + 2OH—
|
+0,49
| |
|
IO3—+ 5H+ + 4e = HIO + 2H2O
|
+1,14
| |
|
| ||
|
Иод
|
IO3—+ 3H2O + 6e = I—+ 6OH—
|
+0,26
|
|
IO3—+ 6H+ + 6e = I— + 3h3O
|
+1,085
| |
|
2IO3—+ 12H+ + 10e = I2+ 6H2O
|
+1,19
| |
|
| ||
|
Кислород
|
O2+ 2H2O + 2e = H2O2+ 2OH—
|
-0,076
|
|
O2 + 2h3O + 4e = 4OH—
|
+0,401
| |
|
O2 + 2H+ + 2e = h3O2
|
+0,682
| |
|
O2 + 4H+ + 4e = 2h3O
|
+1,23
| |
|
h3O2 + 2H+ + 2e = 2h3O
|
+1,77
| |
|
О3 + H2O + 2e = O2+ 2OH—
|
+1,24
| |
|
O3 + 6H+ + 6e = 3h3O
|
+1,511
| |
|
O3+ 2H+ + 2e = O2+ H2O
|
+2,076
| |
|
Марганец
|
MnO4—+ e = MnO42-
|
+0,56
|
|
MnO4—+ 2H2O + 3e = MnO2+ 4OH—
|
+0,6
| |
|
MnO2 + 4H+ + 2e = Mn2+ + 2h3O
|
+1,228
| |
|
MnO4—+ 8H+ + 5e = Mn2+ + 4H2O
|
+1,51
| |
|
| ||
|
Медь
|
Cu2+ + e = Cu+
|
+0,15
|
|
Cu+ + e = Cu
|
+0,52
| |
|
Cu2+ + Br— + e = CuBr
|
+0,64
| |
|
Cu2+ + I—+ e = CuI
|
+0,86
| |
|
| ||
|
Свинец
|
PbO + H2O + 2e = Pb + 2OH—
|
-0,580
|
|
PbO + 2H+ + 2e = Pb + H2O
|
+0,248
| |
|
Pb(OH)2 + 2H+ + 2e = Pb + h3O
|
+0,277
| |
|
PbO2 + SO42-+ 4H+ + 2e = PbSO4 + 2h3O
|
+1,685
| |
|
Pb4+ + 2e = Pb2+
|
+1,69
| |
|
| ||
|
Селен
|
Se + 2e = Se2-
|
-0,92
|
|
Se + 2H+ + 2e = H2Se
|
-0,36
| |
|
SeO42-+ 4H+ +2e = h3SeO3
|
+1,15
| |
|
h3SeO3 + 4H+ + 4e = Se + 3h3O
|
+0,74
| |
|
SeO32-+ 3h3O + 4e = Se + 6OH—
|
-0,366
| |
|
| ||
|
Сера
|
S + 2e = S2-
|
-0,48
|
|
S + 2H+ + 2e = H2S
|
+0,17
| |
|
SO42-+ 8H+ + 6e = S + 4H2O
|
+0,357
| |
|
SO42-+ 10H+ + 8e = H2S + 4H2O
|
+0,311
| |
|
SO42-+ 8H+ + 8e = S2-+ 4H2O
|
+0,149
| |
|
SO42-+ 4H+ + 2e = h3SO3 + h3O
|
+0,17
| |
|
SO42-+ h3O + 2e = SO32-+ 2OH—
|
-0,93
| |
|
SO42-+ 2H+ + 2e = SO32-+ H2O
|
+0,20
| |
|
h3SO3 + 4H+ + 4e = S + 3h3O
|
+0,449
| |
|
SO32-+ 6H+ + 6e = S2-+ 3h3O
|
+0,231
| |
|
| ||
|
Фосфор
|
H3PO4+ 2H+ + 2e = H3PO3+ H2O
|
-0,276
|
|
| ||
|
Фтор
|
F2+ 2e = 2F—
|
+2,87
|
|
F2+ 2H+ + 2e = 2HF
|
+3,06
| |
|
| ||
|
Хлор
|
Cl2+ 2e = 2Cl—
|
+1,36
|
|
HClO + H+ + 2e = Cl—+ H2O
|
+1,49
| |
|
2HClO + 2H+ + 2e = Cl2 + 2h3O
|
+1,63
| |
|
ClO—+ H2O + 2e = Cl—+ 2OH—
|
+0,88
| |
|
ClO3—+ 6H+ + 6e = Cl— + 3h3O
|
+1,45
| |
|
2ClO3—+ 12H+ + 10e = Cl2+ 3H2O
|
+1,47
| |
|
ClO3—+ 3h3O + 6e = Cl— + 6OH—
|
+0,63
| |
|
ClO4—+ 2H+ + 2e = ClO3—+ h3O
|
+1,189
| |
|
ClO4—+ 16H+ + 14e = Cl2(водн) + 8H2O
|
+1,385
| |
|
2HCl(r) + 2H+ + 2e = Cl2(водн) + 2H2O
|
+1,594
| |
|
| ||
|
Хром
|
Cr2O72-+ 14H+ + 6e = 2Cr3+ + 7H2O
|
+1,36
|
|
Cr3+ + 3e = Cr
|
-0,744
| |
|
Cr2+ + 2e = Cr
|
-0,913
| |
|
Cr3+ + e = Cr2+
|
-0,407
| |
|
| ||
|
Цинк
|
ZnO22-+ 4H+ + 2e = Zn + 2H2O
|
+0,44
|
|
ZnO22-+ 2H2O + 2e—= Zn + 4OH—
|
-1,216
| |
2.2. Стандартный электродный потенциал
Скачок потенциала
на границе металл – раствор, как и
разности потенциалов между двумя
точками, находящимися в различных фазах,
экспериментально измерить невозможно.
Поскольку экспериментально можно
измерить лишь величину ЭДС электрохимической
цепи, то опытным путем можно определить
только относительные величины так
называемых электродных потенциалов,
т.е. ЭДС цепи, составленной из данного
электрода и некоторого стандартного
электрода, потенциал которого условно
принимают равным нулю. Таким стандартным
электродом, или электродом сравнения,
является обратимый водородный электрод
– стеклянный сосуд, наполненный раствором
сильной кислоты (HCl или H2SO4)
с концентрацией ионов водорода [Н+]
= 1 моль/л, в который частично погружена
платиновая пластинка, покрытая платиновой
чернью (порошкообразная
платина), способная
адсорбировать подаваемый газообразный
водород при давлении 1 атм (рис. 7).
Рис. |
Этому электроду отвечает обратимый
процесс, который можно записать в виде
2Н+
+2ē ↔ Н2,
.
Соединив с водородным электродом в
гальванический элемент другой полуэлемент,
можно определить ЭДС этого гальваноэлемента,
а по ней – относительный стандартный
электродный потенциал данной гальванопары
(приложение 1). Например, в гальваноэлементе
Zn0|Zn2+||2H+|H2ЭДС, определяемая вольтметром равна
0,76B (см. рис. 8).
Знак «+» электродного
потенциала отвечает движению ионов от
раствора к электроду в элементе, где
рассматриваемый электрод соединен с
водородным электродом, и движению
электронов по внешней цепи от водородного
электрода. Знак «–» ставится перед
значением электродного потенциала при
движении ионов и электронов в обратном
направлении.
Рис. |
Поскольку
в нашем примере опытным путем установлено
повышение концентрации ионов Zn2+
и уменьшение концентрации ионов H+,
то значения электродного потенциала
цинкового электрода следует приводить
со знаком «–».
Относительно стандартного водородного
электрода можно определить потенциалы
не только пар Ме/Меn+, но и пар,
составленных из любого восстановителя
и его окисленной формы и любого окислителя
и его восстановленной формы.
2.3. Ряд стандартных электродных потенциалов металлов
Если расположить
все металлы по возрастанию величины
стандартного электродного потенциала,
получают ряд стандартных электродных
потенциалов металлов,
который представляет собой электрохимическую
характеристику металлов. В этом ряду,
чем ниже алгебраическая величина
электродного потенциала, тем с большей
легкостью данный металл отдает электроны
(окисляется) и тем самым проявляет более
высокую восстановительную способность.
Например, Ca
(=
–2,8 В)
является лучшим восстановителем, чем
железо (=
–0,44 В).Чем больше алгебраическая величина
электродного потенциала, тем тяжелее
данный металл отдает электроны, а катион,
соответствующий данному металлу,
является более активным акцептором
электронов. Например, катионCu2+более сильный окислитель, чемZn2+,
а тем болееCu2+. Таким
образом, в электрохимическом ряду
стандартных электродных потенциалов
с возрастанием величины стандартного
электродного потенциала металлов
увеличивается окислительная способность
катионов, соответствующих этим металлам,
восстановительная же способность атомов
металлов в этом ряду уменьшается. С
уменьшением стандартного электродного
потенциала наблюдается зависимость,
противоположная рассмотренной выше.
Все металлы, расположенные в
электрохимическом ряду стандартных
электродных потенциалов до водорода,
имеют более отрицательный потенциал,
чем у водорода, а следовательно, в
стандартных условиях могут быть окислены
Н+. По этой причине эти металлы
могут вытеснять водород из растворов
разбавленных сильных минеральных
кислот. Металлы, расположенные после
водорода, не вытесняют водород из
растворов разбавленных кислот.
Потенциал водородного электрода зависит
от концентрации катионов Н+в
растворе
φ = φ0 + 0,059lg [H+], | (2.8) |
где φ0– стандартный
потенциал водородного электрода, равный
нулю;
тогда | (2.9) |
или, учитывая, что lg [H+]
= – pH, получаем
Подставляя значения
водородных показателей, получаем, что
в нейтральной среде (рН = 7)
= –0,41 В, в кислой среде (рН = 0)= 0 В и в щелочной средепринимает значение, равное –0,82 В.
Из этого следует, что металлы, имеющие
более отрицательный потенциал, чем
–0,41 В, могут восстанавливать водород
из воды. К ним относятся металлы, включая
кадмий. Однако на практике не все металлы,
расположенные до кадмия, вытесняют
водород из воды, а металлы, расположенные
до водорода, – водород из растворов
кислот. Это происходит потому, что при
окислении некоторых металлов на их
поверхности образуются нерастворимые
пленки, препятствующие дальнейшему
взаимодействию. Примером этому может
служить пассивирование свинца в серной
кислоте из-за нерастворимости соли
PbSO4. Металлы в
электрохимическом ряду до магния
взаимодействуют с водой, магний вытесняет
водород из горячей воды, а все последующие
металлы, включая кадмий, образуют на
поверхности нерастворимые гидроксиды
и не взаимодействуют с водой.
Таким образом, ряд стандартных электродных
потенциалов металлов нужно использовать
с учетом особенностей данного химического
процесса.
| Катод (восстановление) Полуреакция | Стандартный потенциал E ° (вольт) |
| Li + (водн.) + E — -> Li ( с) | -3,04 |
| K + (водн.) + e — -> K (с) | -2,92 |
| Ca 2+ (водн.) + 2e — — > Ca (s) | -2,76 |
| Na + (водн.) + E — -> Na (s) | -2.71 |
| Mg 2+ (водн.) + 2e — -> Mg (s) | -2,38 |
| Al 3+ (водн.) + 3e — -> Al (s) ) | -1,66 |
| 2H 2 O (л) + 2e — -> H 2 (г) + 2OH — (водн.) | -0,83 |
| Zn 2 + (водн.) + 2e — -> Zn (s) | -0,76 |
| Cr 3+ (водн.) + 3e — -> Cr (s) | -0.74 |
| Fe 2+ (водн.) + 2e — -> Fe (s) | -0,41 |
| Cd 2+ (водн.) + 2e — -> Cd (s ) | -0,40 |
| Ni 2+ (вод.) + 2e — -> Ni (s) | -0,23 |
| Sn 2+ (вод.) + 2e — — > Sn (s) | -0,14 |
| Pb 2+ (водн.) + 2e — -> Pb (s) | -0.13 |
| Fe 3+ (водн.) + 3e — -> Fe (s) | -0,04 |
| 2H + (водн.) + 2e — -> H 2 (г) | 0,00 |
| Sn 4+ (водн.) + 2e — -> Sn 2+ (водн.) | 0,15 |
| Cu 2+ (водн.) + e — -> Cu + (водн.) | 0,16 |
| ClO 4 — (водн.) + H 2 O (л) + 2e — -> ClO 3 — (водн.) + 2OH — (водн.) | 0.17 |
| AgCl (s) + e — -> Ag (s) + Cl — (водн.) | 0,22 |
| Cu 2+ (водн.) + 2e — -> Cu (s) | 0,34 |
| ClO 3 — (водн.) + H 2 O (л) + 2e — -> ClO 2 — (водн.) + 2OH — (водн.) | 0,35 |
| IO — (водн.) + H 2 O (л) + 2e — -> I — (водн.) + 2OH — (водн.) | 0.49 |
| Cu + (водн.) + E — -> Cu (s) | 0,52 |
| I 2 (s) + 2e — -> 2I — (водн. ) | 0,54 |
| ClO 2 — (водн.) + H 2 O (л) + 2e — -> ClO — (водн.) + 2OH — (водн.) | 0,59 |
| Fe 3+ (водн.) + E — -> Fe 2+ (водн.) | 0.77 |
| Hg 2 2+ (водн.) + 2e — -> 2Hg (л) | 0.80 |
| Ag + (водн.) + E — -> Ag ( с) | 0,80 |
| Hg 2+ (водн.) + 2e — -> Hg (л) | 0,85 |
| ClO — (водн.) + H 2 O (л ) + 2e — -> Cl — (водн.) + 2OH — (водн.) | 0,90 |
| 2Hg 2+ (водн.) + 2e — -> Hg 2 2+ (водн.) | 0.90 |
| NO 3 — (вод.) + 4H + (вод.) + 3e — -> NO (г) + 2H 2 O (л) | 0,96 |
| Br 2 (л) + 2e — -> 2Br — (водн.) | 1.07 |
| O 2 (г) + 4H + (водн.) + 4e — -> 2H 2 O (л) | 1,23 |
| Cr 2 O 7 2- (водн.) + 14H + (водн.) + 6e — -> 2Cr 3+ (водн.) + 7H 2 O (л) | 1.33 |
| Cl 2 (г) + 2e — -> 2Cl — (водн.) | 1,36 |
| Ce 4+ (водн.) + E — -> Ce 3+ (водн.) | 1,44 |
| MnO 4 — (водн.) + 8H + (водн.) + 5e — -> Mn 2+ (водн.) + 4H 2 O (л) | 1,49 |
| H 2 O 2 (водн.) + 2H + (водн.) + 2e — -> 2H 2 O (л) | 1.78 |
| Co 3+ (водн.) + E — -> Co 2+ (водн.) | 1,82 |
| S 2 O 8 2- (водн.) + 2e — -> 2SO 4 2- (водн.) | 2,01 |
| O 3 (г) + 2H + (водн.) + 2e — -> O 2 (г) + H 2 O (л) | 2,07 |
| F 2 (г) + 2e — -> 2F — (водн.) | 2.87 |
Стандартный потенциал — обзор
7.2.4 Электродный потенциал в нестандартных условиях
В таблице 3.1 в главе 3 приведены значения стандартных потенциалов для различных реакций восстановления только тогда, когда все реагенты и продукты имеют единичную активность. Однако это условие маловероятно для большинства сред, в которых имеет место коррозия металла. Уравнение Нернста позволяет рассчитать потенциал электрода в нестандартных условиях.Уравнение Нернста может быть получено с использованием принципа свободной энергии Гиббса для электрохимических реакций (Милаццо и Кароли, 1978; Бард и Фолкнер, 1980).
Общая электрохимическая реакция в состоянии равновесия может быть выражена как
[7.17] aA + bB = cC + dD
, где a моля реагента A реагируют с b моля реагента B с образованием c моль продукта C и d моль продукта D. Соответствующее изменение свободной энергии Гиббса для реакции в стандартных условиях представлено следующим уравнением:
[7.18] ΔG0 = cGC0 + dGD0-aGA0 + bGB0
, где верхний индекс 0 обозначает стандартные условия (т.е. единицу активности для продуктов и реагентов при 25 ° C). Для нестандартных условий уравнение [7.18] может быть выражено как
[7.19] ΔG = cGC + dGD − aGA + bGB
Алгебраическое вычитание уравнения [7.19] из уравнения [7.18] дает
[7.20] ΔG − ΔG0 = cGC + cGC0 + dGD-dGD0-aGA-GA0-bGB-GB0
Каждый член в правой части уравнения [7.20] может быть выражен в терминах активности для оценки изменения свободной энергии Гиббса по отношению к стандарту. государственный.Например, изменение свободной энергии Гиббса реагента A определяется выражением
[7.21] aGA-GA0 = aRTlnA
В этом выражении активность вида A заменена его концентрацией [A], предполагая эта реакция происходит в разбавленном растворе — условие, применимое для большинства коррозионных сред. Подстановка уравнения [7.21] и эквивалентных выражений для других реагентов и продуктов в уравнение [7.20] дает
[7.22] ΔG-ΔG0 = RTlnCcDdAaBb
.например, ΔG 0 = — n FE 0 и ΔG = — n FE) дает
[7.23] E − E0 = RTnFlnCcDdAaBb
Уравнение [форма 7.23] уравнения Нернста. Для удобства натуральная логарифмическая функция в этом уравнении преобразована в логарифмическую функцию по основанию 10, что дает
[7.24] E − E0-2.303RTnFlogCcDdAaBb
Уравнение [7.24] может быть применено для определения потенциала электрода при не- стандартные условия.Это представление уравнения Нернста удобно использовать, потому что концентрация и pH водной среды часто представлены как 10 x , где x — действительное число.
Чтобы проиллюстрировать использование уравнения Нернста, рассматривается электродный потенциал реакции восстановления водорода. Электродный потенциал для реакции восстановления водородом, представленный уравнением [7.7], получают с использованием уравнения [7.24]
[7.25] EH + / h3 = EH + / h30-2.303RT2Flogh3H +
Если [H 2 ] = pH 2 , равное 1 атмосферному давлению, уравнение [7.25] дает
[7.26] EH + / h3 = EH + / h30−2.303RT2F − logH + = EH + / h302−2p.303
При 25 ° C потенциал электрода для реакции восстановления водорода как функция pH раствора может быть представлен как
[7,27] EH + / h3 = 0,059pH
Аналогично, выражение для электродного потенциала кислорода реакция восстановления, представленная уравнением [7.15], также получается с использованием уравнения [7.24]
[7,28] EO2 / OH- = EO2 / OH-0-2,303RT2FlogOH-4pO2
, где pO 2 представляет собой парциальное давление кислорода. Эти два примера показывают, что даже несмотря на то, что уравнение Нернста является удобным инструментом для определения потенциала электрода в нестандартных условиях, для эффективного использования уравнения необходима дополнительная информация о химической среде. Однако во многих ситуациях точные химические условия окружающей среды и возможные электрохимические реакции, которые могут произойти, недоступны.В таких случаях можно использовать несколько потенциометрических методов, чтобы получить представление о термодинамической жизнеспособности различных процессов коррозии.
| F 2 + 2e — & rlhar; 2F — | +2,87 В | |
| O 3 + 2H + + 2e — & rlhar; O 2 + H 2 O | +2,07 В | |
| S 2 O 8 2− + 2e — & rlhar; 2СО 4 2− | +2.05 V | |
| H 2 O 2 + 2H + + 2e — & rlhar; 2H 2 O | +1,78 В | |
| PbO 2 + 3H + + HSO 4 — + 2e — & rlhar; ПбСО 4 + 2Н 2 О | +1,69 В | |
| Au + + e — & rlhar; Au | +1.69 В | |
| Pb 4+ + 2e — & rlhar; Пб 2+ | +1,67 В | |
| 2 HClO + 2H + + 2e — & rlhar; Класс 2 + 2H 2 O | +1,63 V | |
| Ce 4+ + e — & rlhar; CE 3+ | +1,61 В | |
| MnO 4 — + 8H + + 5e — & rlhar; Mn 2+ + 4H 2 O | +1.51 В | |
| PbO 2 + 4H + + 2e — & rlhar; Pb 2+ + 2H 2 O | +1,46 В | |
| Au 3+ + 3e — & rlhar; Au | +1,40 В | |
| Класс 2 + 2e — & rlhar; 2Cl — | +1,36 В | |
| Cr 2 O 7 2− + 14H + + 6e — & rlhar; 2Cr 3+ + 7H 2 O | +1.33 В | |
| O 2 + 4H + + 4e — & rlhar; 2H 2 O | +1,23 В | |
| MnO 2 + 4H + + 2e — & rlhar; Mn 2+ + 2H 2 O | +1,21 В | |
| 2IO 3 — + 12H + + 10e — & rlhar; Я 2 + 6H 2 O | +1.20 В | |
| Pt 2+ + 2e — & rlhar; Pt | +1.20 В | |
| Br 2 + 2e — & rlhar; 2Br — | +1,09 В | |
| VO 2 + + 2H + + e — & rlhar; VO 2+ + H 2 O | +1,00 В | |
| AuCl 4 — + 3e — & rlhar; Au + 4Cl — | +0.99 В | |
| НЕТ 3 — + 4H + + 3e — & rlhar; НЕТ + 2H 2 O | +0,96 В | |
| 2Hg 2+ + 2e — & rlhar; Hg 2 2+ | +0,92 В | |
| Pd 2+ + 2e — & rlhar; Pd | +0,915 В | |
| ClO — + H 2 O + 2e — & rlhar; Класс — + 2OH — | +0.89 В | |
| Ag + + e — & rlhar; Аг | +0,80 В | |
| Hg 2 2+ + 2e — & rlhar; 2Hg | +0,79 В | |
| Fe 3+ + e — & rlhar; Fe 2+ | +0,77 В | |
| Ni (OH) 2 + 2e — & rlhar; Ni + 2OH — | +0.714 В | |
| MnO 4 — + 2H 2 O + 3e — & rlhar; MnO 2 + 4OH — | +0,60 В | |
| I 2 + 2e — & rlhar; 2I — | +0,54 В | |
| NiO (OH) + H 2 O + e — & rlhar; Ni (OH) 2 + OH — | +0.49 В | |
| O 2 + 2H 2 O + 4e — & rlhar; 4OH – | +0,40 В | |
| Cu 2+ + 2e — & rlhar; Cu | +0,34 В | |
| Bi 3+ + 3e — & rlhar; Би | +0,31 В | |
| Hg 2 Cl 2 + 2e — & rlhar; 2Hg + 2Cl — | +0.27 В | |
| AgCl + e — & rlhar; Ag + Cl — | +0,22 В | |
| Sn 4+ + 2e — & rlhar; Sn 2+ | +0,15 В | |
| NO 3 — + H 2 O + 2e — & rlhar; НЕТ 2 — + 2OH — | +0,010 В | |
| 2H + + 2e — & rlhar; Н 2 | 0.000 V |
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Стандартные электродные потенциалы
В электрохимической ячейке электрический потенциал создается между двумя разнородными металлами. Этот потенциал является мерой энергии на единицу заряда, которая доступна в реакциях окисления / восстановления для запуска реакции. Принято визуализировать клеточную реакцию в виде двух полуреакций, полуреакции окисления и полуреакции восстановления.
| Восстановленные частицы -> окисленные частицы + ne — | |
| Окисленные частицы + ne — -> восстановленные частицы |
Потенциал клетки (часто называемый электродвижущей силой или ЭДС) имеет вклад анода, который является мерой его способности терять электроны — он будет называться его «окислительным потенциалом».Катод имеет вклад, основанный на его способности собирать электроны, его «восстановительном потенциале». Тогда потенциал ячейки может быть записан
E ячейка = окислительный потенциал + восстановительный потенциал
Если бы мы могли табулировать потенциалы окисления и восстановления всех доступных электродов, то мы могли бы предсказать потенциалы ячеек гальванических элементов, созданных из любой пары электроды. Фактически, табулирования того или другого достаточно, поскольку окислительный потенциал полуреакции является отрицательным по отношению к восстановительному потенциалу обратной реакции.Чтобы составить такую таблицу, необходимо преодолеть два основных препятствия.
- Электродный потенциал не может быть определен изолированно, а в реакции с каким-либо другим электродом.
- Электродный потенциал зависит от концентраций веществ, температуры и давления в случае газового электрода.
На практике первое из этих препятствий преодолевается путем измерения потенциалов относительно стандартного водородного электрода. Природа электрического потенциала такова, что ноль потенциала является произвольным; практическое значение имеет разность потенциалов.Табулирование всех электродных потенциалов относительно одного и того же стандартного электрода обеспечивает практическую рабочую основу для широкого диапазона расчетов и прогнозов. Стандартный водородный электрод имеет нулевой потенциал.
Второе препятствие преодолевается путем выбора стандартных термодинамических условий для измерения потенциалов. Стандартные электродные потенциалы обычно определяются при концентрации растворенного вещества 1 моль, давлении газа 1 атмосфера и стандартной температуре, которая обычно составляет 25 ° C.Стандартный потенциал ячейки обозначается знаком степени в виде верхнего индекса.
| E ° Ячейка |
|
В приведенном ниже примере показаны некоторые экстремальные значения для стандартных потенциалов ячейки.
| Катод (восстановление) Полуреакция | Стандартный потенциал E ° (вольт) |
| Li + (вод.) + E — -> Li (s) | -3 .04 |
| K + (водн.) + E — -> K (s) | -2,92 |
| Ca 2+ (водн.) + 2e — -> Ca (s) | -2,76 |
| Na + (водн.) + E — -> Na (s) | -2,71 |
| Zn 2+ (водн.) + 2e — -> Zn (s) | -0,76 |
| Cu 2+ (водн.) + 2e — -> Cu (s) | 0.34 |
| O 3 (г) + 2H + (вод.) + 2e — -> O 2 (г) + H 2 O (л) | 2,07 |
| F 2 (g) + 2e — -> 2F — (водн.) | 2,87 |
Значения для записей в таблице являются потенциалами восстановления, поэтому литий в верхней части списка имеет наиболее отрицательные значения. число, указывающее, что это самый сильный восстановитель. Самый сильный окислитель — фтор с наибольшим положительным числом для стандартного электродного потенциала.Ссылка ниже приведет вас к более обширной таблице.
Ниже перечислены полезные применения стандартных электродных потенциалов.
% PDF-1.4
%
1711 0 объект
>
эндобдж
xref
1711 91
0000000016 00000 н.
0000002175 00000 н.
0000002274 00000 н.
0000002786 00000 н.
0000002981 00000 н.
0000003318 00000 н.
0000003533 00000 н.
0000003555 00000 н.
0000003679 00000 н.
0000003701 00000 п.
0000003830 00000 н.
0000003852 00000 н.
0000003981 00000 н.
0000004003 00000 п.
0000004132 00000 н.
0000004154 00000 п.
0000004283 00000 п.
0000004305 00000 н.
0000004434 00000 н.
0000004456 00000 п.
0000004586 00000 н.
0000004623 00000 н.
0000004645 00000 н.
0000004773 00000 н.
0000004795 00000 н.
0000004922 00000 н.
0000004944 00000 н.
0000005071 00000 н.
0000005093 00000 н.
0000005221 00000 н.
0000005243 00000 п.
0000005370 00000 н.
0000005392 00000 п.
0000005520 00000 н.
0000005542 00000 н.
0000005670 00000 п.
0000005692 00000 п.
0000005822 00000 н.
0000005844 00000 н.
0000005974 00000 п.
0000005996 00000 н.
0000006126 00000 н.
0000006148 00000 н.
0000006276 00000 н.
0000006298 00000 н.
0000006427 00000 н.
0000006449 00000 н.
0000006578 00000 н.
0000006600 00000 н.
0000006693 00000 н.
0000006715 00000 н.
0000007001 00000 н.
0000007025 00000 н.
0000010294 00000 п.
0000010318 00000 п.
0000013023 00000 п.
0000013047 00000 п.
0000014809 00000 п.
0000014833 00000 п.
0000019547 00000 п.
0000019571 00000 п.
0000028068 00000 п.
0000028092 00000 п.
0000035459 00000 п.
0000035483 00000 п.
0000040580 00000 п.
0000040603 00000 п.
0000041121 00000 п.
0000041145 00000 п.
0000043468 00000 п.
0000043492 00000 п.
0000051146 00000 п.
0000051170 00000 п.
0000055374 00000 п.
0000055398 00000 п.
0000057687 00000 п.
0000057711 00000 п.
0000065668 00000 п.
0000065692 00000 п.
0000070481 00000 п.
0000070505 00000 п.
0000080610 00000 п.
0000080635 00000 п.
00000 00000 н.
00000 00000 п.
0000099669 00000 н.
0000099693 00000 п.
0000103551 00000 н.
0000103573 00000 п.
0000002429 00000 н.
0000002763 00000 н.
трейлер
]
>>
startxref
0
%% EOF
1712 0 объект
>
эндобдж
1713 0 объект
> / Кодировка> >>
/ DA (/ Helv 0 Tf 0 г)
>>
эндобдж
1800 0 объект
>
поток
Hb«e`e`f`8 Ȁ
Таблица общих стандартных восстановительных потенциалов
Эта таблица представляет собой алфавитный список общих полуреакций восстановления и их стандартный восстановительный потенциал, E 0 , при 25 ° C и давлении 1 атмосфера.
Все стандартные восстановительные потенциалы основаны на стандартном водородном электроде. Стандартные потенциалы окисления могут быть рассчитаны путем обращения полуреакций и изменения знака стандартного потенциала восстановления.
E 0 СНИЖЕНИЕ = — E 0 ОКИСЛЕНИЕ
| Полуреакция восстановления | Понижающий потенциал — E 0 в вольтах |
| Ag + + e — → Ag | 0.7996 |
| Ag 2+ + e — → Ag + | 1,980 |
| Ag 3+ + e — → Ag 2+ | 1,8 |
| AgBr + e — → Ag + Br – | 0,0713 |
| AgCl + е — → Ag + Cl – | 0,2223 |
| AgF + e — → Ag + F – | 0.779 |
| AgI + e — → Ag + I – | -0,1522 |
| AgNO 2 + e — → Ag + 2 НО 2 — | 0,564 |
| Ag 2 S + 2 e — → 2 Ag + S 2- | -0,691 |
| Ag 2 S + 2 H + + 2 е — → 2 Ag + H 2 S | -0,0366 |
| Al 3+ + 3 e — → Аl | -1.662 |
| руб. 2 (водн.) +2 эл. — → 2 руб. – | 1.0873 |
| руб. 2 (ℓ) +2 эл. — → 2 руб. – | 1.066 |
| Ca 2+ + 2 e — → Са | -2,868 |
| Кд 2+ + 2 e — → Кд | -0,4030 |
| Cl 2 + 2 е — → 2 Cl — (г) | 1.3583 |
| Cr 2+ + 2 e — → Cr | -0,913 |
| Cr 3+ + e — → Кр 2+ | -0,407 |
| Cr 3+ + 3 e — → Cr | -0,744 |
| Cr 2 O 7 2- + 14 часов + + 6 e — → 2 кр 3+ + 7 часов 2 O | 1,36 |
| Cu + + e — → Cu | -3.026 |
| Cu 2+ + e — → Cu + | 0,153 |
| Cu 2+ + 2 e — → Cu | 0,3419 |
| Cu 3+ + e — → Cu 2+ | 2,4 |
| ф. 2 + 2 ч + + 2 е — → 2 HF | 3,053 |
| ф. 2 + 2 е — → 2 ж. – | 2.866 |
| Fe 2+ + 2 e — → Fe | -0,447 |
| Fe 3+ + 3 e — → Fe | -0,037 |
| Fe 3+ + e — → Fe 2+ | 0,771 |
| 2 часа + + 2 е — → Н 2 | 0,0000 |
| H 2 O 2 + 2 ч + + 2 е — → 2 ч 2 O | 1.776 |
| я 2 + 2 е — → 2 я – | 0,5355 |
| К + + e — → К | -2,931 |
| Li + + e — → Li | -3,0401 |
| мг + + e — → мг | -2,70 |
| мг 2+ + 2 e — → мг | -2,372 |
| млн 2+ + 2 e – → Mn | -1.185 |
| млн 3+ + e — → Mn 2+ | 1,5415 |
| Na + + e — → Na | -2,71 |
| Ni 2+ + 2 e — → Ni | -0,257 |
| O 2 + 2 ч + + 2 е — → 2 ч 2 O 2 | 0,695 |
| O 2 + 4 ч + + 4 эл. — → Н 2 O | 1.229 |
| Пб 2+ + 2 e — → Пб | -0,1262 |
| ПбСО 4 + 2 е — → Pb + SO 4 2- | -0,3588 |
| Пт 2+ + 2 e — → Pt | 1,18 |
| S + 2 e — → Ю 2- | -0,4284 |
| S + 2 H + + 2 е — → Н 2 S | 0.142 |
| СО 4 2- + H 2 + 2 е — → СО 3 2- + 2 ОН – | -0,93 |
| Zn 2+ + 2 e — → Zn | -0,7618 |
Ссылка: Справочник по химии и физике, 89-е издание, CRC Press 2008
.
