Содержание
Физические и химические свойства веществ
Различные вещества отличаются друг от друга своими свойствами.
Свойства вещества — это признаки, по которым одно вещество отличается от других веществ или сходно с ними.
Пример. Сходства и отличия между водой и ацетоном на примере трёх свойств:
| Свойства | Вещества | |
|---|---|---|
| Вода | Ацетон | |
| Температура кипения | 100 °C | 56 °C |
| Цвет | нет | нет |
| Запах | нет | есть |
Свойства вещества делятся на физические и химические.
Физические свойства вещества — это свойства вещества, которые можно определить наблюдением, измерением или экспериментальным путём, без его превращения в другое вещество.
Пример. Вода не имеет цвета, вкуса, запаха, в зависимости от окружающих условий может находиться в одном из трёх агрегатных состояний — жидком, твёрдом или газообразном. Цвет, запах, вкус, агрегатное состояние при определённых температуре и давлении — физические свойства.
Физические свойства вещества зависят от его агрегатного состояния.
Пример. Плотность льда, воды и водяного пара различна. Газообразный кислород бесцветный, а жидкий — голубой.
Химические свойства вещества — это свойства вещества, которые проявляются в химических реакциях.
Пример. Вода при очень высокой температуре разлагается на водород и кислород. Вода вступает в химическую реакцию с натрием, при этом образуются гидроксид натрия и водород. Железо окисляется при нагревании на воздухе или в токе кислорода, или при высокой влажности воздуха. Способность окисляться, вступать в химическую реакцию с другими веществами и разлагаться — химические свойства.
Способность окисляться, вступать в химическую реакцию с другими веществами и разлагаться — химические свойства.
Для установления свойств вещества необходимо брать его с минимально возможным количеством примесей. Иногда даже очень малое содержание примеси может привести к сильному изменению некоторых свойств вещества.
Пример. Содержание в цинке лишь сотых долей процента железа или меди ускоряет его взаимодействие с соляной кислотой в сотни раз.
Изучить вещество — это значит узнать его свойства, описать из чего и как оно построено.
Вещество химические свойства — Справочник химика 21
Характерным для всех элементарных веществ химическим свойством, как уже указано выше, является их неспособность разлагаться с образованием двух или большего числа веществ. Способность же элементарных веществ вступать в реакции с другими веществами проявляется индивидуально и характеризует каждое элементарное вещество. [c.7]
[c.7]
Антрацен является кристаллическим веществом. Химические свойства его определены строением два ядра бензола придают ему свойства, характерные ароматическим углеводородам, а среднее кольцо является носителем свойств алифатических углеводородов. Например, средняя часть антрацена легко поддается окислению хромовой смесью, причем образуется а н т р а х и-н о н. [c.157]
Атом — ЭТО наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям [c.10]
Приступая к решению задач по неорганической химии, необходимо прежде всего обратить внимание на связь и взаимные превращения между различными классами соединений. Поэтому так важна классификация химических соединений, под которой понимают объединение разнообразных соединений в определенные классы, обладающие сходными свойствами (оксиды, соли и т. д.). Классификация естественным образом связана с проблемой номенклатуры, т. е. системой названий веществ. Химические свойства веществ проявляются в разнообразных химических реакциях, которые также классифицируются по различным признакам. Нужно уметь распознавать основные типы химических реакций соединения, разложения, обмена, замещения, окислительно-восстановительные, обратимые, необратимые и т. д. Как номенклатура, так и классификация соединений (а также химических реакций) складывались на протяжении столетий, поэтому они не всегда являются логическими и требуют вдумчивого осмысливания. [c.151]
д.). Классификация естественным образом связана с проблемой номенклатуры, т. е. системой названий веществ. Химические свойства веществ проявляются в разнообразных химических реакциях, которые также классифицируются по различным признакам. Нужно уметь распознавать основные типы химических реакций соединения, разложения, обмена, замещения, окислительно-восстановительные, обратимые, необратимые и т. д. Как номенклатура, так и классификация соединений (а также химических реакций) складывались на протяжении столетий, поэтому они не всегда являются логическими и требуют вдумчивого осмысливания. [c.151]
Исходя из общепринятого в настоящее время положения, что катализ, несмотря на своеобразие и специфичность, представляет собой в первую очередь химическое явление, следует ожидать наиболее широкой корреляции между каталитическими и химическими свойствами веществ. Химические свойства определяют, кроме того, большую или меньшую устойчивость вещества в условиях катализа и, следовательно, возможность его применения как катализатора для данного типа реакций. А так как химические свойства веществ в наиболее общем виде определяются положением образующих их элементов в периодической таблице, последняя принята за основу классификации. [c.3]
А так как химические свойства веществ в наиболее общем виде определяются положением образующих их элементов в периодической таблице, последняя принята за основу классификации. [c.3]
Что касается расположения материала, то рациональной систематики каталитических реакций, как уже было сказано, нет,— ее еще предстоит искать. Основываться же на какой-либо произвольной системе каталитических реакций, подобно тому как это делалось неоднократно в различных специальных монографиях, мы считали нецелесообразным. Материал справочника систематизирован исходя из периодической системы элементов Д. И. Менделеева. Отталкиваясь от общепринятого в настоящее время положения о том, что катализ, несмотря на все его своеобразие и специфичность, является в первую очередь химическим явлением, следует ожидать наиболее широкой корреляции между каталитическими и химическими свойствами веществ. Химические свойства веществ определяют, кроме того, большую или меньшую устойчивость данного вещества в условиях катализа и, следовательно, возможность его применения как катализатора для данного типа реакций. А так как химические свойства веществ в наиболее общем виде определяются положением образующих их элементов в периодической таблице, принятие ее за основу классификации каталитических свойств мы сочли наиболее оправданным. Поэтому распределение материала по главам соответствует положению элемента, образующего соединение, которое служит катализатором в периодической таблице. Нужно сказать, что при реализации этого принципа мы встретились с рядом трудностей. Основные из них таковы [c.4]
А так как химические свойства веществ в наиболее общем виде определяются положением образующих их элементов в периодической таблице, принятие ее за основу классификации каталитических свойств мы сочли наиболее оправданным. Поэтому распределение материала по главам соответствует положению элемента, образующего соединение, которое служит катализатором в периодической таблице. Нужно сказать, что при реализации этого принципа мы встретились с рядом трудностей. Основные из них таковы [c.4]
Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства атома определяются его строением. Исходя из последнего, дается и современное определение атома атом — это электронейтральная частица, состоящая из положительно заряженного ядра и одного или нескольких электронов. [c.11]
Молекула есть наименьшая частица вещества, способная существовать самостоятельно и имеющая одинаковые с данным веществом химические свойства. При разложении молекулы на более мелкие частички, на атомы, последние уже не имеют тех свойств, которыми обладает вещество. [c.23]
При разложении молекулы на более мелкие частички, на атомы, последние уже не имеют тех свойств, которыми обладает вещество. [c.23]
Галогенсиланы — очень реакционноспособные вещества. Химические свойства их обусловлены наличием связей Si—Н и Si—X поэтому для них характерны и те реакции, которые присущи силану, и те, в которых связь Si—Н сохраняется, а галоген замещается другими группами. В отличие от силана, его галогенпроизводные способны к образованию комплексных соединений. При повышенных температурах или при действии катализаторов галогенсиланы подвергаются диспропорционированию. [c.569]
Молекула состоит из атомов. Атом — наименьшая частица химического элемента, входящая в состав молекулы простого или сложного вещества. Химические свойства атома определяются его строением. [c.15]
Первая трудность обусловлена самой природой твердых веществ, химические свойства которых очень чувствительны к малейшим изменениям [c. 20]
20]
Гексафторид урана — весьма реакционноспособное вещество химические свойства его во многом аналогичны свойствам высших фторидов актинидов и элементов подгруппы хрома. [c.35]
Атом — наименьшая частица химического элемента, входяищя в состав молекул простых и сложных веществ . Химические свойства атома определяются его строением. [c.13]
Среди циклических непредельных соединений выделяется большая группа веществ, имеющих общее характерное отличие — шестичленный цикл с недостаточным, по сравнению с предельными соединениями, содержанием водорода. По химическому составу эпт мо.текулы отвечают формуле С Н.2 в, т. е. содержат на шесть атомов водорода меньше, чем циклоалканы, и должны иметь три двойных связи. Но в действительности, эти вещества химических свойств непредельных углеводородов не проявляют. Простейшим соединением этого ряда является углеводород бензол состава СвНв. [c.121]
Кислотно-основные свойства химических соединений, их изменение в группе и периоде
Как определить какими свойствами обладает вещество — кислотными или основными? Что такое кислота? И что есть основание?
Существует три подхода к определению кислот и оснований.
1) По определению Аррениуса:
кислоты в водных растворах диссоциирует на ионы водорода и анионы,
основания диссоциируют на гидроксид-ионы и катионы.
2) Теория Бренстеда–Лоури (протонная теория):
кислота — вещество, способное быть донором протонов,
основание – вещество, которое может присоединить (акцептировать) протон.
Аммиак, согласно теории Бренстеда -Лоури, является основанием: NH3 +H+ →NH4+
3) Электронная теория Льюиса (апротонная теория)
допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной.
Кислота — вещество, способное присоединять электронную пару,
основание – вещество, способное отдавать электронную пару.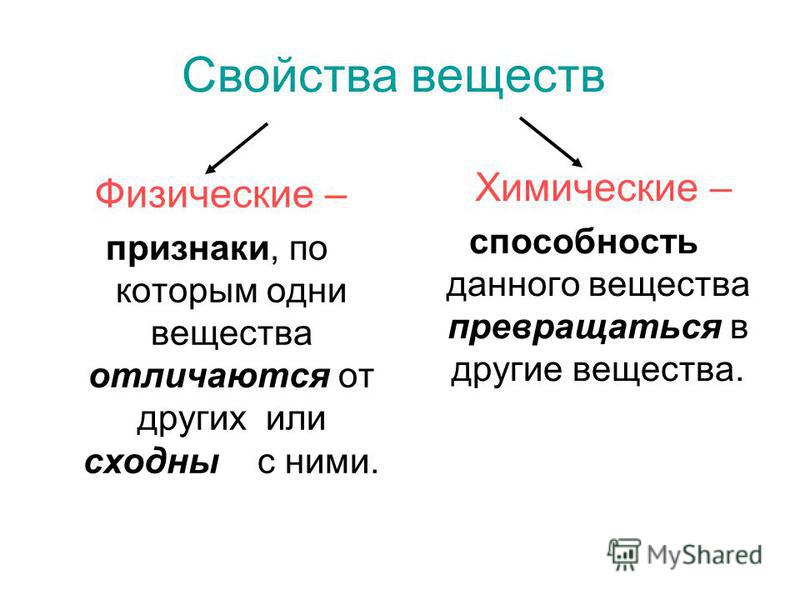
При взаимодействии донора электронной пары: NF3 (основание) и акцептора электронной пары BF3 (кислота) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Теперь давайте рассмотрим, как происходит изменение кислотно-основных свойств некоторых соединений по группам и по периодам.
1) Бинарные соединения неметаллов с водородом
В группах сверху вниз (например, в ряду НF-HCl-HBr-HI) отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+ (т.к радиус ионов неметаллов увеличивается и, соответственно, увеличивается длина связи). В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается.
Метан не проявляет кислотно-основных свойств (и в воде не растворяется), раствор аммиака в воде дает щелочную среду, вода — нейтральное соединение, раствор фтороводорода в воде — слабая кислота (плавиковая).
2) Кислородосодержащие кислоты
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз:
Интеллектуальная система предсказания свойств химических веществ Текст научной статьи по специальности «Компьютерные и информационные науки»
SCIENCE TIME
ИНТЕЛЛЕКТУАЛЬНАЯ СИСТЕМА ПРЕДСКАЗАНИЯ СВОЙСТВ ХИМИЧЕСКИХ ВЕЩЕСТВ
Осипов Александр Леонидович, Трушина Вероника Павловна, Новосибирский государственный университет экономики и управления, г. Новосибирск
Новосибирск
E-mail: [email protected]
Аннотация. Рассматривается интеллектуальная информационная система для прогнозирования свойств химических веществ. Продемонстрирована эффективность системы на экспериментальном материале. Проведена оценка степени воздействия структурных и иных характеристик молекул на биологические и физико-химические свойства.
Ключевые слова: интеллектуальная система, физико-химические и биологические свойства, математические модели, статистическая теория решений, точность прогнозирования, подструктурные дескрипторы.
Современное состояние научных и прикладных исследований в химии и целого ряда, смежных с ней областей характеризуется использованием математических методов и новых информационных технологий для автоматизации эксперимента и обработки получаемых физико-химических, биологических и других данных, которые включают в себя: систему поддержки профессиональных структурно-химических и биологических баз данных и знаний; интеллектуальную систему, позволяющую предсказывать, и оценивать степень воздействия структурных и иных характеристик органических молекул на их биологические и физико-химические свойства [1, 11, 13].
Для целенаправленного синтеза препаратов с заданными свойствами важно установить взаимосвязи строения химических веществ с их действием. Выявление этой связи основано на знании молекулярных механизмов взаимодействия биологических систем с химическими веществами. Теоретические построения, описывающие детальный механизм воздействия биологически активных соединений на живые организмы, пока не привели к заметным результатам и, по-видимому, должны развиваться эмпирические методы исследований. Использование при таком поиске математических методов
моделирования, компьютерных технологий и фактографических банков данных и знаний позволяет обнаруживать скрытые закономерности, формализовать некоторые решения, направленно вести поиск и синтез препаратов с заданными свойствами [2, 14]. Интеллектуальная компьютерная система состоит из нижеследующего.
1. Оригинальная СУБД, которая поддерживает обработку таких сложноструктурированных объектов как молекулярные химические графы. СУБД имеет встроенный гипертекстовый HELP, дружественный интерфейс с пользователем, редактор входных и выходных форм. Ввод, вывод и манипулирование структурными формулами молекул осуществляется графическим экранным редактором, основные режимы, которого: рисование, удаление, редактирование, сборка из фрагментов, создание ароматических комплексов, манипулирование структурными формулами и другие. Поиск информации в БД осуществляется по любому полю или совокупности полей, включая подструктурный поиск, который происходит путем рисования структурного фрагмента и/или фрагментов графическим редактором и внесения их в поисковые предписания на специально разработанном языке запросов. Идентификация химических веществ происходит по каноническому коду, программно порождаемому системой [3, 10].
Оригинальная СУБД, которая поддерживает обработку таких сложноструктурированных объектов как молекулярные химические графы. СУБД имеет встроенный гипертекстовый HELP, дружественный интерфейс с пользователем, редактор входных и выходных форм. Ввод, вывод и манипулирование структурными формулами молекул осуществляется графическим экранным редактором, основные режимы, которого: рисование, удаление, редактирование, сборка из фрагментов, создание ароматических комплексов, манипулирование структурными формулами и другие. Поиск информации в БД осуществляется по любому полю или совокупности полей, включая подструктурный поиск, который происходит путем рисования структурного фрагмента и/или фрагментов графическим редактором и внесения их в поисковые предписания на специально разработанном языке запросов. Идентификация химических веществ происходит по каноническому коду, программно порождаемому системой [3, 10].
2. Инструментальная система для прогнозирования биологических свойств химических препаратов и конструирования новых биологически активных соединений с заданными свойст вами по их ст рукт урным формулам с учетом или без учета физико-химических параметров молекул позволяет создавать обучающие и экзаменационные выборки из БД, задавать или выбирать из меню различные описания химической структуры или иных признаков, выбирать различные модели статистической обработки данных для принятия решений о принадлежности химического соединения к тому или иному типу биологической активности, оценивать их адекватность, предсказывать биологические, фармакологические, токсические, мутагенные и канцерогенные свойства органических веществ по их структурным формулам с учетом или без учета физико-химических параметров. Точность прогнозирования (процент правильных решений) в разработанной системе при предсказании различных биологических свойств составила 88-96% [4].
Точность прогнозирования (процент правильных решений) в разработанной системе при предсказании различных биологических свойств составила 88-96% [4].
3. Инструментальная система моделирования физико-химических и токсикологических свойств, основанная на оригинальных мат емат ических моделях (структурно-аддитивных и неаддитивных), которые затем применяются при нахождении количественных корреляций структура-свойство, что позволяет предсказывать такие важные параметры химических веществ, как молекулярная рефракция и липофильность, которые используются в дальнейшем при прогнозировании биологической активности химических веществ. Система
позволяет предсказывать токсикологические параметры химических соединений с использованием моделей распознавания образов и кусочно-линейных регрессионных моделей, где интервалами линейности регрессии являются классы опасности химических веществ [5, 9].
4. Инструментальная система автоматического порождения модельных знаний и их пополнения в базу знаний. Модельные знания заключают в себе способность проявлять свойства, моделируемого ими объекта в рамках представленного пользователем описания за счет помещения их в предполагаемую математическую среду [6].
Инструментальная система автоматического порождения модельных знаний и их пополнения в базу знаний. Модельные знания заключают в себе способность проявлять свойства, моделируемого ими объекта в рамках представленного пользователем описания за счет помещения их в предполагаемую математическую среду [6].
5. Инструментальная система генерации неизоморфных химических графов на основе соответствующего множества помеченных вершин с возможностью задания дополнительных ограничений путем указания сведений о связывании вершин отдельных типов между собой, а также в виде списков обязательных и запрещенных фрагментов, которым соответственно разрешается и запрещается присутствовать в структурах финального списка. Из всего множества сгенерированных гипотетических структур происходит отбор биологически активных соединений, и даются машинные рекомендации, какими биологическими и/или физико-химическими свойствами они обладают [7].
6. Система интеллектуальных интерфейсов, позволяющая производить ввод, корректировку и кодировку данных, а также обеспечивающих работу графических средств визуализации данных на всех этапах ее функционирования. Блока анализа и объяснения, который позволяет пользователю проследить всю цепочку принимаемых системой решений [8].
Система интеллектуальных интерфейсов, позволяющая производить ввод, корректировку и кодировку данных, а также обеспечивающих работу графических средств визуализации данных на всех этапах ее функционирования. Блока анализа и объяснения, который позволяет пользователю проследить всю цепочку принимаемых системой решений [8].
7. Инструментальная система компьютерной диагностики канцерогенной опасности и радиоактивности химических веществ. Предсказание канцерогенных и радиоактивных свойств осуществлялось на основе моделей и алгоритмов распознавания образов и теории статистических решений. Рассматривалась задача распознавания образов применительно к случаю двух классов [3, 5].
Обозначим через Н1 соответствующий класс «канцерогены». Будем
рассматривать объекты обучающей выборки, входящие в Н1, как положительные примеры класса Н1 , а объекты не входящие в Н 1 , — как
контпримеры или отрицательные объекты класса Н1 , множество которых мы
обозначим через Н2 . ёк1к +10, где
ёк1к +10, где
к=1
lk = log—— — информационный вес k — го дескриптора, а l0 =У log1 Pk —
qk(1 — Pk) k=1 1 — qk
константа. Байесовское решающее правило, минимизирующее среднюю вероятность ошибки, запишется следующим образом:
p( H )
если l(X) > log , то X е h2, иначе X е h3.
P( h2)
При выводе решающего правила исходили из того, что потери при правильной классификации равны нулю, а при ошибочной единице. При построении систем распознавания возможны такие ситуации, когда априорные вероятности появления объектов соответствующих классов p(h2) и p(h3)
неизвестны. Применительно к этой ситуации рационально использовать минимаксный критерий, который минимизирует максимально возможное значение среднего риска. Известно, что минимаксное правило представляет собой специальное правило Байеса для наименее благоприятных априорных вероятностей. В этом случае решающая граница выбирается так, чтобы обеспечить равенство ошибок первого и второго рода, которые соответственно равны:
Применительно к этой ситуации рационально использовать минимаксный критерий, который минимизирует максимально возможное значение среднего риска. Известно, что минимаксное правило представляет собой специальное правило Байеса для наименее благоприятных априорных вероятностей. В этом случае решающая граница выбирается так, чтобы обеспечить равенство ошибок первого и второго рода, которые соответственно равны:
ех = |Р(X/Н1)ёХ и а2 = |Р(X/Н2)ёХ .
Н 2 Н1
Оценка величин р, и чг осуществляется по конечному числу
выборочных представителей образов в соответствующих классах:
к +1 к, 2 +1
Рг =-, Чг =—-,
г N + 2 г Ы2 + 2
где кп, кг2 — числа встречаемости г — го дескриптора в первом и втором
классах, а ы1, Ы2 — объемы обучающих выборок в этих классах.
Проверка эффективности решающего правила исследовалась на обучающих выборках, указание которых вместе с выбором информативных подструктурных фрагментов осуществлялась при помощи оригинальной СУБД и системы запросов к базе данных [2, 10]. Объемы обучающих выборок по канцерогенным свойствам химических веществ составляли по 600 органических соединений в каждом из двух классов («канцерогены» — «неканцерогены»), а объем экзаменационной выборки составил 200 химических веществ. Точность предсказания по выбранным классам колебалась от 91% до 95%. В работе [15] представлены химические соединения, обладающие канцерогенной активностью (40 веществ) и не обладающие канцерогенной активностью (20 веществ). Из них была сформирована экзаменационная выборка. Точность предсказания для данной экзаменационной выборки оказалась равной 100%. Все 40 соединений, обладающие канцерогенной активностью, полностью были отделены от соединений, не обладающих канцерогенным действием. , где ак2 — ошибка, второго рода для к — го класса в зависимости от отношения правдоподобия I , а значение к , на котором достигается тах(1 — аи2) , и является номером соответствующего класса [4].
, где ак2 — ошибка, второго рода для к — го класса в зависимости от отношения правдоподобия I , а значение к , на котором достигается тах(1 — аи2) , и является номером соответствующего класса [4].
и
Проблема химической защиты организма от воздействия ионизирующей радиации с каждым годом приобретает все большую актуальность в связи с
SCIENCE TIME
развитием атомной энергетики, а также расширением сфер использования источников ионизирующих излучений в народном хозяйстве, биологии и медицине. По этой причине становится весьма важной проблема поиска препаратов, обладающих радиозащитными свойствами, используя методы молекулярного моделирования. Разработана компьютерная система моделирования радиопротекторных свойств органических веществ, состоящая из:
— подсистемы ведения и манипулирования фактографической базой данных по радиопротекторным свойствам химических веществ;
— подсистемы анализа, моделирования, прогнозирования и синтеза информации, которая обеспечивает: ввод, вывод и манипулирование структурными формулами, порождение дескрипторного описания химических веществ, генерацию моделей байесовской классификации, регрессионного анализа и нечетких алгоритмов обработки данных.
Объемы обучающих выборок по радиопротекторным свойствам химических веществ составляли по 1500 органических соединений в каждом из двух классов («радиопротекторы» — «нерадиопротекторы»), а объем экзаменационной выборки составил 500 химических веществ. Точность предсказания по выбранным классам колебалась от 92% до 96% [8]. В работе [15] представлены химические соединения, обладающие радиозащитной активностью (32 вещества) и не обладающие радиозащитной активностью (28 веществ). Из них была сформирована экзаменационная выборка. Точность предсказания для данной экзаменационной выборки оказалась равной 100%. Все 32 соединения, обладающие радиозащитной активностью, полностью были отделены от соединений, не обладающих защитным действием. В работе использовались подструктурные дескрипторы, порождаемые автоматически и описанные на весьма простом языке. Это язык описания атомов и функциональных групп с учетом их валентного состояния, а также их цепочки произвольной длины с указанием атома или группы в цепи, кольце или мостике. Созданная компьютерная информационно-аналитическая система представляет собой мощный инструментарий, который дает возможность в режиме диалога вести оперативный прогноз радиопротекторных и других свойств химических соединений, проверять на больших выборках гипотезы о связи структуры веществ с их биологическим действием, а также анализировать сравнительную информативную ценность различных групп факторов при изучении механизмов взаимодействия веществ с живым организмом. Таким образом, использование простых байесовских решающих правил сделало эффективным диагностику канцерогенно сти и радиоактивности без привлечения более сложных дескрипторов и алгоритмов.
Созданная компьютерная информационно-аналитическая система представляет собой мощный инструментарий, который дает возможность в режиме диалога вести оперативный прогноз радиопротекторных и других свойств химических соединений, проверять на больших выборках гипотезы о связи структуры веществ с их биологическим действием, а также анализировать сравнительную информативную ценность различных групп факторов при изучении механизмов взаимодействия веществ с живым организмом. Таким образом, использование простых байесовских решающих правил сделало эффективным диагностику канцерогенно сти и радиоактивности без привлечения более сложных дескрипторов и алгоритмов.
Литература:
1. Осипов А.Л., Семенов Р.Д., Зацепин В.М. Система компьютерного предсказания физико-химических и биологических свойств веществ // Автометрия. 1995. № 5. С. 86.
2. Осипов A. Л., Башелханов А.А., Борисов М.Б. Система моделирования параметров, представляющих эффекты биологической среды //Автометрия. 1998. № 3. C. 54.
Л., Башелханов А.А., Борисов М.Б. Система моделирования параметров, представляющих эффекты биологической среды //Автометрия. 1998. № 3. C. 54.
3. Осипов А.Л., Бобров Л.К. Об использовании моделей статистического распознавания в системе виртуального скрининга химических веществ // Научно -техническая информация. Серия 2: Информационные процессы и системы. 2012. № 7. С. 1-6.
4. Нигматуллин Р.С., Осипов А.Л., Пузаткин А.П., Коптюг В.А. Статистический метод предсказания биологической активности многоатомных молекул на основе дескрипторов графов структурных формул // Химико-фармацевтический журнал. 1985. № 2.
5. Осипов А. Л., Бобров Л.К. Прогнозирование свойств химических соединений на основе структурно-неаддитивных моделей с учетом парциальных вкладов структурных элементов // Научно-техническая информация. Серия 2: Информационные процессы и системы. 2013. № 9. С. 35-39.
6. Осипов А.Л. Метод моделирования адиабатической температуры горения химических веществ на основе дескрипторов графов структурных формул // Автометрия. 2004. Т. 40. № 1. C. 74-83.
7. Осипов А. Л., Криветченко О.В., Трушина В.П., Рапоцевич Е.А. Компьютерный анализ химико-биологических данных //В мире научных открытий. 2014. № 4 (52). С. 117-122.
8. Осипов А.Л., Трушина В.П., Чентаева Е.А. Предсказание радиопротекторных свойств методами распознавания образов // В мире научных открытий. 2014. № 4 (52). С. 123-127.
9. Osipov A.L., Aleksandrov V.V. Statistical Classification method of chemicals with respect to the toxicity degree // Автометрия. 2003. № 1. С. 114-125.
10. Нигматуллин Р.С., Осипов А.Л., Карпова Н.А. Система поиска и анализа патентной информации о химических соединениях // Научно-техническая информация. Серия 2: Информационные процессы и системы. 1989. № 1. С. 14.
11. Осипов А. Л., Криветченко О.В. Компьютерная оценка нижнего концентрационного предела воспламенения химических веществ // В мире научных открытий. 2013. № 10. С. 34.
12. Осипов А.Л., Рапоцевич Е.А., Трушина В.П., Подборщаева Н.В., Трифонова А.С. Математические модели оптимизации ассортимента химических средств защиты растений // В мире научных открытий. 2014. № 4 (52). С. 183-188.
SCIENCE TIME
13. Трушина В.П., Шляпкин Г.В., Пятницев Д.В. Компьютерная система моделирования физико-химических свойств органических соединений. В сборнике: Новые задачи технических наук и пути их решения. Сборник статей Международной научно-практической конференции. Научный центр «Аэтерна». Уфа, 2014. С. 60-61.
14. Осипов А.Л., Трушина В.П., Пятницев Д.В., Шляпкин Г.В., Павлик И.О. Интеллектуальные технологии анализа химико-биологических данных // В мире научных открытий. 2014. № 12.2 (60). С. 749-757.
15. Мухоморов В.К. Моделирование биологической активности химических соединений. Соотношения структура — активность. Монография, Saarbrucken: LAP LAMBERT Academic Publishing, 2012. 167 c.
16. Chemical induction of cancer: structure basis and biological mechanism. N.J. 1982. Vol. 3a. 747 p.
Антимикробные свойства химических соединений классов азаадамантанов и четвертичных аминов
На правах рукописи
УДК 619 614 48
ВОЛОГИНА ИРИНА ВИКТОРОВНА
АНТИМИКРОБНЫЕ СВОЙСТВА ХИМИЧЕСКИХ СОЕДИНЕНИЙ КЛАССОВ АЗААДАМАНТАНОВ И ЧЕТВЕРТИЧНЫХ АМИНОВ
16 00 03 — ветеринарная микробиология, вирусология, эпизоотология, микология с микотоксикологией и иммунология 16 00 06 — ветеринарная санитария, экология, зоогигиена и ветеринарно-санитарная экспертиза
Автореферат диссертации на соискание ученой степени кандидата ветеринарных наук
Работа выполнена в Государственном научном учреждении Всероссийском научно-исследовательском институте ветеринарной вирусологии и микробиологии Российской академии сельскохозяйственных наук (ГНУ ВНИИВВиМ РОССЕЛЬХОЗАКАДЕМИИ)
Научные руководители
доктор биологических наук, старший научный сотрудник кандидат ветеринарных наук, старший научный сотрудник
Селянинов Юрий Олегович Зубаиров Муртазали Мухтарович
Официальные оппоненты:
доктор ветёринарных наук, старший научный сотрудник доктор биологических наук, профессор
Кушнир Анатолий Тимофеевич Денисов Аркадий Алексеевич
Ведущая организация — ГНУ Всероссийский НИИ ветеринарной санитарии, гигиены и экологии (ГНУ ВНИИВСГЭ)
Защита диссертации состоится 11 июля 2008 г. в 12 часов на заседании диссертационного совета Д 006.003.01 при ГНУ Всероссийском научно-исследовательском институте ветеринарной вирусологии и микробиологии по адресу 601120, Владимирская обл, Покров, ГНУ ВНИИВВиМ Тел/ факс (49243) 62125
С диссертацией можно ознакомиться в библиотеке ГНУ ВНИИВВиМ Автореферат разослан 2 июня 2008 г
Ученый секретарь диссертационного совета,
кандидат биологических наук Савукова В Я
1. Общая характеристика работы 1.1. Актуальность темы. В последней трети XX века, несмотря на определенные успехи в борьбе с инфекционными болезнями, значение инфекционной патологии, как одного из основных критериев здоровья населения, признано всем мировым медицинским и ветеринарным сообществом
Сегодня можно констатировать, что суммарная распространенность инфекционных (и паразитарных) болезней, несмотря на предпринимаемые усилия, направленные на борьбу с ними, не только не сокращается, но даже возрастает Так, если в начале 90-х годов в России ежегодно регистрировалось в среднем 30 млн случаев инфекционных заболеваний, то в последние годы эта величина превышает 40 млн [М Г Шандала, 2005, Н А Семина и др , 2006]
Мировой опыт борьбы с болезнями животных показал, что в системе мероприятий ветеринарного обеспечения здоровья всех видов животных наряду со специфической профилактикой важное место занимают антимикробная терапия и дезинфекционные мероприятия, которые позволяют значительно снизить наносимый отрасли экономический ущерб Это связано с тем, что хотя активная иммунизация и является наиболее эффективным средством предотвращения многих болезней вирусной и бактериальной этиологии, в ряде случаев высокая изменчивость и антигенная вариабельность патогенов, особенности их репродукции или биологических свойств, недостаточная изученность некоторых инфекционных болезней, могут свести на нет эффективность любых совершенных вакцин (последний пример — грипп птиц) [Н А Семина с соавт, 2006, А М Смирнов, 2006, М Г Шандала, 2003, В В Шкарин, 2006, Е Б Иванова, Е Б Ежлова, 2006]
В ветеринарной практике при проведении общих противоэпизоотических мероприятий для снижения микробной обсемененности наиболее широкое применение нашли такие вещества как гашеная известь, горячие растворы кальцинированной соды, растворы формальдегида, едкого натра, хлорной извести, гипохлорита кальция, хлорамина и др [А В Каштанов, 2003, М Р Саврилов, 2004, Н И Попов с соавт, 2005, А Э Высоцкий, 2005] Вместе с тем, эффективность их применения невысока, в рекомендуемых концентрациях они оказывают коррозионное действие, после применения этих соединений необходима
нейтрализация воздуха, их нельзя применять в присутствии животных Кроме того, большинство из применяемых препаратов может длительно находиться во внешней среде без изменения или трансформироваться до канцерогенов и экотоксинов [А Э Высоцкий, 2005, 2006] Следует отметить, что, не смотря на то, что за последние годы в России расширился ассортимент разрешенных к применению дезсредств в период 2001—2005 гг в РФ зарегистрировано более 100 дезинфектантов [М Г Шандала, 2006, Т А Костюкова, М Н Ляпин, Т А Малюкова, 2005], арсенал экологически безопасных препаратов, разлагающихся в природных условиях до продуктов, не загрязняющих окружающую среду, ограничен [МРСаврилов, 2004, Т А Костюкова, М Н Ляпин, Т А Малюкова, 2005] Поэтому изучение антибактериальных и антивирусных свойств соединений различных классов, с целью разработки новых нетоксичных, высокоэффективных, экологически безопасных антимикробных препаратов представляет собой весьма актуальную задачу для ветеринарной науки и практики [А Э Высоцкий, 2005, В Н Аржаков, М М Ермакович, П В Аржаков, 2003, 2004]
1.2. Цель и задачи исследования. Целью работы являлось изучение антимикробных свойств химических соединений в ряду азаадамантанов и четвертичных аминов, оценка взаимосвязи их химической структуры и бактерицидных свойств, а также определение их пригодности для применения в комплексе общих противоэпизоотических мероприятий
Для достижения поставленной цели необходимо бьшо решить следующие задачи
1 Провести скрининг производных азаадамантанов по антимикробной активности
2 Изучить m vitro антибактериальную активность отобранных соединений класса азаадамантанов в отношении тест-микроорганизмов, возбудителей токсикоинфекций (сальмонеллез, листериоз) и сибирской язвы.
3 Изучить антивирусную активность отобранных соединений класса азаадамантанов на модели ДНК-содержащего вируса миксомы кроликов и РНК-содержащего вируса гриппа А птиц
4 Оценить дезинфицирующие свойства тетраазадигомоадамантана и его производных на различных тест-объектах
5 Изучить токсикологические показатели безопасности тетраазадигомоадамантана и его производных
6 Провести электронно-микроскопическое изучение изменений бактериальных клеток под воздействием тетраазадигомоадамантана
7 Изучить антимикробную активность и обеззараживающие свойства соединений класса четвертичных аминов
1J. Научная новизна исследований. Научная новизна данной работы состоит в следующем
— изучена антимикробная активность 250 вновь синтезированных веществ, относящихся к химическому классу каркасных гетероциклических соединений группы азаадамантанов, в результате чего впервые установлена взаимосвязь характера и положения заместителей в боковых цепях и количества атомов азота в узловых положениях структуры азаадамантанов с их бактерицидной активностью,
— изучены бактерицидные и вирулицидные свойства наиболее активного соединения класса азаадамантанов — тетраазадигомоадамантана (теотропин) и двух его Zn- и ЫН3-содержащих производных,
установлена высокая инактивирующая способность тетраазадигомоадамантана и его производных в отношении тест-микроорганизмов, возбудителей токсикоинфекций (листериоз, сальмонеллез), сибирской язвы, ДНК- и РНК-содержащих вирусов
— изучены токсикологические показатели безопасности отобранных соединений и установлена их низкая токсичность (III класс опасности) для теплокровных животных,
— изучено влияние тетраазадигомоадамантана на ультраструктуру St aureus и установлены основные механизмы его бактерицидного действия,
— изучен спектр антимикробной активности соединений класса четвертичных аминов и их дезинфицирующие свойства
1.4. Теоретическая и практическая значимость исследований
Сведения, полученные при экспериментальной оценке антимикробного действия соединений класса азаадамантанов с различными заместителями в боковых цепях и количеством атомов азота в узловых положениях, а также четвертичных аминов дополнили теорию взаимосвязи структуры и антибактериальной активности в ряду этих соединений новыми данными и могут быть использованы при разработке препаратов, пригодных для эффективного и безопасного применения в комплексе противоэпизоотических мероприятий
Результаты экспериментальной работы использованы при разработке следующих документов
— проекта нормативной документации на препарат «Теотропин» СТО 00495549-0008-2006, предназначенный для профилактической и вынужденной дезинфекции объектов ветеринарно-санитарного надзора
— «Методические рекомендации по подготовке проб почв к исследованию на контаминацию возбудителем сибирской язвы» (2008 г)
Вышеперечисленные документы одобрены ученым советом и утверждены директором ГНУ Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии
1.5. Основные положения диссертационной работы, выносимые на защиту:
1 Теоретические и экспериментальные аспекты антимикробной активности соединений класса азаадамантанов
2 Результаты комплексного изучения бактерицидной, спороцидной, вирулицидной, обеззараживающей активности и токсикологических показателей безопасности тетраазадигомоадамантана и его производных
3 Экспериментальная оценка антимикробных свойств соединений класса четвертичных аминов
1.6. Апробация работы
Результаты исследований, выполненных по теме диссертационной работы, доложены и обсуждены на заседаниях ученого совета ГНУ ВНИИВВиМ (2005-2007 г г), межгосударственной научно-практической конференции «Санитарная охрана территорий государств — участников СНГ проблемы биологической безопасности и противодействия биотерроризму в современных условиях» (Волгоград, 2005), международной научно-практической конференции «Актуальные проблемы инфекционной патологии и иммунологии животных» (Москва, 2005), международных научно-практических конференциях «Научные основы производства ветеринарных биологических препаратов» (Щелково, 2006, 2007), Международной научно-практической конференции «Профилактика, диагностика и лечение инфекционных болезней, общих для людей и животных» (Ульяновск, 2006)
1.7. Публикации
По теме диссертации опубликовано 6 научных работ, в том числе 1 статья в журнале «Ветеринария»
1.8. Личный вклад соискателя
Представленные в диссертационной работе экспериментальные исследования, теоретический и практический анализ полученных результатов проведены автором самостоятельно В выполнении работы по отдельным этапам работы оказывали практическую и консультативную помощь сотрудники ГНУ ВНИИВВиМ В Н Пономарев, Г Ф Архипова, И Ю Егорова
Соединения синтезировали сотрудники Московской государственной академии тонкой химической технологии им М В Ломоносова
1.9. Объем и структура диссертации
Диссертация изложена на 135 страницах и содержит следующие разделы введение, обзор литературы, материалы и методы, результаты исследований, обсуждение, выводы, дополнена приложениями Список литературы включает 197 источников Работа иллюстрирована 10 рисунками и 24 таблицами
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ 2.1. Материалы и методы
Микроорганизмы: культуры возбудителя сибирской язвы — В anthracis — вакцинный штамм 55-ВНИИВВиМ, инв№25 и М-71, инв.№6, кишечной палочки — Ecoh (штаммы К-12 (инв№17) и 195(3 (инв№21)), золотистого стафилококка — St aureus (штамм 209-Р), инв_№2, сальмонеллы -S enteritidis (инв №33), S tranoroa{инв№37), листерии — L monocytogenes (штамм 766 серогруппа I), В cereus штамм 96 (инв.№41), вирус гриппа А птиц подтип H5N), кат №2573, вирус миксомы кроликов штамм MP, кат №1827
Все перечисленные штаммы микроорганизмов получены из музея бактериальных культур и музея микроорганизмов ГНУ ВНИИВВиМ
Культуры клеток:
первично-трипсинизированная культура клеток куриных эмбриональных фибробластов (ФЭК),
— перевиваемая культура клеток тестикул поросенка (ПТП), кат №10.1,
— перевиваемая культура клеток почки сибирского горного козерога, линия ПСГК-60, монослойный трофовариант, кат.№25,
— перевиваемая культура клеток почки крольчонка (RK-13), кат №36 Все культуры клеток получены в лабораториях «Биология и культивирование вирусов» и «Культуры клеток с музеем клеточных штаммов» ГНУ ВНИИВВиМ
Животные- аутбредные белые мыши живой массой 18-20 г, развивающиеся эмбрионы кур 8-10-дневного возраста, свободные от специфических патогенных агентов
Содержание и кормление осуществляли согласно принятым нормам Питательные среды, растворы, реактивы: питательная среда для культивирования клеточных культур Игла (MEM) фирм Sigma, Ну Clon, сыворотка плода КРС (Sigma,США), питательный бульон (ПБ) и агар (ПА) для культивирования микроорганизмов, желточно-солевой агар, солевой бульон, среда Эндо, SS-arap, среда Кода, питательный агар и бульон с 1% глюкозы, агар Сабуро, питательная среда для выделения и идентификации энтеробактерий сухая (SDS-бульон), физиологический раствор, дистиллированная вода, стерильная водопроводная вода, Tween-80, фосфатно-буферный раствор (ФБР), 3%-ная фосфорно-вольфрамовая кислота
Изучение антимикробной активности. Антимикробную (бактерицидную, спороцидную, вирулицидную) активность определяли методом серийных разведений препаратов согласно «Методическим указаниям по отбору, испытаниям и оценке антивирусных и антибактериальных химиопрепаратов среди соединений различных химических классов», (Москва, 2004), а также «Методическим указаниям по определению чувствительности микроорганизмов к антибактериальным препаратам МУК 4 2 1890-04»
Изучение обеззараживающей активности. Обеззараживающую активность соединений определяли на тест-поверхностях из различных материалов согласно «Методам испытаний дезинфекционных средств для оценки их безопасности и эффективности» (Москва, 1998), а также как описано В И Вашковым, 1977
Определение показателей токсичности препаратов. Изучение токсических свойств препаратов проводили на культурах клеток, куриных эмбрионах и аутбредных белых мышах согласно методике, изложенной в «Методических указаниях по отбору, испытаниям и оценке антивирусных и
антибактериальных химиопрепаратов среди соединений различных химических классов», (Москва, 2004) и «Методах испытаний дезинфекционных средств для оценки их безопасности и эффективности» (Москва, 1998)
Электронная микроскопия. Для изучения изменений, происходящих в структуре бактериальных клеток под воздействием соединений проводили негативное контрастирование суспензий клеток, подвергшихся их воздействию с последующим микроскопированием при увеличении от 15 до 40 тыс раз
Статистическая обработка результатов. При анализе и обработке результатов исследований использовались статистические методы, описанные ИПАшмариным и А А Воробьевым (1962), а также пакет прикладных программ Statgraphics (Version 21) для персонального компьютера Достоверными считались данные, полученные после обобщения результатов не менее 3-х опытов
2.2. Результаты собственных исследований 2.2.1. Скрининг производных азаадамантанов по антимикробной активности
На данном этапе исследований нами были проведены эксперименты по первичной оценке антимикробной активности ряда синтезированных соединений химического класса каркасных гетероциклов групп аза- (моно-, ди-, три-, тетраазаадамантаны), азагомо- (ди-, три-, тетраазагомоадамантаны) и азадигомоадамантанов (тетраазадигомоадамантаны) с различными заместителями в боковой цепи (табл 1)
В общей сложности была оценена бактерицидная активность 250 веществ В качестве тест-микроорганизма использовали В anthracis штамм «55-ВНИИВВиМ» в вегетативной форме Вещества, не проявлявшие выраженной бактерицидной активности в концентрации 10,0 и более мг/см3, считались неактивными и дальнейшим испытаниям не подвергались
Как показали результаты исследований бактерицидная активность в концентрации 10 мг/см3 и менее выявлена приблизительно у 8 % исследованных соединений Характерно, что вещества с выраженной бактерицидной активностью в ходе скрининга обнаружены в основном в группе азагомо- и азадигомоадамантанов, тогда как среди представителей
группы азаадамантанов выявлено лишь 1 вещество со значимой бактерицидной активностью
Таблица 1
Тип химической структуры ряда соединений класса азаадамантанов, обладающих бактерицидной активностью
Структурный тип
Формула (шифр соединения, бактерицидная концентрация, _мг/см3)_
Моноазаадамантаны
АИ-1 (> 10 мг/см3) АИ-2 (> 10 мг/см3)
Ди-, три-,
тетраазаадамантаны
СООН
мн.
N к. /
АИ-3 (>10 мг/см3) АИ-4 (> 10 мг/см3) АИ-6 (1,25 мг/см3)
;=снс6н4ыо2
АИ-7 (> 10 мг/см3) АИ-8 (> 10 мг/см3)
\
Ди-, три-,
гетраазагомоадамантаны
ООН
АИ-1 В (1,25 мг/см3) АИ-19 (1,25 мг/см3) АИ-11 (>10 мг/см3)
N Н г
N02
\
¿¿Уч/
М е
АИ-12 (1,25 мг/см3) АИ-13 (0,3 мг/см3) АИ-9 (1,25 мг/см3)
Таким образом установлено, что соединения химического класса каркасных гетероциклов групп аза-, азагомо- и азадигомоадамантанов
обладают антимикробной активностью, которая в значительной степени варьирует и зависит от наличия, характера и положения заместителей Так, например, при введении у соединения 8-амино-1,3,6-триазагомоадамантан (АИ-11) в положение С(4) метальной группы (АИ-12) бактерицидная активность вещества возрастает в 8 раз, а при замене амино- на нитрогруппу в положении С(8) у этого же соединения (АИ-13) — более чем в 30 раз Синтез гомо- и дигомоадамантановых структур с атомами азота в узловых положениях ведет к повышению бактерицидной активности соединений в указанном классе химических веществ
Одним из наиболее перспективных для более углубленного изучения соединений явилось вещество — 1,3,6,8-тетраазатрицикло[4 4 1 I3,8] додекан (АИ-20, теотропин) Однако, теотропин — сильный комплексон, поэтому для улучшения проникающей способности было приготовлено два его комплексных производных — комплекс с ацетатом цинка (7п-тетраазадигомоадамантан — АИ-21) и с ЫН3 (ЫН3-тетраазадигомоадамантан -АИ-22), которые испытывались в сравнении с исходным соединением 2.2.2. Изучение спектра антимикробного действия тетраазадигомоадамантана и его производных 2.2.2.1. Бактерицидная активность тетраазадигомоадамантана и его
Ъп- и ]ЧН3-содержащих производных Бактерицидную активность соединений определяли методом серийных разведений, контроль полноты инактивации бактериальных суспензий — путем высева на твердые питательные среды В ходе опытов определяли минимальную бактерицидную концентрацию (МБК) изучаемых соединений в отношении тест-микроорганизмов, наиболее часто применяемых в качестве моделей для оценки эффективности дезинфектантов Результаты представлены в табл 2
Из данных таблицы 2 видно, что тетраазадигомоадамантан (АИ-20) в концентрациях 0,07-0,67мг/см3 полностью инактивирует все исследуемые микроорганизмы Бактерицидная активность его Ъл,- и ИНз-содержащих производных в отношении различных видов микроорганизмов несколько ниже и находится в пределах 0,13-0,78 мг/см3 и 0,07-0,67 мг/см3, соответственно Наиболее устойчивыми к действию испытуемых соединений являлись бактериальные клетки ВсегеиБ штамм 96, которые погибали при воздействии тетраазадигомоадамантана и его ЫН3-производного (АИ-21) в
концентрации 0,67±0,03 мг/см3, а Zn-содержащего производного (АИ-22) -0,78±0,00 мг/см3
Дополнительно была изучена динамика инактивации испытуемых тест-микроорганизмов тетраазадигомоадамантаном и его производными (рис 1-3) Установлено, что инактивация микроорганизмов тетраазадигомоадамантаном (АИ-20) проходит несколько быстрее, чем его производными При концентрации тетраазадигомоадамантана 0,313% рост тест-микроорганизмов на поверхности агара отсутствовал через 3 часа после внесения инактиванта, тогда как аналогичное количество Zn- (АИ-21) и Nh4-производных (АИ-22) инактивировало бактерии St aureus 209-Р и Е coll К-12 в более поздние сроки
Таблица 2
Бактерицидная активность тетраазадигомоадамантана и его производных
п=3
Микроорганизм Бактерицидная активность соединений, мг/см
АИ-20 АИ-21 АИ-22
В anthracis штамм «55-ВНИИВВиМ» 0,39±0,00 0,32±0,07 0,39±0,00
В cereus штамм 96 0,67±0,03 0,78±0,00 0,67±0,03
St aureus штамм 209-Р 0,32±0,07 0,32±0,07 0,39±0,00
L monocytogenes 766 0,20±0,00 0,20±0,00 0,20±0,00
Е coh штамм К-12 0,17±0,03 0,32±0,09 0,25±0,07
Е coll штамм 195 Р 0,12±0,03 0,25±0,07 0,12±0,03
S enteritidis 0,19±0,00 0,30±0,01 0,19±0,00
S tranoroa 0,07±0,02 0,13±0,03 0,07±0,02
Примечание АИ-20 — тетраазадигомоадамашан,
АИ-21 — Zn-содержащее производное тетраазадигомоадамантана, АИ-22 — Nh4 -содержащее производное тетраазадигомоадамантана
Через 24 часа экспозиции инактивацию культур St aureus 209-Р, Е coli К-12, Е coli 195ß и S enteritidis наблюдали при концентрации тетраазадигомоадамантана не ниже 0,032%, 0,017%, 0,012% и 0,019%, соответственно Кроме того, чем выше была концентрация внесенных в бактериальную суспензию инактивантов, тем быстрее снижалось количество живых микробов
Результаты экспериментов свидетельствуют о наличии у тетраазадигомоадамантана и его производных высокой бактерицидной активности в отношении как грамположительной, так и грамотрицательной микрофлоры Несмотря на незначительные различия, грамотрицательные микроорганизмы более чувствительны к инактивирующему воздействию соединений, чем грамположительные — инактивация клеток Е coli и S
enteritidis происходила при более низких концентрациях и за более короткое время, чем St. aureus.
3 6 9 18 24
Экспозиция в часах
Рис. 1. Бактерицидная активность тетраазадигомоадамантана в отношении различных видов бактерий.
3 6 9 18 24
Экспозиция в часах
Рис. 2. Бактерицидная активность ¿п-содержащего производного тетраазадигомоадамантана в отношении различных видов бактерий.
Экспозиция в часах
Рис. 3. Бактерицидная активность 14Нз-содержащего производного тетраазадигомоадамантана в отношении различных видов бактерий.
Показано, что белки питательной среды (белковая нагрузка) оказывают влияние на активность испытуемых соединений, снижая ее в 1,23-2,78 раза Наиболее выраженное снижение активности наблюдалось в отношении культур кишечной палочки Белковый индекс (отношение концентрации препарата, вызывающей гибель микроорганизмов в присутствии белковой нагрузки к концентрации препарата без добавления белков в те же сроки) тетраазадигомоадамантана для St aureus 209-Р равнялся 1,23, Е coli К-12 -1,89, £ coli 195ß- 1,00, S enteritidis — 1,33
2.2.2.2. Спороцидная активность тетраазадигомоадамантана и его Zn- и ТЧНз-содержащих производных Так как исследуемые соединения обладали выраженной бактерицидной активностью, нами была изучена их спороцидная активность, которую оценивали в отношении В anthracis (штаммы «55-ВНИИВВиМ» и М-71) и близкородственных спорообразующих сапрофитов (В cereus штамм 96) Результаты представлены в табл 3
Таблица 3
Спороцидная активность тетраазадигомоадамантана и его производных,
мг/см3
п=3
Шифр соединения В anthracis 55-ВНИИВВиМ В anthracis М-71 В cereus 96
Экспозиция, ч
24 48 24 48 24 48
АИ-20 12,5 0,78 25,0 12,5 50,0 6,25
АИ-21 12,5 3,13 25,0 6,25 50,0 6,25
АИ-22 25,0 6,25 25,0 12,5 50,0 25,0
Примечание АИ-20 — тетраазадигомоадаманган,
АИ-21 — Zn-содержащее производное тетраазадигомоадамантана, АИ-22 — ЫНз-содержащее производное тетраазадигомоадамантана
Из данных таблицы 3 видно, что наиболее устойчивыми к воздействию тетраазадигомоадамантана и его производных являлись споры В сегеия 96, которые гибли через 24 часа при содержании действующего вещества 50,0 мг/см3 Споры В агикгасю 55-ВНИИВВиМ и М-71 инактивировались тетраазадигомоадамантаном и гп-содержащим производным при 24-часовой экспозиции в концентрациях 12,5 мг/см3 и 25,0 мг/см3, соответственно При увеличении времени контакта до 48 часов эти показатели снижались в 2 — 16
раз Споры В cereus 96 инактивировались изучаемыми соединениями в концентрации 50,0 мг/см3
2.2.2.3. Вирулицидная активность тетраазадигомоадамантана и его
Zn- и 1ЧНз-содержащих производных Для оценки вирулицидной активности исследуемых соединений были использованы РНК-содержащий вирус гриппа А птиц (подтип H5N1) и ДНК-содержащий вирус миксомы кроликов (штамм MP)
В ходе проведенных опытов установлено, что тетраазадигомоадамантан и его производные в концентрации 0,1% (по действующему веществу) оказывают вирулицидное действие по отношению вируса гриппа А птиц при экспозиции 3 часа и по отношению вируса миксомы кроликов при экспозиции 10-12 часов и температуре 37°С
Таким образом, проведенные исследования указывают на широкий спектр антимикробного действия исследованных соединений, как в отношении вирусов различных таксономических групп (вирусы гриппа А птиц и миксомы кроликов), так и в отношении грамположительных и грамотрицательных бактерий (Staphylococcus aureus, Escherihia coli, Salmonella enteritidis, Salmonella tranoroa, Bacillus anthracis, Bacillus cereus, Listeria monocytogenes)
2.2.3 Изучение обеззараживающих свойств тетраазадигомоадамантана и его Zn- и РШ3-содержащих производных На первом этапе исследований нами были проведены опыты по изучению бактерицидного действия 5,0%-ных растворов соединений по отношению Е coli К-12, Е coli 195ß, St aureus 209-P, Sal enteritidis in vitro
Установлено, что в зависимости от вида тест-микроорганизма время, необходимое для его полной инактивации, находилось в пределах 2-3 часов для 5,0%-ных растворов всех испытуемых соединений Менее выраженной бактерицидной активностью обладало Zn-содержащее производное тетраазадигомоадамантана
Учитывая, что инактивирующее действие препаратов in vitro может не соответствовать их бактерицидной активности в отношении микроорганизмов, находящихся на объектах внешней среды, нами изучена активность их растворов при нанесении на тест-объекты из различных материалов
Обеззараживающую активность 5%-ных растворов
тетраазадигомоадамантана и его производных изучали на батистовых тест-объектах в отношении пяти тест-культур микроорганизмов Escherichia coli (штаммы К-12 и 195Р), Staphylococcus aureus (штамм 209-Р), Salmonella enteritidis и В anthracis в споровой форме Результаты исследований представлены в табл 4
Из представленных в табл 4 данных видно, что эффективность изучаемых соединений в отношении тест-микробов, находящихся на батистовых тест-объектах, характеризовалась следующими показателями 5%-ные растворы тетраазадигомоадамантана и его производных при температуре 37°С инактивировали не спорообразующие тест-микроорганизмы в течение не менее 1 часа При температуре 20-22°С 5%-ные растворы тетраазадигомоадамантана и его производных инактивировали культуры этих же микроорганизмов после 18-24 часовой экспозиции
Таблица 4
Динамика инактивации тест-микроорганизмов на батистовых тест-объектах при температурах инкубации 37°С и 20-22°С
п=3
Соединение Тест-микроорганизм Экспозиция, ч Контроль
t=37″C t=20-22″C
1 3 6 9 18 18 24 48 72
5%-ный раствор АИ-20 Ecoli К-12 + — — — — + — — — +
Е coli 195 ß + — — — — + — — — +
St aureus 209-Р + — — — — + — — — +
S enteritidis + — — — — + — — — +
Споры В anthracis 55-ВНИИВВиМ + + + + + + + + + +
5%-ный раствор АИ-21 Ecoli К-12 + — +
Ecoh 195 ß + — — — — + — — — +
St aureus 209-P + — +
S enteritidis + — — — — + — — — +
Споры В anthracis 55-ВНИИВВиМ + + + + + + + + + +
5%-ный раствор АИ-22 E coli К-12 + — — — — + — — — +
Ecoh 195 ß + — — — — + — — — +
St aureus 209-P + — — — — + — — — +
S enteritidis + — — — — + — — — +
Споры В anthracis 55-ВНИИВВиМ + + + + + + + + + +
Примечание «+/-»- наличие/отсутствие роста тест-микроорганизма,
АИ-20 — тетраазадигомоадамантан,
АИ-21 — Zn-содержащее производное тетраазадигомоадамантана, АИ-22 — ЫНз-содержащее производное тетраазадигомоадамантана
Полной инактивации спор В anthracis при испытанных условиях проведения эксперимента не наблюдалось
Изучение эффективности исследуемых соединений при обеззараживании поверхностей проводили по общепринятой методике В качестве тест-объектов использовали гладкие (стекло) и пористые (метлахская плитка) тест-поверхности Инактивирующую активность исследуемых соединений изучали в отношении тест-культур, обозначенных в «Инструкции по определению свойств новых дезинфицирующих средств» — St aureus, Е coli, В anthracis, дополнительно нами была изучена активность соединений по отношению к L monocytogenes Обработка проводилась методом полива из расчета 5 см3 рабочего раствора препарата (температурой 20-22°С и 40-80°С) на 100 см2 обрабатываемой поверхности Контрольные поверхности обрабатывались стерильной водопроводной водой При этом за 100% результат принималось отсутствие (в трех повторностях) роста возбудителей в смывах с поверхностей после проведенной дезобработки, при росте возбудителя в посевах с контрольных поверхностей Результаты представлены в табл 5
Таблица 5
Бактерицидная активность 5%-ных растворов азаадамантанов
п=3
Микро- Экспо- t Тест-объект Контроль
организм зиция, раствора,°С Стекло Метлахская
ч плитка
АИ- АИ- АИ- АИ- АИ- АИ-
20 21 22 20 21 22
1 40 + + + + + + +
60 — — — — — — +
St aureus 2 + + + + + + +
3 20-22 — — — + + + +
4 — — — — — — +
20 + + + + + + +
1 70 + + + + + + +
L monocytogenes 80 — — — — — — +
3 20-22 — — — — — — +
1 — — + — — + +
2 70 — — — — — — +
E coli + + + + + + +
3 20 — — — — — — +
Примечание «+/-»- наличие/отсутствие роста тест-микроорганизма
АИ-20 — тетраазадигомоадамантан,
АИ-21 — Zn-содержащее производное тетраазадигомоадамантана, АИ-22 — Nh4 -содержащее производное тетраазадигомоадамантана
Как видно из данных табл 5 при температуре раствора 20-22°С время контакта, необходимое для полного обеззараживания поверхности стекла и метлахской плитки колеблется от 3 до 4 часов в зависимости от типа тест-объекта и вида микроорганизма
При повышении температуры рабочего раствора до 60-80°С экспозиция, необходимая для полного обеззараживания стекла и метлахской плитки, обсемененных вегетативными формами микроорганизмов уменьшается до 1 часа
Испытуемые растворы при аналогичных условиях не вызывают полной инактивации ВаШгаав нанесенных на поверхность метлахской плитки и стекла, ни в споровой, ни в вегетативной формах
Другим не менее важным объектом для обеззараживания является почва, которая часто контаминирована патогенными микроорганизмами, в частности В ашИгаск, длительно сохраняющим в ней свою жизнеспособность [Е В Пименов и соавт, 2000, И А Бакулов и соавт, 2001, Б Л Черкасский, 2002, П И Маринин, 2006, Н П.Иванов, 2006], представляя постоянную угрозу возникновения заболевания В связи с этим разработка методов индикации и средств деконтаминации почвы являются одними из наиболее важных задач при проведении противоэпизоотических мероприятий при сибирской язве Известно, что существующие в настоящее время методы выделения возбудителя сибирской язвы из проб почв не обладают достаточно высокой эффективностью — процент выделения патогена из почвы колеблется от 0,6 до 9,7 [П Н Бургасов и сотр, 1970, А Г Абгарян и сотр, 2003] Для получения более объективных данных о количественном содержании сибиреязвенных спор в пробах почвы нами была проведена работа по усовершенствованию способа пробоподготовки почв для исследования на контаминацию возбудителем сибирской язвы В результате работ по оптимизации состава элюирующей жидкости и непосредственно методики пробоподготовки почвы, включающей двукратную элюцию, отмывку спор от остатков элюирующей жидкости центрифугированием и концентрирование, эффективность выделения спор ВамИгаск из почвы была повышена в 7,6-12 раз. Разработаны «Методические рекомендации по подготовке проб почв для исследования на контаминацию возбудителем сибирской язвы», которые рассмотрены на ученом совете и утверждены директором ГНУ ВНИИВВиМ (27 03 2008 г)
В ходе экспериментов по обеззараживанию почвы установлено, что в песчаной почве 5%-ный раствор тетраазадигомоадамантана инактивирует споры при 2-х суточной экспозиции В черноземной и глинистой почвах единичные жизнеспособные споры выявлялись и после 4 суток экспозиции Вероятно, это связано с наличием органических веществ, которые взаимодействуют с активными группами дезинфектантов и блокируют их действие Дополнительно нами были проведены исследования, в ходе которых установлено, что только при сочетанном применении химического и физического методов (использование тетраазадигомоадамантана и прогревания при температуре 80°С) обработки зараженной почвы независимо от ее типа в течение 1 часа происходит полная инактивация спор штамма 55-ВНИИВВиМ возбудителя сибирской язвы
2.2.4. Изучение токсикологических показателей тетраазадигомоадамантана и его Ъа- и 1ЧН3-содержащнх производных
Препараты, используемые в качестве обеззараживающих веществ при проведении общих противоэпизоотических мероприятий в присутствии животных в соответствии с требованиями, предъявляемыми к ним, наряду с высокими бактерицидными и дезинфицирующими свойствами, не должны оказывать вредного воздействия на организм животного, птиц и человека Учитывая это, нами были проведены исследования по изучению ряда токсикологических показателей отобранных соединений, характеризующих степень воздействия химических средств на биологические системы организма
Объем токсикологических исследований включал изучение цитотоксического действия соединений на культуру клеток (определение максимально переносимой дозы — МПД), определение МПД соединений на развивающихся куриных эмбрионах, а также при пероральном введении белым мышам
В ходе экспериментов установлено, что токсическое действие соединений на культуры клеток проявляется на 4-6-сутки инкубирования в зависимости от испытуемой культуры и дозы вносимого вещества, характеризуется образованием конгломератов клеток и в дальнейшем полным отслоением монослоя
Анализ полученных результатов показал, что МПД тетраазадигомоадамантана и его 7п-содержащего производного для культуры
клеток ФЭК составляет 3125 мкг/см3 (спустя 6 суток инкубирования), для культуры клеток ПТП — 1562,5 мкг/см3 (спустя 4 суток инкубирования), для культуры клеток ПСГК-60 МПД тетрааздигомоадамантана составляет — 250 мкг/см3, Nh4- и Zn-содержащих производных — 97,65 мкг/см3 и 195,3 мкг/см3 (спустя 2 суток инкубирования), соответственно
МПД тетраазадигомоадамантана для РЭК составляет 729,0 мкг/КЭ, а его Zn- и ЫНз-содержащих производных — 1938,0 мкг/КЭ и 400,0 мкг/КЭ, соответственно (табл 6) Существенных отклонений в развитии РЭК опытных групп, которым вводили соединения, по сравнению с контрольными группами не отмечено
Таким образом, исследованные соединения обладают низкой токсичностью для РЭК и культур клеток, а в указанных дозах не обладают терратогенным действием
МПД для белых мышей при введении тетраазадигомоадамантана per os составляет 3500,0 мг/кг (70,0 мг/гол), Zn-содержащего производного — более 750,0мг/кг (15,0 мг/гол), а ЫН3-содержащего производного — более 500,0 мг/кг (10,0 мг/гол) (табл 6)
Таблица 6
Характеристика токсических свойств тетраазадигомоадамантана и его
производных
п=3
Шифр соединения Характеристика
МПД для РЭК мг/КЭ МПД для культур клеток, мкг/см3 Острая токсичность на белых мышах (МПД), мг/кг
ФЭК ПТП ПСГК
АИ-20 729,0 3125,0 1562,5 250,0 3500,0
АИ-21 1938,0 3125,0 1562,5 195,3 >750,0
АИ-22 400,0 Ни Ни 97,65 >500,0
Примечание ФЭК — первично трипсинизированная культура куриных эмбриональных фибробластов, ПТП — перевиваемая культура тестикул поросенка, ПСГК — перевиваемая культура почки сибирского горного козерога, Н и — не исследовалась АИ-20 — тетраазадигомоадаманган, АИ-21 — 2п-содержащее производное тетраазадигомоадамантана, АИ-22 — N11 (-содержащее производное тетраазадигомоадамантана
Клиническая симптоматика острого отравления
тетраазадигомоадамантаном для белых мышей носила дозозависимый характер Признаки интоксикации при этом проявлялись через 3-5 минут и характеризовались сильным беспокойством, одышкой, дрожью, ослаблением сердечно-сосудистой деятельности, параличами. Смерть наступала через 0,5 -1 час после введения препарата Картина патолого-анатомических изменений характеризовалась общим венозным застоем, отеком легких, асфиксией
Полученные данные свидетельствуют о том, что тетрааздигомоадамантан и его производные согласно ГОСТ 12 1 007-76 относятся к классу умеренно опасных веществ
2.2.5. Определение срока годности рабочих растворов тетраазадигомоадамантана и его производных Определение срока годности рабочих растворов проводили на основе метода «ускоренного старения» при повышенной температуре (37°С) и при температуре 20-22°С Для определения срока годности образцы 5%-ных растворов тетраазадигомоадамантана и ЫН3-производного, а также 2,5%-ный раствор Zn-содержащего производного помещали во флаконы, которые хранили при указанных температурах
Основным показателем, по которому определялась стабильность растворов в процессе хранения, служила их бактерицидная активность по отношению к вегетативной форме штамма «55-ВНИИВВиМ» В anthracis
Установлено, что бактерицидная активность рабочих водных растворов тетраазадигомоадамантана и его производных сохраняется не менее 3 месяцев при температуре хранения 20-22°С и не менее 1 месяца при температуре хранения 37°С
2.2.6. Электронно-микроскопическое изучение изменений бактериальных клеток под воздействием тетраазадигомоадамантана В данных экспериментах мы применяли методику, позволяющую изучать динамику инактивации бактерий на популяционном уровне [Е А Голов, 2005, И Б Павлова и соавт, 2007], которая основана на определении числа колониеобразующих единиц (КОЕ) микроорганизмов до и после воздействия антимикробных соединений с последующим исследованием электронной микроскопией специально подготовленных образцов
Электронно-микроскопические исследования изменений структуры клеток St aureus под воздействием тетраазадигомоадамантана, позволили выявить определенные закономерности процесса инактивации Так, исходные микробные клетки в основном представлены в виде микроколоний, заключенных в оболочки В течение 30 мин тетраазадигомоадамантан вызывает разрыхление покровов микроколоний и нарушение их структуры в виде снижения плотности упаковки за счет расхождения отдельных клеток После 60 минутной экспозиции в поле зрения микроскопа наблюдаются
разъединенные клетки с разрыхленной клеточной стенкой, а при более продолжительном воздействии (120 и 180 мин) — не имеющие четко очерченных границ округлые образования с темным центром и светлой периферией
Полученные данные, а также данные литературы о биологических свойствах азаадамантанов, позволяют сделать предположение о том, что основным механизмом действия соединения АИ-20 является его воздействие на внутриклеточные структуры и, в частности, блокировка матрично-генетической функции нуклеиновых кислот Дезинтегрирующее действие соединения на покровы микроколоний стафилококков с последующим разрушением их клеточной стенки и внутриклеточных компонентов позволяет инактивировать оставшуюся, наиболее устойчивую к воздействию химических веществ часть популяции St aureus
Представленные результаты экспериментов позволяют сделать следующее заключение растворы тетраазадигомоадамантана и его Zn- и ЫНз-содержащих производных обеззараживают тест-объекты из различных материалов, контаминированных микроорганизмами и могут применяться в качестве дезинфектантов среднего уровня при проведении общих противоэпизоотических мероприятий, направленных на уменьшение микробной обсемененности и улучшение ветеринарно-санитарной обстановки в животноводческих помещениях
Для подтверждения эффективности применения
тетраазадигомоадамантана нами были проведены его испытания в производственных условиях в свиноводческих хозяйствах, на мясоперерабатывающих предприятиях Московской и Смоленской областей, Госкомплексе «Завидово» Тверской области Установлена высокая эффективность дезинфекции помещений с применением 2 — 5%-ных водных растворов препарата, в том числе использованных и в присутствии животных
2.2.7. Изучение спектра антимикробной активности некоторых четвертично-аммониевых соединений
Нами было проведено изучение антимикробной активности следующих соединений, относящихся к этому классу — клатрат додецилдиметилдиаммоний бромида, бензилтриэтиламмоний бромида и 1,2 -этилен-бис-(Ы,К-диметил-карбдецил-оксиметил)-аммония дихлорида
(этоний) Поскольку только первое из них обладало выраженной активностью в отношении возбудителя сибирской язвы, более глубокие исследования антимикробной активности были проведены именно с этим соединением
Установлено, что клатрат додецилдиметилдиаммоний бромида обладает выраженной вирулицидной, бактерицидной, спороцидной активностью по отношению к St aureus штамм 209-Р, В anthracis штамм 55-ВНИИВВиМ, В cereus штамм 96, а также к вирусам гриппа А птиц и миксомы кроликов
В ходе проведенных экспериментов установлено, что это соединение в концентрации 0,039-0,078 мг/см3 оказывает бактерицидное действие на В anthracis, В cereus и St aureus, а в концентрации 0,15-0,31 мг/см3 оказывает спороцидное действие на В anthracis и В cereus Раствор клатрата додецидиметиламмоний бромида в 1%-ной концентрации обладает вирулицидной активностью, инактивируя вирусы гриппа А птиц и миксомы кроликов при экспозиции 15 мин, при экспозиции 1 час обладает обеззараживающей активностью, полностью инактивируя St aureus, а также вегетативные формы Bacillus anthracis и В cereus, нанесенные на метлахскую плитку и окрашенные металлические поверхности При оценке инактивирующей активности испытуемого четвертично-аммониевого соединения в отношении споровых форм микроорганизмов установлено, что при 2 часовой экспозиции происходит обеззараживание контаминированных окрашенных металлических поверхностей, а при 3 часовой экспозиции -метлахской плитки, контаминированной спорами Bacillus anthracis
Таким образом, среди соединений класса четвертичных аминов имеются вещества как не обладающие антимикробной активностью, так и обладающие различным уровнем противомикробного действия, вплоть до высокоактивных Из трех испытанных ЧАС клатрат додецилдиметилдиаммоний бромид обладает наиболее выраженным бактерицидным, спороцидным и вирулицидным действием, которое в испытаниях in vitro проявляется при экспозиции 15 минут В то же время бактерицидность данного соединения в экспериментах с использованием однократной обработки тест-объектов методом орошения 1 %-ным раствором проявляется после 1 часовой экспозиции, а спороцидность после 2-3 часов воздействия Это указывает на то, что его, в отличие от тетраазадигомоадамантана и его производных, можно использовать лишь в
качестве потенцирующей добавки в составе композиционных антимикробных средств
Выводы
1 При изучении бактерицидной активности химических соединений класса азаадамантанов, синтезированных в Московской государственной академии тонкой химической технологии им М В Ломоносова, установлено, что из 250 производных лишь 20 (8 %) обладают выраженным антимикробным действием
2 Тетраазадигомоадамантан и его Zn- и Nh4-содержащие производные обладают широким спектром антимикробной, в том числе спороцидной активности в отношении грамотрицательной и грамположительной микрофлоры (Staphylococcus aureus, Escherihia colt, Salmonella enteritidis, Salmonella tranoroa, Bacillus anthracis, Bacillus cereus, Listeria monocytogenes), имеющей этиологическое значение в инфекционной патологии Бактерицидная концентрация колеблется от 0,07 до 0,78 мг/см3, а спороцидная — от 12,5 до 50,0 мг/см3 в зависимости от вида микроорганизма
3 Исследуемые химические соединения в концентрации 0,1% оказывают вирулицидное действие по отношению к вирусам различных таксономических групп (вирус гриппа А птиц (РНК-содержащий), вирус миксомы кроликов (ДНК-содержащий))
4 Установлено, что 5%-ные растворы изучаемых веществ обеззараживают тест-поверхности, контаминированные штаммами кишечной палочки, золотистого стафилококка и листерий в течение 3-4 часов
5 Тетраазадигомоадамантан и его Zn- и ИНз-содержащие производные по токсикологическим показателям безопасности являются малотоксичными препаратами и согласно ГОСТ 12 1 007-76 относятся к классу умеренно опасных веществ
6 При определении срока годности рабочих растворов тетраазадигомоадамантана и его производных показано, что они не снижают антимикробной активности в течение не менее 3 мес при температуре 20°С
7 При электронно-микроскопическом исследовании культур стафилококка, подвергнутых воздействию тетраазадигомоадамантана, установлены морфологические изменения, характеризующиеся разрыхлением микроколоний, разъединением клеток и разрыхлением клеточной стенки бактерий
8 Из трех испытанных четвертично-аммониевых соединений — клатрат додецилдиметилдиаммоний бромида, бензилтриэтиламмоний бромида и 1,2-Этилен-бис-(Ы,Н-диметил-карбдецил-оксиметил)-аммония дихлорида
(этоний), только первое обладает наиболее выраженным бактерицидным, спороцидным и вирулицидным действием
Практические предложения
В комплексе мероприятий по борьбе, профилактике и ликвидации инфекционных болезней животных применять безопасный препарат «Теотропин», предназначенный для профилактической и вынужденной дезинфекции объектов ветеринарно-санитарного надзора (СТО 004955490008-2006) Эффективность применения теотропина подтверждена положительными результатами испытаний, проведенных в свиноводческих хозяйствах, на мясоперерабатывающих предприятиях Московской и Смоленской областей, Госкомплексе «Завидово», Тверской области
На основании проведенных исследований разработаны, утверждены директором ГНУ ВНИИВВиМ и рекомендуются для практического применения «Методические рекомендации по подготовке проб почв к исследованию на контаминацию возбудителем сибирской язвы» (протокол №3 от 26 03 2008г)
Список работ, опубликованных по материалам диссертации
1 Вологина, И В Антимикробное действие производных азаадамантанов / ИВ Вологина, И Ю Егорова // Санитарная охрана территорий государств — участников СНГ проблемы биологической безопасности и противодействия биотерроризму в современных условиях материалы VI Межгосударст науч -практ конф государств — участиников СНГ, Волгоград — 2005 — С 215-217
2 Вологина, И В Дезинфицирующие средства в ветеринарии / И В Вологина / Актуальные проблемы инфекционной патологии и иммунологии животных материалы Междунар науч -практ конф / ВИЭВ -Москва -2005 -С 601-603
3 Егорова, И Ю Сравнительная эффективность методов индикации Bacillus anthracis в почве / И Ю Егорова, Ю О Селянинов, И В Вологина // Ветеринария -2006 -№6 — С 26-30
4 Вологина, И В Сравнительное изучение антимикробной активности теотропина и его производных /ИВ Вологина, Ю О Селянинов,
М М Зубаиров // Профилактика, диагностика и лечение инфекционных болезней, общих для людей и животных материалы Междунар науч конф -Ульяновск — ГСХА -2006 -С 396-400
5 Вологина, И В Изучение дезинфицирующих свойств азаадамантана и его производных / ИВ Вологина, Ю О Селянинов // Научные основы производства ветеринарных биологических препаратов материалы Междунар науч -прак конф — Щелково — 2006 — С 220-224
6 Вологина, И В Антимикробная активность и характеристики токсических свойств теотропина и его производных /ИВ Вологина // Научные основы производства ветеринарных биологических препаратов материалы Междунар науч -практ конф — Щелково — 2007 — С 345-349
Отпечатано в типографии ГНУ ВНИИВВиМ РОССЕЛЬХОЗАКАДЕМИИ, г Покров Владимирской области Тираж 75 экз
СРАВНИТЕЛЬНЫЙ АНАЛИЗ АКТОПРОТЕКТОРНЫХ СВОЙСТВ НОВЫХ ХИМИЧЕСКИХ СОЕДИНЕНИЙ | Стратиенко
1. Даренская Н. Г., Ушаков И. Б., Иванов И. В., Иванченко А. В., Насонова Т. А. От эксперимента на животных — к человеку: поиски и решения. Воронеж: Научная книга; 2010: 237.
2. Яременко К. В. Оптимальное состояние организма и адаптогены. СПб.: ЭЛБИ-СПб; 2008: 130.
3. Стратиенко Е. Н., Катунина Н. П., Цеева Ф. Н. и соавт. Фармакологическая коррекция физической работоспособности при экстремальных состояниях. Материалы международной научно-практической конференции «Актуальные вопросы коррекции экстремальных состояний», Брянск, 26 ноября 2013. Брянск; 2013: 30–32.
4. Катунина Н. П., Гнеушев И. М. Экспериментальное изучение антигипоксической активности новых производных физиологически совместимых антиоксидантов на модели острой гемической гипоксии. Ежегодник НИИ экспериментальных и прикладных исследований. 2013; 1(4): 47–51.
5. Солодков А. С. Физическая работоспособность спортсменов и общие принципы ее коррекции. Ученые записки. 2014; 3(109): 148–157.
6. Бакулин В. С., Макаров В. И., Федорова И. В. Использование микроклиматических режимов у спортсменов высоких квалификационных разрядов при физической нагрузке возрастающей мощности. Лечебная физкультура и спортивная медицина. 2016; 6(138): 14–19.
7. Моррисон В. В., Берсудский С. О. Общая патология. Типовые нарушения обмена веществ. Саратов: СМУ; 2003: 43.
8. Панченкова Л. А., Юркова Т. Е., Шелковникова М. О., Мартынов А. И. Физическая работоспособность больных ишемической болезнью сердца с субклинической дисфункцией щитовидной железы. Российский кардиологический журнал. 2003; 8(2): 17–22.
9. Бобринская И. Г., Васильев В. Ю., Гордова А. М. и соавт. Улучшение периферического кровообращения как профилактики гипоксии. Материалы IV Российской конференции «Гипоксия: механизмы, адаптация, коррекция», Москва, 12– 14 октября 2005. М.; 2005: 14.
10. Гилев Г. А., Кулиненков О. С., Савостьянов М. В. Фармакологическая поддержка тренировочного процесса спортсменов. М.: Московский государственный индустриальный университет; 2007: 224.
11. Пыжикова Ж. В. Профессиональная работоспособность: средства и методы сохранения. Самара: Универс-групп; 2007: 176.
12. Халимов Ю. Ш., Загородников Г. Г., Боченков А. А., Лось С. П., Ветошкин С. Л., Комнатный С. Б., Филь С. Н. Адаптация военнослужащих к воздействию экстремальных факторов. MEDLINE.RU. Российский биомедицинский журнал. 2011; 12(3): 724–732.
13. Лукянчук В. Д., Сімонова І. В. Актопротектори: фармакологія та фармакотерапія. Фармакологія та лікарська токсикологія. 2015; 2(43): 14–26.
14. Гридин Л. А., Ихалайнен А. А., Богомолов А. В., Ковтун А. Л., Кукушкин Ю. А. Методы исследования и фармакологической коррекции физической работоспособности человека. Ушаков И. Б., редактор. М.: Медицина; Шико; 2007: 104.
15. Стратиенко Е. Н., Цеева Ф. Н., Кухарева О. В. Фармакологическая коррекция физической работоспособности в обычных и осложненных условиях. Материалы VI международной конференции «Достижения фундаментальных наук в решении актуальных проблем медицины». Астрахань, 9–11 сентября 2008. Астрахань; 2008: 270–271.
Влияние химических элементов на свойства стали.
Условные обозначения химических элементов:
| хром ( Cr ) — Х никель ( Ni ) — Н молибден ( Mo ) — М титан ( Ti ) — Т медь ( Cu ) — Д ванадий ( V ) — Ф вольфрам ( W ) — В | азот ( N ) — А алюминий ( Аl ) — Ю бериллий ( Be ) — Л бор ( B ) — Р висмут ( Вi ) — Ви галлий ( Ga ) — Гл | иридий ( Ir ) — И кадмий ( Cd ) — Кд кобальт ( Co ) — К кремний ( Si ) — C магний ( Mg ) — Ш марганец ( Mn ) — Г | свинец ( Pb ) — АС ниобий ( Nb) — Б селен ( Se ) — Е углерод ( C ) — У фосфор ( P ) — П цирконий ( Zr ) — Ц |
ВЛИЯНИЕ ПРИМЕСЕЙ НА СТАЛЬ И ЕЕ СВОЙСТВА
Углерод — находится в стали обычно в виде химического соединения Fe3C, называемого цементитом. С увеличением содержания углерода до 1,2% твердость, прочность и упругость стали увеличиваются, но пластичность и сопротивление удару понижаются, а обрабатываемость ухудшается, ухудшается и свариваемость.
Кремний — если он содержится в стали в небольшом количестве, особого влияния на ее свойства не оказывает.(Полезная примесь; вводят в качестве активного раскислителя и остается в стали в кол-ве 0,4%)
Марганец — как и кремний, содержится в обыкновенной углеродистой стали в небольшом количестве и особого влияния на ее свойства также не оказывает. (Полезная примесь; вводят в сталь для раскисления и остается в ней в кол-ве 0,3-0,8%. Марганец уменьшает вредное влияние кислорода и серы.
Сера — является вредной примесью. Она находится в стали главным образом в виде FeS. Это соединение сообщает стали хрупкость при высоких температурах, например при ковке, — свойство, которое называется красноломкостью. Сера увеличивает истираемость стали, понижает сопротивление усталости и уменьшает коррозионную стойкость. В углеродистой стали допускается серы не более 0,06-0,07%. ( От красноломкости сталь предохраняет марганец, который связывает серу в сульфиды MnS).
Фосфор — также является вредной примесью. Снижает вязкость при пониженных температурах, то есть вызывает хладноломкость. Обрабатываемость стали фосфор несколько улучшает, так как способствует отделению стружки.
ЛЕГИРУЮЩИЕ ЭЛЕМЕНТЫ И ИХ ВЛИЯНИЕ НА СВОЙСТВА СТАЛИ
Хром (Х) — наиболее дешевый и распространенный элемент. Он повышает твердость и прочность, незначительно уменьшая пластичность, увеличивает коррозионную стойкость; содержание больших количеств хрома делает сталь нержавеющей и обеспечивает устойчивость магнитных сил.
Никель (Н) — сообщает стали коррозионную стойкость, высокую прочность и пластичность, увеличивает прокаливаемость, оказывает влияние на изменение коэффициента теплового расширения. Никель – дорогой металл, его стараются заменить более дешевым.
Вольфрам (В) — образует в стали очень твердые химические соединения – карбиды, резко увеличивающие твердость и красностойкость. Вольфрам препятствует росту зерен при нагреве, способствует устранению хрупкости при отпуске. Это дорогой и дефицитный металл.
Ванадий (Ф) — повышает твердость и прочность, измельчает зерно. Увеличивает плотность стали, так как является хорошим раскислителем, он дорог и дефицитен.
Кремний (С)- в количестве свыше 1% оказывает особое влияние на свойства стали: содержание 1-1,5% Si увеличивает прочность, при этом вязкость сохраняется. При большем содержании кремния увеличивается электросопротивление и магнитопроницаемость. Кремний увеличивает также упругость, кислостойкость, окалиностойкость.
Марганец (Г) — при содержании свыше 1% увеличивает твердость, износоустойчивость, стойкость против ударных нагрузок, не уменьшая пластичности.
Кобальт (К) — повышает жаропрочность, магнитные свойства, увеличивает сопротивление удару.
Молибден (М) — увеличивает красностойкость, упругость, предел прочности на растяжение, антикоррозионные свойства и сопротивление окислению при высоких температурах.
Титан (Т) — повышает прочность и плотность стали, способствует измельчению зерна, является хорошим раскислителем, улучшает обрабатываемость и сопротивление коррозии.
Ниобий (Б) — улучшает кислостойкость и способствует уменьшению коррозии в сварных конструкциях.
Алюминий (Ю) — повышает жаростойкость и окалиностойкость.
Медь (Д) — увеличивает антикоррозионные свойства, она вводится главным образом в строительную сталь.
Церий — повышает прочность и особенно пластичность.
Цирконий (Ц) — оказывает особое влияние на величину и рост зерна в стали, измельчает зерно и позволяет получать сталь с заранее заданной зернистостью.
Лантан, цезий, неодим — уменьшают пористость, способствуют уменьшению содержания серы в стали, улучшают качество поверхности, измельчают зерно.
Химические свойства элементов и соединений
Атомный номер
Атомный номер указывает количество протонов в ядре атома. Атомный номер — важное понятие химии и квантовой механики. Элемент и его место в периодической таблице выводятся из этой концепции.
Когда атом обычно электрически нейтрален, атомный номер будет равен количеству электронов в атоме, которые можно найти вокруг ядра.Эти электроны в основном определяют химическое поведение атома. Атомы, несущие электрические заряды, называются ионами. Ионы имеют либо количество электронов, большее (отрицательно заряженное), либо меньшее (положительно заряженное), чем атомный номер.
Атомная масса
Название указывает на массу атома, выраженную в атомных единицах массы (а.е.м.). Большая часть массы атома сосредоточена в протонах и нейтронах, содержащихся в ядре. Каждый протон или нейтрон весит около 1 а.е.м., и, таким образом, атомная масса всегда очень близка к массовому (или нуклонному) числу , которое указывает количество частиц в ядре атома; это означает протоны и нейтроны.Каждый изотоп химического элемента может различаться по массе. Атомная масса изотопа указывает количество нейтронов, которые присутствуют в ядре атомов. Полная атомная масса элемента эквивалентна единицам массы его изотопов. Относительное присутствие изотопов в природе является важным фактором при определении общей атомной массы элемента. Что касается определенного химического элемента, то атомная масса, указанная в периодической таблице, представляет собой среднюю атомную массу всех стабильных изотопов химического элемента.Среднее значение взвешено по относительному естественному содержанию изотопов элемента.
Электроотрицательность согласно Полингу
Электроотрицательность измеряет склонность атома притягивать электронное облако в своем направлении во время химической связи с другим атомом.
Шкала Полинга — широко используемый метод для упорядочения химических элементов по их электроотрицательности. Лауреат Нобелевской премии Линус Полинг разработал эту шкалу в 1932 году.
Значения электроотрицательности не рассчитываются на основе математических формул или измерений.Это больше похоже на прагматический диапазон.
Полинг дал элементу с максимально возможной электроотрицательностью фтор значение 4,0. Францию, элементу с наименьшей возможной электроотрицательностью, было присвоено значение 0,7. Всем остальным элементам дается значение где-то между этими двумя крайностями.
Плотность
Плотность элемента указывает количество единиц массы элемента, которые присутствуют в определенном объеме среды. Традиционно плотность выражается греческой буквой ро (пишется как r).В системе единиц СИ плотность выражается в килограммах на кубический метр (кг / м 3 ). Плотность элемента обычно выражается графически с помощью температуры и давления воздуха, поскольку эти два свойства влияют на плотность.
Точка плавления
Точка плавления элемента или соединения означает температуры, при которых твердая форма элемента или соединения находится в равновесии с жидкой формой. Обычно мы предполагаем, что давление воздуха составляет 1 атмосферу.
Например: температура плавления воды 0 o C или 273 K.
Точка кипения
Точка кипения элемента или соединения означает температуру, при которой жидкая форма элемента или соединения в равновесии с газообразной формой. Обычно мы предполагаем, что давление воздуха составляет 1 атмосферу.
Например: температура кипения воды составляет 100 o C или 373 K.
При температуре кипения давление пара элемента или соединения составляет 1 атмосферу.
Радиус Вандервальса
Даже когда два атома, которые находятся рядом друг с другом, не связываются, они все равно будут притягиваться друг к другу. Это явление известно как взаимодействие Вандервальса.
Силы Вандервальса вызывают силу между двумя атомами. Эта сила становится сильнее по мере сближения атомов. Однако, когда два атома приближаются слишком близко друг к другу, срабатывает отталкивающая сила, как следствие чрезмерного отторжения между отрицательно заряженными электронами обоих атомов.В результате между двумя атомами образуется определенное расстояние, известное как радиус Вандервальса.
Путем сравнения радиусов Вандервальса нескольких различных пар атомов мы разработали систему радиусов Вандервальса, с помощью которой мы можем предсказать радиус Вандервальса между двумя атомами путем сложения.
Ионный радиус
Ионный радиус — это радиус, который имеет ион в ионном кристалле, где ионы упакованы вместе до точки, в которой их внешние электронные орбитали контактируют друг с другом.Орбиталь — это область вокруг атома, где, согласно теории орбиталей, вероятность нахождения электрона наибольшая.
Изотопы
Атомный номер не определяет количество нейтронов в ядре атома. В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, различающиеся атомной массой, называются изотопами.
В основном с более тяжелыми атомами, которые имеют более высокий атомный номер, количество нейтронов в ядре может превышать количество протонов.
Изотопы одного и того же элемента часто встречаются в природе попеременно или в смесях.
Пример: хлор имеет атомный номер 17, что в основном означает, что все атомы хлора содержат 17 протонов в своем ядре. Есть два изотопа. Три четверти атомов хлора, встречающихся в природе, содержат 18 нейтронов, а одна четверть — 20 нейтронов. Массовые числа этих изотопов 17 + 18 = 35 и 17 + 20 = 37. Изотопы записываются следующим образом: 35Cl и 37Cl.
Когда изотопы указаны таким образом, количество протонов и нейтронов не должно упоминаться отдельно, потому что символ хлора в периодической таблице (Cl) расположен на семнадцатом месте.Это уже указывает количество протонов, так что всегда можно легко вычислить количество нейтронов с помощью массового числа.
Большое количество изотопов нестабильно. Они развалятся в процессе радиоактивного распада. Радиоактивные изотопы называются радиоизотопами.
Электронная оболочка
Электронная конфигурация атома — это описание расположения электронов по кругу вокруг ядра. Эти круги не совсем круглые; они содержат волнообразный узор.Для каждого круга вероятность присутствия электрона в определенном месте описывается математической формулой. Каждый из кругов имеет определенный уровень энергии по сравнению с ядром. Обычно уровни энергии электронов выше, когда они находятся дальше от ядра, но из-за своих зарядов электроны также могут влиять на уровни энергии друг друга. Обычно сначала заполняются средние кружки, но могут быть исключения из-за отказов.
Круги разделены на оболочки и подоболочки, которые можно пронумеровать с помощью количества.
Энергия первой ионизации
Энергия ионизации означает энергию, которая требуется, чтобы свободный атом или молекула потеряли электрон в вакууме. Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов внешнего круга.
Энергия второй ионизации
Помимо энергии первой ионизации, которая показывает, насколько сложно удалить первый электрон из атома, существует также мера энергии для второй ионизации.Эта энергия второй ионизации указывает на степень сложности удаления второго атома.
Таким образом, существует также энергия третьей ионизации, а иногда даже энергия четвертой или пятой ионизации.
Стандартный потенциал
Стандартный потенциал означает потенциал окислительно-восстановительной реакции, когда он находится в равновесии, по отношению к нулю. Когда стандартный потенциал превышает ноль, мы имеем дело с реакцией окисления. Когда стандартный потенциал ниже нуля, мы имеем дело с реакцией восстановления.Стандартный потенциал электронов выражается в вольтах (В) символом V 0 .
Вернуться к периодической таблице или к предметам химии
Физические и химические свойства соединений: типы и примеры — видео и стенограмма урока
Физические свойства
Физическое свойство — это характеристика, которую можно наблюдать или измерять. Есть много типов физических свойств, которые можно использовать для различения соединений.Давайте посмотрим на некоторые из наиболее общих физических свойств соединений. Цвет и запах — это физические свойства. И то и другое очень легко наблюдать, используя зрение и обоняние. Например, соль, о которой мы узнали, которая на самом деле представляет собой соединение хлорида натрия, имеет белый цвет и не имеет запаха, тогда как химическое соединение сероводорода, имеющее формулу h3S, бесцветно и пахнет тухлыми яйцами.
Точка плавления и точка кипения — это другие общие физические свойства. Когда вещества плавятся, они превращаются из твердого в жидкое.Точка плавления — это температура, при которой плавится твердое вещество. Например, замороженный куб h3O, который вы называете кубиком льда, имеет температуру плавления 0 градусов Цельсия. При достижении этой температуры кубик льда начинает таять в жидкую воду. Если вы продолжите увеличивать нагрев, эта жидкая вода достигнет точки кипения , то есть температуры, при которой жидкость превращается в газ.
В случае воды точка кипения достигается при 100 градусах Цельсия.При такой температуре вода превращается в водяной пар или пар, как если бы вы видели парящую над кастрюлей с водой на плите. Конечно, не все вещества плавятся или закипают одновременно. Это помогает нам идентифицировать загадочные вещества. Например, если у вас есть жидкость, которую вы не знаете, вы можете вскипятить ее и определить температуру кипения. Вы также можете отметить другие физические свойства, такие как цвет и запах. Эта информация дает вам подсказки, которые помогут идентифицировать загадочную сущность.
Химические свойства
Химическое свойство также можно использовать для отличия одного соединения от другого.Однако это свойство не так просто наблюдать, как физическое свойство. Химическое свойство — это характеристика вещества, которую можно наблюдать только во время некоторого типа химической реакции. Например, некоторые соединения реагируют на кислоту. Когда вы напишете свое имя на доске с помощью мелка, на руке может остаться немного меловой пыли, но не более того. Однако, если вы уроните тот же кусок мела, который на самом деле представляет собой химическое соединение карбоната кальция или CaCO3, в стакан с соляной кислотой, он отреагирует, выпуская наблюдаемые пузырьки углекислого газа.
Другие соединения реагируют на свет. Одно из химических соединений, с которым вы, возможно, знакомы, — это перекись водорода или h3O2. На самом деле, у вас дома может быть коричневая бутылка перекиси водорода, которую вы используете в качестве антисептика, когда получаете порезы или царапины. Вы когда-нибудь задумывались, почему бутылка с этим составом всегда коричневая? Темная бутылка защищает перекись водорода внутри от света. Если бы это было в прозрачной бутылке, соединение разложилось бы на воду и кислород. Перекись водорода и другие соединения также могут изменяться под действием тепла, поэтому мы видим, что реакция на тепло является еще одним химическим свойством соединений.
Еще одно важное химическое свойство — горючесть. Вы помните, как ранее в этом уроке я сказал, что соединение состоит из элементов и что свойства вновь образованного соединения отличаются от свойств его элементов? Что ж, старый добрый h3O настолько негорюч, насколько вы можете найти. Итак, мы можем сказать, что химическое свойство воды состоит в том, что она негорючая. Однако этого нельзя сказать о водороде, составляющем воду. Водород легко воспламеняется и легко горит.
Резюме урока
Давайте рассмотрим:
- Соединения определяются как вещества, состоящие из двух или более различных элементов, которые химически соединены. Соединения обладают физическими и химическими свойствами, которые помогают нам их идентифицировать.
- Физическое свойство — это характеристика, которую можно наблюдать или измерять. В этом уроке мы рассмотрели некоторые из наиболее распространенных физических свойств соединений, включая цвет, запах, точку плавления и точку кипения .
- A химическое свойство — это характеристика вещества, которая может наблюдаться только во время некоторого типа химической реакции. Например, соединения могут иметь реакцию на кислоту, реакцию на свет или реакцию на нагревание. То, насколько хорошо вещество горит, иными словами его воспламеняемость, также является химическим свойством.
Ключевые термины
соединения: вещества, состоящие из двух или более различных элементов, которые химически объединены
физическое свойство: характеристика, которую можно наблюдать или измерять
точка плавления: температура плавления твердого вещества
точка кипения: температура, при которой жидкость превращается в газ
химическое свойство: характеристика вещества, которая может наблюдаться только во время некоторого типа химической реакции
Результат обучения
После просмотра этого урока, вы должны быть в состоянии объяснить различные свойства, по которым можно идентифицировать различные соединения.
1.3 Физические и химические свойства — химия
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения вещества как физические или химические
- Определять свойства материи как экстенсивные или интенсивные
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами. Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава.Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными противоугонными бирками) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Рисунок 1. (a) Воск претерпевает физические изменения при нагревании твердого воска и образует жидкий воск. (б) Конденсация пара внутри кастрюли — это физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит а: модификация работы «95jb14» / Wikimedia Commons; кредит б: модификация работы «mjneuby» / Flickr)
Изменение одного типа вещества в другой тип (или невозможность изменения) — это химическое вещество . недвижимость . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания.Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Рис. 2. (a) Одно из химических свойств железа — то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что это не так. (кредит а: модификация работы Тони Хисгетта; кредит б: модификация работы «Атома» / Wikimedia Commons)
Чтобы определить химическое свойство, мы ищем химическое изменение.Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Рис. 3. (a) Медь и азотная кислота претерпевают химические изменения с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ.(Фото b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи можно разделить на две категории. Если свойство зависит от количества присутствующего вещества, это обширная собственность . Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества.Если свойство образца вещества не зависит от количества присутствующего вещества, это интенсивное свойство . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, тогда как горшок с горячим маслом вызывает серьезные ожоги.И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Опасный алмаз
Вы могли видеть символ, показанный на Рисунке 4, на контейнерах с химикатами в лаборатории или на рабочем месте. Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», дает ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рисунок 4. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ. Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки).Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д. Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 4). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 4. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным.
Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории.Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Упражнения по химии в конце главы
- Классифицируйте шесть подчеркнутых свойств в следующем абзаце как химические или физические:
Фтор — это бледно-желтый газ , который вступает в реакцию с большинством веществ .Свободный элемент плавится при −220 ° C и кипит при −188 ° C . Мелкодисперсные металлы горят во фторе ярким пламенем. Девятнадцать граммов фтора вступят в реакцию с 1,0 граммами водорода .
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) конденсация пара
(б) сжигание бензина
(в) сквашивание молока
(г) растворение сахара в воде
(д) плавка золота
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) сжигание угля
б) таяние льда
(c) смешивание шоколадного сиропа с молоком
(г) взрыв петарды
(д) намагничивание отвертки
- Объем пробы газообразного кислорода изменился с 10 мл до 11 мл при изменении температуры.Это химическое или физическое изменение?
- 2,0-литровый объем газообразного водорода в сочетании с 1,0 литром газообразного кислорода для получения 2,0 литров водяного пара. Кислород претерпевает химические или физические изменения?
- Объясните разницу между экстенсивными и интенсивными свойствами.
- Укажите следующие свойства: экстенсивные или интенсивные.
(а) том
(б) температура
(в) влажность
(г) тепло
(е) точка кипения
- Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).
[латекс] \ text {density} = \ frac {\ text {mass}} {\ text {volume}} [/ latex] [latex] \ text {d} = \ frac {\ text {m}} {\ текст {V}} [/ latex]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Физические и химические свойства материи
Мы все ежедневно окружены материей. Все, что мы используем, прикасаемся, едим и т. Д., Является примером материи. Материю можно определить или описать как все, что занимает пространство, и состоит из крошечных частиц, называемых атомами.Он должен отображать два свойства: массу и объем.
Введение
Различные типы материи можно различить по двум компонентам: состав и свойства. Состав вещества относится к различным компонентам вещества вместе с их относительными пропорциями. Свойства материи относятся к качествам / атрибутам, которые отличают один образец материи от другого. Эти свойства обычно делятся на две категории: физические и химические.
Рисунок \ (\ PageIndex {1} \): Организационная структура химических и физических свойств материи.
Физические свойства и изменения
Физические свойства можно наблюдать или измерять без изменения состава вещества. Физические свойства используются для наблюдения и описания материи. Физические свойства материалов и систем часто описываются как интенсивные и экстенсивные свойства. Эта классификация относится к зависимости свойств от размера или степени рассматриваемой системы или объекта.
Интенсивное свойство — это объемное свойство, означающее, что это физическое свойство системы, которое не зависит от размера системы или количества материала в системе. Примеры интенсивных свойств включают температуру, показатель преломления, плотность и твердость объекта. При огранке алмазы части сохраняют свою внутреннюю твердость (до тех пор, пока их размер не достигнет толщины в несколько атомов). Напротив, обширное свойство является аддитивным для независимых, невзаимодействующих подсистем.Свойство пропорционально количеству материала в системе.
Интенсивные свойства : Физическое свойство, которое будет одинаковым независимо от количества вещества.
- плотность: \ (\ rho = \ frac {m} {v} \)
- цвет: пигмент или оттенок
- проводимость: электричество, протекающее через вещество
- пластичность: если вещество можно сплющить
- lustre: как блестит субстанция
Расширенные свойства : физическое свойство, которое изменится при изменении количества вещества.
- Масса
- : сколько вещества в образце
- volume: сколько места занимает сэмпл
- : длина образца
Длина
Физическое изменение
Изменение, при котором внешний вид материи изменяется, но состав остается неизменным.
Физическое изменение происходит без каких-либо изменений молекулярного состава. Один и тот же элемент или соединение присутствует до и после изменения. Та же самая молекула присутствует во всех изменениях.Физические изменения связаны с физическими свойствами, поскольку некоторые измерения требуют внесения изменений. Три основных состояния материи: твердое, жидкое, газообразное
.
- Solid отличается фиксированной структурой. Его форма и объем не меняются. В твердом теле атомы плотно упакованы вместе в фиксированном порядке.
- Жидкость отличается своей податливой формой (может принимать форму емкости), но постоянным объемом. В жидкости атомы расположены близко друг к другу, но не в фиксированном порядке.
- Газ состоит из отдельных атомов. Однако, в отличие от твердого тела и жидкости, газ не имеет фиксированной формы и объема.
Пример \ (\ PageIndex {1} \): физическое изменение
Когда жидкая вода (\ (H_2O \)) превращается в твердое состояние (лед), она кажется измененной; Однако это изменение носит только физический характер, поскольку состав составляющих молекул тот же: 11,19% водорода и 88,81% кислорода по массе.
Рисунок \ (\ PageIndex {2} \) : Физическое изменение: таяние льда — это физическое изменение.из Википедии.
Химические свойства и изменения
Химические свойства вещества описывают его «способность» претерпевать некоторые химические изменения или реакции в силу своего состава. Какие элементы, электроны и связи присутствуют, чтобы создать потенциал для химических изменений. Довольно сложно определить химическое свойство без слова «изменение». В конце концов, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень сложно сделать, и от вас не ожидается, что вы сможете это сделать.Например, водород может воспламениться и взорваться при правильных условиях. Это химическое свойство. Металлы в целом обладают химическим свойством реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода. Это химическое свойство.
Химическое изменение приводит к образованию одного или нескольких веществ, состав которых полностью отличается от состава исходных веществ. Элементы и / или соединения в начале реакции перегруппировываются в новые производные соединения или элементы. ХИМИЧЕСКОЕ ИЗМЕНЕНИЕ изменяет состав исходного вещества. В конце химического изменения присутствуют различные элементы или соединения. Атомы в соединениях перегруппировываются, чтобы образовать новые и разные соединения.
Пример \ (\ PageIndex {1} \): Коррозия металлов
Коррозия — это нежелательное окисление металлов, приводящее к образованию оксидов металлов.
\ [2 Mg + O_2 \ стрелка вправо 2 MgO \]
Рисунок \ (\ PageIndex {3} \): Химическое изменение: горящая лента из магния с очень коротким воздействием для получения подробных сведений об окислении.от капитана Джона Йоссариана (Википедия)
Проблемы
Следующие вопросы являются множественным выбором.
1. Молоко скисает. Это ________________
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
2. HCl, будучи сильной кислотой, является __________, Древесина, распиленная пополам, составляет ___________
- Химические изменения, Физические изменения
- Физическое изменение, Химическое изменение
- Химические свойства, физические изменения
- Физические свойства, химические изменения
- Ничего из вышеперечисленного
3.CuSO 4 растворяется в воде
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
4. Фосфат алюминия имеет плотность 2,566 г / см3
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
5. Что из следующего является примерами материи?
- Собака
- Двуокись углерода
- Кубики льда
- нитрат меди (II)
- Движущийся автомобиль
6.Признаком какого типа изменения является образование пузырьков газа?
7. Верно ли, что выпечка хлеба — это физическое свойство. 8. Верно ли, что картофель — это физическое изменение. 9. Имеет ли значение солнечный свет? 10. Свинцовая масса является _____________ свойством.
Решения
- химическое изменение
- химическое свойство, физическое изменение
- физическое изменение
- физическая собственность
- Все вышеперечисленное
- химический
- Ложь
- Истинно
- №
- физическая собственность
Список литературы
- Петруччи, Биссоннетт, Селедка, Мадура.Общая химия: принципы и современные приложения. Десятое изд. Река Аппер Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011.
- Cracolice, Peters. Основы вводной химии Активный подход к обучению. Второе изд. Бельмонт, Калифорния 94001: Брукс / Коул, 2007.
Авторы и авторство
Физические и химические свойства вещества
1.5: Физические и химические свойства вещества
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами.
Физические свойства вещества
Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.
Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи). Мы наблюдаем физические изменения, когда, например, воск плавится, сахар растворяется в кофе, а пар конденсируется в жидкую воду. Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых тел в порошки. В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Химические свойства вещества
Превращение одного типа материи в другой (или невозможность изменения) является химическим свойством. Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется. Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Чтобы определить химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения), созревание фруктов и приготовление, переваривание или гниение пищи.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 1.3: Физические и химические свойства.
Элементы, соединения и смеси
Элементы, соединения и смеси
Элементы,
Соединения и смеси
Элементы
Известно любое вещество, содержащее только один вид атома.
как элемент . Потому что атомы не могут быть созданы или
разрушаются в химической реакции, такие элементы, как фосфор (P 4 )
или сера (S 8 ) не может быть разбита на более простые
веществами этими реакциями.
Пример: вода разлагается на смесь водорода и
кислород, когда через жидкость пропускают электрический ток.
С другой стороны, водород и кислород не могут быть разложены на
более простые вещества. Следовательно, они являются элементарными, или
простейшие, химические вещества — элементы.
Каждый элемент представлен уникальным символом. Обозначение
для каждого элемента можно найти в периодической таблице элементов.
Элементы можно разделить на три категории, которые имеют
характерные свойства: металлы, неметаллы и полуметаллы.Большинство элементов — это металлы, которые находятся слева и ближе к
нижняя часть таблицы Менделеева. Горстка неметаллов
сгруппированы в правом верхнем углу периодической таблицы. В
полуметаллы можно найти по разделительной линии между
металлы и неметаллы.
Атомы
Элементы состоят из атомов, самые маленькие
частица, обладающая любым из свойств элемента.Джон
Дальтон в 1803 г. предложил современную теорию атома, основанную на
следующие предположения.
1. Дело составлено |
2. Все атомы элемента |
3. Атомы различных элементов имеют |
4. Атомы различных элементов. |
5. Атомы не могут быть созданы или |
Соединения
Элементы объединяются в химические соединения, которые часто
разделены на две категории.
Металлы часто реагируют с неметаллами с образованием ионных соединений .
Эти соединения состоят из положительных и отрицательных ионов, образованных
путем добавления или вычитания электронов из нейтральных атомов и
молекулы.
Неметаллы соединяются друг с другом, образуя ковалентную форму .
соединения , которые существуют в виде нейтральных молекул.
Сокращенное обозначение соединения описывает количество
атомов каждого элемента, который обозначен нижним индексом, написанным
после символа элемента.По соглашению, нижний индекс не используется.
записывается, когда молекула содержит только один атом элемента.
Таким образом, вода — это H 2 O, а диоксид углерода — это CO 2 .
Характеристики
Ионные и ковалентные соединения
Ионный | Ковалентные соединения | |
Содержит | Существуют как нейтральные | |
Твердые вещества | Твердые, жидкие или | |
Высокая | Нижняя плавка и | |
Сильный | Относительно слабое усилие | |
Отдельно | Остаться той же самой молекулы | |
Определение наличия
Соединение ионное или ковалентное
Рассчитайте разницу между электроотрицательностями
два элемента в соединении и среднее их
электроотрицательности, и найти пересечение этих значений на
рисунок, показанный ниже, чтобы помочь определить, является ли соединение ионным
или ковалентный, или металлический.
| Практическая задача 1: Для (а) оксид хрома (III), Cr 2 O 3 (б) четыреххлористый углерод, CCl 4 (в) метанол, CH 3 OH (г) фторид стронция, SrF 2 Нажмите здесь |
| Практическая задача 2: Использование
Нажмите |
Формулы
Молекула — самая маленькая частица, имеющая любой из
свойства соединения.Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться количеству отрицательных зарядов.
Примеры:
| CaCl 2 | Сбалансированная формула имеет 2 положительных заряда (1 кальций ион с +2 зарядом) и 2 отрицательных заряда (2 хлорида ионы с зарядом -1) |
| Al 2 (SO 4 ) 3 | Сбалансированная формула имеет 6 положительных зарядов (2 алюминиевых ионы с зарядом +3) и 6 отрицательных зарядов (3 сульфатных ионов с зарядом -2) |
Смеси Vs.Соединения
Закон постоянного состава гласит, что
соотношение по массе элементов в химическом соединении равно
всегда одинаково, независимо от источника соединения. В
закон постоянного состава может использоваться, чтобы различать
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу независимо от его источника.Латунь — это
пример смеси двух элементов: меди и цинка. Может
содержат всего от 10% до 45% цинка.
Еще одно различие между соединениями и смесями элементов
это легкость, с которой можно разделить элементы. Смеси,
такие как атмосфера, содержат два или более веществ, которые
относительно легко отделить. Отдельные компоненты
смеси могут быть физически отделены друг от друга.
Химические соединения сильно отличаются от смесей:
элементы в химическом соединении могут быть разделены только
уничтожение соединения.Некоторые различия между химическими
соединения и смеси элементов иллюстрируются
следующий пример с использованием изюмных отрубей и «Crispix.».
Изюмовые отруби обладают следующими характеристиками смеси .
- Крупа не имеет постоянного состава; то
соотношение изюма и отрубей меняется от образца к
образец. - Легко физически разделить два
«элементы», чтобы выбрать изюм, для
пример, и есть их отдельно.
Crispix имеет некоторые характерные свойства соединения .
- Соотношение рисовых хлопьев и кукурузных хлопьев постоянно; Это
составляет 1: 1 в каждой выборке. - Нет возможности разделить «элементы»
не разрывая узы, скрепляющие их вместе.
.
