Содержание
Разнообразие веществ. Свойства соли и сахара. Крахмал. Кислоты
Проверь себя
С.45.
1.Вопрос: каковы главные свойства поваренной соли и сахара?
Ответ: поваренная соль и сахар — кристаллические твердые вещества белого цвета, без запаха, растворимые в воде, обладающие вкусом: сахар – сладкий, соль — соленая; поваренная соль и сахар отличные консерванты, для того чтобы заготовить впрок овощи и плоды и предотвратить их порчу, мы их либо солим, либо варим из них варенье. Соль и сахар сложные по своему составу вещества. Составные части соли и сахара входят в состав крови. И недостаток и переизбыток составных частей соли и сахара в крови человека приводят к заболеваниям. (повышенный уровень сахара в крови приведет к сахарному диабету, а его недостаток к плохой умственной деятельности, недостаток натрия, составной части соли, приводит к гипотонии – пониженному артериальному давлению, а переизбыток к гипертонии, заболеваниям почек. ) Для того чтобы человек постоянно восполнял необходимое количество сахара и соли в организме, мы пищу солим, и подслащиваем, делаем мы это еще и для улучшения вкуса употребляемой пищи.
) Для того чтобы человек постоянно восполнял необходимое количество сахара и соли в организме, мы пищу солим, и подслащиваем, делаем мы это еще и для улучшения вкуса употребляемой пищи.
2. Вопрос: как обнаружить крахмал в продуктах питания?
Ответ: для того чтобы обнаружить крахмал в продуктах питания, нужно ножом надрезать испытуемый продукт и на срез капнуть каплю йода, если через некоторое время на срезе проявится сине-фиолетовое пятно, значит в продукте содержится крахмал.
3. Вопрос: какие кислоты встречаются в природе?
Ответ: лимонная, яблочная, щавелевая, молочная кислота имеют природное происхождение.
4. Вопрос: чем опасны кислотные дожди?
Ответ: любые осадки, которые содержат загрязняющие вещества – оксиды азота, серы и другие кислотные оксиды – называют кислотными дождями. Последствия такого метеорологического явления для окружающей среды плачевны: они губят растения, лишают животных пищи, загрязняют водоемы. Человек тоже страдает от кислотных дождей, организм реагирует на загрязнения появлением ряда заболеваний.
Человек тоже страдает от кислотных дождей, организм реагирует на загрязнения появлением ряда заболеваний.
Задания для домашней работы:
Задание 2.
Дома возьми три блюдца, и насыпь в одно из них сахар, в другое поваренную соль, а в третье крахмал. Как различить эти вещества?
Ответ: для того чтобы различить сахар, крахмал и поваренную соль, необходимо каждое вещество разделить на две части, к одной части всех веществ прилить каплю йода, то вещество, в котором образуется сине-фиолетовое пятно, есть крахмал. Остальные вещества можно попробовать на вкус, какое сладкое – сахар, а какое соленое — соль. Вообще нельзя пробовать на вкус неизвестные вещества, но в данном опыте точно известно, что вещества безвредные и на вкус их можно различить. Но это исключение из общего правила!
На следующем уроке
С. 45.
Вопрос: вспомни, как можно доказать, что вокруг нас есть воздух. Какое значение имеет воздух для растений, животных, человека?
Какое значение имеет воздух для растений, животных, человека?
Ответ: ветер, особенно сильный, — это наглядное доказательство наличия вокруг нас воздуха. Ветер срывает легкие листья с деревьев и тяжелые крыши с домов. Ветер — это движение воздушных масс.
Наше дыхание — также способ обнаружить воздух. Набирая в легкие воздух мы можем задержать дыхание и потом с шумом выпустить воздух. Особенно хорошо это видно зимой на улице когда мороз.
Накачать велосипедные шины также можно воздухом, с помощью простого насоса.
И надуть воздушный шарик. А стенки воздушного шарика ведь казалось бы ничего не сдерживает, однако он упругий и сохраняет форму.
Воздух имеет для всего живого на Земле первостепенное значение – мы им дышим, поэтому и можем жить. Строго говоря, мы дышим не воздухом, а кислородом, который входит в состав воздуха.
Наука о веществах. Вещества на кухне — урок. Окружающий мир, 3 класс.

Веществ известно очень много. Никто точно не может их сосчитать. Учёные утверждают, что существует более \(10\) миллионов разных веществ. Их изучает химия.
Химия — наука, которая занимается изучением веществ.
Химик — это учёный, который изучает вещества.
Многие вещества существуют в природе (вода, крахмал, соль, сахар). Из них состоят все природные тела. Других веществ в природе нет, они созданы человеком (пластмассы, железо, алюминий, сода).
У каждого вещества свои признаки — цвет, вкус, запах, растворимость в воде и др.
Самое известное вещество — это вода. Она образует океаны, моря, реки. Воду мы пьём, используем для приготовления пищи. Водой мы умываемся.
Вода — прозрачная жидкость без вкуса и запаха.
Вспомним вещества, с которыми мы постоянно встречаемся дома. Заглянем сначала на кухню. Там мы найдём много веществ: соль, сахар, соду, крахмал, уксус.
Заглянем сначала на кухню. Там мы найдём много веществ: соль, сахар, соду, крахмал, уксус.
Поваренная соль
Поваренная соль — твёрдое белое солёное вещество.
Соль есть в каждом доме. Её используют, чтобы придать солёный вкус пище.
Обнаружены и разрабатываются подземные залежи поваренной соли. Имеется она также в воде солёных озёр и в морской воде.
Сахар — твёрдое белое сладкое вещество.
По внешнему виду сахар похож на соль, но отличается по вкусу. Сахар сладкий, поэтому его добавляют во многие продукты. Получают сахар из растений — сахарной свёклы и сахарного тростника.
Ещё одно сладкое вещество — глюкоза. В аптеках она продаётся в виде больших сладких таблеток с витамином C.
В природе глюкоза содержится в различных частях растений и придаёт им сладкий вкус. Особенно много её в винограде. Поэтому глюкозу называют также виноградным сахаром.
Глюкоза — твёрдое белое вещество, сладкое на вкус.
Крахмал — твёрдое белое безвкусное вещество.
Крахмал — это вещество, которое мы употребляем с разными продуктами питания. Много крахмала в картофеле, хлебе, макаронах, крупах.
Определить, содержится ли крахмал в каком-нибудь продукте можно с помощью настойки йода. Нужно эту настойку разбавить водой и капнуть на продукт. Если настойка станет сине-фиолетовой, значит, в продукте есть крахмал. Таким способом можно определить крахмал в булке и макаронах.
Сода — твёрдое белое вещество (не сладкое и не солёное). Сода используется для приготовления теста. Она помогает почистить посуду. Раствор соды применяют для полоскания горла при простуде.
Разнообразие веществ стр. 41 — 45. Окружающий мир 3 класс 1 часть
Практическая работа
1. С помощью разбавленной настойки йода определи, есть ли крахмал в продуктах, выданных тебе учителем.

Учитель выдал для проведения опыта кусочек хлеба, картофель, яблоко и сосиску. Чтобы определить наличие крахмала в этих продуктах учитель выдал разбавленный раствор йода.
Пипеткой следует капнуть на исследуемые образцы продуктов раствор йода. При наличии в продуктах крахмала, поверхность образца потемнеет. Если крахмала нет, поверхность образца не изменит свой цвет.
2. Результаты исследования запиши и зарисуй в рабочей тетради.
В результате опыта установлено, что крахмал присутствует в хлебе и картофеле. После попадания на них йода, их поверхность потемнела.
Крахмала не оказалось в яблоке и сосиске. Их поверхность не поменяла цвет после контакта с йодом.
Работаем со взрослыми:
1. Пользуясь текстом учебника, устно опишите 1—2 вещества по плану: название вещества, внешние признаки, главные свойства, где встречается в природе (содержится), как используется человеком.
Описание вещества “Соль”по плану для 3 класса:
Название вещества: соль
Внешние признаки: белая однородная масса в виде мелких крупинок.
Главные свойства: солёная на вкус, растворяется в воде.
Где встречается в природе: под землёй в виде каменной соли, в растворенном виде в воде океанов.
Как используется человеком: используется в кулинарии для придания пищи солёного вкуса.
Описания вещества “Сахар” по плану для 3 класса:
Название вещества: сахар
Внешние признаки: белая однородная масса в виде мелких кристаллов.
Главные свойства: сладкий на вкус, растворяется водой.
Где встречается в природе: содержится в тростнике и сахарной свёкле, в растениях.
Как используется человеком: используется в кулинарии для придания пищи сладкого вкуса.
2. Прочитайте текст. Используя полученную информацию, объясните, что изображено на рисунках.
На рисунках мы видим, как животные и растения используют кислоты для собственной защиты.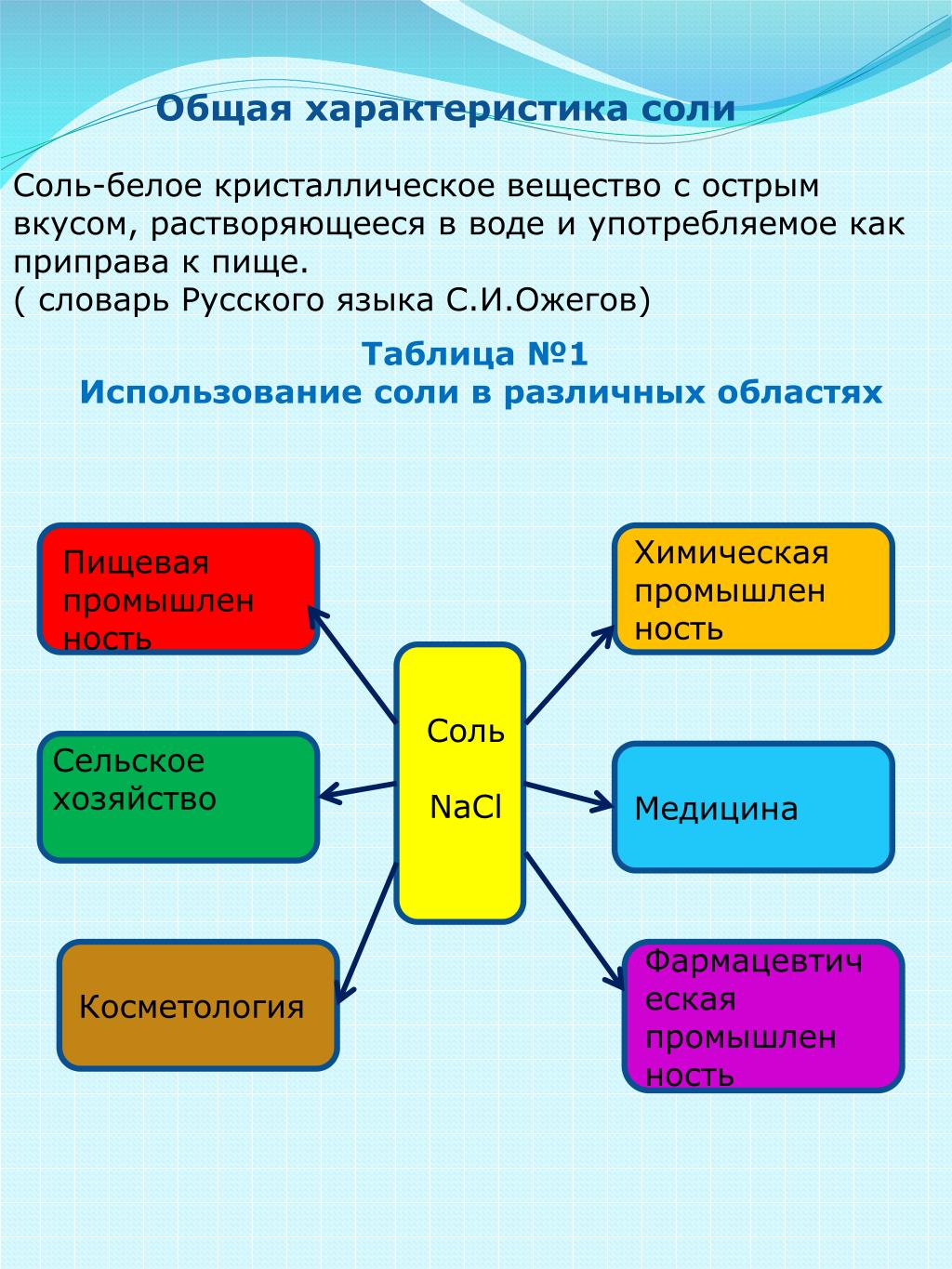 Муравей может выбрызгивать муравьиную кислоту и отпугивать врагов. Пчела может ввести кислоту с помощью жала обороняясь. А крапива защищает себя жгучими волосками на листьях, в которых тоже содержится кислота.
Муравей может выбрызгивать муравьиную кислоту и отпугивать врагов. Пчела может ввести кислоту с помощью жала обороняясь. А крапива защищает себя жгучими волосками на листьях, в которых тоже содержится кислота.
Проверь себя
1. Каковы главные свойства поваренной соли и сахара?
Главные свойства поваренной соли и сахара одинаковы. Они белого цвета, хорошо растворяются в воде. Но соль на вкус солёная, а сахар — сладкий.
2. Как обнаружить крахмал в продуктах питания?
Обнаружить крахмал можно с помощью раствора йода. Достаточно капнуть немного йода на поверхность продукта, и если продукт питания потемнеет, в нём содержится крахмал.
3. Какие кислоты встречаются в природе?
В природе встречаются щавелевая, молочная, лимонная, яблочная кислоты, и многие другие.
4. Чем опасны кислотные дожди?
От кислотных дождей страдают растения и животные, от них портятся постройки и в том числе старинные памятники.
Задания для домашней работы
1.
 Запиши в словарик: химия, поваренная соль, крахмал, кислота.
Запиши в словарик: химия, поваренная соль, крахмал, кислота.
Химия — наука о веществах
Поваренная соль — простое вещество, на вкус солёное
Крахмал — белый порошок, содержится в растениях
Кислота — вещество, обладающее кислым вкусом
2. Дома возьми три блюдца и насыпь в одно из них сахар, в другое — поваренную соль, в третье — крахмал. Как различить эти вещества?
Проще всего отличить эти вещества по вкусу. Соль будет солёной, сахар сладким, а крахмал безвкусным. Крахмал не растворяется в воде.
На следующем уроке
Вспомни, как можно доказать, что вокруг нас есть воздух. Какое значение имеет воздух для растений, животных, человека?
Доказать наличие воздуха можно надув воздушный шарик. Он пустой на вид, но заполнен воздухом.
Воздух содержит кислород, который нужен для дыхания человеку, животным и растениям. А также в воздухе содержится углекислый газ, который нужен растениям для питания.
Без воздуха невозможно существование жизни.
Урок 5. тела, вещества, частицы. разнообразие веществ — Окружающий мир — 3 класс
Окружающий мир 3 класс
Урок 5. Тела, вещества, частицы. Разнообразие веществ
Перечень вопросов, рассматриваемых на уроке:
- Что такое тела.
- Что такое вещества.
- Что такое частицы.
- Разнообразие веществ.
- Кислотные дожди.
Глоссарий по теме:
Молекула — наименьшая частица вещества, обладающая всеми его химическими свойствами.
Атом — мельчайшая частица элемента.
Кислота – кислый вкус.
Уксус – жидкость с резким, кислым вкусом.
Основная и дополнительная литература по теме урока:
- Окружающий мир. Рабочая тетрадь. 3 кл.: учеб.пособие для общеобразоват. организаций. В 2 ч. / А. А. Плешаков. — М.: Просвещение, 2017. с. 24.
Дополнительная литература:
- Атлас — определитель «От земли до неба» с. 8, с. 14.
Открытые электронные ресурсы по теме урока:
http://www. alto-lab.ru/himicheskie-opyty/opyty-s-limonom/
alto-lab.ru/himicheskie-opyty/opyty-s-limonom/
http://www.alto-lab.ru/zanimatelnya-himia/sluchajnye-otkrytiya-v-himii/
Теоретический материал для самостоятельного изучения
Если мы с вами оглядимся вокруг, что мы увидим? Мы увидим различные предметы – стол, стул, дома, машины, деревья, горы, люди, животные. Перечислить все предметы невозможно, потому что их очень много. Любой предмет или живое существо можно назвать телом. Планеты, солнце, Луна – тоже тела. Их называют небесными телами. Все тела делятся на две группы – естественные и искусственные. Естественные тела, это природные тела. Растения, животные, птицы, человек – всё это естественные тела. Искусственные тела, это тела, созданные руками человека. Дома, мосты, книги, машины – всё это и многое другое создал человек.
Все тела состоят из веществ. Например, сахар – это вещество, а кусок сахара – это уже тело. Стекло – это вещество, а стакан – это тело. Из одного вещества можно сделать разные тела. Например, из пластмассы – линейка, проволока, пластмассовый стаканчик. Есть тела, которые образованы несколькими веществами: карандаш, ножницы. Есть тела, которые образованы многими веществами. Например, растения состоят из воды, сахара, соли, крахмала и других веществ. Очень сложный состав имеют живые тела. Вещества тоже делятся на группы. Различают твёрдые, жидкие и газообразные вещества.
Есть тела, которые образованы несколькими веществами: карандаш, ножницы. Есть тела, которые образованы многими веществами. Например, растения состоят из воды, сахара, соли, крахмала и других веществ. Очень сложный состав имеют живые тела. Вещества тоже делятся на группы. Различают твёрдые, жидкие и газообразные вещества.
Ученые установили, что вещества состоят из мельчайших частиц, которые видны только под микроскопом. Чтобы убедиться в этом, давайте проведём опыт. Возьмём тело, состоящее из одного вещества, например кусочек сахара, опустим его в стакан с водой и хорошо помешаем. Сначала сахар будет виден, но постепенно станет исчезать. Попробуем воду на вкус, она сладкая. Значит, сахар не исчез, а остался в стакане. А мы его не видим, потому что он распался на маленькие, невидимые нашему глазу частицы, из которых он состоял, и эти частицы перемешались с частицами воды, поэтому вода стала сладкой на вкус. Мельчайшую, невидимую частицу вещества учёные назвали молекулой. А каждая молекула состоит из ещё более мелких частиц, которые называются атомами. Молекулы и атомы разных веществ отличаются друг от друга формой и размерами. Эти мельчайшие частицы постоянно движутся. Между частицами есть промежутки. В твёрдых веществах эти промежутки совсем маленькие, частицы плотно прижаты друг к другу, поэтому твёрдые тела сохраняют форму. В жидких промежутки немного больше, и молекулы могут перемещаться, поэтому жидкости текучи. Самые большие промежутки – в газообразных веществах. У газообразных веществ расстояние между молекулами намного больше самих молекул, поэтому молекулы в газах свободно и очень быстро движутся. Запомним, веществами называют то, из чего состоят тела.
Молекулы и атомы разных веществ отличаются друг от друга формой и размерами. Эти мельчайшие частицы постоянно движутся. Между частицами есть промежутки. В твёрдых веществах эти промежутки совсем маленькие, частицы плотно прижаты друг к другу, поэтому твёрдые тела сохраняют форму. В жидких промежутки немного больше, и молекулы могут перемещаться, поэтому жидкости текучи. Самые большие промежутки – в газообразных веществах. У газообразных веществ расстояние между молекулами намного больше самих молекул, поэтому молекулы в газах свободно и очень быстро движутся. Запомним, веществами называют то, из чего состоят тела.
Веществ тоже очень и очень много. Сейчас их известно около миллиона. В старших классах вы будете изучать очень интересный предмет – химию. Химия, это наука, которая изучает вещества, их состав, строение. Есть природные вещества, к примеру, это соль, вода, железо. И есть вещества, которые создал человек – стекло, резина, пластмасса. И каждый год человек придумывает новые вещества.
Чтобы познакомиться с некоторыми веществами, нам достаточно просто пойти на кухню. На столе мы видим солонку, а в ней поваренная соль. Самое важное для человека свойство поваренной соли – то, что она солёная на вкус, её используют для подсаливания пищи. Добывают соль из-под земли, это настоящее полезное ископаемое. Под землёй соль встречается в виде камня. Очень много соли содержится в водах солёных морей и озёр. Есть она и в почве, и в телах живых организмов.
Сахар мы тоже обязательно встретим на кухне. По внешнему виду сахар похож на соль. Сладкий вкус – главное свойство сахара. Получают сахар из растений – сахарной свёклы и сахарного тростника, который растёт в жарких странах. Глюкоза – ещё одна разновидность сахара. Она встречается в различных частях растений.
Крахмал – это вещество, которое мы тоже можем встретить на кухне. Крахмал – это белый порошок. Его добавляют, когда варят кисель. Крахмал очень важное питательное вещество, которое необходимо человеку. Он содержится во многих растительных продуктах – в белом хлебе, в картофеле. Чтобы узнать, есть ли в продукте крахмал, нам понадобится разбавленная водой настойка йода. Если капнуть ею на продукт, в котором содержится крахмал, настойка йода окрасится в сине-фиолетовый цвет.
Он содержится во многих растительных продуктах – в белом хлебе, в картофеле. Чтобы узнать, есть ли в продукте крахмал, нам понадобится разбавленная водой настойка йода. Если капнуть ею на продукт, в котором содержится крахмал, настойка йода окрасится в сине-фиолетовый цвет.
Большая группа веществ, с которыми мы сталкиваемся на кухне – это кислоты. Всем нам знаком вкус лимона. Такой вкус ему придаёт лимонная кислота. В яблоках содержится яблочная кислота. Когда прокисает молоко, в нём образуется молочная кислота. Общее свойство эти веществ – кислый вкус. Надо быть острожным, нельзя пробовать любую кислоту на вкус. Многие кислоты очень едкие – они разрушают одежду, древесину, кожу человека, бумагу. Поэтому обращаться с ними надо осторожно. На кухне вы можете встретить и такую кислоту – уксусную. Её используют только в разбавленном виде. К бутылочке с этой кислотой вообще нельзя прикасаться! Из-за загрязнения окружающей среды стали образовываться кислоты высоко в небе. Они выпадают вместе с дождем на землю, такие дожди называют кислотные. От них страдают растения и всё живое, портятся многие постройки. Некоторые животные и растения используют кислоту, как средство защиты от врагов. Например, муравьи в момент опасности поднимают брюшко и выбрызгивают струйки муравьиной кислоты. Эта же кислота содержится в пчелином яде и в жгучих волосках крапивы.
От них страдают растения и всё живое, портятся многие постройки. Некоторые животные и растения используют кислоту, как средство защиты от врагов. Например, муравьи в момент опасности поднимают брюшко и выбрызгивают струйки муравьиной кислоты. Эта же кислота содержится в пчелином яде и в жгучих волосках крапивы.
Окружающий нас мир полон загадок и тайн. Нас впереди ждёт ещё много новых интересных открытий.
Примеры и разбор решения заданий
1. Выберите вещества, которые не относятся к твёрдым.
Варианты ответов: глина; молоко; соль; песок; почва; мел; сок; воздух; алюминий.
Правильный вариант ответа:
Молоко; сок; воздух; вода.
Разбор типового контрольного задания
2. В какой строчке указаны только вещества?
Варианты ответов: алюминий, соль, железо, линейка, проволока, крахмал, сахар, роса; бумага.
Правильный вариант ответа: алюминий, соль, железо.
Урок № 9. «Разнообразие веществ», 3 класс, ФГОС
Кинопособие уроков « Окружающий мир» 3класс
Тип урока: комбинированный
Цель
— формирование целостной картины мира и осознание места в нём человека на основе единства рационально-научного познания и эмоционально-ценностного осмысления ребёнком личного опыта общения с людьми и природой;
Проблема:
какие вещества наиболее распространены в быту?
Задачи:
познакомить с наиболее распространенными в быту веществами: поваренной солью, сахаром, крахмалом, кислотой, их свойствами, научить ставить опыты.
Предметные результаты
Научатся
-определять свойства соли, сахара, крахмала, кислоты;
— различать сахар, соль, крахмал по характерным признакам
Универсально учебные действия (УУД)
Регулятивные: научатся ставить опыты, используя лабораторное оборудование.
Познавательные: контролировать и оценивать процесс и результат деятельности; овладение логическими действиями сравнения, анализа.
Коммуникативные: умение работать в паре, вести диалог, излагать свое мнение; осуществлять взаимный контроль в совместной деятельности.
Личностные результаты
Формирование целостного взгляда на мир. Развитие мотивов учебной деятельности
Основные понятия и определения
Химия-наука о веществах. Вещества: соль, крахмал, сахар, кислота. Наиболее распространенные в быту вещества – соль, сахар, крахмал, кислоты.
Проверка готовности к усвоению нового материала
На свете очень много различных веществ. Сейчас их известно несколько миллионов. Одни из них существуют в природе, а другие созданы искусственно (например, пластмассы). Приведи примеры веществ.
Сейчас их известно несколько миллионов. Одни из них существуют в природе, а другие созданы искусственно (например, пластмассы). Приведи примеры веществ.
Изучение нового материала
Разнообразие веществ
Вещества изучает наука химия.
Познакомимся с некоторыми из веществ. Для этого отправимся… на кухню.
Вот на столе солонка, а в ней поваренная соль. Мы привыкли, что это вещество имеет вид белых крупинок. Но в природе, под землёй, оно встречается в виде камня. Самое важное для человека свойство поваренной соли — то, что она солёная на вкус. Поэтому её используют в пищу.
В природе поваренная соль встречается не только под землёй. Очень много её содержится в морской воде, а также в воде солёных озёр. Есть она и в почве, и в телах живых организмов.
Поваренная соль — это одна из минеральных солей, встречающихся в природе. Некоторые из них люди добывают и используют как удобрение для растений
Некоторые из них люди добывают и используют как удобрение для растений
Сахар — ещё одно вещество, с которым мы обязательно встретимся на кухне. По внешнему виду его можно спутать с солью. Зато их не спутаешь по вкусу. Сладкий вкус — главное свойство сахара, поэтому его добавляют во многие продукты. Получают сахар из растений — сахарного тростника (в жарких странах) и сахарной свёклы.
Сахарная свёкла и сахарный тростник
Обыкновенный сахар не единственное сладкое вещество в природе. Многим детям знакомы большие сладкие таблетки — витамин С с глюкозой. Глюкоза — ещё одна разновидность сахара. В природе она содержится в различных частях растений. Особенно богаты глюкозой плоды винограда и виноградный сок. Поэтому глюкозу также называют виноградным сахаром.
Крахмал — одно из важнейших питательных веществ, необходимых человеку. Он содержится во многих продуктах растительного происхождения.
Учёные-химики подсказали, как узнать, есть ли крахмал в том или ином продукте. Для этого нужна разбавленная водой настойка йода. Если капнуть ею на продукт, в котором содержится крахмал, настойка йода приобретёт сине-фиоле- товый цвет. Таким способом можно установить, что крахмал содержится, например, в белом хлебе, рисовой каше, клубнях картофеля.
Большая группа веществ, с некоторыми из которых мы наверняка встретимся на кухне, — кислоты. Каждому знаком кислый вкус лимона. Такой вкус ему придаёт содержащаяся в нём лимонная кислота. В яблоках содержится яблочная кислота, а в листьях щавеля — щавелевая кислота. Когда прокисает молоко, в нём образуется молочная кислота.
Общее свойство этих веществ — кислый вкус. Но это не значит, что любую кислоту можно пробовать на вкус. Многие кислоты очень едкие — они разрушают кожу человека, одежду, бумагу, древесину. Поэтому обращаться с ними надо осторожно. На кухне мы встретим одну из таких опасных кислот — это уксусная кислота, или уксус. Ты уже знаешь, что к бутылочке с уксусом нельзя прикасаться. Это вещество используют только в разбавленном виде.
На кухне мы встретим одну из таких опасных кислот — это уксусная кислота, или уксус. Ты уже знаешь, что к бутылочке с уксусом нельзя прикасаться. Это вещество используют только в разбавленном виде.
Из-за загрязнения окружающей среды кислоты стали образовываться высоко в небе. Нередко они выпадают на землю вместе с дождём. Это так называемые кислотные дожди. От них страдают растения и всё живое, портятся многие постройки, в том числе старинные памятники.
Где и как добывают соль. Добыча соли в России
Как добывают морскую соль
Как производится каменная и экстра соль
Сахар: как это делается
Производство сахара из сахарного тростника
Крахмал из картофеля.
Что будет, если опустить ЯЙЦО В УКСУС?
Осмысление и понимание полученных знаний
Практическая работа
С помощью разбавленной настойки йода определи, есть ли крахмал в продуктах, выданных тебе учителем.
Результаты исследования запиши и зарисуй в рабочей тетради.
Пользуясь текстом учебника, устно опишите 1—2 вещества по плану: название вещества, внешние признаки, главные свойства, где встречается в природе (содержится), как используется человеком.
Прочитайте текст. Используя полученную информацию, объясните, что изображено на рисунках.
Некоторые животные и растения с помощью кислоты защищаются от врагов. Так, муравьи в момент опасности поднимают брюшко и выбрызгивают едкие струйки муравьиной кислоты. Эта же кислота содержится в пчелином яде и жгучих волосках крапивы.
Как вырастить кристалл из сахара! Опыты для детей!
Вывод. Вещества очень разнообразны. В повседневной жизни люди часто сталкиваются с поваренной солью, сахаром, крахмалом, различными кислотами.
Самостоятельное применение знаний
1.Каковы главные свойства поваренной соли и сахара?
2. Как обнаружить крахмал в продуктах питания?
3. Какие кислоты встречаются в природе?
4. Чем опасны кислотные дожди?
Задания для домашней работы
1.Запиши в словарик: химия, поваренная соль, крахмал, кислота.
2.Дома возьми три блюдца и насыпь в одно из них сахар, в другое — поваренную соль, в третье — крахмал. Как различить эти вещества?
Источники информации:
А. А. Плешаков учебник, рабочая тетрадь Окружающий мир 3 класс Москва
«Просвещение» 2014
Сайт YouTube: https://www.youtube.com /
Хостинг презентаций окружающий мир
— http://ppt4web.ru/nachalnaja-shkola/prezentacija-k-uroku-okruzhajushhego-mira-vo-klasse-chto-takoe-ehkonomika.html
Презентация по окружающему миру «Волшебные свойства соли»
1 слайд
Тема нашего исследования «Волшебная соль»
2слайд
Цель проекта: Узнать как можно больше о соли и о её свойствах.
И доказать, что соль – не только необходимый продукт, но и интересный материал для проведения опытов и творчества.
Задачи проекта:
-Расширять знания о соли, определить свойства соли, как ее добывают, где применяется.
-Узнать о значении соли в жизни человека;
— Проверить некоторые свойства соли практическим путем.
-Провести опыты по выращиванию кристаллов соли.
-Проанализировать полученные результаты.
3 слайд
Происхождение слова «соль», по мнению некоторых учёных, связано с Солнцем: старинное славянское название Солнца – Солонь. Такое же древнее по корню слово и также живущее во многих индоевропейских языках. По-латыни «соль» звучало «саль», по-французски — «sel» («сэль»), у латышей — «салс», у древних готов — «салт»…
Латинское слово “sаlarium” и английское слово “salary”, означающие “жалование”, “зарплата”, – имеют “солевое” происхождение. По своей ценности она приравнивалась к золоту. В Римской империи легионерам платили жалование солью. Ученые считают, что, ‘возможно, с этим связано происхождение французского слова «салер» (жалование) и итальянского «сольди» (мелкая монета). Отсюда и произошло слово “солдат”.
4 слайд История поваренной соли.
Древнегреческий философ Кассиодор полагал, что соль дороже золота, поскольку без золота жить можно, а без соли нельзя…Необходимость соли для жизни была известна со времен глубочайшей древности. Имеются свидетельства того, что добыча поваренной соли осуществлялась еще 3-4 тыс. лет до нашей эры. Соль стала очень рано одной из самых важных единиц обмена. Было время, когда на Руси княжеским дружинам платили солью, а в царской России соль входила в состав жалованья. В некоторых странах соль выполняла даже роль денежной единицы. Венецианский путешественник Марко Поло, посетивший Китай в 1286 г., описал использовавшиеся там монеты из кристаллов каменной соли. Особое распространение денежной единицы из соли получило во многих районах Центральной Африки. В Эфиопии стандартные бруски каменной соли были в ходу в качестве денежной единицы еще в XIX в.
На протяжении многих веков в разных государствах, где соли было мало, она ценилась очень высоко.
На столах императоров, царей, королей и шахов стояли солонки из золота, и заведовал ими особо доверенный человек – солоничий. Нам трудно представить, что в прошлом во многих странах соль служила существенным источником пополнения казны, была важным предметом торговли. Ломоносов писал, что в то время за четыре небольших куска соли можно было купить раба. Ее берегли, экономили, хвастались ею: наличие соли на столе было признаком достатка и благополучия.
5 слайд
Первое упоминание о солеварении на Руси датируется XII веком. Но тогда торговля солью была вольным промыслом. Ее продавали наряду с мехами, кожей, воском и медом. Между тем вывозить соль в больших объемах за границу не разрешалось. А при царе Михаиле Федоровиче продажа соли иностранцам каралась смертной казнью.
Из-за соли велись кровопролитные войны между соседними народами, а по причине непомерно высоких налогов, устанавливаемых на соль, происходили народные восстания (соляные бунты). Например, такой бунт произошел в Москве весной 1648 г. Этому послужил повышенный налог на соль, введенный царем Алексеем Михайловичем. Этот бунт окончился благополучно. Царь, напуганный размахом волнений (из Москвы бунт перекинулся на Сольвычегодск, Устюг Великий, Соликамск), снизил уровень налога. Многие народные волнения в Китае, других странах Азии, в Европе кончались не столь благополучно. В 1711 году Петр I издал указ о введении соляной монополии. Торговля солью стала исключительным правом государства. Соляная монополия просуществовала еще более полутораста лет и была отменена в 1862 году.
6 слайд
Значение соли отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека »Хлеб да соль» — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значении соли. Хлеб и соль стали символом гостеприимства и радушия русской нации. Говорят: “Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5,5 кг соли. Одна присказка «без золота прожить можно, а без соли нельзя» чего стоит! Значит соль важный минерал и в связи с этим у нее особые свойства. Делить хлеб-соль» означало претерпеть все тяготы в жизни, в дружбе. Отсюда, если просыпать соль — к ссоре…
Хорошая русская поговорка гласит: «Не один пуд соли вместе съели…». А ещё выражение «Соль земли» означает суть — самое главное и ценное, что есть в этом мире.Соль издревле была на Руси неким оберегом от враждебных сил.
В народе сложены поговорки и пословицы о соли:
Надо пуд соли вместе съесть, чтобы друга узнать.
Без соли, без хлеба — половина обеда.
Без хлеба не сытно, без соли не сладко.
Без хлеба смерть, без соли смех.
Думай не думай, а лучше хлеба-соли не придумаешь.
За хлебом-солью каждая шутка хороша.
И старая кобыла до соли лакома.
Сердись, бранись, дерись, а за хлебом-солью сходись.
Соли не жалей, так и есть веселей.
Щепотка соли делает сахар слаще.
7 слайд Добыча соли
Давно было обнаружено, что некоторые растения имеют приятный соленый вкус. Такие растения сушились, а затем сжигались в костре. Получающуюся золу использовали в качестве приправы к пище.
Позднее люди научились поливать горящие в костре куски дерева соленой водой из моря или озера и оставшуюся золу также использовать в пищу.
В древности люди использовали несколько способов добычи поваренной соли: естественное испарение морской воды в «соляных садках», где выпадал хлорид натрия — «морская» соль, вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной» соли в подземных рудниках. Каменная соль, или галит, — это минерал, который состоит из кубических кристаллов. Галит как бы подчеркивает происхождение этого минерала из моря: галос по-гречески обозначает и соль и море.
Существовал способ производства соли – «выжиганием». Этот способ использовали около тех побережий современной Германии, где недалеко от воды находились залежи торфа. При шторме или приливе соленая морская вода насыщала торф. Когда вода уходила, торф подсыхал, а соль оставалась. Постепенно в нем накапливалось много соли. Насыщенный торф выкапывали и сжигали, а золу выщелачивали в воде и раствор выпаривали.
На севере нашей страны морская вода выпаривалась (варилась) в больших чанах, а источником энергии служили дрова. Однако в северных районах, в частности на берегах Белого моря, было и существенное усовершенствование способа извлечения соли из морской воды.Поморы давно заметили, что при замерзании морской воды лед получается несоленым, а оставшаяся незамерзшая вода становится гораздо солонее. Расплавляя лед, можно получать пресную воду из морской, а из рассола вываривали поваренную соль с меньшими энергетическими затратами.
8 слайд
Соль или хлорид натрия находится в природе уже в готовом виде. Соль является минеральным веществом. Соль природного происхождения практически всегда имеет примеси других минеральных солей, которые могут придавать ей оттенки разных цветов. Особенно его много в морской воде и в соленых озерах, в больших массах он встречается в виде твердой каменной соли. Подсчитано, что в морской воде всех морей и океанов содержится столько соли, что она могла бы покрыть весь земной шар пластом толщиной в 45 м.
Всего в мире производится 210 млн. тонн соли в год.
Первое место в производстве принадлежит США, Китай на втором месте, Россия на 14.
Крупнейшими российскими месторождениями являются Артемовское, Верхнекамское, Серёговское, Астраханское.
9 слайд
Освоение месторождений на территории России имеет свою историю, легенды. Давным–давно в сухой приволжской степи, у горы Большое Бог До, рассказывает казахская легенда, жил бай. Самым большим богатством бая была красавица дочь. А она полюбила пастуха. Узнав об этом, бай приказал казнить его. Девушка залилась слезами. Проходили дни, недели, слезы лились и лились из ее глаз. Так появилось в степи соленое озеро Баскунчак или в народе его называют “Озеро слез”.
Еще во времена царя Петра I на озере побывала экспедиция, чтобы определить, какая там соль и возможен ли ее промысел. Установили: промысел возможен, особенно хороша соль в Баскунчаке – “чиста… как лед”. Но только в 1774 году решил начать добычу озерной соли.
Озеро Баскунчак является в настоящее время основной сырьевой базой в Нижнем Поволжье.
10 слайд
Более пятисот лет существует на Урале город Соликамск, раскинувшийся по берегам притока Камы – реки Усолки. Издавна славиться он своей солью. Много миллионов лет назад здесь было огромное море. Наконец наступило время, когда пермское море исчезло. От него остались пласты соли толщиною в несколько сот метров, прикрытые, словно толстым одеялом, наслоениями глины, известняка, песка. Грунтовые воды размывают скрытые в земле залежи солей и текут под землёй солёными ручейками и реками. Местные жители, охотники, рыболовы испокон века находили соляные ключи и источники и пользовались рассолом. В 1430 году новгородские купцы Калашниковы построили в Соликамске первые солеварни. По деревянным трубам выкачивали рассол из земли и выпаривали его в больших железных сковородах.
В России еще в XVI веке известные русские предприниматели Строгановы самые большие доходы получали от добычи соли. С предгорий Урала соль отправлялась в Москву, Казань, Нижний Новгород, Калугу, даже за границу.
11 слайд
В Нижегородской области находится одно из самых крупных месторождений соли не только в масштабах в России, но и в Мире — это Белбажское соляное месторождение.
12 слайд
Одним из распространенных способов добычи поваренной соли является открытый способ. Разработку данным способом производят тогда, когда верхний горизонт соляного пласта находится на небольшой глубине. Соль таким способом добывают на глубине до 20 метров, а порой и до 150 метров. В этом случае устраивают карьер или разнос, для этого пласт соли разрыхляется (дробится) механическим или взрывным способом, чтобы удалить верхний слой покровных пород, затем производят выемку соли. На крупных разработках для этой цели используют экскаваторы, скреперы с лебедками или с тракторной тягой, механические лопаты и другие механизмы. Одним из недостатков добычи соли открытым способом является загрязнение соли наносами пыли, а особенно заливание карьера атмосферными осадками и почвенными.
13 слайд
Какие виды соли бывают?
-На самом деле соль природного происхождения имеет сероватый оттенок.
— Есть соль неочищенная (каменная) и очищенная (поваренная), а также крупная и мелкая.
— Морская соль — добывается путем выпаривания морской воды.
14 слайд
Пова́ренная соль, или пищевая соль (хлорид натрия, NaCl; употребляются также названия «хлористый натрий», «столовая соль», «каменная соль», «пищевая соль» или просто «соль»).
Свойства Хлорид натрия имеет вид бесцветных кристаллов, крупного помола, без запаха со специфическим горьковато — солёным вкусом.
Магнитные свойства: не притягивается
Плотность: 2,16
Температура плавления 800,8 С
Температура кипения 1465 С.
15 слайд
NaCl (поваренная соль) — единственный минерал, который непосредственно употребляется в пищу.
Чистая поваренная соль состоит из хлорида натрия NaCl. В природе соль встречается в виде минерала галита – каменной соли.
В твердой соли атомы натрия и хлора расположены в определенном порядке, образуя кристаллическую решетку. Все кристаллы имеют солеобразный характер. Из-за того, что силы притяжения распространяются одинаково по всем направлениям, частицы в узлах решетки связаны относительно прочно.
16 слайд Опыт №1. Растворимость в воде в зависимости от температуры.
В два стакана налили горячую и холодную воду. В каждый стакан внесли поваренную соль (одну чайную ложку). При интенсивном перемешивании наблюдали за скоростью растворимости поваренной соли в холодной и горячей воде. Вода в обеих банках помутнела. Но вот в банке с горячей водой соль растворилась быстрее, и вода была почти прозрачной. А в банке с холодной водой соль упала на дно, сама же вода долго оставалась мутной.
Вывод: в горячей воде соль растворяется быстрее.
17 слайд Опыт №2. Сравнение скорости замерзания пресной и соленой воды.
В чашку налили пресную воду, добавили в нее несколько чайных ложек соли. Налили в бутылку, обозначенной цифрой I. В бутылку, которая обозначена цифрой II, налили пресную воду. И наблюдали в течение 12 часов.
Пресная вода замерзла в течение 4 часов при температуре -20 С0. Соленая вода начала замерзать через 7 часов.
Это же свойство соленой воды используется коммунальными службами. Если ко льду прибавить одну двадцатую соли, то она растворит лед и образуется раствор, который замерзнет при более низкой температуре, чем вода. На этом основано посыпание солью проезжей части и тротуаров, когда надо, чтобы растаял слежавшийся снег или лед при гололеде
18 слайд Опыт №3. Реакция соли на огонь.
Соль не горит. При смачивании спиртом, спирт сгорает, а соль нет.
Платочек, обработанный поваренной солью не горит.
19 слайд Опыт 4. Соль и температура кипения воды.
Если соль в горячей воде растворяется быстрее, то что произойдет с ней в кипящей воде? Вода в кастрюле закипела, и я бросил туда соли. Удивительно, но после того, как соль попала в кастрюлю, кипение воды сильно уменьшилось. Через некоторое время солёная вода закипает, и термометр показывает температуру выше 100 °С.
Вывод: соль повышает температуру кипения. Опытные хозяйки при консервировании продуктов стерилизуют банки подсоленной водой. Соль, содержащаяся в воде, не испаряется, но стерилизация будет эффективнее, т.к. температура кипения повышена.
20 слайд Опыт 5. Получение соли в домашних условиях.
Замачиваем в воде соленые огурцы на 3 дня.
Полученную жидкость выпариваем на огне.
На дне кастрюли остается чистая соль.
Счищаем чистую соль со дна кастрюли в тарелку.
21 слайд Опыт 6. Соль повышает плотность воды.
Для опыта взяли 1 сырое яйцо и банку с водой. Положили яйцо в банку, яйцо утонуло. Положили банку столовую ложку соли, яйцо всплыло.В концентрированном растворе соленой воды физическое тело не тонет.
22 сла-23 слайды Опыт 9. Получение кристаллов из соли.
Кристаллы – это вещества, в которых мельчайшие частицы «упакованы» в определенном порядке. В результате при росте кристаллов на их поверхности самопроизвольно возникают плоские грани, а сами кристаллы принимают разнообразную геометрическую форму.
Вырастить кристалл из соли легко: нужно взять шерстяную нитку, добавить в воду столько соли, чтобы она уже не растворялась, и оставить на 2 недели.
В 0,5 стакана воды добавили 2 столовые ложки соли, размешали. Размешивали очень долго, т. к. вода была холодная. Вода стала приобретать белый цвет, где даже и не видно было ложки. Положили нитку в подсоленную воду.
На следующий день вода стала прозрачной, с ниткой ничего не произошло. Через несколько дней заметили, что на нитке, которая была не в воде, появились первые кристаллы. Они видны в форме прозрачных кубиков, размеры которых были различны, а на стенках стакана ничего не было. Еще через неделю стенки стакана были полностью все в кристаллах. Вода с каждым днем испаряется и на стенках стакана нарастает более толстый слой солевых кристаллов. Опыт завершился, когда испарилась вся вода. Точно такой же опыт я проделал, но с большим количеством соли, и кристаллы были намного больше.
24 слайд Опыт 13 Электропровдимость
— Типичным свойством соли является то, что ее водный раствор способен проводить электрический ток
25 слайд Опыт Очистка солью
27 слайд Опыт 14 ОБНАРУЖЕНИЕ СОЛИ В РАЗЛИЧНЫХ ПРОДУКТАХ
4.1. Обнаружение частиц натрия и хлора в растворе поваренной соли, в соках фруктов и овощей
4.1.1.Обнаружение частиц натрия и хлора в растворе поваренной соли.
В 50 г воды растворил 5 г соли. К порции полученного раствора по каплям приливаю раствор нитрата серебра.Выпадение белого творожистого осадка говорит о наличии в соли частиц хлора.
Каплю исследуемого раствора внес в пламя спиртовки. Пламя окрасилось в желтый цвет, что говорит о наличии частиц натрия в составе соли.
Вывод: в поваренной соли есть частицы натрия и хлора.
4.1.2. Обнаружение частиц хлора и натрия в соках фруктов и овощей
Для опыта я взял зеленые яблоки, апельсины, морковь, картофель, огурцы, помидоры, капусту. Фрукты и овощи тщательно измельчил, выжал сок и профильтровал его.
Взял равное количество (по 1 мл) полученного сока и к каждой порции по каплям добавил раствор нитрата серебра. Во всех образцах произошло выпадение белого творожистого осадка, но в разном количестве.
В яблоках большое содержание частиц хлора, апельсинах его значительно меньше.
В моркови, картофеле, огурцах, помидорах обнаружил малое содержание частиц хлора, а в капусте их значительно больше.
Каплю исследуемых растворов поочередно внес в пламя спиртовки. Пламя окрасилось в желтый цвет, что говорит о наличии частиц натрия в составе соли.
Вывод: фрукты и овощи содержат некоторое количество соли.
27 слайд Соль и организм человека
Без этой соли невозможна жизнь растений, животных, человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможно переваривание и усвоение пищи.
В теле человека до 3 кг минеральных солей, из которых 5/6 входит в состав скелета, значительную долю занимает поваренная соль. При весе 50 кг в нашем организме содержится около 150 г соли.
Она «отвечает» за то, чтобы жидкость в клетках и вокруг них распределялась равномерно. Кроме того, без неё невозможна деятельность наших нервов и мускулов. Соль входит в состав крови, лимфы, слюны, желудочного сока, желчи. Благодаря соли обеспечивается необходимое осмотическое давление, от которого зависит нормальная жизнедеятельность клеток. Соль является источником образования соляной кислоты, необходимой для пищеварения. Таким образом, без соли процесс переваривания пищи замедляется.
Так же в небольших количествах она содержится в желудочном соке. Чтобы постоянно иметь в организме достаточное количество соли, мы должны съедать 10-12 г соли ежедневно. За год человек потребляет 4,5 кг соли. А за 70 лет жизни 200-300 кг.
28 слайд
Хронический недостаток соли в организме может привести:
- к головокружениям и обморокам;
- нарушениям сердечной деятельности;
- резкому сокращению выделения пищеварительных соков;
- снижению аппетита;
- уменьшению количества воды в крови и организме.
- Без соли не прожить человеку. Вода вымывает вместе со шлаками и поваренную соль из нашего организма, тем самым нарушая водный баланс внутри него. Ведь, именно, соль задерживает воду в организме, вот почему так важно в жаркие дни, чтобы не мучила жажда, съедать немного соли. Об этом знают все путешественники, жители степей, исследователи пустынь и тайги.
39 слайд
Целебные свойства соли
- замечено, что люди, работающие на добыче соли в соляных шахтах почти не болеют простудными заболеваниями и гриппом, их не мучает астма и кашель, скорее всего благодаря тому, что дышат воздухом, насыщенным парами каменной соли.
Лечение поваренной солью гнойных ран
— Соль, попавшая в ранку, щиплет, но потерпеть стоит, ведь соль останавливает кровь, убивает инфекции, подсушивает и ускоряет заживление. Не зря наша кровь по составу похожа на солевой раствор. В период Первой мировой войны раненых спасали тем, что вместо потерянной крови вливали им в сосуды подсоленную дождевую воду. Опытные хирурги, накладывали повязки с раствором соли на раны, особенно на гнойные. В результате рана быстро очищалась, спадала температура. Итак, еще одно свойство – антисептическое. Благодаря своему абсорбирующему свойству она помогала обеззараживать поврежденные участки кожи, снимать воспаление.
Так в войну, когда госпитали испытывали нехватку антибиотиков, перевязочного материала, в ход шёл обычный раствор поваренной соли. После наложения такой повязки рана очищалась, становилась розовой и быстро заживала. Солевая повязка действует локально — только на больной орган или на участок тела. По мере поглощения жидкости из подкожного слоя в него поднимается тканевая жидкость из более глубоких слоев, увлекая за собой все болезнетворные начала: микробы, вирусы и органические вещества.
Таким образом, во время действия повязки в тканях больного организма происходит обновление жидкости, очищение от патогенного фактора и, как правило, ликвидация патологического процесса.
Как приготовить 8-10%% лечебный гипертонический раствор для лечения ран в домашних условиях
Возьмите 1 литр кипячённой воды, остудите до 50 градусов, добавьте 80-100 грамм поваренной соли размешайте и смочите в растворе несколько слоёв марли 4-5, чуть отожмите, влажной салфетку наложите на рану. Сверху можно положить сухую марлю. Нельзя класть сверху полиэтилен, целлофан, чтобы не вызвать парникового эффекта. Держать повязку можно 8-10 часов, по мере ощущений. После того, как сняли повязку, можно рану протереть чистой воду и чуть подсушить.
Повязка с гипертоническим раствором поваренной соли действует постепенно. Лечебный результат достигается в течение 7-10 дней, а иногда и более.
Лечение солью суставных болей
Поваренная соль даёт хороши результаты снятия суставных болей методом аппликаций. Раствором аналогичной концентрации 10% пропитайте повязку и наложите на больной сустав, если это ноги, можно смочить носки или чулки в растворе и надеть их на ночь. Процедуры выполнять 7-10 дней.
30 слайд
Лечение зубной боли, боли в горе солью
При боли в горле, стоматите или зубной боли хорошо помогает следующий рецепт:
Растворите в стакане воды пол чайной ложки соли и столько же соды и добавьте несколько капель йода. Такой раствор даже снимает отёки, вызванные болезнью зубов, различные свищи и кисты десны.
При начинающей простуде, заложенности носа
Чтобы предупредить насморк, каждый день нужно втягивать в нос соленую воду — поочередно в одной и другой ноздрей.
Если болит горло, можно в стакан с горячей водой добавить по одной чайной ложке соли, несколько капель йода, а затем этим раствором полоскать горло или закапывать нос.
Если в платок насыпать 2-3 столовые ложки соли, нагреть, положить на нос или грудь как компресс, это хорошо помогает при кашле и насморке.
Солевым раствором соли можно промывать слизистую носа при насморке и гайморите. Начинать надо с 5%‑го солевого раствора, затем постепенно переходя на 1–2%‑й.
- Укусило насекомое — смажьте место укуса, зуд и боль пройдут.
31 слайд
Головная боль
Солевая повязка может облегчить и даже устранить головную боль. Марлю, смоченную в солевом растворе, можно накладывать на лоб и шею.
Солевые ванны и ванночки
— Целебное воздействие солевого раствора нередко используют в качестве дополнительного терапевтического средства при лечении различных неврологических заболеваний.
Местное воздействие солевого раствора и кристаллов хлорида натрия помогает избавиться от кожных заболеваний, артритов и артрозов, воспалительных процессов, а также улучшить самочувствие, устранить усталость и депрессию. Иногда врачи рекомендуют проведение солевых ванн для устранения усталости, успокоения нервов, избавления от последствий стресса, бессонницы и раздражительности.
— Для укрепления ногтевых пластинок можно делать ванночки с морской солью
— Физиологический раствор
представляет собой не что иное, как водный раствор соли – натрия хлорида. Медики применяют раствор для проведения реанимационных мероприятий. Ним разводят самые разные медикаменты, как заменитель крови при кровопотерях.
32 слайд
СПЕЛЕОТЕРАПИЯ – ЛЕЧЕНИЕ В ПРИРОДНЫХ СОЛЯНЫХ ПЕЩЕРАХ
В выработках соляных шахт создают подземные лечебницы,санатории. Там очень целебный воздух и совсем нет вредных микроорганизмов.
Березники (Россия) – соляные копи в Пермской области
Соляные копи небольшого города Березники, расположенного в Пермской области, разрабатываются с начала XVII столетия. Первое упоминание о добыче здесь соли относится к 1623 году. Березники буквально стоят на запутанном лабиринте старых солевых выработок. С 1977 года здесь функционировала первая в мире сильвинитовая спелеологическая лечебница, располагавшаяся в старой выработке калийного рудника.
В настоящее время красивейшие подземные интерьеры соляных выработок доступны для осмотра туристами, однако помещения спелеолечебницы подверглось затоплению подземными водами. В городе функционирует несколько спелеокабинетов со стенами, обложенными натуральными соляными и сильвинитовыми блоками, где воссозданы природные условия соляной пещеры.
33 слайд
Вред соли
В 1960–е годы с легкой руки Герберта Шелтона и Поля Брэгга (диетологи) поваренную соль окрестили “белой смертью”, и это утверждение бытует до сих пор. Все началось с объявления соли виновницей гипертонии, почечной недостаточности, ишемической болезни сердца и ожирения. Отчасти это верно. Пищевая соль может быть сильнейшим ядом. Для человека смертельной дозой является разовое употребление около 250 г соли.
Хлорид натрия способствует задерживанию воды в организме, что, в свою очередь, приводит к
- увеличивает риск сердечно-сосудистых заболеваний,
- повышает артериальное давление,
- вызывает болезнь почек,
- нарушает обмена кальция,
- способствует отложению солей, вызывая остеопороз, различные заболевания суставов.
- способствует увеличению массы тела за счёт задержки воды в организме, а также увеличивает аппетит.
34 слайд
Чаша весов до сих пор не склонилась однозначно ни в пользу сторонников употребления соли, ни в пользу сторонников поговорки ХХ века «Соль – это белый яд!».
Как говорил великий Парацельс ( знаменитый швейцарский алхимик, врач, естествоиспытатель эпохи Возраждения):« Всё есть яд и всё есть лекарство, и только доза отличает одно от другого».
Как видим и здесь, как и везде в жизни, важна МЕРА!Каждый вправе сам принимать решение. Здоровый организм думаю сам знает что и сколько ему надо. Поэтому, если у вас всё хорошо со здоровьем, ешьте соль в меру.
ОПРОС
35 слайд
Применение соли в быту и в промышленности.
Лишь 3% от всего количества добытой соли попадает в наши желудки.
3,5% применяют в стиральных и моечных машинах для снятия накипи. Соль также используют в красильных и кожевенных цехах, в комбикормовой промышленности и, как и прежде, в изготовлении рыбных и других консервов и солений.
36 слайд
Ещё 12% соли расходуется в коммунальном хозяйстве. Её разбрасывают на мостовых и тротуарах, чтобы таяли лёд и снег. Для окружающей среды, конечно вредно, что такое количество соли попадает в почву, реки и озёра. Поэтому соль разрешается использовать только городским службам, чтобы уменьшить количество несчастных случаев и автомобильных аварий в течение зимы.
Основная часть – 80% — соли используется в производстве соды, хлора, соляной кислоты. А ещё соль необходима при производстве стекла, алюминия, мыла, медикаментов, бумаги и многого другого.
37 слайд
Заключение
-В ходе своего исследования я узнал, что история соли насчитывает не одну тысячу лет, что она когда — то была предметом роскоши и из -за нее начинались войны.-Узнал, что раньше люди не знали, откуда она берется, как ее добывать, приписывали ей магические свойства — поэтому она была такой дорогой.-Выяснил, что в современном мире соль используется не только в пищевой промышленности, но и в разных других областях, имеет широкий спектр применения.-Убедился, что современный мир не приписывает соли «волшебных» свойств, но нуждается в ней не меньше наших предков.- Провел практические опыты и узнал о некоторых свойствах соли.
Соль и сахар. (3 класс)
1. Что у нас в солонке и сахарнице?
Выполнил ученик 3 «Н» класса
гимназии №1 им. академика Е.Ф. Карского г. Гродно
Ясюков Артем
2. Что у нас в солонке и сахарнице?
Цель исследования: углубить знания о соли и сахаре
Задачи:
1. Изучить исторические сведения о соли и сахаре.
2. Узнать о значении соли и сахара в жизни людей.
3. Найти интересные факты о соли и сахаре.
4. Изучить свойства соли и сахара и узнать
технологию их производства.
5. Провести опыты с поваренной солью и сахаром,
проанализировать полученные результаты.
3. Объекты исследования:
СОЛЬ
И
САХАР
4. Гипотезы:
1. Вода в море солёная, так как в ней растворено
много соли.
2. Солёная вода хуже замерзает, и, если
посыпать лёд солью, то он быстрее растает.
3. В морской воде легче плавать, так как она
солёная.
4. Если соль и сахар растворяются в воде, то,
испарив воду, я смогу опять получить соль и сахар.
5. Методы исследования
Для проверки своих гипотез я использовал
следующие методы исследования:
1. Поговорил со взрослыми.
2. Изучил научно-популярную литературу.
3. Почитал статьи в интернете.
4. Провёл собственные опыты.
Вот что я узнал…
6. Эта удивительная соль
Поваренная соль
(хлорид натрия)это минерал
В теле человека
около 300 г соли
7-8кг соли в год
Потребность 1015г в сутки (до
25г в жару)
500кг за всю
жизнь
7. Роль соли в жизни человека
1. Улучшает вкус пищи;
2. Консервирование, квашение, соление;
3. Участвует в физиологических процессах (водносолевой обмен, передача нервных импульсов,
сокращение мышц. Входит в состав крови,
лимфы, желудочного сока;
4. Используется при производстве бумаги, стекла,
мыла, ткани.
8. Как добывают соль
1. Каменная соль добывается в шахтах
2. Выварочная – из солевых рассолов
из минерала галита
3. Садочная – из морской воды в
специальных бассейнах
4. Самосадочная – из солёных озер
9. В нашей стране
3 крупнейших месторождения:
Мозырское, Старобинское, Давыдавское.
Запас 22 млрд тонн.
В Мировом океане 120 биллионов тонн соли.
Если всю её выпарить, она покроет земной шар
слоем 45 метров.
10. Сладкий песок
Сахар (сахароза)-это углевод, в организме
он распадается на глюкозу и фруктозу
1.Источник энергии для организма;
2.Стимулирует выработку гормона радости.
100г в сутки
Вред:
Родина Индия
Портятся зубы
Сахарный диабет
37кг в год
11. Как получают сахар из сахарной свеклы
12. Как получают сахар из сахарного тростника
13. В нашей стране
В Беларуси сахар получают из сахарной свеклы;
Работают 4 сахарных комбината;
В Гродненской области находится Скидельский
сахарный комбинат;
В год перерабатывается 600 тыс. тонн сахара.
14. Приступаю к опытам…
15. Выберите опыт
Опыт №4
Опыт №1
Растворимость
Влияние соли на
плотность воды
Опыт №2
Влияние соли на
таяние льда
Опыт №5
Кристаллизация
Опыт №3
Влияние соли на
замерзание воды
16. Опыт 1 «Растворимость»
Почему вода в море солёная, а чай сладкий?
Мне понадобится: 3 стакана тёплой воды, соль, сахар
1. В первый стакан я добавил чайную ложку соли, во второй –
чайную ложку сахара, третий оставил нетронутым, размешал.
Результат: через некоторое время все три стакана выглядели
одинаковою соль и сахар полностью растворились. В первом
стакане вода стала соленой на вкус, во втором – сладкой, в
третьем безвкусной.
Вывод 1: соль состоит из мелких прозрачных
кристалликов, хорошо растворяется в воде и делает
воду солёной.
Вывод 2:сахар также состоит из мелких прозрачных
кристалликов, хорошо растворяется в воде (лучше
горячей) и делает воду сладкой.
17. Опыт 2 «Влияние соли на таяние льда»
Зачем тротуары посыпают солью?
Мне потребуется: 2 стакана воды, соль и 2 кубика льда
1. В один из стаканов добавил столовую ложку соли и
размешал
2. Поместил по кубику льда в каждый стакан
Результат: лёд в стакане с солёной водой растаял намного
быстрее, чем в пресной воде.
Вывод: лёд в солёной воде тает гораздо быстрее,
поэтому если посыпать лёд солью, то он быстро
расплавит лёд
18. Опыт 3 «Влияние соли на замерзание воды»
Мне потребуется: 2 стакана воды, соль, пищевой
краситель жёлтого цвета, пластиковый контейнер из-под
яиц
1. В первый стакан я добавил столовую ложку соли,
пищевой краситель и перемешал до полного растворения
2. В первый ряд контейнера я вылил пресную воду, а во
второй – солёную воду с красителем. Поставил контейнер
в морозилку на ночь
Результат: пресная вода замёрзла, а солёная вода (с
красителем) осталась жидкой.
Вывод: соль в воде затрудняет процесс замерзания.
Чем больше соли в растворе, тем ниже температура
его замерзания.
19. Опыт 4 «Влияние соли на плотность воды»
Почему в море легче плавать, чем в реке или бассейне?
Мне потребуется: 2 стакана с водой, 2 сырых яйца, соль.
1. Во второй стакан я добавил столовую ложку соли и
перемешал до полного растворения
2. В оба стакана положил яйца
Результат: в первом стакане яйцо опустилось на дно, а во
втором осталось плавать на поверхности
Вывод: при добавлении соли плотность воды
увеличивается, поэтому легче плавать в море, чем в
реке или бассейне
20. Опыт 5 «Кристаллизация»
Смогу ли я получить соль и сахар из раствора?
Мне понадобится: 2 стакана с горячей водой, соль, сахар, 2 карандаша и 2
шерстяные нитки.
1. В первый стакан я постепенно насыпал соли и все время размешивал до
полного насыщения раствора.
2. Я привязал нитку к карандашу. Обмакнул её в соль (это затравка).
3. Опустил нитку с затравкой в соляной раствор и поставил на подоконник
4. То же самое проделал с сахаром. Раствор сахара получился густой.
Результат: на стенках первого стакана появился белый налёт из соли, а на
нитке образовалось целое ожерелье из мелких кристалликов соли
правильной кубической формы.
Во втором стакане часть сахара выпала на дно, а нитка оказалась вся
облеплена крупными кристаллами сахара.
Вывод: при испарении воды в солёном и сахарном
растворе происходит кристаллизация соли и сахара.
21. Выводы
1.
Сахар получают из сахарного тростника и сахарной
свеклы.
2. Соль добывают из-под земли, где она залегает в виде
минерала галита, а также из морской воды.
3. Соль и сахар играют важную роль в жизни людей. Это
отразилось в народном фольклоре. С ними связано
много примет, суеверий, пословиц, загадок и сказок.
4. Соль и сахар обладают удивительными свойствами,
это интересный материал для опытов.
22. В процессе
23. Интересное рядом
5.1: Сахар и соль — Chemistry LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \ (\ ce {NaCl} \), представляющей соотношение 1: 1 ионов натрия и хлорида. Он обычно используется в качестве приправы и пищевого консерванта. Соль можно создать, сложив вместе два очень реактивных элемента: металлический натрий (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
)
\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ label {eq1} \]
Элемент натрий (рисунок \ (\ PageIndex {1a} \)) является очень химически активным металлом; Если у вас есть возможность, он вступит в реакцию с потом на ваших руках и образует гидроксид натрия, который является очень едким веществом.Элемент хлор (рис. \ (\ PageIndex {1b} \)) — это бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитости. Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.
Рисунок \ (\ PageIndex {1} \): Натрий + Хлор = Хлорид натрия (a) Натрий — очень реактивный металл. (b) Хлор — это бледно-желтый ядовитый газ. (c) Вместе натрий и хлор образуют хлорид натрия — соль, которая необходима для нашего выживания.{-}} \) ионы необходимы для нормальной работы нервов и дыхания. Оба эти иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний из известных ароматизаторов и один из немногих камней, которые мы едим. Очевидно, что когда элементарный натрий и хлор объединяются (уравнение \ ref {eq1}), образующийся солевой продукт имеет радикально разные свойства (как физические, так и химические). Наблюдать за этой реакцией очень интересно (Видео \ (\ PageIndex {1} \)).
Видео \ (\ PageIndex {1} \): Приготовление столовой соли с использованием металлического натрия и газообразного хлора
Еще одно соединение — сахар, общее название сладких растворимых углеводов, многие из которых используются в пище.Сахар имеет химическую формулу \ (\ ce {C12h32O11} \) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
\ [\ ce {C12h32O11 (s) + тепло → 12C (s) + 11h3O (g)} \ label {eq2} \]
Видео \ (\ PageIndex {2} \): Научный эксперимент на кухне показывает, что происходит с молекулами сахара при их нагревании. Эксперимент не разочаровал!
Как и соль, сахар имеет радикально отличные свойства (как физические, так и химические) от составляющих его элементов.Это различие в свойствах составляющих элементов и соединений является главной особенностью химических реакций.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Свойства соли и сахара
Валерий Евлахов / iStock / GettyImages
Соль и сахар имеют много общих свойств.Оба имеют кристаллическую структуру, в некоторых формах не имеют цвета и запаха, и оба являются усилителями вкуса. Оба обладают противомикробными свойствами, которые с древних времен были признаны эффективными при лечении ран и болезней, а также при хранении продуктов. Производство как сахара, так и соли делает их крупными отраслями промышленности как в Соединенных Штатах, так и за рубежом, причем ежегодно производятся и потребляются миллионы тонн обоих продуктов.
Свойства соли
Соль представляет собой кристаллическую структуру, соединение элементов натрия и хлорида.Химически он присутствует во многих различных формах, помимо поваренной соли (NaCl). Он хорошо растворяется в воде и снижает температуру замерзания и повышает температуру кипения воды при растворении в ней. Соль бывает цвета от бесцветного до белого, серого и коричневого. Соль — самый распространенный минерал на Земле. На самом деле его так много, что его запасы считаются неисчерпаемыми. Мировое потребление, добываемое в месторождениях по всей Земле в виде галита или добываемое в Мировом океане и соленых озерах, оценивается в 240 миллионов тонн в год.
Свойства сахара
Сахар (сахароза), как и соль, имеет кристаллическую структуру. Он присутствует во всех фруктах и овощах в виде углеводов и вырабатывается во время фотосинтеза. Его собирают для производства сахара из сахарного тростника, сахарной свеклы, сорго и сока сахарного клена. Он также присутствует в меде. После сбора с растений его перерабатывают в разные окрашенные и ароматизированные сахара, которые являются как твердыми, так и жидкими, включая гранулированный, коричневый, порошкообразный, сырой, патока и золотистый сироп.Добавление сахара в жидкости снижает их температуру замерзания и повышает температуру кипения. Сахар использовался для лечения ран на протяжении тысячелетий. Ежегодно в мире мы потребляем 168 миллионов тонн сахара. Бразилия — крупнейший производитель сахара.
Типы соли
Существуют различные соли. Кошерная соль добывается и собирается в море, и обычно ее можно увидеть в виде скалистых кристаллов, которые отлично подходят для вяления мяса и приготовления пищи. Морская соль собирается на побережьях всего мира и используется в кулинарии.Морская соль в хлопьях, или Maldon, собирается вдоль побережья Англии в Эссексе и используется в кулинарии для придания продуктам характерного соленого вкуса. Fleur de Sel (по-французски «соляной цветок») собирается вручную в прибрежных песчаных прудах во Франции. Каменная соль добывается и не используется в пищу. Ценится за способность бороться с обледенением. Сбор соли, которую добывают и собирают из источников соленой воды, является самой чистой формой соли и используется в качестве консерванта.
Типы сахара
Сахар можно разделить на белый и коричневый, в зависимости от степени очистки и наличия патоки.Белый сахар доступен в виде столового сахара, сахарной пудры, мелко измельченной и просеянной с добавлением кукурузного крахмала для предотвращения слеживания, и фруктового сахара. Коричневый сахар бывает светлым или темным, причем Барбадос / Мускавадо имеет сильный аромат патоки, а Демерара и Турбинадо имеют более светлый цвет и вкус. Сахар также можно найти в жидкой форме после того, как он был растворен в воде для производства сахарных сиропов.
Различия между солью и сахаром
Хотя сахар и соль могут выглядеть одинаково, они совершенно разные.В природе встречаются различные сахара, но термин «сахар» обычно относится к сахарозе, которая представляет собой дисахарид, состоящий из глюкозы и фруктозы. Точно так же существует много различных видов соли, но слово «соль» обычно относится к поваренной соли, которая представляет собой решетчатую структуру из ионов натрия и хлорида, удерживаемых вместе водородными связями.
Химический состав
Химическая формула сахарозы — C12h32O11, что означает, что каждая молекула сахарозы имеет 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.Атомы происходят от одного мономера глюкозы и одного мономера фруктозы. Эти два моносахарида связаны гликозидной связью. Химическая формула поваренной соли, также известной как хлорид натрия, — NaCl. Зная, что хлорид натрия представляет собой соль, а не молекулу, подобную сахарозе, эта химическая формула говорит нам, что поваренная соль представляет собой решетчатую структуру, состоящую из катионов натрия и анионов хлорида, расположенных в соотношении 1: 1. Хлорид натрия удерживается водородными связями, а не молекулярными связями.
Источники
Основными источниками сахарозы являются сахарный тростник и сахарная свекла. Другие источники включают сахарный клен и сорго. Основными источниками поваренной соли являются рассол и природная каменная соль, также известная как галит. Соединенные Штаты — крупнейший производитель хлорида натрия.
Использует
И сахароза, и соль используются в пищу человеком. Мы запрограммированы на то, чтобы любить вкус сладкой и соленой пищи, потому что нашему организму для выживания необходимы сахар и соль.Как и большинство углеводов, сахароза содержит много энергии, хранящейся в ее молекулярных связях. Наши тела способны расщеплять сахарозу и высвобождать эту энергию. Когда мы едим соль, она естественным образом растворяется в натрии и хлориде. Хлорид натрия также может быть полезен в промышленности, поскольку для многих промышленных продуктов требуется хлор.
Влияние на здоровье
Хотя наш организм, безусловно, нуждается в сахаре и соли, слишком много хорошего может быть вредным для здоровья. Потребление слишком большого количества сахара может привести к кариесу, потому что бактерии, которые живут на поверхности наших зубов, метаболизируют сахар таким образом, чтобы производить кислый побочный продукт.Эта кислота разрушает эмаль в наших зубах. Поскольку сахароза содержит так много энергии, ее чрезмерное потребление может привести к увеличению веса. Чрезмерное потребление соли может привести к высокому кровяному давлению, задержке жидкости и определенным метаболическим нарушениям.
Использование растворения для идентификации неизвестного | Глава 5: Молекула воды и растворение
Проведите демонстрацию, чтобы показать, что разные вещества имеют разную растворимость.
Скажите студентам, что в этой демонстрации вы будете наливать в воду соль и сахар, чтобы узнать, что растворяется лучше.Чтобы сделать этот тест справедливым, вы будете использовать такое же количество (массу) соли и сахара, такое же количество воды при той же температуре и будете перемешивать их одинаковым образом в течение одного и того же периода времени.
Вопрос для расследования
Что лучше растворяется в воде, соль или сахар?
Материалы для демонстрации
- Весы с граммами
- Градуированный цилиндр
- Вода
- 2 прозрачных пластиковых стакана
- 2 маленьких пластиковых стаканчика
- Соль
- Сахар
Подготовка учителя
- Этикетка 1 прозрачная пластиковая чашка и 1 маленькая чашка соли.
- Пометьте другой прозрачный пластиковый стаканчик и еще один небольшой стакан сахаром.
- Отмерьте 5 граммов соли и 5 граммов сахара и поместите их в пару небольших чашек с этикетками.
- Налейте 5 мл воды комнатной температуры в две большие пустые чашки.
Процедура
- Одновременно насыпьте в воду соль и сахар в соответствующие чашки. Помешивайте каждую чашку одновременно и одинаково примерно 20 секунд.
- Обойдите комнату, чтобы показать студентам, сколько соли и сахара осталось на дне каждой чашки. Если у вас есть диапроектор, поместите чашки на проектор, чтобы весь класс мог сравнить то, что осталось нерастворенным в каждой чашке. Спросите студентов, кажется ли, что одно вещество растворяется лучше, чем другое.
- Снова покрутите 20 секунд и наблюдайте. Затем покрутите еще 20 секунд и попросите учеников сделать свои последние наблюдения.
- Медленно и осторожно перелейте раствор из каждой чашки обратно в пустую чашку с этикеткой.Старайтесь не допускать попадания нерастворенных кристаллов в эти чашки. Покажите студентам чашки, чтобы они могли сравнить количество оставшихся нерастворенных кристаллов.
Ожидаемые результаты
Растворится гораздо больше сахара, чем соли. Нерастворенной соли в чашках будет больше, чем сахара.
Примечание. Растворимость обычно измеряется количеством граммов вещества, растворяющегося в определенном объеме воды при данной температуре.В предыдущей демонстрации использовался этот традиционный способ измерения растворимости. Другой подход может заключаться в сравнении количества молекул или ионов каждого вещества, растворяющегося в воде. Для этого потребуется способ «подсчитать» молекулы или ионы в каждом веществе.
Обсудите результаты демонстрации и представьте идею о том, что каждое вещество имеет свою характерную растворимость.
Спросите студентов:
- На дне чашки осталось больше соли или сахара?
- На дне чашки осталось еще нерастворенной соли.
- Что лучше растворяется, соль или сахар?
- Так как на дне чашки сахара почти не было, значит, больше его растворилось в воде.
- Как вы думаете, мы бы получили аналогичные результаты, если бы попробовали снова растворить соль и сахар?
- Мы, вероятно, получили бы аналогичные результаты, потому что количество растворенной соли или сахара имеет какое-то отношение к тому, как каждое вещество взаимодействует с водой.
- Насколько хорошо вещество растворяется в воде, называется его растворимостью. Ожидаете ли вы, что разные вещества будут иметь одинаковую или разную растворимость?
- Каждое вещество состоит из молекул определенного типа, которые по-разному взаимодействуют с водой. Разные вещества должны иметь разную растворимость.
Скажите студентам, что они будут сравнивать растворимость четырех различных бытовых кристаллов — соли (хлорид натрия), английской соли (сульфат магния), глутамата натрия (глутамата натрия) и сахара (сахарозы).Объясните, что они также будут проверять неизвестный кристалл, который по химическому составу совпадает с одним из других кристаллов. Поскольку он химически такой же, он должен иметь такую же растворимость, что и один из кристаллов, которые они будут тестировать. К концу упражнения учащиеся должны уметь идентифицировать неизвестное.
Раздайте каждому учащемуся рабочий лист.
Учащиеся запишут свои наблюдения и ответят на вопросы о деятельности в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально, в зависимости от ваших инструкций.Посмотрите на версию листа деятельности для учителя, чтобы найти вопросы и ответы.
Попросите учащихся попытаться определить неизвестное по внешнему виду.
Сообщите учащимся, что перед проведением теста на растворимость они внимательно изучат кристаллы, чтобы увидеть, смогут ли они получить некоторые подсказки о личности неизвестного только по внешнему виду. Попросите учащихся выполнить описанную ниже процедуру и записать свои наблюдения о кристаллах на листе занятий.Сообщите учащимся, что они могут смотреть на кристаллы и дотрагиваться до них, но не пробовать их.
Вопрос для расследования
Можете ли вы идентифицировать неизвестный кристалл по внешнему виду?
материалов для каждой группы
- Черная плотная бумага
- Малярная лента
- Ручка или перманентный маркер
- 5 маленьких пластиковых стаканчиков
- Соль
- Соль Эпсома
- MSG
- Сахар
- Неизвестно (Грубая кошерная соль)
- Лупа
Подготовка учителя
- Пометьте 5 маленьких пластиковых стаканчиков солью, английской солью, глутаматом натрия, сахаром и неизвестным.
- Добавьте не менее двух чайных ложек каждого кристалла в чашку с этикеткой.
Процедура
- Используйте малярную ленту и ручку, чтобы пометить четыре угла куска черной плотной бумаги «Сахар», «Соль», «Английская соль» и «глутамат натрия». Назовите центр Неизвестным.
- Поместите небольшие образцы английской соли, поваренной соли, сахара, глутамата натрия и других веществ на помеченные участки плотной бумаги.
Используйте лупу, чтобы внимательно рассмотреть каждый тип кристалла.
Ожидаемые результаты
Все кристаллы белые, но некоторые из них более прозрачны или непрозрачны, чем другие. Каждый тип кристалла также имеет разный размер и форму.
Обсудите наблюдения студентов и попросите группы спланировать, как они могут провести тест на растворимость, чтобы идентифицировать неизвестное.
Спросите студентов:
- Что вы замечаете в каждом кристалле? Включите любые сходства или различия, которые вы заметили между ними.
- Учащиеся должны описать физические свойства, такие как размер, форма, цвет и текстура. Они также должны указать, являются ли кристаллы блестящими, тусклыми, прозрачными или непрозрачными.
- Можете ли вы определить неизвестное?
- У студентов не должно быть достаточно доказательств, чтобы правильно идентифицировать неизвестное на данном этапе. Пока не говорите студентам, что неизвестное — это грубая кошерная соль. Они обнаружат это к концу урока.
Объясните: одного взгляда на кристаллы недостаточно, чтобы определить неизвестное.Но тест на растворимость предоставит полезную информацию, если он хорошо контролирует переменные. Попросите учащихся подумать о том, как они могут провести тест на растворимость соли, английской соли, глутамата натрия, сахара и других неизвестных веществ. Попросите учащихся поработать в группах, чтобы обсудить свои идеи и записать простой план в свой рабочий лист.
Предложите студенческим группам поделиться своими идеями относительно теста на растворимость и подумать, как каждый план управляет переменными.
По мере того, как каждая группа представляет свои планы, попросите класс определить, как каждый тест на растворимость контролирует переменные.Все группы, вероятно, предложат использовать один и тот же объем воды при одинаковой температуре в контейнерах одного типа и одинаковое количество каждого кристалла. Но могут быть некоторые разногласия в том, как измерить одинаковое количество каждого кристалла. Некоторые студенты могут предложить им использовать одинаковый объем каждого кристалла, в то время как другие могут предложить одинаковую массу каждого кристалла. Если никто не предлагает использовать массу, объясните, что в демонстрации вы использовали равную массу соли и сахара — по 5 г каждого.
Спросите студентов:
- Что лучше: использовать один и тот же объем (например, чайную ложку или 5 мл) или одинаковую массу (например, 5 г) каждого кристалла? Почему?
- Скажите студентам, что вы проведете демонстрацию, которая поможет им понять, следует ли им использовать измеритель объема или массы, чтобы они могли растворить одинаковое количество каждого кристалла в воде.
Проведите демонстрацию, чтобы показать, что при измерении равных количеств для теста на растворимость масса лучше, чем объем.
Вопрос для расследования
Что лучше — измерять одинаковый объем или одинаковую массу каждого кристалла при проведении теста на растворимость для определения неизвестного?
Материалы для демонстрации
- 2 прозрачных пластиковых стакана
- Зерновые шарики (Kix работают хорошо)
- Пластиковый пакет с застежкой-молнией (для хранения кварт)
- Весы
Подготовка учителя
Полностью наполните две прозрачные пластиковые чашки шариками из хлопьев.Обе чашки должны быть идентичными и содержать одинаковое количество шариков из хлопьев. Проверьте эти чашки на весах, чтобы убедиться, что они имеют одинаковую массу.
Процедура
- Поднимите чашки, наполненные хлопьями, так, чтобы учащиеся могли видеть, что в них обоих примерно одинаковое количество хлопьев.
- Поместите чашки в центр каждого конца простых весов, чтобы доказать своим ученикам, что оба содержат одинаковое количество хлопьев.
Попросите учащихся сделать прогноз:
- Я собираюсь раздавить хлопья в одной чашке. Ожидаете ли вы, что высота зерна в этой чашке будет выше, ниже или такая же, как в другой чашке?
- Студенты, вероятно, скажут, что измельченная крупа не займет столько места в чашке.
- Перелейте хлопья из одной из чашек в пригодный для хранения пластиковый пакет с застежкой-молнией.Выпустите как можно больше воздуха и закройте пакет.
- Поставьте пакет на землю и хорошенько раздавите хлопья ногой. После того, как крупа будет измельчена, откройте пакет и вылейте измельченную крупу обратно в чашку.
Спросите студентов:
- В какой чашке больше хлопьев?
- Учащиеся поймут, что обе чашки содержат одинаковое количество хлопьев, но у некоторых может возникнуть желание сказать, что чашка с шариками из хлопьев содержит больше хлопьев.
- Были ли добавлены или удалены какие-либо злаки из любой чашки?
- Укажите, что даже несмотря на то, что измельченный злак занимает меньше места, это все равно то же количество вещества (злака), которое было в чашке до того, как оно было раздавлено.
- Как вы могли доказать, что эти две чашки содержат одинаковое количество вещества?
- Студенты должны предложить поставить чашки на весы, как вы это делали раньше.
Поставьте чашки на противоположные концы весов, чтобы убедиться, что масса хлопьев в каждой чашке одинакова.
Ожидаемые результаты
Даже если объем зерновых шариков больше, чем объем измельченных зерновых шариков, чашки будут уравновешиваться на весах.
Свяжите наблюдения студентов во время демонстрации с пятью кристаллами, которые они растворят в воде.
Предложите студентам представить, что большие шарики злаков представляют собой большие кристаллы, а измельченные злаки — маленькие кристаллы.Объясните, что размер и форма кристаллов могут быть разными, но весы показывают, что их масса одинакова. Напомните учащимся, что масса — это мера количества вещества. Поскольку большие и маленькие кристаллы (крупы) имеют одинаковую массу, обе чашки содержат одинаковое количество вещества. Сделайте вывод, что для измерения равных количеств лучше измерять массу веществ, чем объем.
Спросите студентов:
- В тесте на растворимость, который вы будете выполнять, вам нужно будет отмерить равные количества пяти кристаллов.Как вы будете измерять равные суммы?
- После этой демонстрации учащиеся должны понять, что измерение массы для теста на растворимость лучше, чем измерение по объему.
Основываясь на том, что студенты наблюдали, когда они внимательно смотрели на разные кристаллы, а также на доказательствах из демонстрации, они должны понять, что разные кристаллы имеют немного разные размер или форму. Это приведет к тому, что они будут упаковываться в ложку по-разному, так что в одной ложке будет больше гранул, чем в другой.
Примечание. Следующее объяснение может быть слишком сложным для учащихся, но оно включено здесь, чтобы вы могли подумать и обсудить с учащимися, если вы считаете, что это уместно. Даже если бы гранулы соли и сахара были точно такого же размера и формы и точно так же были упакованы в ложку, все равно было бы не лучшим решением использовать чайную ложку для измерения равных количеств для теста растворимости. Вот почему: соль примерно на 25% плотнее сахара. Поэтому чайная ложка соли весит больше чайной ложки сахара почти на 25%.Ваш тест на растворение не будет точным, потому что вы начнете с большей массы соли, чем сахара.
Попросите учащихся взвесить пять граммов каждого кристалла для теста на растворимость.
материалов для каждой группы
- Остаток в граммах
- 5 маленьких пластиковых стаканчиков
- 5 прозрачных пластиковых стаканчиков
- Малярная лента и ручка или перманентный маркер
- Соль
- Соль Эпсома
- MSG
- Сахар
- Неизвестно (грубая кошерная соль)
- Вода
Процедура
- Используйте малярную ленту и ручку, чтобы пометить 5 маленьких пластиковых стаканчиков «Соль», «Английская соль», «глутамат натрия», «Сахар» и «Неизвестно».
- Пометьте 5 прозрачных пластиковых стаканчиков большего размера таким же образом.
- Взвесьте 5 г каждого кристалла и поместите каждый в свою маленькую чашку с этикеткой.
Если у вас недостаточно времени, вы можете остановиться на этом и попросить учеников сохранить кристаллы и провести тест в другой день. Если у вас все же есть время провести тест, выполните следующие действия.
Попросите учащихся растворить четыре известных кристалла и неизвестное в воде комнатной температуры.
Количество воды, используемой в процедуре, является определенным, и его следует использовать, потому что это дает четкие результаты. Помешайте кристаллы в воде, чтобы они растворились. Ведите класс так, чтобы все группы одновременно выливали свои образцы кристаллов в воду. Также скажите студентам, когда нужно покрутить воду и кристаллы, а когда остановиться и понаблюдать. Будет три 20-секундных интервала.
Вопрос для расследования
Можно ли определить неизвестное с помощью теста на растворимость?
материалов для каждой группы
- Градуированный цилиндр
- По 5 г соли, английской соли, глутамата натрия, сахара и неизвестного вещества (грубая кошерная соль)
- 5 прозрачных пластиковых стаканчиков
- Вода
Процедура
- С помощью градуированного цилиндра добавьте 5 мл воды комнатной температуры в каждый пустой прозрачный пластиковый стаканчик.
- Совместите каждую пару чашек с этикетками так, чтобы каждая чашка кристалла находилась рядом с соответствующей чашкой с водой.
Когда ваш учитель скажет вам, поработайте со своими партнерами по лаборатории, чтобы одновременно вылить взвешенное количество каждого кристалла в чашку с водой.
- С помощью ваших партнеров по лаборатории взбалтывайте каждую чашку одновременно и одним и тем же способом в течение примерно 20 секунд и наблюдайте. Снова покрутите еще 20 секунд и наблюдайте.Снова покрутите в течение последних 20 секунд и сделайте последние наблюдения.
Медленно и осторожно перелейте раствор из каждой чашки обратно в небольшую пустую чашку. Старайтесь не допускать попадания нерастворенных кристаллов в маленькую чашку. Сравните количество кристаллов, оставшихся в каждой прозрачной пластиковой чашке.
Ожидаемые результаты
Результаты могут отличаться. Однако больше всего должен раствориться сахар, а за ним — английская соль. Кажется, что глутамат натрия растворяет немного больше, чем соль и неизвестное.Соль и неизвестное должны растворяться в одинаковой степени.
Обсудите наблюдения студентов и возможную личность неизвестного.
Спросите студентов:
- Есть ли какие-нибудь кристаллы, которые можно исключить как неизвестные?
- Основываясь на своих наблюдениях, студенты, скорее всего, исключат сахар и английскую соль как неизвестные.
- В какой чашке или чашках осталось примерно такое же количество нерастворенных кристаллов, как и в неизвестном?
- Неизвестно, соль и глутамат натрия, похоже, содержат одинаковое количество кристаллов, которые не растворяются.
- Как вы думаете, что такое неизвестное?
- Студенты могут заключить, что неизвестное — это соль, но в некоторых случаях могут подумать, что это также может быть глутамат натрия.
- Какие доказательства у вас есть в поддержку вашего вывода?
- Учащиеся должны указать количество кристаллов, оставшихся в каждой чашке, как доказательство того, что неизвестным является соль или глутамат натрия.
- Если кто-то в классе пришел к совершенно другому выводу и имел совсем другие наблюдения, что, по вашему мнению, могло привести к этим различиям?
- Учащиеся должны указать возможные ошибки при взвешивании кристаллов, при измерении количества использованной воды, при перемешивании другим способом или случайном переливании кристаллов в неправильные чашки.
Сообщите учащимся, что их тест показал, что разные вещества имеют разную растворимость. На самом деле растворимость — это характерное свойство вещества. Объясните учащимся, что этот тип теста на растворимость может помочь удалить некоторые кристаллы, но может быть недостаточно точным, чтобы идентифицировать неизвестное. Поскольку у них могут быть некоторые сомнения в идентичности неизвестного, учащиеся проведут тест на перекристаллизацию с кристаллическими растворами, приготовленными во время теста на растворимость.
Попросите учащихся провести еще один тест, чтобы подтвердить личность неизвестного.
Объясните студентам, что они могли бы получить больше подсказок о личности неизвестного, если они позволят растворам растворенных кристаллов перекристаллизоваться. Если позволить веществам перекристаллизоваться из их растворов, могут появиться сходства и различия, которые не так легко увидеть в исходных кристаллах.
Примечания по материалам: Тест на перекристаллизацию следует проводить сразу после теста на растворимость с растворами, приготовленными во время теста на растворимость.Студенты будут повторно использовать большие прозрачные пластиковые стаканчики и растворы из растворяющей части упражнения в соответствии с процедурой.
Вопрос для расследования
Помогут ли кристаллы, образующиеся при испарении растворов, идентифицировать неизвестное?
материалов для каждой группы
- Пять решений, каждое в небольшом пластиковом стаканчике
- 5 прозрачных пластиковых стаканчиков из активности
- Лупа
- Вода
- Бумажное полотенце
Процедура
- Промойте каждую большую прозрачную пластиковую чашку водой, чтобы удалить оставшиеся кристаллы.Просушите каждый бумажным полотенцем.
- Осторожно перелейте раствор из каждой маленькой чашки в соответствующую большую прозрачную пластиковую чашку.
- Дайте растворам оставаться на ночь.
- На следующий день с помощью лупы внимательно осмотрите кристаллы как сверху, так и снизу чашки.
Ожидаемые результаты
Соль и неизвестное выглядят очень похоже. Английская соль, глутамат натрия и сахар отличаются друг от друга и отличаются от соли и неизвестного.Сахар, возможно, еще не перекристаллизовался, но по прошествии большего времени он образует кристаллы.
Спросите студентов:
- Опишите кристаллы в каждой чашке. Как вы думаете, в чем заключается личность неизвестного?
- Студенты должны обсудить форму и размер различных кристаллов и заметить, что соль и неизвестное выглядят очень похоже.
Скажите студентам, что неизвестное — это грубая кошерная соль. По химическому составу она такая же, как обычная соль, но процесс приготовления обычной поваренной соли и кошерной соли отличается, и поэтому они выглядят по-разному.
Покажите молекулярные модели соли, английской соли, сахара и глутамата натрия.
Спроецируйте изображение «Все четыре кристалла».
Объясните: поскольку эти вещества состоят из разных атомов и ионов, связанных между собой по-разному, они по-разному взаимодействуют с водой, придавая каждому из них собственную характерную растворимость.
- Соль
- Напомните студентам, что хлорид натрия — это ионное соединение.Есть положительный ион натрия (Na + ) и отрицательный ион хлорида (Cl — ). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя соль.
- Соль Эпсома
- Скажите студентам, что соль Эпсома — это ионное соединение. Есть положительный ион магния (Mg 2+ ) и отрицательный сульфат-ион (SO 4 2-). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя английскую соль.
- MSG
- MSG состоит из положительного иона натрия (Na + ) и отрицательного иона глутамата, который имеет молекулярную формулу (C 5 H 8 NO 4 — ).Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя глутамат натрия.
- Сахар
- Сахароза не является ионным соединением. Сахароза имеет много связей O – H, которые придают ей положительные и отрицательные полярные области. Эти области притягивают другие молекулы сахарозы и удерживают их вместе в кристалле. Эти полярные области взаимодействуют с водой и заставляют целые молекулы сахарозы отделяться друг от друга и растворяться.
Помогите студентам рассмотреть сходства и различия в способах растворения соли и сахара в воде.
Сообщите студентам, что в зависимости от растворяемого вещества ионы отделяются друг от друга или молекулы отделяются друг от друга. Соль и сахар — типичные примеры растворения обоих типов твердых веществ.
Спроецируйте изображение «Вода растворяет соль».
Спросите студентов:
- Почему при растворении соли молекулы воды притягиваются к ионам натрия и хлора?
- Хлорид натрия — это ионное соединение с положительным ионом натрия (Na + ) и отрицательным ионом хлорида (Cl — ).Полярная вода взаимодействует с этими противоположно заряженными ионами, заставляя ее растворяться.
Спроецируйте изображение «Вода растворяет сахар».
Спросите студентов:
- Когда сахар растворяется, почему молекулы воды притягиваются к молекулам сахарозы?
- Сахароза имеет много связей O – H, которые придают ей положительные и отрицательные полярные области. Эти области притягивают другие молекулы сахарозы и удерживают их вместе в кристалле. Эти полярные области взаимодействуют с водой и заставляют целые молекулы сахарозы отделяться друг от друга и растворяться.
- В чем сходство и различие между водорастворимой солью и водорастворяющим сахаром?
- Ионы натрия и хлора отделяются друг от друга и по мере растворения окружаются молекулами воды. Целые молекулы сахарозы отделены от других молекул сахарозы. Ковалентные связи, удерживающие атомы в молекуле сахарозы, не распадаются.
Как разделить соль и сахар
Разделите смесь соли и сахара, используя различия между двумя соединениями, такие как растворимость при кипении и температура кипения.(фото: C Drying)
Если вы рассыпаете на кухне вместе сахар и соль, не стоит тратить силы на их разделение. Но вы можете разделить смеси соли и сахара в качестве научного проекта, чтобы узнать о химических и физических свойствах и химии разделения. Вот три способа разделить соль и сахар, плюс еще один, который кажется, что он должен работать, но на самом деле не работает.
Разделение соли и сахара по растворимости
И соль, и сахар растворяются в воде. Однако сахар (сахароза) намного лучше растворяется в спирте, чем соль (хлорид натрия).Практически соль не растворяется в спирте. Растворимость соли составляет 14 г / кг в метаноле (25 ° C или 77 ° F) и 0,65 г / кг в этаноле (25 ° C или 77 ° F). Если вы когда-нибудь планируете есть соль или сахар, используйте этанол для разделения компонентов смеси, потому что метанол токсичен. Если ваша цель — эффективность, используйте метанол, потому что вам понадобится меньше его, чтобы растворить соль, оставив сахар. Выпарить или вскипятить спирт, чтобы восстановить соль.
Имейте в виду, что этот метод не сработает, если вы не употребляете абсолютный алкоголь.Если вы попытаетесь разделить сахар и соль с помощью 50% спирта, вероятно, в жидкости будет достаточно воды, чтобы растворить оба компонента смеси!
Разделить соль и сахар по плотности
Плотность чистой поваренной соли (NaCl) составляет 2,17 г / см 3 , а плотность чистого столового сахара (сахароза) составляет 1,587 г / см 3 . Итак, чтобы отделить чистые твердые частицы, вы можете встряхнуть смесь. Более тяжелая соль опускается на дно емкости. Хотя материал наверху контейнера будет почти чистым сахаром, а внизу — почти чистой солью, может быть трудно сказать, где заканчивается одно соединение и начинается другое.Добиться 100% разделения только этим методом не получится.
Разделение соли и сахара с помощью формы кристалла
Если у вас есть бесконечное время и терпение, вы можете разделить сахар и соль в смеси с помощью лупы и пинцета. Кристаллы соли имеют кубическую форму, а кристаллы сахара — моноклинные шестиугольники.
Как насчет использования точки плавления?
Сахар — ковалентное соединение, а соль — ионное соединение. Итак, вы можете предсказать, что сможете разделить сахар и соль, используя температуру плавления.Температура плавления соли очень высока (800,7 ° C или 1473,3 ° F). Проблема в том, что сахар разлагается при 186 ° C (367 ° F), а не тает. Если вы попытаетесь разделить компоненты смеси с помощью тепла, все, что вы получите, — это сожженный сахар (углерод) и соль. Сохраните этот метод отделения соли от песка (хотя есть варианты получше).
Ссылки
- Берджесс, Дж. (1978). Ионы металлов в растворе . Нью-Йорк: Эллис Хорвуд. ISBN 978-0-85312-027-8.
- Рамбл, Джон (изд.) (2019). CRC Справочник по химии и физике (100-е изд.). CRC Press. ISBN: 978-1138367296.
- Westphal, Gisbert et al. (2002) «Хлорид натрия» в энциклопедии промышленной химии Ульмана . Wiley-VCH, Weinheim. DOI: 10.1002 / 14356007.a24_317.pub4
- Wilson, Ian D .; Адлард, Эдвард Р .; Кук, Майкл; и др., ред. (2000). Энциклопедия науки о разделении . Сан-Диего: Academic Press. ISBN 978-0-12-226770-3.
Соль или сахар: что быстрее растворяется в разных жидкостях?
Растворы — это не что иное, как смеси различных соединений или элементов.Вы сталкиваетесь с решениями каждый день, даже не осознавая этого.
Даже воздух, которым вы дышите и который содержит воду, представляет собой раствор жидкости и газа. Если вы сегодня выпили газировку, вы на самом деле выпили раствор газа, растворенного в ароматизированной воде. Если вы носите браслет из стерлингового серебра, вы носите раствор двух металлов.
В этом эксперименте вы будете работать с жидким раствором, который является одним из трех типов растворов. Остальные типы — это газообразные растворы и твердые растворы.
Итак, в чем, похоже, проблема?
При смешивании жидкости с газом образуется другой тип раствора, называемый газообразным раствором. Примером такого типа раствора является влажность. Влажность — это вода (жидкость), растворенная в воздухе (газ).
В твердом растворе , таком как серебро, медь, нагретая при высоких температурах, смешивается с серебром, которое также нагревается до плавления. Медь — это растворенное вещество , которое будет растворяться в растворителе .Серебро — растворитель.
Тип раствора определяется состоянием вещества растворителя. Если растворяющееся вещество является жидкостью, раствор называется жидким раствором. Если растворителем является газ, раствор называется газообразным раствором. И вы правильно угадали: твердый растворитель образует твердый раствор.
Есть несколько факторов, которые обычно увеличивают количество растворенного вещества, которое может быть растворено. Например, если вы хотите растворить больше сахара в том же количестве воды, вы можете нагреть воду.Вы также можете измельчить сахар на более мелкие частицы, чтобы увеличить его площадь поверхности, или вы можете перемешать смесь.
За те годы, что вы использовали соль и сахар в своих продуктах, вы, вероятно, заметили, что каждый кусочек соли, который на самом деле представляет собой кристалл, немного меньше, чем каждый кусок сахара, который также является кристаллом. .
Проблема, которую вы попытаетесь решить в этом эксперименте, заключается в том, растворяется ли сахар или соль быстрее при смешивании с различными жидкостями. Влияет ли размер кусочков на то, как быстро они смешиваются с жидкостью?
Когда вы растворяете сахар или соль в жидкости, скажем, в воде, происходит то, что молекулы сахара перемещаются, чтобы поместиться между молекулами воды в стакане или химическом стакане.На рисунке ниже показано, как различные молекулы расположены в контейнере.
Растворенное вещество, такое как сахар, растворенное в растворителе, таком как вода, дает жидкий раствор.
В ходе эксперимента вы увидите, как молекулы соли и сахара перемещаются в разных жидкостях и растворяются с разной скоростью.
Название этого раздела: «Соль или сахар: что быстрее растворяется в разных жидкостях?» может служить названием вашего проекта, если хотите. Вы также можете рассмотреть одно из следующих названий для своего проекта:
- The Great Salt vs.Конкурс на растворение сахара
- Использование соли и сахара для изучения того, как растворяются вещества
Какое бы название вы ни выбрали, это нормально. Давайте теперь посмотрим, почему этот проект позволяет вам с пользой использовать ваше время.
В чем смысл?
И когда избыточное растворенное вещество растворяется при нагревании раствора, считается, что это перенасыщенный .
Суть этого эксперимента, помимо изучения того, растворяется ли соль или сахар быстрее в различных жидкостях, состоит в том, чтобы узнать, как молекулы взаимодействуют в растворе.
Как вы видели на предыдущем рисунке, молекулы воды занимают большую часть места в контейнере. Но все же есть свободное пространство, в котором могут поместиться молекулы сахара или соли. В ходе эксперимента вы узнаете, насколько быстро молекулы сахара помещаются в эти пространства по сравнению с частицами соли.
Знание этого поможет вам лучше понять процесс растворения вещества.
Контролем в вашем эксперименте будет вода. Другие жидкости, в которых вы растворяете соль и сахар, будут переменными.
| Контроли: | Растворитель-вода |
| Растворимые вещества-сахар, соль | |
| Переменные: | Пять разных прозрачных жидкостей (могут быть окрашены) |
. Поэкспериментируйте: очень важно, чтобы все жидкости, которые вы используете, были одной температуры. Вы уже узнали, что сахар растворяется быстрее в теплой жидкости, чем в холодной, поэтому вы знаете, что это не будет точным экспериментом, если некоторые из используемых вами жидкостей будут теплыми, а некоторые — холодными.Температура жидкости станет переменной.
Следовательно, все жидкости, которые вы используете, включая воду, должны иметь комнатную температуру. Если вы обычно храните их в холодильнике, не забудьте оставить их на столе на ночь, пока они не достигнут одинаковой температуры.
Чтобы дать вам немного больше гибкости при проведении эксперимента, вы можете выбрать жидкости, в которых вы будете растворять сахар и соль. Нет смысла идти и покупать дополнительные жидкости, если у вас уже есть то, что вам нужно.
Просто убедитесь, что вы выбираете жидкости, которые отличаются друг от друга по вкусу, цвету, запаху и назначению. Вам также нужно будет выбрать те, которые позволят вам наблюдать за растворением соли и сахара. Например, если вы используете молоко или апельсиновый сок, вы не сможете увидеть растворение соли и сахара. Вот несколько предложений по жидкостям:
- Белый уксус
- Клубная газировка
- Имбирный эль
- Очиститель для стекол (например, Windex)
- Лимонад
- Чай или холодный чай (каждый при комнатной температуре)
- Яблочный сок
- Медицинский спирт
Все это обычно можно найти дома, что, возможно, избавит вас от поездки в магазин.
Как вы думаете, что произойдет?
Теперь, когда вы знаете, как образуются растворы и некоторые факторы, которые будут влиять на скорость растворения сахара и соли, которые вы будете использовать, вы сможете точно догадаться, какой из них будет растворяться быстрее. .
Хотя вы не узнаете до окончания эксперимента, повлияют ли свойства различных жидкостей, которые вы выбираете, на скорость растворения соли и сахара, вы знаете, что кристаллы соли обычно меньше кристаллов сахара.И вы знаете, что температура жидкостей не будет иметь значения в вашем эксперименте.
Просто попробуйте использовать свой прошлый опыт, информацию, которую вы читали ранее в этом разделе, и свой здравый смысл, чтобы придумать обоснованную гипотезу.
Помните, что ваша гипотеза должна быть сформулирована как объективное предложение, а не как вопрос. Итак, догадайтесь, соль или сахар растворится быстрее, и давайте приступим к эксперименту.
Материалы, которые вам понадобятся для этого проекта
Некоторые жидкости, предлагаемые для использования в этом эксперименте, — это белый уксус, газированная вода, имбирный эль, очиститель для стекол, медицинский спирт, яблочный сок, лимонад и чай.Если вы хотите заменить одну или несколько предложенных жидкостей другой, ничего страшного. Только убедитесь, что все жидкости прозрачные и комнатной температуры.
Указанного ниже количества материалов достаточно, чтобы вы могли провести эксперимент трижды с каждой жидкостью. Вам понадобится:
- 12 прозрачных пластиковых стаканчиков (10 унций [300 мл])
- Один перманентный маркер
- Одна мерная ложка (1 чайная ложка) (5,0 мл)
- Одна ( 1 2 чайная ложка) ) (2.5 мл) мерная ложка
- Одна (1 чашка) (240 мл) мерная чашка
- 8 чайных ложек (40 мл) соли, разделенных на 16 ( 1 2 чайных ложки) порций
- 8 чайных ложек (40 мл) сахара , разделенных на 16 ( 1 2 чайных ложек) порций
- 48 унций (1440 мл) воды при комнатной температуре
- 24 унции (720 мл) каждой из пяти различных прозрачных жидкостей, все при комнатной температуре
- Одни часы или часы с секундной стрелкой
- Одна прозрачная пластиковая чашка, содержащая восемь жидких унций (240 мл) воды комнатной температуры
Не забудьте убедиться, что все жидкости имеют комнатную температуру.
Проведение эксперимента
Когда вы соберете все свои материалы, вы будете готовы начать свой эксперимент. Просто выполните следующие действия:
- Перманентным маркером напишите «соль» на шести пластиковых стаканчиках и «сахар» на шести других.
- Поместите 1 / 2 чайную ложку (2,5 мл) соли в каждую из шести чашек с надписью «соль».
- Положите 1 / 2 чайную ложку (2,5 мл) сахара в каждую из шести чашек с надписью «сахар».»
- Добавьте 8 унций (240 мл) воды в одну чашку, содержащую соль, и одну чашку, содержащую сахар. Немедленно запишите время, когда была добавлена вода, на диаграмме данных, аналогичной той, которая показана в следующем разделе« Отслеживание вашего эксперимента ».
- Наблюдайте за растворенными веществами (солью и сахаром), растворяющимися в растворителе (воде). Запишите на диаграмме данных время, когда вам кажется, что каждое растворенное вещество полностью растворилось. Это время, вероятно, не будет то же
- Рассчитайте время, в течение которого произошло растворение.Возьмите время, когда вода была добавлена в чашки и началось растворение, и вычтите время, когда растворение закончилось. Это дает вам общее количество минут, необходимое для полного растворения соли и сахара в жидкости.
- Повторите шаги с 4 по 6, используя разные жидкости вместо воды.
- Вымойте, ополосните и тщательно высушите каждую из 12 чашек.
- Повторите шаги 2–8 еще два раза, всего три попытки для каждой из шести жидкостей.
- Рассчитайте среднее время растворения соли и сахара в каждой из шести жидкостей.
Помните, что, чтобы найти среднее время, необходимое для растворения соли и сахара в каждой жидкости, вы складываете три раза, записанные для каждой из них, а затем делите их на три. Число, которое вы получите, когда разделите время, — это среднее время.
Отслеживание своего эксперимента
Используйте эту таблицу, чтобы записать время, необходимое для растворения сахара и соли.
Таблицы, подобные приведенной ниже, можно использовать для записи информации по каждому растворителю. Просто измените названия растворителей в заголовке.
Обязательно записывайте время по мере продвижения. Не полагайтесь на свою память, чтобы записать их позже. К тому времени, как вы закончите эксперимент, у вас будет много цифр.
Собираем все вместе
Что вы заметили о скорости растворения соли и сахара? Вы доказали, что ваша гипотеза верна? Или неверно? Можете ли вы обнаружить какой-либо узор при добавлении соли и сахара в различные жидкости? Было ли очевидно, что в некоторых жидкостях соль растворяется лучше и быстрее, чем сахар? Можете ли вы вспомнить причины, по которым это могло произойти?
Считаете ли вы, что химическая природа растворенного вещества и растворителя повлияла на скорость растворения? Используйте информацию, которую вы собрали при изучении своей темы, чтобы ответить на эти вопросы.
Чем больше вы знаете о своем проекте, тем лучше вы сможете правильно проанализировать свои данные и прийти к обоснованному заключению.
Дальнейшие исследования
Как упоминалось ранее, на растворимость твердых растворенных веществ влияют следующие факторы:
- Повышение или понижение температуры растворителя
- Увеличение площади поверхности растворенного вещества
- Перемешивание
Если вы хотите Сделав еще один-два шага в этом проекте, вы могли бы разработать эксперимент, который проверил бы одну или, возможно, все эти переменные.
Вы можете легко сравнить скорость растворения кубиков сахара в жидкости со скоростью растворения сахарного песка.
Или вы можете использовать то же растворенное вещество, скажем, сахар, и проверить, вызывает ли перемешивание раствор его более быстрое растворение. Нагревание и охлаждение растворителя при добавлении того же растворенного вещества также было бы возможностью для дальнейших экспериментов.
Если вам любопытно и вы готовы поэкспериментировать, вы, вероятно, сможете придумать множество вариантов этого проекта. А поскольку для эксперимента требуются только обычные и недорогие материалы, вы должны иметь возможность экспериментировать, сколько душе угодно.
Свойства соли — The Salt Association
Соль — химическое соединение с рядом интересных свойств:
- Кристаллы или белый кристаллический порошок.
- Прозрачный и бесцветный в кристаллической форме, похожий на лед.
- Кристаллизуется в изометрической системе, обычно в форме кубов.
- Растворим в воде (35,6 г / 100 г при 0 ° C и 39,2 г / 100 г при 100 °).
- Слабо растворим в спирте, но не растворим в концентрированной соляной кислоте.
- Плавится при 801 ° C и начинает испаряться при температурах чуть выше этой точки кипения 1413 ° C.
- Твердость 2,5 по шкале твердости MOH.
- Удельный вес 2,165.
- Негорючие — низкая токсичность.
- Гигроскопичен — впитывает влагу из влажной атмосферы с относительной влажностью выше 75% — ниже этого она высыхает.
В естественной форме соль часто содержит следы хлорида магния, сульфата магния, бромида магния и других.Эти примеси могут окрашивать прозрачные кристаллы в желтый, красный, синий или фиолетовый цвет.
Химикаты из соли
При пропускании электрического тока через крепкий раствор соли в воде происходит электролиз и образуются три продукта:
- Хлор (Cl 2 )
- Гидроксид натрия (NaOH)
- Водород (H 2 ).
Поскольку газообразные водород и хлор образуют взрывоопасную смесь, важно держать их разделенными.Все три продукта полезны по отдельности, и их также можно комбинировать для создания других продуктов. Гидроксид натрия и хлор объединяются с образованием раствора гипохлорита натрия, который широко используется в домашних условиях в качестве отбеливателя. Более крепкий раствор гипохлорита натрия используется в качестве молочного и промышленного дезинфицирующего средства.
В разных условиях реакции гидроксид натрия и хлор будут реагировать с образованием хлората натрия. Он образуется в виде белых кристаллов, которые могут быть взрывоопасными или легковоспламеняющимися при смешивании с органическими веществами.Растворы хлората натрия широко используются в качестве гербицидов.
Когда газообразный хлор сжигается в водороде, два газа реагируют с образованием хлористого водорода. Хлороводород растворяется в воде с образованием соляной кислоты. Полученная таким образом соляная кислота очень чиста и может безопасно использоваться в пищевой и фармацевтической промышленности.
.
