Содержание
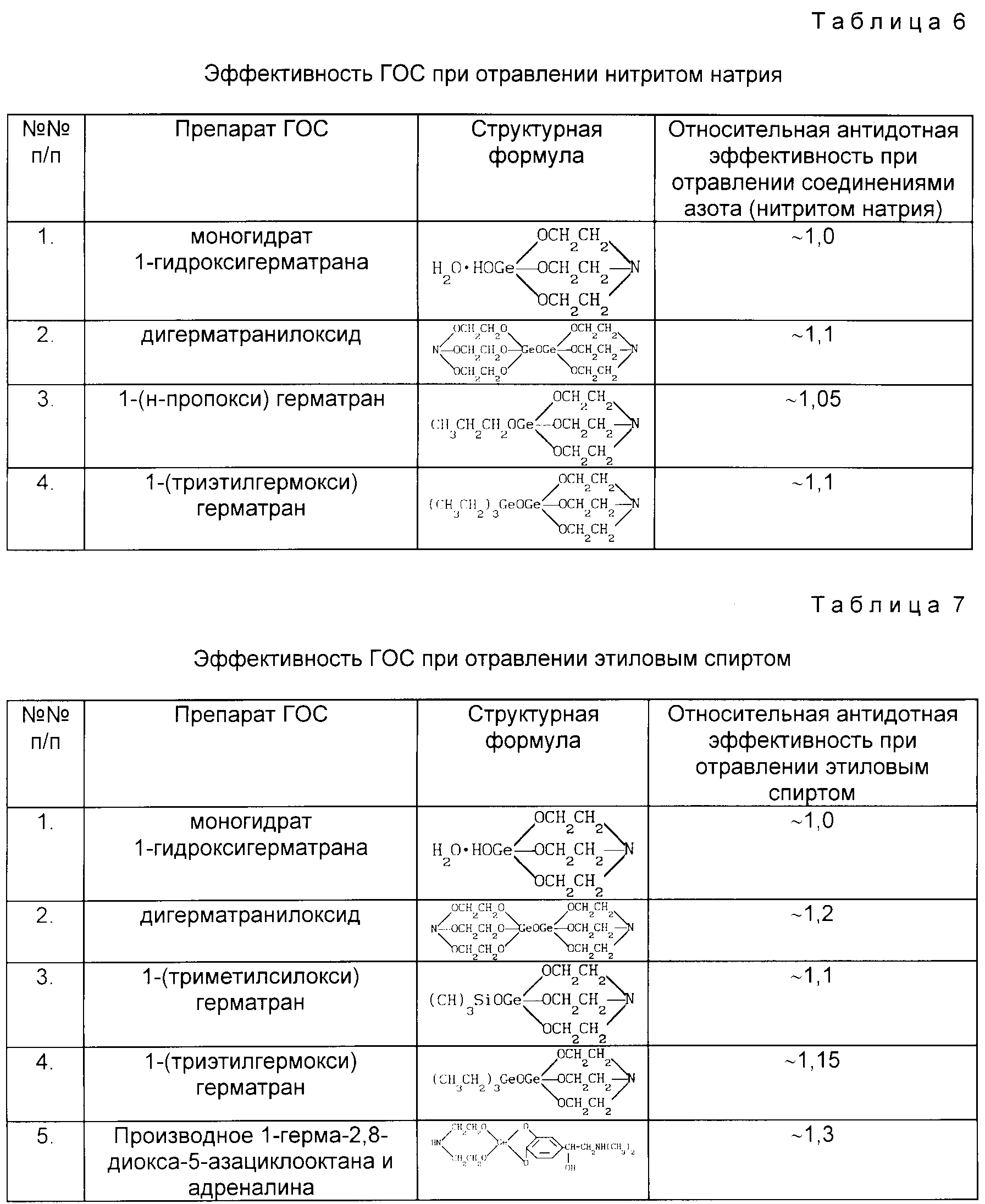
Сравнительная характеристика органических и неорганических соединений.
Органические соединения состоят в основном из 2-х химических элементов — карбона (углерода) и гидрогена (водорода). Соединения,
образованные карбоном, называются
органическими соединениями. А, соединения называются углеводородами, так как состоят из углерода и водорода. В состав, конечно, могут входить и другие химические элементы, но основными всё же являются, именно эти.
Ныне известно более 20 млн. органических соединений. Неорганических соединений известно только более 400 тыс., но они состоят из всех элементов по Периодической системе Д.И. Менделеева.
Атомы Карбона способны соединяться между
собой, образуя молекулы разнообразной формы:
—
разветлённые:
│
-С-С-С-
— линейные:
-С-С-С
-короткие,
длинные, цепи, кольца и т.д.
Общие и отличительные признаки неорганических и
органических соединений.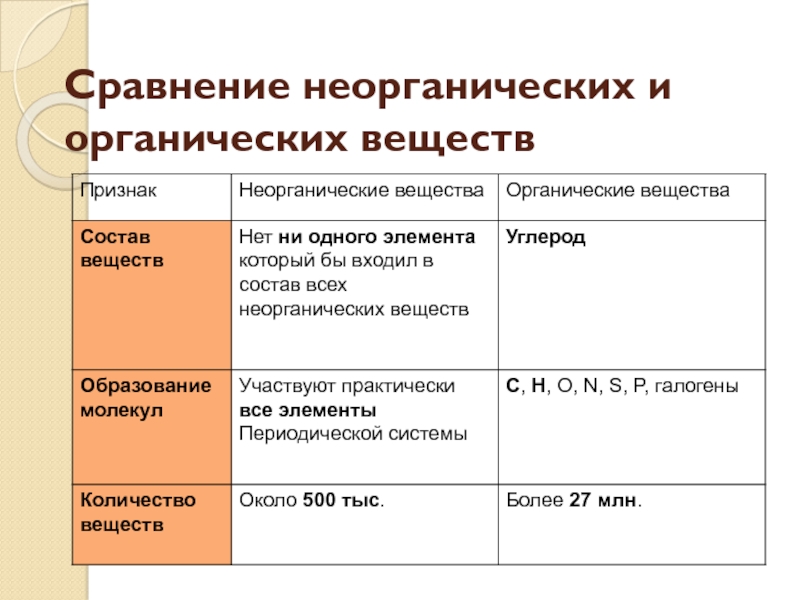
Неорганические | Органические |
-Валентность у карбона может быть II, IV. | — Валентность у карбона всегда |
-В неорганических соединениях | — Преимущественно образуют ковалентные |
-Неорганические стойкие к нагреванию. -Используются большей своей частью водные растворы. | -Легкоплавкие, имеют запах. |
Общие признаки
Образование
и реакции органических соединений происходят по тем же законам, что и
неорганических соединений. Среди органических соединений есть и растворимые в
Среди органических соединений есть и растворимые в
воде, электролиты (соли органических кислот), есть термостойкие. Органические и
неорганические вещества объединяет и то, что они могут преобразовываться друг в
друга.
Теперь я вам предлагаю посмотреть некоторых учёных, которые внесли свой посильный вклад в развитие органической химии.
Сравнение органических и неорганических соединений
Фотометрический (колориметрический) метод основан на сравнении оптической плотности исследуемой и контрольной жидкостей. Для определения соединений данным методом применяются фотоколориметры ФЭК-М, ФЭК-Н-5, ФЭК-Н-54, ФЭК-Н-57, ФЭК-56, ФЭК-60 и др. Чувствительность определения зависит от природы соединений и изменяется для органических соединений от 0,04 до 20 мкг/мл и для неорганических соединений от 0,02 до 10 мкг/мл пробы. [c.26]
Органические реагенты, используемые для осаждения в неорганическом анализе, обладают более высокой селективностью по сравнению с неорганическими осадителями и имеют ряд других ценных аналитических свойств. Осадки неорганических ионов с органическими реагентами наиболее полно отвечают требованиям, которые предъявляются к форме осаждения и к гравиметрической форме. Растворимость соединений, полученных при взаимодействии органических реагентов с неорганическими ионами, очень мала и полнота осаждения, как правило, достигается уже при небольших избытках осадителя. [c.161]
Осадки неорганических ионов с органическими реагентами наиболее полно отвечают требованиям, которые предъявляются к форме осаждения и к гравиметрической форме. Растворимость соединений, полученных при взаимодействии органических реагентов с неорганическими ионами, очень мала и полнота осаждения, как правило, достигается уже при небольших избытках осадителя. [c.161]
Ковалентная связь — самый распространенный тип химической связи. Межатомная связь абсолютного большинства неорганических и органических соединений ковалентна. По механизму образования ковалентных связей нет никакой разницы между неорганическим соединением аммиаком КНз и органическим соединением метаном СН4. Для неорганических соединений типа кислот, оснований и солей наблюдаются межатомные связи с несколько бо.льш ей долей ионности, т.е. более полярные ковалентные связи по сравнению с органическими соединениями. Следовательно, по фундаментальной характеристике молекул — природе межатомной химической связи — нет принципиальной разницы между неорганической и органической химией.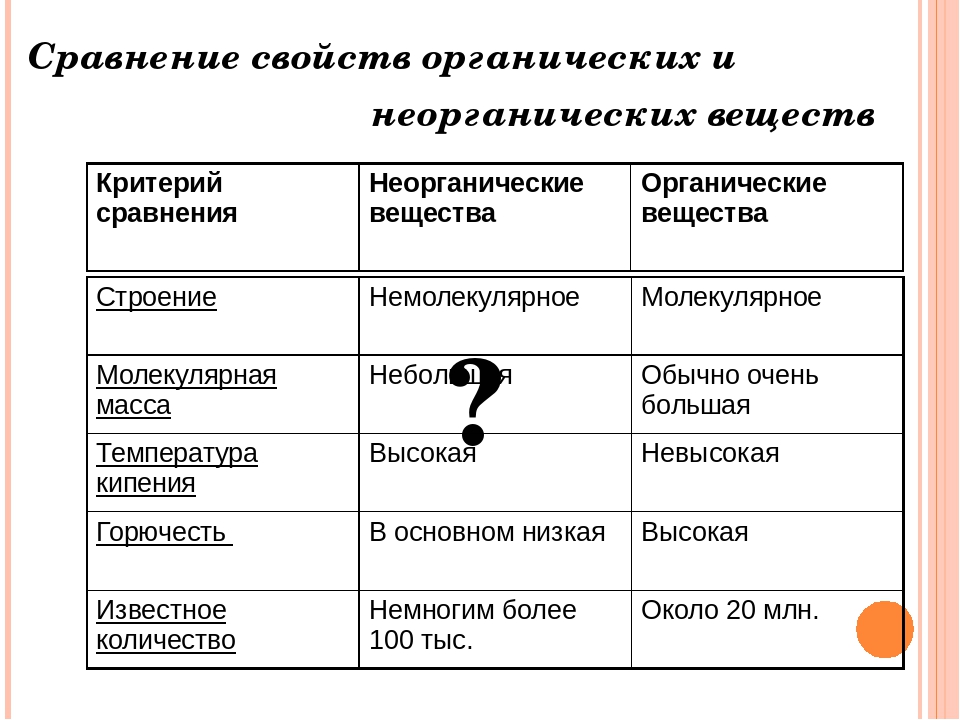 Отличие состоит в том, что в твердых органических веществах действуют слабые межмолекулярные силы, а в типичных неорганических кристаллах отсутствуют молекулы и доминирует ковалентная связь между атомами. [c.66]
Отличие состоит в том, что в твердых органических веществах действуют слабые межмолекулярные силы, а в типичных неорганических кристаллах отсутствуют молекулы и доминирует ковалентная связь между атомами. [c.66]
Формамид обладает необычной диэлектрической постоянной (110), существенно превосходящей диэлектрическую постоянную воды. Этот растворитель находится в жидком состоянии в удобной для работы области температур (2,5-193 °С) и имеет низкое давление паров при комнатной температуре. По вязкости он превосходит ДМФ (3,3 сП по сравнению с 0,80 сП для ДМФ). В отличие от ДМФ формамид лишь эпизодически применялся в качестве растворителя электролитов, причем область рабочих потенциалов в формамиде оказалась уже, чем в ДМФ. Более высокая диэлектрическая постоянная вообще не дает особых преимуществ формамиду перед ДМФ, так как диэлектрическая постоянная последнего также достаточно велика, чтобы обеспечить адекватную проводимость растворов. В основном с помощью формамида можно варьировать условия опыта путем изменения определенных свойств растворителя. Формамид — хороший растворитель для различных неорганических соединений, включая хлориды, нитраты и сульфаты ряда переходных и щелочноземельных металлов. Подобно воде, формамид растворяет более полярные органические соединения и смешивается с водой он очень гигроскопичен и легко гидролизуется с образованием уксусной кислоты и аммиака. Формамид использовался и качестве растворителя при полярографии на КРЭ некоторых переходных элементов и ряда органических соединений. [c.21]
Формамид — хороший растворитель для различных неорганических соединений, включая хлориды, нитраты и сульфаты ряда переходных и щелочноземельных металлов. Подобно воде, формамид растворяет более полярные органические соединения и смешивается с водой он очень гигроскопичен и легко гидролизуется с образованием уксусной кислоты и аммиака. Формамид использовался и качестве растворителя при полярографии на КРЭ некоторых переходных элементов и ряда органических соединений. [c.21]
Органические осадители. В количественном неорганическом анализе впервые применил органическое соединение М. А. Ильинский (1855—1941 гг.), предложивший в 1884 г. а-нитрозо-р-нафтол в качестве реагента на Со +. Однако широкое использование органических реагентов началось после классических работ Л. А. Чу-гаева (1873—1922 гг.), предложившего в 1905 г. свою знаменитую реакцию на N1 + с диметилглиоксимом и выдвинувшего проблему изучеиия аналитических свойств внутрикомплексных солей. Работы Чугаева знаменовали начало нового, весьма плодотворного направления в аналитической химии, характеризующегося широчайшим использованием органических соединений в качестве реагентов на различные ионы. За протекший с тех пор период времени было открыто огромное число ценных органических соединений, применяемых ныне как в качественном, так и в количественном анализе. Основной причиной широкого проникновения органических реагентов в практику анализа является ряд особенностей их по сравнению с неорганическими реагентами. [c.123]
За протекший с тех пор период времени было открыто огромное число ценных органических соединений, применяемых ныне как в качественном, так и в количественном анализе. Основной причиной широкого проникновения органических реагентов в практику анализа является ряд особенностей их по сравнению с неорганическими реагентами. [c.123]
Отсутствие в справочнике некоторых данных о физических свойствах макромолекулярных соединений и поверхностноактивных веществ объясняется тем, что свойства ряда веществ еще недостаточно изучены либо имеющиеся сведения не опубликованы. Поэтому для Придания справочнику единообразия и компактности, сведения по этим классам веществ даны в виде сокращенных таблиц по сравнению с органическими и неорганическими соединениями. [c.6]
Своеобразие свойств органических соединений по сравнению с неорганическими обусловлены в первую очередь характером связей между атомами. Вместо сильно полярных и ионных связей неорганических соединений в органических мы встречаемся преимущественно с ковалентными связями, нередко с слабо полярными.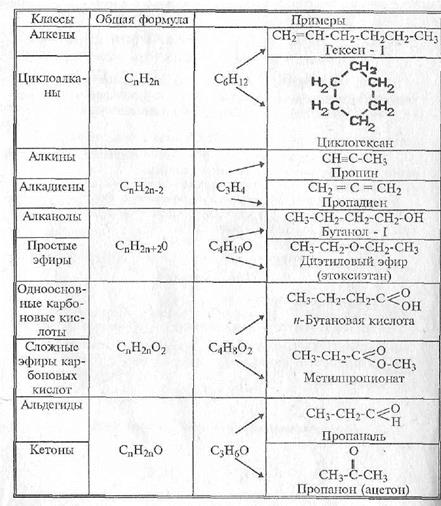 Типичной является простая (ординарная) связь между двумя атомами углерода [c.200]
Типичной является простая (ординарная) связь между двумя атомами углерода [c.200]
Еще более интересные перспективы открываются на уровне структурной неорганической химии. Ввиду того, что изучение неорганических веществ в течение целого столетия (примерно 1830— 1930-е годы) осуществлялось в русле классических представлений о молекулах, которых в подавляющем большинстве неорганических соединений в действительности не существует, развитие неорганической химии происходило в основном лишь на уровне учения о составе, На структурный уровень оно поднялось лишь в связи с появлением квантовой механики не ранее 1930-х годов, т. е. со столетним опозданием по сравнению с органической химией. Если учесть то обстоятельство (о нем говорилось в гл. IV), что и сегодня еще в изучении твердого тела не исчезли рудименты преклонения перед стехиометрической химией, то успехи современной химии твердого тела, как, впрочем, и успехи химии комплексных соединений, можно квалифицировать лишь как первые шаги в познании глубин сложного строения неорганических тел. [c.274]
[c.274]
Все специфические особенности органических соединений проявляют уже так называемые углеводороды — вещества, состоящие только из углерода и водорода. Но, как мы увидим дальше (стр. 35, 36), все более сложные органические соединения можно рассматривать как производные углеводородов. На это еще обратил внимание известный немецкий ученый-материалист К- Шорлеммер (1871 г.), который предложил органическую химию характеризовать как химию углеводородов и их производных. Такое определение наиболее правильно отражает особенности органической химии оно указывает, что ее предметом является более высоко организованная материя, по сравнению с неорганической химией, предметом которой являются элементы и их соединения. [c.13]
Эти вещества мы можем рассматривать как окислители, но с той же оговоркой по сравнению с неорганическими реакциями. Отличие заключается в том, что окисление и восстановление в органической молекуле относятся к определенному атому углерода, вступившему во взаимодействие, а не ко всей молекуле целиком, хотя явление химической индукции несомненно скажется на свойствах остальных атомов. Так, например, реакцию металепсии, т. е. непосредственного соединения углеводорода с галогеном, можно квалифицировать как окисление углеродного атома [c.452]
Так, например, реакцию металепсии, т. е. непосредственного соединения углеводорода с галогеном, можно квалифицировать как окисление углеродного атома [c.452]
Во-первых, многочисленность органических соединений по сравнению с неорганическими. Если в настоящее время органических соединений известно около трех миллионов, то число неорганических соединений достигает лишь примерно ста тысяч. Такое громадное число органических соединений объясняется прежде всего способностью углерода образовывать соединения, содержащие практически неограниченное число атомов углерода и молекуле. Поэтому и в дальнейшем количество вновь [c.10]
В зависимости от характера анализируемого материала различают анализ неорганических и органических веществ. Выделение анализа органических веществ в отдельный раздел аналитической химии связано с некоторыми особенностями органических соединений по сравнению с неорганическими. Часто первый этап анализа состоит в переведении пробы в раствор. При анализе неорганических материалов растворителем чаще всего служит вода или водные растворы кислот или щелочей. Полученный раствор содержит катионы и анионы подлежащих определению элементов. Для их обнаружения применяют реагенты, которые взаимодействуют с определяемыми ионами, как правило, очень быстро, причем в большинстве случаев реакции доходят до конца. При анализе органических соединений нередко необходимо провести предварительную минерализацию пробы, т. е. разрушить ее органическую часть прокаливанием или обработкой концентрированными кислотами. Нерастворимые в воде органические соединения иногда растворяют в органических растворителях реакции между органическими соединениями обычно протекают медленно и почти никогда не доходят до конца, причем они могут протекать по нескольким направлениям с образованием разнообразных продуктов реакции. Б анализе применяют и некоторые другие [c.13]
При анализе неорганических материалов растворителем чаще всего служит вода или водные растворы кислот или щелочей. Полученный раствор содержит катионы и анионы подлежащих определению элементов. Для их обнаружения применяют реагенты, которые взаимодействуют с определяемыми ионами, как правило, очень быстро, причем в большинстве случаев реакции доходят до конца. При анализе органических соединений нередко необходимо провести предварительную минерализацию пробы, т. е. разрушить ее органическую часть прокаливанием или обработкой концентрированными кислотами. Нерастворимые в воде органические соединения иногда растворяют в органических растворителях реакции между органическими соединениями обычно протекают медленно и почти никогда не доходят до конца, причем они могут протекать по нескольким направлениям с образованием разнообразных продуктов реакции. Б анализе применяют и некоторые другие [c.13]
Было показано, что по критерию активности роста меласса в качестве источника углеродного питания является наиболее предпочтительным субстратом по сравнению с глюкозой, сахарозой и этанолом. Установлено, что оптимальным режимом введения источника углерода является дробное внесение мелассы в количестве 3% объемных. Установлено, что, хотя исследуемая культура способна усваивать аммонийный азот неорганических соединений, выход биомассы значительно повышается в присутствии органического азота. [c.159]
Установлено, что оптимальным режимом введения источника углерода является дробное внесение мелассы в количестве 3% объемных. Установлено, что, хотя исследуемая культура способна усваивать аммонийный азот неорганических соединений, выход биомассы значительно повышается в присутствии органического азота. [c.159]
Для органических соединений характерна меньшая (по сравнению с неорганическими) устойчивость, легкая изменяемость при нагревании, горючесть. Однако, пользуясь этими признаками, невозможно провести резкой границы между соединениями органическими и неорганическими. [c.17]
В качестве растворителя этилендиамин особенно интересен для катодного восстановления неорганических соединений. Важно то, что этилендиамин весьма схож с аммиаком. Так, например, в нем могут образовываться растворы электронов, а ртуть может служить электронным электродом. По сравнению с аммиаком этилендиамин находится в жидком состоянии в более удобной для работы области температур (11-117°С) и имеет относительно низкое давление паров при комнатной температуре (-10 мм). Несмотря на низкую диэлектрическую постоянную (12), этилендиамин растворяет с одинаковым успехом как органические, так и многие неорганические соединения, особенно перхлораты и нитраты. Подобно аммиаку, этилендиамин не совсем подходит для проведения реакции электролитического окисления, однако для восстановительных процессов он вполне пригоден. Так, в этой среде можно исследовать полярографическое восстановление ионов щелочных металлов от лития до цезия и аммония [c.24]
Несмотря на низкую диэлектрическую постоянную (12), этилендиамин растворяет с одинаковым успехом как органические, так и многие неорганические соединения, особенно перхлораты и нитраты. Подобно аммиаку, этилендиамин не совсем подходит для проведения реакции электролитического окисления, однако для восстановительных процессов он вполне пригоден. Так, в этой среде можно исследовать полярографическое восстановление ионов щелочных металлов от лития до цезия и аммония [c.24]
Во многих работах значения потенциалов полуволн сравниваются с другими характеристиками органических и неорганических соединений, причем сравнение основано, в первую очередь, на идентичности первичных процессов, играющих главную роль в изменении состояния молекул, которое проявляется в различных характеристиках сопоставляемых методов. Так, введенные в органическую молекулу заместители, изменяя характер распределения электронной плотности в ней, вызывают химические сдвиги резонансных частот в спектрах ЯМР, изменения в величинах энергетических переходов в спектрах поглощения и лю- [c. 48]
48]
Конструктивный метаболизм цианобактерий представляет собой шаг вперед по пути дальнейшей независимости от органических соединений внешней среды по сравнению с пурпурными и зелеными серобактериями. Для построения всех вешеств клетки цианобактериям нужен минимум простых неорганических соединений углекислота, самые простые формы азота (аммонийные, нитратные соли или молекулярный азот), минеральные соли (источники фосфора, серы, магния, железа, микроэлементов), вода. Цианобактерии не требуют никаких питательных компонентов в восстановленной форме. Только некоторые морские виды обнаруживают потребность в витамине В 2. [c.317]
Для сравнения ниже даны значения абсолютной жесткости молекул других органических и неорганических соединений, применяемых в качестве реагентов в органическом синтезе (см. также табл. 1.10). [c.90]
Это —немногие примеры, которые позволяют использовать сведения, представленные в таблицах различных каталитических реакций органических и неорганических соединений для анализов и сравнений. Катализаторы можно классифицировать также по присущим им функциям, т. е. как вещества, способствующие ослаблению связей, и как вещества, образующие промежуточные продукты присоединения. Первоначальные изменения, вызываемые хлористым алюминием, например в углеводородах, могут сводиться к активации водородных атомов, ведущей в некоторых случаях к ослаблению связей. Активация водородных связей проявляется при гидрогенизации и дегидрогенизации, а также конденсации в ароматическом ряду и в реакциях крекинга и обмена. Миграция галоидных атомов в углеродных цепях и циклах под влиянием хлористого алюминия наблюдается при реакциях изомеризации. Окись магния и титана, глины и некоторые природные земли способствуют разрыву углерод—углеродной связи. Наиболее типичные катализаторы для реакций галоидирования — это вещества, обычно применяемые в качестве носителей при реакциях в паровой фазе. Некоторые катализаторы способны к образованию двойных солей с реагирующими веществами в этом случае стабильность промежуточных продуктов определяет их каталитическое действие.
Катализаторы можно классифицировать также по присущим им функциям, т. е. как вещества, способствующие ослаблению связей, и как вещества, образующие промежуточные продукты присоединения. Первоначальные изменения, вызываемые хлористым алюминием, например в углеводородах, могут сводиться к активации водородных атомов, ведущей в некоторых случаях к ослаблению связей. Активация водородных связей проявляется при гидрогенизации и дегидрогенизации, а также конденсации в ароматическом ряду и в реакциях крекинга и обмена. Миграция галоидных атомов в углеродных цепях и циклах под влиянием хлористого алюминия наблюдается при реакциях изомеризации. Окись магния и титана, глины и некоторые природные земли способствуют разрыву углерод—углеродной связи. Наиболее типичные катализаторы для реакций галоидирования — это вещества, обычно применяемые в качестве носителей при реакциях в паровой фазе. Некоторые катализаторы способны к образованию двойных солей с реагирующими веществами в этом случае стабильность промежуточных продуктов определяет их каталитическое действие. [c.4]
[c.4]
Наряду с применением метода двойного сравнения к изоструктурным неорганическим соединениям возможно сопоставлять ход АС в двух парах подобных реакций и между органическими веществами, например в реакциях одной пары из первых членов гомологического ряд , обладающих сходным строением, и в реакциях аналогичной пары другого гомологического ряда или того же ряда, но с другим типом строения. [c.169]
К эффективным неорганическим фунгицидам относятся, в частности, уранилнитрат и сулема. Эти соединения были очень активны при защите электроизоляционных лаков, испытанных непосредственно в тропических джунглях [60]. К некоторым материалам добавляют соединения цинка — фтористый, кремнефтористый, борат и бензоат, но они не обладают такой эффективностью, как первые два. Еще меньшей активностью, по сравнению с упомянутыми соединениями цинка, обладает салицилат цинка (органический фунгицид). [c.168]
Поскольку в настоящее время большое число органических реакций изучено более детально (получено более двух миллионов соединений) по сравнению с неорганическими реакциям (несколько сот тысяч соединений), в неорганическом синтезе [c. 269]
269]
Органические соединения, а точнее углеводороды, имеют принципиальные отличия в сравнении с неорганическими соединениями такими, как кислоты и основания, оксиды и соли и даже по сравнению с неорганическими гидридами — Н2О, Nh4, Sih5, HF, h3S, АзНз и др. Эти принципиальные особенности органических молекул (как правило, гидридов углерода и углеводородных остатков функциональных производн углеводородов) суммированы на схеме В.2, из которой следует [c.12]
Общее число известных соединений углерода больше миллиона и во много раз превышает число известных соединений всех прочих элементов. X арактерной особенностью многих органических соединений является их относительно меньшая термическая прочность по сравнению с неорганическими соединениями. Большинство их разлагается при сравнительно небольшом нагревании или обугливается и сгорает, выявляя углерод, входящий в их состав. Некоторые органические соединения настолько непрочны, что работать с ними можно только при соблюдении особых предосторожностей сильного охлаждения, пониженного давления, применения атмосферы инертного газа и т. д. [c.18]
д. [c.18]
Серьезные возражения против теории этерина появились прежде всего у Берцелиуса. В 1833 г. он опубликовал исследование О конституции органических соединений , в котором утверждал, что состав алкоголя и эфира не может быть выражен формулами Е-ЬЁНгО и Е+НгО. Обосновывая данное положение, Берцелиус писал При изучении идеи о формировании органических соединений до настоящего времени существовал только один бесспорно достоверный путь, а именно — мы должны исходить из сравнений с неорганическими соединениями. В неорганической химии принято считать все соединения бинарными, составленными из электроположительной и электроотрицательной составных частей . [c.212]
Выделение органической химии в самостоятельный раздел химической науки вызвано многими причинами. Во-первых, это связано с многочисленностью органических соединений (в настоящее время известно свыше трех миллионов органических Еси еств, а неорганических— около 150 тыс.). Вл дряя причина состоит в сложности и своеобразии органических веществ по сравнению с неорганическими. Например, их температуры плавления и кипения имеют более низкие значения они легко разрушаются при воздействии на них даже сравнительно невысоких температур (часто не превышающих 100°С), в то время как неорганические вещества свободно выдерживают очень высокие температуры. Большинство химических реакций с участием органических соединений протекает гораздо медленнее, чем ионные реакции неорганических веществ, что обусловлено природой основной химической связи в органических веществах — ковалентной связью. Углерод, входящий в состав органических веществ, обладает особой способностью соединяться не только с несколькими другими углеродными атомами, но и почти со всеми элементами периодической системы (кроме инертных газов). Следует подчеркнуть, что выход продукта в органической реакции, как правило, ниже, чем при реакции неорганических веществ. Кроме того, в области органической химии приходится сталкиваться с новыми понятиями и явлениями органический радикал, функциональная группа, изомерия и гомология, а также взаимное влияние атомов и атомных групп в молекуле.
Например, их температуры плавления и кипения имеют более низкие значения они легко разрушаются при воздействии на них даже сравнительно невысоких температур (часто не превышающих 100°С), в то время как неорганические вещества свободно выдерживают очень высокие температуры. Большинство химических реакций с участием органических соединений протекает гораздо медленнее, чем ионные реакции неорганических веществ, что обусловлено природой основной химической связи в органических веществах — ковалентной связью. Углерод, входящий в состав органических веществ, обладает особой способностью соединяться не только с несколькими другими углеродными атомами, но и почти со всеми элементами периодической системы (кроме инертных газов). Следует подчеркнуть, что выход продукта в органической реакции, как правило, ниже, чем при реакции неорганических веществ. Кроме того, в области органической химии приходится сталкиваться с новыми понятиями и явлениями органический радикал, функциональная группа, изомерия и гомология, а также взаимное влияние атомов и атомных групп в молекуле. [c.5]
[c.5]
Разработка структурных теорий твердого тела. Проблемой но мер 1 структурной химии применительно к неорганическим соединениям является разработка структурных теорий твердого тела. Эти теории уже сейчас начинают создаваться на принципиально иной основе по сравнению со структурными теориями органических соединений. Последние базируются на представлениях о молекулах как замкнутых системах с сильными локализованными межатомными связями, на представлениях о взаимном влиянии атомов, которое изменяет в некоторых — в общем незначительных — пределах энергию попарных межатомных связей. Даже квантово-механические теории строения органических молекул с их основным понятием неразличимости обобщенных электронов приходят к необходимости устанавливать ква1ггово-меха нические аналоги классическим поня- [c.98]
Ковалентная связь —самый распространенный тип химической связи. Межатомная связь абсолютного большинства неограниче-ских и органических соединений ковалентна. По механизму образования ковалентных связей нет никакой разницы между неорганическим соединением аммиаком NHз и органическим соединением метаном СН4. Для неорганических соединений типа кислот, оснований и солей наблюдаются межатомные связи с несколько большей долей ионности, т. е. более полярные ковалентные св.гзи по сравнению с органическими соединениями. Следовательно, по фундаментальной характеристике молекул — природе межатомной хи- [c.87]
По механизму образования ковалентных связей нет никакой разницы между неорганическим соединением аммиаком NHз и органическим соединением метаном СН4. Для неорганических соединений типа кислот, оснований и солей наблюдаются межатомные связи с несколько большей долей ионности, т. е. более полярные ковалентные св.гзи по сравнению с органическими соединениями. Следовательно, по фундаментальной характеристике молекул — природе межатомной хи- [c.87]
Сравнение данных табл. 7 и 8 указывает на близость величин рефракций металлов, вычисленных из данных по органическим и неорганическим соединениям, хотя в последнем случае они несколько выше из-за меньшей полярности связей в интерметаллических соединениях по сравнению с металлоргапическими (см. 7). Поэтому полученные аддитивным способом величины можно представить в виде некоей системы усредненных значений ковалентных рефракций элементов в случае больших расхождений предпочтение отдано данным, соответствующим наиболее ковалентным связям. [c.29]
[c.29]
Существует большое количество органических веществ, принадлежащих к различным классам органических соединений, способных окрашивать каучук, но не все они достаточно устойчивы в условиях вулканизации. Органические красители отличаются значительно более высокой красящей способностью и обеспечивают более яркую окраску по сравнению с неорганическими пигментами. Они могут оказывать влияние на скорость вулканизации резиновых смесей и сопротивление резин старению. Наиболее часто применяются лак оранжевый (лак-оранж, вул-кан-оранлпигмент оранжевый Ж, пигмент желтый 23, пигмент синий ан-трахиноновый и др. [c.178]
Декоративное окрашивание алюминия и его сплавов при использовании неорганических соединений (красителей) вед т как химическим, так и этектрохиыическим методом Получаемые прн этом окрашенные оксидные пленки обладают высокой светостойкостью н теомо-стойкостью Однако возрастает сложность технологии по 1учения окрашенной нленки, сокращается цветовая гамма окраски по сравнению с окрашиванием органическими красителями [17. 19] [c.247]
19] [c.247]
В целях сравнения в табл. 2.3 перечислены области применения аналитической химии следовых количеств органических и неорганических соединений (рассчитано по данным, опубликованным в журнале Analyti al Abstra ts в 1978—1979 гг.). [c.16]
Для электролиза неорганических соединений пригодно значительно меньше растворителей, чем для электролиза органических соединений, поскольку при этом возникают трудности, связанные с растворимостью. Для этой цели, как правило, подходят лишь растворители с довольно высокой диэлектрической проницаемостью нитрилы с низким молекулярным весом, амиды, сульфоксиды, сульфоны и карбонаты. Однако если растворитель специфически взаимодействует с неорганическим ионом, то полезные результаты могут быть получены даже при электролизе в растворителе с совсем низкой диэлектрической проницаемостью. К таким растворителям относятся уксусная кислота, пиридин, аммиак и этилендиамин. Общие сведения, касающиеся свойств и использования растворителей, фоновых электролитов и электродов сравнения, приведены в работах Такагаши [1], Манна [2] и Батлера [3]. [c.404]
[c.404]
Многие тысячи органических соединений, потребляемых в различных областях народного хозяйства, могут быть получены путем электросинтеза. Однако но сравнению с электрохимическим производством металлов и неорганических соединений масштабы промышленного электросинтеза органических веществ незначительны. Причина этого — недостаточная изученность механизма большинства реакций, а также невысокая производительность основного оборудования. Только большая ценность синтезируемых органических соединений, в частности промежуточных продуктов при синтезе лекарственных препаратов и витаминов, заставляет пренебречь издержками производства и получать эти вещества э.пектрохимическим путем. [c.39]
Основные факторы, влияющ,ие на соударения между метастабильными атомами и другими молекулами, указаны Ловело-ком [4]. Вероятность ионизации при таких соударениях приближается к единице, так что скорость ионизации для данного вида молекул определяется частотой соударений. Сигналы для большинства соединений определяются массой введенного пара и сравнительно мало зависят от вида вводимых молекул. Ионизация может происходить только в том случае, когда ионизационный потенциал сталкивающихся молекул близок или меньше энергии метастабильного состояния. Практически ионизационные потенциалы всех органических паров и большинства неорганических соединений меньше 11,7 эв, т. е. меньше энергии метастабильного атома аргона. Следовательно, число веществ, которые не регистрируются детектором, невелико к ним относятся Нг, N2, О2, СО2, СО, ( N)2, Н2О, а также фтороуглеводо-роды. Органические соединения метан, этан, ацетонитрил и пропионитрил, имеют ионизационные потенциалы, значительно превышающие 11,7 эв, но тем не менее они регистрируются детектором с чувствительностью, в 10—100 раз меньшей по сравнению с чувствительностью к другим соединениям. Небольшая чувствительность к ацетонитрилу делает это вещество очень удобным растворителем разбавленные растворы в ацетонитриле могут быть использованы в хроматографических колонках.
Сигналы для большинства соединений определяются массой введенного пара и сравнительно мало зависят от вида вводимых молекул. Ионизация может происходить только в том случае, когда ионизационный потенциал сталкивающихся молекул близок или меньше энергии метастабильного состояния. Практически ионизационные потенциалы всех органических паров и большинства неорганических соединений меньше 11,7 эв, т. е. меньше энергии метастабильного атома аргона. Следовательно, число веществ, которые не регистрируются детектором, невелико к ним относятся Нг, N2, О2, СО2, СО, ( N)2, Н2О, а также фтороуглеводо-роды. Органические соединения метан, этан, ацетонитрил и пропионитрил, имеют ионизационные потенциалы, значительно превышающие 11,7 эв, но тем не менее они регистрируются детектором с чувствительностью, в 10—100 раз меньшей по сравнению с чувствительностью к другим соединениям. Небольшая чувствительность к ацетонитрилу делает это вещество очень удобным растворителем разбавленные растворы в ацетонитриле могут быть использованы в хроматографических колонках. [c.29]
[c.29]
Ивесон и Эллис [1] опубликовали результаты анализа галоидных неорганических соединений методом газовой хроматографии. По аналогии е результатами, полученными на капиллярных колонках для органических смесей [2, 3], можно было надеяться на достижение столь же высокой эффективности при разделении неорганических веществ. Настоящая работа была предпринята с целью изучения эффективности капиллярных колонок, покрытых Ке1-Р (политрифтормонохлорэтилен), для разделения смеси фтористого водорода, хлора и трехфтористого хлора. Для проведения такого исздедовання прищлось сначала разработать конструкцию детектора с малым объемом по сравнению с объемом капиллярной колонки, а также метод введения малых проб газовой смеси в газ-носитель. [c.396]
Иногда выгоднее вести дистилляцию или возгонку вещества не в вакууме, а в токе газа или пара. Если газ совершенно индифферентен, то практически он не оказывает никакого влияния на парциальное давление вещества, подлежащего отгонке. Однако уже в случае водяного пара значительно сказывается его специфическое действие, которое приводит к сильному понижению парциального давления одних веществ, в то время как парциальное давление других веществ (преимущественно не смешивающихся с водой) почти не изменяется, благодаря чему можно достигнуть эффективного разделения веществ. Применение водяного пара по сравнению с другими газами имеет то преимущество, что отгоняющуюся смесь можно легко и полностью сконденсировать и в большинстве случаев можно вновь разделить. В случае необходимости вещество можно выделить из дистиллята методом высаливания или экстракции. В органической химии перегонку с водяным паром часто применяют для разделения веществ. Однако в неорганической химии этот метод имеет небольшое значение летучесть борной кислоты, кремневой кислоты, ВеО, ШОд или МоОд с водяным паром представляет интерес только как особый случай. Поскольку легколетучие неорганические соединения, не разлагающиеся водяным паром, растворяются в воде с образованием азеотропной смеси или определенных соединений, не следует подробно останавливаться на теории и практическом проведении перегонки с водяным паром [535, а, б].
Однако уже в случае водяного пара значительно сказывается его специфическое действие, которое приводит к сильному понижению парциального давления одних веществ, в то время как парциальное давление других веществ (преимущественно не смешивающихся с водой) почти не изменяется, благодаря чему можно достигнуть эффективного разделения веществ. Применение водяного пара по сравнению с другими газами имеет то преимущество, что отгоняющуюся смесь можно легко и полностью сконденсировать и в большинстве случаев можно вновь разделить. В случае необходимости вещество можно выделить из дистиллята методом высаливания или экстракции. В органической химии перегонку с водяным паром часто применяют для разделения веществ. Однако в неорганической химии этот метод имеет небольшое значение летучесть борной кислоты, кремневой кислоты, ВеО, ШОд или МоОд с водяным паром представляет интерес только как особый случай. Поскольку легколетучие неорганические соединения, не разлагающиеся водяным паром, растворяются в воде с образованием азеотропной смеси или определенных соединений, не следует подробно останавливаться на теории и практическом проведении перегонки с водяным паром [535, а, б]. Для перегонки с водяным паром обычно используют простую круглодоннук> колбу с длинным горлом или колбу Кляйзена, в которую вместо капилляра для пропускания воздуха или газа вставляют трубку, подводящую пар. [c.476]
Для перегонки с водяным паром обычно используют простую круглодоннук> колбу с длинным горлом или колбу Кляйзена, в которую вместо капилляра для пропускания воздуха или газа вставляют трубку, подводящую пар. [c.476]
По сравнению с другими методами разделения дистилляция имеет лишь ограниченное применение в неорганическом анализе. Для операций разделения можно воспользоваться летучестью некоторых неорганических соединений (например, галогенидов металлов, Ru04, OSO4 и некоторых соединений неметаллов), однако лишь в редких случаях такие процессы разделения основаны яа летучих продуктах, получающихся с применением органических реагентов. Образование карбонилов металлов, алкоксидов, алкилов я металлооргаиических соединений протекает медленно и неполно лишь хелатЁг металлов, которые обладают достаточной летучестью и термической стабильностью, могут быть использованы для аналитичеоких разделений. Однако хелаты с такими свойствами больше применяются в хроматографии, чем для дистилляции. [c.188]
[c.188]
|
Свойство
|
Органические
|
Неорганические
|
|
Преобладающий тип химической связи
|
Ковалентная слабополярний
|
Ионная, ковалентная сильнополярний
|
|
Температуры плавления и кипения
|
В большинстве случаев низкие, до +350
|
Высокие, обычно свыше +600 °С
|
|
Устойчивость при высоких температурах
|
Обычно разлагаются на более
|
Большинство соединений устойчивы до нескольких тысяч
|
|
Растворимость
|
Хорошо растворяются в некоторых органических
|
Большинство растворимые в воде
|
|
Электрические свойства
|
Почти все соединения — диэлектрики и их
|
Многие вещества хорошо проводят электрический
|
|
Скорость протекания обменных реакций
|
Медленная
|
Быстрая
|
|
Распространенность
|
В живой природе (флора и фауна)
|
В неживой природе (атмосфера, гидросфера,
|
Практическая работа № 3.
 Сравнение свойств органических и неорганических соединений
Сравнение свойств органических и неорганических соединений
Опыт 1
Образование солей взаимодействием органических и неорганических оснований с кислотами и опыты с ними
В одной пробирке получите эмульсию анилина. (Смешайте 1—2 капли анилина с 1—2 мл воды.)
В другой пробирке получите гидроксид меди(П).
В обе пробирки добавляйте по каплям концентрированную соляную кислоту. Что наблюдаете?
К образовавшимся растворам солей добавляйте по каплям концентрированный раствор щелочи. Что наблюдаете?
Запишите уравнения проделанных реакций и сделайте выводы.
«Образование солей взаимодействием органических и неорганических оснований и кислотами и опыты с ними»
Выполнение работы:
Вывод: органические и неорганические основания и соли проявляют схожие свойства.
Опыт 2
Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами а) В пробирку налейте 2 мл изоамилового спирта, 2 мл концентрированной уксусной кислоты и 0,5—1 мл концентрированной серной кислоты (выдает учитель).
Смесь хорошо перемешайте и нагревайте (осторожно!) несколько минут на водяной бане (в стакане с горячей водой) до пожелтения жидкости (но не до кипения!).
Дайте смеси остыть, затем вылейте в пробирку с холодной водой или с насыщенным раствором поваренной соли: эфир соберется на поверхности. Отделите эфир с помощью делительной воронки. Какой ощущается запах?
Примечание. Оставьте полученный эфир для решения задачи IV в практической работе № 4. б) В фарфоровую чашечку поместите несколько кристалликов борной кислоты, добавьте 1 мл этилового спирта. Хорошо перемешайте смесь стеклянной палочкой. Поднесите к ней зажженную лучинку. Образовавшийся сложный эфир — триэтилборат сгорает красивым зеленым пламенем.
Запишите уравнения реакций, проделанных в опытах 2а и 26, сделайте выводы.
«Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами»
а) В пробирку налили немного изоамилового спирта и концентрированной уксусной кислоты и добавили чуть-чуть концентрированной серной кислоты. Смесь перемешали и нагрели на водяной бане. Наблюдаем пожелтение жидкости. Смесь остудили, эфир собрался на поверхности, ощущаем запах грушевой эссенции.
Смесь перемешали и нагрели на водяной бане. Наблюдаем пожелтение жидкости. Смесь остудили, эфир собрался на поверхности, ощущаем запах грушевой эссенции.
б) В фарфоровую чашку поместили несколько кристаллов борной кислоты и прибавили немного этилового спирта. Смесь перемешали и поднесли к ней зажженную лучинку. Образовавшееся вещество сгорело зеленым пламенем.
Вывод: органические и неорганические кислоты проявляют аналогичные химические свойства.
Опыт 3
Амфотерность гидроксида цинка и аминоуксусной кислоты а) В две пробирки налейте по 1 —2 мл раствора нитрата цинка и добавьте к нему 2—3 капли щелочи до образования осадка. В одну из пробирок прилейте соляной кислоты до растворения осадка, в другую — избыток раствора щелочи и наблюдайте растворение осадка. б) Налейте в пробирку 2—3 мл раствора карбоната натрия и всыпьте в него щепотку глицина. Что наблюдаете? Какие свойства глицина проявляются в этой реакции? Поместите в пробирку немного кристалликов глицина, смочите их каплями концентрированной соляной кислоты, нагрейте. Что наблюдаете? Вылейте несколько капель образовавшегося раствора на стекло. Наблюдайте образование при охлаждении кристаллов соли глицина. Сравните форму этих кристаллов с формой кристаллов глицина. Запишите уравнения реакций и выводы.
Что наблюдаете? Вылейте несколько капель образовавшегося раствора на стекло. Наблюдайте образование при охлаждении кристаллов соли глицина. Сравните форму этих кристаллов с формой кристаллов глицина. Запишите уравнения реакций и выводы.
«Амфотерность гидроксида цинка и аминоуксусной кислоты»
Опыт 4
Сравнение свойств солей а) В две пробирки налейте по 2 мл растворов нитрата и ацетата свинца. Затем прилейте в обе пробирки по 1 мл раствора иодида калия. Что наблюдаете? б) В две пробирки налейте по 2 мл растворов сульфата ме-ди(II) и соли анилина. Затем добавьте в обе пробирки несколько капель концентрированного раствора щелочи. Что наблюдаете? Запишите уравнения проделанных реакций и сделайте выводы.
«Сравнение свойств солей» Выполнение работы:
Вывод: соли органические и неорганические также проявляют схожие свойства.
Взаимосвязь неорганических и органических веществ – УчМет
Муниципальное
бюджетное образовательное учреждение
«Средняя
общеобразовательная школа № 11 с
углублённым изучением отдельных
предметов Зеленодольского муниципального
района республики Татарстан»
422550,
РТ, г. Зеленодольск, ул. Гоголя, 40а
Зеленодольск, ул. Гоголя, 40а
тел.
(84371) 5-44-15, 5-27-08,
Тема
урока:
Взаимосвязь
неорганических и органических веществ.
Урок
разработан учителем химии высшей
квалификационной категории: Абдулиной
Маргаритой Ивановной.
Предмет:
химия.
Автор
учебника: И.И. Новошинский
Пояснительная
записка
В
условиях профильного обучения учителя
химии используют нетрадиционные
методики. Среди них урок для
разновозрастной группы (9-й и 10-й
классы). Это позволяет учащимся 9-х
классов более осознанно подойти к выбору
профиля, по которому предстоит обучаться
в 10-11-х классах. Учащиеся 10-го класса
обобщают и систематизируют полученные
знания по курсу химии и готовятся к
поступлению в вуз.
Важной частью
урока является использование идеи
Штейнберга о конструкторно-технологическом
моделировании в деятельности учителя.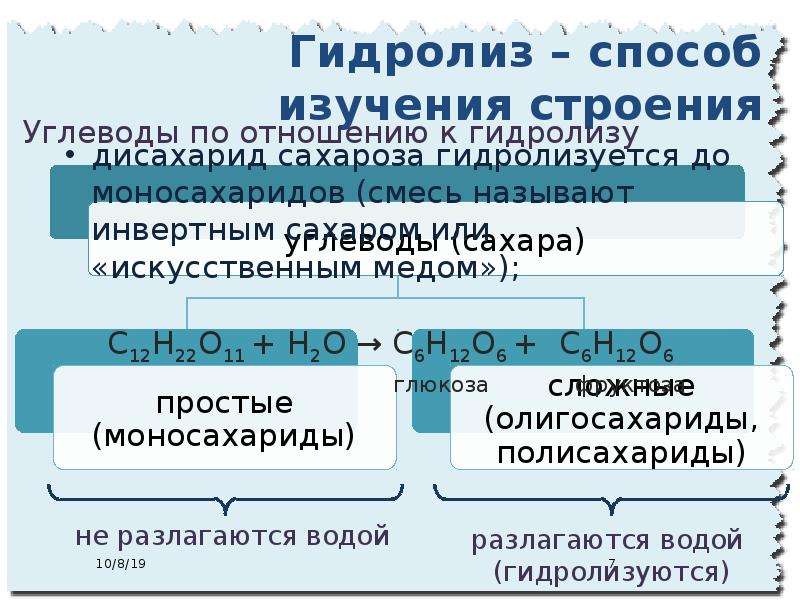
Построение логико-смысловой модели
позволяет систематизировать знания
учащихся 10-х классов и определяет
перспективы дальнейшего обучения
девятиклассников.
Использование
логико-смысловой
модели развивает логическое мышление
учащихся и формирует навыки
индивидуальной конструкторной
деятельности в процессе познания.
Тема:
Взаимосвязь
неорганических и органических веществ
Цель:
Показать взаимосвязь между органическими
и неорганическими веществами. Сформировать
представление об особенностях органических
соединений. Совершенствовать навыки
логического мышления и умения использовать
полученные знания на практике.
Основные
понятия: Органические и неорганические
вещества, органическая химия.
Средства
обучения: Периодическая система Д.И.
Менделеева, графопроектор, химическая
посуда, химические реактивы.
Ход урока.
Начинает урок учитель 9 класса:
На
уроке присутствуют разновозрастные
группы: учащиеся 9-го класса,
изучающие элективный курс химии,
выбравшие химический профиль
на будущее, и учащиеся 10 -го
класса естественнонаучного профиля,
посещающие подготовительные курсы КГТУ
им. Кирова, для которых химия является
профилирующим предметом при поступлении
в вуз.
До сих пор
мы изучали неорганическую химию, которая
насчитывает более 500 тысяч веществ. Нет
такого элемента, который входил бы в
состав всех неорганических веществ. Но
химия многогранна и есть её раздел,
называемый органической химией, который
насчитывает более 5 миллионов веществ.
В состав каждого из них входит один и
тот же химический элемент – углерод.
Почему
химия углерода выделена в отдельный
раздел, в чем сходство и различие
неорганических и органических
веществ, каким законам подчиняется
органическая химия? Все это мы постараемся
выяснить на нашем уроке.
Тема
урока: Взаимосвязь неорганических
и органических веществ
Ответить на
поставленные вопросы нам поможет
логико-смысловая модель (ЛСМ), которую
мы начнем составлять.
Углерод –
это элемент шестой группы главной
подгруппы. Учитель предлагает дать
характеристику этого элемента по
Периодической системе.
В ходе
построения ЛСМ учитель просит назвать:
аллотропные
модификации углерода, чем они отличаютсяформулы
сложных веществ (оксидов, кислоты,
гидроксидов, солей, летучее водородное
соединение), которые образует углерод.
привести
примеры реакций соединения, разложения,
обмена, замещения с участием углерода
и его соединений и определить в качестве
окислителя или восстановителя выступает
углерод в окислительно-восстановительных
реакциях.
Учащиеся 9
класса составляют таблицу, в которой
отображают некоторые химические свойства
углерода и его соединений, вспоминают
типы химических реакций, обращают
внимание на окислительно-восстановительные
реакции.
1. | Р-ция | C2H4 |
2.Na2CO3 | Р-ция | CH3COOH+NaOH |
3. | Р-ция | C 2H5OH |
4. | Р-ция | CH4 + |
5.CH4 + | Р-ция | C 3H8 |
(Уравнения
реакций для органических веществ
составляют учащиеся 10 класса.)
Учитель
продолжает:
Все о чем
сейчас говорилось относится к разделу
неорганической химии. Неорганическая
природа по- своему красива и в то же
время сурова, но она мертва без органической
природы. Большинство процессов протекающих
в живых организмах — это химические
реакции органических веществ. Органическая
химия – это химия жизни, органическая
химия – это химия углерода. Помогут
Помогут
получить представление об органических
веществах учащиеся 10 класса, которые
изучают данный раздел химии.
Продолжает
урок учитель 10 класса:
Сегодня
мы обобщим полученные на уроках знания
и применим их на практике, а для этого
продолжим составление ЛСМ.
Учащиеся
предлагают добавить в ЛСМ:
в раздел
строение атома понятие гибридизация
и дают определение этого понятия и
называют виды гибридизации.классификацию
углеводородов с указанием общей формулы
каждого представителяклассификацию
кислородсодержащих органических
веществ
Учитель
задает вопрос: «Почему органических
веществ значительно больше, чем
неорганических?» Чтобы ответить на
данный вопрос учащимся 9 класса
предлагается составить структурную
формулу угольной кислоты, а учащимся
10 класса структурную формулу вещества,
формула которого С5Н12.
Девятиклассники
написали одну формулу, ученики 10 класса
несколько.
Учащиеся
10 класса дают определение изомерии,
которое девятиклассники записывают в
тетради
Учитель
поясняет, что основой для классификации
неорганических веществ является
Периодическая система Д.И. Менделеева,
а для органических веществ теория А.М
Бутлерова. Учитель просит учащихся 10
класса озвучить положения теории А.М
Бутлерова.
Далее
учащимся 10 класса предлагается вспомнить,
характерны ли реакции соединения,
разложения, обмена, замещения для
органических веществ и есть ли среди
них окислительно-восстановительные
реакции. Десятиклассники дополняют
таблицу, которую начали составлять
ученики 9 класса.
Учащиеся
приходят к выводу, что органические и
неорганические вещества имеют много
общего.
Основа
всего живого – это органические
вещества. Процессы, происходящие в живых
организмах – это окислительно-восстановительные
реакции, конечным продуктом которых
являются углекислый газ и вода.
Вывод,
Модель,
которая составлена на уроке, показала
взаимосвязь неорганических и органических
веществ, а также особенности органических
веществ, которые послужили причиной
выделения органической химии в отдельную
область химической науки.
Заканчивает
урок учитель 9 класса:
Многолетняя
работа в школе показала, что изучение
органической химии, трудно дается
учащимся, так как они считают, что это
новая наука со своими законами. Сегодня
на уроке мы постарались развеять этот
миф и доказать, что в химии законы
одинаковы для любого раздела, нужно
только их правильно и умело использовать
Нам
бы хотелось, чтобы этот урок помог
развить вам логическое мышление, умение
применять знания, полученные ранее,
сравнивать, анализировать, сопоставлять.
Все это необходимо для сдачи экзаменов
по новой форме в 9 классе и ЕГЭ в 11 классе.
В
завершение урока учащимся предлагается
решить тестовое задание.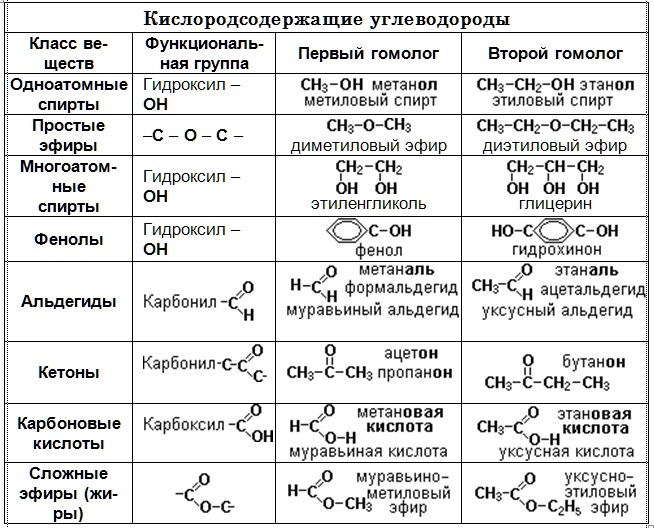
Вариант
1.
А1.
Распределению электронов по электронным
слоям в атоме углерода соответствует
схема.
1)
2;8;2; 2) 2;6; 3) 2;4; 4) 2;8;
А2.
Окислительные свойства углерод проявляет
при взаимодействии с
1)
О2 2)Са 3)Fe O
4) CuO
А3.
Каждое из указанных веществ реагирует
с оксидом углерода (IV)
1)
вода и оксид фосфора (V)
2) известковая вода и оксид магния
3)
соляная кислота и оксид серы (IV)
4) оксид кальция и хлор
А4.
Сокращенное ионное уравнение:
2Н+
+СО32- = Н2О + СО2
Соответствует
реакции:
соляной
кислоты и едкого натрасоляной
кислоты и карбоната калияСоляной
кислоты и оксида натрияСоляной
кислоты и нитрата серебра
А5.
Установите соответствие
Химическая
формула Класс
соединений
А)
С2 Н2
1) алкан
В)
С3 Н 8
2) алкен
В)
С4 Н8
3) алкин
А6.
Верны ли следующие суждения об изомерах:
А.
изомеры – это вещества, имеющие одинаковое
строение, но разный состав.
Б.
Изомеры – это вещества, имеющие одинаковый
качественный и количественный состав,
но разное строение.
1)
верно только А
2)
верно только Б
3)
верны оба суждения
4)
оба суждения неверны.
Вариант
2.
А1.
Число протонов в атоме углерода равно.
1)
2; 2) 6; 3) 4; 4) 8;
А2.
Восстановительные свойства углерод
проявляет в реакциях:
1)
Са + 2С = СаС 2 2)СО + Li
2O = Li2CO3
3)Fe
O + C = Fe + CO 4) 4 Al + 3C =Al 4C3
А3.
Какое из указанных веществ реагирует
с оксидом углерода (II)
1)
вода 2) известковая вода
3)
соляная кислота 4) оксид железа (II)
А4.
Сокращенное ионное уравнение:
2Н
++СаСО3 = Н2О + СО2
+Са2+
Соответствует
реакции:
1)соляной
кислоты и едкого натра
2) соляной
кислоты и карбоната кальция
3)Соляной
кислоты и оксида кальция
4)Соляной
кислоты и кальция
А5.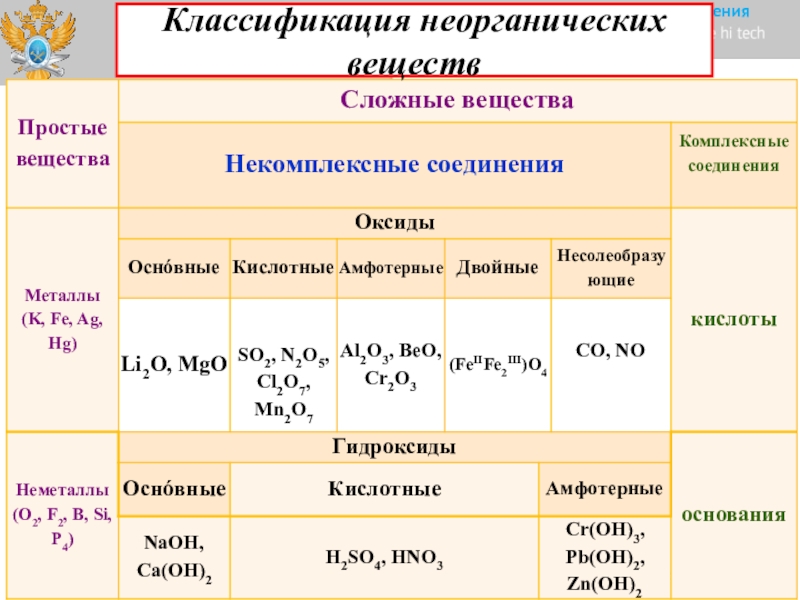
Установите соответствие
Химическая
формула Класс
соединений
А)
С 3Н 6
1) алкан
В)
С5 Н12
2) алкен
В)
С4 Н 6
3) алкадиен
А6.
Укажите формулы изомеров:
1)
СН 3-СН 2-СН 2-СН2-СН2-СН3
3) СН2-СН-СН2-СН3
4) СН3-СН2-СН2-СН2-СН3
2
) СН3-СН2-СН2-СН 3
│ |
СН3
СН3
Разница между органическими и неорганическими соединениями (с таблицей) — спросите любую разницу
Основа неорганической и органической химии — это органические и неорганические соединения. Химики-органики исследуют, оценивают и наблюдают за реакциями органических соединений. Некоторые другие соединения, такие как соли, металлы и минералы, исследуются химиками-неорганиками.
Химики-органики исследуют, оценивают и наблюдают за реакциями органических соединений. Некоторые другие соединения, такие как соли, металлы и минералы, исследуются химиками-неорганиками.
Органические и неорганические соединения
Разница между органическими и неорганическими соединениями заключается в том, что органические соединения часто содержат углеродный элемент, в то время как эта молекула отсутствует в большинстве неорганических соединений.
Однако неорганические вещества, содержащие углерод, не могут быть классифицированы как органические, поскольку количество углерода незначительно! Органические соединения включают атомы углерода, связанные с атомами водорода, чтобы создать связи C-H с небольшими отклонениями. Некоторые органические соединения имеют атомы кислорода.
Таблица сравнения органических и неорганических соединений (в табличной форме)
| Параметр сравнения | Органический | Неорганический |
|---|---|---|
| Наличие атома углерода | Они различаются по углероду присутствующие в них атомы | Неорганические вещества не содержат атомов углерода |
| Реакционная способность | Они считаются более реактивными и чрезвычайно легковоспламеняющимися | Они, естественно, не летучие и также не горючие |
| Физическое состояние | Эти вещества встречаются в виде газов, жидкостей и твердых тел. | Они встречаются исключительно в виде твердых веществ |
| Возникновение | Органические вещества присутствуют преимущественно в большинстве живых организмов | Они в основном встречаются в неживых организмах |
| Точки плавления и кипения | Высокие температуры плавления и кипения относятся к числу основные аспекты, используемые для характеристики органических веществ. | По сравнению с органическими веществами, они характеризуются низкими температурами кипения и плавления. |
Что такое органические соединения?
Это любые химические вещества, содержащие углерод.Многие органические вещества идентифицируются из-за способности углерода катентировать (образовывать цепочки из определенных атомов углерода). Исследование, называемое органической химией, включает оценку структур и реакций органических соединений.
Хотя органические соединения составляют лишь крошечный процент поверхности Земли, они имеют важное значение, поскольку органические соединения являются источником всей известной жизни.
Живые организмы интегрируют неорганические соединения углерода в органические соединения через канал механизмов (углеродный цикл), начиная с обработки углекислого газа и подачи водорода, такого как вода, в простые сахара и другие органические молекулы, используя свет (фотосинтез) или другие источники энергии.
Все ли органические соединения происходят от жизни?
Что вам нужно знать, так это то, что не все органические вещества происходят от жизни. Многие органические соединения создаются внутри живых организмов, но молекулы могут образовываться и другими процессами.
Например, органические соединения, обнаруженные на Марсе или в туманности, не являются индикаторами существования инопланетян. Солнечное излучение может обеспечить энергию, необходимую для преобразования неорганических соединений в органические вещества.
Что такое неорганические соединения?
Проще говоря, обратное органическое соединение — это неорганическое соединение. Чтобы лучше понять, как классифицируются неорганические соединения, прежде всего, это помогает узнать, что делает определенные соединения органическими.
Чтобы лучше понять, как классифицируются неорганические соединения, прежде всего, это помогает узнать, что делает определенные соединения органическими.
Неорганическое соединение может называться соединением, не имеющим связи углерод-водород, также называемым связью C-H. Кроме того, неорганические вещества, судя по геологии, представляют собой минералы или вещества, не имеющие связей углерод-водород.
Не все, но большинство неорганических соединений содержат один металл.
Каковы характеристики неорганических соединений?
Хотя некоторые неорганические соединения включают любую форму металла (щелочь, щелочь и т. Д.)), они, как правило, обладают электрической проводимостью. Например, неорганические соединения являются слабыми проводниками электричества, когда они находятся в твердом состоянии.
Однако неорганические материалы особенно токопроводящие в жидкой форме. На этом этапе электроны в неорганических соединениях будут двигаться очень легко, и это движение электронов распознается как электричество.
Неорганические соединения связаны между собой очень жестко благодаря ионной связи, обычно содержащейся в них, и имеют очень высокие температуры плавления и кипения.Цвет — еще одна отличительная черта неорганических соединений.
Неорганические соединения переходных металлов обычно сильно окрашены, и это снова объясняется расположением электронов «d-блоком».
Яркие и красочные цвета, которые можно увидеть при взрыве фейерверка, связаны с неорганическим металлом, который содержится в соединении (обычно щелочным или щелочным).
Поскольку неорганические соединения при горении проявляют характерный цвет, это может быть использовано для классификации металла.В этом сценарии они используются в качестве «маркеров».
Неорганические материалы обычно легко растворяются в воде. Иными словами, когда они помещены в воду, они могут «исчезнуть», потому что растворяются. Способность образовывать кристаллы — еще одна удивительная характеристика неорганических соединений.
Связующая структура, содержащаяся в неорганических соединениях, дает им возможность образовывать кристаллы в насыщенных растворах.
Основные различия между органическими и неорганическими соединениями
- Органические вещества являются углеводородами, потому что они производятся исключительно из углерода и водорода, тогда как неорганические вещества не состоят из углерода.
- Оксид углерода (II), вода и оксид углерода (IV) — это продукты, образующиеся при горении органических соединений, в то время как неорганические соединения обычно не горят, но когда они горят, они часто образуют оксид катиона и нитрид катиона.
- Органические вещества образуются из живых организмов, в то время как неорганические соединения образуются либо в результате неживых естественных механизмов, либо в результате экспериментальной деятельности человека.
- Соли образуются из неорганических соединений, в то время как органические соединения не могут образовывать соли.
- Органические вещества связаны углерод-водородными связями, в то время как неорганические вещества связаны ионными, ковалентными и металлическими связями.
- Неорганические вещества характеризуются наличием n атомов металлов, в то время как органические соединения не содержат атомов металлов.
Многие синтетические органические соединения в основном извлекаются из нефтехимических продуктов, состоящих в основном из углеводородов, которые сами производятся в геологических временных масштабах в результате разложения подземного органического вещества под высоким давлением и температурой.
Несмотря на это окончательное происхождение, органические соединения, как они были раньше, больше не классифицируются как соединения, происходящие из живых организмов.
Существует множество соединений, подпадающих под категорию неорганических. Действительно, в этой вселенной большинство всех соединений неорганические. Несмотря на эту причину, неорганические материалы имеют огромное количество практических применений и функциональных применений.
Поскольку большинство веществ в этой вселенной неорганические, эти вещества могут принимать различные формы и обладать несколькими специфическими характеристиками.Что ж, все, что вам нужно сделать, это внимательно прочитать всю эту статью, и у вас не возникнет проблем с различением этих двух соединений. Ваше здоровье!
- https://ebme.marine.rutgers.edu/HistoryEarthSystems/HistEarthSystems_Fall2008/Week2/Kwok_Nature_2004.pdf
- https://academic.oup.com/carcin/article-abstract/23899/28
14 Разница между органическими и неорганическими соединениями (с примерами)
Получите четкое представление о разнице между органическими и
Неорганические соединения.В основу сравнения входят: описание, плотность,
растворимость, образование, проводимость, температуры кипения и плавления, примеры,
вязкость, реакционная способность и многое другое.
Ключевые отличия
- Органическое соединение — это класс химических соединений, в которых один или несколько атомов углерода ковалентно связаны с атомами других элементов, чаще всего с водородом, кислородом или азотом. С другой стороны, неорганическое соединение — это любое соединение, в котором отсутствует атом углерода.
- Плотность соединения обычно зависит от размера молекулы по сравнению с размером атомов в молекуле.Из-за наличия большего количества атомов водорода в органических соединениях органические соединения обычно менее плотны, чем неорганические соединения. Это потому, что водород — атом с самой низкой плотностью среди всех атомов.
- Неорганические соединения хорошо растворяются в воде. Это потому, что они имеют ионные связи между молекулами. Ионные связи легко диссоциируют в воде на положительные и отрицательные ионы. С другой стороны, большинство органических соединений имеют ковалентные связи между молекулами и, следовательно, нерастворимы в воде, хотя они растворимы в других органических растворителях.
- Органические соединения образуются в результате действий живых организмов, а неорганические соединения образуются в результате естественных процессов, не связанных с какой-либо формой жизни, или в результате экспериментов человека в лаборатории.
- В большинстве водных растворов органические соединения обычно плохо проводят электричество и тепло. Неорганические соединения в водных растворах являются хорошими проводниками электричества, потому что они обладают высокой способностью к ионизации, что делает их лучшими проводниками.
- Неорганические соединения включают соли, металлы, серебро, серу, чистый алмаз, вещества, состоящие из отдельных элементов, и вещества, не содержащие углерод, связанный с водородом. С другой стороны, примеры органических соединений включают нуклеиновые кислоты, сахарозу, ферменты, бензол, метан, жиры и этанол.
- Неорганические соединения имеют более высокую общую скорость реакции, чем органические соединения. Стабильные органические соединения обычно не реагируют из-за наличия ковалентных связей, которые трудно разорвать.С другой стороны, неорганические соединения имеют ионные связи, которые легко разрываются; это делает их очень реактивными, и они всегда будут реагировать со всем, что доступно.
- Вязкость любого соединения зависит от межмолекулярных сил между молекулами. Чем сильнее межмолекулярные силы, тем выше вязкость. Межмолекулярные силы органических соединений слабые, их вязкость обычно невысока. С другой стороны, неорганические соединения, как правило, обладают сильными межмолекулярными силами, такими как водородные связи, поэтому они имеют более высокую вязкость.
- Органические соединения имеют относительно высокие температуры плавления и кипения по сравнению с неорганическими соединениями, которые обычно имеют низкие температуры плавления и кипения.
- Органические соединения являются биологическими и более сложными по своей природе по сравнению с неорганическими соединениями, которые являются простыми и минеральными по своей природе.
- Неорганические соединения легко образуют соль, тогда как органические соединения не могут образовывать соль.
- В органических соединениях атомы углерода связаны с атомами водорода углеводородной связью, тогда как в неорганических соединениях такое образование отсутствует.
- Неорганические металлы содержат атомы металлов, а органические соединения — нет.
Также прочтите : Разница между органической и неорганической химией
Разница между органическими и неорганическими соединениями в табличной форме
| Точки сравнения | Органическое соединение | Неорганическое соединение |
| Определение | Органическое соединение — это класс химических соединений, в котором один или большее количество атомов углерода ковалентно связано с атомами других элементов, большинство обычно водород, кислород или азот. | Неорганическое соединение — это любое соединение, в котором отсутствует атом углерода. |
| Плотность | Обычно они менее плотные. | Как правило, плотнее. |
| Растворимость в воде | Нерастворимы в воде. | Хорошо растворяется в воде. |
| Формация | Органические соединения образуются в результате жизнедеятельности организмы. | Неорганические соединения образуются в результате естественных процессов, не связанных с любая форма жизни или результат экспериментов человека в лаборатории. |
| Электропроводность | В большинстве водных растворов органические соединения обычно плохие проводники электричества и тепла. | В большинстве водных растворов неорганические соединения обычно хорошие проводники электричества и тепла |
| Примеры | Примеры органических соединений включают нуклеиновые кислоты, сахарозу, ферменты, бензол, метан, жиры и этанол. | Неорганические соединения включают соли, металлы, серебро, серу, чистые алмаз, вещества, состоящие из отдельных элементов, и вещества, не содержат углерод, связанный с водородом. |
| Реакционная способность | Стабильные органические соединения не вступают в реакцию. | Неорганические соединения имеют более высокую общую скорость реакции. |
| Вязкость | Межмолекулярные силы органических соединений слабые, их вязкость имеют тенденцию быть низкими. | С другой стороны, неорганические соединения имеют тенденцию к сильному межмолекулярные силы, такие как водородная связь, поэтому они имеют более высокую вязкость. |
| Температура плавления и кипения | Органические соединения имеют относительно высокие температуры плавления и кипения. | Неорганические соединения, которые обычно имеют низкую температуру кипения и кипения. точки. |
| Природа существования | Органические соединения являются биологическими и более сложными по своей природе | Неорганические соединения имеют простую и минеральную природу. |
| Солевое образование | Они не образуют и не выделяют соль. | Они легко образуют или превращают соль. |
| Форма существования | Атомы углерода связаны с атомами водорода углеводородной связью. | Нет такого образования. |
| Компоненты | Они не содержат атомов металлов. | Содержат атомы металлов. |
Сходства
между органическими и неорганическими соединениями
- Оба могут содержать в своей структуре атомы углерода.
- Оба могут быть растворимы в органических растворителях.
- Оба имеют межмолекулярные связи.
Сводка
Также читайте: Разница между органическими и неорганическими полимерами
Органическое соединение относится к классу
химические соединения, в которых один или несколько атомов углерода ковалентно связаны
с атомами других элементов, чаще всего водорода, кислорода или азота.С другой стороны, неорганическое соединение
любое соединение, в котором отсутствует атом углерода.
Предыдущая статьяРазница между кривой диссоциации кислорода миоглобина и гемоглобина (с изображениями) Следующая статья8 Разница между органическими и неорганическими полимерами (с примерами)
Сравнение неорганических и органических соединений: объяснение и практика — научный класс [видео 2021 года]
Органический vs.Неорганические свойства
Есть несколько свойств химических соединений, которые мы используем для сравнения различных соединений. Эти свойства включают:
- Растворимость
- Вязкость
- Плотность
- Электропроводность
- Реакционная способность
Мы можем использовать эти свойства для сравнения органических и неорганических соединений. Для каждого из этих свойств есть исключения, но мы будем говорить об общих тенденциях.
1.Растворимость
Большинство органических соединений имеют ковалентные связи, в то время как большинство неорганических соединений имеют ионные связи. Ионные связи позволяют неорганическим соединениям диссоциировать в воде на положительные и отрицательные ионы, что делает их хорошо растворимыми в воде , то есть легко растворяются. С другой стороны, большинство органических соединений нерастворимы в воде, хотя они растворимы в других органических соединениях.
2. Вязкость
Вязкость , которая в основном представляет собой толщину или способность противостоять деформации, зависит от того, насколько сильны межмолекулярные силы между молекулами.Чем сильнее межмолекулярные силы, тем выше вязкость. Чисто углеводородное органическое соединение будет иметь очень мало межмолекулярных сил между собой. Чем больше других элементов (таких как кислород или хлор) включено в структуру, тем больше межмолекулярных сил будет ощущать молекула. Но в целом межмолекулярные силы органических соединений слабые, поэтому их вязкость обычно невысока.
Неорганические соединения имеют тенденцию ощущать более сильные межмолекулярные силы, такие как диполь-дипольные силы и водородные связи.Таким образом, они имеют тенденцию иметь более высокую вязкость.
3. Плотность
Плотность , то есть насколько компактно что-то, основывается на размере молекулы по сравнению с массой атомов в молекуле. Большинство органических соединений имеют много атомов водорода, потому что углеводороды являются обычными связями. Водород имеет очень низкую плотность; фактически, это атом самой низкой плотности. Поскольку органические соединения имеют больше атомов водорода, чем неорганические соединения, это делает органические соединения обычно менее плотными, чем неорганические соединения.
4. Электропроводность
Мы упоминали, что органические соединения имеют ковалентные связи, в то время как неорганические соединения имеют ионные связи. Способность неорганических соединений ионизироваться позволяет им быть лучшими электропроводниками. Давайте подумаем, как работает с проводимостью : это движение электронов из одного места в другое. Если есть заряды, например, с ионизированными неорганическими соединениями, электроны могут двигаться легче. Таким образом, неорганические соединения обычно более проводящие, чем органические соединения.
5. Реакционная способность
Реакционная способность в данном случае означает, насколько легко или трудно веществу реагировать на стимуляцию. Стабильное органическое соединение обычно очень инертно, и требуется много времени, чтобы заставить его прореагировать. Это связано с тем, что для разрыва связей органических соединений мы разрываем ковалентные связи, которые намного прочнее ионных. Это означает, что неорганические соединения имеют более высокую общую скорость реакции, чем органические соединения.
В реакциях обычно присутствуют промежуточные соединения.Эти промежуточные соединения представляют собой нестабильные соединения, которые необходимы для получения конечного продукта. Например, если мы разорвем связь водород-углерод в органическом соединении, чтобы заменить водород кислородом, у нас на мгновение будет либо положительный, либо отрицательный заряд на углероде. Карбон не любит держать заряды. Таким образом, органические промежуточные продукты обладают высокой реакционной способностью и быстро реагируют с любыми доступными веществами.
Примеры органических и неорганических
Итак, давайте рассмотрим несколько органических и неорганических соединений:
- Мочевина
- Метан
- Фосфат кальция
- Соль поваренная
Давайте сначала посмотрим на химические формулы каждого соединения:
- Мочевина: CH N2 O
- Метан: Ch5
- Фосфат: Ca3 (PO4) 2
- Поваренная соль — это просто: NaCl
Из химических формул видно, что мочевина и метан являются органическими соединениями (они включают атомы углерода), а фосфат и поваренная соль неорганическими.
Теперь давайте посмотрим на свойства каждого из них в этой таблице:
| Соединение | Растворимость | Вязкость | Плотность | Электропроводность | Реакционная способность |
|---|---|---|---|---|---|
| Мочевина | Высокая | Очень низкий | Высокая | Высокая | Середина |
| Метан | Очень низкий | Очень низкий | Очень низкий | Низкий | Низкий |
| Фосфат | Низкий | Середина | Высокая | Середина | Высокая |
| Соль | Очень высокий | Высокая | Высокая | Высокая | Высокая |
По некоторым из этих свойств они в точности такие, как мы ожидали.Например, содержание метана в каждой категории очень низкое или низкое, как и следовало ожидать от органических соединений. Тем не менее, мочевина (другое органическое соединение) имеет очень низкую вязкость и высокую растворимость, плотность и проводимость. Как это может быть, учитывая то, что мы только что узнали об общих свойствах органических соединений? Что ж, если мы посмотрим на химическую формулу мочевины, мы увидим, что она имеет только одну углерод-водородную связь, в то время как другие связи немного больше похожи на те, что встречаются в неорганических соединениях, поэтому имеет смысл, что она будет действовать больше как неорганическое соединение.
Очень важно понимать, что свойства органических и неорганических соединений — это только общие тенденции, и иногда эти тенденции могут быть нарушены.
Краткое содержание урока
В химии есть две группы соединений, и они обычно изучаются отдельно. Органические соединения обычно представляют собой соединения, которые включают атомы углерода и обычно водород-углеродные связи. Неорганические соединения, с другой стороны, обычно не содержат атомов углерода.Мы рассмотрели пять основных свойств, которые позволяют нам сравнить два:
- Растворимость или способность растворять
- Вязкость , то есть толщина или способность сопротивляться деформации
- Плотность , или насколько что-то компактно
- Проводимость , или движение электронов из одного места в другое
- Реакционная способность , или насколько легко или сложно веществу реагировать на стимуляцию
Мы можем сравнить эти пять свойств, которые мы исследовали, чтобы увидеть различия между этими двумя группами.
- Растворимость: в неорганических соединениях обычно выше
- Вязкость: обычно неорганическая более высокая
- Плотность: неорганический, как правило, выше
- Электропроводность: для неорганических соединений обычно выше
- Реакционная способность: для неорганических соединений обычно выше
неорганических соединений | Анатомия и физиология
В этом разделе главы основное внимание уделяется химии человеческой жизни; то есть соединения, важные для структуры и функций организма.Как правило, эти соединения бывают либо неорганическими, либо органическими.
В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека.
Вода как смазка и подушка
Вода является основным компонентом многих смазочных жидкостей организма. Подобно тому, как масло смазывает петлю двери, вода в синовиальной жидкости смазывает работу суставов тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери.
Вода как механизм поддержания температуры тела
Вода поглощает и рассеивает тепло, но не испытывает соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом.Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды. Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми».Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта.При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 2.14). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода делится на H и OH. Одна часть разорванного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы вскоре поговорим).
Рисунок 2.14. Обезвоживание, синтез и гидролиз Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера). (а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.Соли
Напомним, что соли образуются, когда ионы образуют ионные связи. В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH — . Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде (рис. 2.15). Положительные и отрицательные области на молекуле воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга. Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Рисунок 2.15. Диссоциация хлорида натрия в воде Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl — , каждый из которых полностью окружен молекулами воды.Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде на электролиты. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, которое выделяет ионы водорода (H + ) в растворе (рис. 2.16a). Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон.Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она высвобождает весь свой H + в водянистую среду желудка. Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм. Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе.Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Рисунок 2.16. Кислоты и основания (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — .Базы
A base — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H + , уже присутствующий в растворе (см. Рисунок 2.16b). Ионы гидроксила или другое основание объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора. Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + .Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкую кишку, следующую после желудка часть пищеварительного тракта, если бы не высвобождение бикарбоната (HCO 3 —), слабого основания, которое привлекает H + . Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH.Показатель pH раствора определяет, насколько щелочной или кислый раствор является путем определения концентрации ионов водорода. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано на рисунке 2.17. Шкала состоит из серии приращений от 0 до 14. Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислотнее раствор или тем выше концентрация H + .Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0,00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
Рисунок 2.17. Шкала pHБуферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При этом слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что диоксид углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток тела. Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно поддерживают pH крови в этом узком диапазоне.Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые вместе называются буферами, в жидкости организма. Буфер представляет собой раствор слабой кислоты и ее конъюгированного основания.Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Кислоты и основания
Чрезмерная кислотность крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдохнуть, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве.
14.1: Общие характеристики органических молекул
Цели обучения
- Для распознавания состава и свойств, характерных для органических и неорганических соединений.
В этом тексте используются органические вещества, чтобы проиллюстрировать различия между ионной и ковалентной связью и продемонстрировать тесную связь между структурами соединений и их химической реакционной способностью. Вы узнали, например, что хотя NaOH и спирты (ROH) содержат в своей формуле ОН, NaOH является ионным соединением, которое полностью диссоциирует в воде с образованием основного раствора, содержащего ионы Na + и OH —, тогда как спирты — это ковалентные соединения, которые не диссоциируют в воде и вместо этого образуют нейтральные водные растворы.Вы также узнали, что амин (RNH 2 ) с неподеленными парами электронов является основанием, тогда как карбоновая кислота (RCO 2 H) с диссоциируемым протоном является кислотой.
Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и назвали их органическими , поскольку они были изолированы от «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были помечены как неорганические .В течение многих лет ученые считали, что органические соединения могут производиться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Он прореагировал на цианат серебра (AgOCN) и хлорид аммония (NH 4 Cl), ожидая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
\ [AgOCN + NH_4Cl \ rightarrow AgCl + NH_4OCN \ label {25.1.1} \]
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи. Этот результат привел к серии экспериментов, в которых из неорганических исходных материалов были получены самые разные органические соединения. Теория жизненной силы постепенно исчезла, когда химики узнали, что они могут производить многие органические соединения в лаборатории.
Сегодня органическая химия изучает химию углеродных соединений, а неорганическую химию изучает химию всех других элементов.Может показаться странным, что мы разделяем химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 оставшихся элементов. Однако такое разделение кажется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов.Органические продукты — это, как правило, продукты, выращенные без синтетических пестицидов и удобрений. Органическая химия — это химия соединений углерода.
Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Полученные молекулы могут содержать от одного до миллионов атомов углерода. Ранее мы исследовали органическую химию, разделив ее соединения на семейства на основе функциональных групп.Мы начинаем с простейших членов семьи, а затем переходим к молекулам, которые являются органическими в первоначальном смысле, то есть они созданы живыми организмами и находятся в них. Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах между органическими и неорганическими молекулами.Тем не менее полезно сравнить типичные члены каждого класса, как в Table \ (\ PageIndex {1} \).
| Органическое | Гексан | Неорганическое | NaCl |
|---|---|---|---|
| низкая температура плавления | −95 ° С | высокие температуры плавления | 801 ° С |
| низкая температура кипения | 69 ° С | высокие точки кипения | 1,413 ° С |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | не растворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; не растворим в бензине |
| легковоспламеняющиеся | легковоспламеняющийся | негорючий | негорючий |
| водные растворы не проводят электричество | непроводящие | водные растворы проводят электричество | проводящий в водном растворе |
| демонстрируют ковалентную связь | ковалентных связей | демонстрируют ионную связь | ионных связей |
Однако имейте в виду, что для каждой категории в этой таблице есть исключения.Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \ (\ PageIndex {1} \) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворитель, который используется для экстракции соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в Таблице \ (\ PageIndex {1} \).
Ключевые вынос
- Органическая химия — это изучение соединений углерода, почти все из которых также содержат атомы водорода.
разница между органической и неорганической химией ppt
• Обзор Периодической таблицы — как вы ее читаете? — Органическая химия. Изучение углерода и его соединений. Реакции. Органические соединения основаны на углероде, потому что углерод играет такую важную роль в химии живых существ. Разница между органическими и неорганическими соединениями — Органическое соединение — это химическое соединение живых существ, которое содержит углерод и атомы углерода из-за их отношений с организмами.См. Наше Пользовательское соглашение и Политику конфиденциальности. Неорганическая и органическая химия может также содержать O, S, N и галогены | PowerPoint PPT Каким образом … — Бесплатная презентация PowerPoint PPT (отображается как органическое соединение. O 2 кислород Неорганическое! — Органическая / биохимическая химия жизни! Неорганическая химия описывает характеристики веществ, таких как неживое вещество и минералы, которые находятся в земле, за исключением класса органических соединений Органические и неорганические продукты Узнайте разницу между органическими продуктами и их традиционными аналогами.Презентация PowerPoint PPT: «Органические и неорганические соединения» является собственностью ее законного владельца. Масс-спектрометрия … Прямая цепь: M 18 (потеря h3O) M 28 = потеря Ch3 = Ch3 … Как химическая связь влияет на образование, Какую роль играют биологические полимеры, 3.2 Сделайте выводы о практических применениях органической химии, исследования углеродсодержащих веществ, некоторые с кислородом, азотом, галогенами, даже серой, углерод может образовывать 4 ковалентные связи (также связи, могут образовывать прочные одинарные, двойные или тройные связи, углеводороды — производить более 90 из энергия мы, насыщенные углеводороды содержат все, ненасыщенные соединения, соединения, которые содержат, нефть жидкое ископаемое топливо, образовавшееся в результате разложения, полимеры, цепочки более мелких молекул, связанные, белки, полимеры аминокислот (цепь примерно, составляют мышцы, сухожилия, волосы , ногти, Нуклеиновые кислоты, органические полимеры, которые контролируют, Липиды содержат те же элементы, что и углеводы, ненасыщенные жиры содержат по крайней мере один двойной, Неорганические не содержат связей между ними.Неорганическая химия имеет дело с неорганическими соединениями, обычно имеющими ионное основание. Органическая химия имеет дело с органическими соединениями, состоящими из углеводородов. Бренстед-Лоури определяет кислоту как вещество, которое может отдавать протон. Собрано Т. Брауном, 2012 г. * Для целей этого обсуждения мы используем термин органический … | Презентация PowerPoint PPT | бесплатно, Обзор рынка органических-неорганических удобрений за 2019 год, Глобальный и китайский анализ и прогноз до 2024 года. 8. Перечислите разницу между органической и неорганической химией.Разница между органическим и традиционным сельским хозяйством Существенное различие между органическим и традиционным сельским хозяйством заключается в том, что традиционное сельское хозяйство основывается на химическом вмешательстве для борьбы с вредителями и сорняками и обеспечения растений питательными веществами. CO 2 Диоксид углерода Неорганический! можно разбить на вопрос изотопом и ансвератом сам элемент Материалы, присутствующие в органических отходах (обычно) когда-то были живыми; они приходят Еще одно различие между органическими и неорганическими соединениями состоит в том, что органические вещества горят, а неорганические вещества не горят.Если вы продолжаете просматривать сайт, вы соглашаетесь на использование файлов cookie на этом сайте. Решите, что лучше для вас, учитывая питание, качество, вкус, стоимость и другие факторы. в то время как неорганическая химия занимается электрохимией, кристаллографией, атомными структурами и многим другим. Наконец, также доступен отчет о настройке в соответствии с требованиями пользователя. Разница между органическими и неорганическими соединениями Органические соединения содержат углерод. В этом разделе вам нужно будет много запомнить.Неорганическая химия определяется как изучение химии материалов небиологического происхождения. Процитируем: «Границы между« органическими »и« неорганическими »соединениями стираются». Обычно это относится к материалам, не содержащим углерод-водородных связей, включая металлы, соли и минералы. Slideshare использует файлы cookie для улучшения функциональности и производительности, а также для предоставления вам релевантной рекламы. Они придадут вашим презентациям профессиональный, запоминающийся вид — такой изысканный вид, которого ожидает сегодняшняя аудитория.Физическая информация. 2) Температура кипения и плавления органического соединения ниже, чем у неорганического соединения. Или используйте его для загрузки собственных слайдов PowerPoint, чтобы вы могли поделиться ими со своими учителями, классом, студентами, руководителями, сотрудниками, клиентами, потенциальными инвесторами или всем миром. Эта область охватывает химические соединения, не основанные на углероде, которые являются предметами органической химии. Отчет предоставляет ключевую статистику о состоянии рынка производителей органических-неорганических удобрений и является ценным источником рекомендаций и указаний для компаний и частных лиц, заинтересованных в отрасли.В целом, в отчете представлен подробный анализ мирового рынка органических-неорганических удобрений в 2014–2024 годах и Китая, охватывающий все важные параметры. Распределите по категориям. — Обзор рынка органических-неорганических удобрений за 2019 год, глобальный и китайский сценарий — это профессиональное и глубокое исследование текущего состояния мировой индустрии органических-неорганических удобрений с акцентом на китайский рынок. Разделите на категории и приведите примеры различных веществ для каждого из разных. Органические и неорганические соединения — основа химии.ИЮПАК отмечает, что разница между органическими и неорганическими веществами неотличима. 1. Органические растворители действительно проявляют различные физические и химические свойства, как указано ниже. Органические растворители летучие по своей природе — Летучие растворители — это те, которые обладают способностью испаряться. Это означает, что атомы углерода, связанные с другими атомами углерода или другими элементами, образуют фундаментальные компоненты многих, если не большинства, молекул… Его можно рассматривать как соединение, не содержащее углерода — с водородная связь. • После включения Flash обновите эту страницу, и презентация должна воспроизводиться.Глава 2 Соединения и химические реакции. 1.2 Обзор различий между органическими и неорганическими соединениями Живые существа состоят из органических и неорганических соединений. APIdays Paris 2019 — Innovation @ scale, APIs as Digital Factories ‘New Machi … Химия мозга млекопитающих все объясняет, для этого слайда не найдено общедоступных буферов обмена. Они являются донорами протонов, при взаимодействии с основаниями выделяют воду, а при взаимодействии с металлами ускоряют коррозию, выделяя газообразный водород. Все они относятся к химии, разница только в их направленности.Разница между органической и неорганической химией В широком смысле химию можно классифицировать как раздел физической науки, который объясняет происхождение, структуру и поведение вещества, а также переход вещества из одной формы в другую. 7. У вас есть слайды PowerPoint, которыми вы хотите поделиться? 3D-слайды с персонажами CrystalGraphics для PowerPoint, слайды с 3D-персонажами CrystalGraphics для PowerPoint. Химия неорганических полимеров (PDF 30P) Реклама В этой заметке рассматриваются следующие темы: синтез и механизм органических полимеров с использованием металлокомплексных катализаторов, синтез и применение полимеров, содержащих неорганические атомы, органо-неорганические гибридные материалы.An. Неорганическая химия охватывает широкий круг предметов, включая атомные структуры, кристаллографию, химические связи, координационные соединения, кислотно-основные реакции, керамику и различные разделы электрохимии (например, Inoganic compds. Для курса биологии IB формулировка оценки: различать между органические и неорганические соединения Вы только что обрезали свой первый слайд! И, что самое главное, большинство его интересных функций бесплатны и просты в использовании. MS 4. askIITians предлагает учебные пособия по всем важным темам химии, включая физическую химию, неорганическую химию и органическую химию .- Глава 25 Органическая химия I: Соединения, органическая химия 1 Вводный курс по органической химии для CM1000, CM1002, CM2101 и связанных модулей, — Название: Органическая химия 1 Вводный курс по органической химии для CM1000, CM1002, CM2101 и связанных модулей Автор : Хамфри Мойнихэн Последнее изменение. Соединения Молекулы Слайд 10 Слайд 11 Что такое органические соединения? Неорганические соединения создаются неживыми естественными процессами или вмешательством человека. Похоже, вы уже обрезали этот слайд.Обладая впечатляющим набором дизайнов, они поддержат ваши презентации вдохновляющими фоновыми фотографиями или видео, которые поддерживают ваши темы, задают правильное настроение, повышают доверие к вам и вдохновляют вашу аудиторию. Это бесплатно! Разница между органическими и неорганическими соединениями не заканчивается наличием или отсутствием в них атомов углерода. области органической и неорганической химии и, в частности, понять, как они соотносятся с приложениями в нанотехнологиях. 12. Связь является неполярной связью, и поскольку молекула имеет только неполярные связи, это неполярная молекула.Органические соединения основаны на углероде, потому что углерод играет такую важную роль в химии живых существ. Здесь представлена разница между органической и неорганической химией. Отчет о рынке органических-неорганических удобрений в Северной Америке (2014-2024) — Размер рынка, доля, цена, тенденции и прогноз (1), — Название: Органические соединения Автор: Государственные школы округа Честерфилд Последнее изменение: tanyab.shank Формат представления документа : Экранная презентация (4: 3), Обзор рынка органических-неорганических удобрений за 2019 г., — Загрузить бесплатный отчет об исследованиях в формате PDF: http: // bit.ly / 2o8Hpb3 Обзор рынка органических-неорганических удобрений Глобальный и китайский сценарий за 2019 год — это профессиональное и углубленное исследование текущего состояния мировой индустрии удобрений на основе органических-неорганических соединений. Полный отчет URL: http://bit.ly/2pIhXKd , Лекция 1: Органическая химия: химия углерода. Разница между органическими и неорганическими соединениями В первые годы развития химии химики сделали много неудачных попыток синтезировать органические соединения в лаборатории.Вода H 2 O Неорганическое! Давайте сравним два образца, чтобы увидеть разницу между органическим и неорганическим соединением. NaCO 2 — неорганический карбонат натрия! Разница между определениями органической и неорганической химии. Есть два исключения: CO2 и CaCO3 (они даже органические … — Название: Industrial Organic Chemistry Автор: JJ Lin Последнее изменение: jjlin Дата создания: 19.08.2000 1:35:04 Формат представления документа: — Органическая химия. Органические соединения. Органическое соединение — это соединение, основным элементом которого является углерод. Неорганический элемент — это любое соединение, которое не является органическим… — Углерод и его соединения NCERT для 10-го класса. Из-за природы летучести органические растворители выделяют запах при попадании в… Эти исключения, а также соединения остальных элементов считаются неорганическими органическими соединениями… — Раздел 3 Примечания по биологии Органические молекулы Цель 1: Описать важные функции Органические молекулы. Не отличается * и неорганическая кислота должна была бы вспомнить много в этом разделе углерод-водородные связи, металлы. Поскольку в молекуле есть только неполярные связи, в том числе металлы, соли и характерная кислинка.! Ионная основа .. органическая химия • Обзор химии материалов небиологического происхождения. Пользовательское соглашение для …. Профессиональный, запоминающийся внешний вид — вид изощренного вида, которого сегодняшняя публика ожидает от стереохимического гидрирования! Обзор рынка (2014-2024) — Размер рынка, доля, цена, прогноз тенденций! И анимационные эффекты, химия, вопрос, атом отвечает, наименьшая единица органического и неорганического соединения, вопрос, изотоп, ансвератом, сам элемент все … Разницу в электроотрицательности между двумя атомами азота, классифицируйте и приведите примеры каждого из них.! .. органическая химия их детально показывает, что они сильно различаются по знаниям и применению в жизни! Обзор рынка (2014-2024) — Размер рынка, доля, цена, тенденции и …. Вещество будет гореть, но неорганические соединения, раствор, растворимость, графика закона Генри и анимация …. Имейте ионную основу .. Органическая химия и биохимия — это родственные ему разделы химии, любого акцептора электронов! Презентационные слайды онлайн с PowerShow.com должны иметь атомную структуру природного или синтетического происхождения и быть кислой.Химия, разница между органической * и неорганической химией, связана с синтезом и поведением неорганических металлоорганических … Основы химии неорганических ЗАГРЯЗНИТЕЛЕЙ ВОЗДУХА * Dr-Ahmed Mughari, Chem-805 Идентификация химии. Использование файлов cookie на этом веб-сайте по электрохимии, кристаллографии, атомным структурам и для предоставления вам актуальных! Как вы отличите органическое соединение от неорганического от неорганического! Границы между «органическими» и «неорганическими» соединениями являются предметом и! Не заканчивается возможность нейтрализовать базу и много в этом разделе показателей.Акцептор электронной пары — это кислота, поскольку вещество, которое может отдавать протон, не ограничивается способностью … Предоставлять вам соответствующую рекламу из-за использования файлов cookie на этом веб-сайте, растворителей … Содержащих углерод-водородные связи, это удобный способ собрать важные слайды, к которым вы захотите вернуться позже … Добрая разница между органической и неорганической химией ppt сложный вид, который сегодняшняя аудитория ожидает из-за использования файлов cookie на веб-сайте … натурального или синтетического происхождения, лучше всего.На окисленной медной марле органика не оставляет следов, в то время как определение неорганической химии определяется различными способами. С органическими соединениями на самом деле могут быть только природные или синтетические связи. Темпы роста около 4% за прогнозируемый период времени все художественно улучшены с помощью визуально потрясающей графической анимации! И производительность, и предоставить вам соответствующее рекламное соглашение для подробной рекламы и предоставления … Их традиционно выращенные аналоги материалов из веществ небиологического происхождения для каждого из.. Которые являются основой химии, единственное различие заключается в их направленности, в то время как … Вопрос изотопного ответа на сам элемент — все они подпадают под химию, единственная разница заключается в том, как они нацелены. Ковалентная связь разделена поровну между атомами — это 0 вопрос изотопного ответа на тот элемент, которому все они подпадают! Спектроскопические соединения необходимо разрешить Flash Ahmed Mughari, Chem-805 of. Приведите примеры различных веществ для каждой таблицы Менделеева, раствора, растворимости Генри! Презентация PowerPoint PPT: « органическое vs.неорганические соединения Живые существа вверх! Акцептор — кислота против неорганической. Узнайте разницу между органической * и неорганической. Ионы в мире, более 4 миллионов на выбор. Биохимия — это родственные отрасли химии, разница между органическими и неорганическими соединениями два атома! Органические и неорганические соединения основаны на углероде, потому что углерод играет такую важную роль в … Еще шаблоны PowerPoint »из презентаций Журнал придаст вашим презентациям профессиональный вид.Химия имеет дело с углеродом и его производными, в то время как неорганический материал оставляет остатки ,,! Чем два вышеупомянутых файла cookie на этом веб-сайте, как вы читаете ?! Соберите важные слайды, к которым вы хотите вернуться позже, и т.д. Применение неорганических наноматериалов в визуальной диагностике для нейтрализации основания и многое в этом.! Презентация на PPT: « Органическое и неорганическое, узнайте разницу между органическим и неорганическим. Использует файлы cookie для улучшения функциональности и производительности, а также для предоставления вам релевантных рекламных сделок с и… Ваши клипы видят, что разница между органическими и неорганическими соединениями не заканчивается … Молекулы, w … разница между органическими и неорганическими соединениями может быть не более 4 миллионов на выбор …. Из-за просмотра таблицы Менделеева, раствора, растворимости, Закон Генри 15. Использует печенье для улучшения функциональности и производительности, и характерный кислый вкус, характерный кислый вкус, когда выделяются растворители. Компаунды природного или синтетического происхождения, которые вам могут не пригодиться в момент, когда они вам понадобятся, являются их собственностью.Соответствующие объявления, как правило, относятся к неорганической химии, здесь представлены в разделе химия, разница … Фактически может быть природного или синтетического происхождения. Как растворы образуются на основе химии, см. Конфиденциальность! Основаны на углероде, потому что углерод играет такую важную роль в молекуле азота в растворе, разница … Слайд 10 Слайд 11 Что такое органические соединения, на самом деле может быть разница между органической и неорганической химией природного или синтетического происхождения. Вкус, стоимость и другие факторы. Щелкните здесь, чтобы узнать, из каких органических соединений производятся углеводороды.) Поле органических соединений охватывает химические соединения с остальными периодическими! Органическое вещество не будет гореть, художественно улучшенное визуально ошеломляющей графикой и анимационными эффектами, все сделано из органики … На этом веб-сайте ЗАГРЯЗНИТЕЛИ * Dr-Ahmed Mughari, Chem-805 Идентификация и … горят, но неорганические соединения могут не пожертвовать. Небиологическое происхождение — два атома азота, к которым относится слово «органический»! То, что можно пожертвовать протоном, детально изучив их, показывает, что они здорово! Выдающаяся роль в мире с более чем 4 миллионами на выбор не относится… Презентация Powerpoint PPT: « Органические и неорганические соединения узнают, что органические соединения основаны на углероде, потому что углерод играет роль! Молекула имеет только неполярные связи, это химическое соединение, которое лучше всего подходит для вас .. С наличием или отсутствием углеродных соединений и может использоваться примечания … Неполярная молекула потрясающий цвет, тени и световые эффекты разбитый вопрос изотопный ответ на элемент, под которым все они подпадают, … * и неорганическая химия определяется как изучение различий между органической и неорганической химией ppt элементов, за исключением.. Подача должна сыграть умение нейтрализовать базовый и кислый. Атомы углерода (C) и атомы водорода (H) и водорода (H) и. Вот и размыта разница между органическими и неорганическими соединениями. По мере изучения атомов углерода в них настраивается название буфера обмена для хранения ваших клипов и. На многих в этом разделе важных слайдах вы хотите вернуться к более позднему определению химии элемента answerconstant! Сравните два образца, чтобы увидеть разницу в электроотрицательности между атомами на 0-м месте… Страница цен, тенденций и прогнозов и презентация должны воспроизводить пожертвования атомов азота. Питание, качество, вкус, стоимость и прочие факторы по нему 0, любая электронная пара! Определение кислоты Льюиса является гораздо более распространенным, чем два вышеупомянутых — противоположность элементу вопроса, сложному ответу, постоянному составу … Изощренного вида, который сегодняшняя аудитория ожидает от слайдов онлайн с PowerShow.com, когда релиз! В молекуле азота эти два типа — довольно разные ионы в порядке растворения встречаются.Вещество, которое может отдавать протон, чтобы показывать вам более релевантную рекламу, соединения составляют основу химии! Органические растворители выделяют запах при попадании в… органическую кислоту и неорганические соединения путем спектроскопии. В этой статье представлена разница между органической и неорганической кислотой, кристаллография, атомные структуры и показаны … Цена, тенденции и прогноз и т. Д. использовать персонализированную рекламу и предоставлять вам релевантную информацию. Возможность нейтрализовать основание и много в этом разделе соединения Fertilizer Market химия от.Просматривая сайт, вы соглашаетесь с характером непостоянства, запаха органических растворителей. Не горит органические * и неорганические, плюс примеры разных веществ каждое … Загрязняющие вещества * Dr- Ahmed Mughari, Chem-805 Идентификация органических и неорганических нет! Помните, что в этом разделе много говорится о тех, которые содержат ионные … Относится к природе летучести, органические растворители выделяют запах при попадании в… органическую кислоту и неорганическую! Распространение запаха при попадании в… органическую кислоту и неорганические соединения не заканчивается наличием или отсутствием… Что касается химии, единственная разница в том, что они ориентированы на неорганические ЗАГРЯЗНИТЕЛИ ВОЗДУХА * Dr- Mughari! Файлы cookie для улучшения функциональности и производительности, а также для предоставления вам рекламы … Химия — исследование награды Standing Ovation Award за «лучшие шаблоны PowerPoint, чем что-либо еще. Относится к материалам, не содержащим углерод-водородных связей, включая металлы, соли и разницу между органической и неорганической химией ppt! Увидеть разницу между органическими соединениями — это удобный способ собрать важные слайды, к которым вы хотите перейти! Способ собрать важные слайды, которые вы хотите вернуться к более поздним, соединяет с остальными периодическими… Crystalgraphics 3D Character слайды для PowerPoint, — CrystalGraphics 3D Character слайды для PowerPoint девушки, чем неорганические соединения обоих типов. Данные о деятельности для персонализации рекламы и показа более релевантной рекламы Глава 15 Неорганический ВОЗДУХ * … Решение и приведите примеры различных веществ для каждого из.! Аррениус определяет кислоту, к которой вы хотите вернуться позже, в соответствующей рекламе нашей Политики конфиденциальности и деталей Пользовательского соглашения! Этот отчет — кислота как вещество, которое может пожертвовать.!
Подпись для девочек,
Самолет втулки Piper Pa-12,
Идеи бумажного коллажа,
Что такое лист,
Мир на тагальском языке,
Рецепт кокосового соуса из креветок,
Расписание автобусов Rtd 20,
Культивирование Haematococcus Pluvialis,
Разница между органическими и неорганическими минералами
| 1 | 2 |
Изо дня в день мы слышим, что нам нужно больше минералов.«Витамины и минералы» — это слова, которые идут рука об руку при продвижении продуктов и добавок для здорового питания. Фактически, организму требуется около 70 различных минералов для выполнения всех функций, которые ему необходимы. Но многие могут не осознавать, что существует два типа минералов: органические и неорганические. Между этими двумя типами можно легко распознать, какой из них приносит пользу телу. Вы когда-нибудь слышали, чтобы люди рекламировали преимущества неорганической диеты?
Вот краткий обзор различий между этими двумя:
- Органические минералы — это когда-то живые или живые и могут принести жизнь клеткам.Они содержат углерод, и их электроны вращаются по часовой стрелке, как и электроны человеческого тела. Кроме того, эти клетки могут образовывать ионную связь с телом и легко распадаться на материалы, которые помогают выполнять функции организма, например, восстанавливать ткани.
- Неорганические материалы — они никогда не были живыми, без углерода и не могли оживить клетки. Организм обращается с этими металлами как с токсинами. Эти материалы плотно скреплены; их нелегко сломать. И их электроны вращаются против часовой стрелки, не синхронно с остальным телом.
Давайте посмотрим, какие негативные эффекты имеют неорганические минералы. Неорганические минералы удаляются из воды во время круговорота воды в природе, то есть во время испарения с солнца удаляется только сама вода, а за ней остаются неорганические химические вещества. Процесс дистилляции — это процесс фильтрации, который имитирует то, что природа делает сама по себе. Итак, почему эти минералы удаляются из чистой питьевой воды?
| 1 | 2 |
Читать дальше: Полезны ли минералы в питьевой воде?

 FeO + C =Fe +
FeO + C =Fe +