Содержание
Типичные реакции кислот, оснований, оксидов, солей (условия их проведения)
Типичные реакции кислот, оснований, оксидов, солей (условия их проведения)
Типичные реакции кислот
1. Кислота + основание → соль + вода
2. Кислота + оксид металла → соль + вода
3. Кислота + металл → соль + водород (условия: а) металл должен находиться в электрохимическом ряду напряжений левее водорода; б) должна получиться растворимая соль; в) нерастворимая кислота – кремниевая не реагирует с металлами; г) концентрированные серная и азотная кислоты реагируют иначе с металлами, водород не выделяется)
4. Кислота + соль → новая кислота + новая соль. (условие: реакция идёт в том случае, если образуется осадок или газ)
Типичные реакции оснований
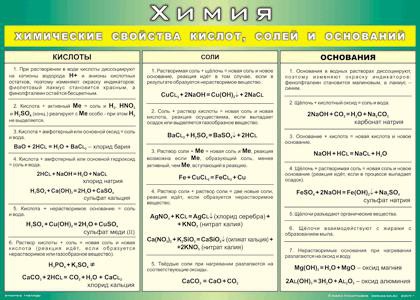
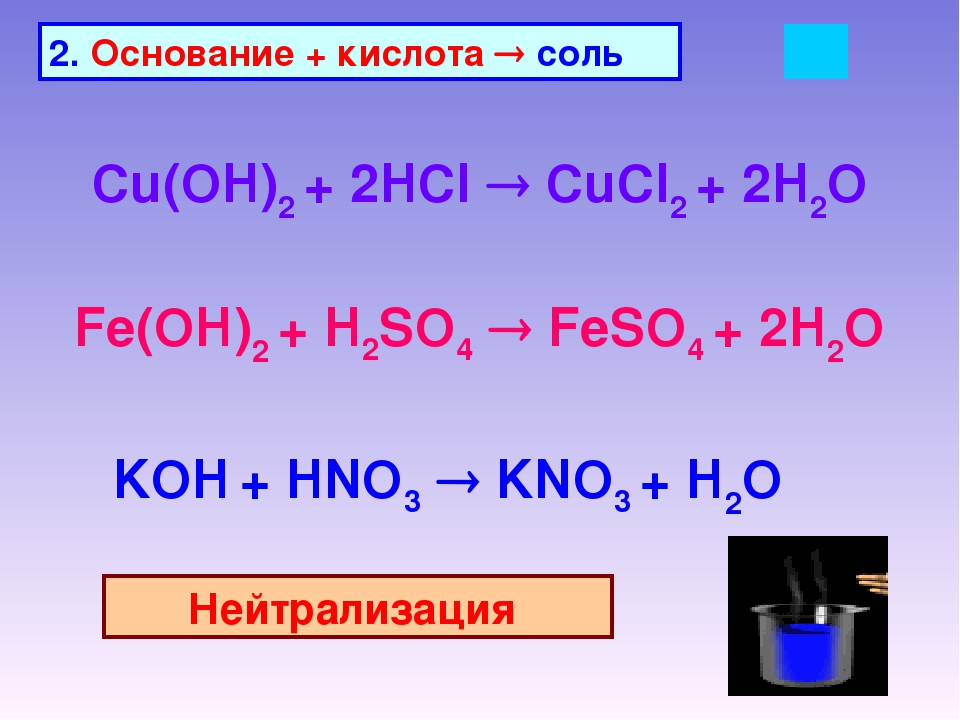
1. Основание + кислота → соль + вода
Основание + кислота → соль + вода
2. Основание + оксид неметалла → соль + вода (условие: оксид неметалла – кислотный оксид)
3. Щёлочь + соль → новое основание + новая соль (условие: образуется осадок или газ)
Типичные реакции основных оксидов
1. Основный оксид + кислота → соль + вода
2. Основный оксид + кислотный оксид → соль
3. Основный оксид + вода → щёлочь (условие: образуется растворимое основание-щёлочь)
Типичные реакции кислотных оксидов
1. Кислотный оксид + основание → соль + вода
2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + вода → кислота (условие: кислота должна быть растворимой)
Типичные реакции солей
1. Соль + кислота → другая соль + другая кислота (условие: если образуется осадок или газ)
Соль + кислота → другая соль + другая кислота (условие: если образуется осадок или газ)
2. Соль + щёлочь → другая соль + другое основание (условие: если образуется осадок или газ)
3. Соль1 + соль2 → соль3 + соль 4 (условие: образуется осадок)
4. Соль + металл → другая соль + другой металл (условие: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений; при этом обе соли должны быть растворимыми)
Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
 Классификация, получение, свойства. Часть I
Классификация, получение, свойства. Часть I
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O
(Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб. ) + Fe = FeSO4 + H2
) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.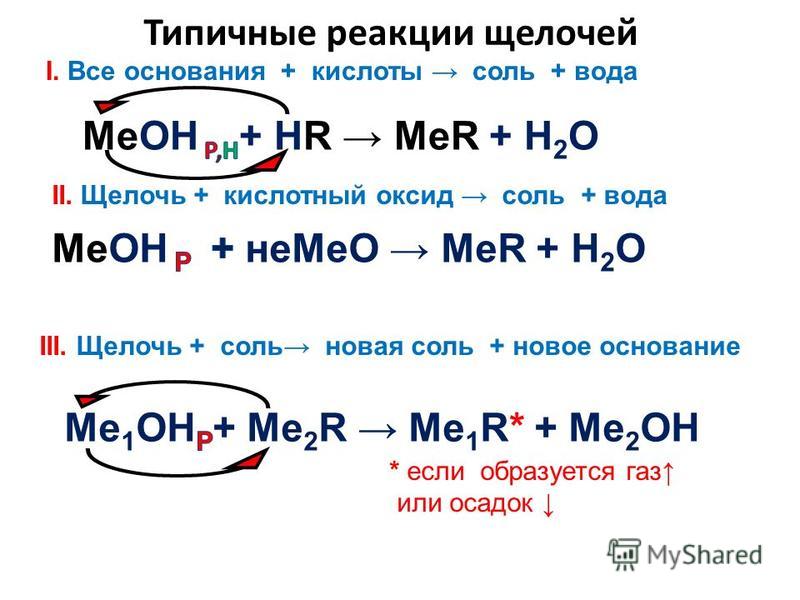
Возможно, вам также будут интересны другие разделы справочника по химии:
Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:
CuO+h3SO4→CuSO4+h3O.
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:
CO2+CaO→CaCO3.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.
Новости школы -Подготовка к ЕГЭ по химии. Часть А-3.
Неорганические вещества, их номенклатура, классификация.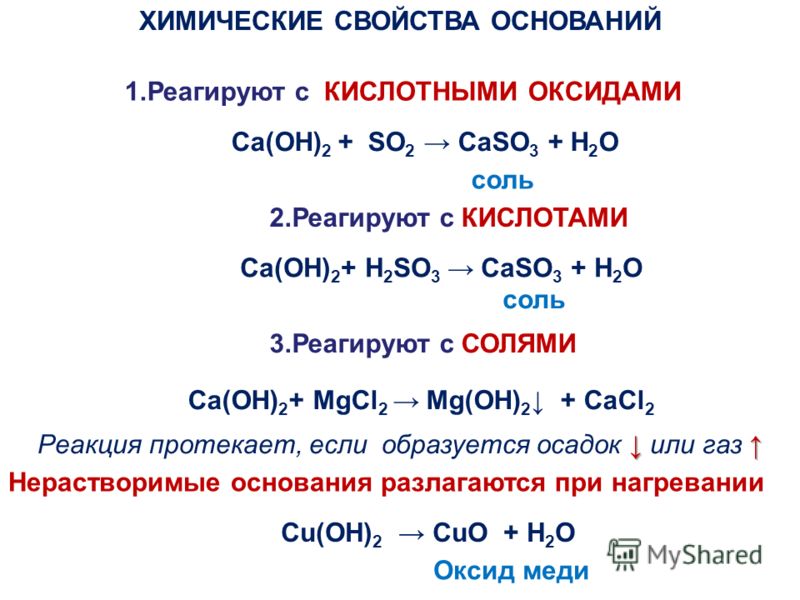
Характерные химические свойства неорганических веществ
различных классов
Обязательный минимум знаний
Схема 2
Классификация неорганических веществ
Вещества
Простые Сложные
Металлы Благородные Оксиды Соли
газы
Неметаллы Кислоты Основания
Схема 3
Оксиды и их классификация
Оксиды – бинарные соединения с кислородом в с.о. – 2
Несолеобразующие Солеобразующие
N2O, NO, CO 1. Основные – оксиды металлов в с.о. +1, +2
Основные – оксиды металлов в с.о. +1, +2
(оксиды металлов IА и IIА групп но не ZnO,
BeO), оксиды металлов в низших с.о. (СrO, FeO)
2. Кислотные – оксиды неметаллов (N2O5, SO2,
SO3) и металлов с высокой с.о. +5,+6,+7, (CrO3, Mn2O7).
3. Амфотерные — ZnO, BeO, Al2O3,
оксиды металлов в промежуточных с.о. (Cr2O3, Fe2O3).
Таблица 2
Характерные химические свойства солеобразующих оксидов
Гр. Оксидов Свойства | Основные оксиды | Кислотные оксиды | Амфотерные оксиды |
Образуют соль и воду в реакции обмена при взаимодействии | с кислотами | с основаниями | и с кислотами, и с основаниями |
Образуют соль в реакции соединения при взаимодействии | с кислотными и амфотерными оксидами | с основными и амфотерными оксидами | с основными и кислотными оксидами |
Образуют растворимый гидроксид при взаимодействии с водой | щелочи | кислородсодержащие кислоты | не взаимодействуют с водой |
Основания
Основания (в свете атомно-молекулярного учения) – сложные вещества, состоящие из металла и гидроксогрупп.
Основания (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп.
Основания (в свете протонной теории) – акцепторы катионов водорода.
Таблица 3
Классификация оснований
Характерные химические свойства оснований
и амфотерных гидроксидов
1. 1) Основание (или амфотерный гидроксид) + кислота = соль + вода
2) Бескилородное основание (аммиак, амины) + кислота = соль
2. Основание + кислотный оксид = соль + вода
3. Щелочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ)
4. Щелочь + амфотерный гидроксид = соль + вода
t
5. Нерастворимые основания (или амфотерный гидроксид) =
= оксид металла + вода
Кислоты
Кислоты (в свете атомно-молекулярного учения) – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты (в свете протонной теории) – доноры катионов водорода.
Характерные химические свойства кислот
1. Кислота + металл = соль + водород, если:
— металл находится в ряду напряжений до водорода,
— образуется растворимая соль,
— кислота растворима,
Примечания:
· щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют, в первую очередь, с водой,
· азотная кислота любой концентрации и концентрированная серная кислота взаимодействует с простыми веществами по-особому (см. табл. 5)
2. Кислота + оксид металла (основный или амфотерный) = соль + вода
3. Кислота + основание (гидроксид или бескислородное основание) = соль +
+ вода (для бескилородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок, газ или слабый электролит).
Таблица 4
Классификация кислот
Соли
Соли (в свете атомно-молекулярного учения) – сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
Примечание. Эти определения справедливы только для нормальных или средних солей.
Схема 4
Классификация солей
Соли
Средние Кислые Основные Двойные Комплексные
или нормальные Сa (HCO3)2, (CuOH)CO3, (NH4)2Fe (SO4)2, K3[Fe (CN)6]
NaCl, K2SO4, NaHSO4, Al (OH)2Cl, KAl (SO4)2, K4[Fe (CN)6]
CaCO3, RCOONa KH2PO4 Fe (OH)SO4 KCl∙NaCl
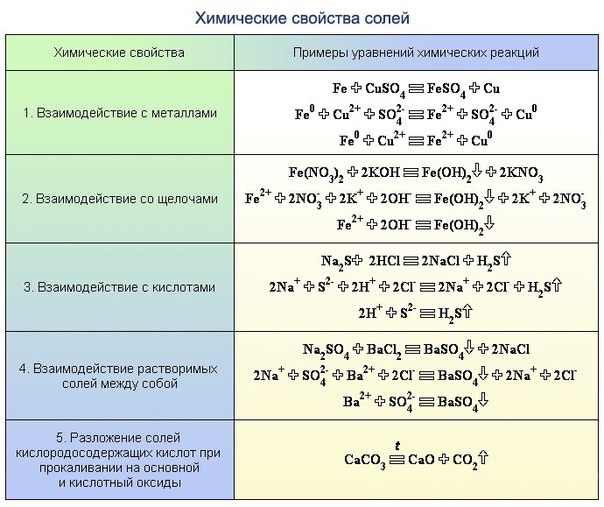
Характерные химические свойства солей
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щелочь = новая соль + новое основание (если образуется осадок или газ)
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок)
4. Соль (раствор) + металл = новая соль + новый металл, если:
· металл находится в ряду напряжений до металла соли,
· образуется растворимая соль.
Примечание: щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют, в первую очередь, с водой.
Примеры тестовых заданий и
рекомендации к их выполнению
1. Только солеобразующие оксиды находятся в ряду
1) P2O5, ZnO, NO
2) CO, N2O5, Na2O
3) Al2O3, N2O, N2O3
4) SiO2, BeO, CaO
Это задание следует выполнить методом исключения тех рядов веществ, в которых содержаться формулы несолеобразующих оксидов, так как таких оксидов немного и их нужно знать. Исключаются варианты ответов 1-3. Ответ 4.
Исключаются варианты ответов 1-3. Ответ 4.
2. Амфотерными гидроксидами являются вещества, формулы которых
1) CsOH и Cr (OH)2
2) KOH и Ca (OH)2
3) Be (OH)2и Cr (OH)3
4) NaOH и Mg (OH)2
Это задание также следует выполнить методом исключения тех пар веществ, в которых содержатся формулы щелочей, так как таких веществ в школьном курсе изучается немного и их следует знать. Ответ 3.
3. Кислотными оксидами являются вещества, формулы которых
1) N2O3, N2O5, CrO3
2) Cr2O3, CrO, N2O
3) NO, Na2O, P2O5
4) SiO2, BeO, CaO
Для быстрого определения верного ответа из предложенных вариантов необходимо исключить те, в которых встречаются оксиды металлов в с. о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
4. Содержит все три типа гидроксидов ряд веществ, формулы которых
1) H2SO4, Ca (OH)2, NaOH
2) Cr (OH)3, Cr (OH)2, H2CrO4
3) NaOH, HNO3, Mg (OH)2
4) KOH, HClO4, Ba (OH)2
Достаточно сложное, многофакторное задание, которое требует знания ряда химических понятий: гидрооксиды (это понятие объединяет основания, амфотерные гидрооксиды и кислородсодержащие кислоты), зависимость свойств оксидов и гидроксидов металлов от величины с.о. (как правило, оксид и гидроксид с низшей с. о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
5. Формулы только кислых солей записаны в ряду
1) K2SO4, KOH, H2SO4, NaHCO3
2) Fe (HSO4)2, CaHPO4, CaCO3, Ca (OH)NO3
3) NH4HSO4, NH4NO3, (NH4)2HPO4, (NH4)2 CO3
4) NaH2PO4, Na2HPO4, NaHCO3, NaHS
Для быстрого определения верного ответа нужно ориентироваться на ключевое словосочетание «кислая соль», т. е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
6. Двухосновная, растворимая, кислородсодержащая, сильная и стабильная кислота имеет формулу
1) H2SO3 2) H2S 3) H2SO4 4) H2S2O3
Условию задания отвечает вариант 3, т.к. любому школьнику известно, что сернистая кислота нестабильна, а сероводородная – слабая. Тиосерная кислота для обычного школьника представляет собой «экзотику», поэтому необходимо остановиться на привычной и хорошо известной серной кислоте. Ответ 3.
7. Средняя соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Сa (НСO3)2, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
Для успешного выполнения этого задания необходимо мысленно разделить предложенные ответы на три подстолбика. Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3)FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
Успешное выполнение этого задания зависит от ключевого слова «соответственно», которое задает порядок поиска верного ответа: средняя, кислая и основная соли. Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
9. В следующей характеристике гидроксида бария неверно положение
1) кислородсодержащее основание, щелочь
2) сильное двухкислотное основание
3) способно образовать два ряда солей – средние и основные
4) летучее, непрочное соединение
Ключевым словосочетанием к выполнению задания является «неверно положение», оно и позволит определить искомый ответ. Ответ 4.
10. Оксиду фосфора (V) не соответствует кислота, формула которой
1) H3PO4 2) H4P2O7 3)H3PO3 4) HPO3
Ключом к решению этого задания является положение о том, что с. о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
11. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) Al, Zn, Cu 2) Zn, Fe, Pb 3) Mg, Zn, Fe 4) Pb, Cu, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II) – практически нерастворимая соль, о чем свидетельствует соответствующая клеточка в таблице растворимости. Ответ 3.
Ответ 3.
12. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1, 2 и 4. Ответ 3.
13. С раствором хлорида меди (II) не реагирует
1) Mg 2) Zn 3) Fe 4) Ag
Легкое заданий на знание ряда напряжений металлов. Ответ 4.
14. С раствором сульфата меди (II) не реагирует
1)Pb 2)Zn 3) Fe 4) Mg
Задание аналогично предыдущему, но с учетом условий протекания реакций между раствором соли и металлом. Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
15. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида – щелочи. Следовательно, это должен быть оксид щелочного или щелочноземельного металла. Ответ 3.
16. Серебро из раствора нитрата серебра вытесняют все металлы ряда
1) Na, Cr, Zn 2) K, Fe, Cu 3) Fe, Zn, Cu 4) Zn, Fe, Au
Задание на знание свойств солей и ряда напряжений металлов. Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
17. При взаимодействии меди с концентрированной серной кислотой образуются
1) CuSO4, SO2, H2O
2) CuSO4, H2
3) CuO, SO2, H2O
4) Cu2SO4, SO2, H2O
Задание на знание свойств концентрированной серной кислоты, которая при взаимодействии с металлами, стоящими в ряду напряжений до и после водорода, образует соль, воду и один из продуктов восстановления сульфат-иона (SO2, S или H2S). Это знание позволит выбрать ответы 1 и 4. Более вероятен ответ 1, так как серная кислота – сильный окислитель и образование Cu2SO4 неневозможно. Ответ 1.
Ответ 1.
18. Железо способно вытеснять из растворимых солей – нитратов магния, свинца (II), меди (II), ртути (II), серебра – металлы
1) Mg, Pb, Cu, Hg, Ag
2) Pb, Cu, Hg, Ag
3) Cu, Hg, Ag
4) Hg, Ag
Задание на знание свойств солей и ряда напряжений металлов. Ответ 2.
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
Так как разбавленная серная кислота проявляет характерные свойства растворов кислот, то она не взаимодействует с металлами, стоящими в ряду напряжений металлов после водорода. Верный ответ, записанный в вариантах первым, позволит другие ответы не рассматривать. Ответ 1.
20. И с гидроксидом натрия, и с соляной кислотой реагирует
И с гидроксидом натрия, и с соляной кислотой реагирует
1) СaO 2) BeO 3) SiO2 4) P2O5
И с кислотой, и со щелочью взаимодействует амфотерный оксид. Ответ 2.
21. С гидроксидом бария реагирует ряд веществ, имеющих формулы
1) NaCl, Na2SO4, Na2CO3
2) HNO3, NaOH, K2SO4
3) ZnO, K2O, CO2
4) Al (OH)3, CuSO4, HCl
Так как Ba (OH)2 – щелочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ – 4. К такому результату можно прийти, исключив варианты 2 (он включает щелочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
22. Сульфат железа (II) не может быть получен взаимодействием
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) гидроксида железа (II) с разбавленной серной кислотой
Задание на знание свойств классов неорганических соединений: кислот, солей, гидроксидов. Это знание позволит определить верный ответ. Ответ 3.
23. Веществами, при взаимодействии которых образуется соль, являются
1) щелочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Несложное задание на знание химических свойств оксидов. Ответ 3.
Ответ 3.
24. В цепочке превращений
S →X1→SO3→X2→CuSO4→X3→CuO→Cu
веществами X1,X2 и X3 являются соответственно
1) H2S, H2SO4, Cu (OH)2
2) FeS, H2SO4, Cu (OH)2
3) SO2, H2SO4, CuCl2
4) SO2, H2SO4, Cu (OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, а SO2.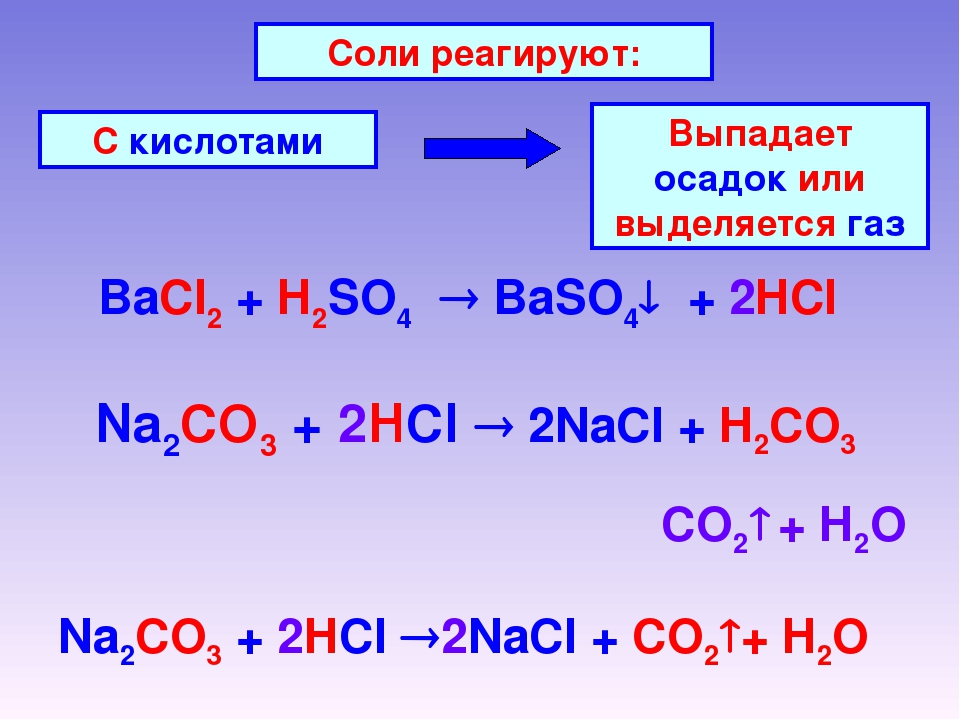 В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
25. В цепочке превращений
Сa → X1 → Ca (OH)2 →X2 →Ca (HCO3)2 → X2 → CaO
веществами X1, X2 являются соответственно
1) CaCl2, СaCO3,
2) CaO, Ca (NO3)2
3) CaО, СaCO3
4) CaО, Ca3 (PO4)2
Вещество X1 определить несложно – это CaO. Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
26. В цепочке превращений
Zn → X1 → Zn (NO3)2 → X2 → Na2ZnO2 →ZnCl2→AgCl→X3
веществами X1, X2 и X3 являются соответственно
1) ZnCl2, ZnO, Ag
2) ZnO, Zn (OH)2, Ag
3) ZnSO4, Zn (OH)2, PbCl2
4) ZnO, Zn (OH)2, AgNO3
Рассуждения, аналогичные приведенным выше, но с учетом амфотерности гидроксида цинка, позволят определить вещества X1, X2 — ZnO, Zn (OH)2 соответственно. Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
27. В схеме превращений
X1 X2 X3
AlCl3 → Al (OH)3 → NaAlO2 → AlCl3
веществами X1,X2 и X3 являются соответственно
1) H2O, NaOH, NaCl
2) H2O, Cu (OH)2, HCl
3) NaOH, NaCl, HCl
4) NaOH, Na2O, HCl
Непростое задание на знание свойств солей и амфотерных гидроксидов. Для выпускников определение X2 представляет сложность, т. к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
28. Вещество, которое может реагировать с фосфорной кислотой, гидроксидом натрия и цинком, имеет формулу
1) Al (OH)3 2) Ba (NO3)2 3) CuCl2 4) NaHCO3
Для решения этого задания необходимо отнести каждое из предложенных веществ к соответствующей группе: амфотерный нерастворимый гидроксид, две средние соли, кислая соль. Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
Ответ 3.
29. Веществу, которое может реагировать с хлором, нитратом серебра и ацетатом свинца, соответствует формула
1) KI 2) Cu 3) K2SO4 4) NaF
Задание более сложное, чем 28, так как требует знания о «ряде активности галогенов» (каждый предыдущий галоген вытесняет каждый последующий из растворов галогеноводородных кислот и их солей), а также знание номенклатуры солей органических кислот: ацетату свинца соответствует формула (CH3COO)2Pb. Обращение к таблице растворимости и учет условий взаимодействия растворов солей между собой позволят прийти к правильному решениию. Ответ 1.
30. Верны ли следующие суждения применительно к солям
А) В результате взаимодействия кислых солей со щелочами образуются средние соли
Б) В результате взаимодействия средних солей с основаниями образуются кислые соли
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Второе утверждение неверно, т. к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
Задания для самостоятельной работы
1. В перечне веществ
1) N2O
2) N2O5
3) N2O3
4) CO2
5) NO
6) CO
к несолеобразующим оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1,4,6 2) 3,5,6 3) 1,5,6 4) 4,5,6
2. Амфотерными оксидами являются вещества
1) оксид серы (IV), оксид железа (III)
2) оксид цинка, оксид кальция
3) оксид хрома (III), оксид бериллия
4) оксид алюминия, оксид магния
3. Основными оксидами являются вещества
1) оксид кальция, оксид хрома (II)
2) оксид калия, оксид олова (IV)
3) оксид меди (I), оксид алюминия
4) оксид бериллия, оксид железа (П)
4. Содержит все три типа гидроксидов ряд веществ
Содержит все три типа гидроксидов ряд веществ
1) H3AlO3, Fe (OH)3, H2SO4
2) H2ZnO2, H3PO4, Ba (OH)2
3) H2BeO2, HCI, Cu (OH)2
4) H2CO3, H2CrO4, NaOH
5. Формулы только основных солей записаны в ряду
1) (CaOH)2SO4, Ca (OH)2, CaOHCl
2) Fe (OH)3, Fe (OH)2NO3, [Fe (OH)2]SO4
3) MnOHNO3, CuOHCl2, Mg (OH)2
4) FeOHCl2, FeOHCl, [Fe (OH)2]SO4
6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) Mg (OH)2 2) NH3 3) NaOH 4) Ва (ОН)2
7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Na2SO4, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3) FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
9. Гидроксид алюминия – это
1) амфотерный гидроксид
2) трехкислотное основание
3) щелочь
4) летучее основание
10. Оксиду марганца (VII) соответствует гидроксид, формула которого
Оксиду марганца (VII) соответствует гидроксид, формула которого
1) Mn (OH)2 2) MnO (OH) 3) H2MnO4 4) HMnO4
11. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
12. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
13. С раствором щелочи не реагирует
1) Mg 2) Zn 3) Al 4) Be
14. С раствором сульфата меди (II) взаимодействует
1) Pb 2) Hg 3) Fe 4) Ag
15. Взаимодействием соответствующего оксида с водой нельзя получить
Взаимодействием соответствующего оксида с водой нельзя получить
1) Cu (OH)2 2) Ba (OH)2 3) H2SO4 4) NaOH
16. Медь из раствора сульфата меди (II) вытесняет все металлы ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
17. При взаимодействии меди с концентрированной азотной кислотой образуются
1) CuO, NO2, H2O
2) Cu (NO3)2, H2
3) Cu (NO3)2, NO, H2O
4) Cu (NO3)2, NO2, H2O
18. Окислительно-восстановительная реакция протекает при разложении соли, формула которой
1) NH4Cl 2) KMnO4 3) CaCO3 4) (CuOH)2CO3
19. C концентрированной азотной кислотой при комнатной температуре не взаимодействует
C концентрированной азотной кислотой при комнатной температуре не взаимодействует
1) медь
2) железо
3) серебро
4) цинк
20. С раствором серной кислоты реагируют все три вещества набора
1) СaO, NaOH, KCl
2) Cu (OH)2, HCl, CH3COONa
3) BaCl2, Zn, SiO2
4) MgCO3, Fe, Al (OH)3
21. И с соляной кислотой, и с водой реагирует
1) аммиак 2) хлор 3) никель 4) карбонат кальция
22. Сульфат железа (III) может быть получен взаимодействием железа с
1) разбавленной серной кислотой
2) раствором сульфата меди (II)
3) хлором
4) серой
23. Веществами, при взаимодействии которых не образуется соль, являются
1) кислотный оксид и щелочь
2) кислотный оксид и вода
3) основный оксид и кислота
4) кислота и основание
24. В цепочке превращений
В цепочке превращений
Ca →X1→Ca (OH)2 → X2→ CaO → X3→ AgCl
веществами X1,X2 и X3 являются соответственно
1) CaO, CaCO3, CaCl2
2) CaSO4, CaCO3, CaCl2
3) CaO, CaSO4, CaCl2
4) CaO, Ca (HCO3), CaCO3
25. В цепочке превращений
N2 → X1 → NO →X2 → HNO3
веществами X1, X2 являются соответственно
1) N2O, NO2
2) NO2, NH3
3) N2O3, N2O
4) NH3, NO2
26. В цепочке превращений
Al → X1 → Al2 (SO4)3 → X2 → KAlO2 →AlCl3→X2®Al2O3
веществами X1 и X2 являются соответственно
1) AlCl3, AlN
2) Al (OH)3, KAl (SO4)2
3) Al2O3, Al2S3
4) Al2O3, Al (OH)3
27. В схеме превращений
В схеме превращений
X1 X2 X3
SO2 → SO3 → H2SO4 → (NH4)2SO4
веществами X1,X2 и X3 являются соответственно
1) O2, H2O, NH3
2) NO2, H2, NH3
3) O2, H2O, N2
4) O2, H2, NH3∙H2O
28. Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
1) Cl2 2) H2SO4 3) Сr2O3 4) Na2CO3
29. При нагревании не разлагается на простые вещества
1) аммиак 2) хлорид натрия 3) оксид ртути (II) 4) иодоводород
30. Верны ли следующие суждения применительно к кислотам
Верны ли следующие суждения применительно к кислотам
А) Любую кислоту можно получить растворением соответствующего кислотного оксида в воде
Б) Кислоты способны взаимодействовать со щелочами
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
03 Октябрь 2011, 15584 просмотра.
Комментарии
Список детей, зачисленных в 1 класс на 2019-2020 учебный год
Уважаемые родители!
Организационное родительское собрание состоится 14 мая 2019 года в 17.00 в актовом зале гимназии (3 этаж).
Явка всех родителей обязательна.
В этот же день (14 мая) вы сможете заказать школьную форму установленного образца с 16.00 ч. до 20.00 ч. (будут проводится обмеры детей).
Список детей, зачисленных в 1 класс на 2019-2020 учебный год
| 1А МАЛЬЧИКИ | |
| 1 | Гизатуллин Матвей |
| 2 | Жуков Никита |
| 3 | Кармазинский Георгий |
| 4 | Левенберг Александр |
| 5 | Мельничук Лука |
| 6 | Макеев Егор |
| 7 | Нефедов Степан |
| 8 | Никитин Иван |
| 9 | Потапов Семен |
| 10 | Токарев Никита |
| 1Б ДЕВОЧКИ | |
| 1 | Блинова Любовь |
| 2 | Белова Юлия |
| 3 | Глухова Мария |
| 4 | Габидинова София |
| 5 | Галянина Елизавета |
| 6 | Измайлова Ангелина |
| 7 | Лебедева Ярослава |
| 8 | Мурашева Дарья |
| 9 | Миняйло Мария |
| 10 | Миняйло Татьяна |
| 11 | Михельсон Софья |
| 12 | Шипицына Татьяна |
ЕГЭ по химии, подготовка к ЕГЭ по химии 2021 в Москве, сложность, оценки, задачи, шкала перевода баллов — Учёба.
 ру
ру
Что требуется
Из предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
Особенности
Это одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Советы
Окислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
1. Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
2. Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
3. При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Химические свойства кислот, химия 8 класс
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.

Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
- бескислородные
- кислородсодержащие.
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
- сильные
- слабые электролиты.
Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать её в классах и школах с углублённым изучением естественно-научных предметов.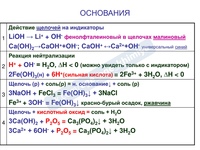
Купить
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
HNO3 → H+ + NO—3
HCl → H+ + Cl—
Многоосновные кислоты диссоциируют ступенчато.
Н3РО4 ↔ Н+ + Н2РО—4 (первая ступень)
Н2РО—4 ↔ Н+ + НРO2-4 (вторая ступень)
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
H2CO3 → H2O + CO2↑
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
В результате взаимодействия образуется соль и выделяется водород.
Mg + 2HCl → MgCl2 + H2↑
Найти ряд активности можно на последней странице электронного учебника
«Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
Au + HNO3 + 4HCl → HAuCl4 + NO + 2H2O.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Na2CO3 + 2CH3 — COOH → 2CH3 — COONa + H2O + CO2↑.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
K2O + 2HNO3 → 2KNO3 + H2O
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
В результате реакций образуются свободные галогены.
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Что ещё почитать?
Неметаллы
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
18HBr + 2KMnO4 →2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 →3I2↓ + 2Crl3 + 2KI + 7H2O
#ADVERTISING_INSERT#
14.
 5: Реакции кислот и оснований
5: Реакции кислот и оснований
Цели обучения
- Запишите реакции кислотно-щелочной нейтрализации.
- Напишите реакции кислот с металлами.
- Запишите реакции оснований с металлами.
Реакция нейтрализации
Реакция, которая происходит, когда кислота, такая как \ (\ ce {HCl} \), смешивается с основанием, например \ (\ ce {NaOH} \):
\ [\ ce {HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H_2O (l)} \ nonumber \]
При объединении кислоты и основания образуются вода и соль. .{-}} \)] \) — получается нейтральный раствор с pH = 7. Кислота и основание нейтрализовали друг друга, и кислотные и основные свойства больше не присутствуют.
Однако солевые растворы не всегда имеют pH 7. Посредством процесса, известного как гидролиз , ионы, образующиеся при объединении кислоты и основания, могут реагировать с молекулами воды с образованием слабокислого или основного раствора. Как правило, если сильная кислота смешивается со слабым основанием, полученный раствор будет слегка кислым.Если сильное основание смешать со слабой кислотой, раствор будет слегка щелочным.
Как правило, если сильная кислота смешивается со слабым основанием, полученный раствор будет слегка кислым.Если сильное основание смешать со слабой кислотой, раствор будет слегка щелочным.
Видео: Эквимолярный (~ 0,01 M) и эквивалентный растворы \ (\ ce {HCl} \) и \ (\ ce {NaOH} \) объединяются для получения соленой воды. https://youtu.be/TS-I9KrUjB0
Пример \ (\ PageIndex {1} \): пропионовая кислота + гидроксид кальция
Пропионат кальция используется для подавления роста плесени в пищевых продуктах, табаке и некоторых лекарствах. Напишите сбалансированное химическое уравнение реакции водного раствора пропионовой кислоты (CH 3 CH 2 CO 2 H) с водным гидроксидом кальция [Ca (OH) 2 ].
Решение
| Ступени | Реакция |
|---|---|
Напишите несбалансированное уравнение. Это реакция двойного вытеснения, когда катионы и анионы меняются местами, образуя воду и соль. | CH 3 CH 2 CO 2 H (водн.) + Ca (OH) 2 (водн.) → (CH 3 CH 2 CO 2 ) 2 Ca (водн.) + H 2 O (л) |
Сбалансируйте уравнение. Поскольку в формуле для Ca (OH) 2 присутствуют два иона OH — , нам нужны два моля пропионовой кислоты, CH 3 CH 2 CO 2 H, чтобы получить H + ионы. | 2 CH 3 CH 2 CO 2 H (водн.) + Ca (OH) 2 (водн.) → (CH 3 CH 2 CO 2 ) 2 Ca (водн. |
Упражнение \ (\ PageIndex {1} \)
Напишите сбалансированное химическое уравнение реакции твердого гидроксида бария с разбавленной уксусной кислотой.
- Ответ
\ [\ ce {Ba (OH) 2 (s) + 2Ch4CO2H (вод.) → Ba (Ch4CO2) 2 (вод.) + 2h3O (l)} \ nonumber \ nonumber \]
Кислоты и основания реагируют с металлами
Кислоты реагируют с большинством металлов с образованием соли и газообразного водорода. Как обсуждалось ранее, металлы, которые более активны, чем кислоты, могут подвергаться реакции однократного замещения . Например, металлический цинк реагирует с соляной кислотой с образованием хлорида цинка и газообразного водорода.
\ [\ ce {Zn (s) + 2HCl (водн.) → ZnCl2 (водн.) + H3 (g)} \ nonumber \]
Основания также реагируют с некоторыми металлами, такими как цинк или алюминий, с образованием газообразного водорода. Например, гидроксид натрия реагирует с цинком и водой с образованием цинката натрия и газообразного водорода.
Например, гидроксид натрия реагирует с цинком и водой с образованием цинката натрия и газообразного водорода.
\ [\ ce {Zn (s) + 2NaOH (водн.) + 2h3O (l) → Na2Zn (OH) 4 (водн.) + H3 (g)}. \ Nonumber \]
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
кислотно-основная реакция | Определение, примеры, формулы и факты
Кислотно-основная реакция , тип химического процесса, типичным примером которого является обмен одного или нескольких ионов водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода , H 2 O; или уксусная кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−). Он также включает аналогичное поведение молекул и ионов, которые являются кислотными, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
Он также включает аналогичное поведение молекул и ионов, которые являются кислотными, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
сульфат натрия
Сульфат натрия, также называемый глауберовской солью, является, как и другие соли, продуктом кислотно-щелочной реакции.
Martin Walker
Популярные вопросы
Что такое кислоты и основания?
Кислоты — это вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода.Кислота в водном растворе имеет кислый вкус, меняет цвет голубой лакмусовой бумаги на красный, вступает в реакцию с некоторыми металлами (например, с железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует определенным химическим реакциям (кислотный катализ). Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий.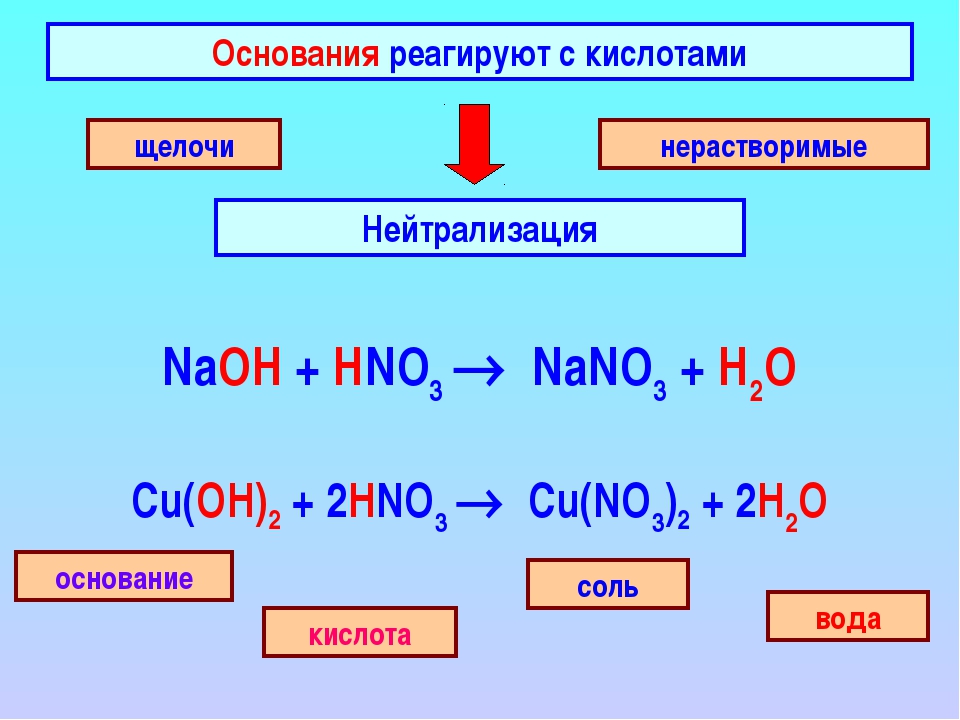 Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Как измеряются кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в зависимости от их относительной силы.Чистая вода, которая является нейтральной, имеет pH 7. Раствор с pH менее 7 считается кислым, а раствор с pH более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения, близкие к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения, близкие к 14. Более слабые кислоты и основания ближе к значению pH 7, чем их более сильные собратья.
Что происходит во время кислотно-щелочной реакции?
Кислотно-основная реакция — это тип химической реакции, которая включает обмен одним или несколькими ионами водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода, H 2 O) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2-). Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Как кислоты и основания нейтрализуют друг друга (или нейтрализуют друг друга)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно разлагаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания нейтрализация более подходящим образом включает прямой перенос протонов от кислоты к основанию.Если один из реагентов присутствует в большом избытке, реакция может дать соль (или ее раствор), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, реагирующих друг с другом.
Кислоты — это химические соединения, которые в водном растворе проявляют резкий вкус, разъедающее действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основания — это химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом и без характерных свойств кислот или оснований.
Основания — это химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом и без характерных свойств кислот или оснований.
Идея о том, что одни вещества являются кислотами, а другие — основаниями, почти так же стара, как и химия, а термины кислота , основание и соль встречаются в трудах средневековых алхимиков очень рано. Кислоты, вероятно, были первыми из них, которые были распознаны, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota происходит от слов, означающих кислый (лат. acidus , немецкий sauer , древнескандинавский sūur и Русский кислый ).К другим свойствам, ранее ассоциировавшимся с кислотами, относились их растворяющее или коррозионное действие; их действие на растительные красители; и вспенивание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались, главным образом, их способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Основания (или щелочи) характеризовались, главным образом, их способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Несмотря на их неточный характер, эти идеи служили для сопоставления значительного диапазона качественных наблюдений, и многие из самых обычных химических материалов, с которыми сталкивались первые химики, можно было классифицировать как кислоты (соляная, серная, азотная и угольная кислоты), (сода, поташ, известь, нашатырный спирт) или соли (поваренная соль, нашатырный спирт, селитра, квасцы, бура).Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из первых примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в некотором химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать с регенерированием исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция утверждает, что обратимые химические реакции достигают точки баланса или равновесия, в которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать с регенерированием исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция утверждает, что обратимые химические реакции достигают точки баланса или равновесия, в которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Помимо теоретического интереса, кислоты и основания играют большую роль в промышленной химии и в повседневной жизни. Серная кислота и гидроксид натрия входят в число продуктов, производимых в наибольших количествах химической промышленностью, и большой процент химических процессов включает кислоты или основания в качестве реагентов или катализаторов. Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии пронизывают повседневную жизнь, и термин соль является особенно распространенным.
Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии пронизывают повседневную жизнь, и термин соль является особенно распространенным.
Реакция кислот — кислоты, основания и соли — (CCEA) — GCSE Chemistry (Single Science) Revision — CCEA
1. Кислотные реакции с металлами
Кислоты реагируют с металлами с образованием соли и водорода.
кислота + металл → соль + водород
Пример:
zuv0wqlg2a.0.0.0.1:0.1.0.$0.$1.$4″> соляная кислота + магний → хлорид магния + водород
2HCl (водный) + Mg (s) → MgCl 2 (водный) + H 2 (g)
Наблюдения: серый твердый магний исчезает, образуется бесцветный раствор, выделяется тепло, пузыри.
Водород в этих реакциях можно проверить. Тест на водород :
- наложите светящуюся шину
- результаты хлопка
2. Кислотные реакции с основаниями
zuv0wqlg2a.0.0.0.1:0.1.0.$0.$2.$1″> Кислоты реагируют с основаниями с образованием соли и воды.
кислота + основание → соль + вода
Пример:
серная кислота + оксид меди (II) → сульфат меди (II) + вода
H 2 SO 4 (водный) + CuO (s) → CuSO 4 (водн.) + H 2 O (l)
Наблюдения: черный твердый оксид меди (II) исчезает, образуется голубой раствор.
3. Кислотные реакции с карбонатами и гидрокарбонатами
Кислоты реагируют с карбонатами и гидрокарбонатами металлов одинаковым образом. Эти реакции производят соль, воду и углекислый газ.
кислота + карбонат → соль + вода + диоксид углерода
или
кислота + гидрокарбонат → соль + вода + диоксид углерода
Пример — карбонат:
соляная кислота + карбонат меди (II) → хлорид меди (II) + вода + диоксид углерода
zuv0wqlg2a.0.0.0.1:0.1.0.$0.$3.$7″> 2HCl (водн.) + CuCO 3 (т) → CuCl 2 (водн.) + H 2 O (л) + CO 2 (г)
Наблюдения: зеленый твердый карбонат меди (II) исчезает, образуется голубой раствор, выделяется тепло, пузыри.
Пример — гидрокарбонат:
соляная кислота + гидрокарбонат натрия → хлорид натрия + вода + диоксид углерода
HCl (водн.) + NaHCO 3 (т) → NaCl (водн.) + H zuv0wqlg2a.0.0.0.1:0.1.0.$0.$3.$11.$3″> 2 O (л ) + CO 2 (г)
Наблюдения: твердый белый гидрокарбонат натрия исчезает, образуется бесцветный раствор, пузырьки.
Газообразный диоксид углерода, образующийся в этих реакциях, можно проверить. Тест на диоксид углерода :
- пузырьковый газ в бесцветной известковой воде (раствор гидроксида кальция)
- раствор изменится с бесцветного на молочный, если газ представляет собой диоксид углерода
4.Кислотные реакции с аммиаком
zuv0wqlg2a.0.0.0.1:0.1.0.$0.$4.$1″> Кислоты реагируют с аммиаком с образованием соли.
кислота + аммиак → соль аммония
Пример:
серная кислота + аммиак → сульфат аммония
H 2 SO 4 (водн.) + 2NH 3 (г) → (NH 4 ) 2 SO 4 (водн.)
Кислоты, основания и соли | CPD
Хлорид натрия — это источник натрия в нашем рационе, необходимый для передачи нервных импульсов и поддержания надлежащего баланса жидкости в организме. На протяжении всей истории люди использовали эту соль для консервирования мяса, очистки ран и изготовления мыла.
На протяжении всей истории люди использовали эту соль для консервирования мяса, очистки ран и изготовления мыла.
Натрия хлорид — один из примеров соли. В химии термин «соль» относится к группе ионных соединений, образующихся в результате реакции нейтрализации между кислотой и основанием.
Понятия кислот, оснований и солей вводятся в начале обучения в средней школе, развиваются и уточняются по мере успеваемости учащихся и лежат в основе многих будущих тем. Вот несколько идей, которые помогут заинтересовать студентов, избежать неправильных представлений и связать практическую работу с основными концепциями.
Что нужно знать студентам
- Кислоты — это водородсодержащие вещества с кислым вкусом, которые образуют растворы со значением pH менее 7. Обычные примеры включают соляную кислоту, серную кислоту, лимонную кислоту и этановую кислоту (уксус / уксусная кислота).
- Основания — это группа веществ, нейтрализующих кислоты.
- Растворимые основания называются щелочами.
 Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак.
Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак. - Нейтрализация — это реакция между кислотой и щелочью с образованием соли и воды.
- Соли не имеют запаха и имеют соленый вкус, многие из них растворимы в воде. Общие примеры включают хлорид натрия, йодид калия, карбонат кальция и сульфат меди.
- Шкала pH используется для измерения кислотности и щелочности.
- Индикаторы — это вещества, меняющие цвет при изменении кислотности / щелочности. Лакмус — общий индикатор; щелочные растворы окрашиваются в красный лакмусовый синий цвет, а кислые растворы — в синий лакмусовый красный цвет.
- Кислоты могут реагировать с некоторыми металлами с образованием соли и газообразного водорода.
Идеи для занятий
Учащиеся имеют богатый опыт работы с кислотами, основаниями и солями, накопленный как в школе, так и в повседневной жизни. Стоит начать тему с выявления их существующих идей путем совместного построения карты разума. Будьте внимательны к недопониманиям и постарайтесь устранить их, прежде чем двигаться дальше.
Стоит начать тему с выявления их существующих идей путем совместного построения карты разума. Будьте внимательны к недопониманиям и постарайтесь устранить их, прежде чем двигаться дальше.
Использование реальных примеров и анекдотов в классе может помочь закрепить идеи.Загрузите подборку анекдотов о кислотах, основаниях и солях (MS Word или pdf).
Использование реальных примеров и анекдотов в классе может помочь закрепить идеи. Загрузите подборку анекдотов о кислотах, основаниях и солях с веб-сайта Education in Chemistry : rsc.li/2Oj0lQk.
Одна особая проблема, которая может возникнуть при введении лабораторных кислот и щелочей, заключается в том, что они оба похожи на воду. Учащимся сложно использовать химические свойства для характеристики этих растворов.Задача «Мудрец и писец» может использоваться для демонстрации ограничений визуального описания и усиления необходимости искать наличие или отсутствие определенных характеристик или свойств. Загрузите информацию об учениках (MS PowerPoint или pdf) и заметки учителя (MS Word или pdf) для этого упражнения.
Загрузите информацию об учениках (MS PowerPoint или pdf) и заметки учителя (MS Word или pdf) для этого упражнения.
Одна особая проблема, которая может возникнуть при введении лабораторных кислот и щелочей, заключается в том, что они оба похожи на воду. Учащимся сложно использовать химические свойства для характеристики этих растворов.Задача «Мудрец и писец» может использоваться для демонстрации ограничений визуального описания и усиления необходимости искать наличие или отсутствие определенных характеристик или свойств. Загрузите информацию об учениках и заметки для учителей для этого упражнения: rsc.li/2Oj0lQk.
В этом упражнении мудрец должен описать простое изображение двум писцам. Один писец записывает описание мудреца, а другой пытается нарисовать по нему рисунок. Могут ли переписчики идентифицировать изображение? Описания субъективны и могут быть неправильно истолкованы, тогда как идентификация требует объективного подхода.
Свяжите эту идею с тем, как мы можем четко различать два раствора, которые выглядят как вода, особенно с использованием индикаторов с кислотами и щелочами.
Стремитесь одинаково вводить кислоты и щелочи, а не сосредотачиваться только на кислотах. В качестве домашнего задания попросите учащихся определить бытовые вещества, являющиеся кислотами и щелочами. Их обычно можно найти на кухне и в ванной комнате. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами.Студент может принести образцы и протестировать их с помощью кислоты или щелочи? Кислый или щелочной? Мероприятия. Затем активность Color creactions может быть использована для введения универсального индикатора и шкалы pH перед переходом к нейтрализации.
Стремитесь одинаково вводить кислоты и щелочи, а не сосредотачиваться только на кислотах. В качестве домашнего задания попросите учащихся определить бытовые вещества, являющиеся кислотами и щелочами. Их обычно можно найти на кухне и в ванной комнате. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами.Студент может принести образцы и протестировать их с помощью «Кислота или щелочь? Кислая или щелочная активность? ’(Rsc. li/2PueBT7). Затем активность «Цветные реакции» можно использовать для введения универсального индикатора и шкалы pH перед переходом к нейтрализации (rsc.li/2CaCriy).
li/2PueBT7). Затем активность «Цветные реакции» можно использовать для введения универсального индикатора и шкалы pH перед переходом к нейтрализации (rsc.li/2CaCriy).
Важно продумать, чему вы хотите, чтобы учащиеся извлекли уроки из этих занятий, и как этого можно достичь. Время должно быть поровну разделено между практическими занятиями (включая просмотр демонстраций и видео) и последующей умственной деятельностью по обсуждению основных концепций и идей.Учащиеся могут совместно работать над развитием своего понимания, используя структурированные беседы, которые позволяют установить связи между практической работой и лежащими в основе концепциями.
Связывание практических задач с основополагающими концепциями
Помните, что время, выделяемое на практическую работу, должно быть поровну разделено между практическими занятиями и установлением связей между явлениями и лежащими в их основе концепциями.
Призывайте студентов наблюдать и интерпретировать, задавая вопросы. Попробуйте повторить их ответы на правильном языке. Например, замените «проделал дыру» или «прожжил» на «корродировал».
Попробуйте повторить их ответы на правильном языке. Например, замените «проделал дыру» или «прожжил» на «корродировал».
С практикой студенты могут вести свои практические беседы в своей группе. У структурированных разговоров должны быть строгие ограничения по времени. Строительные леса, такие как основы предложений, побуждают как слушать, так и отвечать друг другу.
вопросов
- Что вы наблюдали?
- Что вы можете сделать из этого?
- Почему…?
- Что вы думаете о…?
- Каковы последствия для…?
- Как может…?
Основы приговора
- Я видел…
- Я думаю, это показывает…
- Это говорит о том, что…
- Думаю, это говорит нам…
- А как насчет…?
- Я не согласен с вами, потому что…
- Я не понимаю…
Распространенные заблуждения
Студенты часто считают, что только кислоты вызывают коррозию и могут быть идентифицированы, потому что они разъедают / сжигают материалы. Однако щелочи также могут быть очень агрессивными, как показано на видео о банках из-под кока-колы.
Однако щелочи также могут быть очень агрессивными, как показано на видео о банках из-под кока-колы.
Студенты часто считают, что только кислоты вызывают коррозию и могут быть идентифицированы, потому что они разъедают / сжигают материалы. Однако щелочи также могут вызывать сильную коррозию, как показано в видеоролике «Коксовые банки в кислоте и щелоче» (bit.ly/2C5YyXv).
Используйте видео как подсказку, чтобы выявить идеи коррозии. Объясните, что коррозию можно определить как «разрушение или разрушение материала из-за реакции с окружающей средой».Деградация — это изменение объемных свойств материала, который будет выглядеть иначе, станет более слабым или даже разрушится из-за химических изменений. Это описание побуждает студентов видеть материалы как на макроскопическом (объемном) уровне, так и на субмикроскопическом (частицы) уровне. Например, раствор гидроксида натрия добавляют в алюминиевую банку, которая распадается с выделением газа (макроскопически), потому что частицы гидроксида натрия реагируют с частицами алюминия с образованием соли алюминия и газообразного водорода (субмикроскопические). .
.
Используйте видео как подсказку, чтобы выявить идеи коррозии. Объясните, что коррозию можно определить как «разрушение или разрушение материала из-за реакции с окружающей средой». Деградация — это изменение объемных свойств материала, который будет выглядеть иначе, станет более слабым или даже разрушится из-за химических изменений. Это описание побуждает студентов видеть материалы как на макроскопическом (объемном) уровне, так и на субмикроскопическом (частичном) уровне (узнайте больше о том, как заставить ваших учеников задуматься о том, как они учатся: rsc.li / 2C596X0). Например, раствор гидроксида натрия добавляют в алюминиевую банку, которая распадается с выделением газа (макроскопически), потому что частицы гидроксида натрия реагируют с частицами алюминия с образованием соли алюминия и газообразного водорода (субмикроскопические). .
Старайтесь избегать использования антропоморфных описаний, таких как «атаковать» или «съесть». Эти термины, как правило, приводят к представлениям о химических веществах, которые «хотят» или «нуждаются» в реакции.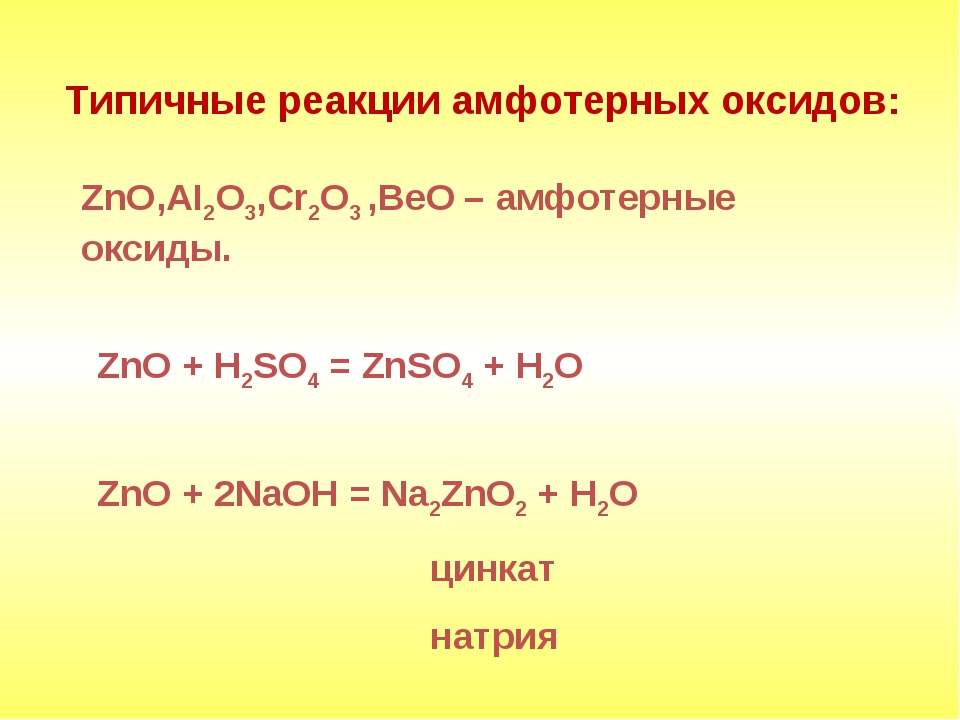 Это усложнит учащимся четкое понимание того, как и почему протекают химические реакции.
Это усложнит учащимся четкое понимание того, как и почему протекают химические реакции.
Формирующее оценивание
Сопоставление концепций — полезный инструмент для усиления связи этой темы с учебной программой. Упражнение «Пересмотр кислот» (rsc.li/2OTINtu) было адаптировано как оценивание для учебной деятельности (rsc.li/2A365VQ).
Предоставьте студентам возможность практиковаться как в более длинных ответах (четыре и шесть баллов), так и в вопросах с несколькими вариантами ответов (одна оценка) при подготовке к экзаменам. Покажите вопрос и дайте студентам две минуты, чтобы написать свой ответ на мини-доске.Важно отметить, что попросите их написать, почему они выбрали свой ответ. Это дает возможность выявить недопонимание и незамедлительно дать обратную связь.
Переход на 14–16
В уроках 14–16 используется более сложная модель кислотности, основанная на ионах водорода и гидроксида. Кислоты выделяют ионы водорода (H + ) в растворе и ионы гидроксида щелочей (OH — ).
pH формально определяется как логарифмическая мера концентрации ионов водорода.Нейтрализация определяется как реакция ионов водорода и гидроксид-ионов с образованием воды. Также проводится различие между разбавленным / концентрированным (количество вещества) и слабым / сильным (степень ионизации). Наконец, есть специальные устройства и методы, которые необходимо использовать и понимать, включая скорость реакции и титрование (см. Наши руководства по практической работе в спецификациях GCSE).
pH формально определяется как логарифмическая мера концентрации ионов водорода. Нейтрализация определяется как реакция ионов водорода и гидроксид-ионов с образованием воды.Также проводится различие между разбавленным / концентрированным (количество вещества) и слабым / сильным (степень ионизации). Наконец, необходимо использовать и понимать определенные устройства и методы, включая скорость реакции и титрование (см. Наши руководства по практической работе в спецификациях GCSE: rsc. li/2pIPwbD).
li/2pIPwbD).
Итого
- Кислые и щелочные растворы можно идентифицировать по их химическим свойствам.
- Усилить твердую природу кислот, оснований и солей, чтобы учащиеся отошли от простого упоминания об объемных свойствах и антропоморфных описаниях, таких как «съел дыры».
- Объясните связь между практической работой и основополагающими концепциями, используя макроскопические и субмикроскопические представления.
- Эта тема лежит в основе многих будущих тем, включая синтез и анализ химических веществ.
Использование химических реакций для получения соли
Нейтрализация
Реакция между кислотой и основанием называется нейтрализацией. Именно так работают лекарства от расстройства желудка — они содержат химические вещества, которые реагируют и нейтрализуют избыток желудочной кислоты.Промышленность использует этот же метод для производства широкого спектра солей и продуктов.
Вот как работает нейтрализация:
Кислые растворы содержат ионы водорода (H + ).
Щелочные растворы содержат ионы гидроксида (OH — ).
Вот слово уравнение реакции между кислотой и щелочью:
Кислота + щелочь → соль + вода
Ионное уравнение для всех реакций нейтрализации:
H + (водн.) + OH — (водн.) → H 2 O (л)
Тип соли, образующейся во время реакции, зависит от используемых кислоты и щелочи.
Кислоты, щелочи и соли, которые они производят
При нейтрализации соляной кислоты образуются хлоридные соли.
Соляная кислота + гидроксид натрия → хлорид натрия + вода
При нейтрализации азотной кислоты образуются нитратные соли.
Азотная кислота + гидроксид калия → нитрат калия + вода.
При нейтрализации серной кислоты образуются сульфатные соли.
Серная кислота + гидроксид натрия → сульфат натрия + вода.
Изготовление солей из оксидов металлов
Оксиды металлов также могут использоваться в качестве оснований и вступать в реакцию с кислотами с образованием солей и воды.
Вот словесное уравнение реакции между кислотой и металлическим основанием:
Оксид металла + кислота → соль + вода
Например:
Оксид меди (CuO) + соляная кислота (2HCl) → хлорид меди (CuCl 2 ) + вода (H 2 0)
В то время как довольно химически активные металлы могут реагировать с кислотами с образованием соли и водорода, соли очень инертных металлов, таких как медь, не могут быть получены таким образом, потому что эти металлы не реагируют с кислотами.
И соли очень реакционноспособных металлов, таких как натрий, не могут быть получены таким способом, потому что реакция между металлом и кислотой слишком интенсивна, чтобы ее можно было проводить безопасно.
Получение соли из реакции осаждения
Некоторые нерастворимые соли могут быть получены в результате реакции между двумя растворами. Сульфат бария — нерастворимая соль. Это может быть получено реакцией между растворами хлорида бария и сульфата натрия.
Например:
Хлорид бария + сульфат натрия → сульфат бария + хлорид натрия
Реакции осаждения могут использоваться для удаления нежелательных ионов из растворов. Этот метод используется для очистки питьевой воды и сточных вод.
Изготовление солей из карбонатов металлов
Кислоты можно нейтрализовать карбонатами металлов с образованием солей. Большинство карбонатов металлов нерастворимы, поэтому они являются основаниями, но не щелочами.
При нейтрализации кислот карбонатами металлов образуются соль, вода и диоксид углерода. Это означает, что такие породы, как известняк, содержащие карбонатные соединения, повреждаются кислотными дождями.
Вот слово уравнение реакции:
Карбонат металла + кислота → соль + вода + диоксид углерода
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нейтрализация
Влияние кислот и оснований на здоровье:
Кислоты и основания являются примерами коррозионных ядов, которые вступают в реакцию
локально на клетках ткани.Химические вещества, которые являются очень простыми или очень
кислые являются реактивными. Эти химические вещества могут вызвать серьезные ожоги.
Кислота для автомобильных аккумуляторов — это химическое соединение, обладающее химической активностью.
Автомобильные аккумуляторы содержат более сильную форму некоторых из тех же
кислота, которая находится под кислотным дождем. Бытовые очистители канализации часто содержат
щелок, очень щелочное химическое вещество, обладающее реакционной способностью.
Кислоты и основания способны вызывать сильные «ожоги».
похожи на ожоги от тепла.Эти материалы действуют в первую очередь
дегидратация клеточных структур. Тогда структуры белков
разрушается под действием кислоты или основания, которое катализирует расщепление
пептидных связей. В результате получаются все меньшие и меньшие фрагменты, ведущие
к окончательному распаду тканей.
Глаза и легкие особенно чувствительны к коррозии.
яды. Роговица глаз повреждается кислотными или щелочными ожогами.
Отек легких (наполнение водой) возникает при высокой концентрации
едкие загрязнители (острое отравление) достигают легких.Подкладка
носа, носовых пазух и легких раздражаются и заболевают водой
(путем обезвоживания клеток). Это происходит при попытке разбавить
ядовитый агент. Это заболоченное состояние препятствует нормальному
обмен кислорода и углекислого газа.


 ) + 2 H 2 O (л)
) + 2 H 2 O (л) Знакомство
Знакомство