Содержание
Просто выберите вариант ответа.
1.Основные оксиды образуют металлы:
А)
Ответ:
Объяснение:
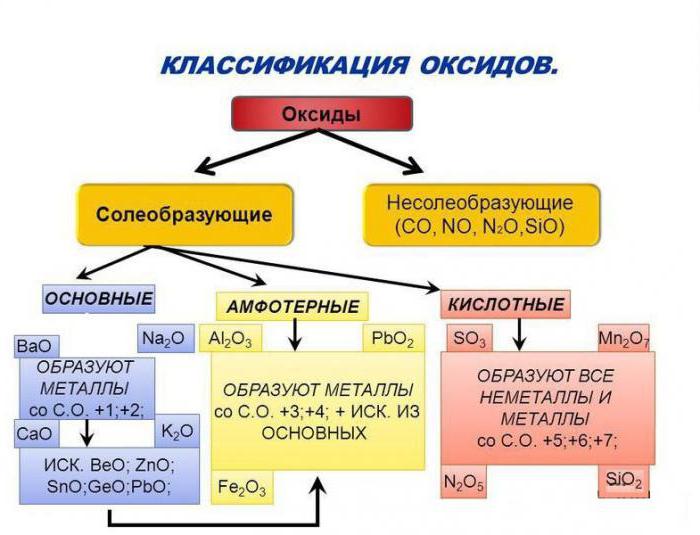
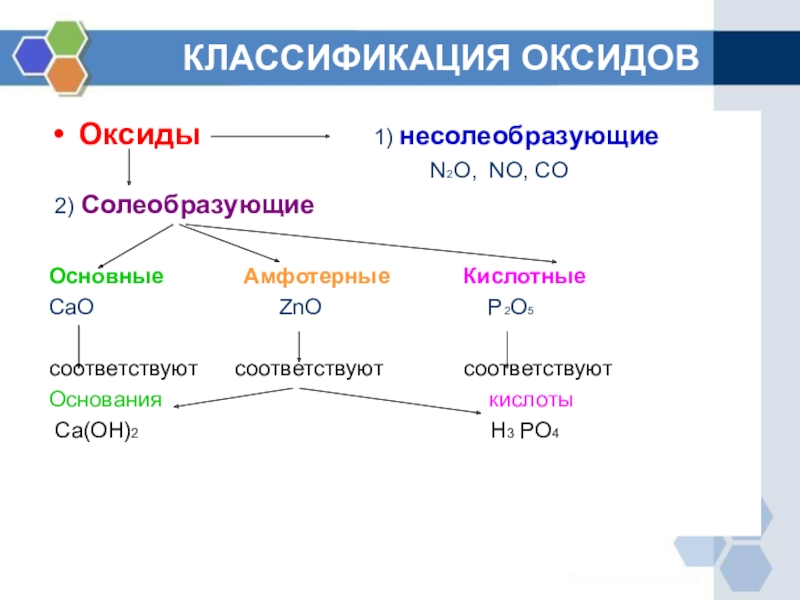
По способности образовывать соли в реакциях с соединениями других классов оксиды делят на солеобразующие и несолеобразующие (CO, SiO, NO, N2O). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные. Осно́вными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы металлы: щелочные (Li2O, Na2O, K2O, Cs2O, Rb2O), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3 (Cu2O, CuO, Ag2O, CrO, FeO, MnO, CoO, NiO, Sc2O3).
Кислотные оксиды образуют как элементы неметаллы (CO2, SO2, NO2, P2O5, Cl2O7), так и элементы металлы, причем в последнем случае степень окисления атома металла должна быть +5 и выше (V2O5, CrO3, Mn2O7, MnO3, Sb2O5, OsO4).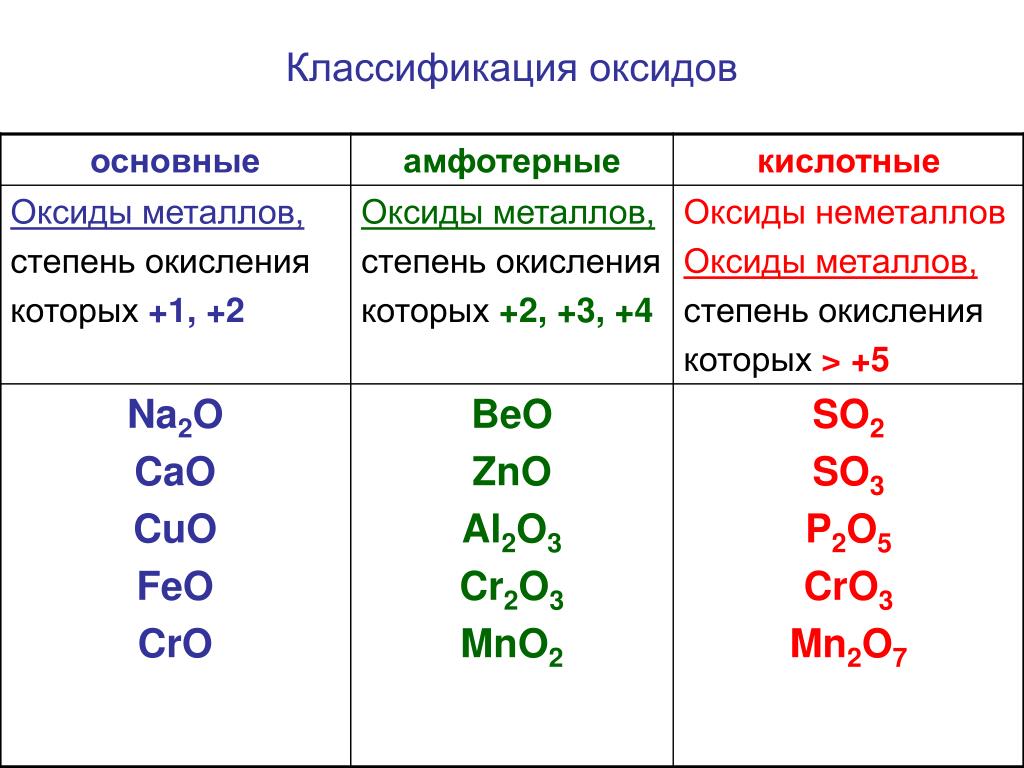 Амфотерные оксиды образуют, как правило, элементы металлы (ZnO, Al2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Амфотерные оксиды образуют, как правило, элементы металлы (ZnO, Al2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Оксиды металлов в степени окисления +5 и выше являются кислотными и имеют молекулярное строение.
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды — твердые вещества, кислотные оксиды могут быть жидкими (SO3, Cl2O7, Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2). Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Al2O3 и ZnO, другие — бесцветные (h3O, CO2, SO2). Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра.
Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов — вещества молекулярного строения (одно из немногих исключений — оксид кремния(IV), имеющий атомную кристаллическую решетку). Примеры графических формул кислотных оксидов (для оксидов немолекулярного строения приводить графические формулы не рекомендуется):
Примеры графических формул кислотных оксидов (для оксидов немолекулярного строения приводить графические формулы не рекомендуется):
Специфические свойства оксидов. Оксиды. Получение и свойства. Типичные реакции амфотерных оксидов
Оксиды
— сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2
.
По способности образовывать соли оксиды делят на солеобразующие
и несолеобразующие
(СО,SiO,NO,N 2 О). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные
.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li 2 О, Na 2 О, К 2 О, Cs 2 О, Rb 2 О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu 2 O, CuO, Ag 2 O, СrO, FeO, MnO, СоO, NiO).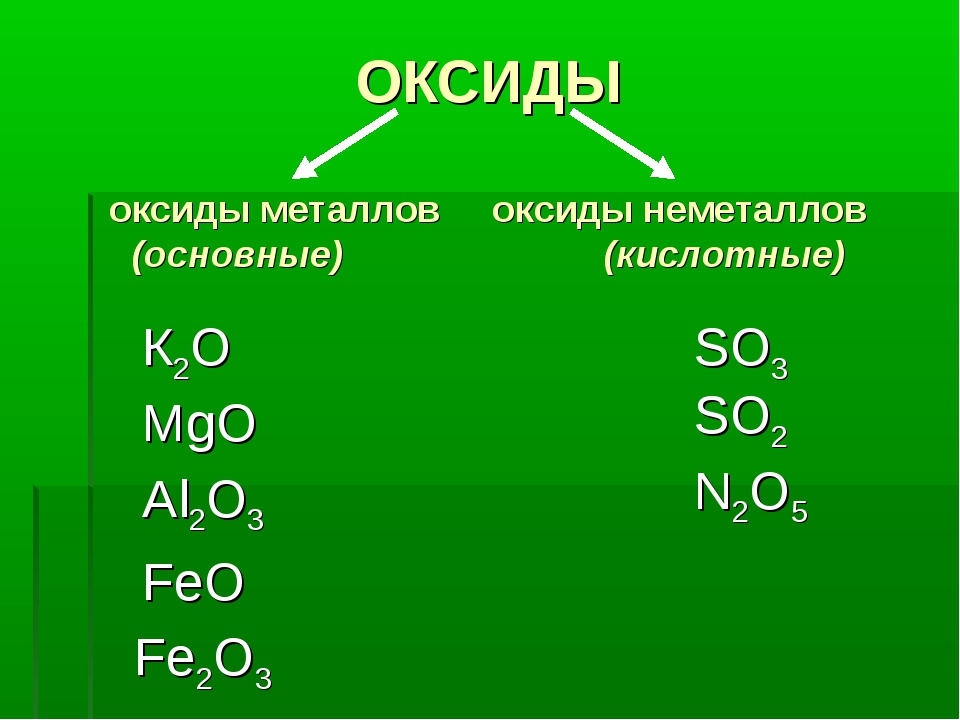
Кислотные оксиды образуют как элементы-неметаллы (СО 2 , SO 2 , NO 2 ,Р 2 O 5 , Cl 2 O 7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V 2 O 5 , СrO 3 , Mn 2 O 7 , MnO 3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI 2 O 3 , Fe 2 O 3 , BeO, Cr 2 O 3 , PbO, SnO, MnO 2).
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO 3 ,Сl 2 O7,Mn 2 O7), газообразными (CO 2 , SO 2 , NO 2) и твердыми (P 2 O 5 , SiO 2). Некоторые имеют запах (NO 2 , SO 2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый газ NO 2 , вишнево-красный CrO 3 , черные CuO и Ag 2 O, красные Cu 2 O и HgO, коричневый Fe 2 O 3 , белые SiO 2 , Аl 2 O 3 и ZnO, другие — бесцветные (H 2 O, CO 2 , SO 2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют , для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Большинство кислотных оксидов вещества (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Al 2 O 3 +6KOH+3H 2 O=2K 3 — гексагидроксоалюминат калия;
ZnO+2NaOH+H 2 O=Na 2 — тетрагидроксоцинкат натрия;
2. Классификация, получение и свойства оксидов
Из бинарных соединений наиболее известны оксиды. Оксидами
называются соединения, состоящие из двух элементов, одним из которых является
кислород, имеющий степень окисления -2.
По функциональным признакам
оксиды подразделяются на солеобразующие и несолеобразующие (безразличные)
.
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и
амфотерные.
Названия оксидов
образуются с применением слова «оксид» и русского названия элемента в
родительном падеже с указанием римскими цифрами валентности элемента, например:
SO
2
— оксид серы (IV
),
SO
3
— оксид серы (VI
),
CrO
— оксид хрома (II
),
Cr
2
O
3
— оксид хрома (III
).
2.1. Основные оксиды
Основными называются
оксиды, взаимодействующие с кислотами (или с кислотными оксидами) с
образованием солей.
К основным оксидам
относятся оксиды типичных металлов , им соответствуют гидроксиды, обладающие
свойствами оснований (основные гидроксиды), причем степень окисления элемента
не изменяется при переходе от оксида к гидроксиду, например,
Получение
основных оксидов
1. Окисление металлов при
нагревании в атмосфере кислорода:
2Mg
+ O 2 = 2MgO,
2Cu
+ O 2 = 2CuO.
Этот метод неприменим для щелочных
металлов, которые при окислении обычно дают пероксиды и супероксиды, и только
литий, сгорая, образует оксид
Li
2
O
.
2. Обжиг сульфидов:
2
CuS
+ 3
O
2
= 2
CuO
+
2
SO
2
,
4
FeS
2
+ 11
O
2
= 2
Fe
2
O
3
+ 8
SO
2
.
Метод неприменим для сульфидов
активных металлов , окисляющихся до сульфатов.
3. Разложение гидроксидов
(при высокой температуре):
С
u
(OH
) 2 =
CuO
+
H
2
O
.
Этим методом нельзя получить оксиды
щелочных металлов.
4. Разложение солей
кислородсодержащих кислот (при высокой температуре):
ВаСО
3
=
ВаО
+
СО
2
,
2Pb(NO 3) 2
= 2PbO + 4NO 2 + O 2 ,
4
FeSO
4
= 2
Fe
2
O
3
+ 4
SO
2
+
O
2
.
Этот способ получения оксидов
особенно легко осуществляется для нитратов и карбонатов, в том числе и для
основных солей:
(ZnOH) 2 CO 3
= 2ZnO +CO 2 + H 2 O.
Свойства основных оксидов
Большинство основных
оксидов представляет собой твердые кристаллические вещества ионного характера,
в узлах кристаллической решетки расположены ионы металлов, достаточно прочно
связанные с оксид-ионами О —2 , поэтому оксиды типичных металлов
обладают высокими температурами плавления и кипения.
1. Большинство основных
оксидов не распадаются при нагревании, исключение составляют оксиды ртути и
благородных металлов:
2HgO
= 2Hg + O 2 ,
2Ag 2 O
= 4Ag + O 2 .
2. Основные оксиды при
нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с
кислотами:
BaO
+ SiO 2 = BaSiO 3 ,
MgO
+ Al 2 O 3 = Mg(AlO 2) 2 ,
ZnO
+ H 2 SO 4 = ZnSO 4 + H 2 O.
3. Присоединяя
(непосредственно или косвенно) воду, основные оксиды образуют основания
(основные гидроксиды). Оксиды щелочных и щелочноземельных металлов
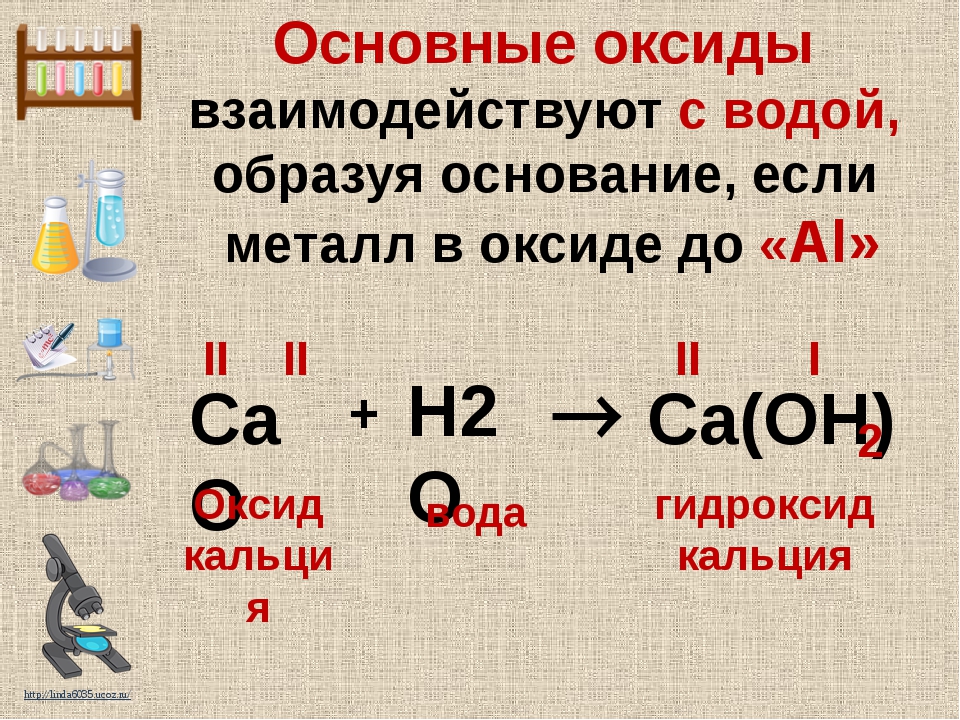
непосредственно реагируют с водой:
Li
2
O
+
H
2
O
= 2
LiOH
,
CaO
+
H
2
O
=
Ca
(OH
) 2 .
Исключение составляет оксид магния
MgO
. Из него нельзя получить гидроксид
магния
Mg
(OH
) 2 при взаимодействии с водой.
4. Как и все другие типы
оксидов, основные оксиды могут вступать в окислительно-восстановительные
реакции:
Fe 2 O 3
+ 2Al = Al 2 O 3 + 2Fe,
3CuO
+ 2NH 3 = 3Cu + N 2 + 3H 2 O,
4
FeO
+
O
2
= 2
Fe
2
O
3
.
М.В. Андрюxoва, Л.Н. Бopoдина
Взаимодействие оксидов с кислотами
С кислотами реагируют основные и амфотерные оксиды. При этом образуются соли и вода:
FeO + H 2 SO 4 = FeSO 4 + H 2 O
Несолеобразующие оксиды не реагируют с кислотами вообще, а кислотные оксиды не реагируют с кислотами в большинстве случаев.
Когда все-таки кислотный оксид реагирует с кислотой?
Решая часть ЕГЭ с вариантами ответа, вы должны условно считать, что кислотные оксиды не реагируют ни с кислотными оксидами, ни с кислотами, за исключением следующих случаев:
1) диоксид кремния, будучи кислотным оксидом, реагирует с плавиковой кислотой, растворяясь в ней. В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
SiO 2 + 6HF = H 2 + 2H 2 O
,
а в случае недостатка HF:
SiO 2 + 4HF = SiF 4 + 2H 2 O
2) SO 2 , будучи кислотным оксидом, легко реагирует с сероводородной кислотой H 2 S по типу сопропорционирования
:
S +4 O 2 + 2H 2 S -2 = 3S 0 + 2H 2 O
3) Оксид фосфора (III) P 2 O 3 может реагировать с кислотами-окислителями, к которым относятся концентрированная серная кислота и азотная кислота любой концентрации. При этом степень окисления фосфора повышается от значения +3 до +5:
| P 2 O 3 | + | 2H 2 SO 4 | + | H 2 O | =t o => | 2SO 2 | + | 2H 3 PO 4 | ||||||||
(конц. ) ) | ||||||||||||||||
| 3P 2 O 3 | + | 4HNO 3 | + | 7H 2 O | =t o => | 4NO | + | 6H 3 PO 4 | ||||||||
| (разб.) | ||||||||||||||||
| P 2 O 3 | + | 4HNO 3 | + | H 2 O | =t o => | 2H 3 PO 4 | + | 4NO 2 |
| (конц.) |
4) Оксид серы (IV) SO 2 может быть окислен азотной кислотой, взятой в любой концентрации. При этом степень окисления серы повышается с +4 до +6.
| 2HNO 3 | + | SO 2 | =t o => | H 2 SO 4 | + | 2NO 2 | ||
| (конц.) | ||||||||
| 2HNO 3 | + | 3SO 2 | + | 2H 2 O | =t o => | 3H 2 SO 4 | + | 2NO |
| (разб.) |
Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO 3 + 2NaOH = Na 2 SO 4 + H 2 O
Кислотные оксиды, которым соответствуют слабые кислоты или кислоты средней силы, с щелочами могут образовывать как нормальные, так и кислые соли:
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
P 2 O 5 + 4KOH = 2K 2 HPO 4 + H 2 O
P 2 O 5 + 2KOH + H 2 O = 2KH 2 PO 4
«Привередливые» оксиды CO 2 и SO 2 , активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только осно
Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только осно
вные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH) 2 + CO 2 = (ZnOH) 2 CO 3 + H 2 O
(в растворе)
2Cu(OH) 2 + CO 2 = (CuOH) 2 CO 3 + H 2 O
(в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH) 3 , Cr(OH) 3 , Fe(OH) 3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO 2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO 2 =
t o
=> Na 2 SiO 3 + H 2 O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H 2 O = Na 2
— тетрагидроксоцинкат натрия
BeO + 2NaOH + H 2 O = Na 2
— тетрагидроксобериллат натрия
Al 2 O 3 + 2NaOH + 3H 2 O = 2Na
— тетрагидроксоалюминат натрия
Cr 2 O 3 + 6NaOH + 3H 2 O = 2Na 3
— гексагидроксохромат (III) натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO 2 x- , где x
= 2 в случае амфотерного оксида типа Me +2 O и x
= 1 для амфотерного оксида вида Me 2 +2 O 3:
ZnO + 2NaOH =
t o
=> Na 2 ZnO 2 + H 2 O
BeO + 2NaOH =
t o
=> Na 2 BeO 2 + H 2 O
Al 2 O 3 + 2NaOH =
t o
=> 2NaAlO 2 + H 2 O
Cr 2 O 3 + 2NaOH =
t o
=> 2NaCrO 2 + H 2 O
Fe 2 O 3 + 2NaOH =
t o
=> 2NaFeO 2 + H 2 O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na 2 =
t o
=> Na 2 ZnO 2 + 2H 2 O
Na =
t o
=> NaAlO 2 + 2H 2 O
Взаимодействие оксидов с солями
Чаще всего соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO 2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO 2) и углекислый (CO 2) газы соответственно. Например:
Al 2 O 3 + Na 2 CO 3 =
t o
=> 2NaAlO 2 + CO 2
SiO 2 + K 2 SO 3 =
t o
=> K 2 SiO 3 + SO 2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na 2 CO 3 + CO 2 + H 2 O = 2NaHCO 3
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K 2 СO 3 + SO 2 = K 2 SO 3 + CO 2
ОВР с участием оксидов
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2.
Единственным элементом, не образующим оксид, является фтор
, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие
оксиды (CO 2 , N 2 O 5 ,Na 2 O, SO 3 и т. д.) - Несолеобразующие
оксиды(CO, N 2 O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды
— (Оксиды металлов — Na 2 O, CaO, CuO и т д) - Кислотные оксиды
— (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn 2 O 7 ,CO 2 , N 2 O 5 , SO 2 , SO 3 и т д) - (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты
Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты
. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания
, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность
.
CO 2 – оксид углерода (IV)
N 2 O 3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н 2 О), так и газами (СО 2 , SO 3) или твёрдыми веществами (Al 2 O 3 , Fe 2 O 3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н 2 О, СО) и белой (ZnO, TiO 2) до зелёной (Cr 2 O 3) и даже чёрной (CuO).
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований:Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO 3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO 2 является основным компонентом стекла. Оксид хрома Cr 2 O 3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO 2 , который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO 2), так и твердыми (Fe 2 O 3) или жидкими веществами (H 2 O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K 2 O, СaO соответствуют основания KOH, Ca(OH) 2 .
Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO 2 (кислотный оксид)=СaCO 3 (соль)
FeO (основной оксид)+H 2 SO 4 (кислота)=FeSO 4 (соль)+2H 2 O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H 2 O (вода)=Ba(OH) 2 (основание щелочнозем. металла)
металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH 3 =3Cu+3H 2 O+N 2
При нагревании разлагаются только оксиды ртути и благородных металлов:
Рис. 3. Оксид ртути.
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| HgO | твердое вещество красного или желто-оранжевого цвета | |
| Оксид калия | K 2 O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na 2 O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li 2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
ЕГЭ по химии.
 А 6. Классификация веществ. Ответы. на Сёзнайке.ру
А 6. Классификация веществ. Ответы. на Сёзнайке.ру
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация органических веществ. Систематическая номенклатура.
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А12Оз и К2О
3) CO2 и NO
4) Fe2O3 и CO
2. Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO2
2) Na2O, SiO2, Сг2Оз
3) CrO.SQ2, CaO
4) CuO, А12Оз, FeO
4. Какие из приведенных утверждений верны?
А. Основные оксиды — это оксиды, которым соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) основными
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na2O, MgO, AI2O3
2) ZnO, SnO РЬО2
3) CO2,SiO2,SO2
4) N2O,NO,CO
7. В каком ряду расположено вещество, которое не является кислотой?
1) Н2С2О4, HCN, HSCN
2) H2S,H2SO3,H2SO4
3) HC1O2,HC1O3,HC1O4 .
4) HNO3.HNO2, H3N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO3,SiO2,Cl2O7
2) N2O5,CO, SiO2
3) P2O5,NO,CO2
4) N2O3,Na2O,NO
9. В каком ряду приведены формулы только гидроксидов неметаллов?
В каком ряду приведены формулы только гидроксидов неметаллов?
1) H2SO4, HC1, HNO3
2) Н3РО4, H2SiO3, HCIO4
3) Н3ВО3, НАlO2, H2S
4) НСlO3, НВг, Н3РО3
10. В каком ряду приведены формулы только основных оксидов?
1) А12О3, MgO, Na2O
2) N2O, CuO, ZnO
3) N2O5, CaO, K2O
4) FeO, Li2O, BaO
11. Кислотным является оксид, формула которого
1) СгО3
2) СаО
3) А12О3
4) NO
12. Только двухосновные кислоты расположены в ряду:
1) Н2СОз, Н3РО4, H3AsO3, HNO3
2) НС1O4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO,, H2SO4, H2Cr04
4) HMnO4, H3As04 H2BeO4, H2ZnO2
13. Только кислоты расположены в ряду
Только кислоты расположены в ряду
1) НNО3, Са(OH)2, NО2
2) КНСОз, Ba(HSO4)2, ZnOHCl
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
14. Несолеобразующим оксидом является
1} N2O5 2) NO2 3) N2O3 4) NO
15. Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
Mn(NO3)2, Mg(H2P04)2, A12(SO4)3, (NH4)2HP04, Na2SO3,
(NH4)2S, BaSiO3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17. Вещество СН3 — О — СН3 относится к
Вещество СН3 — О — СН3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простым эфирам
18. В перечне солей, формулы которых:
Ag2CO3, NaHS, Cu(NO3)2, Fe2(SO4)3, Ca(HCO3)2, KH2PO4, KMnO4, число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
1) (NH4)2SO4 2) Fe(OH)SO4 3) KHSO4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А12O3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl2,
2) SO2, H2S, NaHSO4
3) SO2, A12(SO4)3, HNO3
4) ZnO, Zn(OH)2, H2S
23. Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na2SiO3, КОН, К2O
2} Са(ОН)2, H2S, СаО
3) HF, Mg(OH)2, ВаО
4) H2S04, Ва(ОН)г, SiO2
24. Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25. Амфотерным оксидом является
I) СаО 2) СгО3 3) FeO 4) Сr2О3
26. Какой из элементов может образовать кислотный оксид?
1)стронций
2)марганец
3)кальций
4)магний
| 27.Кислотой является |
1) NaH 2) Sih5 3) HI 4) NH3
28. Солью является
Солью является
1) СаН2 2) РС1з 3) [CНзNНз]С1 4) СНзOH
29. Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
1) азота(I) 2) хрома(II) 3) хлора(III) 4) кремния(IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12-3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24-3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
Химические свойства оксидов | Дистанционные уроки
17-Мар-2015 | Нет комментариев | Лолита Окольнова
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов:
Оксиды, образованные металлами | Оксиды, образованные неметаллами | ||
Основные | Амфотерные | Кислотные | Несолеобразующие |
— Na2O, CaO; | Оксиды: Al2O3, ZnO, d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2 | 1) оксиды неметаллов в высших и средних степенях окисления CO2, N2O3, N2O5, SO3, SO2 2) оксиды d-элементов в высшей с.о.: CrO3, Mn2O7 |
|
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
K2O + h3O = 2KOH
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
CuO + h3 = Cu + h3O
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + h3O
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2h3O + 2NaOH = 2Na[Al(OH)4] + 3h3
2. Образование солей с кислотами:
ZnO + h3SO4 = ZnSO4 + h3O
Ответ: 3)
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
N2O3 + h3O = 2HNO2
1. + O2
если элемент, образующий оксид в средней с.о.:
2SO2 + O2 = 2SO3
2. + h3
восстановление до несолеобразующего оксида или простого вещества:
CO2 + h3 = CO + h3O
SO2 + h3 = S + h3O
3. + вещества. образованные металлами:
SO2 + 2Ca = 2CaO + S
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + h3O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
N2O + O2 = N2O3
CO + h3 = C + h3O
Ответ: 3)
Еще на эту тему:
Обсуждение: «Химические свойства оксидов»
(Правила комментирования)
основных, амфотерных, кислотных / Справочник :: Бингоскул
Почти все химические элементы образуют оксиды. Лишь инертные газы не могут образовывать данные соединения.
Лишь инертные газы не могут образовывать данные соединения.
Оксиды – это сложные вещества, в состав которых входят 2 элемента, одним из которых является кислород. Таким образом, можно представить общую формулу данных соединений:
ЭmOn, где
- Э – химический элемент;
- m, n – индексы.
Номенклатура оксидов
Номенклатура этих веществ складывается из слова «оксид», названия химического элемента и валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название оксида = «Оксид» + название х.э. + валентность (в скобках)
Например:
- СO — оксид углерода (IV)
- Fe2O3 — оксид железа (III)
Классификация оксидов
Все оксиды подразделяются на две большие группы:
- Оксиды, которые при взаимодействии с кислотами и основаниями не образуют солей относят к несолеобразующим (CO, SiO, N2O, NO).
 В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность.
В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность. - Солеобразующие оксиды – это оксиды, которые при взаимодействии с кислотами, либо с основаниями, образуют соли. Эти оксиды являются производными от соответствующих оснований и кислот, в которых элемент находится в высшей валентности.
Все солеобразующие оксиды разделяются на три типа:
- К основным оксидам относят оксиды, гидраты которых являются основаниями. Образуются металлами, валентность которых меньше IV. Например:
- Na2O → NaOH
- CaO → Ca(OH)2
- FeO → Fe(OH)2
В состав данных соединений входят металлы с I и II, исключение цинк, бериллий, свинец, олово.
- К кислотным оксидам относят оксиды, гидраты которых являются кислотами. Образованы неметаллами и металлами побочных подгрупп с валентностью V, VI, VII.
 Например:
Например:- CO2 → h3CO3
- SO3 → h3SO4
- P2O5 → h4PO4
- Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды. Образованы металлами с валентностью III и IV. Например:
- ZnO → Zn(OH)2
- Al2O3 → Al(OH)3
Химические свойства оксидов
Все три группы оксидов обладают разными химическими свойствами. Амфотерные оксиды занимают промежуточное положение между основными и кислотными, поэтому для них характерны и кислотные, и щелочные химические свойства.
Свойства | Оксиды основные (ОО) | Оксиды амфотерные (АО) | Оксиды кислотные (КО) |
| ОО +к-та = соль(С) + вода(В) | АО + к-та = С + В | — |
| — | (только со щелочами) АО + щелочь = С + В | КО + основание = С + В |
| ОО + В = щелочь | — | КО + В = кислота |
| — | АО + ОО = С | ОО + КО = соль |
| ОО + КО = С | АО + КО = С | — |
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Химические свойства простых веществ
Химические свойства металлов
Металл + Кислород
С кислородом большинство металлов образует оксиды — амфотерные и основные:
- 4Li + O2= 2Li2O
- 4Al + 3O2 = 2Al2O3
Щелочные металлы, за исключением лития, образуют пероксиды:
Металл + галогены
С галогенами металлы образуют соли галогеноводородных кислот:
Металл + Водород
С водородом самые активные металлы образуют ионные гидриды — солеподобные вещества, в которых водород имеет степень окисления -1.
Металл + Сера
С серой металлы образуют сульфиды — соли сероводородной кислоты
Металл + Азот
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании
Металл + Углерод
С углеродом образуются карбиды
Металл + Фосфор
С фосфором — фосфиды
Металл + вода
С водой — гидроксиды. Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода
- 2Nа + 2Н2О = 2NаОН + Н2
- Са + 2Н2О = Са(ОН)2 + Н2
Химические свойства неметаллов
Взаимодействие с металлами. В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
- 2Na + Cl2 = 2NaCl
- Fe + S = FeS
- 6Li + N2 = 2Li3N
- 2Ca + O2 = 2CaO
Взаимодействие с другими неметаллами. Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды.
- 3h3 + N2 = 2Nh4
- h3 + Br2 = 2HBr
Взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства.
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
При взаимодействии с фтором фтор является окислителем, а кислород — восстановителем.
Неметаллы взаимодействуют между собой: более электроотрицательный металл играет роль окислителя, менее электроотрицательный — роль восстановителя.
- S + 3F2 = SF6
- C + 2Cl2 = CCl4
Полезные ссылки
Источник материала
Конспект лекции по теме «Оксиды
Химия
Лекция
Тема: Оксиды – классификация, свойства, получение
Все неорганические соединения делят на классы. Каждый класс объединяет вещества, сходные по составу и свойствам. Зная особенности классов соединений, можно охарактеризовать свойства отдельных их представителей. Важнейшими классами неорганических соединений являются оксиды, основания, кислоты и соли.
Оксиды
Оксиды — это соединения, состоящие из атомов двух элементов, одним из которых является кислород в степени окисления -2.
Состав оксидов выражается общей формулой ЭхОу, где Э — любой элемент.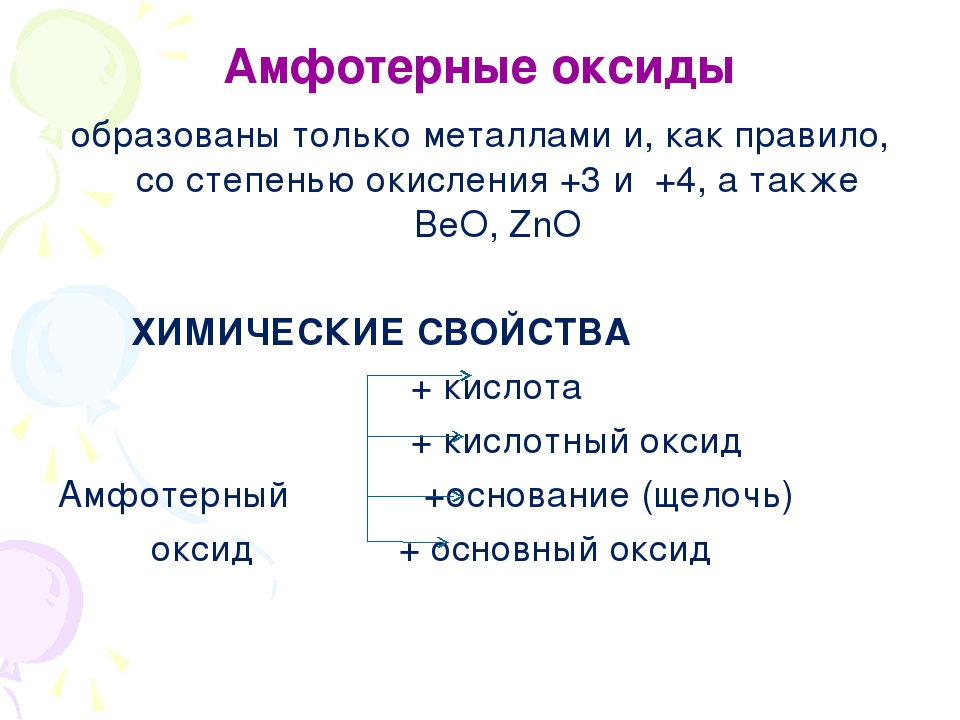 Числовые значения х и у определяются степенью окисления элемента. Кислород образует соединения со всеми элементами, кроме гелия, неона и аргона.
Числовые значения х и у определяются степенью окисления элемента. Кислород образует соединения со всеми элементами, кроме гелия, неона и аргона.
В соединении состава ОF2 кислород проявляет положительную степень окисления, поэтому это соединение не относится к оксидам, это фторид кислорода (II).
Способы получения оксидов
1. Окисление простых веществ:
2Mg + O2 = 2MgO S + О2 = SO2
2. Горение на воздухе сложных веществ (при этом, как правило, образуются оксиды тех элементов, из которых состоит сложное вещество):
СН4 + 2O2 = СO2 + 2Н2O 2H2S + 3O2 = 2SO2 + 2Н2O
избыток
3.Разложение сложных веществ:
Mg(OH)2 = MgO + Н2O Zn(OH)2 = ZnO + Н2O
4. Удаление воды из кислородсодержащих кислот действием на них водоотнимающих веществ:
Удаление воды из кислородсодержащих кислот действием на них водоотнимающих веществ:
2HNO3 + Р2O5 = 2НРO3 + N2O5 2НС1О4 + Р2О5 = 2НРО3 + С12О7
дымящая безводная
5. Обжиг сульфидов:
2ZnS + 3О2 = 2ZnO + 2SО2 4FeS + 7О2 = 2Fe2О3 + 4SО2
6. Вытеснение одних оксидов другими (нелетучие кислотные и амфотерные оксиды при нагревании вытесняют более летучие из их солей):
СаС03 + SiО2 = CaSi03 + CО2 Na2C03 + Cr2О3 = 2NaCrOa + CО2
7. Взаимодействие кислот-окислителей с металлами и неметаллами:
С + 2H2SО4 = СО2 + 2SO2 + 2Н2О Сu + 4HNО3 = Cu(NO3)2 + 2NO2 + 2H2O
конц. конц.
конц.
Физические свойства оксидов
Оксиды могут быть твердыми (MgO, Fe2O3, Р2O5, СаО), жидкими (SO3, Н2O) и газообразными (СO2, SO2). Они обладают разнообразной окраской: оксид меди (II) СuО — черный, оксид цинка ZnO — белый, оксид свинца (II) РbО — желтый, оксид железа (III) Fe2O3 — бурый, оксид xpoмa (VI) СгО3 — ярко-красный и т. д.
Классификация и химические свойства оксидов
По химическим свойствам оксиды классифицируют на солеобразующие и несолеобразующие. Последним не соответствуют гидроксиды, они не взаимодействуют ни с кислотами, ни с основаниями, следовательно, не образуют солей. К ним относятся оксиды SiO, N2О, NO, СО и др. Солеобразующие оксиды делят на основные, кислотные и амфотерные (схема 4).
Схема 4
оксиды
несолеобразующие солеобразующие
CO, NO
основные кислотные амфотерные
MgO, CaO SO3, Cr3 ZnO, Al2O3
Классификация оксидов
Основные оксиды — это оксиды, которым в качестве гидроксидов соответствуют основания, например:
Na2O NaOH, СаО Са(ОН)2
Основные оксиды образуют только металлы, и, как правило, в степени окисления +1 и +2 (исключения — BeO, CuO, ZnO, SnO, РbО).
Основные оксиды взаимодействуют с кислотами, кислотными и амфотерными оксидами:
MgO + H2SO4 = MgSO4 + Н2O CaO + SO2 = CaSO3 Li2O + A12O3 = 2LiA1O2
Оксиды активных металлов (щелочных и щелочно-земельных — Са, Sr, Ва) взаимодействуют с водой с образованием щелочей:
Na2O + Н2O = 2NaOH ВаО + Н2O = Ва(ОН)2
Кислотные оксиды — это оксиды, которым в качестве гидроксидов соответствуют кислоты, например:
SO3 H2SO4, CrO3 Н2СгO4
Кислотные оксиды образуют все неметаллы независимо от степени окисления (исключения — несолеобразующие оксиды СО, NO, N20, SiO и др.) и металлы в степени окисления +5 и выше.
Кислотные оксиды взаимодействуют с основаниями, основными и амфотерными оксидами:
СO2 + Са(ОН)2 = СаСO3 + Н2O SO3 + MgO = MgSO4 Р2O5 + 3ZnO = Zn3(PO4)2
Большинство кислотных оксидов взаимодействуют с водой с образованием кислот (исключение — Si02):
N2O5 + Н2O = 2HNO3 CrO3 + Н2O = H2CrO4
Оксиды углерода(1У) и серы(1У) реагируют с водой обратимо:
СO2 + Н2O СO2 • Н2O Н2СO3
Амфотерные оксиды — это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот, например:
ZnO Zn(OH)2 или H2ZnO2
как основание как кислота
Амфотерные оксиды образуют только металлы, и, как правило, в степени окисления +3 и +4. Амфотерными являются также оксиды BeO, СиО, ZnO, SnO, PbO.
Амфотерными являются также оксиды BeO, СиО, ZnO, SnO, PbO.
Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов. Как основные они взаимодействуют с кислотами и кислотными оксидами, образуя соли катионного типа:
ZnO + H2SO4 = ZnSO4 + Н2О ZnO + SiO2 = ZnSiO3
катион катион
Как кислотные они взаимодействуют с основаниями и основными оксидами, образуя соли анионного типа.
1. При сплавлении
— с твердыми щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2O
анион
ZnO + СаО — CaZnO2 + Н2О
2. При взаимодействии с растворами щелочей образуются растворимые комплексные соли:
ZnO + 2NaOH + НОН = Na2[Zn(OH)4]
ОН— анион
Амфотерные оксиды не взаимодействуют с водой.
Таким образом, с повышением степени окисления атомов элемента усиливаются кислотные свойства его оксидов и гидроксидов:
+2 +3 +6
СгО Сг203 СгОз
основный оксид амфотерный оксид кислотный оксид
Сг(ОН)2 Сг(ОН)3 —-
— Н3СгО3 Н2Сг04
основный гидроксид (основание) амфотерный гидроксид кислотный гидроксид
Итак, характер свойств оксида зависит от того, атомы какого элемента и в какой степени окисления его образуют.
Состав и свойства оксидов
Неметаллы образуют кислотные оксиды (исключение: несолеобразующие оксиды SiO, N2О, NО, СО)
степени окисления +1, +2 образуют основные оксиды (исключение: CuO, BeO, ZnO, SnO, PbO — амфотерные)
металлы степени окисления +3, +4 образуют амфотерные оксиды
степени окисления +5 и выше образуют кислотные оксиды
Двойные (смешанные) оксиды — это оксиды, в состав которых входят атомы одного элемента в различных степенях окисления.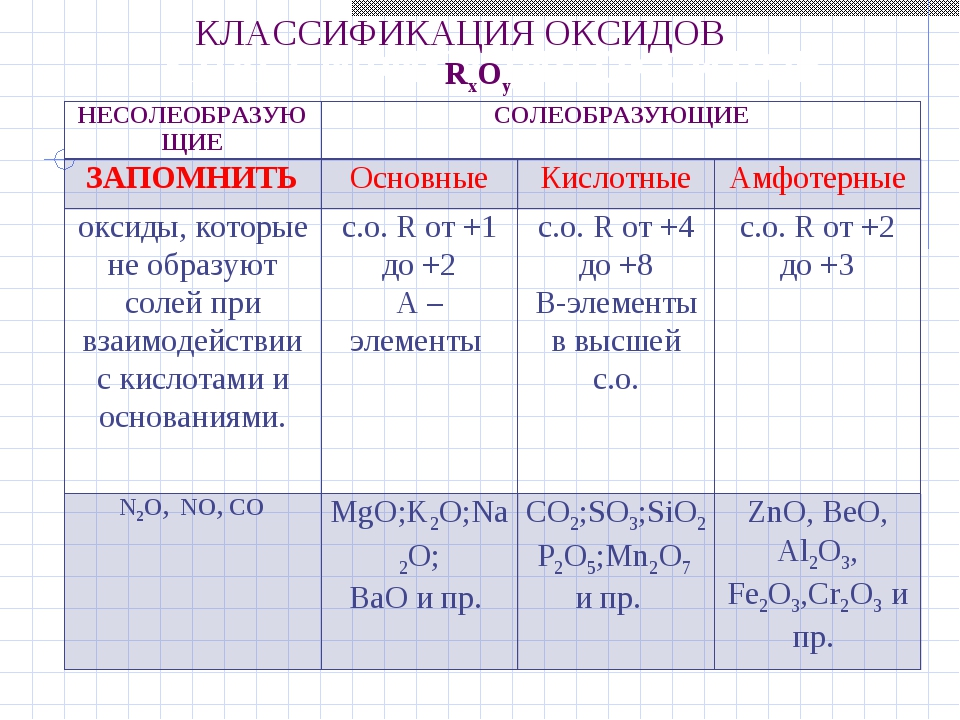
+2 +3
Например, оксид Fe3О4 (FeO • Fe2О3) содержит атомы железа в двух разных степенях окисления и при взаимодействии с кислотами образует две разные соли:
Fe3О4 + 8НС1 = FeCl2 + 2FeCl3 + 4Н2О
(FeO • Fe2О3)
Окислительно-восстановительные свойства оксидов
Оксиды, как солеобразующие, так и несолеобразующие, могут вступать в окислительно-восстановительные реакции. Если элемент, образующий оксид, проявляет максимальную степень окисления, то оксид выполняет функцию окислителя:
+4 0 +4 +2
Si02 + 2Mg = Si + 2MgO CO2 + C = 2CO
+2 0
3CuO + 2NH3 = N2 + 3Cu + 3H2О
Если степень окисления элемента промежуточная, то оксид проявляет окислительно-восстановительную двойственность. Как окислитель такой оксид реагирует с сильными восстановителями:
Как окислитель такой оксид реагирует с сильными восстановителями:
+1 0
N2O + H2 = N2 + H2O
+2 0 +4 0
4NO + СН4 = 2N2 + С02 + 2Н20 SO2 + 2H2S = 3S + 2Н2О
Как восстановитель такой оксид реагирует с сильными окислителями:
+1 +5
5N2О + 8КМпО4 + 12H2SО4 = 10HNО3 + 8MnSО4 + 4K2SО4 + 7H2О
+2 +5
2NO + K2Cr2О7 + 4H2SО4 = 2HNО3 + Cr2(SО4)3 + K2SО4 + 3H2О
+4 +6
SО2 + 2H2О + Br2 = H2SО4 + 2HBr
Для некоторых оксидов возможны реакции диспропорционирования:
+4 +5 +3
2NО2 + 2NaOH = NaNО3 + NaNО2 + H2О
Распознавание оксидов
Распознайте оксид меди (П), оксид кальция, оксид железа (III) по внешнему виду. Подтвердите свой вывод, используя один реактив. Составьте уравнения соответствующих реакций в кратком ионно-молекулярном виде.
Подтвердите свой вывод, используя один реактив. Составьте уравнения соответствующих реакций в кратком ионно-молекулярном виде.
Вопросы и задания
1. Объясните, как зависят свойства оксидов от типа химической связи между атомами элемента и кислорода.
2. Напишите формулы оксидов, отвечающих следующим гидроксидам: H3P04, HN03, Ве(ОН)2, H2Si03, H2S04, НСlO4.
3. Вода реагирует с каждым оксидом набора:
а) NO, CaO, S03; в) N205, BaO, Si02;
б) BaO, S03, N205; г) СО, CaO, S03.
Напишите уравнения реакций воды с оксидами этого набора.
4. Гидроксид натрия реагирует в растворе с каждым оксидом набора:
а) CaO, С02, А1203; в) BeO, MgO, Si02;
б) Al203, N205, ВеО; г) NO, А1203, ВеО.
Напишите уравнения этих реакций в молекулярном и кратком ионно-молекулярном видах.
| 1968 | «Формоустойчивые аноды с оксидным покрытием» для хлорщелочной промышленности: H. Beer, Belg. Пат. 710551 (1968), US 362492 (1972), US 4052271 (1977) |
| A. Martinsons et al., US 3562008 (1971) | |
| V. Hock et al., US 5055169 (1991) | |
| 1972 | US 3634736, Standard Oil Co . Огайо . (США): электроды из активированного угля или карбидов или боридов металлов (например, из активированного угля).g., BC, WC) |
| US 3652902, IBM (США), пластины из активированного угля, разделенные пористой инертной прокладкой, пропитанные KOH или H 2 SO 4 | |
| 1983 | EP 0078404, CD 1196683 (1985): электроды с керамическим оксидным покрытием и псевдоемкость |
| 1986 | US 4633372, Standard Oil Co . Огайо . (США): полиоксометаллат, адсорбированный на активированном угле, например, H 5 (PV 2 Mo 10 O 40 ), (NH 4 ) 6 (P 2 Mo 18 O 62 ) |
| 1988 | Нитрид молибдена, полученный реакцией химического осаждения из паровой фазы между MoCl 5 и NH 3 при 500… 800 ° C или реактивным пиролизом MoO 3 |
| США 4766522, Hughes Aircraft Co .(США): оксиды Pt и Ir в твердом электролите | |
| 1990 | JP 2085387, Japan Gore Tex Inc . (Япония): углеродный порошок, поддерживающий металл семейства Pt или порошок RuO 2 , IrO 2 или PbO 2 , связанный ПТФЭ или ионообменной смолой, например, сополимер тетрафторэтиленсульфонилфторида и винилового эфира |
| 1992 | US 5079674, Motorola (США): оксиды, хлориды, нитриды и другие соли Ru, Ta, Rh, Zr, Co, Ni, Mo, W, V, нанесенные на пористый углерод и связанные в матрице из фторполимер |
| US 5136474, Giner Inc. (США): Порошки RuO 2 на связке PTFE на Nafion 117 | |
| США 5151848, ВВС США : Титан, покрытый RuO 2 и пропитанный твердым полимерным электролитом персульфоновой кислотой при давлении 1000 бар | |
| 1994 | WO 9407272, Pinnacle Research Institute (США): биполярные электроды из RuO 2 / Ti; см. текст |
| DE 4313474, EP 0622815, Dornier (Daimler Group, Германия): гидрат оксида рутения термическим и осажденным методами на никелевой и копировальной бумаге | |
| JP 6345441, Japan Energy Corp .: Гидрат оксида рутения RuO 2 · x H 2 O с однородным размером частиц за счет восстановления предшественника рутения (V или более) в водном растворе | |
| US 551164, Институт Фронцевича (Киев, Украина) ): Халькогениды висмута, например, Bi 2 Te 3 , Bi 2 Se 3 | |
| 1995 | US 5429893, Motorola (США): электроды из оксида металла и активированного угля в водной и неводный раствор |
| US 5392191, Motorola (США): оксиды V, Zr, Hf, Ti, Nb, Sc со связанным хлором (MO 1.68 Cl 0,68 ), смешанный с углеродом и полимером | |
| US 5388025, Motorola (США): металлоцен, порфирин металла, ацетилацетонат металла, металлоорганический полимер, бипиридин металла, например, ацетилацетонат марганца, фталоцианин никеля. | |
| 1996 | JP 8268722, Sumitomo Metal Mining Co . (Япония): порошок RuO 2 для толстопленочных резисторов. Водный раствор частиц RuO 2 в КОН или NaOH выпаривают, а оставшиеся частицы RuO 2 , покрытые гидроксидом, обжигают при 200–1000 ° C, промывают и сушат |
| Pinnacle Research (США ): Исследование нитридов молибдена, титана и железа | |
| 1997 | US 5600535, Армия США : RuO 2 , образованных на титановой подложке пиролизом растворов алкоголятов металлов |
| 1998 | WO 9815961: Dornier & amp; ZSW (Германия): Перовскиты для суперконденсаторов |
| 2000 | US 6025020: Углеродный порошок или углеродные волокна в целлюлозной матрице в качестве темплата для высокодисперсного аморфного гидрата RuO 2 (нагреванием источника рутения в паровая атмосфера при & lt; 500 ° C) |
| 2002 | WO 0235635, Kim Kwang Bum (Корея): Производство тонкопленочного электрода из гидрата RuO 2 |
| DE 10053276, Dornier (Германия): Наноструктурированный пленочный электрод из игольчатых элементов (напр.g., Al 2 O 3 ) закреплен на поверхности | |
| US 6496357, Ness Capacitor Co . (Корея): аморфный диоксид марганца. Токоприемник: никель, медь или алюминий. Электролит: соли лития и аммония в пропиленкарбонате или ацетонитриле, например, LiBF 4 , LiClO 4 , LiPF 6 , Et 4 NBF 4 , Et 4 NPF 6 , Et 4 NClO 4 , MeEt 3 NBF 4 |
Свойства металлических и неметаллических элементов — Металлы и неметаллы — Eduqas — Совместная научная редакция GCSE — Eduqas
Металлы расположены слева — стороны периодической таблицы Менделеева и неметаллы справа.
Физические свойства
В таблице приведены некоторые типичные свойства металлов и неметаллов.
| Металлы | Неметаллы | |
|---|---|---|
| Блестящий | Тусклый | |
| Высокие точки плавления | Низкие температуры плавления | |
| Хорошие проводники электричества | ||
| Хорошие проводники тепла | Плохие проводники тепла | |
| Высокая плотность | Низкая плотность | |
| Податливая и пластичная | Хрупкая |
Некоторые элементы обладают нетипичными свойствами.Например:
- ртуть (металл) имеет низкую температуру плавления и существует в виде жидкости при комнатной температуре
- графит, форма углерода (неметалл), имеет высокую температуру кипения и также является хорошим проводником. электричества
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера.
Тягучие вещества можно сгибать или придавать им форму без разрушения, в то время как хрупкие вещества разбиваются при сгибании или ударе.
Дуктильный означает, что вещество можно растянуть в длинную проволоку без разрывов и разрывов.
Химические свойства
Металлы и неметаллы также можно отличить по некоторым химическим свойствам.
Наиболее распространенным химическим свойством является тип оксида, который образует элемент. Металлы образуют основные оксиды, но неметаллы образуют кислые оксиды. Например, сера и углерод — неметаллы. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода. Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Некоторые оксиды не растворяются в воде, поэтому не влияют на цвет индикатора, добавляемого в воду.
- Вопрос
Элемент таллий образует оксид Tl 2 O. Оксид таллия не растворяется в воде, но реагирует с кислотами с образованием солей таллия. Таллий — это металл или неметалл? Поясните свой ответ.
- Показать ответ
Таллий — это металл. Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, которые являются основаниями.
Металлы также более подвержены коррозии, чем неметаллы. Это означает, что неметаллы с меньшей вероятностью реагируют с водой или кислотами, чем металлы.
Наноструктуры оксидов металлов путем простой обработки горячей водой
В этом исследовании 45 различных типов металлов, содержащих несколько чистых элементов, сплавов и соединений, были обработаны горячей деионизированной водой в поисках того, какие металлы реагируют на HWT и образуют MONSTR . Сначала мы исследовали изменение морфологии металлических поверхностей после проведения HWT при температуре воды 75 ° C.Те металлы, которые не образовывали MONSTR, обрабатывались более длительное время, а некоторые — при 95 ° C. На рис. 1 показаны изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ) тех металлов, которые сформировали MONSTR на поверхности, что соответствует 30 из 45 исследованных металлов. Другими словами, MONSTR смогли вырасти на поверхности примерно 67% всех металлов в этой работе, что проиллюстрировано на круговой диаграмме на рис. 2. Было подтверждено, что большинство наноструктур, наблюдаемых на рис. 1, являются оксидами металлов. термодинамически стабильных составов, что подтверждается данными энергодисперсионной рентгеновской спектроскопии (EDS, таблица S1) и рентгеноструктурного анализа (рис.S1). Считается, что фаза гидроксида металла, которая может образовываться в результате гидролиза, которая обычно является аморфной 38 , незначительна во время роста HWT MONSTR в основном из-за заметного образования пузырьков водорода, наблюдаемого для большинства исследованных металлов (например, дополнительное видео 1 для Al) и хорошо выраженные текстурированные формы кристаллов MONSTR (рис.1). Изображения на рис. 1 были упорядочены в порядке, основанном на времени обработки, необходимом для формирования четко определенных наноструктур оксида металла.Например, олово (Sn) образует MONSTR через 10 мин при 75 ° C (рис. 1, группа элементов, вверху слева), а для меди — 24 часа (Cu; рис. 1, группа элементов, внизу справа). Среди исследованных сплавов и соединений алюминиевые сплавы давали MONSTR за 10 минут, а бронза образовывала наноструктуры только через 7 часов при 75 ° C. Никаких MONSTR не наблюдалось при 75 ° C для некоторых металлов даже через 24 часа. Затем эти образцы обрабатывали при 95 ° C, что привело к образованию MONSTR. Например, наноструктуры наблюдались на индии (In) при 95 ° C примерно через 10 часов.В зависимости от используемого металла на рис. 1 можно наблюдать несколько форм MONSTR, включая кубы, пирамиды, пластины, проволоку, сферы и листовые наноструктуры. Как будет обсуждаться ниже, предполагается, что такие разные геометрические формы происходят из различных кристаллических структур, поверхностной диффузии и минимизации поверхностной энергии за счет формирования определенных граней кристалла 39 . Кроме того, некоторые металлы (например, Al, Mg, Ni) образовывали взаимосвязанные MONSTR, в то время как для других они были хорошо изолированы (например.грамм. Zn, Mo, In, Cu). MONSTR для всех исследованных металлов на однородно покрытых подложках (рис. S2), что указывает на масштабируемость метода HWT.
Рис. 1
Показаны СЭМ-изображения вида сверху различных элементарных металлов и некоторых сплавов и металлических соединений после обработки горячей водой (HWT). Последовательность изображений организована в зависимости от времени обработки, необходимого для формирования четко определенных наноструктур оксида металла (MONSTR): от самого короткого до самого длительного времени обработки в порядке ( a ) слева направо и сверху до снизу ( b ) сверху вниз.
Рис. 2
Гистограмма показывает приблизительное минимальное время HWT, необходимое для того, чтобы на металлах, включенных в данное исследование, можно было наблюдать отдельные MONSTR. Большинство металлов образуют наноструктуры при 75 ° C (указывает вправо на столбчатой диаграмме), в то время как для некоторых других требуется более высокая температура, равная 95 ° C (слева). В правом столбце представлены некоторые статистические данные о реакции металлов на HWT по отношению к группе металлов (верхний график гистограммы), необходимые периоды обработки для формирования наноструктуры (в центре) и процент металлов, которые реагировали или не реагировали на HWT (внизу ).
Хотя об образовании тонкой пленки оксида металла на границе раздела металл / вода во время HWT широко сообщалось 33, 40,41,42,43,44 , впервые наши результаты показывают, что широкий диапазон металлов может также формируют MONSTR вместо тонких пленок с помощью HWT. Одна из возможных причин, по которой такой простой процесс формирования наноструктуры не был замечен, может быть связана с тем, что более ранние исследования были сосредоточены на составе оксидов металлов, а не на изменении морфологии.Другая причина может быть связана с процессом подготовки образца в этих исследованиях, который мог не удалить естественный оксид с поверхности перед HWT, который может действовать как самодиффузионный барьер 45 и препятствовать образованию MONSTR. Как мы обсудим ниже, механизмы роста образования MONSTR во время HWT могут сильно зависеть от существования неокисленных атомов металла на границе раздела вода / металл. Мы также отмечаем, что оставшиеся 15 металлов из 45, которые не отреагировали на HWT в условиях, используемых в наших экспериментах, могут по-прежнему образовывать MONSTR при более длительном времени обработки или более высоких температурах, что требует дальнейшего изучения.
Столбиковая диаграмма на рис. 2 (слева) суммирует значения температуры и критическое время обработки, использованные для формирования MONSTR на поверхности тех 30 металлов, которые отреагировали на HWT. Как видно, 22 из 30 металлов смогли образовать MONSTR при более низкой температуре 75 ° C, а для остальных 8 требовалось 95 ° C. Это показывает потенциал процесса HWT как низкотемпературного метода синтеза наноструктур оксидов металлов. Кроме того, как показано на гистограмме на рис. 2 (в центре справа), большинство исследованных металлов давали MONSTR всего за несколько часов после обработки, что делает HWT хорошим кандидатом для высокопроизводительного метода изготовления.В частности, металлы, которые важны для промышленного применения, такие как Al, Zn, Mg, Pb, сплавы Al и стали, образуют MONSTR даже в течение десятков минут.
Кроме того, как можно видеть на рис. 3 и гистограмме групп металлов на рис. 2, переходные, постпереходные и щелочные металлы, по-видимому, более реактивны к HWT по сравнению с другими группами, как и ожидалось из общего поведения реакция металл-вода 46 . Среди переходных металлов, охваченных этим исследованием (21 металл), 13 из них (Sc, Ti, V, Mn, Cr, Fe, Co, Ni, Cu, Zn, Mo, Cd и Ta) отреагировали на HWT и наблюдались MONSTR. , в то время как другие (Zr, Y, Nb, Ag, Hf, W, Pt и Au) не показали заметного отклика.Например, HWT при 95 ° C в течение 36 часов была проведена для Pt и W, однако никаких морфологических или композиционных изменений не было обнаружено при характеристике с помощью SEM, XRD и EDS. За исключением Ga, который плавится при комнатной температуре и был исключен из этого исследования, поверхность всех постпереходных металлов (Al, In, Tl, Sn, Pb и Bi) показала образование наноразмерных особенностей после HWT. Кроме того, в это исследование были включены Mg и Be из группы щелочноземельных металлов, и после HWT на их поверхностях наблюдались MONSTR.Среди исследованных лантаноидов (Nd, Gd, Tb, Dy и Er) только Nd и Er реагировали на процесс HWT. Наконец, только Sb из исследованных металлоидов (B, Si, Ge, As, Sb и Te) показал образование MONSTR после HWT.
Рисунок 3
Периодическая таблица элементов, показывающая элементарные металлы, включенные в это исследование (жирный синий шрифт), и их реакцию на время и температуру HWT. Зеленые сплошные кружки относятся к металлам, которые отреагировали на процесс HWT, и наблюдались MONSTR; в то время как красные сплошные кружки соответствуют металлам, которые не показывают никаких признаков образования MONSTR.Температуры обработки представлены квадратами для HWT-обработки при 75 ° C и треугольниками для 95 ° C. Время лечения обозначено сплошными полосами.
Кроме того, мы исследовали потенциальные механизмы роста, участвующие в формировании MONSTR. Образование плоских пленок оксида металла в воде широко описано в литературе 47,48,49,50,51 (Примечание: как обсуждалось выше, образование гидроксида металла в нашей работе считается незначительным). Как показано на рис.4b, процесс начинается с образования положительно заряженного иона металла, который попадает в воду, оставляя электроны на поверхности. Этот катион металла все еще остается близко к границе раздела вода / металл из-за отрицательного потенциала твердой поверхности. Затем электроны на поверхности могут реагировать с адсорбированным кислородом и молекулами воды с образованием гидроксильных ионов. Наконец, ионы металлов в воде могут реагировать с гидроксильными ионами на поверхности с образованием молекулы оксида металла вместе с водородом 48 .Выделяется водород, и молекулы оксида могут образовывать плоскую пленку оксида металла, но сам по себе этот механизм не может объяснить наноструктуры оксида металла, наблюдаемые при HWT. Здесь мы предлагаем новый механизм роста, который может привести к образованию MONSTR с помощью HWT.
Рис. 4
Процесс HWT и этапы, участвующие в формировании MONSTR. Проиллюстрированы ( a ) процесс HWT, ( b ) образование оксида металла во время HWT на границе раздела металл / вода и этапы ( c ), участвующие в образовании MONSTR во время HWT.Основной механизм формирования наноструктуры включает «закупорку» и поверхностную диффузию.
Рисунок 4c иллюстрирует важные этапы формирования MONSTR во время HWT. Первый этап включает образование молекул оксида металла на поверхности металлической подложки («оксид металла №1» на рис. 4), которое следует реакции, аналогичной этапам формирования пленки оксида металла, описанным выше (рис. 4b). . В наших экспериментах HWT мы наблюдали образование газообразного водорода, которое еще раз подтверждает этот первый шаг (дополнительное видео 1).В качестве следующего потенциального шага во время роста MONSTR молекулы оксида металла могут диффундировать по поверхности. Однако поверхностная диффузия не считается доминирующим механизмом, объясняющим формирование наноструктуры при относительно низких температурных условиях HWT (<100 ° C). Более вероятным следующим шагом является процесс растворения-осаждения, называемый «закупоривание» 52 , который использовался для описания коррозии металлов. Он включает высвобождение молекулы оксида металла («высвобождение №2») с поверхности в жидкость с последующим переносом через воду («миграция №3») и осаждением («повторное осаждение №4») на другое место на поверхности.Повторно осажденные молекулы могут инициировать образование изолированных наноструктур. Однако случайный характер закупоривания может быть недостаточным для объяснения гладких кристаллических поверхностей, наблюдаемых в наноструктурах HWT. Повторно осажденные молекулы оксида металла могут диффундировать по поверхности, что может помочь в формировании гладких индивидуальных наноструктур, наблюдаемых на СЭМ-изображениях на рис. 1.
Эти отдельные этапы могут зависеть от нескольких важных факторов. Например, на стадии окисления металла скорость окисления может зависеть от детального химического состава воды, такого как уровень pH, проводимость и растворенный кислород 53 .Это также может зависеть от конкретных свойств металла, включая энергию ионизации, электроотрицательность, соотношение заряд / размер и энергию образования оксида, которые могут играть решающую роль в чувствительности данного металла в HWT при формировании MONSTR. Однако мы не смогли наблюдать четкой корреляции между любым из этих отдельных параметров с критическим временем реакции, наблюдаемым на гистограмме на рис. 2. Это указывает на то, что предельная промежуточная реакция во время образования оксида металла варьируется от материала к материалу.После стадии окисления, когда силы адгезии между молекулой оксида металла и металлической подложкой являются слабыми или имеет место движение жидкости, стадия высвобождения может упроститься и сделать процесс закупоривания более доминирующим. Такой процесс закупоривания может привести к образованию шероховатых наноструктур, особенно в случае низких скоростей поверхностной диффузии. Кроме того, начальный химический состав поверхности подложки может играть решающую роль в зарождении наноструктур оксидов металлов. Считается, что молекулы оксидов металлов могут предпочтительно прилипать к дефектам (например,g., пустоты или границы зерен с оборванными связями), которые могут действовать как области зародышеобразования. Миграция и повторное осаждение также могут зависеть от внешних факторов, таких как структура потока жидкости, морфология подложки, механические колебания или даже внешние магнитные и электрические поля.
Дополнительное свидетельство этапов миграции и повторного осаждения, происходящих в HWT, показано одновременным размещением пластин Zn и Cu на расстоянии друг от друга (около 2 см) и выполнением HWT при 75 ° C в течение 60 минут (рис.S3). Во время эксперимента мы непрерывно и осторожно перемешивали воду для получения равномерного ламинарного потока в контейнере HWT. СЭМ-изображения поверхности Cu и Zn после HWT и соответствующего анализа EDS, которые показаны на рис. S3, показывают наличие нанопроволок ZnO не только на подложке Zn, но и на Cu. При этом, как показал анализ с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) на пробе воды, взятой из эксперимента HWT, молекулы ZnO мигрировали через воду и повторно осаждались на поверхности Cu.Это дополнительно подтверждает важный вклад стадии миграции как части механизма закупоривания в формировании MONSTR во время HWT.
Что касается стадии поверхностной диффузии, ожидается, что подвижность повторно осажденных молекул оксида будет зависеть от поверхностной энергии граней кристалла, на которые они приземляются. Их поверхностная диффузия будет выше на плоскостях с низкой поверхностной энергией, что заставляет повторно осажденные молекулы двигаться к краям и еще больше увеличивает размер грани. Следовательно, кристаллические плоскости с низкой поверхностной энергией могут расти быстрее и определять окончательную форму MONSTR.С этой целью мы сначала идентифицировали кристаллические структуры MONSTR на основе анализа XRD (рис. S1 и S5), большинство из которых являются термодинамически стабильными оксидными фазами. Затем мы разделили формы наноструктур на четыре разные категории, включая сферическую, проволочную (например, проволоку и стержни), двумерную многоугольную (листообразные формы, такие как пластины, диски и листы) и трехмерную многоугольную (например, кубы и пирамиды) геометрии. Гистограмма на рис. S5 сравнивает соотношение между кристаллической структурой и формой MONSTR.Наблюдается, что большинство моноклинных, тетрагональных и орторомбических оксидов приводят к образованию двумерных полигональных наноструктур. Это указывает на преобладающую скорость поверхностной диффузии на плоскости кристаллов с заметно низкой поверхностной энергией для этих кристаллических структур. С другой стороны, для исследованных нами кубических и гексагональных оксидов, похоже, не существует корреляции между формой наноструктуры и кристаллической структурой. Это может быть связано с конкурирующими и более сопоставимыми скоростями поверхностной диффузии на различных кристаллических плоскостях кубических и гексагональных оксидов металлов.
Кроме того, мы выполнили HWT на пластине из Zn с шероховатой поверхностью с помощью пескоструйной обработки и сравнили результаты с результатами на относительно гладком полированном Zn. Как показано на рис. S6, мы наблюдали, что ZnO MONSTR преимущественно росли на вершинах холмов, в то время как рост был более равномерным на полированной пластине. Это может быть связано с относительно большой длиной свободного пробега молекул ZnO, которая может зависеть от нескольких факторов, включая их концентрацию в воде. Концентрация молекулярного оксида может уменьшаться на более поздних стадиях роста HWT из-за ограниченного поступления ионов металла, блокированных оксидом, образованным на более ранних стадиях.Например, на основе измерений FTIR (рис. S3) на образце раствора HWT с более поздних стадий роста ZnO мы наблюдали низкие концентрации ~ 3,28 × 10 -12 моль / см 3 , что соответствует приблизительному расстоянию ~ 0,4 мкм среди молекул ZnO. Такое разделение между молекулами ZnO сравнимо с особенностями поверхности в масштабе от микрометра до субмикрона на шероховатой подложке Zn. Следовательно, большая длина свободного пробега молекул оксида может привести к преимущественному осаждению на вершинах холмов, а не на впадинах из-за «эффекта затенения», который наблюдается в тонких пленках и наноструктурах, осажденных из паровой фазы 54, 55 .
Также важно поддерживать баланс между температурой воды и растворенным кислородом во время HWT. Хотя при более высоких температурах воды скорость высвобождения катионов металлов в воду увеличивается из-за повышенной активации поверхности, с другой стороны, уровни растворенного кислорода уменьшаются. Это может затем привести к снижению уровней гидроксид-ионов из-за более низкой концентрации кислорода. Следовательно, образование молекул оксидов металлов и MONSTR может быть ограничено при относительно высоких температурах воды.Другими словами, могут быть желательны более высокие температуры HWT для активации поверхности металла с образованием катионов; тем не менее, это не обязательно означает, что наноструктуры оксидов металлов будут формироваться быстрее по сравнению с более низкими температурами. Это может потребовать дополнительного кислорода с помощью таких средств, как продувка O 2 в воду, чтобы увеличить скорость роста MONSTR. Кроме того, мы также провели эксперименты с закрытой крышкой стакана HWT, чтобы изолировать воду от окружающего воздуха и намеренно снизить уровень растворенного кислорода.Мы заметили, что образование MONSTR значительно уменьшилось, что дополнительно показывает важность стадии образования оксида металла в предлагаемых механизмах роста, описанных выше.
Еще одним фактором, который может повлиять на образование катионов, является состояние поверхности, которое может быть улучшено такими способами, как предварительная обработка кислотой. Например, мы обрабатывали Cu азотной кислотой (HNO 3 ) перед HWT и наблюдали, что критическое время образования MONSTR уменьшилось с 24 часов до 8 часов. Кроме того, предварительная обработка поверхности может увеличить оборванные связи, которые могут улучшить этап повторного осаждения в механизме роста MONSTR (рис.4). Для некоторых материалов простых методов предварительной обработки, таких как механическое шлифование, может быть достаточно, чтобы активировать поверхность. Мы наблюдали заметное увеличение плотности MONSTR на поверхности Zn, когда основной металл подвергался пескоструйной очистке перед HWT. С другой стороны, образование катионов может быть затруднено из-за примесей либо в объеме, либо на поверхности основного металла. Такие примеси могут действовать как инертные частицы по отношению к HWT и предотвращать реакцию воды с нижележащим металлом, или они могут быть более активными, чем основной металл, и образовывать защитный оксидный слой наверху.
Управление такими свойствами HWT-MONSTR, как размер, геометрия, разделение и кристаллическая структура, потенциально может быть достигнуто путем изменения факторов роста, описанных выше. Например, размер MONSTR можно просто контролировать с помощью времени HWT до определенного момента, когда еще есть запас катионов из основного металла. Как обсуждалось ранее, геометрия тесно связана с кристаллической структурой. Следовательно, вопрос может заключаться в том, как мы можем управлять кристаллической структурой. Такие параметры, как растворенный кислород, могут влиять на тип фазы оксида металла и косвенно приводить к различным формам наноструктур.Наконец, разделение может контролироваться количеством дефектов поверхности подложки или уже существующими выступами на поверхности, на которых MONSTR могут преимущественно расти из-за эффекта затенения.
Мы отмечаем, что миграция молекул оксидов металлов через воду может потенциально вызвать опасения для здоровья, особенно в ситуациях, когда металлы находятся в прямом контакте с горячей водой. Кроме того, из-за общих механизмов роста, описанных выше, MONSTR могут образовываться на повседневных металлических инструментах даже в присутствии неочищенной воды, что может еще больше увеличить опасные риски.Для этого мы провели предварительные испытания медного котла, который использовался для нагрева водопроводной воды до 75 ° C. Поверхность горшка перед экспериментом отполировали, чтобы имитировать чистку скрабом, которая удаляет уже существующий слой оксида меди и может активировать поверхность. На рисунке S7a показано СЭМ-изображение наноструктур оксида меди, которые сформировались через 18 часов. Хотя эти MONSTR не очень хорошо развиты, они все же могут отрываться от поверхности кастрюли при повторной очистке во время процесса очистки, что в конечном итоге может загрязнить водные ресурсы.Другой пример, который мы рассмотрели, — это алюминиевая фольга, обернутая вокруг горячей еды. Пар, исходящий от пищи, может конденсироваться на поверхности алюминиевой фольги, образовывать капли горячей воды и, по существу, создавать условия образования MONSTR с помощью HWT. На рисунке S7b показаны изображения наноструктур оксида алюминия, которые появились на поверхности алюминиевой фольги после воздействия источника пара в течение 25 минут. В таких случаях весьма вероятно, что молекулы оксидов металлов могут смешаться с нагретой водой и потребляться людьми или животными, что требует детального исследования.
Оксиды металлов
Подписка на ежемесячный технический совет от Тони Хансена
Весь глоссарий
Порошки оксидов металлов используются в керамике для получения цвета. Но одного времени недостаточно, чтобы изучить сложность их использования и потенциал в глазури, ангобах, телах и эмалях.
Детали
Оксиды металлов — это то, что следует из названия. Оксид металла можно буквально получить, расплавив металл и распыляя его в виде тумана в кислородную камеру.Полученный порошок представляет собой совершенно новую форму материи с новыми свойствами, он выходит из области металлургии и легко вписывается в мир керамики. Карбонатный краситель может быть получен таким же образом (конечно, с использованием газа CO 2 ). Оксиды металлов используются не только в керамике, но и в десятках отраслей. Само собой разумеется, что некоторые из них дороги, некоторые нет, их спрос (и цена) часто определяется их полезностью в технологических продуктах.
В керамике оксиды металлов придают цвет глазурям, телам, ангобам и морилкам (но не всем красителям).Наиболее распространенные глазури, используемые в керамике, представляют собой композит из прозрачной основы с добавлением оксида металла для ее окраски (с дополнительным глушителем и вариегатором).
Обычными оксидными материалами являются оксид железа, оксид кобальта, оксид хрома, оксид меди, диоксид марганца, оксид никеля. Некоторые из них имеют карбонатные формы (например, кобальт, медь, никель). Некоторые из них стабильны и предсказуемы по своему цвету (например, кобальт, хром). Некоторые из них, хотя и называются «оксидами», на самом деле представляют собой смесь оксидной и гидроксидной форм металла (например,грамм. оксид меди). Некоторые оксиды металлов могут иметь несколько цветов в зависимости от соотношения металл: кислород (оксид железа может быть красным, желтым, коричневым, зеленым, бордовым, черным). Некоторые оксиды металлов привередливы к развитию своего цвета, что требует определенного химического состава основной глазури, для других требуются особые условия обжига. Некоторые из них очень сильнодействующие, менее 1% дают интенсивный цвет, в то время как для других требуется гораздо большее процентное содержание. Цинк, свинец и олово не создают цвет сами по себе, но взаимодействуют с другими, создавая уникальные эффекты.Существует множество смесей оксидов металлов (называемых системами), которые дают совершенно уникальные цвета. У некоторых есть температурные ограничения, они становятся летучими и выделяются газом сверх этого (например, кадмий, селен). Некоторые цвета несколько разлагаются во время обжига и выделяют газы, которые могут вызвать дефекты глазури (например, диоксид марганца, карбонат меди). Другие разлагаются и газифицируются с образованием паров металлов (например, кадмия, свинца, марганца). Некоторые оксиды металлов содержат более крупные частицы, образующие вкрапления в глазури (например, оксид железа и кобальта).Некоторые материалы, используемые в керамике, технически не являются оксидами металлов, но представляют собой минералы с высоким содержанием оксидов металлов (обычно это смесь металлов). Пример — рутил, он и окрашивает глазурь, и разнообразит ее (благодаря титану). Другие примеры — Barnard Slip, Raw Umber.
В случае оксидов металлов в керамике проявление цвета зависит от химического состава, концентрации, размера частиц, атмосферы обжига и графика обжига. Необработанный цвет оксида металла редко бывает похожим на цвет после обжига, который он производит (в отличие от пятен).Смеси различных оксидов металлов обычно не дают ожидаемых цветов (например, хром дает зеленый цвет, олово дает белый цвет, но определенные их смеси могут давать розовый и красный цвет, если химический состав глазури правильный). Теоретически красители устраняют эту проблему, поскольку они были предварительно обожжены и смешаны со стабилизаторами, чтобы сделать их огнеупорными. Интересно, что два основных стабилизатора — это оксиды металлов, которые не окрашивают (алюминий и цирконий). Пятна также каталогизируют системы окраски оксидов металлов, которым нас научила история.
Многие люди избегают пятен и продолжают использовать оксиды металлов, чтобы сэкономить деньги. Но это может быть ошибочным. Людям нравятся яркие цвета, и добиться их тоже с помощью оксидов металлов не получится. Обычно для получения заданного цвета требуется меньшее количество пятен. И часто толщину слоя глазури можно уменьшить. Кроме того, на пятнах не появляются пузыри и пятна, такие как карбонаты или гидроксиды металлов. И с пятнами безопаснее обращаться. И более последовательный. И они делают более практичным использование подхода, основанного на глазури с добавками, что сводит к минимуму количество рецептов, которые вам нужно поддерживать.Пятна однозначно лучше подходят для подглазурных цветов. Также, возможно, стоит научиться наносить глазури распылением, окраской или двойным окунанием, чтобы можно было поддерживать ведра меньшего размера.
При этом некоторые врачи страстно предпочитают оксиды металлов морилкам. Лучшее объяснение, которое я слышал об этом, было от Уилла Робертсона: «Керамические пятна были бы намного проще, но я думаю, что они дадут слишком большой человеческий контроль — с ионами металла в стекле стекло обеспечивает связь между зрителем и окружающей средой. квантово-механический мир внешних орбиталей ионов в стекле и те, которые, в свою очередь, дают связь с полями лигандов окружающих атомов и ионов (за исключением редкоземельных элементов с их поглощением света внутренними электронными оболочками).Я думаю, что создание цвета и работа в среде, которая не может быть полностью подчинена человеческому контролю, — это азарт и цельность. Я также немного об использовании красителей для керамики, которые действуют как пигменты — ионы металлов могут действовать как краситель, растворяясь в стекле и создавая четкое трехмерное цветное пространство. Люди привыкли видеть цвета на поверхностях, а не в трех измерениях, поэтому, надеюсь, в этом есть какая-то магия ».
С большинством оксидов тяжелых металлов опасно обращаться, их пары особенно опасны для дыхания, а их растворенные вещества могут быть токсичными.Добыча и производство красителей из тяжелых металлов в мире широко известны как дико неэтичные. Приобрести материалы, полученные из этичных источников, будет непросто, это означает, что вам придется платить больше за и без того дорогие продукты. Иногда можно добиться желаемого цвета другими способами (например, начиная с натурального материала, в котором уже есть часть или большая часть красителя в естественной форме).
Токсичность является проблемой для глазурей, содержащих красители из оксидов металлов: в частности, выщелачивание и опасность металлических паров во время обжига.Очевидно, что чем выше процент металла в глазури или теле, тем больше вероятность образования дыма. А здравый смысл — это руководство по выщелачиванию. Одно дело, если глазурь содержит 4% марганца, а 30% — совсем другое! Используйте тест GLLE как простой способ проверки. Всегда будьте осторожны с обожженной посудой очень ярких цветов, которая обычно содержит высокий процент оксида металла. Устойчивость глазури к кислотам и щелочам снижается по мере насыщения стекла оксидами металлов. Когда процентное содержание металлов становится достаточно высоким, они могут фактически выпадать из расплава во время охлаждения в печи, образуя кристаллы.Они могут выглядеть великолепно, но очень часто они растворимы.
Связанная информация
Кувшин для люстры от Jonathan Chiswell Jones
Процесс, который он разработал, требует 3 обжига. Сначала сухая фарфоровая посуда украшается распылением оксидами металлов (оксиды железа, марганца, меди, хрома и кобальта), а затем обжигается с высоким бисквитом до конуса 9, чтобы склеить их и застеклить тело. Затем покрытие из свинцовой боросиликатной глазури обжигается на конусе 04. Люстры (сделанные из глины, которая смывается после обжига блеска, смешанная с хлоридом серебра или карбонатом серебра) обычно наносится кистью поверх обожженной глазури 04 и восстановления выстрелил по конусу 018.Он делает красный цвет, смешивая карбонат меди и субнитрат висмута с глиной, и это может быть смешано с пастой серебряной глины для получения «золота». Он также иногда добавляет серебро в оксидные аэрозоли, что создает блестящую подглазурку.
Проданные онлайн-рецепты, ждущие, пока жертва их попробует!
Вы нашли несколько рецептов. Их фотографии выглядели великолепно, вы купили материалов на 500 долларов, чтобы попробовать их, но ни один из них не сработал! Почему? Рассмотрим эти рецепты. Многие содержат 50 +% полевого шпата / корнуолла / нефелина (с небольшим количеством доломита или талька, чтобы противодействовать их высокому тепловому расширению, они сойдут с ума).Многие из них с высоким содержанием Герстли Бората (он превратит суспензию в ведро с желе, что вызовет ползание). Другие тратят большое количество дорогого олова, лития и кобальта на дрянные базовые рецепты. В некоторых случаях карбонаты металлов способствуют образованию пузырей. Некоторые слишком сильно тают и стекают на полку печи. Некоторые почти не содержат глины (они оседают, как камень в ведре). Способ лучше? Найдите или разработайте рецепты фриттированной, стабильной, прозрачной, глянцевой и матовой основы, которые подходят вашему телу, обладают хорошими свойствами суспензии, устойчивы к вымыванию и маркировке столовых приборов.Определите механизмы (красители, замутнители и вариегаторы) в рецепте, который вы хотите попробовать, и перенесите их на свою собственную основу (или смесь основ). А для цвета используйте морилки (вместо оксидов металлов).
Как оксиды металлов соотносятся по степени плавления?
Оксиды металлов с 50% ферро-фритты 3134 в тиглях на конусе 6ox. Хром и рутил не плавятся, медь и кобальт — чрезвычайно активные плавители. Кобальт и медь кристаллизовались при охлаждении, марганец образовал радужное стекло.
Что могло заставить глазурь вырастить эти невероятные кристаллы?
Крупный план кристаллической глазури Фары Шимбо. Кристаллы этого типа могут достигать очень больших (сантиметров) размеров. Они растут, потому что химия глазури и обжига настроены так, чтобы их поощрять. Это включает в себя расплавы, которые являются очень текучими (много флюсов) с добавлением оксидов металлов и катализатора. Обычно используются флюсы B 2 O 3 , K 2 O и Na 2 O (из фритт), катализатор — оксид цинка (в большом количестве).Поскольку Al 2 O 3 увеличивает жесткость расплавов глазури, предотвращая рост кристаллов, она очень низкая в этих глазурах (глины и полевые шпаты содержат Al 2 O 3 , поэтому в этих глазури почти нет). Обжиг имеет строго контролируемый цикл охлаждения, включающий быстрые спуски и удержания (иногда их несколько циклов). Между циклами иногда бывают небольшие подъемы. Каждый разрыв кривой охлаждения создает определенные эффекты в росте кристалла. Тысячи гончаров по всему миру исследовали сложные химические процессы, обжиг и бесконечный диапазон добавок оксидов металлов.
Глубокий, темно-синий без кобальта. Как?
Это нужно увидеть, чтобы поверить, это самый глубокий и насыщенный синий цвет, который мы когда-либо производили. Это Plainsman M340, стреляющий по конусу 6. Ангоб L3954B черного обжига (с 10% жженой (не сырой) умброй вместо обычного 10% Zircopax) был нанесен внутри и частично снаружи (на этапе жесткой кожи). Надрез был сделан после того, как ангоб достаточно просох, чтобы его можно было обработать. Глазурь — рутилово-синяя Alberta Slip.График обжига: Конус 6 капельно-впитывающий.
звенья
оксиды
оксиды
Два самых важных
свойства оксидов и гидроксидов
- их структура и связь
- их кислотно-основные свойства.
Рассмотрим оксиды
Группа 1, Группа 2, B и Al из группы 3, C, Si и Pb из группы 4, P, S, Cl и
первый блок d .
Некоторые определения.
Ионные оксиды и гидроксиды
являются ионными, если они имеют высокие температуры плавления и кипения и кристаллическую структуру, которая
состоит из отдельных ионов.
Ковалентные оксиды и оксокислоты
являются молекулярными, если они имеют низкие температуры плавления и кипения и состоят из
дискретные молекулы. Гигантское ковалентное соединение имеет высокую температуру плавления и кипения.
с непрерывной структурой.
Слоистая решетка. Многие
гидроксиды имеют структуру решетки слоев с ионами металлов, зажатыми между слоями
гидроксид-ионы. Они имеют ионный / ковалентный характер. При нагревании до высокой температуры,
они дают ионные оксиды.
Базовый. Металлы с
электроотрицательность менее 1,3 образуют основные оксиды и гидроксиды. Эти оксиды и
гидроксиды легко растворяются в разбавленных кислотах. Если они растворимы в воде, они вызывают
щелочные растворы.
Кислый.Неметаллы с
электроотрицательность более 2,0 образуют кислые оксиды. Если они растворимы в воде, они
дают кислые оксикислоты. Гигантские ковалентные оксиды B 2 O 3 и
SiO 2 не растворяются в воде, но классифицируются как кислые, поскольку вступают в реакцию с
конденсированный NaOH; кроме того, их оксокислоты, полученные гидролизом хлоридов, растворяются
в водном NaOH.
Амфотерный. Металлы с
электроотрицательность между 1,3 и 2,0 должен образовывать амфотерные оксиды, но многие из них имеют
очень нерастворимые гидроксиды, которые лишь незначительно растворяются в водном NaOH.Эти оксиды будут
считаться амфотерными, только если их гидроксиды легко растворяются в водном NaOH;
в противном случае они будут считаться базовыми.
Формула. Если гидрокси
соединение является основным или амфотерным, оно будет записано в виде M (OH) x ,
даже несмотря на то, что многие триположительные металлы образуют гидроксиды с формулой MO.OH. x H 2 O ..
Если гидроксисоединение является кислотным, это будет записано в виде H x XO y .
Группа 1 и Группа 2.
Все оксиды группы 1 являются ионными
и щелочные:
M 2 O (т)
+ H 2 O (л) 2MOH (водн.)
То же самое и для группы 2.
оксиды:
MO (s) + H 2 O (л)
M (OH) 2 (водн.)
хотя бериллий и магний
гидроксиды почти нерастворимы (растворимость гидроксидов увеличивается вниз по группе).
Оксид бериллия растворяется в обоих
разбавленная кислота и щелочь и поэтому амфотерный (сравните с алюминием):
BeO (s) + 2H + (водн.)
Be 2+ (водн.) + H 2 O (л)
BeO (ов) + 2OH —
+ H 2 O (л) Be (OH) 4 2- (водн.)
Группа 3.
Оксид бора является гигантским ковалентным и
кислая. Он не растворяется в воде, но растворяется в расплавленном NaOH. Слабая кислота, H 3 BO 3,
, полученный гидролизом BCl 3 , растворяется в водном NaOH (сравните с кремнием).
B 2 O 3 (т)
+ NaOH (л) 2NaBO 2 (л) + H 2 O (г)
H 3 BO 3 (т)
+ OH — (водн.) B (OH) 4 — (водн.)
Оксид алюминия ионный и
гидроксид образует слоистую решетку.Его оксид показывает поведение, аналогичное поведению бора.
(замените Al на B в приведенных выше уравнениях), и, поскольку он также растворяется в кислотах, он
амфотерный.
Al 2 O 3 (т)
+ 6H + (водн.) 2Al 3+ (водн.) + 3H 2 O (л)
Al (OH) 3 (т)
+ 3H + (водн.) Al 3+ (водн.) + 3H 2 O (л)
Образовавшийся ион алюминия, Al (H 2 O) 6 3+ (водн.),
имеет высокую плотность заряда и действует как слабая кислота с p K a 4.8, то же
как этановая кислота.
[Al (H 2 O) 6 ] 3+ (водн.)
+ H 2 O (л) [Al (H 2 O) 5 OH] 2+ + H 3 O + (водн.)
При добавлении водного NaOH,
равновесие смещается вправо до тех пор, пока не выпадет в осадок Al (OH) 3 (s); это
легко реагирует с избытком NaOH с образованием алюминатного иона Al (OH) 4 — (водн.).
Группа 4.
Угарный газ молекулярный
и считается нейтральным. Формально это ангидрид метановой кислоты HCOOH, но
он не реагирует с водой, хотя обратный процесс, дегидратация метановой кислоты
кислота с концентрированной серной кислотой, является стандартным методом получения окиси углерода.
Двуокись углерода является молекулярной и
растворяется в воде с образованием угольной кислоты, которая является слабой кислотой с p K 1 6.4:
CO 2 (г)
+ H 2 O (л) H 2 CO 3 (водн.)
Только около 1 молекулы из 600
CO 2 (г) превращается в кислоту, и большая его часть остается в форме CO 2 (водн.).
Диоксид кремния гигантский
ковалентные, содержащие одинарные связи Si-O. Молекулярная структура будет содержать связи Si = O;
они были бы намного слабее, чем две одинарные связи Si-O, обнаруженные в решетке кремнезема.
SiO 2 не растворяется в воде, но реагирует с конденсированным NaOH:
SiO 2 (т)
+ 2NaOH (л) Na 2 SiO 3 (л) + H 2 O (г)
Очень слабая кислота, H 4 SiO 4 (s),
полученный гидролизом хлорида, также растворяется в водном NaOH.
H 4 SiO 4 (т)
+ 2OH — (водн.) SiO 3 2- (водн.) + 3H 2 O (l).
Окись свинца ионная
твердое вещество, цвет которого варьируется от желтого до оранжевого. Когда жарко, он красный и снова становится
желтый при охлаждении. Он растворяется в разбавленной азотной кислоте (сульфат и хлорид являются
не растворим в холодной воде) и в концентрированном водном гидроксиде натрия.
PbO (s) + 2H + (водн.)
Pb 2+ (водн.) + H 2 O (л)
PbO (s) + H 2 O (л)
+ OH — (водн.) Pb (OH) 3 — (водн.)
Добавление водного NaOH к
раствор соли свинца дает белый осадок, обычно записываемый как Pb (OH) 2 (s)
(но возможно 2Пбо.H 2 O), который реагирует с избытком NaOH с образованием Pb (OH) 3 — (водн.),
отвес (II).
Диоксид свинца, PbO 2 (т)
представляет собой ионное твердое вещество коричневого цвета. При нагревании разлагается на PbO и кислород.
при температуре он растворяется в концентрированной HCl с образованием PbCl 4 и комплексного иона
PbCl 6 2-. При нагревании эти вещества выделяют газообразный хлор. PbO 2 (т)
также растворяется в концентрированном NaOH.
PbO 2 (т)
+ 2OH — (водн.) + 2H 2 O (л) Pb (OH) 6 2- (водн.).
Гидроксид свинца (IV) неизвестен;
Вместо этого осаждается PbO 2 (т).
Фосфор, сера и хлор.
Все образуют молекулярные оксиды, которые
кислые.
оксид фосфора (III) и
оксид фосфора (V) имеет молекулярные формулы P 4 O 6 (s) и P 4 O 10 (s)
но часто встречаются как P 2 O 3 (s) и P 2 O 5 (s).Они реагируют с водой с образованием слабой кислоты H 3 PO 3 с p K 1
2.0, и немного более сильная кислота, H 3 PO 4 с p K 1
1.49. Это иллюстрирует общую тенденцию к тому, что оксид с более высокой степенью окисления является
более кислый.
P 2 O 3 (т)
+ 2H 2 O (л) 2H 3 PO 3 (водн.)
P 2 O 5 (т)
+ 2H 2 O (л) 2H 3 PO 4 (водн.)
Сернистый газ и сера
триоксид растворяется в воде с образованием слабой кислоты, H 2 SO 3 с p K 1
1.81) и очень сильной кислоты H 2 SO 4 . Обратите внимание, что даже в
в этом случае вторая ионизация достаточно мала, чтобы оказать очень небольшое влияние на
pH; см. страницу «pH серной кислоты».
Хлор образует несколько оксидов
из которых наиболее важными являются Cl 2 O и Cl 2 O 7 . Они
реагируют с водой с образованием слабокислой HClO с p K a 7,53), и очень
сильная кислота, HClO 4 .
Cl 2 O (г)
+ 2H 2 O (л) 2HClO (водн.)
Класс 2 O 7 (л)
+ 2H 2 O (л) 2HClO 4 (водн.)
3 d металлические блоки
Оксид скандия очень
аналогичен оксиду алюминия
Важнейший оксид титана
представляет собой TiO 2 , который является кислым.
Ванадий имеет четыре основных
состояния окисления. VO и V 2 O 3 являются ионными и основными и растворяются
в кислотах, чтобы получить ион сирени [V (H 2 O) 6 ] 2+ и
сине-зеленый [V (H 2 O) 6 ] 3+ ион.Оба эти иона
легко окисляется до V (IV) или V (V). VO 2 бывает ионным и амфотерным. Он растворяется в
кислоты с образованием синего иона VO 2+ (вероятно [VO (H 2 O) 5 ] 2+ )
и в концентрированной щелочи с получением коричневого иона VO 4 4-. В 2 О 5
имеет пограничную ионно-ковалентную структуру. Он обратимо теряет кислород при нагревании, и это
может быть, поэтому это такой эффективный катализатор в контактном процессе для превращения
диоксид серы в триоксид серы.Он амфотерный.
V 2 O 5 (т)
+ 2H + (водн.) 2VO 2 + (водн.) + H 2 O (l) желтый
раствор
V 2 O 5 (т)
+ 6OH — (водн.) 2VO 4 3- ( водн.) + 3H 2 O (л)
бесцветный раствор
Два основных оксида хрома
это зеленый Cr 2 O 3 , который является ионным, и красный CrO 3
который ковалентен.Первый является амфотерным в виде зелено-серого осадка Cr (OH) 3
растворяется в кислотах с образованием пурпурного иона [Cr (OH) 6 ] 3+ , а в щелочи
чтобы получить зеленый раствор, который, возможно, может содержать Cr (OH) 4 —
ион. В растворе аммиака зелено-серый осадок растворяется с образованием розово-пурпурного цвета.
Комплексный ион [Cr (NH 3 ) 6 ] 3+ .
[Cr (H 2 O) 6 ] 3+ (водн.)
+ 3OH — (водн.) Cr (OH) 3 (т.) + 6H 2 O (л)
Это депротонирование или
кислотно-основная реакция.
Cr (OH) 3 (т)
+ 6NH 3 (водн.) [Cr (NH 3 ) 6 ] 3+ (водн.) + 3OH — (водн.)
Это обмен лиганда
реакция.
Триоксид хрома является кислым и
растворяется в воде с образованием довольно сильной кислоты, H 2 CrO 4 с p K a
0,74. При нагревании он теряет кислород с образованием Cr 2 O 3 . При лечении
щелочь раствор содержит желтый ион CrO 4 2- (водн.).Это реагирует
с сильными кислотами, чтобы получить оранжевый раствор, содержащий ион дихромата (VI):
| CrO 3 (т) | + H 2 O (л) | H 2 CrO 4 (водн.) | ||||
| 2CrO 4 2- (водн.) | + 2H + (водн.) | Cr 2 O 7 2- (водн.) | + H 2 O (л) | |||
| желтый | оранжевый |
Соединения марганца (II) содержат
очень бледно-розовый ион d 5 , устойчивый к окислению.Если добавлена щелочь
к раствору, содержащему ион Mn 2+ (водн.), не совсем белый осадок Mn (OH) 2
легко окисляется воздухом до коричневого гидратированного Mn 2 O 3 и затем, возможно,
до 2MnO 2 .H 2 O. Уменьшение пурпурного MnO 4 —
ион в щелочном растворе (например, алкенами) дает коричневый гидратированный MnO 2.
Оксид железа (II) FeO
трудно приготовить, так как он быстро окисляется на воздухе с образованием Fe 2 O 3 ,
который содержит ион d 5 .Оба эти оксида являются основными. Свежее
осажденный Fe (OH) 2 имеет зеленый цвет, но быстро темнеет на воздухе и
окончательно образует коричневый Fe (OH) 3 .
розовый кобальт соединений
содержат ион [Co (H 2 O ) 6 ] 2+ . При добавлении NaOH a
образуется осадок Co (OH) 2 , который сначала становится синим, но затем становится розовым
потепление. Синяя форма может иметь четыре, а не шесть групп OH — вокруг каждой.
ион кобальта в твердом состоянии.С аммиаком Co (OH) 2 растворяется с образованием комплекса
который подвергается окислению на воздухе с образованием коричневого [Co (NH 3 ) 6 ] 3+ (водн.)
ион.
Растворы никель (II)
содержащий зеленый [Ni (H 2 O) 6 ] 2+ (водный) ион дает, с
NaOH, бледно-зеленый осадок Ni (OH) 2 , который растворяется в аммиаке с образованием
пурпурный ион [Ni (NH 3 ) 6 ] 2+ (водн.) ион.
Когда Оксид меди (I) Cu 2 O (s)
обрабатывается водной серной кислотой, первоначально образуется ион Cu + (водн.)
диспропорционирует до коричневого осадка Cu (s) и синего иона Cu 2+ (водн.),
Гидратированный ион [Cu (H 2 O) 6 ] 2+ (водн.) Содержит четыре воды
молекулы более прочно связаны, чем две другие, и именно эти молекулы воды являются
замещается, когда бледно-голубой Cu (OH) 2 (s) растворяется в водном аммиаке с образованием
темно-синий [Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ (водн.)
ион.
Оксид цинка становится желтым
при нагревании и снова становится белым при охлаждении. Это результат движения ионов внутри
кристаллическая решетка обратимая. Он является амфотерным, что дает [Zn (H 2 O) 4 ] 2+ (водн.)
ион с кислотами и Zn (OH) 3 — (водн.) и Zn (OH) 4 2- (водн.)
ионы при обработке NaOH. Он также реагирует с аммиаком (контраст Al (OH) 3 (s),
что не дает) с образованием иона [Zn (NH 3 ) 4 ] 2+ (водн.).
Питер Хьюз
работал на химическом факультете в г.
Вестминстерская школа, где он ранее был главой науки.
Индекс проблем Домашняя страница
Узнайте об оксидах металлов | Chegg.com
Оксиды металлов — это ионные соединения, содержащие катионный металл и анионный оксид. Оксиды металлов представляют собой твердые кристаллические вещества. Оксиды металлов являются основными по своей природе и, следовательно, реагируют с водой с образованием гидроксида металла, делающего раствор основным, и они реагируют с кислотами с образованием солей.Оксиды, образованные щелочными и щелочноземельными металлами, имеют бинарную природу. Обычно они образуют три типа соединений:
Щелочные металлы — это металлы группы 1 и имеют заряд +1. Эти металлы могут образовывать оксиды, то есть M2O \ mathrm {M} _ {2} \ mathrm {O} M2 O, пероксиды, то есть M2O2 \ mathrm {M} _ {2} \ mathrm {O} _ {2} M2 O2 и супероксиды, то есть MO2 \ mathrm {M} \ mathrm {O} _ {2} MO2 MO2 \ mathrm {M} \ mathrm {O} _ {2} MO2, где M — щелочной металл, а O — атом кислорода. Щелочноземельные металлы 2 группы имеют заряд +2.Эти металлы могут образовывать оксиды, то есть MO \ mathrm {MO} MO, и пероксиды, то есть MO2 \ mathrm {MO} _ {2} MO2, и здесь M — щелочноземельный металл. Оксиды металлов щелочных металлов обычно получают реакцией их нитратов металлов с элементарным металлом в присутствии тепла. Эта реакция имеет вид:
2MNO3 + 10M → Δ6M2O + N22 \ text {MN} {{\ text {O}} _ {3}} + 10 \ text {M} \ xrightarrow {\ Delta} 6 {{\ text {M}} _ {2}} \ text {O} + {{\ text {N}} _ {2}} 2MNO3 + 10MΔ 6M2 O + N2
Аналогичным образом получают оксиды щелочноземельных металлов нагреванием их карбонатов металлов.Используемая реакция:
MCO3 + Δ → MO + CO2 \ mathrm {MCO} _ {3} + \ Delta \ rightarrow \ mathrm {MO} + \ mathrm {CO} _ {2} MCO3 + Δ → MO + CO2
Как оксиды металлов, то есть оксиды щелочноземельных металлов, так и оксиды щелочных металлов при взаимодействии с водой делают раствор основным, поскольку они являются ионными по своей природе и образуют гидроксиды металлов, которые в воде диссоциируют с образованием гидроксид-ионов, что делает раствор основным. Эти оксиды известны как основные оксиды. Поскольку они являются основными по своей природе, они подвергаются реакции нейтрализации кислотами с образованием соли и воды.
M2O + 2HCl → 2MCl + h3O \ mathrm {M} _ {2} \ mathrm {O} +2 \ mathrm {HCl} \ rightarrow 2 \ mathrm {MCl} + \ mathrm {H} _ {2} \ mathrm {O} M2 O + 2HCl → 2MCl + h3 O
Некоторыми оксидами металлов, имеющими большое значение и применением, являются оксиды магния и оксиды кальция. Они полезны из-за своих свойств, таких как оксид магния, который является хорошим проводником тепла и плохим проводником электричества. Это связано с тем, что они используются в огнеупорных кирпичах, а оксид кальция используется для очистки воды и в сталелитейной промышленности.Оксид кальция также известен как негашеная известь. В периодической таблице Менделеева при движении слева направо ионный характер оксидов уменьшается, а ковалентный характер увеличивается. Кроме того, оксиды самых левых элементов являются основными, а оксиды большинства правых элементов являются кислотными, следовательно, основность также уменьшается слева направо. И по мере продвижения вниз по группе основность оксидов увеличивается.
Определение оксида в химии.
Примеры оксидов в следующих темах:
Число окисления металлов в координационных соединениях
- Переходные металлы обычно образуют несколько степеней окисления и, следовательно, имеют несколько порядков окисления .
- Это число окисления является индикатором степени окисления (потеря электронов) атома в химическом соединении.
- O2- и S2- имеют степень окисления -2.
- В молекуле или соединении число окисления представляет собой сумму чисел окисления составляющих его атомов.
- Степень окисления H составляет +1 (H + имеет степень окисления +1).
Оксиды
- Оксиды металла обычно содержат анион кислорода в степени окисления -2.
- Большая часть земной коры состоит из твердых оксидов, , в результате элементов, окисленных кислородом воздуха или воды.
- Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами.
- Только кислотами подвержены основные оксиды ; атакованные только основаниями кислотные оксиды .
- Металлы имеют тенденцию образовывать основные оксиды , неметаллы имеют тенденцию образовывать кислые оксиды , а амфотерные оксиды образуются элементами вблизи границы между металлами и неметаллами (металлоидами).
Окисление и восстановление
- Параллельный и независимый метод характеристики органических реакций — это окисление, — терминология восстановления.
- Атомы углерода могут иметь любую степень окисления от –4 (например,
- К счастью, нам не нужно определять абсолютное состояние окисления каждого атома углерода в молекуле, а только изменение состояния окисления тех атомов углерода, которые участвуют в химическом превращении.
- Атомы углерода, окрашенные в синий цвет, восстановлены, а окрашенные в красный цвет — это окисленные .
- Эпоксидирование надкислотой и добавление брома окисляют обоих атомов углерода, поэтому они называются реакциями окисления .
Окисление
- Атом углерода карбонильной группы имеет относительно высокую степень окисления .
- Полезные тесты на альдегиды, тест Толленса, тест Бенедикта и тест Фелинга используют преимущества этой легкости окисления за счет использования Ag (+) и Cu (2+) в качестве окислителей ( окислителей ).
- В тестах Фелинга и Бенедикта в качестве окислителя используется катион меди. .
- Этот темно-синий реагент восстанавливается до оксида меди , который выпадает в осадок в виде твердого вещества от красного до желтого цвета.
- Все эти окисления катиона должны проводиться в щелочных условиях.
Состояния окисления
- Повышение атома в состоянии окисления посредством химической реакции называется окислением , и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением, и оно включает в себя усиление электронов.
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Например, Cl- имеет степень окисления -1.
- Когда он присутствует в большинстве соединений, водород имеет степень окисления +1, а кислород степень окисления -2.
- Это помогает определить степень окисления любого одного элемента в данной молекуле или ионе, предполагая, что мы знаем общие состояния окисления всех других элементов.
Марганец
- Наиболее распространенные степени окисления металлического марганца : +2, +3, +4, +6 и +7; степень окисления +2 является наиболее стабильной.
- Соединения марганца, в которых марганец находится в состоянии окисления 7+, являются мощными окислителями .
- Соединения с степенью окисления состояния 5+ (синий) и 6+ (зеленый) являются сильными окислителями .
- Степень окисления 3+ наблюдается в таких соединениях, как ацетат марганца (III); это очень мощные окислители .
- Предскажите окислительно- или восстановительную склонность разновидностей марганца с учетом его формулы или степени окисления .
Окисление фенолов
- Фенолы довольно легко окисляются , несмотря на отсутствие атома водорода на атоме углерода, несущем гидроксил.
- Окислительно-восстановительное равновесие между дигидроксибензолами гидрохиноном и катехолом и их состояниями окисления хинона настолько легкое, что обычно предпочтительны более мягкие окислители , чем хромат (реагент Джонса).
- Одним из таких окислителей является соль Фреми, показанная ниже.
- Хотя хромовая кислота окисление фенолов, имеющих незамещенное пара-положение, дает некоторое количество п-хинонового продукта, реакция является сложной и не является синтетической.
- Растворителем для этих окислений обычно является метанол или диметилформамид (ДМФ).
Нитрификация
- Nitrobacter играет важную роль в круговороте азота, окисляя нитрит в нитрат в почве.
- Нитрификация является чистым результатом двух различных процессов: окисление аммония до нитрита (NO2-) нитрозификацией или аммиаком; окисление бактерий и окисление нитрита (NO2-) до нитрата (NO3-) нитритом — окисляющих бактерий.
- Нитрификация — это процесс окисления соединения азота (фактически, потеря электронов от атома азота к атомам кислорода):
- Биохимически окисление аммония происходит путем ступенчатого окисления аммония до гидроксиламина (Nh3OH) ферментом аммониймонооксигеназой в цитоплазме с последующим окислением гидроксиламина до нитрита ферментом гидроксиламиноксидоредуктазой в периплазме.
- Кислород необходим для окисления аммония и нитрита , это означает, что как нитрозирующие, так и нитрит- окисляющие бактерии являются аэробами.
Хром
- Хром демонстрирует широкий диапазон возможных состояний окисления , , где состояние +3 является наиболее стабильным с энергетической точки зрения.
- Он обезвоживается путем нагревания с образованием зеленого оксида хрома (III) (Cr2O3), который представляет собой стабильный оксид с кристаллической структурой, идентичной структуре корунда.
- Соединения хрома (VI) являются мощными окислителями при низком или нейтральном pH.
- Хроматный и дихроматный анионы являются сильными окисляющими реагентами при низком pH.
- Степень окисления +5 реализуется только в нескольких соединениях, но является промежуточным звеном во многих реакциях, включающих окисление хроматом.
Окисление восстановленных соединений серы
- Окисление серы включает окисление восстановленных соединений серы, неорганической серы и тиосульфата с образованием серной кислоты.
- Окисление серы включает окисление восстановленных соединений серы, таких как сульфид (h3S), неорганическая сера (S0) и тиосульфат (S2O2−3), с образованием серной кислоты (h3SO4).
- Примером бактерии , окисляющей серу-, является Paracoccus.
- Помимо аэробного окисления серы , некоторые организмы (например,
- Морские автотрофные виды Beggiatoa способны окислять внутриклеточной серы до сульфата.
.

 о. — CrO, FeO
о. — CrO, FeO