Содержание
Химия X10 — задачи и реакции
“Химия X10” решает дз и контрольные.
• Подходит для 7, 8, 9, 10 и 11 классов
• Работает без интернета
• 800 000 скачавших
▶ РЕШЕНИЕ ЗАДАЧ
Вводим: “дано” и “найти”
Получаем: решенную задачу с ходом решения и ответом
Типы решаемых задач:
• по формулам
• на растворы
• на смеси
• по уравнению реакции
• на избыток и недостаток
Не решает задачи на вывод формулы вещества
▶ ХИМИЧЕСКИЕ РЕАКЦИИ
Находит уравнения реакций по введенной части
8000 реакций доступны без интернета
▶ ЦЕПОЧКИ ПРЕВРАЩЕНИЙ
Решает открытые цепочки.
Вводим:
Cu = CuO = CuCl2 = Cu(OH)2
Получаем:
1) Cu + h3SO4 = CuO + SO2 + h3O
2) 4CuO + 2Nh5Cl = 3Cu + CuCl2 + N2 + 4h3O
3) 2NaOH + CuCl2 = 2NaCl + Cu(OH)2
▶ РАССТАНОВКА КОЭФФИЦИЕНТОВ
Расставляет коэффициенты подбором и методом электронного баланса.
Вводим:
h3 + O2 = h3O
Получаем:
2h3 + O2 = 2h3O
▶ МОЛЯРНЫЕ МАССЫ
Считает молярные массы сложных веществ.
Вводим: Cu(OH)2
Получаем:
98 г/моль. Найдем в таблице Менделеева все элементы, из которых состоит Cu(OH)2. Это: Cu, O и H…
▶ ФОРМУЛЫ ДЛЯ ЗАДАЧ
Формулы разбиты на разделы с величинами: масса, молярная масса и т.д.
Для каждой записаны готовые формулы: масса: m = nM, m = ρV и другие.
▶ ШПАРГАЛКИ
Школьный курс химии доступен оффлайн. В нем 70 тем по неорганической и 90 по органической химии.
▶ ТАБЛИЦА МЕНДЕЛЕЕВА
Можно посмотреть: период, группу, атомную массу, класс, валентности, тип кристаллической решетки, цвет, температуры плавления и кипения, электронную конфигурацию, энергетические уровни, электроотрицательность
▶ ЗАЩИТА ОТ УЧИТЕЛЯ: звонок от мамы и часы
Игорь списывает на итоговой контрольной. Учительница это заметила и идет забирать телефон.
“Извините, мама звонит”, — говорит Игорь и показывает телефон.
Учительница смотрит на экран — там входящий от мамы.
“Выйди на коридор и ответь”, — предлагает она.
Игорь выходит из класса. За дверью жмет в левый верхний угол экрана — и вместо звонка снова решенная задача. Он в спокойной обстановке смотрит решение и возвращается в класс.
За дверью жмет в левый верхний угол экрана — и вместо звонка снова решенная задача. Он в спокойной обстановке смотрит решение и возвращается в класс.
Мама не звонила. Игорь включил защиту от учителя.
В “Химии X10” 2 вида защиты: звонок мамы и часы. Часы работают работают по умолчанию, звонок есть в Pro-версии
——
“Pro-версия” — это услуга по месячной подписке. Она дает бесконечные кристаллы и открывает функции, которые доступны только в “Pro-версии”: защиту от учителя «Звонок мамы» и подробное решение задач. “Pro-версия” стоит 1.99 USD (эквивалент в местной валюте) в неделю.
Подписка будет обновляться автоматически, если не отключить автоматическое продление не позже чем за 24 часа до истечения срока текущей подписки. Оплата будет взиматься со счета iTunes в течение 24 часов до окончания текущего срока подписки.
Подписками может управлять пользователь. Отключить автоматическое продление можно в настройках учетной записи после покупки.
Политика конфиденциальности:
http://appcrab. net/privacy-policy
net/privacy-policy
Условия пользования:
http://appcrab.net/terms-of-use
Решение задач по химии. Расчет по уравнениям химических реакций. In-chemistry.ru
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.

- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
Давайте запишем эти данные под уравнением реакции для наглядности.
\begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \end{matrix}
Следом запишем молярные массы для этих веществ
\begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
\begin{matrix}49 \: г & & X \: г & & & & \\ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
Для этого разделим известную массу вещества (49 грамм) на молярную массу:
49\98=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
\begin{matrix}49 \: г & & X \: г & & & & \\ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \\ 98 \: г & & 80 \: г & & 142 \: г & & 36 \: г \end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Составим из этих данных пропорцию.
\frac{49}{98} = \frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
Ответы | § 14. Составление уравнений химических реакций — Химия, 7 класс
1. Что обозначает схема химической реакции? Чем она отличается от уравнения химической реакции?
Уравнение химической реакции – это условная запись реакции с помощью химических формул и знаков «+», «-», «=».
Схема показывает только формулы исходных и конечных веществ. Между ними ставят стрелку, не расставляют коэффициенты.
2. Почему число атомов каждого элемента в обеих частях химического уравнения должно быть одинаковым?
Составление химических уравнений основано на законе сохранения массы веществ при химических реакциях.
3.
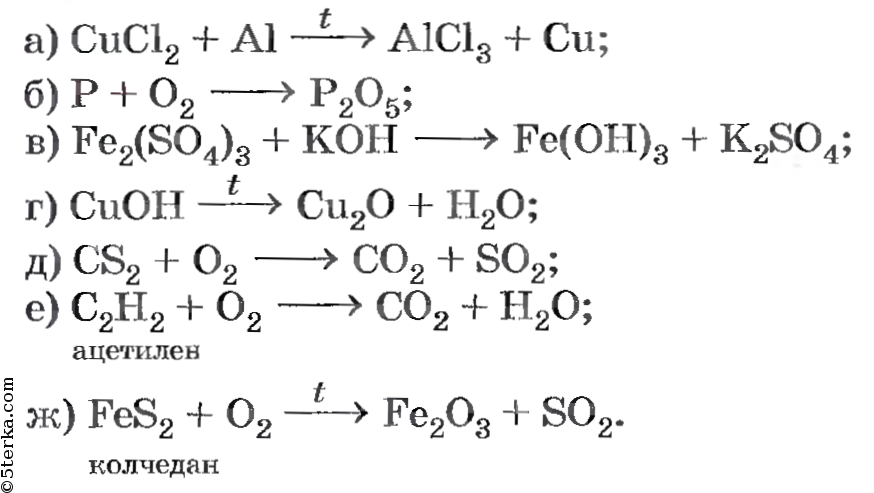 Какие из приведенных записей представляют собой схемы химических реакций, а какие — уравнения:
Какие из приведенных записей представляют собой схемы химических реакций, а какие — уравнения:
а) CaCO3 = CaO + CO2↑;
б) CH4 + O2→ CO2 + H2O;
в) Ca(OH)2 + 2HCl = CaCl2 + 2H2O;
Схемы химических реакция – б, г; уравнения – а, в.
4. Перечислите основные действия, которые необходимо выполнить, чтобы составить уравнение химической реакции.

1. составить формулы исходных и конечных веществ.
2. формулы исходных веществ записать слева, конечных справа.
3. уравнять числа атомов каждого элемента до и после реакции.
4. поставить знак «=».
5. Составьте уравнения химических реакций, приняв во внимание, что в образующихся веществах азот проявляет валентность три, а сера — два: а) магний + азот; б) калий + сера; в) алюминий + азот; г) алюминий + сера.

а) 3Mg+N2=Mg3N2
б) 2K + S = K2S
в) 4Al+3N2=2Al2N3
г) 2Al+3S=Al2S
6. Составьте уравнения химических реакций:
а) Zn + O2 → ; б) H2 + Cl2 → ; в) KClO3 →KCl + O2; г) Al + O2 →Al2О3.
а) 2Zn + O2 =2ZnO
б) H2 + Cl2 = 2HCl
в) 2KClO3 = 2KCl + 3O2↑
г) 4Al + 3O2 = 2Al2О3
7. Вместо знака вопроса запишите формулы веществ и составьте уравнения химических реакций:
а) HgO → Hg + ?; б) H2O→ O2 + ?; в) P + O2 →?; г) Ca + O2 = ?; д) Fe + ? →FeCl3; е) Al + S → ?.
а) 2HgO = 2Hg + O2↑
б) H2O= O2↑ + 2H2
в) 4P + 5O2 = 2P2O5
г) 2Ca + O2 = 2CaO
д) 2Fe + 3Cl2 = 2FeCl3
е) 2Al +3S = Al2S3
8. Для остановки кровотечения и дезинфекции раны ее обрабатывают раствором вещества Н2О2 (т. н. перекиси водорода). При контакте с кровью оно превращается в два новых вещества — Н2О и О2. Напишите уравнение соответствующей реакции.
9.
 Перечислите важнейшие химические реакции, протекающие в: а) природе; б) живых организмах; в) быту; г) промышленности.
Перечислите важнейшие химические реакции, протекающие в: а) природе; б) живых организмах; в) быту; г) промышленности.
а) образование озона при грозе, фотосинтез
б) расщепление питательных веществе с целью получения энергии, пищеварение, свёртываемость крови
в) приготовление творога, брожение сока, горение угля, прокисание молока
г) получение металлов из руд, переработка отходов, получение удобрений
Присоединяйтесь к Telegram-группе @superresheba_7,
делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!
МЦКО
Число сдающих ЕГЭ по химии ежегодно увеличивается. Чтобы успешно сдать этот предмет, будущим участникам экзамена стоит потренироваться в решении комбинированных заданий, записи заданий с развернутым ответом и научиться грамотно распределять свое время. Серию публикаций от специалистов Федерального института педагогических измерений (ФИПИ) продолжает обзор методических рекомендаций с советами по подготовке к ЕГЭ по химии.
Чтобы успешно сдать этот предмет, будущим участникам экзамена стоит потренироваться в решении комбинированных заданий, записи заданий с развернутым ответом и научиться грамотно распределять свое время. Серию публикаций от специалистов Федерального института педагогических измерений (ФИПИ) продолжает обзор методических рекомендаций с советами по подготовке к ЕГЭ по химии.
На протяжении нескольких лет сохраняется тенденция к увеличению количества выпускников, выбирающих экзамен по химии. Это может быть связано как с возрастанием в обществе внимания к подготовке специалистов в области естественных наук, так и с увеличением количества вузов и расширением перечня специальностей, для поступления на которые нужны результаты ЕГЭ по химии.
В 2019 году структура и содержание экзаменационной работы по химии не менялись по сравнению с предыдущим годом.
Наиболее успешно участники экзамена выполняют задания, проверяющие умения характеризовать особенности строения атомов химических элементов, определять степени окисления атомов, определять принадлежность веществ к классам/группам неорганических и органических веществ, классифицировать химические реакции, составлять уравнения реакций ионного обмена и гидролиза, анализировать зависимость скорости химической реакции от различных факторов. Практически все эти умения относятся к содержательным блокам «Теоретические основы химии» и «Химическая реакция» и отрабатываются на уроках на протяжении всех лет изучения химии в школе.
Практически все эти умения относятся к содержательным блокам «Теоретические основы химии» и «Химическая реакция» и отрабатываются на уроках на протяжении всех лет изучения химии в школе.
Одной из важных составляющих качественной подготовки к ЕГЭ по химии является совершенствование навыков работы с химической информацией, представленной в различной форме: текстов, схем, таблиц, рисунков.
Рекомендуется также для повторения изученного материала использовать комбинированные задания, в которых для решения требуется проведение различных типов расчетов и применение знаний из разных тем. Например, это могут быть задания, включающие перечень веществ, для которых нужно определить возможность их взаимодействия и составить соответствующие им химические реакции: молекулярные уравнения, полные и сокращенные ионные для реакций ионного обмена и окислительно-восстановительные реакции с составлением электронного баланса.
Одним из наиболее важных факторов, определяющих результат ЕГЭ у конкретного участника, является умение четко записывать решение заданий с развернутым ответом. Поэтому в процессе подготовки к экзамену надо обратить внимание на отработку записи решения задач, в том числе выходящих за рамки ЕГЭ. Для расчетных задач в ряде случаев можно предложить учащимся прописывать в общем виде порядок нахождения физических величин, без арифметических расчетов. Такой подход позволит сформировать у старшеклассников умение самостоятельно разрабатывать алгоритм решения заданий.
Поэтому в процессе подготовки к экзамену надо обратить внимание на отработку записи решения задач, в том числе выходящих за рамки ЕГЭ. Для расчетных задач в ряде случаев можно предложить учащимся прописывать в общем виде порядок нахождения физических величин, без арифметических расчетов. Такой подход позволит сформировать у старшеклассников умение самостоятельно разрабатывать алгоритм решения заданий.
Ежегодно существенные затруднения у экзаменуемых вызывают задания, направленные на проверку знаний о способах получения и областях применения веществ (задание 26) и качественных реакциях на вещества (задание 25). Выполнение этих заданий основывается на опыте проведения реального химического эксперимента. Учитывая распределение данного материала практически по всем темам курса химии, важным моментом при подготовке к экзамену становится составление обобщающих таблиц, в которых фиксируются необходимые сведения о веществах: реактивы для распознавания, области применения, способы получения.
Успех на экзамене связан и с умением выпускников рационально использовать время, отведенное на выполнение экзаменационной работы. В процессе предэкзаменационной тренировки важно выработать для себя индивидуальный порядок и темп выполнения заданий экзаменационного варианта.
Как легко решать химические уравнения. Как уравнять химическое уравнение: правила и алгоритм
Реакции между разного рода химическими веществами и элементами являются одним из главных предметов изучения в химии. Чтобы понять, как составить уравнение реакции и использовать их в своих целях необходимо достаточно глубокое понимание всех закономерностей при взаимодействии веществ, а также процессов с химическими реакциями.
Составление уравнений
Одним из способов выражения химической реакции является – химическое уравнение. В нем записывается формула исходного вещества и продукта, коэффициенты, которые показывают, какое количество молекул имеет каждое вещество. Все известные химические реакции разделяются на четыре типа: замещение, соединение, обмен и разложение. Среди них выделяют: окислительно-восстановительные, экзогенные, ионные, обратимые, необратимые и т.д.
Среди них выделяют: окислительно-восстановительные, экзогенные, ионные, обратимые, необратимые и т.д.
Подробнее о том, как составлять уравнения химических реакций:
- Необходимо определить, название веществ, взаимодействующих между собой в реакции. Пишем их в левой части нашего уравнения. В качестве примера рассмотрим химическую реакцию, которая образовалась между серной кислотой и алюминием. Реагенты располагаем слева: h3SO4+Al. Далее пишем знак «равно». В химии вы можете повстречать знак «стрелочка», которая указывает вправо, или же направленные противоположно две стрелки, они означают «обратимость». Результат взаимодействия металла и кислоты – соль и водород. Полученные после реакции продукты запиши после знака «равно», то есть справа. h3SO4+Al= h3+ Al2(SO4)3. Итак, у нас видна схема реакции.
- Для составления химического уравнения обязательно нужно найти коэффициенты. Вернемся к предыдущей схеме. Посмотрим на левую ее часть. В составе серной кислоты содержатся атомы водорода, кислорода и серы, в примерном соотношении 2:4:1.
 В правой части – 3 атома серы и 12 атомов кислорода в соли. Два атома водорода содержится в молекуле газа. В левой части соотношение этих элементов составляет2:3:12
В правой части – 3 атома серы и 12 атомов кислорода в соли. Два атома водорода содержится в молекуле газа. В левой части соотношение этих элементов составляет2:3:12 - Для уравнивания количества атомов кислорода и серы, которые в составе сульфата алюминия (III), необходимо поставить перед кислотой в левую часть уравнения коэффициент 3. Теперь у нас в левой части имеется 6 атомов водорода. Для того чтобы сравнять количество элементов водорода, нужно поставить 3 перед водородом в правой части уравнения.
- Теперь осталось лишь уравнять количество алюминия. Поскольку в состав соли входит два атома металла, то в левой части перед алюминием выставляем коэффициент 2. В итоге, мы получим уравнение реакции этой схемы: 2Al+3h3SO4=Al2(SO4)3+3h3
Поняв основные принципы как составить уравнение реакции химических веществ, в дальнейшем не вызовет особого труда записать любую, даже самую экзотическую, с точки зрения химии, реакцию.
Поговорим о том, как составить уравнение химической реакции. Именно этот вопрос в основном вызывает серьезные затруднения у школьников. Одни не могут понять алгоритм составления формул продуктов, другие неправильно расставляют коэффициенты в уравнении. Учитывая, что все количественные вычисления осуществляются именно по уравнениям, важно понять алгоритм действий. Попробуем выяснить, как составлять уравнения химических реакций.
Именно этот вопрос в основном вызывает серьезные затруднения у школьников. Одни не могут понять алгоритм составления формул продуктов, другие неправильно расставляют коэффициенты в уравнении. Учитывая, что все количественные вычисления осуществляются именно по уравнениям, важно понять алгоритм действий. Попробуем выяснить, как составлять уравнения химических реакций.
Составление формул по валентности
Для того чтобы правильно записывать процессы, происходящие между различными веществами, нужно научиться записывать формулы. Бинарные соединения составляют с учетом валентностей каждого элемента. Например, у металлов главных подгрупп она соответствует номеру группы. При составлении конечной формулы между этими показателями определяется наименьшее кратное, затем расставляются индексы.
Что такое уравнение
Под ним понимают символьную запись, которая отображает взаимодействующие химические элементы, их количественные соотношения, а также те вещества, которые получаются в результате процесса. Одно из заданий, предлагаемых ученикам девятого класса на итоговой аттестации по химии, имеет следующую формулировку: «Составьте уравнения реакций, характеризующих химические свойства предложенного класса веществ». Для того чтобы справиться с поставленной задачей, ученики должны владеть алгоритмом действий.
Одно из заданий, предлагаемых ученикам девятого класса на итоговой аттестации по химии, имеет следующую формулировку: «Составьте уравнения реакций, характеризующих химические свойства предложенного класса веществ». Для того чтобы справиться с поставленной задачей, ученики должны владеть алгоритмом действий.
Алгоритм действий
Например, нужно написать процесс горения кальция, пользуясь символами, коэффициентами, индексами. Поговорим о том, как составить уравнение химической реакции, воспользовавшись порядком действий. В левой части уравнения через «+» записываем знаками вещества, которые участвуют в данном взаимодействии. Так как горение происходит с участием кислорода воздуха, который относится к двухатомным молекулам, его формулу пишем О2.
За знаком равенства формируем состав продукта реакции, используя правила расстановки валентности:
2Ca + O2 = 2CaO.
Продолжая разговор о том, как составить уравнение химической реакции, отметим необходимость использования закона постоянства состава, а также сохранения состава веществ.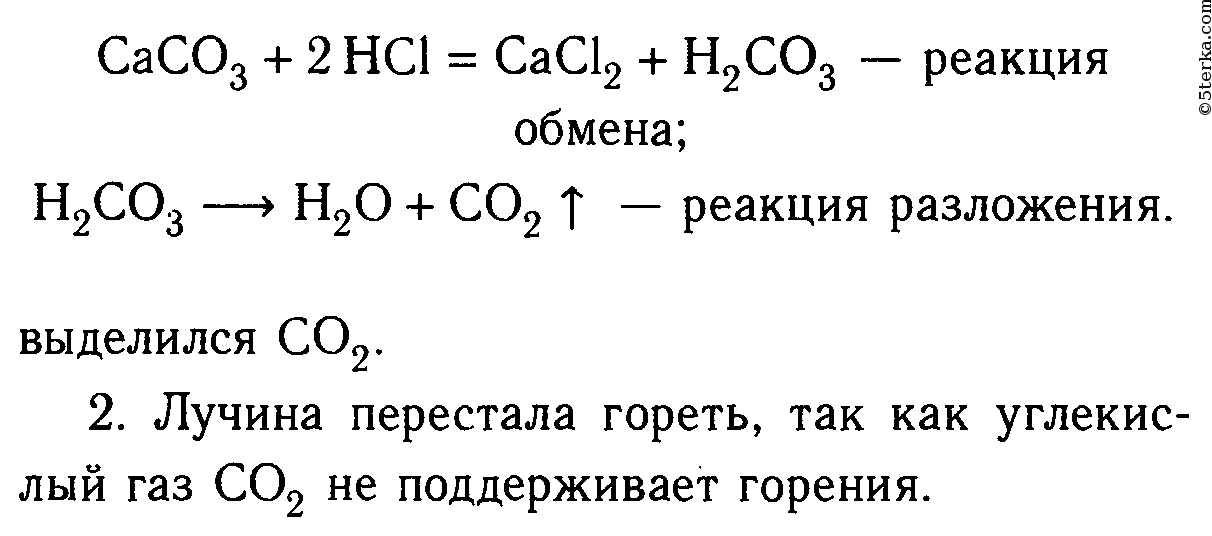 Они позволяют проводить процесс уравнивания, расставлять в уравнении недостающие коэффициенты. Данный процесс является одним из простейших примеров взаимодействий, происходящих в неорганической химии.
Они позволяют проводить процесс уравнивания, расставлять в уравнении недостающие коэффициенты. Данный процесс является одним из простейших примеров взаимодействий, происходящих в неорганической химии.
Важные аспекты
Для того чтобы понять, как составить уравнение химической реакции, отметим некоторые теоретические вопросы, касающиеся этой темы. Закон сохранения массы веществ, сформулированный М. В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
При уравнивании левой и правой частей уравнения используют наименьшее общее кратное, аналогично тому, как составляется формула соединения с учетом валентностей каждого элемента.
Окислительно-восстановительные взаимодействия
После того как у школьников будет отработан алгоритм действий, они смогут составить уравнение реакций, характеризующих химические свойства простых веществ.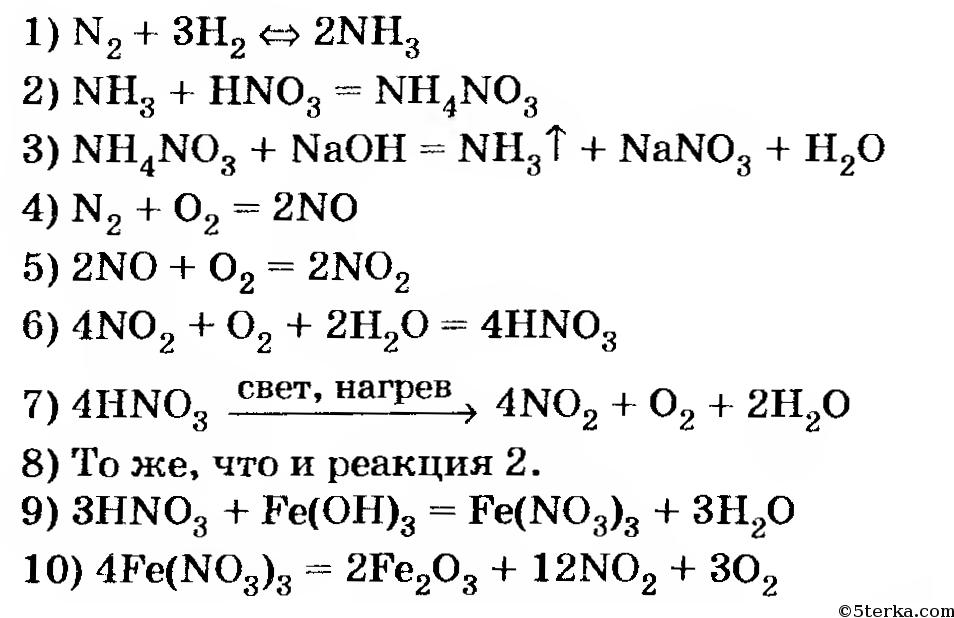 Теперь можно переходить к разбору более сложных взаимодействий, например протекающих с изменением степеней окисления у элементов:
Теперь можно переходить к разбору более сложных взаимодействий, например протекающих с изменением степеней окисления у элементов:
Fe + CuSO4 = FeSO4 + Cu.
Существуют определенные правила, согласно которым расставляют степени окисления в простых и сложных веществах. Например, у двухатомных молекул этот показатель равен нулю, в сложных соединениях сумма всех степеней окисления также должна быть равна нулю. При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
Между этими показателями определяется наименьшее кратное, а также коэффициенты. Завершающим этапом разбора окислительно-восстановительного взаимодействия является расстановка коэффициентов в схеме.
Ионные уравнения
Одним из важных вопросов, который рассматривается в курсе школьной химии, является взаимодействие между растворами. Например, дано задание следующего содержания: «Составьте уравнение химической реакции ионного обмена между хлоридом бария и сульфатом натрия». Оно предполагает написание молекулярного, полного, сокращенного ионного уравнения. Для рассмотрения взаимодействия на ионном уровне необходимо по таблице растворимости указать ее для каждого исходного вещества, продукта реакции. Например:
Оно предполагает написание молекулярного, полного, сокращенного ионного уравнения. Для рассмотрения взаимодействия на ионном уровне необходимо по таблице растворимости указать ее для каждого исходного вещества, продукта реакции. Например:
BaCl2 + Na2SO4 = 2NaCl + BaSO4
Вещества, которые не растворяются на ионы, записывают в молекулярном виде. Реакция обмена ионами протекает полностью в трех случаях:
- образование осадка;
- выделение газа;
- получение малодиссоциируемого вещества, например воды.
При наличии у вещества стереохимического коэффициента он учитывается при написании полного ионного уравнения. После того как будет написано полное ионное уравнение, проводят сокращение тех ионов, которые не были связаны в растворе. Конечным итогом любого задания, предполагающего рассмотрение процесса, протекающего между растворами сложных веществ, будет запись сокращенной ионной реакции.
Заключение
Химические уравнения позволяют объяснять с помощью символов, индексов, коэффициентов те процессы, которые наблюдаются между веществами. В зависимости от того, какой именно протекает процесс, существуют определенные тонкости записи уравнения. Общий алгоритм составления реакций, рассмотренный выше, основывается на валентности, законе сохранения массы веществ, постоянстве состава.
В зависимости от того, какой именно протекает процесс, существуют определенные тонкости записи уравнения. Общий алгоритм составления реакций, рассмотренный выше, основывается на валентности, законе сохранения массы веществ, постоянстве состава.
Имеет валентность равную двум, но в некоторых соединениях может проявлять высшую валентность. Если будет написана неправильно, то может не уравняться.
После правильного написания получившихся формул расставляем коэффициенты. Они для уравнения элементов. Суть уравнивания заключается в том, чтобы число элементов до реакции равнялось числу элементов после реакции. Начинать уравнивание стоит всегда с . Расставляем коэффициенты согласно индексам в формулах. Если с одной стороны реакции имеет индекс два, а с другой не имеет (принимает значение единицы), то во втором случае перед формулой ставим двойку.
Как только перед веществом поставлен коэффициент, значения всех элементов в этом увеличиваются в значение коэффициента. Если элемент обладает индексом, то сумма получившихся будет равняться произведению индекса и коэффициента.
После уравнивания металлов переходим к неметаллам. Затем переходим к кислотным остаткам и гидроксильным группам. Далее уравниваем водород. В самом конце проверяем реакцию
по уравненному кислороду.
Химические реакции – это взаимодействие веществ, сопровождаемое изменением их состава. Иными словами, вещества, вступающие в , не соответствуют веществам, получающимся в результате реакции. С подобными взаимодействиями человек сталкивается ежечасно, ежеминутно. Ведь процессы, протекающие в его организме (дыхание, синтез белков, пищеварение и т.д.) – это тоже химические реакции.
Инструкция
Итак, запишите в левой части реакции исходные вещества: СН4 + О2.
В правой, соответственно, будут продукты реакции: СО2 + Н2О.
Предварительная запись этой химической реакции будет следующей: СН4 + О2 = СО2 + Н2О.
Уравняйте вышенаписанную реакцию, то есть добейтесь выполнения основного правила: количество атомов каждого элемента в левой и правой частях химической реакции должно быть одинаковым.
Вы видите, что количество атомов углерода совпадает, а количество атомов кислорода и водорода разное. В левой части 4 атома водорода, а в правой — только 2. Поэтому поставьте перед формулой воды коэффициент 2. Получите: СН4 + О2 = СО2 + 2Н2О.
Атомы углерода и водорода уравнены, теперь осталось сделать то же самое с кислородом. В левой части атомов кислорода 2, а в правой – 4. Поставив перед молекулой кислорода коэффициент 2, получите итоговую запись реакции окисления метана: СН4 + 2О2 = СО2 + 2Н2О.
Как неудивительна природа для человека: зимой она окутывает землю снежным пуховым одеялом, весной — раскрывает, словно хлопья поп корна, все живое, летом — бушует буйством красок, осенью поджигает рыжим огнем растения… И только если вдуматься и присмотреться, можно увидеть, что стоят за всеми этими столь привычными изменениями сложные физические процессы и ХИМИЧЕСКИЕ РЕАКЦИИ. А чтобы исследовать все живое, необходимо уметь решать химические уравнения. Основным требованием при уравнивании химических уравнений — знание закона сохранения количества вещества: 1)количество вещества до реакции равно количеству вещества после реакции; 2)общее количество вещества до реакции равно общему количеству вещества после реакции.
Инструкция
Чтобы уравнять «пример» необходимо выполнить несколько шагов.
Записать уравнение
реакции в общем виде. Для этого неизвестные коэффициенты перед обозначить буквами латинского (х, y, z, t и тд). Пусть требуется уравнять реакцию соединения водорода и , в результате которой получится вода. Перед молекулами водорода, кислорода и воды поставить латинские
Часть I
1. Закон Ломоносова-Лавуазье – закон сохранения массы веществ:
2. Уравнения химической реакции – это
условная запись химической реакции с помощью химических формул и математических знаков.
3. Химическое уравнение должно соответствовать закону
сохранения массы веществ, что достигается расстановкой коэффициентов в уравнении реакции.
4. Что показывает химическое уравнение?
1) Какие вещества вступают в реакцию.
2) Какие вещества образуются в результате.
3) Количественные отношения веществ в реакции, т.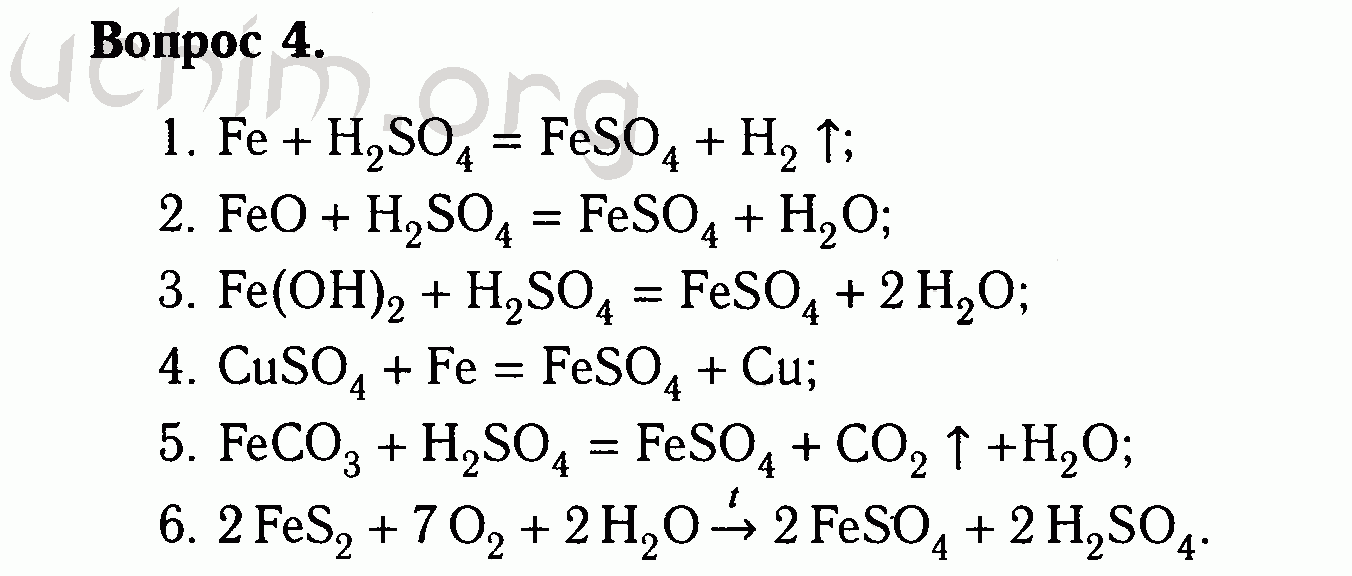 е. количества реагирующих и образующихся веществ в реакции.
е. количества реагирующих и образующихся веществ в реакции.
4) Тип химической реакции.
5. Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и фосфорной кислоты с образованием фосфата бария и воды.
а) Запишите схему реакции, т. е. формулы реагирующих и образующихся веществ:
б) начинайте уравнивать схему реакции с формулы соли (если она имеется). При этом помните, что несколько сложных ионов в составе основания или соли обозначаются скобками, а их число – индексами за скобками:
в) водород уравняйте в предпоследнюю очередь:
г) кислород уравняйте последним – это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Часть II
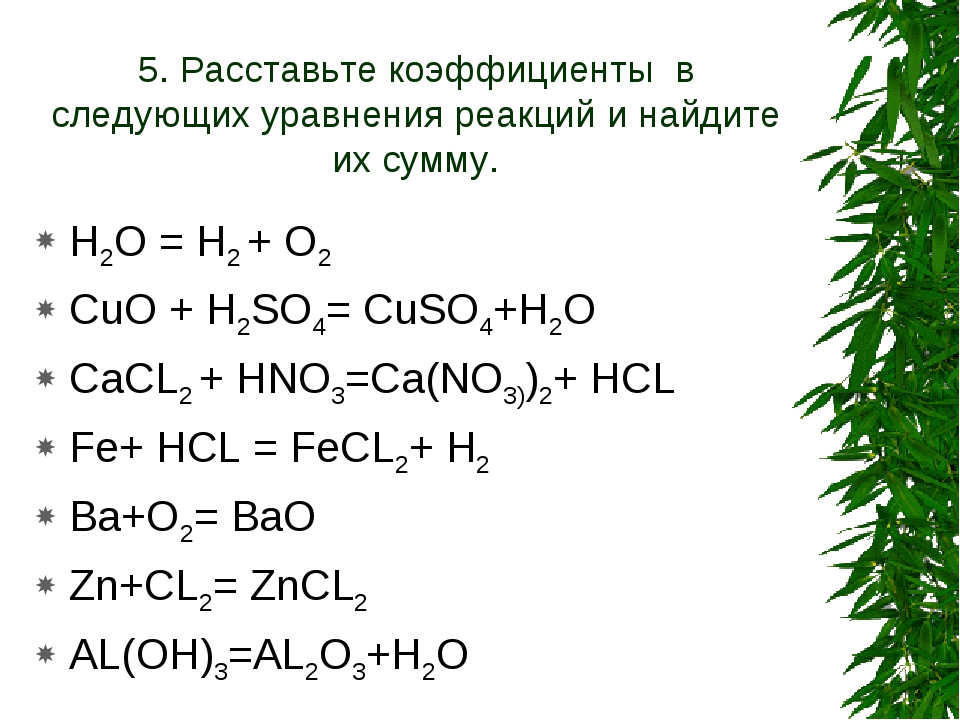
1. Составьте уравнения реакций, схемы которых:
2. Напишите уравнения химических реакций:
3. Установите соответствие между схемой и суммой коэффициентов в химической реакции.
Установите соответствие между схемой и суммой коэффициентов в химической реакции.
4. Установите соответствие между исходными веществами и продуктами реакции.
5. Что показывает уравнение следующей химической реакции:
1) Вступили в реакцию гидроксид меди и соляная кислота;
2) Образовались в результате реакции соль и вода;
3) Коэффициенты перед исходными веществами 1 и 2.
6. С помощью следующей схемы составьте уравнение химической реакции, используя удвоение дробного коэффициента:
7. Уравнение химической реакции:
4P+5O2=2P2O5
показывает количество вещества исходных веществ и продуктов, их массу или объём:
1) фосфора – 4 моль или 124 г;
2) оксида фосфора (V) – 2 моль, 284 г;
3) кислорода – 5 моль или 160 л.
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений — важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.
Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий — металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород — это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na 2 O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам.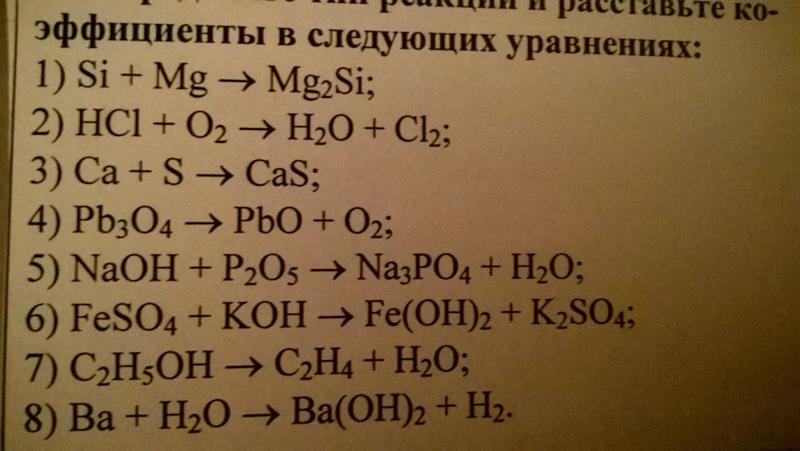 Итак, составление химических уравнений предполагает определенный порядок действий.
Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
Им будет в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O 2 =MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O 2 =2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl 2 +H 2 .
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl 2 +H 2 .
Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью коэффициентов, индексов.
Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
Самостоятельная работа по химии на тему «Химические уравнения» (Два варианта) 8 класс | Тренажёр по химии (8 класс) на тему:
Самостоятельная работа по теме «Химические уравнения» 1 вариант
Задание 1. Расставьте коэффициенты в следующих схемах реакций:
- Al + O2 = Al2O3
- N2 + h3 = Nh4
- Ca + h4PO4 = Ca3(PO4)2 +h3
- Ba(OH)2 + HCl = BaCl2 + h3O
- ZnCl2 + AgNO3 = AgCl + Zn(NO3)2
Задание 2. Напишите уравнения реакций по следующим схемам:
Напишите уравнения реакций по следующим схемам:
- Натрий + вода = гидроксид натрия + водород
- Фосфор + кислород = оксид фосфора (III)
- Хлорид железа (III) + гидроксид калия = гидроксид железа (III) + хлорид калия
- Гидроксид алюминия = оксид алюминия + вода
- Сульфат алюминия + хлорид бария = хлорид алюминия + сульфат бария
Самостоятельная работа по теме «Химические уравнения» 2 вариант
Задание 1. Расставьте коэффициенты в следующих схемах реакций:
- P + O2 = P2O3
- Li + N2 = Li3N
- Zn + HCl = ZnCl2 +h3
- Fe(OH)3 + HCl = FeCl3 + h3O
- BaCl2 + Al2(SO4)3 = AlCl3 + BaSO4
Задание 2. Напишите уравнения реакций по следующим схемам:
- Барий + вода = гидроксид бария + водород
- Азот + кислород = оксид азота (III)
- Гидроксид железа (III) = оксид железа (III) + вода
- Нитрат алюминия + фосфат натрия = фосфат алюминия + нитрат натрия
- Серная кислота + гидроксид натрия = сульфат натрия + вода
Самостоятельная работа по теме «Химические уравнения» 1 вариант
Задание 1. Расставьте коэффициенты в следующих схемах реакций:
Расставьте коэффициенты в следующих схемах реакций:
- Al + O2 = Al2O3
- N2 + h3 = Nh4
- Ca + h4PO4 = Ca3(PO4)2 +h3
- Ba(OH)2 + HCl = BaCl2 + h3O
- ZnCl2 + AgNO3 = AgCl + Zn(NO3)2
Задание 2. Напишите уравнения реакций по следующим схемам:
- Натрий + вода = гидроксид натрия + водород
- Фосфор + кислород = оксид фосфора (III)
- Хлорид железа (III) + гидроксид калия = гидроксид железа (III) + хлорид калия
- Гидроксид алюминия = оксид алюминия + вода
- Сульфат алюминия + хлорид бария = хлорид алюминия + сульфат бария
Самостоятельная работа по теме «Химические уравнения» 2 вариант
Задание 1. Расставьте коэффициенты в следующих схемах реакций:
- P + O2 = P2O3
- Li + N2 = Li3N
- Zn + HCl = ZnCl2 +h3
- Fe(OH)3 + HCl = FeCl3 + h3O
- BaCl2 + Al2(SO4)3 = AlCl3 + BaSO4
Задание 2. Напишите уравнения реакций по следующим схемам:
- Барий + вода = гидроксид бария + водород
- Азот + кислород = оксид азота (III)
- Гидроксид железа (III) = оксид железа (III) + вода
- Нитрат алюминия + фосфат натрия = фосфат алюминия + нитрат натрия
- Серная кислота + гидроксид натрия = сульфат натрия + вода
Реакции, которые уравниваются, но не идут, и реакции, которые идут, но не уравниваются.

После ряда наблюдений я установил с исключительной точностью, что каждая селедка — рыба, но не каждая рыба — селедка.
А. Некрасов, «Приключения капитана Врунгеля».
Сегодня мы обсудим два распространенных заблуждения, которые касаются химических реакций:
если в уравнении реакции удается расставить коэффициенты, то она точно протекает;
если реакцию не получается уравнять, то исходные вещества не реагируют друг с другом.
Когда речь идет об уравнениях химических реакций, необходимо понимать, что они отображают реально протекающие в природе, в лаборатории, в реакторе или где-то еще процессы. Символы в них несут определенный смысл, как буквы в словах или числа в математических операциях, поэтому их невозможно просто хаотически переставить и получить верное уравнение, отражающее осуществимое превращение.
Сравните:
«осуществимый» и «сущемыйвисто»
2K + 2HCl = 2KCl + h3 и K2 + 2HCl = K2h3 + Cl2
Для химика второе уравнение выглядит так же пугающе, неверно и непонятно, как второе слово для людей, разговаривающих на русском языке.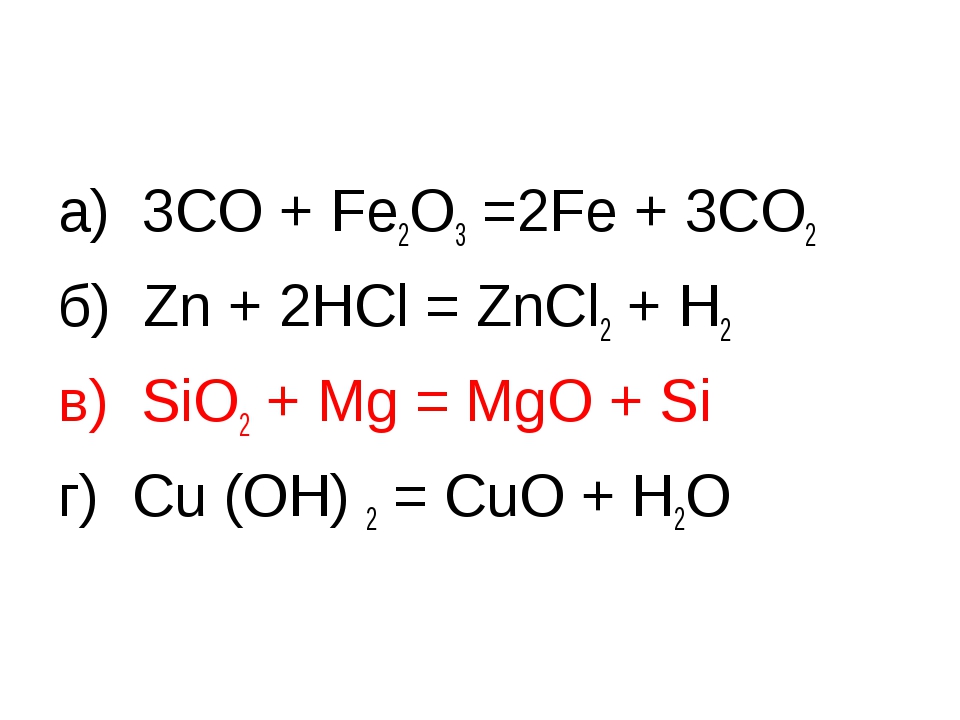
Таким образом, верное с точки зрения баланса элементов химическое уравнение не может считаться верным по своей сути, если не отражает реальных свойств вещества.
Fe + 2HCl = FeCl2 + h3 – это верно, а 2Fe + 6HCl = 2FeCl3 + 3h3 – неверно, хотя и уравнено.
С другой стороны, если коэффициенты не получается расставить, это далеко не всегда означает, что взятые реагенты не взаимодействуют между собой. Давайте рассмотрим несколько пар реакций и обсудим, что в них пошло не так.
CuO + h3 = Cu(OH)2
CuO + h3 = Cu + h3O
Во второй реакции все коэффициенты единичные, с балансом элементов нет никаких проблем. В первом случает коэффициенты словно «зацикливаются» – при постановке, казалось бы, финального коэффициента сбивается соотношение между уже уравненными элементами. Такое положение вещей может сигнализировать о том, что продукты указаны неверно. Реакция между водородом и оксидом меди (II) является окислительно-восстановительной, но при записи CuO + h3 = Cu(OH)2 заряд меняется только у атомов водорода, что противоречит здравому смыслу.
FeO + h3SO4 = FeSO4 + h3O
2FeO + 3h3SO4 = Fe2(SO4)3 + 3h3O
С первой реакцией все в порядке, а во второй не получается сбалансировать кислород. Это связано с тем, что при составлении формулы соли в правой части уравнения железу присвоена неверная степень окисления. При взаимодействии оксида железа с раствором серной кислоты его степень окисления не должна изменяться, а в примере (2) она выросла с +2 до +3. Не надо так!
CaCO3 + 2HCl = CaCl2 + h3O + CO2
CaCO3 + 2HCl = 2CaCl + h3O + CO2
Первое уравнение составлено верно, во втором «зацикливаются» коэффициенты. В этом примере ошибка допущена при составлении (если точнее, то в несоставлении) формулы хлорида кальция. При записи реакций не забывайте смотреть в таблицу растворимости и проверять индексы в каждой формуле.
Для тренировки попробуйте исправить ошибки в уравнениях (ответы будут ниже):
MnO2 + 2HCl = MnCl2 + 2h3O
2NaOH + Br2O = 2NaBr + h3O
NaOH + SO3 = NaSO3 + h3O
Fe2O3 + 4HNO3 = 2Fe(NO3)2 + 2h3O
Ba(OH)2 + HBr = BaBr + 2h3O
Учите химию, будьте бдительны и помните – чтобы реакция уравнялась, правильно запишите ее продукты.
Ответы (выделены вещества, из-за которых все пошло не так):
MnO2 + 4HCl = MnCl2 + 2h3O + Cl2
2NaOH + Br2O = 2NaBrO + h3O
2NaOH + SO3 = Na2SO4 + h3O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3h3O
Ba(OH)2 + 2HBr = BaBr2 + 2h3O
Уравнение химии — вводная химия — 1-е канадское издание
Цели обучения
- Определите химическое уравнение .
- Определяет составные части химического уравнения.
Химическая реакция выражает химическое изменение. Например, одним из химических свойств водорода является то, что он вступает в реакцию с кислородом с образованием воды. Мы можем написать это так:
водород реагирует с кислородом с образованием воды
Мы можем представить это химическое изменение более кратко как
водород + кислород → вода
, где знак + означает, что два вещества химически взаимодействуют друг с другом, а символ → означает, что происходит химическая реакция. Но вещества также могут быть представлены химическими формулами. Помня, что водород и кислород существуют в виде двухатомных молекул, мы можем переписать наше химическое изменение как
Но вещества также могут быть представлены химическими формулами. Помня, что водород и кислород существуют в виде двухатомных молекул, мы можем переписать наше химическое изменение как
H 2 + O 2 → H 2 O
Это пример химического уравнения, краткого описания химической реакции. Исходные вещества называются реагентами, а конечные вещества — продуктами.
К сожалению, это также неполное химическое уравнение .Закон сохранения материи гласит, что материя не может быть создана или уничтожена. В химических уравнениях количество атомов каждого элемента в реагентах должно быть таким же, как количество атомов каждого элемента в продуктах. Если мы посчитаем количество атомов водорода в реагентах и продуктах, мы найдем два атома водорода. Но если мы посчитаем количество атомов кислорода в реагентах и продуктах, мы обнаружим, что в реагентах есть два атома кислорода, но только один атом кислорода в продуктах.
Что мы можем сделать? Можно ли изменить индексы в формуле для воды так, чтобы в ней было два атома кислорода? Нет; вы не можете изменить формулы отдельных веществ, потому что химическая формула данного вещества характерна для этого вещества. Однако то, что может сделать , — это изменить количество молекул, которые вступают в реакцию или образуются. Мы делаем это по одному элементу за раз, переходя от одной стороны реакции к другой, изменяя количество молекул вещества до тех пор, пока все элементы не будут иметь одинаковое количество атомов с каждой стороны.
Однако то, что может сделать , — это изменить количество молекул, которые вступают в реакцию или образуются. Мы делаем это по одному элементу за раз, переходя от одной стороны реакции к другой, изменяя количество молекул вещества до тех пор, пока все элементы не будут иметь одинаковое количество атомов с каждой стороны.
Чтобы использовать два атома кислорода в качестве реагентов, предположим, что у нас есть две молекулы воды в качестве продуктов:
H 2 + O 2 → 2 H 2 O
2 перед формулой для воды называется коэффициентом. Теперь в реагентах такое же количество атомов кислорода, как и в продукте. Но чтобы удовлетворить потребность в одинаковом количестве атомов кислорода на обеих сторонах реакции, мы также изменили количество атомов водорода на стороне продукта, поэтому количество атомов водорода больше не равно.Нет проблем — просто вернитесь к реакционной стороне уравнения и добавьте коэффициент перед H 2 . Действующий коэффициент 2:
Действующий коэффициент 2:
.
2 H 2 + O 2 → 2 H 2 O
Теперь в реагентах есть четыре атома водорода, а также четыре атома водорода в продукте. В реагентах есть два атома кислорода и два атома кислорода в продукте. Закон сохранения вещества соблюден. Когда реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов, мы говорим, что уравнение сбалансировано.Все правильные химические уравнения сбалансированы. Если перед веществом не написан коэффициент, предполагается, что он равен 1. Кроме того, принято использовать все целые числа при балансировании химических уравнений. Иногда это заставляет нас делать немного больше «туда-сюда» при балансировании химического уравнения.
Пример 1
Напишите и уравновесите химические уравнения для каждой данной химической реакции.
- Водород и хлор реагируют с образованием HCl.
- Этан, C 2 H 6 , реагирует с кислородом с образованием диоксида углерода и воды.

Решение
Давайте начнем с простого написания химического уравнения в терминах формул веществ, помня, что и элементарный водород, и хлор двухатомны:
H 2 + Cl 2 → HCl
В реагентах есть два атома водорода и два атома хлора, а в продукте — по одному на каждый атом. Мы можем исправить это, включив коэффициент 2 на стороне продукта:
H 2 + Cl 2 → 2 HCl
Теперь есть два атома водорода и два атома хлора по обе стороны химического уравнения, так что оно уравновешено.
Начните с написания химического уравнения в терминах используемых веществ:
C 2 H 6 + O 2 → CO 2 + H 2 O
У нас два атома углерода слева, поэтому нам нужны две молекулы диоксида углерода на стороне продукта, чтобы на каждой стороне было по два атома углерода; этот элемент сбалансирован. У нас есть шесть атомов водорода в реагентах, поэтому нам нужно шесть атомов водорода в продуктах.
 Мы можем получить это, имея три молекулы воды:
Мы можем получить это, имея три молекулы воды:C 2 H 6 + O 2 → 2 CO 2 + 3 H 2 O
Теперь у нас есть семь атомов кислорода в продуктах (четыре из CO 2 и три из H 2 O).Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород — двухатомная молекула, мы можем получить только четное количество атомов кислорода за один раз. Этого можно добиться, умножив остальные коэффициенты на 2:
.
2 C 2 H 6 + O 2 → 4 CO 2 + 6 H 2 O
Умножая все остальное на 2, мы не выводим из равновесия другие элементы, и теперь мы получаем четное число атомов кислорода в произведении — 14. Мы можем получить 14 атомов кислорода на стороне реагента, имея 7 молекул кислорода:
2 C 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O
Для проверки пересчитайте все, чтобы определить, что каждая сторона имеет одинаковое количество атомов каждого элемента.
 Это химическое уравнение теперь сбалансировано.
Это химическое уравнение теперь сбалансировано.
Проверьте себя
Напишите и уравновесите химическое уравнение, которое представляет реакцию азота и водорода с образованием аммиака, NH 3 .
Ответ
N 2 + 3 H 2 → 2 NH 3
Многие химические уравнения также включают метки фаз для веществ: (s) для твердого вещества, (ℓ) для жидкости, (g) для газа и (aq) для водного (т. Е., растворенный в воде). Над стрелкой также могут быть указаны особые условия, например температура. Например,
2 NaHCO 3 (с) → 200 ° C Na 2 CO 3 (с) + CO 2 (г) + H 2 O (ℓ)
Ключевые выводы
- Химическое уравнение — это краткое описание химической реакции.
- Правильные химические уравнения сбалансированы.
Упражнения
Из утверждения «азот и водород реагируют с образованием аммиака» укажите реагенты и продукты.

Из заявления «металлический натрий реагирует с водой с образованием гидроксида натрия и водорода» укажите реагенты и продукты.
Из заявления «гидроксид магния реагирует с азотной кислотой с образованием нитрата магния и воды» укажите реагенты и продукты.
Из утверждения «пропан реагирует с кислородом с образованием диоксида углерода и воды» укажите реагенты и продукты.
Напишите и уравновесите химическое уравнение, описанное в упражнении 1.
Напишите и уравновесите химическое уравнение, описанное в упражнении 2.
Напишите и уравновесите химическое уравнение, описанное в упражнении 3.
Напишите и уравновесите химическое уравнение, описанное в упражнении 4. Формула для пропана: C 3 H 8 .
Остаток: ___NaClO 3 → ___NaCl + ___O 2
Остаток: ___N 2 + ___H 2 → ___N 2 H 4
Остаток: ___Al + ___O 2 → ___Al 2 O 3
Остаток: ___C 2 H 4 + ___O 2 → ___CO 2 + ___H 2 O
Как бы вы написали сбалансированное химическое уравнение в упражнении 10, если бы все вещества были газами?
- Как бы вы написали сбалансированное химическое уравнение в упражнении 12, если бы все вещества, кроме воды, были газами, а сама вода была жидкостью?
Ответы
реактивов: азот и водород; продукт: аммиак
3.
реактивы: гидроксид магния и азотная кислота; продукция: нитрат магния и вода
5.
N 2 + 3 H 2 → 2 NH 3 7.
Mg (OH) 2 + 2 HNO 3 → Mg (NO 3 ) 2 + 2 H 2 O
9.
2 NaClO 3 → 2 NaCl + 3 O 2 11.
4Al + 3O 2 → 2Al 2 O 3 13.
N 2 (г) + 3 H 2 (г) → 2 NH 3 (г)
Как объединить химические уравнения
Химические уравнения определяют, как конкретные химические вещества взаимодействуют и реагируют друг с другом. Для простых реакций химическое уравнение представляет собой единый процесс, однако происходит множество сложных реакций, требующих объединения нескольких уравнений в окончательные уравнения, учитывающие все реагенты и продукты. Вы объединяете несколько реакций в одно уравнение, перечисляя все реагенты в левой части уравнения и все продукты в правой части уравнения.Упрощение общего уравнения устранит химические соединения, которые существуют по обе стороны уравнения, без изменений.
Вы объединяете несколько реакций в одно уравнение, перечисляя все реагенты в левой части уравнения и все продукты в правой части уравнения.Упрощение общего уравнения устранит химические соединения, которые существуют по обе стороны уравнения, без изменений.
Перечислите все уравнения, которые участвуют в общем процессе. Это множественные полуреакции для электрохимических или окислительно-восстановительных реакций, уравнения растворения, которые описывают процесс растворения твердого вещества в растворителе, реакцию осаждения и реакции замещения. Каждая из этих индивидуальных реакций описывает только часть процесса.
Сложите правую часть отдельных реакций вместе, чтобы сформировать общую сторону реагентов процесса, и сложите отдельные стороны продуктов реакций вместе, чтобы получить общую сторону продукта процесса. Например, предположим, что процесс включает превращение Fe2 + в Fe3 + и Cu2 + в Cu +. Эта окислительно-восстановительная реакция состоит из двух различных половинных реакций: Fe2 + -> Fe3 + + e- и Cu2 + + e- -> Cu +. Объедините уравнения, чтобы получить Fe2 + + Cu2 + + e- -> Fe3 + + Cu + + e-.
Объедините уравнения, чтобы получить Fe2 + + Cu2 + + e- -> Fe3 + + Cu + + e-.
Исключите виды, которые существуют по обе стороны уравнения, без изменений. В случае примера один электрон существует с обеих сторон, поэтому они компенсируют друг друга. Это оставляет уравнение как Fe2 + + Cu2 + -> Fe3 + + Cu +.
Уравновесите общее уравнение массы и заряда. Продолжая пример, предположим, что реакция протекает полностью: Fe2O3 + Al -> Al2O3 + Fe. Вам не нужно балансировать заряд в этом уравнении, но необходимо уравновесить его по массе. Должно быть два атома алюминия с обеих сторон уравнения и два атома железа с обеих сторон, чтобы масса до и после реакции уравновешивалась.Окончательное вычисленное уравнение: Fe2O3 + 2 Al -> 2 Fe + Al2O3.
Пошаговые решения для химии: химические реакции — блог Wolfram
Если вы изучаете химию или изучаете дисциплину, требующую обязательных курсов по химии, то вы знаете, насколько дорогими могут быть необходимые учебники. Чтобы бороться с этим, сообщество химического образования разработало открытые образовательные ресурсы, чтобы предоставить бесплатные учебники химии. Однако, хотя бесплатные учебники хранят деньги в вашем кошельке, в них нет руководств по решению всех домашних задач.
Чтобы бороться с этим, сообщество химического образования разработало открытые образовательные ресурсы, чтобы предоставить бесплатные учебники химии. Однако, хотя бесплатные учебники хранят деньги в вашем кошельке, в них нет руководств по решению всех домашних задач.
К счастью, функция «Пошаговые решения» в Wolfram | Alpha вас поддержала! Независимо от того, учитесь ли вы удаленно или сотрудничаете с помощью видеоконференцсвязи, Wolfram | Alpha поможет вам изучить и применить фреймворки для решения проблем с химическими текстами. Пошаговые решения содержат пошаговые руководства по решениям, которые можно просматривать по очереди или все сразу. Руководства не только оттачивают эффективное решение проблем, но и способствуют более глубокому изучению концепций, которые все еще могут быть неясными.
В течение следующих нескольких недель мы будем изучать некоторые из популярных тем, с которыми учащиеся средних и старших классов и колледжей сталкиваются на своих курсах химии и выпускных экзаменах: химические реакции, структура и связывание, химические растворы и, наконец, квантовая химия. Прочтите, например, о проблемах химических реакций и их пошаговых решениях!
Прочтите, например, о проблемах химических реакций и их пошаговых решениях!
Уравновешивание химических уравнений
Фундаментальный аспект химии — уравновешивание химических уравнений. Если химические уравнения — это язык, на котором выражаются химические процессы, то уравновешивающие химические уравнения — это соответствующая грамматика.Пошаговое решение проведет вас через надежный алгебраический подход к определению стехиометрических коэффициентов.
Пример задачи
Напишите сбалансированное уравнение реакции меди с азотной кислотой с образованием нитрата меди, оксида азота и воды.
Пошаговое решение
Для этого класса задач просто введите «баланс медь + азотная кислота -> нитрат меди + диоксид азота + вода».
Масса
После уравновешивания соответствующих химических уравнений следующим шагом в планировании лабораторного эксперимента будет вычисление количества каждого реагента, которое необходимо отмерить. Для этого нужна молярная масса каждого реагента. Доступны пошаговые решения для молекулярной массы и относительной молекулярной массы в дополнение к молярной массе. Во всех случаях общая структура для решения этих типов проблем предоставляется на этапе «Планирование». Предоставляется подробная информация о том, какую формулу использовать и как собрать необходимую информацию.
Для этого нужна молярная масса каждого реагента. Доступны пошаговые решения для молекулярной массы и относительной молекулярной массы в дополнение к молярной массе. Во всех случаях общая структура для решения этих типов проблем предоставляется на этапе «Планирование». Предоставляется подробная информация о том, какую формулу использовать и как собрать необходимую информацию.
Пример задачи
Рассчитайте молярную массу сульфата серебра Ag 2 SO 4 .
Пошаговое решение
В этом случае просто введите «молярная масса сульфата серебра».
Массовый состав
Один из способов анализа отдельных химических веществ — вычисление и сравнение массовых и атомных процентов. Пошаговое решение обеспечивает общую основу для решения этого класса проблем на этапе «Планирование». Приведены подробные сведения о соответствующих уравнениях, а также о том, как вычислить необходимые промежуточные значения. Способы, которыми вы можете проверить свою работу во время расчетов, также доступны с помощью кнопок «Показать промежуточные шаги».
Пример задачи
Антигемофильный фактор — коагулянт с формулой C 11794 H 18314 N 3220 O 355 S 83 .Каков его процентный состав?
Пошаговое решение
Для ответа просто введите «элементный состав антигемофильного фактора».
Химическая конверсия
Химические превращения возникают почти в каждом домашнем задании по химии или в исследовательской задаче. Таким образом, доступны пошаговые решения для преобразования между молями, массой, объемом, молекулами и атомами. Предоставляется преобразование единиц измерения и подробный анализ размеров.
Пример задачи
Сколько атомов в пяти миллилитрах единицы.5 мМ раствор гидроксида магния?
Пошаговое решение
Чтобы решить эту проблему, просто введите «преобразовать 5 мл 1,5 мМ гидроксида магния в атомы».
Стехиометрия
После проведения химической реакции часто хочется узнать, как протекала реакция, вычисляя выходы реакции. Доступны пошаговые решения для расчета количества необходимых реагентов и теоретического выхода в дополнение к процентному выходу. Подробно объясняется использование стехиометрических факторов для получения желаемых значений.
Доступны пошаговые решения для расчета количества необходимых реагентов и теоретического выхода в дополнение к процентному выходу. Подробно объясняется использование стехиометрических факторов для получения желаемых значений.
Пример задачи
При взаимодействии 1,274 грамма сульфата меди с избытком металлического цинка было получено 0,392 грамма металлической меди в соответствии со следующим уравнением: CuSO 4 (водн.) + Zn (s) & xrarr; Cu (s) + ZnSO 4 (водн.). Какой процент доходности?
Пошаговое решение
Чтобы найти процентный выход, просто добавьте значения массы к соответствующим химическим соединениям и запросите стехиометрию: «1,274 г CuSO4 + Zn -> 0,392 г Cu + ZnSO4, стехиометрия».
Задачи вызова
Проверьте свои навыки решения проблем с химическими реакциями, используя описанные инструменты Wolfram | Alpha для решения этих текстовых задач. Ответы будут предоставлены в следующем сообщении в блоге этой серии.
- Вычислите молекулярную массу ацетаминофена. Является ли элемент с наибольшим числом атомов элементом с наибольшим массовым процентом?
- Каков предельный реагент и теоретический выход при 24,8 граммах белого фосфора и 0.200 молей кислорода реагируют с образованием 10,0 граммов пятиокиси фосфора?
И еще больше химии в будущем
Готовитесь ли вы к предстоящим выпускным экзаменам, решаете ли вы домашнее задание или просто хотите освежиться, химические реакции — одна из многих тем по химии, охватываемых базой знаний Wolfram | Alpha. На следующей неделе мы рассмотрим пошаговые инструкции для химических растворов, затем структуру и связывание, а затем квантовую химию. Если у вас есть предложения по другому пошаговому содержанию (по химии или другим предметам), сообщите нам об этом! Вы можете связаться с нами, оставив комментарий ниже или отправив отзыв внизу любой страницы запроса Wolfram | Alpha.
химических уравнений — Концепция — Видео по химии от Brightstorm
Хорошо, давайте поговорим о химических уравнениях. Итак, в химической реакции, как узнать, имеет ли место процесс, как узнать, химическая это реакция или нет? Ну, самое главное, одна из основных идей, если это случилось или нет, — это не вернуть в исходное состояние. Это довольно хороший вопрос, который вы можете задать себе, например, если что-то случится, могу ли я вернуться туда, где я был изначально, чтобы увидеть, действительно ли это была химическая реакция.Есть 4 основных показателя того, что химическая реакция действительно имела место. Пузырьки — одна из них, поэтому когда вы складываете две вещи вместе, и начинают появляться пузырьки, это означает образование газа, так что эти пузырьки на самом деле являются газом. Итак, когда у вас есть пузырьки, вы фактически формируете новые частицы газа.
Итак, в химической реакции, как узнать, имеет ли место процесс, как узнать, химическая это реакция или нет? Ну, самое главное, одна из основных идей, если это случилось или нет, — это не вернуть в исходное состояние. Это довольно хороший вопрос, который вы можете задать себе, например, если что-то случится, могу ли я вернуться туда, где я был изначально, чтобы увидеть, действительно ли это была химическая реакция.Есть 4 основных показателя того, что химическая реакция действительно имела место. Пузырьки — одна из них, поэтому когда вы складываете две вещи вместе, и начинают появляться пузырьки, это означает образование газа, так что эти пузырьки на самом деле являются газом. Итак, когда у вас есть пузырьки, вы фактически формируете новые частицы газа.
Другое дело изменение цвета. Если вы подумаете, допустим, осенью листья меняют цвет, это настоящая химическая реакция, которая имеет место. Итак, что-то, что меняет цвет, вы соединяете две вещи, и оно превращается из розового в синий, это хороший индикатор того, что что-то произошло, там есть химическое изменение. Еще одна проблема — это выделение энергии, которая может быть в форме света или тепла. Любая из этих вещей, например, когда вы сжигаете что-то, что хорошо показывает, что произошла химическая реакция, это действительно может быть какая-то энергия, неважно, термическая ли она, не имеет значения кинетическая одна из этих вещей тип энергии, которую вы собираетесь высвободить, определенно является хорошим индикатором. Также об образовании осадка сейчас вы, вероятно, не слышали. Осадок — это когда у вас есть две жидкости, вы соединяете их вместе и получаете твердую массу, твердый материал, который выходит из нее.Так что это может выглядеть как маленькие хлопья твердого вещества, это осадок. Вы могли бы провести лабораторное занятие, чтобы образовались осадки.
Еще одна проблема — это выделение энергии, которая может быть в форме света или тепла. Любая из этих вещей, например, когда вы сжигаете что-то, что хорошо показывает, что произошла химическая реакция, это действительно может быть какая-то энергия, неважно, термическая ли она, не имеет значения кинетическая одна из этих вещей тип энергии, которую вы собираетесь высвободить, определенно является хорошим индикатором. Также об образовании осадка сейчас вы, вероятно, не слышали. Осадок — это когда у вас есть две жидкости, вы соединяете их вместе и получаете твердую массу, твердый материал, который выходит из нее.Так что это может выглядеть как маленькие хлопья твердого вещества, это осадок. Вы могли бы провести лабораторное занятие, чтобы образовались осадки.
Это на самом деле просто создание, это может выглядеть как просто изменение цвета, но на самом деле они похожи на твердое вещество в растворе или водном растворе, поэтому, чтобы указать, что произошла химическая реакция, вы собираетесь написать это что-то похожее на это, очевидно, это упрощенная форма, которую вы собираетесь иметь. В самом начале у вас будет то, что у вас будет, называется реагентами.Это ребята, которые собираются вместе отреагировать. И затем мы скажем стрелку, которая указывает, хорошо, они собираются перейти от реагентов к чему-то еще. Они собираются изменить форму и на самом деле сказать, что вы собираетесь использовать слово yield. Как реагенты производят продукты, это новый для вас химический термин.
В самом начале у вас будет то, что у вас будет, называется реагентами.Это ребята, которые собираются вместе отреагировать. И затем мы скажем стрелку, которая указывает, хорошо, они собираются перейти от реагентов к чему-то еще. Они собираются изменить форму и на самом деле сказать, что вы собираетесь использовать слово yield. Как реагенты производят продукты, это новый для вас химический термин.
И продукты в конце — это молекулы, которые у вас получатся. Хорошо, давайте сделаем что-нибудь вместе, хорошо, здесь у нас есть письменная реакция rxn — это моя короткая стрелка для реакции, поэтому у нас есть твердый цинк, так как мы это записать? Мы собираемся сказать, что просто напишите элемент цинк, и я должен был указать это как твердое тело, потому что это важно.Итак, рядом с ним я заключу скобки и s, чтобы указать, что это твердое [состояние вещества] и водный сероводород, поэтому, поскольку я складываю их вместе, я помещаю небольшой знак добавления, который показывает, что эти 2 собираются вместе. Водный, это важно, мы вернемся к этому через секунду. Сульфат водорода хорошо, так что сульфат, который мы знаем, — это сера минус 2 водорода, это водород плюс, мы собираемся распилить, это плюс 1, так что это будет h3SO4, нам нужно 2 атома водорода и 1 сульфат.Мы должны убедиться, что мы показали, что это водный раствор, что означает, что он находится в растворе, так что он находится в водном растворе, поэтому мы собираемся добавить немного воды, чтобы сказать, что раствор этого материала реагирует, чтобы увидеть, как эти вещи собираюсь отреагировать. Я собираюсь использовать свою стрелу, чтобы произвести что-то новое, газообразный водород, и, как водород — это одна из наших диатомовых водорослей, не забывайте, что наша двухатомная разновидность [посыпьте половину] Я знаю, что вы слышали о [посыпьте половину], но бром не может существовать отдельно, хлор не может существовать отдельно, йод не может существовать отдельно, водород, кислород и фтор.
Водный, это важно, мы вернемся к этому через секунду. Сульфат водорода хорошо, так что сульфат, который мы знаем, — это сера минус 2 водорода, это водород плюс, мы собираемся распилить, это плюс 1, так что это будет h3SO4, нам нужно 2 атома водорода и 1 сульфат.Мы должны убедиться, что мы показали, что это водный раствор, что означает, что он находится в растворе, так что он находится в водном растворе, поэтому мы собираемся добавить немного воды, чтобы сказать, что раствор этого материала реагирует, чтобы увидеть, как эти вещи собираюсь отреагировать. Я собираюсь использовать свою стрелу, чтобы произвести что-то новое, газообразный водород, и, как водород — это одна из наших диатомовых водорослей, не забывайте, что наша двухатомная разновидность [посыпьте половину] Я знаю, что вы слышали о [посыпьте половину], но бром не может существовать отдельно, хлор не может существовать отдельно, йод не может существовать отдельно, водород, кислород и фтор.
Эти элементы вы никогда не увидите сами по себе, когда-либо, когда бы вы ни увидели газообразный водород, например, у вас будет, это будет h3, хорошо, и это газ, поэтому мы собираемся указать, что в нижнем регистре g и водном сульфате цинка, цинк — плюс 2, сульфат — минус 2. Итак, мы скажем, что сульфат цинка хорошо, и это водный раствор, поэтому мы должны указать это также, имея в виду, что он находится в растворе. так что мы собираемся поставить небольшой вод. Таким образом, мы должны убедиться, что мы поместили наше состояние материи: твердое тело — s, жидкость — это газ, очевидно, — это газ, и если он находится в растворе, я знаю, что это тот вопрос, к которому мы привыкли, мы должны убедиться, что у нас есть, если он в растворе он называется водным, и мы будем говорить водн.Это то, что мы собираемся назвать скелетным уравнением, мы должны пойти дальше, чтобы сбалансировать это, и мы еще не совсем закончили с этим, но это то, как вы начинаете, чтобы преобразовать письменное решение извините письменную реакцию в реальную скелетное уравнение.
Итак, мы скажем, что сульфат цинка хорошо, и это водный раствор, поэтому мы должны указать это также, имея в виду, что он находится в растворе. так что мы собираемся поставить небольшой вод. Таким образом, мы должны убедиться, что мы поместили наше состояние материи: твердое тело — s, жидкость — это газ, очевидно, — это газ, и если он находится в растворе, я знаю, что это тот вопрос, к которому мы привыкли, мы должны убедиться, что у нас есть, если он в растворе он называется водным, и мы будем говорить водн.Это то, что мы собираемся назвать скелетным уравнением, мы должны пойти дальше, чтобы сбалансировать это, и мы еще не совсем закончили с этим, но это то, как вы начинаете, чтобы преобразовать письменное решение извините письменную реакцию в реальную скелетное уравнение.
линейной алгебры — сбалансировать химические уравнения без проб и ошибок?
Один из методов, который мне особенно нравится, — это уравновешивание половинных реакций протекающей окислительно-восстановительной реакции (окислительно-восстановительной). В следующей реакции:
В следующей реакции:
$$ \ mathrm {Al} + \ mathrm {O_2} \ rightarrow \ mathrm {Al_2 O_3} $$
должно быть ясно, что Al окисляется, а O восстанавливается.{-2}}) $$
Теперь переведите наши коэффициенты обратно в исходное уравнение, и баланс готов:
$$ 4 \ mathrm {Al} + 3 \ mathrm {O_2} \ rightarrow 2 \ mathrm {Al_2 O_3} $$
Да, хотя этот процесс действительно кажется очень долгим, он применим к более сложным окислительно-восстановительным реакциям. Сюда входят реакции, в которых частицы, участвующие в окислительно-восстановительной реакции, не единственные, требующие уравновешивания, и даже реакции, в которых сразу несколько видов окисляются / восстанавливаются.Это довольно просто, как только вы освоитесь, и я надеюсь, что этот сократит время, которое вы тратите на балансировку уравнений в долгосрочной перспективе.
Балансировка химических уравнений — Химия для старших классов
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
то
информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
6.1 Написание и балансировка химических уравнений — CHEM 1114 — Введение в химию
Упражнения
1. Что значит сказать, что уравнение сбалансировано? Почему важно, чтобы уравнение было сбалансированным?
2. Сбалансируйте следующие уравнения:
Сбалансируйте следующие уравнения:
a) [латекс] \ text {PCl} _5 (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {POCl} _3 (l) + \ text {HCl} (aq) [/ латекс]
b) [латекс] \ text {Cu} (s) + \ text {HNO} _3 (aq) \ longrightarrow \ text {Cu (NO} _3) _2 (aq) + \ text {H} _2 \ text {O } (l) + \ text {NO} (g) [/ latex]
c) [латекс] \ text {H} _2 (g) + \ text {I} _2 (s) \ longrightarrow \ text {HI} (s) [/ latex]
d) [латекс] \ text {Fe} (s) + \ text {O} _2 (g) \ longrightarrow \ text {Fe} _2 \ text {O} _3 (s) [/ latex]
e) [латекс] \ text {Na} (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {NaOH} (aq) + \ text {H} _2 (g) [ / латекс]
f) [латекс] \ text {(NH} _4) _2 \ text {Cr} _2 \ text {O} _7 (s) \ longrightarrow \ text {Cr} _2 \ text {O} _3 (s) + \ text {N} _2 (g) + \ text {H} _2 \ text {O} (g) [/ latex]
г) [латекс] \ text {P} _4 (s) + \ text {Cl} _2 (g) \ longrightarrow \ text {PCl} _3 (l) [/ latex]
h) [латекс] \ text {PtCl} _4 (s) \ longrightarrow \ text {Pt} (s) + \ text {Cl} _2 (g) [/ latex]
3. Сбалансируйте следующие уравнения:
Сбалансируйте следующие уравнения:
a) [латекс] \ text {Ag} (s) + \ text {H} _2 \ text {S} (g) + \ text {O} _2 (g) \ longrightarrow \ text {Ag} _2 \ text { S} (s) + \ text {H} _2 \ text {O} (l) [/ latex]
b) [латекс] \ text {P} _4 (s) + \ text {O} _2 (g) \ longrightarrow \ text {P} _4 \ text {O} _ {10} (s) [/ latex]
c) [латекс] \ text {Pb} (s) + \ text {H} _2 \ text {O} (l) + \ text {O} _2 (g) \ longrightarrow \ text {Pb (OH)} _ 2 (s) [/ латекс]
d) [латекс] \ text {Fe} (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {Fe} _3 \ text {O} _4 (s) + \ text { H} _2 (г) [/ латекс]
e) [латекс] \ text {Sc} _2 \ text {O} _3 (s) + \ text {SO} _3 (l) \ longrightarrow \ text {Sc} _2 \ text {(SO} _4) _3 (s ) [/ латекс]
f) [латекс] \ text {Ca} _3 \ text {(PO} _4) _2 (aq) + \ text {H} _3 \ text {PO} _4 (aq) \ longrightarrow \ text {Ca (H} _2 \ text {PO} _4) _2 (aq) [/ latex]
г) [латекс] \ text {Al} (s) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {Al} _2 \ text {(SO} _4) _3 (s) + \ text {H} _2 (g) [/ латекс]
ч) [латекс] \ text {TiCl} _4 (s) + \ text {H} _2 \ text {O} (g) \ longrightarrow \ text {TiO} _2 (s) + \ text {HCl} (g) [/ латекс]
4. Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.
Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.
a) Твердый карбонат кальция нагревается и разлагается на твердый оксид кальция и газообразный диоксид углерода.
b) Газообразный бутан, C 4 H 10 , реагирует с газообразным двухатомным кислородом с образованием газообразного диоксида углерода и водяного пара.
c) Реакция взаимодействия водных растворов хлорида магния и гидроксида натрия с образованием твердого гидроксида магния и водного хлорида натрия.
d) Водяной пар реагирует с металлическим натрием с образованием твердого гидроксида натрия и газообразного водорода.
5. Красочный фейерверк часто связан с разложением нитрата бария и хлората калия и реакцией металлов магния, алюминия и железа с кислородом.
а) Напишите формулы нитрата бария и хлората калия.
b) Разложение твердого хлората калия приводит к образованию твердого хлорида калия и газообразного двухатомного кислорода.Напишите уравнение реакции.
c) Разложение твердого нитрата бария приводит к образованию твердого оксида бария, газообразного двухатомного азота и газообразного двухатомного кислорода. Напишите уравнение реакции.
d) Напишите отдельные уравнения реакций твердых металлов магния, алюминия и железа с газообразным двухатомным кислородом с образованием соответствующих оксидов металлов. (Предположим, что оксид железа содержит ионы Fe 3+ .)
6. Заполните пробел единственной химической формулой ковалентного соединения, которая уравновесит уравнение:
7.Водный фтороводород (плавиковая кислота) используется для травления стекла и анализа минералов на содержание кремния. Фтороводород также вступает в реакцию с песком (диоксид кремния).
a) Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.
б) Минеральный флюорит (фторид кальция) широко встречается в Иллинойсе. Твердый фторид кальция можно также получить реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта.Напишите полные и чистые ионные уравнения для этой реакции.
8. Из сбалансированных молекулярных уравнений напишите полные ионные и чистые ионные уравнения для следующего:
a) [латекс] \ text {K} _2 \ text {C} _2 \ text {O} _4 (aq) + \ text {Ba (OH)} _ 2 (aq) \ longrightarrow 2 \ text {KOH} (aq ) + \ text {BaC} _2 \ text {O} _2 (s) [/ latex]
b) [латекс] {\ text {Pb (NO} _3)} _ 2 (aq) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {PbSO} _4 (s) + 2 \ text {HNO} _3 (aq) [/ latex]
c) [латекс] \ text {CaCO} _3 (s) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {CaSO} _4 (s) + \ text {CO} _2 ( g) + \ text {H} _2 \ text {O} (l) [/ latex]
9.Из утверждения «газообразный азот и газообразный водород реагируют с образованием газообразного аммиака» определите реагенты и продукты.
10. Из утверждения «раствор гидроксида магния вступает в реакцию с раствором азотной кислоты с образованием раствора нитрата магния и воды» определите реагенты и продукты.
11. Напишите и уравновесите химическое уравнение, описанное в упражнении 1.
12. Напишите и уравновесите химическое уравнение, описанное в упражнении 2.
13.Баланс: ___NaClO 3 [латекс] \ longrightarrow [/ латекс] ___NaCl + ___O 2
14. Остаток: ___N 2 + ___H 2 [латекс] \ longrightarrow [/ латекс] ___N 2 H 4
15. Остаток: ___Al + ___O 2 [латекс] \ longrightarrow [/ латекс] ___Al 2 O 3
16. Баланс: ___C 2 H 4 + ___O 2 [латекс] \ longrightarrow [/ латекс] ___CO 2 + ___H 2 O
17.Остаток: ___N 2 (г) + ___H 2 (г) [латекс] \ longrightarrow [/ латекс] ___NH 3 (г)
18. Напишите химическое уравнение, которое описывает диссоциацию NaBr в воде.
19. Напишите химическое уравнение, которое представляет собой диссоциацию (NH 4 ) 3 PO 4 (s) в воде.
20. Напишите полное ионное уравнение реакции FeCl 2 (водн.) И AgNO 3 (водн.).Возможно, вам придется ознакомиться с правилами растворимости.
21. Напишите полное ионное уравнение реакции KCl (водн.) И NaC 2 H 3 O 2 (водн.). Возможно, вам придется ознакомиться с правилами растворимости.
22. Напишите чистое ионное уравнение реакции FeCl 2 (водн.) И AgNO 3 (водн.). Возможно, вам придется ознакомиться с правилами растворимости.
23. Напишите чистое ионное уравнение реакции KCl (водн.) И NaC 2 H 3 O 2 (водн.).Возможно, вам придется ознакомиться с правилами растворимости.
24. Определите ионы-зрители в упражнениях 20 и 21.
Ответы
1. Уравнение сбалансировано, если одинаковое количество каждого элемента представлено на сторонах реагента и продукта. Уравнения должны быть сбалансированы, чтобы точно отражать закон сохранения материи.
2. a) [латекс] \ text {PCl} _5 (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {POCl} _3 (l) + 2 \ text {HCl} (водный) [/ латекс]
b) [латекс] 3 \ text {Cu} (s) + 8 \ text {HNO} _3 (aq) \ longrightarrow 3 \ text {Cu (NO} _3) _2 (aq) + 4 \ text {H} _2 \ text {O} (l) + 2 \ text {NO} (g) [/ latex]
c) [латекс] \ text {H} _2 (g) + \ text {I} _2 (s) \ longrightarrow 2 \ text {HI} (s) [/ latex]
d) [латекс] 4 \ text {Fe} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Fe} _2 \ text {O} _3 (s) [/ latex]
e) [латекс] 2 \ text {Na} (s) + 2 \ text {H} _2 \ text {O} (l) \ longrightarrow 2 \ text {NaOH} (aq) + \ text {H} _2 ( г) [/ латекс]
f) [латекс] \ text {(NH} _4) _2 \ text {Cr} _2 \ text {2O} _7 (s) \ longrightarrow \ text {Cr} _2 \ text {O} _3 (s) + \ text {N} _2 (g) + 4 \ text {H} _2 \ text {O} (l) [/ latex]
г) [латекс] \ text {P} _4 (s) + 6 \ text {Cl} _2 (g) \ longrightarrow 4 \ text {PCl} _3 (l) [/ latex]
h) [латекс] \ text {PtCl} _4 (s) \ longrightarrow \ text {Pt} (s) + 2 \ text {Cl} _2 (g) [/ latex]
3.а) [латекс] 4 \ text {Ag} (s) + 2 \ text {H} _2 \ text {S} (g) + \ text {O} _2 (g) \ longrightarrow 2 \ text {Ag} _2 \ текст {S} (s) + 2 \ text {H} _2 \ text {O} (l) [/ latex]
b) [латекс] \ text {P} _4 (s) + 5 \ text {O} _2 (g) \ longrightarrow \ text {P} _4 \ text {O} _ {10} (s) [/ latex]
c) [латекс] 2 \ text {Pb} (s) + 2 \ text {H} _2 \ text {O} (l) + \ text {O} _2 (g) \ longrightarrow 2 \ text {Pb (OH )} _ 2 (s) [/ latex]
d) [латекс] 3 \ text {Fe} (s) + 4 \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {Fe} _3 \ text {O} _4 (s) + 4 \ text {H} _2 (g) [/ latex]
e) [латекс] \ text {Sc} _2 \ text {O} _3 (s) + 3 \ text {SO} _3 (l) \ longrightarrow \ text {Sc} _2 \ text {(SO} _4) _3 ( s) [/ латекс]
f) [латекс] \ text {Ca} _3 \ text {(PO} _4) _2 (aq) + 4 \ text {H} _3 \ text {PO} _4 (aq) \ longrightarrow 3 \ text {Ca (H } _2 \ text {PO} _4) _2 (водн.) [/ Латекс]
г) [латекс] 2 \ text {Al} (s) + 3 \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {Al} _2 \ text {(SO} _4) _3 ( s) + 3 \ text {H} _2 (g) [/ латекс]
ч) [латекс] \ text {TiCl} _4 (s) + 2 \ text {H} _2 \ text {O} (g) \ longrightarrow \ text {TiO} _2 (s) + 4 \ text {HCl} ( г) [/ латекс]
4.a) [латекс] \ text {CaCO} _3 (s) \ longrightarrow \ text {CaO} (s) + \ text {CO} _2 (g) [/ latex]
b) [латекс] 2 \ text {C} _4 \ text {H} _ {10} (g) + 13 \ text {O} _2 (g) \ longrightarrow 8 \ text {CO} _2 (g) + 10 \ text {H} _2 \ text {O} ( g) [/ latex]
c) [латекс] \ text {MgCl} _ {2} (aq) + 2 \ text {NaOH} (aq) \ longrightarrow \ text {Mg (OH)} _ 2 (s) + 2 \ text {NaCl} (aq) [/ latex]
d) [латекс] 2 \ text {H} _2 \ text {O} (g) + 2 \ text {Na} (s) \ longrightarrow 2 \ text {NaOH } (s) + \ text {H} _2 (g) [/ latex]
5. a) [латекс] \ text {Ba (NO} _3) _2 [/ latex], [latex] \ text {KClO} _3 [/ latex]
b) [латекс] 2 \ text {KClO} _3 ( s) \ longrightarrow 2 \ text {KCl} (s) + 3 \ text {O} _2 (g) [/ latex]
c) [латекс] 2 \ text {Ba (NO} _3) _2 (s) \ longrightarrow 2 \ text {BaO} (s) + 2 \ text {N} _2 (g) + 5 \ text {O} _2 (g) [/ latex]
d) [латекс] 2 \ text {Mg} (s) + \ text {O} _2 (g) \ longrightarrow 2 \ text {MgO} (s) [/ latex]; [латекс] 4 \ text {Al} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Al} _2 \ text {O} _3 (g) [/ latex]; [латекс] 4 \ text {Fe} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Fe} _2 \ text {O} _3 (s) [/ latex]
6.{2 -} (aq) \ longrightarrow \ text {CaSO} _4 (s) + \ text {CO} _2 (g) + \ text {H} _2 \ text {O} (l) [/ latex]
9. Реактивы: азот и водород; продукт: аммиак
10. Реактивы: гидроксид магния и азотная кислота; продукция: нитрат магния и вода
11. N 2 (г) + 3 H 2 (г) [латекс] \ longrightarrow [/ латекс] 2 NH 3 (г)
12. Mg (OH) 2 (водн.) + 2 HNO 3 (водн.) [латекс] \ longrightarrow [/ латекс] Mg (NO 3 ) 2 (водн.) + 2 H 2 O (ℓ)
13.2 NaClO 3 [латекс] \ longrightarrow [/ латекс] 2 NaCl + 3 O 2
14. N 2 + 2 H 2 [латекс] \ longrightarrow [/ латекс] N 2 H 4
15. 4Al + 3O 2 [латекс] \ longrightarrow [/ латекс] 2Al 2 O 3
16. C 2 H 4 + 3 O 2 [латекс] \ longrightarrow [/ латекс] 2 CO 2 + 2 H 2 O
17. N 2 (г) + 3 H 2 (г) [латекс] \ longrightarrow [/ латекс] 2 NH 3 (г)
18.NaBr (s) [латекс] \ longrightarrow [/ латекс] Na + (водн.) + Br — (водн.)
19. (NH 4 ) 3 PO 4 (s) [латекс] \ longrightarrow [/ latex] 3 NH 4 + (водн.) + PO 4 3- (водн. )
20. Fe 2+ (водн.) + 2 Cl — (водн.) + 2 Ag + (водн.) + 2 NO 3 — (водн.) [Латекс] \ longrightarrow [/ латекс] Fe 2+ (водн.) + 2 NO 3 — (водн.) + 2 AgCl (s)
21.K + (водн.) + Cl — (водн.) + Na + (водн.) + C 2 H 3 O 2 — (водн.) [Латекс] \ longrightarrow [/ латекс ] Na + (водн.) + Cl — (водн.) + K + (водн.) + C 2 H 3 O 2 — (водн.)
22. 2 Cl — (водн.) + 2 Ag + (водн.) [Латекс] \ longrightarrow [/ латекс] 2 AgCl (s)
23. Общей реакции нет.
24. В упражнении 20 Fe 2+ (водный) и NO 3 — (водный) — ионы-наблюдатели; в упражнении 21 Na + (водн.) и Cl — (водн.) — ионы-наблюдатели.
.


 В правой части – 3 атома серы и 12 атомов кислорода в соли. Два атома водорода содержится в молекуле газа. В левой части соотношение этих элементов составляет2:3:12
В правой части – 3 атома серы и 12 атомов кислорода в соли. Два атома водорода содержится в молекуле газа. В левой части соотношение этих элементов составляет2:3:12
 Мы можем получить это, имея три молекулы воды:
Мы можем получить это, имея три молекулы воды: Это химическое уравнение теперь сбалансировано.
Это химическое уравнение теперь сбалансировано.