Содержание
Химические уравнения тест (8 класс) по химии онлайн
Сложность: новичок.Последний раз тест пройден 5 часов назад.
Вопрос 1 из 10
Реакция, уравнение которой H2SO4 + CuS = CuSO4 + H2S является реакцией
- Правильный ответ
- Неправильный ответ
- Вы и еще 72% ответили правильно
- 72% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветить
Вопрос 2 из 10
Какое уравнение соответствует реакции замещения?
- Правильный ответ
- Неправильный ответ
- Вы и еще 75% ответили правильно
- 75% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 3 из 10
Реакция, уравнение которой P2O5 + 3H2O = 2H3PO4 является реакцией
- Правильный ответ
- Неправильный ответ
- Вы и еще 89% ответили правильно
- 89% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 4 из 10
Какое уравнение соответствует реакции обмена?
- Правильный ответ
- Неправильный ответ
- Вы и еще 88% ответили правильно
- 88% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 5 из 10
Реакция, уравнение которой 2H2S + O2=2S + 2H2O является реакцией
- Правильный ответ
- Неправильный ответ
- Вы и еще 69% ответили правильно
- 69% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 6 из 10
В соответствии с каким законом составляются уравнения химических реакций?
- Правильный ответ
- Неправильный ответ
- Вы и еще 67% ответили правильно
- 67% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 7 из 10
Взаимодействие серной кислоты и гидроксида алюминия: 3H2SO4 + 2Al(OH)3 = Al2(SO4)3+ 6H2O относится к реакции
- Правильный ответ
- Неправильный ответ
- Вы и еще 73% ответили правильно
- 73% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 8 из 10
Реакция, уравнение которой 2KClO3 = 2KCl + 3O2 является реакцией
- Правильный ответ
- Неправильный ответ
- Вы и еще 85% ответили правильно
- 85% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 9 из 10
Химическим уравнением называют:
- Правильный ответ
- Неправильный ответ
- Вы и еще 89% ответили правильно
- 89% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Вопрос 10 из 10
Реакция, уравнение которой 2HCl + Zn = ZnCl2 + H2 является реакцией
- Правильный ответ
- Неправильный ответ
- Вы и еще 68% ответили правильно
- 68% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Лука Успенский
9/10
Иван Иванов
10/10
Руслан Гарифуллин
9/10
Юлия Карасева
10/10
Матвей Шумилов
8/10
Кристина Авраам-Антокольская
10/10
Сергей Новиков
10/10
Саша Волков
8/10
Ридван Асанов
8/10
Алина Сайбель
10/10
ТОП-5 тестовкоторые проходят вместе с этим
Тесты «Химические уравнения» (8 класс) предназначены для подготовки учеников средней школы к занятиям по теме. Вопросы проверяют умение решать химические уравнения различной сложности, применяя знания о взаимодействии химических веществ. Представленные задания могут использовать ученики старших классов для повторения материала и подготовки к ЕГЭ по предмету. Решать задания можно онлайн. К тесту прилагаются правильные ответы, что позволяет сразу запоминать то, что «упущено».
Тест по химии «Уравнения реакций» – один из эффективных способов качественной подготовки к самостоятельным и контрольным работам, а также к текущим урокам.
Рейтинг теста
Средняя оценка: 3.9. Всего получено оценок: 3771.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Уравнивание окислительно-восстановительной реакции: онлайн калькулятор
Окислительно-восстановительные реакции — это процесс «перетекания» электронов от одних атомов к другим. В результате происходит окисление или восстановление химических элементов, входящих в состав реагентов.
Основные понятия
Ключевой термин при рассмотрении окислительно-восстановительных реакций — это степень окисления, которая представляет собой условный заряд атома и количество перераспределяемых электронов. Окисление — процесс потери электронов, при котором увеличивается заряд атома. Восстановление, наоборот, представляет собой процесс присоединения электронов, при котором степень окисления уменьшается. Соответственно, окислитель принимает новые электроны, а восстановитель — теряет их, при этом такие реакции всегда происходят одновременно.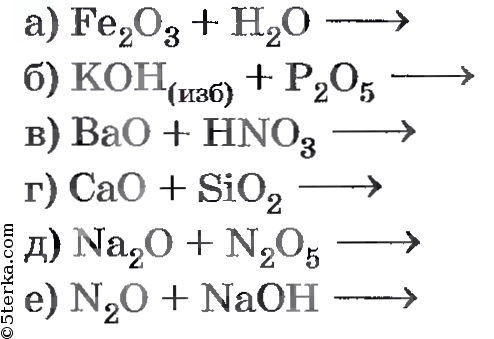
Определение степени окисления
Вычисление данного параметра — одна из самых популярных задач в школьном курсе химии. Поиск зарядов атомов может быть как элементарным вопросом, так и задачей, требующей скрупулезных расчетов: все зависит от сложности химической реакции и количества составляющих соединений. Хотелось бы, чтобы степени окисления указывались в периодической таблице и были всегда под рукой, однако этот параметр приходится либо запоминать, либо вычислять для конкретной реакции. Итак, существует два однозначных свойства:
- Сумма зарядов сложного соединения всегда равна нулю. Это значит, что часть атомов будет иметь положительную степень, а часть — отрицательную.
- Степень окисления элементарных соединений всегда равна нулю. Простыми называются соединения, которые состоят из атомов одного элемента, то есть железо Fe2, кислород O2 или октасера S8.
Существуют химические элементы, электрический заряд которых однозначен в любых соединениях. К таким относятся:
- -1 — F;
- -2 — О;
- +1 — H, Li, Ag, Na, K;
- +2 — Ba, Ca, Mg, Zn;
- +3 — Al.

Несмотря на однозначность, существуют некоторые исключения. Фтор F —уникальный элемент, степень окисления которого всегда составляет -1. Благодаря этому свойству многие элементы изменяют свой заряд в паре с фтором. Например, кислород в соединении с фтором имеет заряд +1 (O2F2) или +2 (ОF2). Кроме того, кислород меняет свою степень в перекисных соединениях (в перекиси водорода h302 заряд равен -1). И, естественно, кислород имеет нулевую степень в своем простом соединении O2.
При рассмотрении окислительно-восстановительных реакций важно учитывать вещества, которые состоят из ионов. Атомы ионных химических элементов имеют степень окисления, равную заряду иона. Например, в соединении гидрида натрия NaH по идее водород имеет степень +1, однако ион натрия также имеет заряд +1. Так как соединение должно быть электрически нейтральным, то атом водорода принимает заряд -1. Отдельно в этой ситуации стоят ионы металлов, так как атомы таких элементов ионизируются на разные величины. К примеру, железо F ионизируется и на +2, и на +3 в зависимости от состава химического вещества.
К примеру, железо F ионизируется и на +2, и на +3 в зависимости от состава химического вещества.
Пример определения степеней окисления
Для простых соединений, которые включают в себя атомы с однозначным зарядом, распределение степеней окисления не составляет труда. Например, для воды h3O атом кислорода имеет заряд -2, а атом водорода +1, что в сумме дает нейтральный нуль. В более сложных соединениях встречаются атомы, которые могут иметь разный заряд и для определения степеней окисления приходится использовать метод исключения. Рассмотрим пример.
Сульфат натрия Na2SO4 имеет в своем составе атом серы, заряд которого может принимать значения -2, +4 или +6. Какое значение выбрать? Первым делом определяем, что ион натрия имеет заряд +1. Кислород в подавляющем большинстве случаев имеет заряд –2. Составляем простое уравнение:
+1 × 2 + S + (–2) × 4 = 0
2 + S – 8 = 0
S = 8 − 2
S = 6
Таким образом, заряд серы в сульфате натрия равен +6.
Расстановка коэффициентов по схеме реакции
Теперь, когда вы знаете, как определять заряды атомов, вы можете расставлять коэффициенты в окислительно-восстановительных реакциях для их балансировки. Стандартное задание по химии: подобрать коэффициенты реакции при помощи метода электронного баланса. В этих заданиях вам нет нужды определять, какие вещества образуются на выходе реакции, так как результат уже известен. Например, определите пропорции в простой реакции:
Na + O2 → Na2O
Итак, определим заряд атомов. Так как натрий и кислород в левой части уравнения — простые вещества, то их заряд равен нулю. В оксиде натрия Na2O кислород имеет заряд -2, а натрий +1. Мы видим, что в левой части уравнения натрий имеет нулевой заряд, а в правой – положительный +1. То же самое с кислородом, который изменил степень окисления с нуля до -2. Запишем это «химическим» языком, указав в скобках заряды элементов:
Na(0) – 1e = Na(+1)
O(0) + 2e = O(–2)
Для балансировки реакции требуется уравновесить кислород и добавить коэффициент 2 к оксиду натрия. Получим реакцию:
Получим реакцию:
Na + O2 → 2Na2O
Теперь у нас дисбаланс по натрию, уравновесим его при помощи коэффициента 4:
4Na + O2 → 2Na2O
Теперь количество атомов элементов совпадают с обеих сторон уравнения, следовательно, реакция сбалансирована. Все это мы проделали вручную, и это было несложно, так как реакция сама по себе элементарна. Но что делать, если требуется сбалансировать реакцию вида K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + H2O + K2SO4? Ответ прост: используйте калькулятор.
Калькулятор балансирования окислительно-восстановительных реакций
Наша программа позволяет автоматически расставить коэффициенты для самых распространенных химических реакций. Для этого вам необходимо вписать в поле программы реакцию или выбрать ее из раскрывающегося списка. Для решения выше представленной окислительно-восстановительной реакции вам достаточно выбрать ее из списка и нажать на кнопку «Рассчитать». Калькулятор мгновенно выдаст результат:
Калькулятор мгновенно выдаст результат:
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 7H2O + 4K2SO4
Использование калькулятора поможет вам быстро сбалансировать наиболее сложные химические реакции.
Заключение
Умение балансировать реакции необходимо всем школьникам и студентам, которые мечтают связать свою жизнь с химией. В целом расчеты выполняются по строго определенным правилам, для понимания которых достаточно элементарных знаний по химии и алгебре: помнить, что сумма степеней окисления атомов соединения всегда равна нулю и уметь решать линейные уравнения.
Метод электронного баланса
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась — составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.

Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
Как это выглядит на практике, рассмотрено на примере задач по шагам.
Задача.
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + H2O
б) Ca +H2SO4 → CaSO4 + H2S + H2O
в) Be + HNO3 → Be(NO3)2 + NO + H2O
Решение.
Для решения данной задачи воспользуемся правилами определения степени окисления.
Применение метода электронного баланса по шагам. Пример «а»
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H2O.
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса — какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась — в данном расчете не участвуют)
Ag0 — 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента «3» для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Пример «б»
Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2S + H2O
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6
Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 — 2e = Ca+2 (коэффициент 4)
S+6 + 8e = S-2
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример «в»
Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. выше
выше
Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2
Be0 — 2e = Be+2 (коэффициент 3)
N+5 +3e = N+2 (коэффициент 2)
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
Полный список степеней окисления элементов |
Описание курса
| Тесты (2)
Химия в кармане: 10 мобильных приложений для детей и их родителей / Newtonew: новости сетевого образования
В современном мире человек всё больше времени проводит за смартфоном или планшетом. Однако это вовсе не означает, что использование гаджетов вредит уровню сегодняшнего образования и мешает увлечённости детей наукой. Мы предлагаем вам ознакомиться с десятью самыми интересными и практически применимыми приложениями, которые помогут полюбить химию, облегчат учебный процесс, а некоторые даже пригодятся профессионалам.
Однако это вовсе не означает, что использование гаджетов вредит уровню сегодняшнего образования и мешает увлечённости детей наукой. Мы предлагаем вам ознакомиться с десятью самыми интересными и практически применимыми приложениями, которые помогут полюбить химию, облегчат учебный процесс, а некоторые даже пригодятся профессионалам.
Инструментальный ящик (Android)
Очень удобный обучающий сервис для школьников и студентов. Включает в себя периодическую таблицу, в которой высвечивается полная информация о физических и электронных свойствах выбранного элемента. В бесплатной версии открыты таблица растворимости, физические константы, сведения о длинах волн в ЯМР, что особенно полезно для студентов профильных вузов. Кроме того, в Инструментальном ящике можно посмотреть различные характеристики растворителей, такие как вязкость, показатели преломления света и т.д. Из недостатков — в бесплатной версии приложение не пишет уравнения реакций и не производит расчётов, но диапазон данных и без того весьма велик.
Удобное приложение, ориентированное на российских школьников. Похоже, что его создатели действительно смогли предусмотреть всё, что требуется для учёбы в 8−11 классе. Химия Х10 включает в себя периодическую таблицу с краткими сведениями об элементе, конвертер, а также великолепно решает задачи. Как показывает практика, приложение приводит подробные решения всех задач основного курса школьной химии, не требуя написания текста — нужно просто ввести данные в специальных графах. Программа совмещает в себе множество теоретического и практически применимого материала с красивой графикой и понятным интерфейсом.
Химия для детей (Android)
Достойное приложение, позволяющее разнообразить семейный досуг и заинтересовать детей наукой. Ориентировано на ребят 8−10 лет. Обладает красочной трёхмерной графикой, которая просто не может не заинтересовать ребёнка. Состоит примерно из 25−30 химических опытов, установку для которых можно быстро и легко собрать с помощью подсказок. Также есть возможность посмотреть основные свойства химических веществ и процессов, таких как горение пламени и его цвет, способность к воспламенению, красивые взрывы и т. д. Предлагается описание реакций, но не даётся объяснения, почему они протекают именно так, в чём и заключается существенный минус этого приложения.
Также есть возможность посмотреть основные свойства химических веществ и процессов, таких как горение пламени и его цвет, способность к воспламенению, красивые взрывы и т. д. Предлагается описание реакций, но не даётся объяснения, почему они протекают именно так, в чём и заключается существенный минус этого приложения.
Сhemistry Allie (Android, iOS)
Химическая англоязычная викторина с красочной графикой. Любители химии смогут оттачивать свои знания в самых различных областях: определение атомного номера, названий элементов, формул основных классов соединений, нахождение коэффициента уравнения и т.д. Время ответа на каждый вопрос ограничено десятью секундами. Предлагается 5 вариантов ответа, после пятой ошибки приложение «вылетает». Вопросы по органике и неорганике поделены на 9 уровней с повышением сложности. Хорошее знание языка не требуется, хотя Chemistry Allie и на английском. Приложение очень достойно и всем заинтересованным рекомендуется.
Chemistry calculations (Android)
Американское образовательное приложение, ориентированное на студентов химических вузов. Для пользования достаточно базового уровня владения языком. Вместе с тем Chemistry calculations имеет огромный диапазон применения, что крайне необходимо среднестатистическому студенту. Использование такого приложения дарит отличную возможность быстро и правильно посчитать pH, молекулярный вес, вычислить любые параметры по уравнению идеального газа, провести расчёты по уравнению Нернста и т. п. Содержит конвертер, периодическую таблицу, таблицу физических констант. Великолепное приложение, которое рекомендуется к скачиванию всем заинтересованным студентам.
Для пользования достаточно базового уровня владения языком. Вместе с тем Chemistry calculations имеет огромный диапазон применения, что крайне необходимо среднестатистическому студенту. Использование такого приложения дарит отличную возможность быстро и правильно посчитать pH, молекулярный вес, вычислить любые параметры по уравнению идеального газа, провести расчёты по уравнению Нернста и т. п. Содержит конвертер, периодическую таблицу, таблицу физических констант. Великолепное приложение, которое рекомендуется к скачиванию всем заинтересованным студентам.
Chemistry Lab (iOS)
Исходя из увиденного, можно сказать, что данное приложение уверенно входит в тройку самых полезных и увлекательных онлайн-игр. Оно понравится всем без исключения и действительно поможет полюбить химию как науку. Chemistry Lab представляет собой онлайн-лабораторию с очень реалистичной графикой в стиле американской школы. Можно выбирать на свой вкус колбу или химический стакан, присутствует горелка. И, что самое потрясающее, приложение содержит ВСЕ реально существующие неорганические соли, гидроксиды, кислоты, простые вещества и оксиды. На экране реагенты находятся в прозрачных пробирках, а цвет и агрегатное состояние самих веществ соответствуют действительным. Все реакции также протекают очень красочно, при этом сопровождающие их процессы отражают реальную картину (например, взрыв, выпадение в осадок и т. д.). По завершении реакции высвечивается уравнение, показывающее, что же произошло. Приложение действительно учит химии, лучше некоторых школ. Единственный существенный минус — скачать его могут только обладатели гаджетов Apple.
На экране реагенты находятся в прозрачных пробирках, а цвет и агрегатное состояние самих веществ соответствуют действительным. Все реакции также протекают очень красочно, при этом сопровождающие их процессы отражают реальную картину (например, взрыв, выпадение в осадок и т. д.). По завершении реакции высвечивается уравнение, показывающее, что же произошло. Приложение действительно учит химии, лучше некоторых школ. Единственный существенный минус — скачать его могут только обладатели гаджетов Apple.
Сhemistry Quiz (Android)
К сожалению, мир химических обучающих сервисов весьма беден стоящими викторинами на русском языке, поэтому вот ещё одно англоязычное приложение. Надо сказать, что язык в нём весьма прост и вполне понятен для школьников 7−8 класса, ведь именно в этом возрасте начинается изучение химии в непрофильных школах. Вопросы викторины удобно разбиты на темы преимущественно из курса общей и неорганической химии. Chemistry Quiz будет интересен как детям, так и взрослым: вопросы разнообразны и нетривиальны, заставляют подумать и вспомнить некоторые детали из школьного и вузовского курса, а также позволяют узнать много новой информации.
Очень красиво оформленные карточки для запоминания на названия, символы, группу или картинку, связанную с элементом. Сначала предлагается вопрос, над которым можно подумать неограниченное количество времени и, нажав на экран, увидеть ответ. Запоминать, где расположен тот или иной элемент, удобно благодаря длиннопериодной таблице. Приложение английское, но это его не портит, так как языком пользоваться вообще не приходится. Существенным недостатком является то, что картинки на запоминание элемента не всегда бывают однозначными, и даже студенту профильного вуза будет сложно догадаться, о каком именно элементе идёт речь. Но, даже несмотря на это, Flash Cards — крайне достойное приложение с качественной HD-графикой.
Learning Science (iOS)
Невероятно красивое приложение с мультяшной качественной графикой для детей 3−6 лет. Подобранные специально для детей младшего возраста задания очень просты и эффектны. Например: собрать гальванический элемент, перетаскивая детали по экрану, после чего загорится лампочка. Такие «научные» эксперименты разработаны для изучения химии, физики и биологии, всего их около 20 для каждого предмета. Красиво и со вкусом, приятное развлечение для всей семьи.
Такие «научные» эксперименты разработаны для изучения химии, физики и биологии, всего их около 20 для каждого предмета. Красиво и со вкусом, приятное развлечение для всей семьи.
Одно из лучших существующих приложений по визуализации молекул, которое доступно пользователям как Android, так и iOS. Выгодно отличается от своих аналогов разнообразием представленных молекул, которые можно посмотреть на экране или с помощью очков виртуальной реальности. Молекулы представлены в разных видах: так, как они нарисованы в учебниках, и в форме масштабной модели. Также у пользователей есть возможность покрутить молекулу в разные стороны, что действительно очень наглядно и удобно.
16 февраля 2016, 12:00
Мнение автора может не совпадать с позицией редакции.
АВТОРСКАЯ КОЛОНКА
MEL Science
Хотите, чтобы ваш ребёнок занимался чем-то полезным и на всю жизнь получил фундаментальное представление об устройстве природы? А ведь вы можете узнать много нового вместе с детьми! Рассказываем о том, как войти в мир науки и по-настоящему полюбить его.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Метод полуреакций — Составление уравнений окислительно-восстановительных реакций — Окислительно-восстановительные реакции. Электролиз — Теоретические основы химии
9 января 2007
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н2S – 2е– = S + 2H+
Это первая полуреакция – процесс окисления восстановителя Н2S.
Обесцвечивание раствора связано с переходом иона MnO4– (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4– → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4– + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4– + 8Н+ + 5e–= Mn2+ + 4Н2О
Это вторая полуреакция – процесс восстановления окислителя, т.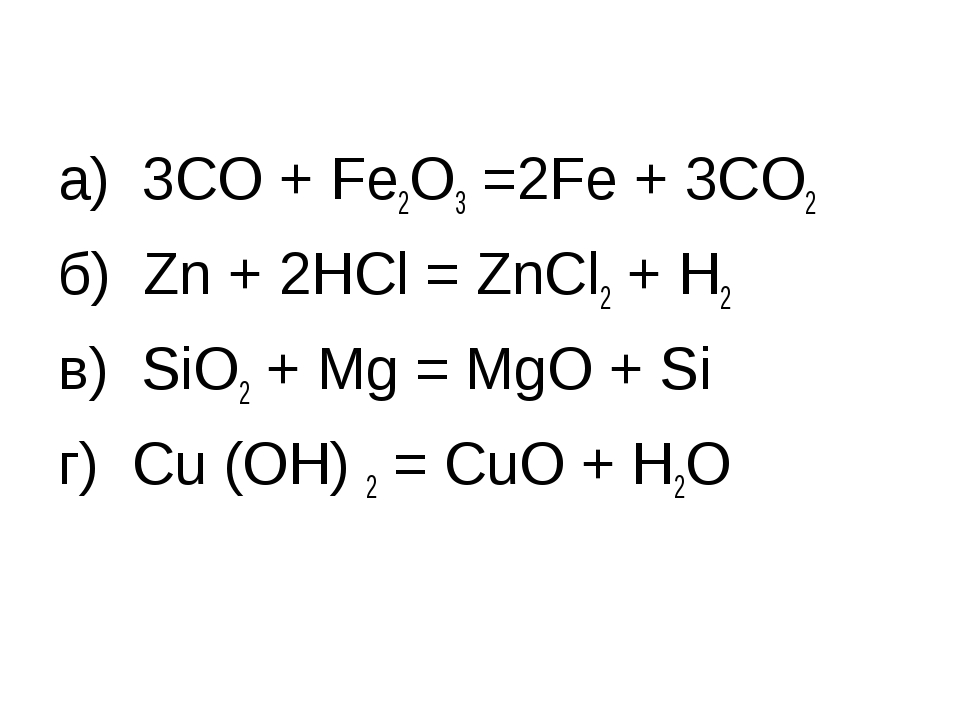 е. перманганат–иона
е. перманганат–иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4– + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону – анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
Таким образом, составление уравнений окислительно–восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов а есть ионы
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно–восстановительных реакций, протекающих в водных растворах.
Контрольная работа по химии 8 класс за 3 четверть
Вариант 1.
1. Расставьте коэффициенты, определите тип реакции:
а) H2 + N2 → NH3
б) HNO3 → NO2 + H2O + O2↑
в) Ba + H2O → Ba(OH)2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества и указать тип реакции
а) Na + O2 →
б) P2О5 + Н2О →
в) Al2O3 + HCl →
3. К 150 г раствора карбоната натрия добавляли раствор хлорида кальция до прекращения выделения осадка. Масса осадка составила 12,0 г. Вычислите массовую долю карбоната натрия в исходном растворе.
4. Напишите уравнения диссоциации следующих веществ: Na2CO3, AlCl3
5. Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде, укажите признак реакции:
гидроксид натрия + фосфорная кислота =
Вариант 2.
- Расставьте коэффициенты, определите тип реакции:
а) Mg + N2 → Mg3N2
б) C + Cr2 O3→ CO2 + Cr
в) HNO3 + CaO→ Ca(NO3)2 + H2O
- Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества и указать тип реакции
а) Al + O2 →
б) Mg(NO3)2 + NaOH →
в) Al2O3 + H2SO4 →
3. К 85 г раствора с массовой долей нитрата серебра 2% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
4. Напишите уравнения диссоциации следующих веществ: Ba(OH)2, H2SO4
5. Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде, укажите признак реакции:
Нитрат серебра + хлорид бария =
Вариант 3.
1. Расставьте коэффициенты, определите тип реакции:
а) HNO3 + CaCO3 → Ca (NO3)2+ H2O + CO2↑
б) CuO + Al → Al2O3 + Cu
в) KClO3 → KCl + O2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества и указать тип реакции
а) Al +S →
б) CаСO3 →
в) MnO2 + H2 →
3. Вычислите объём углекислого газа (н.у.), который выделится при действии на избыток карбоната кальция 730 г 20%-ного раствора соляной кислоты.
4. Напишите уравнения диссоциации следующих веществ: NaOH, K2CO3
5. Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде, укажите признак реакции:
Гидроксид калия + нитрат цинка =
Вариант 4.
1. Расставьте коэффициенты, определите тип реакции:
а) N2О3 + Н2О → НNО2
б) Li + Cl2 → LiCl
в) Cu(NO3) → CuO+O2↑+NO2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества и указать тип реакции
Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества и указать тип реакции
а) СО2 +CaO→
б) К + N2→
в) FeO + Al →
3. Через раствор нитрата меди(II) массой 37,6 г с массовой долей 5% пропустили избыток сероводорода. Вычислите массу осадка, образовавшегося в результате реакции.
4. Напишите уравнения диссоциации следующих веществ: Al(NO3)3, Li2SO4
5. Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде, укажите признак реакции:
Карбонат натрия + серная кислота =
Chemical Reactions | Protocol (Translated to Russian)
2.8: Химические реакции
Обзор
Химическая реакция – это процесс, с помощью которого связи в атомах веществ перестраиваются для генерации новых веществ. Материя не может быть создана или уничтожена в результате химической реакции – тот же тип и количество атомов, которые составляют реакционные средства, все еще присутствуют в продуктах. Просто перегруппировка химических связей производит новые соединения.
Материя не может быть создана или уничтожена в результате химической реакции – тот же тип и количество атомов, которые составляют реакционные средства, все еще присутствуют в продуктах. Просто перегруппировка химических связей производит новые соединения.
Химические реакции перегруппировывают атомы в новые вещества
Химическая реакция принимает стартовые материалы-реагенты- и изменяет их в различные вещества-продукты. Элементов одинаковы по обе стороны уравнения, но после реакции они попадают в другие соединения. В химических реакциях связи между атомами ломаются и реформируются, что означает, что общие электроны между атомами перестраиваются. Реакции могут быть спонтанными, или они могут происходить только в присутствии источника энергии, например, тепла или света. Кроме того, макромолекулы могут выступать в качестве ферментов-катализаторов, которые значительно ускоряют химические реакции. Большинство биологических реакций потребовали бы слишком много времени для завершения в отсутствии ферментов.
Химические реакции могут быть необратимыми или обратимыми
Некоторые типы реакций будут действовать необратимо, пока все реагирующие не будут использованы, в то время как другие обратимы, с продуктами, которые могут быть преобразованы обратно в реагенты, если условия меняются. Некоторые виды химических реакций, такие как реакции горения или реакции осадков, которые образуют твердый продукт из двух растворенных веществ, как правило, продолжаются только в одном направлении. Примером необратимой реакции является сжигание углеводородного топлива в присутствии атмосферного кислорода, который производит тепловую и световую энергию, углекислый газ и воду. Другие реакции происходят в любом направлении до тех пор, пока реагенты и продукты находятся в равновесии – точка, в которой нет явных изменений в реагентах или продуктах.
Закон сохранения материи и сбалансированные химические уравнения
При химической реакции материя не может быть создана или уничтожена — этот принцип известен как Закон сохранения материи. Тем не менее, продукты, которые формируются, часто содержат другие соотношения атомов по сравнению с реагентами. Сбалансированное химическое уравнение содержит все атомы по обе стороны уравнения, включая коэффициенты при продуктах и реагентах, такие, что общие количества каждого типа атома равны по обе стороны уравнения. Коэффициент применяется ко всем атомам соединения, подобно математическому коэффициенту, применимому ко всем переменным, содержащимся в скобках. Например, реакция образования (генерации) воды из водорода и кислорода (газов):
Тем не менее, продукты, которые формируются, часто содержат другие соотношения атомов по сравнению с реагентами. Сбалансированное химическое уравнение содержит все атомы по обе стороны уравнения, включая коэффициенты при продуктах и реагентах, такие, что общие количества каждого типа атома равны по обе стороны уравнения. Коэффициент применяется ко всем атомам соединения, подобно математическому коэффициенту, применимому ко всем переменным, содержащимся в скобках. Например, реакция образования (генерации) воды из водорода и кислорода (газов):
H2 + O2 → H2O
В этом несбалансированном уравнении с каждой стороны содержится по два атома водорода, но количества атомов кислорода неравны. Чтобы сбалансировать уравнение, коэффициенты добавляются так, что оказывается равное количество атомов водорода и кислорода с обеих сторон:
2H2 + O2 → 2H 2O
В сбалансированном уравнении в общей сложности присутствует четыре атома водорода и два атома кислорода на каждой стороне уравнения.
Химические реакции заставляют клетки функционировать
Два важных процесса, которые буквально поддерживают жизнь на Земле, — это фотосинтез, который преобразует солнечный свет в шестиуглеродную глюкозу, и клеточное дыхание, которое преобразует глюкозу в полезную энергию. Оба этих процесса, по своей сути, всего лишь пара дополнительных химических реакций. Фотосинтез использует энергию солнечного света для преобразования углекислого газа и воды в глюкозу и молекулярный кислород. Клеточное дыхание затем используется всеми аэробными организмами, чтобы расщепить глюкозу, независимо от того, создают ли они её, или потребляют — в присутствии кислорода для производства энергии для всех своих основных потребностей.
Как сбалансировать химические уравнения
Обзор
В химической реакции количество каждого элемента не меняется. Таким образом, каждая сторона уравнения должна представлять одно и то же количество любого конкретного элемента. В случае чистых ионных реакций одинаковый заряд должен присутствовать с обеих сторон несбалансированного уравнения. Изменяя скалярное число для каждой молекулярной формулы, можно сбалансировать уравнение.
В случае чистых ионных реакций одинаковый заряд должен присутствовать с обеих сторон несбалансированного уравнения. Изменяя скалярное число для каждой молекулярной формулы, можно сбалансировать уравнение.
Использование проб и ошибок / проверки
Пример # 1 (Простой)
Простые химические уравнения можно сбалансировать путем проверки, то есть методом проб и ошибок.Как правило, лучше сначала сбалансировать самую сложную молекулу. Водород и кислород обычно уравновешиваются последними.
- Na + O 2 = Na 2 O
Для того чтобы это уравнение было сбалансировано, в левой части должно быть такое же количество Na, что и в правой части. В нынешнем виде слева 1 Na, а справа 2 Na. Эта проблема решается путем установки 2 перед Na с левой стороны:
- 2Na + O 2 = Na 2 O
Здесь 2 атома Na слева и 2 атома Na справа.На следующем этапе атомы кислорода также уравновешиваются. В левой части находится 2 атома O, а в правой — только один. Это все еще несбалансированное уравнение. Чтобы исправить это, перед Na 2 O с правой стороны добавляется цифра 2. Теперь уравнение выглядит так:
В левой части находится 2 атома O, а в правой — только один. Это все еще несбалансированное уравнение. Чтобы исправить это, перед Na 2 O с правой стороны добавляется цифра 2. Теперь уравнение выглядит так:
.
- 2Na + O 2 = 2Na 2 O
Обратите внимание, что 2 в правой части «распределены» как для Na 2 , так и для О. В настоящее время левая часть уравнения содержит 2 атома Na и 2 атома O.В правой части всего 4 Na и 2 O. Опять же, это проблема, с обеих сторон должно быть равное количество каждого химического вещества. Чтобы исправить это, с левой стороны добавлены еще 2 Na. Уравнение теперь будет выглядеть так:
- 4Na + O 2 = 2Na 2 O
Это уравнение является сбалансированным, поскольку в левой и правой частях уравнения содержится равное количество атомов каждого элемента.
Пример № 2 (Комплексный)
- P 4 + O 2 = 2P 2 O 5
Это уравнение не сбалансировано, так как в обеих частях уравнения содержится неравное количество 0. В левой части 4 P, а в правой — 4 P. Итак, атомы P уравновешены. В левой части 2 «O», а в правой — 10 «O».
В левой части 4 P, а в правой — 4 P. Итак, атомы P уравновешены. В левой части 2 «O», а в правой — 10 «O».
Чтобы исправить это несбалансированное уравнение, 5 перед O 2 с левой стороны добавляется, чтобы получить 10 O с обеих сторон, в результате получается
- P 4 + 5O 2 = 2P 2 O 5
Уравнение теперь сбалансировано, поскольку в левой и правой частях уравнения равное количество веществ.
Пример № 3 (Комплексный)
- C 2 H 5 OH + O 2 = CO 2 + H 2 O
Это уравнение сложнее предыдущих примеров и требует большего количества шагов. Самая сложная молекула здесь — C 2 H 5 OH, поэтому балансировка начинается с размещения коэффициента 2 перед CO 2 , чтобы сбалансировать атомы углерода.
- C 2 H 5 OH + O 2 = 2CO 2 + H 2 O
Поскольку C 2 H 5 OH содержит 6 атомов водорода, атомы водорода можно уравновесить, поместив 3 перед H 2 O:
- C 2 H 5 OH + O 2 = 2CO 2 + 3H 2 O
Наконец, необходимо уравновесить атомы кислорода.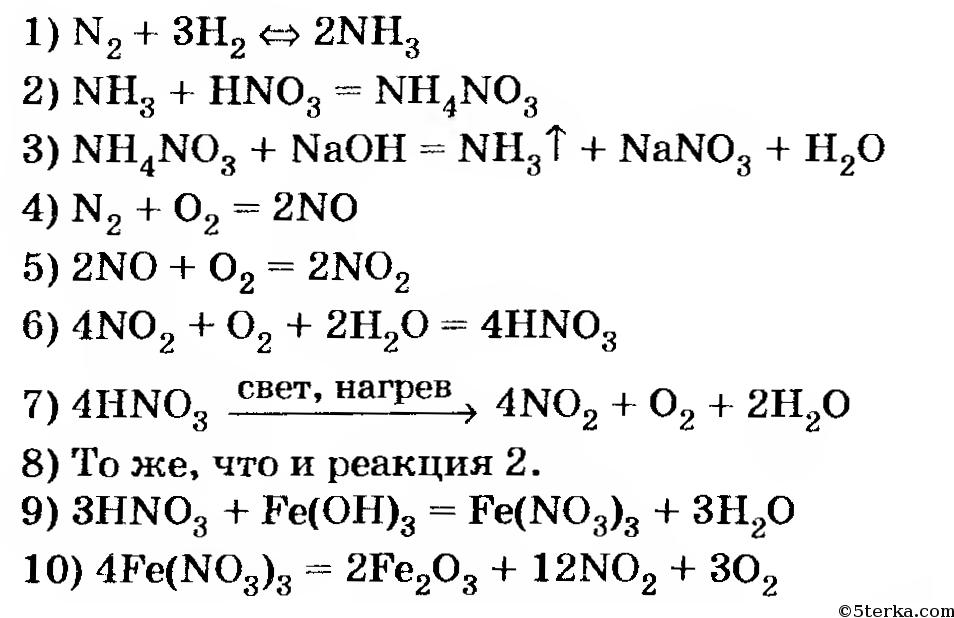 Поскольку 7 атомов кислорода справа и только 3 слева, перед O 2 ставится 3, чтобы получить сбалансированное уравнение:
Поскольку 7 атомов кислорода справа и только 3 слева, перед O 2 ставится 3, чтобы получить сбалансированное уравнение:
- C 2 H 5 OH + 3O 2 = 2CO 2 + 3H 2 O
Использование линейных систем
В реакциях с участием многих соединений уравнения могут быть сбалансированы с использованием алгебраического метода, основанного на решении системы линейных уравнений.
1. Назначьте переменные каждому коэффициенту.(Коэффициенты представляют как базовую единицу, так и молярные отношения в сбалансированных уравнениях.):
- a K 4 Fe (CN) 6 + b H 2 SO 4 + c H 2 O = d K 2 SO 4 + e FeSO 4 + f (NH 4 ) 2 SO 4 + г CO
2. На каждой стороне уравнения должно быть одинаковое количество каждого атома. Итак, для каждого элемента посчитайте его атомы и пусть обе стороны будут равны.
- К: 4a = 2d
- Fe: 1a = 1e
- С: а = 6 г
- N: a = 3f
- H: 2b + 2c = 8f
- S: b = d + e + f
- O: 4b + c = 4d + 4e + 4f + g
3. Решите систему (Прямая замена обычно является лучшим способом.)
- d = 2a
- e =
- г = 6а
- f = 3a
- b = 6a
- c = 6a
, что означает, что все коэффициенты зависят от параметра a, просто выберите a = 1 (число, которое сделает их все маленькими целыми числами), что дает:
- a = 1 b = 6 c = 6 d = 2 e = 1 f = 3 g = 6
4.И наконец сбалансированное уравнение:
- K 4 Fe (CN) 6 + 6 H 2 SO 4 + 6 H 2 O = 2 K 2 SO 4 + FeSO 4 + 3 (NH 4 ) 2 SO 4 + 6 CO
Чтобы ускорить процесс, можно объединить оба метода, чтобы получить более практичный алгоритм:
1. Определите элементы, которые входят в одно соединение в каждом элементе. (Это очень часто.)
Определите элементы, которые входят в одно соединение в каждом элементе. (Это очень часто.)
2. Начните с одного из тех, у которого есть большой индекс (это поможет продолжить работу с целыми числами), и назначьте переменную, например a.
- a K 4 Fe (CN) 6 + H 2 SO 4 + H 2 O = K 2 SO 4 + FeSO 4 + (NH 4 ) 2 СО 4 + СО
3. K 2 SO 4 должно быть 2a (из-за K), а также FeSO 4 должно быть 1a (из-за Fe), CO должно быть 6a (из-за C) и (NH 4 ) 2 SO 4 должно быть 3a (из-за N).Это удаляет первые четыре уравнения системы. Уже известно, что какими бы ни были коэффициенты, эти пропорции должны соблюдаться:
- a K 4 Fe (CN) 6 + H 2 SO 4 + H 2 O = 2a K 2 SO 4 + a FeSO 4 + 3a (NH 4 ) 2 SO 4 + 6a CO
4. Можно продолжить, написав уравнения сейчас (и имея более простую задачу для решения), или, в этом конкретном случае (хотя и не столь конкретно), можно продолжить, заметив, что добавление серы дает 6a для H 2 SO 4 и, наконец, добавляя атомы водорода (или атомы кислорода), можно найти длительный 6a для H 2 SO 4 .
Можно продолжить, написав уравнения сейчас (и имея более простую задачу для решения), или, в этом конкретном случае (хотя и не столь конкретно), можно продолжить, заметив, что добавление серы дает 6a для H 2 SO 4 и, наконец, добавляя атомы водорода (или атомы кислорода), можно найти длительный 6a для H 2 SO 4 .
5. Опять же, имея удобное значение для a (в данном случае подойдет 1, но если a приводит к дробным значениям в других коэффициентах, нужно отменить знаменатели) Результат —
- K 4 Fe (CN) 6 + 6 H 2 SO 4 + 6 H 2 O = 2 K 2 SO 4 + FeSO 4 + 3 (NH 4 ) 2 SO 4 + 6 CO
Использование инструмента
Вы также можете использовать наш балансировщик химических уравнений, чтобы сбалансировать уравнения за вас.
Калькулятор балансировочных уравнений | Баланс химического уравнения
Здесь мы даем 5 простых шагов, чтобы сбалансировать любой тип химического уравнения. Следуйте этим рекомендациям и легко и быстро сбалансируйте свое уравнение.
Следуйте этим рекомендациям и легко и быстро сбалансируйте свое уравнение.
- Подсчитайте количество атомов в каждой части уравнения
- Проверьте коэффициенты атомов и добавьте любое число n в качестве коэффициента для необходимых атомов, чтобы сбалансировать уравнение.
- Вы можете просто указать коэффициент перед реагентом или продуктом, но не можете изменять индексы элементов.
- После сложения коэффициентов один раз проверьте, что количество атомов в левой части равно количеству атомов в правой части.
- Измените коэффициенты для необходимых атомов, чтобы уравнение сбалансировалось.
- Когда вы имеете дело с многоатомными ионами, относитесь к каждому полиатомному иону как к одному элементу.
- Добавьте коэффициенты к этим элементам, чтобы получить сбалансированное уравнение.
- Иногда подсчитайте все атомы в химическом уравнении, даже если оно содержит многоатомные ионы, и добавьте к нему коэффициенты, чтобы получить сбалансированное уравнение.

Пример
Вопрос: Уравновесить это уравнение: CaCl 2 + AgNO 3 → Ca (NO 3 ) 2 + AgCl?
Решение:
Данное несбалансированное уравнение —
CaCl 2 + AgNO 3 → Ca (NO 3 ) 2 + AgCl
Запишите количество атомов в каждом элементе
Левая сторона имеет Ca = 1, Cl = 2, Ag = 1, N = 1, O = 3
Правая часть имеет Ca = 1, Cl = 1, Ag = 1, N = 2, O = 6
Атомы азота, хлора и кислорода не сбалансированы.
Добавьте 2 элемента AgNO 3 и AgCl.
Левая сторона имеет Ca = 1, Cl = 2, Ag = 1 * 2 = 2, N = 1 * 2 = 2, O = 3 * 2 = 6
Правая сторона имеет Ca = 1, Cl = 1 * 2 = 2, Ag = 1 * 2 = 2, N = 2, O = 6
Наконец, уравнение сбалансировано.
CaCl 2 +2 AgNO 3 → Ca (NO 3 ) 2 + 2AgCl
Онлайн калькулятор.guru — лучшее место, где вы можете найти калькуляторы различных понятий по математике, физике и химии. Взгляните на них и используйте при необходимости, чтобы получить мгновенные результаты.
простых шагов для балансировки химических уравнений
Джеффри Кулидж / Getty Images
Химическое уравнение — это письменное описание того, что происходит в химической реакции. Исходные материалы, называемые реагентами, указаны в левой части уравнения. Далее идет стрелка, указывающая направление реакции.В правой части реакции перечислены производимые вещества, называемые продуктами.
Сбалансированное химическое уравнение сообщает вам количество реагентов и продуктов, необходимых для удовлетворения Закона сохранения массы. По сути, это означает, что в левой части уравнения находится такое же количество атомов каждого типа, что и в правой. уравнения. Кажется, что балансировать уравнения должно быть просто, но это навык, требующий практики. Итак, хотя вы можете чувствовать себя манекеном, это не так! Вот шаг за шагом процесс, которому вы следуете, чтобы сбалансировать уравнения.Вы можете применить эти же шаги, чтобы сбалансировать любое несбалансированное химическое уравнение …
уравнения. Кажется, что балансировать уравнения должно быть просто, но это навык, требующий практики. Итак, хотя вы можете чувствовать себя манекеном, это не так! Вот шаг за шагом процесс, которому вы следуете, чтобы сбалансировать уравнения.Вы можете применить эти же шаги, чтобы сбалансировать любое несбалансированное химическое уравнение …
Простые шаги по уравновешиванию химических уравнений
Выполните четыре простых шага, чтобы сбалансировать химическое уравнение:
- Напишите несбалансированное уравнение, чтобы показать реагенты и продукты.
- Запишите, сколько атомов каждого элемента находится по обе стороны от стрелки реакции.
- Сложите коэффициенты (числа перед формулами), чтобы количество атомов каждого элемента было одинаковым с обеих сторон уравнения.Проще всего уравновесить атомы водорода и кислорода последними.
- Укажите состояние вещества реагентов и продуктов и проверьте свою работу.
Запишите несбалансированное химическое уравнение
Первый шаг — написать несбалансированное химическое уравнение. Если вам повезет, это вам дадут. Если вам сказали сбалансировать химическое уравнение и дали только названия продуктов и реагентов, вам нужно будет либо найти их, либо применить правила наименования соединений, чтобы определить их формулы.
Если вам повезет, это вам дадут. Если вам сказали сбалансировать химическое уравнение и дали только названия продуктов и реагентов, вам нужно будет либо найти их, либо применить правила наименования соединений, чтобы определить их формулы.
Давайте попрактикуемся, используя реакцию из реальной жизни — ржавчину железа в воздухе. Чтобы написать реакцию, вам нужно идентифицировать реагенты (железо и кислород) и продукты (ржавчину). Затем напишите несбалансированное химическое уравнение:
Fe + O 2 → Fe 2 O 3
Обратите внимание, что реагенты всегда идут слева от стрелки. Их разделяет знак «плюс». Далее идет стрелка, указывающая направление реакции (реагенты превращаются в продукты).Товары всегда находятся справа от стрелки. Порядок, в котором вы пишете реагенты и продукты, не важен.
Запишите количество атомов
Следующим шагом для уравновешивания химического уравнения является определение количества атомов каждого элемента на каждой стороне стрелки:
Fe + O 2 → Fe 2 O 3
Для этого имейте в виду, что нижний индекс указывает количество атомов. Например, O 2 имеет 2 атома кислорода.В Fe 2 O 3 2 атома железа и 3 атома кислорода. В Fe 1 атом. Отсутствие нижнего индекса означает, что имеется 1 атом.
Например, O 2 имеет 2 атома кислорода.В Fe 2 O 3 2 атома железа и 3 атома кислорода. В Fe 1 атом. Отсутствие нижнего индекса означает, что имеется 1 атом.
Со стороны реагента:
1 Fe
2 O
Со стороны продукта:
2 Fe
3 O
Откуда вы знаете, что уравнение еще не сбалансировано? Потому что количество атомов на каждой стороне не одинаковое! Сохранение массовых состояний: масса не создается и не разрушается в результате химической реакции, поэтому вам нужно добавить коэффициенты перед химическими формулами, чтобы отрегулировать количество атомов, чтобы они были одинаковыми с обеих сторон.
Добавить коэффициенты для уравновешивания массы в химическом уравнении
При балансировании уравнений вы никогда не меняете индексы . Вы складываете коэффициенты . Коэффициенты — это множители целых чисел. Если, например, вы напишете 2 H 2 O, это означает, что у вас в 2 раза больше атомов в каждой молекуле воды, то есть 4 атома водорода и 2 атома кислорода. Как и в случае с индексами, вы не пишете коэффициент «1», поэтому, если вы не видите коэффициент, это означает, что имеется одна молекула.
Как и в случае с индексами, вы не пишете коэффициент «1», поэтому, если вы не видите коэффициент, это означает, что имеется одна молекула.
Есть стратегия, которая поможет вам быстрее сбалансировать уравнения. Он называется балансировкой по осмотру . По сути, вы смотрите, сколько атомов у вас есть на каждой стороне уравнения, и добавляете коэффициенты к молекулам, чтобы сбалансировать количество атомов.
- Сначала уравновесить атомы, присутствующие в одной молекуле реагента и продукта.
- Остаток любых атомов кислорода или водорода последними.
В примере:
Fe + O 2 → Fe 2 O 3
Железо присутствует в одном реагенте и одном продукте, поэтому сначала сбалансируйте его атомы.Один атом железа слева и два справа, так что вы можете подумать, что размещение 2 Fe слева будет работать. Хотя это уравновесит железо, вы уже знаете, что вам придется регулировать и кислород, потому что он не сбалансирован. Осмотрев (то есть глядя на это), вы знаете, что должны отбросить коэффициент 2 для некоторого большего числа.
Осмотрев (то есть глядя на это), вы знаете, что должны отбросить коэффициент 2 для некоторого большего числа.
3 Fe не работает слева, потому что вы не можете ввести коэффициент из Fe 2 O 3 , который уравновесил бы его.
4 Fe работает, если затем добавить коэффициент 2 перед молекулой ржавчины (оксида железа), и получится 2 Fe 2 O 3 .Это дает вам:
4 Fe + O 2 → 2 Fe 2 O 3
Железо сбалансировано, по 4 атома железа на каждой стороне уравнения. Далее вам нужно сбалансировать кислород.
Баланс последних атомов кислорода и водорода
Это уравнение сбалансировано для железа:
4 Fe + O 2 → 2 Fe 2 O 3
При балансировании химических уравнений последний шаг — добавить коэффициенты к атомам кислорода и водорода.Причина в том, что они обычно появляются в нескольких реагентах и продуктах, поэтому, если вы сначала разберетесь с ними, вы обычно делаете дополнительную работу для себя.
Теперь посмотрите на уравнение (используйте осмотр), чтобы увидеть, какой коэффициент будет работать для баланса кислорода. Если вы введете 2 из O 2 , это даст вам 4 атома кислорода, но у вас будет 6 атомов кислорода в продукте (коэффициент 2, умноженный на индекс 3). Итак, 2 не работает.
Если вы попробуете 3 O 2 , то у вас будет 6 атомов кислорода на стороне реагента, а также 6 атомов кислорода на стороне продукта.Это работает! Сбалансированное химическое уравнение:
4 Fe + 3 O 2 → 2 Fe 2 O 3
Примечание: Вы могли бы написать сбалансированное уравнение, используя кратные коэффициенты. Например, если вы удвоите все коэффициенты, у вас все равно будет сбалансированное уравнение:
8 Fe + 6 O 2 → 4 Fe 2 O 3
Однако химики всегда пишут простейшие уравнения, поэтому проверьте свою работу, чтобы убедиться, что вы не можете уменьшить свои коэффициенты.
Вот как вы сбалансируете простое химическое уравнение для массы. Вам также может потребоваться сбалансировать уравнения для массы и заряда. Кроме того, вам может потребоваться указать состояние вещества (твердое, жидкое, водное, газообразное) реагентов и продуктов.
Сбалансированные уравнения с состояниями материи (плюс примеры)
Пошаговые инструкции по уравновешиванию уравнений окисления-восстановления
Смотри:
Как сбалансировать химические уравнения
Химическое уравнение — Простая английская Википедия, бесплатная энциклопедия
Химическое уравнение — это способ предсказать, как два или более химических вещества будут работать вместе.Используя то, что знают химики о том, как действуют химические вещества, мы складываем буквенные символы вместе, как в математической задаче. Таким образом, мы можем правильно угадать, получим ли мы новое химическое вещество, когда мы смешаем два или более химикатов вместе, и что это будет за химикат.
Химические уравнения сформулированы или записаны с использованием символов элементов, количества элемента и в каком состоянии (твердое [s], жидкое [l], газовое [g]) он находится.
Например: водный раствор хлорида натрия (NaCl [водн.]) И другой водный раствор нитрата серебра (AgNO 3 [водн.]).Они смешиваются вместе, образуя нитрат натрия (NaNO 3 [водн.]) И хлорид серебра (AgCl [s]).
Что в символах:
NaCl (водн.) + AgNO 3 (водн.) → NaNO 3 (водн.) + AgCl (т. Е.)
Растворы образуют твердый AgCl. Это образование можно назвать осадком, а реакцию между двумя растворами — реакцией осаждения, поскольку образовавшееся твердое вещество не растворяется, тогда как все другие продукты растворяются.
Чтобы удовлетворить закону сохранения материи, необходимо сбалансировать химические уравнения.Химические уравнения говорят, что в замкнутой системе материя не создается и не разрушается. Химическое уравнение необходимо сбалансировать так, чтобы оно подчинялось закону сохранения массы. [1] Сбалансированное химическое уравнение возникает, когда количество различных атомов элементов на стороне реагентов равно количеству атомов на стороне продуктов.
Уравновешивание химических уравнений — это процесс проб и ошибок. Чтобы сбалансировать уравнение, необходимо изменить количество реагентов и продуктов.При необходимости, добавляя коэффициенты перед соответствующими формулами. При балансировке уравнения никогда не меняйте индексы, потому что это меняет суть. Чтобы определить количество атомов каждого элемента, коэффициент умножается на индексы в каждой формуле.
Методы балансировки химических уравнений [изменить | изменить источник]
Химическое уравнение — это письменное символическое представление химической реакции. Химические реагенты указаны слева, а химические продукты — справа.Закон сохранения массы гласит, что никакие атомы не могут образоваться в результате химической реакции. Кроме того, его нельзя уничтожить. Таким образом, количество атомов, присутствующих в реагентах, должно уравновешивать количество атомов, присутствующих в реакции.
Есть два способа уравновесить химическое уравнение. Первый — это балансировка осмотром. Балансировка путем осмотра — это самый основной используемый метод. Он лучше всего подходит для простых задач. Более сложные требуют опыта. Второй — балансировка численным методом.На самые важные части метотрексат числовой, в отличие от метода обследования, дает ответ. Если реакцию можно уравновесить, можно увидеть коэффициенты. Если реакцию невозможно сбалансировать, это означает, что неидентифицированных утверждений больше, чем независимых, или что утверждения противоположны. Метод проверки не докажет, что уравнение невозможно сбалансировать.
зачем нам балансировать химическое уравнение?
нам необходимо сбалансировать химическое уравнение, потому что «закон сохранения массы» утверждает, что масса не может быть ни создана, ни разрушена в химической реакции.
Таким образом, количество элементов, участвующих в химической реакции, должно оставаться неизменным на стороне реагента и продукта.
(реагент = продукт)
Сбалансированное химическое уравнение: определение и примеры — видео и стенограмма урока
Шаги по уравновешиванию уравнения
Практика всегда добивается совершенства. В общем, чтобы сбалансировать уравнение, нам нужно сделать следующее:
- Подсчитать атомы каждого элемента в реагентах и продуктах.
- Использовать коэффициенты; при необходимости разместите их перед составами.
Шаги просты, но это процесс проб и ошибок. Давайте рассмотрим еще несколько примеров уравнений и методов, которые можно использовать для балансировки каждого из них.
Пример 1
Это реакция между метаном (Ch5) и кислородом (O2) с образованием диоксида углерода (CO2) и воды (h3O).
Показанная реакция представляет собой реакцию горения : соединение реагирует с кислородом с образованием диоксида углерода и воды.Метод заключается в том, чтобы сначала уравновесить атомы углерода (C), затем атомы водорода (H), а затем атомы кислорода (O).
В этом случае атомы углерода (C) уже сбалансированы. Итак, теперь мы посмотрим на атомы водорода (H). Есть 4 атома водорода (H) на стороне реагентов и 2 атома водорода (H) на стороне продуктов. Чтобы уравновесить их, мы ставим коэффициент 2 перед h3O.
Теперь атомы водорода (H) уравновешены.Из-за коэффициента 2 перед h3O всего на стороне продуктов находится 4 атома кислорода (O). Чтобы уравновесить атомы кислорода с обеих сторон, мы ставим коэффициент 2 перед O2. Теперь химическое уравнение сбалансировано.
Пример 2
Это реакция между оксидом железа (Fe2O3) и углеродом (C) с образованием железа (Fe) и диоксида углерода (CO2).
Эта реакция не сбалансирована.Во-первых, нам нужно сбалансировать атомы кислорода. Мы делаем это так, чтобы с каждой стороны было по 6 атомов кислорода. Для этого нам нужно поставить коэффициент 2 перед Fe2O3 и коэффициент 3 перед CO2.
Теперь, когда атомы кислорода уравновешены, нам нужно сначала уравновесить атомы железа (Fe). Для этого нам нужно поставить коэффициент 4 перед Fe на стороне продуктов. Теперь, когда атомы Fe уравновешены, мы можем уравновесить атомы углерода.Мы делаем это, устанавливая коэффициент 3 перед C на стороне реагентов. Теперь химическое уравнение сбалансировано.
Пример 3
При работе с химическими уравнениями с многоатомными ионами , которые представляют собой ионы, состоящие из более чем одного атома, существует специальный метод для уравновешивания химического уравнения.
Этот метод заключается в обработке всего многоатомного иона, как если бы это был только один атом.Давайте посмотрим на это химическое уравнение.
Многоатомный ион в данном случае — PO4 (зеленый). Мы будем рассматривать весь этот многоатомный ион как один атом. Со стороны реагентов есть один ион PO4, а со стороны продуктов — два иона PO4.
Первый шаг — сбалансировать многоатомные ионы с обеих сторон. Для этого мы ставим коэффициент 2 перед Na3PO4. Атомы натрия (Na) удваиваются, и PO4 теперь сбалансирован с обеих сторон.
Следующий шаг — уравновесить атомы магния (Mg), натрия (Na) и хлора (Cl). Сначала мы уравновешиваем атомы магния, задав коэффициент 3 перед MgCl2.
Затем мы уравновешиваем атомы Na и Cl с обеих сторон, помещая коэффициент 6 перед NaCl. В результате получается сбалансированное уравнение:
Пример 4
Давайте рассмотрим реакцию между алюминием (Al) и серной кислотой (h3SO4).В этой реакции наш многоатомный ион, который мы будем считать за один атом, — это SO4. Со стороны реагентов имеется один ион SO4, а со стороны продуктов — три иона SO4.
Сначала нам нужно сбалансировать ионы SO4, и для этого мы ставим коэффициент 3 перед h3SO4.
Атомы водорода и алюминия неуравновешены. Следующий шаг — уравновесить атомы водорода (H), поставив коэффициент 3 перед h3.
Последний шаг — уравновесить атомы алюминия (Al). Мы делаем это, помещая коэффициент 2 перед Al. Теперь химическое уравнение сбалансировано.
Резюме урока
Согласно закону сохранения массы , масса реагентов должна быть равна массе продуктов, когда происходит химическая реакция. Это означает, что количество различных атомов, участвующих в реагирующих веществах, должно оставаться неизменным после того, как реакция протекает.Там, где есть химическая реакция, есть химическое уравнение. Химическое уравнение необходимо сбалансировать так, чтобы оно подчинялось закону сохранения массы. Сбалансированное химическое уравнение возникает, когда количество различных атомов элементов на стороне реагентов равно количеству атомов на стороне продуктов.
Уравновешивание химических уравнений — это процесс проб и ошибок. При балансировании химических уравнений нам сначала нужно подсчитать различные атомы на стороне реагентов и на стороне продуктов.Если уравнение не сбалансировано, нам нужно использовать коэффициенты , которые представляют собой числа, которые мы ставим перед реагирующими веществами, чтобы сбалансировать уравнение. Если перед химической формулой нет коэффициента, это означает, что коэффициент равен единице.
Для реакций горения метод заключается в уравновешивании атомов углерода (C), за которыми следуют атомы водорода (H), а затем атомы кислорода (O). Для атомов, включающих многоатомные ионы, общая методика состоит в том, чтобы считать весь многоатомный ион за один атом, сначала уравновесить их, а затем уравновесить остальные атомы.
Результаты обучения
После того, как вы закончите, вы должны уметь:
- Вспомнить, как закон сохранения массы требует сбалансированного химического уравнения
- Укажите шаги, чтобы сбалансировать химическое уравнение
- Уравновесить химическое уравнение
Уравновешивание химических уравнений | Представляет химическое изменение
Уравновесить следующие уравнения:
\ [\ text {Mg} + \ text {O} _ {2} \ rightarrow \ text {MgO} \]
Решение пока недоступно
\ [\ text {Ca} + \ text {H} _ {2} \ text {O} \ rightarrow \ text {Ca (OH)} _ {2} + \ text {H} _ {2} \]
Решение пока недоступно
\ [\ text {CuCO} _ {3} + \ text {H} _ {2} \ text {SO} _ {4} \ rightarrow \ text {CuSO} _ {4} + \ text {H} _ {2 } \ text {O} + \ text {CO} _ {2} \]
Решение пока недоступно
\ [\ text {CaCl} _ {2} + \ text {Na} _ {2} \ text {CO} _ {3} \ rightarrow \ text {CaCO} _ {3} + \ text {NaCl} \]
Решение пока недоступно
\ [\ text {C} _ {12} \ text {H} _ {22} \ text {O} _ {11} + \ text {O} _ {2} \ rightarrow \ text {CO} _ {2} + \ text {H} _ {2} \ text {O} \]
Решение пока недоступно
Хлорид бария реагирует с серной кислотой с образованием сульфата бария и соляной кислоты.
Решение пока недоступно
Этан \ ((\ text {C} _ {2} \ text {H} _ {6}) \) реагирует с кислородом с образованием диоксида углерода и пара.
Решение пока недоступно
Карбонат аммония часто используется как нюхательная соль. Сбалансируйте следующую реакцию разложения карбоната аммония: \ (\ text {(NH} _ {4} \ text {)} _ {2} \ text {CO} _ {3} \ text {(s)} \ rightarrow \ text {NH} _ {3} \ text {(aq)} \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \)
Решение пока недоступно
Водородные топливные элементы чрезвычайно важны для развития альтернативных источников энергии.Многие из этих клеток работают, взаимодействуя вместе с газами водорода и кислорода с образованием воды, реакция, которая также производит электричество. Сбалансируйте следующее уравнение: \ (\ text {H} _ {2} \ text {(g)} + \ text {O} _ {2} \ text {(g)} \ rightarrow \ text {H} _ {2 } \ text {O (l)} \)
Решение пока недоступно
Синтез аммиака \ ((\ text {NH} _ {3}) \), прославленный немецким химиком Фрицем Габером в начале 20 века, является одной из важнейших реакций в химической промышленности.Сбалансируйте следующее уравнение, используемое для производства аммиака: \ [\ text {N} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {(g)} \ rightarrow \ text {NH } _ {3} \ text {(g)} \]
Решение еще не доступно
Уравновешивание химических реакций с примерами
Уравновешивание химических реакций с примерами
Теорема сохранения массы:
В химической реакции масса сохраняется, а не теряется и не создается. Таким образом;
- Число атомов элементов сохраняется.Другими словами, сумма атомов в части реагентов равна сумме атомов продуктов.
- Масса элементов сохранена. Масса реактивов равна массе продуктов.
- Заряды элементов / соединений сохранены. Суммарные затраты на реагенты равны сумме затрат на продукты.
- В химической реакции количество молекул сохраняется не всегда. Например;
H 2 + Cl 2 → 2HCl
В этой реакции; Молекула 1 H 2 и молекула 1Cl 2 вступают в реакцию, и образуется 2 молекулы HCl.Итак, количество молекул сохраняется. Напротив,
2H 2 + O 2 → 2H 2 O
В этой реакции 2 молекулы H 2 реагируют с 1 молекулой O 2 и образуются 2 молекулы H 2 O. Таким образом, количество молекул не сохраняется.
Пример: 4 г вещества A реагирует с 2,5 г вещества B и 1,4 л газа C и образуются 3,5 г D. Найдите молярную массу C.
Решение:
В химических реакциях масса всегда сохраняется.Так;
A масса + B масса = C масса + D масса
4 + 2,5 = C масса + 3,5
C масса = 3 г
В стандартных условиях 1 моль газа составляет 22,4 литра, количество молей C;
n C = 1,4 / 22,4 = 1/16 моль
1/16 моль C составляет 3 г
1 моль C составляет X
___________________
X = 48 г
Молярная масса of C = 48 g
- Уравновешивая химические уравнения, вы должны уравновесить H и O после уравновешивания других элементов.
- Вы можете умножать коэффициенты реакции на дроби вроде 3/2.
Пример: Баланс по химическому уравнению.
C 3 H 4 + O 2 → CO 2 + H 2 O
Реагенты:
3 атома C, 4 атома H, 2 атома O
Продукты:
1 атом C, 3 атома O, 2 атома H,
Чтобы уравновесить реакцию, мы умножаем CO 2 на 3, и реакция становится;
C 3 H 4 + O 2 → 3CO 2 + H 2 O
Теперь у нас есть 4 атома H в реагентах и 2 атома H в продуктах, поэтому мы умножаем H 2 O на 2, и реакция становится;
C 3 H 4 + O 2 → 3CO 2 + 2H 2 O
Теперь у нас есть 2 атома O в реагентах и 6 + 2 = 8 атомов O в продуктах, чтобы сбалансировать O, мы умножаем O 2 в реагентах на 4.
C 3 H 4 + 4O 2 → 3CO 2 + 2H 2 O
Теперь наша реакция уравновешена.
Балансировка окислительно-восстановительных реакций:
При уравновешивании окислительно-восстановительных реакций вы должны уравновесить количество атомов и заряды веществ в реакции. Таким образом, вы должны знать степени окисления атомов элементов. Мы приводим несколько примеров и пытаемся на них разъяснить эту тему.
Пример: Остаток после реакции;
HNO 3 + H 2 S → NO + H 2 O + S
Решение:
Сначала записываем степени окисления всех элементов;
H + N +5 O 3 -2 + H + 2 S -2 → N +2 O -2 + H + 2 О -2 + С 0
Затем мы запишем половинных реакций , которые показывают окисление и восстановление (перенос электрона) элементов.
Редукция: N +5 + 3e — → N +2
Окисление: S -2 → S 0 + 2e —
Чтобы уравновесить количество полученных и потерянных электронов, мы умножаем реакцию восстановления на 2 и реакцию окисления на 3.
Чтобы уравновесить количество атомов N с обеих сторон, мы добавляем 2 перед молекулами, включая N, а чтобы сбалансировать количество атомов S, мы пишем 3 перед всеми веществами, включая S.Теперь реакция становится;
2HNO 3 + 3H 2 S → 2NO + H 2 O + 3S
Теперь мы уравновешиваем количество атомов H с обеих сторон: 8 атомов H слева и 2 атома H справа. Если мы умножим H 2 O на произведения, мы уравновесим количество атомов H в реакции. Конечная реакция становится;
2HNO 3 + 3H 2 S → 2NO + 4H 2 O + 3S
Вы можете проверить количество O с обеих сторон, оно также сбалансировано.У нас 6 атомов O слева и 6 атомов O справа.
Будьте осторожны!
Уравновешивающий (+) заряд в ионных реакциях, протекающих в кислой среде, добавить H + , а для уравновешивания количества атомов H и O добавить H 2 O.
Пример: Равновесие следующей реакции в кислой среде;
ClO 3 — + Cr +3 → ClO 2 + Cr 2 O 7 -2
Пишем степени окисления всех элементов, будьте осторожны, не путайте заряд иона и степени окисления элементов.
Cl +5 O -2 3 — + Cr +3 → Cl +4 O -2 2 + Cr +6 2 O -2 7 -2
Полуреакции окисления и восстановления;
Редукция: Cl +5 + e — → Cl +4
Окисление: Cr +3 → Cr +6 + 3e —
Чтобы уравновесить количество электронов в обеих сторонах, мы умножаем половину реакции восстановления на 6 и половину реакции окисления на 2.Теперь реакция становится;
6ClO 3 — + 2Cr +3 → 6ClO 2 + Cr 2 O 7 -2
Рассчитываем электрические заряды с обеих сторон и уравновешиваем их.
Левая сторона: ClO 3 — : 6x (заряд ионов = -1) = — 6
Cr +3 : 2x (+3) = + 6
-6 + 6 = 0
Полный электрический заряд слева равен нулю.
Правая сторона: Cr 2 O 7 -2 : -2
Суммарный заряд -2, уравновешивая электрический заряд, добавляем ионы H + в кислых средах.Таким образом, мы добавляем ион 2H + в правую часть реакции и уравновешиваем реакцию.
6ClO 3 — + 2Cr +3 → 6ClO 2 + Cr 2 O 7 -2 + 2H +
Теперь мы должны сбалансировать количество атомов H на обеих сторонах реакции. Слева нет атома H, но с правой стороны есть атомы 2H. Чтобы сбалансировать реакцию, мы добавляем 1 молекулу H 2 O в левую часть реакции и уравновешиваем ее. Окончательная сбалансированная реакция:
6ClO 3 — + 2Cr +3 + H 2 O → 6ClO 2 + Cr 2 O 7 -2 + 2H +
Будьте осторожны!
Уравновешивая (-) заряд в ионных реакциях, протекающих в основной среде, добавьте OH — , а для уравновешивания количества атомов H и O добавьте ион OH — .
Пример: Остаток следующей реакции в основной среде;
Br 2 → Br — + BrO 3 —
Пишем степени окисления всех элементов, будьте осторожны, не путайте заряд иона и степени окисления элементов.
Br 2 0 → Br — + Br +5 O -2 3 —
Полуреакции окисления и восстановления;
Редукция: Br 0 + e — → Br -1
Окисление: Br 0 → Br +5 + 5e —
Чтобы уравновесить количество электронов в обеих сторонах, мы умножаем половину реакции восстановления на 5 и половину реакции окисления на 1.Чтобы сбалансировать количество Br в обеих сторонах, мы добавляем 3 перед Br 2 в реагентах. Теперь реакция становится;
3Br 2 → 5Br — + BrO 3 —
Рассчитываем электрические заряды с обеих сторон и уравновешиваем их.
Левая сторона: Br 2 : 0
Полный электрический заряд слева равен нулю.
Правая сторона: 5Br — + BrO 3 — : -5 + (- 1) = — 6
Общий заряд -6, уравновешивая электрический заряд, мы добавляем ионы OH — слева в основных средах.Таким образом, мы добавляем ион 6OH — в левую часть реакции и уравновешиваем реакцию.
3Br 2 + 6OH — → 5Br — + BrO 3 —
Теперь мы должны сбалансировать количество атомов H на обеих сторонах реакции. В правой части нет атома H, но есть атомы 6H в левой части. Чтобы сбалансировать реакцию, мы добавляем молекулу 3 H 2 O в правую часть реакции и уравновешиваем ее. Окончательная сбалансированная реакция:
3Br 2 + 6OH — → 5Br — + BrO 3 — + 3H 2 O
Теперь все заряды и количество атомов уравновешены.
Исследования химических реакций и решения проблем
| Окислительно-восстановительные реакции (окислительно-восстановительные) <Пред. | Далее> Стехиометрия химической реакции с примерами |
|---|
.
