Содержание
Типы кристаллических решеток и свойства веществ
По характеру структуры кристаллические решетки всех веществ относят к одному из четырех основных типов:
а) молекулярная решетка,
б) атомная,
в) ионная,
г) металлическая.
В основу этой классификации положен род структурных частиц (молекулы-атомы-ионы), находящихся в узлах кристаллической решетки.
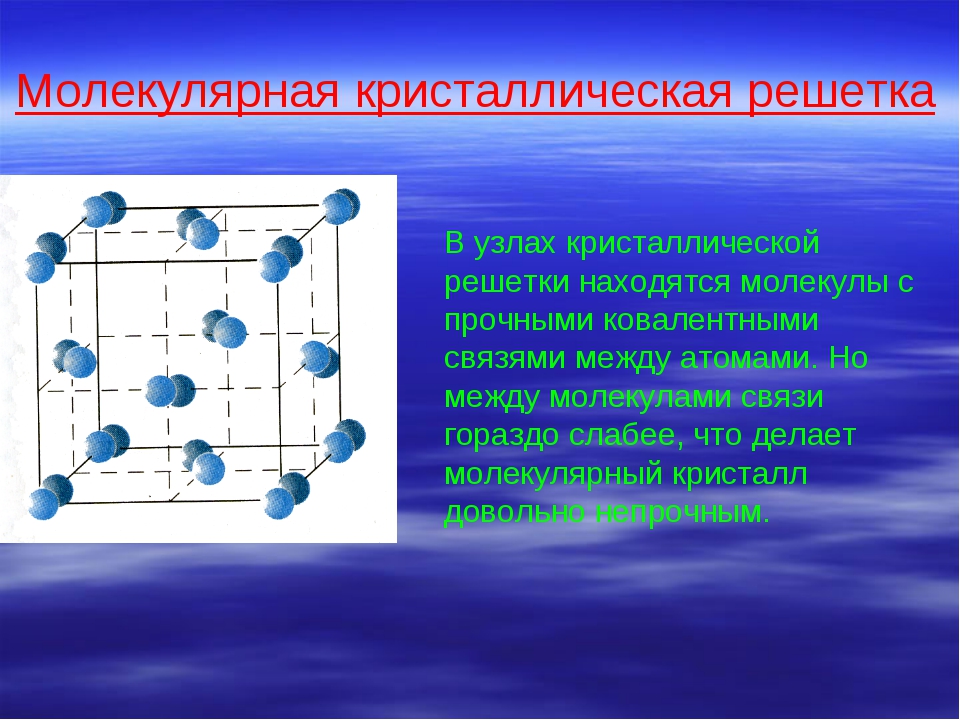
Молекулярная решетка
В узлах молекулярной решетки находятся полярные или неполярные молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Молекулы в кристалле способны совершать незначительные колебания различного характера. Вещества с молекулярным типом решетки, например, органические вещества, кристаллы инертных газов и большинства неметаллов, сухой лед (СО2 тверд.) обладают малой твердостью, низкими температурами плавления и кипения. Эти характеристики объясняются тем, что при приложении незначительной энергии межмолекулярные связи разрываются и кристалл разрушается с образованием отдельных молекул, что и наблюдается при плавлении и при испарении кристаллов.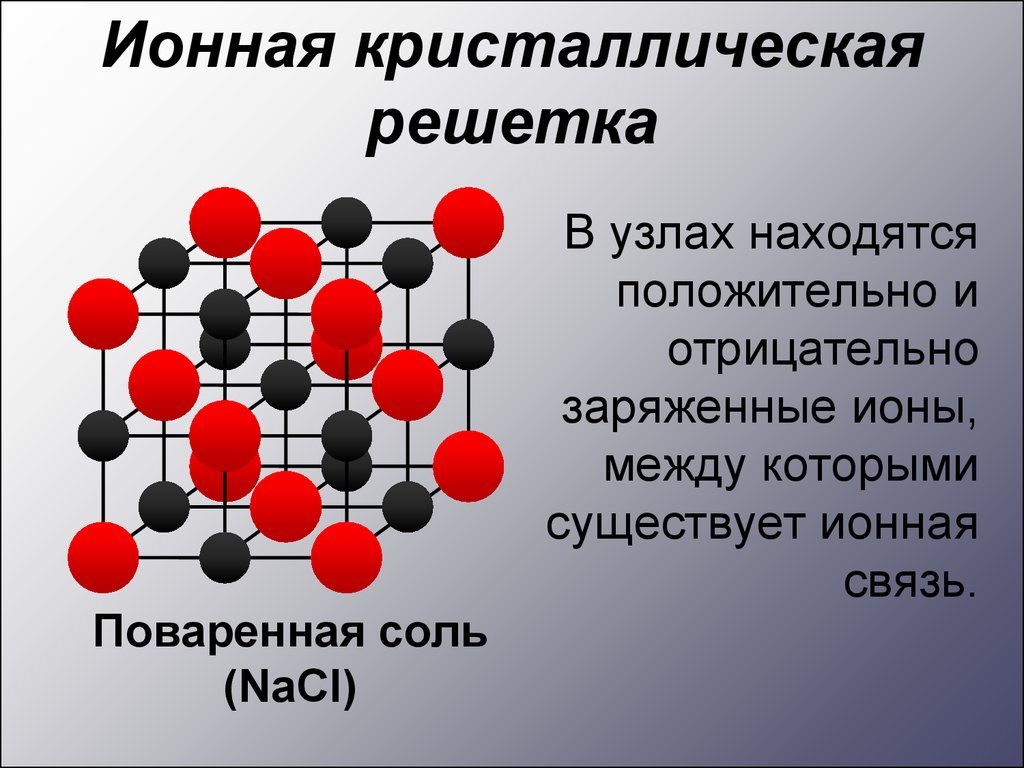 Внутри отдельных молекул атомы связаны значительно более прочными связями (ковалентными полярными или неполярными). Эти связи разрушаются при более высокой температуре, и молекулы распадаются на составляющие их атомы (происходит термическая диссоциация).
Внутри отдельных молекул атомы связаны значительно более прочными связями (ковалентными полярными или неполярными). Эти связи разрушаются при более высокой температуре, и молекулы распадаются на составляющие их атомы (происходит термическая диссоциация).
Атомная решетка
В узлах атомной кристаллической решетки находятся атомы. Роль сил межмолекулярного взаимодействия здесь играют достаточно прочные ковалентные связи. Выделить из общей массы атомов один невозможно. Вещества с атомным типом кристаллической решетки (алмаз, бор, кремний, карборунд SiC, нитрид алюминия и другие) характеризуются очень большой твердостью, иногда сочетающейся с хрупкостью, нерастворимостью в обычных растворителях, очень высокими температурами плавления и кипения. Все связи в кристалле равноценны. При разрыве этих связей, достигаемом лишь при высокой температуре, кристалл диссоциирует на отдельные атомы: плавление, кипение и термическая диссоциация практически совпадают.
Ионная (координационная) решетка
В узлах ионной кристаллической решетки находятся чередующиеся положительные и отрицательные ионы, связанные между собой силами кулоновского взаимодействия.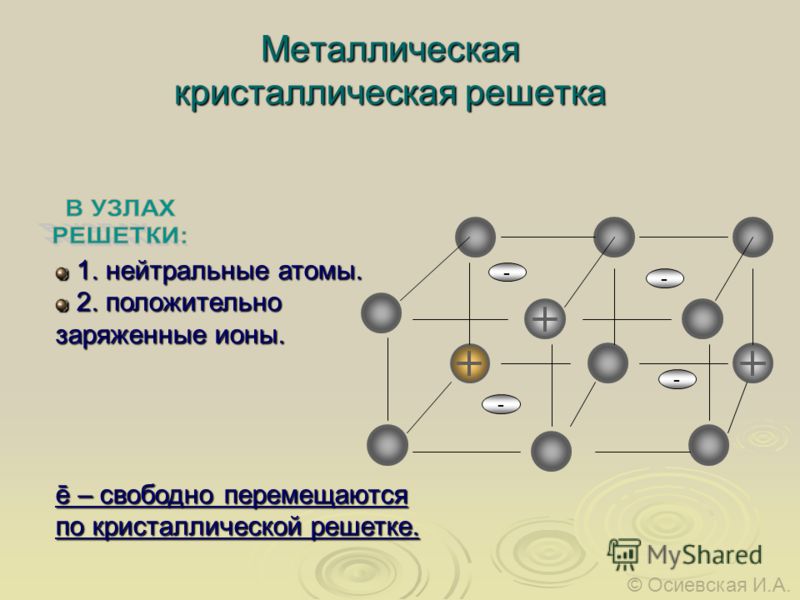 Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
Металлическая решетка
В узлах металлической решетки находятся положительно заряженные ионы металлов, окруженные электронами. Эти электроны, связанные отчасти с ионами силами электростатического взаимодействия, являются «полусвободными», иначе говоря «не прикреплены» к отдельным ионам, а более или менее свободно перемещаются между ними. Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия.
Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия. Прочность и температуры плавления и кипения у металлов не всегда имеют промежуточные значения между этими же свойствами у веществ с атомными и ионными решетками. Это зависит от природы металла. Интересно, что заряд ионов в металлах не всегда отвечает номеру группы периодической системы, в которой металл находится. Например, в кристаллической решетке алюминия ионы имеют средний заряд +2. Это можно объяснить двумя способами:
Прочность и температуры плавления и кипения у металлов не всегда имеют промежуточные значения между этими же свойствами у веществ с атомными и ионными решетками. Это зависит от природы металла. Интересно, что заряд ионов в металлах не всегда отвечает номеру группы периодической системы, в которой металл находится. Например, в кристаллической решетке алюминия ионы имеют средний заряд +2. Это можно объяснить двумя способами:
а) все атомы алюминия отдали по два электрона в «электронный газ»;
б) все атомы отдали по три электрона, но в среднем одна треть образовавшихся ионов Al+3 снова образует «атомы», поэтому средний заряд всех структурных частиц +2.
Таким образом, металлическое состояние в упрощенном представлении подобно атомарному ввиду его суммарной электронейтральности; это сосуществование и взаимосвязь «атомов»-ионов-электронов.
Типы кристаллических решеток и свойства веществ
№ | Тип кристаллической решетки | Структурные частицы кристалла | Характер связи между структурными частицами кристалла | Характер связи в молекулах | Примеры кристаллических веществ | Характерные свойства |
1. | Молекулярная | Полярные молекулы – диполи | 1. Электростатическое взаимодействие диполей. | Ковалентные полярные | HF, H2O, HCl, H2S, PCl3, NH3 (твердые) | Межмолекулярное взаимодействие средней силы. |
| Неполярные молекулы | Силы Ван-дер-Ваальса (слабые) | Ковалентные неполярные и ковалентные полярные | H2, Cl2, O2, N2, F2, СО2, SO3 (образованы молекулами симметричного строения) | Межмолекулярное взаимодействие слабое. Растворимы в неполярных растворителях, очень малая термическая устойчивость, очень слабая электропроводность, легкая летучесть (очень низкие температуры плавления и кипения), очень слабые механические свойства. | ||
2. | Атомная | Атомы | Ковалентные связи | — | C, Si, SiC, AlN, ВеО (образованы элементами, среднее арифметическое номеров групп которых равно 4) | Нерастворимы в обычных растворителях, термически устойчивы, неэлектропроводны, температуры плавления и кипения очень высокие; твердые, но хрупкие, прочность связей между частицами очень высокая. |
3. | Ионная | Ионы: катионы, анионы | 1. Электростатическое взаимодействие. | — | CsF, KCl, CaF2, CsH, NaF, ВаCl2 | Растворимы в полярных растворителях, термическая устойчивость высокая, большая электропроводность в растворах и расплавах, высокие температуры плавления; вещества твердые, но хрупкие, прочность связей между частицами высокая. |
4. | Металлическая | Катионы, «атомы», электроны | 1. Электростатическое притяжение ионов и электронов. | — | Na, K, Cu, Zn, Fe, Pt, Pb | Растворимы в расплавленных металлах, термическая устойчивость различная, электропроводность высокая, температуры плавления и кипения лежат в широких пределах; вещества пластичные, твердость, как и прочность связей между частицами, различная. |
Как различаются типы кристаллической решетки? Какие способы определения?
Существует 4 типа кристаллических решеток: ионные, молекулярные, атомные и металлические.
В узлах ионных кристаллических решеток находятся ионы, как можно понять из названия. Такой тип решетки характерен для солей, оксидов и некоторых гидроксидов. Например, самый яркий представитель — NaCl. Вещества подобного строения характеризуются высокой твердостью, тугоплавкостью и нелетучестью.
В молекулярных кристаллических решетках в узлах находятся молекулы. Такие решетки могут быть полярные и неполярные. Например, I2 или N2 — неполярные, а HCl или h3O — полярные. Характерны для жидких и газообразных веществ (при н.у.). Так как молекулярные взаимодействия слабые, то и кристаллические решетки эти будут нетвердые, летучие и с низкой температурой плавления. К таким решеткам относят твердую органику (сахар, глюкоза, нафталин).
В атомных кристаллических решетках в узлах находятся атомы, связанные друг с другом прочными ковалентными связями. Такая решетка характерна простым веществам неметаллам, которые при нормальных условиях находятся в твердом состоянии, например алмаз. Температура плавления у подобных веществ очень высокая, они прочные, твердые и нерастворимы в воде.
Такая решетка характерна простым веществам неметаллам, которые при нормальных условиях находятся в твердом состоянии, например алмаз. Температура плавления у подобных веществ очень высокая, они прочные, твердые и нерастворимы в воде.
Металлические решетки характеризуются тем, что в узлах находятся атомы или ионы одного или нескольких металлов (у сплавов). Для металлических решеток характерно наличие так называемого общего электронного облака. Так как непрерывно происходит процесс перехода валентных электронов одного атома к другому с образованием иона, то можно говорить о том, что электроны свободно двигаются в объеме всего металла. Этим свойством объясняется электро- и теплопроводность металлов. Вещества такого строения ковки и пластичны.
Вообще в материаловедении для изучения кристаллических структур существует множество методов, основанных на свойствах рентгеновского излучения (дифракция, интерференция), электронографический анализ и другие. Но если вы хотите просто определить тип решетки вещества известного состава, нужно понять к какому классу веществ оно относится и какие физико-химические свойства имеет.
Тестирование по теме «Кристаллические решётки веществ» | Тест по химии (8 класс) по теме:
Вариант 1 Тест: « Типы кристаллических решёток»
1.В узлах разных кристаллических решеток могут находиться
1.Атомы 2. Электроны 3.Протоны
4.Ионы 5.Молекулы
2.Выберите вещества, имеющие атомную кристаллическую решетку.
1Графит 3.Алмаз
2.Сульфат меди 4.Оксид кремния
3.Выберите вещества, имеющие ионную кристаллическую решетку:
1. оксид кремния 2.хлорид натрия 3.гидроксид калия 4.сульфат алюминия
4.Атомная кристаллическая решётка характерна для:
a). алюминия и графита б). серы и йода
в). оксида кремния и хлорида натрия г). алмаза и бора
5) Изотопами являются:
а). этан и этен б). О16 и О17
О16 и О17
в). натрий и калий г). графит и азот
6) Вещества, имеющие металлическуюую кристаллическую решётку, как правило:
a). тугоплавки и хорошо растворимы в воде
б). легкоплавки и летучи
в). Тверды и электропроводны
г). Теплопроводны и пластичны
8. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: 1.вода, 2.уксусная кислота (Ch4COOH), 3.сахар (C12h32O11), 4.алмаз? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
9 По формулам приведённых веществ: NaBr, C2h3 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
10.выберите признаки характерные для веществ с молекулярнойой кристаллической решёткой:
- В узлах кристаллической решётки находятся нейтральные атомы
- Это летучие вещества
- Основным агрегатным состоянием — является твердое состояние вещества
- Это тугоплавкие вещества
- В узлах кристаллической решётки находятся полярные и неполярные молекулы
- Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью
- Данные вещества не растворяются в воде
- Это ковкие и пластичные вещества
- В узлах кристаллической решётки находятся положительные и отрицательные ионы
- Это твёрдые и прочные вещества
- Это непрочные вещества
- Частицы в узлах кристаллической решетке связаны друг с другом ионной связью
- Эти вещества имеют металлический блеск
- В узлах кристаллической решётки находятся нейтральные атомы и положительные ионы металла
- Частицы в узлах кристаллической решетке связаны друг с другом силами межмолекулярного взаимодействия
- Представителями являются соли
- Представителями являются простые вещества неметаллы, в обычном состоянии являющиеся газами
- Данные вещества хорошо растворяются в воде
- Растворимость этих веществ зависит от полярности химической связи
- Данные вещества имеют низкую температуру кипения
- Частицы в узлах кристаллической решетке связаны друг с другом металлической связью
- Представителями являются твердые, тугоплавкие неметаллы
- Данные вещества способны проводить электрический ток
Вариант 2 Тест: « Типы кристаллических решёток»
1. Среди перечисленных веществ выберите вещества, которые имеют кристаллическое строение.
Среди перечисленных веществ выберите вещества, которые имеют кристаллическое строение.
1.воск 2.алмаз 3.каменная соль 4.»сухой лед»
2.В узлах разных кристаллических решеток могут находиться
1.атомы 2.электроны 3.протоны 4.ионы 5.молекулы
3. Аллотропией называется:
1. существование для атомов одного и того же элемента нескольких устойчивых изотопов
2. способность атомов элемента образовывать несколько сложных веществ с атомами другого элемента
3. существование нескольких сложных веществ, молекулы которых имеют одинаковый состав, но различное химическое строение
4. существование нескольких простых веществ, образованных атомами одного и того же элемента
5) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
а). молекулярная б). атомная
в). ионная г). металлическая
металлическая
6) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a). тугоплавки и хорошо растворимы в воде
б). легкоплавки и летучи в). Тверды и электропроводны
7. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: 1.калийное удобрение (KCl), 2.речной песок (SiO2) – температура плавления 1710 0C, 3.аммиак (Nh4), 4.поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
8 По формулам приведённых веществ: SiC, CS2 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
9.выберите признаки характерные для веществ с ионной кристаллической решёткой:
- В узлах кристаллической решётки находятся нейтральные атомы
- Это летучие вещества
- Основным агрегатным состоянием — является твердое состояние вещества
- Это тугоплавкие вещества
- В узлах кристаллической решётки находятся полярные и неполярные молекулы
- Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью
- Данные вещества не растворяются в воде
- Это ковкие и пластичные вещества
- В узлах кристаллической решётки находятся положительные и отрицательные ионы
- Это твёрдые и прочные вещества
- Это непрочные вещества
- Частицы в узлах кристаллической решетке связаны друг с другом ионной связью
- Эти вещества имеют металлический блеск
- В узлах кристаллической решётки находятся нейтральные атомы и положительные ионы металла
- Частицы в узлах кристаллической решетке связаны друг с другом силами межмолекулярного взаимодействия
- Представителями являются соли
- Представителями являются простые вещества неметаллы, в обычном состоянии являющиеся газами
- Данные вещества хорошо растворяются в воде
- Растворимость этих веществ зависит от полярности химической связи
- Данные вещества имеют низкую температуру кипения
- Частицы в узлах кристаллической решетке связаны друг с другом металлической связью
- Представителями являются твердые, тугоплавкие неметаллы
- Данные вещества способны проводить электрический ток
Кристаллическая решётка — Химия — Презентации
Кристаллы – твердые вещества, частицы которых образуют периодически повторяющуюся в пространстве структуру – кристаллическую решетку.
Кристаллические решётки веществ — это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства.
Точки размещения частиц называют узлами кристаллической решётки.
В узлах кристаллической решетки могут быть молекулы, атомы или ионы.
Кристаллическая решетка алмаза
- В узлах атомных кристаллических решеток находятся отдельные атомы, которые соединены ковалентными связями.
- Связи между атомами веществ, находящихся в узлах кристаллической решетки прочные, с трудом разрушаются.
- Вещества с атомной кристаллической решеткой имеют высокие температуры плавления, обладают повышенной твердостью.
- Алмаз – самый твердый природный материал
Каркасные (алмаз, кремний )
Слоистые (графит)
Цепочные (карбин)
Кристаллическая решетка йода
- В узлах располагаются молекулы веществ.

- Химические связи в них ковалентные, как полярные, так и неполярные.
- Связи между молекулами веществ слабые, легко разрушаются
- Вещества с молекулярной кристаллической решеткой имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии. (О 2 , N 2 , СО 2 , Н 2 О)
Кристаллическая решетка металла
- В узлах металлических кристаллических решёток находятся атомы и ионы металла.
- Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Кристаллическая решетка хлорида натрия
- В узлах ионных кристаллических решеток находятся ионы.
- Связи между ионами в кристалле очень прочные и устойчивые.
- Вещества с ионной решеткой обладают высокой твердостью и прочностью, тугоплавки и нелетучи.
Ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов.
Кристаллическая решетка — металл — Большая Энциклопедия Нефти и Газа, статья, страница 4
Кристаллическая решетка — металл
Cтраница 4
Для электронов кристаллическая решетка металла играет такую же роль, как линии, нанесенные на стекле для видимого света. И наблюдающаяся дифракция указывает на идентичность поведения пучка электронов и световых волн.
[46]
Сравнивая описанные выше кристаллические решетки металлов и соли ( хлористого натрия), легко объяснить, поч: ему металлы могут быть деформированы без разрушения, а соли разрушаются даже при незначительной деформации их кристаллов. При деформировании кристалла металла происходит смещение атомов ( ионов) в металле друг относительно друга. Электрическое равновесие, нарушение которого привело бы к разрушению кристалла металла, немедленно восстанавливается благодаря возможности беспрепятственного перемещения в междуузлиях электронов, имеющих малые размеры. В результате в каждой части объема кристалла сразу же восстанавливается равновесие внутренних сил.
В результате в каждой части объема кристалла сразу же восстанавливается равновесие внутренних сил.
[47]
Принципиальное отличие кристаллических решеток металлов от кристаллических решеток солей заключается в следующем.
[49]
Основными несовершенствами кристаллической решетки металлов считают точечные, линейные и поверхностные.
[51]
В узлах кристаллической решетки металлов, в отличие от неметаллов, находятся атомы, потерявшие один или несколько валентных электронов, так называемые ион-атомы.
[52]
В узлах кристаллических решеток металлов расположены положительные ионы, между которыми беспорядочно, подобно газовым молекулам, движутся обобществленные электроны, отщепившиеся от атомов при образовании кристалла. Эти электроны являются проводниками тока и одновременно удерживают вместе положительные ионы решетки. Таким образом, сопротивление металлов возрастает с увеличением температуры.
Таким образом, сопротивление металлов возрастает с увеличением температуры.
[53]
Особенность строения кристаллической решетки металлов заключается в том, что одни ее узлы заняты атомами, а другие положительными ионами. В промежутках между узлами перемещаются свободные электроны, образующие как бы электронный газ. Нахождение свободных электронов в металлических кристаллах обусловливают общие свойства металлов, их электро — и теплопроводность. Они же объясняют способность металлов к механической деформации.
[55]
Основными типами кристаллических решеток металлов являются следующие: кубическая гранецентрированная, кубическая объемноцентрированная, гексагональная решетка.
[56]
В узлах кристаллической решетки металла находятся положительно заряженные ионы. В результате их взаимодействия с полярными молекулами растворителя они отрываются от кристалла и переходят в раствор. Параллельно происходит противоположный процесс перехода ионов из раствора в металл под влиянием поля кристаллической решетки. Раствор приобретает положительный заряд. Положительно заряженные ионы не удаляются от поверхности металла, а вследствие электростатических взаимодействий скапливаются у поверхности. В результате образуется двойной электрический слой, который можно представить себе в виде конденсатора, отрицательная обкладка которого образована металлом ( избыточными электронами), а положительная — слоем катионов в растворе, прилегающим к металлу. Между разноименно заряженными обкладками возникает скачок потенциала. Если в начальный момент скорость перехода ионов в раствор vi меньше скорости перехода ионов из раствора в металл vz, то поверхность металла зарядится положительно, и отрицательно заряженные ионы притянутся к поверхности металла, создавая избыток отрицательных зарядов.
В результате их взаимодействия с полярными молекулами растворителя они отрываются от кристалла и переходят в раствор. Параллельно происходит противоположный процесс перехода ионов из раствора в металл под влиянием поля кристаллической решетки. Раствор приобретает положительный заряд. Положительно заряженные ионы не удаляются от поверхности металла, а вследствие электростатических взаимодействий скапливаются у поверхности. В результате образуется двойной электрический слой, который можно представить себе в виде конденсатора, отрицательная обкладка которого образована металлом ( избыточными электронами), а положительная — слоем катионов в растворе, прилегающим к металлу. Между разноименно заряженными обкладками возникает скачок потенциала. Если в начальный момент скорость перехода ионов в раствор vi меньше скорости перехода ионов из раствора в металл vz, то поверхность металла зарядится положительно, и отрицательно заряженные ионы притянутся к поверхности металла, создавая избыток отрицательных зарядов.
[57]
Страницы:
1
2
3
4
Кристаллические решетки, подготовка к ЕГЭ по химии
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.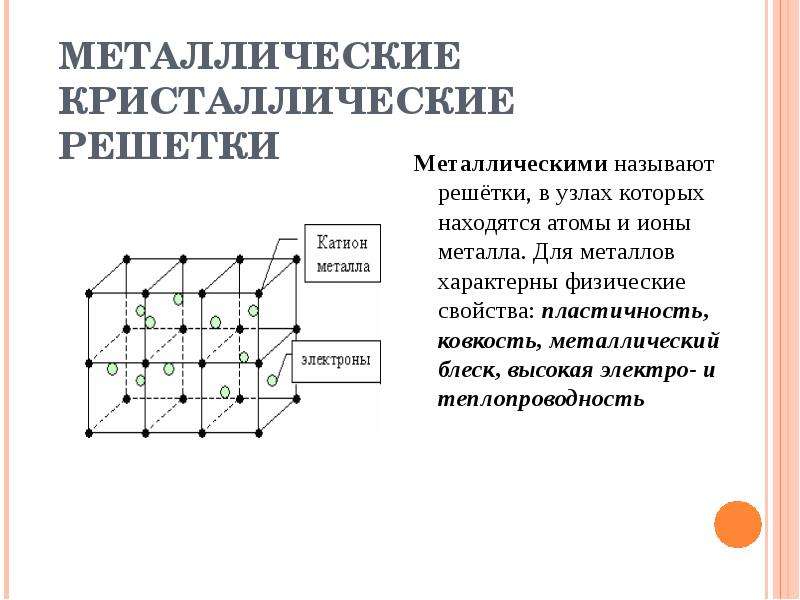
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Кристаллические решетки
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном, твердом и жидком. Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными.
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H20), так и неполярными (N2, O3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H2, O2, CL2, N2, I2), трех – (O3), четырех – (P4), восьмиатомными (S8) молекулами.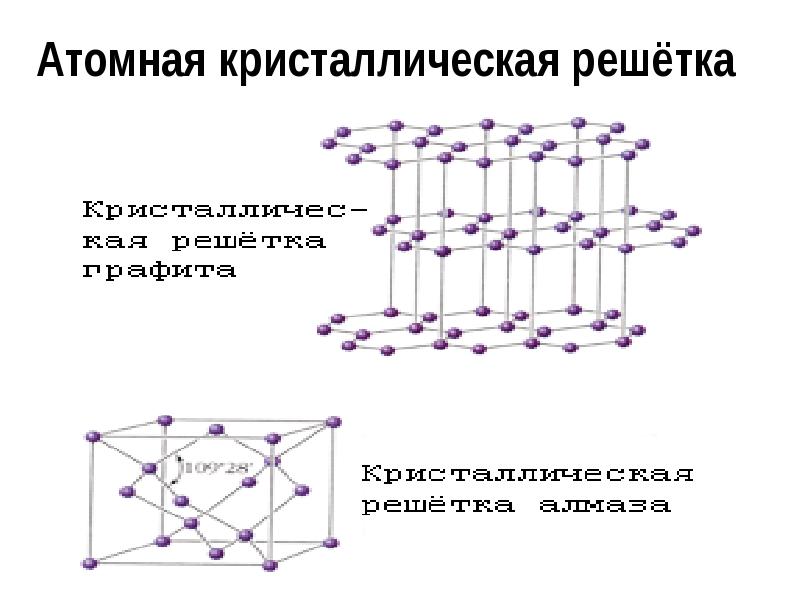 Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
кристаллов
кристалл
Кристаллы
Кристаллы — твердые тела с дальним порядком,
периодичность. Атомы в кристалле регулярно повторяются.
Модель называется кристаллической решеткой . А
кристалл — это повторяющийся массив. При описании этой структуры мы
должен различать образец повторения (решетка
тип ) и то, что повторяется (элементарная ячейка ).Таким образом, свойства кристалла можно связать со свойством
элементарной ячейки.
Самое фундаментальное свойство кристалла
решетка — это ее симметрия . Симметрия ограничивает единицу
Симметрия ограничивает единицу
ячейки определенной формы, чтобы можно было покрыть все пространство
без пропусков и нахлёстков. В 2-х измерениях,
например, пятиугольники не могут удовлетворить это,
, но квадраты, прямоугольники и шестиугольники могут.
В 3-х измерениях идея
подобное — элементарные ячейки складываются как коробки, заполняя пространство, делая
кристалл. Обычно выделяют семь типов кристаллов.
латексы:
| Триклиник | a> |
| Моноклиника | a> |
| Орторомбическая | a> |
| Тетрагональная | a = b> |
| Тригональный | a = b = c a = b <2p / 3; g> |
| Шестигранник | a = b> |
| Кубический | a = b = c a = b = g = p / 2 |
Кристаллы образуются из-за притяжения между атомами.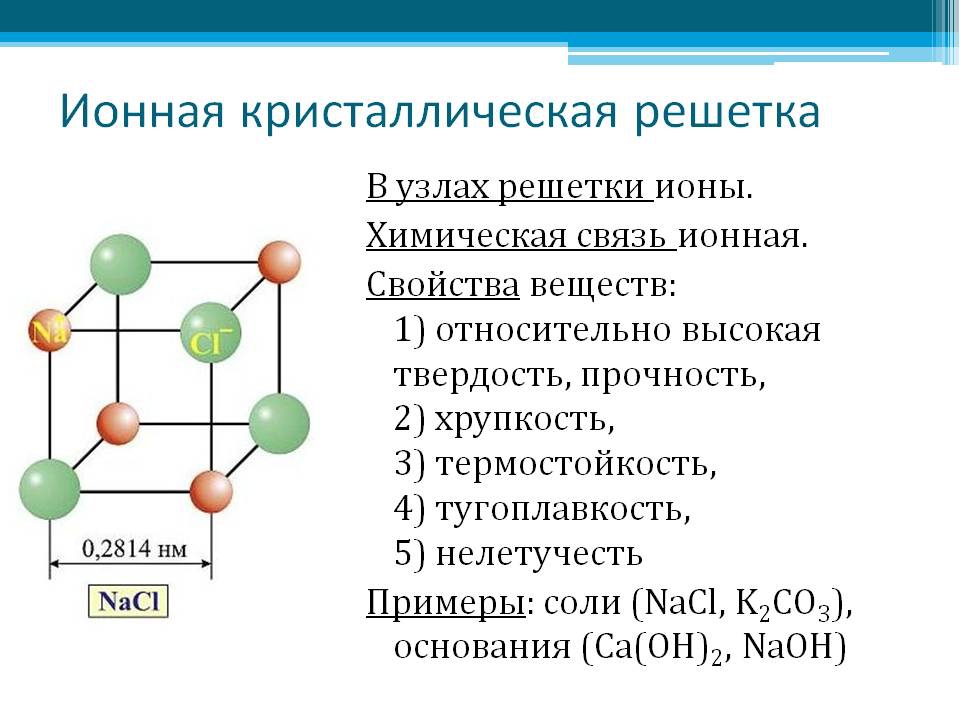 Из-за
Из-за
их привлекательность, благоприятно иметь много соседей и
неблагоприятный — чтобы было много пустого места. Таким образом, согласование
число , или число соседних атомов, важно.
В 2-х измерениях . На кв.
решетки , как показано слева, координационное число
4 (количество кругов, касающихся любого человека). В
Координационная геометрия — квадратная, как показано ниже.Пустые места
между атомами междоузлий . С
каждого атома касаются 4 кружка, междоузлия
тоже 4-х координатная, и геометрия тоже квадратная. В этом
Например, количество межстраничных сайтов равно количеству
круги.
Поскольку атомы притягиваются друг к другу, возникает
тенденция к минимизации пустого пространства. Эффективность упаковки
(PE) — это доля кристалла (или элементарной ячейки) на самом деле
заняты атомами.Оно всегда должно быть меньше 100%, потому что
невозможно упаковать сферы (атомы обычно сферические)
без пустого пространства между ними.
P.E. = (площадь кругов внутри блока
ячейка) / (площадь элементарной ячейки)
Что касается квадратной решетки кругов, мы можем
рассчитать эффективность упаковки (PE) для этой конкретной решетки
следующим образом:
стр.E. = п р 2
/ (2r) 2 = p / 4 = 78,54%.
Межстраничные сайты должны занимать 100% — 78,54% = 21,46%.
Для гексагональной решетки :
атомное координационное число 6, но межузельная координация
номер 3
геометрия координации атомов гексагональная, но межузельная
Координационная геометрия треугольная
эффективность упаковки 90.69%
Как видите, в этой упаковке вдвое больше
этих трехкоординатных промежуточных сайтов в виде кружков — для
в каждом круге один указывает влево, а другой указывает
верно. Таким образом, эти сайты намного меньше, чем в
квадратная решетка. Большее координационное число (больше связей) и
Большее координационное число (больше связей) и
большая эффективность упаковки предполагает, что это будет более
решетка более стабильная, чем квадратная.
Трехмерный
у нас есть выбор.
Простая кубика (sc) — самая простая и
часто наблюдается для металлов, где встречается слишком плотная упаковка
большее отталкивание катионов. Вот два способа нарисовать юнит
ячейка для простой кубической структуры. В элементарной ячейке на
слева, атомы в углах обрезаются, потому что только часть (в
этот случай 1/8) принадлежит этой ячейке.Остальная часть атома принадлежит
в соседние ячейки, как показано на рисунке ниже. (Я взял
картинки из Структуры
Кристаллы) Картинка справа подчеркивает, что фактически имеется единиц.
атом на элементарную ячейку .
В трехмерном изображении эффективность упаковки определяется выражением:
P. E. = (объем сфер в элементарной ячейке)
E. = (объем сфер в элементарной ячейке)
/ (объем ячейки)
Для простой кубической решетки это: P.E. = (1/8
х 8) (4/3 п р 3 ) / (2 р) 3
= P / 6 = 52,35%.
Это низкое значение неудивительно. Помните, что
Двумерная квадратная решетка неэффективно использует пространство. Простая кубическая
решетка является его трехмерным аналогом и также содержит много пустого пространства.
Кстати, каждая элементарная ячейка содержит одно большое межузельное пространство .
участок в его центре (47,65% объема). Всего 8
атомов, соприкасающихся с этим пространством, поэтому межстраничный
координационное число 8 , геометрия кубическая (a
куб имеет 8 углов).
Поскольку каждая элементарная ячейка содержит (8 x 1/8 =) 1 атом и 1
междоузлия, количество атомов и междоузлий
тоже самое. Расположение относительно любого отдельного атома в
простая кубическая решетка задается 6 соседними атомами, поэтому
атомное координационное число — 6 . Координация
Координация
геометрия — октаэдр (у октаэдра 6 углов).
Есть две возможности для в закрытой упаковке
структуры : Кубик с плотной упаковкой (ccp)
и шестигранник с плотной упаковкой (hcp)
Cubic Close Packed (ccp) также поставляется с
другое название, Face Centered Cubic (fcc) .
Эта ячейка имеет дополнительный атом на каждой грани простого
кубическая решетка — отсюда и название «кубическая гранецентрированная».Эффективный
количество атомов 3 на элементарную ячейку . На рисунке ниже используются различные цвета, чтобы помочь увидеть, как
ячейки складываются в твердое тело (все атомы одинаковые).
Элементарная ячейка здесь показана в развернутом виде для
видимость. На самом деле угловые атомы касаются одного
в центре лица. Название «плотно упакованный»
относится к эффективности упаковки 74. 05%. Никакая другая упаковка не может
05%. Никакая другая упаковка не может
превышают эту эффективность (хотя есть и другие с таким же
эффективность упаковки).
Если мы сложим ячейки в решетку, мы заметим, что атомы
сформировать диагональные слои — причина цвета в том, чтобы сделать эти
выделяться, быть заметным. Обратите внимание, что диагональные слои также образуются вдоль нашего
Поле зрения. Поскольку они пересекают другие слои, каждый
слой будет содержать все три цвета.
Эти слои можно увидеть следующим образом:
закрытые упакованные конструкции.
Если мы начнем с шестиугольного массива сфер (синий
Слой «А»), это была бы самая упакованная аранжировка —
нет возможности упаковать больше сфер в данную область. В
второй плотноупакованный слой (золотой слой «B»), также
шестиугольные, будут располагаться поверх первых, поэтому они приживаются к
отверстия, указывающие влево в первом. Все сферы на самом деле
того же атома, цвета должны помочь вам отслеживать слои.
Обратите внимание, что есть два отдельных варианта для второго
слой; в анимации (все взяты из Структуры
Кристаллы) выше, мы произвольно выбрали покрытие
отверстия, указывающие влево. Мы можем положить их на все
«указывающие влево» промежутки или все
«указывающие вправо» пустоты. Если мы положим их на
указывающие вправо промежутки, мы создаем другой слой, помеченный
зеленый или «C» слой. Помните, что есть
в два раза больше межстраничных сайтов, чем сфер. (Один
указывающий влево и один направо).
Мы можем продолжать складывать эти слои в любом порядке, при условии
что нет двух одинаковых слоев рядом. Кубическое закрытие ( ccp
= fcp ) упакованная структура может быть построена из
A — B — C — A — B — C . . . . .
последовательность. Альтернативная последовательность может быть B — A — C.
— Б — А — С … который представляет ту же структуру. В
В
полученная структура является трехмерным аналогом гексагональной
упаковка в самолет — самый эффективный способ упаковать
сферы. Примеры металлов с ГЦК / ЦПУ включают:
никель, серебро,
золото,
медь,
и алюминий.
Шестигранник с закрытой упаковкой (hcp) . Другой способ
при наложении этих слоев следует исключить слои «C»
вместе и чередовать только «А» и «Б».Это также плотноупакованный массив с 3 атомами на элементарную ячейку , но симметрия
разные. Он называется Hexagonal Close.
Упакованный (ГПУ). Шестигранник плотноупакованный
структура может быть сделана путем наложения слоев в A — B — A —
Б — А — Б. . . . . последовательность. An
альтернативная последовательность: A — C — A — C — A …
Примеры ГПУ-металлов включают цинк,
титан
и кобальт.Элементарная ячейка представлена ниже:
Сравнение fcc / ccp и hcp.
Обе структуры состоят из уложенных друг на друга гексагональных слоев. Их
эффективность упаковки идентична и составляет:
P.E. = (объем сфер в элементарной ячейке)
/ (объем ячейки)
Для ccp и hcp: P.E. = (4) (4/3 p r 3 ) / (2 9/2 r 3 )
= P / (3 x 2 1/2 ) =
74.05% — максимально возможное.
Так как межстраничные сайты могут быть построены только на одном слое или
между двумя слоями и hcp, и ccp имеют одно и то же межстраничное объявление .
сайты . Есть три типа межстраничных сайтов:
тригональные, тетрагональные и октаэдрические. Трехкоординатный тригональный
интерстициальные сайты появляются внутри одного слоя, два других — между
слои. Рассмотрим пару слоев — синий и золотой.
Под каждым атомом золота находится небольшое пространство, окруженное 4
атомы в тетраэдрическом расположении . Это 4 —
Это 4 —
координата четырехгранный межузельный участок
Полости с повторяющимися отверстиями в двух слоях окружены
на 6 атомов в октаэдрической геометрии.Это 6 —
координата октаэдрическая межузельная позиция.
Между этими
две плотно упакованные структуры. Координационная геометрия по каждому
атом показан ниже. Обратите внимание, что хотя обе структуры имеют CN = 12
аранжировки немного отличаются. В hcp топ и
три нижних расположены прямо друг над другом.В ccp они
пошатнулся.
Еще одно отличие связано с порядком упаковки. В ГПУ
в каждом втором слое есть повторяющиеся дыры. Таким образом, если мы посмотрим
прямо на конструкции мы можем видеть крошечные каналы через
структура ГПУ. Они отсутствуют в ccp.
Body Center Cubic (bcc) имеет дополнительный
атом в центре кубической ячейки.
Атомы на картинке выше разбросаны для лучшего обзора. Ясно
что фактически имеется 1 + 8 * 1/8 = 2 атома на элементарную ячейку . Эффективность упаковки ОЦК значительно выше, чем у
простая кубическая, но ниже, чем у закрытой упаковки
единицы:
P.E. = (2) (4/3 p r 3 )
/ [(2 r) 3 /3 3/2 ] = 3 1/2 p / 8 = 68.02%
Более высокое координационное число и эффективность упаковки означают, что
эта решетка использует пространство более эффективно, чем простая кубическая. BCC
решетки очень распространены в металлах, примеров : железо,
хром
вольфрам
и натрий.
Ионные соединения обычно имеют больше
сложные конструкции, чем металлы. Вероятно, потому что:
- В решетке есть как минимум два вида частиц,
вообще разных размеров.
- Катионы притягивают анионы, но, как ионы, отталкивают один
Другой. Конструкция должна уравновешивать оба типа сил.
- Многие ионы (например, нитрат, карбонат, азид) очень
несферической формы. Таким образом, они будут упаковываться по-разному
в разные стороны.
Цезий
Хлорид Хлорид цезия кристаллизуется в
кубическая решетка.Элементарная ячейка может быть изображена, как показано.
(Cs + бирюзовый, Cl —
золото). Ионы немного раздвинуты, что позволяет
интерьер для просмотра.
Один из способов описать кристалл — это рассмотреть
катионы и анионы отдельно. Начнем с большего (золотого
окрашенные) Cl — ионов. Игнорируя Cs + , мы
обратите внимание, что сами Cl — образуют простой кубический анион
подрешетка.Учитывая только Cs + , они образуют
простая кубическая катионная подрешетка.
Мы можем описать структуру CsCl как две взаимопроникающие
простые кубические катионные и анионные подрешетки. (Две подрешетки
не обязательно одинаковы, хотя в этом примере они совпадают.)
В простой кубической решетке есть большие межузельные узлы
между каждыми 8 атомами. Следовательно, CsCl можно получить, поместив
размещение Cl — на интерстициальных сайтах.В
тот же кристалл можно построить в обратном порядке, сделав sc
структура Cl- и размещение Cs + в межстраничном
сайтов
Окрестность, в которой находится каждый ион, очевидна
от элементарной ячейки. Каждый Cs + окружен 8 Cl —.
(так что CS +
координационное число 8 ) по углам каждого куба.Каждый Cl — также окружен 8 Cs + на
углы куба, поэтому Cl —
имеет CN = 8 .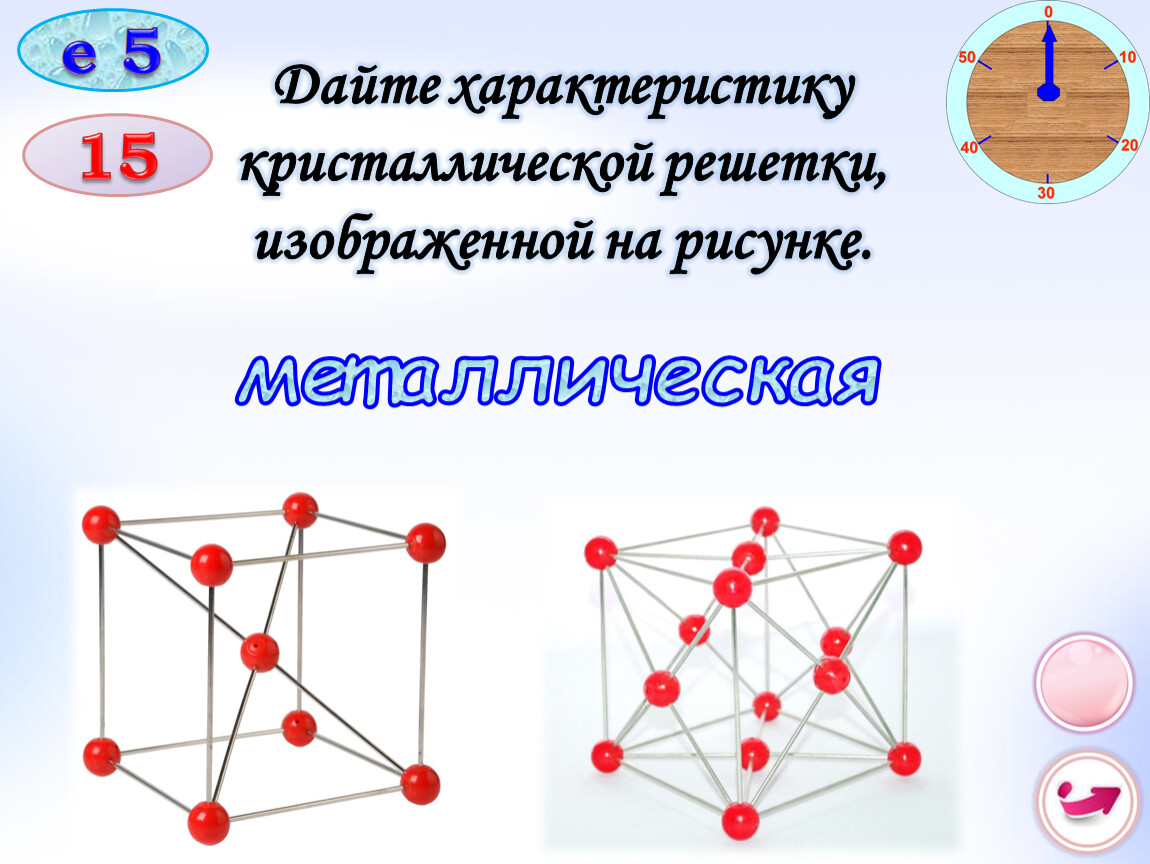
Если бы мы попытались построить подрешетку Cl —
как ГЦК, межузельные узлы для этой решетки не будут
достаточно большой, чтобы вместить ионы Cs + . Меньший Na +
ионы, с другой стороны, могут поместиться в эти полости.Как
в результате Хлорид натрия кристаллизуется в кубической решетке
где (красный на картинке) ионы Cl — образуют ГЦК
подрешетка. Na + (синий) также образуют ГЦК
подрешетка.
6 Cl окружают каждый Na и 6 Na вокруг каждого Cl.
Мы можем рассматривать NaCl как состоящий из решеток ГЦК / ГПУ.
взаимопроникающие. Na занимают октаэдрические позиции в Cl.
подрешетки, а Cl занимают октаэдрические позиции в Na
подрешетка.
Эти два кристалла имеют стехиометрию MX. Что насчет MX n ,
где n> 1? Каждая элементарная ячейка должна иметь в n раз больше X, чем M.
Базы данных по кристаллической структуре
Следующие онлайн-ресурсы содержат файлы, которые можно загрузить для интерактивного просмотра либо из автономного программного обеспечения для визуализации, либо просмотреть с веб-сайта в виде Java-апплета.
- База данных по кристаллической структуре американских минералогов. Этот сайт представляет собой интерфейс к базе данных кристаллических структур, которая включает все структуры, опубликованные в American Mineralogist, Canadian Mineralogist и European Journal of Mineralogy. База данных поддерживается Минералогическим обществом Америки и Минералогической ассоциацией Канады и финансируется Национальным научным фондом. Сайт доступен для поиска по минералу, автору, химическому составу или параметрам ячейки и симметрии. (подробнее)
- Структуры кристаллической решетки. Эта страница, поддерживаемая Лабораторией военно-морских исследований США, предлагает краткий указатель общих структур кристаллической решетки, в том числе из минералов и неминералов. Несколько различных графических представлений, интерактивный Java-апплет структуры и полезную информацию о решетках можно получить, щелкнув изображения кристаллических структур. (подробнее)
- Кристаллические структуры.
 На этом веб-сайте представлены интерактивные Java-апплеты различных кристаллических структур минералов и неминералов.Аплет Java позволяет пользователю вращать и изменять размер кристалла. На сайте также есть ссылки на другие веб-страницы о кристаллических структурах. (подробнее)
На этом веб-сайте представлены интерактивные Java-апплеты различных кристаллических структур минералов и неминералов.Аплет Java позволяет пользователю вращать и изменять размер кристалла. На сайте также есть ссылки на другие веб-страницы о кристаллических структурах. (подробнее) - Кристаллографическая база данных минералов и их структурных аналогов. Эта доступная для поиска база данных, поддерживаемая Российским фондом фундаментальных исследований, включает 4785 записей (2365 уникальных названий минералов). Каждый минерал можно искать по названию, спецификации, кристаллохимической формуле или характеристикам кристаллической структуры.Информация о кристаллической структуре включает название минерала, спецификацию, кристаллохимическую формулу, пространственную группу, параметры элементарной ячейки, координаты, тепловые факторы и расположение атомов, а также ссылки на литературу по определению кристаллической структуры. (подробнее)
- Открытая база данных кристаллографии.
 Эта база данных является сестрой Базы данных по кристаллической структуре американских минералогов (AMCSD) и содержит все данные, хранящиеся в AMCSD, а также данные, депонированные отдельными лицами и лабораториями.База данных доступна для поиска по тексту, словам, элементам, объему или количеству элементов. Данные о кристаллической структуре можно загрузить в формате CIF, и пользователи могут загружать данные о кристаллах в виде файлов CIF или REF. (подробнее)
Эта база данных является сестрой Базы данных по кристаллической структуре американских минералогов (AMCSD) и содержит все данные, хранящиеся в AMCSD, а также данные, депонированные отдельными лицами и лабораториями.База данных доступна для поиска по тексту, словам, элементам, объему или количеству элементов. Данные о кристаллической структуре можно загрузить в формате CIF, и пользователи могут загружать данные о кристаллах в виде файлов CIF или REF. (подробнее) - ICSD Web: База данных неорганических кристаллов. Этот сайт содержит бесплатную демонстрационную версию базы данных неорганических кристаллов. Эта база данных содержит 3325 структурных подмножеств из 76480 неорганических структур по состоянию на 2004 год. Демонстрационная версия может быть запрошена и доступна через веб-интерфейс, который позволяет использовать несколько методов поиска, а полученные кристаллические структуры затем можно просмотреть в Интернете (с помощью CHIME плагин) или загружены для просмотра с помощью другого программного обеспечения для визуализации.
 На сайте также представлены обновления с исправлениями ошибок, условия использования и цены, советы по отображению структур, галерея изображений, флэш-ролик и инструкции по установке сервера ICSD. (подробнее)
На сайте также представлены обновления с исправлениями ошибок, условия использования и цены, советы по отображению структур, галерея изображений, флэш-ролик и инструкции по установке сервера ICSD. (подробнее)
Кубические кристаллические решетки
Когда вещества образуют твердые тела, они имеют тенденцию собираться вместе, образуя упорядоченные массивы атомов, ионов или молекул, которые мы называем кристаллами . Почему возникает этот порядок и какие возможны договоренности?
Это некоторые из вопросов, которые мы рассмотрим в этом уроке.
Мы ограничимся рассмотрением кубических кристаллов , которые образуют простейшие и наиболее симметричные из всех типов решеток. Кубические решетки также очень распространены — они образованы многими металлическими кристаллами, а также большинством галогенидов щелочных металлов, некоторые из которых мы рассмотрим в качестве примеров.
1 Плотная упаковка одинаковых сфер
Кристаллы, конечно, трехмерные объекты, но мы начнем с изучения свойств массивов в двухмерном пространстве. Это упростит разработку некоторых основных идей без дополнительных сложностей, связанных с визуализацией в трехмерном пространстве, что часто требует некоторой практики.
Это упростит разработку некоторых основных идей без дополнительных сложностей, связанных с визуализацией в трехмерном пространстве, что часто требует некоторой практики.
Кубическая и шестиугольная плотная упаковка
Предположим, у вас есть дюжина или около того шариков. Как их сложить одним компактным слоем на столешнице? Очевидно, они должны контактировать друг с другом, чтобы минимизировать площадь, которую они покрывают. Оказывается, есть два эффективных способа достижения этого, в зависимости от количества точек контакта между данным атомом и его ближайшими соседями.
Существенная разница между кубической и гексагональной плотной упаковкой иллюстрируется количеством крошечных синих отметок «x» на двухмерных изображениях, показанных здесь. Любой шарик внутри массива с квадратной упаковкой находится в контакте с четырьмя другими шариками, в то время как это число возрастает до шести в структуре с гексагональной упаковкой.
Также должно быть очевидно, что последняя схема охватывает меньшую площадь, а это означает, что она содержит меньше пустого пространства и, следовательно, является более эффективным устройством упаковки. Из геометрии можно показать, что квадратная упаковка сфер покрывает 78 процентов площади, в то время как гексагональная упаковка дает 91 процент покрытия.
Из геометрии можно показать, что квадратная упаковка сфер покрывает 78 процентов площади, в то время как гексагональная упаковка дает 91 процент покрытия.
Если мы перейдем от мира мрамора к миру атомов, какую упаковку предпочтут атомы данного элемента?
Если атомы идентичны и связаны друг с другом в основном дисперсионными силами, которые являются полностью ненаправленными, они предпочтут структуру, в которой как можно больше атомов могут находиться в прямом контакте.Это, конечно, будет шестиугольное расположение.
Направленные химические связи между атомами имеют большое влияние на упаковку. Версия гексагональной упаковки, показанная справа, представляет собой углерод, известный как графит , который образует двумерные листы. Каждый атом углерода внутри листа связан с тремя другими атонами углерода. В результате получается просто основная гексагональная структура с отсутствием некоторых атомов. [Подробнее о графите здесь]
Координационное число 3 отражает sp 2 -гибридизацию углерода в графите, приводящую к плоско-тригональной связи и, следовательно, к структуре листа.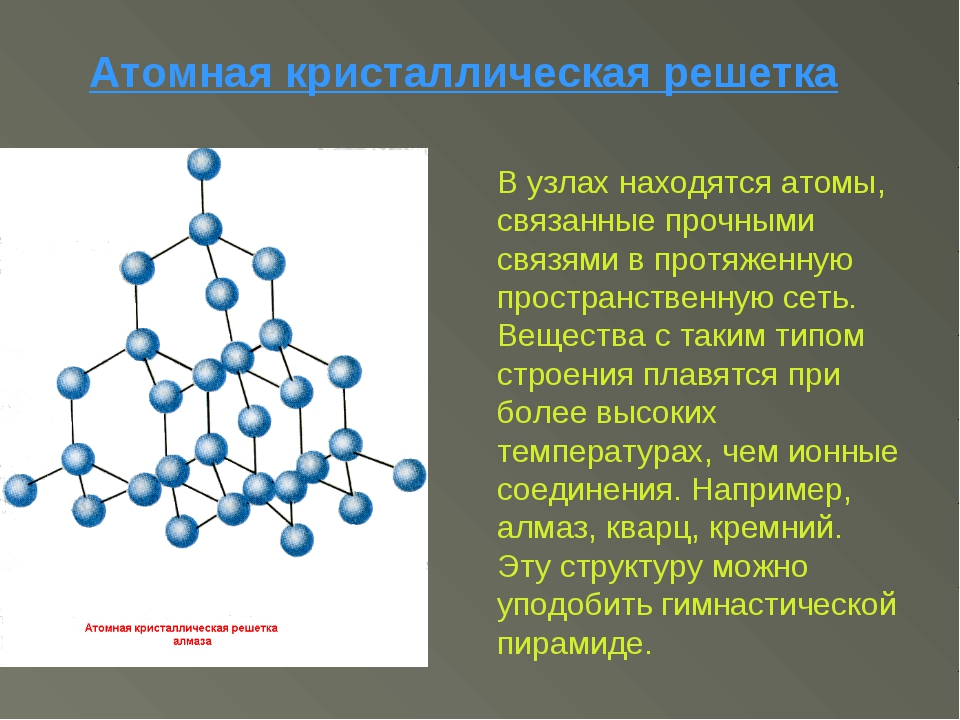 Соседние листы связаны слабыми дисперсионными силами, позволяя листам скользить друг по другу и приводя к смазывающим и отслаивающимся свойствам графита.
Соседние листы связаны слабыми дисперсионными силами, позволяя листам скользить друг по другу и приводя к смазывающим и отслаивающимся свойствам графита.
2 Кристаллические решетки
Порядок, лежащий в основе кристаллического твердого тела, может быть представлен массивом регулярно расположенных точек, указывающих на расположение основных структурных единиц кристалла. Этот массив называется кристаллической решеткой.
Кристаллические решетки можно рассматривать как построенные из повторяющихся единиц, содержащих всего несколько атомов.Эти повторяющиеся единицы действуют как резиновый штамп: прижмите его к бумаге, переместите («переместите») на величину, равную шагу решетки, и снова проштампуйте бумагу.
Серые кружки представляют собой квадратный массив точек решетки. | Оранжевый квадрат — это простейшая элементарная ячейка, которую можно использовать для определения двумерной решетки. | Построение решетки путем перемещения («перевода») элементарной ячейки в серию шагов, |
Хотя настоящие кристаллы на самом деле не растут таким образом, этот процесс концептуально важен, потому что он позволяет нам классифицировать тип решетки с точки зрения простой повторяющейся единицы, которая используется для ее «построения».Мы называем эту форму элементарной ячейкой .
Для определения элементарной ячейки данной кристаллической решетки можно использовать любое количество примитивных форм. Тот, который на самом деле используется, в значительной степени является вопросом удобства, и он может содержать точку решетки в своем центре, как вы видите в двух из показанных здесь элементарных ячеек. В общем, лучшая элементарная ячейка — это самая простая ячейка, способная построить решетку.
Здесь показаны элементарные ячейки для плотноупакованных квадратных и гексагональных решеток, которые мы обсуждали в начале этого урока.Обратите внимание, что мы используем ромб (а не шестиугольник) для определения шестиугольной решетки, потому что это проще.
В обеих этих решетках углы элементарных ячеек центрированы в точке решетки. Это означает, что атом или молекула, расположенная в этой точке реальной кристаллической решетки, используется совместно с соседними ячейками. Как здесь более ясно показано для двумерной решетки с квадратной упаковкой, одна элементарная ячейка может претендовать на «владение» только одной четвертью каждой молекулы и, таким образом, «содержит» 4 × × = 1 молекулу.
Графитовая форма углерода основана на гексагональной решетке, но направленные связи не позволяют ей быть плотно упакованной. Тем не менее его элементарная ячейка также представляет собой ромб, хотя и включает в себя два атома углерода.
Обратите внимание, что для создания этой структуры из элементарной ячейки нам необходимо сместить ячейку в обоих направлениях: x и y , чтобы оставить пустые места в нужных местах.В качестве альтернативы мы могли бы использовать правильные шестиугольники в качестве элементарных ячеек, но сдвиги x + y все равно потребуются, поэтому обычно предпочтительнее более простой ромб.
Как вы увидите в следующих разделах, пустые пространства внутри этих элементарных ячеек играют важную роль при переходе от двухмерных решеток к трехмерным.
3 Кубических кристалла
Чтобы сохранить этот урок в разумных рамках, мы ограничиваем его в основном кристаллами, принадлежащими так называемой кубической системе .Поступая таким образом, мы можем развить основные концепции, полезные для понимания более сложных структур (как будто в одних кубиках недостаточно усложнений!) Но, кроме того, кубические кристаллы встречаются очень часто; большинство металлических элементов имеют кубическую структуру, как и обычная соль, хлорид натрия.
Обычно мы думаем о кубической форме с точки зрения равенства длин ее кромок и углов 90 ° между ее сторонами, но есть другой способ классификации форм, который химики считают очень полезным.Это нужно для того, чтобы посмотреть, какие геометрические преобразования (например, вращения вокруг оси) мы можем выполнить, чтобы внешний вид остался неизменным. Например, вы можете повернуть куб на 90 ° вокруг оси, перпендикулярной любой из его шести граней, не внося в него никаких видимых изменений. Мы говорим, что куб имеет три взаимно перпендикулярных оси вращения четырехкратного вращения , сокращенно C 4 осей. Но если задуматься, куб также можно вращать вокруг осей, проходящих между противоположными углами; в этом случае для прохождения полного круга требуется три поворота на 120 °, поэтому эти оси (также четыре) являются тройными или осями C 3 .
Кубическая симметрия — это нечто большее; эта страница NYU показывает все операции симметрии куба; посмотрите это видео для живой демонстрации.
Кубические кристаллы относятся к одной из семи кристаллических систем, узлы решетки которых можно неограниченно расширять, чтобы заполнить трехмерное пространство, и которые могут быть построены путем последовательных перемещений (перемещений) примитивной элементарной ячейки в трех измерениях. Как мы увидим ниже, кубическая система, как и некоторые другие, могут иметь варианты, в которых дополнительные точки решетки могут быть размещены в центре блока или в центре каждой грани.Это дает в общей сложности 14 возможных решеток Браве , на которых основаны все кристаллы (или любой повторяющийся массив точек в трех измерениях).
Три типа кубических решеток
Здесь показаны три решетки Браве, которые образуют кубическую кристаллическую систему.
Структурные примеры всех трех известны, при этом гораздо более распространены тела и лицо (BCC и FCC); большинство металлических элементов кристаллизуются в одной из этих последних форм.Но хотя простая кубическая структура сама по себе необычна, оказывается, что многие структуры ОЦК и ГЦК, состоящие из ионов, можно рассматривать как взаимопроникающие комбинации двух простых кубических решеток, одна из которых состоит из положительных ионов, а другая — из отрицательных. Обратите внимание, что только структура ГЦК, которую мы опишем ниже, представляет собой решетку с плотной упаковкой внутри кубической системы.
4 Плотно упакованные решетки в трех измерениях
Плотноупакованные решетки обеспечивают максимальное взаимодействие между атомами.Если эти взаимодействия в основном являются привлекательными, то плотная упаковка обычно приводит к более энергетически стабильным структурам. Эти геометрические формы решетки широко используются в металлических, атомных и простых ионных кристаллах.
Как мы указывали выше, гексагональная упаковка одного слоя более эффективна, чем квадратная, поэтому мы начнем с этого. Представьте, что мы начинаем с одного слоя зеленых атомов, показанного ниже. Мы назовем это слоем A.
Если мы поместим второй слой атомов (оранжевый) поверх A-слоя, мы ожидаем, что атомы нового слоя будут располагаться в полостях в первом слое.Но если все атомы идентичны, будут доступны только некоторые из этих пустот.
Обратите внимание на диаграмму слева, что есть два класса пустот между атомами A; один набор (окрашен в синий цвет) имеет вершину, направленную вверх, а другой набор (не окрашенный) имеет вершины, направленные вниз. Каждое пустое пространство представляет собой углубление, в котором могут размещаться атомы второго слоя (B-слоя). Два набора пустот полностью эквивалентны, но только один из этих наборов может быть занят вторым слоем атомов, размер которого аналогичен размерам нижнего слоя.На иллюстрации справа выше мы произвольно разместили атомы B-слоя в синих пустотах, но с таким же успехом могли бы выбрать и белые.
Два варианта третьего слоя приводят к двум различным типам плотноупакованной решетки
Теперь посмотрим, что происходит, когда мы кладем третий слой атомов. Они впишутся в пустоты в B-слое. Как и прежде, есть два набора этих позиций, но, в отличие от случая, описанного выше, они не эквивалентны.
Атомы в третьем слое представлены открытыми синими кружками, чтобы не закрывать слои под ними. На иллюстрации слева этот третий слой размещен на B-слое в местах, которые находятся непосредственно над атомами A-слоя, поэтому наш третий слой — это просто еще один слой A. Если мы добавим еще несколько слоев, вертикальная последовательность A-B-A-B-A-B-A … будет повторяться бесконечно.
На диаграмме справа вверху синие атомы размещены над белыми (незанятыми) пустотами в слое A.Поскольку этот третий слой смещен по горизонтали (на наш взгляд) от слоя A, мы назовем его слоем C. По мере добавления новых слоев атомов последовательность слоев будет A-B-C-A-B-C-A-B-C …, поэтому мы называем это упаковкой ABC.
Для наглядности на следующих диаграммах показаны только три атома слоев A и C. Но на самом деле каждый слой состоит из расширенного гексагонального массива; два слоя просто смещены друг от друга.
Эти два вида вертикального стека в разобранном виде дополнительно иллюстрируют довольно небольшое фундаментальное различие между схемами HCP и FCC, но, как вы увидите ниже, они имеют сильно расходящиеся структурные последствия.Обратите внимание на противоположную ориентацию слоев A и C
.
Гексагональная замкнутая структура
Укладка HCP, показанная слева чуть выше, выводит нас из кубической кристаллической системы в гексагональную, поэтому мы не будем здесь много говорить об этом, за исключением того, что укажем, что у каждого атома есть 12 ближайших соседей: шесть в собственном слое, и по три в каждом слое над и под ним.
Кубическая плотноупакованная структура
Здесь слева мы воспроизводим структуру FCC, показанную выше. Вы заметите, что атомы B-слоя образуют шестиугольник, но это, тем не менее, кубическая структура . Как это может быть? Ответ заключается в том, что стек FCC наклонен по отношению к граням куба и фактически совпадает с одной из трех осей, проходящих через противоположные углы.Чтобы увидеть взаимосвязь, необходимо немного изучить, и мы предоставили вам два представления, чтобы помочь вам. Слева показан куб в нормальной изометрической проекции; тот, что справа, смотрит вниз на вершину куба под слегка наклонным углом.
Обратите внимание, что две заштрихованные плоскости, пересекающие диагонали внутри куба, содержат атомы разных цветов, что означает, что они принадлежат разным слоям стека CCP. Каждая плоскость содержит три атома из B-слоя и три из C-слоя, что снижает симметрию до C 3 , которая должна быть у кубической решетки.
И CCP, и HCP структуры заполняют 74 процента доступного пространства, когда атомы имеют одинаковый размер.
Элементарная ячейка FCC
На рисунке справа показана гранецентрированная кубическая элементарная ячейка плотноупакованной кубической решетки.
Сколько атомов содержится в элементарной ячейке? Каждый угловой атом используется совместно с восемью соседними элементарными ячейками, поэтому одна элементарная ячейка может занимать только 1/8 каждого из восьми угловых атомов.Точно так же каждый из шести атомов с центром на грани принадлежит ячейке только наполовину. В итоге получается (8 × 1/8) + (6 × ½) = 4 атома на элементарную ячейку.
5 Промежуточные пустоты
Атомы в каждом слое этих плотноупакованных стопок находятся в углублении в слое под ним. Как мы объяснили выше, эти пустые пространства не заполнены полностью. (Геометрически невозможно, чтобы более двух одинаковых сфер соприкасались в одной точке.Позже мы увидим, что эти межузельные пустоты иногда могут вмещать дополнительные (но, как правило, более мелкие) атомы или ионы.
Если мы посмотрим сверху двух слоев плотно упакованных сфер, мы можем выделить два класса пустотных пространств, которые мы называем тетраэдрическими и октаэдрическими дырками .
Четырехгранные отверстия
Если мы обратим наше внимание на область на приведенной выше диаграмме, где один атом находится в контакте с тремя атомами в слоях непосредственно под ним, пустое пространство известно как тетраэдрическая дыра .Аналогичное пространство будет находиться между этим единственным атомом и тремя атомами (не показаны), которые будут лежать на нем в расширенной решетке. Любой межузельный атом, который может занимать это место, будет взаимодействовать с четырьмя окружающими его атомами, поэтому это также называется четырехкоординатным межузельным пространством .
Не обманывайтесь этим именем; границами пустотного пространства являются сферические сечения, а не тетраэдры. Тетраэдр — это просто воображаемая конструкция, четыре угла которой указывают на центры четырех атомов, находящихся в контакте.
Восьмигранные отверстия
Точно так же, когда два набора из трех тригонально ориентированных сфер находятся в плотно упакованном контакте, они будут ориентированы на 60 ° друг от друга, а центры сфер будут определять шесть углов воображаемого октаэдра с центром в пустоте между двумя слоями. , поэтому мы называем эти октаэдрических отверстий или шестикоординатными интерстициальными узлами . Октаэдрические сайты больше тетраэдрических.
У восьмигранника шесть углов и восемь сторон. Обычно мы рисуем октаэдры в виде двойной квадратной пирамиды, стоящей на одном углу (слева), но для того, чтобы визуализировать форму октаэдра в плотно упакованной решетке, лучше представить октаэдр как лежащий на одной из его граней (справа). .
Каждая сфера в решетке с плотной упаковкой связана с одним октаэдрическим узлом, тогда как тетраэдрических узлов всего вдвое меньше.Это можно увидеть на этой диаграмме, которая показывает центральный атом в слое B, выровненный с полостями в слоях C и A выше и ниже.
Гранецентрированная кубическая элементарная ячейка содержит одно октаэдрическое отверстие внутри себя, но октаэдрические отверстия, общие с соседними ячейками, существуют в центрах каждого края.
Каждый из этих двенадцати расположенных на краях узлов является общим с четырьмя соседними ячейками и, таким образом, вносит (12 ×) = 3 атома в ячейку.При добавлении к единственному отверстию, содержащемуся в середине ячейки, получается в общей сложности 4 октаэдрических узла на элементарную ячейку. Это то же самое, что мы вычислили выше для числа атомов в ячейке.
6 Некоторые распространенные кубические плотноупакованные структуры
С помощью элементарной тригонометрии можно показать, что атом точно впишется в октаэдрическую позицию, если его радиус на 0,414 больше, чем радиус основных атомов. Соответствующий показатель для меньших тетраэдрических отверстий равен 0.225.
Многие соединения на основе ионов и чистые металлы образуют гранецентрированные кубические (кубические плотноупакованные) структуры. Существование тетраэдрических и октаэдрических дырок в этих решетках дает возможность «чужеродным» атомам занять некоторые или все из этих междоузлий. Чтобы сохранить плотную упаковку, межузельные атомы должны быть достаточно маленькими, чтобы поместиться в эти отверстия, не нарушая решетку основной КПК. Когда эти атомы слишком большие, что обычно имеет место в ионных соединениях, атомы в интерстициальных узлах будут раздвигать основные атомы, так что гранецентрированная кубическая решетка в некоторой степени открывается и теряет свой характер плотной упаковки.
Структура каменной соли
Галогениды щелочных металлов, которые кристаллизуются со структурой «каменной соли», примером которой является хлорид натрия, можно рассматривать либо как структуру ГЦК одного типа ионов, в которой октаэдрические отверстия заняты ионами противоположного заряда, либо как две взаимопроникающие решетки ГЦК, образованные вверх двух видов ионов. Два заштрихованных октаэдра иллюстрируют идентичную координацию двух типов ионов; каждый атом или ион данного вида окружен шестью атомами противоположного типа, в результате чего координация выражается как (6: 6).
Сколько единиц NaCl содержится в элементарной ячейке? Если мы проигнорируем атомы, которые были размещены за пределами ячейки, чтобы построить октаэдры, вы сможете насчитать четырнадцать «оранжевых» атомов и тринадцать «синих». Но многие из них используются совместно с соседними элементарными ячейками.
Атом в углу куба делится на восемь соседних кубов и, таким образом, вносит 1/8 вклад в любую одну ячейку. Точно так же центр ребра является общим для четырех других ячеек, а атом с центром на грани является общим для двух ячеек.Принимая все это во внимание, вы сможете подтвердить следующий результат, показывающий, что в элементарной ячейке такого типа есть четыре единицы AB.
| Оранжевые атомы | Голубые атомы |
|---|---|
| 8 углов: 8 x 1/8 = 1 | 12 в центрах кромок: 12 x ¼ = 3 |
| 6 в центрах граней: 6 x ½ = 3 | 1 в центре корпуса = 1 |
| всего: 4 | всего: 4 |
Если мы примем во внимание фактические размеры ионов (Na + = 116 мкм, Cl — = 167 мкм), очевидно, что ни один ион не поместится в октаэдрические дырки с решеткой КПК, состоящей из других ion, поэтому реальная структура NaCl несколько выходит за рамки модели плотной упаковки.
Модель, заполняющая пространство справа, изображает гранецентрированную кубическую элементарную ячейку из хлорид-ионов (фиолетовый) с ионами натрия (зеленый), занимающими октаэдрические позиции. [источник]
Структура цинковой обманки: несколько тетраэдрических отверстий
Поскольку на каждый атом в плотноупакованной решетке приходится два тетраэдрических узла, мы можем иметь бинарные соединения со стехиометрией 1: 1 или 1: 2 в зависимости от того, заняты ли половина или все тетраэдрические дырки.
Цинковая обманка — это минералогическое название сульфида цинка, ZnS. Неочищенная форма, известная как сфалерит , является основной рудой, из которой получают цинк.
Эта структура состоит в основном из решетки FCC (CCP) атомов серы (оранжевый цвет) (эквивалентен решетке хлорид-ионов в NaCl), в которой ионы цинка (зеленый цвет) занимают половину тетраэдрических узлов. Как и в любой решетке ГЦК, на элементарную ячейку приходится четыре атома серы, и все четыре атома цинка полностью содержатся в элементарной ячейке.
Каждый атом в этой структуре имеет четырех ближайших соседей и, таким образом, имеет тетраэдрическую координацию.
Интересно отметить, что если все атомы заменить углеродом, это будет соответствовать структуре алмаза .
Структура флюорита: все тетраэдрические позиции заняты
Флюорит, CaF 2 , содержащий в два раза больше ионов фторида, чем кальция, использует все восемь тетраэдрических отверстий в решетке CPP ионов кальция (оранжевый), изображенной здесь.Чтобы помочь вам понять эту структуру, мы показали некоторые из октаэдрических узлов в следующей ячейке справа; вы можете видеть, что ион кальция в позиции A окружен восемью ионами фтора, и это, конечно, относится ко всем сайтам кальция. Поскольку каждый ион фтора имеет четыре ближайших иона кальция, координация в этой структуре описывается как (8: 4).
Хотя радиусы двух ионов (F — = 117 пм, Ca 2+ = 126 пм не допускают истинной плотной упаковки, они достаточно похожи, чтобы можно было описать структуру как ГЦК-решетку ионы фтора с ионами кальция в октаэдрических дырках.
7 Простые и объемно-центрированные кубические структуры
В разделе 4 мы видели, что единственная кубическая решетка, допускающая плотную упаковку, — это гранецентрированная кубическая структура. В простейшей из трех типов кубической решетки, в простой кубической решетке , отсутствуют гексагонально расположенные слои, необходимые для плотной упаковки. Но, как показано на этом изображении в разобранном виде, пустое пространство между двумя квадратными слоями этой ячейки представляет собой октаэдрическое отверстие, которое может вместить другой атом, давая упаковку, которая в благоприятных случаях может приближаться к истинной плотной упаковке.Каждый атом B второго слоя (синий) находится в элементарной ячейке, определяемой слоями A выше и ниже нее.
Атомы A и B могут быть одного или разных типов. Если они одинаковы, мы имеем объемно-центрированную кубическую решетку . Если они разные, и особенно если это ионы с противоположным зарядом (как в структуре CsCl), существуют ограничения по размеру: если атом B слишком велик, чтобы поместиться в межузельное пространство, или если он настолько мал, что атом A слои (которые все несут одинаковый электрический заряд) вступают в контакт без достаточного кулоновского притяжения AB, это структурное устройство может быть нестабильным.
Структура хлорида цезия
CsCl — это общая модель для структуры BCC. Как и в случае со многими другими структурами, включающими два разных атома или иона, мы можем рассматривать одну и ту же базовую структуру по-разному. Таким образом, если мы посмотрим за пределы одной элементарной ячейки, мы увидим, что CsCl можно представить как две взаимопроникающие простые кубические решетки, в которых каждый атом занимает октаэдрическую дырку внутри кубов другой решетки.
Что вы должны уметь
Убедитесь, что вы полностью понимаете следующие важные идеи, представленные выше.
- Разница между квадратной и шестиугольной упаковкой в двух измерениях.
- Определение и значение элементарной ячейки.
- Нарисуйте три решетки Браве кубической системы и вычислите количество атомов, содержащихся в каждой из этих элементарных ячеек.
- Покажите, как альтернативные способы наложения трех плотно упакованных слоев могут привести к шестиугольным или кубическим структурам с плотной упаковкой.
- Объясните происхождение и значение октаэдрических и тетраэдрических дырок в плотно уложенных слоях и покажите, как они могут возникать.
Концептуальная карта
Галерея
BIG кристаллы галита (NaCl) в соляной шахте [Merkers] | флюорит (CaF 2 ) [R.Веллера] Цвета из-за примесей | сфалерит (ZnS) |
Другие галереи минералов:
Роджер Веллер, Колледж Кочиз — База данных по минералам — Институт минералов — TheImage
общих кубических структур | Кембриджский центр нитрида галлия
Общие кубические структуры
Кубическая кристаллическая система — один из наиболее распространенных (и, безусловно, самых простых) классов кристаллов.Как следует из названия, все кристаллические структуры этой системы имеют элементарную ячейку кубической формы с длиной ребра, определяемой параметром решетки «а».
Три основных общих представителя:
- простая кубическая структура (sc) (также известная как примитивная кубическая)
- объемно-центрированная кубическая структура (ОЦК)
- гранецентрированная кубическая структура (ГЦК)
Простая кубическая структура (СБН)
В простой кубической структуре есть только одна точка решетки в каждом углу кубической элементарной ячейки.Они отмечают положение либо одного атома, либо одной и той же группы атомов, известного как мотив, который повторяется по всей решетке. Простая кубическая структура с одним атомом на точку решетки относительно редко встречается в природе, поскольку она довольно нестабильна из-за ее низкой эффективности упаковки и небольшого числа ближайших соседей вокруг каждого атома. Сообщается, что полоний (Po) кристаллизуется в простой кубической структуре.
Создайте свою собственную трехмерную бумажную модель простой кубической структуры с помощью наших инструкций по вырезанию и исследуйте ее природу.
Инструкции и обучающие пункты Шаблон
Объемно-центрированная кубическая структура (ОЦК)
Объемно-центрированная кубическая структура основана на простой кубической структуре, но имеет дополнительную точку решетки в самом центре куба. Эффективность упаковки и взаимодействие ближайших соседей немного выше, чем для простой структуры, поэтому она более распространена в природе. Известными металлическими твердыми телами с такой структурой являются иром (Fe), хром (Cr) и вольфрам (W).
Создайте свою собственную трехмерную бумажную модель объемно-центрированной кубической структуры с помощью наших инструкций по вырезанию и исследуйте ее природу.
Инструкции и обучающие пункты Шаблон
Гранецентрированная кубическая структура (ГЦК)
Другой структурой, основанной на простой кубической структуре, является гранецентрированная кубическая. В этой кристаллической структуре есть восемь узлов решетки в каждом углу, как в простой кубической структуре, но есть дополнительные точки решетки в центре каждой грани куба.Эта структура очень характерна для металлических элементов, поскольку она максимизирует эффективность упаковки и имеет наибольшее количество ближайших соседей, что увеличивает ее стабильность. Поэтому ГЦК-структуру иногда называют кубической плотноупакованной структурой.
Создайте свою собственную трехмерную бумажную модель гранецентрированной кубической структуры с помощью наших инструкций по вырезанию и исследуйте ее природу.
Инструкции и обучающие пункты Шаблон
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Определение кристаллической структуры | Вернер Масса
Из обзоров:
«Отличается вниманием к практичности работы с реальными кристаллами… ясное и относительно сжатое описание современных решений кристаллической структуры… ценное для всех, кто интересуется уточнением кристаллической структуры.»Геологический журнал
» Книга обеспечивает хороший баланс между описанием математических основ и практическими советами о том, как решить кристаллическую структуру … подходящей для студентов (особенно в области химии), а также для аспирантов или исследователей, которые сочтут нужным лучшее понимание предмета … очень полезное дополнение к коллекции вводных текстов по рентгеновской кристаллографии. Особенно для обработки распространенных ошибок при сборе данных интенсивности и интерпретации результатов.»
Acta Crystallographica
» Подробно описывает подводные камни и ошибки, с которыми можно столкнуться при расчете кристаллических структур с использованием новых программ. Автор отлично описывает эти ошибки и способы их распознавания, когда они появляются в ваших расчетах. «Mineralium Deposita
Из обзоров второго издания:
» Этот учебник дает краткое введение в определение современной кристаллической структуры … . Теоретические разделы поддерживаются множеством иллюстраций и делают упор на хорошее понимание….




