Содержание
Урок 5. тела, вещества, частицы. разнообразие веществ — Окружающий мир — 3 класс
Окружающий мир 3 класс
Урок 5. Тела, вещества, частицы. Разнообразие веществ
Перечень вопросов, рассматриваемых на уроке:
- Что такое тела.
- Что такое вещества.
- Что такое частицы.
- Разнообразие веществ.
- Кислотные дожди.
Глоссарий по теме:
Молекула — наименьшая частица вещества, обладающая всеми его химическими свойствами.
Атом — мельчайшая частица элемента.
Кислота – кислый вкус.
Уксус – жидкость с резким, кислым вкусом.
Основная и дополнительная литература по теме урока:
- Окружающий мир. Рабочая тетрадь. 3 кл.: учеб.пособие для общеобразоват. организаций. В 2 ч. / А. А. Плешаков. — М.: Просвещение, 2017. с. 24.
Дополнительная литература:
- Атлас — определитель «От земли до неба» с. 8, с. 14.
Открытые электронные ресурсы по теме урока:
http://www. alto-lab.ru/himicheskie-opyty/opyty-s-limonom/
alto-lab.ru/himicheskie-opyty/opyty-s-limonom/
http://www.alto-lab.ru/zanimatelnya-himia/sluchajnye-otkrytiya-v-himii/
Теоретический материал для самостоятельного изучения
Если мы с вами оглядимся вокруг, что мы увидим? Мы увидим различные предметы – стол, стул, дома, машины, деревья, горы, люди, животные. Перечислить все предметы невозможно, потому что их очень много. Любой предмет или живое существо можно назвать телом. Планеты, солнце, Луна – тоже тела. Их называют небесными телами. Все тела делятся на две группы – естественные и искусственные. Естественные тела, это природные тела. Растения, животные, птицы, человек – всё это естественные тела. Искусственные тела, это тела, созданные руками человека. Дома, мосты, книги, машины – всё это и многое другое создал человек.
Все тела состоят из веществ. Например, сахар – это вещество, а кусок сахара – это уже тело. Стекло – это вещество, а стакан – это тело. Из одного вещества можно сделать разные тела. Например, из пластмассы – линейка, проволока, пластмассовый стаканчик. Есть тела, которые образованы несколькими веществами: карандаш, ножницы. Есть тела, которые образованы многими веществами. Например, растения состоят из воды, сахара, соли, крахмала и других веществ. Очень сложный состав имеют живые тела. Вещества тоже делятся на группы. Различают твёрдые, жидкие и газообразные вещества.
Есть тела, которые образованы несколькими веществами: карандаш, ножницы. Есть тела, которые образованы многими веществами. Например, растения состоят из воды, сахара, соли, крахмала и других веществ. Очень сложный состав имеют живые тела. Вещества тоже делятся на группы. Различают твёрдые, жидкие и газообразные вещества.
Ученые установили, что вещества состоят из мельчайших частиц, которые видны только под микроскопом. Чтобы убедиться в этом, давайте проведём опыт. Возьмём тело, состоящее из одного вещества, например кусочек сахара, опустим его в стакан с водой и хорошо помешаем. Сначала сахар будет виден, но постепенно станет исчезать. Попробуем воду на вкус, она сладкая. Значит, сахар не исчез, а остался в стакане. А мы его не видим, потому что он распался на маленькие, невидимые нашему глазу частицы, из которых он состоял, и эти частицы перемешались с частицами воды, поэтому вода стала сладкой на вкус. Мельчайшую, невидимую частицу вещества учёные назвали молекулой. А каждая молекула состоит из ещё более мелких частиц, которые называются атомами. Молекулы и атомы разных веществ отличаются друг от друга формой и размерами. Эти мельчайшие частицы постоянно движутся. Между частицами есть промежутки. В твёрдых веществах эти промежутки совсем маленькие, частицы плотно прижаты друг к другу, поэтому твёрдые тела сохраняют форму. В жидких промежутки немного больше, и молекулы могут перемещаться, поэтому жидкости текучи. Самые большие промежутки – в газообразных веществах. У газообразных веществ расстояние между молекулами намного больше самих молекул, поэтому молекулы в газах свободно и очень быстро движутся. Запомним, веществами называют то, из чего состоят тела.
Молекулы и атомы разных веществ отличаются друг от друга формой и размерами. Эти мельчайшие частицы постоянно движутся. Между частицами есть промежутки. В твёрдых веществах эти промежутки совсем маленькие, частицы плотно прижаты друг к другу, поэтому твёрдые тела сохраняют форму. В жидких промежутки немного больше, и молекулы могут перемещаться, поэтому жидкости текучи. Самые большие промежутки – в газообразных веществах. У газообразных веществ расстояние между молекулами намного больше самих молекул, поэтому молекулы в газах свободно и очень быстро движутся. Запомним, веществами называют то, из чего состоят тела.
Веществ тоже очень и очень много. Сейчас их известно около миллиона. В старших классах вы будете изучать очень интересный предмет – химию. Химия, это наука, которая изучает вещества, их состав, строение. Есть природные вещества, к примеру, это соль, вода, железо. И есть вещества, которые создал человек – стекло, резина, пластмасса. И каждый год человек придумывает новые вещества.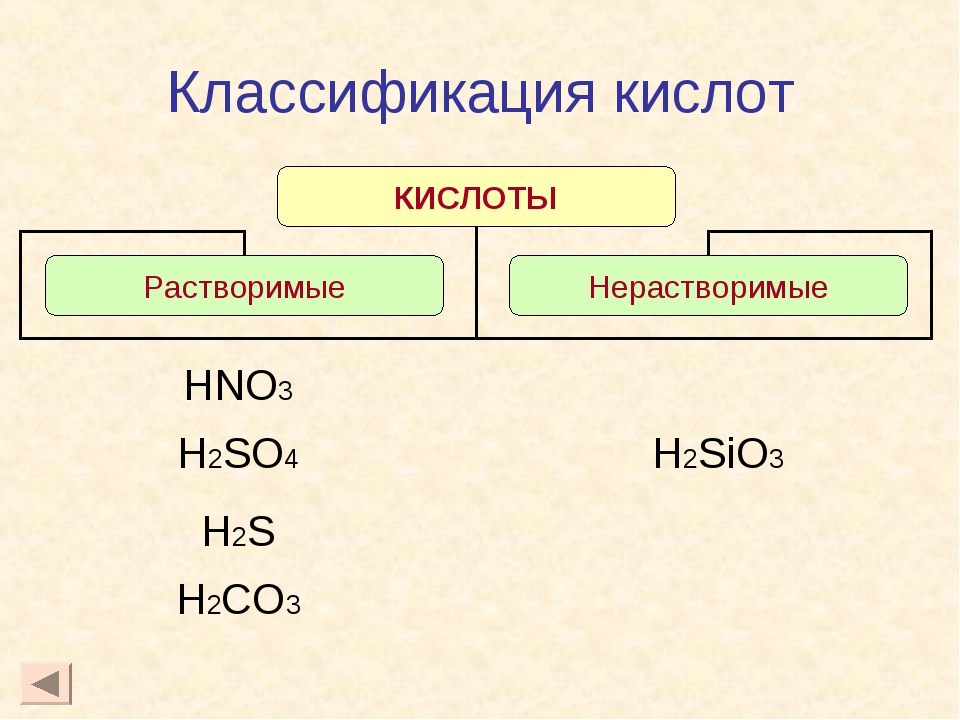
Чтобы познакомиться с некоторыми веществами, нам достаточно просто пойти на кухню. На столе мы видим солонку, а в ней поваренная соль. Самое важное для человека свойство поваренной соли – то, что она солёная на вкус, её используют для подсаливания пищи. Добывают соль из-под земли, это настоящее полезное ископаемое. Под землёй соль встречается в виде камня. Очень много соли содержится в водах солёных морей и озёр. Есть она и в почве, и в телах живых организмов.
Сахар мы тоже обязательно встретим на кухне. По внешнему виду сахар похож на соль. Сладкий вкус – главное свойство сахара. Получают сахар из растений – сахарной свёклы и сахарного тростника, который растёт в жарких странах. Глюкоза – ещё одна разновидность сахара. Она встречается в различных частях растений.
Крахмал – это вещество, которое мы тоже можем встретить на кухне. Крахмал – это белый порошок. Его добавляют, когда варят кисель. Крахмал очень важное питательное вещество, которое необходимо человеку. Он содержится во многих растительных продуктах – в белом хлебе, в картофеле. Чтобы узнать, есть ли в продукте крахмал, нам понадобится разбавленная водой настойка йода. Если капнуть ею на продукт, в котором содержится крахмал, настойка йода окрасится в сине-фиолетовый цвет.
Он содержится во многих растительных продуктах – в белом хлебе, в картофеле. Чтобы узнать, есть ли в продукте крахмал, нам понадобится разбавленная водой настойка йода. Если капнуть ею на продукт, в котором содержится крахмал, настойка йода окрасится в сине-фиолетовый цвет.
Большая группа веществ, с которыми мы сталкиваемся на кухне – это кислоты. Всем нам знаком вкус лимона. Такой вкус ему придаёт лимонная кислота. В яблоках содержится яблочная кислота. Когда прокисает молоко, в нём образуется молочная кислота. Общее свойство эти веществ – кислый вкус. Надо быть острожным, нельзя пробовать любую кислоту на вкус. Многие кислоты очень едкие – они разрушают одежду, древесину, кожу человека, бумагу. Поэтому обращаться с ними надо осторожно. На кухне вы можете встретить и такую кислоту – уксусную. Её используют только в разбавленном виде. К бутылочке с этой кислотой вообще нельзя прикасаться! Из-за загрязнения окружающей среды стали образовываться кислоты высоко в небе. Они выпадают вместе с дождем на землю, такие дожди называют кислотные. От них страдают растения и всё живое, портятся многие постройки. Некоторые животные и растения используют кислоту, как средство защиты от врагов. Например, муравьи в момент опасности поднимают брюшко и выбрызгивают струйки муравьиной кислоты. Эта же кислота содержится в пчелином яде и в жгучих волосках крапивы.
От них страдают растения и всё живое, портятся многие постройки. Некоторые животные и растения используют кислоту, как средство защиты от врагов. Например, муравьи в момент опасности поднимают брюшко и выбрызгивают струйки муравьиной кислоты. Эта же кислота содержится в пчелином яде и в жгучих волосках крапивы.
Окружающий нас мир полон загадок и тайн. Нас впереди ждёт ещё много новых интересных открытий.
Примеры и разбор решения заданий
1. Выберите вещества, которые не относятся к твёрдым.
Варианты ответов: глина; молоко; соль; песок; почва; мел; сок; воздух; алюминий.
Правильный вариант ответа:
Молоко; сок; воздух; вода.
Разбор типового контрольного задания
2. В какой строчке указаны только вещества?
Варианты ответов: алюминий, соль, железо, линейка, проволока, крахмал, сахар, роса; бумага.
Правильный вариант ответа: алюминий, соль, железо.
Презентация по окружающему миру для 3 класса на тему «Разнообразие веществ»
Тема: «Разнообразие веществ».
Цель: познакомить детей с веществами: соль, сахар, крахмал, кислота, научить править пользоваться этими веществами.
Тема урока Разнообразие веществ
Цели:познакомить детей с веществами :сол,сахар,крахмал,кислота,научить правильно пользоваться этими веществами
Задачи:
Образовательная: научить сравнивать и классифицировать вещества по основным признакам, расширять кругозор учащихся.
Воспитательная: воспитывать бережное отношение к продуктам питания, аккуратности в быту.
Развивающая: развивать умения работать со схемами, наблюдательность, внимательность, память.
Просмотр содержимого документа
«Презентация по окружающему миру для 3 класса на тему «Разнообразие веществ» »
Разнообразие веществ
Презентация к уроку окружающего мира в 3 классе
Подготовила:Камалова Зугра Аваловна
учитель начальных классов
МБОУ СОШ с. Карамалы
Карамалы
- Вещества изучает особая наука – химия. На Земле множество веществ – несколько миллионов. С некоторыми из них мы встречаемся каждый день .
СОЛЬ
— Отдельно я не так вкусна, но в пище каждому нужна
Поваренная соль
Поваренная соль – это одна из минеральных солей, встречающихся в природе. Для человека соль жизненно необходима. Если ее долго не хватает, человек может погибнуть. В древности соль ценилась буквально на вес золота. Времена эти прошли, сейчас соль добывают в достаточном количестве. И запасы соли на Земле поистине неисчерпаемы. Целые соляные горы есть в недрах Земли и на ее поверхности. В растворенном состоянии соль содержится в воде морей и океанов.
Соль в природе
Морская соль
Я бел, как снег,
В чести у всех,
В рот попал –
Там и пропал.
Сахар
С этим веществом вы знакомы всю свою жизнь. Главное его свойство – сладкий вкус.
Главное его свойство – сладкий вкус.
- . Было время, когда на Руси о сахаре и знать не знали. В ходу были мед, сладкий сок березы, липы, клена.
- Сладкий сироп из сахарного тростника получали в Индии. Сахар был очень дорогой диковинкой. Долго искали замену сахарному тростнику. Чего только не предлагали: капусту, тыкву, кукурузу, да вот беда – сахара в них мало. Победила сахарная свекла. В начале XIX века в России и Германии были построены первые заводы, которые начали делать сахар из сахарной свеклы.
Сахарный тростник
Тростниковый сахар
Сахарная свёкла
Глюкоза
Ещё есть в природе сладкое вещество: глюкоза. Это разновидность сахара. В природе содержится в различных частях растений. Особенно богаты глюкозой плоды винограда и виноградный сок.
Крахмал
- – Белый порошок – это крахмал. Его используют, когда варят кисель.
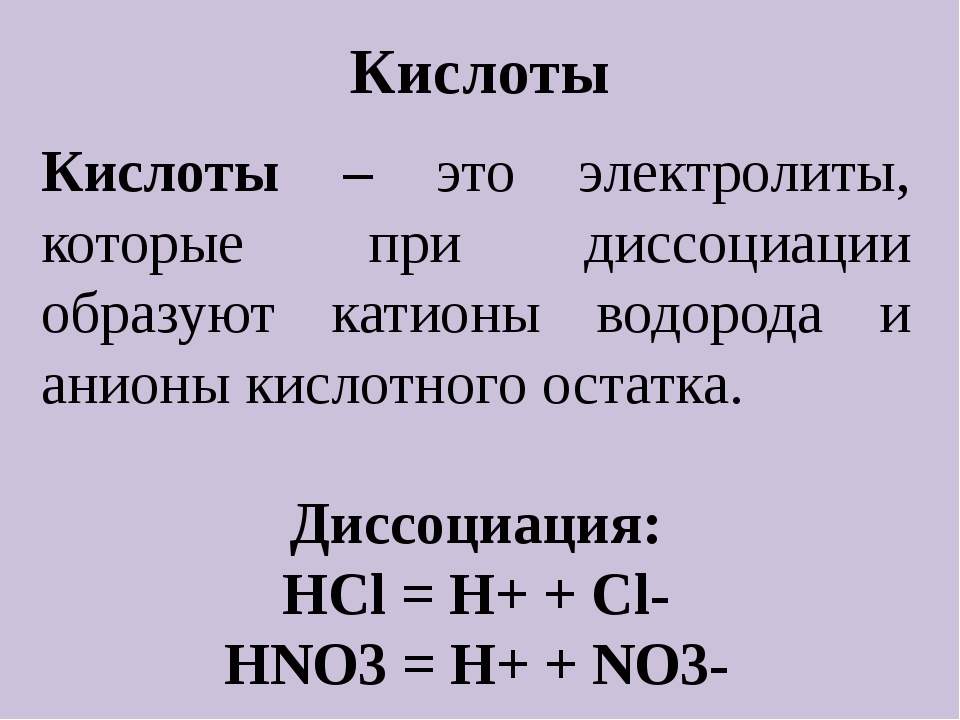 Он содержится во многих продуктах растительного происхождения.
Он содержится во многих продуктах растительного происхождения.
кислоты
- – Кислоты – это большая группа веществ, с которыми мы встречаемся на кухне. Всем известен кислый вкус лимона. Этот вкус придает ему лимонная кислота. В яблоках – яблочная кислота, в щавеле – щавелевая кислота.
- С кислотами на кухне надо обращаться очень осторожно. Особенно с уксусной кислотой. К бутылочке с этой кислотой нельзя прикасаться.
П р о в е р ь с е б я
- Назовите главные свойства поваренной соли и сахара. Где эти вещества встречаются в природе?
- Что представляет собой крахмал? Как обнаружить его в продуктах питания?
- Какие кислоты встречаются в природе?
- Какое общее свойство этих веществ?
- Почему с кислотами нужно обращаться осторожно? Можно ли пробовать на вкус любую кислоту?
- Что такое кислотные дожди? В чём их опасность?
Конспект урока по Окружающему миру в 3 классе на тему «Разнообразие веществ»
Уровень образования: начальное общее образование
3 класс
Предмет: Окружающий мир
Цель урока:
Познакомить с веществами: соль, сахар, крахмал, кислота. Учить пользоваться этими веществами. Расширять кругозор учащихся
Учить пользоваться этими веществами. Расширять кругозор учащихся
Тип урока: Урок изучения и первичного закрепления новых знаний
Учеников в классе: 31
Используемые учебники и учебные пособия: А.А.Плешаков «Окружающий мир» учебник для 3 класса; Целоусова Т.Ю., Максимова Т.В. Поурочные разработки по курсу «Окружающий мир» 3 класс
Используемое оборудование: Мультимедиа
1. Орг. Момент.
2. Повторение пройденного.
Вспомним значение терминов, отгадав кроссворд.
3. Проверка д/з.
-Что такое вещества? (то, из чего состоят тела)
-Из чего состоят вещества? (из частиц – молекул и атомов)
-Какими могут быть вещества? (тв., жидк., газообр.)
Упражнения в рабочей тетради.
4. Тема сегодняшнего урока «Разнообразие веществ». На уроке мы познакомимся с некоторыми веществами. Вещества изучает особая наука – химия. На свете очень много веществ: сейчас их известно несколько миллионов. С некоторыми из них мы встречаемся каждый день.
С некоторыми из них мы встречаемся каждый день.
Сейчас мы отправимся на кухню! Какое первое вещество нам встретится, вы узнаете из загадки:
Меня не едят-
И без меня мало съедят. (соль)
Вот на столе солонка, а в ней поваренная соль. Самое важное для человека свойство поваренной соли – то, что она солёная на вкус. Поэтому её используют для подсаливания пищи. (ПРИЛОЖЕНИЕ К УРОКУ)
Есть ещё одно вещество, с которым мы обязательно встретимся на кухне. О себе оно говорит так:
Я бел, как снег, В чести у всех,
В рот попал – там и пропал. (сахар)
По внешнему виду его можно спутать с солью. Зато их не спутаешь по вкусу. Сладкий вкус – главное свойство сахара. Когда-то сахар делали только из сахарного тростника , который растёт в Индии, Китае и других странах, где климат постоянно тёплый и влажный. Сахар был очень дорогой диковинкой. Во многих странах вместо него употребляли мёд, сладкий сок клёна, березы, липы. Долго искали замену сахарному тростнику. И только в начале 19 века в России и Германии бвли построены первые заводы, которые делали сахар из сахарной свёклы. Сейчас почти половину всего сахара в мире получают из свёклы.
И только в начале 19 века в России и Германии бвли построены первые заводы, которые делали сахар из сахарной свёклы. Сейчас почти половину всего сахара в мире получают из свёклы.
Обыкновенный сахар не единственное сладкое вещество в природе. Во фруктах содержится фруктовый сахар, в молоке – молочный сахар. Глюкоза – ещё одна разновидность сахара. В природе она встречается в различных частях растений. Особенно богаты глюкозой плоды винограда и виноградный сок. Глюкозу ещё называют виноградным сахаром.
-А это что за вещество, похожее по цвету на соль и сахар?
Белый порошок – это крахмал. Его обычно используют, когда варят кисель.
Крахмал – одно из питательных веществ, необходимых человеку. Он содержится во многих продуктах растительного происхождения. Вот этим мы с вами сейчас и займёмся – узнаем, в каких продуктах содержится крахмал. Для этого нужна настойка йода. Если капнуть на продукт, в котором содержится крахмал, настойка приобретает сине-фиолетовый цвет.
5. Практическая работа.
По окончании исследования каждый экипаж отчитывается о результатах исследования.
6. Физкультминутка.
-С какими телами вы работали на практической работе? Естественными.
-Какими ещё бывают тела? Искусственными.
Если я называю искусственное тело, вы садитесь, а если естественное – прыжок на месте: радуга, трактор, кукла, зайчик, трава, дождь, воздушный шар, туман, самолёт, солнце, звёзды, медведь.
7. Кислоты – теоретический материал.
Большая группа веществ, с которыми мы с вами можем встретиться на кухне – это кислоты. Каждому знаком кислый вкус лимона. Такой вкус ему придает содержащаяся в нём лимонная кислота. В яблоках содержится яблочная кислота, в листьях щавеля – щавелевая. Когда прокисает молоко, в нем образуется молочная кислота.
Как вы думаете, можно ли пробовать кислоту на вкус?
На кухне можно встретить одну из кислот – уксусную. Её можно использовать только в разбавленном виде.
8. Работа в тетради.
9. Итог урока.
С какими веществами мы сталкиваемся каждый день на кухне?
10. Домашнее задание
Учебник стр.39-43
Тетрадь
1. Первая ступень познания.
2. Крошечные организмы.
3. Совокупность людей, объединённых формами совместной жизни и деятельности.
4. Группа живущих вместе близких родственников.
5. Как называют огромные группы, на которые делят всё живое?
6. Как называется любой предмет, любое живое существо?
7. Участок земли, где вся природа находится под строгой охраной.
8. Население государства, жители страны.
1. Первая ступень познания.
2. Крошечные организмы.
3. Совокупность людей, объединённых формами совместной жизни и деятельности.
4. Группа живущих вместе близких родственников.
5. Как называют огромные группы, на которые делят всё живое?
6. Как называется любой предмет, любое живое существо?
7. Участок земли, где вся природа находится под строгой охраной.
Участок земли, где вся природа находится под строгой охраной.
8. Население государства, жители страны.
1. Первая ступень познания.
2. Крошечные организмы.
3. Совокупность людей, объединённых формами совместной жизни и деятельности.
4. Группа живущих вместе близких родственников.
5. Как называют огромные группы, на которые делят всё живое?
6. Как называется любой предмет, любое живое существо?
7. Участок земли, где вся природа находится под строгой охраной.
8. Население государства, жители страны.
1. Первая ступень познания.
2. Крошечные организмы.
3. Совокупность людей, объединённых формами совместной жизни и деятельности.
4. Группа живущих вместе близких родственников.
5. Как называют огромные группы, на которые делят всё живое?
6. Как называется любой предмет, любое живое существо?
7. Участок земли, где вся природа находится под строгой охраной.
8. Население государства, жители страны.
1. Первая ступень познания.
2. Крошечные организмы.
3. Совокупность людей, объединённых формами совместной жизни и деятельности.
4. Группа живущих вместе близких родственников.
5. Как называют огромные группы, на которые делят всё живое?
6. Как называется любой предмет, любое живое существо?
7. Участок земли, где вся природа находится под строгой охраной.
8. Население государства, жители страны.
1. Первая ступень познания.
2. Крошечные организмы.
3. Совокупность людей, объединённых формами совместной жизни и деятельности.
4. Группа живущих вместе близких родственников.
5. Как называют огромные группы, на которые делят всё живое?
6. Как называется любой предмет, любое живое существо?
7. Участок земли, где вся природа находится под строгой охраной.
8. Население государства, жители страны.
Разнообразие веществ. Свойства соли и сахара. Крахмал.
 Кислоты
Кислоты
Проверь себя
С.45.
1.Вопрос: каковы главные свойства поваренной соли и сахара?
Ответ: поваренная соль и сахар — кристаллические твердые вещества белого цвета, без запаха, растворимые в воде, обладающие вкусом: сахар – сладкий, соль — соленая; поваренная соль и сахар отличные консерванты, для того чтобы заготовить впрок овощи и плоды и предотвратить их порчу, мы их либо солим, либо варим из них варенье. Соль и сахар сложные по своему составу вещества. Составные части соли и сахара входят в состав крови. И недостаток и переизбыток составных частей соли и сахара в крови человека приводят к заболеваниям. (повышенный уровень сахара в крови приведет к сахарному диабету, а его недостаток к плохой умственной деятельности, недостаток натрия, составной части соли, приводит к гипотонии – пониженному артериальному давлению, а переизбыток к гипертонии, заболеваниям почек. ) Для того чтобы человек постоянно восполнял необходимое количество сахара и соли в организме, мы пищу солим, и подслащиваем, делаем мы это еще и для улучшения вкуса употребляемой пищи.
) Для того чтобы человек постоянно восполнял необходимое количество сахара и соли в организме, мы пищу солим, и подслащиваем, делаем мы это еще и для улучшения вкуса употребляемой пищи.
2. Вопрос: как обнаружить крахмал в продуктах питания?
Ответ: для того чтобы обнаружить крахмал в продуктах питания, нужно ножом надрезать испытуемый продукт и на срез капнуть каплю йода, если через некоторое время на срезе проявится сине-фиолетовое пятно, значит в продукте содержится крахмал.
3. Вопрос: какие кислоты встречаются в природе?
Ответ: лимонная, яблочная, щавелевая, молочная кислота имеют природное происхождение.
4. Вопрос: чем опасны кислотные дожди?
Ответ: любые осадки, которые содержат загрязняющие вещества – оксиды азота, серы и другие кислотные оксиды – называют кислотными дождями. Последствия такого метеорологического явления для окружающей среды плачевны: они губят растения, лишают животных пищи, загрязняют водоемы. Человек тоже страдает от кислотных дождей, организм реагирует на загрязнения появлением ряда заболеваний.
Человек тоже страдает от кислотных дождей, организм реагирует на загрязнения появлением ряда заболеваний.
Задания для домашней работы:
Задание 2.
Дома возьми три блюдца, и насыпь в одно из них сахар, в другое поваренную соль, а в третье крахмал. Как различить эти вещества?
Ответ: для того чтобы различить сахар, крахмал и поваренную соль, необходимо каждое вещество разделить на две части, к одной части всех веществ прилить каплю йода, то вещество, в котором образуется сине-фиолетовое пятно, есть крахмал. Остальные вещества можно попробовать на вкус, какое сладкое – сахар, а какое соленое — соль. Вообще нельзя пробовать на вкус неизвестные вещества, но в данном опыте точно известно, что вещества безвредные и на вкус их можно различить. Но это исключение из общего правила!
На следующем уроке
С. 45.
Вопрос: вспомни, как можно доказать, что вокруг нас есть воздух. Какое значение имеет воздух для растений, животных, человека?
Какое значение имеет воздух для растений, животных, человека?
Ответ: ветер, особенно сильный, — это наглядное доказательство наличия вокруг нас воздуха. Ветер срывает легкие листья с деревьев и тяжелые крыши с домов. Ветер — это движение воздушных масс.
Наше дыхание — также способ обнаружить воздух. Набирая в легкие воздух мы можем задержать дыхание и потом с шумом выпустить воздух. Особенно хорошо это видно зимой на улице когда мороз.
Накачать велосипедные шины также можно воздухом, с помощью простого насоса.
И надуть воздушный шарик. А стенки воздушного шарика ведь казалось бы ничего не сдерживает, однако он упругий и сохраняет форму.
Воздух имеет для всего живого на Земле первостепенное значение – мы им дышим, поэтому и можем жить. Строго говоря, мы дышим не воздухом, а кислородом, который входит в состав воздуха.
ICSC 1675 — ТРИХЛОРИЗОЦИАНУРОВАЯ КИСЛОТА
ICSC 1675 — ТРИХЛОРИЗОЦИАНУРОВАЯ КИСЛОТА
| ТРИХЛОРИЗОЦИАНУРОВАЯ КИСЛОТА | ICSC: 1675 |
| Апрель 2007 |
| CAS #: 87-90-1 | |
| UN #: 2468 | |
| EINECS #: 201-782-8 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при нагревании. Риск пожара или взрыва при контакте с горючими веществами или несовместимыми веществами. См. Химические Опасности. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при нагревании. Риск пожара или взрыва при контакте с горючими веществами или несовместимыми веществами. См. Химические Опасности. | НЕ допускать контакта с горючими веществами. | Использовать большое количество воды, пену, сухой порошок. В случае пожара: охлаждать бочки и т.д. распыляя воду. НЕ допускать прямого контакта с водой. |
| СТРОГО СОБЛЮДАТЬ ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Затрудненное дыхание. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Обратиться за медицинской помощью. Обратиться за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. |
| Глаза | Покраснение. Боль. Ожоги. | Использовать защитные очки. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Боль в животе. Ощущение жжения. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. НЕ вызывать рвоту. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. НЕ допускать попадания этого химического вещества в окружающую среду. Сухие блокируемыеСмести просыпанное вещество в закрытые контейнеры. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. НЕ допускать попадания этого химического вещества в окружающую среду. Сухие блокируемыеСмести просыпанное вещество в закрытые контейнеры. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН
ОПАСНО
Транспортировка |
| ХРАНЕНИЕ | |
Хранить сухим. Хорошо закрывать. Отдельно от аминов, горючих веществ и восстановителей. См. химические опасности. Хранить в местах не имеющих сливов или доступа к канализации Предотвратить попадание продуктов пожаротушения в сточные воды. | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ТРИХЛОРИЗОЦИАНУРОВАЯ КИСЛОТА | ICSC: 1675 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C3Cl3N3O3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Вещество очень токсично для водных организмов. Настоятельно рекомендуется не допускать попадания вещества в окружающую среду. Настоятельно рекомендуется не допускать попадания вещества в окружающую среду. |
| ПРИМЕЧАНИЯ |
|---|
| The substance decomposes in water producing hypochloric acid and cyanuric acid. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. См. карту ICSC 1313. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: O, Xn, N; R: 8-22-36/37-31-50/53; S: (2)-8-26-41-60-61 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
ЧТО НАДО ЗНАТЬ ОБ ОМЕГА-3 ЖИРНЫХ КИСЛОТАХ
Омега-3 – это собирательное название для жирных кислот. Рассказываем, для чего нам омега-3 и как насытить организм жирными кислотами.
ДЛЯ ЧЕГО НАМ ОМЕГА-3 ЖИРНЫЕ КИСЛОТЫ
Омега-3 – это жирные кислоты, которым не хватает двух протонов, они «не насыщенные» водородом. Есть два главных класса ненасыщенных жирных кислот – омега-3 и омега-6. Они отличаются по расположению двойной связи в молекуле.
Омега-3 – это собирательное название для жирных кислот. К главным омега-3 относят альфа-линоленовую, эйкозапентаеновую и докозагексаеновую кислоты, сокращенно –ALA, EPA и DHA. Так, АLA содержится в льняном семени, EPA и DHA – только в рыбе и морепродуктах.
Некоторые люди способны сами образовывать незаменимые жирные кислоты EPA и DHA из ALA. Такова их генетическая особенность. Таких людей особенно много в Индии и странах, где исторически главенствует вегетарианство.
Таких людей особенно много в Индии и странах, где исторически главенствует вегетарианство.
Омега-3 необходимы для образования оболочек вокруг нейронов, синтеза эйкозаноидов – одного из типов молекул, с помощью которых клетки иммунной системы общаются между собой. Также омега-3 необходимы нам для настройки процессов воспаления в теле, сжатия сосудов, образование спермы, здоровья и развития мозга.
Главным открытием и разочарованием 2018 года в области исследования добавок стало то, что омега-3 не уменьшают риск болезней сердца и смертности от них. В то же время люди, которые едят рыбу и морепродукты хотя бы раз в неделю (а лучше четыре), имеют значительно меньший риск умереть от болезней сердца. Связано это с тем, что в рыбе содержание выше, чем в капсулах.
Высокие дозы омега-3 уменьшают уровень триглицеридов крови. Это важно пациентам с атеросклерозом. Омега-3 могут быть полезными в облегчении симптомов ревматоидного артрита. В то же время нет достоверных данных, что омега-3 уменьшают дегенерацию сетчатки глаза, депрессию и гиперактивность у детей.
Качество добавок с рыбьим жиром сильно варьирует, также жиры могут окисляться и портиться со временем. Кроме того, в добавках может не хватить EPA и DHA, и ни цена, ни страна производства или срок годности не могут гарантировать качество добавки омега-3.
Пить «сбалансированы омега-3 / омега-6» не стоит – мы потребляем достаточно омега-6 жирных кислот с растительными маслами. Главным фактором, определяющим баланс, является абсолютное количество всех типов омега-3, а не их соотношение с омега-6.
ГДЕ ВЗЯТЬ ОМЕГА-3
Чтобы насытить организм омега-3 жирными кислотами, достаточно дважды в неделю есть жирную морскую рыбу – сельдь, скумбрию, лосося, сардину. Этого достаточно, чтобы получить необходимую дозу жирных кислот. Кроме того, исследования показывают, что для профилактики сердечно-сосудистых заболеваний или лучшего умственного развития детей полезна именно рыба, а не рыбий жир в виде биологически активных добавок.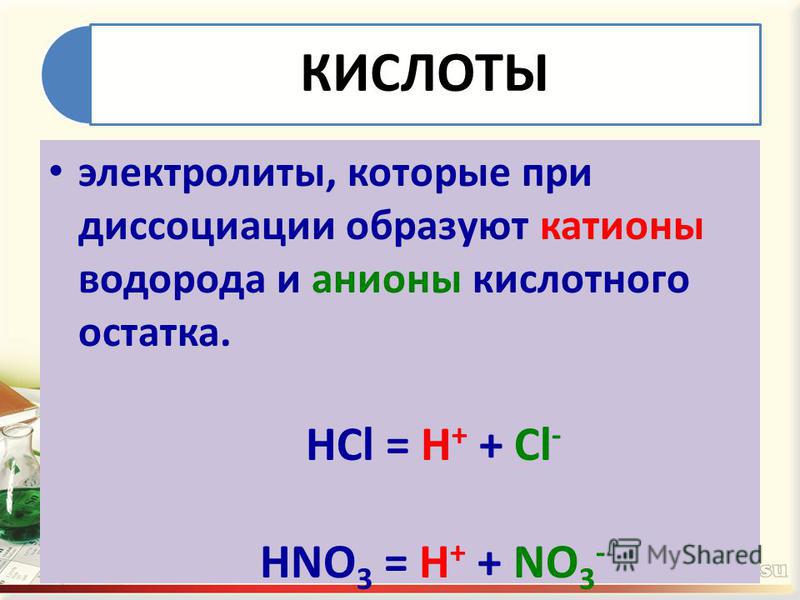 Омега-3 присутствуют также в морских водорослях, поэтому регулярно берите морскую капусту (ламинарию) или сушеные азиатские водоросли.
Омега-3 присутствуют также в морских водорослях, поэтому регулярно берите морскую капусту (ламинарию) или сушеные азиатские водоросли.
Ешьте льняное семя и масло. В них содержится ALA, из которой, хотя и неэффективно, мы создаем другие типы омега-3. Льняное семя полезнее потреблять молотым, чем целым. Чтобы не тратить напрасно деньги на таблетки, лучше потребляйте омега-3 из надежных источников. А также консультируйтесь с врачом относительно каких-либо добавок, которые планируете принимать. Пить добавки наугад и «на всякий случай» – вредно для здоровья.
Источник
Витамин C, или аскорбиновая кислота
Витамин С – это основной водорастворимый антиоксидант в крови и клетках тканей.
Витамин С нужен:
- для развития и работы кожи, десен, зубов, костей,
- для нормального заживления ран,
- для повышения сопротивляемости организма, предотвращения весенней усталости и стресса,
- для уменьшения образования нитрозаминов,
- для превращения поступающей в организм фолиевой кислоты в фолаты,
- для нормальной работы мозга,
- для управления синтезом стероидных гормонов, для синтеза из холестерина желчной кислоты и регулирования уровня холестерина в крови,
- для усиления всасывания негемового железа (т.
 е. из пищи растительного происхождения).
е. из пищи растительного происхождения).
Витамин С легко распадается под воздействием температуры, кислорода и света. Поэтому:
- не храните и не вымачивайте овощи и фрукты в воде,
- используйте оставшуюся после варки овощей жидкость,
- держите свежие фрукты в холодильнике, в открытом виде не более 2-3 дней.
По сравнению с другими людьми курильщикам требуется больше витамина С (на 30 мг в день больше). Также в бóльших количествах витамина С нуждаются беременные и кормящие матери (на 10 мг в день больше). Нехватка витамина С может проявляться в пониженной способности организма сопротивляться окислительным процессам, в истощении и раздражительности. При длительном дефиците витамина С может развиться цинга. Симптомы цинги появляются, когда уровень витамина С в плазме крови падает ниже 11 мкг/л или общие запасы в организме – ниже 300 мг. Цинга – крайне редкое состояние. Биодоступность витамина С при дозах не более 100 мг составляет не менее 80%, при 200–500 мг – 60–70%, при дозах более 1000 мг – менее 50%.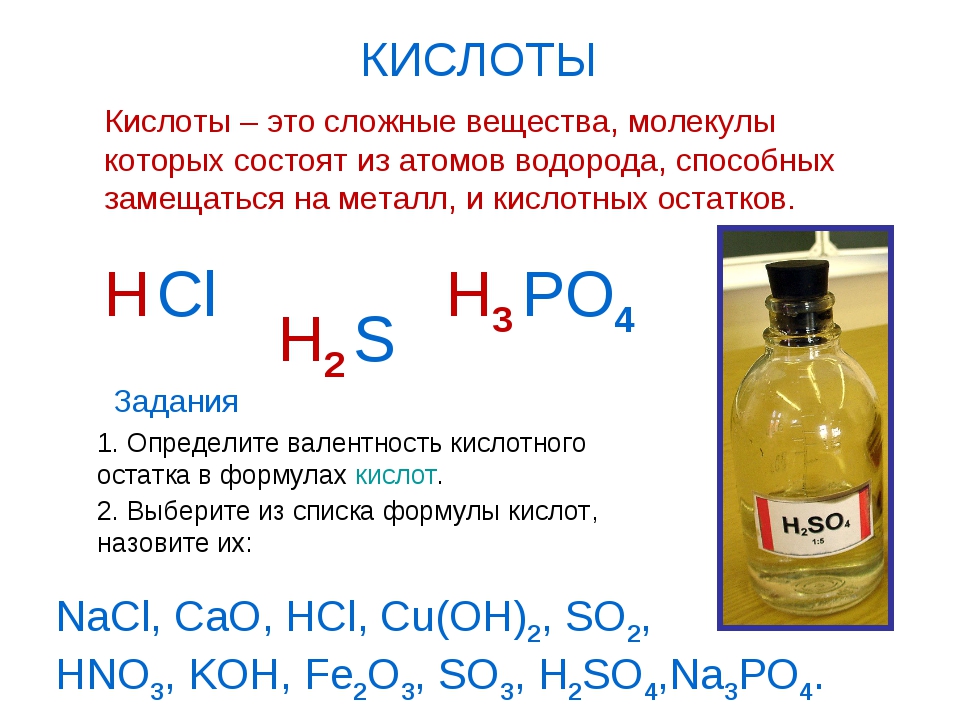 Большие количества витамина С могут привести к диарее и другим нарушениям пищеварения, а у людей с повышенной чувствительностью к аскорбиновой кислоте – и к повышенному образованию камней в почках. Лучшими источниками витамина С являются овощи и фрукты, ягоды, соки; шиповник, облепиха, паприка, черная смородина, ежевика, клубника, цитрусовые, красная смородина, капуста, брокколи, лук-порей, брюква, крыжовник, малина, помидоры, цветная капуста.
Большие количества витамина С могут привести к диарее и другим нарушениям пищеварения, а у людей с повышенной чувствительностью к аскорбиновой кислоте – и к повышенному образованию камней в почках. Лучшими источниками витамина С являются овощи и фрукты, ягоды, соки; шиповник, облепиха, паприка, черная смородина, ежевика, клубника, цитрусовые, красная смородина, капуста, брокколи, лук-порей, брюква, крыжовник, малина, помидоры, цветная капуста.
Рекомендуемые в день примерно 100 мг витамина С содержат следующие продукты:
- 12 г ягод шиповника,
- 60 г ягод облепихи; паприки или петрушки,
- 80 г ягод черной смородины,
- 200 г ягод красной смородины,
- 250 г брюквы,
- 230 г белокочанной капусты, апельсинов, мандаринов или лимонов,
- 330 г крыжовника.
Гастроэзофагеальный лоскутный клапан отражает морфологию EGJ и коррелирует с кислотным рефлюксом | BMC Gastroenterology
Субъекты
В исследование были включены следующие амбулаторные пациенты с изжогой и / или срыгиванием в качестве основной жалобы. Симптомы у пациента должны сохраняться не менее 3 месяцев и более 2 дней в течение одной недели. Все пациенты прошли эндоскопию в нашей больнице, которую проводил один и тот же врач (Чэнси Се) и осмотрел другой врач (Инлиянь Сяо), чтобы получить согласие по схеме GEFV.Пациенты также будут исключены, если у них было следующее: перенесенные ранее хирургические вмешательства на пищеводе или желудочно-кишечном тракте, язвенная болезнь, опухоль желудочно-кишечного тракта, первичные или вторичные тяжелые нарушения моторики пищевода, тяжелые сердечные, почечные или легочные заболевания.
Симптомы у пациента должны сохраняться не менее 3 месяцев и более 2 дней в течение одной недели. Все пациенты прошли эндоскопию в нашей больнице, которую проводил один и тот же врач (Чэнси Се) и осмотрел другой врач (Инлиянь Сяо), чтобы получить согласие по схеме GEFV.Пациенты также будут исключены, если у них было следующее: перенесенные ранее хирургические вмешательства на пищеводе или желудочно-кишечном тракте, язвенная болезнь, опухоль желудочно-кишечного тракта, первичные или вторичные тяжелые нарушения моторики пищевода, тяжелые сердечные, почечные или легочные заболевания.
Протокол был одобрен этическим комитетом Первой дочерней больницы Университета Сунь Ятсена. Письменное информированное согласие было получено от всех людей перед каждой процедурой.
Верхняя эндоскопия
Наличие эрозивного эзофагита определяли и классифицировали на основании классификации Лос-Анджелеса [17].GEFV был проспективно оценен во время эндоскопического обследования от I до IV на основании классификации Hill [1]. Четкое изображение GEFV будет сделано при эндоскопии обычным эндоскопистом (Chengxi Xie), и оценка будет подтверждена, если другой автор (Yinglian Xiao) согласится. Если им не удавалось достичь согласия (для 8 пациентов), участвовали другие авторы, и оценка подтверждалась, если с этой оценкой соглашались более двух третей авторов.
Четкое изображение GEFV будет сделано при эндоскопии обычным эндоскопистом (Chengxi Xie), и оценка будет подтверждена, если другой автор (Yinglian Xiao) согласится. Если им не удавалось достичь согласия (для 8 пациентов), участвовали другие авторы, и оценка подтверждалась, если с этой оценкой соглашались более двух третей авторов.
Марки GEFV показаны на рис.1.
Рис. 1
Сорта Хилла ГЭФВ. GEFV оценивался от I до IV проспективно во время эндоскопического обследования на основании классификации Хилла: Степень I: складка ткани, максимально приближенная к эндоскопу; Степень II: складка ткани менее выражена, чем степень I. Ткань вокруг эндоскопа может открываться во время дыхания и быстро закрываться; Степень III: складка ткани едва заметна, эндоскоп не сжимает ткань плотно; Степень IV: отсутствует выступающая складка ткани, имеется грыжа пищеводного отверстия диафрагмы
Манометрия с высоким разрешением (HRM)
После голодания в течение не менее 8 часов, HRM выполнялась у всех испытуемых в положении лежа на спине. Катетер HRM собран с 36 окружными датчиками, расположенными с интервалом в 1 см (Given Imaging, Duluth, GA, USA). Датчики были откалиброваны при 0 и 300 мм рт. Ст. С использованием внешнего давления. Катетер установлен трансназально. По крайней мере, три датчика были помещены в желудок, и изменения давления можно было регистрировать от верхнего сфинктера пищевода к желудку. Манометрический протокол включал регистрацию исходного уровня за 30 секунд и десять глотков жидкости по 5 мл. Исследования были проанализированы вручную с использованием программного обеспечения Manoview (Given Imaging, Дулут, Джорджия, США).
Катетер HRM собран с 36 окружными датчиками, расположенными с интервалом в 1 см (Given Imaging, Duluth, GA, USA). Датчики были откалиброваны при 0 и 300 мм рт. Ст. С использованием внешнего давления. Катетер установлен трансназально. По крайней мере, три датчика были помещены в желудок, и изменения давления можно было регистрировать от верхнего сфинктера пищевода к желудку. Манометрический протокол включал регистрацию исходного уровня за 30 секунд и десять глотков жидкости по 5 мл. Исследования были проанализированы вручную с использованием программного обеспечения Manoview (Given Imaging, Дулут, Джорджия, США).
Метрики EPT были определены обновленной Чикагской классификацией [18]. Морфология EGJ может быть разделена на три подтипа в соответствии с относительной локализацией LES и CD, это было описано в обновленной Чикагской классификации [17]. В исследовании были измерены четыре показателя, включая интегрированное давление релаксации (IRP), сократительный индекс EGJ (EGJ-CI), давление EGJ на выдохе (EGJP-exp) и давление на вдохе EGJ (EGJP-insp).
Необходимо было вычислить EGJ-DCI до получения значений EGJ-CI.EGJ-DCI рассчитывали в состоянии покоя без проглатывания. Для пациентов с морфологией EGJ II или III LES и CD были разделены, компонент CD был исключен, если расстояние между LES и CD было более 2 см, как показывает HRM [15]. Рамка ласточки была добавлена к трем циклам дыхания, начиная с вдоха. Используя изобарический контур, давление на 2 мм рт. Ст. Выше, чем внутрижелудочное давление, было установлено в качестве границы барьера. Затем инструмент DCI был использован для измерения значения EGJ-DCI (рис.2). Затем значение было разделено на продолжительность трех дыхательных циклов, чтобы получить EGJ-CI [13].
Рис. 2
Расчет EGJ-DCI. В исходном состоянии рамка для глотания была добавлена на трех циклах дыхания, начиная с вдоха. Используя изобарический контур, давление на 2 мм рт. Ст. Выше, чем внутрижелудочное давление, было установлено в качестве границы барьера. Затем инструмент DCI был использован для измерения значения EGJ-DCI. a Изменения общего давления в пищеводе в состоянии покоя были показаны с помощью HRM.Желтое поле использовалось для обозначения области, выбранной для расчета EGJ-DCI. LES и CD были наложены друг на друга. b Расчет EGJ-DCI. Компонент CD был исключен, когда расстояние между LES и CD было более 2 см
a Изменения общего давления в пищеводе в состоянии покоя были показаны с помощью HRM.Желтое поле использовалось для обозначения области, выбранной для расчета EGJ-DCI. LES и CD были наложены друг на друга. b Расчет EGJ-DCI. Компонент CD был исключен, когда расстояние между LES и CD было более 2 см
IRP представляет собой среднее значение EGJ для 4-секундной максимальной глотательной релаксации в 10-секундном окне после релаксации верхнего сфинктера пищевода (UES). В исследовании принималось во внимание среднее значение IRP для 10 глотков жидкости. EGJP-insp представляет собой среднее максимальное инспираторное давление EGJ и EGJP-exp.представляет собой среднее давление EGJ в промежутке между вдохами. Они были рассчитаны для тех же трех дыхательных циклов, которые были выбраны для измерения EGJ-DCI.
Круглосуточный многоканальный мониторинг внутрипросветного импеданса-pH (MII – pH)
Все субъекты прошли 24-часовой мониторинг с использованием амбулаторной системы мониторинга MII-pH (Sleuth; Sandhill Scientific, Inc . ; Highland Ranch, CO, США ). PH-электрод помещали на 5 см выше верхнего края нижнего сфинктера пищевода (LES), и импеданс регистрировали в шести местах (3, 5, 7, 9, 15 и 17 см выше LES соответственно).Время приема пищи было исключено из анализа.
; Highland Ranch, CO, США ). PH-электрод помещали на 5 см выше верхнего края нижнего сфинктера пищевода (LES), и импеданс регистрировали в шести местах (3, 5, 7, 9, 15 и 17 см выше LES соответственно).Время приема пищи было исключено из анализа.
Пациенты с НЭРБ были определены как без эзофагита, но с аномальным воздействием кислоты на пищевод (время воздействия кислоты (AET) ≥ 4%). А пациенты с рефлюксной гиперчувствительностью определялись как без эзофагита и патологического кислотного рефлюкса, но с вероятностью ассоциации симптомов ≥ 95%. Пациентов с изжогой более 2 дней в неделю, без явной корреляции с кислотным или некислотным рефлюксом и с плохой реакцией на оптимизированное лечение ИПП, следует классифицировать как «функциональную изжогу (СГ)» [19, 20].В исследовании исключались пациенты без ЭЭ и положительных результатов 24-часового мониторинга MII-pH, поскольку только этих проявлений было недостаточно для постановки диагноза СГ. Блок-схема представлена на рис. 3.
Рис. 3
3
Блок-схема исследования
Статистический анализ
Односторонний дисперсионный анализ ANOVA использовался для сравнения различий, если данные следовали нормальному распределению. Тест суммы рангов использовался, если данные были представлены в виде медианы (межквартальный диапазон).Ранговая корреляция Спирмена использовалась для изучения корреляции между AET% и оценками GEFV, а также корреляции между AET% в положении лежа на спине и морфологией EGJ. Значение p менее 0,05 считалось статистически значимым. Статистический анализ был выполнен с использованием SPSS 20.0 (SPSS Inc., Чикаго, Иллинойс, США).
ГЭРБ: симптомы, причины и лечение
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы совершаете покупку по ссылкам на этой странице, мы можем получить небольшую комиссию.Вот наш процесс.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — это хроническое заболевание, при котором кислота из желудка попадает в пищевод.
Многие люди иногда испытывают гастроэзофагеальный рефлюкс (ГЭР).
Однако, если у человека наблюдается стойкий кислотный рефлюкс, который происходит более двух раз в неделю, ему может быть поставлен диагноз ГЭРБ. Другими словами, ГЭРБ — это длительное регулярное проявление ГЭР.
На этой странице представлена информация о симптомах, причинах, диагностике и лечении ГЭРБ.
Поделиться на PinterestЕсли сфинктер в верхней части желудка не закрывается должным образом, содержимое желудка может вытекать вверх.
Гастроэзофагеальная рефлюксная болезнь — это состояние, при котором желудочная кислота постоянно и регулярно попадает в пищевод.
Пищевод может также называться пищеводом или пищеводом, и это трубка, по которой пища транспортируется изо рта в желудок.
Кислота в пищеводе вызывает изжогу и другие симптомы, а также возможное повреждение тканей.
Американский колледж гастроэнтерологии утверждает, что по крайней мере 15 миллионов американцев, или 20 процентов населения Америки, испытывают изжогу каждый день.
Случайный кислотный рефлюкс — довольно распространенное явление, часто возникающее в результате переедания, ложного положения после еды или употребления определенных продуктов.
Однако рецидивирующий кислотный рефлюкс, диагностированный как ГЭРБ, обычно имеет другие причины и факторы риска и может иметь более серьезные осложнения.
Гастроэзофагеальная рефлюксная болезнь возникает у людей любого возраста, а иногда и по неизвестным причинам.
Короче говоря, ГЭРБ возникает, когда сфинктер в нижней части пищевода становится слабым или открывается, когда этого не должно происходить.
ГЭРБ чаще встречается у людей, которые:
- имеют избыточный вес или страдают ожирением из-за повышенного давления на живот
- беременных, из-за того же повышенного давления
- принимают определенные лекарства, в том числе некоторые лекарства от астмы, блокаторы кальциевых каналов, антигистаминные препараты , седативные средства и антидепрессанты
- курение и воздействие вторичного табачного дыма
Хиатальная грыжа — это состояние, при котором отверстие в диафрагме позволяет верхней части желудка подниматься в грудную клетку. Это снижает давление в сфинктере пищевода и повышает риск ГЭРБ.
Это снижает давление в сфинктере пищевода и повышает риск ГЭРБ.
Основным симптомом ГЭРБ является изжога.
Изжога — это ощущение дискомфорта за грудиной в виде жжения. Это имеет тенденцию ухудшаться, если человек ложится или наклоняется, а также после еды.
Однако не все люди с ГЭРБ испытывают изжогу, есть и другие возможные симптомы:
- тошнота или рвота
- неприятный запах изо рта
- проблемы с дыханием
- затруднение или боль при глотании
- кариес
ГЭРБ может ухудшиться превратиться в другие условия, если их не лечить.
К ним относятся:
- Эзофагит : это воспаление пищевода.
- Стриктура пищевода : В этом состоянии пищевод становится узким, что затрудняет глотание.
- Пищевод Барретта : клетки, выстилающие пищевод, могут превращаться в клетки, похожие на слизистую оболочку кишечника. Это может перерасти в рак.
- Респираторные проблемы : можно вдохнуть желудочную кислоту в легкие, что может вызвать ряд проблем, включая заложенность грудной клетки, охриплость голоса, астму, ларингит и пневмонию.
Любой, кто испытывает частые симптомы кислотного рефлюкса, должен поговорить со своим врачом, который может направить его к специалисту по кишечной медицине, известному как гастроэнтеролог, для дальнейшего исследования.
Существует несколько возможных тестов для диагностики ГЭРБ, в том числе:
- Мониторинг pH пищевода и импеданса : Измеряет количество кислоты в пищеводе, когда организм находится в разных состояниях, например, во время еды или сна.
- Эндоскоп верхних отделов желудочно-кишечного тракта (ЖКТ) : Это трубка с прикрепленной камерой, которая используется для осмотра пищевода.Небольшой образец ткани также может быть взят одновременно с биопсией.
- Серия верхних отделов желудочно-кишечного тракта : это тип рентгеновского снимка, который выявляет определенные физические отклонения, которые могут вызвать ГЭРБ.
- Манометрия пищевода : Измеряет сокращение мышц пищевода во время глотания.
 Он может измерить силу сфинктера.
Он может измерить силу сфинктера. - Беспроводной мониторинг pH пищевода Bravo : В этом тесте к пищеводу прикрепляется небольшая временная капсула.Он измеряет кислотность непрерывно в течение 48 часов.
ГЭРБ часто лечат лекарствами, прежде чем пытаться использовать другие методы лечения.
Ингибиторы протонной помпы — один из основных вариантов фармацевтического лечения людей с ГЭРБ. Они уменьшают количество кислоты, производимой желудком.
Другие варианты включают:
- Блокаторы h3: Это еще один вариант, помогающий снизить выработку кислоты.
- Антациды: Они противодействуют кислоте в желудке с помощью щелочных химикатов.Побочные эффекты могут включать диарею и запор. Антациды можно приобрести в Интернете.
- Prokinetics: Они помогают желудку быстрее опорожняться. Побочные эффекты включают диарею, тошноту и беспокойство.
- Эритромицин: Ths — это тип антибиотика, который также помогает опорожнять желудок.

Хирургические варианты
Если изменение образа жизни не приводит к значительному улучшению симптомов ГЭРБ или лекарства не оказывают желаемого эффекта, гастроэнтеролог может порекомендовать операцию.
Хирургические процедуры включают:
- Фундопликация: Хирург сшивает верхнюю часть желудка вокруг пищевода. Это увеличивает давление на нижний конец пищевода и обычно помогает уменьшить рефлюкс.
- Эндоскопические процедуры: Это диапазон процедур, включающий эндоскопическое шитье, при котором используются швы для сжатия мышцы сфинктера, и радиочастота, при которой тепло используется для образования небольших ожогов, которые помогают подтянуть мышцу сфинктера.
Другие изменения образа жизни и поведения могут помочь облегчить ГЭРБ:
- Ешьте умеренное количество пищи и избегайте переедания.
- Прекратите есть за 2–3 часа до сна.
- Бросьте курить или не курите.
- Если у человека избыточный вес, снижение веса может помочь предотвратить симптомы.

- Не носите одежду, обтягивающую живот.
- Спите под небольшим углом, слегка приподняв голову.
Определенные продукты могут вызывать симптомы ГЭРБ у некоторых людей.
Сюда входят:
- жирные продукты
- острые продукты
- шоколад
- мята перечная
- кофе
- продукты, содержащие томатные продукты
- алкогольные напитки
Если вы избегаете этих продуктов и все еще испытываете регулярную изжогу, Важно посетить врача, так как симптомы могут быть вызваны другими причинами.
Кислотный тест — Science NetLinks
Назначение
Разработать научное исследование для обнаружения кислот и оснований в обычных материалах.
Контекст
В этом упражнении учащиеся приготовят тестовый раствор, цвет которого меняется при добавлении кислоты или основания; определять, являются ли различные бытовые вещества кислотами или щелочами, и искать закономерности в результатах; определить, как их тестовый раствор сравнивается с коммерческими кислотно-щелочными тестерами; и поиск других тестовых решений.
Эти занятия могут быть феноменологическим введением в кислоты и основания, важную концепцию для изучения химии.Одно из свойств кислот и оснований заключается в том, что они меняют цвет некоторых красителей. Если эти красители используются для испытания вещества, появление определенного цвета можно рассматривать как указание на присутствие кислоты или основания в испытуемом веществе.
На этом уровне учащиеся должны стать более систематичными и изощренными в проведении своих исследований, некоторые из которых могут длиться неделями и более. Это означает приближение к пониманию того, что представляет собой хороший эксперимент.Концепция управляющих переменных проста, но реализовать ее на практике сложно. Однако студенты могут добиться определенного прогресса, участвуя в достаточном количестве экспериментальных исследований (не исключая, конечно, других видов исследований) и подробно обсуждая, как объяснение соотносится с планом эксперимента.
Мотивация
Предложите учащимся обсудить, что они знают о кислотах и основаниях, в том числе привести примеры кислотных и основных веществ. Попросите класс согласовать пару веществ, которые, по их мнению, являются кислыми (например, уксус или соляная кислота), а также основными (например, аммиак или щелочь). Составьте список этих веществ и сообщите учащимся, что они будут тестировать некоторые из этих веществ, чтобы определить, действительно ли они являются кислотами или основаниями.
Попросите класс согласовать пару веществ, которые, по их мнению, являются кислыми (например, уксус или соляная кислота), а также основными (например, аммиак или щелочь). Составьте список этих веществ и сообщите учащимся, что они будут тестировать некоторые из этих веществ, чтобы определить, действительно ли они являются кислотами или основаниями.
Развитие
Тестирование с соком краснокочанной капусты
В этой части урока учащиеся знакомятся с явлениями в управляемой манере с использованием веществ, определенных учащимися как кислоты или основания в разделе «Мотивация».Предложите учащимся работать в совместных группах для проведения цветовых тестов в небольших контейнерах с белой внутренней стороной (например, в небольших бумажных стаканчиках). Попросите их выполнить описанную ниже процедуру.
Процедура:
- Добавьте одну столовую ложку (15 мл) капустного сока в каждую из двух чашек. Опишите цвет сока.

- Оставьте одну из чашек в качестве элемента управления (ничего не добавляйте к ней). В другую чашку добавьте несколько капель жидкой кислоты или основания или примерно одну восьмую чайную ложку твердой кислоты или основания.
- Вихревое движение для смешивания испытуемого раствора с кислотой или щелочью.Сразу обратите внимание на цвет и опишите его. (Растворы будут иметь красный диапазон с добавлением кислоты и диапазон от зеленого до синего с добавлением основания. Цвета в основе особенно «хрупкие» и меняют один оттенок на другой за несколько минут.)
Вопросы:
- Если капустный сок разбавить водой, будут ли результаты такие же? Цвета легче или сложнее различать и описывать?
- Каковы результаты, если приготовить и испытать более концентрированный сок?
После того, как студенты обсудят свои результаты, они могут прочитать объяснение того, что происходит в Lose the Indicator Blues !, на веб-сайте WonderNet.
Где в вашем доме кислоты и щелочи?
Дайте студентам капустный сок и попросите их протестировать продукты из дома. Студенты должны рассмотреть целый ряд вещей из кухни, ванной комнаты и стирки. То, что можно проверить, ограничено только необходимостью использования не слишком сильно окрашенных веществ, поскольку цвета могут мешать тестам. Примером могут быть безалкогольные напитки; можно тестировать прозрачные или светлоокрашенные, но очень темные колы, вероятно, не дадут интерпретируемых цветов.В дополнение к простому тестированию множества бытовых веществ, ученики могут исследовать, дают ли твердые вещества, смешанные или измельченные с небольшим количеством воды, перед тестированием другой результат, чем только твердое вещество.
Студенты должны рассмотреть целый ряд вещей из кухни, ванной комнаты и стирки. То, что можно проверить, ограничено только необходимостью использования не слишком сильно окрашенных веществ, поскольку цвета могут мешать тестам. Примером могут быть безалкогольные напитки; можно тестировать прозрачные или светлоокрашенные, но очень темные колы, вероятно, не дадут интерпретируемых цветов.В дополнение к простому тестированию множества бытовых веществ, ученики могут исследовать, дают ли твердые вещества, смешанные или измельченные с небольшим количеством воды, перед тестированием другой результат, чем только твердое вещество.
Каждый студент должен записать шаги, необходимые для проведения своего исследования. При проведении расследования они должны выполнить шаги и записать свои наблюдения / данные.
Задание должно сопровождаться полным обсуждением результатов в классе, включая поиск закономерностей в результатах.Например, некоторые классы веществ могут быть в основном кислотными или основными. Попросите учащихся подумать о причинах наблюдаемых закономерностей.
Попросите учащихся подумать о причинах наблюдаемых закономерностей.
Чем другие кислотно-щелочные тесты соотносятся с вашим?
Начните со сравнения исследований студентов с использованием панели pH из Музея науки Майами. Сюда входят такие вещества, как пищевая сода, аспирин, лавовое мыло, бура и лимонный сок. После того, как студенты изучили кислоты и основания с помощью описанных выше упражнений, они готовы расширить свои знания с помощью дальнейших исследований.
Вопросы для расследования включают:
- Как соотносятся результаты с капустным соком с результатами (для тех же образцов) из коммерческого набора для кислотно-щелочного анализа для аквариумов или почв?
- Какой тест может определить разницу между самым широким диапазоном образцов?
- Какие другие виды ярко окрашенных растворов (например, фруктовые соки) можно использовать для проверки кислот и щелочей?
- Можно ли сделать более удобные кислотно-щелочные тестеры, смочив фильтровальную бумагу в соке и используя высушенную бумагу в качестве тестера?
Этим не исчерпываются вопросы, которые студенты могут захотеть изучить, но каждая студенческая команда должна попробовать хотя бы один из этих трех, поскольку результаты помогут классу лучше понять, как действуют кислоты и основания.
Каждая группа должна четко определить свое расследование и процедуры и задокументировать свою работу. Эта документация должна включать четкое представление их данных и объяснение того, как они использовали средства контроля в своем расследовании. Студенческие группы должны сообщить классу о своих выводах.
Оценка
Оценка работы студентов может быть основана на качестве данных, которые они собирают, чтобы ответить на исследуемый вопрос (ы); использование соответствующих средств контроля; и объяснения, которые согласуются с экспериментальными результатами и принципами, которые студенты должны знать и уметь использовать.
В презентациях в классе учащиеся должны подробно объяснить свои экспериментальные планы и обсудить, как они соотносятся со своими выводами или объяснениями относительно кислот и оснований.
Добавочные номера
Не задерживайте дыхание; посмотреть, что в нем:
Студенты могут работать в кооперативных группах, но каждый должен иметь возможность проверить свое дыхание, чтобы определить его влияние на цвет капустного сока. Самый эффективный способ сделать анализ — в пробирках, заполненных соком примерно на треть.Одну пробирку следует оставить в качестве контрольной для сравнения цветов, и ученик должен аккуратно и равномерно подуть через трубочку в другую. Чтобы изменения стали очевидными, нужно время, потому что газы не растворяются в воде быстро.
После того, как наблюдения были сделаны и записаны, класс должен обсудить их и попытаться интерпретировать их с точки зрения того, что они знают о газах в выдыхаемом воздухе (около 80% азота, 16% кислорода и 4% углекислого газа). Как можно проверить интерпретацию (и)? Есть ли способы производить и проверять газ (ы), которые считаются ответственными?
Отправьте нам отзыв об этом уроке>
Лечение гастроэзофагеальной рефлюксной болезни (ГЭРБ)
пациентов в Johns Hopkins получают помощь в нашем уникальном многопрофильном центре, специализирующемся на ГЭРБ и других рефлюксных расстройствах.Специалисты из разных областей, включая хирургию, гастроэнтерологию, уши, нос и горло, встречаются, чтобы обсудить сложные случаи рефлюкса. Мы обсуждаем случаи и составляем индивидуальные планы лечения.
Наши большие объемы и передовые технологии в сочетании с опытными специалистами означают, что вы получаете превосходное обслуживание, которого заслуживаете.
Подходы к лечению ГЭРБ в Johns Hopkins
Существует четыре подхода к лечению ГЭРБ, включая медикаментозное лечение и хирургическое вмешательство.Часто пациенты хорошо реагируют на сочетание изменения образа жизни и режима приема лекарств.
Некоторым пациентам эти методы не приносят удовлетворительного облегчения, и им требуется хирургическое вмешательство. Другие пациенты могут выбрать операцию в качестве альтернативы пожизненному приему лекарств.
Лечение ГЭРБ включает:
- Образ жизни и диетические изменения
- Лекарства
- Эндоскопическая терапия
- Хирургия
Лечение ГЭРБ: изменения образа жизни и питания
Изменение диеты и образа жизни — первый шаг в лечении ГЭРБ.Некоторые продукты ухудшают рефлюкс. Предложения по облегчению симптомов включают:
- Похудейте, если у вас избыточный вес — из всех изменений в образе жизни, которые вы можете сделать, это самое эффективное.
- Избегайте продуктов, повышающих уровень кислоты в желудке, включая напитки с кофеином.
- Избегайте продуктов, снижающих давление в нижних отделах пищевода, например жирной пищи, алкоголя и перечной мяты.
- Избегайте продуктов, влияющих на перистальтику (движения мышц в пищеварительном тракте), таких как кофе, алкоголь и кислые жидкости.
- Избегайте продуктов, которые замедляют опорожнение желудка, включая жирную пищу.
- Избегайте больших приемов пищи.
- Бросить курить.
- Не ложитесь сразу после еды.
- Ложитесь, приподнимите голову.
Лечение ГЭРБ: лекарства
Если изменения в образе жизни и диете не помогают, ваш врач может назначить определенные лекарства. Есть две категории лекарств от рефлюкса. Один снижает уровень кислоты в желудке, а другой увеличивает уровень моторики (движения) в верхних отделах желудочно-кишечного тракта.
Антациды
Антациды, отпускаемые без рецепта, лучше всего подходят при прерывистых и относительно нечастых симптомах рефлюкса. При частом приеме антациды могут усугубить проблему. Они быстро покидают желудок, и в результате в желудке увеличивается выработка кислоты.
Блокаторы гистамина
Блокаторы гистамина 2 (h3) — это препараты, которые помогают снизить секрецию кислоты. Блокаторы h3 излечивают эрозии пищевода примерно у 50 процентов пациентов.
Ингибиторы протонной помпы
Ингибиторы протонной помпы (ИПП) — это препараты, которые блокируют три основных пути производства кислоты.ИПП подавляют выработку кислоты намного эффективнее, чем блокаторы h3. ИПП излечивают эрозивный эзофагит у многих пациентов, даже с тяжелым поражением пищевода.
Прокинетические агенты
Прокинетические агенты — это препараты, повышающие активность гладкой мускулатуры желудочно-кишечного тракта. Эти препараты несколько менее эффективны, чем ИПП. Ваш врач может назначить их в сочетании с препаратами, подавляющими кислотность.
TIF и другая эндоскопическая терапия
Трансоральная фундопликация без разреза (TIF) — это вариант лечения ГЭРБ.TIF может означать более короткое время лечения, меньшую боль и более быстрое восстановление по сравнению с лапароскопической операцией. Процедура включает использование специального устройства TIF для создания прохода для гибкого трубчатого инструмента визуализации, называемого эндоскопом. Процедура позволяет врачу использовать предварительно нагруженный пинцет и застежки для ремонта или воссоздания клапана, который служит естественным барьером для рефлюкса.
В настоящее время проводятся клинические испытания эффективности эндоскопической терапии ГЭРБ. В одной из форм терапии используется эндоскопическая швейная машина для наложения швов на желудок и увеличения антирефлюксного барьера.
Операция по поводу ГЭРБ
Если ваши симптомы не улучшились после изменения образа жизни или медикаментозной терапии, вы можете быть кандидатом на операцию. Некоторые пациенты предпочитают хирургический подход в качестве альтернативы пожизненному приему лекарств. Цель операции при рефлюксной болезни — укрепить антирефлюксный барьер.
Во время процедуры, известной как фундопликация Ниссена, ваш хирург оборачивает верхнюю часть вашего желудка вокруг нижней части пищевода. Это усиливает антирефлюксный барьер и может обеспечить постоянное облегчение от рефлюкса.Ваш хирург может выполнить эту операцию лапароскопически, что означает менее инвазивную процедуру с более коротким временем восстановления.
Экстраэзофагеальные проявления
Рефлюкс может поражать не только пищевод. Рефлюкс может привести к воспалению глотки (часть глотки сразу за ртом) и гортани (голосовой ящик). Это также может вызвать бронхит, астму или пневмонию. Если очевидных причин воспаления нет, врач может заподозрить рефлюкс. Цель лечения — улучшить симптомы с помощью лекарств.
Пассивация
азотной и лимонной кислотой для нержавеющей стали (SS) и Ti
Пассивация
азотной и лимонной кислотой: в чем разница?
Многие спрашивают, чем отличаются азотная кислота и лимонная кислота для пассивирования деталей из нержавеющей стали (SS), титана (Ti) и других сплавов. И азотная, и лимонная кислоты эффективны для пассивирования многих марок нержавеющей стали, и оба метода подробно описаны в отраслевых стандартах ASTM A967 и AMS 2700.Однако пассивация титана обычно регулируется ASTM F86, который определяет только азотную кислоту, а не лимонную кислоту.
Так в чем разница между азотной и лимонной пассивацией? По сравнению с методом пассивации азотной кислотой, пассивация лимонной кислотой составляет:
- Более новые — начали приниматься в 1990-е годы
- Более экологически чистый — отсутствие паров оксида азота (NOx), которые способствуют образованию смога и кислотных дождей и влияют на озоновый слой атмосферы
- Безопаснее — неопасный материал не требует специального обращения или надзора со стороны регулирующих органов и не вызывает коррозии другого оборудования.
В 1960-х годах военные США определили первые спецификации для пассивации с использованием азотной кислоты в стандарте QQ-P-35. Однако со временем опасность использования азотной кислоты для окружающей среды и безопасности стала более очевидной. Поиск эффективной и безопасной альтернативы был выполнен с использованием пассивации лимонной кислотой , которая начала применяться в 1990-х годах.
Отраслевые стандарты для пассивации лимонной кислотой сначала появились в аэрокосмической промышленности, где стандарт QQ-P-35 стал AMS-QQ-P-35, который позже был заменен стандартом AMS 2700 в начале 2000-х годов.Для других отраслей, таких как медицинское оборудование, отраслевой стандарт ASTM A967 заменил старый стандарт QQ-P-35 в 2005 году.
Сегодня как азотная, так и лимонная кислоты являются широко используемыми и признанными в промышленности методами пассивации.
Пассивация азотной кислотой
Являясь традиционным методом пассивации, азотная кислота предлагает преимущество проверенного, хорошо зарекомендовавшего себя процесса. Для тех, кто привержен использованию азотной пассивации, существует множество вариантов оптимизации производительности с использованием конкретной марки нержавеющей стали.
Менее коррозионно-стойкие марки нержавеющих сталей имеют больший риск травления, также известного как вспышка, во время пассивации в азотной кислоте. Чтобы снизить этот риск, можно использовать следующие подходы:
- Добавление дихромата натрия к азотной кислоте
- Более высокая концентрация азотной кислоты
- Более высокая температура азотной кислоты.
Обратите внимание, что даже несмотря на то, что эти параметры снижают риск травления, они увеличивают риски для безопасности рабочих, связанные с опасными химическими веществами.Дихромат натрия — это соединение шестивалентного хрома и известный канцероген.
Варианты пассивации азотной кислотой в соответствии с ASTM A967
| Тип | Химия | Температура | Время | Лучшее для |
| Азотная 1 | 20-25% азотной кислоты по объему, 2,5% +/- 0,5% бихромата натрия по массе | 120 — 130 ° F | 20 мин.минимум |
|
| Азот 2 | 20-45% азотной кислоты по объему | 70-90 ° F | 30 мин. минимум |
|
| Азот 3 | 20-25% азотной кислоты по объему | 120–140 ° F | 20 мин.минимум |
|
| Азотная 4 | 45-55% азотной кислоты по объему | 120 — 130 ° F | 30 мин. минимум |
|
| Азотная 5 | Другие комбинации температуры, времени, концентрации азотной кислоты и других химикатов, позволяющие производить детали, соответствующие требованиям испытаний ASTM A967. | |||
Азотная кислота сама по себе является опасным химическим веществом, которое выделяет токсичные и коррозионные пары, и поэтому требует особого внимания к вентиляции и безопасному обращению с химическими веществами. Хотя азотная кислота не является канцерогеном, она может быстро вызвать тяжелые химические ожоги. Выбросы азотной кислоты в атмосферу вызывают кислотные дожди и смог, а также могут повлиять на озоновый слой. Все это объясняет, почему промышленное использование азотной кислоты строго регулируется с жесткими требованиями к безопасности труда и защите окружающей среды.
Пассивация лимонной кислотой
Пассивация лимонной кислотой является более безопасной и экологически чистой альтернативой пассивации азотной кислотой. Лимонная кислота — это органическая кислота, которую получают из цитрусовых, таких как апельсины, и поэтому она безопасна для сотрудников. Пары лимонной кислоты не токсичны и не вредны для атмосферы. Лимонная пассивация соответствует всем действующим отраслевым стандартам и эффективна практически для всех марок нержавеющей стали.
В прошлом некоторые производители избегали лимонной кислоты из-за потенциального органического роста и проблем с формованием.Сегодня лимонная кислота улучшилась благодаря новым составам биоцидов, которые предотвращают рост органических веществ в растворе. Эти новые достижения позволили более мелким производителям, у которых практически не было опыта работы с химическими веществами, внедрить свой процесс пассивации внутри компании.
Сравнение лимонной пассивации и азотной пассивации также обеспечивает более короткое время цикла. Детали можно обработать всего за 4 минуты при использовании лимонной кислоты по сравнению с минимум 20 минутами при использовании азотной кислоты.
Как и в случае с азотной кислотой, при пассивации лимонной кислотой важно поддерживать баланс между температурой, временем погружения и концентрацией кислоты, чтобы избежать проблемы неконтролируемой коррозии, известной как мгновенное воздействие.
Варианты пассивации лимонной кислотой в ASTM A967
| Тип | Химия | Температура | Время |
| лимонный 1 | 4-10% лимонной кислоты по массе * | 140 — 160 ° F | 4 мин. минимум |
| лимонный 2 | 4-10% лимонной кислоты по массе | 120–140 ° F | 10 мин. минимум |
| лимонный 3 | 4-10% лимонной кислоты по массе | 70–120 ° F | 20 мин.минимум |
| лимонный 4 | Другие комбинации температуры, времени, концентрации лимонной кислоты и других химикатов, из которых производятся детали, соответствующие требованиям испытаний ASTM A967. | ||
| лимонный 5 | То же, что и Citric 4, за исключением того, что значение pH в иммерсионной ванне должно поддерживаться в диапазоне 1,8–2,2. | ||
* Обратите внимание, что процентное содержание лимонной кислоты измеряется по весу, а процентное содержание азотной кислоты измеряется по объему.
Подробнее о пассивации лимонной кислотой см. На нашей странице Пассивация лимонной кислотой , включая Руководство по совместимости для различных марок нержавеющей стали.
В следующей таблице приведены основные различия между азотной и лимонной пассивацией .
Сводное сравнение: азотная и лимонная пассивация
Азотная кислота | Лимонная кислота | |
| Безопасность | Требуются опасные операции | Очень безопасно использовать в соответствии с указаниями |
| Воздух для дыхания | Выбрасывает токсичные и едкие газы | Не выделяет токсичных и едких газов |
| Простота использования | Оборудование для обеспечения безопасности при работе с химическими веществами и особая осторожность, необходимая для большинства случаев использования | Минимальное необходимое оборудование для обеспечения безопасности при обращении с химическими веществами |
| Пассивация | Превосходная пассивация большинства марок нержавеющей стали | Превосходная пассивация почти всех марок нержавеющей стали |
| Окружающая среда | Опасно для окружающей среды | Экологичность |
| Стоимость |
|
|
| Продолжительность процесса пассивации | От 20 минут до нескольких часов | Обычно 5-20 минут |
| Температура процесса |
|
|
| Техническое обслуживание химических процессов | Требуется регулярный мониторинг раствора (титрование) | Требуется регулярный контроль раствора (удельный вес) |
| Удаление оксида железа | Медленно удаляет оксиды железа | Легко удаляет оксиды железа |
| Оборудование | Долговременное коррозионное разложение оборудования или компонентов из металлических или полимерных материалов, отличных от нержавеющей стали | Отсутствие коррозионного разрушения оборудования |
| Стабильность процесса | Необходимо тщательно контролировать время и температуру, так как существует опасность газообразного оксида азота — требуется надлежащая вентиляция | Менее подвержен колебаниям температуры и времени, не опасен паров |
| ASTM A967 | Отвечает требованиям | Отвечает требованиям |
| AMS 2700 | Отвечает требованиям | Отвечает требованиям |
| ASTM A380 | Отвечает требованиям, указанным в ASTM A967 | Отвечает требованиям, указанным в ASTM A967 |
| AMS QQ-P-35 | Отвечает требованиям AMS 2700 и ASTM A967 | Теперь ссылка на AMS 2700 и ASTM A967 |
Чтобы узнать больше о азотной и лимонной пассивации , отраслевые стандарты и спецификации , пожалуйста, посетите нашу страницу «Что такое пассивация?»
Сегодня многие компании по-новому смотрят на лимонную кислоту из-за простоты обращения с химическими веществами, утилизации и общей безопасности для сотрудников. Все это становится более сложной задачей при использовании пассивации азотной кислотой по сравнению с пассивацией лимонной кислотой.Best Technology тесно сотрудничает со многими компаниями в области авиакосмической промышленности и производства медицинского оборудования и успешно помогла этим компаниям перейти с азотной кислоты на лимонную. Часто это так же просто, как поговорить с конечным потребителем и показать ему эквивалентность типов пассивации.
Видео: Автоматическая настраиваемая система азотной и лимонной пассивации
Необходима пассивация как азотной, так и лимонной кислотой? Эта система справится со всем.Эта система 3-в-1 предлагает 3 различных варианта автоматической пассивации:
- Азотная кислота
- Азотная кислота с бихроматом натрия
- Лимонная кислота.
Ключевым преимуществом автоматизированной системы пассивации является то, что она разработана для работы в режиме замкнутого цикла, поэтому оператор не подвергается воздействию химических веществ, таких как азотная кислота.
Интересует оборудование?
Best Technology — признанный лидер в области оборудования, систем, резервуаров и линий для пассивации.Наше автоматическое пассивирующее оборудование особенно хорошо подходит для пассивации азотной кислотой из-за уменьшения взаимодействия рабочего с опасными химическими веществами. Будь то пассивация лимонной или азотной кислотой, Best Technology может предоставить систему, подходящую для вашей компании.
Виды пассивационного оборудования
Если не указано иное, каждый из этих типов пассивирующего оборудования может быть сконструирован для работы с лимонной или азотной кислотой. Системы с азотной кислотой требуют дополнительной вентиляции в конструкции системы, поэтому важно понимать, какой химический состав вы будете использовать при выборе оборудования для пассивации.
Проконсультируйтесь со специалистом
Нужен совет по пассивации азотной или лимонной кислотой или планирование линии пассивации? Хотите перейти от азотной кислоты к лимонной? Мы можем помочь. Свяжитесь со специалистом по пассивации в Best Technology, чтобы узнать больше.
10 Обычные кислоты и химические структуры
Вот список из десяти распространенных кислот с химической структурой. Кислоты — это соединения, которые диссоциируют в воде, отдавая ионы / протоны водорода или принимая электроны.
Уксусная кислота
Уксусная кислота также известна как этановая кислота.ЛАГУНА ДИЗАЙН / Getty Images
Уксусная кислота: HC 2 H 3 O 2
Также известна как этановая кислота, Ch4COOH, AcOH.
Уксусная кислота содержится в уксусе. Уксус содержит от 5 до 20 процентов уксусной кислоты. Эта слабая кислота чаще всего встречается в жидкой форме. Чистая уксусная кислота (ледяная) кристаллизуется при температуре чуть ниже комнатной.
Борная кислота
Это химическая структура борной кислоты: бор (розовый), водород (белый) и кислород (красный).ЛАГУНА ДИЗАЙН / Getty Images
Борная кислота: H 3 BO 3
Также известна как acidum boricum, водород ортоборат
Борная кислота может использоваться как дезинфицирующее средство или пестицид. Обычно это белый кристаллический порошок. Бура (тетраборат натрия) — знакомое родственное соединение.
Угольная кислота
Это химическая структура угольной кислоты.
ЛАГУНА ДИЗАЙН / Getty Images
Угольная кислота: CH 2 O 3
Также известна как: воздушная кислота, кислота воздуха, дигидрокарбонат, кигидроксикетон.
Растворы углекислого газа в воде (газированная вода) можно назвать угольной кислотой. Это единственная кислота, которая выделяется легкими в виде газа. Угольная кислота — слабая кислота. Он отвечает за растворение известняка с образованием геологических объектов, таких как сталагмиты и сталактиты.
Лимонная кислота
Лимонная кислота — это слабая кислота, которая содержится в цитрусовых и используется в качестве натурального консерванта и для придания кислого вкуса. Атомы представлены в виде сфер и имеют цветовую маркировку: углерод (серый), водород (белый) и кислород (красный).ЛАГУНА ДИЗАЙН / Getty Images
Лимонная кислота: H 3 C 6 H 5 O 7
Также известна как: 2-гидрокси-1,2,3-пропантрикарбоновая кислота.
Лимонная кислота — это слабая органическая кислота, получившая свое название из-за того, что она является натуральной кислотой цитрусовых. Это химическое вещество является промежуточным звеном в цикле лимонной кислоты, который играет ключевую роль в аэробном метаболизме. Кислота широко используется в качестве ароматизатора и подкислителя в пищевых продуктах. Чистая лимонная кислота имеет острый терпкий вкус.
соляная кислота
Это химическая структура соляной кислоты: хлор (зеленый) и водород (белый).
ЛАГУНА ДИЗАЙН / Getty Images
Соляная кислота: HCl
Также известна как морская кислота, хлороний, солевой спирт.
Соляная кислота — это чистая, сильно коррозионная сильная кислота. Он находится в разбавленном виде как соляная кислота. Это химическое вещество имеет множество промышленных и лабораторных применений. Соляная кислота для промышленных целей обычно составляет от 20 до 35 процентов соляной кислоты, а соляная кислота для бытовых целей составляет от 10 до 12 процентов соляной кислоты.HCl — это кислота, содержащаяся в желудочном соке.
Плавиковая кислота
Это химическая структура плавиковой кислоты: фтор (голубой) и водород (белый).
ЛАГУНА ДИЗАЙН / Getty Images
Плавиковая кислота: HF
Также известна как: фтористый водород, гидрофторид, монофторид водорода, фтористоводородная кислота.
Хотя фтористоводородная кислота очень агрессивна, она считается слабой кислотой, потому что она обычно не диссоциирует полностью. Кислота поедает стекло и металлы, поэтому HF хранится в пластиковых контейнерах.При попадании на кожу фтористоводородная кислота проходит через мягкие ткани и поражает кости. HF используется для производства соединений фтора, включая тефлон и прозак.
Азотная кислота
Это химическая структура азотной кислоты: водород (белый), азот (синий) и кислород (красный).
ЛАГУНА ДИЗАЙН / Getty Images
Азотная кислота: HNO 3
Также известна как: aqua fortis, азотовая кислота, гравировальная кислота, нитроспирт.
Азотная кислота — сильная минеральная кислота. В чистом виде это бесцветная жидкость.Со временем он приобретает желтый цвет в результате разложения на оксиды азота и воду. Азотная кислота используется для изготовления взрывчатых веществ и чернил, а также в качестве сильного окислителя для промышленного и лабораторного использования.
щавелевая кислота
Это химическая структура щавелевой кислоты.
Тодд Хелменстайн
Щавелевая кислота: H 2 C 2 O 4
Также известны как этандиовая кислота, оксалат водорода, этандионат, ацидум щавелевый, HOOCCOOH, оксировая кислота.
Щавелевая кислота получила свое название потому, что впервые была выделена в виде соли из щавеля ( Oxalis sp.). Кислоты относительно много в зеленой, листовой пище. Он также содержится в чистящих средствах для металла, антикоррозионных средствах и некоторых типах отбеливателей. Щавелевая кислота — слабая кислота.
фосфорная кислота
Фосфорная кислота также известна как ортофосфорная кислота или фосфорная (V) кислота.
Бен Миллс
Фосфорная кислота: H 3 PO 4
Также известна как ортофосфорная кислота, тригидрофосфат, ацидум фосфорный.
Фосфорная кислота — это минеральная кислота, которая используется в бытовых чистящих средствах в качестве химического реагента, ингибитора ржавчины и зубного травителя.Фосфорная кислота также является важной кислотой в биохимии. Это сильная кислота.
Серная кислота
Это химическая структура серной кислоты.
Серная кислота: H 2 SO 4
Также известна как: аккумуляторная кислота, кислота для окунания, матирующая кислота, Terra Alba, купоросное масло.
Серная кислота — это сильная минеральная кислота, вызывающая коррозию. Хотя обычно прозрачный или слегка желтоватый, он может быть окрашен в темно-коричневый цвет, чтобы привлечь внимание людей к его составу. Серная кислота вызывает серьезные химические ожоги, а также термические ожоги в результате экзотермической реакции дегидратации.Кислота используется в свинцовых батареях, очистителях стоков и химическом синтезе.
Ключевые моменты
- Кислоты обычны в повседневной жизни. Они находятся в клетках и пищеварительной системе, естественным образом встречаются в продуктах питания и используются во многих обычных химических реакциях.
- Общие сильные кислоты включают соляную кислоту, серную кислоту, фосфорную кислоту и азотную кислоту.
- Общие слабые кислоты включают уксусную кислоту, борную кислоту, фтористоводородную кислоту, щавелевую кислоту, лимонную кислоту и угольную кислоту.
Обнаружение ТСХ серной кислоты
Для измерения воздействия серной кислоты на рабочих необходимо выполнить отбор проб воздуха в течение всей смены для сравнения с 8-часовым средневзвешенным по времени пределом или в течение 5 минут для сравнения с кратковременным пределом воздействия MSHA . В течение рабочей смены можно собрать несколько краткосрочных образцов для расчета взвешенной по времени экспозиции при полной смене. Метод NIOSH 7903 используется для измерения содержания серной кислоты в воздухе. 25 сентября 2005 г. · 100 мл 10% серной кислоты.п-анисальдегид. 9,2 мл п-метоксибензальдегида 3,75 мл уксусной кислоты 338 мл 95% этанола 12,5 мл концентрированной серной кислоты. Молибдат церия (окраска Ханессиана) 5 г CeSO 4 25 г (NH 4) Mo 7 O 24 · 4H 2 O 450 мл воды 50 мл концентрированной серной кислоты. Сульфат церия. 8 г Ce (SO 4) 2 · 2H 2 SO 4 100 мл 15% серной кислоты …
Концентрация серной кислоты в атмосфере в Хиёси, Иокогама, с января по октябрь 1985 года составляла 0,13 ~ 0,95 мкг / м3. Предел обнаружения серной кислоты этим методом составил 0.005 мкг / м3 при отборе 4 м3 воздуха. AB — Был исследован метод определения серной кислоты в атмосфере с помощью ионной хроматографии. Воздух сушат, пропуская через серную кислоту, дегидратирующий агент. Это сделано во избежание кислотного тумана и коррозии в выходных трубах. Охлажденный триоксид серы из последнего слоя катализатора растворяют в 98% -ной серной кислоте в абсорбционной башне.
Купоросное масло, серная кислота, дигидросульфат, матирующая кислота, аккумуляторная кислота, окунающая кислота, сернистая кислота, электролитная кислота, сернокислый купорос, коричневое масло купоросного цвета.Химическое название или материал. Серная кислота, 1 н. (0,5 М) стандартный раствор. Показать больше Показать меньше Серная кислота 1,0 M (2,0 N) аналитический объемный раствор (AVL), Reagecon 5 L Sulfuric Acid Acids
Серная кислота используется в химическом и фармацевтическом производстве в качестве реагента, как осушающий агент, а также в качестве противодействующего вещества. ион для основных соединений. Серная кислота не имеет УФ-активности, но может быть определена с помощью ELSD и определения проводимости. Часто требуется количественное определение серной кислоты вместе с основным основным соединением.Хроматографическое удерживание … Фенол-сернокислотный метод — это простой и быстрый колориметрический метод определения общего количества углеводов в образце.


