Содержание
Валентность и степень окисления
☰
Валентность химического элемента определяет сколько одинарных химических связей способны образовывать атомы этого элемента с другими атомами. Атомы многих химических элементов могут проявлять разную валентность.
Химическую связь образует общая электронная пара двух атомов, которая образуется в ковалентной связи. Таким образом, валентность атомов определяется только в ковалентных соединениях. В ионной и металлической связи нет общих электронных пар, поэтому для веществ с такой связью понятие валентности не уместно.
Поскольку на внешнем энергетическом уровне атома не может быть больше 8 электронов, то валентность атомов разных химических элементов изменяется от I до VIII.
В структурных формулах молекул валентность изображают черточками между атомами. Сколько черточек отходит от одного атома, такова и его валентность.
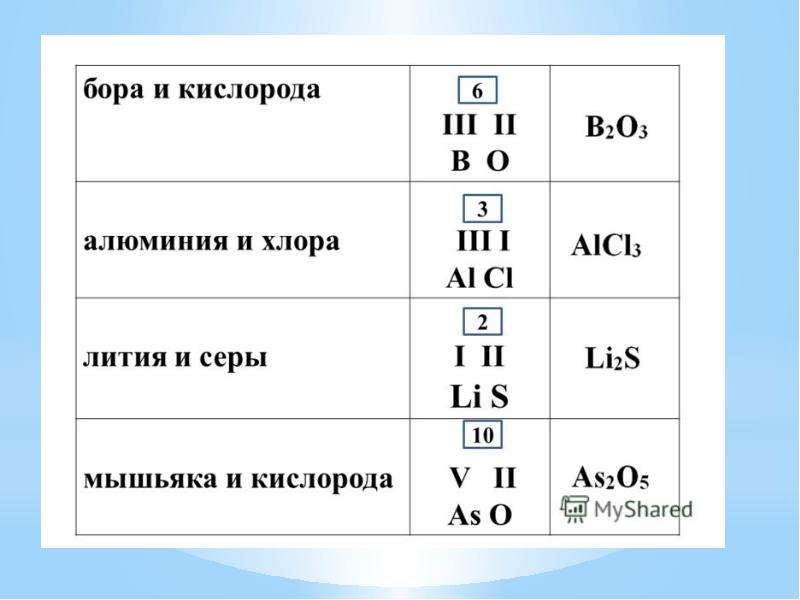
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится.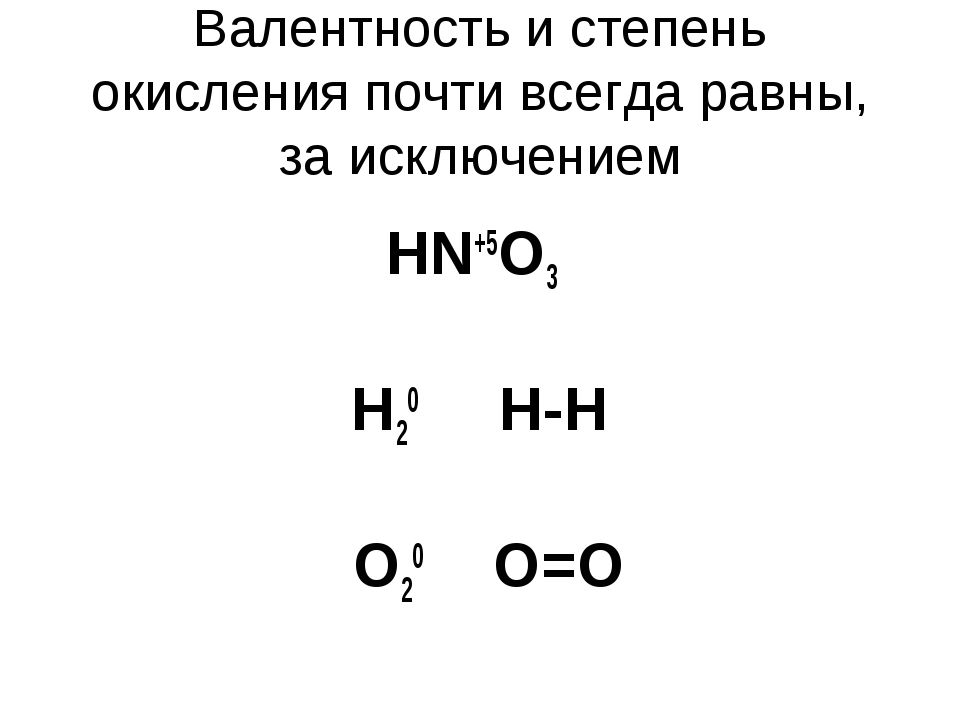 Так, углерод находится в IV группе и его высший оксид — CO2. Для натрия — Na2O, для хлора — Cl2O7.
Так, углерод находится в IV группе и его высший оксид — CO2. Для натрия — Na2O, для хлора — Cl2O7.
Однако обычно атом проявляет валентность, равную количеству его неспаренных электронов. Так у галогенов — это один электрон, у кислорода — два, у водорода и щелочных металлов — по одному.
Степень окисления, по сравнению с валентностью, более универсальное понятие. Оно не зависит от вида химической связи и является характеристикой для соединений как с ковалентной, так и ионной и металлической связью. Степень окисления — это условный заряд на атоме в веществе. При определении степени окисления делают предположение, что все связи в соединении ионные. Степень окисления может быть положительной, отрицательной, нулевой.
В простых случаях степень окисления совпадает с зарядами ионов. Однако в отличие от заряда ионов степень окисления записывают после знака «+» или «-». Например:
Na+Cl—, Ca+2O-2, C+4O2-2
Поскольку металлы обычно образуют ионные связи неметаллами, то под их валентность понимают именно степень окисления.
В простых веществах степень окисления атомов считают равной нулю. Однако валентность не равна нулю, она равна числу общих электронных пар между атомами. Например, в молекуле h3 валентность атомов равна I, а степень окисления 0.
Отрицательную степень окисления имеют атомы с большей электроотрицательностью. Так в хлориде калия K+1Cl-1 электронная пара смещена к хлору.
При определении степеней окисления атомов в молекуле следует иметь в виду, что сумма степеней окисления должна быть равна нулю, так как молекула электронейтральна.
Урок 32. валентность и степень окисления. правила определения степеней окисления элементов — Химия — 8 класс
Урок
Конспект
Дополнительные материалы
Конспект
Валентность и степень окисления. Правила определения степеней окисления эле-ментов
Правила определения степеней окисления эле-ментов
Валентность – это свойство атома химического элемента присоединять или заме-щать определённое число атомов другого химического элемента.
Определим валентность элементов в метане Ch5, аммиаке Nh4, воде h3O и хлоро-водороде HCl. Валентность водорода равна единице.
Эти вещества образованны ковалентной полярной химической связью. Рассмотрим графические формулы этих веществ:
Углерод образует четыре общие электронные пары с атомами водорода – валентность углерода в метане равна четырём. Атом азота образует три общие электронные пары с атомами водорода – валентность азота в аммиаке равна трём. Атом кислорода образует две общие электронные пары с атомами водорода, валентность кислорода в воде – два. Атом хлора образует одну общую электронную пару с атомом водорода, валентность хлора в этом соединении равна одному. Валентность не может быть равна нулю, иметь положительное или отрицательное значение.
Рассмотрим ионное соединение фторид натрия.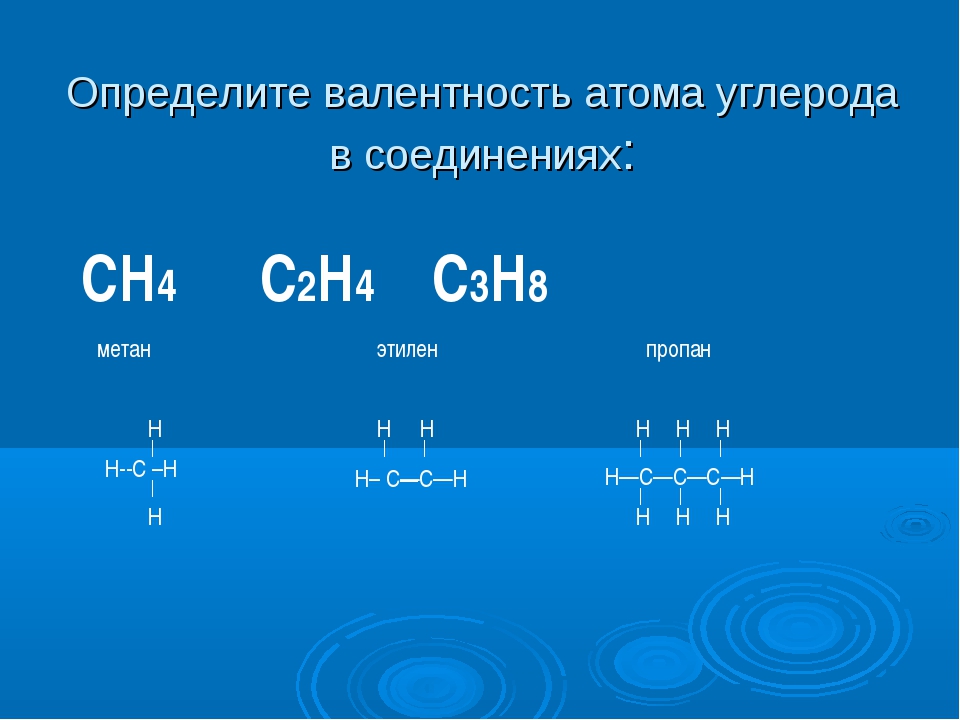 При образовании этого вещества атом натрия отдал свой электрон атому фтора:
При образовании этого вещества атом натрия отдал свой электрон атому фтора:
В молекуле воды на атомах тоже есть заряды, только частичные:
Если предположить, что электроны полностью сместятся к более электроотрицательному кислороду, то можно определить условные заряды, которые называются степенью окисления: Na+1F-1, h3+1O-2
Степень окисления – это условный заряд атома в соединении, рассчитанный исходя из условия, что все связи в соединении ионные. Степень окисления может иметь положительное, отрицательное и нулевое значение:
Определить степень окисления химических элементов в соединениях можно, используя правила:
— в простых веществах степень окисления атомов химических элементов равна нулю;
— в сложных веществах кислород обычно имеет степень окисления –2
— в сложных веществах водород обычно имеет степень окисления +1 (кроме соединений с металлами
— металлы I-IIIA групп проявляют степень окисления, совпадающую с зарядом их иона в солях
— сумма степеней окисления всех атомов химических элементов в веществе равна нулю
Определим степень окисления серы в серной кислоте
1. Суммарный заряд всех атомов водорода плюс два: 2 * (+1) = +2.
Суммарный заряд всех атомов водорода плюс два: 2 * (+1) = +2.
2. Суммарный заряд всех атомов кислорода минус восемь: 4 * (–2) = –8.
3. Молекула электронейтральна, поэтому: +2 + х – 8 = 0
4. х = +6
Степень окисления серы + 6
4. Валентность. Степень окисления химических элементов
Тема № 4. Валентность химических элементов. Степень окисления химических элементов
Рекомендованные видеоуроки
Дополнительные видеоуроки, рекомендованные к просмотру
Теоретический материал
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
— неспаренных электронов;
— неподеленных электронных пар;
— вакантных валентных орбиталей.
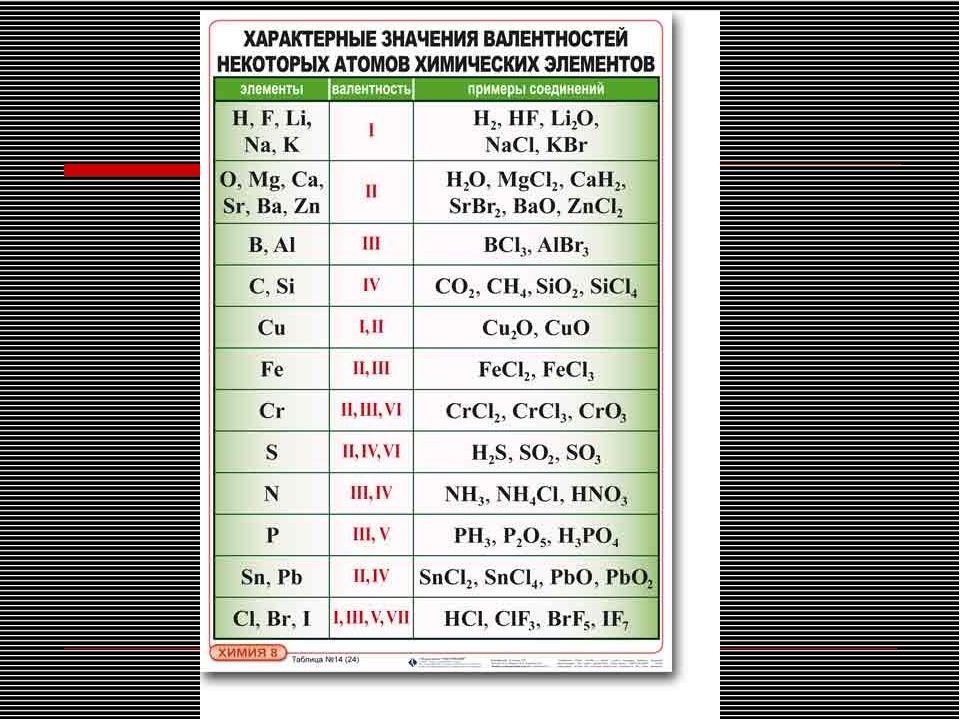
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I (единицу).
2. Кислород в своих соединениях всегда проявляет валентность II.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — № группы.
5. Валентность может быть постоянной или переменной.
6. Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример.
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор (P) проявляет валентности V и III.
Запомни!!!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики.
НО!!!
СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1.
Аналогично во всех пероксидах валентность кислорода равна II.
N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
H2I, N2III, O2II, F2I, Cl2I, Br2I, I2I, а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления – это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение.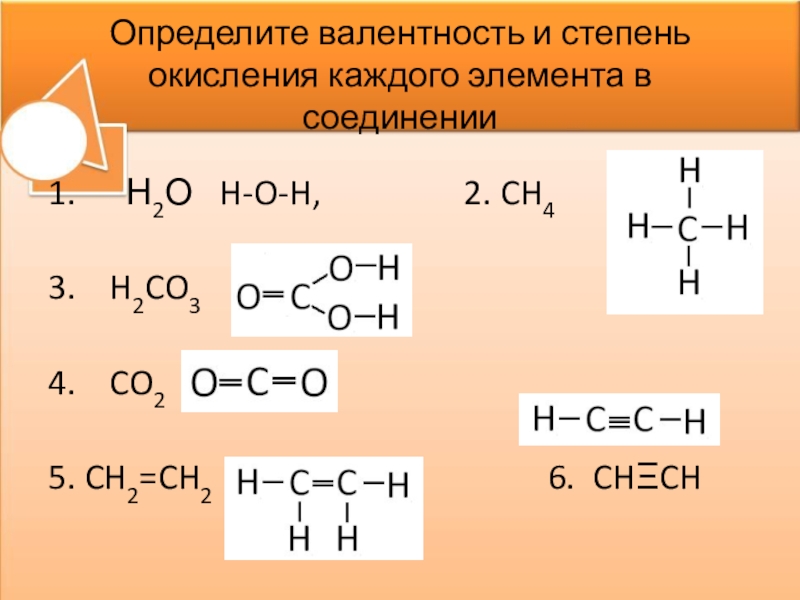 Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю!!!
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения:
1. Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si+4H4—, B2+3H6—, B+3H3—, где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1 (Na+H—, Ca+2h3—).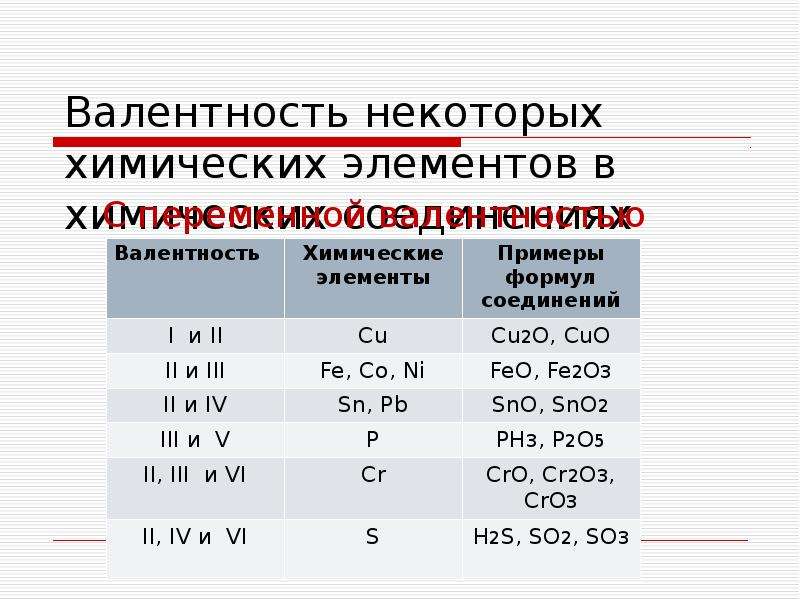
2. Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2+O2—, Na2+O2—, Ba+2O2— и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2+F2—, O+2F2—.
3. Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
4. Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
5. Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
Высшая степень окисления: +№ группы.
Низшая степень окисления: +№ группы — 8.
Промежуточная степень окисления: +№ группы — 2.
Пример:
Фосфор (P):
Высшая степень окисления: +5.
Низшая степень окисления: -3
Промежуточная степень окисления: +3
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Пример:
Задание.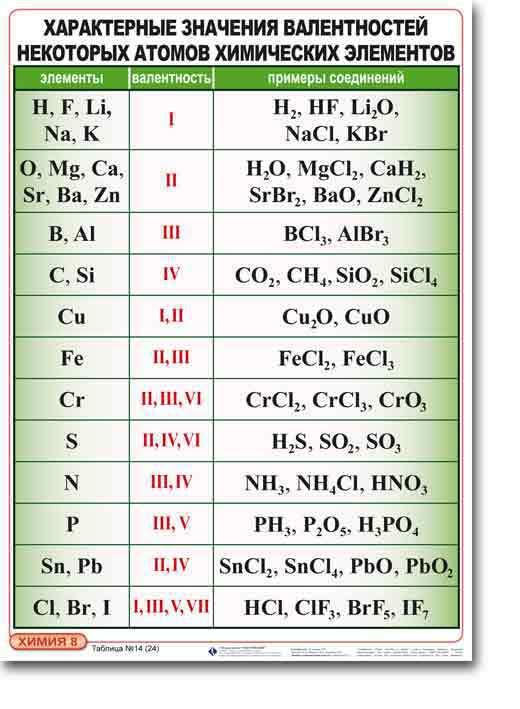 Определите степени окисления всех элементов в соединение N2O5
Определите степени окисления всех элементов в соединение N2O5
Решение. В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Пример:
Задание. Определите степени окисления всех элементов в соединение Na2SO4.
Решение. Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Отсюда х = +6.
Пример:
Задание. Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение. Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение:
2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Использованные интернет-источники
Валентность и АМУ — презентация онлайн
ХИМИЯ
8 класс
Валентность и АМУ
Мария Дмитриевна Смирнова
[email protected]
Vk.com/masha2101
1
Проверка ДЗ
Химическая формула вещества
Название вещества
Вода
Простое или сложное вещество
Сложное
Качественный состав
Атомы водорода и кислорода
Количественный состав
2 атома водорода, 1 кислорода
Относительная молекулярная масса
1+1+16 = 18
Молярная масса
18
2
Химическая формула
Видно, что каждый элемент соединяется с другими элементами по
определённым законам.
Коэффициенты
6Fe(OH)3 3 SnO2 10HNO3
Индексы
3
Валентность
Валентность – это свойство атома химического элемента присоединять или замещать
определённое число атомов другого химического элемента.
4
Валентность
Валентность – это свойство атома химического элемента
присоединять или замещать определённое число атомов другого
химического элемента.
СН4
Определим валентности
h3O
HF
LiH
5
Валентность
Валентность – это свойство атома химического элемента присоединять или замещать
определённое число атомов другого химического элемента.
СН4
h3O
HF
LiH
Водород способен присоединять только ОДИН атом. Поэтому его валентность один.
А какая валентность у h3?
6
Валентность
Определить валентность можно, если мы знаем бинарное соединение нужного элемента
с элементом для которого валентность известна.
Валентности указываются над знаками элемента римскими цифрами.
ЗАПОМНИМ валентность водорода – I, кислород, почти всегда — II.
LiH
h3
N2 Nh4
Cl2 HOCl
CaC2 CO2 CO
Ne
7
Валентность
Химические элементы с постоянной валентностью:
h3O Na2O MgO CaO Al2O3
C переменной валентностью:
Сu2O CuO
FeO Fe2O3
SnO SnO2
Ph4 P2O5
CrO Cr2O3 CrO3
h3S SO2 SO3
8
Контрольные задания билеты по химии
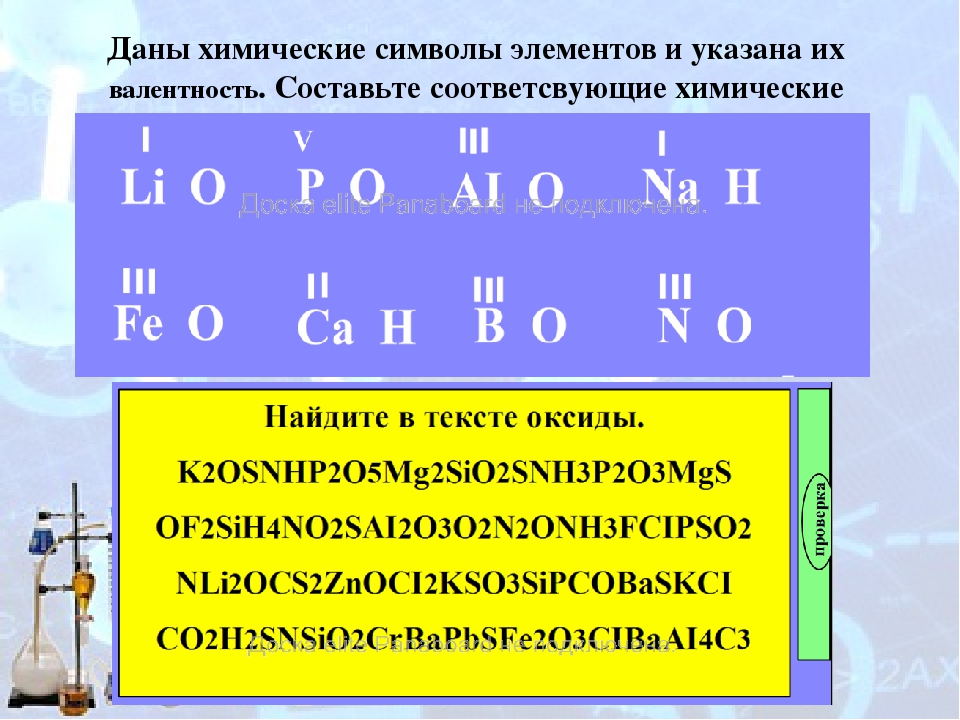
Вариант 1 Задание 1. Определите валентность химических элементов по формулам соединений: ? I ? II 1) СН4; 2) SO2; 3) FeO; 4) N2O5; 5) Li3N. (Пользуйтесь таблицей химических элементов Д. И. Менделеева) Задание 2. Напишите формулы соединений в состав которых входят следующие химические элементы: 1) азот (III) и водород; 2) углерод (IV) и кислород; 3) кальций (см. таблицу Д. И. Менделеева) и кислород; 4) калий и сера. Задание 3. 1) Расставьте коэффициенты в уравнении реакции К + CL2 → KCL 2) Расставьте коэффициенты в схеме реакции Fe + HCL → FeCl2 + h3↑. Подчеркните формулы сложных веществ в уравнении реакции. 3) Заполните пропуски в схеме реакции …CL2 + … … → …PCL5 Задание 4. 1) В уравнении реакции между водородом и кислородом напишите формулу продукта реакции и расставьте коэффициенты: Н2 + О2 → 2) Допишите уравнения реакции Na + CL → 3) Напишите уравнение реакций между калием и серой. Вариант 2 Задание 1. Определите валентность химических элементов по формулам соединений: ? I ? II 1) Sih5; 2) SO3; 3) CaO; 4) P2O5; 5) Na3N. (Пользуйтесь таблицей химических элементов Д. И. Менделеева) Задание 2. Напишите формулы соединений в состав которых входят следующие химические элементы: 1) фосфор (III) и водород; 2) сера (IV) и кислород; 3) барий (см. таблицу Д. И. Менделеева) и кислород; 4) натрий и сера. Задание 3. 1) Расставьте коэффициенты в уравнении реакции Na + Br2 → NaBr 2) Расставьте коэффициенты в схеме реакции KCLO3 → KCl + O2↑. Подчеркните формулы сложных веществ в уравнении реакции. 3) Заполните пропуски в схеме реакции …CL2 + … … → …PCL3 Задание 4. 1) Допишите уравнение реакции соединения лития (проявляет валентность I) с кислородом: Li2 + О2 → Напишите формулу продукта реакции и расставьте коэффициенты.
3) Заполните пропуски в схеме реакции …CL2 + … … → …PCL5 Задание 4. 1) В уравнении реакции между водородом и кислородом напишите формулу продукта реакции и расставьте коэффициенты: Н2 + О2 → 2) Допишите уравнения реакции Na + CL → 3) Напишите уравнение реакций между калием и серой. Вариант 2 Задание 1. Определите валентность химических элементов по формулам соединений: ? I ? II 1) Sih5; 2) SO3; 3) CaO; 4) P2O5; 5) Na3N. (Пользуйтесь таблицей химических элементов Д. И. Менделеева) Задание 2. Напишите формулы соединений в состав которых входят следующие химические элементы: 1) фосфор (III) и водород; 2) сера (IV) и кислород; 3) барий (см. таблицу Д. И. Менделеева) и кислород; 4) натрий и сера. Задание 3. 1) Расставьте коэффициенты в уравнении реакции Na + Br2 → NaBr 2) Расставьте коэффициенты в схеме реакции KCLO3 → KCl + O2↑. Подчеркните формулы сложных веществ в уравнении реакции. 3) Заполните пропуски в схеме реакции …CL2 + … … → …PCL3 Задание 4. 1) Допишите уравнение реакции соединения лития (проявляет валентность I) с кислородом: Li2 + О2 → Напишите формулу продукта реакции и расставьте коэффициенты.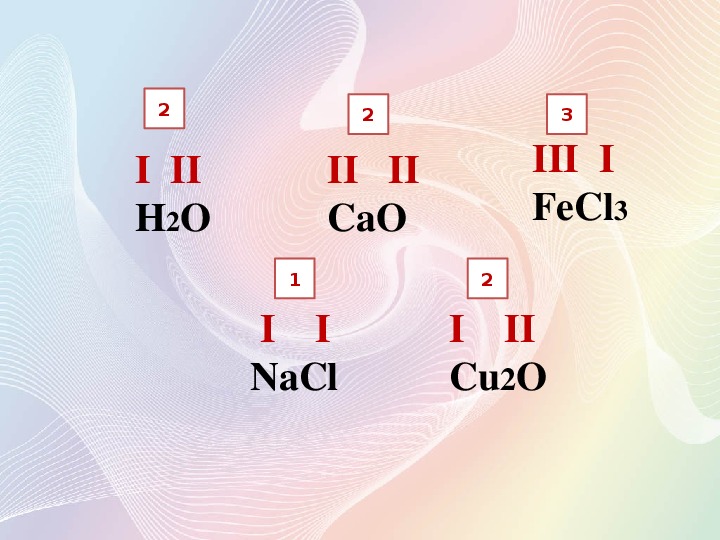 2) Допишите уравнения реакции Zn + O2 → 3) Напишите уравнение реакций между алюминием и серой и серой. Вариант 3 Задание 1. Определите валентность химических элементов по формулам соединений: ? I ? II 1) h3S; 2) CuO; 3) Fe2O3; 4) SiO2; 5) Na3P. (Пользуйтесь таблицей химических элементов Д. И. Менделеева) 2) валентность кальция в оксиде кальция CaO равна: а) I; б) II; в) III; г) IV. 3) Валентность азота в оксиде азота NO2 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – алюминия и кислорода: а) AlO3; б)Al2O3; в) AlO; г) Ag2O 2) В формуле соединения, состоящего из химических элементов бария (II) и кислорода индекс у химического знака бария: а)1; б) 2; в) 3; г) 4. 3) Сумма индексов в формуле оксида лития равна: а)1; б) 2; в) 3; г) 4. Задание 4. 1) коэффициент перед формулой калия в уравнении реакции, схема которой K + Cl2 → KCl равен: а)1; б) 2; в) 3; г) 4. 2) Коэффицент перед формулой продукта реакции Сa + O2 → равен: а)1; б) 2; в) 3; г) 4.
2) Допишите уравнения реакции Zn + O2 → 3) Напишите уравнение реакций между алюминием и серой и серой. Вариант 3 Задание 1. Определите валентность химических элементов по формулам соединений: ? I ? II 1) h3S; 2) CuO; 3) Fe2O3; 4) SiO2; 5) Na3P. (Пользуйтесь таблицей химических элементов Д. И. Менделеева) 2) валентность кальция в оксиде кальция CaO равна: а) I; б) II; в) III; г) IV. 3) Валентность азота в оксиде азота NO2 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – алюминия и кислорода: а) AlO3; б)Al2O3; в) AlO; г) Ag2O 2) В формуле соединения, состоящего из химических элементов бария (II) и кислорода индекс у химического знака бария: а)1; б) 2; в) 3; г) 4. 3) Сумма индексов в формуле оксида лития равна: а)1; б) 2; в) 3; г) 4. Задание 4. 1) коэффициент перед формулой калия в уравнении реакции, схема которой K + Cl2 → KCl равен: а)1; б) 2; в) 3; г) 4. 2) Коэффицент перед формулой продукта реакции Сa + O2 → равен: а)1; б) 2; в) 3; г) 4. 3) Сумма коэффициентов в уравнении реакции между калием и серой равна: а)1; б) 2; в) 3; г) 4. Вариант 2 T Задание 1. Заполните пропуски в тексте словами соответственно. 1) при разложении … … воды Н2О образуется два … … — водород Н2 и кислород О2. А) «простого вещества» и «химических элемента»; Б) «простого вещества» и «сложных вещества»; В) «сложного вещества» и «химических элемента»; Г) «сложного вещества» и «простых вещества». 2) Поваренная соль NaCl — … … , так как состоит из разных … … , а именно натрия и хлора. А) «сложное вещество» и «простых веществ»; Б) «простое вещество» и «химических элементов»; В) «простое вещество» и «сложных веществ». Г) «сложное вещество» и «химических элементов»; 3)Бертолетова соль КСlO3 — … … , так как состоит из разных … … — калия, хлора и кислорода; оно разлагается при нагревании на … … хлорид калия KCl и окись О2. А) «сложное вещество», «простых веществ», «сложное вещество», «химический элемент». Б) «сложное вещество», «химических элементов», «простое вещество», «химический элемент».
3) Сумма коэффициентов в уравнении реакции между калием и серой равна: а)1; б) 2; в) 3; г) 4. Вариант 2 T Задание 1. Заполните пропуски в тексте словами соответственно. 1) при разложении … … воды Н2О образуется два … … — водород Н2 и кислород О2. А) «простого вещества» и «химических элемента»; Б) «простого вещества» и «сложных вещества»; В) «сложного вещества» и «химических элемента»; Г) «сложного вещества» и «простых вещества». 2) Поваренная соль NaCl — … … , так как состоит из разных … … , а именно натрия и хлора. А) «сложное вещество» и «простых веществ»; Б) «простое вещество» и «химических элементов»; В) «простое вещество» и «сложных веществ». Г) «сложное вещество» и «химических элементов»; 3)Бертолетова соль КСlO3 — … … , так как состоит из разных … … — калия, хлора и кислорода; оно разлагается при нагревании на … … хлорид калия KCl и окись О2. А) «сложное вещество», «простых веществ», «сложное вещество», «химический элемент». Б) «сложное вещество», «химических элементов», «простое вещество», «химический элемент». В) «простое вещество», «сложных веществ», «простое вещество», «химический элемент». Г) «сложное вещество», «химических элементов», «сложное вещество», «простое вещество». Задание 2. 1) Кислород проявляет валентность: а) I; б) II; в) III; г) IV. 2) валентность цинка в оксиде цинка ZnO равна: а) I; б) II; в) III; г) IV. 3) Валентность углерода в оксиде углерода СО2 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – кальция и кислорода: а) СaO; б)Ca2O2; в) Cah3; г) K2O 2) В формуле соединения, состоящего из химических элементов алюминия (III) и кислорода индекс у химического знака алюминия: а)1; б) 2; в) 3; г) 4. 3) Сумма индексов в формуле оксида серы (VI) равна: а)1; б) 2; в) 3; г) 4. Задание 4. 1) коэффициент перед формулой натрия в уравнении реакции, схема которой Na + Cl2 → NaCl равен: а)1; б) 2; в) 3; г) 4. 2) Коэффицент перед формулой продукта реакции Mg + O2 → равен: а)1; б) 2; в) 3; г) 4. 3) Сумма коэффициентов в уравнении реакции между натрием и серой равна: а)1; б) 2; в) 3; г) 4.
В) «простое вещество», «сложных веществ», «простое вещество», «химический элемент». Г) «сложное вещество», «химических элементов», «сложное вещество», «простое вещество». Задание 2. 1) Кислород проявляет валентность: а) I; б) II; в) III; г) IV. 2) валентность цинка в оксиде цинка ZnO равна: а) I; б) II; в) III; г) IV. 3) Валентность углерода в оксиде углерода СО2 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – кальция и кислорода: а) СaO; б)Ca2O2; в) Cah3; г) K2O 2) В формуле соединения, состоящего из химических элементов алюминия (III) и кислорода индекс у химического знака алюминия: а)1; б) 2; в) 3; г) 4. 3) Сумма индексов в формуле оксида серы (VI) равна: а)1; б) 2; в) 3; г) 4. Задание 4. 1) коэффициент перед формулой натрия в уравнении реакции, схема которой Na + Cl2 → NaCl равен: а)1; б) 2; в) 3; г) 4. 2) Коэффицент перед формулой продукта реакции Mg + O2 → равен: а)1; б) 2; в) 3; г) 4. 3) Сумма коэффициентов в уравнении реакции между натрием и серой равна: а)1; б) 2; в) 3; г) 4. Вариант 3Т Задание 1. Заполните пропуски в тексте словами соответственно. 1) При нагревании … … , оксида золота образуются два … … — золото и кислорлод. А) «простого вещества» и «химических элемента»; Б) «простого вещества» и «сложных вещества»; В) «сложного вещества» и «химических элемента»; Г) «сложного вещества» и «простых вещества». 2) Углекислый газ СО2 — … … , так как состоит из разных … … , а именно углерода и кислорода. А) «сложное вещество» и «простых веществ»; Б) «простое вещество» и «химических элементов»; В) «простое вещество» и «сложных веществ». Г) «сложное вещество» и «химических элементов»; 3) Пероксид водорода Н2О2 — … … , так как состоит из разных … … — водорода и кислорода. При нагревании это вещество разлагается на … воду Н2О и … … кислород О2. А) «сложное вещество», «простых веществ», «сложное вещество», «химический элемент». Б) «сложное вещество», «химических элементов», «простое вещество», «химический элемент». В) «простое вещество», «сложных веществ», «сложное вещество», «химический элемент».
Вариант 3Т Задание 1. Заполните пропуски в тексте словами соответственно. 1) При нагревании … … , оксида золота образуются два … … — золото и кислорлод. А) «простого вещества» и «химических элемента»; Б) «простого вещества» и «сложных вещества»; В) «сложного вещества» и «химических элемента»; Г) «сложного вещества» и «простых вещества». 2) Углекислый газ СО2 — … … , так как состоит из разных … … , а именно углерода и кислорода. А) «сложное вещество» и «простых веществ»; Б) «простое вещество» и «химических элементов»; В) «простое вещество» и «сложных веществ». Г) «сложное вещество» и «химических элементов»; 3) Пероксид водорода Н2О2 — … … , так как состоит из разных … … — водорода и кислорода. При нагревании это вещество разлагается на … воду Н2О и … … кислород О2. А) «сложное вещество», «простых веществ», «сложное вещество», «химический элемент». Б) «сложное вещество», «химических элементов», «простое вещество», «химический элемент». В) «простое вещество», «сложных веществ», «сложное вещество», «химический элемент». Г) «сложное вещество», «химических элементов», «сложное вещество», «простое вещество». Задание 2. 1) Валентность водорода по определению равна: а) I; б) II; в) III; г) IV. 2) валентность меди в оксиде меди CuO равна: а) I; б) II; в) III; г) IV. 3) Валентность азота в оксиде азота NO2 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – золота и кислорода: а) AuCl3; б)Au2O3; в) CaO; г) Au(OH)3. 2) В формуле соединения, состоящего из химических элементов железа (III) и кислорода индекс у химического знака железа: а)1; б) 2; в) 3; г) 4. 3) Сумма индексов в формуле соединения фосфора (проявившего высшую валентность) с кислородом равна: а)1; б) 2; в) 3; г) 4. Задание 4. 1) коэффициент перед формулой железа в уравнении реакции, схема которой Fe + Cl2 → FeCl3 равен: а)1; б) 2; в) 3; г) 4. 2) Коэффициент перед формулой продукта реакции, в котором валентность углерода равна IV С + O2 → равен: а)1; б) 2; в) 3; г) 4. 3) Соединение с кислородом, формула которого Э2О, образует химический элемент: а) калий; б) кальций; в) алюминий; г) сера.
Г) «сложное вещество», «химических элементов», «сложное вещество», «простое вещество». Задание 2. 1) Валентность водорода по определению равна: а) I; б) II; в) III; г) IV. 2) валентность меди в оксиде меди CuO равна: а) I; б) II; в) III; г) IV. 3) Валентность азота в оксиде азота NO2 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – золота и кислорода: а) AuCl3; б)Au2O3; в) CaO; г) Au(OH)3. 2) В формуле соединения, состоящего из химических элементов железа (III) и кислорода индекс у химического знака железа: а)1; б) 2; в) 3; г) 4. 3) Сумма индексов в формуле соединения фосфора (проявившего высшую валентность) с кислородом равна: а)1; б) 2; в) 3; г) 4. Задание 4. 1) коэффициент перед формулой железа в уравнении реакции, схема которой Fe + Cl2 → FeCl3 равен: а)1; б) 2; в) 3; г) 4. 2) Коэффициент перед формулой продукта реакции, в котором валентность углерода равна IV С + O2 → равен: а)1; б) 2; в) 3; г) 4. 3) Соединение с кислородом, формула которого Э2О, образует химический элемент: а) калий; б) кальций; в) алюминий; г) сера. Вариант 4Т Задание 1. Заполните пропуски в тексте словами соответственно. 1) При нагревании … … оксида серебра образуется два … … — серебро и кислород. А) «сложного вещества» и «простых вещества»; Б) «простого вещества» и «сложных вещества»; В) «сложного вещества» и «химических элемента»; Г) «простого вещества» и «химических элемента». 2) Метан СН4 — … … , так как состоит из разных … … , а именно углерода и водорода. А) «сложное вещество» и «химических элементов»; Б) «простое вещество» и «химических элементов»; В) «простое вещество» и «сложных веществ». Г) «сложное вещество» и «простых веществ». 3) Пероксид бария BaO2 — … … , так как состоит из разных … … — бария и кислорода. При нагревании это вещество разлагается на … … оксид бария BaO и … … кислород О2. А) «сложное вещество», «простых веществ», «сложное вещество», «химический элемент». Б) «сложное вещество», «химических элементов», «сложное вещество», «простое вещество». В) «простое вещество», «сложных веществ», «сложное вещество», «химический элемент».
Вариант 4Т Задание 1. Заполните пропуски в тексте словами соответственно. 1) При нагревании … … оксида серебра образуется два … … — серебро и кислород. А) «сложного вещества» и «простых вещества»; Б) «простого вещества» и «сложных вещества»; В) «сложного вещества» и «химических элемента»; Г) «простого вещества» и «химических элемента». 2) Метан СН4 — … … , так как состоит из разных … … , а именно углерода и водорода. А) «сложное вещество» и «химических элементов»; Б) «простое вещество» и «химических элементов»; В) «простое вещество» и «сложных веществ». Г) «сложное вещество» и «простых веществ». 3) Пероксид бария BaO2 — … … , так как состоит из разных … … — бария и кислорода. При нагревании это вещество разлагается на … … оксид бария BaO и … … кислород О2. А) «сложное вещество», «простых веществ», «сложное вещество», «химический элемент». Б) «сложное вещество», «химических элементов», «сложное вещество», «простое вещество». В) «простое вещество», «сложных веществ», «сложное вещество», «химический элемент». Г) «сложное вещество», «химических элементов», «простое вещество», «химический элемент». Задание 2. 1) Валентность в соединениях равна: а) I; б) II; в) III; г) IV. 2) валентность железа в оксиде железа FeO равна: а) I; б) II; в) III; г) IV. 3) Валентность фосфора в оксиде фосфора P2O5 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – серебра и кислорода: а) AgCl; б)AgOH; в) Al2O3; г) Ag2O. 2) В формуле соединения, состоящего из химических элементов серы (IV) и кислорода индекс у химического знака серы:
Г) «сложное вещество», «химических элементов», «простое вещество», «химический элемент». Задание 2. 1) Валентность в соединениях равна: а) I; б) II; в) III; г) IV. 2) валентность железа в оксиде железа FeO равна: а) I; б) II; в) III; г) IV. 3) Валентность фосфора в оксиде фосфора P2O5 равна: а) I; б) II; в) III; г) IV. Задание 3. 1) Формула соединения состоящая из двух химических элементов – серебра и кислорода: а) AgCl; б)AgOH; в) Al2O3; г) Ag2O. 2) В формуле соединения, состоящего из химических элементов серы (IV) и кислорода индекс у химического знака серы:
Что такое валентность водорода?
Атомы соединяются химическими связями, разделяя электроны. Это основано на том, сколько электронов у данного элемента заполнено его электронными облаками. Однако количество электронов во внешнем электронном облаке, доступных для совместного использования, эквивалентно валентному числу.
TL; DR (слишком долго; не читал)
Водород и все другие элементы в первой группе таблицы периодов имеют валентность, равную единице.
Валентные электроны
Валентные электроны — это электроны на самом высоком уровне энергии, доступные для химической связи.В ковалентной связи эти валентные электроны доступны для совместного использования с другим атомом для заполнения доступных энергетических уровней. Этот внешний уровень имеет восемь потенциальных электронов, но когда присутствуют все восемь электронов, образующееся химическое вещество является инертным благородным газом. Атомы с менее чем восемью электронами во внешних оболочках будут связываться с другими атомами, чтобы разделить достаточно электронов, чтобы образовалось восемь. Например, атом фтора с семью валентными электронами хочет разделить один электрон от другого атома, чтобы получить восемь валентных электронов.
Валентность водорода
Водород — уникальный атом, потому что он имеет только два пятна на внешнем электронном уровне. Гелий имеет два электрона и проявляет свойства благородного газа. Валентное число водорода равно единице, потому что он имеет только один валентный электрон и ему нужен только один общий электрон, чтобы заполнить свои энергетические уровни. Это означает, что он может связываться со многими элементами. Например, четыре атома водорода могут связываться с атомом углерода, который имеет четыре валентных электрона, с образованием метана.Точно так же три атома водорода могут связываться с атомом азота, который имеет пять валентных электронов, с образованием аммиака.
Валентное число водорода равно единице, потому что он имеет только один валентный электрон и ему нужен только один общий электрон, чтобы заполнить свои энергетические уровни. Это означает, что он может связываться со многими элементами. Например, четыре атома водорода могут связываться с атомом углерода, который имеет четыре валентных электрона, с образованием метана.Точно так же три атома водорода могут связываться с атомом азота, который имеет пять валентных электронов, с образованием аммиака.
Другие водородные соединения
Поскольку водород может либо разделять электрон, либо терять электрон, чтобы иметь полную или пустую внешнюю оболочку, он также может образовывать ионные связи. Водород может отдать свой одинокий электрон химическому веществу вроде фтора или хлора, которое имеет семь электронов во внешних оболочках. Точно так же, поскольку водород обладает свойствами как первой, так и седьмой групп периодической таблицы, он может связываться с самим собой, образуя молекулы водорода. Водород также может потерять свой валентный электрон в растворе, образуя положительный ион водорода, что и вызывает кислотность в растворе.
Водород также может потерять свой валентный электрон в растворе, образуя положительный ион водорода, что и вызывает кислотность в растворе.
Валентность других атомов
Водород и все другие атомы первой группы периодической таблицы (включая литий, натрий и калий) имеют валентность, равную единице. Атомы второй группы (включая бериллий, магний, кальций, стронций и барий) имеют валентность, равную двум. Атомы с более чем двумя валентными электронами могут иметь более одной валентности, но их максимальная валентность обычно равна числу их валентных электронов.
Группы с 3-й по 12-ю (переходные элементы, включая большинство металлов) имеют разную валентность от 1 до 7. Атомы группы 13 (включая бор и алюминий) имеют максимальную валентность, равную трем. Атомы группы 14 (включая углерод, кремний и германий) имеют максимальную валентность, равную четырем. Атомы группы 15 (включая азот, фосфор и мышьяк) имеют максимальную валентность пять. Атомы группы 16 (включая кислород, серу и селен) имеют максимальную валентность шесть. Атомы группы 17 (включая фтор, хлор и бром) имеют максимальную валентность семь.Атомы группы 18, благородные газы (включая неон и аргон), имеют восемь валентных электронов, но поскольку они почти никогда не разделяют эти электроны, говорят, что они имеют нулевую валентность.
Атомы группы 16 (включая кислород, серу и селен) имеют максимальную валентность шесть. Атомы группы 17 (включая фтор, хлор и бром) имеют максимальную валентность семь.Атомы группы 18, благородные газы (включая неон и аргон), имеют восемь валентных электронов, но поскольку они почти никогда не разделяют эти электроны, говорят, что они имеют нулевую валентность.
Водородные соединенияДва атома водорода образуют связь друг с другом, разделяя электроны, так что каждый из них имеет более стабильную электронную конфигурацию гелия с двумя электронами. Связь, в которой два атома разделяют электроны, называется ковалентной связью .Элементы во втором ряду, от лития до фтора, также образуют связи, так что они могут достичь стабильной электронной конфигурации с заполненной оболочкой неона с 8 электронами. Представление электронной конфигурацииЭлектронная конфигурация элементов второго ряда (n = 2) приведена в таблице. Литий имеет один электрон на своей 2s-орбитали (обозначен точкой). Бериллий имеет 2 электрона на своей 2s-орбитали, представленных двумя точками, расположенными близко друг к другу. Углерод имеет пару электронов на своей 2s-орбитали (2 точки вместе) и по 1 электрону на 2-х своих 2p-орбиталях (например, 2p x и 2p y ), представленных одиночными точками. Поскольку существует 4 валентных орбитали, некоторые элементы имеют другую электронную конфигурацию, которая лишь немного выше по энергии. Связь с водородомВодород может соединяться со всеми элементами второй роли, кроме неона, для образования молекул.
Полярные и неполярные связиЭлектроны в связи между двумя атомами являются общими, но в связях между разными атомами они не обязательно разделяются поровну. Двигаясь слева направо по второй строке периодической таблицы, элементы имеют все большую тенденцию притягивать связывающие электроны к себе.Эта тенденция называется электроотрицательностью . Элементам присвоены номера, указывающие на их относительную электроотрицательность. Электроотрицательность — это периодическое свойство, которое увеличивается слева направо по строке и снизу вверх по столбцу. Когда два связанных атома отличаются электроотрицательностью более чем на 0,4 единицы, мы говорим, что связь полярная. Элемент с более низким числом электроотрицательности будет более бедным электронами, чем элемент с более высоким числом. Назад Компас Индекс Столы Вступление Следующий |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.

Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
химическая связь | Определение и примеры
Химическая связь , любое из взаимодействий, которое объясняет объединение атомов в молекулы, ионы, кристаллы и другие стабильные частицы, составляющие привычные вещества повседневного мира. Когда атомы приближаются друг к другу, их ядра и электроны взаимодействуют и стремятся распределиться в пространстве таким образом, что полная энергия ниже, чем при любом другом расположении. Если полная энергия группы атомов ниже, чем сумма энергий составляющих атомов, тогда они связываются вместе, и снижение энергии является энергией связи.
Если полная энергия группы атомов ниже, чем сумма энергий составляющих атомов, тогда они связываются вместе, и снижение энергии является энергией связи.
связывание кристаллов
Различные типы соединения кристаллов.
Британская энциклопедия, Inc.
Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Идеи, которые помогли установить природу химической связи, воплотились в жизнь в начале 20 века, после того, как был открыт электрон, и квантовая механика предоставила язык для описания поведения электронов в атомах. Однако, хотя химикам нужна квантовая механика для детального количественного понимания образования связей, большая часть их прагматического понимания связей выражается в простых интуитивных моделях.Эти модели рассматривают связи в основном как два типа, а именно ионные и ковалентные. Тип связи, которая наиболее вероятно возникнет между двумя атомами, можно предсказать на основе расположения элементов в периодической таблице, и в некоторой степени свойства образованных таким образом веществ могут быть связаны с типом связи.
Однако, хотя химикам нужна квантовая механика для детального количественного понимания образования связей, большая часть их прагматического понимания связей выражается в простых интуитивных моделях.Эти модели рассматривают связи в основном как два типа, а именно ионные и ковалентные. Тип связи, которая наиболее вероятно возникнет между двумя атомами, можно предсказать на основе расположения элементов в периодической таблице, и в некоторой степени свойства образованных таким образом веществ могут быть связаны с типом связи.
Ключевым понятием при обсуждении химической связи является понятие молекулы. Молекулы — это самые маленькие единицы соединений, которые могут существовать. Одна из особенностей молекул, которую можно с достаточным успехом предсказывать, — это их форма.Молекулярные формы имеют большое значение для понимания реакций, в которых могут проходить соединения, поэтому в этой статье кратко обсуждается связь между химическим связыванием и химической реакционной способностью.
Хотя простые модели связывания полезны в качестве практических правил для обоснования существования соединений, а также физических и химических свойств и структур молекул, их необходимо обосновать, обращаясь к более сложным описаниям связывания. Более того, есть некоторые аспекты молекулярной структуры, которые выходят за рамки простых теорий.Чтобы достичь этого понимания, необходимо прибегнуть к полностью квантово-механическому описанию. На практике эти описания в значительной степени зависят от компьютеров. Такие численные подходы к химической связи дают важную информацию о связи.
молекулярная структура
Шарообразная модель молекулярной структуры, показывающая атомы, связанные вместе.
© asiseeit / iStock.com
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Эта статья начинается с описания исторической эволюции современного понимания химической связи, а затем обсуждается, как возникли современные теории образования химических связей, которые превратились в мощное описание структуры материи. После исторического введения обсуждаются качественные модели связывания, при этом особое внимание уделяется образованию ионных и ковалентных связей и корреляции последних с молекулярными формами. Затем описываются более сложные квантово-механические подходы к образованию связей, после чего дается обзор ряда частных случаев, которые поднимают интересные проблемы или приводят к важным открытиям.
После исторического введения обсуждаются качественные модели связывания, при этом особое внимание уделяется образованию ионных и ковалентных связей и корреляции последних с молекулярными формами. Затем описываются более сложные квантово-механические подходы к образованию связей, после чего дается обзор ряда частных случаев, которые поднимают интересные проблемы или приводят к важным открытиям.
Для подробного обсуждения структуры и свойств атомов, см. атом.Химические соединения рассматриваются в статье химический состав, а элементы описаны в статье химический элемент.
Исторический обзор
Появление количественной химии
Ранние греки, в первую очередь Демокрит, утверждали, что материя состоит из элементарных частиц, называемых атомами. Однако взглядам атомистов не хватало авторитета, исходящего из экспериментов, и доказательства существования атомов не появлялись в течение двух тысячелетий до появления количественной эмпирической науки в 18 веке.
Life Sciences Cyberbridge
Life Sciences Cyberbridge
КОВАЛЕНТНЫЕ ОБЛИГАЦИИ
1) Ковалентные связи образуются между атомами в результате одновременного «разделения» электронов.
2) Более чем одна пара электронов может быть разделена между атомами с образованием двойных или тройных ковалентных связей.
В отличие от ионных связей, ковалентные связи часто образуются между атомами, когда один из атомов не может легко достичь конфигурации электронной оболочки благородного газа из-за потери или усиления одного или двух электронов.В таких случаях легче «разделить» валентные электроны.
«Разделение» электронов происходит, когда электроны во внешней электронной оболочке или электроны валентной оболочки одного атома могут быть использованы для завершения внешней электронной оболочки другого атома без постоянного переноса, как это происходит при образовании иона. Электроны могут быть далеко от атома только до того, как перестанут с ним связываться; поэтому совместное использование электронов и образование ковалентных связей ограничивает максимальное расстояние между двумя связанными атомами.
Полная внешняя электронная оболочка является наиболее стабильным состоянием. Следовательно, атомы, которые связываются ковалентно, делятся своими электронами, образуя свою валентную оболочку. Давайте сначала возьмем пример с водородом (H). Водород имеет один электрон и требует еще одного электрона, чтобы иметь ту же конфигурацию валентной оболочки, что и благородный газ гелий (He). Самый простой способ добиться этого — разделить один электрон между двумя атомами водорода. Как показано ниже, каждый атом водорода (H) и его единственный электрон изображены красным или синим цветом.Когда два атома разделяют свои одиночные электроны (показаны в овале), источники электронов неотличимы друг от друга. Следовательно, кажется, что есть два электрона в валентных оболочках как красного H, так и синего H.
А как насчет более сложных примеров? Углерод (C) имеет четыре валентных электрона и требует четырех дополнительных электронов, чтобы иметь ту же конфигурацию валентной оболочки, что и неон (Ne).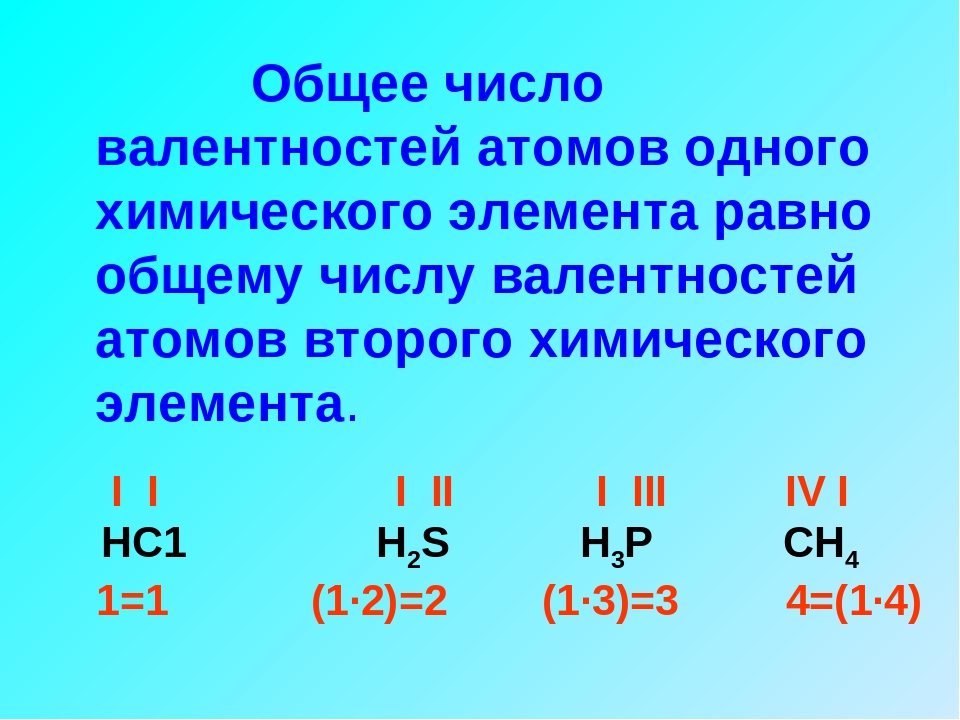 Образование одинарной ковалентной связи со вторым атомом углерода не завершает валентную оболочку любого атома.Следовательно, атом углерода может вместо этого делить каждый из своих электронов с четырьмя отдельными атомами водорода. Это завершает валентные оболочки для четырех атомов водорода и одного атома углерода. В этом примере одна пара электронов используется двумя атомами. Все ковалентные связи, показанные ниже, называются простыми ковалентными связями.
Образование одинарной ковалентной связи со вторым атомом углерода не завершает валентную оболочку любого атома.Следовательно, атом углерода может вместо этого делить каждый из своих электронов с четырьмя отдельными атомами водорода. Это завершает валентные оболочки для четырех атомов водорода и одного атома углерода. В этом примере одна пара электронов используется двумя атомами. Все ковалентные связи, показанные ниже, называются простыми ковалентными связями.
Как можно догадаться, существует множество способов организации электронов ковалентными связями. Различные атомы, связанные ковалентной связью, не обязательно вносят одинаковое количество электронов.Более того, отдельный атом может внести более одного электрона в ковалентную связь. Снова используя углерод и водород в качестве примеров, рассмотрим конфигурации разделения электронов, необходимые для создания C 2 H 6 , C 2 H 4 и C 2 H 2 .
Связи, образованные общими электронами, часто упрощаются до линий между связанными атомами. Каждая линия представляет одну пару электронов. Поэтому три приведенных выше соединения можно перерисовать, как показано ниже.
Использование общих электронов для завершения валентных оболочек имеет некоторые прямые последствия для соединений. Валентные оболочки будут полными только до тех пор, пока электроны разделены, что требует, чтобы связанные атомы оставались близко друг к другу. Атомы в ковалентных связях потеряли бы свои полные валентные оболочки, если бы они были разделены. Это в отличие от ионных связей; валентные оболочки ионов не изменяются при разрыве ионных связей. Таким образом, ковалентные связи часто бывают очень прочными независимо от окружающей среды, потому что последствия для валентных оболочек будут одинаковыми во всех ситуациях.
Ковалентная связь — обзор
1.1 Определения
Координационные соединения — это соединения, содержащие одну или несколько координационных ковалентных связей.
Координатные ковалентные связи — это ковалентные связи, в которых оба связывающих электрона вносятся одним из партнеров по связи. На рисунке 2 ковалентные связи отличаются от координационных ковалентных связей в NH 3 BF 3 . В то время как три ковалентные связи BF образуются из-за совместного использования электронных пар в результате вкладов как атомов бора, так и атомов фтора, связь NB образуется из-за передачи неподеленной пары электронов из азота на пустые орбитали бора.Координатная ковалентная связь показана стрелкой с головкой, указывающей в направлении передачи пары электронов, как показано на рисунке 2.
Рисунок 2. Связывание в NH 3 BF 3 .
Комплекс представляет собой молекулу / ион, содержащую центральный атом / ион металла, окруженный определенным числом лигандов, удерживаемых вторичными валентностями или координационными ковалентными связями.
Первичная валентность относится к заряду над ионом металла e. грамм. Co (III) имеет заряд +3, который можно уравновесить -3 зарядообразующими соединениями, такими как CoCl 3 . Первичная валентность является ионной и выполняется во второй координационной сфере, как показано на рисунке 3.
грамм. Co (III) имеет заряд +3, который можно уравновесить -3 зарядообразующими соединениями, такими как CoCl 3 . Первичная валентность является ионной и выполняется во второй координационной сфере, как показано на рисунке 3.
Рисунок 3. Первая и вторая координационные сферы в [Co (NH 3 ) 6 ] Cl 3 .
Вторичная валентность — это количество пустых валентных орбиталей, как показано на рисунке для [Co (NH 3 ) 6 ] Cl 3 .Ион Co (III) имеет шесть пустых валентных орбиталей. Следовательно, его вторичная валентность равна шести. Вторичная валентность — это координатная ковалентная валентность, и она выполняется в первой координационной сфере иона металла, как показано на рисунке 4.
Рисунок 4. Вторичная валентность Co (III) в [Co (NH 3 ) 6 ] Cl 3 .
Координационное число — это свойство иона металла, представляющее общее количество донорных атомов, непосредственно связанных с центральным атомом.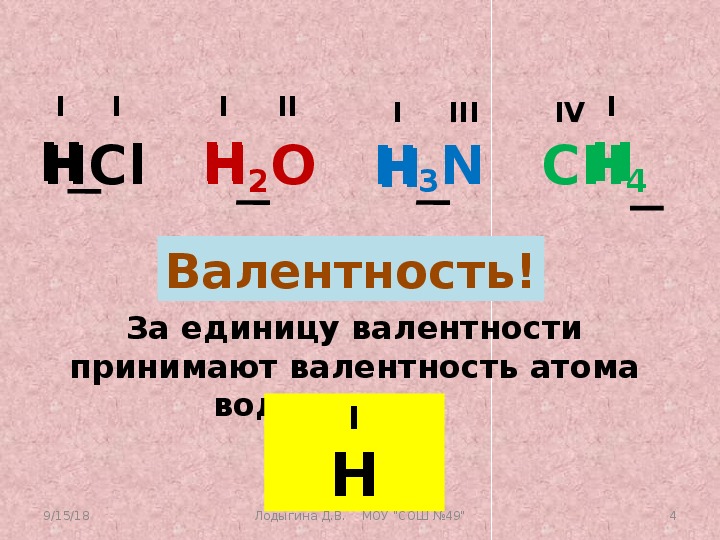 В приведенном выше случае координационное число Co (III) равно шести, поскольку шесть донорных атомов азота напрямую связаны с центральным ионом металла (кобальтом (III)).
В приведенном выше случае координационное число Co (III) равно шести, поскольку шесть донорных атомов азота напрямую связаны с центральным ионом металла (кобальтом (III)).
Лиганд представляет собой любой атом, ион или нейтральную молекулу, способную отдавать электронную пару и связанную с центральным ионом или атомом металла посредством вторичной валентности.
Зубчатый знак — это свойство лиганда, представляющего ряд координирующих атомов.
В случае [Co (NH 3 ) 6 ] Cl 3 , аммиак, NH 3 лиганд содержит один донорный атом (N).Следовательно, его зубчатый характер является единым и классифицируется как монодентатный лиганд. Точно так же хлор (Cl —) представляет собой анионный, одноатомный и монодентатный лиганд, а гидроксо (OH —) представляет собой двухатомный, монодентатный и анионный лиганд. Aquo (OH 2 ) представляет собой нейтральный трехатомный монодентатный лиганд. Несколько популярных лигандов и их характеристики показаны на рисунке 5.
Несколько популярных лигандов и их характеристики показаны на рисунке 5.
Рисунок 5. Структуры и характеристики нескольких важных лигандов.
Из-за большей зубчатости лигандов иногда также образуются различные комплексы, известные как хелаты. Хелат — это соединение, образующееся, когда полидентатный лиганд использует более одного из своих координирующих атомов для образования замкнутой кольцевой структуры, которая включает центральный ион металла. Известно, что пяти- и шестичленные кольца придают хелатам дополнительную стабильность. Процесс образования хелатов известен как хелатирование. Полидентатный лиганд, участвующий в образовании хелата, также известен как хелатирующий лиганд. Хелаты обычно обладают более высокой стабильностью, чем аналогичные комплексы.
Полидентатный лиганд может быть присоединен к центральному иону металла через функциональные группы более чем одного типа.Таким образом, количество и вид связей, с помощью которых ион металла присоединяется к лигандам, могут стать критерием для классификации хелатов. Ковалентные связи образуются за счет замены одного или нескольких H-атомов, в то время как координационные ковалентные связи образуются за счет передачи электронной пары от лигандов. Некоторые хелаты, включающие множество полидентатных лигандов и связей, показаны на фиг. 6. Координатные ковалентные связи показаны тонкими нитевидными связями.
Ковалентные связи образуются за счет замены одного или нескольких H-атомов, в то время как координационные ковалентные связи образуются за счет передачи электронной пары от лигандов. Некоторые хелаты, включающие множество полидентатных лигандов и связей, показаны на фиг. 6. Координатные ковалентные связи показаны тонкими нитевидными связями.
Рисунок 6.Структуры и характеристики некоторых хелатов.
Полиядерный комплекс представляет собой комплекс с более чем одним атомом / ионом металла. Эти ионы металлов иногда соединяются мостиковыми связями через соответствующие лиганды, что приводит к образованию мостиковых полиядерных комплексов.
4.1 Ковалентные облигации | Основы общей, органической и биологической химии
Обмен электронами
Глава 3 «Ионные связи и простые ионные соединения» описывает, как электроны могут передаваться от одного атома к другому, так что оба атома имеют энергетически стабильную внешнюю электронную оболочку. Поскольку в большинстве заполненных электронных оболочек содержится восемь электронов, химики назвали эту тенденцию правилом октетов. Но есть еще один способ, которым атом может создать полную валентную оболочку: атомов могут совместно использовать электронов.
Поскольку в большинстве заполненных электронных оболочек содержится восемь электронов, химики назвали эту тенденцию правилом октетов. Но есть еще один способ, которым атом может создать полную валентную оболочку: атомов могут совместно использовать электронов.
Эту концепцию можно проиллюстрировать на примере двух атомов водорода, каждый из которых имеет один электрон на валентной оболочке. (Для небольших атомов, таких как атомы водорода, валентная оболочка будет первой оболочкой, содержащей только два электрона.) Мы можем представить два отдельных атома водорода следующим образом:
Напротив, когда два атома водорода сближаются достаточно близко друг к другу, чтобы поделиться своими электронами, их можно представить следующим образом:
Благодаря совместному использованию валентных электронов оба атома водорода теперь имеют по два электрона в соответствующих валентных оболочках.Поскольку каждая валентная оболочка теперь заполнена, это расположение более стабильно, чем когда два атома разделены. Распределение электронов между атомами называется ковалентной связью , а два электрона, которые соединяют атомы ковалентной связью, называются связывающей парой электронов . Дискретная группа атомов, соединенных ковалентными связями, называется молекулой — наименьшая часть соединения, которая сохраняет химическую идентичность этого соединения.
Распределение электронов между атомами называется ковалентной связью , а два электрона, которые соединяют атомы ковалентной связью, называются связывающей парой электронов . Дискретная группа атомов, соединенных ковалентными связями, называется молекулой — наименьшая часть соединения, которая сохраняет химическую идентичность этого соединения.
Химики часто используют диаграммы Льюиса для представления ковалентных связей в молекулярных веществах.Например, диаграммы Льюиса двух отдельных атомов водорода выглядят следующим образом:
Диаграмма Льюиса двух атомов водорода, разделяющих электроны, выглядит так:
Это изображение молекул дополнительно упрощено за счет использования тире для обозначения ковалентной связи. Молекула водорода тогда представлена следующим образом:
Помните, что прочерк, также называемый одинарной связью , представляет собой пару электронов.
Связь в молекуле водорода, измеренная как расстояние между двумя ядрами, составляет около 7. 4 × 10 −11 м, или 74 пикометра (pm; 1 pm = 1 × 10 −12 м). Эта конкретная длина связи представляет собой баланс между несколькими силами: притяжением между противоположно заряженными электронами и ядрами, отталкиванием между двумя отрицательно заряженными электронами и отталкиванием между двумя положительно заряженными ядрами. Если бы ядра были ближе друг к другу, они бы отталкивали друг друга сильнее; если бы ядра были дальше друг от друга, между положительными и отрицательными частицами было бы меньше притяжения.
4 × 10 −11 м, или 74 пикометра (pm; 1 pm = 1 × 10 −12 м). Эта конкретная длина связи представляет собой баланс между несколькими силами: притяжением между противоположно заряженными электронами и ядрами, отталкиванием между двумя отрицательно заряженными электронами и отталкиванием между двумя положительно заряженными ядрами. Если бы ядра были ближе друг к другу, они бы отталкивали друг друга сильнее; если бы ядра были дальше друг от друга, между положительными и отрицательными частицами было бы меньше притяжения.
Фтор — еще один элемент, атомы которого соединяются попарно с образованием двухатомных (двухатомных) молекул. Два отдельных атома фтора имеют следующие электронные точечные диаграммы:
Каждый атом фтора вносит один валентный электрон, образуя одинарную связь и давая каждому атому полную валентную оболочку, что соответствует правилу октетов:
Кружки показывают, что вокруг каждого атома фтора восемь электронов. Как и в случае с водородом, мы можем изобразить молекулу фтора с чертой вместо связывающих электронов:
Как и в случае с водородом, мы можем изобразить молекулу фтора с чертой вместо связывающих электронов:
Каждый атом фтора имеет шесть электронов или три пары электронов, которые не участвуют в ковалентной связи.Считается, что они не являются общими, а принадлежат одному атому. Их называют несвязывающими парами (или неподеленными парами) электронов.
Ковалентные связи между разными атомами
Теперь, когда мы рассмотрели распределение электронов между атомами одного и того же элемента, давайте посмотрим на образование ковалентных связей между атомами разных элементов. Рассмотрим молекулу, состоящую из одного атома водорода и одного атома фтора:
Каждому атому требуется один дополнительный электрон для завершения своей валентной оболочки.Делая вклад в один электрон, они образуют следующую молекулу:
В этой молекуле атом водорода не имеет несвязывающих электронов, а атом фтора имеет шесть несвязывающих электронов (три неподеленные электронные пары). Кружками показано, как заполнены валентные электронные оболочки обоих атомов.
Пример 1
Нарисуйте диаграмму Льюиса для каждого соединения.
- молекула, состоящая из двух атомов хлора
- Молекула, состоящая из атома водорода и атома брома
Решение
Покажи ответ
- Хлор имеет ту же электронную конфигурацию валентной оболочки, что и фтор, поэтому диаграмма Льюиса для молекулы, состоящей из двух атомов хлора, аналогична диаграмме для фтора:
- Бром имеет ту же электронную конфигурацию валентной оболочки, что и фтор, поэтому диаграмма Льюиса для молекулы, состоящей из атома водорода и атома брома, аналогична диаграмме для водорода и фтора:
Упражнение по развитию навыков
Нарисуйте диаграмму Льюиса для каждого соединения.
молекула, состоящая из одного атома хлора и одного атома фтора
молекула, состоящая из одного атома водорода и одного атома йода
Более крупные молекулы построены аналогичным образом, при этом некоторые атомы участвуют в более чем одной ковалентной связи. Например, воду с двумя атомами водорода и одним атомом кислорода и метан (CH 4 ) с одним атомом углерода и четырьмя атомами водорода можно представить следующим образом:
Атомы обычно образуют характерное количество ковалентных связей в соединениях.Рисунок 4.2 «Сколько образуется ковалентных связей?» показывает количество ковалентных связей, которые обычно образуют различные атомы.
Рис. 4.2. Сколько образуется ковалентных связей? В молекулах существует определенное количество ковалентных связей, которые могут образовывать разные атомы. Каждый блок с номером указывает количество ковалентных связей, образованных этим атомом в нейтральных соединениях.
Упражнения по обзору концепции
- Как образуется ковалентная связь между двумя атомами?
- Как ковалентная связь позволяет атомам в группе 6A удовлетворять правилу октетов?
Ответы
Покажи ответ
- Ковалентные связи образованы двумя атомами, разделяющими электроны.
- Атомы в группе 6A образуют две ковалентные связи.
Ключевые вынос
- Ковалентная связь образуется между двумя атомами за счет обмена электронами.
Упражнения
Что такое обмен электронами?
Изобразите диаграмму Льюиса для ковалентной связи в молекуле Br 2 .
Изобразите диаграмму Льюиса для ковалентной связи в молекуле I 2 .
Изобразите диаграмму Льюиса для ковалентной связи в молекуле HCl.
Изобразите диаграмму Льюиса для ковалентной связи в молекуле HI.
В чем разница между молекулой и формульной единицей?
Почему атомы водорода не подчиняются правилу октетов, когда они образуют ковалентные связи?
Изобразите диаграмму Льюиса для ковалентной связи в H 2 S.Сколько в молекуле связывающих электронов и несвязывающих электронов?
Изобразите диаграмму Льюиса для ковалентной связи в NI 3 . Сколько связывающих электронов и несвязывающих электронов в молекуле?
Изобразите диаграмму Льюиса для ковалентной связи в CF 4 . Сколько связывающих электронов и несвязывающих электронов в молекуле?
Изобразите диаграмму Льюиса для ковалентной связи в PCl 3 .Сколько связывающих электронов и несвязывающих электронов в молекуле?
Сколько ковалентных связей обычно образует атом водорода? Почему?
Сколько ковалентных связей обычно образует атом кислорода? Почему?
Атомы теллура образуют ковалентные связи. Сколько ковалентных связей образовал бы атом теллура? Предскажите формулу соединения теллура и водорода.
Атомы олова образуют ковалентные связи.Сколько ковалентных связей образовал бы атом олова? Предскажите формулу соединения олова и водорода.
Астатин — синтетический элемент, производимый по одному атому в огромных машинах для уничтожения атомов. Он находится в группе галогенов в периодической таблице. Сколько ковалентных связей образовал бы атом этого элемента?
Были сообщения, что атомы элемента 116 были образованы путем столкновения более мелких атомов вместе. Используя периодическую таблицу, определите, в каком столбце будет элемент 116, и предположите, сколько ковалентных связей образовал бы атом этого элемента.
Ответы
Покажи ответ
1. Ковалентная связь образуется, когда два атома разделяют электроны.
3.
5.
7. Молекула — это дискретная комбинация атомов; формульная единица — это наименьшее соотношение ионов в кристалле.
9.
связывающих электронов: 4; несвязывающие электроны: 4
11.
связывающих электронов: 8; несвязывающие электроны: 24
13. Атомы водорода образуют только одну ковалентную связь, потому что у них есть только один валентный электрон для спаривания.
15. два; h3Te
17.

 Мы можем изобразить валентные электроны, находящиеся во внешней оболочке, точками. Заполненная орбиталь оболочки (1s 2 для этих элементов) не может быть общей и не участвует в каких-либо химических связях.Каждый из элементов второго ряда имеет 4 валентные орбитали: 2s, 2p x , 2p y и 2p z .
Мы можем изобразить валентные электроны, находящиеся во внешней оболочке, точками. Заполненная орбиталь оболочки (1s 2 для этих элементов) не может быть общей и не участвует в каких-либо химических связях.Каждый из элементов второго ряда имеет 4 валентные орбитали: 2s, 2p x , 2p y и 2p z . Наполовину заполненная водородная орбиталь 1s может объединяться с любыми другими наполовину заполненными орбиталями этих элементов. Неон не имеет полузаполненных орбиталей. Когда электроны делятся между двумя атомами, они включаются в подсчет валентных электронов каждого из них.
Наполовину заполненная водородная орбиталь 1s может объединяться с любыми другими наполовину заполненными орбиталями этих элементов. Неон не имеет полузаполненных орбиталей. Когда электроны делятся между двумя атомами, они включаются в подсчет валентных электронов каждого из них.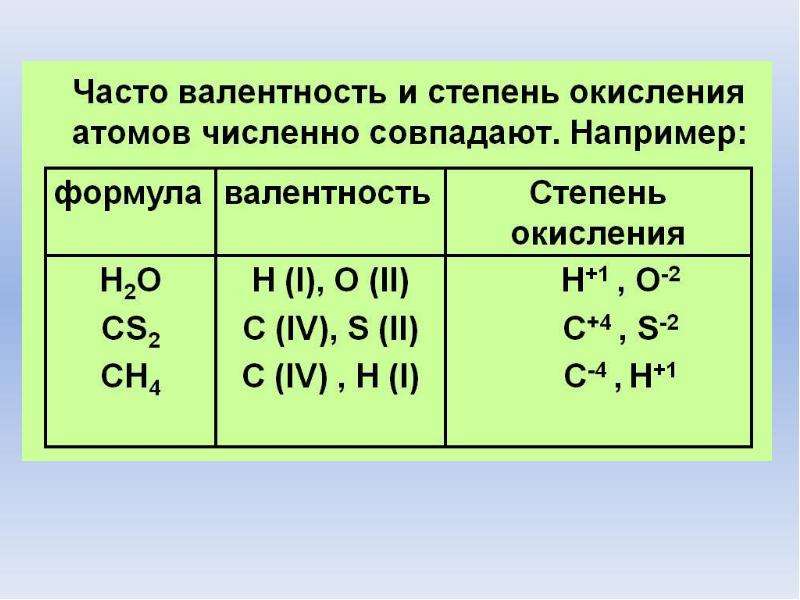 Каждый водород имеет 2 валентных электрона, как и гелий.
Каждый водород имеет 2 валентных электрона, как и гелий.