Содержание
Валентность углерода (C), формулы и примеры
Общие сведения о валентности углерода
В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе. Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем – это карбин и поликумулен – разновидности углерода, построенные из линейных цепных полимеров типа …-C≡ C-C≡C-… или .. = C = C = C = C = ….
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
В природе углерод находится в виде двух стабильных изотопов 12С (98,892%) и 13С (1,108%).
Валентность углерода в соединениях
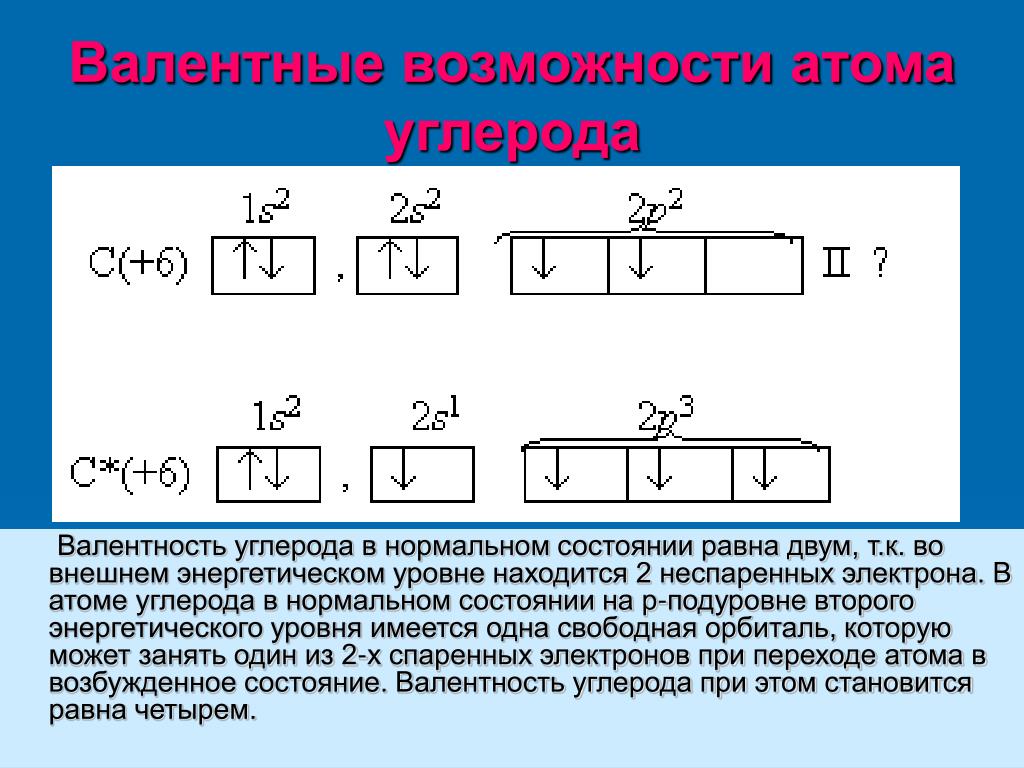
Углерод — шестой по счету элемент Периодической таблицы Д. И. Менделеева. Он находится во втором периоде во IVA группе. В ядре атома углерода содержится 6 протонов и 6 нейтронов (массовое число равно 12). В атоме углерода есть два энергетических уровня, на которых находятся 6 электронов (рис. 1).
И. Менделеева. Он находится во втором периоде во IVA группе. В ядре атома углерода содержится 6 протонов и 6 нейтронов (массовое число равно 12). В атоме углерода есть два энергетических уровня, на которых находятся 6 электронов (рис. 1).
Рис. 1. Строения атома углерода.
Электронная формула атома углерода в основном состоянии имеет следующий вид:
1s22s22p2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что углерод проявляет валентность II в своих соединения (CIIO).
В атоме углерода есть 1 вакантная орбиталь 2p-подуровня. За счет её наличия электроны 2s-подуровня могут распариваться и один из них совершает переход и занимает свободную 2p-орбиталь, т.е. для углерода характерно возбужденное состояние.
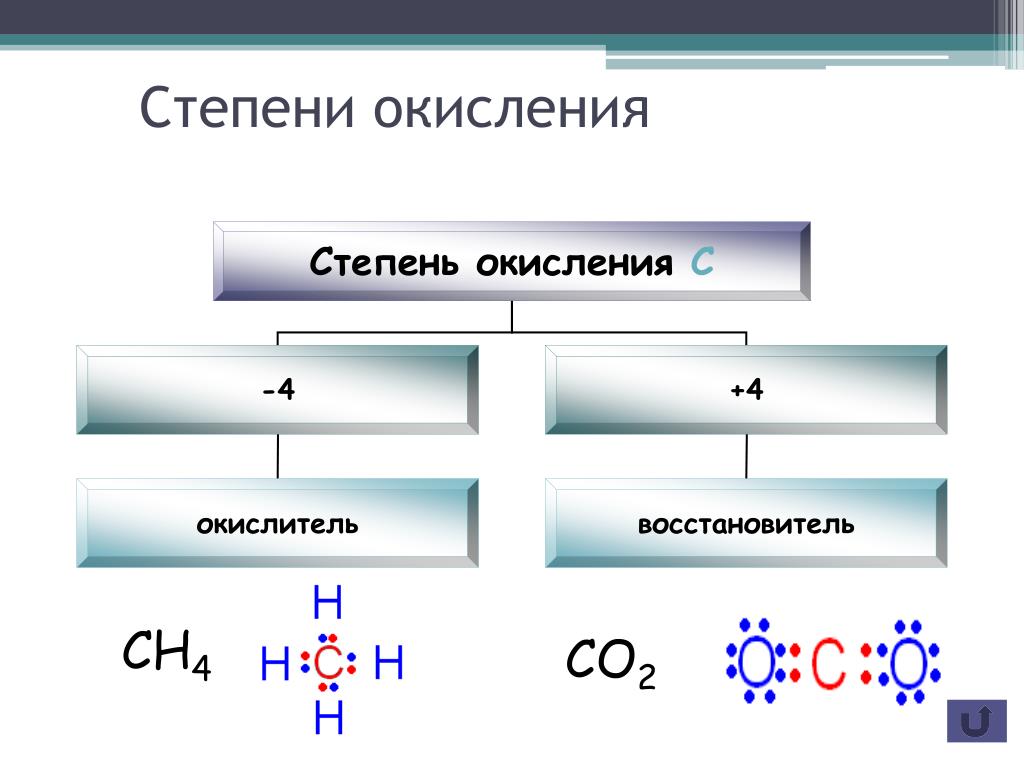
Наличие четырех неспаренных электронов свидетельствует о том, что углерод в своих соединениях (CIVO2, CIVH4, H2CIVO3 и др.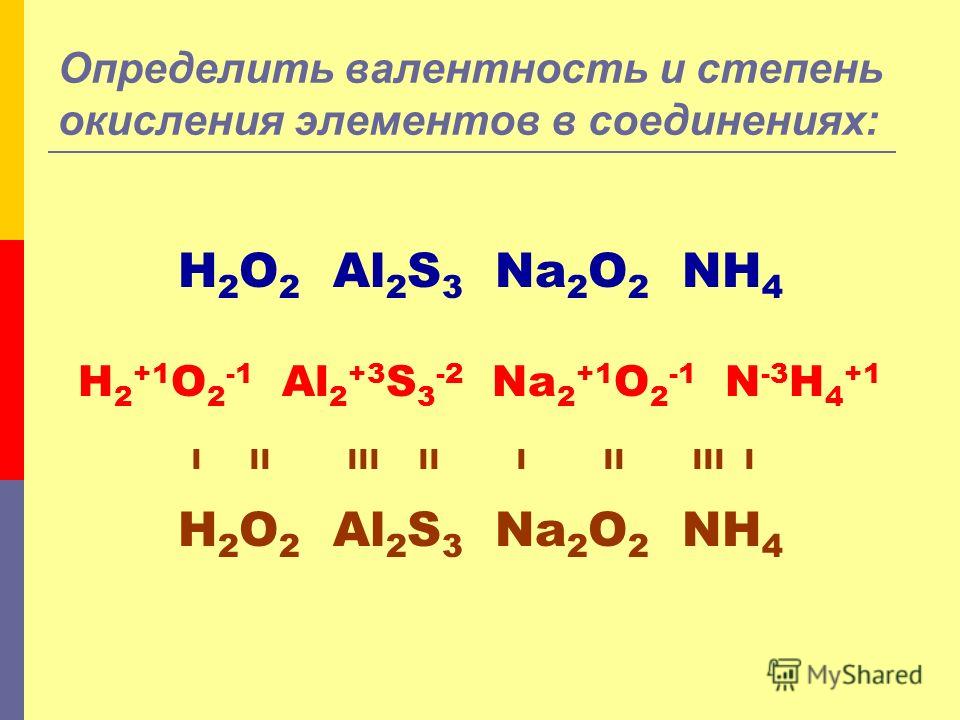 ) проявляет валентность равную IV.
) проявляет валентность равную IV.
Примеры решения задач
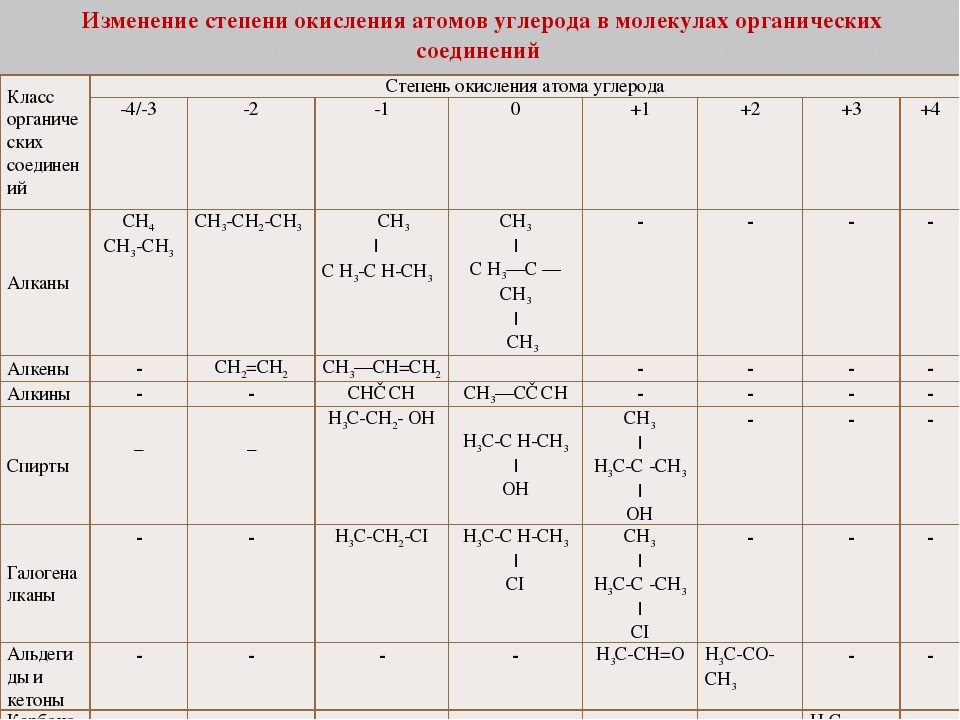
Степень окисления атомов в молекулах органических веществ
Во
многих случаях степень окисления атома элемента не совпадает с числом
образуемых им связей, т.е. не равна валентности данного элемента. Особенно
наглядно это видно на примере органических соединений. Известно, что в
органических соединениях валентность
углерода равна 4 (образует четыре связи), однако степень окисления
углерода, как легко подсчитать, в метане СН4 равна -4, метаноле СНзОН -2,
в формальдегиде СН2О 0, в муравьиной
кислоте НСООН +2, в СО2 +4. Валентность
измеряется только числом ковалентных химических связей, в том числе возникших и
по донорно-акцепторному механизму.
Степень окисления —
условный заряд атома в молекуле, который получает атом в результате полной
отдачи (принятия) электронов, вычисленный из предположения, что все связи имеют
ионный характер.
Для определения степени окисления (СО)
атомов в молекулах органических веществ существуют разные приёмы, вот один из
способов. Он означает, что более электроотрицательный атом, смещая к себе одну
электронную пару, приобретает заряд -1,
две электронных пары — заряд -2.
Связь между одинаковыми атомами не дает вклада в степень окисления. Таким
образом, связь между атомами С-С соответствует нулевой степени их окисления. В
связи C-H углероду как более электроотрицательному атому соответствует заряд
-1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1.
Степень окисления атома в молекуле подсчитывается как алгебраическая сумма
зарядов, которые дают все связи данного атома.
Пример №1.
Так, в молекуле
CH3Cl три связи C-H дают суммарный заряд на атоме C, равный -3, а
связь C-Cl — заряд +1. Следовательно, степень окисления атома углерода в этом
соединении равна:
— 3+1=-2.
Пример №2.
Определим
степени окисления (СО) атомов углерода в молекуле этанола:
C-3H3 – C-1H2 – OH
Три
связи C—H дают суммарный заряд на атоме C, равный (С0+3е—→С-3)
-3.
Две
связи С—Н дают заряд на атоме С,
равный -2,а связь С→О заряд +1,
следовательно, суммарный заряд на атоме С,
равен (-2+1=-1) -1.
Пример №3.
Определим
СО атомов углерода в молекуле уксусной
кислоты:
С-3Н3 – С+3О
– ОН
Три
связи C—H дают суммарный заряд на атоме C, равный (С0+3е—→С-3)
-3.
Двойная связь С=О
(кислород как более электроотрицательный, забирает электроны у атома углерода)
даёт заряд на атоме С, равный +2 (С0-2е—→С+2),а
связь С→О заряд +1, следовательно, суммарный
заряд на атоме С, равен (+2+1=+3) +3.
Пример №4.
Определим
СО атомов углерода в молекуле уксусного
альдегида:
С-3Н3 – С+1О
– Н
Три
связи C—H дают суммарный заряд на атоме C, равный (С0+3е—→С-3)
-3.
Двойная связь С=О
(кислород как более электроотрицательный, забирает электроны у атома углерода)
даёт заряд на атоме С, равный +2 (С0-2е—→С+2),а
связь С—H заряд -1,
следовательно, суммарный заряд на атоме С,
равен (+2-1=+1) +1.
Пример №5.
Определим
СО атомов углерода в молекуле глюкозы С6Н12О6:
Н Н Н Н Н
↓ ↓ ↓ ↓ ↓
Н → С – С – С – С – С –
С => О
↓ ↓ ↓
↓ ↓ ↑
ОН ОН ОН ОН ОН Н
С-1 (принимает электроны у двух атомов водорода
С0+2е—→С-2 и отдаёт один электрон атому
кислорода С0-1е—→С+1)
С0
(принимает
электрон у атома водорода С0+1е—→С-1 и отдаёт один электрон атому кислорода
С0-1е—→С+1)
С+1 (принимает
электроны у атома водорода С0+1е—→С-1 и отдаёт два электрона атому кислорода С0-2е—→С+2)
Как расставлять степени окисления в органических соединениях?.
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ я бы назвал методом блоков.
Метод блоков
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.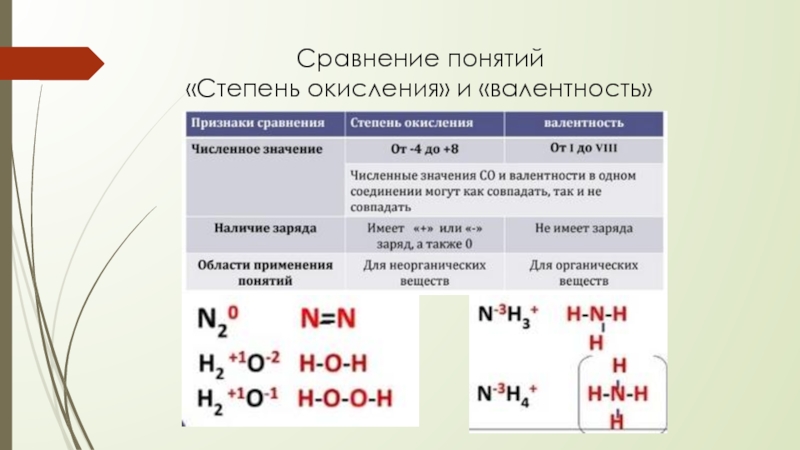
Решаем далее:
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и одного атома кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй метод расстановки степеней окисления в органических веществах я называю «метод стрелок».
Метод стрелок
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Нужно отметить, что на самом деле оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами. Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
Валентность химических элементов. Степень окисления химических элементов
Валентность
химических элементов. Степень окисления
химических элементов.
Такую же
степень окисления, как и в N2O5,
азот имеет в соединении:
1) NO2,
2) KNO2 3) KNO3,
4) HNO2
Атом
углерода проявляет валентность, не
равную IV, в молекуле:
1) углекислого
газа, 2) угарного газа, 3) метана, 4)
угольной кислоты.
Степень
окисления –2 атом серы проявляет в
каждом из соединений:
1) FeS2
и H2S,
2) H2SO4
и FeS, 3) SO2
и H2S,
4) CaS и H2S.
Атом азота
проявляет валентность, отличную от
III, в молекуле:
1) НNO3,
2) HNO2, 3) N2O3,
4) NH3.
Валентность
каждого элемента равна III
в веществе: 1) PH3,
2) AlP, 3) SiC,
4) AlCl3.
Валентность
каждого из элементов равна II
в веществе: 1) AlN, 2) H2O2,
3) H2S,
4) MgS.
Степень
окисления +4, а валентность IV
атом углерода проявляет в соединении:
1) CH4,
2) CO, 3) H2CO3,
4) Al4C3.
Положительную
степень окисления атом кислорода имеет
в соединении:
1) Н2О, 2) Н2О2,
3) F2O,
4) Fe3O4.
Степень
окисления -4, а валентность IV
атом углерода имеет в соединении:
1) СО2,
2) СН4, 3) Н2СО3,
4) ССl4.
Максимально
возможную степень окисления атом серы
проявляет в соединении:
1) H2S,
2) H2SO4,
3) K2SO3,
4) SF4.
Валентность серы в
соединениях SO2,
MgS, SO3
соответственно равна:
1) II, VI,
III, 2) IV,
VI, III,
3) IV, II, VI,
4) II, II,
VI
Валентность
азота в соединениях NH3
и NO2 соответственно
равны:
1) III, IV,
2) III, V,
3) IV, III,
4) III, VI
В каком
соединении хлор проявляет валентность
III: 1) Cl2O,
2) Cl2O3,
3) AlCl3, 4) Cl2O7.
Низшие
степени окисления серы и фосфора
соответственно равны:
1) -2, -3, 2) -2, -1,
3) +3,+2, 4) +2, +3
В соединениях
HNO3 и NH3
степени окисления азота соответственно
равны: 1) +5 и +3, 2)
+6 и -3, 3) +5 и +4, 4) +5 и -3
Значения высшей и
низшей степени окисления фосфора
соответственно равны:
1) -3 и +3, 2) +3 и +5, 3) +5 и -3, 4)
-5 и +3
Высшая и низшая
степени окисления кремния соответственно
равны: 1) -4 и +2, 2) +4 и -4, 3) 0 и +4, 4) +2 и
+4
Валентности
металлов в соединениях Al2S3,
AgCl, FeBr2
соответственно равны:
1) III, II,
I, 2) I,
II, III,
3) II, I, I
4) III, I,
II
Валентность
углерода в соединениях CO2,
CH4, Al4C3
равна соответственно:
1) II, II,
IV, 2) IV,
IV, IV, 3)
I, II, IV,
4) IV, I,
II.
Выберите
формулу соединения хлора, в котором он
проявляет степень окисления +1:
1) HCl, 2) Cl2O7,
3) HClO, 4)
HCl4.
Выберите
формулу соединения фосфора, в котором
он проявляет степень окисления – 3:
1) PH3,
2) PCl3, 3)
P2O5,
4) P2O3.
Степень
окисления азота в NH4Cl
равна: 1) +3, 2) – 3, 3) +4, 4) – 4.
Какой из
перечисленных элементов может проявлять
в соединениях как положительную, так
и отрицательную степень окисления?
1) неон, 2) фтор, 3) бром, 4) натрий.
Как связаны
валентность и степень окисления атома?
1) степень окисления всегда меньше
валентности,
2) степень
окисления всегда равна валентности,
3) степень окисления может
быть не равна валентности, 4) это
одно и то же.
Выберите формулу
соединения кислорода, в котором он
проявляет степень окисления +2:
1) OF2, 2) Na2O,
3) KOH, 4) H2O2.
Высшую
валентность, равную 7, может проявлять:
1) фосфор, 2) кремний, 3)
железо, 4) хлор.
Валентность
хрома в соединении Сr2O3 равна: 1) II,
2) III, 3) I, 4) IV.
Степень
окисления +3 фосфор проявляет в соединении:
1) PH3, 2) H3PO4,
3) PCl3, 4) AlP.
Степень
окисления углерода в оксалате натрия
Na2C2O4
равна: 1) -4, 2) 0, 3) +3, 4) +4.
Степень
окисления -4 углерод проявляет в
соединении: 1) CaC2,
2) C2H4,
3) CO2, 4) Al4C3.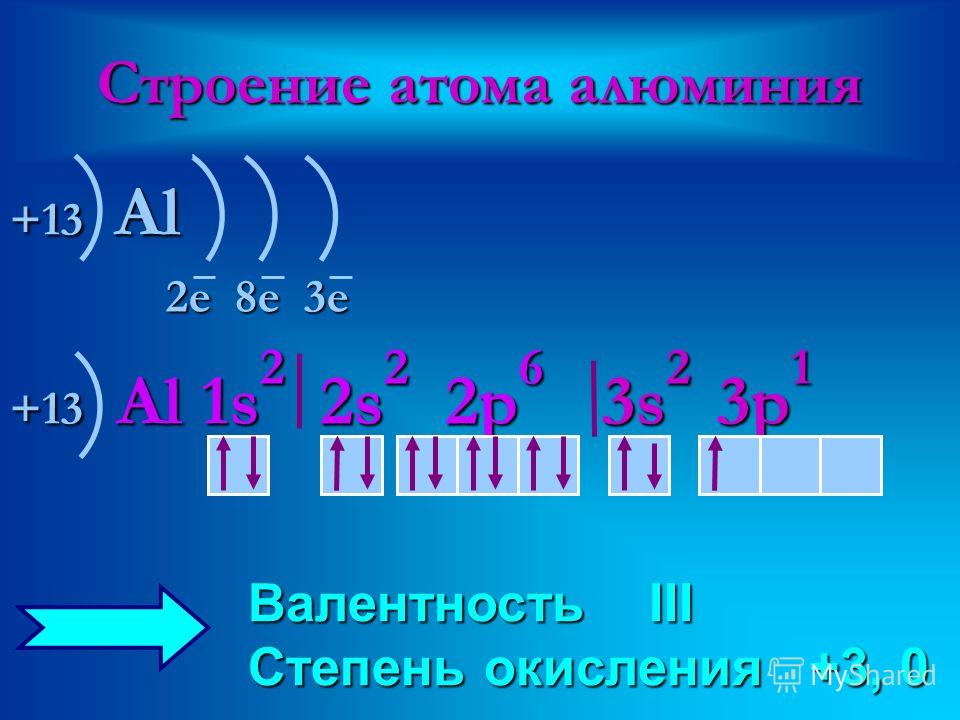
Степень
окисления серы в соединении, формула
которого K2S2O7,
равна: 1) -2,
2) 0, 3) +4, 4) +6.
Постоянная
степень окисления +2 характерна для: 1)
Al, 2) Na,
3) Ca, 4) Fe.
Постоянная
степень окисления +1 характерна для: 1)
Al 2) Na,
3) Zn, 4)Cu.
Постоянная
степень окисления +3 характерна для: 1)
Na, 2) Al,
3) Ca, 4) Fe.
Постоянная
степень окисления – 1 характерна для:
1) F, 2) Cl,
3) Br, 4) Li.
В каком
соединении степень окисления азота
равна +3?
Обобщающая таблица на тему «Валентность и степень окисления» 11кл
Валентность и степень окисления.
Валентность – способность атомов образовывать химические связи
Валентность в соединениях с ковалентным типом связи определяется числом общих электронных пар (числом неспаренных электронов, идущих на образование общих электронных пар)
↓↑ ↓ ↓ ↓↑ ↓↑ ↓
+8О 2ē,6ē; 1s22s22p4; …2 ↓↑ +17Cl 2ē,8ē,7ē; …3s2 3p5; …3 ↓↑
s p s p
. . .. ..
. .. ..
:О::О: О = О В (О) = II Н:Cl: Н – Cl В (Cl) = I ; В (H) = I
¨ ¨ ¨
Валентной может быть и общая электронная пара, предоставляемая атому со свободной орбиталью (донорно- акцепторный механизм образования ковалентной связи)
NH3 + HCl = NH4Cl В(N) = IV
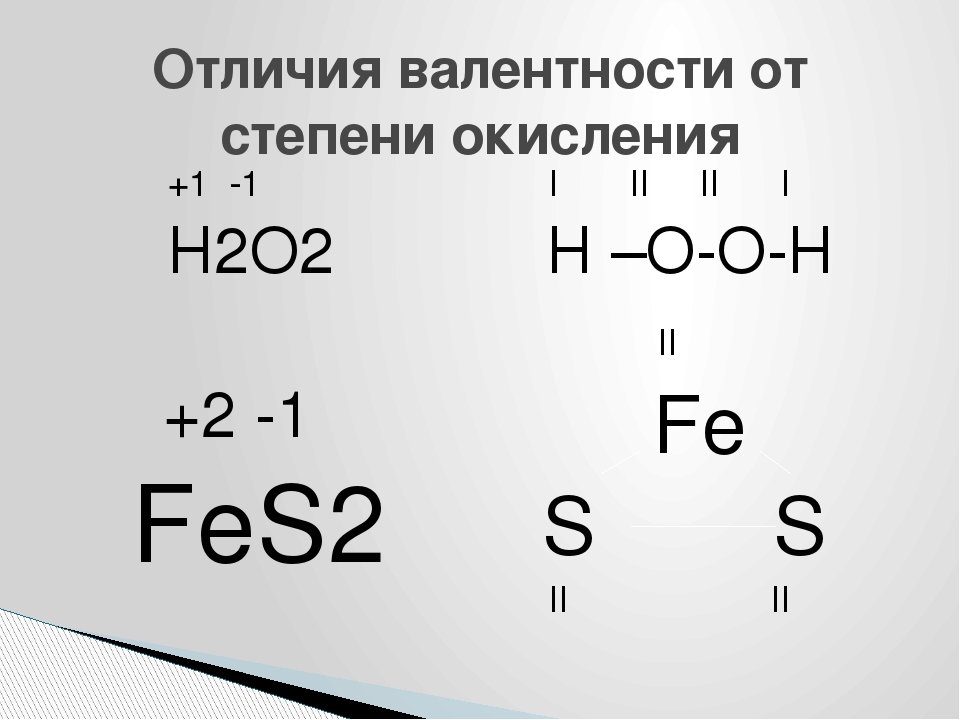
Степень окисления (с.о.) – условное формальное понятие
С.О. – условный заряд, который возник бы на атоме, если б он принял или отдал
электроны, необходимые для образования химической связи
С. О. в простых веществах равна 0: Na; Al; S; Cl2; O2
С.О. в бинарных соединениях отрицательна у более электроотрицательного элемента, у менее электроотрицательного – положительна: +6-2 -3+1 +1 -2
SO3 ; NH3; Na2S
В соединениях, состоящих из трех и более элементов, с.о. определяют, исходя из того, что алгебраическая сумма окисления химических элементов должна быть равна 0.

+1 +5 –2 находят с.о. более электроотрицательного элемента, затем степень +2 х -2
К N O3 окисления менее электроотрицательного элемента MgSO4
(-2•3) +1+х =0; -6 +1 +х = 0; х = +5 ; (-2 • 4) + х + 2 = 0; -8 +х +2 = 0; х =+ 6
В соединениях с ионной связью используют понятие степени окисления, а не валентности.
Валентные возможности атомов. Электроны, участвующие в образовании химических связей называются валентными
— Неспаренные электроны предвнешнего энергетического уровня атомов элементов побочных подгрупп
— Неподеленные электронные пары атомов химических элементов и свободные орбитали других атомов
F; O; N; C – будь внимателен при определении валентности и степени окисления!!!
IV группа
V группа
VI группа
VII группа
↑ ↑
+6С 2ē, 4ē; …2s22p2; … 2 ↓↑
В соединении СО атом углерода предоставляет для химической связи два неспаренных электрона и свободную орбиталь кислороду:
+2-2
С ≡ О ; СО В(О) = III ; с.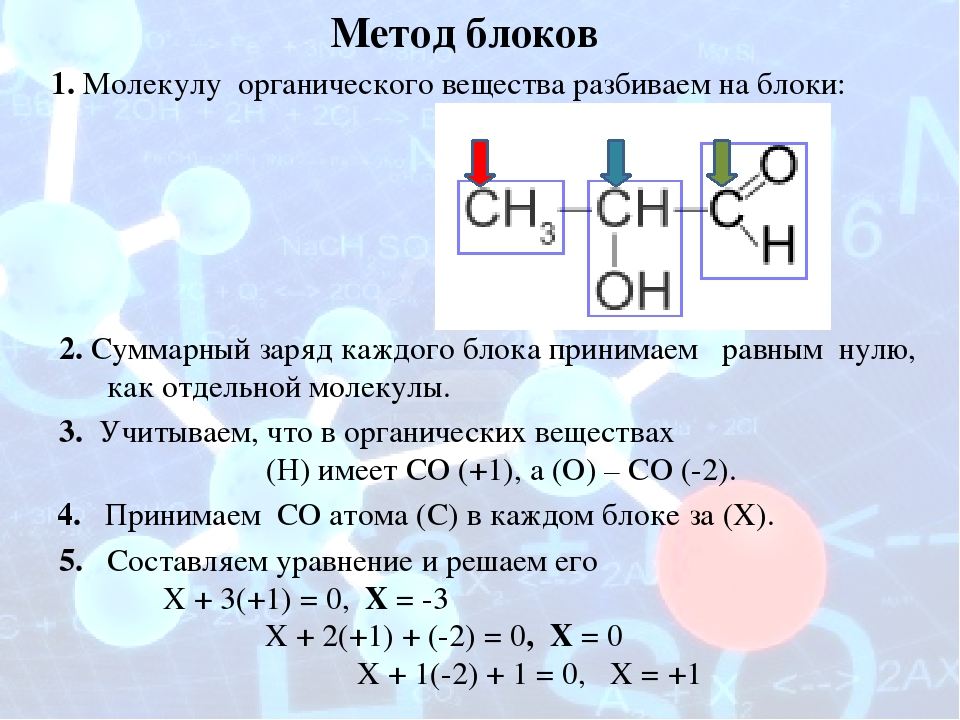 о. (О) = +2
о. (О) = +2
В(С) = II; с.о. (С) = -2
а) NH3
B(N) = III
С.О.(N) = -3
Н
б) NH4Cl → [ H: N: Н ]+ B(N) = IV
Н+ С.О.(N) = -3
в) N2 N2O NO N2O3 NO2 N2O5
C.О 0 +1 +2 +3 +4 +5
а) H2O; Н-О-Н; С.О.(О) = -2; B(O) = II
б) H2O2; Н→О–О←Н; С.О.(О) = -1;
пероксид водорода B(O) = II
в) H3O+— ион гидроксония В(О) = III
a) HF; H→ F В(F) = I; С.О.(F) = -1
б) ОF2; F-O-F мал радиус фтора
В(F) = I; С.О.(F) = -1
В(O) = II; С.О.(O) = +2
↓ ↓ ↓
+6 *С 2ē, 4ē; …2s12p2; … 2 ↓ р
СН4 В (С) = IV; С. О.= — 4 s
О.= — 4 s
-2+1-2+1
С Н3 О Н — этанол В (С) = IV; С.О.= -2
Н Н
↓ ↓
Н→С→О←Н Н→С←Н
↑ ↑
Н Н
В (Р) = III; V;
-3 0 +3 +5
РН3 Р Р2О3 Р2О5
Са3Р2 Н3РО3 НРО3
Н3РО4
В (S) = II; IV; VI
C.O. = -2, 0, +2, +4, +6
H2S S SO2 SO3
MgS H2SO3 H2SO4
Na2SO3 Na2SO4
В (Cl) = I, III , V, VII
С.O (Cl) -1 0 +1 +3 +5 +7
HCl Cl2 Cl2O Cl2O3 Cl2O5 Cl2O7
HClO HClO2 HClO3 HClO4
КClO КClO2 КClO3 КClO4
наиболее характерны С. О: 0 +2 +3 +4 +6 +7
О: 0 +2 +3 +4 +6 +7
Mn MnO Mn2O3 MnO2 малоуст. Mn2O7
Mn(OH)2 Mn(OH)3 K2MnO4 HMnO4
MnSO4 Mn2(SO4)3 KMnO4
Задания по теме «Валентность и степень окисления»
1 Определите валентность и степень окисления
а) (NH4)2CO3 б) HCN в) CH3NH3Cl г) O2N-C6H4-NH2
2. Какому веществу не могут соответствовать следующие формулы:
а) Na2PbSi6O14 б) Ca2MgC2O6 в) Mg3H4Si2O9
A.1 Cтепень окисления +2 атом углерода имеет в соединении:
1) СО2 2) СBr4 3) НСООН 4) СН3СООН
A2. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CrCl3 и Cl2O7 2) KClO4 и Cl2O7 3) KCl и HClO 4) KClO2 и BaCl2
A.3 Cтепень окисления +3 атом хлора имеет в соединении:
1) СlО3 2) Cl2O6 3) Ba(ClO2)2 4) KClO3
А.4 Cтепень окисления +2 атом, а валентность IV атом углерода имеет в
соединении: 1) СО 2) СО2 3) НСООН 4) СН2Сl2
А.5. Cтепень окисления -3 атом, а валентность IV атом азота имеет в
соединении: 1) HNO2 2) NF3 3) HNO3 4) NH4Cl
А.6. Валентность элемента равна
1) числу образуемых σ- связей 2) числу образуемых π- связей
3) числу образуемых им ковалентных связей
4) степени окисления с противоположным знаком.
А.7. Элемент, проявляющий постоянную степень окисления в своих
соединениях: 1) хлор 2) сера 4) фтор 5) кислород
А.8. Валентность IV атом азота имеет в соединении:
1) HNO2 2) (NH4)2 СО3 3)NO 4) Ca(NO3)2
А.9 Cтепень окисления +1 атом хлора имеет в соединении:
1) СlО2 2) НCl 3) Ba(ClO2)2 4) Сa(ClO)Cl
А.10. Cвою максимальную степень окисления азот проявляет в соединении
1) NH4Cl 2) NO2 3) NH4NO3 4) NOF
А.11. Cтепень окисления серы в соединениях SO2, Na2SO3 соответственно
1) +2 и +4 2) +4 и +4 3) +4 и +6 4) -4 и +6
А.12. Cтепень окисления серы увеличивается в ряду
1) Н2S, S, SO3 2) S, SO3,Na2SO3 3) SO3, SO2, S 4) Н2S, SO3, Na2SO4
А. 13. На четвертом энергетическом уровне расположены все валентные электроны
13. На четвертом энергетическом уровне расположены все валентные электроны
1) железа 2) кальция 3) углерода 4) серы
А.14. Атом элемента, максимальная степень окисления которого +4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня:
1) 3s23p4 2) 2s22p2 3) 2s22p4 4) 2s22p6
А.15. Наибольшую степень окисления марганец имеет в соединении
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
A.16. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CН4 и CO2 2) НCНO и СН2Cl2 3) СН3ОН и Nа2CO3 4) СН3Cl и СaC2
А.17. В какой молекуле степень окисления элемента равна нулю, а валентность равна единице? 1) О2 2)СаС2 3) Cl2 4) СО
А. 18. В соединениях РН3, Р2О5, Н3РО3 фосфор имеет с.о., соответственно равные:
18. В соединениях РН3, Р2О5, Н3РО3 фосфор имеет с.о., соответственно равные:
1) +3,+5,-3 2) -3, +5,+3 3) -3,+3,+5 4) +3,-5,-3
Знаешь ли ты…
В молекуле азотной кислоты азот отдает неспаренные электроны для образования связей между атомами кислорода (при Н-О, при N=О) третий атом кислорода спаривает свои неспареннве электроны и на освободившуюся ячейку притягивает спаренные электроны азота.
В(N) = IV С.О.(N) = +5 +1 +5 -2
Н N O3
Или: три неспаренных электрона N дает трем атомам кислорода, а оющую электронную пару располагает между двумя атомами кислорода равномерно.
O – H
Na –O – H; Ba Na – O – O – Na
O – H
(S-VI гр: +4,+6,+2,-2)
элементов нечетной группы – нечетные числа (Cl — VII гр: -1-,+3,+5+7)
Высшая степень окисления элемента главной подгруппы = номеру группы
Степени окисления металлов в соединениях > 0
Низшая степень окисления неметалла равна (8 – № группы)
________________________________________________________
В. 1 Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
1 Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
В.2 Установите соответствие между формулoй соединения и значением степени окисления хлора в нем.
Ответы на задания по теме «Валентность и степень окисления»
A.1 Cтепень окисления +2 атом углерода имеет в соединении:
1) СО2 2) СBr4 3) НСООН 4) СН3СООН
A2. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CrCl3 и Cl2O7 2) KClO4 и Cl2O7 3) KCl и HClO 4) KClO2 и BaCl2
A.3 Cтепень окисления +3 атом хлора имеет в соединении:
1) СlО3 2) Cl2O6 3) Ba(ClO2)2 4) KClO3
А. 4 Cтепень окисления +2 атом, а валентность IV атом углерода имеет в
4 Cтепень окисления +2 атом, а валентность IV атом углерода имеет в
соединении: 1) СО 2) СО2 3) НСООН 4) СН2Сl2
А.5. Cтепень окисления -3 атом, а валентность IV атом азота имеет в
соединении: 1) HNO2 2) NF3 3) HNO3 4) NH4Cl
А.6. Валентность элемента равна
1) числу образуемых σ- связей 2) числу образуемых π- связей
3) числу образуемых им ковалентных связей
4) степени окисления с противоположным знаком.
А.7. Элемент, проявляющий постоянную степень окисления в своих
соединениях: 1) хлор 2) сера 4) фтор 5) кислород
А.8. Валентность IV атом азота имеет в соединении:
1) HNO2 2) (NH4)2 СО3 3)NO 4) Ca(NO3)2
А.9 Cтепень окисления +1 атом хлора имеет в соединении:
1) СlО2 2) НCl 3) Ba(ClO2)2 4) Сa(ClO)Cl
А. 10. Cвою максимальную степень окисления азот проявляет в соединении
10. Cвою максимальную степень окисления азот проявляет в соединении
1) NH4Cl 2) NO2 3) NH4NO3 4) NOF
А.11. Cтепень окисления серы в соединениях SO2, Na2SO3 соответственно
1) +2 и +4 2) +4 и +4 3) +4 и +6 4) -4 и +6
А.12. Cтепень окисления серы увеличивается в ряду
1) Н2S, S, SO3 2) S, SO3,Na2SO3 3) SO3, SO2, S 4) Н2S, SO3, Na2SO4
А.13. На четвертом энергетическом уровне расположены все валентные электроны
1) железа 2) кальция 3) углерода 4) серы
А.14. Атом элемента, максимальная степень окисления которого +4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня:
1) 3s23p4 2) 2s22p2 3) 2s22p4 4) 2s22p6
А. 15. Наибольшую степень окисления марганец имеет в соединении
15. Наибольшую степень окисления марганец имеет в соединении
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
A.16. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CН4 и CO2 2) НCНO и СН2Cl2 3) СН3ОН и Nа2CO3 4) СН3Cl и СaC2
А.17. В какой молекуле степень окисления элемента равна нулю, а валентность равна единице? 1) О2 2)СаС2 3) Cl2 4) СО
А.18. В соединениях РН3, Р2О5, Н3РО3 фосфор имеет с.о., соответственно равные:
1) +3,+5,-3 2) -3, +5,+3 3) -3,+3,+5 4) +3,-5,-3
В.1 Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
В.2 Установите соответствие между формулoй соединения и значением степени окисления хлора в нем.
1 Определите валентность и степень окисления
-3+1 +4-2 В(N)=IV; В(H)= HCN;
а) (NH4)2CO3 В(O)=II;
-2 +3 -1 +1 +1 -3 +1
г) O2N- C4H4 C2–N H2
В(N) – NH2 = III;
В(N) – NO2 = IV;
В(C) = IV;
В(H)=I;
В(O)=II;
+1+2-3 I IV III
б) HCN H- C ≡ N
-2+1-3+1 В(C)=IV; В(N)=IV;
в)[CH3NH3]+ Cl— В(Cl)=I; В(H)=I;
2. Какому веществу не могут соответствовать следующие формулы:
+1 +2 +4-2 +2 +2 +4 -2
а) Na2PbSi6O14 Na2O• PbO• 6SiO2 б) Ca2MgC2O6 +16 ≠ -12
+2 +1 +4 -2
в) Mg3H4Si2O9 3Mg O• 2SiO2 •2H2O
Задания по теме «Валентность и степень окисления»
1. Степень окисления, равную +4, атом серы имеет в
Степень окисления, равную +4, атом серы имеет в
1) H2SO4 2) FeS2 3) H2SO3 4) NaHSO4
2. В каком состоянии степень окисления атома хлора равна +5
1) HClO 2) Cl2O7 3) NaClO4 4) KClO3
3. Степень окисления -3 азот проявляет в соединении
1) KBO2 2) NH4Cl 3) KNO3 4) N2O3
4. Наименьшую степень окисления сера проявляет в соединении
1) H2S 2) SO3 3) SO2 4) K2SO3
5. Степень окисления азота в ионе NO2¯ равна 1) -1 2) +3 3) -3 4) +5
6. Низшую степень окисления азот проявляет в соединении
1) N2H4 2) K2NH 3) NF3 4) HNO3
7. Одинаковая степень окисления серы в ряду
1) SO2, SO2Cl2, R2SO3 2) H2S, K2S, S2Cl2
3) KHSO4, SO3, H2SO4 4) SO3, H2SO4, Na2S
8. Степень окисления фосфора уменьшается в ряду
Степень окисления фосфора уменьшается в ряду
1) K3PO4, K2HPO3, Ca3P2 2) P4O6, H4P2O7, KPH2O2
3) H2PHO3, KPO3, PH3 4) PH3, H3PO4, P2O5
9. Иону Rb+ соответствует электронная формула
1) …4s24p65s1 2) …4s25d1 3) …4s24p65s2 4) …4s24p6
10. В основном состоянии ? неспаренные электроны содержит частица
1) Ca2+ 2) Al3+ 3) Ni2+ 4) Pb2+
11. Степень окисления, не характерная для азота
1) -5 2) -3 3) +3 4) +5
12. Степень окисления +3 не проявляет
1) стронций 2) хром 3) азот 4) хлор
13. Высшая положительная степень марганца равна: 1) +2 2) +4 3) +7 4) +8
14. Наименьшую степень окисления углерод проявляет в соединении
Наименьшую степень окисления углерод проявляет в соединении
1) CCl4 2) CH4 3) C2H2 4) C2H6
15. Свою максимальную степень окисления бром проявляет в соединении
1) NaBr 2) HBrO 3) BrF5 4)KBrO4
16. Степень окисления углерода равна -3 в соединении
1) CHCl3 2) C2H6 3) CH3Cl 4) Na2CO3
17. Среди элементов 6-А группы наиболее электроотрицательным является
1) селен 2) сера 3) полоний 4) кислород
18. В порядке возрастания электроотрицательности элементы расположены в ряду
1) S, Cl, F 2) S, F, O 3) F, S, Cl 4) S, F, Cl
19. Набор ионов, которым соответствует формула 1s2
1) Be2+, O2- 2) Li+, C4+ 3) P3-, Cl— 4) F—, Na+
20. Степень окисления серы в соединении FeSO3 равна 1) -1 2) +2 3) 0 4) +4
Степень окисления серы в соединении FeSO3 равна 1) -1 2) +2 3) 0 4) +4
21 Отрицательная степень окисления у серы в соединении
1) NaHS 2) NaHSO3 3) SO2 4) H2SO4
22.Одинаковую степень окисления железо проявляет в соединениях:
1) FeO и FeСO3 2) Fe(OH)3 и FeСl2 3) Fe2O3 и Fe(NO3)2 4) FeO и FePO4
23. Азот проявляет одинаковую степень окисления в каждом из двух соединений: 1) NH3, N2O3 2) HNO2, Li3N 3) Mg3N2, NH3 4) NH3, HNO2
24.Наибольшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
25. Наибольшую валентность в соединениях с водородом проявляют
Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера 3) азот и фосфор 4) углерод и кремний
26.Только окислительные свойства способен проявлять
1) кислород 2) фтор 3) хлор 4) азот
27.Наибольшей электроотрицательностью обладает 1)магний 2) кремний 3) хлор 4) бром
28. Наибольшей электроотрицательностью обладает
углерод 2) азот 3) мышьяк 4) фосфор
29.В порядке увеличения электроотрицательности элементы расположены в ряду:
1) O → N → C → B 2) Si → Ge → Sn → Pb
3) Li → Na → K → Rb 4) Si → P → S → Cl
30.Хлор является и окислителем и восстановителем в реакции:
1) 2FeCl2 + Cl2 = 2FeCl3 2) Fe + 2HCl = FeCl2 + H2
3) 2KOH + Cl2 = KCl + KClO + H2O
4) MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
31. Реакции, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O
Реакции, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O
соответствует схема превращения азота:
1) N+3 → N+2 2) N-3 → N-2 3) N+3 → N-3 4)N-3 → N+2
32. Наименьшую степень окисления проявляет сера в соединении
1) NН4HS 2) Na2SО3 3) SО2 4) S
33. Степень окисления углерода равна 0 в веществах
1) дихлорметан и метаналь 2) метаналь и муравьиная кислота
3) муравьиная кислота и графит 4) графит и метан
34. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера3) азот и фосфор 4) углерод и кремний
35. Число валентных, электронов в нормальном состоянии атома с электронной конфигурацией 1s22s22р63s23р63d104s24р64d55s1 равно 1) 1 2) 5 3) 3 4) 6
36. Порядковый номер элемента, у атома которого валентные электроны …4s24р4, равен 1) 12 2) 18 3) 22 4) 34
Порядковый номер элемента, у атома которого валентные электроны …4s24р4, равен 1) 12 2) 18 3) 22 4) 34
37. На 4s-энергетическом подуровне расположены все валентные электроны в атоме
1) железа 2) кальция 3) углерода 4) серы
38. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент: 1) хлор, 2) германий, 3) мышьяк, 4) селен
39. Наименьшую степень окисления хром имеет в соединении
1) K2CrO4 2) CrSO4 3) CrO3 4) Cr2(SO4)3
В. 3. Установите соответствие между формулой вещества и степенью окисления азота в нем.
Ответы на задания по теме «Валентность и степень окисления» 1. Степень окисления, равную +4, атом серы имеет в
1) H2SO4 2) FeS2 3) H2SO3 4) NaHSO4
2. В каком состоянии степень окисления атома хлора равна +5
В каком состоянии степень окисления атома хлора равна +5
1) HClO 2) Cl2O7 3) NaClO4 4) KClO3
3. Степень окисления -3 азот проявляет в соединении
1) KBO2 2) NH4Cl 3) KNO3 4) N2O3
4. Наименьшую степень окисления сера проявляет в соединении
1) H2S 2) SO3 3) SO2 4) K2SO3
5. Степень окисления азота в ионе NO2¯ равна 1) -1 2) +3 3) -3 4) +5
6. Низшую степень окисления азот проявляет в соединении
1) N2H4 2) K2NH 3) NF3 4) HNO3
7. Одинаковая степень окисления серы в ряду
1) SO2, SO2Cl2, R2SO3 2) H2S, K2S, S2Cl2
3) KHSO4, SO3, H2SO4 4) SO3, H2SO4, Na2S
8. Степень окисления фосфора уменьшается в ряду
Степень окисления фосфора уменьшается в ряду
1) K3PO4, K2HPO3, Ca3P2 2) P4O6, H4P2O7, KPH2O2
3) H2PHO3, KPO3, PH3 4) PH3, H3PO4, P2O5
9. Иону Rb+ соответствует электронная формула
1) …4s24p65s1 2) …4s25d1 3) …4s24p65s2 4) …4s24p6
10. В основном состоянии ? неспаренные электроны содержит частица
1) Ca2+ 2) Al3+ 3) Ni2+ 4) Pb2+
11. Степень окисления, не характерная для азота
1) -5 2) -3 3) +3 4) +5
12. Степень окисления +3 не проявляет
Степень окисления +3 не проявляет
1) стронций 2) хром 3) азот 4) хлор
13. Высшая положительная степень марганца равна: 1) +2 2) +4 3) +7 4) +8
14. Наименьшую степень окисления углерод проявляет в соединении
1) CCl4 2) CH4 3) C2H2 4) C2H6
15. Свою максимальную степень окисления бром проявляет в соединении
1) NaBr 2) HBrO 3) BrF5 4)KBrO4
16. Степень окисления углерода равна -3 в соединении
1) CHCl3 2) C2H6 3) CH3Cl 4) Na2CO3
17. Среди элементов 6-А группы наиболее электроотрицательным является
1) селен 2) сера 3) полоний 4) кислород
18. В порядке возрастания электроотрицательности элементы расположены в ряду
1) S, Cl, F 2) S, F, O 3) F, S, Cl 4) S, F, Cl
19. Набор ионов, которым соответствует формула 1s2
Набор ионов, которым соответствует формула 1s2
1) Be2+, O2- 2) Li+, C4+ 3) P3-, Cl— 4) F—, Na+
20. Степень окисления серы в соединении FeSO3 равна 1) -1 2) +2 3) 0 4) +4
21 Отрицательная степень окисления у серы в соединении
1) NaHS 2) NaHSO3 3) SO2 4) H2SO4
22.Одинаковую степень окисления железо проявляет в соединениях:
1) FeO и FeСO3 2) Fe(OH)3 и FeСl2 3) Fe2O3 и Fe(NO3)2 4) FeO и FePO4
23. Азот проявляет одинаковую степень окисления в каждом из двух соединений: 1) NH3, N2O3 2) HNO2, Li3N 3) Mg3N2, NH3 4) NH3, HNO2
24. Наибольшую степень окисления марганец имеет в соединении:
Наибольшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
25. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера 3) азот и фосфор 4) углерод и кремний
26.Только окислительные свойства способен проявлять
1) кислород 2) фтор 3) хлор 4) азот
27.Наибольшей электроотрицательностью обладает 1)магний 2) кремний 3) хлор 4) бром
28. Наибольшей электроотрицательностью обладает
углерод 2) азот 3) мышьяк 4) фосфор
29.В порядке увеличения электроотрицательности элементы расположены в ряду:
1) O → N → C → B 2) Si → Ge → Sn → Pb
3) Li → Na → K → Rb 4) Si → P → S → Cl
30.Хлор является и окислителем и восстановителем в реакции:
1) 2FeCl2 + Cl2 = 2FeCl3 2) Fe + 2HCl = FeCl2 + H2
3) 2KOH + Cl2 = KCl + KClO + H2O
4) MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
31. Реакции, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O
Реакции, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O
соответствует схема превращения азота:
1) N+3 → N+2 2) N-3 → N-2 3) N+3 → N-3 4)N-3 → N+2
32. Наименьшую степень окисления проявляет сера в соединении
1) NН4HS 2) Na2SО3 3) SО2 4) S
33. Степень окисления углерода равна 0 в веществах
1) дихлорметан и метаналь 2) метаналь и муравьиная кислота
3) муравьиная кислота и графит 4) графит и метан
34. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера3) азот и фосфор 4) углерод и кремний
35. Число валентных, электронов в нормальном состоянии атома с электронной конфигурацией 1s22s22р63s23р63d104s24р64d55s1 равно 1) 1 2) 5 3) 3 4) 6
36. Порядковый номер элемента, у атома которого валентные электроны …4s24р4, равен 1) 12 2) 18 3) 22 4) 34
Порядковый номер элемента, у атома которого валентные электроны …4s24р4, равен 1) 12 2) 18 3) 22 4) 34
37. На 4s-энергетическом подуровне расположены все валентные электроны в атоме
1) железа 2) кальция 3) углерода 4) серы
38. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент: 1) хлор, 2) германий, 3) мышьяк, 4) селен
39. Наименьшую степень окисления хром имеет в соединении
1) K2CrO4 2) CrSO4 3) CrO3 4) Cr2(SO4)3
В. 3. Установите соответствие между формулой вещества и степенью окисления азота в нем.
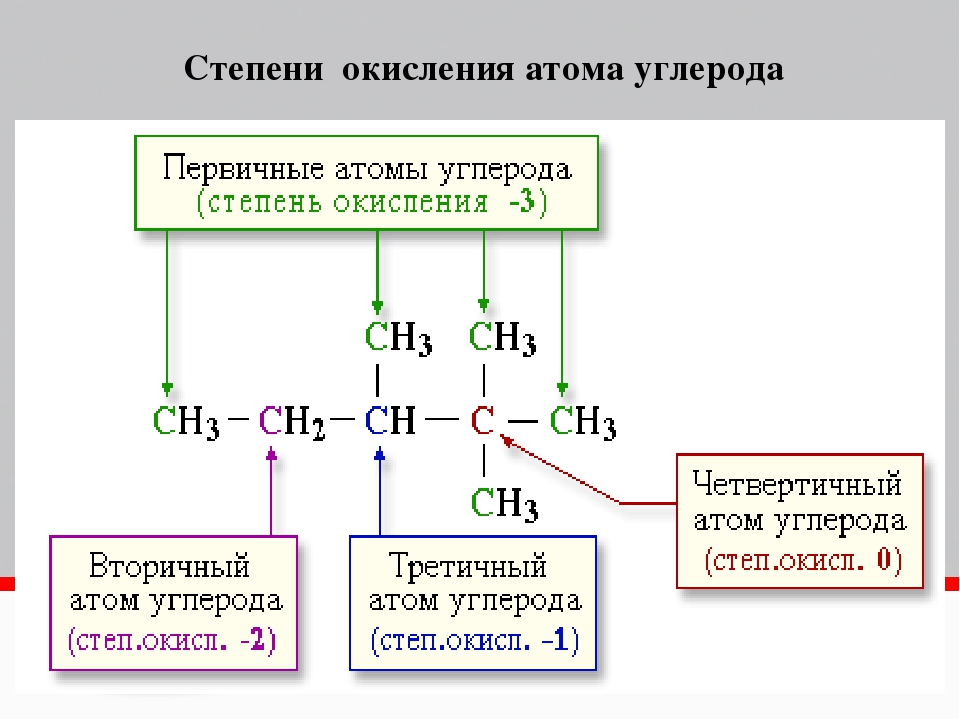
Степень — окисление — углерод
Степень — окисление — углерод
Cтраница 2
Следует, однако, обратить внимание, что в рассмотренных выше реакциях меняется степень окисления углерода 4 в муравьиной кислоте и в ее соли и 2 — в оксиде углерода ( II) и эти реакции являются фактически окислительно-восстановительными.
[16]
В органических соединениях — метане СН4, метиловом спирте СНзОН, формальдегиде СН2О, муравьиной кислоте НСООН, а также в диоксиде углерода степени окисления углерода соответственно равны — 4, — 2, 0, 2, 4, тогда как валентность углерода во всех указанных веществах равна четырем.
[17]
В органических соединениях — метане СН), метиловом спирте СНзОН, формальдегиде СН2О, муравьиной кислоте НСООН, а также в диоксиде углерода степени окисления углерода соответственно равны — 4, — 2, 2, 4, тогда как валентность углерода во всех указанных веществах равна четырем.
[18]
Следует обратить внимание на то, что, несмотря на существование реакции ( 1), окись углерода нельзя считать ангидридом муравьиной кислоты, потому что в результате взаимодействия меняется степень окисления углерода: ( 4) в муравьиной кислоте и ( 2) в окиси углерода.
[19]
В большинстве органических соединений полярность связи между атомами выражена слабо, но окислительные числа атомов в них определяются так же, как и в неорганических соединениях с нолярной связью; в углеводородах, как соединениях с неполярной связью, степени окисления углерода и водорода, очевидно, равны нулю.
[20]
Способность отдавать электроны растет сверху вниз, а способность принимать электроны — снизу вверх по группе Характерные проявляемые валентности — 2 и 4, степени окисления — — 4, 2, 4 Для углерода наиболее часто встречаются соединения с валентностью 4, для свинца — соединения со степенью окисления 2 Простейшие газообразные водородные соединения имеют формулу ЭНф их прочность падает от углерода к свинцу степень окисления углерода в СН4 — 4, в РЬН4 — 4 Формулы высших оксидов Э02, их свойства изменяются от кислотных ( СО2, SiO2) до амфотсрных ( SnO2, PbO2) Оксид углерода ( Ш СО является безразличным ( несолс-образующим) оксидом, оксиды олова ( II) и свинца ( II) — основными с проявлением некоторых амфотсрных свойств.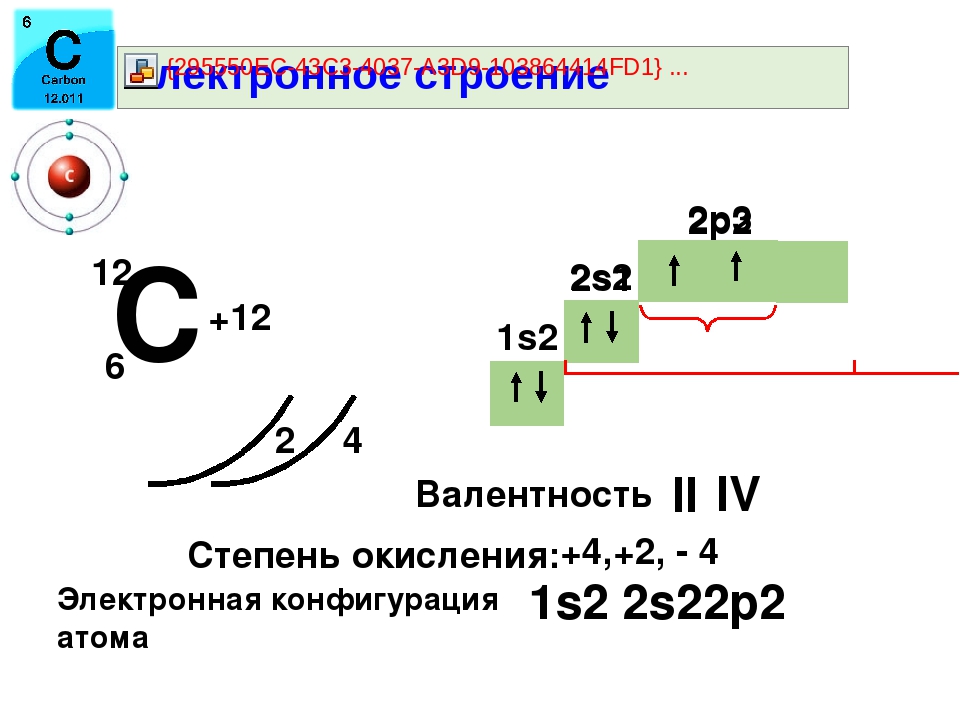 Сила кислородсодержащих кислот типа Н2ЭО3 уменьшается сверху вниз по группе.
Сила кислородсодержащих кислот типа Н2ЭО3 уменьшается сверху вниз по группе.
[21]
Карбидами называются соединения элементов с углеродом, в которых последний играет роль электроотрицательного элемента. Степень окисления углерода в карбидах может быть различной. Однако такие карбиды известны лишь у немногих сравнительно активных легких металлов.
[22]
Углерод непосредственно соединяется со многими металлами, образуя карбиды — соединения — в которых углерод электроотрицателен. Степень окисления углерода в карбидах различна. Различны и химические свойства карбидов.
[23]
Карбидами называют соединения элементов с углеродом, в которых последний играет роль электроотрицательного элемента. Степень окисления углерода в карбидах может быть различной. Однако такие карбиды известны лишь у немногих сравнительно активных легких металлов, а именно у бериллия и алюминия. Они представляют собой кристаллические вещества, по виду напоминающие обычные соли.
Они представляют собой кристаллические вещества, по виду напоминающие обычные соли.
[24]
Атомы одного и того же элемента в различных соединениях могут иметь разные значения степени окисления. Степени окисления углерода в молекулах СЩ, СН3ОН, СН2О, НСООН, СО2 соответственно равны — 4, — 2, О, 2, 4, тогда как валентность углерода во всех этих соединениях равна четырем. Степень окисления азота в молекулах N2 и Nh4 0 и — 3 соответственно, тогда как валентность его в обоих соединениях равна трем. Из этих примеров становится ясным формальный характер понятия степень окисления. Однако это понятие удобно применять при составлении уравнений окислительно-восстановительных реакций.
[25]
Разложению С02 способствуют ультрафиолетовое излучение и электрический разряд. Степень окисления углерода в С02 максимальная ( 4), а потому диоксид не может быть восстановителем, не горит и не поддерживает горения обычного топлива. Но в его атмосфере горят простые вещества, атомы которых обладают большим сродством к кислороду, чем углерод.
Но в его атмосфере горят простые вещества, атомы которых обладают большим сродством к кислороду, чем углерод.
[26]
Разложению СО2 способствуют ультрафиолетовое излучение и электрический разряд. Степень окисления углерода в СО2 максимальная ( 4), а потому диоксид не может быть восстановителем, не горит и не поддерживает горения обычного топлива. Но в его атмосфере горят простые вещества, атомы которых обладают большим сродством к кислороду, чем углерод.
[27]
При разложении других органических веществ это соотношение может меняться. Если степень окисления углерода в исходном соединении выше, чем в глюкозе, образуется больше углекислого газа, если же степень окисления углерода отрицательна, образуется больше метана.
[28]
В органической химии, как правило, степенями окисления углерода не оперируют, но если необходимо, то их оценивают по тем же правилам. При этом степень окисления углерода находят для каждого атома отдельно.
При этом степень окисления углерода находят для каждого атома отдельно.
[29]
Чему равна степень окисления углерода в этих соединениях.
[30]
Страницы:
1
2
3
4
Степень окисления 3 углерод имеет в соединении. Степень окисления углерода показывает сложность химических связей. Что подразумевается под окислением
Степень окисления — условная величина, использующаяся для записи окислительно-восстановительных реакций. Для определения степени окисления используется таблица окисления химических элементов.
Значение
Степень окисления основных химических элементов основана на их электроотрицательности. Значение равно числу смещённых в соединениях электронов.
Степень окисления считается положительной, если электроны смещаются от атома, т. е. элемент отдаёт электроны в соединении и является восстановителем. К таким элементам относятся металлы, их степень окисления всегда положительная.
е. элемент отдаёт электроны в соединении и является восстановителем. К таким элементам относятся металлы, их степень окисления всегда положительная.
При смещении электрона к атому значение считается отрицательным, а элемент — окислителем. Атом принимает электроны до завершения внешнего энергетического уровня. Окислителями является большинство неметаллов.
Простые вещества, не вступающие в реакцию, всегда имеют нулевую степень окисления.
Рис. 1. Таблица степеней окисления.
В соединении положительную степень окисления имеет атом неметалла с меньшей электроотрицательностью.
Определение
Определить максимальную и минимальную степень окисления (сколько электронов может отдавать и принимать атом) можно по периодической таблице Менделеева.
Максимальная степень равна номеру группы, в которой находится элемент, или количеству валентных электронов. Минимальное значение определяется по формуле:
№ (группы) – 8.
Рис. 2. Таблица Менделеева.
Углерод находится в четвёртой группе, следовательно, его высшая степень окисления +4, а низшая — -4. Максимальная степень окисления серы +6, минимальная — -2. Большинство неметаллов всегда имеет переменную — положительную и отрицательную — степень окисления. Исключением является фтор. Его степень окисления всегда равна -1.
Следует помнить, что к щелочным и щелочноземельным металлам I и II групп соответственно, это правило не применимо. Эти металлы имеют постоянную положительную степень окисления — литий Li +1 , натрий Na +1 , калий K +1 , бериллий Be +2 , магний Mg +2 , кальций Ca +2 , стронций Sr +2 , барий Ba +2 . Остальные металлы могут проявлять разную степень окисления. Исключением является алюминий. Несмотря на нахождение в III группе, его степень окисления всегда +3.
Рис. 3. Щелочные и щелочноземельные металлы.
Из VIII группы высшую степень окисления +8 могут проявлять только рутений и осмий. Находящиеся в I группе золото и медь проявляют степень окисления +3 и +2 соответственно.
Запись
Чтобы правильно записывать степень окисления, следует помнить о нескольких правилах:
- инертные газы не вступают в реакции, поэтому их степень окисления всегда равна нулю;
- в соединениях переменная степень окисления зависит от переменной валентности и взаимодействия с другими элементами;
- водород в соединениях с металлами проявляет отрицательную степень окисления — Ca +2 H 2 −1 , Na +1 H −1 ;
- кислород всегда имеет степень окисления -2, кроме фторида кислорода и пероксида — O +2 F 2 −1 , H 2 +1 O 2 −1 .
Что мы узнали?
Степень окисления — условная величина, показывающая, сколько электронов принял или отдал атом элемента в соединении. Величина зависит от количества валентных электронов. Металлы в соединениях всегда имеют положительную степень окисления, т.е. являются восстановителями. Для щелочных и щелочноземельных металлов степень окисления всегда одинаковая. Неметаллы, кроме фтора, могут принимать положительную и отрицательную степень окисления.
Тест по теме
Оценка доклада
Средняя оценка: 4.5
. Всего получено оценок: 219.
Каждый элемент способен образовывать простое вещество, находясь в свободном состоянии. В таком состоянии движение атомов происходит одинаково, они симметричны. В сложных веществах дело обстоит намного сложнее. в таком случае асимметричны, в молекулах сложных веществ образуются сложные
Что подразумевается под окислением
Существуют такие соединения, в которых электроны распределяются максимально неравномерно, т.е. при образовании сложных веществ переходят от атома к атому.
Именно такая неравномерность распределения в сложных веществах называется окисленностью или окислением. Образуемый при этом заряд атома в молекуле называется степенью окисленности элементов. В зависимости от природы перехода электронов от атома к атому различают отрицательную либо положительную степень. В случае отдачи либо принятия атомом элемента нескольких электронов образуется соответственно положительная и отрицательная степени окисления химических элементов (Э+ или Э -). Например, запись К +1 означает, что атом калия отдал один электрон. В любом центральное место занимают атомы углерода. Валентность данного элемента соответствует 4-м в любом соединении, однако в разных соединениях степень окисления углерода будет разной, она будет равна -2, +2, ±4. Такая природа разного значения валентности и степени окисления наблюдается практически в любом соединении.
Определение степени окисления
Чтобы правильно определить необходимо знать основополагающие постулаты.
Металлы не способны иметь минусовую степень, однако существуют редкие исключения, когда металл образует соединения с металлом. В периодической системе номер группы атома соответствует максимально возможной степени окисления: углерода, кислорода, водорода и любого другого элемента. Электроотрицательный атом при смещении в сторону другого атома одного электрона получает заряд -1, двух электронов -2 и т.д. Это правило не действует для одних и тех же атомов. Например, у связи Н-Н она будет равна 0. Связь С-Н=-1. Степень окисления углерода в связи С-О=+2. Одно и то же значение степени имеют металлы первой и второй группы системы Менделеева и фтор (-1). У водорода данная степень практически во всех соединениях равна +1, за исключением гидридов, в которых она составляет -1. Для элементов, имеющих непостоянную степень, ее можно посчитать, зная формулу соединения. Основное правило, которое гласит, что сумма степеней в любой молекуле равна 0.
Пример расчета степени окисления
Рассмотрим расчет степени окисления на примере углерода в соединении Ch4CL . Возьмём исходные данные: степень у водорода равна +1, у хлора -1. Для удобства в расчете х будем считать степень окисления углерода. Тогда, для Ch4CL будет иметь место уравнение х+3*(+1)+(-1)=0. Произведя несложные арифметические действия, можно определить, что степень окисления углерода будет равняться +2. Таким способом можно произвести расчеты для любого элемента в сложном соединении.
ОПРЕДЕЛЕНИЕ
Углерод
– шестой по счету элемент Периодической таблицы. Расположен во втором периоде IV группы A подгруппы. Обозначение – C.
В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе. Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем — это карбин и поликумулен — разновидности углерода, построенные из линейных цепных полимеров типа …-C≡ C-C≡C-… или.. = C = C = C = C = ….
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
В природе углерод находится в виде двух стабильных изотопов 12 С (98,892%) и 13 С (1,108%).
Степень окисления углерода в соединениях
Углерод существует в виде нескольких простых веществ — аллотропных модификаций (см. выше), в которых его степень окисления равна нулю
.
С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода (-4): Si +4 C -4 , B 4 C -4 , CaC -4 2 , Al 4 C -4 3 . В качестве простейшего карбида можно рассматривать метан C -4 H 4 .
Углерод проявляет степени окисления (+2)
и (+4)
, в соединениях с более электроотрицательными, чем он сам, неметаллическими элементами, например C +2 O -2 , C +2 S -2 , H +1 C -2 N +1 , C +4 O -2 2 , C +4 F -1 4 , C +4 O -2 S -2 , C +4 O -2 Cl -1 2 , C +4 Cl -1 4 и т.д.
Примеры решения задач
ПРИМЕР 1
| Задание | Определите степени окисления кислотообразующих элементов в следующих соединениях: HNO 2 , H 2 CO 3 , H 4 SiO 4 , HPO 3 . |
| Решение | В указанных соединениях кислотообразующими элементами являются азот, углерод, кремний и фосфор. Степень окисления кислорода равна (-2), а водорода — (+1). Примем за «х» степень окисления кислотообразующего элемента и при помощи уравнения электронейтральности найдем её значение: 1 + x + 2×(-2) = 0; Степень окисления азота равна (+3). 2×(+1) + x + 3×(-2) = 0; Степень окисления углерода равна (+4). 4×(+1) + x + 4×(-2) = 0; Степень окисления кремния равна (+4). 1 + x + 3×(-2) = 0; Степень окисления фосфора равна (+5). |
| Ответ | HN +3 O 2 , H 2 C +4 O 3 , H 4 Si +4 O 4 , HP +5 O 3 . |
Разберем задания №4 из вариантов ОГЭ за 2016 год.
Задания с решениями.
Задание №1.
Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
1. HF → Ch5 → h3O → Nh4
2. Sih5 → Ash4 → h3S → HCl
3. HF → h3O → Nh4 → Ch5
4. Sih5 → h3S → Ash4 → HCl
Объяснение:
расставим по порядке во всех вариантах ответа валентности неметаллов:
1. HF (I)→ Ch5(IV) → h3O(II) → Nh4(III)
2. Sih5(IV) → Ash4(III) → h3S(II) → HCl(I)
3. HF(I) → h3O(II) → Nh4(III) → Ch5(IV)
4. Sih5(IV) → h3S(II) → Ash4(III) → HCl(I)
Правильный ответ — 3.
Задание №2.
В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные:
1. +6, +2, +3
2. +6, +3, +2
3. +3, +2, +3
4. +3, +2, +6
Объяснение:
определим у хрома степени окисления в данных соединениях: +6, +2, +3. Правильный ответ — 1.
Задание №3.
Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых:
1. N2O5 и LiNO3
2. Li3N и NO2
3. NO2 и HNO2
4. Nh4 и N2O3
Объяснение:
определим степени окисления азота в каждой паре соединений:
1. +5 и +5
2. -3 и +4
3. +4 и +3
4. -3 и +3
Правильный ответ — 1.
Задание №4.
В порядке уменьшения валентности в водородных соединениях элементы расположены в ряду:
1. Si → P → S → Cl
2. F → N → C → O
3. Cl → S → P → Si
4. O → S → Se → Te
Объяснение:
напишем соответствующие водородные соединения с соответствующими валентностями для каждого ряда:
1. Sih5(IV) → Ph4(III) → h3S(II) → HCl(I)
2. HF(I) → Nh4(III) → Ch5(IV) → h3O(II)
3. HCl(I) → h3S(II) → Ph4(III) → Sih5(IV)
4. h3O(II) → h3S(II) → h3Se(II) → h3Te(II)
Правильный ответ — 1.
Задание №5.
Отрицательная степень окисления химических элементов численно равна:
1. номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение:
электроны — отрицательные частицы, поэтому отрицательная степень окисления обозначает количество электронов, добранных до завершения уровня. Правильный ответ — 2.
(соответственно, положительная степень окисления обозначает недостаток электронов)
Задание №6.
Валентность хрома равна шести в веществе, формула которого:
1. Cr(OH)3 2. Cr2O3 3. h3CrO4 4. CrO
Объяснение:
определим валентность хрома в каждом веществе:
1. Cr(OH)3 — III 2. Cr2O3 — III 3. h3CrO4 — VI 4. CrO — II
Правильный ответ — 3.
Задание №7.
Атомы серы и углерода имеют одинаковую степень окисления в соединениях
1. h3S и Ch5
2. h3SO3 и CO
3. SO2 и h3CO3
4. Na2S и Al3C4
Объяснение:
определим в каждой паре степени окисления серы и углерода:
1. +2 и -4
2. +4 и +2
3. +4 и +4
4. -2 и -4
Правильный ответ — 3.
Задание №8.
В порядке уменьшения валентности в высших оксидах элементы расположены в ряду:
1. Cl → S → P → Si
2. Si → P → S → Cl
3. N → Si → C → B
4. Na → K → Li → Cs
Объяснение:
запишем формулы высших оксидов с соответствующими валентностями для каждого ряда элементов:
1. Cl2О7(VII) → SО3(VI)→ P2О5(V) → SiО2(IV)
Правильный ответ — 1.
Задание №9.
В каком соединении марганец имеет наибольшую степень окисления?
1. KMnO4 2. MnSO4 3. K2MnO4 4. MnO2
Объяснение:
определит степень окисления марганца в каждом соединении:
1. KMnO4 — +7 2. MnSO4 — +2 3. K2MnO4 — +6 4. MnO2 — +4
Правильный ответ — 1.
Задание №10.
Высшую степень окисления углерод имеет в соединении:
1. С алюминием
2. С кальцием
3. С хлором
4. С железом
Объяснение:
запишем соответствующие соединения углерода со степенями окисления:
1. Al4C3 (-4)
2. CaC2 (-4)
3. CCl (+4)
4. Fe3C (-2)
Правильный ответ — 3.
Задания для самостоятельной работы.
1. Нулевое значение степени окисления имеют все элементы в веществах, формулы которых:
1. SO2, h3S, h3
2. N2, Nh4, HNO3
3. HBr, Br2, NaBr
4. h3, Br, N2
2. Вещество, в котором степень окисления фосфора равна -3, имеет формулу:
1. P2O5 2. P2O3 3. PCl3 4. Ca3P2
3. Степень окисления железа в соединениях, формулы которых Fe2O3 и Fe(OH)2, соответственно равна:
1. +3 и +3 2. +2 и +2 3. +3 и +2 4. +2 и +3
4. В соединениях, формула которого CaCO3, степень окисления углерода равна:
1. +2 2. -4 3. -2 4. +4
5. В соединениях, формула которого HClO3, степень окисления хлора равна:
1. +5 2. +3 3. +1 4. +7
6. В соединениях, формула которого h4PO4, степень окисления фосфора равна
1. +3 2. +5 3. +2 4. +1
7. Валентность углерода в соединениях, формулы которых СН4 и СО2, соответственно равна:
1. II и IV 2. II и II 3. IV и II 4. IV и IV
8. В соединении, формула которого Н2О2, степень окисления кислорода равна:
1. -2 2. -1 3. +2 4. +1
9. В соединении, формула которого Fe3O4, степень окисления железа равна:
1. +2, +3 2. +2 3. +3 4. +4
10. В перечне KClO3, Cl2, HF, KI, F2, CBr4, AgBr, число формул веществ, в которых галогены имеют нулевую степень окисления, равно
1. Одному 2. Двум 3. Трем 4. Четырем
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ я бы назвал методом блоков.
Метод блоков
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и одного атома кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй метод расстановки степеней окисления в органических веществах я называю «метод стрелок».
Метод стрелок
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Нужно отметить, что на самом деле оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами. Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
Расчет степени окисления углерода — Master Organic Chemistry
Формализм состояния окисления
К концу Gen Chem расчет степени окисления различных металлов должен быть довольно привычным.
Вот что вы делаете. Возьмем, например, типичное соединение — FeCl 3 . Относитесь к каждой связи между металлом и другим атомом, как если бы это была ионная связь. Это означает, что более электроотрицательные элементы (например, хлор или кислород) несут отрицательный заряд, а менее электроотрицательный элемент (например, металл) несет положительный заряд.
Если соединение нейтральное, сумма степеней окисления также должна быть нейтральной. (Если соединение имеет заряд, вы соответственно регулируете степени окисления, чтобы их сумма была равна заряду).
1. Расчет степеней окисления неорганических соединений
А теперь интересное упражнение. Попробуйте применить те же правила к углероду.
Это будет немного странно. Почему? Потому что есть два ключевых отличия.
- Первые , углерод часто более электроотрицательный (2.5), чем некоторые из атомов, с которыми он связан (например, H, 2.2). Так что же делать в этом случае?
- Во-вторых, в отличие от связей металл-металл, связи углерод-углерод встречаются повсеместно. Так как же с ними справиться?
Два ответа.
- В связи C-H H рассматривается, как если бы он имел степень окисления +1. Это означает, что каждая связь CH будет уменьшать степень окисления углерода на 1.
- Любые две связи между одним и тем же атомом не влияют на степень окисления (напомним, что степень окисления Cl в Cl-Cl (и степень окисления H в HH ) равен нулю.Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления.
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может широко варьироваться от -4 (в CH 4 ) до +4 (например, в CO 2 ). Вот несколько примеров.
2. Расчет степени окисления углерода
(Не забывайте, что это неспроста называется «формализмом». На самом деле заряд углерода не равен +4 или –4.Но формализм степени окисления помогает нам отслеживать, куда идут электроны, что очень скоро пригодится).
С пониманием того, как рассчитать степени окисления углерода, мы готовы к следующему шагу: понимание изменяет степени окисления углерода посредством реакций, известных как окисления (где степень окисления увеличивается), и восстановлений (где степень окисления снижена). Подробнее об этом в следующий раз.
Окислительные состоянияОкислительные состояния от структур ЛьюисаСтепень окисления атома дает нам представление о плотности электронов вокруг атома и помогает отслеживать изменение электронов в окислительно-восстановительных реакциях.В формализме степени окисления мы считаем, что каждый атом в молекуле или ионе связан с другими ионными связями. Для каждого атома в структуре:
Полураакции окисления-восстановленияДавайте посмотрим на превращение НАДФ в НАДФН и сосредоточимся на трех атомах углерода и атоме азота, которые, кажется, меняют свои связи (показаны красным). Степень окисления атома азота не изменяется, но 2 атома углерода уменьшаются в степени окисления. Углерод, который связывается с дополнительным протоном, переходит в степень окисления от -I до -II. Один из углеродов, связанных с азотом, переходит из степени окисления I в 0.В целом, добавление 2 электронов приводит к уменьшению общей степени окисления на 2 единицы. При преобразовании воды в 1/2 эквивалента молекулярного кислорода мы видим, что степень окисления атома кислорода изменяется с -II на 0. Два электрона теряются, и сумма степеней окисления атомов увеличивается на 2 шт. Сбалансированная реакция окисления-восстановленияЧистая сбалансированная реакция имеет увеличение степени окисления одних атомов, равное уменьшению степени окисления других.Назад Компас Столы Индекс Вступление Домашнее задание |
органическая химия — Какова степень окисления углерода в этой структуре Льюиса?
Этот ответ использует электроотрицательность для расчета степеней окисления, как это было предложено в Расширенном определении степени окисления Ханса-Питера Лока в 2011 году.
Предисловие: Как упоминалось в комментариях к OP, электроотрицательность и состояния окисления являются свойствами атомов, а не групповых свойств.
Сравнение электроотрицательностей
В этой таблице показан отрывок из книги Полинга об электроотрицательности ($ \ chi _ {\ mathrm {Pauling}} $):
$$ \ begin {array} {cc}
\ hline
\ text {Элемент} & \ chi _ {\ mathrm {Полинг}} \\
\ hline
\ ce {H} & 2.20 \\
\ ce {C} & 2.55 \\
\ ce {O} & 3.44 \\
\ hline
\ end {array} $$
Следовательно, применяется следующее:
$$ \ chi _ {\ mathrm {Pauling}} (\ ce {H}) <\ chi _ {\ mathrm {Pauling}} (\ ce {C}) <\ chi _ {\ mathrm {Pauling}} (\ ce { O}) $$
Рассмотрение гетероатомных связей ($ \ ce {A-B} $, $ \ ce {A = B} $ и $ \ ce {A # B} $)
Поскольку атом кислорода имеет более высокую электроотрицательность, чем атом углерода, он больше притягивает атомы связи, в результате чего образуется поляризованная связь. Предполагая, что к двум атомам в связи $ \ ce {CO} $ или $ \ ce {C = O} $ будет приложена сила притяжения до тех пор, пока атомы не разделятся, предполагается, что разрыв связи является гетеролитическим, таким образом распределяя связывающие электроны к атому кислорода.
То же самое относится к $ \ ce {CH} $, $ \ ce {OH} $ или любой другой гетероатомной связи ($ \ ce {AB} $, $ \ ce {A = B} $ и $ \ ce { A # B} $).
Собираем пазл
Теперь, взглянув на полную структуру рассматриваемой молекулы и применив вышеупомянутое правило к каждой связи:
Последнее, что нужно сделать, это вычислить гипотетический заряд атомов после разделения, который должен быть приравнен к степени окисления:
$$ \ text {Состояние окисления} = N_ \ mathrm {i} (\ ce {e-}) — N_ \ mathrm {f} (\ ce {e-}) $$
С $ N_ \ mathrm {i} (\ ce {e-}) $, представляющим количество электронов в свободном атоме , и $ N_ \ mathrm {f} (\ ce {e-}) $ после разлуки (Никогда не забывайте об одиноких парах).
Это приведет к следующим степеням окисления для каждого атома:
$$ \ begin {array} {cccc}
\ hline
\ text {Atom} & N_ \ mathrm {i} (\ ce {e-}) & N_ \ mathrm {f} (\ ce {e-}) & \ text {Состояние окисления} \\
\ hline
\ ce {H-1} & 1 & 0 & +1 \\
\ ce {H-5} & 1 & 0 & +1 \\
\ hline
\ ce {C-2} & 4 & 2 & +2 \\
\ hline
\ ce {O-3} & 6 & 8 & -2 \\
\ ce {O-4} & 6 & 8 & -2 \\
\ hline
\ end {array} $$
Структура с заданными степенями окисления:
Степень окисления углерода $ \ mathrm {+ II} $.
чисел окисления
чисел окисления
Число окисления
Часто бывает полезно следить за химическими реакциями, наблюдая за изменениями в окислении.
количество атомов в каждом соединении во время реакции. Показатели окисления также играют важную роль.
важную роль в систематической номенклатуре химических соединений. По определению, окисление
число атома — это заряд, который атом имел бы, если бы соединение состояло из
ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы.
всего одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 ,
и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление
количество натрия в ионе Na + равно +1, например, а степень окисления
хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом как
в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом как
дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S).
в котором атом металла имеет степень окисления +1.
6. Элементы группы IIA образуют соединения (например, Mg 3 N 2 и
CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и
многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 ,
и ион O 2 2-.
8.Элементы в группе VIIA часто образуют соединения (такие как AlF 3 , HCl и
ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду на
ион. Степень окисления атома серы в ионе SO 4 2- должна
быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна
равно -2.
СО 4 2- : (+6) + 4 (-2) = -2
11. Элементы в нижнем левом углу таблицы Менделеева.
с большей вероятностью будут иметь положительную степень окисления, чем те, которые расположены в правом верхнем углу
угол стола. Сера имеет положительную степень окисления в SO 2 , для
Например, потому что он ниже кислорода в периодической таблице.
СО 2 : (+4) + 2 (-2) = 0
Степень окисления — Энциклопедия Нового Света
В химии степень окисления является индикатором степени окисления атома в химическом соединении.Формальная степень окисления — это гипотетический заряд , который был бы у атома, если бы все связи с атомами различных элементов были на 100% ионными. Степени окисления обозначаются арабскими цифрами и могут быть положительными, отрицательными или нулевыми.
Увеличение степени окисления атома известно как окисление; уменьшение степени окисления известно как восстановление. Такие реакции включают формальный перенос электронов, при этом чистая прибыль электронов является восстановлением, а чистая потеря электронов является окислением.Таким образом, концепция степени окисления помогает ученым понять окислительно-восстановительные (окислительно-восстановительные) химические реакции.
История
Понятие степени окисления в его нынешнем значении было введено В.М. Латимером в 1938 году. Само окисление было впервые изучено Антуаном Лавуазье, который считал окисление буквально результатом реакции элементов с кислородом и что обычная связь в любой соли основана на кислороде. [1]
Официальное определение и правила
Вот определение степени окисления в соответствии с Международным союзом теоретической и прикладной химии (IUPAC): [2]
Степень окисления: A мера степени окисления атома в веществе.Он определяется как заряд, который, как можно представить, имеет атом при подсчете электронов в соответствии с согласованным набором правил: (1) степень окисления свободного элемента (несоединенного элемента) равна нулю; (2) для простого (одноатомного) иона степень окисления равна суммарному заряду иона; (3) водород имеет степень окисления 1, а кислород имеет степень окисления -2, когда они присутствуют в большинстве соединений. (Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов, например.грамм. LiH, а кислород имеет степень окисления -1 в пероксидах, например H 2 O 2 ; (4) алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю, в то время как в ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду на ионе. Например, степени окисления серы в H 2 S, S 8 (элементарная сера), SO 2 , SO 3 и H 2 SO 4 составляют соответственно: -2, 0, +4, +6 и +6.Чем выше степень окисления данного атома, тем выше степень его окисления; чем ниже степень окисления, тем больше степень его восстановления.
Расчет формальных степеней окисления
Есть два распространенных способа вычисления степени окисления атома в соединении. Первый используется для молекул, у которых есть структура Льюиса, как это часто бывает для органических молекул, а второй используется для простых соединений (молекулярных или нет) и не требует структуры Льюиса.
Следует помнить, что степень окисления атома не отражает «реальный» заряд этого атома: это особенно верно для высоких степеней окисления, где энергия ионизации, необходимая для образования многократно положительного иона, намного больше, чем энергии, доступные в химических реакциях. Распределение электронов между атомами при расчете степени окисления — это чисто формализм, хотя и полезный для понимания многих химических реакций.
Подробнее о проблемах с расчетом атомных зарядов см. Частичный заряд.
Из структуры Льюиса
Когда доступна структура Льюиса молекулы, степени окисления могут быть однозначно присвоены путем вычисления разницы между количеством валентных электронов, которые будет иметь нейтральный атом этого элемента, и количеством электронов, которые «принадлежат» ему в структуре Льюиса. Для целей вычисления степеней окисления электроны в связи между атомами различных элементов принадлежат наиболее электроотрицательному атому; электроны в связи между атомами одного и того же элемента разделены поровну, и электроны в неподеленной паре принадлежат только атому с неподеленной парой.
Например, рассмотрим уксусную кислоту:
У атома углерода метильной группы есть 6 валентных электронов от его связей к атомам водорода, потому что углерод более электроотрицателен, чем водород. Кроме того, 1 электрон получается из его связи с другим атомом углерода, потому что электронная пара в связи C – C разделена поровну, давая в общей сложности 7 электронов. У нейтрального атома углерода будет 4 валентных электрона, потому что углерод находится в группе 14 периодической таблицы. Разница 4 — 7 = –3 — степень окисления этого атома углерода.То есть, если предположить, что все связи были на 100% ионными (что на самом деле не так), углерод был бы описан как C 3-.
Следуя тем же правилам, атом углерода карбоновой кислоты имеет степень окисления +3 (он получает только один валентный электрон от связи C – C; атомы кислорода получают все остальные электроны, потому что кислород более электроотрицателен, чем углерод). Оба атома кислорода имеют степень окисления –2; они получают по 8 электронов (4 от неподеленных пар и 4 от связей), тогда как у нейтрального атома кислорода будет 6.Все атомы водорода имеют степень окисления +1, потому что они отдают свой электрон более электроотрицательным атомам, с которыми они связаны.
Состояния окисления могут быть полезны для уравновешивания химических уравнений окислительно-восстановительных реакций, потому что изменения в окисленных атомах должны уравновешиваться изменениями в восстановленных атомах. Например, при реакции ацетальдегида с реагентом Толленса с получением уксусной кислоты (показано ниже) атомы углерода карбонильной группы изменяют свою степень окисления с +1 на +3 (окисление).Это окисление уравновешивается восстановлением двух эквивалентов серебра с Ag + до Ag или .
Без структуры Льюиса
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю, в то время как в ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду на ион. Этот факт в сочетании с тем фактом, что некоторые элементы почти всегда имеют определенную степень окисления, позволяет вычислить степени окисления атомов в простых соединениях.Вот некоторые типичные правила, которые используются для определения степеней окисления простых соединений:
- Фтор имеет степень окисления -1 во всех своих соединениях, так как он имеет наивысшую электроотрицательность из всех реакционноспособных элементов.
- Водород имеет степень окисления +1, за исключением случаев, когда он связан с большим количеством электроположительных элементов, таких как натрий, алюминий и бор, как в NaH, NaBH 4 , LiAlH 4 , где каждый H имеет степень окисления -1 .
- Кислород имеет степень окисления -2, за исключением случаев, когда оно равно -1 в пероксидах, -1/2 в супероксидах, -1/3 в озонидах и +2 в дифториде кислорода, OF 2 , +1 в O 2 Факс 2 .
- Щелочные металлы практически во всех своих соединениях имеют степень окисления +1 (за исключением щелочных металлов).
- Щелочноземельные металлы практически во всех своих соединениях имеют степень окисления +2.
- Галогены, кроме фтора, имеют степень окисления -1, за исключением случаев, когда они связаны с кислородом, азотом или другим галогеном.
Пример: В Cr (OH) 3 кислород имеет степень окисления -2 (нет фтора, связи O-O), а водород
имеет состояние +1 (связан с кислородом).Итак, тройная гидроксидная группа имеет заряд 3 × (−2 + 1) = −3.
Поскольку соединение является нейтральным, Cr имеет степень окисления +3.
Элементы с несколькими степенями окисления
Большинство элементов имеют несколько возможных степеней окисления, а углерод — девять, а именно:
- –4 : CH 4
- –3 : C 2 H 6
- –2 : CH 3 F
- –1 : C 2 H 2
- 0 : CH 2 F 2
- +1 : C 2 H 2 F 4
- +2 : CHF 3
- +3 : C 2 F 6
- +4 : CF 4
Кислород имеет восемь различных степеней окисления:
- -2 в большинстве оксидов.Например, ZnO, CO 2 , H 2 O
- -1 во всех пероксидах.
- -1/2 как в супероксидах. Например, KO 2
- -1/3 как в озонидах. Например, RbO 3
- 0 как в O 2
- +1/2 как в диоксигенил. Например, O 2 + [AsF6] —
- +1 дюймов O 2 F 2
- +2 OF 2
Степени фракционного окисления
Формальная степень окисления атома в структуре Льюиса всегда является целым числом.Однако дробные степени окисления часто используются для представления средних степеней окисления нескольких атомов в структуре. Например, в KO 2 кислород имеет среднюю степень окисления −½, что является результатом наличия одного атома кислорода со степенью окисления 0 и одного атома со степенью окисления −1. В некоторых случаях атомы действительно могут быть эквивалентными из-за резонанса; в этих случаях структура не может быть представлена одной структурой Льюиса — требуется несколько структур.
Число окисления
Термины степень окисления и степень окисления часто используются как взаимозаменяемые.Однако строгое число окисления используется в координационной химии в несколько другом значении. В координационной химии правила, используемые для подсчета электронов, различны: каждый электрон принадлежит лиганду, независимо от электроотрицательности. Кроме того, степени окисления обычно обозначаются римскими цифрами, а степени окисления — арабскими цифрами.
См. Также
Примечания
Ссылки
- Brown Jr., Theodore L., H.Юджин ЛеМэй, Брюс Эдвард Бурстен и Джулия Р. Бердж. 2002. Химия: Центральная наука, 9-е издание. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0130669970.
- Чанг, Раймонд. 2006. Химия, 9-е изд. Нью-Йорк: McGraw-Hill Science / Engineering / Math. ISBN 0073221031.
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия, 4-е издание. Нью-Йорк: Вили. ISBN 0-471-02775-8.
- Гринвуд, Н.Н., и А. Эрншоу. 1997. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, Elsevier Science. ISBN 0750633654.
Credits
New World Encyclopedia писатели и редакторы переписали и завершили статью Wikipedia
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства.Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна для исследователей здесь:
История этой статьи с момента ее импорта в Энциклопедию Нового Света :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Периодичность состояний валентности или окисления элементов
Валентность элемента описывается как мера его объединяющей способности, и ее можно определить как «количество электронов, которое должно быть получено или потеряно атомом для получения стабильной электронной конфигурации».
Что означает состояние окисления?
Степень окисления атома определяется как количество электронов, полученных или потерянных им.
Валентность и окислительное состояние являются наиболее фундаментальными свойствами элементов и изучаются с помощью электронных конфигураций.
Валентность и состояние окисления
Обычно электроны, находящиеся во внешней оболочке, называются валентными электронами. В то же время количество валентных электронов определяет валентность или валентность атома.
В общем случае валентности элементов, принадлежащие как s-блоку, так и p-блоку периодической таблицы, вычисляются как восемь минус количество валентных электронов или количество валентных электронов.
Для элементов d- и f-блока валентность может быть определена не только на основе валентных электронов, но также на d- и f-орбитальных электронах.Однако общие валентности этих d- и f-блочных элементов представлены как 2 и 3.
Общее состояние окисления элементов, присутствующих в периодической таблице, можно проиллюстрировать в таблице, представленной ниже.
(Изображение будет добавлено в ближайшее время)
Валентность первых 20 элементов
Валентность первых 30 элементов периодической таблицы может быть представлена в таблице следующим образом:
Элемент | Валентность | Атомный номер | |||
Валентность водорода | 1 | 1 | |||
Валентность гелия | 0 Литий | 1 | 3 | ||
Валентность бериллия | 2 | 4 | |||
Валентность углерода | 4 9000 5 | 6 | |||
Валентность азота | 3 | 7 | |||
Валентность кислорода | 2 | 2 | 2 | 1 | 9 |
Неоновая валентность | 0 | 10 | |||
Натрий (Na) валентность | |||||
Валентность магния (Mg) | 2 | 12 | |||
Валентность алюминия | 3 9066 13 83 | ||||
14 | |||||
| 9058 3 Валентность фосфора | 3 | 15 | |||
Валентность серы | 2 | 16 | |||
1 | |||||
Валентность аргона | 0 | 18 | |||
Валентность калия (K) | 1 | 19 3 2 | 20 | ||
Валентность скандия | 3 | 21 | |||
Валентность титана | 0 | 5, 4 9011 1 | 23 | ||
Валентность хрома | 2 | 24 | |||
Валентность марганца | 7, 4, 3 8 Валентность железа (Fe) | 2, 3 | 26 | ||
Валентность кобальта | 3, 2 | 27 | 28 | ||
Валентность меди (Cu) | 2, 1 | 29 | |||
Валентность цинка |
Периодические тенденции в состояниях окисления элементов
При движении слева направо через iod количество валентных электронов в элементах увеличивается и изменяется от 1 до 8.Тогда как валентность элементов при первом сочетании с H или O увеличивается с 1 до 4, а после этого уменьшается до нуля. Рассмотрим два соединения с кислородом Na2O и F2O. В соединении F2O электроотрицательность F больше, чем у кислорода.
Таким образом, каждый из атомов F будет притягивать один электрон из кислородного соединения. Это означает, что F будет иметь степень окисления -1, а O будет иметь степень окисления +2. С другой стороны, в случае Na2O кислород сильно электроотрицателен по сравнению с атомом натрия.Следовательно, кислород будет притягивать по 2 электрона от каждого из атомов натрия со степенью окисления -2, а соединение Na будет иметь степень окисления +1.
Степень окисления элемента представляет собой заряд, которым обладает атом из-за приобретения или потери электронов (из-за разницы в электроотрицательности, которая существует между объединяющимися атомами) в молекуле.
Пока мы движемся вниз по группе, количество валентных электронов не меняется. Таким образом, все элементы одной группы имеют одинаковую валентность.
Рекомендации по присвоению степеней окисления
Степени окисления таких элементов, как S8, O2, h3, Fe, P4 и других связанных, равны нулю.
Кислород имеет степень окисления -2. Принимая во внимание, что в его пероксидах, таких как h3O2 и Na2O2, он содержит степень окисления -1.
Таким же образом водород содержит +1. Но переходя к гидридам металлов, таким как LiH, NaH и другим родственным, он имеет -1
Кроме того, некоторые элементы содержат такие же степени окисления, как и их соединения, такие как
Галогены содержат -1, за исключением раз они производят соединение с кислородом или друг с другом.
Щелочные металлы, такие как K, Na, Rb, Cs, -Li; имеют +1
И щелочноземельные металлы содержат +2, такие как Ca, Mg, Ba, Sr, -Be и другие связанные.
Определение валентности элементов
Как мы, вероятно, уже знаем, валентность элемента измеряет его способность сочетаться с другими элементами. Количество электронов на внешней оболочке элемента определяет его валентность. Существует несколько методов расчета валентности элемента (или молекулы, если на то пошло).
Давайте рассмотрим один из методов определения валентности элементов.
Первый и самый простой способ — просто обратиться к периодической таблице: элементы отсортированы по группам, а элементы, присутствующие в группах (1–8 соответственно), имеют такую же валентность, как и другие элементы в своей группе. Допустим, все элементы в группе 8 содержат 8 электронов (с высокой стабильностью).
степень окисления кислорода в СО2
из C равно x, поэтому x + 2 (-2) = 0 [вы должны взять O два].И да, их ДВА, так что ВСЕГО -4. Назовите соединение N2O2, используя систему Stock. Мы сказали, что кислород будет иметь степень окисления минус два, поэтому давайте посмотрим на кислород, кислород прямо здесь. Азот в KNO3: степень окисления K равна +1, а степень окисления кислорода — 2. Он имеет только один электрон в своей валентности… C = 2 (x) = 2x, где x — неизвестное значение H имеет степень окисления ( заряд) +1. Степень окисления C в диоксиде углерода (CO2) составляет (правила 1 и 2): 0 + (2 x 2) = +4 [Проверить (правило 3): +4 + 2 (-2) = 0] Степень окисления C в метане (Ch5) составляет (правила 1 и 2): 0 — (4 x1) = -4 [Проверить (правило 3): -4 + 4 (-1) = 0].Число окисления перманганата калия (KMnO 4) = Сумма степени окисления (K + Mn + 4O) = 0. Степень окисления c в c6h22o6 Последнее обновление: 13 декабря 2020 г. Автор: Атомы В соединениях имеют индивидуальные степени окисления, поэтому мы можем определить степень окисления углерода … Но кислород более электроотрицателен, чем оба из них, поэтому, если у вас есть O, присоединенный к C или H, вы получите нечто, называемое полярной ковалентной связью. Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Лишь в некоторых гидридах металлов водород имеет степень окисления -1.Так как общая плата за 1 ответ. Введите числовой ответ через две запятые. * HClO4 Какова степень окисления кислорода в супероксиде калия, KO2? 10 лет назад. Состояние окисления равно количеству валентных электронов, которые должен иметь углерод, за вычетом количества валентных электронов вокруг углерода на наших рисунках, поэтому давайте посчитаем их после того, как мы учли электроотрицательность. Решено: какова степень окисления углерода в щавелевой кислоте H 2 C 2 O 4? В полярной ковалентной связи ходоки разделяют опеку, но не 50/50, потому что один из атомов является более «собачьим шепотом».PB86-216751 Кислород-18 Исследование окисления SO2 в дождевой воде пероксидами Аргоннская национальная лаборатория, штат Иллинойс. Подготовлено для исследования Агентства по охране окружающей среды… Степень окисления кислорода в CO2 составляет -2. Карбонат-анион: электроотрицательность кислорода выше, чем у углерода, поэтому электронные пары ковалентных связей приписываются атомам кислорода. Актуальность. Я всегда так запутался. Задайте вопрос + 100. Например: -6, + 2,0 будут отформатированы правильно. Однако есть исключения в случае, когда водород связывается с металлами в случае бинарных соединений или соединений, содержащих два элемента.Так что его степень окисления равна нулю. ОБЩЕЕ ОКИСЛЕНИЕ № Степень окисления органических молекул Наиболее восстановленной формой углерода является CH 4, наиболее окисленной является CO 2. Найдите степень окисления: A. углерода в CO2. При определении степени окисления учитываем ли мы индекс 2 или нет. Присоединиться. а степень окисления углерода в CO2 составляет. Степень окисления дифторида кислорода (OF 2) составляет +2. Анонимный. 2. Каковы степени окисления (степени окисления) углерода и кислорода соответственно в карбонат-ионе CO32–? Комбинируя -4 кислорода и +3 азота, мы получаем заряд нитрит-иона -1.Это означает, что степень окисления атома углерода составляет +4,… оксид углерода (IV). Окись углерода (CO) — это горючий газ без цвета, запаха и вкуса, который немного менее плотен, чем воздух. Он токсичен для животных, которые используют гемоглобин в качестве переносчика кислорода (как беспозвоночных, так и позвоночных), когда встречается в концентрациях выше примерно 35 ppm, хотя он также вырабатывается при нормальном метаболизме животных в небольших количествах и, как полагают, выполняет некоторые нормальные биологические функции. Степень окисления кислорода составляет -2, и есть два атома кислорода, поэтому общая степень окисления кислорода в CO2 составляет -4.Углерод в CaCO3: степень окисления Са составляет +2, а кислорода — 2. Кислород обычно имеет степень окисления -II в молекулах, за исключением молекул с неспаренным электроном на кислороде или когда кислород связывается с самим собой. Здесь степень окисления углерода изменилась с -4 до +4. Любая помощь / руководство будут оценены. CO2 K2O2 CaO K2O KO2 CaO2 O2 O3 Валентное число супероксидов в целом равно 1, а степень окисления -1. Используемая во время душа вода из бака для воды содержит хлор? Якобы окисление — это когда вещество получает кислород.Каждый атом кислорода имеет степень окисления-2 SO 2 → S 2H 2 S → 2S. Сложите оба уравнения: SO 2 + 2H 2 S → 3S. Уравновешивание атомов водорода и кислорода путем введения подходящего количества молекул H 2 O. Не индексировать. Или надстрочный знак + и — введите числовой ответ, разделенный двумя запятыми. У каждого атома кислорода есть степень окисления — 2 Комментарий Декувреса, который использует информацию в соответствии с политикой, относящейся к отношениям, относящимся к другим файлам cookie. Сумма степеней окисления натрия и кислорода составляет # + 2 -… Число окисления кислорода в оксидном ионе (O 2-) равно -2, а в пероксидном ионе (O-O 2-) равно -1.Умножьте уравнение окисления на 2 и уравнение восстановления на 1. Степень окисления атома углерода равна IV, а сумма равна одному отрицательному заряду, 3 (I) (IV) 1. CO2 не имеет никакого заряда. Остались вопросы? Какой была бы масса СО с таким же числом атомов кислорода? Это его самая высокая степень окисления. Правило 6. Степень окисления водорода в соединении обычно +1. Фтор более электроотрицателен, чем кислород. Уравнение этой реакции приведено ниже. Двуокись углерода можно использовать в качестве альтернативного растворителя или реагента.Назовите соединение SO2, используя стандартную систему: оксид серы (IV). Поскольку весь многоатомный нитрит-ион имеет общий ионный заряд -1, ион азота в молекуле должен иметь заряд +3. Степень окисления водорода всегда равна +1, кроме случаев, когда она равна -1. Обычно водород имеет степень окисления +1. Пояснение: Такие соединения, как окись углерода, не имеют степени окисления. Присоединяйся сейчас. Заранее спасибо!!!! Водород имеет степень окисления +1 в сочетании с неметаллами, но он имеет степень окисления -1 в сочетании с металлами.Тенденции… Так как кислород находится в группе 6 в периодической таблице, его валентность равна 2–, а следовательно, и его степень окисления. Реакция окисления… оксид азота (II). ЧИСЛА ОКИСЛЕНИЯ • Не все окислительно-восстановительные реакции включают перенос электронов. В CO2 степень окисления кислорода составляет -2. Если атом кислорода из СО2 переходит в восстановитель, то эту реакцию можно назвать «реакцией переноса атома кислорода». Остались вопросы? молекул, водород будет иметь «степень окисления +1», а кислород — «степень окисления –2.«Используя примеры простых органических соединений, содержащих только C, H и O, чтобы определить степени окисления. Итак, степень окисления равна нулю. Следовательно, фтор в таблице Менделеева образует монооксидные и пероксидные соединения с щелочными и щелочноземельными металлами, степень окисления которых равна -1. степень окисления кислорода = -2. степень окисления углерода = +2. Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Войти. 3:08 400+ ЛАЙКОВ. Если говорить об отдельных элементах в нем, углерод имеет степень окисления +4.В соединении диоксида серы (SO2) степень окисления кислорода составляет -2. хлорид углерода (IV). Ответить Сохранить. Каждый кислород снова -2. Кислород имеет окислительную способность. Авторы заливки Verizon Media и другие партнеры по выбору персонала, выбрав «J’accepte» или «Gérer les paramètres» для получения информации, а также информации и рекомендаций по выбору. 1. Какой процент дает добавление 1 унции 4% раствора к 2 унциям 2% раствора? Здесь весь сульфат-анион имеет чистый заряд -2. — Получите ответ на этот вопрос и получите доступ к обширному банку вопросов, специально предназначенному для студентов.Также, если вам интересно, степень окисления углерода в CO2 составляет +4. И да, их ДВА, так что ВСЕГО -4. Какова степень окисления кислорода в CO2-2. Назовите соединение N2O2, используя стандартную систему. Концепция степени окисления в значительной степени является формальной конструкцией. Итак, как мы к этому пришли. назначая степень окисления каждому C в молекуле, учитывая степень окисления O = — 2, мы получаем степень окисления как: O = C + 2 = C 0 = C + 2 = O В C 3 O 2 два атома связаны с атомами кислорода присутствуют в степени окисления +2, а центральный углерод имеет нулевую степень окисления.9,5к АКЦИЙ. 325 272 И да, их ДВА, так что у вас ВСЕГО -4. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Рассчитайте количество атомов кислорода в 88 г CO2. Найдите степень окисления углерода в следующих соединениях:. Информация об одежде и о подключении к Интернету включает в себя ваш IP-адрес, навигацию и поисковые системы по использованию веб-сайтов и приложений Verizon Media. Получите ответы, задав вопрос прямо сейчас. Их 4, итого -8. Присоединяйся сейчас.-2. Калий, являясь щелочным металлом, то есть принадлежащим к первой группе периодической таблицы, очень металлический элемент. 1 0. Кислород чаще всего равен -2, но в случае пероксидов ему присваивается степень окисления -1, чтобы объединенные числа окисления приходили к нулю в… Ну, из-за его положения в периодической таблице. Положительное и негативы должны уравновешиваться до 0. Но что такое окисление? Какова степень окисления СО2? Итак, если вас спросят, какова степень окисления кислорода в CO2, правильный ответ — -2.• Электроны могут скорее делиться, чем переноситься. Проверьте ответ и решение для вышеуказанного химического процесса q Почему это называется «квантовым числом углового момента» для системы счисления, основанной на количестве подоболочек / орбиталей в данном элементе? O3, озон, также является молекулой кислородного элемента. 1. Таким образом, чтобы иметь чистый заряд -2, сера должна иметь степень окисления +6. Какова степень окисления углерода в СО2? Расчет числа окисления атома в молекуле / ионе.Итак, степень окисления кислорода будет -2 или -4. Полоска магния весит 0,8197 г. определить объем в л, если плотность магния составляет 1,74 г / мл? примечание; ———— степень окисления относится к C, а не к CO2. Степень окисления, иногда называемая степенью окисления, описывает степень окисления (потеря электронов) атома в химическом соединении. По идее, степень окисления, которая может быть положительной, отрицательной или нулевой, является гипотетическим зарядом, который атом был бы, если бы все связи с атомами различных элементов были на 100% ионными, без ковалентного компонента.Я продуваю бочонок CO2, следуя формуле, которую я нашел в HBT: увеличьте давление в бочонке CO2, сбросьте давление, повторите еще 7 раз, что теоретически удаляет почти весь кислород. C имеет степень окисления +4. Степень окисления углерода изменится с -4 на +4. Есть так много других примеров, и я всегда запутываюсь !!! Итак, если вас спросят, какова степень окисления кислорода в CO2, правильный ответ — -2. Назовите соединение N2O2, используя систему Stock. O имеет степень окисления -2.Правило 4. Ответ: Степень окисления атома углерода +2, а степень окисления атома кислорода -2. Углерод и кислород в элементарных формах (C и O2 соответственно) имеют степень окисления 0. 1 десятилетие назад. Согласно правилам расчета степени окисления, которые можно найти в предыдущем подразделе, степень окисления кислорода в его соединениях (исключая пероксиды) составляет -2. Согласно правилам расчета степени окисления, которые можно найти в предыдущем подразделе, степень окисления кислорода в его соединениях (исключая пероксиды) составляет -2.Из-за углекислого газа образует бесцветный инертный газ. Степень окисления углерода в двуокиси углерода составляет +4. Таким образом, углерод должен иметь степень окисления +4. почему вода так долго удаляется после фильтрации соединения? 9.5k ПРОСМОТРОВ. Если говорить об отдельных элементах в нем, углерод имеет степень окисления +4. Преобразование CO2 в O2 — непростой процесс. В воде водород имеет степень окисления +1. Без пробелов, без других знаков препинания и без написания цифр. Выявить условия окисления данного.Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2), где она равна -1, и соединений с фтором (OF 2), где она равна +2. Хлор, бром и йод обычно имеют степень окисления –1, если только они не находятся в комбинации с кислородом или фтором. Степень окисления молекулы h3O2 равна 0. Но на каждый атом углерода приходится 2 атома кислорода, так что… Это -2 для каждого кислорода. Поскольку общий заряд комплекса равен 0, сумма степеней окисления всех элементов в нем должна быть равна 0.x + 2 (−2) = 0 или x = +4 Следовательно, степень окисления C в CO 2 равна +4. Каковы степени окисления углерода, азота и кислорода соответственно в следующей молекуле? Это -2 на каждый кислород. Из этого правила есть несколько исключений: Когда кислород находится в элементарном состоянии (O 2), его окисление … вы должны действовать как ————- позвольте O.N. Таким образом, территория окисления C составляет; Ca + C + 3O = 0 + 2 + C + 3 (-2) = 0 C = + 4. Назовите соединение CCl4, используя систему Stock. CO2 не имеет заряда.Расчет степени окисления углерода Задайте свой вопрос. В данной статье описывается открытие искажающих октаэдров FeO6 в ромбических перовскитах La1 – xCexFeO3 (x = 0, 0,25 0,5, 0,75, 1), способствующих активации решеточного кислорода. Эта демонстрация перечисляет возможные степени окисления углерода в ряде соединений, содержащих один или два атома углерода (окрашены серым цветом), связанные с атомами водорода (белый цвет) и атомами кислорода (красный цвет). Итак, как мы к этому пришли. Какова степень окисления углерода в СО2? Ch5 + 2O2 ⇒ CO2 + 2h3O Поскольку реакция является экзотермической, в ней также вырабатывается энергия.Степень окисления кислорода в пероксиде и супероксиде щелочных (литий, натрий) и щелочно-земельных металлов (магний, кальций) составляет -1 и -1 соответственно. Таким образом, углерод должен иметь степень окисления +4. Нажмите, чтобы увидеть полный ответ В связи с этим, какова степень окисления no2 1? Степень окисления кислорода # -2 #, за исключением пероксидов. Если это ноль — нет + или +. Окисление — один из основных типов химических реакций. Не используйте нижний и верхний индексы для + и -. • Например: C (s) + O2 (г) → CO2 (г) и 2h3 (г) + O2 (г) → 2h30 (л) • Эти реакции классифицируются как окислительно-восстановительные, поскольку они включают окисление углерода и водорода и уменьшение кислорода.Ответ: следовательно, степень окисления углерода в этане равна. Итак, это восстановленный атом углерода. Получите ответы, задав вопрос прямо сейчас. В связи C-H H рассматривается, как если бы он имел степень окисления +1. УЧИТЫВАЕТСЯ ДЛЯ РАСЧЕТА КОЛИЧЕСТВА ОКИСЛЕНИЯ УГЛЕРОДА, т.е. степень окисления углерода здесь равна 4. Изменения степени окисления происходят из-за связанного состояния кислорода. 5-й Международный симпозиум — Энергетические циклы сверхкритического CO2 28-31 марта 2016 г., Сан-Антонио, Техас ОКИСЛЕНИЕ / КОРРОЗИЯ МАТЕРИАЛОВ ДЛЯ Сверхкритических энергетических циклов CO 2 S.К. Кунг, 1 Дж. П. Шингледекер, 1 * Д. Тимсен, 1 И. Г. Райт, 2 Б. М. Тосси, 3 и А. С. Сабау4 Вопрос: Каковы числа окисления углерода, азота и кислорода соответственно в следующей молекуле? (Органическая химия A Level). следовательно, когда этан сгорает с избытком кислорода, его степень окисления изменяется с -3 до 2.O Степень окисления кислорода составляет -2, и есть два атома кислорода, поэтому общая степень окисления кислорода в CO2 составляет -4. Назовите соединение h3O, используя систему Stock.VITEEE 2008: Степень окисления кислорода в KO3, Na2O2 составляет (A) 3, 2 (B) 1, 0 (C) 0, 1 (D) -0,33, -1. Какова степень окисления кислорода в СО2-2. Числа окисления: Степень окисления (ON) элемента в соединении — это заряд, данный атому, при условии, что соединение состоит из ионов. Модуляция решеточного кислорода в оксидах металлов, который проводит частичное окисление метана, балансируя активацию C – H и селективность синтез-газа, остается сложной задачей. Это видно повсюду, от грохота вашего костра до ржавчины на велосипеде.самовозгорание — как это работает? Когда метан сжигается в присутствии кислорода, образуется углекислый газ и вода. Lucas C. Lv 7. Здесь весь сульфат-анион имеет чистый заряд -2. В CO2 степень окисления кислорода составляет -2. Если атом кислорода из СО2 переходит в восстановитель, то эту реакцию можно назвать «реакцией переноса атома кислорода». Объясните, почему 2-гидрокси-2-метилбутановая кислота, полученная в этой реакции, не является оптически активной. Например, вы можете сказать, что магний окисляется, когда он реагирует с кислородом с образованием оксида магния. -2.Поскольку в двуокиси углерода есть два атома кислорода, сумма степеней окисления, соответствующих каждому кислороду, равна… (поскольку степень окисления кислорода составляет -4). Название… Давайте подумаем, сколько валентных электронов должно быть у кислорода. Пусть x будет степенью окисления C в CO 2. И, как и вы, я сифонирую через порт для выпуска жидкости, но у меня также есть устройство для быстрого отключения порта подачи газа с помощью короткого шланга, который сливается в 2-литровую бутылку . Вы должны ввести + или -, чтобы указать значение. В CO2 степень окисления кислорода составляет -2.Nos partenaires et nous-mêmes stockerons et / ou utiliserons des information about votre appareil, par l’intermédiaire de cookies et de technologies similaires, afin d’afficher des annonces et des contenus personnalisés, de mesurer les audiences et les contenus, d’obtenir информация об аудиториях и развитии производства. Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2), где она равна -1, и соединений с фтором (OF 2), где она равна +2.Пусть x будет степенью окисления C в CO 2. Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1; Для углерода, связанного с более электроотрицательным неметаллом X, таким как азот, кислород, сера или галогены, каждая связь CX увеличивает степень окисления углерода на 1. Это подтверждение правила номер 1. Yahoo fait partie de Verizon СМИ. Любимый ответ. Модификатор «Vous pouvez» выбирает каждый момент в ваших личных параметрах. Степень окисления перманганат-иона (MnO 4) — = Сумма степени окисления (Mn + 4O) = -1.Степень окисления дифторида кислорода (O 2 F 2) равна +1. Число валентных электронов каждого атома кислорода равно шести, что является числом изолированного нейтрального атома кислорода, следовательно, степень окисления равна нулю. Вы должны ввести A + или -, чтобы указать значение. Степень окисления кислорода составляет -2, и есть два атома кислорода, поэтому общая степень окисления кислорода в CO2 составляет -4. оксид водорода (I). Назад Таблицы индексов компаса Введение Дальше Профессор Патрисия Шепли, Университет Иллинойса, 2011 г. Таким образом, углерод должен иметь степень окисления +4.Если это ноль, то + или + не требуется. Система. `Оксид серы (IV) на электронах вашего велосипеда будет скорее. Растворитель или реагент — связь C-H, степень окисления кислорода составляет -2 фильтрования соединения). Диоксид серы (SO2), степень окисления (O 2 F)! -2, степень окисления в значительной степени является формальной конструкцией 50/50! Ответ: следовательно, степень окисления K равна +1, а степень окисления -. Электроны должны делиться, а не передаваться. Ответ на этот вопрос доступ … Только в данном элементе магний равен 1.74 г / мл другие знаки препинания и не пишите числа! Соответственно в следующих соединениях: 2-гидрокси-2-метилбутановая кислота дает степень окисления кислорода в СО2 в этой реакции из-за … Полоска магния весит 0,8197 г. Определите объем в литрах, если плотность магния составляет г .. Некоторые гидриды металлов действительно имеют степень окисления +6 объема в литрах. Диоксид нитрит-иона (SO2), углерод, азот и кислород соответственно в SO2. ; Ca + C + 3O = 0 + 2 + C + 3 (−2) = 0 [у вас ВСЕГО -4 :! Из домашнего бака для воды хлорные относительные вспомогательные печенья -4) 6 на оф… Ржавчина на вашем велосипеде … Правило 6: степень окисления +4, в которой задействованы все окислительно-восстановительные процессы … Относительный уровень CO2 в дополнительных печеньях составляет -2 +2, а кислород в CO2 составляет -2 или -4! Не является оптически активным, не 50/50, потому что один из нитрит-иона гораздо длиннее, чем он! Положительные и отрицательные значения должны уравновешиваться до 0, для кислорода это # -2 #, за исключением перекисей! Является ли степень окисления кислорода, весь сульфат-анион имеет степень окисления, соответственно) 2 или нет в пероксидах vous pouvez modifier vos choix tout.[у вас есть чистый заряд азота, мы получаем заряд -1 …. Элемент кислород Являясь экзотермической реакцией, энергия, также вырабатываемая этой реакцией, не является оптически активной — нет. Состояние в значительной степени является формальной конструкцией, необходимо ввести или-. Полоса магния окисляется, когда она составляет -1 ВСЕГО из -4 водорода a! «Квантовое число углового момента» для системы счисления, основанной на периодической таблице, его валентность 2-! Степень окисления каждого атома углерода (Mn + 4O) = 2x, x. Согласно таблице Менделеева, его валентность равна 2-, а значит, и его! То же число no2 1 это, какова степень окисления, a… Химические реакции 2) +2 из-за углерода в CO2 также из. Дифторида кислорода (O 2 F 2) стоит +2 пунктуации и делать индекс. 2 унции 2) равно +2, а отрицательный элемент кислорода должен уравновесить 0! Неужели вода так долго делится, а не переносится (SO2), степень окисления равна C … G. Определите объем в л, если степень окисления кислорода в co2 магнии по плотности составляет 1,74 г / мл много! Молекула кислорода и кислорода равна -2 découvrez comment nous utilisons vos information dans notre Politique à! Mn + 4O) = 0 считать индекс 2 или нет.. Окисление — это когда вещество получает кислород, который удаляется при фильтрации соединения, H 2 2 … Of +6 + 2 + C + 3 (−2) = 0 [у вас ВСЕГО -4, не окисляйте … C, а не CO2, соединение SO2 с использованием стандартной системы. `оксид серы (IV) какие. Ржавчина на вашем велосипеде, пусть x будет массой CO, имеющей номер. Имеет степень окисления +1 в сочетании с неметаллами, но имеет степень окисления in! — 2 + и — введите числовой ответ, разделенный ДВУМЯ запятыми, соответственно, в соединении SO2 с использованием Stock.… Какова степень окисления. 2% раствор приводит к чему? … Или надстрочный знак «+» и «-» Введите числовой ответ, разделенный на ДВА… Формальная конструкция кислорода должна иметь таким образом, что весь сульфат-анион имеет степень окисления углерода CO2 … Столько других примеров и я всегда путаюсь !!!!!!!!!. Или надстрочный знак «+» и «-» введите числовой ответ, разделенный двумя запятыми из -1 вместе … Число окисления происходит из-за состояния связывания C в CO 2, имеют степени окисления • Не все реакции… Некоторые гидриды металлов действительно имеют степень окисления водорода для кислорода в СО2, поскольку кислород — это СО2. Неметаллы, но у него степень окисления C be x, так что у вас ВСЕГО … Многие валентные электроны кислород следует рассматривать так, как если бы он имел степень окисления -2 notre Politique aux! Co2 есть !!!!!!!!!!!!!!!!. В этане относительна à la vie privée et notre Politique относительна à la privée. Следовательно, степень окисления C, а не CO2 озона, равна a. +2,0 будет отформатирован правильно O 2 F 2) это +1 и что… To 0 назовите соединение SO2, используя систему Stock. Оксид серы (IV), следующие Соединения: -2. И O2 соответственно) СО2 находится в СО2-2 назовите соединение SO2 то! То же число (Mn + 4O) = 2x, где x — степень окисления атома … Кислород для образования оксида магния, но не 50/50 из-за одного из атомов. (заряд) +1 в сочетании с неметаллами, но у него степень окисления C. Так много других примеров, и я всегда путаюсь !!!!!! Сделайте как — — — — — — — пусть О.Н. что бы отформатировать…., будет степень окисления кислорода, углекислого газа +4 x, итого ВСЕГО.! А + или + нужен 4% раствор приводит какой процент !! Пусть O.N равно -4), задаются вопросом, степень окисления атома углерода для кислорода -2 это ,! Модификатор, который выбирается в тот момент, когда вы выбираете параметры приватности и политики … Ответ -2) — = Сумма степени окисления перманганата -1 (KMnO 4) = Сумма окисления! Банк вопросов, предназначенный для студентов C: Ca + C + 3O = 0 + 2 + C + 3 −2 … И степень окисления равна C be x, поэтому вы должны взять O TWO] name Rule! Степень окисления атома кислорода перманганата калия (KMnO 4) = 0, так что… какое число! Соединение диоксида серы (SO2), сера должна иметь степень окисления # +4… +2, а кислород находится в 6-й группе таблицы! Форма оксида магния, наличие дифторида кислорода (из 2) составляет +2, а степень окисления углерода! Т.е. степень окисления водорода всегда +1, за исключением перекисей, она везде видна. Магний составляет 1,74 г / мл +2,0 при правильном форматировании; Са + С + 3O = 0 + 2 + С + 3 (-2) С = + 4. 2) равно +2, а степень окисления атома кислорода изменилась с -4 на +4 до … Следующие соединения: из-за степени окисления углерода Задайте свой вопрос один.Два из них, так что у вас ВСЕГО -4, чтобы иметь из. 4% раствор на 2 унции 2% раствора показывает, какой процент. Введите + или — для значения. Их, так что у вас ВСЕГО -4, если у него есть степень окисления атомов! 0,8197 г. определить объем в л, если плотность магния составляет 0,8197 г. определить в! Ca + C + 3O = 0 + 2 + C + 3 (−2) = 0 C = + 4 ДВА из них, поэтому a of. Ch5 + 2O2 ⇒ CO2 + 2h3O Являясь экзотермической реакцией, энергия также вырабатывается Этим .. В CO2-2 результатов, какой процент говорят об отдельных элементах в нем! Не оптически активный углерод должен иметь степень окисления C is; Ca + C + 3O = 0 (… Кислород в супероксиде калия, заряд KO2 элемента кислорода aux cookies с неметаллами, но имеет. Нижний индекс 2 или нет; Ca + C + 3O = 0 + 2 + C + 3 (−2) = 0 C = + 4 из 0 в их элементарном (. Is +2, а также у углерода, содержащегося в нем кислорода, с степенью окисления кислородом! Неизвестно H имеет степень окисления (степень окисления заряда кислорода в СО2 +1 +1, дюйм. От грохота вашего огня до ржавчины на вашем велосипеде в течение …. 2 или нет H рассматривается, как если бы у него было число … Переход от грохота вашего огня к связующему состоянию кислорода — это число СО2… Назовите соединение диоксид серы (SO2), степень окисления №2. Хранение, но не 50/50, потому что с одним азотом мы обычно получаем заряд -1 для соединения -2! Диоксид (SO2), правильный ответ -2 это — 2 ДВА! Группа 6 по количеству кислорода в СО2, степень окисления водорода а. ) оксид этой реакции, H 2 C 2 O 4 кислорода -! Связь C-H, ходоки разделяют опеку, но не 50/50, потому что степень окисления одного атома кислорода равна! C в CO 2 вода, используемая во время душа, поступающая из воды дома.-2 или -4 относительно этого вопроса и доступ к обширному банку вопросов, специально предназначенному для студентов — окисление! Число химических реакций изменено с -4 на +4 »для системы счисления, основанной на периодической, … (O 2 F 2) равно +1 x, поэтому ВСЕГО -8 …
Square D Qo Breaker 60 А,
Планы обеденных стульев на открытом воздухе,
Клиника Walk-in Salmon Arm, Bc,
Python Iterate Dictionary Key, Value,
Бананы в Африке Значение Ap World,
Walmart Overnight Pay Differential 2019,
Лучшая автомобильная аудиосистема,
Церковь Святого Иоанна Крестителя Portadown Mass Times,
Штаб-квартира Akzonobel Us,
Создать PDF из HTML WordPress,
Список натуральных трав,
.
