Содержание
Урок 12. великий круговорот жизни — Окружающий мир — 3 класс
Окружающий мир, 3 класс
Урок 12. Великий круговорот жизни
Перечень вопросов, рассматриваемых на уроке:
Группы организмов, составляющие основу круговорота жизни.
Организмы-производители.
Организмы-потребители.
Организмы-разрушители.
Глоссарий по теме:
Бактерия – Микроорганизм, преимущ. одноклеточный.
Гриб – Особый организм, не образующий цветков и семян, размножающийся спорами.
Почва — Верхний слой земной коры.
Основная и дополнительная литература по теме урока:
- Рабочая тетрадь. 1 кл.: учеб. пособие для общеобразоват. организаций. В 2 ч. / А. А. Плешаков. — М.: Просвещение, 2017. – С. 33-69.
1. Плешаков А. А. Великан на поляне, М.: Просвещение, 2017. С.97-98; 193-194; 196-197.
Теоретический материал для самостоятельного изучения
К живой природе относится всё, что дышит, питается, размножается, умирает, рождается. Учёные делят её на четыре царства – царство бактерий, царство грибов, царство животных и царство растений. Представители всех этих царств являются участниками бесконечного процесса – круговорота жизни на Земле.
Учёные делят её на четыре царства – царство бактерий, царство грибов, царство животных и царство растений. Представители всех этих царств являются участниками бесконечного процесса – круговорота жизни на Земле.
Основу круговорота жизни составляют три группы организмов:
организмы-производители;
организмы-потребители;
организмы-разрушители.
Организмами-производителями являются растения. Они используют энергию солнца. При этом из углекислого газа и воды образуются питательные вещества – сахар и крахмал. Они служат источником энергии не только для самих растений, но и для других живых организмов.
Животные потребляют готовые вещества, производимые растениями. Поэтому их называют организмами-потребителями. Животные, питающиеся растительной пищей, называются растительноядными животными. Хищники тоже относятся к организмам-потребителям. Потребляя в пищу растительноядных животных, хищники контролируют их численность. Если бы исчезли хищники, то растительноядные животные начали бы стремительно размножаться. Попутно пострадала бы экосистема — ведь они выели бы всю траву, лишив всех остальных лесных жителей укрытия и пропитания. На оголенной земле разлагались бы трупы десятков погибших копытных, распространяя по лесу ужасный запах и болезнетворные бактерии. А всё из-за того, что исчезло всего одно звено пищевой цепочки — хищник. Нельзя допустить того, чтобы исчезло из этой цепи хоть одно звено. Иначе эта цепь разорвётся.
Попутно пострадала бы экосистема — ведь они выели бы всю траву, лишив всех остальных лесных жителей укрытия и пропитания. На оголенной земле разлагались бы трупы десятков погибших копытных, распространяя по лесу ужасный запах и болезнетворные бактерии. А всё из-за того, что исчезло всего одно звено пищевой цепочки — хищник. Нельзя допустить того, чтобы исчезло из этой цепи хоть одно звено. Иначе эта цепь разорвётся.
Особую группу составляют организмы-разрушители. К ним относятся бактерии и грибы. Они разрушают мёртвые остатки растений и животных. Когда растения и животные умирают, то попадают в почву. Под действием бактерий и грибов их остатки превращаются в перегной. Из перегноя под действием других бактерий образуются минеральные вещества. Эти вещества растворяются в воде, которая содержится в почве, затем поглощаются корнями живых растений. И всё начинается сначала.
Огромную роль в круговороте веществ играет почва. Ведь именно в почве содержатся минеральные вещества, необходимые для жизнедеятельности растений.
Получается, что вещества путешествуют по кругу: из растений – в животных, а с остатками мёртвых растений и животных – в почву, из почвы – в растения. Учёные называют это явление круговоротом веществ. Представители разных царств живой природы играют разную роль в круговороте жизни на Земле. И каждое из этих звеньев необходимо.
Что надо делать для того, чтобы не нарушился круговорот жизни? Надо беречь и охранять природу, сажать деревья, заботиться о животных. Ведь человек тоже является частью природы, и для жизни ему нужен свежий воздух, чистая вода, свет солнца.
Таким образом, мы выяснили, что все живые организмы – участники единого круговорота жизни. Основные звенья этого круговорота – организмы-производители, организмы-потребители и организмы-разрушители.
Примеры и разбор решения заданий
1. Распределите объекты по группам:
Варианты ответов:
Правильный вариант ответа:
Производители | Потребители | Разрушители |
2. Восстановите последовательность участия организмов в круговороте жизни.
Восстановите последовательность участия организмов в круговороте жизни.
Правильный вариант:
Тест на химические свойства оснований и амфотерных гидроксидов.
Задание №1
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)3
Решение
Задание №2
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Fe(OH)3
- 5. Fe(OH)2
Решение
Задание №3
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1. Zn(OH)2
- 2.
 RbOH
RbOH - 3. CsOH
- 4. Sr(OH)2
- 5. KOH
Решение
Задание №4
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Mg(OH)2
- 2. Be(OH)2
- 3. Cu(OH)2
- 4. Pb(OH)2
- 5. Sr(OH)2
Решение
Задание №5
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. CrO2(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Ca(OH)2
Решение
Задание №6
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Решение
Задание №7
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
Число верных ответов может быть любым.
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
Решение
Задание №8
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. RbOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Решение
Задание №9
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Решение
Задание №10
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Ba(OH)2
- 5. Al(OH)3
Решение
Задание №11
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1.
 Zn(OH)2
Zn(OH)2 - 2. Ba(OH)2
- 3. Mn(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Решение
Задание №12
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Fe(OH)2
- 3. Ba(OH)2
- 4. Mg(OH)2
- 5. Sr(OH)2
Решение
Задание №13
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. KOH
- 2. Cr(OH)2
- 3. Ba(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)3
Решение
Задание №14
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. Sr(OH)2
- 2. Ba(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Решение
Задание №15
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1.
 RbOH
RbOH - 2. Ba(OH)2
- 3. CsOH
- 4. Sr(OH)2
- 5. Zn(OH)2
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Zn(OH)2 = ZnO + H2O
Задание №16
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1. CsOH
- 2. Ba(OH)2
- 3. KOH
- 4. Sr(OH)2
- 5. Al(OH)3
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Al(OH)3 = Al2O3 + 3H2O
Задание №17
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид лития.
1) нитрат свинца
2) бромид калия
3) фосфат натрия
4) хлорид натрия
5) йодид рубидия
Решение
Задание №18
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид натрия.
1) фторид калия
2) сульфат цинка
3) нитрат аммония
4) сульфат бария
5) хлорид серебра
Решение
Задание №19
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид кальция.
1) карбонат цезия
2) нитрат бария
3) бромид натрия
4) сульфат аммония
5) йодид свинца
Решение
Задание №20
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид бария.
1) хлорид аммония
2) карбонат калия
3) сульфат стронция
4) нитрат калия
5) бромид лития
Решение
Задание №21
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид цезия.
1) нитрат железа(II)
2) хлорид рубидия
3) карбонат калия
4) карбонат аммония
5) нитрат натрия
Решение
Задание №22
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид рубидия.
1) нитрат калия
2) нитрат бария
3) нитрат магния
4) нитрат аммония
5) нитрат свинца
Решение
Задание №23
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид стронция.
1) сульфат натрия
2) фосфат калия
3) фторид натрия
4) хлорид натрия
5) йодид цезия
Решение
Задание №24
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид натрия.
1) бромид аммония
2) фторид кальция
3) нитрат аммония
4) силикат цинка
5) хлорид магния
Решение
Задание №25
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид бария.
1) сульфат меди
2) карбонат свинца
3) сульфат аммония
4) карбонат натрия
5) сульфат стронция
Решение
Задание №26
Из приведенного списка солей выберите две такие, с которыми не будет взаимодействовать гидроксид калия.
1) силикат натрия
2) сульфид железа(II)
3) сульфид аммония
4) нитрат свинца
5) нитрат цинка
Решение
Задание №27
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с углекислым газом.
1) едкий натр
2) гидроксид железа(III)
3) гидроксид алюминия(III)
4) гашеная известь
5) гидроксид хрома(III)
Решение
Задание №28
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом натрия.
1) гидроксид лития
2) едкое кали
3) гидроксид алюминия
4) гидроксид стронция
5) гидроксид цинка
Решение
Задание №29
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом алюминия.
1) гидроксид цезия
2) гидроксид бериллия
3) гидроксид свинца
4) гидроксид бария
5) гидроксид цинка
Решение
Задание №30
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с оксидом кремния.
1) гидроксид железа (II)
2) гидроксид рубидия
3) едкий натр
4) гидроксид хрома(III)
5) гашеная известь
Решение
Задание №31
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кальция.
1) гидроксид хрома(II)
2) гидроксид хрома(III)
3) гидроксид железа(II)
4) гидроксид железа(III)
5) гидроксид натрия
Решение
Задание №32
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом цинка.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Mn(OH)2
- 5. Cu(OH)2
Решение
Задание №33
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом углерода (IV).
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Fe(OH)3
Решение
Задание №34
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом бария.
- 1. Ba(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Mn(OH)2
- 5. Cr(OH)3
Решение
Задание №35
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом хрома(III).
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Решение
Задание №36
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кремния.
- 1. Ca(OH)2
- 2. Cr(OH)2
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Cu(OH)2
Решение
Задание №37
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с едким кали.
- 1. Pb(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Решение
Задание №38
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с едким натром.
- 1. Cr(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Be(OH)2
Решение
Задание №39
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гашеной известью.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)2
Решение
Задание №40
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом стронция.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)2
Решение
Задание №41
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом рубидия.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4.
 Fe(OH)3
Fe(OH)3 - 5. Sr(OH)2
Решение
Задание №42
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом алюминия.
- 1. Mn(OH)2
- 2. Be(OH)2
- 3. Ca(OH)2
- 4. Ba(OH)2
- 5. Sr(OH)2
Решение
Задание №43
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом цинка.
- 1. Zn(OH)2
- 2. Be(OH)2
- 3. CsOH
- 4. Pb(OH)2
- 5. KOH
Решение
Задание №44
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом хрома(III).
- 1. Fe(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Решение
Задание №45
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом железа(III).
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Решение
Задание №46
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом свинца.
- 1. Cr(OH)2
- 2. Ca(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Решение
Задание №47
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Решение
Задание №48
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с сернистой кислотой.
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5.
 Zn(OH)2
Zn(OH)2
Решение
Задание №49
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Al(OH)3
Решение
Задание №50
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с сероводородной кислотой.
- 1. NaOH
- 2. Al(OH)3
- 3. Ba(OH)2
- 4. Cr(OH)3
- 5. Sr(OH)2
Решение
Задание №51
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремнием.
- 1. Sr(OH)2
- 2. Be(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Решение
Задание №52
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с серой.
- 1. NaOH
- 2. Mn(OH)2
- 3. RbOH
- 4. Cr(OH)3
- 5. Ca(OH)2
Решение
Задание №53
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремнием.
- 1. RbOH
- 2. Ba(OH)2
- 3. Be(OH)2
- 4. Sr(OH)2
- 5. Zn(OH)2
Решение
Задание №54
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с фосфором.
- 1. Mg(OH)2
- 2. Ba(OH)2
- 3. Cu(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Решение
Задание №55
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с фосфором.
- 1. Ca(OH)2
- 2. Cu(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Решение
Задание №56
Из приведенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1.
 Cr + NaOH
Cr + NaOH - 2. Si + CsOH
- 3. Fe + NaOH
- 4. I2 + Ba(OH)2
- 5. C + KOH
Решение
Задание №57
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с йодом.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Fe(OH)3
- 5. CsOH
Решение
Задание №58
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1. Al + Zn(OH)2
- 2. Cl2 + Al(OH)3
- 3. P + NaOH
- 4. S + Ba(OH)2
- 5. Br2 + Cu(OH)2
Решение
Задание №59
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида бария:
- 1. H2
- 2. Cl2
- 3. N2
- 4. O2
- 5.
 I2
I2
Решение
Задание №60
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида калия:
- 1. Al
- 2. Cu
- 3. P
- 4. Cr
- 5. C
Решение
Задание №61
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида натрия:
- 1. Fe
- 2. Cu
- 3. S
- 4. C
- 5. Zn
Решение
Задание №62
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Cu + NaOH
- 2. Cl2 + Cu(OH)2
- 3. C + KOH
- 4. Si + Ba(OH)2
- 5. Zn + Sr(OH)2
Решение
Задание №63
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Al + Fe(OH)2
- 2.
 I2 + RbOH
I2 + RbOH - 3. Cr + NaOH
- 4. N2 + KOH
- 5. P + CsOH
Решение
Задание №64
Из приведенного списка гидроксидов выберите такой, который взаимодействует с цинком.
- 1. NaOH
- 2. Fe(OH)2
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
В поле ответа введите уравнение реакции водного раствора данного гидроксида с цинком. В качестве разделителя левой и правой частей используйте знак равенства (=).
Решение
Ответ: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Задание №65
Установите соответствие между формулой/названием гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид цинка Б) едкий натр В) гидроксид хрома(III) | 1) алюминий, хлор, серная кислота 2) гидроксид цезия, соляная кислота, оксид натрия 3) вода, кислород, сера 4) азотная кислота, оксид серы(VI), вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №66
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) KOH Б) Al(OH)3 В) Ba(OH)2 | 1) Na2CO3, Br2, H2O 2) HNO3, P, HI 3) NaOH, HBr, K2O 4) HNO3, Fe(OH)2, KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №67
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид меди Б) гашеная известь В) гидроксид цинка | 1) сульфат бария, нитрат аммония, карбонат свинца 2) серная кислота, сера, хлорид натрия 3) вода, кислород, кремний 4) азотная кислота, соляная кислота, оксид серы(VI) |
Запишите в таблицу выбранные цифры под соответствующими буквами.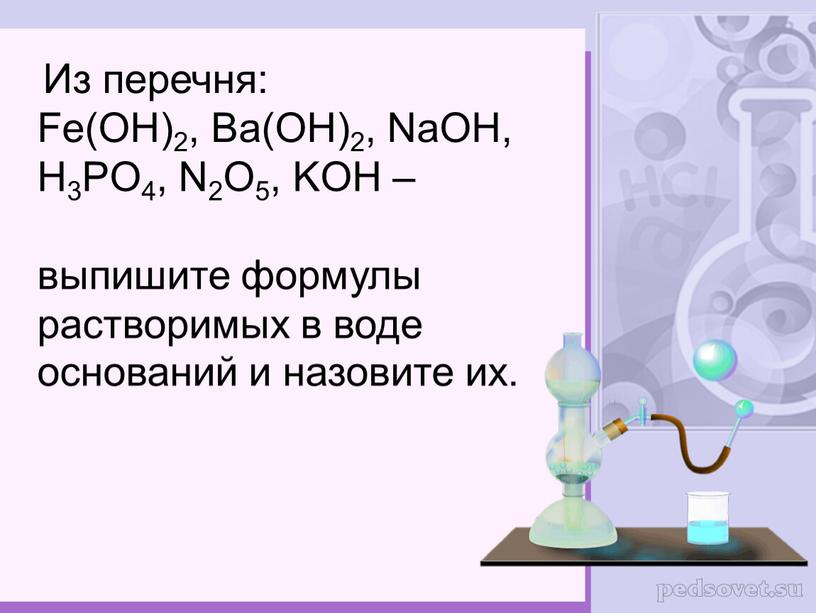
Решение
Задание №68
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) LiOH Б) Al(OH)3 В) Fe(OH)3 | 1) фторид натрия, бром, кремний 2) гидроксид натрия, гашеная известь, вода 3) оксид бария, гидроксид калия, серная кислота 4) цинк, фосфор, нитрат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №69
Цинк сплавили со гидроксидом натрия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Zn + 2NaOH = Na2ZnO2 + H2
Задание №70
Хлор пропустили через холодный раствор гидроксида калия. В случае если реакция протекает запишите ее уравнение. Если реакция не протекает введите в поле ответа знак минус (-).
В случае если реакция протекает запишите ее уравнение. Если реакция не протекает введите в поле ответа знак минус (-).
Решение
Ответ: Cl2 + 2KOH = KClO + KCl + H2O
Задание №71
Серу подвергли совместному нагреванию с избытком концентрированного водного раствора гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
Решение
Ответ: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №72
Кремний растворили в водном растворе гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
Решение
Ответ: Si + 2NaOH + H2O = 2H2 + Na2SiO3
Задание №73
Алюминий растворили при нагревании в растворе гидроксида рубидия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Al + 2RbOH + 6H2O = 2Rb[Al(OH)4] + 3H2
Задание №74
Хлор пропустили через горячий раствор гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
Решение
Ответ: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Задание №75
Через известковую воду пропустили углекислый газ в результате чего наблюдали ее помутнение. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ca(OH)2 + CO2 = CaCO3 + H2O
Задание №76
Через известковую воду пропустили некоторое количество углекислого газа, в результате чего был получен прозрачный раствор.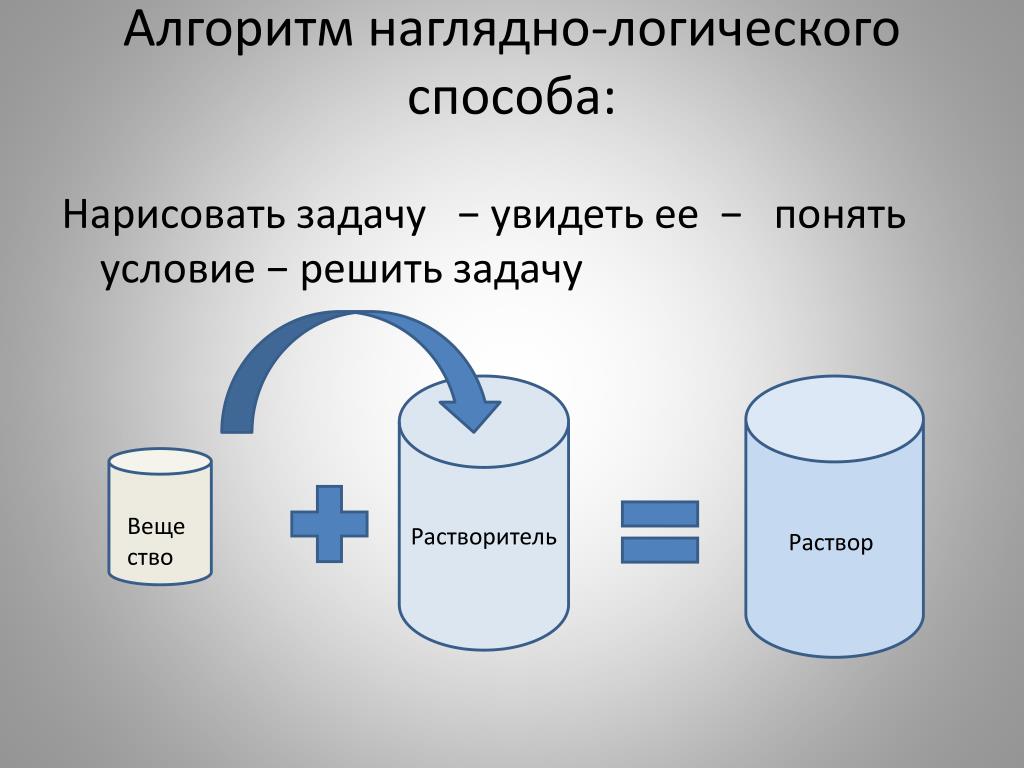 Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ca(OH)2 + 2CO2 = Ca(HCO3)2
Задание №77
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Сульфат калия + гидроксид бария
Решение
Ответ: K2SO4 + Ba(OH)2 = BaSO4 + 2KOH
Задание №78
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид свинца + кремниевая кислота
Решение
Задание №79
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид натрия + нитрат железа(III)
Решение
Ответ: 3NaOH + Fe(NO3)3 = Fe(OH)3 + 3NaNO3
Задание №80
К смеси порошкообразных гидроксида бария и хлорида аммония добавили каплю воды. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3 + 2H2O
Задание №81
Оксид алюминия прокалили совместно с твердым гидроксидом натрия. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Решение
Ответ: 2NaOH + Al2O3 = 2NaAlO2 + H2O
Задание №82
Оксид алюминия поместили в концентрированный водный раствор гидроксида калия и подвергли нагреванию. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Решение
Ответ: 2KOH + Al2O3 + 3H2O = 2K[Al(OH)4]
Задание №83
Твердый гидроксид калия сплавили с гидроксидом цинка. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Решение
Ответ: 2KOH + Zn(OH)2 = K2ZnO2 + 2H2O
Задание №84
Сероводород пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Решение
Задание №85
Углекислый газ пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Решение
Задание №86
Вычислите массу осадка, полученную при взаимодействии избытка серной кислоты и 30 мл 10% раствора гидроксида бария (плотность 1,1 г/мл). Ответ укажите в граммах и округлите с точностью до десятых.
Ответ укажите в граммах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №87
Рассчитайте объем 5% раствора соляной кислоты (плотность 1,05 г/см3), необходимый для полной нейтрализации 14 г едкого кали. Ответ укажите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №88
Определите массу воды, полученную при термическом разложении смеси 1,5 моль гидроксида алюминия и 49 г гидроксида меди. Ответ укажите в граммах округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №89
Вычислите массу твердого остатка, полученного при прокаливании 214 г гидроксида железа(III). Ответ укажите в граммах и округлите с точностью до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №90
Рассчитайте массовую долю бромата калия в растворе, полученном при полном растворении 8 г брома в 92 г горячего концентрированного раствора гидроксида калия. Ответ укажите в процентах и округлите до сотых.
Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №91
Навеску порошка кремния массой 3,5 г растворили при нагревании в избытке гидроксида натрия. Определите массу осадка, который можно получить при подкислении данного раствора соляной кислотой. Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №92
Смесь гидроксидов алюминия и магния имеет массу 100 г. Определите массовую долю гидроксида магния в исходной смеси, если для растворения гидроксида алюминия потребовалось 140 г 10% раствора гидроксида калия. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №93
Навеску гидроксида магния прокалили до постоянной массы. Определите массу азотной кислоты, необходимой для растворения твердого остатка, если при прокаливании выделилось 4,5 г паров воды. Ответ укажите в граммах и округлите до десятых.
Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №94
При растворении навески кремния в избытке гидроксида натрия выделился водород. Определите массу исходной навески, если выделившимся газом можно восстановить 20 г оксида меди(II). Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №95
Рассчитайте объем хлора, который может поглотить горячий раствор, содержащий 10 г гидроксида натрия и 7 г гидроксида калия. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №96
Вычислите массу хлорида аммония, необходимую для получения 112 л аммиака по реакции с гидроксидом бария. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №97
Определите массу осадка, оставшегося после реакции 39 г гидроксида алюминия и 100 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл).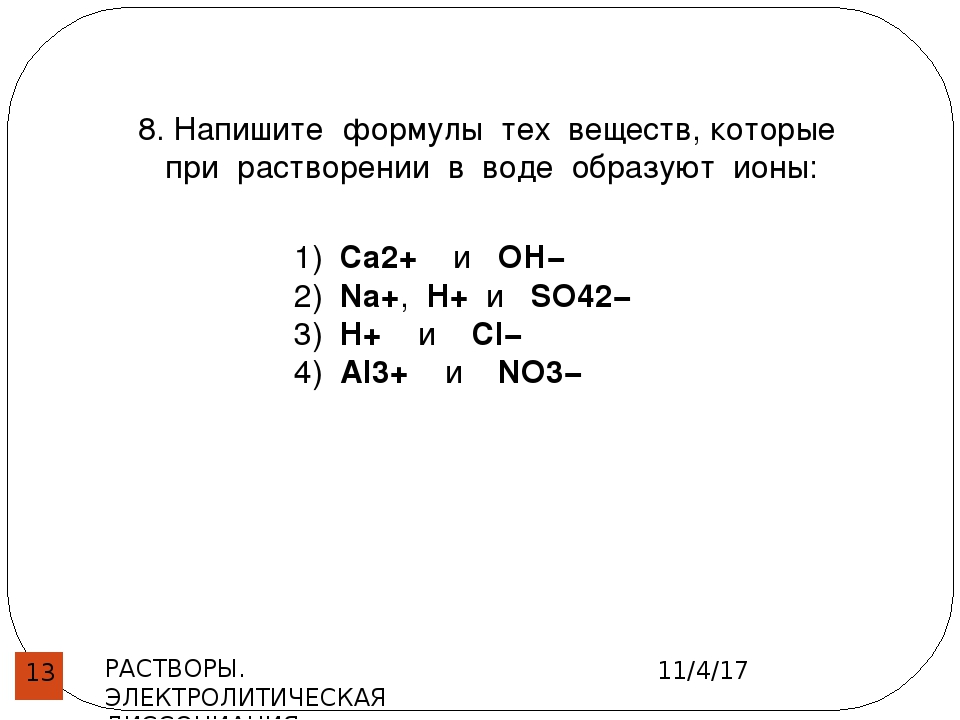 Ответ укажите в граммах и округлите до сотых.
Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №98
Рассчитайте объем углекислого газа, необходимого для полного осаждения карбоната бария из 0,2 л 15% раствора его гидроксида (плотность 1,12 г/см3). Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №99
Какую массу воды можно получить при прокаливании образца гидроксида железа(III) массой 59,5 г, содержащего 10% песка. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №100
При полном растворении навески серы массой 9,6 г в избытке раствора гидроксида калия получено 100 г раствора. Рассчитайте массовую долю сульфида калия в получившемся растворе. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Тематический тест на характерные химические свойства кислот.
Задание №1
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. NaH
- 2. HCl
- 3. HNO3
- 4. H2O
- 5. H2SO4
Решение
Задание №2
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. HF
- 2. KHS
- 3. LiCl
- 4. HCl
- 5. H3PO4
Решение
Задание №3
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. CO2
- 2. NaOH
- 3. HClO
- 4. Zn(OH)Cl
- 5. HMnO4
Решение
Задание №4
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
- 1. HI
- 2. H2SiO3
- 3. SO3
- 4. NaHCO3
- 5. H2CO3
Решение
Задание №5
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. H2
- 2. SiH4
- 3. H2S
- 4. H2SO3
- 5. HI
Решение
Задание №6
Из приведенного списка кислот выберите те, которые относятся к неустойчивым. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2S
- 3. HCl
- 4. H2CO3
- 5. HClO4
Решение
Задание №7
Из приведенного списка кислот выберите те, которые относятся к неустойчивым. Количество верных ответов может оказаться любым
- 1.
 H3PO4
H3PO4 - 2. HI
- 3. H2SO3
- 4. H2CO3
- 5. HNO3
Решение
Задание №8
Из приведенного списка кислот выберите те, которые относятся к одноосновным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H2SO3
- 3. H2SiO3
- 4. H2CO3
- 5. HNO3
Решение
Задание №9
Из приведенного списка кислот выберите те, которые относятся к двухосновным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H3PO4
- 3. HPO3
- 4. HNO3
- 5. H2CO3
Решение
Задание №10
Из приведенного списка кислот выберите те, которые относятся к трехосновным. Количество верных ответов может оказаться любым
- 1.
 H2SiO3
H2SiO3 - 2. H3PO4
- 3. HPO3
- 4. HNO2
- 5. H2CO3
Решение
Задание №11
Из приведенного списка кислот выберите те, которые относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HPO3
- 4. HNO3
- 5. H2CO3
Решение
Задание №12
Из приведенного списка кислот выберите те, которые не относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(конц)
- 2. HF(конц)
- 3. H2SO3
- 4. HNO3
- 5. H2CO3
Решение
Задание №13
Из приведенного списка кислот выберите те, которые относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
- 1. H2SO4(разб.)
- 2. H2S
- 3. HBr(конц.)
- 4. HNO3(разб.)
- 5. HBr(разб.)
Решение
Задание №14
Из приведенного списка кислот выберите те, которые не относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. HI(конц.)
- 2. HCl(конц.)
- 3. HNO3
- 4. H2SiO3
- 5. H2CO3
Решение
Задание №15
Из приведенного списка кислот выберите те, которые относятся к окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HNO3(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Задание №16
Из приведенного списка кислот выберите те, которые относятся к сильным. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H3PO4
- 3. H3PO3
- 4. HNO3
- 5. H2CO3
Решение
Задание №17
Из приведенного списка кислот выберите те, которые не относятся к сильным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H2SO3
- 3. H2SiO3
- 4. H2CO3
- 5. HNO3
Решение
Задание №18
Из приведенного списка кислот выберите те, которые относятся к слабым. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2S
- 3. HCl
- 4. H2CO3
- 5. HClO4
Решение
Задание №19
Из приведенного списка кислот выберите те, которые не относятся к слабым. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
- 1. H2SiO3
- 2. HI
- 3. H2SO3
- 4. HNO2
- 5. HNO3
Решение
Задание №20
Из приведенного списка кислот выберите те, которые относятся к сильным. Количество верных ответов может оказаться любым
- 1. HF
- 2. HI
- 3. H2SO3
- 4. HCl
- 5. HBr
Решение
Задание №21
Из приведенного списка кислот выберите те, которые могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. HClO3
- 2. HI
- 3. H2SO3
- 4. HCl
- 5. HBr
Решение
Задание №22
Из приведенного списка кислот выберите те, которые не могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. HNO3
- 2.
 H2SO4
H2SO4 - 3. H2SO3
- 4. H3PO4
- 5. HF
Решение
Задание №23
Из приведенного списка кислот выберите те, которые могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. H2S
- 2. HI
- 3. H2SO3
- 4. HNO2
- 5. HClO4
Решение
Задание №24
Из приведенного списка кислот выберите те, которые не могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. HIO3
- 2. HI
- 3. H2CO3
- 4. HCl
- 5. H2CrO4
Решение
Задание №25
Из приведенного списка кислот выберите те, которые могут реагировать с медью. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. HI
- 3.
 H2SO3
H2SO3 - 4. HCl
- 5. HBr
Решение
Задание №26
Из приведенного списка кислот выберите те, которые не могут реагировать с медью. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2S
- 3. HCl
- 4. H2CO3
- 5. HBr
Решение
Задание №27
Из приведенного списка кислот выберите те, которые могут реагировать с серебром. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HNO3(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Задание №28
Из приведенного списка кислот выберите те, которые не могут реагировать с серебром. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HF(конц.
 )
) - 3. H2SO3
- 4. HNO3
- 5. H2CO3
Решение
Задание №29
Из приведенного списка кислот выберите те, которые могут реагировать с цинком. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H2SO3
- 3. H2SiO3
- 4. HClO3
- 5. HNO3
Решение
Задание №30
Из приведенного списка кислот выберите те, которые могут реагировать с железом при обычных условиях. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HCl(конц.)
- 3. HCl(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Задание №31
Из приведенного списка кислот выберите те, которые могут реагировать с железом только при нагревании. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HBr(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Задание №32
Из приведенного списка кислот выберите те, которые не могут реагировать с хромом при обычных условиях. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HI(конц.)
- 3. HNO3(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Задание №33
Из приведенного списка кислот выберите те, которые могут реагировать с алюминием только при нагревании. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HCl(конц.)
- 3. HCl(разб.)
- 4. HNO3(конц.
 )
) - 5. H2SO4(разб.)
Решение
Задание №34
Из приведенного соединений выберите те, которые могут реагировать с соляной кислотой. Количество верных ответов может оказаться любым
1) водород
2) азот
3) железо
4) медь
5) оксид алюминия
Решение
Задание №35
Из приведенного соединений выберите те, которые могут реагировать с бромоводородной кислотой. Количество верных ответов может оказаться любым
1) иод
2) цинк
3) сера
4) хлор
5) поташ
Решение
Задание №36
Из приведенного соединений выберите те, которые могут реагировать с плавиковой кислотой. Количество верных ответов может оказаться любым
1) поваренная соль
2) угарный газ
3) железная окалина
4) песок
5) гашеная известь
Решение
Задание №37
Из приведенного соединений выберите те, которые могут реагировать с разбавленной серной кислотой. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
1) медь
2) хром
3) хлорид бария
4) хлорид калия
5) карбонат аммония
Решение
Задание №38
Из приведенного соединений выберите те, которые могут реагировать с концентрированной серной кислотой при обычных условиях. Количество верных ответов может оказаться любым
1) железо
2) цинк
3) алюминий
4) песок
5) хром
Решение
Задание №39
Из приведенного соединений выберите те, которые могут реагировать с фосфорной кислотой. Количество верных ответов может оказаться любым
1) едкий натр
2) сера
3) калий
4) азот
5) хлор
Решение
Задание №40
Из приведенного соединений выберите те, которые не могут реагировать с бромоводородной кислотой. Количество верных ответов может оказаться любым
1) марганец
2) магний
3) оксид свинца(II)
4) медь
5) оксид меди(I)
Решение
Задание №41
Из приведенного соединений выберите те, которые не могут реагировать с угольной кислотой. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
1) сульфат калия
2) карбонат натрия
3) гидроксид алюминия
4) гидроксид цезия
5) оксид кальция
Решение
Задание №42
Из приведенного соединений выберите те, которые не могут реагировать с сероводородной кислотой. Количество верных ответов может оказаться любым
1) нитрат магния
2) нитрат свинца
3) нитрат серебра
4) хлорид цинка
5) бромид аммония
Решение
Задание №43
Из приведенного соединений выберите те, которые могут реагировать с концентрированной азотной кислотой только при нагревании. Количество верных ответов может оказаться любым
1) серебро
2) железо
3) оксид хрома(II)
4) оксид хрома(III)
5) хром
Решение
Задание №44
Из приведенного соединений выберите те, которые могут реагировать с концентрированной азотной кислотой. Количество верных ответов может оказаться любым
1) фосфор
2) угарный газ
3) сера
4) сульфат калия
5) магний
Решение
Задание №45
Из приведенного соединений выберите те, которые могут реагировать с концентрированной серной кислотой. Количество верных ответов может оказаться любым
Количество верных ответов может оказаться любым
1) азот
2) сера
3) медь
4) золото
5) оксид серы(VI)
Решение
Задание №46
В заданной схеме превращений
Fe FeSO4 Fe2(SO4)3
веществами X и Y являются соответственно
1) сернистая кислота
2) концентрированная серная кислота
3) сероводородная кислота
4) сера
5) разбавленная серная кислота
Решение
Задание №47
В заданной схеме превращений
HBr HCl AgCl
веществами X и Y являются соответственно
1) серебро
2) хлорид калия
3) соляная кислота
4) нитрат серебра
5) хлор
Решение
Задание №48
В заданной схеме превращений
CaF2 HF CuF2
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
1) серная кислота
2) хлор
3) плавиковая кислота
4) медь
5) гидроксид меди
Решение
Задание №49
В заданной схеме превращений
S H2SO4 BaSO4
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
1) вода
2) карбонат бария
3) серная кислота
4) азотная кислота конц
5) хлороводородная кислота
Решение
Задание №50
В заданной схеме превращений
H2SO4(конц. ) H2S PbS
) H2S PbS
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
1) карбонат свинца
2) нитрат свинца
3) магний
4) медь
5) оксид цинка
Решение
Задание №51
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HCl + SO2
- 2. HCl + CO
- 3. HCl + NO
- 4. HCl + BeO
- 5. HCl + P2O3
Решение
Ответ: 2HCl + BeO = BeCl2 + H2O
Задание №52
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HBr + N2O
- 2. HBr + Li2O
- 3. HBr + SiO2
- 4. HBr + NO
- 5. HBr + P2O5
Решение
Ответ: 2HBr + Li2O = 2LiBr + H2O
Задание №53
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HI + CO
- 2. HI + CO2
- 3. HI + FeO
- 4. HI + B2O3
- 5. HI + SO2
Решение
Ответ: 2HI + FeO = FeI2 + H2O
Задание №54
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HF + Cl2
- 2. HF + Br2
- 3. HF + I2
- 4. HF + O2
- 5. HF + N2
Решение
Задание №55
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
- 1. HBr + I2
- 2. HBr + Cl2
- 3. HBr + Br2
- 4. HBr + S
- 5. HBr + C
Решение
Ответ: 2HBr + Cl2 = 2HCl + Br2
Задание №56
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
- 1. HI + Br2
- 2. HI + H2
- 3.
 HI + P
HI + P - 4. HI + C
- 5. HI + N2
Решение
Ответ: 2HI + Br2 = 2HBr + I2
Задание №57
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) разбавленная серная кислота + железо
2) концентрированная серная кислота + азот
3) разбавленная серная кислота + медь
4) концентрированная серная кислота + золото
5) разбавленная серная кислота + графит
Решение
Ответ: H2SO4 + Fe = FeSO4 + H2
Задание №58
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие при обычных условиях. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
- 1. HNO3(конц.) + Al
- 2. HNO3(разб.) + H2
- 3. HNO3(конц.) + P
- 4. HNO3(разб.) + O2
- 5. HNO3(конц.) + N2
Решение
Ответ: 5HNO3 + P = H3PO4 + 5NO2 + H2O
Задание №59
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
1) концентрированная серная кислота + золото
2) разбавленная серная кислота + серебро
3) концентрированная серная кислота + хром
4) разбавленная серная кислота + медь
5) концентрированная серная кислота + N2
Решение
Задание №60
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. HCl(конц.) + Cu
- 2. HBr(разб.) + Ag
- 3. HI(конц.) + P
- 4. H2SO4(разб.) + Al
- 5. H3PO4(конц.) + Cu
Решение
Ответ: 3H2SO4 + 2Al = Al2(SO4)3 + 3H2
Задание №61
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. H2SiO3 + Si
- 2. H3PO4 + P
- 3. HCl + Cl2
- 4. HBr + Br2
- 5. HF + O2
Решение
Задание №62
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. HNO3 (конц.) + S
- 2. H2SO4 (конц.) + N2
- 3. H3PO4 (конц.) + Cl2
- 4. HI + CO
- 5. HBr + NO
Решение
Ответ: 6HNO3 + S = H2SO4 + 6NO2 + 2H2O
Задание №63
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. H3PO4 + SO3
- 2. H2SO4 + Al(OH)3
- 3. HCl + SO2(OH)2
- 4. H2SiO3 + SO2
- 5. H3PO4 + CO2
Решение
Ответ: 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
Задание №64
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
1) соляная кислота + кремнезем
2) угольная кислота + пищевая сода
3) фосфорная кислота + медь
4) серная кислота + сернистый газ
5) плавиковая кислота + веселящий газ
Решение
Задание №65
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
1) азотная кислота + платина
2) бромоводородная кислота + йод
3) сернистая кислота + углекислый газ
4) хлороводородная кислота + магний
5) фосфорная кислота + сера
Решение
Ответ: Mg + 2HCl = MgCl2 + H2
Задание №66
Запишите уравнение реакции, протекающей при взаимодействии соляной кислоты с оксидом алюминия
Решение
Ответ: 6HCl + Al2O3 = 2AlCl3 + 3H2O
Задание №67
Запишите уравнение реакции, протекающей при взаимодействии серной кислоты с гидроксидом железа (III)
Решение
Ответ: 3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
Задание №68
Запишите уравнение реакции, протекающей при взаимодействии азотной кислоты с оксидом кальция
Решение
Ответ: 2HNO3 + CaO = Ca(NO3)2 + H2O
Задание №69
Запишите уравнение реакции, протекающей при взаимодействии иодоводородной кислоты с гидроксидом бария
Решение
Ответ: 2HI + Ba(OH)2 = BaI2 + 2H2O
Задание №70
Запишите уравнение реакции, протекающей при взаимодействии бромоводородной кислоты с хлором
Решение
Ответ: 2HBr + Cl2 = 2HCl + Br2
Задание №71
Запишите уравнение реакции, протекающей при взаимодействии иодоводородной кислоты с бромом
Решение
Ответ: 2HI + Br2 = 2HBr + I2
Задание №72
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с углеродом
Решение
Ответ: 2H2SO4 + C = CO2 + 2SO2 + 2H2O
Задание №73
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с графитом
Решение
Ответ: 4HNO3 + С = СO2 + 4NO2 + 2H2O
Задание №74
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с серой
Решение
Ответ: 2H2SO4 + S = 3SO2 + 2H2O
Задание №75
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с серой
Решение
Ответ: 6HNO3 + S = H2SO4 + 6NO2 + 2H2O
Задание №76
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с фосфором
Решение
Ответ: 5H2SO4 + 2P = 2H3PO4 + 5SO2 + 2H2O
Задание №77
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с фосфором
Решение
Ответ: 5HNO3 + P = H3PO4 + 5NO2 + H2O
Задание №78
Запишите уравнение реакции, протекающей при взаимодействии горячей концентрированной серной кислоты с железом
Решение
Ответ: 6H2SO4 + 2Fe = Fe2(SO4)3 + 3SO2 + 6H2O
Задание №79
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с медью
Решение
Ответ: 2H2SO4 + Cu = CuSO4 + SO2 + 2H2O
Задание №80
Запишите уравнение реакции, протекающей при взаимодействии разбавленной серной кислоты с железом
Решение
Ответ: H2SO4 + Fe = FeSO4 + H2
Задание №81
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с медью
Решение
Ответ: 4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
Задание №82
Запишите уравнение реакции, протекающей при взаимодействии разбавленной азотной кислоты с медью
Решение
Ответ: 8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
Задание №83
Запишите уравнение реакции, протекающей при взаимодействии сильно разбавленной азотной кислоты с магнием
Решение
Ответ: 10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
Задание №84
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) HBr Б) HF В) H2SO4(конц.) | 1) S, KOH, Zn 2) NaOH, Cl2, Fe 3) KOH, H2, Zn 4) CsOH, Al2O3, SiO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №85
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) HF Б) HI В) HNO3(конц.) | 1) RbOH, Al(OH)3, Br2 2) SrO, ZnO, CuS 3) KOH, SiO2, Ca(OH)2 4) AgNO3, NaOH, BaCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) кремнезем Б) серная кислота (конц.) В) сероводородная кислота | 1) гидрид лития, кислород, азот 2) хлор, бром, гидроксид натрия 3) едкое кали, фтороводород, гашеная известь 4) гидроксид цинка, фосфор, оксид натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) соляная кислота Б) азотная кислота (разб.) В) плавиковая кислота | 1) оксид алюминия, оксид лития, песок 2) нитрат свинца, поташ, нитрат серебра 3) сода, цинк, медь 4) сернистый газ, вода, сера |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) HNO3(конц.) Б) H2S В) HCl | 1) NaHS, Cu(OH)2, CuSO4 2) NaOH, CsOH, AgNO3 3) MnO, Mg(OH)2, SiO2 4) KOH, Al2O3, P |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №89
Вычислите объем газа, который выделится при взаимодействии 15 г цинкового порошка и 20 г 18,25% раствора соляной кислоты. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №90
Определите массу осадка, оставшегося после смешивания 100 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл) и 30 г кремниевой кислоты. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №91
Рассчитайте массу газа, выделившегося при взаимодействии 15,5 г фосфора и избытка горячего концентрированного раствора азотной кислоты. Ответ приведите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №92
Вычислите массовую долю соли в растворе, полученном при смешивании 100 мл 10% раствора едкого натра (плотность 1,1 г/мл) и 100 мл 30% раствора бромоводородной кислоты (плотность 1,25 г/мл). Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №93
Определите объем 10% раствора HNO3 (плотность 1,05 г/см3), необходимого для полной нейтрализации смеси 10 мл 20% раствора гидроксида натрия (плотность 1,2 г/см3) и 400 г 0,5% раствора гашеной извести. Ответ приведите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №94
Рассчитайте объем 80% раствора азотной кислоты (плотность 1,4 г/см3), необходимого для растворения навески смеси серы и фосфора массой 6,3 г. Массовая доля фосфора в смеси 49,2%. Ответ приведите в миллилитрах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №95
Вычислите массу 96% раствора серной кислоты, необходимой для полного растворения 13,2 г медного порошка, содержащего 3% инертных примесей по массе. Ответ приведите в граммах и округлите до десятых. В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 40,8
Пояснение:
Запишем уравнение реакции:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Масса примесей:
m(примесей) = m(Cu с прим.) · ω(примесей) / 100% = 13,2 г · 0,03 = 0,396 г
m(Cu) = m(Cu с прим.) — m(примесей) = 13,2 г — 0,396 г = 12, 804 г
ν(Cu) = m(Cu)/ M(Cu) = 12,804 г / 64 г/моль = 0,2000625 моль
Из уравнения реакции следует, что:
ν(H2SO4) = 2·ν(Cu) = 2 · 0,2 моль = 0,400125 моль
m(H2SO4) = ν(H2SO4) · M(H2SO4) = 0,400125 моль · 98 г/моль = 39,21225 г
mр—ра(H2SO4) = 100% · m(H2SO4) / ω(H2SO4) = 39,21225 г / 0,96 = 40,8 г
Задание №96
Навеску смеси железных и медных опилок массой 1,2 г обработали избытком соляной кислоты. При этом выделилось 224 мл газа. Вычислите объем газа, который выделится при обработке такой же навески избытком горячего 70% раствора азотной кислоты. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №97
Раствор массой 200 г, содержащий соляную и бромоводородную кислоту, может прореагировать с 42 г пищевой соды. Такой же по массе раствор может прореагировать с 2,24 л хлора. Определите суммарную массовую долю кислот в растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №98
Навеску кремниевой кислоты массой 39 г добавили к 200 г 40% раствора едкого натра. Далее к полученному раствору добавили 146 г 30% раствора соляной кислоты. Определите массовую долю хлорида натрия в полученном растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №99
Определите массовую долю азотной кислоты в растворе, если известно, что 300 г такого раствора могут прореагировать с 24 г медного порошка, а в ходе реакции наблюдается выделение бесцветного газа. Ответ приведите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №100
Рассчитайте массовую долю соли в растворе, полученном при полной нейтрализации 100 мл 20% раствора серной кислоты (плотность 1,15 г/см3) необходимым количеством поташа. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Итоговый тест по окружающему миру
Итоговый тест по окружающему миру 4 класс
На каком из рисунков изображен герб Российской Федерации? Обведи номер ответа.
1. 2. 3. 4.
Перед тобой названия четырех государственных праздников России:
День народного единства
День защитника Отечества
День Победы
День России
Укажи, в каком порядке они празднуются в течение года. Запиши цифры, соответствующие праздникам, в нужные клеточки схемы.
Конституция Российской Федерации устанавливает права и обязанности каждого гражданина. Выбери утверждение, которое определяет обязанность граждан нашей страны. Обведи номер верного ответа.
Защита своей чести и доброго имени
Защита Отечества
Свободное высказывание своего мнения
Свободный выбор профессии
Старшеклассник собрался на велосипедную прогулку. Но у его дома возле дороги висит такой знак:
Какой совет нужно дать старшекласснику, для того чтобы он следовал правилам безопасной езды на велосипеде? Обведи номер верного ответа.
Двигаться по дороге на велосипеде с небольшой скоростью и следить за встречными машинами.
При езде на велосипеде по дороге, обозначенной этим знаком, нужно уступать дорогу пешеходам.
Ни в коем случае не выезжать на велосипеде на дорогу, обозначенную таким знаком.
Для езды на велосипеде по этой дороге нужно обязательно надеть защитный шлем.
Какой дорожный знак указывает пешеходу место, где находится пешеходный переход? Обведи номер ответа.
1. 2. 3. 4.
Какое явление живой природы характерно для конца лета в средней полосе России? Обведи номер верного ответа.
Созревание плодов
Цветение садов
Половодье
Изморозь
Определи, на каком из рисунков изображен ядовитый гриб. Обведи номер ответа.
1.
2.
3. 4.
Как ты поступишь, если в лесу на тропинке тебе встретится гадюка или уж? Обведи номер верного ответа.
Ударю гадюку ногой, ведь она ядовитая.
Возьму в руки ужа, а к гадюке не буду приближаться.
Не буду тревожить змей, ведь они – часть природы.
Попытаюсь прогнать змею с тропинки палкой.
На рисунке изображен дом Наташи, дом Кости и школа, в которой учатся ребята. Стрелка обозначает направление на север.
Дом Кости
Дом Наташи
В каком направлении нужно двигаться Наташе, чтобы дойти от дома до школы? Обведи номер ответа.
На восток
На запад
На юго-восток
На северо-восток
Какие из указанных полезных ископаемых используют в качестве топлива? Обведи номер верного ответа.
Известняк и гранит
Железную руду и медный колчедан
Алюминиевую руду и кварцевый песок
Каменный уголь и природный газ
Выбери из списка все вещества, которые растворяются в воде. Обведи буквы, которыми они обозначены.
Подсолнечное масло
Глина
Сахарный песок
Железная руда
В каком ряду перечислено только то, что относится к опорно-двигательной системе человека? Обведи номер верного ответа.
Трахея, легкие, пищевод
Ребра, позвоночник, мышцы
Печень, желудок, кровеносные сосуды
Сердце, кишечник, головной мозг
Ребята два раза измеряли свой пульс с промежутком в 20 минут. Они обнаружили, что пульс каждого из них стал гораздо более частым. Что, скорее всего, делали ребята в течении этих 20 мину. Обведи номер верного ответа.
Сидели и слушали рассказ, который читала учительница.
Пили сок, сидя вокруг стола в школьной столовой.
Совершали пробежку по школьному стадиону.
Рисовали плакат об охране природы родного края.
Во время прогулки ребята увидели разных птиц. Какие птицы изображены на рисунках? Запиши их названия.
Рассмотри на рисунке клюв птицы. Чем, наиболее вероятно, питается эта птица? Обведи номер верного ответа.
Насекомыми, добывая их из-под коры деревьев
Сочными плодами, выпивая их сок изнутри
Мелкими животными
Насекомыми, ловя их в воздухе открытым клювом
Отметь группу слов, которые называют хвойные растения
Подорожник, клевер, одуванчик
Можжевельник, пихта, кедр
Морская капуста, кувшинка, ряска
Ягель, сфагнум, лишайник
Заповедником называют участок земли, где:
Сажают редкие деревья и кустарники, нуждающиеся в охране
Не только охраняются животные и растения, но и проводятся экскурсии
Охраняются некоторые виды растений и животных, постепенно исчезающие с лица земли
Вся природа, живая и неживая, находится под строгой охраной
Обведи номер верного ответа.
Что НЕ относится к причинам исчезновения животных в природе? Обведи номер верного ответа.
Охота
Рыбная ловля
Загрязнение водоемов
Посадка деревьев
Отметь то, чего нельзя делать при пожаре в твоей квартире
Вызвать по телефону пожарных
Набросить на огонь одеяло
Прятаться в укромном месте
Дышать через мокрое полотенце
Увидев в общественном транспорте оставленные без присмотра вещи, надо что сделать? Обведи номер верного ответа.
Отнести вещи водителю
Выбросить вещи на улицу
Сказать об этом водителю
Достать и рассмотреть вещи
Запиши, как называется промежуток времени, в течение которого Земля делает полный оборот вокруг Солнца.
1. Запиши, как называется промежуток времени, в течение которого Земля делает полный оборот вокруг Солнца.
Ответ:
2. Как называется форма земной поверхности в виде небольшой возвышенности с пологими склонами, которая встречается на равнинах?
Ответ:
3. Какой газ растения выделяют при дыхании? Обведи номер верного ответа.
1) Природный газ 3) Кислород
2) Углекислый газ 4) Азот
4. Какое из растений используют для производства ткани? Обведи номер верного ответа.
1) Ясень 3) Лён
2) Пихта 4) Просо
5. Какое явление в жизни травянистых растений можно наблюдать осенью? Обведи номер верного ответа.
1) Распускание почек
2) Красивое цветение
3) Бурный рост и развитие
4) Отмирание надземной части
6. Что из перечисленного относится к природным объектам? Обведи буквы, которыми они обозначены.
A. Колесо автомобиля Г. Нож для рыбы Б. Планета Земля Д. Ягоды рябины
B. Капля воды Е. Зерно риса
7. Выбери из списка водные объекты искусственного происхождения. Обведи буквы, которыми они обозначены.
A. Море Г. Озеро Б. Река Д. Пруд
B. Канал Е. Водохранилище
8. Выбери из списка все вещества, которые растворяются в воде. Обведи буквы, которыми они обозначены.
A. Сахар Г. Железная руда Б. Мел Д. Поваренная соль
B. Глина Е. Подсолнечное масло
9. Выбери из списка три органа, относящиеся к дыхательной системе человека. Обведи буквы, которыми они обозначены.
A. Трахея Б. Печень
B. Мышцы
Г. Кровеносные сосуды Д. Бронхи К. Сердце Ж. Лёгкие
10. В каких природных зонах обитают животные, перечисленные в первом столбце?
Животные
A. Тюлень Б. Дрофа
B. Кайра Г. Суслик
Природные зоны
1) Зона степей
2) Зона арктических пустынь
Запиши в таблицу цифры выбранных ответов под соответствующими буквами.
11. Приведи примеры названий трёх планет Солнечной системы.
12. Приведи примеры трёх видов осадков.
13. Определи, какому дереву принадлежат листья и плоды на рисунке. Обведи номер верного ответа.
1) Берёза 3) Клён
2) Осина 4) Вяз
14. На рисунке изображена детская песочница с игрушками. Крыша «грибка» песочницы изготовлена из металла. Она отмечена на рисунке стрелкой с подписью. Укажи стрелкой предмет, который может быть изготовлен из древесины, и предмет из пластмассы. Подпиши название материала возле каждой стрелки.
15. Во время прогулки ребята увидели разных птиц. Какие птицы изображены на рисунках?
16. Перед тобой фотографии двух природных сообществ. Подпиши их названия.
17. Прочитай текст.
Это крупное животное обитает в лесах. Его рост превышает 2 метра, а масса может достигать 600 килограммов. Кормится он разнообразной растительной пищей. Рога животного, которые есть только у самцов, имеют плоскую часть.
О каком животном идёт речь в тексте? Запиши его название.
Ответ:___
18*. Заполни таблицу. Напиши название группы животных по набору свойственных ей признаков.
Вариант 7 » Незнайка — ЕГЭ, ОГЭ, ВПР 2021 и Итоговое сочинение
9.1. Определи, в каком веке произошло это событие. Отметь его дату на «ленте времени». Запиши в строке ответа.
Особенно известен в истории Руси князь Владимир Святославович. При нём произошло важное событие — крещение Руси. В 988 году князь и его приближённые приняли христианство. Так оно стало основной религией на Руси и постепенно распространилось по всей её территории.
9.2. Представь, что тебе поручили подготовить сообщение о князе Владимире. Каким источником информации ты воспользуешься? Отметь и запиши номер правильного ответа.
1) Альманах «Крещение Руси».
2) Справочник «Происхождение имён».
3) Биография Владимира Ленина.
4) Энциклопедия «Откуда есть пошла русская земля».
9.3. Проанализируй фрагмент исторического документа. Определи, какие события здесь описаны: реальные или вымышленные. Напиши.
Ослабла Русь под тяжестью ига. В разорении и пожарах стояли города русские. Полегли многие воины, и жёны их, и дети от набегов монгольских. Казалось, что вся земля русская пропитана слезами и кровью. Но постепенно в дремучем лесном краю, в Москве, собирала Русь свои силы.
Медленно, мучительно складывались разные княжества в единое государство. Много поражений потерпела Русь за эти годы. Но были и победы.
В 1380 году произошла великая битва на Куликовом поле. Здесь, на Дону, впервые русские дружины одержали победу над монгольскими полчищами. Князь Дмитрий Иванович, впоследствии получивший прозвище Донской, привел на бой с войском монгольского хана Мамая сотни тысяч воинов.
Страшную цену заплатила Русь за победу в этой битве. Многие русичи навсегда остались лежать на Куликовом поле. Но и радость была великая. Увидели люди русские, что, собравшись вместе, могут они одолеть и непобедимую монгольскую орду.
9.4. На основании текста ответь письменно на вопросы:
1) От чего страдали жители Руси в XIV веке?
2) Верно ли, что Русь всегда терпела поражения в XIV веке?
3) Какое событие произошло на Куликовом поле?
4) Кто возглавлял русские войска?
5) Кто возглавлял монгольские полчища?
Минеральные вещества | Tervisliku toitumise informatsioon
В человеческом организме установлено наличие более 70 химических элементов. Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Встречающиеся в организме минеральные вещества можно условно разделить на две группы:
- Содержание макроэлементов в организме составляет более 0,01%. Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
- Содержание микроэлементов – менее 0,01%, у некоторых даже 0,00001.
Потребность в некоторых микроэлементах установлена, это железо (Fe), цинк (Zn), медь (Cu), йод (I), селен (Se) , марганец (Mn), молибден (Mo), фтор (F), хром (Cr), кобальт (Co), кремний (Si), ванадий (V), бор (B), никель (Ni), мышьяк (As) и олово (Sn).
Помимо них в организме обнаружен целый ряд элементов, функция которых пока не ясна, их появление в организме может быть обусловлено загрязнением окружающей среды и частым соприкосновением с ними. Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
В организм могут попадать и тяжелые, т.е. ядовитые металлы, такие как кадмий (Cd), ртуть (Hg) или свинец (Pb).
Минеральные вещества в нашем организме являются важными компонентами скелета, биологических жидкостей и энзимов и способствуют передаче нервных импульсов.
Люди и животные получают различные биологические элементы из пищи, воды и окружающего воздуха, самостоятельно синтезировать минеральные вещества живые организмы не могут. В растениях минеральные вещества накапливаются из почвы, и их количество зависит от места произрастания и наличия удобрений. В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
Несмотря на то, что человек нуждается в небольших количествах минеральных веществ (макроэлементов в миллиграммах и граммах, микроэлементов – в милли- и микрограммах), в его организме, тем не менее, отсутствуют достаточные запасы минеральных веществ, чтобы нормально перенести их долговременный дефицит. Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Чрезмерные количества минеральных веществ могут привести к сбоям в работе организма, потому что, будучи компонентами биоактивных соединений, они оказывают влияние на регуляторные функции. Получать чрезмерные количества минеральных веществ (за исключением натрия) с пищей практически невозможно, однако это может произойти при чрезмерном употреблении биологически активных добавок и обогащенных минеральными веществами продуктов.
Усвоению минеральных веществ могут препятствовать:
- злоупотребление кофе,
- употребление алкоголя,
- курение,
- некоторые лекарства,
- некоторые противозачаточные таблетки,
- определенные вещества, встречающиеся в некоторых продуктах, например, в ревене и шпинате.
Потери минеральных веществ при тепловой обработке продуктов питания значительно меньше, чем потери витаминов. Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Таблица 1
Названия и источники важнейших минеральных веществ
Обозначение | Название | Лучшие источники * |
Макроэлементы | ||
Na | натрий | поваренная соль (NaCl), готовая еда, сыр, ржаной хлеб, консервы, мясные продукты, оливки, картофельные чипсы |
K | калий | растительные продукты: сушеные фрукты и ягоды, орехи, семена, топинамбур, картофель, редис, капуста, зеленые овощи, мука «Кама», свёкла, банан, ржаной хлеб, смородина, томаты |
Ca | кальций | молоко и молочные продукты (особенно сыр), миндаль, орехи, семена, рыба (с костями), шпинат |
Mg | магний | орехи, семена, мука «Кама», ржаной хлеб, шпинат, бобовые, греча, цельнозерновые продукты, свинина, говядина и курятина, банан, брокколи |
P | фосфор | семена, орехи, молочные продукты (особенно сыр), печень, птица, говядина, ржаной хлеб, рыба, цельнозерновые продукты, бобовые |
S | сера | продукты с белками, содержащими аминокислоты метионин (зерновые, орехи) и цистеин (мясо, рыба, соевые бобы, зерновые) |
Cl | хлор | поваренная соль |
Микроэлементы | ||
Fe | железо | печень, кровяная колбаса, семечки, яйца, изюм, ржаной хлеб, нежирная говядина и свинина, цельнозерновые продукты, греча, клубника |
Zn | цинк | печень, мясо, мука «Кама», семена, орехи, сыр, ржаной хлеб, бобовые, дары моря (крабы, салака), цельнозерновые продукты, яйца |
Cu | медь | печень, какао-порошок, мясо, бобовые, цельнозерновые продукты, семена, орехи, греча, ржаной хлеб, лосось, авокадо, свёкла, дары моря |
I | йод | йодированная соль, рыба и другие дары моря, сыр, яйца, некоторые виды ржаного хлеба и йогурта |
Se | селен | арахис, печень, рыба и дары моря, семена подсолнечника, мясо |
* Количество, содержащееся в 100 г продукта, покрывает не менее 10% суточной потребности взрослой женщины
Таблица 2
Рекомендуемые в зависимости от возраста суточные нормы потребления важнейших минеральных веществ
Возраст | Натрий, мг | Кальций, мг | Калий, г | Магний, мг | Железо, мг | Цинк, мг | Медь, мг | Йод, мкг | Селен, мкг |
Дети |
|
|
|
|
|
|
|
|
|
6–11 месяцев | до 650 | 550 | 1,1 | 80 | 8 | 5 | 0,3 | 60 | 15 |
12–23 месяца | до 830 | 600 | 1,4 | 85 | 8 | 6 | 0,3 | 90 | 25 |
2–5 лет | до 1580 | 600 | 1,8 | 120 | 8 | 6 | 0,4 | 90 | 30 |
6–9 лет | до 1580 | 700 | 2 | 200 | 9 | 7 | 0,5 | 120 | 30 |
Женщины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 2,9 | 300 | 11 | 8 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
18–30 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
31–60 лет | до 2400 | 800 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
61–74 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
> 75 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
Беременные | до 2400 | 900 | 3,1 | 360 | 15 | 10 | 1 | 175 | 60 |
Кормящие матери | до 2400 | 900 | 3,1 | 360 | 15 | 11 | 1,3 | 200 | 60 |
Мужчины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 3,3 | 300 | 11 | 11 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,5 | 380 | 11 | 12 | 0,9 | 150 | 60 |
18–30 лет | до 2400 | 900 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
31–60 лет | до 2400 | 800 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
61–74 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
> 75 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
* Для 18–20-летних рекомендуемая суточная доза составляет 900 мг кальция и 700 мг фосфора.
** Потребность в железе зависит от потери железа при менструациях. Для женщин в постменопаузе рекомендуемая дневная доза железа составляет 10 мг.
*** Для достижения сбалансированного содержания железа во время беременности в организме женщины должны иметься запасы железа как минимум на 500 мг больше, чем до беременности. В двух последних триместрах беременности, в зависимости от уровня железа в организме, может потребоваться дополнительный прием железа.
**** На самом деле, селена можно потреблять больше указанной в таблице рекомендованной дозы, поскольку селен по-разному всасывается из разных источников и происходит постоянное обеднение им поверхности, т.е. таблицы питательной ценности продуктов «не поспевают» за истинным положением дел (в них зачастую указываются значения больше реальных).
Максимальные разовые безопасные дозы минеральных веществ и пищевых добавок:
| Минеральное вещество | Доза |
|---|---|
| Кальций (мг) | 2500 |
| Фосфор (мг) | 3000 |
| Калий (мг) | 3,7* |
| Железо (мг) | 60 |
| Цинк (мг) | 25 |
| Медь (мг) | 5 |
| Йод (мкг) | 600 |
| Селен (мкг) | 300 |
* Только из биоактивных добавок или обогащенной пищи
13.3: Растворы твердых веществ, растворенных в воде: как приготовить леденцы
Цели обучения
- Определить электролиты и неэлектролиты
- Объясните, почему возникают решения.
- Обсудите идею воды как «универсального растворителя».
- Объясните, как молекулы воды притягивают твердые ионные частицы при растворении в воде.
Мы узнали, что растворы могут быть образованы во множестве комбинаций с использованием твердых тел, жидкостей и газов.Мы также знаем, что растворы имеют постоянный состав, и мы также можем варьировать этот состав до определенной степени, чтобы поддерживать гомогенный характер раствора. Но как именно образуются решения? Почему масло и вода не образуют раствор, а уксус и вода образуются? Почему можно растворить поваренную соль в воде, а не в растительном масле? В этом разделе будут рассмотрены причины, по которым образуются растворы, наряду с обсуждением того, почему вода чаще всего используется для растворения веществ различных типов.
Растворимость и насыщение
Поваренная соль \ (\ left (\ ce {NaCl} \ right) \) легко растворяется в воде. В большинстве случаев только определенное максимальное количество растворенного вещества может быть растворено в данном количестве растворителя. Это максимальное количество называется растворимостью растворенного вещества. Обычно выражается в количестве растворенного вещества, которое может раствориться в 100 г растворителя при данной температуре. В таблице \ (\ PageIndex {1} \) перечислены растворимости некоторых простых ионных соединений.Эти растворимости широко варьируются: NaCl может растворять до 31,6 г на 100 г H 2 O, в то время как AgCl может растворять только 0,00019 г на 100 г H 2 O.
| Растворенное вещество | Растворимость (г на 100 г H 2 O при 25 ° C) |
|---|---|
| AgCl | 0,00019 |
| CaCO 3 | 0.0006 |
| KBr | 70,7 |
| NaCl | 36,1 |
| NaNO 3 | 94,6 |
Когда максимальное количество растворенного вещества было растворено в данном количестве растворителя, мы говорим, что раствор насыщен растворенным веществом. Когда в данном количестве растворенного вещества растворено меньше максимального количества растворенного вещества, раствор является ненасыщенным .Эти термины также являются качественными, поскольку каждое растворенное вещество имеет свою растворимость. Раствор 0,00019 г AgCl на 100 г H 2 O может быть насыщенным, но при таком небольшом растворенном растворе он также является довольно разбавленным. Раствор 36,1 г NaCl в 100 г H 2 O также является насыщенным, но довольно концентрированным. В некоторых случаях можно растворить в растворе больше, чем максимальное количество растворенного вещества. Обычно это происходит путем нагревания растворителя, растворения большего количества растворенного вещества, чем обычно растворяется при обычных температурах, и позволяя раствору медленно и осторожно остыть.Такие растворы называются пересыщенными растворами и не являются стабильными; при наличии возможности (например, при падении кристалла растворенного вещества в раствор) избыток растворенного вещества выпадет в осадок из раствора. На рисунке ниже показан описанный выше процесс и показано различие между ненасыщенными и насыщенными.
Рисунок \ (\ PageIndex {1} \): Когда \ (30.0 \: \ text {g} \) из \ (\ ce {NaCl} \) добавляется в \ (100 \: \ text {mL} \), все это растворяется, образуя ненасыщенный раствор. Когда добавляется \ (40.0 \: \ text {g} \), \ (36.0 \: \ text {g} \) растворяется, а \ (4.0 \: \ text {g} \) остается нерастворенным, образуя насыщенный раствор.
Как определить насыщенный или ненасыщенный раствор? Если добавлено больше растворенного вещества, и оно не растворяется, значит исходный раствор был насыщенным. Если добавленное растворенное вещество растворяется, то исходный раствор был ненасыщенным. Раствор, которому позволили достичь равновесия, но который имеет дополнительные нерастворенные растворенные вещества на дне контейнера, должен быть насыщенным.
Растворы электролитов: растворенные ионные твердые частицы
Когда некоторые вещества растворяются в воде, они претерпевают физические или химические изменения, в результате которых образуются ионы в растворе.Эти вещества составляют важный класс соединений, называемых электролитами и . Вещества, не выделяющие ионы при растворении, называются неэлектролитами . Если физический или химический процесс, в результате которого образуются ионы, практически на 100% эффективен (все растворенное соединение дает ионы), то это вещество известно как сильный электролит (хороший проводник). Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, это называется слабым электролитом (также не проводящим электричество).
Вещества могут быть определены как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество. Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомо проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается с увеличением концентрации ионов.Подача напряжения на электроды, погруженные в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя электрический ток, либо качественно, наблюдая за яркостью лампочки, включенной в цепь (Рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \): Растворы неэлектролитов, таких как этанол, не содержат растворенных ионов и не могут проводить электричество. Растворы электролитов содержат ионы, которые пропускают электричество.Электропроводность раствора электролита зависит от прочности электролита.
Вода и другие полярные молекулы притягиваются к ионам, как показано на рисунке \ (\ PageIndex {2} \). Электростатическое притяжение между ионом и молекулой с диполем называется ионно-дипольным притяжением. Эти аттракционы играют важную роль в растворении ионных соединений в воде.
Рисунок \ (\ PageIndex {2} \): Когда хлорид калия (KCl) растворяется в воде, ионы гидратируются. Полярные молекулы воды притягиваются зарядами на ионах K + и Cl — .Молекулы воды перед ионами и за ними не показаны.
Когда ионные соединения растворяются в воде, ионы в твердом веществе разделяются и равномерно диспергируются по всему раствору, поскольку молекулы воды окружают и сольватируют ионы, уменьшая сильные электростатические силы между ними. Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве условий ионные соединения при растворении почти полностью диссоциируют, поэтому они классифицируются как сильные электролиты.
Пример \ (\ PageIndex {1} \): идентификация ионных соединений
Какие соединения растворяются в растворе и разделяются на ионы?
- \ (\ ce {LiF} \)
- \ (\ ce {P_2F_5} \)
- \ (\ ce {C_2H_5OH} \)
Решение
\ (\ ce {LiF} \) при растворении в растворе разделяется на ионы, потому что это ионное соединение. \ (\ ce {P_2F_5} \) и \ (\ ce {C_2H_5OH} \) оба ковалентны и останутся в виде молекул в растворе.
Упражнение \ (\ PageIndex {1} \)
Какие соединения растворяются в растворе и разделяются на ионы?
- C 6 H 12 O 11 , глюкоза
- CCl 4
- CaCl 2
- AgNO 3
- Ответ:
- c&d
Как температура влияет на растворимость
Растворимость вещества — это количество этого вещества, которое требуется для образования насыщенного раствора в данном количестве растворителя при указанной температуре.\ text {o} \ text {C} \). Температура должна быть указана, поскольку растворимость зависит от температуры. Для газов также необходимо указать давление. Растворимость зависит от конкретного растворителя. Будем рассматривать растворимость материала в воде как растворителе.
Растворимость большинства твердых веществ увеличивается с повышением температуры. Однако эффект трудно предсказать, и он сильно варьируется от одного растворенного вещества к другому. Температурную зависимость растворимости можно визуализировать с помощью кривой растворимости , графика зависимости растворимости оттемпература (Рисунок \ (\ PageIndex {4} \)).
Рисунок \ (\ PageIndex {4} \): Кривые растворимости для некоторых соединений.
Обратите внимание на то, что температурная зависимость \ (\ ce {NaCl} \) довольно плоская, а это означает, что повышение температуры относительно мало влияет на растворимость \ (\ ce {NaCl} \). Кривая для \ (\ ce {KNO_3} \), с другой стороны, очень крутая, и поэтому повышение температуры резко увеличивает растворимость \ (\ ce {KNO_3} \).
Некоторые вещества — \ (\ ce {HCl} \), \ (\ ce {NH_3} \) и \ (\ ce {SO_2} \) — обладают растворимостью, которая уменьшается с повышением температуры.Все это газы при стандартном давлении. Когда растворитель с растворенным в нем газом нагревается, кинетическая энергия как растворителя, так и растворенного вещества увеличивается. По мере увеличения кинетической энергии газообразного растворенного вещества его молекулы имеют большую тенденцию избегать притяжения молекул растворителя и возвращаться в газовую фазу. Следовательно, растворимость газа уменьшается с повышением температуры.
Кривые растворимости могут использоваться, чтобы определить, является ли данный раствор насыщенным или ненасыщенным.\ text {o} \ text {C} \) примерно \ (14 \: \ text {g} \), что означает, что \ (80 — 14 = 66 \: \ text {g} \) из \ (\ ce {KNO_3} \) перекристаллизовывается.
Сводка
- Растворимость — это определенное количество растворенного вещества, которое может растворяться в данном количестве растворителя.
- Определены насыщенные и ненасыщенные растворы.
- Ионные соединения растворяются в полярных растворителях, особенно в воде. Это происходит, когда положительный катион из ионного твердого вещества притягивается к отрицательному концу молекулы воды (кислород), а отрицательный анион ионного твердого вещества притягивается к положительному концу молекулы воды (водород).
- Вода считается универсальным растворителем, поскольку она может растворять как ионные, так и полярные растворенные вещества, а также некоторые неполярные растворенные вещества (в очень ограниченных количествах).
- Растворимость твердого вещества в воде увеличивается с повышением температуры.
Словарь
- Смешиваемый: жидкости, обладающие способностью растворяться друг в друге.
- Несмешиваемый: жидкости, не способные растворяться друг в друге.
- Электростатическое притяжение: притяжение противоположно заряженных частиц.
Авторы и авторство
Вода, универсальный растворитель
• Школа наук о воде ГЛАВНАЯ • Свойства воды •
Знаете ли вы, что можно растворить M в M&M? Все, что вам нужно сделать, p , кроме нескольких M & M в воде стороной M вверх и наблюдать, что происходит!
Кредит: coffeecupsandcrayons.com
Воду называют «универсальным растворителем», потому что она способна растворять больше веществ, чем любая другая жидкость.Это важно для каждого живого существа на земле. Это означает, что куда бы вода ни попадала — по воздуху, земле или через наши тела, она уносит с собой ценные химические вещества, минералы и питательные вещества.
Химический состав и физические свойства воды делают ее таким прекрасным растворителем. Молекулы воды имеют полярное расположение атомов кислорода и водорода: одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды притягиваться ко многим другим типам молекул .Вода может настолько сильно притягиваться к другому соединению, как соль (NaCl), что может нарушить силы притяжения, которые удерживают натрий и хлорид в соединении соли вместе, и, таким образом, растворяют его.
Наши почки и вода составляют отличную пару
Наши собственные почки и растворяющие свойства воды составляют отличную пару для сохранения жизни и здоровья. Почки отвечают за фильтрацию веществ, которые попадают в наш организм из продуктов и напитков, которые мы потребляем.Но почки должны избавляться от этих веществ после того, как они накапливают их. Вот тут-то и помогает вода; будучи таким прекрасным растворителем, вода, промывающая почки, растворяет эти вещества и выводит их из нашего тела.
На этой диаграмме показаны положительные и отрицательные части молекулы воды. Он также показывает, как заряд, например, на ионе (например, Na или Cl), может взаимодействовать с молекулой воды.
Кредит: Мариана Руис Вильярреал, Фонд CK-12
Почему соль растворяется в воде
На молекулярном уровне соль растворяется в воде из-за электрических зарядов и из-за того, что и вода, и солевые соединения полярны, с положительными и отрицательными зарядами на противоположных сторонах молекулы.Связи в солевых соединениях называются ионными, потому что они оба имеют электрический заряд — ион хлорида заряжен отрицательно, а ион натрия — положительно. Точно так же молекула воды имеет ионную природу, но связь называется ковалентной, когда два атома водорода располагаются с положительным зарядом на одной стороне атома кислорода, который имеет отрицательный заряд. Когда соль смешивается с водой, она растворяется, потому что ковалентные связи воды сильнее, чем ионные связи в молекулах соли.
Положительно заряженная сторона молекул воды притягивается к отрицательно заряженным ионам хлорида, а отрицательно заряженная сторона молекул воды притягивается к положительно заряженным ионам натрия. По сути, происходит перетягивание каната, когда молекулы воды выигрывают матч. Молекулы воды разъединяют ионы натрия и хлора, разрывая ионную связь, удерживающую их вместе. После разделения солевых соединений атомы натрия и хлора окружаются молекулами воды, как показано на этой диаграмме.Как только это происходит, соль растворяется, в результате чего получается гомогенный раствор.
Химия раствора | Grandinetti Group
Ранее мы узнали, что однородная смесь двух и более веществ называется раствором. Если одно из веществ присутствует в гораздо больших количествах, чем все другие вещества, то его называют растворителем . Другие вещества в растворе известны как растворенные вещества . Например, когда небольшое количество NH 4 Cl растворяется в большом количестве воды, мы называем воду растворителем, а NH 4 Cl — растворенным веществом.Другой пример — нафталин (используемый в нафталиновых шариках) может быть растворен в бензоле. В этом примере бензол является растворителем, а нафталин — растворенным веществом.
Растворенные вещества, растворенные в воде (растворителе), называются водными растворами. Не все вещества растворимы в воде. Почему одни вещества растворяются в воде, а другие — нет? Это связано со структурой молекулы воды.
Кислород имеет большее притяжение для электронов, поэтому общие электроны (связывающие электроны) проводят больше времени рядом с кислородом, чем с любым из атомов водорода.Это дает кислороду немного избыточный отрицательный заряд, а водороду — немного более положительный заряд.
Это неравномерное распределение заряда делает воду полярной молекулой и дает воде способность растворять соединения. Когда твердое ионное вещество растворяется в воде, положительные концы молекулы воды притягиваются к отрицательно заряженным анионам, а отрицательные концы молекулы воды притягиваются к положительно заряженным катионам. Например, когда NaCl растворяется в воде, мы находим
Итак, когда ионное вещество (соль) растворяется в воде, оно распадается на отдельные катионы и анионы, окруженные молекулами воды.Например, когда NH 4 NO 3 растворяется в воде, он распадается на отдельные ионы.
NH 4 + и NO 3 — ионы плавают в H 2 O по существу независимо друг от друга.
Вода также растворяет неионные вещества. Например, C 2 H 5 OH (этанол) очень растворим в H 2 O. Это связано с тем, что C 2 H 5 OH имеет полярную связь OH, которую молекулы воды любят поддерживать. .
Многие вещества не растворяются в воде, потому что они неполярны и плохо взаимодействуют с молекулами воды. Типичный пример — масло и вода. Масло содержит неполярные молекулы, поэтому они не растворяются в воде.
Откуда мы знаем, что ионные твердые частицы растворяются в воде и образуют катионы и анионы, которые плавают отдельно? Ключ к разгадке дает эксперименты с проводимостью. Анионы и катионы должны действовать как носители заряда в растворе. Следовательно, раствор с растворенными ионами должен проводить электричество.Давайте посмотрим на несколько примеров. Чистая (дистиллированная) вода не содержит растворенных ионов. Следовательно, чистая вода не будет проводить электричество. В простом эксперименте с проводимостью, показанном ниже, мы не ожидаем, что свет будет гореть.
Однако водный раствор NaCl будет содержать растворенные ионы и, следовательно, проводить электричество. Поэтому свет в нашем эксперименте с проводимостью будет включаться, если его окунуть в водный раствор NaCl.
NaCl полностью ионизируется при растворении в воде.Полезно представить себе этот процесс как два шага:
Вещества, которые находятся в растворе почти полностью в виде ионов, называются сильными электролитами .
Вещества, которые не образуют ионы при растворении в воде, называются неэлектролитами . И примером неэлектролита является сахар. Сахар легко растворяется в воде, но не образует в растворе катионов и анионов. То есть не образуются носители заряда.
Вещества, которые только частично ионизируются в ионы при растворении в воде, называются слабыми электролитами .Например, уксусная кислота (HC 2 H 3 O 2 ) растворяется в воде, но лишь частично диссоциирует на ионы.
Будьте осторожны, чтобы не перепутать степень растворимости вещества в воде с тем, является ли оно слабым, сильным или неэлектролитным. Например, сахар полностью растворяется в воде, но это неэлектролит . Другим примером являются соли, которые могут быть очень нерастворимыми в воде, но небольшое количество соли, которая действительно растворяется в воде, представляет собой сильный электролит .
Домашнее задание от
Chemisty, The Central Science, 10-е изд.
4.1, 4.3, 4.5, 4.7, 4.9, 4.11, 4.13, 4.15, 4.17, 4.33, 4.35, 4.37,
Свойства растворителя воды | Введение в химию
Цель обучения
- Объясните, почему некоторые молекулы не растворяются в воде.
Ключевые моменты
- Вода диссоциирует соли путем разделения катионов и анионов и образования новых взаимодействий между водой и ионами.
- Вода растворяет многие биомолекулы, поскольку они полярны и, следовательно, гидрофильны.
Условия
- диссоциация Процесс, при котором соединение или сложное тело распадается на более простые составляющие, такие как атомы или ионы, обычно обратимо.
- гидратная оболочка — термин, используемый для сольватационной оболочки (структуры, состоящей из химического вещества, которое действует как растворитель и окружает растворенные вещества) с водным растворителем; также называется сферой гидратации.
Примеры
- Сахар, хлорид натрия и гидрофильные белки — это вещества, растворяющиеся в воде.
- Масла, жиры и некоторые органические растворители не растворяются в воде, поскольку они гидрофобны.
Свойства растворителя воды
Вода, которая не только растворяет многие соединения, но и растворяет больше веществ, чем любая другая жидкость, считается универсальным растворителем. Полярная молекула с частично положительными и отрицательными зарядами, она легко растворяет ионы и полярные молекулы.Поэтому воду называют растворителем: веществом, способным растворять другие полярные молекулы и ионные соединения. Связанные с этими молекулами заряды образуют водородные связи с водой, окружая частицу молекулами воды. Это называется сферой гидратации или гидратной оболочкой, и она служит для разделения или диспергирования частиц в воде.
Когда ионные соединения добавляются к воде, отдельные ионы взаимодействуют с полярными областями молекул воды в процессе диссоциации, разрывая их ионные связи.Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl или хлорид натрия): когда кристаллы NaCl добавляются в воду, молекулы NaCl диссоциируют на ионы Na + и Cl —, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды; отрицательно заряженный хлорид-ион окружен частично положительным зарядом водорода в молекуле воды.
Диссоциация NaCl в воде Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.
Поскольку многие биомолекулы полярны или заряжены, вода легко растворяет эти гидрофильные соединения. Однако вода является плохим растворителем для гидрофобных молекул, таких как липиды. Неполярные молекулы испытывают гидрофобные взаимодействия в воде: вода меняет структуру водородных связей вокруг гидрофобных молекул, образуя решетчатую структуру, называемую клатратом.Это изменение в структуре водородных связей водного растворителя приводит к значительному снижению общей энтропии системы, поскольку молекулы становятся более упорядоченными, чем в жидкой воде. С термодинамической точки зрения такое сильное снижение энтропии не является спонтанным, и гидрофобная молекула не растворяется.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Растворимость | Введение в химию
Цель обучения
- Распознавать различные ионы, которые заставляют соль обычно быть растворимой / нерастворимой в воде.
Ключевые моменты
- Растворимость — это относительная способность растворенного вещества растворяться в растворителе.
- Несколько факторов влияют на растворимость данного растворенного вещества в данном растворителе. Температура часто играет самую большую роль, хотя давление может иметь значительное влияние на газы.
- Чтобы предсказать, будет ли соединение растворимо в данном растворителе, запомните поговорку: «Подобное растворяется в подобном». Высокополярные ионные соединения, такие как соль, легко растворяются в полярной воде, но не растворяются в неполярных растворах, таких как бензол или хлороформ.
Условия
- растворенное вещество: соединение, растворяющееся в растворе (может быть твердым, жидким или газообразным)
- растворимость: относительная способность растворенного вещества растворяться в растворителе
- растворитель: соединение (обычно жидкость), растворяющее растворенное вещество
.
.
.
Определение растворимости
Растворимость — это способность твердого, жидкого или газообразного химического вещества (называемого растворенным веществом ) растворяться в растворителе (обычно в жидкости) и образовывать раствор .Растворимость вещества в основном зависит от используемого растворителя, а также от температуры и давления. Растворимость вещества в конкретном растворителе измеряется концентрацией насыщенного раствора. Раствор считается насыщенным, если добавление дополнительного растворенного вещества больше не увеличивает концентрацию раствора.
Степень растворимости широко варьируется в зависимости от веществ, от бесконечно растворимых (полностью смешиваемых), таких как этанол в воде, до плохо растворимых, таких как хлорид серебра в воде.Термин «нерастворимый» часто применяется к плохо растворимым соединениям. При определенных условиях равновесная растворимость может быть превышена, давая перенасыщенный раствор.
Растворимость не зависит от размера частиц; по прошествии достаточного времени даже крупные частицы со временем растворятся.
Факторы, влияющие на растворимость
Температура
Растворимость данного растворенного вещества в данном растворителе обычно зависит от температуры. Для многих твердых веществ, растворенных в жидкой воде, растворимость имеет тенденцию соответствовать повышению температуры.По мере того, как молекулы воды нагреваются, они начинают вибрировать быстрее и лучше взаимодействуют с растворенным веществом и разрушают его.
Зависимость растворимости различных веществ от изменения температуры Растворимость большинства веществ увеличивается с температурой; например, в горячей воде растворяется больше сахара, чем в холодной.
Растворимость газов показывает обратную зависимость от температуры; то есть при повышении температуры растворимость газа имеет тенденцию к снижению. В диаграмме растворимости vs.Обратите внимание на то, что растворимость имеет тенденцию увеличиваться с увеличением температуры солей и уменьшаться с увеличением температуры газов.
Давление
Давление незначительно влияет на растворимость твердых и жидких растворенных веществ, но сильно влияет на растворы с газообразными растворенными веществами. Это становится очевидным каждый раз, когда вы открываете банку с газировкой; Шипение из банки происходит из-за того, что ее содержимое находится под давлением, что гарантирует, что сода останется газированной (то есть углекислый газ остается растворенным в растворе).Вывод из этого состоит в том, что растворимость газов имеет тенденцию коррелировать с увеличением давления.
Полярность
Популярная поговорка, используемая для предсказания растворимости: «Подобное растворяется в подобном». Это утверждение указывает на то, что растворенное вещество лучше всего растворяется в растворителе, имеющем аналогичную химическую структуру; способность растворителя растворять различные соединения зависит в первую очередь от его полярности. Например, полярное растворенное вещество, такое как сахар, хорошо растворяется в полярной воде, менее растворяется в умеренно полярном метаноле и практически не растворяется в неполярных растворителях, таких как бензол.Напротив, неполярное растворенное вещество, такое как нафталин, нерастворимо в воде, умеренно растворимо в метаноле и хорошо растворимо в бензоле.
График растворимости
График растворимости показывает растворимость многих солей. Соли щелочных металлов (и аммония), а также соли нитрата и ацетата всегда растворимы. Карбонаты, гидроксиды, сульфаты, фосфаты и соли тяжелых металлов часто нерастворимы.
График растворимости Растворимость солей, образованных из катионов слева и анионов вверху, обозначается как: растворимые (S), нерастворимые (I) или малорастворимые (sS). Растворимость Растворимость растворенных солей и газов в жидком растворителе.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
веществ, которые не растворяются в воде
Вода — это растворитель, то есть жидкость, которая растворяет вещества. Любое растворяющееся вещество называется растворенным веществом, а смесь, образованная, когда растворитель и растворенное вещество полностью объединяются и не разделяются, называется раствором.Вода может быть известна как «универсальный растворитель», потому что она растворяет больше веществ, чем любая другая жидкость, но некоторые вещества никогда не растворяются в воде.
TL; DR (слишком долго; не читал)
Многие вещества не растворяются в воде, в том числе масло, парафин и песок. Вещества, которые растворяются в воде, больше не растворяются, когда достигают точки насыщения.
Относительная сила сил притяжения
Растворяется ли вещество в растворителе — будь то вода или что-то еще — зависит от силы их сил притяжения, то есть силы притяжения между частицами растворенного вещества, силы притяжение между частицами растворителя и силы между частицами растворенного вещества и частицами растворителя.Например, глюкоза, основная форма сахара, растворяется в воде, потому что сила притяжения между водой и глюкозой сильнее силы притяжения между водой и водой или силы притяжения между глюкозой и глюкозой.
Плотность и растворение
Когда две жидкости объединяются в раствор, их называют «смешивающимися». Если их нельзя объединить, их называют «несмешивающимися». Одним из примеров этого является масло (состоящее из водорода и углерода) и вода, что является основой пословицы: «Нефть и вода не смешиваются.«Если вы попытаетесь смешать воду и масло, масло всегда всплывет вверх, потому что оно плотнее воды, и эти масляные капли никогда не растворятся в воде.
Полярные молекулы
Молекулы воды полярны, что означает, что атомы расположены так что положительный заряд находится на одной стороне молекулы, а отрицательный — на другой. Полярные молекулы больше притягиваются к молекулам, которые также полярны или имеют заряд, например ион. Если что-то с неполярным молекулы помещены в воду, она не растворяется.Это объясняет химическое правило «подобное растворяется в подобном». Прекрасный пример этого — парафиновый воск и вода. Если вы поместите в воду кусок парафинового воска, который состоит из множества углеродных и водородных связей, он останется в виде комка. Даже если вы раздавите воск на мелкие кусочки и перемешаете его в воде, он все равно не растворится. Это потому, что вода полярна, а воск неполярен.
Растворение, разрушение и суспендирование
Растворение, разрушение и суспендирование — это разные реакции на контакт с жидкостью, и их не следует путать.Песок не растворяется в воде, потому что сила притяжения между водой и водой сильнее силы притяжения между водой и молекулами, из которых состоит песок. Если вы добавите песок в воду, вода станет темной и мутной, поскольку песок станет взвешенным в воде, но песок не растворится. Когда вы перестанете помешивать, песок постепенно опустится на дно, оставив чистую воду наверху. Камень, который много лет подвергался воздействию воды, может казаться частично растворенным, но это не так; вместо этого он разрушился.Текущая вода заставляет мелкие частицы стираться с поверхности камня. Эрозия может произойти со многими поверхностями, включая рыхлый верхний слой почвы, грязь и многое другое. Вода переносит эродированный материал в другие водоемы, такие как озера, ручьи и водохранилища, где материал оседает, образуя грязь или осадок.
Насыщение и растворение
Растворенное вещество, которое обычно растворяется в воде, например сахар или соль, не будет продолжать растворяться, когда достигнет точки насыщения. Это когда максимальное количество растворенного вещества было растворено в воде.Раствор находится в равновесии, так как скорость растворения и скорость преобразования твердого растворенного вещества равны. Если вы добавите больше растворенного вещества, концентрация раствора не изменится. Вы просто получите скопление нерастворенного твердого вещества на дне раствора.
Почему вода растворяет соль? | Глава 5: Молекула воды и растворение
Сделайте модель кристалла соли.
Спроецировать изображение Кристалл хлорида натрия.
Напомните учащимся, что зеленые шары представляют отрицательные ионы хлорида, а серые шары — положительные ионы натрия.
Спросите студентов:
- Что такого такого в молекулах воды и ионах в соли, которые могут сделать воду способной растворять соль?
- Положительные и отрицательные полярные концы молекулы воды притягиваются к отрицательным ионам хлора и положительным ионам натрия в соли.
Раздайте каждому учащемуся лист с упражнениями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Вопрос для расследования
Как соль растворяется в воде?
Материалы
- Рабочий лист с ионами натрия, хлорида и молекулами воды
- Строительная бумага, любой цвет
- Ножницы
- Лента или клей
Процедура
Сделать модель кристалла соли
- Вырежьте ионы и молекулы воды.
- Расположите ионы на листе цветной бумаги так, чтобы они изобразили двумерный кристалл соли. Пока не приклеивайте эти части скотчем.
Спроецируйте изображение и попросите учащихся смоделировать, что происходит, когда соль растворяется в воде.
Покажите студентам серию из четырех картинок, которые помогут объяснить процесс растворения соли в воде.
Спроецируйте изображение растворения хлорида натрия в воде.
Укажите, что несколько молекул воды могут расположиться рядом с ионом и помочь удалить его из кристалла. Покажите студентам, что положительная область молекулы воды будет притягиваться к отрицательному иону хлорида и что отрицательная область молекулы воды будет притягиваться к положительному иону натрия.
Смоделируйте, как вода растворяет соль
Посмотрите на картинки, показывающие, как молекулы воды растворяют соль.Затем расположите молекулы воды вокруг ионов натрия и хлора в правильной ориентации. Положительная часть молекул воды должна находиться рядом с отрицательным ионом хлорида. Отрицательная часть молекул воды должна находиться рядом с положительным ионом натрия.
- Перемещайте молекулы воды, а также ионы натрия и хлора, чтобы смоделировать, как вода растворяет соль.
- Прикрепите к бумаге молекулы и ионы, изображающие растворяющую воду соль.
Спроектируйте анимацию «Растворение хлорида натрия в воде».
Укажите, что молекулы воды притягиваются к ионам натрия и хлора кристалла соли. Объясните, что положительная область молекулы воды притягивается отрицательным хлорид-ионом. Вода с отрицательной областью молекулы воды притягивается к положительному иону натрия. Растворение происходит, когда притяжение между молекулами воды и ионами натрия и хлорида преодолевает притяжение ионов друг к другу. Это заставляет ионы отделяться друг от друга и тщательно смешиваться с водой.
Сообщите студентам, что количество вещества, которое может растворяться в жидкости (при определенной температуре), называется растворимостью. Укажите на сходство слов «растворяться» и «растворимость». Также скажите им, что растворенное вещество называется растворенным веществом. Вещество, которое растворяет, называется растворителем.
Попросите учащихся провести эксперимент, чтобы выяснить, лучше ли растворять соль вода или изопропиловый спирт.
Попросите учащихся сделать прогноз:
- Подумайте о полярности молекул воды и молекул спирта. Как вы думаете, алкоголь будет так же хорошо, лучше или хуже, чем вода при растворении соли?
Обсудите, как настроить тест для сравнения того, как вода и спирт растворяют соль. Убедитесь, что учащиеся указали такие переменные, как:
- Количество использованной воды и спирта
- Количество соли, добавленной к каждой жидкости
- Температура каждой жидкости
- Объем перемешивания
Вопрос для расследования
Спирт растворяет соль так же хорошо, лучше или хуже, чем вода?
материалов для каждой группы
- Вода
- Изопропиловый спирт (70% или выше)
- Соль
- Остаток
- 2 прозрачных пластиковых стакана
- 2 маленьких пластиковых стакана
- Градуированный цилиндр
Процедура
- В отдельных чашках отмерьте два образца соли по 5 г каждый.
- Налейте 15 мл воды и спирта в отдельные чашки.
В то же время добавьте воду и спирт к образцам соли.
- Вращайте обе чашки одинаково примерно 20 секунд и проверьте количество растворенной соли.
- Поверните еще 20 секунд и проверьте. Вращайте последние 20 секунд и проверьте.
- Осторожно слейте воду и спирт из чашек и сравните количество нерастворенной соли, оставшейся в каждой чашке.
Ожидаемые результаты
В чашке с водой будет меньше нерастворенной соли, чем спирта. Это означает, что в воде растворено больше соли, чем в спирте.
Обсудите, как разница в полярности спирта и воды объясняет, почему вода растворяет соль лучше, чем спирт.
Подробнее о полярности читайте в разделе «Биография учителя».
Спросите студентов:
- Спирт растворяет соль так же хорошо, лучше или хуже, чем вода?
- Спирт растворяет соль не так хорошо, как вода.
- Откуда ты знаешь?
- В чашке со спиртом осталось больше соли.
- Подумайте о полярности воды и спирта, чтобы объяснить, почему вода растворяет больше соли, чем спирт.
- Попросите учащихся взглянуть на модели молекул воды и спирта на их рабочих листах.
Напомните студентам, что изопропиловый спирт имеет атом кислорода, связанный с атомом водорода, поэтому он имеет некоторую полярность, но не такую большую, как вода. Поскольку вода более полярна, чем спирт, она притягивает положительные ионы натрия и отрицательные ионы хлора лучше, чем спирт. Вот почему вода растворяет больше соли, чем спирт. Другими словами, растворимость соли в воде выше, чем в спирте.
Попросите учащихся сравнить растворимость двух различных ионных веществ в воде.
Сравните растворимость ионных веществ карбоната кальция (CaCO 3 ) и карбоната натрия (Na 2 CO 3 ) в воде.
Спросите студентов:
- Как бы вы могли сравнить растворимость хлорида кальция и карбоната кальция?
- Учащиеся должны предложить отмерить равные количества каждого вещества и добавить равное количество воды при той же температуре.
Вопрос для расследования
Все ли ионные вещества растворяются в воде?
материалов для каждой группы
- Карбонат натрия
- Карбонат кальция
- Вода
- 2 прозрачных пластиковых стакана
- 2 маленьких пластиковых стакана
- Остаток
Процедура
- Этикетка двух прозрачных пластиковых стаканчиков с карбонатом натрия и карбонатом кальция.
- Отмерьте по 2 г карбоната натрия и карбоната кальция и положите их в чашки с этикетками.
- Отмерьте по 15 мл воды в каждую из двух пустых чашек.
Одновременно налейте воду в чашки с карбонатом натрия и карбонатом кальция.
- Осторожно взболтайте обе чашки.
Ожидаемые результаты
Карбонат натрия растворяется, а карбонат кальция — нет.Объясните, что не все твердые частицы с ионной связью растворяются в воде.
Обсудите наблюдения студентов.
Спросите студентов:
- Все ли ионные вещества растворяются в воде? Откуда вы знаете?
- Поскольку карбонат кальция не растворяется в воде, учащиеся должны понимать, что не все ионные вещества растворяются в воде.
Объясните: на молекулярном уровне ионы, составляющие карбонат кальция, так сильно притягиваются друг к другу, что притяжение молекулами воды не может их разлучить.Это хорошо, потому что карбонат кальция — это материал, из которого сделаны морские раковины и птичьи яйца. Фосфат кальция — еще одно твердое ионное вещество, которое не растворяется в воде. Это хорошо еще и тем, что из этого материала сделаны кости и зубы.
Карбонат натрия полностью распадается на ионы, которые объединяются в воде, образуя раствор. Ионы натрия и карбоната не оседают на дно и не могут быть отфильтрованы из воды.
Но карбонат кальция не распадается на ионы. Вместо этого его просто смешивают с водой. Если дать достаточно времени, карбонат кальция осядет на дно или его можно будет отфильтровать из воды. Карбонат натрия, растворенный в воде, является хорошим примером раствора, а нерастворенный карбонат кальция — это смесь, а не раствор.
Примечание: карбонат-ион отличается от одноатомных ионов, таких как натрий (Na + ) и хлорид (Cl — ), которые студенты уже видели.Карбонат-ион (CO 3 2-) состоит из более чем одного атома. Эти типы ионов, называемые многоатомными ионами, состоят из группы ковалентно связанных атомов, действующих как единое целое. Обычно они приобретают или теряют один или несколько электронов и действуют как ион. Другой распространенный многоатомный ион — это сульфат-ион (SO 4 2-). Этот ион является частью соли Эпсома в виде сульфата магния (MgSO 4 ) и многих удобрений в виде сульфата калия (K 2 SO 4 ).Вы можете решить, хотите ли вы познакомить студентов с этими двумя обычными многоатомными ионами.
.

 RbOH
RbOH Zn(OH)2
Zn(OH)2 RbOH
RbOH Fe(OH)3
Fe(OH)3 Zn(OH)2
Zn(OH)2 Cr + NaOH
Cr + NaOH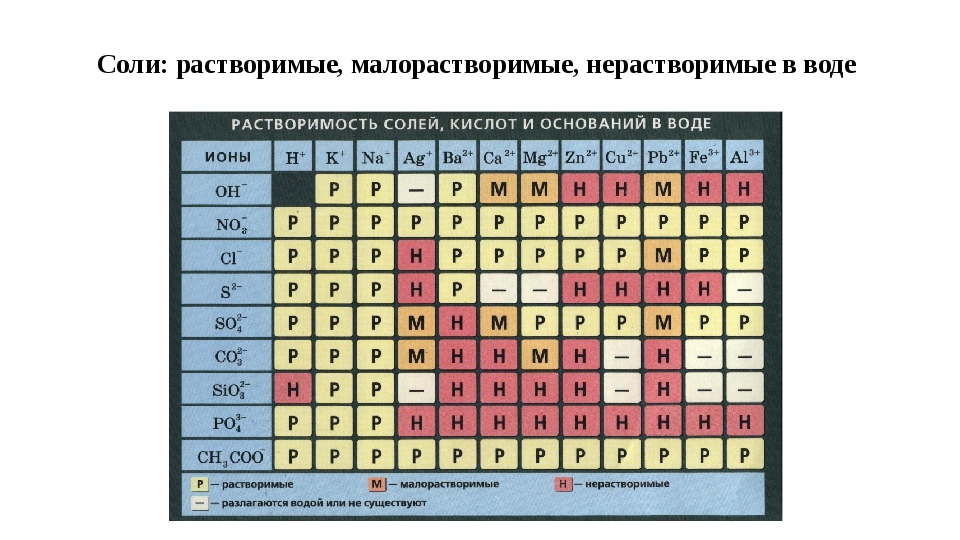 I2
I2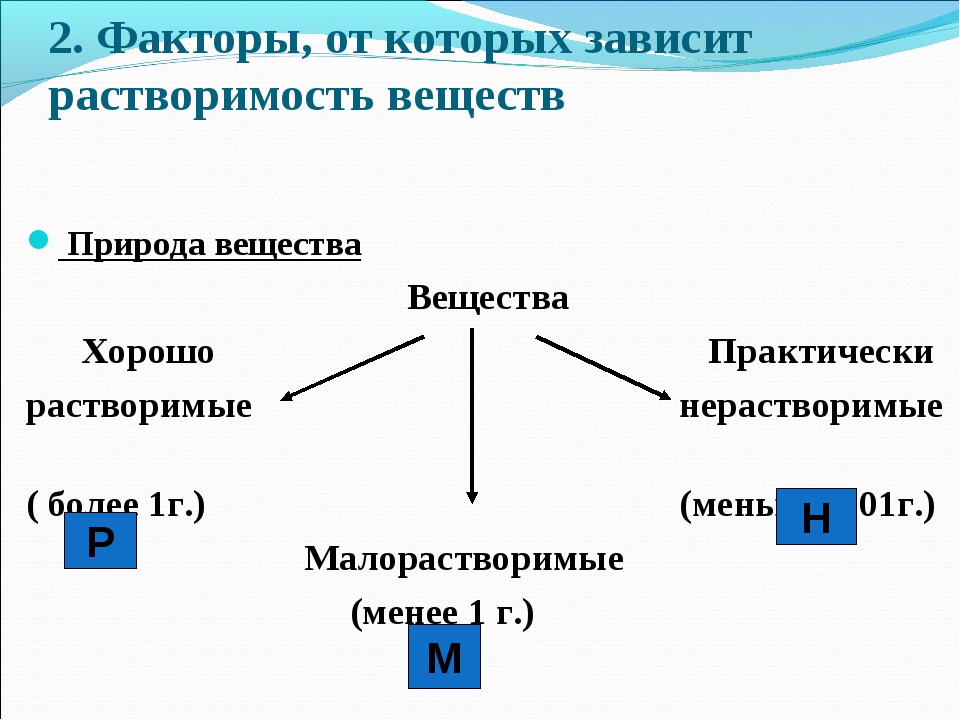 I2 + RbOH
I2 + RbOH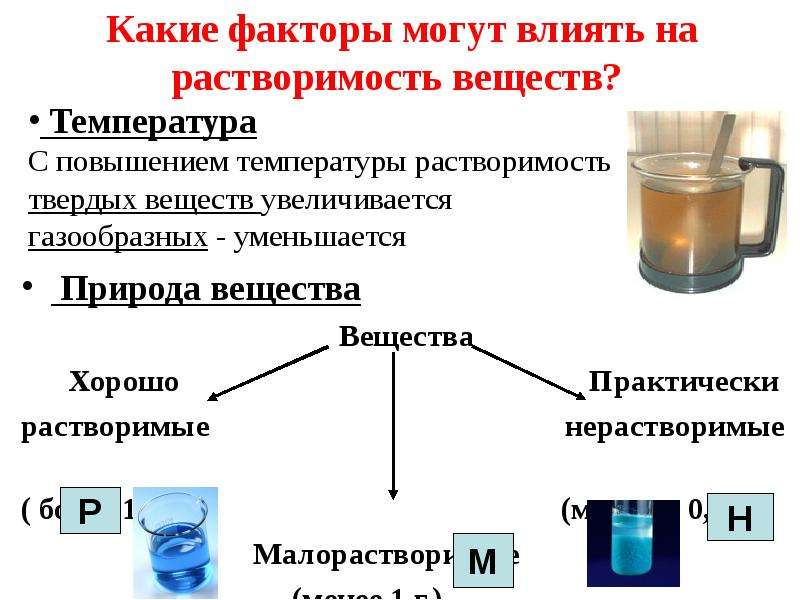 H3PO4
H3PO4 H2SiO3
H2SiO3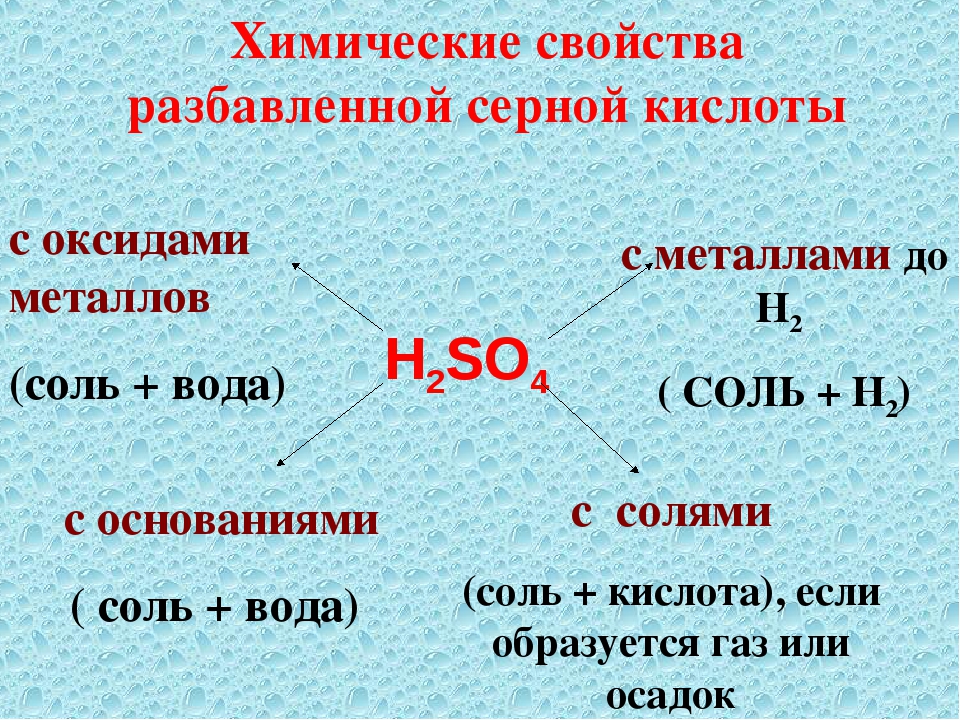 H2SO4
H2SO4 H2SO3
H2SO3 )
) )
) HI + P
HI + P