Содержание
CO кислотный оксид? /////////////////////////// — Школьные Знания.com
у п’яти пронумерованих пробірках міститься розчин калій гідроксиду, хлоридної кислоти , калій ортофосвату , літій сульфату та магній нітрату . запропо
…
нуйте план визначення кожної з речовин. запишіть рівняння в молекулярній, повній, та скороченій йонній формах
Сколько требуется из 2% раствора нитрата серебра и 3,5% раствора поваренной соли, чтобы образовался осадок из 21,525 г хлорида серебра?
доведіть якісний склад бромідної кислоти
Для получения бертолетовой соли использовали 224 г гидроксида калия. Найдите массу полученной бертолетовой соли.
Речовину А, яка з природним полімером є цінним компонентом їжі людини, гідролізували, отримавши речовнну Б, солодку на смак. Унаслідок бродiння з речо
…
новани Б одержали речовину В, безбарвну рідину з характерним запахом, розчиник. Під час дегідратацiї речовнни В отримали речовину Г-газ без кольору. який знебарвлює бромну воду. Цю ж речовину Г можна одержати дeгiдpуванням газоподібного алкану. Склади рівняння всіх згаданих реакцій. Визнач масу pечовини В, яку можна одержати з речовини А кількӀстю речовини 3 моль.
Цю ж речовину Г можна одержати дeгiдpуванням газоподібного алкану. Склади рівняння всіх згаданих реакцій. Визнач масу pечовини В, яку можна одержати з речовини А кількӀстю речовини 3 моль.
Терміново потрібно виконати завдання. Допоможіть, будь ласка, що знаєте!
Назовите следующие соединения по международной номенклатуре
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:сн4 -> с2н2 -> с2н4 -> С2Н5ОН -> СН3СНО -> СН3СОО
…
Н -> СН3СООКУкажите условия протекания и типы реакций, назовите продукты
в таблиці Завдання 1. Доберіть реактиви і здійсніть хімічні перетворення сполук Алюмінію згідно зі схемою Na[Al(OH)
…
4] → Аl(OН)3 → Al2(SO4)3 → Al(NO3)3.Завдання 2. Добудьте ферум(ІІІ) гідроксид із ферум (III) хлориду (кількома способами).
СРОЧНОО !
Fe2O3—Fe3O4—FeO—Fe написать реакции перехода одного оксида в другой для получения железа,цифры это индексы,их нужно писать поменьше.
ЕГЭ по химии. А 6. Классификация веществ. Ответы.
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация органических веществ. Систематическая номенклатура.
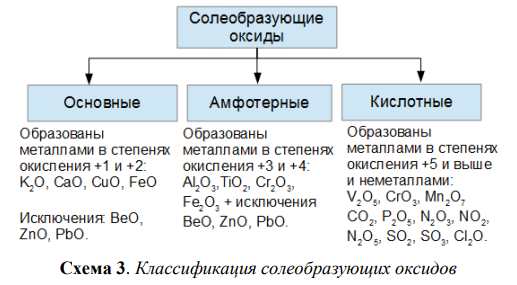
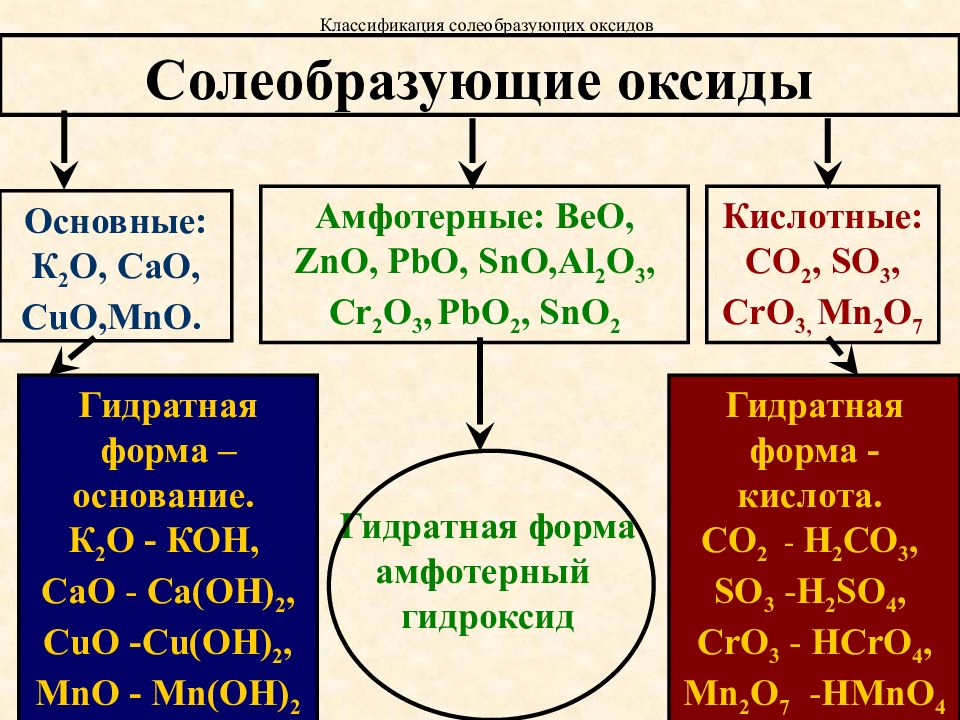
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А12Оз и К2О
3) CO2 и NO
4) Fe2O3 и CO
2. Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO2
2) Na2O, SiO2, Сг2Оз
3) CrO.SQ2, CaO
4) CuO, А12Оз, FeO
4. Какие из приведенных утверждений верны?
А. Основные оксиды — это оксиды, которым соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) основными
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na2O, MgO, AI2O3
2) ZnO, SnO РЬО2
3) CO2,SiO2,SO2
4) N2O,NO,CO
7. В каком ряду расположено вещество, которое не является кислотой?
1) Н2С2О4, HCN, HSCN
2) H2S,H2SO3,H2SO4
3) HC1O2,HC1O3,HC1O4 .
4) HNO3.HNO2, H3N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO3,SiO2,Cl2O7
2) N2O5,CO, SiO2
3) P2O5,NO,CO2
4) N2O3,Na2O,NO
9. В каком ряду приведены формулы только гидроксидов неметаллов?
В каком ряду приведены формулы только гидроксидов неметаллов?
1) H2SO4, HC1, HNO3
2) Н3РО4, H2SiO3, HCIO4
3) Н3ВО3, НАlO2, H2S
4) НСlO3, НВг, Н3РО3
10. В каком ряду приведены формулы только основных оксидов?
1) А12О3, MgO, Na2O
2) N2O, CuO, ZnO
3) N2O5, CaO, K2O
4) FeO, Li2O, BaO
11. Кислотным является оксид, формула которого
1) СгО3
2) СаО
3) А12О3
4) NO
12. Только двухосновные кислоты расположены в ряду:
1) Н2СОз, Н3РО4, H3AsO3, HNO3
2) НС1O4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO,, H2SO4, H2Cr04
4) HMnO4, H3As04 H2BeO4, H2ZnO2
13. Только кислоты расположены в ряду
Только кислоты расположены в ряду
1) НNО3, Са(OH)2, NО2
2) КНСОз, Ba(HSO4)2, ZnOHCl
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
14. Несолеобразующим оксидом является
1} N2O5 2) NO2 3) N2O3 4) NO
15. Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
Mn(NO3)2, Mg(H2P04)2, A12(SO4)3, (NH4)2HP04, Na2SO3,
(NH4)2S, BaSiO3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17. Вещество СН3 — О — СН3 относится к
Вещество СН3 — О — СН3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простым эфирам
18. В перечне солей, формулы которых:
Ag2CO3, NaHS, Cu(NO3)2, Fe2(SO4)3, Ca(HCO3)2, KH2PO4, KMnO4, число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
1) (NH4)2SO4 2) Fe(OH)SO4 3) KHSO4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А12O3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl2,
2) SO2, H2S, NaHSO4
3) SO2, A12(SO4)3, HNO3
4) ZnO, Zn(OH)2, H2S
23. Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na2SiO3, КОН, К2O
2} Са(ОН)2, H2S, СаО
3) HF, Mg(OH)2, ВаО
4) H2S04, Ва(ОН)г, SiO2
24. Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25. Амфотерным оксидом является
I) СаО 2) СгО3 3) FeO 4) Сr2О3
26. Какой из элементов может образовать кислотный оксид?
1)стронций
2)марганец
3)кальций
4)магний
| 27.Кислотой является |
1) NaH 2) Sih5 3) HI 4) NH3
28. Солью является
Солью является
1) СаН2 2) РС1з 3) [CНзNНз]С1 4) СНзOH
29. Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
1) азота(I) 2) хрома(II) 3) хлора(III) 4) кремния(IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12-3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24-3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
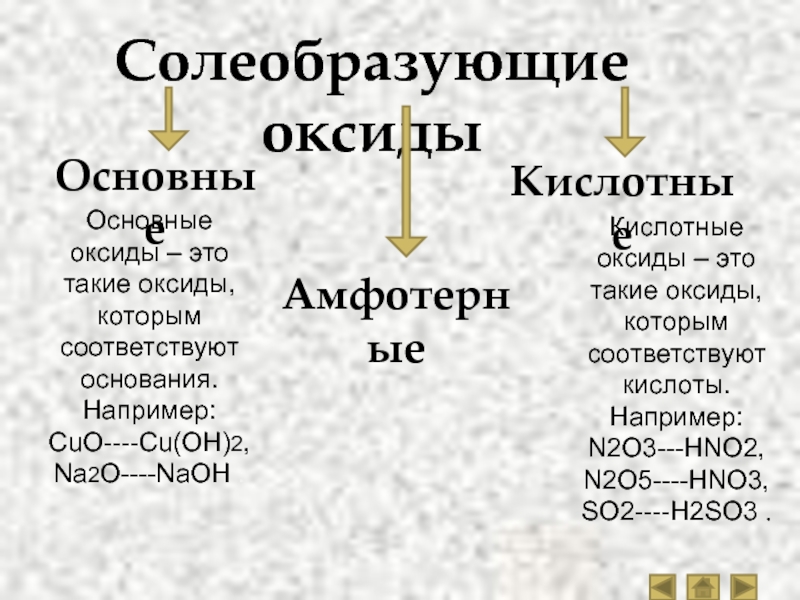
Общая характеристика оксидов
☰
Оксиды — это сложные вещества, состоящие из атомов двух химических элементов, одним из которых является кислород. Например, CO2, CaO, Fe2O3, K2O. Самый известный оксид — это вода — оксид водорода (H2O).
Валентность кислорода равна II.
Оксиды можно получить окислением простых веществ кислородом:
S + O2 = SO2
Fe + O2 = Fe2O3
При нагревании нерастворимых в воде оснований происходит реакция дегидратации, в результате которой образуются оксиды металлов:
Mg(OH)2 = MgO + H2O
2Au(OH)3 = Au2O3 + 3H2O
При разложении ряда кислот получаются оксиды неметаллов:
H2CO3 = CO2 + H2O
H2SO4 = SO3 + H2O
При нагревании карбонатов они разлагаются на оксид металла и углекислый газ:
CaCO3 = CaO + CO2
Различают кислотные и основные оксиды. Из первых при присоединении воды образуются кислоты, а из вторых — основания:
Из первых при присоединении воды образуются кислоты, а из вторых — основания:
SO3 + H2O = H2SO4
Na2O + H2O = 2NaOH
Кислотные оксиды — это в основном оксиды неметаллов. Однако металлы с валентностью больше IV образуют кислотные оксиды. Например, оксид марганца (VII) Mn2O7 образует марганцовую кислоту:
Mn2O7 + H2O = 2HMnO4
Кремниевой кислоте H2SiO3 соответствует оксид SiO2. Однако он не реагирует с водой с образованием кислоты.
Основные оксиды в основном образуют металлы с валентностью от I до III. Многие основные оксиды с водой не взаимодействуют. Однако оксиды щелочных и щелочно-земельных металлов вступают в реакцию с водой.
Оксиды хлора
Свойства оксидов
Оксиды —
это сложные химические вещества,
представляющие собой химические
соединения простых элементов с кислородом.
Они бываютсолеобразующими и не
образующие соли. При этом солеобразующие
бывают 3-х типов: основными (от
слова «основание»), кислотными иамфотерными.
Примером
окислов, не образующих соли, могут быть:
NO (окись азота) — представляет собой
бесцветный газ, без запаха. Он образуется
во время грозы в атмосфере. CO (окись
углерода) — газ без запаха, образуется
при сгорании угля. Его обычно называют
угарным газом. Существуют и другие
окислы, не образующие соли. Теперь
разберём подробнее каждый вид
солеобразующих окислов.
Основные
оксиды —
это сложные химические вещества,
относящиеся к окислам, которые образуют
соли при химической реакции с кислотами
или кислотными оксидами и не реагируют
с основаниями или основными оксидами.
Например, к основным относятся
следующие:
K2O
(окись калия), CaO (окись кальция), FeO (окись
железа 2-валентного).
Рассмотрим химические
свойства оксидов на
примерах
1.
Взаимодействие с водой:
— взаимодействие
с водой с образованием основания (или
щёлочи)
CaO+H2O
= Ca(OH)2 (известная
реакция гашения извести, при этом
выделяется большое количества тепла!)
2.
Взаимодействие с кислотами:
—
взаимодействие с кислотой с образованием
соли и воды (раствор соли в воде)
CaO+H2SO4 =
CaSO4+
H2O
(Кристаллы этого вещества CaSO4 известны
всем под названием «гипс»).
3.
Взаимодействие с кислотными оксидами:
образование соли
CaO+CO2=CaCO3 (Это
вещество известно всем — обычный мел!)
Кислотные
оксиды —
это сложные химические вещества,
относящиеся к окислам, которые образуют
соли при химическом взаимодействии с
основаниями или основными оксидами и
не взаимодействуют с кислотными
оксидами.
Примерами кислотных окислов
могут быть:
CO2 (всем
известный углекислый газ), P2O5 — оксид
фосфора (образуется
при сгорании на воздухе белого
фосфора),
SO3 —
триокись серы — это вещество используют
для получения серной
кислоты.
—
химическая реакция с водой
CO2+H2O=H2CO3 —
это вещество — угольная кислота — одна
из слабых кислот, её добавляют в
газированную воду для «пузырьков»
газа.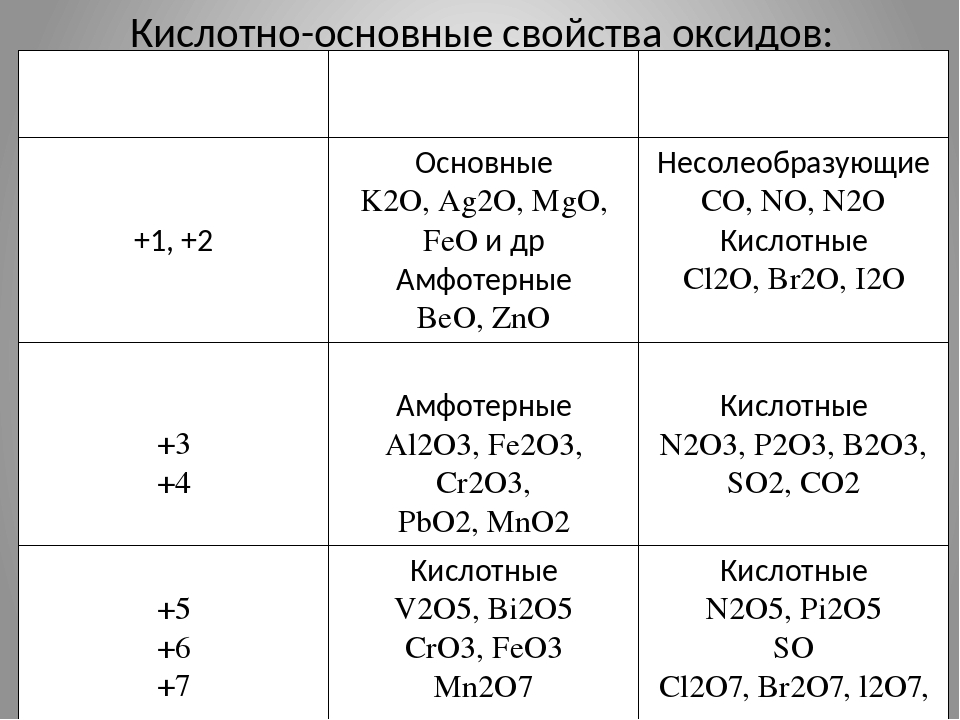 С повышением температуры
С повышением температуры
растворимость газа в воде уменьшается,
а его излишек выходит в виде пузырьков.
—
реакция с щелочами (основаниями):
CO2+NaOH=Na2CO3 —
образовавшееся вещество (соль) широко
используется в хозяйстве. Её название
— кальцинированная сода или стиральная
сода, — отличное моющее средство для
подгоревших кастрюль, жира, пригара.
Голыми руками работать не рекомендую!
—
реакция с основными оксидами:
CO2+MgO=MgCO3 —
получившая соль — карбонат магния — ещё
называется «горькая соль».
Амфотерные
оксиды —
это сложные химические вещества, также
относящиеся к окислам, которые образуют
соли при химическом взаимодействии и
с кислотами (или кислотными
оксидами)
и основаниями (или основными
оксидами).
Наиболее частое применение слово
«амфотерный» в нашем случае относится
к оксидам
металлов.
Примером амфотерных
оксидов могут
быть:
ZnO — окись цинка (белый порошок,
часто применяемый в медицине для
изготовления масок и кремов), Al2O3 —
окись алюминия (называют еще «глинозёмом»).
Химические
свойства амфотерных оксидов уникальны
тем, что они могут вступать в химические
реакции, соответствующие как основаниями
так и с кислотами. Например:
— реакция
с кислотным оксидом:
ZnO+H2CO3 =
ZnCO3 +
H2O
— Образовавшееся вещество — раствор соли
«карбоната цинка» в воде.
— реакция
с основаниями:
ZnO+2NaOH=Na2ZnO2+H2O
— полученное вещество — двойная соль
натрия и цинка.
Получение
оксидов производят
различными способами. Это может
происходить физическим и химическим
способами. Самым простым способом
является химическое взаимодействие
простых элементов с кислородом. Например,
результатом процесса горения или одним
из продуктов этой химической реакции
являются оксиды.
Например, если раскалённое железный
прутик, да и не только железный (можно
взять цинк Zn, олово Sn, свинец Pb, медь Cu,
— вообщем то, что имеется под рукой)
поместить в колбу с кислородом, то
произойдёт химическая реакция окисления
железа, которая сопровождается яркой
вспышкой и искрами. Продуктом реакции
Продуктом реакции
будет чёрный порошок оксида железа
FeO:
2Fe+O2=2FeO
Полностью
аналогичны химические реакции с другими
металлами и неметаллами, Например: Цинк
сгорает в кислороде с образованием
окисла цинка
2Zn+O2=2ZnO
Горение
угля сопровождается образованием сразу
двух окислов: угарного газа и углекислого
газа
2C+O2=2CO
— образование угарного газа.
C+O2=CO2 —
образование углекислого газа. Этот газ
образуется если кислорода имеется в
более, чем достаточном количестве, то
есть в любом случае сначала протекает
реакция с образованием угарного газа,
а потом угарный газ окисляется, превращаясь
в углекислый газ.
Получение
оксидов можно
осуществить другим способом —
путём химической
реакции разложения.
Например, для получения окисла железа
или окисла алюминия необходимо прокалить
на огне соответствующие основания
этих металлов:
Fe(OH)2=FeO+H2O
2Al(OH)3=Al2O3+3H2O,
а
также при разложении отдельных
кислот:
H2CO3=H2O+CO2 —
разложение угольной кислоты
H2SO3=H2O+SO2 —
разложение сернистой кислоты
Получение
оксидов можно
осуществить из солей металлов при
сильном нагревании, например:
CaCO3=CaO+CO2 —
прокаливанием мела получают окись
кальция (или негашенную известь) и
углекислый газ.
Cu(NO3)2 =
2CuO + 4NO2 +
O2 —
в этой реакции разложения получается
сразу два окисла: меди CuO (чёрного цвета)
и азота NO2 (его
ещё называют бурым газом из-за его
действительно бурого цвета).
Ещё одним
способом, которым можно осуществить
получение окислов —
это окислительно-восстановительные
реакции,
например
Cu + 4HNO3(конц.)
=
Cu(NO3)2 +
2NO2 +
2H2O
S
+ H2SO4(конц.)
= 3SO2 +
2H2O
Известны
следующие оксиды
хлора:
Cl2O,
ClO2,
Cl2O6,
Cl2O7.
Все они, за исключением Cl2O7,
имеют желтую или оранжевую окраску и
не устойчивы, особенно ClO2,
Cl2O6.
Все оксиды
хлора взрывоопасны
и являются очень сильными
окислителями.
Реагируя с водой, они
образуют
соответствующие кислородсодержащие и хлорсодержащие кислоты:
Так,
Cl2O
— кислотный
оксид хлора хлорноватистой
кислоты.
Cl2O
+ H2O
= 2HClO — Хлорноватистая
кислота
ClO2 — кислотный
оксид хлора хлорноватистой
и хлорноватой кислоты, так как при
химической реакции с водой образует
сразу две этих кислоты:
ClO2 +
H2O
= HClO2 +
HClO3
Cl2O6 —
тоже кислотный
оксид хлора хлорноватой
и хлорной кислот:
Cl2O6 +
H2O
= HClO3 +
HClO4
И,
наконец, Cl2O7 —
бесцветная жидкость — кислотный
оксид хлора хлорной
кислоты:
Cl2O7 +
H2O
= HClO4
Оксиды азота
Азот
— газ, который образует 5 различных
соединений с кислородом — 5 оксидов
азота.
А именно:
— N2O
— гемиоксид
азота.
Другое его название известно в медицине
под названием веселящий
газ или закись
азота —
это бесцветный сладковатый и приятный
на вкус на газ.
— NO — моноксид
азота —
бесцветный, не имеющий ни запаха ни
вкуса газ.
— N2O3 — азотистый
ангидрид —
бесцветное кристаллическое вещество
—
NO2 — диоксид
азота.
Другое его название — бурый
газ —
газ действительно имеет буро-коричневый
цвет
— N2O5 — азотный
ангидрид —
синяя жидкость, кипящая при температуре
3,5 0C
Из
всех этих перечисленных соединений
азота наибольший интерес в промышленности
представляют NO — моноксид азота и NO2 —
диоксид азота. Моноксид
азота (NO)
и закись
азота N2O
не реагируют ни с водой, ни с
щелочами. Азотистый
ангидрид (N2O3)
при реакции с водой образует слабую и
неустойчивую азотистую кислоту HNO2,
которая на воздухе постепенно переходит
в более стойкое химическое веществоазотную
кислоту.
Рассмотрим
некоторые химические
свойства оксидов азота:
Реакция
с водой:
2NO2 +
H2O
= HNO3 +
HNO2 —
образуется сразу 2 кислоты: азотная
кислота HNO3 и
азотистая кислота.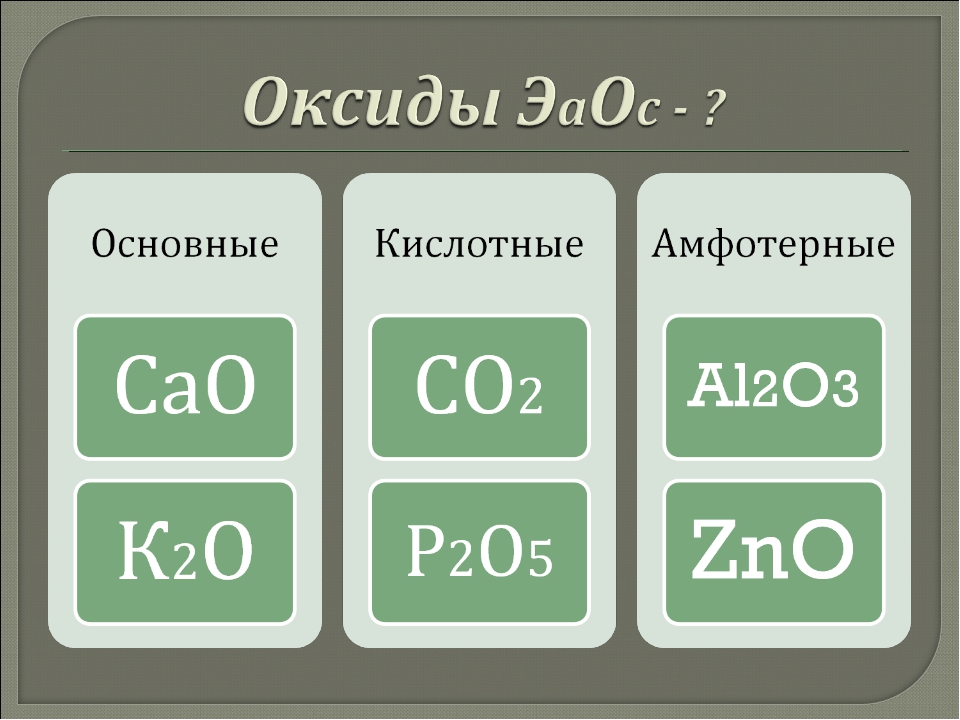
Реакция с
щелочью:
2NO2 +
2NaOH = NaNO3 +
NaNO2 +
H2O
— образуются две соли: нитрат натрия
NaNO3 (или
натриевая селитра) и нитрит натрия (соль
азотистой кислоты).
Реакция с
солями:
2NO2 +
Na2CO3 =
NaNO3 +
NaNO2 +
CO2 —
образуются образуются две соли: нитрат
натрия и нитрит натрия, и выделяется
углекислый газ.
Получают
диоксид азота (NO2)
из моноксида азота (NO) с помощью химической
реакции соединения c кислородом:
2NO
+ O2 =
2NO2
Оксиды железа
Железо образует
два оксида:
FeO — оксид
железа (2-валентный)
— порошок чёрного цвета, который получают
восстановлением оксида
железа(3-валентного)
угарным газом по следующей химической
реакции:
Fe2O3+CO
—> 2FeO+CO2
Этот
основной оксид, легко вступающий в
реакции с кислотами. Он обладает
восстановительными свойствами и быстро
окисляется в оксид
железа (3-валентный).
FeO
+O2 —>
2Fe2O3
Оксид
железа (3-валентный)
— красно-бурый порошок (гематит), обладающий
амфотерными свойствами (может
взаимодействовать и с кислотами и со
щелочами). Но кислотные свойства этого
оксида выражены настолько слабо, что
наиболее часто он его используют,
как основной
оксид .
Есть
ещё так называемы смешанный
оксид железа Fe3O4.
Он образуется при горении железа, хорошо
проводит электрический ток и обладает
магнитными свойствами (его называют
магнитным железняком или магнетитом).
Если
железо сгорает,то в результате реакции
горения образуется окалина, состоящая
сразу из двух оксидов: оксида
железа (III)
и (II) валентные.
Окись углерода является aan A Кислотный оксид B Основной оксид класса 11 по химическому составу CBSE
Подсказка: Молекулярная формула окиси углерода — CO. Окись углерода — это бесцветный газ без запаха и вкуса. Плотность окиси углерода меньше, чем у воздуха. Окись углерода не проявляет кислотных или основных свойств при реакции с водой.
Окись углерода — это бесцветный газ без запаха и вкуса. Плотность окиси углерода меньше, чем у воздуха. Окись углерода не проявляет кислотных или основных свойств при реакции с водой.
Полный ответ:
Бинарные соединения, образующиеся в результате реакции любого металла или неметалла с кислородом, известны как оксиды.
Окись углерода образуется в результате реакции неметаллического углерода с высокореактивным кислородом. Таким образом, оксид углерода — это неметаллический оксид.
Оксиды, которые реагируют с водой с образованием кислоты или оксидов, которые реагируют с основанием с образованием соли, известны как кислые оксиды.
Оксиды, которые реагируют с водой с образованием основания, или оксиды, которые реагируют с кислотой с образованием соли, известны как основные оксиды.
Оксиды, которые не вступают в реакцию с кислотами и основаниями, называются нейтральными оксидами.
Оксиды, которые реагируют с кислотами, а также с основаниями с образованием соли, известны как амфотерные оксиды.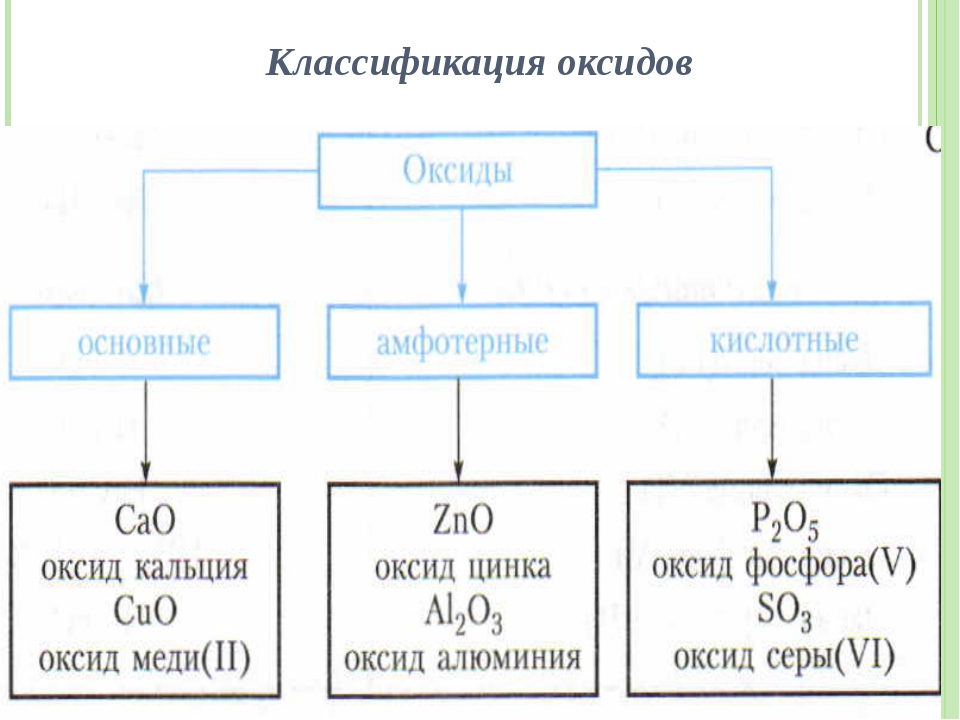
Окись углерода не вступает в реакцию с кислотами и основаниями.
Таким образом, оксид углерода является нейтральным оксидом.
Таким образом, правильный вариант — (D) нейтральный оксид.
Примечание: Тройная ковалентная связь присутствует в атомах углерода и кислорода монооксида углерода. Углерод не ионизируется и, следовательно, не реагирует с кислотой или основанием. Таким образом, оксид углерода — это нейтральный оксид.Другие примеры нейтральных оксидов: вода, закись азота, оксид азота, оксид марганца.
Вы в одном шаге от ответа!
Подпишитесь бесплатно!
Регистрируясь, вы также получаете БЕСПЛАТНЫЙ доступ к тысячам решенных вопросов, викторин
и загружаемым PDF-файлам!
Неорганическая химия — Почему окись углерода — это нейтральный оксид?
Ну, окись углерода может быть получена из муравьиной кислоты путем добавления серной кислоты, которая обезвоживает указанную муравьиную кислоту:
$$ \ ce {HCOOH -> [\ ce {h3SO4}] CO + h3O} $$
Таким образом, мы можем теоретически представить обратную реакцию, в результате которой оксид углерода станет кислым оксидом. Однако прямая реакция протекает нелегко, и для того, чтобы на самом деле работал , необходимы как высокая кислотность серной кислоты, так и ее сильные дегидративные свойства. И в вашем вопросе упоминается использование горячего концентрированного гидроксида натрия , чтобы заставить работать обратное.
Однако прямая реакция протекает нелегко, и для того, чтобы на самом деле работал , необходимы как высокая кислотность серной кислоты, так и ее сильные дегидративные свойства. И в вашем вопросе упоминается использование горячего концентрированного гидроксида натрия , чтобы заставить работать обратное.
Большинство оксидов, которые классифицируются как кислотные или основные, имеют либо очень электрофильный центральный атом (например, $ \ ce {CO2} $), который может быть атакован слабой нуклеофильной водой (которая, в свою очередь, может затем высвободить кислый протон), или они имеют высокую плотность заряда на кислороде, что позволяет ему напрямую отводить протон от воды.Окись углерода ни то, ни другое. Если вы посмотрите на его молекулярные орбитали, вы заметите, что, хотя углерод частично положителен, он имеет наибольший вклад ВЗМО, а это означает, что протон с большей вероятностью прикрепится к углеродной стороне, а она вообще не нужна. LUMO, к счастью, также более ориентирован на углерод, а это означает, что возможны нуклеофильные атаки на углерод. Однако он также является вырожденным из-за двойной связи, так что атака не приветствуется.
Однако он также является вырожденным из-за двойной связи, так что атака не приветствуется.
Таким образом, молекула монооксида углерода вообще не реагирует с водой и полностью противоречит концепции кислотных / основных оксидов.
Сокращения:
HOMO — это широко используемое сокращение для самой высокой занятой молекулярной орбитали , то есть той, которая имеет самую высокую энергию и все еще содержит электроны. Обычно именно орбиталь атакует нуклеофильно или электрофильно.
LUMO — широко используемое сокращение для Lowest Unoccupied Molecular Orbital , то есть виртуальной (незанятой) орбитали с самой низкой энергией.При рассмотрении нуклеофильной атаки атакующие электроны обычно взаимодействуют с НСМО. Электрофилы атакуют HOMO других молекул с помощью LUMO.
Оксиды углерода, кремния, германия, олова и свинца
Оксиды элементов в верхней части группы 4 являются кислыми, но кислотность оксидов падает по мере того, как вы спускаетесь по группе. Ближе к нижней части группы оксиды становятся более основными, хотя при этом полностью не теряют своих кислотных свойств.
Ближе к нижней части группы оксиды становятся более основными, хотя при этом полностью не теряют своих кислотных свойств.
Оксид, который может проявлять как кислотные, так и основные свойства, называется амфотерным .
Таким образом, наблюдается тенденция от кислых оксидов в верхней части группы к амфотерным в нижней части.
Оксиды углерода и кремния
Окись углерода
С монооксидом углерода обычно обращаются как с нейтральным оксидом, но на самом деле он очень и очень слабокислый.Он не реагирует с водой, но он будет реагировать с горячим концентрированным раствором гидроксида натрия с образованием раствора метаноата натрия.
Тот факт, что окись углерода реагирует с основным гидроксид-ионом, показывает, что он должен быть кислым.
Диоксид углерода и кремния
Оба они слабокислые.
С водой
Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры.
Двуокись углерода в некоторой степени реагирует с водой с образованием ионов водорода (строго говоря, ионов гидроксония) и ионов гидрокарбоната.
Всего эта реакция:
Раствор диоксида углерода в воде иногда называют угольной кислотой, но на самом деле только около 0,1% диоксида углерода фактически прореагировало. Положение равновесия находится намного левее.
С основанием
Двуокись углерода реагирует с раствором гидроксида натрия на холоде с образованием карбоната натрия или раствора гидрокарбоната натрия — в зависимости от соотношения реагирующих веществ.
Диоксид кремния также вступает в реакцию с раствором гидроксида натрия, но только если он горячий и концентрированный. Образуется раствор силиката натрия.
Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием.
Это также пример реакции кислого диоксида кремния с основанием.
Оксиды германия, олова и свинца
Окиси
Все эти оксиды амфотерные — они проявляют как основные, так и кислотные свойства.
Основная природа оксидов
Все эти оксиды реагируют с кислотами с образованием солей.
Например, все они реагируют с концентрированной соляной кислотой. Это можно резюмировать как:
.. . где X может быть Ge и Sn, но, к сожалению, требует небольшой модификации для свинца.
Хлорид свинца (II) практически нерастворим в воде, и вместо получения раствора он образовал бы нерастворимый слой над оксидом свинца (II), если бы вы использовали разбавленную соляную кислоту , что остановило бы реакцию.
Однако в этом примере мы говорим об использовании концентрированной соляной кислоты.
Большой избыток хлорид-ионов в концентрированной кислоте реагирует с хлоридом свинца (II) с образованием растворимых комплексов, таких как PbCl 4 2- .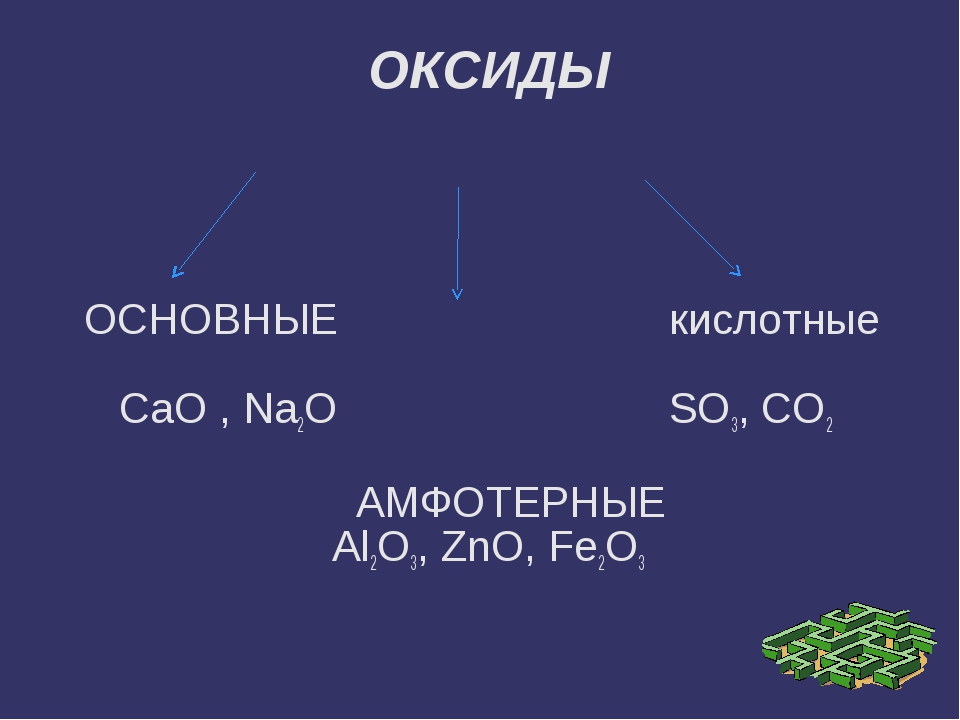 Эти ионные комплексы растворимы в воде, и проблема исчезает.
Эти ионные комплексы растворимы в воде, и проблема исчезает.
К сожалению, это означает, что вам нужно больше помнить!
Кислоты и основания — Кислоты и основания — Национальная 5 редакция химии
Шкала pH
Степень кислотности или щелочности вещества (pH вещества) можно измерить с помощью шкалы pH, непрерывный диапазон которого простирается от нуля до более 14. Наиболее частые значения pH находятся в диапазоне от 0 до 14.
Кислоты имеют pH менее 7.
Щелочи имеют pH более 7.
Водные и нейтральные растворы имеют pH ровно 7.
pH — это мера концентрации ионов водорода в растворе.
0.1:0.1.0.$0.$2.$0″> Образующие кислоты и щелочи
Щелочи — растворимые основания. Щелочной раствор может образоваться при растворении оксида металла в воде. Кислый раствор может образоваться, когда оксид неметалла растворяется в воде.
Например, оксид магния растворяется с образованием щелочных растворов.{} \]
Посмотрите это видео, чтобы увидеть процедуру эксперимента по изучению влияния углекислого газа на pH.
Корреляция основности поверхности оксидов металлов с фотокаталитическим гидроксилированием бороновых кислот до спиртов
. 26 июля 2018 г .; 57 (31): 9780-9784.
DOI: 10.1002 / anie.201805395.
Epub 2018 29 июня.
Принадлежности
Расширять
Принадлежности
- 1 Инновационный центр гибких устройств, Школа материаловедения и инженерии, Технологический университет Наньян, 50 Nanyang Avenue, Сингапур, 639798, Сингапур.
- 2 Лаборатория перспективных материалов, химический факультет, Университет Фудань, Шанхай, 200433, П. Р. Китай.
Элемент в буфере обмена
Ван Ру Леоу и др.
Angew Chem Int Ed Engl.
.
Показать детали
Показать варианты
Показать варианты
Формат
АннотацияPubMedPMID
. 26 июля 2018 г .; 57 (31): 9780-9784.
DOI: 10. 1002 / anie.201805395.
1002 / anie.201805395.
Epub 2018 29 июня.
Принадлежности
- 1 Инновационный центр гибких устройств, Школа материаловедения и инженерии, Технологический университет Наньян, 50 Nanyang Avenue, Сингапур, 639798, Сингапур.
- 2 Лаборатория перспективных материалов, химический факультет, Университет Фудань, Шанхай, 200433, P.Р. Китай.
Элемент в буфере обмена
Полнотекстовые ссылки
Опции CiteDisplay
Показать варианты
Формат
АннотацияPubMedPMID
Абстрактный
Фоторедокс-катализ предоставляет возможности для использования чистых и экологически чистых ресурсов, таких как солнечный свет и O 2 , в то время как кислотные и основные участки поверхности оксидов металлов имеют решающее значение для промышленного катализа, такого как крекинг нефти. Был выяснен вклад поверхностей оксидов металлов в фотокаталитические аэробные реакции, что продемонстрировано путем гидроксилирования бороновых кислот до спиртов. Сила и близость поверхностных базовых участков оказались двумя ключевыми факторами, вызвавшими реакцию; основные и амфотерные оксиды, такие как MgO, TiO 2 , ZnO и Al 2 O 3 , обеспечивали высокие выходы спирта, в то время как кислые оксиды, такие как SiO 2 и B 2 O 3 давали только низкие урожайность.Реакция настраивается на различные источники излучения путем простого выбора фотосенсибилизаторов с совместимыми длинами волн возбуждения. Такие механизмы поверхностного комплексообразования между реагентами и материалами, богатыми землей, могут быть эффективно использованы для достижения более широкого диапазона фотоокислительных реакций.
Был выяснен вклад поверхностей оксидов металлов в фотокаталитические аэробные реакции, что продемонстрировано путем гидроксилирования бороновых кислот до спиртов. Сила и близость поверхностных базовых участков оказались двумя ключевыми факторами, вызвавшими реакцию; основные и амфотерные оксиды, такие как MgO, TiO 2 , ZnO и Al 2 O 3 , обеспечивали высокие выходы спирта, в то время как кислые оксиды, такие как SiO 2 и B 2 O 3 давали только низкие урожайность.Реакция настраивается на различные источники излучения путем простого выбора фотосенсибилизаторов с совместимыми длинами волн возбуждения. Такие механизмы поверхностного комплексообразования между реагентами и материалами, богатыми землей, могут быть эффективно использованы для достижения более широкого диапазона фотоокислительных реакций.
Ключевые слова:
спирты; бороновые кислоты; гидроксилирование; фотокатализ; наземные базовые площадки.
© 2018 Wiley-VCH Verlag GmbH & Co. KGaA, Вайнхайм.
Похожие статьи
Al (2) O (3) Поверхностное комплексообразование для фотокаталитических органических превращений.
Leow WR, Ng WK, Peng T, Liu X, Li B, Shi W, Lum Y, Wang X, Lang X, Li S, Mathews N, Ager JW, Sum TC, Hirao H, Chen X.
Leow WR, et al.
J Am Chem Soc.2017, 11 января; 139 (1): 269-276. DOI: 10.1021 / jacs.6b09934. Epub 2016 29 декабря.
J Am Chem Soc. 2017 г.PMID: 27966340
Кинетика кетонизации и кетенизации валериановой кислоты при каталитическом пиролизе на наноразмерном SiO 2 , γ-Al 2 O 3 , CeO 2 / SiO 2 , Al 2 O 3 80 2 / SiO и TiO 2 / SiO 2 .
Кулик К, Палиница Б, Александр Ж.Д., Азизова Л, Борисенко М, Картель М, Ларссон М, Кулик Т.
Кулик К. и др.
Chemphyschem. 2017 19 июля; 18 (14): 1943-1955. DOI: 10.1002 / cphc.201601370. Epub 2017 10 мая.
Chemphyschem. 2017 г.PMID: 28393449
Колориметрический датчик газообразного водорода на основе гибридных наночастиц PdO / оксиды металлов.
Ким Ю.К., Хван С.Х., Чжон С.М., Сон К.Й., Лим СК.Ким Ю.К. и др.
Таланта. 2018 1 октября; 188: 356-364. DOI: 10.1016 / j.talanta.2018.06.010. Epub 2018 4 июня.
Таланта. 2018.PMID: 30029388
Раскрытие фотокаталитических механизмов на поверхности TiO2 с использованием изотопной метки кислорода-18.
Панг Х, Чэнь Ц., Джи Х, Че И, Ма В, Чжао Дж.
Пан X и др.
Молекулы. 2014 10 октября; 19 (10): 16291-311.DOI: 10,3390 / молекулы191016291.
Молекулы. 2014 г.PMID: 25310153
Бесплатная статья PMC.Рассмотрение.
Материалы на основе металлоорганических каркасов для гетерогенного фотокатализа.
Чжао С.Н., Ван Г, Пельман Д., Ван Дер Вурт П.
Чжао С.Н. и др.
Молекулы. 2018 12 ноября; 23 (11): 2947. DOI: 10,3390 / молекулы23112947.
Молекулы. 2018.PMID: 30424499
Бесплатная статья PMC.Рассмотрение.
Процитировано
1
артикул
Нитрид углерода фотокатализирует региоселективное присоединение радикала амина к карбонильной связи и дает N-конденсированные пирролы.
Курпил Б.
 , Отте К., Мищенко А., Ламаньи П., Липински В., Лок Н., Антониетти М., Саватеев А.Курпиль Б. и др.
, Отте К., Мищенко А., Ламаньи П., Липински В., Лок Н., Антониетти М., Саватеев А.Курпиль Б. и др.
Nat Commun. 2019 26 февраля; 10 (1): 945. DOI: 10.1038 / s41467-019-08652-w.
Nat Commun. 2019.PMID: 30808862
Бесплатная статья PMC.
LinkOut — дополнительные ресурсы
Полнотекстовые источники
Другие источники литературы
Полнотекстовые ссылки
[Икс]
Wiley
[Икс]
цитировать
Копировать
Формат:
AMA
APA
ГНД
NLM
Понимание роли основных центров поверхности катализаторов в активации СО2 в сухом риформинге метана: краткий обзор
rsc.org/schema/rscart38″> Поверхность основных центров в катализаторах играет важную роль во многих каталитических приложениях, таких как сухой риформинг метана для производства возобновляемой водородной энергии.Концепция реакции сухого риформинга метана начинается с кислотно-щелочного взаимодействия, за которым следуют каталитические циклы. Например, реагенты CO 2 действуют как кислоты по отношению к катализаторам, которые действуют как основания. Основные центры катализаторов образуются в результате жесткой температуры предварительной обработки за счет десорбции поверхностных частиц. В настоящее время консенсус относительно роли основных центров состоит в том, чтобы усиливать активацию кислого CO 2 на поверхности носителя катализатора и ингибировать осаждение углерода на катализаторе, тем самым повышая каталитическую стабильность.В этом обзоре выяснено поведение основных центров поверхности по отношению к активации CO 2 при сухом реформинге метана. Был также пересмотрен метод определения основности катализаторов для стратегической разработки катализаторов, которые могли бы повысить каталитическую активность.
Был также пересмотрен метод определения основности катализаторов для стратегической разработки катализаторов, которые могли бы повысить каталитическую активность.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
Взаимодействие кислотно-щелочных молекул зонда с особыми характеристиками на четко очерченных монокристаллических поверхностях оксида металла
Абстрактные
Кислотно-основные характеристики поверхностей оксидов металлов часто используются для объяснения их каталитического поведения. Тем не менее
Тем не менее
подавляющее большинство этих исследований проводилось на порошках или оксидах на носителе, и информации очень мало.
имеющиеся в литературе о взаимодействии молекул зондов кислот / оснований с четко определенными поверхностями оксидов известных
координационная геометрия и степень окисления. Четкие монокристаллические поверхности Cu 2 O (111), SnO 2 (110) и Cr 2 O 3
(10 1 2) были исследованы на предмет их кислотно-основных свойств путем взаимодействия между молекулами зондов и четко определенными
особенности поверхности.Адсорбция NH 3 на катионных центрах была использована для характеристики льюисовской кислотности SnO 2 (110) и Cu 2 O
(111) поверхности. Адсорбция CO 2 , стандартной молекулы кислотного зонда, была использована для характеристики основности по Льюису
анионы кислорода на поверхностях SnO 2 (110), Cu 2 O (111) и Cr 2 O 3 (10 1 2). BF 3 , хотя и не является стандартной молекулой зонда, имеет
BF 3 , хотя и не является стандартной молекулой зонда, имеет
был протестирован в качестве зонда основности Льюиса анионов кислорода на SnO 2 (110) и Cr 2 O 3 (10 1 2).Путем изучения молекул зондов на четко определенных поверхностях оксидов металлов с известной координационной геометрией и окислением
Состояние, общая оценка NH 3 , CO 2 и BF 3 в качестве зондирующих молекул может быть произведена с использованием исследуемых поверхностей. NH 3 проверено
различия в льюисовской кислотности катионов Sn на SnO 2 (110), которые имели различия в координационных средах и окислении
состояния. Но адсорбция NH 3 не дала прямой информации о различиях льюисовской кислотности катионов Cu в разных
локальные координационные геометрии на Cu 2 O (111).CO 2 — плохой зонд основности Льюиса анионов кислорода на оксиде металла.
поверхности, изучаемые здесь.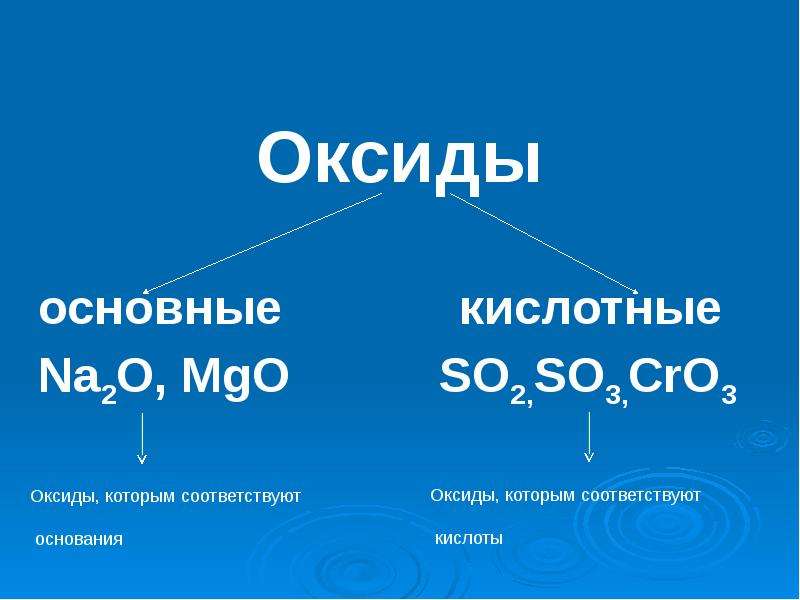 CO 2 не адсорбируется ни на SnO 2 (110), ни на Cu 2 O (111). На Cr 2 O 3 (10 1 2), CO 2 делает
CO 2 не адсорбируется ни на SnO 2 (110), ни на Cu 2 O (111). На Cr 2 O 3 (10 1 2), CO 2 делает
взаимодействуют с кислородными центрами, но в двух разных координациях, которые зависят от состояния поверхности, что позволяет сравнивать основность
трудный. В рассмотренных здесь случаях CO 2 либо не адсорбирует, либо не дает четкого набора результатов, которые могут быть связаны
просто по основности Льюиса.BF 3 , по-видимому, является гораздо лучшим исследованием основности Льюиса, чем CO 2 для четко определенного металла.
оксидные поверхности изучались здесь. На SnO 2 (110) и Cr 2 O 3 (10 1 2) атом бора BF 3 непосредственно взаимодействует с кислородными центрами
принимая их электроны. Термодесорбция BF 3 , кажется, обеспечивает прямую меру основности Льюиса различных
поверхностные формы кислорода, если они термически стабильны в вакууме.
