Содержание
Физические и химические явления. Признаки химических реакций
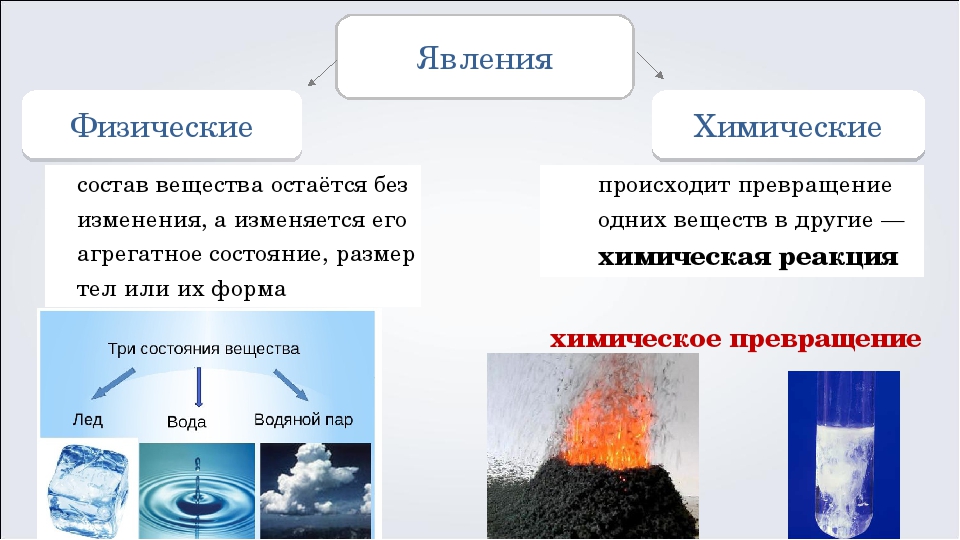
Различные изменения, происходящие с веществами, называются явлениями.
Пример. Испарение воды, плавление стекла, ржавление металлов — явления.
Явления делятся на физические и химические.
Физические явления — это явления, при которых не происходит превращения одних веществ в другие.
Пример. Изменение формы тела или агрегатного состояния вещества — физические явления.
Химические явления — это явления, в результате которых из одних веществ образуются другие, новые вещества с новыми химическими и физическими свойствами. Химические явления иначе ещё называются химическими реакциями или химическими превращениями.
Пример. Ржавление железа, горение веществ, разложение воды при высокой температуре на водород и кислород — химические явления.
О веществах, вступающих в химическую реакцию, говорят, что они реагируют, взаимодействуют между собой или одни вещества превращаются в другие.
Вещества, которые вступают в химическую реакцию, называются исходными веществами или реагентами. Новые вещества, которые образуются в результате химической реакции, называются продуктами реакции.
Пример. При взаимодействии натрия и воды образуются гидроксид натрия и водород. Натрий и вода — реагенты, а гидроксид натрия и водород — продукты реакции.
Признаки химических реакций
О том, что происходит химическая реакция можно узнать по внешним признакам. Возможные признаки протекания химических реакций:
- изменение цвета;
- образование или растворение осадка;
- выделение газа;
- появление или изменение запаха;
- выделение или поглощение теплоты;
- излучение света.

Пример. Горение веществ часто сопровождается излучением света, выделением запаха и теплоты.
Химические явления внутри и вокруг нас
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.
Мы дальше рассмотрим примеры различных химических явлений, так что этот момент станет понятнее.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).
Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Итак, первым делом поговорим про фотосинтез. Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО2 + 12Н2О + свет = С6Н12О6 + 6О2 + 6Н2О.
Дыхание, наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С6Н12О6 + 6О2 = СО2 + 6Н2О + 2,87 * 106 Дж.
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение.
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.
Уверена, вы замечали, как летом легко дышится после грозы. И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О2 + УФ свет → 2О3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О3.
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 и MgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Интересные химические явления
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить.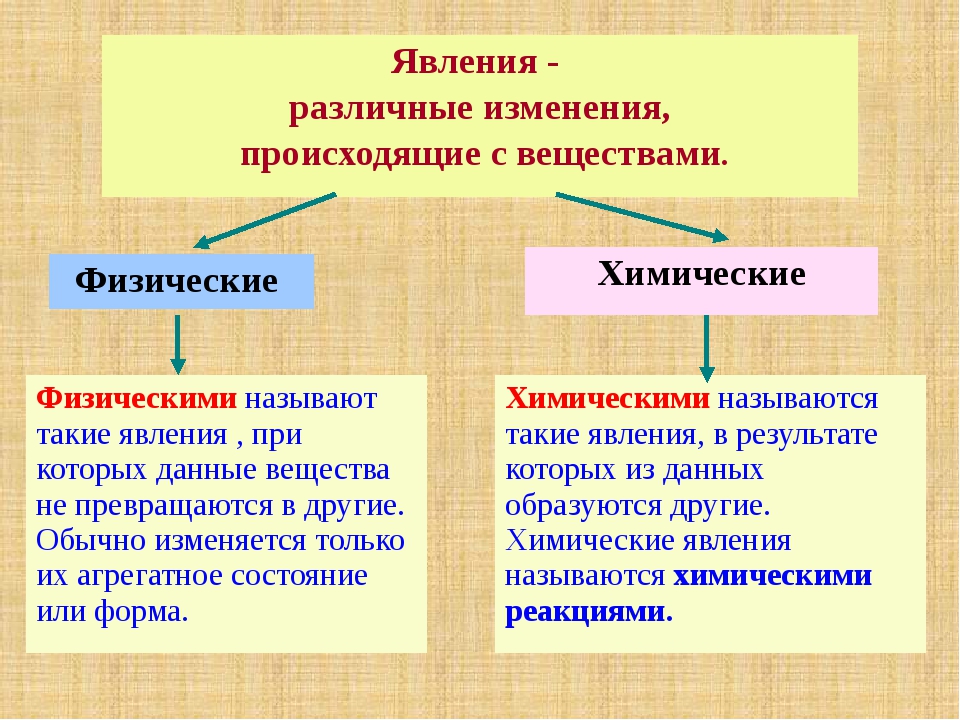 К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление, при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО3. Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты. А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты.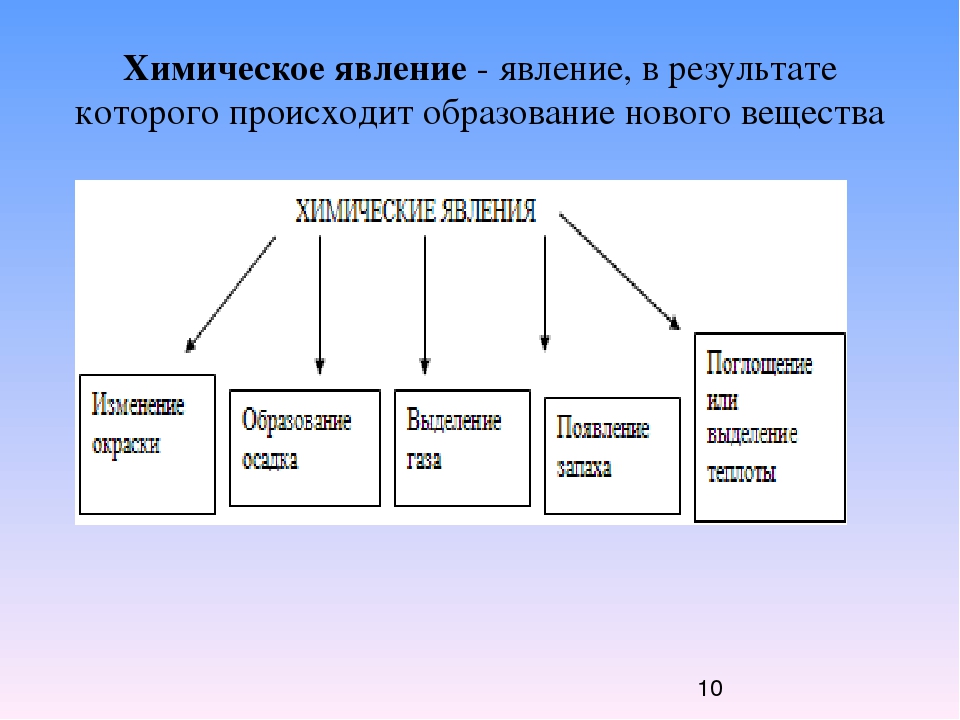
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
Будет здорово, если в комментариях вы расскажете нам, какие еще химические явления вы могли сами наблюдать в природе или у себя дома. И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
04. Химические и физические явления
Изменения веществ, которые не ведут к образованию новых веществ (с иными свойствами), называют физическими явлениями.
1. Вода при нагревании может переходить в пар, а при охлаждении – в лед.
2. Длина медных проводов изменяется летом и зимой: увеличивается при нагревании и уменьшается при охлаждении.
3. Объем воздуха в шаре увеличивается в теплом помещении.
Изменения с веществами произошли, но при этом вода осталась водой, медь – медью, воздух – воздухом.
Новых веществ, несмотря на их изменения по форме или агрегатному состоянию, не образовалось.
Опыт
1. Закроем пробирку пробкой со вставленной в нее трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объем воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3. При охлаждении пробирки объем воздуха уменьшается, и вода входит в пробирку.
Вывод. Изменения объема воздуха – физическое явление.
Задания
Приведи 1–2 примера происходящих с веществами изменений, которые можно назвать физическим явлением. Запиши примеры в тетради.
Химическое явление (реакция) – явление, при котором образуются новые вещества.
А по каким признакам можно определить, что произошла химическая реакция? При некоторых химических реакциях происходит выпадение осадка. Другие признаки – изменение цвета исходного вещества, изменение его вкуса, выделение газа, выделение или поглощение тепла и света.
Примеры таких реакций рассмотри в таблице
Признаки химических реакций | ||||
Изменение цвета исходного вещества | Изменение вкуса исходного вещества | Выпадение осадка | Выделение газа | Появление запаха |
Реакция | Признак |
Изменение цвета | |
Изменение вкуса | |
Выделение газа |
В живой и неживой природе постоянно протекают различные химические реакции. Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Понаблюдаем за некоторыми химическими реакциями.
Опыты с огнем самостоятельно проводить нельзя!!!
Опыт 1
Подержим над огнем кусочек белого хлеба, содержащего органические вещества.
Наблюдаем:
1. обугливание, то есть изменение цвета;
2. появление запаха.
Вывод. Произошло химическое явление (образовалось новое вещество — уголь)
Опыт 2
Приготовим стаканчик с крахмалом. Добавим немного воды, перемешаем. Затем капнем раствором йода.
Наблюдаем признак реакции: изменение цвета (посинение крахмала)
Вывод. Произошла химическая реакция. Крахмал превратился в другое вещество.
Опыт 3
1. Разведем в стакане небольшое количество питьевой соды.
2. Добавим туда несколько капель уксуса (можно взять сок лимона или раствор лимонной кислоты).
Наблюдаем выделение пузырьков газа.
|
Вывод. Выделение газа – один из признаков химической реакции.
Некоторые химические реакции сопровождаются выделением тепла.
Задания
Поместите в стеклянную баночку (или стакан) несколько кусочков сырого картофеля. Добавьте к ним перекись водорода из домашней аптечки. Объясните, по какому признаку можно определить, что произошла химическая реакция.
Физические и химические явления (6-й класс)
Цели урока:
- Закрепить опорные знания понятий “физическое
явление”, “химическое явление”; - Рассмотреть различные явления, встречающиеся в
жизни, классифицировать их, что способствует
развитию логического мышления и способности к
обобщению фактов; - Обеспечить восприятие и осмысление понятий
“признаки химических реакций”; - Создать условия для развития у учащихся умения
анализировать результаты лабораторных
исследований, практических умений работать с
реактивами, оборудованием в соответствии с
правилами безопасности.
Оборудование: компьютер с
мультимедийным проектором, презентация
(приложение), сахар в пробирке, спиртовка, спички,
вода в пробирке, предметное стекло, лучина,
хлорид бария BaCl2, серная кислота H2 SO4,
набор “Механика”, магниты с мелкими
деталями, пищевая сода, уксус, источники тока
(батарейки), провода, ключи, лампочки.
План урока:
- Организация начала урока.
- Активизация внимания. Физический диктант по
теме “Световые явления”. - Изучение нового материала.
- Закрепление новых знаний.
- Домашнее задание.
- Подведение итогов урока.
Ход урока
1. Организация начала урока.
Учитель (У) приветствует учеников,
называет тему урока (слайд 1).
Ученики записывают тему урока в тетрадь.
2. Активизация внимания.
У.: Ребята, достали половину листа,
проверяем домашнее задание.
Вопросы физического диктанта по теме
“Световые явления”.
- Назовите законы распространения света;
- Как расположены Солнце, Земля, Луна при
солнечном затмении? - Какое изображение в плоском зеркале:
действительное или мнимое? - Постройте ход луча (рис.1).
- Назовите недостатки зрения и методы их
исправления.
У.: Ребята, сдали листочки. А теперь
проверяем ответы.
У. называет правильные ответы.
3. Изучение нового материала.
У.: Из курса физики 5 класса вы знаете, что с
телами и веществами происходят изменения,
которые называются явлениями природы (слайд 2). Явления природы делятся на
физические и химические явления. Давайте
Давайте
повторим, что называется физическими и
химическими явлениями (стр. 7, 8 учебника).
Физическими называют такие явления, при
которых не происходит превращений одних веществ
в другие, а меняются их агрегатные состояния,
форма и размеры тел (слайд 3).
Примеры: таяние снега, гром и молния, отражение
и преломление света, механическое движение –
полет парашютиста (слайды 4, 5).
Химическими называют такие явления, при
которых происходит превращения одних веществ в
другие (слайд 6). Примеры: ржавление
железа, скисание молока, окисление монет (слайд 7).
В дальнейшем химические явления мы будем
называть химическими реакциями.
Любая химическая реакция сопровождается
внешними признаками, по которым мы и судим о её
протекании (слайды 8, 9). Это:
- Выделение газа;
- Образование осадка;
- Изменение цвета;
- Выделение или поглощение тепла;
- Изменение запаха и вкуса.
Например, выделение газа при соединении
раствора соды и уксуса, изменение цвета и запаха
при нагревании куска хлеба.
А теперь приведите свои примеры физических и
химических явлений.
Ученики приводят примеры физических и
химических явлений.
У.: Замечательно, а сейчас проверим,
как вы поняли различия между физическими и
химическими явлениями. В тетрадях ответьте на 5
вопросов (слайд 10): если явление
физическое — напротив номера явления поставьте
букву “Ф”, химическое – “Х”.
Учащиеся выполняют задание.
У.: Выполняем лабораторную работу.
Записали в тетради название работы (слайд
11, 12), цель работы. В ходе выполнения работы вы
будете заполнять таблицу (слайд 13).
Часть опытов показываю вам я, а часть опытов вы
делаете сами.
Демонстрации, проводимые учителем:
1. Нагревание сахара: в пробирке в пламени
спиртовки нагреваем сахар. Учащиеся наблюдают
изменение цвета, запаха, выделение угля, газа и
воды, заполняют таблицу.
2. Нагревание воды в пробирке в пламени спиртовки:
поднесли холодное стекло – вода
сконденсировалась на стекле.
3. Зажигание лучины: выделялось тепло, свет,
лучина превратилась в золу.
4. Смешивание хлорида бария BaCl2 и серной
кислоты H2SO4: выделялся осадок,
изменялся цвет.
Таблица.
| № опыта | Что делали | Что наблюдали | Явление |
| 1 | Нагревали сахар | Изменялся цвет, запах, выделялся уголь,
газ и вода | Химическое |
| 2 | Нагревали воду | Вода испарялась | Физическое |
| 3 | Подносили стекло | Вода сконденсировалась | Физическое |
| 4 | Зажигали лучину | Выделялось тепло, свет, лучина
превратилась в золу | Химическое |
| 5 | Смешивали хлорид бария BaCl2 и
серную кислоту H2SO 4 | Выделялся осадок, изменялся цвет. | Химическое |
| 6 | Каретку отпускали по наклонной
плоскости | Изменялось положение каретки в
пространстве | Физическое |
| 7 | Подносили магнит к мелким деталям | Детали притягивались к магниту | Физическое |
| 8 | Смешивали пищевую соду и уксус | Выделялся газ | Химическое |
| 9 | Включали лампу накаливания | Свет и тепло | Физическое |
| Вывод | Химические реакции
сопровождаются выделением газа, осадка, света, тепла, изменением цвета, запаха, вкуса | ||
Далее ученики выполняют работу самостоятельно.
5. Движение каретки по наклонной плоскости:
изменялось положение каретки в пространстве.
6. Притягивание магнитом мелких деталей.
7. Смешивание пищевой соды и уксуса: выделялся
газ.
8. Включение электрической лампы накаливания.
У.: Ребята, какой вывод можно сделать?
Вывод: химические реакции
сопровождаются выделением газа, осадка, света,
тепла, изменением цвета, запаха, вкуса (слайд 14).
4. Закрепление новых знаний.
У.: Ребята, ответьте на вопросы:
1. В чем отличие и сходство горения лучины и
электрической лампы?
2. При взаимодействии сульфата меди и гидрооксида
натрия образуется осадок. Какое это явление?
5. Домашнее задание.
Учитель задает домашнее задание (слайд 15).
6. Подведение итогов урока.
У.: Мы с вами хорошо поработали,
спасибо за урок. У вас есть вопросы? Не забудьте
сдать тетради. До свидания.
Литература:
- Гуревич А. Е., Исаев Д. А., Понтак Л. С. Физика.
Химия. 5-6 классы. — М.: Дрофа, 1999 –2008. - Гуревич А. Е., Исаев Д. А., Понтак Л. С.
Методическое пособие “Физика. Химия. 5-6 классы”.
– М.: Дрофа, 1998 г.
Чем отличаются химические явления от физических
Изменения, происходящие с окружающими нас объектами, классифицируются как химические и физические явления. Чтобы научиться распознавать те и другие, необходимо разобраться в самой их сути.
Определение
Химическими называют явления, приводящие к возникновению абсолютно иных веществ из исходных. Примеры: горение щепки, получение кефира из молока, образование крахмала в растениях.
Физическими называют явления, не затрагивающие молекулярную структуру веществ. Примеры: лепка из пластилина, образование инея, лопается шарик.
к содержанию ↑
Сравнение
Таким образом, решающим критерием становится глубина происходящих изменений. Отличие химических явлений от физических состоит в том, что в первом случае исходные вещества полностью разрушаются, а во втором они остаются сами собой. Иными словами, химические процессы приводят к более кардинальным изменениям, ведь они протекают на молекулярном уровне.
Подобные реакции могут происходить при непосредственном контакте веществ в отсутствие дополнительных факторов, а также под действием электричества, световых волн, при нагревании или участии катализаторов. На выходе получаются вещества с новым составом и свойствами. К примеру, ржавчина, в которую на воздухе под воздействием влаги преобразуется слой железного листа, –это вещество совсем с другими характеристиками, чем само железо.
О том, что произошло химическое превращение, свидетельствуют определенные признаки. В одном случае меняется вкус (как у капусты после квашения), в другом – цвет (посинение крахмального раствора при добавлении в него капли йода), в третьем – выделяется газ (взаимодействие соды и уксуса). Может также образоваться осадок, появиться особый запах или произойти выработка тепла.
В чем разница между химическими и физическими явлениями? В том, что последние, осуществляясь без разрушения молекул, влекут за собой изменения иного характера. Например, наблюдается переход в какое-то другое агрегатное состояние (твердый шоколад в ладони тает). Меняться могут форма (раскатывание теста), размеры (уменьшение длины проводов в мороз), положение в пространстве (падение мяча). Но химический состав во всех случаях остается прежним.
к содержанию ↑
Таблица
| Химические явления | Явления физической природы |
| Разрушение исходных веществ | Молекулярный состав не затрагивается |
| Получение других веществ с присущими им свойствами | В результате новые вещества не образуются |
| Признаки: выработка тепла, выделение газа, появление осадка, изменение таких характеристик, как вкус, цвет, запах | Могут меняться: размеры, форма, положение в пространстве, агрегатное состояние |
§ 14. Физические и химические явления — ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ — ГДЗ химия — Решение упражнений и задач к учебнику «Химия» А. В. Григорович 7 класс 2015 год
ТЕМА И. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
§ 14. Физические и химические явления
Задания для усвоения материала
№ 1. Условия протекания реакций: а) смешивание веществ, в) предварительный нагрев веществ, д) предварительное растворение реагирующих веществ.
№ 2. Ответ: а) молекулы реагентов разрушаются, а из них образуются новые молекулы; г) атомы в химических реакциях не изменяются; д) атомы перегруппировываются, образуя молекулы новых веществ.
№ 3. Примеры физических явлений, при которых изменяется агрегатное состояние веществ: таяние снега, испарение капле росы; закипания воды, замерзание воды.
№ 4. Примеры химических реакций: ржавления железа, брожение квашеной капусты, скисание молока.
№ 5.
Физические явления | Химические явления |
а) Зимой ветви деревьев покрывается изморозью. в) Разлитый ацетон быстро испаряется. г) Запах разлитых духов быстро распространяется по всей комнате. ж) Капля грязи на ботинке до утра превращается в коричневое пятно. с) Ржавый гвоздь очищается от ржавчины наждачной бумагой. | б) За зиму опавшие листья сгнивают. д) Со временем на стенках чайника образуется накипь. е) В теплом месте молоко быстро скисает. есть) Бронзовые памятники покрываются зеленым налетом. |
№ 6. Приведите примеры химических явлений, которые сопровождаются изменением агрегатного состояния веществ.
№ 7. Признаки химических реакций: а) во время горения костра: выделение света, тепла, изменение цвета; б) во время ржавления железа: изменение цвета; в) во время скисания пищи: выделение газа, появление запаха.
№ 8. Приведите примеры химических реакций из повседневной жизни, которые происходят:
а) при постоянном нагревании жир на сковороде начинает подгорать. О ходе этой реакции мы узнаем за появлением запаха акролеина — продукта разложения жира.
б) после первичного нагрева;
в) под действием света происходит фотосинтез;
г) цвет листьев на деревьях осенью меняется от зеленого до желтого или красного.
Явления природы (биологические, физические, химические) | Природоведение. Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга
Как известно, явления — это изменения, происходящие с телами природы. В природе наблюдаются разнообразные явления. Светит Солнце, образуется туман, дует ветер, бегут лошади, из семени прорастает растение — это лишь некоторые примеры. Повседневная жизнь каждого человека также наполнена явлениями, происходящими при участии рукотворных тел, например, едет автомобиль, нагревается утюг, звучит музыка. Посмотрите вокруг, и вы увидите и сможете привести примеры многих других явлений.
Учёные разделили их на группы. Различают биологические, физические, химические явления.
| Явления природы |
Биологические явления. Все явления, которые происходят с телами живой природы, т.е. организмами, называются биологическими явлениями. К ним относятся прорастание семян, цветение, образование плодов, листопад, зимняя спячка животных, полёт птиц (рис. 29).
Физические явления. К признакам физических явлений относятся изменение формы, размеров, места расположения тел и их агрегатного состояния (рис. 30). Когда гончар изготовляет из глины какое-либо изделие, изменяется форма. При добыче каменного угля изменяются размеры кусков горной породы. Во время движения велосипедиста изменяется размещение велосипедиста и велосипеда относительно тел, расположенных вдоль дороги. Таяние снега, испарение и замерзание воды сопровождаются переходом вещества из одного агрегатного состояния в другое. Во время грозы гремит гром и появляется молния. Это физические явления.
| Рис. 29. Биологические явления; а — прорастание семян, б — полёг птицы; в — листопад |
| Рис. 30. Физические явления |
Согласитесь, что данные примеры физических явлений очень разные. Но какими бы разнообразными не были физические явления, ни в одном из них не происходит образование новых веществ.
Физические явления — явления, во время которых новые вещества не образуются, но изменяются размеры, форма, размещение, агрегатное состояние тел и веществ.
Химические явления. Вам хорошо известны такие явления, как горение свечи, образование ржавчины на железной цепи, скисание молока и др. (рис. 31). Это примеры химических явлений. Материал с сайта //iEssay.ru
| Рис. 31. Химические явления: а — ржавение металла; б — выделение углекислого газа при добавлении в соду уксуса; в — химический анализ воды |
Химические явления — это явления, во время которых из одних веществ образуются другие.
Химические явления имеют широкое применение. С их помощью люди добывают металлы, создают средства личной гигиены, материалы, лекарства, готовят разнообразные блюда.
На этой странице материал по темам:
- биологические явления
- явление природы сочинение кратко
- сообщение о биологическом явлении
- конспект на тему химические явления в природе
- биологическое сочинение на тему листопад
Феномен NGSS — Пример научного явления
Считается ли это химической реакцией?
Откуда мы знаем?
Какие химические вещества?
Почему они реагируют?
Откуда берется энергия?
Куда уходит энергия?
Как выпускается?
Как он хранился в первую очередь?
Есть что-нибудь о материале?
Могут ли вопросы Crosscutting Concept помочь нам в этом разобраться?
1.Какие паттерны я замечаю в этом явлении?
2. Каковы границы этого явления? Каковы его компоненты и как они взаимодействуют с ?
3. Что происходит на ненаблюдаемых уровнях от до вызывает наблюдаемых функций или процессов?
4. Какая шкала или шкала объясняют это явление и как я могу описать его количественно ?
5.Как энергия и / или материя втекают, выходят или входят в границы явления?
6. Как структура явления (или его компонентов) соотносится с его функцией ?
7. При каких условиях это явление стабильно ? При каких условиях меняет ?
(Список принадлежит блестящей педагогу Хизер Майло !!)
ДИСЦИПЛИНАРНЫЕ ОСНОВНЫЕ ИДЕИ
PS1.A: СТРУКТУРА И СВОЙСТВА ВЕЩЕСТВА
Вещества состоят из атомов разных типов, которые по-разному сочетаются друг с другом. Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1)
Твердые тела могут состоять из молекул или представлять собой протяженные структуры с повторяющимися субъединицами (например, кристаллы). (MS-PS1-1)
PS1.B: ХИМИЧЕСКИЕ РЕАКЦИИ
Вещества химически реагируют характерным образом.В химическом процессе атомы, из которых состоят исходные вещества, перегруппировываются в разные молекулы, и эти новые вещества имеют свойства, отличные от свойств реагентов. (MS-PS1-2), (MS-PS1-3), (MS-PS1-5)
Общее количество атомов каждого типа сохраняется, и, таким образом, масса не изменяется. (MS-PS1-5)
Некоторые химические реакции выделяют энергию, другие накапливают энергию. (MS-PS1-6)
PS3.A: ОПРЕДЕЛЕНИЯ ЭНЕРГИИ
Термин «тепло», используемый в повседневном языке, относится как к тепловой энергии (движению атомов или молекул внутри вещества) и передача этой тепловой энергии от одного объекта к другому.В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4)
Температура системы пропорциональна средней внутренней кинетической энергии и потенциальной энергии на атом или молекулу (в зависимости от того, что является подходящим строительным блоком для материала системы). Детали этой связи зависят от типа атома или молекулы и взаимодействия между атомами в материале.Температура не является прямым показателем общей тепловой энергии системы. Полная тепловая энергия (иногда называемая полной внутренней энергией) системы зависит от температуры, общего числа атомов в системе и состояния материала. (вторичный по отношению к MS-PS1-4)
Какая наука стоит за этим ?? Примечание: не смотрите сюда, пока не попробуете написать свои собственные объяснения! — http://jchemed.chem.wisc.edu/blog/how-does-orange-peel-pop-balloon-chemistry-course
Ожидаемые характеристики
MS-PS1-2.
Анализируйте и интерпретируйте данные о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция. [Уточнение: Примеры реакций могут включать сжигание сахара или стальной ваты, реакцию жира с гидроксидом натрия и смешивание цинка с хлористым водородом.] [ Граница оценки: Оценка ограничивается анализом следующих свойств: плотность, плавление точка, температура кипения, растворимость, воспламеняемость и запах.]
Химические явления — обзор
2 Моделирование реактора
Соответствующие и полезные модели должны учитывать все физические и химические явления, связанные с процессом осаждения. К ним относятся диффузия газообразных частиц к растущей поверхности и от нее в неизотермическом поле потока, адсорбция реагентов и их диффузия на твердых поверхностях, поверхностные реакции и включение атомов в растущую пленку. В зависимости от того, какой из этих шагов определяет скорость, становятся очевидными два различных температурных режима.При низких температурах преобладают кинетические аспекты, приводящие к скорости роста, которая сильно зависит от температуры. При более высоких температурах преобладают явления переноса через газовую фазу и наблюдается плавная зависимость скорости роста от температуры. Это называется режимом роста массопереноса, и эпитаксиальный рост обычно происходит в этом режиме, потому что эти условия приводят к максимально допустимой скорости роста. Однако реакторы при очень низких давлениях могут работать в кинетически контролируемом режиме, когда поверхностные реакции определяют скорость процесса.
Из предыдущего анализа следует, что полное моделирование процессов осаждения включает понимание явлений, происходящих на различных масштабах длины (Carrà and Masi 1998). Как правило, при моделировании эпитаксиальных реакторов все этапы на поверхности, участвующие в механизме роста террасы-ступеньки-излома, типичного для кремниевой эпитаксии, не включаются в формулировку модели, поскольку они включены в морфологические модели, решенные « a priori ». Чаще оперативные условия эпитаксии определяются экспериментально.Таким образом, модели относятся только к масштабу реактора, где рассматриваемые явления относятся к области гидродинамики, явлений переноса, газовой фазы и кинетики поверхности, анализ которой может быть выполнен с помощью традиционного подхода, основанного на непрерывных уравнениях сохранения.
Соответственно, общая модель реактора для эпитаксии кремния включает непрерывность, импульс и уравнения сохранения энергии вместе с уравнением сохранения массы для прекурсора осаждения, написанным для псевдостационарных условий (Jensen 1993).Поскольку системы CVD обычно работают в разбавленных условиях, можно использовать более простой закон Фика для массового потока вместо подробных уравнений Стефана – Максвелла. Кроме того, учитывая важную роль эффекта термодиффузии, такой вклад должен быть включен в выражение потока массы всякий раз, когда внутри реактора присутствуют большие градиенты температуры (Coltrin и др. , 1986). Что касается энергетического баланса, вклады теплоты реакции и теплоты, генерируемой вязкой диссипацией, обычно не учитываются из-за обычно низких конверсий и высоких разбавлений в этих реакторах.Согласно рассмотренной выше гипотезе уравнения модели типичного реактора для CVD-эпитаксии кремния следующие:
(1) ρu⋅∇u + ∇P = ρg + ∇⋅ [μ∇u + μ∇ut − 23μI∇⋅u]
(2) ρu = 0
(3) ρCPu⋅∇T = ∇⋅ (kT∇T)
(4) ρu⋅∇ωi = −∇⋅ [ρDi (∇ωi − αiωi∇lnT)] + Mi∑m − 1NRGvimGR˜mG
, где u — вектор скорости газа, g , P , ρ, μ, C p и k T — ускорение свободного падения, давление в системе, массовая плотность и вязкость газа, удельная теплоемкость газовой смеси и ее теплопроводность соответственно.ω i , D i , α i и M i — массовая доля частицы i , ее бинарный коэффициент диффузии внутри газа-носителя, коэффициент термодиффузии и его молекулярная масса, соответственно, а ν и указывают его стехиометрический коэффициент в реакции м и соответствующую скорость реакции. I , а верхние индексы t, G и S указывают единичную матрицу, транспонированную матрицу или вектор и величину, относящуюся к газу или поверхности, соответственно.Из-за обычно низких рабочих давлений и высоких температур, существующих в этих реакторах, плотность газа можно рассчитать с помощью уравнения состояния идеальных газов (ρ = PM T / RT ). Кроме того, необходимо учитывать температурную зависимость всех физических и химических свойств, присутствующих в модели (Jensen 1993, Masi и др. . 1996, Yang и др. . 1992).
Граничные условия уравнений. (1) — (4) специфичны для конфигурации реактора, но некоторые из них носят общий характер, например, условия без проскальзывания и непроникания на твердых стенках.Из-за включения атомов и высвобождения газообразных частиц на границе роста должна существовать строго конечная скорость, нормальная к подложке, но такое значение обычно настолько мало, что им можно пренебречь. Скорость потока на входе обычно указывается, а на выходе устанавливаются условия отсутствия напряжения или полностью развитого потока. Тепловые граничные условия существенно влияют на поток. Как правило, рассматривается упрощенная модель системы с постоянными температурами токоприемника и стенки, но в более подробных расчетах следует включать надлежащие граничные условия теплового потока, отражающие преобладающие условия (Kleijn et al .1996 г., Toprac и др. . 1994). Что касается граничного условия сохранения массы, обычно не предполагается, что поток на нереагирующих поверхностях отсутствует. На поверхностях осаждения поток массы приравнивается к чистой скорости включения за счет поверхностных химических реакций, R˜mS:
(5) −ρDin⋅ (∇ωi − αiωi∇lnT) + Mi∑m − 1NRSvimSR˜mS
Поскольку уравнения модели нелинейны, их приходится решать численно. Доступны коммерческие коды вычислительной гидродинамики общего назначения для решения уравнений CVD (например,g., CFX4, FIDAP, FLUENT, MP-SALSA и PHOENICS-CVD). Все эти коды имеют разумные возможности для обработки сложных симуляций потока: двумерные модели с большим кинетическим механизмом или трехмерные модели в условиях ограничения переноса и умеренно сложной геометрии представляют пределы существующей сложности моделирования. Учитывая резкий рост возможностей компьютеров, эти ограничения будут сняты в ближайшем будущем.
Пример уровня точности, который может быть достигнут с помощью этого моделирования, можно вывести из рис.2 (Маси и др. , 1996). Там, помимо естественного результата двумерного моделирования в терминах линий тока и изотерм, показано сравнение расчетного и экспериментального профиля скорости роста (без настройки каких-либо параметров) для эпитаксиального осаждения кремния из SiCl 4 / H 2 смеси в бочкообразном реакторе. Согласие будет даже лучше, если исследовать геометрически более простые реакторы (Habuka и др. . 1996, Kleijn и др. . 1996).
Рис. 2. Моделирование цилиндрического реактора LPE 861 для эпитаксии кремния. Атмосферное давление; температура токоприемника = 1523К; температура стенки = 460К; H 2 расход = 0,41 гс -1 ; SiCl 4 расход = 0,28 гс -1 ; наклон приемника = 3 °; длина токоприемника = 0,45 м; Диаметр пластины = 0,127 м. (а) Пример рассчитанных линий тока, изотерм и линий изокомпозиции. (b) Сравнение расчетных (линии) и экспериментальных значений скорости роста вдоль продольной средней линии токоприемника для двух разных наружных диаметров колокола (по Masi et al .1996).
Когда геометрия реактора может быть уменьшена до более простых воздуховодов (кольцевых или прямоугольных) или почти «без стенки», можно также использовать более простые модели, полученные из приведенных выше уравнений. Они относятся к консолидированным отношениям, полученным с помощью теории пограничного слоя для оценки параметров переноса массы и тепла. Полученные одномерные модели могут удовлетворительно описывать эволюцию скорости роста только по главной координате рассматриваемого реактора. Примеры, приведенные в литературе, относятся к вертикальным, горизонтальным и цилиндрическим реакторам (Carrà and Masi 1998).
Помимо вычислительных трудностей, оценка параметров процесса представляет собой проблему. Оценка термодинамических (например, энтальпии и теплоемкости) и транспортных параметров (например, вязкости, теплопроводности и диффузии) проще, чем оценка кинетических (например, параметров скорости реакции). Доступен большой набор термодинамических параметров для всех молекул и радикалов, участвующих в осаждении кремния. Значения определены экспериментально или с помощью квантово-химических расчетов (Chase et al .1985, Coltrin и др. . 1986). Параметры переноса можно оценить с помощью консолидированных соотношений, полученных из молекулярной теории газов, как функции параметров Леннарда-Джонса (Рейд и др. , 1986). Установление подробного химического механизма требует сочетания экспериментального и теоретического анализа. Теоретические оценки констант скорости реакции « a priori » возможны с помощью теории переходного состояния в сочетании с подходящими квантово-химическими программами « ab initio » (например.г., AMPAC, Gaussian98). В связи с их промышленным значением кинетика разложения большинства прекурсоров кремния была подробно изучена. Таким образом, для этих видов теперь доступны почти консолидированные химические механизмы. Обсуждение вовлеченных реакций и оценка их констант скорости приведены ниже.
Самый быстрый словарь в мире: Vocabulary.com
химическое явление любое природное явление, связанное с химией
физическое явление природное явление, связанное с физическими свойствами материи и энергии
механическое явление физическое явление, связанное с равновесием или движением предметов
геологическое явление природное явление, связанное со структурой или составом земли
оптическое явление физическое явление, связанное со светом или с его участием
электрическое явление физическое явление, связанное с электричеством
Феномен Любое состояние или процесс, известный через органы чувств
природные явления Все неискусственные явления
химический элемент любое из более чем 100 известных веществ (из которых 92 встречаются в природе), которые не могут быть разделены на более простые вещества и которые по отдельности или в комбинации составляют все вещество
психический феномен Явления, которые кажутся противоречащими физическим законам и предполагают возможность причинной связи психическими процессами
органическое явление природное явление с участием живых растений и животных
химическая нотация обозначение, используемое химиками для выражения технических фактов в химии
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
химическая инженерия отрасль машиностроения, которая занимается проектированием, строительством и эксплуатацией установок и оборудования, используемых в промышленных химических процессах
Феномен Тарчанова — изменение электрических свойств кожи в ответ на стресс или тревогу; можно измерить либо путем регистрации электрического сопротивления кожи, либо путем регистрации слабых токов, генерируемых телом
химическая формула: обозначение вещества с использованием символов составляющих его элементов
Процесс химического изменения, определяемый составом и структурой веществ
химическая реакция процесс, в котором вещества превращаются в другие
эпифеномен вторичный феномен, являющийся побочным продуктом другого явления
примеров химических реакций в повседневной жизни
Примеры химических реакций в повседневной жизни включают фотосинтез, ржавчину, выпечку, пищеварение, горение, химические батареи, ферментацию и мытье водой с мылом.
Химические реакции происходят повсюду в мире вокруг вас, а не только в химической лаборатории. Вот 20 примеров химических реакций в повседневной жизни и более пристальный взгляд на то, что происходит на молекулярном уровне.
Как распознать химическую реакцию
Первый шаг к распознаванию химических реакций в окружающем мире — это определить, когда реакция имеет место. Химические реакции вызывают химические изменения. Другими словами, вещества взаимодействуют и образуют новые продукты.Не всякое изменение вещества — это химическая реакция. Например, таяние льда, разрыв листа бумаги на полоски и растворение сахара в воде — это физические изменения, которые не меняют химическую идентичность вещества.
Вот некоторые признаки химической реакции. Если присутствует более одного знака, это похоже на реакцию:
- Изменение температуры
- Изменение цвета
- Запах
- Пузырьки или образование газа
- Образование твердого вещества, называемого осадком, при смешивании жидкостей
20 Примеры химических реакций в повседневной жизни
Вот несколько общих примеров химических реакций в повседневной жизни:
- Горение
- Фотосинтез
- Аэробное клеточное дыхание
- Анаэробное дыхание (включая ферментацию)
- Окисление (включая ржавчину)
- Реакции метатезиса (например, пищевая сода и уксус)
- Электрохимия (включая химические батареи)
- Пищеварение
- Реакции мыла и моющих средств
- Кислотно-основные реакции
- Варка
- Фейерверк
- Гниение продуктов питания
- Гальваника металлов
- Дезинфекция поверхностей и ct линзы
- Наркотики
- Отбеливание
- Цвет волос
- Листья меняют цвет в зависимости от сезона
- Соль удерживает лед на дорогах и помогает заморозить мороженое
Более пристальный взгляд на химические реакции в повседневной жизни
посмотрите на некоторые повседневные реакции, а также на некоторые химические уравнения.
Возгорание
Вы испытываете реакцию возгорания, когда зажигаете спичку, зажигаете свечу, разводите костер или зажигаете гриль. В реакции горения топливо реагирует с кислородом воздуха с образованием воды и углекислого газа. Вот реакция сгорания пропана, топлива, используемого в газовых грилях и некоторых каминах:
C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + энергия
Фотосинтез
Растения используют химическую реакцию, называемую фотосинтезом, для преобразования углекислого газа и воды в пищу (глюкозу) и кислород.Это ключевая реакция, потому что она производит кислород и дает пищу для растений и животных. Общая химическая реакция фотосинтеза:
6 CO 2 + 6 H 2 O + свет → C 6 H 12 O 6 + 6 O 2
Аэробное клеточное дыхание
Животные используют кислород, поставляемый растениями, для осуществления обратной реакции фотосинтеза, чтобы получить энергию для клеток. При аэробном дыхании глюкоза и кислород реагируют с образованием воды и химической энергии в форме аденозинтрифосфата (АТФ).Вот общее уравнение аэробного клеточного дыхания:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + энергия (36 ATP)
Анаэробный Клеточное дыхание
У организмов также есть способы получать энергию без кислорода. Люди используют анаэробное дыхание во время интенсивных или продолжительных упражнений, чтобы получить достаточно энергии для мышечных клеток. Дрожжи и бактерии используют анэробное дыхание в форме ферментации для производства повседневных продуктов, таких как вино, уксус, йогурт, хлеб, сыр и пиво.Уравнение для одной формы анэробного дыхания:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + энергия
Окисление
Rust, verdigris и потускнение — все это примеры обычных реакций окисления. Когда железо ржавеет, оно меняет цвет и текстуру, образуя чешуйчатое покрытие, называемое ржавчиной. При реакции также выделяется тепло, но обычно происходит слишком медленно, чтобы это было заметно. Вот химическое уравнение ржавления железа:
Fe + O 2 + H 2 O → Fe 2 O 3 .XH 2 O
Электрохимия
Электрохимические реакции — это окислительно-восстановительные реакции (окислительные и восстановительные), которые преобразуют химическую энергию в электрическую. Тип реакции зависит от аккумулятора. Спонтанные реакции происходят в гальванических ячейках, в то время как неспонтанные реакции происходят в электролитических ячейках.
Пищеварение
Пищеварение — это сложный процесс, который включает тысячи химических реакций. Когда вы кладете еду в рот, вода и фермент амилаза расщепляют сахар и другие углеводы на более простые молекулы.Соляная кислота и ферменты расщепляют белки в желудке. Бикарбонат натрия, попадающий в тонкий кишечник, нейтрализует кислоту и защищает пищеварительный тракт от растворения.
Реакции с мылом и моющими средствами
Мытье рук водой не является химической реакцией, потому что вы просто механически смываете грязь. Если вы добавите мыло или моющее средство, произойдут химические реакции, которые превратят жир в эмульсию и снизят поверхностное натяжение, так что вы сможете удалить масляную грязь. Еще больше реакций происходит со стиральным порошком, который может содержать ферменты, расщепляющие белки, и отбеливатели, чтобы одежда не выглядела грязной.
Приготовление пищи
Простое смешивание сухих ингредиентов обычно не приводит к химической реакции. Но добавление жидкого ингредиента часто приводит к реакции. Приготовление с использованием тепла также вызывает реакции. Смешивание муки, сахара и соли не является химической реакцией. Также не смешиваются масло и уксус. Приготовление яйца — это химическая реакция, потому что при нагревании белки в яичном белке полимеризуются, а водород и сера в желтке могут реагировать с образованием газообразного сероводорода. Когда вы нагреваете сахар, происходит реакция, называемая кармелизацией.Когда вы нагреваете мясо, оно коричневеет из-за реакции Майяра. Выпечка поднимается из-за пузырьков углекислого газа, образующихся в результате реакции между разрыхлителем или содой и жидкими ингредиентами.
Кислотно-основные реакции
Кислотно-основные реакции происходят всякий раз, когда вы смешиваете кислоту (например, лимонный сок, уксус, соляную кислоту, аккумуляторную кислоту, угольную кислоту из газированных напитков) с основанием (например, пищевой содой, аммиаком, щелоком ). Хорошим примером кислотно-щелочной реакции является реакция между пищевой содой и уксусом с образованием ацетата натрия, воды и углекислого газа:
NaHCO 3 + HC 2 H 3 O 2 → NaC 2 H 3 O 2 + H 2 O + CO 2
Обычно реакция между кислотой и основанием дает соль и воду.Например, если вы прореагируете соляной кислотой (HCl) и щелоком (NaOH), вы получите поваренную соль (NaCl) и воду (H 2 O):
HCl + NaOH → NaCl + H 2 O
In В этой реакции две прозрачные жидкости образуют другую прозрачную жидкость, но вы можете сказать, что реакция происходит, потому что она выделяет много тепла.
Химические изменения | |||
I Это F нашего июля в Взрыв фейерверка — это Во время химического изменения , веществ заменяются на разные | |||
Знаки Как узнать, является ли изменение Если вы думаете, что не знакомы с химическими изменениями, | Физические изменения относительно легко идентифицировать.Если изменяется только форма вещества, вы наблюдаете физическое изменение. Обычное физическое изменение происходит, когда материя | ||
| C ol o r Изменения Как и в случае с осенними листьями, изменение окраски Возможно, вы нашли наполовину съеденное яблоко, которое превращается | Вы только что стали свидетелями впечатляющего химическое изменение, если вы видели изменение листьев цвет осенью. | ||
| Когда ты испечь пирог, энергия поглощается жидким тестом, поскольку оно превращается в жидкое смешать в торт. | Энергия — Поглощено или высвобождено Еще один признак химического изменения — выброс или усиление | ||
| Энергия также может быть выпущена во время химической смены. Фейерверки упомянутые выше высвобождают энергию в виде света что вы можете видеть. Вы также можете видеть, что энергия высвобождается, когда в этом | |||
| Запах Изменения Достаточно одного опыта с тухлым яйцом, чтобы научиться . | Когда вы чувствуете странный запах в еде такие как курица, свинина из майонеза, вы знаете, что еда подверглась химическое изменение. Вы можете использовать эту подсказку, чтобы не есть испорченные еда и заболевание. | ||
| Производство Газы или твердые вещества Образование газа — ключ к разгадке химического Еще один признак того, что произошло химическое изменение, — это | |||
| Когда дерево горит, оно превращается в кучу пепла и газы, поднимающиеся в воздух.После того, как дрова обожжены, его нельзя восстановлен в первоначальном виде в виде бревна. | Непросто перевернутый Чем отличаются друг от друга физические и химические изменения | ||
| Химический и физический Смена | T самое важное самое важное то, что вам нужно запомнить, это что при физическом изменении состав вещества не меняется а при химическом изменении состав вещества менять. | ||
| Химическая промышленность Реакции Химические изменения также называются химическими Дело никогда | |||
| Чтобы создать собственное химическое изменение, нажмите на Fireworks. Найти больше интересной информации о фейерверках, которые вы видите, нажмите здесь. Хранение потребительских фейерверков в Род-Айленде запрещено законом. | |||
Химические реакции
Основные идеи толкания и тяги исследуются в
Противопоставление взглядов студентов и ученых
Ежедневный опыт студентов
Дети испытали множество примеров химических изменений, даже не осознавая этого. Они знакомы с процессами горения, приготовления пищи, ржавления и химическими процессами, которые предполагают растворение. Однако на этом уровне ученики не видят, что новые материалы производятся в результате химических изменений, скорее они видят, что существующие материалы просто каким-то образом были изменены.Например, они видят дым как часть дерева, который каким-то образом выделяется при горении дерева. Поскольку учащиеся редко понимают понятие «вещество», они не видят изменения веществ. Тем не менее, понимание химических изменений является фундаментальным для понимания роли химии в их жизни, и на этом уровне студенты могут начать это понимать.
Студенты часто считают, что для того, чтобы получить что-то новое, нужно просто смешать все вместе. Когда химическая реакция действительно имеет место, они считают, что тот или иной реагент просто модифицируется; на самом деле это не изменилось.Например, учащиеся считают, что ржавчина — это железо / сталь; он только что стал коричневым. Точно так же обычно не замечают отслаивания ржавчины — считается, что утюг просто исчезает. Пузырьки газа, которые часто образуются при растворении таблетки в воде, часто не воспринимаются студентами как новое вещество. Такие процессы, как смешивание с водой, использование красителей в пище, замораживание и кипячение, считаются аналогичными химическим изменениям, которые происходят при приготовлении яиц.
Исследование: Johnson (2002)
Дети часто верят, что при сгорании такие материалы, как дерево или бумага, просто исчезают — в конце концов, от продукта остается немного.По их мнению, воздух имеет мало общего с горением. Студенты считают, что при сжигании углеродных материалов, таких как дерево, древесный уголь (углерод) появляется из
горит , а не
материал .
Исследование: Университет штата Аризона (2001)
Поскольку многие дети знают о таких вещах, как приготовление пищи и сжигание, они предполагают, что тепло всегда необходимо для возникновения реакций.
В обиходе слово «химический» часто используется как ярлык для нежелательных вещей, которых не должно быть в пищевых продуктах или косметике.Следовательно, учащиеся могут рассматривать химические вещества как группу веществ, обнаруженных в лабораториях, а не рассматривать все вещества в продуктах питания (например) как химические вещества.
Научная точка зрения
Все материалы сделаны из химических веществ. Химические реакции включают взаимодействие между химическими веществами, так что все реагенты превращаются в новые материалы. Свойства новых материалов отличаются от свойств реагентов. Это отличается от других изменений, таких как испарение, плавление, кипячение, замораживание и перемешивание, когда изменения не связаны с новыми веществами.Хотя для начала реакций часто требуется тепло, это не обязательно.
Химические реакции включают разрыв химических связей между молекулами реагента (частицами) и образование новых связей между атомами в частицах продукта (молекулах). Число атомов до и после химического изменения одинаково, но число молекул изменится.
Хотя многие химические реакции протекают быстро, небольшие, медленные изменения, такие как ржавление или биологические процессы, могут происходить в течение гораздо более длительных периодов времени.
Химические реакции обратимы (факт, который часто опускается во многих научных текстах), но на практике они больше всего отличаются от других наблюдаемых детьми изменений, таких как плавление, тем, что их очень трудно обратить вспять.
Люди используют химические реакции для производства широкого спектра полезных материалов; разложение отходов также включает химические реакции, которые происходят естественным образом в окружающей среде. Для некоторых антропогенных отходов таких реакций нет, и в результате они вызывают проблемы.
Критические идеи преподавания
При обучении химическим реакциям на этом уровне акцент должен делаться на улучшении понимания учащимися важности химических реакций в нашей жизни в производстве многих вещей, которые мы считаем само собой разумеющимися, а также на улучшении их понимания и понимания что вовлечено в химическое изменение.На этом этапе нет необходимости говорить о таких частицах, как атомы или молекулы, или о химических связях.
- Химические реакции включают производство новых материалов, которые сильно отличаются от реагирующих веществ. Любые новые материалы происходят из реагирующих веществ.
- Изменения, которые могут сопровождать химическую реакцию, включают цвет, внешний вид и образование новых материалов, например, газа.
- Само по себе смешивание не может вызвать химическую реакцию.
- Хотя для инициирования химической реакции часто требуется тепло, это не всегда необходимо.
- Химические реакции используются для производства большей части нашей энергии.
- Химические реакции широко используются для тестирования, идентификации и анализа широкого спектра материалов (например, наборы для тестирования бассейнов и судебно-медицинские тесты из телешоу, таких как « CSI» ).
- Кислород в воздухе является очень реактивным химическим веществом и играет важную роль во многих химических реакциях, таких как горение, ржавление и реакции, посредством которых мы получаем энергию из пищи, которую едим.
Изучите взаимосвязь между идеями о химических реакциях в
Карты развития концепции — (атомы и молекулы, химические реакции, сохранение материи, состояния материи)
При изучении химических реакций учащимся нужно будет описывать различные вещества, которые на этом уровне будут материалами, с которыми они знакомы (кухня и изменения, связанные с приготовлением пищи, являются очень хорошей отправной точкой). Им необходимо будет уметь определять изменения в этих веществах с целью в конечном итоге распознать, когда были произведены новые химические вещества. I.е. произошло химическое изменение. Как упоминалось выше, это может быть сложно, поскольку студенты часто не видят разницы между яичным белком, переходящим из жидкого в твердое состояние в процессе приготовления, и такими изменениями, как таяние шоколада или кипячение воды, которые не связаны с химическими изменениями. Обучение должно быть сосредоточено на том, что происходит, когда образуются новые вещества.
Эти идеи также рассматриваются в идее фокуса
Проблемы с классификацией.
Также можно учитывать воздействие химических реакций на окружающую среду, например, как мы утилизируем некоторые химические вещества после их производства в таких формах, как пластиковые пакеты.
Начать обсуждение посредством обмена опытом
Первоначальная педагогическая деятельность должна быть направлена на выявление существующих идей учащихся. На этом этапе важно, чтобы учащихся поощряли высказывать свои идеи и обсуждать их в небольших группах. Все альтернативы следует рассматривать без разрешения на данном этапе.
Начальным действием может быть наблюдение за горением свечи и обсуждение происходящих изменений. Здесь можно различить плавление воска и появление новых материалов.Можно задать следующие вопросы:
- что происходит с воском?
- что горит?
- как вы думаете, куда идет воск?
- не могли бы вы забрать его снова?
- Это тот же процесс, что и испарение воды?
- горела бы свеча, если бы вокруг не было воздуха?
- воздух или часть воздуха израсходованы при горении свечи?
Содействовать осмыслению и разъяснению существующих идей
Действия, которые ставят проблемы для изучения и оспаривают существующие идеи, полезны для поощрения студентов к поиску новых объяснений наблюдаемых ими вещей.Студенты должны изучить ряд изменений и задать вопросы, аналогичные приведенным выше. Во всех этих случаях студентов следует поощрять наблюдать за происходящими изменениями и определять, какие продукты образуются. Обсуждение также может быть сосредоточено на том, чем они отличаются от исходных материалов. Вот несколько примеров:
- Пищевая сода и уксус в стеклянной бутылке с пробкой — почему пробка отлетает?
- Добавьте бикарбонат соды в стакан с уксусом и шестью смородинами.Почему смородина движется вверх и вниз? Какие пузыри? Откуда берутся пузыри?
- Приготовление щербета — смешайте четыре части сахарной пудры, две части лимонной кислоты и одну часть пищевой соды (все это можно приобрести в супермаркетах). Студенты кладут небольшое количество смеси на язык. Что вызывает шипение? Выделяет ли какой-либо порошок сам по себе шипение?
- Наполните банку стальной мочалкой (без мыла) наполовину и добавьте уксуса, чтобы покрыть стальную мочалку. Оставьте на пять дней.Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку нашатырного спирта и перемешайте. Сформируется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы.
- Изготовление карамели — студентам предлагается изучить сахар. Нагрейте концентрированный сахарный раствор, наблюдая за изменениями по пути — растворение сахара, затем потемнение. Карамелизация включает в себя ряд химических изменений.(Существует множество рецептов карамели — для улучшения вкуса, внешнего вида и текстуры можно добавить масло, пищевую соду и соль). Студентов следует поощрять искать доказательства химических изменений, а не плавления.
Практикуйтесь в использовании и создайте воспринимаемую полезность научной модели или идеи
Другие виды деятельности могут включать изготовление шоколада. Учащимся можно предложить поискать различия между приготовлением шоколада, где шоколад тает, и производством карамели / ириса, когда сахар превращается во что-то другое.
Есть много других подобных химических изменений, которые можно исследовать — дальнейшие действия по приготовлению пищи могут включать: приготовление шоколадного торта, плавление и подрумянивание сыра, изготовление сот, выпечка хлеба, приготовление яиц-пашот и приготовление тостов. Другие изменения могут включать настройку двухкомпонентных клеев, таких как
Аралдит и смешивание стальной ваты и раствора медного купороса (можно приобрести в питомниках растений). Кислород является очень важным реагентом во многих химических реакциях, и студенты могут исследовать изменения, связанные с этим компонентом воздуха.
Уточнение и объединение идей для / путем общения с другими
На этом этапе важно уточнить и закрепить то, что наблюдали студенты, и сосредоточиться на том, что происходит в химической реакции, которая отличается от плавления, кипения и замораживания. Для этого учащихся можно попросить в группах сделать мини-плакаты, которые показывают изменения, происходящие в одной или нескольких реакциях, которые они наблюдали, в частности сравнивая продукты с исходными материалами и демонстрируя, чем они отличаются.Этому можно способствовать, используя новые названия продуктов, такие как «сажа» или «углекислый газ». Затем студенты представляют свои плакаты классу.
Итоговое обсуждение в классе должно выявить идеи учащихся, изучить альтернативы и перейти к более общепринятым научным взглядам на химические реакции.
Должны быть выполнены задания, которые проверят полезность модели химических реакций и дополнительно укрепят представления учащихся о том, что представляет собой химическая реакция. Студентов можно также побудить сравнить продукты с исходными материалами.Например, студенты могут исследовать ржавление стального гвоздя в различных условиях (например, в воздухе / воде / соленой воде).
Для дальнейшего развития понимания учащимися роли химических изменений в их жизни они могли бы исследовать производство металлов из руд (таких как алюминий и сталь) или производство пластмасс и синтетических волокон. Акцент в этом исследовании делается на важности химических изменений в производстве материалов, которые мы используем каждый день.
Дополнительные ресурсы
Интерактивные обучающие объекты, связанные с наукой, можно найти на
Страница ресурсов для учителей FUSE.
Чтобы получить доступ к интерактивному объекту обучения ниже, учителя должны войти в FUSE и выполнить поиск по идентификатору учебного ресурса:
- Mystery Substances: ваш первый случай — студенты раскрывают полицейские дела, определяя чистые вещества и компоненты смесей. Они проводят химические испытания загадочного вещества, такого как соль, пищевая сода или сахар, а также наблюдают и записывают, как каждое вещество реагирует с рядом жидкостей и при нагревании. Затем они обращаются к своей таблице данных о химических свойствах и используют ее для сопоставления загадочного вещества или веществ, обнаруженных на месте преступления.Этот учебный объект является одним из пяти объектов.
Идентификатор учебного ресурса: K6ZRNX
- Загадка сокровищ — ученики должны открыть металлическую дверь в сокровищницу, растворив ее кислотами. Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумагой, бикарбонатом натрия или зубами.
Идентификатор учебного ресурса: 46X2PX
- Спасите озеро — Рыбы умирают в озере из-за загрязнения воды.Студенты проверяют воду в озере с помощью химических индикаторов, чтобы определить, какая отрасль является причиной загрязнения. Затем они предлагают изменения, чтобы спасти озеро.
Идентификатор учебного ресурса: MW25YS
Выявление физических и химических изменений
Эта основная идея исследуется через:
Противоположные взгляды студентов и ученых
Ежедневный опыт студентов
Учащимся трудно различать физические и химические изменения, несмотря на формальное обучение, и это различие в некоторой степени условно.Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно идея образования новых веществ, важно для понимания химии, и студенты очень часто путают эти два понятия. . Типичны следующие разговоры:
Пэт (записывает записи группы о тренировке): Что случилось?
Ким: Оно пошло газом.
Pat: Вы видели какие-нибудь новые вещества?
Ким: Нет.
Сэм: Что мне записать образовалось?
Крис: Синий цвет.
Исследование: Лофран, Малхолл и Берри (2002)
Исследования показывают, что студенты часто используют термин «химическое изменение» для описания изменений в физическом состоянии. Замораживание и кипение считаются примерами химических реакций. Это зависит от их представления о сущности. Если учащиеся рассматривают лед как вещество, отличное от жидкой воды, они, вероятно, классифицируют таяние льда как химическое изменение.Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали, что плавление и расширение при нагревании свидетельствует о химических изменениях.
Исследования: Драйвер, Рашворт и Вуд-Робинсон (1994)
Многие студенты не понимали, что химическое изменение характеризуется образованием вещества, обладающего свойствами, отличными от исходного вещества, и значительная часть студентов, которые понимали, не смогли предложить подходящие причины для различения «нового» вещества.
Исследования: Драйвер, Рашворт и Вуд-Робинсон (1994)
Студенты могут подумать, что вспенивание пива — это пример химического изменения, а созревание яблока — физическое изменение.
Исследование: Цапарлис (2003)
Студенты обычно считают, что физические изменения обратимы, а химические — нет. Студенты также часто считают, что исходное вещество в химической реакции исчезает полностью и навсегда. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка аккумуляторных батарей, включая автомобильные; однако студенты могут полагать, что батареи — это контейнер накопленной электроэнергии, а не химикатов, которые реагируют таким образом, что превращают химическую энергию в электрическую.
Другие широко распространенные мнения состоят в том, что химические изменения вызываются смешиванием веществ / реагентов или что необходимо добавить тепло (которое считается некоторой формой материала).
Научная точка зрения
При физическом изменении внешний вид или форма вещества меняются, а вид вещества в веществе — нет. Однако при химическом изменении вид материи меняется, и образуется по крайней мере одно новое вещество с новыми свойствами.
Различие между физическими и химическими изменениями нечеткое.Часто студентов убеждают в том, что изменение носит физический или химический характер. Фактически, это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать как химический процесс, хотя можно восстановить исходные компоненты физическими средствами.Многие примеры растворения материалов (например, Alka Seltzer в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.
— Исследование: Fensham (1994)
Все химические реакции обратимы, хотя на практике это может быть сложно. Во многих учебниках по естествознанию в начальной школе говорится, что химические изменения необратимы, в то время как физические изменения можно обратить. Разрезание бумаги на крошечные кусочки или раздавливание камня — очевидные физические изменения, но восстановить исходный лист бумаги или камень сложно.Перезаряжаемые батареи используют одну химическую реакцию при разряде, а перезарядка включает в себя движение этой реакции в обратном направлении, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор) в автомобиле постоянно заряжает аккумулятор автомобиля, пока двигатель автомобиля работает.
Критические педагогические идеи
- При физическом изменении природа вещества, частицы, из которых оно состоит, и количество частиц остаются неизменными.
- При химическом изменении свойства новых веществ отличаются от исходных, частицы другие, и количество частиц может измениться.
- Хотя различие между физическими и химическими изменениями является полезным, его следует рассматривать скорее как континуум.
- Химические реакции можно обратить, но на практике это может быть сложно.
Изучите взаимосвязь между идеями о физических и химических изменениях в картах развития концепции — (состояния вещества, химические реакции)
При обучении физическим и химическим изменениям важно позволить учащимся рассматривать классификацию как континуум.Они должны быть в состоянии наблюдать за некоторыми изменениями и формулировать свои взгляды на изменения и проблемы, связанные с процессом классификации. Студенты должны увидеть, что химические реакции производят новые химические вещества, отличные от исходных материалов, но что химические процессы можно обратить. Очень полезно изучить примеры обратимых химических реакций и понять, почему многие химические изменения трудно обратить вспять.
Педагогическая деятельность
Содействовать осмыслению и разъяснению существующих идей
Следующие ниже упражнения предназначены для того, чтобы учащиеся выявили и затем уточнили свои представления о физических и химических изменениях.Студентам важно наблюдать за рядом изменений и записывать свое мнение о происходящем. Они могут записать это в буклет, где будут писать о результатах и наблюдениях. Их следует поощрять формулировать и записывать гипотезы о том, что происходит, зная, что их мнения не будут оцениваться на данном этапе.
Для примера этой техники см .: Использование журналов учета электроэнергии за 10 год.
Это может помочь выявить их существующие идеи и помочь им оспорить и расширить существующие убеждения.
Студенты могут исследовать:
- Нагрев стальной ваты на воздухе и сбор образующегося черного порошка, затем взвешивание реагента и продукта (должно быть увеличение). Это можно сделать в виде POE (прогнозировать-наблюдать-объяснять): учащихся просят предсказать, что произойдет с весом стальной ваты, когда она сгорит. Что было добавлено в стальную вату во время горения?
- Растворение сахара и соли в воде и сравнение того, что происходит с электропроводностью двух растворов при растворении.Восстановление соли путем испарения показывает, что соль все еще там, но проводимость указывает на образование чего-то нового.
- Сравнение кипящей воды со смешиванием уксуса и пищевой соды — оба образуют пузыри, но в чем разница? Пищевую соду и уксус можно смешать в пакете для сэндвичей Ziploc, чтобы продемонстрировать образование нового вещества, которое взрывает пакет.
- Реакции осаждения, особенно те, которые вызывают явное изменение цвета, например, соли Эпсома и раствор аммиака.Это можно сравнить с добавлением перманганата калия в воду. Какие отличия?
- Кислотно-основные реакции можно проиллюстрировать с помощью индикаторов как натуральных (капустный сок), так и синтетических. Изменение цвета помогает проиллюстрировать, что могут формироваться новые материалы.
Практикуйтесь в использовании и укреплении воспринимаемой полезности научной модели или идеи
Важно, чтобы примеры изменений не ограничивались только материалами и химическими веществами, с которыми студенты сталкиваются в классе.В качестве домашнего задания учеников можно попросить собрать примеры изменений, которые они видят вокруг себя, и классифицировать их по своей шкале физических и химических изменений. Некоторые примеры, которые они могут собрать, — это сжигание топлива, приготовление пищи и такие процессы, как пищеварение, дыхание и фотосинтез.
Прояснить и объединить идеи для / путем общения с другими и с другими
Для консолидации своих взглядов учеников в группах можно попросить выбрать два изменения, одно на физическом конце континуума, а другое на химическом, и объяснить класс в чем отличия.Сообщение своих идей другим может помочь учащимся прояснить и консолидировать новые и существующие идеи об изменениях.
Практика использования и создание воспринимаемой полезности научной модели или идеи
Наука — это область, в которой более глубокий смысл ряда ключевых идей создается постепенно путем их использования в различных ситуациях и подчеркивания того, как одна и та же идея помогает обрести смысл многих ситуаций. Это особенно верно в отношении ключевых идей в химических науках, которые нельзя «открыть», «доказать» или даже продемонстрировать с помощью классных экспериментов.Как элементы, так и соединения (ключевая идея на макроуровне), а также атомы и молекулы (которые предполагают то же мышление на микроуровне) являются примерами этого, но их полезность может быть увеличена путем демонстрации (среди прочего) того, как они могут помочь разобраться в физических и химических изменениях. Эти идеи могут быть представлены здесь или возвращены, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть использовано как полезный способ описания некоторых изменений, которые видели ученики, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) так, как это не делают слова.Если точные химические формулы не могут быть записаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезно. Например, древесина состоит в основном из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n , можно использовать для отслеживания изменений в процессах, таких как горение.
Здесь могут помочь модели и схемы. Например, в большинстве школ есть наборы для молекулярного моделирования, которые можно адаптировать, чтобы показать, как молекулы изменились, а атомы перестроились в результате изменений.Схемы размеров плакатов также могут быть нарисованы учащимися, чтобы помочь им в объяснениях.
Испытайте некоторые существующие идеи
Хотя трудно продемонстрировать обратимость химических изменений, учащиеся хорошо знакомы с необходимостью подзарядки своих мобильных телефонов, фотоаппаратов и других перезаряжаемых устройств. Это можно было бы просто обсудить, хотя изучение химических реакций, приводящих в действие эти устройства, могло бы быть полезным исследовательским проектом. Предостережение здесь в том, что большая часть доступной информации может быть очень технической.
Содействовать размышлениям о том, как изменились идеи студентов.
Повторное рассмотрение их исходных журнальных записей может способствовать размышлениям о том, как изменились взгляды студентов. Затем учащиеся могут применить свои новые идеи к большему количеству примеров изменений. Для содействия обсуждению видов происходящих изменений и трудностей классификации некоторых изменений как физических или химических можно использовать следующие действия:
- Растворение металлов в кислоте (магний и цинк) и проверка полученного газа.
- Исследование известняковых и кислотных реакций (образование известняковых пещер — что это за изменение?)
- Добавление цинка в раствор сульфата меди и наблюдение за происходящими изменениями цвета.
- Сравнение схватывания клеев на водной основе, таких как Clag и Aquadhere , с двухкомпонентными клеями, такими как Araldite . Первый работает за счет испарения растворителя (воды) и является обратимым; последний включает химическую реакцию (реакция термореактивной полимеризации) между двумя компонентами и не является обратимой.
