Содержание
Скорость химической реакции
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания, механизм и скорость химической реакции.
Понятие скорости химической реакции
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм.
Определение скорости химической реакции:
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени
Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны.
По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны.
Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени.
Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
υ = ± dn/dt·V
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
υ= ± dC/dt,
где C – концентрация, моль/л
Единица измерения скорости реакции — моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
| υ = — ΔC/Δt [моль/л·с] |
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом:
Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Т.е. скорость прямой химической реакции зависит от концентраций исходных веществ.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением:
υ = k·[A]a·[B]b или
υ = k·CaA·CbB
Здесь [A] и [B] (CA и CB )- концентрации реагентов,
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины константы скорости реакции k — это скорость реакции при единичных концентрациях.
То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
- Реакция активируется термично, т.е. энергией теплового движения молекул.
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k.
К сложным процессам закон действия масс применить нельзя!
Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которая называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок.
Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
υ = k·[A]a·[B]b
a – порядок по реагенту А
b — порядок по реагенту В
Общий порядок a + b = n
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения.
Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Факторы, влияющие на скорость химической реакции
Определим факторы, влияющие на скорость химической реакции υ:
1. Зависимость скорости реакции от концентрации реагирующих веществ
Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс:
υ = k[A]a·[B]b
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами.
Причем, важно учитывать порядок реакции:
если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества.
Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 22 = 4 раза.
А увеличение концентрации в 3 раза ускорит реакцию в 32 = 9 раз.
2. Зависимость скорости реакции от давления
Справедлива для веществ в газообразном состоянии и определяется уравнением Клапейрона – Менделеева, которое связывает концентрацию и давление:
pV = nRT, откуда
С = p/RT
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления.
Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит скорость реакции υ – она станет в 2 раза больше.
3. Зависимость скорости реакции от площади поверхности
Для гетерогенных реакций скорость реакции зависит от площади соприкосновения частиц:
Vгетер.=Δn/(S⋅Δt),
где S — площадь соприкосновения частиц, мм2,
Δn — изменение количества веществ, принимающих участие в реакции (исходных веществ или продуктов реакции), моль;
Δt — промежуток времени, с;
Единица измерения скорости гетерогенной реакции, моль/м2⋅с.
Таким образом, вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше.
Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности.
Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
4. Зависимость скорости реакции от природы вещества.
В этом случае, большое значение имеет строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки.
Например, натрий будет активнее взаимодействовать с водой, чем олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
5. Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса
Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции.
Поэтому, при повышении температуры скорость химической реакции увеличивается.
Сванте Аррениус в 1889 году, изучая зависимость скорости реакции υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Если известна константа скорости k при одной температуре Т1, а требуется найти константу скорости k при некой другой температуре Т2, то это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
ln k1 = lg A – Ea/2,3RT1 и
ln k2 = lg A – Ea/2,3RT2
Вычитая второе равенство из первого, получаем:
Уравнение Аррениуса при определении скорости химической реакции (в случае, если υ описывается степенным уравнением) , принимает вид:
υ = k·[A]a·[B]b
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее выражение:
ln υ = const – Ea/2,3RT
Правило Вант-Гоффа
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф:
увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза.

Правило Вант-Гоффа имеет математическое выражение:
где υT1 и υT2 – скорости реакции при температурах Т1 и Т2
γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
Приведем пример применения правила Вант-Гоффа.
Допустим, что γ = 3, а Т2 – Т1 = 20о, тогда
υT1/υT2 = 32 = 9. Это означает, что υ возросла в 9 раз.
6. Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов).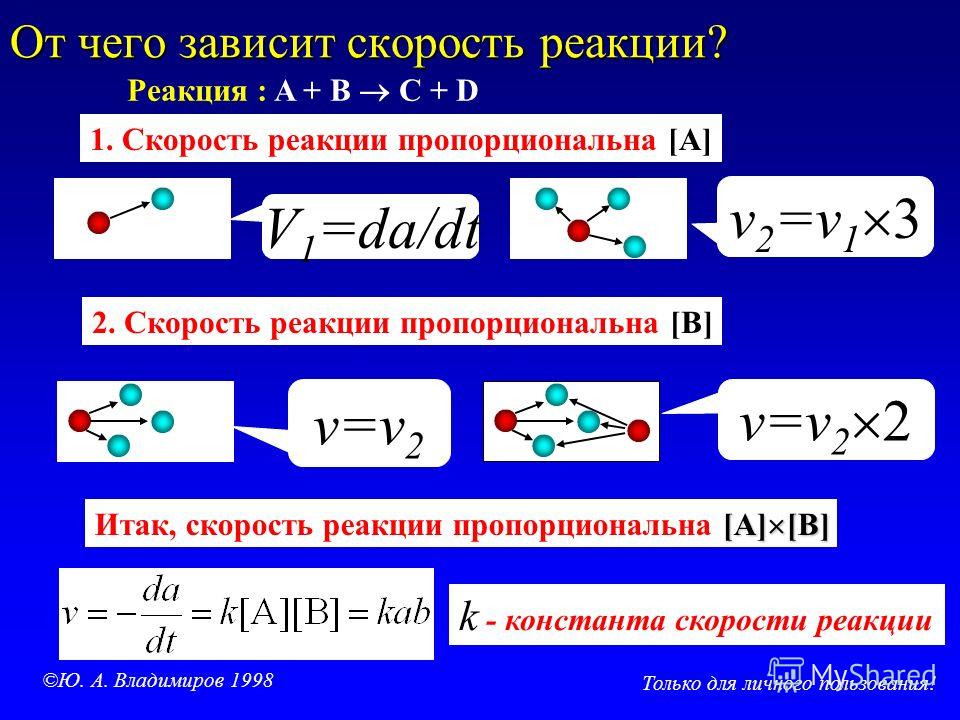 Например, в биохимической среде в качестве катализаторов выступают ферменты.
Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
влияние катализатора на энергию активации
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции.
Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.
Скорость химических реакций влияние давления
Влияние различных факторов. На скорость химической реакции могут влиять различные факторы. В гомогенных системах такими факторами являются температура, давление и состав в гетерогенных системах проблема усложняется. Реагирующее вещество может 22 [c.22]
На скорость химической реакции могут влиять различные факторы. В гомогенных системах такими факторами являются температура, давление и состав в гетерогенных системах проблема усложняется. Реагирующее вещество может 22 [c.22]
На скорость химической реакции оказывает влияние и давление. С изменением давления может меняться константа скорости реакции. Переменными могут оказаться и концентрации. Пусть, например, при изменении давления сохраняется соотношение между компонентами, т. е. сохраняются относительные молярные концентрации /г = = р Р, где Р1— парциальное давление, Р — общее давление. Тогда действующие концентрации компонент С,- = рр РЯТ) будут меняться прямо пропорционально общему давлению, соответственно будет меняться число соударений и скорость реакции. [c.101]
Кинетика химических реакций при высоких давлениях является весьма молодой отраслью физической химии, ибо лишь в течение последних нескольких десятков лет были поставлены серьезные исследования. В отличие от проблемы химического равновесия вопрос о влиянии давления на скорость химических реакций никак не может считаться в принципе решенным, [c.172]
В отличие от проблемы химического равновесия вопрос о влиянии давления на скорость химических реакций никак не может считаться в принципе решенным, [c.172]
Пределы распространения пламени по давлению. Влияние давления на скорость горения связано в основном с зависимостью скорости химической реакции от давления. Для реакции п-то порядка скорость химического превращения в реакционной зоне зависит от давления приблизительно как (ср. с формулой (1.8)) [c.265]
На скорость химических реакций влияет много факторов природа реагирующих веществ, их концентрация, температура, давление, наличие катализаторов и др. В предложенных задачах необходимо учитывать влияние на скорость реакций только двух факторов — концентрации реагирующих веществ и температуры. Кратко охарактеризуем величины, которыми следует оперировать в процессе решения задач, а также закономерности, определяющие зависимости между этими величинами. [c.53]
Рассмотрим зависимость скорости сложных реакций от давления. О влиянии давления на константы скорости различных стадий сложных химических превращений можно высказать лишь некоторые общие соображения. [c.184]
О влиянии давления на константы скорости различных стадий сложных химических превращений можно высказать лишь некоторые общие соображения. [c.184]
На первом уровне рассматриваются процессы, протекающие в единичном структурном элементе — поре — с учетом ее реальных геометрических характеристик и их влияния на процессы переноса. Элемент характеризуется коэффициентами переноса, константами скорости химических реакций, адсорбции, энергиями активации, условиями возникновения межфазных границ и т. д., для него должны быть определены внешние условия — температура, давление, концентрации исходных веществ и продуктов и др. В средах с неоднородной пористой структурой, характеризующейся распределением пор по размерам, учитывается также влияние неравномерности распределения размеров пор на характер протекающих в них процессов. [c.141]
Измерения в таком же сосуде, но с диспергированием газа в жидкости также показали, что при высокой интенсивности перемешивания скорость абсорбции пропорциональна давлению кислорода. Скорость абсорбции оставалась неизменной при использовании кобальта вместо меди (с той же концентрацией). Это свидетельствовало о независимости скорости абсорбции от скорости химической реакции и о влиянии на нее лишь скорости переноса от поверхности в массу жидкости. По данным Филлипса и Джонсона, значения киа при 600 и 4500 оборотах ъ I мин составляли около 0,044 и 0,88 eк соответственно. [c.256]
Скорость абсорбции оставалась неизменной при использовании кобальта вместо меди (с той же концентрацией). Это свидетельствовало о независимости скорости абсорбции от скорости химической реакции и о влиянии на нее лишь скорости переноса от поверхности в массу жидкости. По данным Филлипса и Джонсона, значения киа при 600 и 4500 оборотах ъ I мин составляли около 0,044 и 0,88 eк соответственно. [c.256]
При протекании реакций в жидких средах влияние давления на скорость взаимодействия оказывается весьма неоднозначным. Естественно, что скорость химической реакции под давлением будет зависеть от многих факторов стерических особенностей реагентов, вязкости реакционной среды, изменения каталитического действия и т. д. В настоящее время еще не удается построить теорию химической кинетики при высоких давлениях с учетом всех действующих на процесс факторов. Поэтому кинетические закономерности в средах под высоким давлением приходится выводить с помощью ряда приближений. Сейчас в кинетике химических реакций используются два метода метод активных соударений и метод переходного состояния.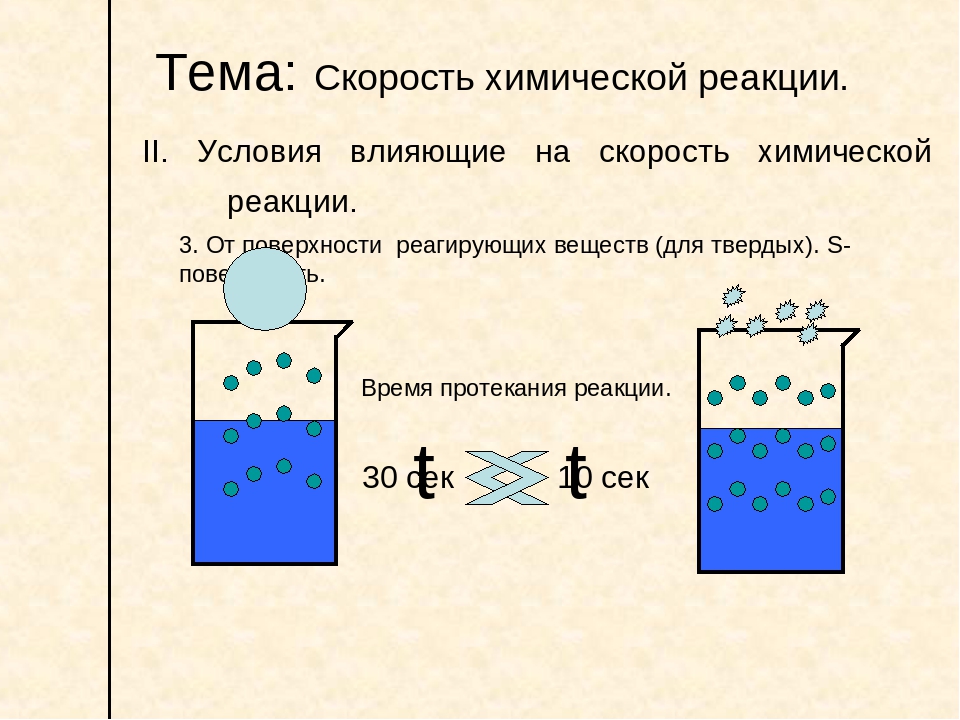 [c.172]
[c.172]
В результате упорных исследований Беккерелю удалось показать, что радиоактивные лучи испускаются различными соединениями урана, но наиболее интенсивно — самим металлическим ураном. Лучи эти появлялись не в результате химической реакции обычные условия, которые влияют на скорость химических реакций,— температура, давление, состояние химического соединения — были абсолютно неэффективны и не оказывали никакого-влияния на интенсивность радиоактивного излучения. [c.454]
Из выражений (8) и (3) следует, что для интенсификации процесса в газожидкостном реакторе необходимо вначале определить лимитирующую стадию процесса. Если лимитирующей стадией является массоперенос, то в целях интенсификации необходимо обратиться к соответствующим РТ- и АК-методам. Для интенсификации собственно реакционного процесса в жидкой фазе следует использовать те РТ-методы, которые оказывают влияние на скорость химической реакции (увеличение давления и температуры, применение катализаторов, совмещение химических реакций и др. ). [c.16]
). [c.16]
Рассмотрим закономерности химической технологии применительно к гомогенным процессам, т. е. влияние концентраций реагирующих веществ, температуры, давления и перемешивания на скорость процессов в газовой и жидких средах. Гомогенные процессы, как правило, идут в кинетической области, т. е. общая скорость процесса определяется скоростью химической реакции, поэтому закономерности, установленные для реакций, применимы и к процессам, идущим в газовой или жидкой среде. [c.139]
Влияние температуры на скорость химической реакции во много раз значительнее, чем на ряд других процессов, таких, как, например, скорость диффузии, изменение вязкости среды, поверхностное натяжение, осмотическое давление и т. д. [c.135]
На скорость химической реакции влияют многие факторы концентрация реагирующих веществ, их природа, температура, природа растворителя (если реакция протекает в растворе), присутствие катализаторов, в случае газовых реакций оказывает влияние на скорость и давление.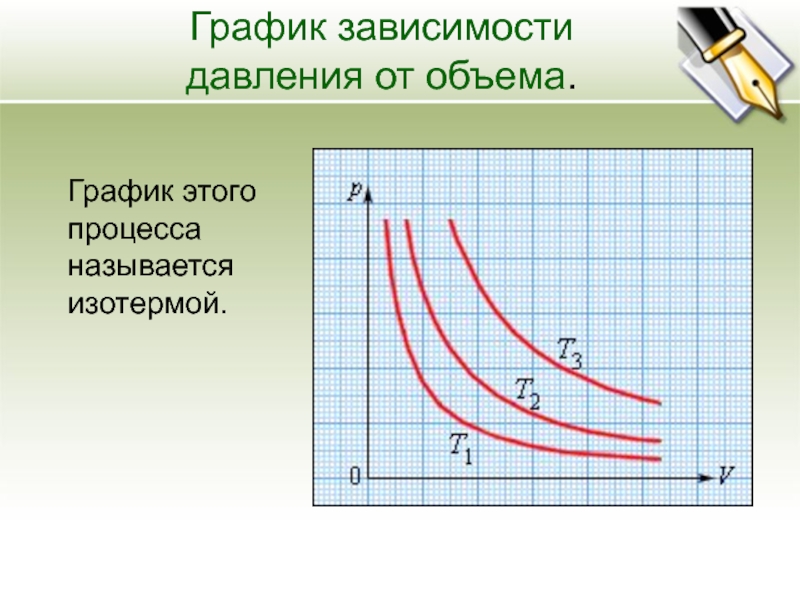 [c.112]
[c.112]
Раздел физической химии, в котором изучается скорость химических реакций и механизм химического взаимодействия, а также влияние на скорость реакций различных факторов (концентрации реагирующих веществ, температуры, давления, света, катализаторов и др.), называется химической кинетикой. [c.82]
Скорость химических реакций в ряде случаев может зависеть от давления. Для некоторых каталитических реакций необходимо принять во внимание изменение степени абсорбции и величины константы скорости под влиянием изменения давления. При пропускании газообразных веш еств через зону реакции с одинаковыми массовыми скоростями повышение давления приводит к, увеличению времени контакта. [c.17]
Согласно теории переходного состояния, влияние давления на константу скорости химической реакции описывается при постоянной температуре уравнением [c.214]
Каково влияние давления на скорость химической реакции [c. 54]
54]
Влияние условий горения и природы исходных соединений на полноту сгорания жидких углеводородных топлив для воздушно-реактивных двигателей изложено в работах [25, 95]. Для полного сгорания топлива необходимо, чтобы давление воздуха на входе в, камеру сгорания двигателя было более 0,15 МПа. При уменьшении давления ниже этого значения наблюдается снижение полноты сгорания. Это объясняется тем, что с уменьшением давления снижается скорость химических реакций окисления, уменьшается турбулентность потока, что понижает скорость сгорания. Кроме того, с уменьшением давления воздуха ухудшается качество распыления и распределения топлива в камере сгорания. [c.70]
И в этом случае повышение температуры приводит к интенсификация процесса (в 1,43 раза), однако в меньшей степени, чем при давлении 10 Па. Причина заключается в том, что при повышении давления процесс сдвигается ближе к области протекания мгновенной реакции (отношение MIR уменьшается), в которой не проявляется положительное влияние роста температуры на скорость химической реакции.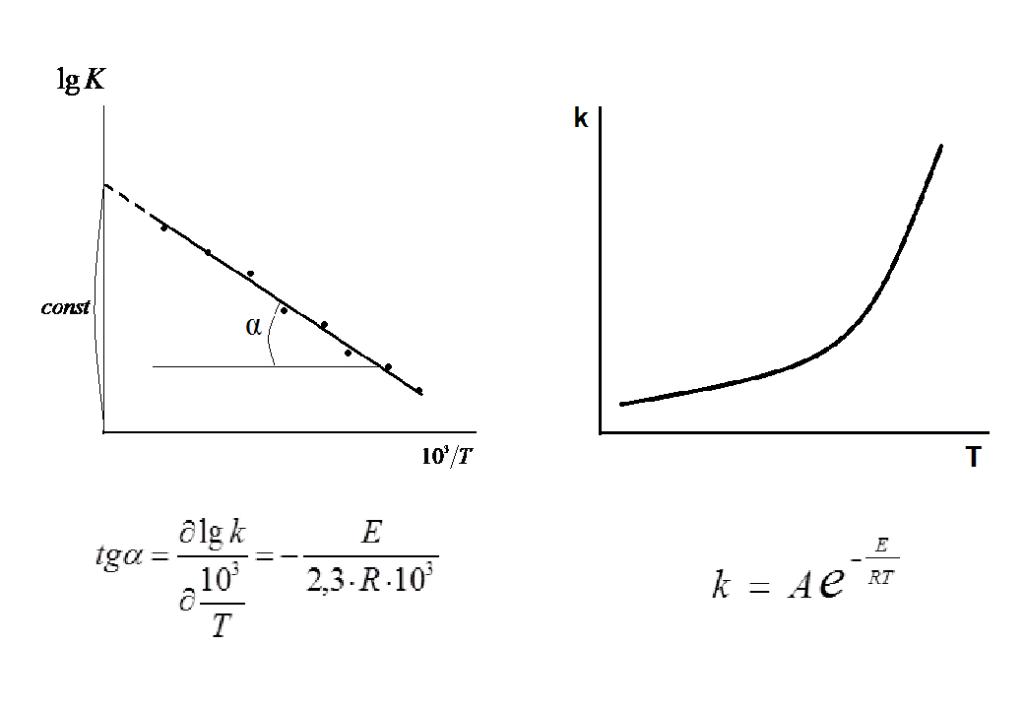 [c.68]
[c.68]
Вопрос о скорости химических реакций, о влиянии на скорость различных факторов и о механизме реакций — предмет изучения в химической кинетике. Этот раздел химии открывает возможность различными способами изменением температуры, давления, концентраций, введением катализаторов, облучением светом и т. д. — влиять на скорость установления равновесия, на скорость желательных и нежелательных реакций, самопроизвольное течение которых термодинамически возможно. Изучение кинетики процессов дает возможность глубже понять их механизм, без чего нельзя управлять ими. Если определение энергоспособности (АН) и работоспособности (АС) процесса требует только знания энтальпии и свободной энергии образования начальных и конечных веществ при заданных условиях, то скорость процесса зависит не только от того, какие вещества стоят в правой и левой частях равенства она также всегда зависит от переходного состояния (промежуточных продуктов), которые далеко не всегда удается выделить и изучить. Поэтому проблемы кинетики очень сложны. [c.39]
Поэтому проблемы кинетики очень сложны. [c.39]
Зависимость скорости срыва от давления, несомненно, обусловлена частично зависимостью числа Не от плотности. В настоящее время еще не совсем ясно, зависят ли от давления А и 1/т. Другой важной причиной зависимости от давления является суммарный порядок скорости химических процессов, которые в недостаточной степени представлены в уравнениях (14) и (15), прежде всего потому, что Х 11 подробно вычислено только для реакции первого порядка. В настоящее время предпринимаются попытки аналитически определить для химических реакций, порядок которых отличается от первого порядка. На основании представленной формулировки срыва мало что можно сказать о влиянии давления, пока не будет лучше выяснено влияние порядка скорости химической реакции. [c.187]
В разделе 5 было рассмотрено влияние давления иа длину зоны реакции. На основании этого можпо объяснить результаты данных опытов следующим образом. Анализируя график рис. 37в, видим, что восстановительная зона сокращается с повышением давления, в то время как кислородная зона остается почти неизменной. Состав газа в конце кислородной зоны при болео высоком давлении несколько ухудшается за счет большого количества двуокиси углерода, но в конце восстановительной зоны оп заметно улучшается. Температура в слое мало изменяется и это попятно, так как она зависит в основном от весового расхода воздуха, остающегося в данном случае постоянным. Следовательно, не изменяются и кинетические константы скоростей химических реакций. Точно так же не изменяется и критерий Рейнольдса, так как он остается постоянным при постоянной весовой скорости дутья. Как известно, суммарная константа скорости реакции к оиределяется из следующего соотношения [c.468]
37в, видим, что восстановительная зона сокращается с повышением давления, в то время как кислородная зона остается почти неизменной. Состав газа в конце кислородной зоны при болео высоком давлении несколько ухудшается за счет большого количества двуокиси углерода, но в конце восстановительной зоны оп заметно улучшается. Температура в слое мало изменяется и это попятно, так как она зависит в основном от весового расхода воздуха, остающегося в данном случае постоянным. Следовательно, не изменяются и кинетические константы скоростей химических реакций. Точно так же не изменяется и критерий Рейнольдса, так как он остается постоянным при постоянной весовой скорости дутья. Как известно, суммарная константа скорости реакции к оиределяется из следующего соотношения [c.468]
Влияние различных факторов на скорость химической реакции. Скорость химической реакции зависит от природы реагирующих веществ, т. е. от их химических и физических свойств. Кроме того, на скорость реакции существенно влияют такие факторы, как концентрация реагирующих веществ, температура, давление, катализатор, интенсивность перемешивания веществ. При проектировании технологического процесса эти параметры выбирают такими, чтобы процесс протекал с максимальной скоростью. [c.229]
Равновесное давление компонента на границе раздела фаз учитывает влияние свойств жидкой фазы и происходящих в ней процессов на скорость абсорбции и является функцией концентрации свободных молекул абсорбтива на границе раздела фаз. Последняя при прочих равных условиях уменьшается при увеличении концентрации хемосорбента, константы скорости химической реакции м коэффициента диффузии молекул активной части хемосорбента. Противоположное влияние наблюдается при увеличении коэффициента диффузии самих молекул абсорбтива. Значение Рр, может быть найдено из экспериментальных данных по зависимости скорости абсорбции от Р и С, как это показано в работах [248, 307, 335]. [c.143]
На этот процесс оказывают влияние равновесие и скорости химических реакций, а также диффузионная кинетика процесса. В силу указанных причин суммарный процесс зависит от свойств топлива, состава газового окислителя, температуры, давления, скорости дутья, перемешивания, конструкции и размеров газогенератора. [c.445]
Тот факт, что влияние давления на скорость химических реакций в существенной степени зависит от природы растворителя, известен уже давно, однако первое удовлетворительное объяснение этому явлению было дано лишь в 1953 г. Букананом и Хэй-манном [436]. В табл. 5.25 в виде схемы представлены эффекты давления и природы растворителя в зависимости от заряда уча- ствующих в них реагентов, установленные Даком [27, 239]. Как показывают приведенные в табл. 5.25 данные, влияние полярности растворителя на АУ» обусловлено более высокой сжимаемостью менее полярных растворителей, благодаря чему под влиянием ионных или биполярных растворенных веществ их объ-. ем уменьшается в большей степени, чем объем более полярных растворителей. Меньшая сжимаемость последних объясняется сильными межмолекулярными взаимодействиями, реализующимися и в отсутствие растворенных веществ. Путем аналогичных рассуждений нетрудно прийти к выводу о том, что между и энтропией активации должна существовать корреляция. Действительно, обусловленное интенсификацией электрического поля вокруг молекул растворенного вещества повышение электрострикции соответствует уменьшению как объема, так и энтропии системы из-за частичной потери свободы движения в рас- [c.393]
Одним из важных факторов, влияющих на скорость химических процессов, является давление. Для реакций, протекающих в присутствии катализатора, давление может влиять на значение константы скорости, время контакта, адсорбцию идр. Изменение давления может оказывать влияние на смещение химического равновесия и, следовательно, на конверсию исходных веществ в продукты реакций. [c.137]
Химическая кинетика имеет дело со скоростями химических реакций и с параметрами, от которых эти скорости зависят. Наиболее важными из этих параметров являются концентрация, температура и давление. Исследуя последовательно влияние всех этих параметров на скорости реакций, можно прийти к определенному заключению о деталях механизмов, по которым протекают химические реакции. Вероятно, правильно будет сказать, что кинетическое исследование является обязательным при изучении механизма реакции. Некинетические исследования, как, например, стереохимические, могут также дать очень серьезную информацию о механизме реакции, и их всегда следует учитывать при кинетическом исследовании. [c.11]
Если скорость диффузии и скорость химической реакции, рассмотренные независимо друг от друга, соизмеримы, то имеется переходная область. Один и тот же процесс, в.зависимости от условий его проведения, может лежать в различных областях. Большое (влияние на характер протекания гетерогенного химического процесса оказывают давления реагирующих веществ,..хкоррстц.п охо,крв, пористость катализатора и темпера- [c.312]
Давление влияет на направление и скорость химических реакций, протекающих при крекинге, но это влияние изменяется в зависимости от условий процесса. Если крекинг протекает в лелого сырья н при умеренных температурах (420—470° С), то давление практически не оказывает влияния па скорость и направление мономолекулярного распада. Одпако как только образующиеся продукты распада или исходное сырье переходят в паровую фазу, роль давлеиия повышается. При этом большое значение имеет абсолютная величина даиления. При умеренных давлениях скорость мономолекулярного распада практически ие изменяется. Поскольку крекинг протекает по радикально-цепному механизму, характер реакции обрыва цепе] изменяется в зависимости от абсолютной величины давления. М. Г. Гоникберги В. В. Воеводский показали, что при невысоких давлениях (порядка нескольких атмосфер) повышение его способствует увеличению константы скорости крекинга, а при высоких (порядка сотен атмосфер и более) наблюдается обратное явление. Так, по данным А. И. Динцеса , в процессе термического крекинга бутана при 575° С и глубине распада около 9—13% повышение избыточного давления с 3,9 до 10,8 ат вызывает увеличение константы скорости реакции с 0,007 до 0,022, т. е. примерно втрое. Г. М. Панченков и В. Я- Баранов , подвергая крекингу фракцию 300—480° С грозненской парафинистой нефти при 510° С и избыточном давлении 1 10 и 50 ат, установили, что максима.яьпое значение констант скорости реакции соответствует давлению около 10 ат-, дальнейшее повышение давления сопровождается снижением скорости разложения. [c.41]
Зависимость скорости химической реакции от кон-центраики реагирующих веществ устанавливает закон действия масс. Частная формулировка этого закона была дана Н. Н. Бекетовым в 1865 г., который изучал влияние давления газообразного водорода на скорость вытеснения им металлов из раствора солей. [c.112]
Число столкновений, а значит и скорость реакции зависят от концентрации реагирующих веществ чем больше молекул, тем больше и столкновений. Общую формулировку влияния концентрации на скорость химической реакции дает закон действия масс, установленный В 1867 г. норвежскими исследователями Гульдбергом и Вааге. Для частного случая реакций вытеснения металлов водородом под давлением этот закон был высказан [c.162]
Задача об определении скорости распространения ламинарного пламени была исследована Малляром и Ле Шателье [Ч, считавшими, что первостепенное значение имеют тепловые потери, в то время как скорость химической реакции имеет второстепенное значение. Воспользовавшись упрощенными моделями, студент Малля-ра Таффанель [Ч и несколько позже, независимо от него, Даниель [ ], по-видимому, впервые получили важный вывод о том, что скорость горения нропорциональна квадратному корню из величины скорости реакции и квадратному корню из отношения коэффициента теплопроводности к удельной теплоемкости при постоянном давлении ). В последующих исследованиях использовались более точные исходные уравнения, в которых было учтено влияние цепных реакций и других процессов. [c.135]
Реакции в системах газ — жидкость под давлением имеют значительное распространение в неорганической и особенно в органической химии. Достаточно хотя бы упомянуть гидрирование в жидкой фазе и синтезы на основе окиси углерода при умеренных температурах и высоких давлениях, гидратацию олефинов и многие другие процессы. Следует, однако, иметь, в виду, что во многих реакциях (например, жидкофазного гидрирования) равновесие уже при атмосферном давлениия практически полностью смещено в сторону продуктов реакции, и высокое давление применяется для ускорения процесса. Подобные реакции будут поэтому рассматриваться во второй части книги, посвященной выяснению влияния давления на скорость химических реакций. [c.60]
Таким образом, влияние давления на скорость химических реакций усматривалось лишь в изменении концентраций реа-(ируюш,их веш,сств. Вопрос о зависимости константы скорости от давления в то время еще не мог быть удовлетворительно )ешен. [c.91]
Вышо было рассмотрено влияние давления на равновесие ы скорость химических реакций. При этом в ряде случаев возникала необходимость истолкования результатов исследований сложных процессов (в частности, в раздело, посвященном кинетике гомогенных и гетерогенно-каталитичс ских газовых реакций). Состав продуктов сложных процессов может претерпевать существенные изменения в зависимости от применяемого давления. Так, повышение давления при полимеризации ненасыщенных соединений не только ускоряет этот процесс, но и приводит во многих случаях к увеличению молекулярного веса образующихся полимеров. Увеличение давления при изосинтезе обусловливает образование, наряду с углеводородами, также значительных количеств кислородсодержащих соединений. Число подобных примеров дюжет быть легко удшожено. Естественно, что состав продуктов сложных процессов определяется равновесием и скоростью составляющих их простых реакций. [c.172]
Влияние давления р на скорость распространения пламени проиллюстрировано на рис. 6.5, где приведены данные Голубева, Янковского, Постнова и Талантова [1973]. Видно, что м, растет с увеличением р. Аналогичные данные получены Дорошенко и Никитским [1960], Храмцовым [1960]. В силу принципа автомодельности турбулентных течений по числу Рейнольдса изменение/) не влияет на и Л. Поэтому приведенный график указывает на влияние скорости химических реакций. Характерное время [c.220]
Тем не менее уравнение (111-16) позволяет довольно просто интер-гфетировать влияние поверхностного давления и состава подложки на величины АУ и поэтому щироко используется. Хотя интерпретация абсолютных значений ДУ представляется до некоторой степени спорной, такие измерения чрезвычайно полезны в качестве независимого способа определения концентрации молекул в пленке (например, при контроле скорости химической реакции или растворения) и проверки однородности пленки. Если при измерении потенциала в различных районах пленки наблюдаются флуктуации АУ, то можно предполагать существование в пленке двух различных фаз. [c.100]
Гомогенная и гетерогенная стадии химических реакций. Для выяснения механизма химической реакции и природы входящих в него отдельных элементарных процессов весьма существенное значение имеет вопрос о том, протекает ли данная реакция целиком в гомогенной (газовой) фазе и какое влияние на течение реакции оказывают гетерогенные факторы. В случае газовых реакций таким фактором чаще всего является стенка реакционного сосуда. На значение стенок реакционного сосуда (в частности, относительной величины их поверхности и их материала) для кинетики химических газовых реакций первый обратил внимание Вант-Гофф [37] (1884), хотя отдельные наблюдения действия стенок на химическую реакцию отмечались и раньше. Изучая реакцию полимеризации хщановой кислоты НСМО в стеклянных сосудах с поверхностью различной величины, Вант-Гофф нашел, что скорость реакции в сосуде с большей поверхностью заметно больше скорости реакции в сосуде с меньшей поверхностью. Он, далее, установил, что предварительное покрытие стенок реакционного сосуда циамелидом — продуктом полимеризации цианово1г кислоты — приводит к увеличению скорости реакции более чем в три раза. Сильное влияние природы стенок на скорость реакции было замечено Вант-Гоффом также в случае окисления гремучей смеси 2Н2-Ь02 (прн 440° С). В последующие годы влияние величины поверхности и природы (материала и характера обработки) стенок на скорость химической реакции было установлено для многих реакций, протекающих в газовой фазе. Оказалось, что в одних случаях стенка тормозит реакцию, в других — ее ускоряет. Известны также случаи двоякого действия стенки, когда стенка благоприятствует реакции и действует тормозящим образом в той же реакции. В качестве одного из примеров здесь можно привести действие стенки в реакции горения водорода. Вводя в зону горения тонкие стерженьки из различных материалов, А. Б. Налбандян и С. М. Шубина [2041 обнаружили при этом резкое замедление реакции. С другой стороны, Алиа и Габер [315] показали, что воспламенение водорода в месте скрещения горячих струй водорода и кислорода (нагретых до 7 миллиметров ртутного столба происходит лишь при внесении в газ тонкого кварцевого стерженька Таким образом, нужно заключить, что твердая иоверхиость способствует возникновению реакции горения водорода и тормозит уже идущую реакцию. Укажем, что согласно [c.50]
Интенсификация процессов первой группы достигается уве личеиием скорости химической реакции, являющейся функцией произведения концентрации реагентов и температур.ы. Практи чески все разобранные нами реакции имеют второй порядок. Давление в большинстве процессов служит функцией температуры и только при восстановленШ 1 нитросоединения водоро-до.м мoяier оказывать самостоятельное влияние на скорость ре акции. [c.302]
Урок 42. движение как качественное изменение. химические реакции — Естествознание — 10 класс
Естествознание, 10 класс
Урок 42. Движение как качественное изменение. Химические реакции
Перечень вопросов, рассматриваемых в теме: Как во времени протекает химическая реакция? Что такое механизм химической реакции и как реакции можно классифицировать по механизму их протекания? Как определяется скорость химической реакции для различных процессов? Что такое кинетическое уравнение реакции и в чём его смысл? Как различные факторы влияют на скорость реакции? Каков механизм действия катализатора?
Глоссарий по теме:
Химическая кинетика – это раздел химической науки, изучающий механизм и скорость химической реакции.
Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем).
Закон действующих масс – при постоянной температуре скорость данной реакции пропорциональна произведению концентраций реагирующих веществ.
Механизм химической реакции – это последовательность элементарных стадий процесса, в результате которого исходные вещества превращаются в продукты реакции.
Энергия активации – это средняя избыточная энергия (по сравнению со средней энергией движения), которой должны обладать реагирующие частицы (атомы, молекулы), чтобы преодолеть энергетический барьер, разделяющий в химической реакции реагенты (исходные вещества) и продукты (конечное состояние).
Правило Вант-Гоффа – при повышении температуры на каждые 100 С скорость реакции увеличивается в среднем в 2 – 4 раза.
Катализ – это изменение скорости реакции под действием катализаторов.
Катализатор (от греч. katalysis – разрушение) – это вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
Ферменты (от лат. fermentum – закваска) – это вещества, катализирующие биохимические реакции в организмах.
Основная и дополнительная литература по теме урока:
1. Естествознание. 10 класс: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд. – М.: Просвещение, 2017. – С. 184-189.
2. Энциклопедия для детей. Том 17. Химия. / Глав. ред. В.А. Володин. – М.: Аванта+, 2000. – С. 116-126; 568-576.
3. Савинкина Е.В. История химии. Элективный курс: Учебное пособие / Е.В. Савинкина, Г.П. Логинов, С.С. Плоткин. – М.: БИНОМ. Лаборатория знаний, 2007. – С. 139-144.
Открытые электронные ресурсы по теме урока:
Левченков С.И. Химическая кинетика // Краткий очерк истории химии: Учебное пособие для студентов химфака РГУ. URL:
http://www.physchem.chimfak.rsu.ru/Source/History/Sketch_7.html#Кинетика
Теоретический материал для самостоятельного изучения
Многообразие объектов Вселенной отражается в многообразии видов и форм движения. Качественные изменения, которые происходят в ходе химических превращений, можно интерпретировать как особый вид движения, а саму химическую реакцию рассматривать как определенную химическую форму движения. Изучением того, как во времени протекают химические процессы, занимается химическая кинетика – область химической науки, становление которой началось со второй половины XIX века.
Химические процессы протекают с различной скоростью: бронзовый памятник во влажном воздухе медленно покрывается голубоватым налетом, значительно быстрее покрывается ржавчиной железный предмет, лежащий в воде, долька яблока через несколько часов покрывается бурой пленкой, а образование осадка при сливании растворов, например, сульфата натрия и хлорида бария, происходит очень быстро. Для количественной характеристики скорости химической реакции используют не время её протекания, а скорость изменения количества вещества (в моль), вступающего в реакцию или образующегося в ходе реакции. Таким образом, скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем). Напомним, что гомогенная система состоит из одной фазы, а гетерогенная система – из нескольких фаз, разграниченных между собой поверхностями раздела. Наиболее часто в химии рассматривается зависимость концентрации веществ от времени, поэтому скорость реакции можно определять как изменение концентрации одного из реагирующих веществ или одного из образующихся в ходе реакции веществ в единицу времени.
𝑣 = ± ∆с/∆t, где 𝑣 – скорость реакции, ∆с – изменение концентрации вещества, ∆t – промежуток времени, в котором определяют скорость реакции. Если скорость определяют по изменению концентрации реагирующего вещества, которая в ходе реакции уменьшается, то перед формулой ставят знак «–», если скорость определяется по изменению концентрации продукта реакции, которая в ходе реакции увеличивается, то перед формулой ставят знак «+». Скорость химической реакции изменяется во времени, поэтому по приведенной формуле можно вычислить только среднюю скорость реакции в определенном интервале времени. Графическое изображение зависимости концентрации реагентов от времени называется кинетической кривой. С помощью кинетической кривой можно графически определить истинную скорость реакции в каждый момент времени.
Чтобы управлять химической реакцией – замедлять или ускорять химические процессы, необходимо знать, от чего зависит скорость реакции. Особенно важно знать зависимость скорости реакции от концентрации реагирующих веществ. Впервые скорость химической реакции и её зависимость от концентрации исходных веществ исследовал немецкий химик Людвиг Фердинанд Вильгельми (1812 – 1864), изучая гидролиз сахарозы. В своей работе, опубликованной в 1850 году, он привел формулу, отражающую зависимость скорости реакции от концентрации реагирующих веществ – первое кинетическое уравнение химической реакции. В 1864 – 1867 гг. норвежские учёные Като Максимилиан Гульдберг (1836 – 1902) и Петер Вааге (1833 – 1900) опубликовали работы, в которых на основе сотен экспериментов доказали, что скорость реакции пропорциональна произведению «действующих масс» реагентов, т.е. (концентрациям). Таким образом, количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для некоторой реакции xA + yB → zD эта зависимость будет иметь вид: 𝑣 = k∙CAx∙CBy, где СА и СВ – молярные концентрации веществ А и В, k – коэффициент пропорциональности, называемый константой скорости химической реакции, численно равный скорости реакции при концентрации всех реагирующих веществ, равных 1 моль/л и определяемый экспериментально. Зависимость скорости реакции от концентрации реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Скорость гетерогенных реакций, протекающих на границе раздела фаз не зависит от концентрации. Как правило, при низких температурах скорость гетерогенных реакций зависит от площади поверхности раздела фаз и температуры.
Превращение одних веществ в другие не является одномоментным событием, – это сложный процесс, который развертывается во времени и пространстве. Еще в XIX веке учёные определили, что химические реакции в подавляющем большинстве являются многостадийными процессами. Последовательность элементарных стадий процесса, в результате которого исходные вещества превращаются в продукты реакции, называется механизмом реакции. По числу стадий реакции подразделяются на простые (элементарные) и сложные. Простые реакции осуществляются в одну стадию, химическое уравнение таких реакций полностью отражает какие и сколько частиц участвуют непосредственно в элементарном акте химического взаимодействия. В реакциях изомеризации или диссоциации, например, происходит химическое превращение одной молекулы. Есть простые реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или разных) или даже трёх частиц. Сложные реакции осуществляются в несколько стадий, каждая из которых является простой реакцией. Каждая из стадий протекает со своей скоростью. Скорости отдельных стадий могут существенно отличаться друг от друга. Скорость сложной реакции в целом будет определяться скоростью самой медленной стадии, которая называется лимитирующей. Механизмы химических реакций определяются экспериментально.
Скорость химической реакции зависит от температуры. Впервые влияние температуры на скорость реакции было учтено Якобом Генриком Вант-Гоффом (1852 – 1911), им было сформулировано эмпирическое правило (правило Вант-Гоффа): при повышении температуры на каждые 10°С скорость реакции увеличивается в 2 – 4 раза. Однако это правило носит приближенный характер и применимо лишь в узком интервале температур. Более точно зависимость скорости химической реакции от температуры была определена шведским химиком Сванте Августом Аррениусом (1859 – 1927), он ввёл понятие энергии активации и сформулировал закон температурной зависимости для константы скорости простых реакций.
Многие химические процессы в растворе или газовой фазе происходят при столкновении частиц реагирующих веществ. Число таких соударений огромно. Если бы все соударения частиц приводили к химическому взаимодействию, то реакции протекали бы мгновенно, однако этого не происходит. Это объясняется тем, что не все соударения приводят к химическому взаимодействию. Чтобы соударение было эффективным (привело к химическому взаимодействию) столкнувшиеся частицы должны обладать достаточной энергией для разрыва или ослабления химических связей в молекулах реагирующих веществ. В результате происходит образование некоторого промежуточного неустойчивого комплекса (активированного комплекса) с последующим перераспределением электронной плотности и образованием продуктов реакции. Средняя избыточная энергия (по сравнению со средней энергией движения), которой должны обладать реагирующие частицы (атомы, молекулы), чтобы преодолеть энергетический барьер, разделяющий в химической реакции реагенты (исходные вещества) и продукты (конечное состояние) называется энергией активации. Так как при повышении температуры доля частиц, обладающих избыточной энергией увеличивается, то увеличивается и число эффективных соударений и, следовательно, константа скорости реакции.
На скорость реакции могут оказывать влияние вещества, которые получили название катализаторов. Еще с начала XIX века химики обратили внимание на необычные химические реакции, для протекания которых требовалось добавление некоторых веществ. Эти вещества в реакциях не расходовались, но без их добавления реакции не протекали. В 1835 году все известные на тот момент каталитические исследования обобщил шведский химик Йёнс Якоб Берцелиус (1779 – 1848), он же первым использовал термин «катализ» (от греч. katalysis – разрушение). Однако, механизм влияния этих добавок был непонятен химикам XIX века. Только в самом конце XIX века немецкий химик Вильгельм Фридрих Оствальд (1853 – 1932) сумел дать современные определения катализа и катализатора. Появление современных теорий катализа относится к 20-м годам XX века. Первой из них была мультиплетная теория, которую разработал российский химик Алексей Александрович Баландин (1898 – 1967).
Катализаторы – это вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся. Изменение скорости реакции под действием катализаторов называют катализом. Известны различные виды катализа. Катализ может быть положительным – увеличивать скорость реакции, или отрицательным – уменьшать скорость реакции. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, замедляющие течение реакции – ингибиторами. Катализ, при котором катализатор образует одну фазу с реагирующими веществами, называют гомогенным катализом. Если катализатор образует самостоятельную фазу и реакция происходит на поверхности катализатора, то катализ называется гетерогенным катализом. Хорошо известный Вам из школьного курса процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 (2SO2 + O2 = 2SO3 + Q) можно проводить с использованием разных катализаторов.
В начале XX века этот процесс осуществляли в газовой фазе с использованием оксида азота (II) NO в качестве катализатора – это пример гомогенного катализа. Если в качестве катализатора использовать оксид ванадия (V) V2O5, который является твердым веществом, то реакция протекает на его поверхности – это пример гетерогенного катализа. Гетерогенный катализ может быть усилен добавлением промоторов – веществ, которые сами не являются катализаторами, но повышают активность катализатора данной реакции. Так, для синтеза аммиака, идущего с использование железного катализатора, используется добавление оксидов алюминия и калия. Однако, есть вещества, которые наоборот снижают активность катализатора. Такие вещества называются каталитическими ядами. Так, например, платиновый катализатор очень чувствителен по отношению к соединениям серы и селена.
Важными свойствами катализаторов является их специфичность и селективность. Под специфичностью катализатора понимается его способность ускорять только какую-то одну группу реакций и никак не влиять на скорость других реакций. Хорошо известный Вам пример: платина Pt и никель Ni являются катализаторами процессов гидрирования. Другое свойство катализаторов – селективность (избирательность) заключается в способности катализаторов ускорять только одну из возможных при данных условиях параллельных реакций. На этом свойстве катализаторов основаны способы получения разных продуктов из одних и тех же исходных веществ. Например, из этилового спирта C2H5OH в присутствии оксида алюминия Al2O3 получают этилен CH2=CH2, а в присутствии меди Cu – уксусный альдегид CH3COH. Наибольшей селективностью отличаются биологические катализаторы белковой природы – ферменты. Кроме того, ферменты обладают высокой активностью, что объясняется значительным снижением энергии активации биохимического процесса ферментами.
В чем же заключается действие катализатора? Оказывается, катализаторы снижают энергию активации реакции, в результате чего увеличивается число частиц, обладающих энергией, достаточной для химического взаимодействия. Катализаторы участвуют в образовании активированного комплекса, требующего меньшей энергия активации.
Таким образом, превращение одних веществ в другие – это процесс, развертывающийся во времени, т. е. имеющий свою временную структуру, которая выражена механизмом реакции. Вместе с тем механизм реакции учитывает не только изменения в составе веществ-участников реакции, но и изменение положений атомов в пространстве по мере протекания реакции. Поэтому можно говорить о пространственно-временной структуре реакции. Любое превращение одних веществ в другие, т.е. химическую реакцию, можно рассматривать как качественное изменение и особую форму движения.
Выводы:
1. Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем).
2. На скорость реакции оказывают влияние: природа реагирующих веществ, их концентрация (для гомогенных систем), площадь поверхности (для гетерогенных систем), температура и наличие катализатора.
3. Количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
4. Большинство химических реакций являются многостадийными процессам, механизм которых определяется экспериментально. Под механизмом химической реакции понимают последовательность элементарных стадий процесса, в результате которых исходные вещества превращаются в продукты реакции.
5. Многие химические реакции являются каталитическими, т.е. для их осуществления необходимы катализаторы – вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
6. Химическая реакция – имеет сложную пространственно-временную структуру, что позволяет её рассматривать не только как качественное изменение веществ, но и особую форму движения.
Примеры и разбор решения заданий тренировочного модуля:
1. Укажите верные утверждения:
Утверждение | Правильный ответ и пояснение |
А. Химическое уравнение не отражает механизм протекания реакции. | Правильное утверждение. Химическое уравнение не отражает механизм протекания реакции, механизм реакции определяется экспериментально. |
Б. Катализатор ускоряет реакцию, но сам в реакции не участвует. | Неправильное утверждение. Катализаторы – вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся. |
В. Закон действующих масс выражает количественную зависимость скорости реакции от концентрации реагирующих веществ. | Правильное утверждение. Количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. |
2. Установление соответствие между элементами двух множеств. К каждой позиции первого столбца подберите соответствующую позицию второго.
Утверждение | Теория |
1. Процесс гидрирования этилена СН2=СН2 c использованием никеля Ni в качестве катализатора. | А. Гомогенный катализ Б. Гетерогенный катализ |
2. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида азота (II) NO в качестве катализатора. | |
3. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида ванадия (V) V2O5 в качестве катализатора. |
Правильный ответ:1 – Б; 2 – А; 3 – Б.
Утверждение | Теория |
1. Процесс гидрирования этилена СН2=СН2 c использованием никеля Ni в качестве катализатора. | Б. Гетерогенный катализ |
2. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида азота (II) NO в качестве катализатора. | А. Гомогенный катализ |
3. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида ванадия (V) V2O5 в качестве катализатора. | Б. Гетерогенный катализ |
Влияние давления на порядок реакции. Влияние концентраций веществ на скорость химической реакции
Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации.
В уравнении Менделеева-Клапейрона:
перенесем V
в правую часть, а RT
— в левую и учтем, что n/V = c
:
Давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации p/RT.
Цепные реакции
включают в свой механизм множество последовательно повторяющихся однотипных элементарных актов (цепь).
Рассмотрим реакцию:
Она состоит из следующих стадий, общих для всех цепных реакций:
1) Инициирование
, или зарождение цепи
Распад молекулы хлора на атомы (радикалы) происходит при УФ-облучении или при нагревании. Сущность стадии инициирования — образование активных, реакционноспособных частиц.
2) Развитие цепи
Cl· + h3 = HCl + H·
H· + Cl2 = HCl + Cl·
В результате каждого элементарного акта развития цепи образуется новый радикал хлора, и эта стадия повторяется вновь и вновь, теоретически — до полного расходования реагентов.
- 3) Рекомбинация
, или обрыв цепи - 2Cl· = Cl2
- 2H· = h3
H· + Cl· = HCl
Радикалы, оказавшиеся рядом, могут рекомбинировать, образуя устойчивую частицу (молекулу). Избыток энергии они отдают «третьей частице» — например, стенкам сосуда или молекулам примесей.
Рассматриваемая цепная реакция является неразветвленной
, поскольку в элементарном акте развития цепи количество радикалов не возрастает. Цепная реакция взаимодействия водорода с кислородом является разветвленной
, т.к. число радикалов в элементарном акте развития цепи увеличивается:
H· + O2 = OH· + O·
O· + h3 = OH· + H·
OH· + h3 = h3O + H·
К разветвленным цепным реакциям относятся многие реакции горения. Неконтролируемый рост числа свободных радикалов (как в результате разветвления цепи, так и для неразветвленных реакций в случае слишком быстрого инициирования) может привести к сильному ускорению реакции и взрыву. Казалось бы, чем больше давление, тем выше концентрация радикалов и вероятнее взрыв. Но на самом деле для реакции водорода с кислородом взрыв возможен лишь в определенных областях давления: от 1 до 100 мм рт.ст. и выше 1000 мм рт.ст. Это следует из механизма реакции. При малом давлении большая часть образующихся радикалов рекомбинирует на стенках сосуда, и реакция идет медленно. При повышении давления до 1 мм рт.ст. радикалы реже достигают стенок, т.к. чаще вступают в реакции с молекулами. В этих реакциях радикалы размножаются, и происходит взрыв. Однако при давлении выше 100 мм рт.ст. концентрации веществ настолько возрастают, что начинается рекомбинация радикалов в результате тройных соударений (например, с молекулой воды), и реакция протекает спокойно, без взрыва (стационарное течение). Выше 1000 мм рт.ст. концентрации становятся очень велики, и даже тройных соударений оказывается недостаточно, чтобы предотвратить размножение радикалов.
Вам известна цепная разветвленная реакция деления урана-235, в каждом элементарном акте которой захватывается 1 нейтрон (играющий роль радикала) и испускается до 3 нейтронов. В зависимости от условий (например, от концентрации поглотителей нейтронов) для нее также возможно стационарное течение или взрыв. Это еще один пример корреляции кинетики химических и ядерных процессов.
В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, — несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе — за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, — нужно замедлить.
Скорость химической реакции
можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) — сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt
. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем
изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени
:
n 2 − n 1
Δn
υ = –––––––––– =
–––––––– = Δс/Δt (1)
(t 2 − t 1) v
Δt v
где c = n / v — концентрация вещества,
Δ (читается «дельта») — общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO 2 + O 2 = 2SO 3
Скорость по кислороду будет: υ = 1: (10 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2: (10 1) = 0,2 моль/л·с
— это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
1)
Скорость реакции зависит от природы реагирующих веществ
. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2)
Скорость реакции тем больше, чем выше концентрация
веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3)
Скорость реакции значительно повышается с повышением температуры
. Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4)
Скорость гетерогенных
реакций увеличивается с увеличением поверхности реагирующих веществ
. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1)
! Формула (2)
выражает скорость на единице площади, следовательно не может зависеть от площади.
5)
Скорость реакции зависит от наличия катализаторов или
ингибиторов.
Катализаторы
— вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример — бурное разложение перекиси водорода при добавлении катализатора — оксида марганца (IV):
2H 2 O 2 = 2H 2 O + O 2
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы
— вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров.
Влияние концентрации на скорость химической реакции
Зависимость скорости реакции от концентрации реагирующих веществ сформулирована в законе действующих масс
: “
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам”
Например: для реакции mA + nB → pAB
математическое выражение закона действующих масс:
υ = k [A] m ∙ [B] n (иначе– кинетическое уравнение реакции),
где [A] и [B] концентрации реагирующих веществ А и В; m и n – стехиометрические коэффициенты; k – коэффициент пропорциональности, названный константой скорости.
Физический смысл константы скорости заключается в том, что при концентрациях реагирующих веществ равных 1,0 моль/л([A]=[B] = 1моль/л), скорость химической реакции равна константе скорости (υ=k). Константа скорости зависит только от природы реагирующих веществ и от температуры, но не зависит от концентрации веществ.
Математическая запись закона действующих масс для гомогенных и гетерогенных систем имеет некоторые отличия. Для гетерогенных реакций в кинетическое уравнение входят концентрации только тех веществ, которые находятся в системе в растворе или в газовой фазе. Концентрация же веществ, находящихся в твердом состоянии на поверхности в течение реакции остается постоянной, поэтому ее величина учитывается в константе скорости реакции.
Например: для гомогенной реакции
2H 2(г) + O 2(г) = 2H 2 O (г)
выражение закона: υ = k ∙ 2 ∙ ;
для гетерогенной реакции
С (тв) +O 2(г) =СО 2(г)
выражение закона υ = k эф ∙ ,
где: k эф – эффективная константа скорости, равная k ∙ [С тв ]
Задача
Как изменится скорость реакции 2H 2(г) + O 2(г) = 2H 2 O (г) при увеличении концентрации исходных веществ в два раза?
Решение
Зависимость скорости реакции от концентрации (кинетическое уравнение) запишется: υ = k ∙ 2 ∙
Если концентрации исходных веществ увеличить в 2 раза, то кинетическое уравнение имеет вид: υ» = k ∙ 2 ∙ , тогда υ»/υ = 8 – скорость данной реакции возросла в 8 раз.
Зависимость скорости реакции от давления описывается выражением аналогичным закону действующих масс, где вместо концентраций веществ используют парциальные давления реагирующих газов.
Например: для реакции 2H 2(г) + O 2(г) = 2H 2 O (г) зависимость скорости реакции от давления запишется: υ = k ∙ Р H 2 2 ∙ Р O 2
Задача
Как изменится скорость реакции, если общее давление в системе CH 4(г) + 2O 2(г) = CO 2(г) + 2H 2 O (г), если общее давление в системе уменьшить в 5 раз?
Решение
Зависимость скорости реакции от давления запишется:
υ = k ∙ Р CH 4 ∙Р 2 O 2 . При уменьшении общего давления в системе уменьшится парциальное давления каждого газа, то есть υ» = k ∙ Р CH 4 /5 ∙(Р O 2 /5) 2 . Тогда υ»/υ = 1/5∙5 2 =1/125 — скорость реакции уменьшилась в 125 раз
Скорость химических реакций — это число элементарных актов химических превращений, приводящих к образованию продуктов реакции в единицу времени в единице объема или на единице поверхности.
Поскольку число элементарных актов не пересчитать, то скорость измеряют, определяя изменение концентраций реагирующих веществ или продуктов реакции в единицу времени:
,
В любой реакции реагенты расходуются, она замедляется. См. рис.3.9.1.
Рис. 3.9.1. Изменение скорости реакции во времени.
V– скорость реакции, C– концентрация А, В.
Поэтому можно говорить только о скорости в данный момент времени. Скорость зависит от концентрации реагирующих веществ.
От чего еще она зависит? От природы реагирующих веществ, температуры, степени измельчения реагентов для гетерогенных реакций (площади поверхности), катализатора и формы сосуда и т.д.
Рассмотрим зависимость vот концентрации. Предположим, имеем реакцию A+ B+ 2D= F+ L. Надо найти зависимость скорости от концентрации реагентов v= f(C A , C B , C D) = ?
Измерим скорость при каких либо концентрациях, а потом увеличим С А вдвое и еще раз измерим скорость. Пусть она возросла вдвое. Это значит, что vпропорциональна С А в первой степени. Увеличим С В вдвое. Предположим, что это не повлияло на скорость — вполне реальная ситуация. Если растворять NO 2 в воде для получения азотной кислоты, то очевидно, что скорость реакции не будет зависеть от количества воды. В таком случае можно сказать, что vзависит от С В в нулевой степени. Пусть теперь мы обнаружили, что от С D скорость зависит как С D 2 . Тогда общее уравнение скорости реакции запишется как v= kC A C B 0 C D 2 .
Это выражение называется кинетическим уравнением реакции; k– константа скорости реакции (численно равна скорости при концентрациях реагентов, равных единице). Показатели степеней при концентрациях в кинетическом уравнении называются порядками реакции по данному веществу, а их сумма – общим порядком реакции.
Порядки реакций устанавливаются экспериментально, а не по стехиометрическим коэффициентам.
Существует совсем немного реакций, где порядок совпадает с суммой стехиометрических коэффициентов.
N 2 O 5 = 2NO 2 + 1/2O 2 v = kC(N 2 O 5) р-ия1 порядка
(H 2)+(J 2)=2(HJ) v=kC(H 2)C(J 2) р-ия2 порядка
но (Н 2) + (Br 2) = 2(HBr) v=kC(H 2)C(Br 2) 1/2
(Cl 2) + 2(NO) = 2(NOCl) v=kC(Cl 2)C(NO) 2 р-ия3 порядка.
Иными словами, порядок может быть и дробным. Почему, рассмотрим ниже.
Реакции обычно идут по стадиям, поскольку невозможно представить себе одновременное столкновение большого числа молекул.
Предположим, что некая реакция
идет в две стадии
A+ B= ABи AB+ B= C+ D,
тогда, если первая реакция идет медленно, а вторая быстро, то скорость определяется первой стадией (пока она не пройдет, не может идти вторая), т.е. накоплением частиц АВ. Тогда и v=kC A C B .
Скорость реакции определяется самой медленной стадией. Отсюда различия между порядком реакции и стехиометрическими коэффициентами. Например, реакция разложения перекиси водорода
2H 2 O 2 = H 2 O+ O 2
является реакцией первого порядка, т.к. она лимитируется первой стадией H 2 O 2 = H 2 O+ O, а вторая стадия О + О = О 2 идет очень быстро.
Может быть самой медленной не первая, а вторая или другая стадия и тогда мы получаем иногда дробный порядок, выражая концентрации интермедиатов через концентрации начальных веществ.
С ростом температуры увеличивается скорость движения частиц, а следовательно, частота их соударений. Поэтому скорость реакций увеличивается с температурой. Существует эмпирическая закономерность, выведенная Вант-Гоффом, что при увеличении температуры на 10 о скорость возрастает в 2-4 раза.
Реакции идут по стадиям. Маловероятно, что в реакции образования аммиака N 2 + 3H 2 = 2NH 3 одновременно столкнутся в одной точке пространства 4 молекулы, да еще нужного сорта.
Количество частиц, принимающих участие в элементарном акте химического превращения называется молекулярностью
реакции.
Реакции могут быть моно- , би- и тримолекулярными.
Мономолекулярные
– реакции разложения и внутримолекулярные перегруппировки.
Бимолекулярные
– 2NO 2 = N 2 O 4
Тримолекулярные
(редкие) — 2NO+ O 2 = 2NO 2 .
В этих примерах порядок и молекулярность совпадают, но часто они различны.
Имеются два критерия возможности самопроизвольного протекания химического процесса – изменение энтальпии DН, которое отражает определенное упорядочение системы и изменение энтропии DS, которое отражает противоположную тенденцию к беспорядочному расположению частиц. Если DS=0, то движущей силой процесса будет стремление системы к минимуму внутренней энергии, то есть, критерий процесса – уменьшение энтальпии (DН
Если DН=0, то критерий самопроизвольного протекания процесса DS>0.
Как влияют величины энтальпийного и энтропийного фактора на протекание процесса.
1) Экзотермическая реакция
,
DН
a) DS>0, тогда для любого Т DGбудет меньше нуля и процесс идет всегда, причем до конца.
б) DS
DG
DG>0 — реакция не идет
Экзотермические реакции, сопровождающиеся уменьшением энтропии, идут при низких температурах, увеличение Т способствует протеканию обратной реакции (Принцип Ле Шателье).
2) Эндотермическая реакция
, DН>0.
а) DS>0, реакция возможна только если |TDS|>|DH|, тогда DG
б) DS0 при любых температурах и процесс самопроизвольно идти не может.
Пример — реакция окисления глюкозы до CO 2 и H 2 O
6(O 2) ®6(CO 2) + 6H 2 O DН= — 2810 кДж
Энтропия при этом, очевидно, возрастает. Следовательно, обратный процесс принципиально не может идти самопроизвольно. Для его протекания требуется энергия извне (фотосинтез).
Следует отметить, что в вопросе о возможности протекания процесса термодинамический критерий – истина в последней инстанции. Если DG>0, никакие катализаторы не помогут провести процесс. При DG
- Геохимия природных и техногенных ландшафтов
- ДИДАКТИЧЕСКИЙ ПЛАН
- ЛИТЕРАТУРА
- Оценка загрязненности воды
- Биохимическое и химическое потребление кислорода
- Аналитическое определение БПК и ХПК
- Неорганические вещества в воде. Ионы, поступающие из удобрений и солей, используемых для снеготаяния и борьбы со льдом. Кислотные выбросы. Ионы тяжелых металлов. Основные химические реакции в гидросфере
- Методы очистки воды: физические, химические и биологические. Основные принципы и аппаратное оформление. Очистка питьевой воды: процессы водоподготовки и химические реакции, лежащие в их основе. Стандарты на воду
- Загрязнение почвы. Химические последствия кислотных загрязнений
- Роль металлов в живой природе
- Необходимость и токсичность ионов металлов
- Взаимосвязь между необходимостью и токсичностью металлов в экосистемах
- Потенциально опасные следы металлов в атмосфере, гидросфере и литосфере
- Глобальный перенос следовых количеств потенциально опасных металлов
- Микроэлементы. Поступление и усвоение металлов в организме
- Молекулярные основы токсичности металлов. Ряды токсичности
- Факторы окружающей среды, влияющие на токсичность
- Толерантность организмов к металлам. Канцерогенность ионов металлов. Пути воздействия металлов на организм
- Ионы тяжелых металлов в природных водах. Формы существования металлов в водных экосистемах, зависимость токсичности от формы. Вторичная токсичность вод
- Строение атмосферы
- Распределение температуры, давления и других параметров по высоте
- Причины образования характерных слоев в атмосфере (барометрическая формула, конвекция, космическое излучение). Значение слоев для человека
- Ионосфера
- Изменение химического состава по высоте (несоответствие барометрической формуле)
- Рассмотрение атмосферы как системы (открытая, замкнутая, изолированная). Термодинамический подход (N2O). Грозы
- Кинетический подход
- Основные химические реакции в атмосфере и тропосфере
- Элементы химической кинетики (порядок реакции, молекулярность, зависимость скорости от давления)
- Озоновый слой
- Разрушающее действие галогенов, фреонов и т.д.
- Характерный химический состав выбросов в атмосферу
- Химические превращения загрязнений
- Возможность самоочищения атмосферы
- Границы биосферы, состав и масса живого вещества
- Кларки и геохимические функции живого вещества, биогеохимические процессы как геологический фактор
- Органическое вещество, процессы синтеза и разложения
- Автотрофные и гетеротрофные организмы
- Сульфатредукция и метанообразование
- Возраст жизни и возраст фотосинтеза
Механизмы протекания химических превращений и их скорости изучает химическая кинетика. Химические процессы протекают во времени с различными скоростями. Какие-то происходят быстро, почти мгновенно, для протекания других требуется весьма продолжительное время.
Вконтакте
Скорость реакции
— скорость с которой расходуются реагенты (их концентрация уменьшается) или образуются продукты реакции в единице объёма.
Факторы, способные влиять на скорость химической реакции
На то, насколько быстро будет происходить химическое взаимодействие, могут повлиять следующие факторы:
- концентрация веществ;
- природа реагентов;
- температура;
- присутствие катализатора;
- давление (для реакций в газовой среде).
Таким образом, изменяя определённые условия протекания химического процесса, можно повлиять на то, насколько быстро будет протекать процесс.
В процессе химического взаимодействия частицы реагирующих веществ сталкиваются друг с другом. Количество таких совпадений пропорционально числу частиц веществ в объёме реагирующей смеси, а значит и пропорционально молярным концентрациям реагентов.
Закон действующих масс
описывает зависимость скорости реакции от молярных концентраций веществ, вступающих во взаимодействие.
Для элементарной реакции (А + В → …) данный закон выражается формулой:
υ = k ∙С A ∙С B,
где k — константа скорости; С A и С B — молярные концентрации реагентов, А и В.
Если одно из реагирующих веществ находится в твёрдом состоянии, то взаимодействие происходит на поверхности раздела фаз, в связи с этим концентрация твёрдого вещества не включается в уравнение кинетического закона действующих масс. Для понимания физического смысла константы скорости, необходимо принять С, А и С В равными 1. Тогда становится понятно, что константа скорости равна скорости реакции при концентрациях реагентов, равных единице.
Природа реагентов
Так как в процессе взаимодействия разрушаются химические связи реагирующих веществ и образуются новые связи продуктов реакции, то большую роль будет играть характер связей, участвующих в реакции соединений и строение молекул реагирующих веществ.
Площадь поверхности соприкосновения реагентов
Такая характеристика, как площадь поверхности соприкосновения твёрдых реагентов, на протекание реакции влияет, порой, довольно значительно. Измельчение твёрдого вещества позволяет увеличить площадь поверхности соприкосновения реагентов, а значит и ускорить протекание процесса. Площадь соприкосновения растворимых веществ легко увеличивается растворением вещества.
Температура реакции
При увеличении температуры энергия сталкивающихся частиц возрастёт, очевидно, что с ростом температуры и сам химический процесс будет ускоряться. Наглядным примером того, как увеличение температуры влияет на процесс взаимодействия веществ, можно считать приведённые в таблице данные.
Таблица 1. Влияние изменения температуры на скорость образования воды (О 2 +2Н 2 →2Н 2 О)
Для количественного описания того, как температура может влиять на скорость взаимодействия веществ используют правило Вант-Гоффа. Правило Вант-Гоффа состоит в том, что при повышении температуры на 10 градусов, происходит ускорение в 2−4 раза.
Математическая формула, описывающая правило Вант-Гоффа, выглядит следующим образом:
Где γ — температурный коэффициент скорости химической реакции (γ = 2−4).
Но гораздо более точно описывает температурную зависимость константы скорости уравнение Аррениуса:
Где R — универсальная газовая постоянная, А — множитель, определяемый видом реакции, Е, А — энергия активации.
Энергией активации называют такую энергию, которую должна приобрести молекула, чтобы произошло химическое превращение. То есть она является неким энергетическим барьером, который необходимо будет преодолеть сталкивающимся в реакционном объёме молекулам для перераспределения связей.
Энергия активации не зависит от внешних факторов, а зависит от природы вещества. Значение энергии активации до 40 — 50 кДж/моль позволяет веществам реагировать друг с другом довольно активно. Если же энергия активации превышает 120 кДж/моль
, то вещества (при обычных температурах) будут реагировать очень медленно. Изменение температуры приводит к изменению количества активных молекул, то есть молекул, достигших энергии большей, чем энергия активации, а значит способных к химическим превращениям.
Действие катализатора
Катализатором называют вещество, способное ускорять процесс, но не входящее в состав его продуктов. Катализ (ускорение протекания химического превращения) разделяют на · гомогенный, · гетерогенный. Если реагенты и катализатор находятся в одинаковых агрегатных состояниях, то катализ называют гомогенным, если в различных, то гетерогенным. Механизмы действия катализаторов разнообразны и достаточно сложны. Кроме того, стоит отметить, что для катализаторов характерна избирательность действия. То есть один и тот же катализатор, ускоряя одну реакцию, может никак не изменять скорость другой.
Давление
Если в превращении участвуют газообразные вещества, то на скорость протекания процесса будет влиять изменение давления в системе. Это происходит потому
, что для газообразных реагентов изменение давления приводит к изменению концентрации.
Экспериментальное определение скорости химической реакции
Определить быстроту протекания химического превращения экспериментально можно, получив данные о том, как в единицу времени меняется концентрация веществ, вступающих в реакцию, или продуктов. Методы получения таких данных делят на
- химические,
- физико-химические.
Химические методы достаточно просты, доступны и точны. С их помощью скорость определяют, непосредственно замеряя концентрацию или количество вещества реагентов или продуктов. В случае медленной реакции, для контроля за тем, как расходуется реагент отбирают пробы. После чего определяют содержание в пробе реагента. Осуществляя отбор проб через равные промежутки времени, можно получить данные об изменении количества вещества в процессе взаимодействия. Чаще всего используют такие виды анализа, как титриметрия и гравиметрия.
Если реакция протекает быстро, то чтобы отобрать пробу, её приходится останавливать. Это можно сделать с помощью охлаждения, резкого удаления катализатора
, также можно произвести разбавление либо перевести один из реагентов в не реакционноспособное состояние.
Методы физико-химического анализа в современной экспериментальной кинетике используются чаще, чем химические. С их помощью можно наблюдать изменение концентраций веществ в реальном времени. При этом реакцию нет необходимости останавливать и отбирать пробы.
Физико-химические методы основываются на измерении физического свойства, зависящего от количественного содержания в системе определённого соединения и изменяющегося со временем. Например, если в реакции участвуют газы, то таким свойством может быть давление. Также измеряют электропроводность, показатель преломления, спектры поглощения веществ.
Скорость реакции — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Скоростью химической реакции называется изменение концентрации вещества в единицу времени, , где концентрация С выражена в моль/л. В ЕГЭ не требуется применение этой формулы, необходимо лишь уметь сравнивать скорости различных реакций и определять, как на них влияют изменения внешних условий.
Скорость реакции зависит от нескольких факторов:
- — Природы взаимодействующих веществ
- — Температуры
- — Концентрации реагирующих веществ
- — Присутствия в реакционной смеси катализатора или ингибитора
- — Площади поверхности соприкосновения реагентов (для гетерогенных процессов).
Рассмотрим каждый пункт отдельно:
1) Природа реагентов
Очевидно, что разные реакции при одних и тех же условиях протекают с различными скоростями. Нейтрализация щелочи кислотой протекает почти моментально, растворение цинка в соляной кислоте — быстро, ржавление железа под действием воды и кислорода – намного дольше. Общее правило очевидно: чем активнее реагирующие вещества, тем быстрее они взаимодействуют друг с другом.
Самые быстрые реакции – гомогенные, протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме смеси реагентов.
Гетерогенные реакции – взаимодействие не смешивающихся друг с другом веществ – протекают на границе раздела фаз. Эти процессы медленнее, и скорость определяется площадью поверхности соприкосновения.
2) Температура
При увеличении температуры молекулы начинают двигаться быстрее, следовательно, чаще сталкиваются друг с другом. Таким образом, скорость реакции всегда возрастает при повышении температуры и уменьшается – при понижении. Мы активно пользуемся этим в быту: например, для замедления процессов гниения (сложных химических реакций) храним продукты в холодильнике, а для ускорения реакции Майяра (взаимодействие белков с сахарами) готовим пищу при высокой температуре.
Зависимость скорости реакции от температуры определяется уравнением Вант-Гоффа: , где v2 и v1 – скорости реакции при температурах Т2 и Т1 соответственно, γ – температурный коэффициент, принимающий значения от 2 до 4. Например, если γ=3, при повышении температуры на 20 градусов скорость реакции возрастет в раз.
3) Концентрация реагентов
Очевидно, что чем выше концентрации реагирующих веществ, тем чаще их молекулы будут сталкиваться друг с другом, следовательно, тем быстрее будет протекать взаимодействие. Зависимость скорости от концентрации реагентов выражается законом действующих масс.
Например, для реакции aA + bB = cC + dD скорость . На самом деле часто зависимость скорости от концентраций реагентов носит более сложный характер, так как многие процессы протекают через образование промежуточных продуктов, но мы оставим эти случаи университетскому курсу.
Пожалуйста, не путайте: скорость реакции зависит от концентраций реагентов и не зависит от концентраций продуктов!
Здесь же рассмотрим влияние давления на скорость реакции. Жидкости и твердые тела практически несжимаемы и давление не влияет на их концентрации. Для газов увеличение давления вызывает возрастание концентрации, следовательно, ускоряет реакцию.
4) Катализаторы и ингибиторы
Катализатор – вещество, увеличивающее скорость реакции, но не расходующееся в ней, ингибитор – это «катализатор наоборот», он замедляет реакцию.
5) Площадь границы раздела фаз
Для примера рассмотрим реакцию цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2.
Кусочек цинка будет постепенно растворяться в кислоте: сначала прореагирует верхний слой молекул, потом следующий, — и так далее. «Внутренние» атомы смогут прореагировать только после того, как перейдут в раствор «внешние».
Если же этот кусочек измельчить (то есть увеличить площадь его поверхности) реакция пойдет заметно быстрее, т.к. возрастет количество «доступных для кислоты» частиц.
Таким образом, чем сильнее измельчено твердое вещество, тем выше скорость реакции. Количество твердого вещества на скорость влияет намного слабее, чем степень его измельченности и концентрация жидких или газообразных реагентов.
Потренируемся. Ниже приведены вопросы из ЕГЭ разных лет:
| А) Скорость химической реакции 2С(тв) + СО2(г) = 2СО(г) не зависит от | 1) температуры 2) концентрации СО 3) степени измельченности угля 4) давления |
| Б) С наибольшей скоростью при комнатной температуре протекает реакция меду водородом и | 1) серой 2) иодом 3) фтором 4) бромом |
| В) Для увеличения скорости химической реакции Mg(тв) + 2HCl(р-р) = MgCl2(р-р) + h3(г) необходимо | 1) увеличить давление 2) уменьшить температуру 3) увеличить концентрацию HCl 4) увеличить количество магния. |
| Г) Повышение давления приведет к увеличению скорости реакции | 1) 2P(тв) + 3S(тв) = P2S3(тв) 2) Br2(ж) + 2Na(тв) = 2NaBr 3) h3O(ж) + 2Na(тв) = 2NaOH + h3(г) 4) N2(г) + 3h3(г) = 2Nh4(г) |
| Ответы:
| |
Ты нашел то, что искал? Поделись с друзьями!
Скорость химических реакций | CHEMEGE.RU
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
A + B → C + D
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Вспомним про энергию активации Ea . Молекулы с энергией меньшей, чем энергия активации в отсутствие катализатора друг с другом взаимодействовать не могут. Катализаторы, изменяют путь, по которому протекает реакция подобно тому, как опытный проводник проложит маршрут экспедиции не напрямую через гору, а с помощью обходных троп, в результате чего даже те спутники, которые не имели достаточно энергии для восхождения на гору, смогут перебраться на другую ее сторону.
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
2Al + 6HCl → 2AlCl3 + 3H2↑
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.
ВЛИЯНИЕ ДАВЛЕНИЯ НА СКОРОСТЬ РЕАКЦИИ На этой странице описывается и объясняется, как изменение давления газа изменяет скорость реакции. Факты Что происходит? Увеличение давления в реакции с участием реагирующих газов увеличивает скорость реакции. Изменение давления в реакции, в которой участвуют только твердые вещества или жидкости, не влияет на скорость. Пример При производстве аммиака по процессу Габера скорость реакции между водородом и азотом увеличивается за счет использования очень высокого давления. Фактически, основной причиной использования высоких давлений является повышение процентного содержания аммиака в равновесной смеси, но это также оказывает полезное влияние на скорость реакции. | ||
Примечание: Если вы хотите изучить равновесие, вы найдете эту тему в отдельном разделе сайта. | ||
Объяснение Связь между давлением и концентрацией Повышение давления газа — это то же самое, что повышение его концентрации. Если у вас есть заданная масса газа, вы увеличиваете его давление, чтобы сжать его до меньшего объема. Если у вас такая же масса в меньшем объеме, то его концентрация выше. Вы также можете показать это соотношение математически, если встретили уравнение идеального газа : Перестановка дает: Поскольку «RT» постоянна, пока температура остается постоянной, это показывает, что давление прямо пропорционально концентрации.Если вы удвоите одну, вы также удвоите и другую. | ||
Примечание: Если у вас есть возможность выполнять вычисления с использованием уравнения идеального газа, но они вас не очень устраивают, возможно, вас заинтересует моя книга расчетов по химии. | ||
Влияние увеличения давления на скорость реакции Столкновения двух частиц Тот же аргумент применим независимо от того, включает ли реакция столкновение двух разных частиц или двух одинаковых частиц. Чтобы произошла какая-либо реакция, эти частицы должны сначала столкнуться. Это верно независимо от того, находятся ли обе частицы в газовом состоянии или одна является газом, а другая — твердым телом. Если давление выше, вероятность столкновения выше. Реакции с участием только одной частицы Объяснить труднее, если у вас есть реакции, в которых что-то происходит с одной частицей, а не в результате столкновения двух частиц.Взаимосвязь между давлением и скоростью намного сложнее и варьируется от реакции к реакции. Это выше уровня А. | ||
Примечание: До мая 2017 года у меня здесь было упрощенное объяснение с точки зрения столкновений частиц, а затем, спустя 15 лет, когда страница находилась в сети, кто-то заметил, что это нелогично! Прошу прощения за это. Существуют теории, которые показывают, что даже для мономолекулярных реакций (реакций с участием только одной молекулы) столкновения необходимы для того, чтобы молекулы приобрели энергию активации.Если вы хотите узнать об этом больше, вам придется заниматься химией на более высоком уровне. Вы можете погуглить, но вы найдете объяснения на высоком уровне и довольно математические. | ||
В меню ставок реакции.. . В меню «Физическая химия». . . В главное меню. . . © Джим Кларк, 2002 г. (последнее изменение — май 2017 г.) | ||
Chem4Kids.com: Реакции: скорость реакций
Скорость реакции — это скорость, с которой происходит химическая реакция. Если реакция имеет низкую скорость, это означает, что молекулы объединяются с меньшей скоростью, чем реакция с высокой скоростью.Некоторые реакции занимают сотни, может быть, даже тысячи лет, в то время как другие могут происходить менее чем за одну секунду. Если вы хотите думать об очень медленной реакции, подумайте о том, сколько времени требуется растениям и древним рыбам, чтобы превратиться в окаменелости (карбонизация). Скорость реакции также зависит от типа соединяющихся молекул. При низких концентрациях необходимого элемента или соединения реакция будет медленнее.
Есть еще одна важная идея для скоростей реакции под названием теория столкновений .Теория столкновений гласит, что чем больше столкновений в системе, тем больше будет на комбинаций молекул, отскакивающих друг от друга. Если у вас больше возможных комбинаций, вероятность того, что молекулы завершат реакцию, выше. Реакция будет происходить быстрее, а это значит, что скорость этой реакции увеличится.
Подумайте, как медленно движутся молекулы в меде по сравнению с вашей газировкой, даже если они оба являются жидкими. В меде меньше столкновений из-за более сильных межмолекулярных сил (сил между молекулами).Большие силы означают, что мед имеет более высокую вязкость, чем газированная вода.
Реакции случаются — несмотря ни на что. Химические вещества всегда соединяются или распадаются. Реакции происходят снова и снова, но не всегда с одинаковой скоростью. Несколько вещей влияют на общую скорость реакции и количество возможных столкновений.
Температура: Когда вы повышаете температуру системы, молекулы отскакивают намного сильнее. У них больше энергии .Чем больше они подпрыгивают, тем выше вероятность столкновения. Этот факт означает, что они с большей вероятностью объединятся. Когда вы понижаете температуру, молекулы становятся медленнее и меньше сталкиваются. Это падение температуры снижает скорость реакции. В химическую лабораторию! Иногда вы будете смешивать растворы со льдом, чтобы температура системы оставалась низкой, а скорость реакции замедлялась.
Концентрация: Если в системе больше вещества, существует большая вероятность столкновения молекул и увеличения скорости реакции.Если чего-то будет меньше, будет меньше столкновений и реакция, вероятно, будет происходить с меньшей скоростью. Иногда, когда вы находитесь в химической лаборатории, вы добавляете один раствор к другому. Если вы хотите, чтобы скорость реакции была ниже, вы будете добавлять только несколько капель за раз вместо всего стакана.
Давление: Давление: Давление влияет на скорость реакции, особенно когда вы смотрите на газы. Когда вы увеличиваете давление, у молекул становится меньше пространства, в котором они могут двигаться.Эта большая плотность молекул увеличивает количество столкновений. Когда вы уменьшаете давление, молекулы не ударяются друг о друга так часто, и скорость реакции снижается.
Давление также связано с концентрацией и объемом. Уменьшая объем, доступный молекулам газа, вы увеличиваете концентрацию молекул в определенном пространстве. Вы также должны помнить, что изменение давления в системе хорошо работает только для газов. Как правило, повышение давления не влияет на скорость реакции твердых веществ и жидкостей.
Как работает NIF (Лаборатория Лоуренса Ливермора)
Факторы, влияющие на скорость реакции
Цель обучения
- Объясните, как концентрация, площадь поверхности, давление, температура и добавление катализаторов влияют на скорость реакции
Ключевые моменты
- При повышении концентрации реагентов реакция протекает быстрее.Это связано с увеличением количества молекул, обладающих минимально необходимой энергией. Для газов повышение давления имеет тот же эффект, что и повышение концентрации.
- Когда твердые вещества и жидкости вступают в реакцию, увеличение площади поверхности твердого вещества увеличивает скорость реакции. Уменьшение размера частиц вызывает увеличение общей площади поверхности твердого тела.
- Повышение температуры реакции на 10 ° C может удвоить или утроить скорость реакции. Это связано с увеличением количества частиц, обладающих минимально необходимой энергией.Скорость реакции снижается с понижением температуры.
- Катализаторы могут снизить энергию активации и увеличить скорость реакции, не расходясь при этом.
- Различия в собственных структурах реагентов могут привести к различиям в скоростях реакции. Молекулы, соединенные более прочными связями, будут иметь более низкие скорости реакции, чем молекулы, соединенные более слабыми связями, из-за повышенного количества энергии, необходимого для разрыва более сильных связей.
Условия
- катализатор Вещество, которое увеличивает скорость химической реакции, но не расходуется в процессе.
- энергия активации Минимальное количество энергии, которое должны иметь молекулы, чтобы реакция произошла при столкновении.
Концентрации реагентов
Повышение концентрации реагентов ускоряет реакцию. Чтобы химическая реакция произошла, должно быть определенное количество молекул с энергией, равной или большей, чем энергия активации. С увеличением концентрации количество молекул с минимально необходимой энергией будет увеличиваться, а значит, и скорость реакции увеличится.Например, если одна из миллиона частиц имеет достаточную энергию активации, то из 100 миллионов частиц только 100 будут реагировать. Однако, если у вас есть 200 миллионов таких частиц в одном объеме, то 200 из них вступают в реакцию. При удвоении концентрации удваивается и скорость реакции.
Interactive: концентрация и скорость реакции В этой модели два атома могут образовывать связь, образуя молекулу. Поэкспериментируйте с изменением концентрации атомов, чтобы увидеть, как это влияет на скорость реакции (скорость, с которой происходит реакция).
Площадь
В реакции между твердым телом и жидкостью площадь поверхности твердого вещества в конечном итоге влияет на скорость протекания реакции. Это связано с тем, что жидкость и твердое тело могут сталкиваться друг с другом только на границе раздела жидкость-твердое тело, которая находится на поверхности твердого тела. Молекулы твердого тела, заключенные в теле твердого тела, не могут вступить в реакцию. Следовательно, увеличение площади поверхности твердого вещества приведет к контакту с жидкостью большего количества твердых молекул, что позволяет ускорить реакцию.2 [/ латекс].
Это показывает, что общая открытая площадь поверхности увеличится, когда более крупное тело разделено на более мелкие части. Следовательно, поскольку реакция происходит на поверхности вещества, увеличение площади поверхности должно увеличивать количество вещества, которое может вступить в реакцию, и, таким образом, также увеличивает скорость реакции.
Сравнение площадей более мелких молекул и более крупных На этом рисунке показано, как разборка кирпича на более мелкие кубики приводит к увеличению общей площади поверхности.
Давление
Повышение давления для реакции с участием газов увеличивает скорость реакции. По мере увеличения давления газа вы уменьшаете его объем (PV = nRT; P и V обратно пропорциональны), в то время как количество частиц ( n ) остается неизменным. Следовательно, увеличение давления увеличивает концентрацию газа ( n / V ) и обеспечивает более частое столкновение молекул газа. Имейте в виду, что эта логика работает только для газов, которые сильно сжимаются; изменение давления для реакции, в которой участвуют только твердые вещества или жидкости, не влияет на скорость реакции.
Температура
Экспериментально обнаружено, что повышение температуры на 10 ° C обычно удваивает или утраивает скорость реакции между молекулами. Минимальная энергия, необходимая для протекания реакции, известная как энергия активации, остается неизменной при повышении температуры. Однако среднее увеличение кинетической энергии частиц, вызванное поглощенным теплом, означает, что большая часть молекул реагента теперь имеет минимальную энергию, необходимую для столкновения и реакции.Повышение температуры вызывает повышение уровней энергии молекул, участвующих в реакции, поэтому скорость реакции увеличивается. Точно так же скорость реакции будет снижаться с понижением температуры.
Interactive: температура и скорость реакции Изучите роль температуры в скорости реакции. Примечание: в этой модели любое тепло, выделяемое самой реакцией, удаляется, поддерживая постоянную температуру, чтобы изолировать влияние температуры окружающей среды на скорость реакции.
Наличие или отсутствие катализатора
Катализаторы — это вещества, которые увеличивают скорость реакции за счет снижения энергии активации, необходимой для протекания реакции. Катализатор не разрушается и не изменяется во время реакции, поэтому его можно использовать снова. Например, в обычных условиях H 2 и O 2 не сочетаются. Однако они объединяются в присутствии небольшого количества платины, которая действует как катализатор, и реакция затем происходит быстро.
Природа реагентов
Вещества заметно различаются по скорости химического изменения.Различия в реакционной способности между реакциями можно отнести к разной структуре используемых материалов; например, имеет значение, находятся ли вещества в растворе или в твердом состоянии. Другой фактор связан с относительной прочностью связи в молекулах реагентов. Например, реакция между молекулами с атомами, которые связаны прочными ковалентными связями, будет происходить медленнее, чем реакция между молекулами с атомами, которые связаны слабыми ковалентными связями.Это связано с тем, что для разрыва прочно связанных молекул требуется больше энергии.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
3b.Какой эффект Док Брауна Док Брауна Ставки СКОРОСТЬ РЕАКЦИИ и ДАВЛЕНИЕ ГАЗА 3.Факторы, влияющие на скорость химических реакций 3б Эффект давления (важный Для каждого фактора, который я представил
Реагенты и растворы твердые («лаборатории»), включающие «скорости реакции», т.е. экспериментальные методы для наблюдения за скоростью реакции приведены в введение.
Применение моделей частиц Первая диаграмма дает представление о том, как думать о вероятности плодотворного Снимки газообразных частиц == Это иллюстрирует Чем больше Молекулы продукта Это иллюстрирует реакцию газа Опять продукт По мере увеличения Ставки
Ключевые слова и фразы. Может ли изменение давления повлиять на Химия GCSE Пересмотр химии IGCSE НАЧАЛО СТРАНИЦЫ
Нормы реакции отмечает НАЧАЛО СТРАНИЦЫ |
2.5: Скорость реакции — Химия LibreTexts
В ходе реакции, показанной ниже, реагенты A и B расходуются, в то время как концентрация продукта AB увеличивается. Скорость реакции можно определить, измерив, насколько быстро уменьшается концентрация A или B или насколько быстро увеличивается концентрация AB.
\ [\ A + B \ longrightarrow AB \]
Рисунок \ (\ PageIndex {1} \): На рисунке выше показан гипотетический профиль реакции, в котором концентрация реагентов (красный) уменьшается по мере увеличения концентрации продуктов (синий).
Для стехиометрически сложной Реакция:
\ [aA + bB \ longrightarrow cC + dD \ label {1} \]
\ [\ text {Rate} = \ dfrac {-1} {a} \ dfrac {d [A]} {dt} = \ dfrac {-1} {b} \ dfrac {d [B]} {dt} = \ dfrac {1} {c} \ dfrac {d [C]} {dt} = \ dfrac {1} {d} \ dfrac {d [D]} {dt} \]
Глядя на рисунок \ (\ PageIndex {1} \) выше, мы видим, что скорость может быть измерена в единицах реагента (A или B) или любого продукта (C или D). Не все переменные необходимы для определения скорости. Следовательно, если у вас есть значение для «A», а также значение для «a», вы можете вычислить скорость реакции.
Вы также можете заметить из уравнения \ ref {1}, что изменение реагентов с течением времени должно иметь отрицательный знак перед ними. Причина этого в том, что количество реагентов уменьшается со временем, скорость будет отрицательной (потому что это обратная скорость). Следовательно, поставив отрицательный знак перед переменной, решение будет положительным.
Химические реакции сильно различаются по скорости.Некоторые из них сверхбыстрые, в то время как другим могут потребоваться миллионы лет, чтобы достичь равновесия.
Определение скорости реакции
Скорость реакции для данной химической реакции является мерой изменения концентрации реагентов или изменения концентрации продуктов в единицу времени. Скорость химической реакции можно определить как изменение концентрации вещества, деленное на интервал времени, в течение которого наблюдается это изменение:
\ [\ text {rate} = \ dfrac {\ Delta \ text {концентрация}} {\ Delta \ text {time}} \ label {2-1} \]
Для реакции формы \ (A + B \ rightarrow C \) скорость может быть выражена через изменение концентрации любого из ее компонентов
\ [\ text {rate} = — \ dfrac {\ Delta [A]} {\ Delta t} \]
\ [\ text {rate} = — \ dfrac {\ Delta [B]} {\ Delta t} \]
\ [\ text {rate} = \ dfrac {\ Delta [C]} {\ Delta t} \]
, в котором \ (Δ [A] \) — разница между концентрацией \ (A \) на временном интервале \ (t_2 — t_1 \):
\ [\ Delta [A] = [A] _2 — [A] _1 \ label {2-2} \]
Обратите внимание на знаки минус в первых двух примерах выше.Концентрация реагента всегда уменьшается со временем, поэтому \ (\ Delta [A] \) и \ (\ Delta [A] \) оба отрицательны. Поскольку отрицательные скорости не имеют особого смысла, скорости, выраженные в терминах концентрации реагентов, равны , всегда с предшествующим знаком минус, чтобы скорость выходила положительной.
Рассмотрим теперь реакцию с другими коэффициентами:
\ [A + 3B \ rightarrow 2D \]
Понятно, что \ ([B] \) уменьшается в три раза быстрее, чем \ ([A] \), поэтому во избежание двусмысленности при выражении скорости через различные компоненты принято делить каждое изменение на концентрация по соответствующему коэффициенту:
\ [\ text {rate} = — \ dfrac {\ Delta [A]} {\ Delta t} = — \ dfrac {\ Delta [B]} {3 \ Delta t} = \ dfrac {\ Delta [D] » } {2 \ Delta t} \ label {2-3} \]
Пример \ (\ PageIndex {1} \): Окисление аммиака
Для окисления аммиака
\ [\ ce {4 Nh4 + 3O2 -> 2 N2 + 6 h3O} \]
было установлено, что скорость образования N 2 равна 0.27 моль л –1 с –1 .
- С какой скоростью образовывалась вода?
- С какой скоростью потреблялся аммиак?
Решение
a) Исходя из стехиометрии уравнения, Δ [H 2 O] = 6/2 Δ [N 2 ], поэтому скорость образования H 2 O составляет
3 × (0,27 моль л -1 с -1 ) = 0,81 моль л -1 с -1 .
б) 4 моля NH 3 расходуются на каждые 2 моля образовавшегося N 2 , поэтому скорость исчезновения аммиака составляет
2 × (0.27 моль л -1 с -1 ) = 0,54 моль л -1 с -1 .
Комментарий : Из-за того, как этот вопрос сформулирован, было бы приемлемо выразить это последнее значение как отрицательное число.
Мгновенные ставки
Большинство реакций замедляются по мере расходования реагентов. Следовательно, скорости, указанные в приведенных выше выражениях, имеют тенденцию терять свой смысл при измерении в течение более длительных интервалов времени Δ t .Примечание. Мгновенные ставки также известны как дифференциальные ставки.
Таким образом, для реакции, ход которой показан здесь, фактическая скорость (измеряемая по возрастающей концентрации продукта) непрерывно изменяется, достигая максимума в нулевой момент времени. Мгновенная скорость реакции задается наклоном касательной к кривой зависимости концентрации от времени.
Мгновенная скорость, взятая в начале реакции (t = 0), известна как начальная скорость (здесь метка (1) ).Как мы вскоре увидим, начальные скорости играют важную роль в изучении кинетики реакции. Если вы изучали дифференциальное исчисление, вы знаете, что эти касательные наклоны представляют собой производных , значения которых могут быть очень разными в каждой точке кривой, так что эти мгновенные скорости на самом деле являются предельными скоростями , определенными как
\ [\ text {rate} = \ lim _ {\ Delta t \ rightarrow 0} \ dfrac {- [A]} {\ Delta T} \]
Если вы не разбираетесь в расчетах, имейте в виду, что чем больше временной интервал Δ t , тем меньше будет точность мгновенной скорости.t \ label {2} \]
Как видно из уравнения \ ref {2} выше, скорость реакции зависит от концентрации реагентов, а также константы скорости. Однако есть и другие факторы, которые могут повлиять на скорость реакции. Эти факторы включают температуру и катализаторы. Когда вы можете написать уравнение закона скорости для определенной реакции, вы можете определить порядок реакции на основе значений s и t.
Порядок реакции
Скорость реакции для данной реакции — важный инструмент, который позволяет нам вычислить конкретный порядок реакции.t \ label {4} \]
\ [\ text {Порядок реакции} = s + t \ label {5} \]
Важно отметить, что хотя порядок реакции может быть определен из закона скорости, в общем случае нет связи между порядком реакции и стехиометрическими коэффициентами в химическом уравнении.
ПРИМЕЧАНИЕ: Скорость реакции должна быть неотрицательной величиной. Это может быть ноль и необязательно целое число.
Как показано в уравнении \ ref {5}, полный порядок реакции равен сумме «s» и «t».«Но что означает каждая из этих переменных? Каждая переменная представляет собой порядок реакции по отношению к реагенту, на который она помещена. В этой определенной ситуации s — это порядок реакции по отношению к [A], а t — это порядок реакции относительно [B].
Вот пример того, как вы можете посмотреть на этот : если порядок реакции относительно [A] был 2 (s = 2), а [B] был 1 (t = 1), то это в основном означает, что концентрация реагента A уменьшается в 2 раза, а концентрация [B] уменьшается в 1 раз.
Итак, если у вас порядок реакции Нулевой (т.е. \ (s + t = 0 \)), это в основном означает, что концентрация реагентов не влияет на скорость реакции. Вы можете удалить или добавить реагенты в смесь, но скорость не изменится.
Список различных уравнений скорости реакции для реакций нулевого, первого и второго порядка можно увидеть в Таблице \ (\ PageIndex {1} \). {- 1}} \)
\ ([A] \) от времени
\ (\ ln [A] \) в зависимости от времени
\ (\ dfrac {1} {[A]} \) в зависимости от времени
\ (\ {slope} = \ {-k} \)
\ (\ {slope} = \ {-k} \)
\ (\ {slope} = \ {k} \)
\ (\ dfrac {[A] _0} {2k} \)
\ (\ dfrac {\ ln2} {k} \)
\ (\ dfrac {1} {k [A] _0} \)
Примеры задач
1.Определить скорость реакции
2. ВЕРНО или ЛОЖНО: изменение температуры или введение катализатора повлияет на константу скорости реакции.
Для примеров задач 3–6 используйте формулу , чтобы ответить на вопросы
\ [H_2O \ longrightarrow 2H_2 + O_2 \ label {6} \]
* Предположим, реакция протекает при постоянной температуре
3. Для данной реакции укажите закон скорости.
4. Укажите общий порядок реакции.
5. Найдите скорость при k = 1,14 x 10 -2 и [H 2 O] = 2,04M
6. Найдите период полураспада реакции.
ответов
1. Скорость реакции является мерой изменения концентрации исчезновения реагентов или изменения концентрации появления продуктов в единицу времени.
2. НЕВЕРНО. Константа скорости не зависит от присутствия катализатора. Однако катализаторы могут влиять на общую скорость реакции.
3. \ (\ {Rate} = \ {k [H_2O]} \)
4. Первый — Заказ
5. 2,33 x 10 -2 с -1
6. 60,8 с ((t1 / 2 = ln 2 / k = ln 2 / 1,14 x 10 -2 = 60,8 с).
Список литературы
- Чанг, Раймонд. (2005). Физическая химия для биологических наук . Саусалито, Калифорния: Университетские научные книги.
- Кроу, Джонатан, Брэдшоу, Тони, МонкПол. (2006) Химия для биологических наук: основные концепции .Oxford Press.
- Айзекс, Н.С. (1995). Physical Organic Chemistry (второе издание). Харлоу Великобритания: Эдисон Уэсли Лонгман.
- Кеннет Коннорс. (1990). Химическая кинетика . Издатели ВЧ.
- Левин, Ира Н. (1988). Physical Chemistry (Третье издание). McGraw-Hill Inc.,
- Сегель, Ирвин. (1993). Кинетика ферментов . Библиотека Wiley Classics.
- Zumdahl, Steven S. и Zumdahl, Susan A. (2003) Chemistry (шестое издание).Houghton Mifflin Co.,
- Шагури, Ричард. Chemistry 1A Lecture Book. 4-е изд. Публикация на заказ. 2006. Печать
.
Авторы и авторство
Факторы изменения — Контроль скорости — Высшая версия химии
Скорость столкновения молекул реагентов можно контролировать, изменяя любой из четырех факторов:
- температура
- концентрация
- давление
- размер частиц
- использование катализатора
Только некоторые из происходящих столкновений вызывают химические изменения.Это называется «успешными» коллизиями. Чем больше количество «успешных» столкновений, тем выше скорость реакции.
Температура
Если температура повышается, частицы получают больше энергии и поэтому перемещаются быстрее. Повышение температуры увеличивает скорость реакции, поскольку частицы чаще сталкиваются.
Концентрация
Если концентрация реагентов увеличивается, вместе движется больше частиц реагентов. Будет больше столкновений, поэтому скорость реакции увеличится.Чем выше концентрация реагентов, тем быстрее будет скорость реакции.
Размер частиц
Уменьшая размер частиц реагента, мы увеличиваем его площадь поверхности. Меньший размер частиц реагентов обеспечивает большую площадь поверхности, на которой могут происходить столкновения. Чем больше площадь поверхности, тем выше скорость реакции.
Давление
Если давление газообразных реагентов увеличивается, в заданном объеме появляется больше частиц реагента.Будет больше столкновений, поэтому скорость реакции увеличится. Чем выше давление реагентов, тем быстрее будет скорость реакции.
Использование катализатора
Катализатор может обеспечить поверхность для протекания реакций.
Молекулы реагента удерживаются под подходящим углом для возникновения столкновений, что увеличивает вероятность успешных столкновений.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.

