Содержание
Химические явления внутри и вокруг нас
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.

Мы дальше рассмотрим примеры различных химических явлений, так что этот момент станет понятнее.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).
Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Итак, первым делом поговорим про фотосинтез. Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО2 + 12Н2О + свет = С6Н12О6 + 6О2 + 6Н2О.
Дыхание, наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С6Н12О6 + 6О2 = СО2 + 6Н2О + 2,87 * 106 Дж.
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение.
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.
Уверена, вы замечали, как летом легко дышится после грозы. И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О2 + УФ свет → 2О3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О3.
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания.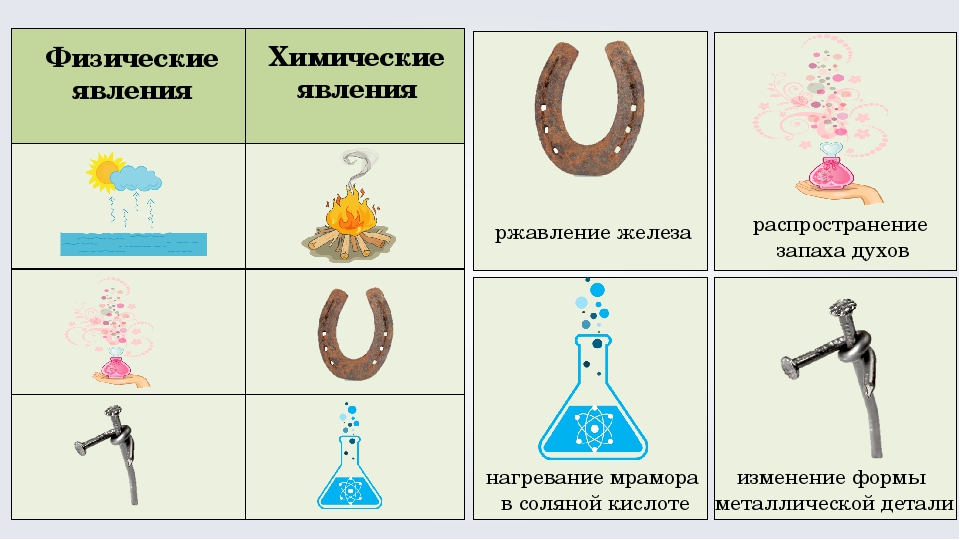 А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 и MgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2.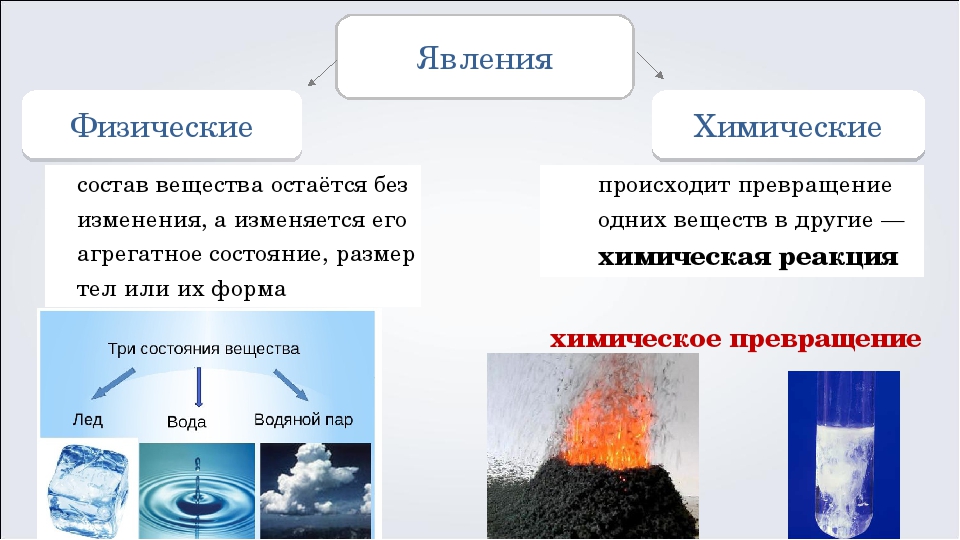 Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Интересные химические явления
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление, при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва.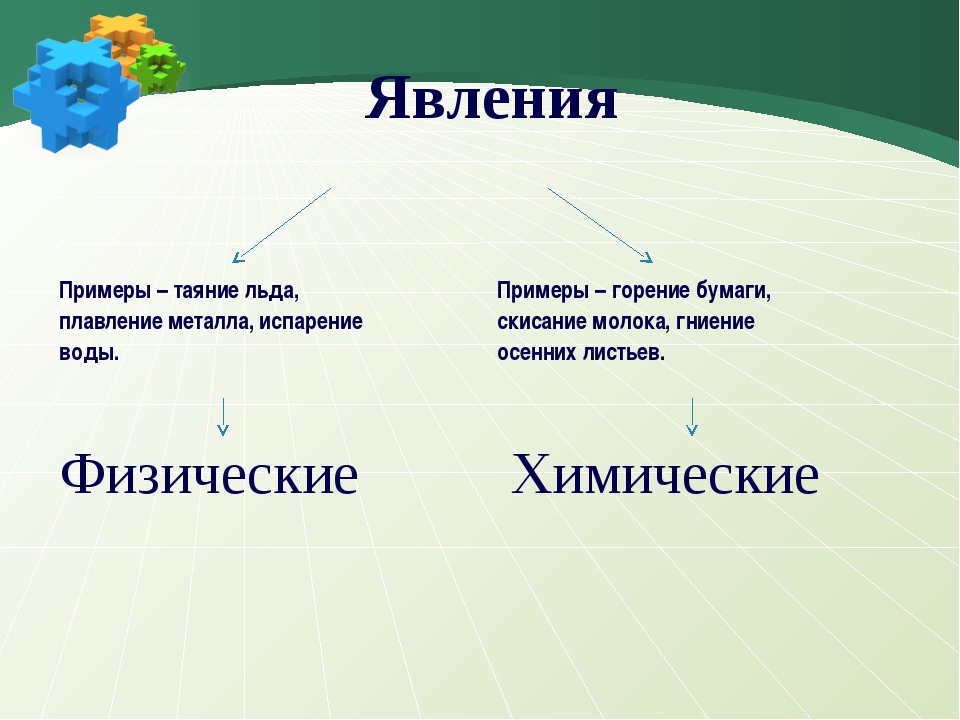 Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО3. Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты. А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты.
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
Будет здорово, если в комментариях вы расскажете нам, какие еще химические явления вы могли сами наблюдать в природе или у себя дома. И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
04. Химические и физические явления
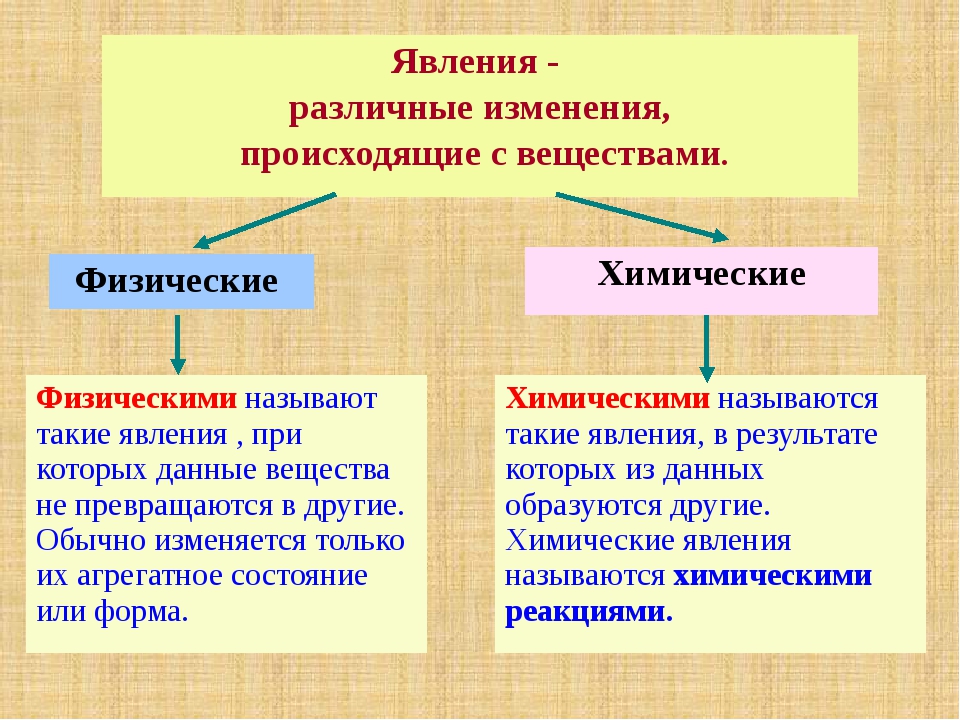
Изменения веществ, которые не ведут к образованию новых веществ (с иными свойствами), называют физическими явлениями.
1. Вода при нагревании может переходить в пар, а при охлаждении – в лед.
2. Длина медных проводов изменяется летом и зимой: увеличивается при нагревании и уменьшается при охлаждении.
3. Объем воздуха в шаре увеличивается в теплом помещении.
Изменения с веществами произошли, но при этом вода осталась водой, медь – медью, воздух – воздухом.
Новых веществ, несмотря на их изменения по форме или агрегатному состоянию, не образовалось.
Опыт
1. Закроем пробирку пробкой со вставленной в нее трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объем воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3. При охлаждении пробирки объем воздуха уменьшается, и вода входит в пробирку.
Вывод. Изменения объема воздуха – физическое явление.
Задания
Приведи 1–2 примера происходящих с веществами изменений, которые можно назвать физическим явлением. Запиши примеры в тетради.
Химическое явление (реакция) – явление, при котором образуются новые вещества.
А по каким признакам можно определить, что произошла химическая реакция? При некоторых химических реакциях происходит выпадение осадка. Другие признаки – изменение цвета исходного вещества, изменение его вкуса, выделение газа, выделение или поглощение тепла и света.
Примеры таких реакций рассмотри в таблице
Признаки химических реакций | ||||
Изменение цвета исходного вещества | Изменение вкуса исходного вещества | Выпадение осадка | Выделение газа | Появление запаха |
Реакция | Признак |
Изменение цвета | |
Изменение вкуса | |
Выделение газа |
В живой и неживой природе постоянно протекают различные химические реакции.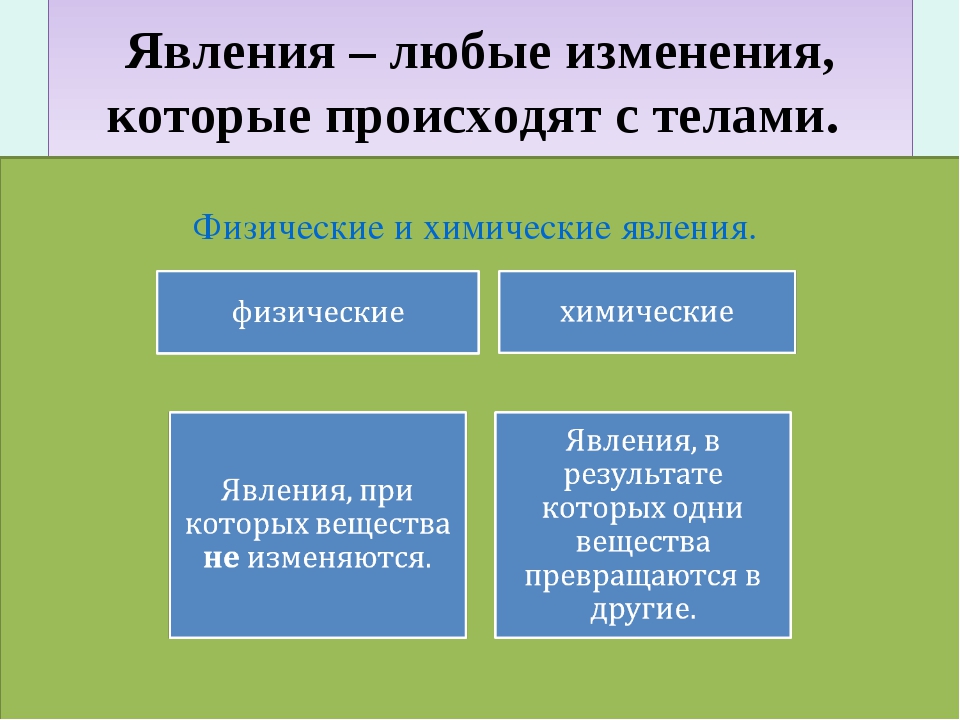 Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Понаблюдаем за некоторыми химическими реакциями.
Опыты с огнем самостоятельно проводить нельзя!!!
Опыт 1
Подержим над огнем кусочек белого хлеба, содержащего органические вещества.
Наблюдаем:
1. обугливание, то есть изменение цвета;
2. появление запаха.
Вывод. Произошло химическое явление (образовалось новое вещество — уголь)
Опыт 2
Приготовим стаканчик с крахмалом. Добавим немного воды, перемешаем. Затем капнем раствором йода.
Наблюдаем признак реакции: изменение цвета (посинение крахмала)
Вывод. Произошла химическая реакция. Крахмал превратился в другое вещество.
Опыт 3
1. Разведем в стакане небольшое количество питьевой соды.
2. Добавим туда несколько капель уксуса (можно взять сок лимона или раствор лимонной кислоты).
Наблюдаем выделение пузырьков газа.
|
Вывод. Выделение газа – один из признаков химической реакции.
Некоторые химические реакции сопровождаются выделением тепла.
Задания
Поместите в стеклянную баночку (или стакан) несколько кусочков сырого картофеля. Добавьте к ним перекись водорода из домашней аптечки. Объясните, по какому признаку можно определить, что произошла химическая реакция.
Урок биологии в 5-м классе по теме «Физические и химические явления»
Задачи:
- Ознакомить учащихся с физическими и химическими явлениями;
- Развивать умение отличать физические явления от химических;
- Воспитать внимательность, наблюдательность, аккуратность.
Оборудование:
- рис.
 31 стр. 51;
31 стр. 51; - спиртовка,
- пробирки,
- зажим,
- стакан с водой,
- лед,
- сера,
- железо.
Тип урока: комбинированный
Метод преподавания: эвристическая беседа
Общие методы: беседа, демонстрация, объяснение
Ход урока
1. Организационный момент
2. Актуализация знаний
— Что такое вещество?
— Какие бывают вещества?
— Приведите примеры простых и сложных веществ.
3. Проверка знаний
1 вариант (выберите правильное утверждение)
- Тела живой природы образованы неорганическими веществами.
- Вещество, состоящее из атомов одного элемента, называют простым.
- Вещество, состоящее из атомов разных элементов,
называют органическими.

- Тела неживой природы образованы неорганическими веществами.
- Белки, жиры, углеводы – это органические вещества.
- Вода – это простое вещество.
- Кислород, азот, водород – это неорганические вещества.
- Озон – это простое вещество.
- Изменение формы, размеров и объема тела называют диффузией.
- Молекулы постоянно находятся в движении.
2 вариант (тест)
1. Вещество – это:
а) капля росы
б) мяч
в) вода
2. Твердые тела способны:
а) сохранять форму
б) сохранять объем
в) сохранять и форму, и объем
3. Жидкости способны:
а) сохранять форму и объем
б) сохранять объем
в) сохранять форму
4. Изменения формы, размеров и объема тела называют:
а) упругостью
б) деформацией
в) пластичностью
5. Свойство тела изменять форму и объем под
действием других тел восстанавливать их после
прекращения действия, называют:
Свойство тела изменять форму и объем под
действием других тел восстанавливать их после
прекращения действия, называют:
а) деформацией
б) упругостью
в) пластичностью
6. Вещество, состоящее из атомов одного элемента, называют:
а) сложным
б) простым
в) органическим
7. Тела неживой природы образованы веществами:
а) простыми
б) неорганическими
в) сложными
8. Вещество, состоящее из атомов разных элементов, называют:
а) органическим
б) неорганическим
в) сложным
4. Изучение нового материала.
На каждой парте лист бумаги с перечислениями явлений природы:
таяние льда, набухание почек на деревьях,
сверкании молнии, гроза, распускание почек,
горение свечи.
Посмотрите, пожалуйста, на листы перед вами, прочтите.
Что за процессы там у вас перечислены?
Верно, все это явления природы. Они отличаются друг от друга? Чем отличаются? (происхождением)
Явления:
- биологические
- физические
- химические
С биологическими явлениями мы познакомимся более подробно позже.
Сегодня рассмотрим физические и химические явления.
Опыт: кусочек льда нагревается. Что происходит со льдом?
Продолжаем нагревание. Что происходит? Если долго нагревать что произойдет?
Вывод: в процессе нагревания твердое вещество превращается в жидкое, жидкое – в пар.
Вода осталась тем же веществом , но изменяется ее состояние.
Если поместить над кастрюлей с кипящей водой
холодный предмет, то вскоре на его поверхности
можно заметить маленькие капельки воды. Т. е. вода
из газообразного состояния при охлаждении вновь
переходит в жидкое. К какому виду явления
относится этот процесс?
К какому виду явления
относится этот процесс?
Физическое явление – это изменение состояния или формы вещества.
Какой пример физического явления можете привести вы?
(изменение осадков по сезонам года, изменение формы алюминиевой проволоки под ударом молотка и т. д.)
ФИЗМИНУТКА
Опыт: смесь порошка серы и железа нагревается в пробирке.
При нагревании меняется окраска, становится черной. Это новое вещество или тоже самое?
Опустим этот кусочек в воду, поднесем к магниту. Что происходит?
Значит при нагревании железа и серы, образовалось новое вещество. (сульфид железа, которое обладает другими свойствами , чем сера и железа в отдельности.
Это химическое явление. Химическое явление – это превращение веществ, в результате которого образуется одно или несколько новых веществ.
Химические явления происходят в условиях
нагревания веществ, при действии на них
электрическим током, сильным давлением и др. .
.
Какие примеры химических явлений можете привести вы?
(получение металлов из руд, дубление кожи и т. д.)
Где происходят химические явления? В окружающей природе.
Так же химические реакции протекают в живых организмах. Благодаря им организмы живут, питаются, движутся, растут.
5. Закрепление
- какие явления происходят в природе?
- чем физические явления отличаются от химических?
- приведите примеры физических явлений.
- приведите примеры химических явлений.
- № 34, 35 в рабочей тетради.
6. Домашнее задание
Параграф 13 читать, ответить на вопросы 1-4 стр. 53
Вещества и явления в окружающем мире
Изучая строение Земли, вы тоже знакомились с телами — это куски горных пород и минералов. Растения, животные, человек — тоже тела.
А изделия состоят из веществ. Железо, стекло, соль, вода, полиэтилен — это вещества. В настоящее время известно более 7 млн разных веществ, и каждый год люди синтезируют новые, ранее неизвестные.
Железо, стекло, соль, вода, полиэтилен — это вещества. В настоящее время известно более 7 млн разных веществ, и каждый год люди синтезируют новые, ранее неизвестные.
В природе вещества находятся в трёх состояниях: твёрдом, жидком и газообразном. Например, вода может находиться в твёрдом, в жидком и газообразном состояниях.
В различных состояниях вещества обладают разными свойствами. Большинство окружающих нас тел состоят из твёрдых веществ. Это дома, машины, инструменты и др.
Форму твёрдого тела можно изменить, но для этого необходимо приложить усилие. Например, чтобы согнуть гвоздь, нужно приложить довольно большое усилие. Твёрдые тела имеют собственную форму и объём.
В отличие от твёрдых тел жидкости легко меняют свою форму. Например, они принимают форму сосуда, в котором находятся. Молоко, наполняющее бутылку, имеет форму бутылки. Налитое же в стакан, оно принимает форму стакана. Но, изменяя форму, жидкость сохраняет свой объём.
В обычных условиях только маленькие капельки жидкости имеют свою форму — форму шара. Это, например, капли дождя или капли, на которые разбивается струя жидкости.
Воздух, которым мы дышим, является газообразным веществом, или газом. Поскольку большинство газов бесцветны и прозрачны, то они не видны. Присутствие воздуха можно почувствовать, например, стоя у движущегося поезда, открытого окна. Его наличие в окружающем пространстве можно ощутить, если в комнате сквозняк, а также доказать с помощью простых опытов. Например, если стакан перевернуть вверх дном и попытаться опустить его в воду, то вода в стакан не войдёт, поскольку он заполнен воздухом.
Эти и многие другие примеры и опыты подтверждают, что в окружающем пространстве имеется воздух.
Газы легко изменяют свой объём. Например, когда мы сжимаем мячик, то тем самым меняем объём воздуха, наполняющего мяч. Газ, помещённый в закрытый сосуд, занимает весь его целиком. Нельзя газом заполнить половину бутылки так, как это можно сделать жидкостью. Газы не имеют собственной формы и постоянного объёма. Они принимают форму сосуда и полностью заполняют предоставленный им объём.
Все вещества разделяют на простые и сложные. Для того чтобы ответить на вопрос, чем они отличаются, нужно знать особенности строения вещества.
В настоящее время известно, что все вещества состоят из мельчайших частиц: молекул и атомов. Они так малы, что увидеть их невооружённым глазом невозможно. Молекулы — это частицы, состоящие из атомов.
Атомы одного вида называют элементами. В одной молекуле может быть два, три и даже сотни и тысячи атомов. Изучая строение атомов, учёные установили, что они отличаются друг от друга, то есть в природе существуют разные виды атомов: один вид — атомы кислорода, другой — атомы углерода и так далее. Современной науке известно 111 видов атомов (элементов). Соединяясь между собой в различных комбинациях, они образуют то многообразие веществ, которое существует в природе.
Таким образом, если в состав веществ входят атомы одного вида, то такие вещества называют простыми. Это хорошо известные вам металлы (например, железо, медь, золото, серебро) и неметаллы (например, сера, фосфор, кремний, мышьяк и многие другие).
Все вещества являются либо чистыми, либо смесями. Чистые вещества состоят из частиц одного вида, а смеси — из частиц разных видов. Медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Значит, медь и цинк — это чистые вещества.
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей. Например, вода считается практически чистой, если образец жидкости не имеет цвета, вкуса и запаха, замерзает при температуре 0 °C, кипит при температуре +100 °С, имеет плотность 1000 кг/м³ при температуре +4 °С и практически не проводит электрический ток.
В большинстве случаев вещества встречаются в виде смесей. Иногда это хорошо заметно даже невооружённым глазом. Например, глядя на кусочек гранита, можно увидеть, что он состоит из смеси веществ: кварца, слюды и полевого шпата, а вот в однородном на вид молоке только под микроскопом можно различить капельки жира и белки, плавающие в жидкости (воде).
В смеси каждое вещество сохраняет свои свойства. Зная эти свойства, смеси можно разделять на составные части.
Многообразие явлений природы
Окружающий нас мир постоянно изменяется в результате различных явлений. Например, с повышением температуры происходит испарение воды. Испарение — это явление. Благодаря наличию кислорода в воздухе происходит горение. Горение ― тоже явление.
Гремит гром, сверкает молния. Гром — это звуковое явление в атмосфере, которое сопровождается разрядами молний.
Интересно, что можно определить расстояние, на котором находится гроза от нас. Для этого необходимо взять скорость звука и умножить её на время между раскатами грома и вспышкой молнии (как правило, речь идёт о нескольких секундах, например, 5 секунд). В результате мы получим определённую цифру, которая и будет означать удалённость грозы (в метрах). Конечно же, цифра эта будет примерной, поскольку скорость звука может сильно изменяться, например, при повышении или понижении температуры. Кстати, в большинстве случаев человек может слышать гром на расстоянии до 20 км.
Что общего между всеми явлениями и чем они отличаются? При нагревании форма тела (кусочка льда) изменилась, однако состав вещества (воды) остался прежним.
При прокаливании медной пластинки образовалось новое вещество — оксид меди. Проведённые опыты показывают, что в одних случаях происходит образование новых веществ, в других — нет.
Химические и физические явления
На основании этого признака различают физические и химические явления. К физическим явлениям относятся распространение запаха в воздухе, свечение раскалённых металлов, прохождение электрического тока по металлической проволоке, растворение сахара в воде, выделение соли из раствора при выпаривании. В этих процессах вещества не изменяют состав и строение.
Физические явления бывают: тепловыми, механическими, световыми, звуковыми, оптическими, электрическими и другими.
Тепловые явления связаны с изменением температуры тел и возникающими в следствие этого изменениями их физического состояния. Так, тела способны нагреваться и охлаждаться.
Некоторые при этом плавятся (как воск свечи при её горении), другие испаряются (вода при нагревании), третьи переходят из жидкого в твёрдое состояние (например, вода превращается в лёд).
При нагревании длина и объём тел увеличиваются, а при охлаждении — уменьшаются. Это явление необходимо учитывать в строительстве и промышленном производстве. Например, при прокладке железнодорожных путей на стыках рельсов оставляют небольшие промежутки, поэтому при нагревании и удлинении рельса путь не разрушается.
К механическим физическим явлениям относятся различные движения и взаимодействия тел, например: автомобили могут набирать скорость (ускоряться), человек может идти, мяч ― сталкиваться с поверхностью Земли и отскакивать, планеты двигаться по орбитам вокруг звёзд.
Световые явления связаны с особенностями светового луча. Например, прямолинейность его распространения объясняет образование теней. Способность света отражаться от тел, на которые он падает, даёт нам возможность видеть их.
Удивительно красивы световые явления в природе (например, радуга). Она образуется в результате разложения света в каплях дождя. Когда луч света «натыкается» на прозрачную преграду — каплю воды или стекло — он распадается на различные цвета.
К звуковым относят явления, связанные с распространением звука в различных средах, поведением звуковых волн при столкновении с препятствиями, и другие явления, связанные со звуком.
Где быстрее распространяется звук ― в воде или воздухе? Любопытно, что скорость распространения звука в воде почти в четыре раза выше, чем в воздухе. То есть рыбы «слышат» быстрее, чем мы.
Что такое эхо? Звуковое эхо — это отражённый звук. Эхо обусловлено тем, что звуковые волны могут отражаться твёрдыми поверхностями. Животные используют эхолокацию для ориентации в пространстве и для определения местоположения объектов вокруг (в основном при помощи высокочастотных звуковых сигналов).
Химические явления
К ним относится, например, образование в зелёных листьях растений крахмала и кислорода из углекислого газа и воды.
По-другому такие явления называют химическими превращениями или химическими реакциями. В результате таких реакций образуются новые вещества, которые отличаются от исходных по ряду признаков.
Некоторые химические реакции протекают очень медленно, и мы их не замечаем, они длятся миллиарды лет. Например, твёрдый камень горных пород — известняк ― под действием воды и углекислого газа разрушается и превращается в другие вещества. Вода вымывает их — так в горах образуются пустоты, пещеры.
Другие реакции происходят очень быстро (например, горение). Так, сгорает топливо в газовой горелке. При горении выделяется много тепла и света.
При гниении тоже выделяется тепло, но оно рассеивается в окружающем пространстве. Это тепло мы обычно не замечаем, но учитывать его должны. Например, неправильно сложенный стог сена, нарушенные условия хранения соломы приводят к развитию процесса гниения. Это может вызвать даже самовозгорание материала.
Вещества и их свойства. Физические и химические явления.
Содержание статьи
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Химия — 7
кону Авогадро, могут браться как объемные соотношения. Объемные соотношения вступающих в реакцию и полученных газов берутся как соотношения наименьших целых чисел (т.е. как соотношение молей газов).
Например:
Объемные соотношения, молярные соотношения и количественное соотношение молекул различных газов при одинаковых условиях всегда равны друг другу: V1:V2=v1:v2=N1:N2
Проверка знаний и способностей
1. Какие явления называют физическими явлениями? Приведите примеры. 2. Какие явления называют химическими явлениями? Приведите примеры. 3. Назовите признаки химических явлений. 4. Какие из нижеприведенных явлений относятся к химическим явлениям? а) кипение воды; б) брожение; в) плавление железа; г) горение спички. 5. Какие из нижеприведенных явлений являются физическими, а какие — химическими явлениями? а) прокисание молока; б) таяние льда; в) горение свечи; г) излучение света спиралью электрической лампы; д) ржавление железа; е) испарение воды; ж) толчение стекла; з) замерзание воды. 6. Перечислите признаки химических явлений в: а) горении природного газа; б) разложении белка в курином яйце. 7. Выберите физические и химические явления, происходящие во время нагревания сахара: а) сахар плавится; б) плавленный сахар кипит; в) плавленный сахар становится бурым, а затем чернеет; г) черный цвет исчезает, образуются углекислый газ и вода.
11. Закон сохранения массы веществ
в химических реакциях
Как уже известно, в химических реакциях атомы не делятся, а также не появляются новые из них. В процессе реакции атомы могут переходить из состава одного вещества в состав другого или же, образовавшись в результате распада молекул, в зависимости от условий, они могут вновь соединиться друг с другом, превратившись в другие вещества. Число атомов в веществах, вступающих в химическую реакцию, всегда остается равным числу атомов в веществах, полученных после реакции. Вследствие неизменности, постоянства массы атомов можно прийти к выводу, что сумма масс реагентов (вступающих в реакцию веществ) должна быть равна сумме масс продуктов реакции (полученных в результате реакции веществ).
К данному выводу, кажущемуся нам таким простым, ученые пришли путем проведения и всестороннего анализа множества химических опытов. Впервые мысль о существовании закона сохранения материи была высказана древнегреческим философом Эпикуром (до н.э.). В средние века французский ученый Пьер Гассенди, а впоследствии английский ученый Роберт
Урок 10. Признаки химических реакций – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 10 «Признаки химических реакций» из курса «Химия для чайников» рассмотрим, что из себя представляют физические и химические явления; выясним, что такое химическая реакция, а также признаки и условия протекания химических реакций.
Давайте внимательно посмотрим вокруг себя. Мы уже знаем, что весь окружающий нас мир состоит из различных веществ: органических и неорганических, простых и сложных, твердых, жидких и газообразных. Остаются ли эти вещества в природе неизменными? Нет, в природе происходят различные изменения, которые называются явлениями. В зависимости от того, какие изменения происходят с веществами, различают явления физические и химические. Эти два рода явлений можно отличить друг от друга.
Физические явления
Нальем воду в колбу и нагреем ее до кипения. Каждый из вас знает, что при кипении вода превращается в пар, т. е. переходит в другое агрегатное состояние. Однако несложно доказать, что вода и пар — это одно и то же вещество. Подумайте, как это можно сделать.
Нагреем тонкую стеклянную трубку в пламени спиртовки. Стекло станет мягким, и мы легко изменим форму трубки, но стекло как вещество остается тем же.
Эти явления физические. При физических явлениях не происходит образования новых веществ. Изменяется только агрегатное состояние веществ, их форма, а состав веществ остается прежним (рис. 48).
Например, вода — это вещество, которое в природе образует не только реки, моря, но и ледники, и облака. Ледники тают, облака роняют капли воды, вода испаряется, т. е. происходит изменение ее агрегатного состояния, но состав молекул остается неизменным.
Сгибание проволоки, дробление соли, плавление металлов (рис. 49), образование мраморной крошки, перемалывание зерна в муку, превращение воды в пар при кипячении — все это физические явления. Они осуществляются в результате деятельности человека. У веществ при этом изменяется только форма или агрегатное состояние.
Физическими называются явления, при которых изменяется только форма или агрегатное состояние веществ.
Химические явления (реакции)
Всегда ли вещества остаются неизменными? Нагреем красную медную проволоку в пламени спиртовки. Проволока покрывается черным налетом, который можно легко соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое превратилась медь. Оно отличается от меди по цвету и плотности. В этом опыте мы наблюдаем химическое явление, которое происходит благодаря химической реакции.
Химические реакции — это явления, при которых происходит превращение одних веществ в другие.
Природа — это огромная лаборатория, в которой непрерывно происходит образование новых веществ. Горные породы и минералы под воздействием солнца, воды, углекислого газа и других веществ постепенно разрушаются и превращаются в новые вещества. В зеленых растениях из углекислого газа и воды образуются глюкоза и крахмал.
Человек превращает взятые из природы вещества (природный газ, нефть, руды) в необходимые ему бензин, резину, пластмассы, волокна, металлы. Часто в результате множества превращений получаются новые вещества, которых нет в природе. При всех этих явлениях происходит разрушение исходных веществ и образование новых веществ.
Например, в результате сгорания магния образуется новое вещество MgO (рис. 50). При сгорании метана получаются два вещества: углекислый газ CO2 и вода H2O. Из одного сложного вещества HgO в результате его разложения образуются два новых — ртуть Hg и кислород O2 (рис. 51).
Ржавление железа (рис. 52), кипячение воды, горение лучины, распространение запаха — какие из этих явлений можно отнести к химическим реакциям? По каким признакам можно судить, что химическая реакция произошла?
Признаки химических реакций
Проведем несколько химических реакций. Нагреем в пробирке зеленый порошок малахита (рис. 53) — минерала, в состав которого входят атомы меди, углерода, водорода и кислорода. Порошок малахита начинает «кипеть» из-за выделяющегося газа. Поднесем к отверстию пробирки спичку, она гаснет — это выделяющийся углекислый газ препятствует ее горению. На стенках пробирки заметны капельки воды, на дне остается черный порошок соединения меди (CuO). Наблюдения доказывают, что образуются новые вещества с другими свойствами. Прекратим нагревание. Сразу прекращается выделение углекислого газа — реакция больше не протекает.
Существуют и другие признаки химических реакций. Например, при горении магния излучается яркий свет и выделяется много теплоты (см. рис. 50).
На заметку: Раньше вспышка магния использовалась для освещения объекта во время фотографирования.
При сливании некоторых растворов наблюдается выпадение осадка (рис. 54). Некоторые осадки можно растворить при помощи других веществ. Например, при сливании растворов соды и известковой воды образуется белый осадок, который легко растворяется в уксусе.
При сгорании спички ощущается резкий запах. Какие еще признаки химических реакций наблюдаются при горении спички?
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Признаки химических реакций:
• Выделение газа.
• Образование или исчезновение осадка.
• Изменение цвета.
• Появление запаха.
• Излучение света.
• Выделение или поглощение теплоты.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия протекания химических реакций
Необходимое и главное условие для протекания большинства реакций между различными веществами — это их соприкосновение. Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Мало знать, как начать химическую реакцию, надо еще знать, при каких условиях она будет протекать дальше. Почему необходимо все время нагревать сахар, чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и она продолжает гореть?
Если при образовании новых веществ выделяется много теплоты, то ее бывает достаточно, чтобы нагревались новые порции вещества и реакция продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии. Примером является горение угля. Другие реакции, например разложение сахара, требуют постоянной затраты энергии на ее продолжение.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Таким образом, окружающий нас мир состоит из множества веществ, которые вступают в различные химические реакции. Изучая химические реакции, человек познает сущность процессов, протекающих в живой и неживой природе. Полученные знания помогают более эффективно использовать вещества для получения больших урожаев, выращивания животных, борьбы с различными болезнями. Человечество учится бережно и грамотно относиться к окружающему нас миру.
Краткие выводы урока:
- Химические реакции — это явления превращения одних веществ в другие.
- О протекании химических реакций судят по выделению газа, выпадению или исчезновению осадка, изменению цвета, появлению запаха, поглощению или выделению теплоты и излучению света.
- Необходимым условием протекания большинства химических реакций является соприкосновение реагирующих веществ.
Надеюсь урок 10 «Признаки химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Примеры простых химических реакций
Вы можете подумать об огромных взрывах или дымящихся пробирках, когда услышите термин химическая реакция . Но на самом деле химические реакции могут быть незаметными, простыми и происходить повсюду вокруг вас! Продолжайте читать, чтобы найти примеры простых химических реакций, которые происходят каждый день.
Примеры простых химических реакций
Химическая реакция происходит, когда химическое вещество или химические вещества (реагенты) превращаются в другое вещество (продукт).Эти реакции происходят во время приготовления пищи, уборки, вождения и других процессов, происходящих внутри вашего тела. Существует четыре основных типа химических реакций: синтез , разложение , одиночная замена и двойная замена .
Примеры химических реакций синтеза
Синтез означает, что два элемента объединяются, чтобы создать что-то новое. В реакции синтеза, также известной как реакция прямого объединения , два химических вещества (A и B) образуют новое вещество (AB).Некоторые примеры простых реакций синтеза включают:
- водород + кислород —> вода
- железо + кислород —> ржавчина
- калий и газообразный хлор —> хлорид
- известь + диоксид углерода —> карбонат кальция (используется для укрепления кладки)
- вода + углекислый газ + свет —> глюкоза и кислород (фотосинтез)
- натрий + хлорид —> хлорид натрия (поваренная соль)
Часто бывают реакции горения включены в списки синтетических реакций.Возгорание происходит, когда химическое вещество соединяется с кислородом. Продукт обычно является огнем или другим типом тепла.
Примеры химических реакций разложения
Когда одно химическое вещество реагирует на стимул, распадаясь на два более простых элемента (AB на A и B), это реакция разложения . Химические реакции разложения противоположны реакциям синтеза. Вы найдете реакции разложения в следующих процессах:
- вода —> водород и вода (электролиз)
- углекислота —> углекислый газ и вода (когда безалкогольный напиток теряет пузырьки)
- еда — -> белки и углеводы (процесс пищеварения)
- хлорид серебра —> серебро и хлор
- хлорат металла —> хлорид металла и вода
- оксид ртути —> металлическая ртуть и кислород
- нитрат аммония — -> вода и оксид диазота (веселящий газ)
Существует три способа расщепления химических веществ на более простые вещества. Термическое разложение разрушает химическое вещество с помощью тепла, а электролитическое разложение использует электричество для разрыва связей. Фоторазложение происходит, когда сложное химическое вещество подвергается воздействию фотонов света.
Примеры химических реакций однократного замещения
Иногда в результате химической реакции элемент отделяется от соединения и добавляется к другому веществу (A + BC = B и AC). Это известно как химическая реакция с одной заменой , и в результате получается совершенно новый продукт.Вот несколько примеров реакций замещения:
- цинк + соляная кислота —> хлорид цинка и газообразный водород
- цинк + нитрат серебра —> нитрат цинка и металлическое серебро
- кальций + вода —> кальций гидроксид и дигидроген
- железо + нитрат меди —> нитрат железа и металлическая медь
- бром + йодид калия —> бром калия и йод
Металлы в сочетании с кислотами почти всегда представляют собой химические реакции однократного замещения.Когда они вступают в реакцию, металл забирает один элемент из кислоты, оставляя после себя единственный элемент. Все химически активные металлы, такие как литий, калий и натрий, сильно реагируют с водой, в то время как менее химически активные металлы могут реагировать не так сильно.
Примеры химических реакций двойного замещения
Подумайте о химических реакциях двойного замещения или реакциях метатезиса , как в торговле химикатами. Когда у вас есть два сложных реагента (AB и CD), которые меняют химические вещества во время реакции, вы получаете два новых продукта (AC и BD).Продолжайте читать, чтобы увидеть примеры реакций двойного замещения.
- сульфид железа + хлористый водород —> хлорид железа и сероводород (ядовитый газ)
- нитрат свинца + йодид калия —> йодид свинца и нитрат калия (селитра)
- бикарбонат натрия (пищевая сода) + уксус —> угольная кислота и ацетат натрия
- серная кислота + гидроксид бария —> сульфат бария и вода
- нитрат серебра + хлорид натрия —> хлорид серебра и нитрат натрия
Также можно вызвать двойную замену химическая реакция, когда вы соединяете кислоту и основание.Реакции, в которых в качестве реагентов используются кислота и основание, известны как реакция нейтрализации . Они не отменяют друг друга, но создают совершенно новые продукты, как и другие реакции двойного замещения.
React to Chemistry
Химические реакции зависят от реагентов и условий их сочетания. Но многие химические реакции запускаются или ускоряются химическими катализаторами . Если вы хотите узнать больше о катализаторах, ознакомьтесь с информативной статьей, которая включает примеров распространенных химических катализаторов.
Химические реакции
Основные идеи толкания и тяги исследуются в
.
Противопоставление взглядов студентов и ученых
Ежедневный опыт студентов
Дети испытали множество примеров химических изменений, даже не осознавая этого. Они знакомы с процессами горения, приготовления пищи, ржавчины и химических процессов, связанных с растворением. Однако на этом уровне ученики не видят, что новые материалы производятся в результате химических изменений, скорее они видят, что существующие материалы просто каким-то образом были изменены.Например, они видят дым как часть дерева, который каким-то образом выделяется при горении дерева. Поскольку учащиеся редко понимают понятие «вещество», они не видят изменения веществ. Тем не менее, понимание химических изменений является фундаментальным для понимания роли химии в их жизни, и на этом уровне студенты могут начать это понимать.
Студенты часто считают, что для того, чтобы получить что-то новое, нужно просто смешать все вместе. Когда химическая реакция действительно имеет место, они считают, что тот или иной реагент просто модифицируется; на самом деле это не изменилось.Например, учащиеся считают, что ржавчина — это все еще железо / сталь; он только что стал коричневым. Точно так же обычно не замечают отслаивания ржавчины — считается, что утюг просто исчезает. Пузырьки газа, которые часто образуются при растворении таблетки в воде, часто не воспринимаются студентами как новое вещество. Такие процессы, как смешивание с водой, использование красителей в пище, замораживание и кипячение, считаются аналогичными химическим изменениям, которые происходят при приготовлении яиц.
Исследование: Johnson (2002)
Дети часто верят, что при сгорании такие материалы, как дерево или бумага, просто исчезают — в конце концов, от продукта остается не так много, чтобы увидеть.По их мнению, воздух имеет мало общего с горением. Студенты считают, что при сжигании углеродных материалов, таких как дерево, древесный уголь (углерод) появляется из
горит , а не
материал .
Исследование: Университет штата Аризона (2001)
Поскольку многие дети знают о таких вещах, как приготовление пищи и сжигание, они предполагают, что тепло всегда необходимо для того, чтобы реакции происходили.
В обиходе слово «химический» часто используется как ярлык для нежелательных вещей, которых не должно быть в продуктах питания или косметике.Следовательно, учащиеся могут рассматривать химические вещества как группу веществ, обнаруженных в лабораториях, а не рассматривать все вещества в продуктах питания (например) как химические вещества.
Научная точка зрения
Все материалы сделаны из химикатов. Химические реакции включают взаимодействие между химическими веществами, так что все реагенты превращаются в новые материалы. Свойства новых материалов отличаются от свойств реагентов. Это отличается от других изменений, таких как испарение, плавление, кипение, замораживание и перемешивание, при которых изменения не связаны с новыми веществами.Хотя для начала реакций часто требуется тепло, это не обязательно.
Химические реакции включают разрыв химических связей между молекулами (частицами) реагентов и образование новых связей между атомами в частицах продукта (молекулах). Число атомов до и после химического изменения одинаково, но число молекул изменится.
Хотя многие химические реакции протекают быстро, небольшие, медленные изменения, такие как ржавление или биологические процессы, могут происходить в течение гораздо более длительных периодов времени.
Химические реакции обратимы (факт, который часто опускается во многих научных текстах), но на практике они больше всего отличаются от других наблюдаемых детьми изменений, таких как плавление, тем, что их очень трудно обратить.
Люди используют химические реакции для производства широкого спектра полезных материалов; разложение отходов также включает химические реакции, которые происходят естественным образом в окружающей среде. Для некоторых антропогенных отходов таких реакций нет, и в результате они вызывают проблемы.
Критические идеи преподавания
При обучении химическим реакциям на этом уровне акцент должен делаться на улучшении понимания учащимися важности химических реакций в нашей жизни в производстве многих вещей, которые мы принимаем как должное, а также на улучшении их понимания и понимания что вовлечено в химическое изменение.На этом этапе нет необходимости говорить о таких частицах, как атомы или молекулы, или о химических связях.
- В результате химических реакций образуются новые материалы, которые сильно отличаются от реагирующих веществ. Любые новые материалы происходят из реагирующих веществ.
- Изменения, которые могут сопровождать химическую реакцию, включают цвет, внешний вид и образование новых материалов, например, газа.
- Само по себе смешивание не может вызвать химическую реакцию.
- Хотя для инициирования химической реакции часто требуется тепло, это не всегда необходимо.
- Для производства большей части нашей энергии используются химические реакции.
- Химические реакции широко используются для тестирования, идентификации и анализа широкого спектра материалов (например, наборы для тестирования бассейнов и судебно-медицинские тесты из телешоу, таких как « CSI» ).
- Кислород в воздухе является очень реактивным химическим веществом и играет важную роль во многих химических реакциях, таких как горение, ржавление и реакции, посредством которых мы получаем энергию из пищи, которую мы едим.
Изучите взаимосвязь между идеями о химических реакциях в
Карты развития концепции — (атомы и молекулы, химические реакции, сохранение материи, состояния материи)
При изучении химических реакций учащимся нужно будет описывать различные вещества, которые на этом уровне будут материалами, с которыми они знакомы (кухня и изменения, связанные с приготовлением пищи, являются очень хорошей отправной точкой). Им необходимо будет уметь идентифицировать изменения в этих веществах с целью в конечном итоге распознать, когда были произведены новые химические вещества. I.е. произошло химическое изменение. Как упоминалось выше, это может быть сложно, поскольку студенты часто не видят разницы между яичным белком, переходящим из жидкого в твердое состояние в процессе приготовления, и такими изменениями, как таяние шоколада или кипячение воды, которые не связаны с химическими изменениями. Обучение должно быть сосредоточено на том, что происходит, когда образуются новые вещества.
Эти идеи также рассматриваются в идее фокуса
Проблемы с классификацией.
Также можно учитывать воздействие химических реакций на окружающую среду, например, как мы утилизируем некоторые химические вещества после их производства в таких формах, как пластиковые пакеты.
Начать обсуждение посредством обмена опытом
Первоначальная педагогическая деятельность должна быть направлена на выявление существующих идей учащихся. На этом этапе важно, чтобы учащихся поощряли высказывать свои идеи и обсуждать их в небольших группах. Все альтернативы следует рассматривать без разрешения на данном этапе.
Начальным действием может быть наблюдение за горением свечи и обсуждение происходящих изменений. Здесь можно различить плавление воска и появление новых материалов.Можно задать следующие вопросы:
- что происходит с воском?
- что горит?
- как вы думаете, куда идет воск?
- не могли бы вы собрать его снова?
- Это тот же процесс, что и испарение воды?
- горела бы свеча, если бы вокруг не было воздуха?
- воздух или часть воздуха израсходованы при горении свечи?
Содействовать размышлению и разъяснению существующих идей
Действия, которые ставят проблемы для изучения и оспаривают существующие идеи, полезны для поощрения студентов к поиску новых объяснений наблюдаемых ими вещей.Студенты должны изучить ряд изменений и задать вопросы, аналогичные приведенным выше. Во всех этих случаях студентов следует поощрять наблюдать за происходящими изменениями и определять, какие продукты образуются. Обсуждение также может быть сосредоточено на том, чем они отличаются от исходных материалов. Вот несколько примеров:
- Пищевая сода и уксус в стеклянной бутылке с пробкой — почему пробка отлетает?
- Добавьте бикарбонат соды в стакан с уксусом и шестью смородинами.Почему смородина движется вверх и вниз? Какие пузыри? Откуда берутся пузыри?
- Приготовление щербета — смешайте четыре части сахарной пудры, две части лимонной кислоты и одну часть пищевой соды (все это можно приобрести в супермаркетах). Студенты кладут небольшое количество смеси на язык. Что вызывает шипение? Выделяет ли какой-либо порошок сам по себе шипение?
- Наполните банку стальной мочалкой (без мыла) наполовину и добавьте уксуса, чтобы покрыть стальную мочалку. Оставьте на пять дней.Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку нашатырного спирта и перемешайте. Образуется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы.
- Изготовление карамели — студентам предлагается изучить сахар. Нагрейте концентрированный сахарный раствор, наблюдая за изменениями по пути — растворение сахара, затем потемнение. Карамелизация включает в себя ряд химических изменений.(Существует множество рецептов карамели — для улучшения вкуса, внешнего вида и текстуры можно добавить масло, пищевую соду и соль). Студентов следует поощрять искать доказательства химических изменений, а не плавления.
Практикуйтесь в использовании и создайте осознанную полезность научной модели или идеи
Другие виды деятельности могут включать изготовление шоколада. Учащимся можно предложить поискать различия между приготовлением шоколада, где шоколад тает, и производством карамели / ириса, когда сахар превращается во что-то другое.
Есть много других подобных химических изменений, которые можно исследовать — дальнейшая кулинария может включать: приготовление шоколадного торта, плавление и подрумянивание сыра, изготовление сот, выпечку хлеба, приготовление яиц-пашот и приготовление тостов. Другие изменения могут включать настройку двухкомпонентных клеев, таких как
Аралдит и смешивание стальной ваты и раствора медного купороса (можно приобрести в питомниках растений). Кислород является очень важным реагентом во многих химических реакциях, и студенты могут исследовать изменения, связанные с этим компонентом воздуха.
Уточнение и объединение идей для / путем общения с другими
На этом этапе важно уточнить и закрепить то, что наблюдали студенты, и сосредоточиться на том, что происходит в химической реакции, которая отличается от плавления, кипения и замораживания. Для достижения этой цели студентов можно попросить в группах сделать мини-плакаты, которые показывают изменения, происходящие в одной или нескольких реакциях, которые они наблюдали, в частности, сравнивая продукты с исходными материалами и демонстрируя, чем они отличаются.Этому можно способствовать, используя новые названия продуктов, такие как «сажа» или «углекислый газ». Затем студенты представляют свои плакаты классу.
Итоговое обсуждение в классе должно выявить идеи учащихся, изучить альтернативы и перейти к более общепринятым научным взглядам на химические реакции.
Должны быть выполнены задания, которые проверят полезность модели химических реакций и дополнительно укрепят представления учащихся о том, что представляет собой химическая реакция. Студентов можно также побудить сравнить продукты с исходными материалами.Например, студенты могут исследовать ржавление стального гвоздя в различных условиях (например, в воздухе / воде / соленой воде).
Для дальнейшего развития понимания учащимися роли химических изменений в их жизни они могли бы исследовать производство металлов из руд (таких как алюминий и сталь) или производство пластмасс и синтетических волокон. Акцент в этом исследовании делается на важности химических изменений в производстве материалов, которые мы используем каждый день.
Дополнительные ресурсы
Интерактивные обучающие объекты, связанные с наукой, можно найти на
Страница ресурсов для учителей FUSE.
Чтобы получить доступ к интерактивному объекту обучения ниже, учителя должны войти в FUSE и выполнить поиск по идентификатору учебного ресурса:
- Mystery Substances: ваш первый случай — студенты раскрывают полицейские дела, определяя чистые вещества и компоненты смесей. Они проводят химические испытания загадочного вещества, такого как соль, пищевая сода или сахар, а также наблюдают и записывают, как каждое вещество реагирует с рядом жидкостей и при нагревании. Затем они обращаются к своей таблице данных о химических свойствах и используют ее для сопоставления загадочного вещества или веществ, обнаруженных на месте преступления.Этот учебный объект является одним из пяти объектов.
Идентификатор учебного ресурса: K6ZRNX
- Загадка сокровищ — ученики должны открыть металлическую дверь в сокровищницу, растворив ее кислотами. Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумагой, бикарбонатом натрия или зубами.
Идентификатор учебного ресурса: 46X2PX
- Спасите озеро — Рыбы умирают в озере из-за загрязнения воды.Студенты проверяют воду в озере с помощью химических индикаторов, чтобы выяснить, какая отрасль является причиной загрязнения. Затем они предлагают изменения, чтобы спасти озеро.
Learning Resource ID: MW25YS
18 Химические реакции, повышающие вашу страсть к науке
Химия — одна из самых завораживающих (а иногда и опасных) наук. Хотя некоторые химические реакции являются частью нашей повседневной жизни, например, смешивание сахара с кофе, другие более сложны и требуют контролируемых условий для визуализации эффектов.Это особенно верно для ситуаций, когда реакция может привести к возгоранию, появлению опасных паров, взрыву или искр.
Самый безопасный способ испытать такие реакции — смотреть издалека, например, через экран компьютера. Ниже представлены 18 ярких видеороликов, которые разожгут вашу страсть к химическим реакциям.
1. Диэтилцинк и воздух
Диэтилцинк — очень нестабильное соединение. Он будет бурно реагировать и воспламеняться при контакте с водой, воздухом и практически всем, что может принять пару электронов или отдать протон.Поставляется в герметичных тубах с углекислым газом и может использоваться в качестве авиационного топлива. В этом видео, когда он вступает в контакт с кислородом, он горит с образованием оксида цинка, CO 2 и воды.
2. Цезий и вода
Цезий — один из наиболее реактивных щелочных металлов. Когда он вступает в контакт с водой, он реагирует с образованием гидроксида цезия и газообразного водорода. Эта реакция происходит так быстро, что вокруг цезия образуется пузырек водорода, который поднимается на поверхность, после чего цезий подвергается воздействию воды, вызывая дальнейшую экзотермическую реакцию, таким образом воспламеняя газообразный водород.Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
Цезий чаще всего используется в качестве бурового раствора. Он также полезен при изготовлении специального оптического стекла, оборудования для радиационного контроля и в атомных часах.
3. Глюконат кальция и тепло
Глюконат кальция обычно используется для лечения дефицита кальция. Однако при нагревании глюконат кальция разрушается и окисляется, образуя водяной пар и диоксид углерода.Продукты распада — оксид кальция и углерод — имеют больший объем, чем исходное вещество, поэтому образуется «змея».
4. Трииодид азота и прикосновение
Это неорганическое соединение можно приготовить дома, но имейте в виду, что это очень опасно. Соединение образуется в результате осторожной реакции йода и аммиака при взаимодействии йода с водным раствором аммиака. В результате получается чрезвычайно чувствительное контактное взрывчатое вещество. Небольшие количества взорвутся с громким резким треском при легком прикосновении к перышку, выпуская пурпурное облако паров йода.
5. Дихромат аммония и тепло
При комнатной температуре дихромат аммония, также известный как «Везувианский огонь», существует в виде оранжевых кристаллов. Когда он воспламеняется, он разлагается экзотермически, образуя искры, пар и газообразный азот, как при извержении мини-вулкана. Он также производит «золу» зеленого оксида хрома (III). Дихромат аммония используется в пиротехнике, фотографии и литографии. Также его можно использовать в качестве протравы при окрашивании пигментов.
6.Перекись водорода и йодид калия
Когда перекись водорода и йодид калия смешиваются в надлежащих пропорциях, перекись водорода разлагается очень быстро. В эту реакцию часто добавляют мыло для образования пенистого вещества, которое иногда называют «зубной пастой слона».
Мыльная вода улавливает кислород, продукт реакции, в результате чего образуется множество пузырьков. В то время как перекись водорода часто используется в качестве дезинфицирующего средства, йодид калия можно использовать в качестве лекарства — он используется для лечения гипертиреоза.
7. Хлорат калия и сахар
Мармеладные мишки в основном состоят только из сахарозы, а хлорат калия используется во взрывчатых веществах, фейерверках и спичках. Однако, когда мармеладных мишек опускают в хлорат калия и добавляют каплю серной кислоты в качестве катализатора, эти два химиката бурно вступают в реакцию друг с другом, выделяя большое количество тепловой энергии, эффектное лиловое пламя и много дыма. очень экзотермическая реакция горения.
8. Реакция Белоусова-Жаботинского (BZ)
Реакция BZ представляет собой семейство колеблющихся химических реакций, образованных комбинацией брома и кислоты. Реакция является ярким примером неравновесной термодинамики и приводит к красочным химическим колебаниям, которые вы видите в этом видео.
9. Окись азота и дисульфид углерода
Реакция, часто называемая «лающей собакой». Это химическая реакция, которая возникает в результате воспламенения сероуглерода и окиси азота или закиси азота в течение длительного времени. трубка.Реакция дает ярко-синюю вспышку и лающий или лающий звук.
При воспламенении смеси по трубе распространяется волна горения. Газ перед фронтом волны сжимается и взрывается на расстоянии, которое зависит от длины трубки. В результате экзотермической реакции разложения монооксида азота (окислитель) и сероуглерода (топливо) образуются азот, монооксид углерода, диоксид углерода, диоксид серы и сера.
В апреле 1853 года Юстус фон Либих, который считается одним из главных основоположников современной органической химии, провел собачий лай перед членами королевской семьи Баварии.К сожалению, стеклянная тара разбилась, в результате чего пострадали семья и сам Либих.
10. Сплав NaK и вода
Сплав NaK представляет собой металлический сплав, образованный смешением натрия и калия в отсутствие воздуха, обычно в керосине. Этот чрезвычайно реактивный сплав будет реагировать с воздухом, но при контакте с водой происходит еще более бурная реакция. Тепло, выделяемое этой реакцией, быстро плавит натрий и калий, и его часто бывает достаточно для воспламенения образовавшегося газообразного водорода.
Хотя реакция может показаться простой, ученые все еще не знают, почему процесс происходит так быстро.
11. Термит и лед
Вы когда-нибудь думали, что смешивание огня и льда может привести к взрыву?
Вот что происходит, когда вам немного помогает термит, который представляет собой смесь алюминиевого порошка и оксида металла, такого как железо. Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, т.е.е. химическая реакция, в которой электроны передаются между двумя веществами. В результате реакции выделяется большое количество тепла в виде пламени и искр, а также поток расплавленного железа и оксида алюминия.
Когда термит помещается на лед и воспламеняется с помощью пламени, лед немедленно поджигается и выделяется большое количество тепла в виде взрыва. Нет единого научного мнения о том, почему термит в сочетании со льдом вызывает взрыв. Но одно ясно из демонстрационного видео — не пробуйте это дома!
12.Осциллирующие часы Бриггса-Раушера
Реакция Бриггса-Раушера — одна из очень немногих колеблющихся химических реакций. Три раствора, необходимые для этого наблюдения, представляют собой разбавленную смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленную смесь малоновой кислоты (HOOOCCH 2 COOH), сульфата марганца. Моногидрат (MnSO 4 . H 2 O) и крахмал витекс, и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
Реакция дает ошеломляющие визуальные эффекты, поскольку цвет раствора меняется взад и вперед. Чтобы инициировать реакцию, три бесцветных раствора смешивают вместе. Полученный раствор будет циклически менять цвет с прозрачного на янтарный на темно-синий в течение 3-5 минут, прежде чем станет темно-синим.
13. Переохлаждение воды
В этом эксперименте очищенная вода охлаждается ниже точки замерзания, а затем кристаллизуется в лед с помощью одного крана.Это можно сделать дома с помощью бутылки с дистиллированной водой. Просто дайте ему остыть в морозильной камере в течение примерно двух часов. Затем выньте его и встряхните или постучите.
Поскольку вода не имеет примесей, у молекул воды нет ядра, вокруг которого могли бы образовываться твердые кристаллы. Внешняя энергия, обеспечиваемая в виде крана, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию, которая быстро кристаллизует воду во всей бутылке.
14. Феррожидкость и магнитные поля
Ферромагнитная жидкость состоит из наноразмерных ферромагнитных частиц, взвешенных в жидкости-носителе, такой как органический растворитель или масло. Магнитные частицы также покрыты поверхностно-активным веществом для предотвращения комкования. Первоначально они были обнаружены Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов контроля жидкостей в космосе.
Под воздействием сильных магнитных полей феррожидкости будут создавать впечатляющие формы и узоры.Эти жидкости могут быть приготовлены путем объединения пропорций соли Fe (II) и солей Fe (III) в щелочном растворе с образованием Fe 3 O 4.
15. Гигантский пузырь сухого льда
Если вы найдете немного сухого льда (замороженного углекислого газа), попробуйте этот эксперимент, чтобы создать гигантский пузырь дома, но при этом не забудьте принять соответствующие меры предосторожности с сухим льдом!
Возьмите миску и наполовину наполните ее водой. Смочите жидкое мыло водой и перемешайте.Намочите края миски пальцами и добавьте в раствор сухой лед. Окуните круглую полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите немного, пока сухой ледяной газ не окажется внутри мыльного пузыря, который начнет постепенно расширяться по мере расширения газа CO 2 .
16. Тиоцианат ртути и тепло
Когда тиоцианат ртути (II) воспламеняется, это приводит к быстрой экзотермической реакции, которая вызывает растущий столб, напоминающий змею, и разноцветное пламя, эффект, также известный как Змея фараона.Раньше тиоцианат ртути использовался в фейерверках. Все соединения ртути токсичны, и самый безопасный способ провести этот эксперимент — в вытяжном шкафу.
17. Эффект Мейснера
Охлаждение сверхпроводника ниже температуры перехода сделает его диамагнитным, заставляя его парить на выше магнита. Этот эффект привел к концепции транспортировки без трения, когда объект может левитировать по рельсам, а не прикрепляться к колесам.Однако этот эффект можно легко воспроизвести в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит, а также жидкий азот. Охладите сверхпроводник жидким азотом и поместите сверху магнит, чтобы наблюдать левитацию.
18. Сверхтекучий гелий
Сверхтекучая среда — это состояние вещества, в котором вещество ведет себя как жидкость с нулевой вязкостью. Точка, в которой жидкость переходит в сверхтекучую, называется лямбда-точкой.Охлаждение гелия до его лямбда-точки (-271 ° C) сделает его сверхтекучим, известным как гелий II.
Способность гелия оставаться жидкостью при очень низких температурах позволяет ему образовывать конденсат Бозе-Эйнштейна, при этом отдельные частицы перекрываются, пока не станут вести себя как одна большая частица. В этом состоянии без трения гелий будет делать то, что другие жидкости не могут, например, проходить сквозь трещины, толщиной с молекулы, преодолевать гравитацию, взбираясь по стенкам тарелки, и оставаться неподвижным внутри движущегося контейнера.
Явления NGSS — Пример научного явления
Считается ли это химической реакцией?
Откуда мы знаем?
Какие химические вещества?
Почему они реагируют?
Откуда берется энергия?
Куда уходит энергия?
Как выпускается?
Как это хранилось в первую очередь?
Есть что-нибудь о материале?
Могут ли вопросы Crosscutting Concept помочь нам в этом разобраться?
1.Какие паттерны я замечаю в этом явлении?
2. Каковы границы этого явления? Каковы его компоненты и как они взаимодействуют с ?
3. Что происходит на ненаблюдаемом уровне от до , вызывает наблюдаемых функций или процессов?
4. Какая шкала или шкалы объясняют это явление и как я могу описать его количественно ?
5.Как энергия и / или материя втекают в, из или внутри границ явления?
6. Как структура явления (или его компонентов) соотносится с его функцией ?
7. При каких условиях это явление стабильно ? При каких условиях меняет ?
(Список принадлежит блестящей педагогу Хизер Майло !!)
ДИСЦИПЛИНАРНЫЕ ОСНОВНЫЕ ИДЕИ
PS1.A: СТРУКТУРА И СВОЙСТВА ВЕЩЕСТВА
Вещества состоят из атомов разных типов, которые по-разному сочетаются друг с другом. Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1)
Твердые тела могут состоять из молекул или представлять собой протяженные структуры с повторяющимися субъединицами (например, кристаллы). (MS-PS1-1)
PS1.B: ХИМИЧЕСКИЕ РЕАКЦИИ
Вещества химически реагируют характерным образом.В химическом процессе атомы, из которых состоят исходные вещества, перегруппировываются в разные молекулы, и эти новые вещества имеют свойства, отличные от свойств реагентов. (MS-PS1-2), (MS-PS1-3), (MS-PS1-5)
Общее количество атомов каждого типа сохраняется, и, таким образом, масса не изменяется. (MS-PS1-5)
Некоторые химические реакции выделяют энергию, другие накапливают энергию. (MS-PS1-6)
PS3.A: ОПРЕДЕЛЕНИЯ ЭНЕРГИИ
Термин «тепло», используемый в повседневном языке, относится как к тепловой энергии (движению атомов или молекул в веществе) и передача этой тепловой энергии от одного объекта к другому.В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4)
Температура системы пропорциональна средней внутренней кинетической энергии и потенциальной энергии на атом или молекулу (в зависимости от того, что является подходящим строительным блоком для материала системы). Детали этой связи зависят от типа атома или молекулы и взаимодействия между атомами в материале.Температура не является прямым показателем общей тепловой энергии системы. Полная тепловая энергия (иногда называемая полной внутренней энергией) системы зависит от температуры, общего числа атомов в системе и состояния материала. (вторичный по отношению к MS-PS1-4)
Какая наука стоит за этим ?? Примечание: не смотрите сюда, пока не попробуете написать свои собственные объяснения! — http://jchemed.chem.wisc.edu/blog/how-does-orange-peel-pop-balloon-chemistry-course
Ожидаемые характеристики
MS-PS1-2.
Анализируйте и интерпретируйте данные о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция. [Уточнение: Примеры реакций могут включать сжигание сахара или стальной ваты, реакцию жира с гидроксидом натрия и смешивание цинка с хлористым водородом.] [ Граница оценки: Оценка ограничивается анализом следующих свойств: плотность, плавление точка, температура кипения, растворимость, воспламеняемость и запах.]
5.3: Типы химических реакций
Результаты обучения
- Классифицируют реакцию как комбинацию, разложение, однократное замещение, двойное замещение или горение.
- Предсказать продукты и уравновесить реакцию горения.
Многие химические реакции можно разделить на пять основных типов. Полное понимание этих типов реакций будет полезно для предсказания продуктов неизвестной реакции.Пять основных типов химических реакций — это комбинация, разложение, однократное замещение, двойное замещение и горение. Анализ реагентов и продуктов данной реакции позволит вам отнести ее к одной из этих категорий. Некоторые реакции можно отнести к нескольким категориям.
Комбинированные реакции
Реакция объединения , также известная как реакция синтеза , представляет собой реакцию, в которой два или более вещества объединяются с образованием единого нового вещества. Реакции комбинирования могут также называться реакциями синтеза. Общая форма реакции комбинирования:
\ [\ ce {A} + \ ce {B} \ rightarrow \ ce {AB} \]
Одна комбинационная реакция — это соединение двух элементов с образованием соединения. Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\ [2 \ ce {Na} \ left (s \ right) + \ ce {Cl_2} \ left (g \ right) \ rightarrow 2 \ ce {NaCl} \ left (s \ right) \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, которые существуют в природе в виде двухатомных молекул (\ (\ ce {H_2} \), \ (\ ce {N_2} \), \ (\ ce {O_2} \), \ (\ ce {F_2} \), \ (\ ce {Cl_2} \), \ (\ ce {Br_2} \) и \ (\ ce {I_2} \)) .
Одним из часто встречающихся видов комбинированной реакции является реакция элемента с кислородом с образованием оксида. И металлы, и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и резко реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния.
\ [2 \ ce {Mg} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {MgO} \ left (s \ right) \]
Реакция разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества. Общая форма реакции разложения:
\ [\ ce {AB} \ rightarrow \ ce {A} + \ ce {B} \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода.
\ [2 \ ce {HgO} \ left (s \ right) \ rightarrow 2 \ ce {Hg} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \]
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением.Карбонат металла разлагается на оксид металла и газообразный диоксид углерода. Например, карбонат кальция разлагается на оксид кальция и диоксид углерода.
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды. Гидроксид натрия разлагается с образованием оксида натрия и воды.
\ [2 \ ce {NaOH} \ left (s \ right) \ rightarrow \ ce {Na_2O} \ left (s \ right) + \ ce {H_2O} \ left (g \ right) \]
Реакции при однократной замене
Реакция однократного замещения — это реакция, в которой один элемент заменяет аналогичный элемент в соединении .Общая форма реакции однократного замещения (также называемой однократным вытеснением):
\ [\ ce {A} + \ ce {BC} \ rightarrow \ ce {AC} + \ ce {B} \]
В этой общей реакции элемент \ (\ ce {A} \) является металлом и заменяет элемент \ (\ ce {B} \), также металл, в соединении. Когда элемент, выполняющий замену, является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает следующий вид:
\ [\ ce {Y} + \ ce {XZ} \ rightarrow \ ce {XY} + \ ce {Z} \]
\ (\ ce {Y} \) является неметаллом и заменяет неметалл \ (\ ce {Z} \) в соединении на \ (\ ce {X} \).
Магний является более химически активным металлом, чем медь. Когда полоса металлического магния помещается в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\ [\ ce {Mg} \ left (s \ right) + \ ce {Cu (NO_3) _2} \ left (aq \ right) \ rightarrow \ ce {Mg (NO_3) _2} \ left (aq \ right) + \ ce {Cu} \ left (s \ right) \]
Многие металлы легко вступают в реакцию с кислотами, и, когда они это делают, одним из продуктов реакции является газообразный водород.Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (см. Рисунок ниже).
\ [\ ce {Zn} \ left (s \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow \ ce {ZnCl_2} \ left (aq \ right) + \ ce {H_2} \ влево (г \ вправо) \]
Рисунок 10.6.1: Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции однократного замещения.
Рис. 10.6.2: На рисунке показано примерно 3 фунта металлического натрия, реагирующего с водой.Металлический натрий бурно реагирует при попадании в емкость с водой с выделением газообразного водорода. Большой кусок натрия часто выделяет столько тепла, что водород воспламеняется.
Реакции двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений обмениваются местами с образованием двух новых соединений . Общая форма реакции двойного замещения (также называемой двойным вытеснением):
\ [\ ce {AB} + \ ce {CD} \ rightarrow \ ce {AD} + \ ce {CB} \]
В этой реакции \ (\ ce {A} \) и \ (\ ce {C} \) являются положительно заряженными катионами, а \ (\ ce {B} \) и \ (\ ce {D} \) являются отрицательно заряженными анионами.Реакции двойного замещения обычно происходят между веществами в водном растворе. Для протекания реакции одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного из реагентов соединяются с анионами другого реагента с образованием нерастворимого ионного соединения. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
\ [2 \ ce {KI} \ left (aq \ right) + \ ce {Pb (NO_3) _2} \ left (aq \ right) \ rightarrow 2 \ ce {KNO_3} \ left (aq \ right) + \ ce {PbI_2} \ left (s \ right) \]
Рисунок 10.6.3: Когда несколько капель нитрата свинца (II) добавляются к раствору иодида калия, сразу образуется желтый осадок иодида свинца (II) в реакции двойного замещения.
Реакции горения
A реакция горения — это реакция, в которой вещество реагирует с газообразным кислородом, выделяя энергию в виде света и тепла. Реакции горения должны включать \ (\ ce {O_2} \) в качестве одного реагента. При сгорании газообразного водорода образуется водяной пар (см. Рисунок ниже).
\ [2 \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (g \ right) + 2 \ ce {H_2O} \ left (g \ right) \]
Обратите внимание, что эта реакция также квалифицируется как реакция комбинации.
Рисунок 10.6.4: Hindenburg был дирижаблем, наполненным водородом, который потерпел аварию при попытке приземлиться в Нью-Джерси в 1937 году.Водород немедленно загорелся огромным огненным шаром, уничтожив дирижабль и убив 36 человек. Химическая реакция была простой: водород соединяется с кислородом с образованием воды.
Многие реакции горения происходят с углеводородом, соединением, состоящим исключительно из углерода и водорода. Продуктами сгорания углеводородов всегда являются углекислый газ и вода. Многие углеводороды используются в качестве топлива, поскольку при их сгорании выделяется очень большое количество тепловой энергии.Пропан \ (\ left (\ ce {C_3H_8} \ right) \) — газообразный углеводород, который обычно используется в качестве источника топлива в газовых грилях.
\ [\ ce {C_3H_8} \ left (g \ right) + 5 \ ce {O_2} \ left (g \ right) \ rightarrow 3 \ ce {CO_2} \ left (g \ right) + 4 \ ce {H_2O } \ left (g \ right) \]
Пример 10.6.1
Этанол можно использовать в качестве источника топлива в спиртовой лампе. Формула для этанола \ (\ ce {C_2H_5OH} \). Напишите сбалансированное уравнение горения этанола.
Решение:
Шаг 1. Спланируйте проблему.
Реагентами являются этанол и кислород. Как и в случае с углеводородом, продуктами сгорания спирта являются углекислый газ и вода.
Шаг 2: Решить.
Запишите скелетные уравнения: \ (\ ce {C_2H_5OH} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (g \ right) \)
Сбалансируйте уравнение.
\ [\ ce {C_2H_5OH} \ left (l \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {CO_2} \ left (g \ right) + 3 \ ce {H_2O } \ left (g \ right) \]
Шаг 3. Подумайте о своем результате.
Реакции горения должны включать кислород в качестве реагента. Обратите внимание, что получаемая вода находится в газообразном, а не в жидком состоянии из-за высоких температур, сопровождающих реакцию горения.
Авторы
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Султ, Ph.D. (Кафедра химии, Университет Кентукки)
химических реакций | Химия | Visionlearning
(Это обновленная версия модуля Химические реакции.Для предыдущей версии см. Эту страницу.)
Химические реакции происходят абсолютно везде. Хотя мы иногда связываем химические реакции со стерильной средой пробирки и лаборатории, ничто не может быть дальше от истины. На самом деле колоссальное количество преобразований приводит к головокружительному, почти непостижимому множеству новых веществ и энергетических изменений, которые происходят в нашем мире каждую секунду каждого дня.
В природе химические реакции можно гораздо хуже контролировать, чем в лаборатории, иногда гораздо более беспорядочно, и они обычно происходят независимо от того, хотите вы этого или нет! Будь то пожар, бушующий в лесу (рис.1), медленный процесс ржавления железа в присутствии кислорода и воды в течение многих лет или нежный способ созревания фруктов на дереве, процесс преобразования одного набор химических веществ (реагентов) к другому набору веществ (продуктов) известен как химическая реакция.
Рис. 1 : Контролируемый пожар в Альберте, Канада, установлен, чтобы создать барьер для будущих лесных пожаров. image © Кэмерон Страндберг, Rocky Mountain House
Хотя химические реакции происходят на Земле с незапамятных времен, первые химики начали понимать их только в 18 веке. Такие процессы, как ферментация, при которой сахар химически превращается в спирт, были известны на протяжении веков; однако химические основы реакции не были поняты.Что это были за трансформации и как ими управляли? На эти вопросы можно было ответить только тогда, когда произошел переход от алхимии к химии как количественной и экспериментальной науке.
Исторический контекст
Начиная с раннего средневековья европейские и персидские философы были очарованы тем, как одни вещества, казалось, «трансмутировались» (или трансформировались) в другие.Простые камни, например, содержащие серу, казалось, волшебным образом горят; и иначе не впечатляющие минералы были преобразованы, как руда киновари, превращающаяся при нагревании в очаровательную серебристую жидкую металлическую ртуть. Алхимики основывали свой подход на идеях Аристотеля о том, что все в мире состоит из четырех основных веществ — воздуха, земли, огня и воды (рис. 2).
Рисунок 2 : Аристотель считал, что все в мире состоит из четырех основных веществ — воздуха, земли, огня и воды.
Таким образом, они предложили и потратили поколения на то, чтобы доказать, что менее дорогие металлы, такие как медь и ртуть, можно превратить в золото. Несмотря на свой ошибочный подход, многие ранние алхимики проводили фундаментальные химические эксперименты, превращая одно вещество в другое, поэтому трудно указать на конкретную дату или событие как на рождение идеи упорядоченной, поддающейся количественной оценке химической реакции. Однако в истории есть несколько важных моментов, которые помогли разобраться в этом.
Лавуазье: Закон сохранения массы
Антуан Лавуазье был французским дворянином в 1700-х годах, который начал экспериментировать с различными химическими реакциями. В то время химию еще нельзя было назвать настоящей количественной наукой. Большинство теорий, которые существовали для объяснения того, как изменяются вещества, основывались на греческой философии, и было очень мало экспериментальных деталей, связанных с работой алхимика.
Однако во второй половине 18-го века Лавуазье провел множество количественных экспериментов и заметил, что, хотя вещества меняют форму во время химической реакции, масса системы — или мера общего количества присутствующего «вещества» — меняется. не изменить. При этом Лавуазье отстаивал идею сохранения массы во время преобразований (рис. 3). Другими словами, в отличие от алхимиков до него, которые думали, что они создают материю из ничего, Лавуазье предположил, что вещества не создаются и не разрушаются, а скорее меняют форму в ходе реакций.Идеи Лавуазье были опубликованы в основополагающей работе Traité élémentaire de Chimie в 1789 году (Lavoisier, 1789), которая широко провозглашается рождением современной химии как количественной науки.
Рисунок 3 : Закон сохранения массы Лавуазье, который гласит, что вещества не создаются и не разрушаются, а меняют форму во время реакций. В этом примере реагенты (цинк и две молекулы хлористого водорода) превращаются в разные продукты (хлорид цинка и дигидроген), но масса не теряется и не создается.
Пруст: Закон постоянной композиции
Жозеф Пруст был французским актером, который пошел по стопам Лавуазье. Пруст провел десятки химических реакций, начиная с разного количества различных материалов. Со временем он заметил, что независимо от того, как он запускал определенную химическую реакцию, соотношение, в котором расходуются реагенты, всегда было постоянным. Например, он много работал с карбонатом меди, и независимо от того, как он менял соотношение исходных реагентов, медь, углерод и кислород все вместе реагировали в постоянном соотношении (Proust, 1804).В результате в последние несколько лет 18 века Пруст сформулировал закон постоянного состава (также называемый законом определенных пропорций, рис. 4).
Он понял, что любое данное химическое вещество (которое мы теперь определяем как соединение) всегда состояло из одного и того же массового соотношения его элементарных частей, независимо от метода приготовления. Это был огромный шаг вперед в современной химии, поскольку ранее считалось, что вещества, образующиеся в ходе химических реакций, были случайными и неупорядоченными.
Рисунок 4 : Пример закона постоянного состава Пруста, который гласит, что любое соединение всегда состоит из одного и того же массового соотношения его элементарных частей, независимо от метода приготовления.
Дальтон: Закон множественных пропорций
Английский химик Джон Дальтон помог разобраться в законах сохранения массы и определенных пропорций в 1803 году, предположив, что материя состоит из атомов уникальных веществ, которые не могут быть созданы или разрушены (см. модуль «Ранние идеи о материи» для получения дополнительной информации).
Дальтон расширил идеи Пруста, признав, что два элемента могут образовывать более одного соединения, но каким бы ни было соединение, оно всегда будет содержать элементы, объединенные в целочисленных отношениях (Dalton, 1808). Это наблюдение известно как закон множественных пропорций (рис. 5), и его атомная теория помогла закрепить наблюдения Лавуазье.
Рисунок 5 : Закон множественных пропорций Далтона, который гласит, что два элемента могут образовывать более одного соединения, но каким бы ни было соединение, оно всегда будет содержать элементы, объединенные в целочисленных соотношениях
Эти достижения, вместе взятые, заложили основу для наше современное понимание химических реакций, химических уравнений и химической стехиометрии, или процесса выражения относительных количеств реагентов и продуктов в химической реакции.
Контрольная точка понимания
____ впервые предположил, что, хотя вещества меняют форму во время химической реакции, масса системы не меняется.
Типы химических реакций
Существует огромное количество химических реакций. Химические реакции постоянно происходят в наших телах, внутри растений и животных, в воздухе, который циркулирует вокруг нас, в озерах и океанах, в которых мы плаваем, и даже в почве, где мы выращиваем урожай и строим дома.На самом деле происходит так много химических реакций, что понять их все будет трудно, а то и невозможно. Однако один метод, который помогает нам понять их, — это разделить химические реакции на несколько общих типов. Хотя это и не идеальная система, объединение реакций в соответствии с их сходством помогает нам идентифицировать закономерности, что, в свою очередь, позволяет делать прогнозы относительно еще не изученных реакций. В этом модуле мы рассмотрим и предоставим некоторый контекст для нескольких категорий реакций, а именно: синтеза, разложения, одиночного замещения, двойного замещения, РЕДОКС (включая горение) и кислотно-основных реакций.
Независимо от типа реакции, одна универсальная истина применима ко всем химическим реакциям. Чтобы процесс был классифицирован как химическая реакция, то есть процесс, в котором происходит химическое изменение, должно быть произведено новое вещество. Образование нового вещества почти всегда сопровождается изменением энергии, а часто и каким-либо физическим или наблюдаемым изменением. Физические изменения могут быть разных типов, например образование пузырьков газа, твердого осадка или изменение цвета.Эти изменения являются ключом к разгадке химической реакции и являются важными триггерами для дальнейших исследований химиков.
Реакции синтеза
До работы Лавуазье плохо понималось, что существуют разные газы, состоящие из разных элементов. Вместо этого различные газы обычно неверно характеризовали как типы «воздуха» или отсутствующих частей воздуха — например, обычно использовались термины «легковоспламеняющийся воздух» или «дефлогистированный воздух».«Лавуазье думал иначе и был убежден, что это разные вещества. Он провел эксперименты, в которых он смешал горючий воздух с дефлогистированным воздухом и искрой, и обнаружил, что эти вещества образуют воду. В ответ он переименовал горючий воздух в« водород »из греческое hydro для «воды» и генов для «создателя». При этом Лавуазье определял реакцию синтеза. В общем, реакция синтеза — это реакция, в которой более простые вещества объединяются, чтобы сформировать другое, более сложное.Водород и кислород (который Лавуазье также переименовал в дефлогистированный воздух) объединяются в присутствии искры, чтобы образовать воду, что резюмируется химическим уравнением, показанным ниже (подробнее о химических уравнениях см. Раздел под названием Анатомия химического уравнения ), он представляет собой простая реакция синтеза.
Уравнение 1
2H 2 (g) + O 2 (g) → 2H 2 O (l)
Реакции разложения
В 1774 году ученый Джозеф Пристли обратил свое любопытство в минерал под названием киноварь — минерал кирпично-красного цвета.Когда он поместил минерал под солнечный свет, усиленный мощным увеличительным стеклом, он обнаружил, что образовался газ, который он описал как имеющий «возвышенную природу», потому что свеча ярко горела в газе (Priestley, 1775). Не осознавая этого, Пристли открыл кислород в результате реакции разложения. Реакции разложения часто рассматриваются как противоположные реакциям синтеза, поскольку они включают разложение соединения на более простые соединения или даже элементы. В случае с кислородом Пристли он разложил оксид ртути (II) (киноварь) с помощью тепла на отдельные элементы.Реакцию можно описать следующим уравнением.
Уравнение 2
2HgO (s) → 2Hg (l) + O 2 (g)
Единичные реакции замещения
Британский химик и метеоролог Джон Даниэлл изобрел одну из самых первых практичных батарей в 1836 году (Рисунок 6) .В своей камере Даниэлл использовал очень обычную реакцию одиночного замещения. Его ранние камеры были сложными, с неуклюжими деталями и сложными конструкциями, но, напротив, химия, лежащая в основе них, была действительно довольно простой.
Рисунок 6 : Батареи Daniell.
В некоторых химических реакциях один компонент может заменять другой, уже включенный в химическое соединение.Ячейка Даниэля работает, потому что цинк может заменять медь в растворе сульфата меди и, таким образом, обменивать электроны, которые используются в элементе батареи. Реакцию можно резюмировать следующим образом:
Уравнение 3
Zn (s) + CuSO 4 (водн.) → ZnSO 4 (вод. многие типы батарей основаны на реакциях замещения металлов.Однако существует несколько других типов реакций одиночного замещения, например, когда металл может заменять водород из кислоты или воды, или галоген может заменять другой галоген в некоторых солевых соединениях.
Реакции возгорания
Контролируемое использование огня было решающим событием для ранней цивилизации. Хотя трудно определить точное время, когда люди впервые приручили реакции горения, приводящие к возникновению огня, недавние исследования показывают, что это могло произойти, по крайней мере, миллион лет назад в пещере в Южной Африке (Berna et al.2012).
С химической точки зрения горение — это не более чем реакция топлива (древесины, масла, бензина и т. Д.) С кислородом. Для того, чтобы произошло горение, должно быть топливо и газообразный кислород. Однако для этих реакций часто требуется энергия активации (более подробно описанная в модуле «Химическая связь: природа химической связи»), которая может быть получена с помощью «искры» или источника энергии для воспламенения. Топливо, кислород и энергия — это три составляющих так называемого огненного треугольника (рис. 7), и отсутствие любого из них означает, что горение не произойдет.
Рис. 7 : Огненный треугольник состоит из трех компонентов — топлива, кислорода и энергии. image © Gustavb
В современном мире многие виды топлива, которые обычно сжигаются для получения энергии, представляют собой углеводороды — вещества, содержащие как водород, так и углерод (как более подробно обсуждается в нашем модуле химии углерода). Растения производят углеводороды, когда они растут, и, таким образом, являются отличным источником топлива, а другие углеводороды производятся, когда растения или животные со временем разлагаются (например, природный газ, нефть и другие вещества).Когда это топливо сгорает, водород и углерод в нем соединяются с кислородом, образуя два очень знакомых соединения: воду и углекислый газ. Один простой пример — сжигание природного газа или метана, CH 4 :
Уравнение 4
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (л)
Как и при сгорании всех видов топлива, тепло и свет являются продуктами, тоже, и именно эти продукты используются для приготовления пищи или обогрева наших домов.
Реакции восстановления-окисления
Каждый из четырех вышеуказанных типов реакций является подкатегорией одного типа химической реакции, известной как окислительно-восстановительные реакции. Окислительно-восстановительная реакция — это реакция, при которой восстановление и окисление протекают вместе, отсюда и название. Отдельные процессы окисления и восстановления могут быть определены более чем одним способом, но независимо от определения, эти два процесса являются симбиотическими, т.е.е., они должны проходить вместе.
В одном из определений окисление описывается как процесс, в котором какое-либо вещество теряет электроны, а восстановление — это процесс, при котором вид приобретает электроны. Таким образом, мы можем увидеть, как пара должна иметь место вместе. Если химическое вещество должно терять электроны (и, следовательно, окисляться), тогда у него должно быть другое взаимозависимое химическое вещество, которому оно может отдать эти электроны. Говорят, что при этом второе вещество (получающее электроны) восстанавливается.Без такого акцептора электронов исходные частицы никогда не могут потерять электроны, и не может произойти окисление. Когда присутствует акцептор электронов, он восстанавливается, и процесс окислительно-восстановительной комбинации завершается. Окислительно-восстановительные реакции этого типа можно резюмировать с помощью пары уравнений: одно показывает потерю электронов (окисление), а другое — прирост электронов (восстановление). Используя приведенный выше пример ячейки Даниэля,
Уравнение 5
Окисление: Zn → Zn 2+ + 2e —
Восстановление: Cu 2+ + 2e — → Cu
Электроны, которые показаны теряемыми цинком в первой реакции, являются теми же электронами, которые принимаются ионами меди во второй.Вместе реакции могут быть объединены для нейтрализации электронов по обе стороны от реакции в общую окислительно-восстановительную реакцию:
Уравнение 6
Zn + Cu 2+ → Zn 2+ + Cu
Существуют и другие определения окисления и восстановления, но в каждом случае две половины окислительно-восстановительной реакции остаются симбиотическими — одна проигрывает, а другая выигрывает.Убыток от одного вида не может произойти без прироста другого вида.
Реакции двойного вытеснения
Когда мыло не образует пену в воде, вода считается «жесткой». Жесткая вода вызывает множество проблем, которые выходят за рамки простого образования пены. Накопление соединений в водопроводных трубах (известное как «накипь») может блокировать поток воды и вызывать проблемы в промышленных процессах.Текстильная промышленность и производство напитков в значительной степени зависят от воды. В таких ситуациях качество воды может иметь значение для конечного продукта, поэтому контроль состава воды имеет решающее значение.
Жесткая вода содержит ионы магния или кальция в виде растворенных солей, таких как хлорид магния или хлорид кальция. Когда мыло (стеарат натрия) вступает в контакт с любой из этих солей, оно вступает в реакцию двойного замещения, в результате которой образуется нерастворимый осадок, известный как «мыльная пена».
Реакция двойного замещения (также известная как реакция двойного замещения) происходит, когда два ионных вещества объединяются и оба вещества обмениваются партнерами. Общий:
Уравнение 7
AB + CD → AD + CB
Где A и C — катионы (положительно заряженные ионы), а B и D — анионы (отрицательно заряженные).
В случае реакции мыла с хлоридом кальция реакция:
Уравнение 8
CaCl 2 (водн.) + 2NA (C 17 H 35 COO) (водн.) → 2NaCl (водн.) + Ca (C 17 H 35 COO) 2 (s)
Твердый стеарат кальция — это то, что мы называем мыльной пеной, которая образуется в результате реакции растворимой соли стеарата натрия (мыла) в реакции двойного замещения с хлоридом кальция.
Кислотно-основные реакции
Кислотно-основные реакции происходят постоянно вокруг и даже внутри нас. От классического вулкана пищевой соды в начальной школе до процесса пищеварения мы ежедневно сталкиваемся с кислотами и основаниями.
Когда атом водорода теряет свой единственный электрон, он образует положительный ион H + .Этот ион водорода является важным компонентом всех кислот, и действительно, одно определение кислоты — это донор иона водорода. Такие соединения, как лимонная кислота в лимонном соке, этановая кислота в уксусе или типичная лабораторная кислота, такая как соляная кислота, все отдают свои ионы водорода в химических реакциях, известных как кислотно-основные реакции. Химические противоположности кислот известны как основания, а основания можно определить как акцепторы ионов водорода. Когда кислота отдает ион водорода основанию, происходит кислотно-основная реакция, например, когда соляная кислота отдает ион водорода основанию, такому как гидроксид натрия:
Уравнение 9a
HCl (водн.) + NaOH (водн.) → H 2 O (l) + NaCl (водн.)
Более пристальный взгляд на эту реакцию показывает, что в воде HCl выделяет H + , как показано ниже:
Уравнение 9b
HCl (водн.) + H 2 O (л) → H 3 O + (водн.) + Cl — (водн.)
Полученные частицы, H 3 O + (ион гидроксония), может, в свою очередь, действовать как кислота, когда вступает в контакт с любыми веществами, которые могут принимать ион водорода, такими как ионы гидроксида из гидроксида натрия:
Уравнение 9c
H 3 O + (водн.) + NaOH (водн.) → 2H 2 O (l) + Na + (водн.)
Объединение уравнений # 9a и # 9b дает нам уравнение № 9c.
Уравнение # 9c можно переписать, чтобы показать отдельные ионы, находящиеся в растворе, таким образом:
Уравнение 9d
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → H 2 O (л) + Na + (водн.) + Cl — (водн.)
Удалив ионы-наблюдатели из приведенного выше уравнения, мы получим чистое ионное уравнение:
Уравнение 9e
H + (водн.) + OH — (водн.) → H 2 O (l)
Любая химическая реакция, в результате которой образуется вода в результате реакции между кислотой и основанием, как в уравнении # 9e известна как реакция нейтрализации.
Контрольная точка понимания
Тип химической реакции, при которой один компонент может заменять другой, уже включенный в химическое соединение:
Анатомия химического уравнения
Химические уравнения всегда связаны с химическими реакциями, поскольку они являются сокращением, с помощью которого описываются химические реакции.Один этот факт делает уравнения невероятно важными, но уравнения также играют решающую роль в описании количественного аспекта химии, то, что мы формально называем стехиометрией.
Все химические реакции протекают в одном и том же основном формате. Исходные вещества или реагенты перечислены с использованием их химической формулы в левой части стрелки, а несколько реагентов разделены знаком плюс. В случае реакции углерода с кислородом:
Уравнение 10a
C + O 2 →
Справа от стрелки находятся химические формулы нового вещества или веществ (известных как продукты), которые образуются в результате химической реакции.В этом случае, поскольку углекислый газ является результатом сжигания углерода в присутствии кислорода:
Уравнение 10b
[Реагенты] C + O 2 → CO 2 [Продукты]
Поскольку реакции могут приводить как к физическим, так и к химическим изменениям, каждому веществу дается символ состояния, записанный в виде нижнего индекса справа от формулы, это описывает физическую форму реагентов и продуктов.Общепринятые аббревиатуры состояний: (s) для твердых веществ, (l) для жидкостей, (g) для газов и (aq) для любых водных веществ, то есть растворенных в воде.
Уравнение 10c
C (s) + O 2 (g) → CO 2 (g)
Наконец, чтобы гарантировать, что это представление подчиняется закону сохранения массы, уравнение может потребоваться уравновесить сложение чисел перед каждым видом, что создает равное количество атомов каждого элемента с каждой стороны уравнения.В случае образования диоксида углерода из углерода и кислорода нет необходимости добавлять такие числа (называемые стехиометрическими коэффициентами), поскольку 1 атом углерода и 2 атома кислорода появляются на каждой стороне уравнения.
Изменения энергии
В природе химические реакции часто происходят за счет обмена энергией. В этом отношении реакции обычно делятся на две категории — те, которые выделяют энергию, и те, которые поглощают энергию.
Экзотермические реакции — это реакции, которые выделяют энергию в окружающую среду (рис. 8, справа). Реакции горения являются очевидным примером, потому что энергия, выделяемая в результате реакции, преобразуется в свет и тепло, видимые в непосредственной близости.
Напротив, эндотермические реакции — это те, которые поглощают энергию из окружающей среды (рис. 8, слева).В этой ситуации, возможно, придется нагреть реакцию или добавить в систему какую-либо другую форму энергии, прежде чем реакция протекает.
Рис. 8 : Слева показана эндотермическая реакция, при которой энергия поглощается из окружающей среды. Напротив, справа — экзотермическая реакция, которая выделяет энергию в окружающую среду.
В обоих случаях важно отметить, что энергия не создается и не разрушается, а передается от одного типа энергии к другому, например, от химической энергии к теплу или свету.Энергия, которая идет на образование химических связей, обменивается на другие виды энергии с окружающей средой вокруг этой реакции. Классическим примером является реакция фотосинтеза, при которой растения поглощают световую энергию солнца, чтобы создать связи между атомами, составляющими сахара, которые сохраняются в виде химической энергии для дальнейшего использования растениями. Процесс дыхания по сути противоположен фотосинтезу, когда связи в молекулах сахара разрываются, и высвобождаемая энергия затем используется растением.
Контрольная точка понимания
_____ реакции — это реакции, которые поглощают энергию из окружающей среды.
Контекст химических реакций
Химические реакции происходят вокруг нас каждый день. Будь то однократная реакция замены в батарее фонарика, реакция синтеза, которая происходит, когда железо ржавеет в присутствии воды и кислорода, или кислотно-щелочная реакция, которая происходит, когда мы едим — мы испытываем химические реакции практически во всем, что мы делать.Понимание этих реакций не является абстрактным понятием для химика, работающего в далекой лаборатории, скорее, оно имеет решающее значение для понимания жизни и мира вокруг нас. Чтобы по-настоящему справиться с химическими реакциями, нам необходимо понимать количественный аспект этих реакций, называемый стехиометрией, и концепцию, которую мы обсудим в другом модуле.
Сводка
В этом модуле исследуется множество химических реакций, сгруппированных по общим типам.Мы рассмотрим синтез, разложение, однократное замещение, двойное замещение, РЕДОКС (включая горение) и кислотно-основные реакции с примерами каждого из них.
Ключевые понятия
- Шаги от качественной науки к количественной имели решающее значение для более полного понимания химии и химических реакций.
- Когда вещество или вещества (реагенты) претерпевают изменение, которое приводит к образованию нового вещества или веществ (продуктов), считается, что произошла химическая реакция.
- В химических реакциях сохраняются масса и энергия. Материя не создается и не разрушается, скорее, она сохраняется, а перестраивается для создания новых веществ. Энергия не создается и не разрушается, она сохраняется, но часто преобразуется в другую форму.
- Химические реакции можно разделить на различные типы в зависимости от их природы. Каждый тип имеет свои собственные определяющие характеристики с точки зрения реагентов и продуктов.
- Химические реакции часто сопровождаются наблюдаемыми изменениями, такими как изменение энергии, изменение цвета, выделение газа или образование твердого вещества.
- Энергия играет решающую роль в химических реакциях. Когда энергия выделяется в окружающую среду, реакция называется экзотермической; когда энергия поглощается из окружающей среды, реакция считается эндотермической
NGSS
- HS-C5.4, HS-PS1.A2, HS-PS1.A3, HS-PS1.B3
Список литературы
Берна, Ф., Голдберг, П., Хорвиц, Л. К., Бринк, Дж., Холт, С., Бэмфорд, М., и Чазан, М. (2012). Микростратиграфическое свидетельство пожара на месте в ашельских пластах пещеры Вандерверк, провинция Северный Кейп, Южная Африка. Proceedings of the National Academy of Sciences, 109 (20), E1215-E1220.
- Далтон, Джон (1808). Новая система химической философии .
- Лавуазье, Антуан (1789). Traité Élémentaire de Chimie, présenté dans un ordre nouveau, et d’après des découvertes modernes .
- Пристли, Джозеф (1775 г.). «Отчет о дальнейших открытиях в воздухе». Философские труды. 65 : 384–94.
- Пруст Жозеф Луи (1804). «Sur les Oxydations Métalliques». J Phys. 59 : 321-343.
Энтони Карпи, доктор философии, Адриан Дингл, бакалавр наук «Химические реакции» Visionlearning Vol. ЧЭ-1 (6), 2003.
Chem4Kids.com: Реакции: Обзор
Начнем с идеи химической реакции .Реакции происходят, когда две или более молекулы взаимодействуют и молекулы изменяются. Связи между атомами разрываются и создаются новые молекулы. Вот и все. Какие это молекулы? Как они взаимодействуют? Что происходит? Возможности безграничны.
Когда вы пытаетесь понять химические реакции, представьте, что вы работаете с атомами. Представьте, что строительные блоки находятся прямо перед вами на столе. Иногда мы используем наши химические игрушки, чтобы визуализировать движение атомов.Мы подключаем и отключаем маленькие разъемы, которые представляют собой химические связи. Вы должны знать несколько ключевых моментов о химических реакциях:
1. Должно произойти химическое изменение . Вы начинаете с одной молекулы и превращаете ее в другую. Химические связи создаются или разрываются, чтобы создать новую молекулу. Одним из примеров химической реакции является ржавление стального мусорного бака. Это ржавление происходит из-за того, что железо (Fe) в металле соединяется с кислородом (O 2 ) в атмосфере.Создаются и разрушаются химические связи, в конечном итоге образуя оксид железа (Fe 2 O 3 ).
Когда холодильник или кондиционер охлаждают воздух, молекулы воздуха не реагируют. Изменение температуры — это физическое изменение . Когда вы растапливаете кубик льда, это физическое изменение. Когда вы добавляете отбеливатель в стиральную машину для стирки одежды, химические изменения разрушают молекулы в ваших пятнах.
2. Реакция может включать атомы, ионы, соединения или молекулы одного элемента. Вы должны помнить, что химическая реакция может произойти с чем угодно, пока происходят химические изменения. Если вы поместите чистый газообразный водород (H 2 ) и чистый газообразный кислород в комнату, они могут участвовать в реакции с образованием воды (H 2 O). Однако это будет в очень небольших количествах. Если бы вы добавили искру, эти газы вступили бы в бурную химическую реакцию, которая привела бы к огромному взрыву (экзотермическому). Другая химическая реакция может включать ионы серебра (Ag + ).Если смешать раствор с ионами серебра с раствором, содержащим ионы хлорида (Cl — ), образуется осадок хлорида серебра (AgCl), который выпадает из раствора.
3. Одиночные реакции часто происходят как часть большой серии реакций. Когда растение производит сахар, может пройти до дюжины химических реакций, чтобы пройти цикл Кальвина и в конечном итоге создать (синтезировать) молекулы глюкозы (C 6 H 12 O 6 ).Пример ржавления, который мы использовали ранее, показал вам только исходные реагентов и конечные продукты химической реакции. Было несколько промежуточных реакций, в которых создавались и разрушались химические связи.

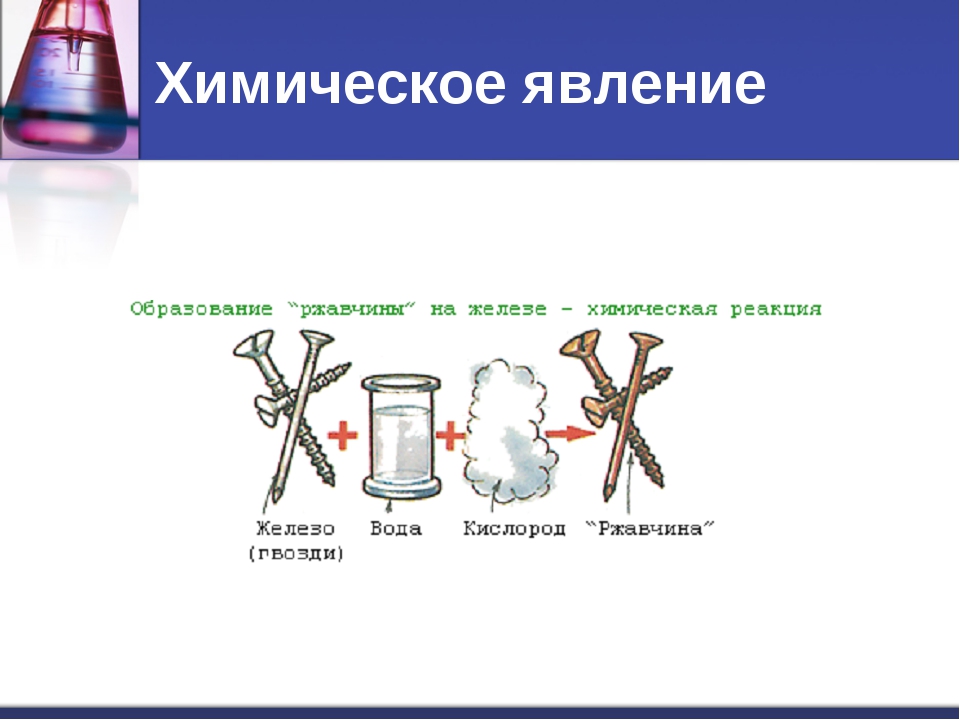
 31 стр. 51;
31 стр. 51;